Предлагаемая заявка является частичным продолжением заявки США рег. 07/670085, поданной 15 марта 1991 г., по которой испрашивается приоритет.
Предшествующий уровень техники
Изобретение относится к рецептору фолликулостимулирующего гормона человека и его синтезу с использованием техники рекомбинантных ДНК.
Фолликулостимулирующий гормон (ФСГ) представляет собой гетеродимерный гликопротеиновый гормон, вырабатываемый гипофизом и имеющий структуру, сходную со структурой лютеинизирующего гормона (ЛГ), тиреотропного гормона (ТТГ), оба из которых также секретируются гипофизом, и хорионического гонадотропина (ХГ), который продуцируется в плаценте. Эти гормоны являются относительно крупными (28-38 кДа) и состоят из нековалентно связанной α-субъединицы, которая является одинаковой для всех указанных гормонов, и β-субъединицы, которая у всех гормонов является разной, и которая ответственна за специфичность связывания с рецептором.
Известно, что клеточные рецепторы для этих гормонов принадлежит к классу белок G-связанных мембранных рецепторов, которые при активации способны стимулировать увеличение активности аденилинциклазы. Это приводит к повышению уровня вторичного посредника - аденозин 3', 5' - монофосфата (цАМР), который в свою очередь способствует увеличению уровня синтеза и секреции стероидов. Диаграммы гигроскопичности аминокислотных последовательностей указанных рецепторов выявили три главных области: 1) гидрофильную аминоконцевую область, называемую амино-концевым внеклеточным доменом; 2) семь гидрофобных сегментов с длиной, составляющем ширину мембраны, называемых трансмембранным доменом; и 3) карбокси-концевую область, содержащую потенциальные сайты фосфорилирования (сериновый, треониновый и тирозиновый остатки), и называемую карбокси-концевым внутриклеточным или цитоплазматическим доменом. Это семейство рецепторов гликопротеиновых гормонов отличается от других белок G-связанных рецепторов (таких, как β2 - адренэргический, родопсиновый рецептор и рецептор субстанции К) большими размерами своих гидрофильных амино-концевых доменов, которые участвуют в связывании гормонов.
Рецептор ФСI экспрессировали на клетках Сертоли яичка и зернистых клетках яичника. Хотя необходимость получения, в основном, чистого рецептора ФСI человека совершенно очевидна; однако, очистка природных препаратов является практически невыгодной процедурой, и к тому же маловероятно, что такая очистка окажется достаточной для определения аминокислотной последовательности. Недавно, одной группой исследователей была клонирована кДНК, кодирующая рецептор крысиного ФСГ; выведена аминокислотная последовательность этого рецептора, который был экспрессирован в клетках млекопитающего (Sprengel, Mol. Endocrunol. 4: 525, 1990). Другой группой исследователей, предпринимавших попытки клонировать ФСI-рецептор, была также, по-видимому, клонирована и идентифицирована часть трансмембранной области рецептора чел. ФСГ (Parmentier, Science 246:1620, 1389).
Краткое описание изобретения
Изобретение относится к, в основном, чистому рецептору человеческого ФСГ, или его фрагменту, или мутанту, способному связывать ФСГ, а также кДНК, кодирующей указанный рецептор, его фрагмент, или мутант; к векторам экспрессии, содержащим указанную ДНК, к клеткам, трансфецированным указанными векторами экспрессии; и к способам продуцирования указанного рецептора, его фрагмента или мутанта путем культивирования указанных трансфецированных клеток. Изобретение также относится к фармацевтическим композициям, содержащим указанный рецептор, его фрагмент, или мутант, и к способам лечения пациентов с использованием таких композиций в целях снижения биоактивности эндогенного ФСГ. В предлагаемой заявке также раскрывается улучшенный анализ чел. ФСГ с использованием рецептора, его фрагмента или мутанта изобретения.
Краткое описание чертежей
На фиг. 1 представлена карта клонов кДНК для рецептора ФСI человека. На фигуре показана частичная карта рестрикции, которая была построена путем объединения данных о ДНК-последовательностях, полученных от частей каждого из пяти клонов. На карте отмечено увеличение в размере на каждые 0,2 тысяч пар оснований (кв). Области, которым соответствуют клоны, показаны сплошными линиями ниже рестрикционной карты. Обозначения и приблизительные размеры клонов (в кв) указаны слева и справа от каждой сплошной линии соответственно. Пунктирными стрелками, выше рестрикционной карты, показано приблизительное расположение амино-концевого внутриклеточного домена, трансмембранного домена, и карбокси-концевого внутриклеточного домена кодированного белка. Положение инсерции (вероятно, интрон или часть интрона) в клоне 5-10 показано рамкой.
На фиг. 2А и 2В показана стратегия, использованная для конструирования кДНК "полного" ФСГ-рецептора человека в целях экспрессии кодированного белка в клеточной линии млекопитающего.
На фиг. 3 представлена диаграмма плазмидного вектора экспрессии, использованного для получения клеточных линии СНО -ДИКХ, стабильно трансфецированных чел. ФCI-рецептором.
На фиг.4 представлена диаграмма плазмидного вектора экспрессии, использованного для получения клеточных линии Y1, стабильно трансфецированных чел. ФСI-рецептором.
На фиг. 5 проиллюстрированы уровни внутриклеточного цАМР, измеренные в СНО-DUKX - клеточной линии GHOHГ ЕР 40-13, после обработки различными дозами либо ФСГ (кружки), либо ЛГ (треугольники). Каждая точка представляет среднее значение. Стандартные ошибки показаны вертикальными черточками.
На фиг.6 проиллюстрированы уровни прогестерона, измеренные в культуральной среде Y1 - клеточной линии Y1HFSHR4-38, после обработки различными дозами ФСI. Вертикальными черточками обозначены стандартные погрешности (ср. кв.ош.) при измерениях прогестерона для каждой дозы ФСI.
Подробное описание изобретения
Рассматриваемые в описании рецептор чел. ФСI, и его ФСI-связывающие фрагменты или мутанты представляют собой полипептиды, обладающие способностью распознавать и селективно связываться с чел. ФСГ, а также продуцировать незначительный иммунологический ответ у человека. Таким образом, изобретение относится к рецептору чел. ФСI, имеющему аминокислотную последовательность, изображенную в SEQ ID 2, а также к его ФСГ-связывающим фрагментам или мутантам, сохраняющим высокую степень гомологии (по крайней мере, 95% идентичности) с указанной аминокислотной последовательностью или, по крайней мере, ее внеклеточной частью. Объем изобретения включает в себя такие фрагменты чел. ФСI-рецептора, которые остаются после делении цитоплазматического и/или трансмембранного доменов из полного полипептида. Особенно предпочтительным фрагментом изобретения является аминоконцевая внеклеточная часть, содержащая приблизительно аминокислоты I-349 аминокислотной последовательности чел. ФСI- рецептора, показанной в SEQ ID 2. Некоторые из петлевых фрагментов, которые простираются по всей ширине трансмембранных областей (указаны в SEQ-ID 2, в разделе "отличительные особенности") являются также внеклеточными, и они могут быть сшиты (посредством соответствующих спейсерных молекул) с фрагментом, содержащим амино-концовую внеклеточную область, для улучшения связывания. Этот полипептид может быть гликосилирован, как и в природном рецепторе, либо он может быть частично или полностью дегликосилирован.
Кроме того, предполагается, что из вышеописанной амино-концевой внеклеточной области лишь ее часть может быть эффективно использована для ФСI-связывания, поскольку вероятность того, что для этой цели не требуется полный внеклеточный домен, очень велика. Таким образом, фрагмент, который является короче, чем 349 аминокислот полного внеклеточного домена, может быть легко продуцирован и проанализирован на эффективное связывание с ФСГ. Поскольку область ФСI-связывания внеклеточного домена целиком сохраняется, то полная длина используемого фрагмента не является критической величиной. По этой причине можно также ожидать, что либо к концу внеклеточного домена, либо к его ФСГ-связывающему фрагменту могут быть также добавлены аминокислоты, не оказывающие неблагоприятного воздействия на способность полипептида к связыванию. В соответствии с этим изобретение относится к фрагменту чел. ФСI-рецептора, который включает в себя, в основном, часть внеклеточного домена, и который, в основном, сохраняет такую же способность к ФСI-связыванию, что и полный внеклеточный домен.
Объем изобретения также включает в себя мутантные формы вышеописанного рецептора и его фрагментов. Такие мутанты могут быть получены с помощью консервативных замещений в 1-10 аминокислотных остатках; причем локализацию и природу этих замещений выбирают таким образом, чтобы они не оказывали неблагоприятного воздействия на ФСI-связывающие свойства модифицируемого рецептора или его фрагмента.
В основном, чистый чел. ФСI-рецептор, или его фрагмент, или мутант получают путем выделения и клонироваиия ДНК, кодирующие указанный рецептор, его фрагмент, или мутант, из кДНК или геномной библиотеки, с последующим лигированием этой ДНК в вектор, трансфецированием клеток-хозяев этим вектором, культивированием трансфецированных хозяйских клеток в условиях, благоприятствующих экспрессии рецептора, фрагмента или мутанта, и выделением рецептора, фрагмента или мутанта из культуры.
ДНК, используемая для получения векторов экспрессии, может быть геномнои ДНК или кДНК, кодирующей редептор чел. ФСГ, и может содержать области, которые способствуют усилению экспрессии, такие как интроны, промоторы, энхансеры, и т.п. Эта ДНК может быть легко модифицирована путем замещения, делеции или инсерции нуклеотидов (например, путем сайт-специфического мутагенеза) таким образом, чтобы эти мутации не оказывали неблагоприятного воздействия на биологическую активность или способность к ФСГ-связыванию экспрессированного белка. Например, консервативные замещения (мутации), которые вносят изменения в 1-10 аминокислотах, могут быть осуществлены без неблагоприятного воздействия на полную структуру и активность экспрессируемого белка (мутеина). Кроме того, некоторые части ДНК, например части, которые кодируют цитоплазматический и/или трансмембранный домены, могут быть делетированы таким образом, чтобы экспрессировался лишь один фрагмент белка, такой как растворимый внеклеточный домен. Рецептор чел. ФСГ или ФСГ-связывающий его фрагмент или мутант могут быть также экспрессированы в виде гибридного белка. Один из таких гибридных белков может содержать полипептид в карбокси-конце, который обладает свойствами, облегчающими очистку белка, или иммобилизацию очищенного белка на твердом субстрате в целях его использования в анализах ФСГ или в процедурах очистки ФСГ. Другой такой гибридный белок может содержать отщепляемый полипептид у амино-конца, который будет способствовать облегчению экспрессии.
Рецептор чел. ФСГ, продуцированный в соответствии с изобретением, является, в основном, чистым, а это означает, что он, в основном, не содержит нежелательных биологических включений, обычно ассоциирующихся с ФСI-рецептором, экстрагированным из натуральных источников, таких как бактерии, вирусы и другие белки. Указанный рецептор может быть включен в фармацевтическую композицию путем смешивания с подходящими фармацевтическими приемлемыми носителями, хорошо известными специалистам.
Вообще говоря, фармацевтические композиции могут быть составлены для перорального, парентерального (подкожно, внутримышечно и внутривенно), вагинального, ректального, буккального (например, подъязычно), трансдермального или внутриносового введения. Композиции для парентерального введения обычно изготавливают в виде жидкого раствора, дисперсии или эмульсии, предпочтительно в виде изотонического раствора; для вагинального или ректального введения - в виде кремов или суппозиториев, для перорального или буккального введения - в виде таблеток или капсул; и для внутриносового введения - в виде порошка, капель для пускания в нос, или аэрозолей. При этом могут быть использованы лекарственные фермы с пролонгированным высвобождением, например имплантат, или инъецируемые формы. Активный компонент может быть тaкже введен в полимерные матрицы, липосомы и микросферы в целях регулирования доставки лекарственного средства к нужным тканям или органам.
Эти композиции могут быть введены в виде разовых лекарственных форм, которые могут быть получены в соответствии с традиционной фармацевтической техникой. Композиции для парентерального введения могут содержать в качестве наполнителей стерильную воду или солевой раствор; алкиленгликоли, такие как пропиленгликоль; полиалкиленгликоли, такие как полиэтиленгликоль; масла растительного происхождения; гидрогенизированные нафталины и т.п. Композиции для вагинального или ректального введения, например суппозитории, могут содержать в качестве наполнителей, например полиалкиленгликоли, вазелин, какао-масло и т.п. Композиции для введения через нос, изготовленные в виде порошков, могут в качестве наполнителей содержать лактозу или декстран; либо они могут быть изготовлены в виде водных или масляных растворов и введены через нос в виде капель или дозируемого распыляемого раствора. Для транс-букального введения стандартными растворителями являются сахар, стеарат кальция, крахмал, набухающий в холодной воде, и т.п. К раствору или порошкообразной композиции могут быть добавлены кислоты или соли поверхностно-активных веществ. Подходящими фармацевтическими приемлемыми солями поверхностно-активных веществ (ПАВ) являются такие соли, которые сохраняют способность к повышенной абсорбции пептида, и свойства ПАВ, а также не оказывают нежелательного воздействия на композицию, и не имеют других нежелательных свойств.
Дозы вводимых активных ингредиентов, а также способ и режим введения зависят от конкретных данных пациента, его состояния и нужного терапевтического эффекта, и могут быть определены лечащим врачом.
Фармацевтические композиции, содержащие рецептор чел. ФСГ, либо его ФСГ-связывающие фрагменты или мутанты, могут быть введены пациенту в дозах, являющихся терапевтически эффективными для связывания с эндогенным пиркулирующим в организме пациента фолликулостимулирующим гормоном (ФСГ), в целях регулирования приемлемого уровня биоактивиого ФСГ. Так, например, фармацевтические композиции изобретения могут быть эффективно использованы для снижения эндогенной ФСГ-биоактивности. Например, женщинам может быть назначено лечение с использованием вышеуказанных композиций в целях предупреждения роста и созревания фолликулов, и тем самым предупреждения беременности. Мужчинам такое лечение может быть назначено для предупреждения сперматогенеза. Особенно предпочтительная фармацевтическая композиция, которая может быть использована в вышеуказанных целях, включает в себя фрагмент рецептора человеческого ФСГ, содержащий амино-концевой внеклеточный домен или его значительную часть, и обладающий, в основном, такой же способностью к ФСГ-связыванию, что и полные рецептор.
В основном, чистый рецептор чел. ФСГ может быть также с успехом использован в стандартном анализе для ФСГ, который, например, описан Reichert в Endocrinology 94: 483, 1974. Замещения в чистом рецепторе изобретения, или в его фрагменте, способном к ФСГ-связыванию, позволит значительно усовершенствовать проведение указанных анализов. Фрагмент, содержащий амино-концевой внеклеточный домен или его ФСГ-связывающую часть и/или гибрид может быть также аффинно связан с колонкой в целях выделения ФСГ из жидкостей, экстрактов и т.п.
Указанный рецептор может быть введен в стабильную клеточную линию, предпочтительно линию эукариотических клеток, а наиболее предпочтительно линию клеток млекопитающего, которая способна продуцировать обнаружимый биологический ответ при стимулировании рецептора. Измерение клеточного ответа в присутствии ФСГ при проведении анализа (например, в сыворотке, плазме, культуральной среде, тканевых гомогенатов) будет служить указанием на биоактивность, и тем самым на значительную ценность диагностического анализа. Указанная клеточная линия может быть также использована для скрининга химических библиотек в целях оценки веществ, которые могут взаимодействовать с ФСГ-рецептором, или испытуемых пептидов, или небольших белков на их способность связываться с ФСГ-рецептором в скринирующей системе с высокой продуктивностью. Примером такой высокопродуктивной скринирующей системы является система, в которой связывание лиганда с рекомбинантным ФСГ-рецептором способствует продуцированию или блокированию образования оцениваемого продукта, такого как цАМР или прогестерона. Кроме того, указанная система может быть усилена путем соответствующего связывания легко обнаружимого маркера, например биолюминесцирующего агента (напр., ген люциферазы), с сигнал-трансдуцирующим участком рецептора (например, с использованием элемента цАМР-ответа).
В основном, чистый рецептор чел. ФСГ или его ФСР-связывающие фрагменты или мутанты могут быть также использованы в кристаллографическом рентгеновском анализе для разработки молекулярных моделей. Такие модели могут быть использованы при определении третичной структуры гормон-связывающих доменов чел. ФСI-рецептора. Полученная таким образом информация внесла бы значительный вклад в изучение структуры важных областей, осуществляющих взаимодействие между ФСГ и его рецептором, что позволило бы конструировать пептиды, обладающие ФСГ-агонистической или ФСГ-антагонистической активностью.
Рекомбинантная техника, используемая для продуцирования белков и ДНК изобретения и включающая в себя способы идентификации соответствующих мутаций, векторы, хозяйские клетки, условия культивирования и т.п., является хорошо известной специалистам, и адекватно описана, например, в патенте США 4761371 и WO 88/09819, раскрытие которых вводится в предлагаемое описание посредством ссылки. Экспериментальные схемы, бактериальные и бактериофаговые культуральные среды и химические растворы, используемые в приведенных ниже примерах (если это не оговорено особо), подробно описаны Sambrook в "Molecular Cloning: A Laboratory Manual". 2-ое изд., Cold Spring Harbor Laboratory Press, 1989.
Пример 1. Выделение и характеризация кДНК-клонов рецептора чел. ФСГ
Скрининг библиотеки
кДНК-клон рецептора крысиного ФСГ, аналогичный описанному Sprengel в "Моl. Endocrinol". 4: 525, 1990, получили от Dr.William Moyle University of Medicine and Dentistry of New Jersey-Robert Wood Johnson Medical School. Этот кДНК - клон инсертировали в поздний экспрессирующий вектор р SVI SV40 (Pharmacia LKB, номер продукта: 27-4509-01) и полученный вектор обозначали р SVLFSUR. 2,1 - кb - фрагмент ДНК, содержащий область, соответствующую области, кодирующей полный рецептор крысиного ФСГ, вырезали из плазмиды с использованием сайтов рестрикции эндонуклеаз ХbаI и BamHI. Переваренную ДНК фракционировали по размерам с помощью гель-электрофореза, и 2,1 кb - фрагмент рецептора крысиного ФСГ очищали с помощью электроэлюции с геля. Этот очищенный ДНК - фрагмент использовали в качестве пробы для скрининга библиотеки в целях идентификации кДНК-клонов рецептора чел. ФСГ.
кДНК - библиотеку лямбда - gtII, сконструированную из PНK, экстрагированной из яичка человека, получали из Clontech, Palo AltO, CA (кат.номер HL 101Оb), и до ее использования амплифицировали. 20 аликвот амплифицированной библиотеки, что соответствует приблизительно 7,5•104 бляшкообразующих единиц (БОЕ), были адсорбированы, примерно в 0,5 мл суспензии для культивирования штамма YI088 Е. соli. Эту суспензию получали путем культивирования ночной культуры YI088 при 37oС в NZYМ или LВ-среде, дополненной 0,2% мальтозой и 10 мМ МgSO4, и осаждения клеток с последующим их ресуспендированием в 10 мМ MgSO4 до 0, П600=0,5. Затем к каждом суспензии фага/клетки добавляли около 6,5 мл расплавленной верхней NZYМ - агарозы (0,7%) при температуре 48oС, и полученную смесь выливали в одну из 20 чашек (150 мм) с NZYМ - агаром, предварительно нагретым до 42oС. Общее число фага, пассированного для первичного скрининга, составляло около 1,5•106. После 4-часового инкубирования при 42oC с последующим охлаждением при 4oС в течение нескольких часов, для каждой чашки генерировали слои бляшек на дубликатных нитроцеллюлозных фильтрах (Millipore) в соответствии с процедурами, описанными Benton и Davies (Science 196: 180, 1977). С помощью процедуры праймирования с использованием олигонуклеотида, описанной Feinberg и Vogelstein (Anal. Biochem. 137: 266, 1983), из фрагмента - матрицы ДНК рецептора крысиного ФСГ, описанного в предыдущем параграфе, генерировали 32Р - меченную пробу со специфической активностью 1-2•109 им. в мин. /микрограмм (мкг). Предгибридизацию фаговых слоев на нитроцеллюлозных фильтрах проводили в буфере, содержащем 50% формамида, 5•SSС [I•SSC=0,15 М хлорида натрия, 0,015 М цитрат натрия], 20 мМ фосфатно-натриевого буфера (pH 7,2), 10 • реагента Денхардта (50•реагент Денхардта = 1% Фиколл, 1% полифинилпирролидон, и 1% альбумин бычьей сыворотки), и 100 мкг/мл тРНК при 37oС, примерно в течение 6 часов. Гибридизацию фильтров осуществляли в том же буфере, за исключением того, что пробу ДНК крысиного ФСГ-рецептора добавляли при концентрации около 3•106 им/мин на мл буфера. После гибридизации при 37oC в течение 16-24 часов избыток пробы промывали с фильтром в 2•SSС, 0,1% ДCН при комнатной температуре в течение 30 минут, а затем в 0,2•SSС, 0,1% ДСН при 37oС в течение 60 минут. Затем фильтры экспонировали с рентгеновской пленксй (ХАR Коdак) в течение ночи при -70oС. 6 дубликатных позитивов идентифицировали, исходя из первичного скрининга библиотеки. Широким концом пастеровской пипетки бляшкосодержащие агаровые слои удаляли из 150 мм - чашек в тех местах, где располагались позитивные клоны. Фаг элюировали путем погружения этих слоев в SM. Суспендированный фаг затем снова засевали на 150 мм - чашки с NZYМ - агаром, как описано выше для первичного скрининга. Чашки, содержащие около 500 БОЕ/ чашка, отбирали для вторичного скрининга. Процедуры, используемые для получения фильтров и их гибридизации для вторичного скрининга, были аналогичны процедурам, описанным выше для первичного скрининга.
После вторичного скрининга 5 предполагаемых чел. ФСГ-рецептор-позитивных клонов идентифицировали и выделяли в виде очищенных клонов бактериофага λgtII. Эти клоны обозначали: 1-5, 5-10, 11-11, 13-9 и 15-6.
Определение ДНК-последовательностей предполагаемых кДНК-клонов рецептора чел. ФСГ
Фаговую ДНК получали от каждого изолята кДНК λgtII с использованием метода лизиса в чашках, описанного Sambrook в "Molecular Cloning: A Laboratory Manual, "2-ое изд. , Cold Spring Harbor Laboratory Press, 1989, стр.2.118. Фаговую ДНК переваривали рестриктирующей эндонуклеазой EcoRI, а затем факционировали по размерам в агарозном геле для очистки инсерционных фрагментов кДНК. Очищенные кДНК-вставки субклонировали в ЕсоRI - caйт рUС18 в целях облегчения последующих манипуляций по клонированию и секвенированию. Двухцепочечную плазмидвую ДНК считали из 5 мл культуры штамма-хозяина E.coli MC1066 с использованием метода мелкомасштабного щелочного лизиса (Sambrook, там же, см. выше, стр.1,25), а затем очищали путем пропускания через Elutip-d-колонки (Schleicher, & Schuell Keene, NH) в соответствии с инструкцией изготовителей. После этого половину плазмидной дНК, полученной от каждого препарата, денатурировали в 0,2 н. NaOH, 0,2 мМ EDТА в объеме 20 мкл, при комнатной температуре, в течение 10 минут. Денатурированную плазмидную ДНК нейтрализовали и осаждали этанолом путем добавления 7,5 мкл 7,5 М ацетата аммония и 110 мкл 100% этанола, после чего смесь охлаждали в жидком азоте. ДНК-преципитат осаждали в течение 10 минут на микроцентрифугe. ДНК-осадок промывали в 70% этаноле и осушали. Реакции секвенирования осуществляли с использованием ДНК-полимеразы Т7(United States Biochemical) в соответствии с инструкцией изготовителем. Предварительные реакции секвенирования осуществляли с использованием прямого и обратного сeквенирующих праймеров (Pharmacia LКВ) для полилинкерной области рUС18. Данные, полученные в результате предварительного секвенирования, использовали для конструирования чел. ФСГ - рецептор-специфических секвенирующих праймеров. Эти праймеры либо синтезировали на ДНК-синтезаторе модели 391 Арplied Biosystem, либо заказывали в National Biosciences Ihc, Hamel, MN. Некоторые данные о ДНК-последовательности были получены путем субклонирования более мелких рестрикционных фрагментов исходных клонов в рUС18 и повторного секвенирования с использованием прямого и обратного праймеров.
Предварительные данные секвенирования показали, что ни один из пяти кДНК-изолятов не представляет область, кодирующую полный чел. ФСI - рецептор, однако объединенные данные секвенирования по пяти клонам могут быть использованы для вывода полной последовательности белка. Схематическая диаграмма относительного расположения каждого из пяти клонов по отношению к полной кДНК-последовательности, кодирующей чел. ФСГ-рецептор, представлена (см. ниже) на фиг.1. кДНК-последовательность полного чел. ФСI - рецептора, полученная путем объединения данных секвенирования, проводимого в соответствии с компьютерной программой сборки фрагментов (Genetic Computer Group) (GCG), изображена в SEQ ID 1, а выведенная аминокислотная последовательность изображена в SEQ ID 2. Анализ ДНК-последовательности чел. ФСI - рецептора позволил идентифицировать длинную открытую рамку считывания из 2085 нуклеотидов, которая кодирует белок в 695 аминокислот. Рецептор человеческого ФСГ на 3 аминокислоты длиннее рецептора крысиного ФСГ. Полный % сходства между ДНК крысиного и человеческого ФСГ и белковыми последовательностями, который был определен с использованием программы GGG Веstfit, составлял 87% и 90% соответственно. По проведенным оценкам внеклеточная амино-концевая гидрофильная часть рецептора чел. ФСГ составляет в длину 349 аминокислот и имеет 87% сходства с соответствующем областью крысиного ФСГ. Семь трансмембранных областей этих двух видов, которые связаны мостиковой связью тремя внеклеточными и тремя внутриклеточными петлями, имеют идентичность 95%, а карбокси-концевые внутриклеточные области имеют лишь 81% идентичности. Частичная аминокислотная последовательность, опубликованная Parmentier, Science 246:1620-1622, 1989, соответствует аминокислотам 399-525 в SEQ ID 2.
Клон 5-10 был мутантным и имел инсерцию 0,25 кb после нуклеотида Т в положении 446 в SEQ ID 1. ДНК-последовательность инсерции не имеет сходства с какой-либо частью ДНК - последовательности крысного ФСГ - или человеческого ФСГ-рецептора, а также не похожа на какую-либо известную последовательность в Банке генов или базах данных ДНК-последовательностей в EMBL. Соответствующая область в клоне 11-11 не содержит указанной инсерции. кДНК-клоны рецептора LH, выделенные из кДНК-библиотеки щетовидной железы человека, содержат аналогичные мутации (Frazier, Mol.Endocrinol. 4:1264-1276, 1990). Эти мутации, очевидно, происходят в результате неполного и/или аберрантного сплайсинга РНК-молекул. Это объяснение подтверждается присутствием 3' - сплайсируемого консенсуса (САG'G) в 3' - области соединения инсерции 5-10.
Плазмиды рUС18, содержащие кДНК-вставки: 10-11 (обозначенная pHFSHR 11-11), 15-6 (обозначенная рНFSHR 15-6), и 5-10 (обозначенная рНFSHR 5-10), были депонированы Американской коллекцией типовых культур (АТСС, Роквилл, МД), 1 марра 1991, и имеют следующие номера допуска: АТСС68538, АТСС68500 и АТСС68539 соответственно. Указанное депонирование было осуществлено в соответствии со всеми требованиями Будапештского соглашения.
Пример 2. Конструирование векторов для экспрессии полного рецептора чел. ФСГ в клетках млекопитающего
Стратегия конструирования ДНК, кодирующей рецептор чел. ФСГ, для экспрессии в клетках млекопитающих показана на фиг.2А и 2В. На фиг. 2А, NSiI-ВamHI - фрагмент из 5'-691 пар оснований (п.о.), содержащий старт АТС, выделяли из рНFS НR II-II и субклонировали в рUС18, переваренную PstI и ВаmНI. Полученную плазмиду, рНFSHR II-IInb, линеаризовали с помощью SphI. Концы затупляли путем обработки фрагментом Кленова ДНК - полимеразы I (New England Biolobs, Beverly, MA). После лигирования Хhol - линкеров (New England Biolabs, Beverly, MA) с тупыми концами плазмиды, смесь переваривали ХhoI и BamHI и 5'-фрагмент рецептора чел. ФСГ, составляющий приблизительно 700 п.о., очищали. Фрагмент из срединной области кДНК чел. ФСГ-рецептора выделяли из рНFSHR II-II путем переваривания BamHI и Sрhl и проводили гель-очистку фрагмента прибл. в 734 п. о. 3' - фрагмент чел. ФСГ-рецептора, содержащий стоп-кодон ТАА, выделяли из pHFSHR15-6 сначала путем переваривания плазмиды ферментом DraIII, а затем затупления концов в реакции с ДНК-полимеразой Т4, ХhoI - лигировали в тупые концы, полученную смесь переваривали SphI и XhoI, а 3' - SphI-XhoI - фрагмент приблизительно 690 п.о.
На фиг. 2В, 5'-700 п.о. - ХhoI - BamНI - и срединный 734. п.о. BamHI -SphI - фрагменты кДНК чел. рецептора ФСГ субклонировали в pUCI8 - XhoI (созданного в лаборатории путем превращения Smal-сайта в полилинкере pUC18 в XhоI-сайт с использованием XhoI-линкеров), переваренного ХhoI и SрhI. Полученную плазмиду (pHFSHR 1.4XS) переваривали ХhoI и SphI. Переваренную ДНК фракционировали по размерам с помощью электрофореза в 5-6% полиакриламидном геле, и фрагмент (примерно 1400 п.о.), содержащий 5' - и срединную области кДНК чел. ФСI-рецептора, вырезали и очищали путем электроэлюирования. 3-SphI-XhoI-фрагмент, содержащий стоп-кодон ТАА, субклонировали в pUC18-XhoI, переваренный SphI и XhoI. Полученную плазмиду переваривали SphI и EcoRI. Переваренную ДНК фракционировали в 5-6% полиакриламидном геле, и кусок приблизительно 700 п.о. вырезали и очищали путем электроэлюирования. Затем осуществляли сборку области, кодирующей полный чел. ФСГ-рецептор, объединяя 5'-1400 п. о. - XhoI-SphI-фрагмент с 3'-700 п.о. -SphI-EcoRI-фрагментом при лигировании с рUC18-ХhoI, переваренным ХhoI и ЕcоRI. Правильность сборки конструкции, обозначенной рНFSHRX, проверяли путем переваривания рестриктирующими эндонуклеазами и ДНК-секвенирования. Полностью сконструированный 2,1 кb-XhoI-фрагмент чел. ФСГ - рецептора который содержит приблизительно 18 п. о. 5'-некодирующей последовательности и 12 п.о. 3'-некодирующей последовательности в дополнение к области, кодирующей полный чел. ФСГ-рецептор, вырезали из pHFSHRX путем ХhoI-переваривания. Переваренную ДНК фракционировали по размерам с помощью электрофореза в 0,7% агарозном геле. 2,1 кb - фрагмент вырезали из геля, очищали путем электроэлюирования в Little ВlueTankтм(ISCO) с использованием процедуры, рекомендованной изготовителями, и вставляли в XhoI-сайты клонирования плазмидного вектора для экспрессии в клетке млекопитающего. Плазмиды, содержащие вставку в соответствующей ориентации для транскрипции мРНК чел. ФСГ-рецептора, отбирали путем рестрикционного анализа. Перед введением в клетки млекопитающих плазмидную ДНК вектора экспрессии очищали либо с помощью двух последовательных процедур высокоскоростного центрифугирования в градиенте плотности хлорида цезия, либо с помощью плазмидного набора maxi-kit (Qiagen, Chatsworth, CA) в соответствии с инструкцией изготовителя.
Для экспрессии чел. ФМГ - рецептора может быть использован любой подходящий экспрессирующий вектор клетки млекопитающего. Плазмидный вектор имеет следующие необходимые компоненты: эукариотический промотор, такой как промотор мышиного металлотионеина I (ММT-I), промотор вируса саркомы Рауса, либо ранний или поздний промотор обезьяньего вируса SV40, для запуска транскрипции мРНК чел. ФСГ-рецептора; маркерный ген, такой как ген резистентности к неомицину (neo), ген дигидрофолактедуктазы (DНFR), или ген, кодирующий множественную лекарственную устойчивость (МDR), для селекции трансфецированных клеток, сигнал полиаденилирования (поли А), такой как ранний участок полиаденилирования SV40 для 3'-процессинга РНК - транскрипта рецептора; и бактериальную область репликации и гена устойчивости к антибиотику, такую как ori pBP322 и ген резистентности к ампициллину; присутствие этих компонентов необходимо для роста и размножения плазмидного вектора в соответствующем штамме E.coli. Для некоторых клеточных линий может оказаться необходимым введение нитрона в область, которая транскрибируется в мРНК, кодирующую чел. ФСГ-рецептор. Этот интрон предпочтительно поместить между промотором и кДНК-вставкой чел. ФСГ-рецептора, что соответствует его локализации в 5'-нетраслированной области РНК-транскрипта чел. ФСГ-рецептора. В этих целях может быть использован любой подходящий интрон. В данных экспериментах в качестве интрона была использована XbaI-PstI- часть (2 кв) интрона А в гене α-субъединицы человеческого гликопротеина (Fiddes, J. Mol. Appl. Genet. 1: 13, 1931). В векторах экспрессии эту часть интрона вставляли между областью протомора ММT-I и кДНК-фрагментом чел. ФСГ- рецептора. Усеченный интрон сохранял акцептор эндогенного сплайсированного фрагмента, но донор сплайсированного фрагмента поставлялся синтетическим олигонуклеотидом.
Диаграмма экспрессирующего вектора чел. ФСГ-рецептора, используемого для трансфекции CНО- клеток, а именно рDαHFSHRX (чел. ФСГ-рецептор в СLH3AXSV2DHFRhα IVS ), показана на фиг.3, а диаграмма экспрессирующего вектора чел. ФСГ-рецептора, используемого для стабильной трансфекции Y1-клеток, а именно pNαHFSHRX (чел. ФСГ-рецептор в CLН3АХSV2 NEOhα IVS), показана на фиг. 4. Последовательности ММT-1-гена (нуклеотиды 4542-7514 на фиг.3, и нуклеотиды 5192-8164 на фиг.4), включающие в себя промоторную область, аналогичны последовательностям, показанным "вверх по течению" от ХhoI-сайта в конструкции CLH3X (Reddy, ДНК, 6: 461, 1987) Фрагмент интрона А гена α-субъединицы чел. гликопротеина, описанный в предыдущем абзаце, расположен между нуклеотидами 7514 и 9514 на фиг. 3 и между нуклеотидами 8164-10164 на фиг. 4. "Вниз по течению" от Хh01-сайта, ММT-1-интроны и последовательности сигнала полиаденилирования удаляли и заменяли ранним участком полиаденилирования SV40 (нуклеотиды 11614-11857 на фиг.3 и нуклеотиды 12264-12508 на фиг. 4) рML область (Lusky, Nature 293:79, 1981) содержит бактериальный сайт инициации репликации и ген резистентности к ампициллину от рВН 322 (нуклеотиды 1925-4542 на фиг.3, и нуклеотиды 2575-5192 на фиг.4). Транскриптон гена DHFR (нуклеотиды 1-1925 на фиг.3), который включает в себя кДНК мышиной DHFR и область раннего промотора SV40, небольшой Т-интрон, и последовательностей ранней области полиаденилирования, соответствует РvuII-BamHI-фрагменту в рSV2DHFR (Subramani, Mol, Cell, Biol., 1:854, 1981). PvuII-сайт превращали в BamHI-сайт перед введением этого фрагмента в плазмидный вектор экспрессии. Транскриптон гена neo (нуклеотиды 1-2575 на фиг.4) синтезировали путем замены кДНК DHFR (нуклеотиды 342-1077 на фиг.3) HindIII-SmaI-фрагментом (1385 п.о.), происходящим от pSV2-neo (Southern, J. NoI, Appl. Genet, 1:327, 1982). SmaI-сайт - превращали в ВаmHI-сайт перед введением этого фрагмента в экспрессирующий плазмидный вектор.
Для трансфекции большинства стабильных клеточных линий млекопитающих может быть использована плазмида pNαhFSHRX, которая была депонирована в АТСС 19 ноября 1991 года под номером допуска АТСС68833. Это депонирование было осуществлено в соответствии со всеми требованиями Будапештского договора. Плазмида pDαhFSHRX является наиболее подходящей для трансфекции клеточных линий, в которых отсутствует активность дигидрофолактедуктазы (DHFR).
Техника клонирования и конструирования ДНК может быть использована любым специалистом в целях модифицирования экспрессирующей конструкции ДНК чел. ФСГ-рецептора, так чтобы кодировались фрагменты ФСГ-связывания. Эти модифицированные ДНК-фрагменты могут быть вставлены в векторы экспрессии аналогично тому, что как было описано выше, и использованы для трансфекции клеток млекопитающего в целях получения линий, секретирующих растворимые фрагменты ФСГ-связывания чел. ФМГ-рецептора, такие, как амино-концевой внеклеточный демент или его ФСГ-связывающий фрагмент.
Пример 3. Получение клеточных линий млекопитающего, которые стабильно экспрессируют функциональный рекомбинантный ч. ФСГ-рецептор или его ФСГ-связывающий фрагмент или мутант
Подходящими клеточными линиями млекопитающих для экспрессии рекомбинантного чел. ФСГ- рецептора и его производных являются клетки яичника китайского хомячка (СНО), мышиной аденокарциномы Y1, крысиного гипофиза GH3, карциномы молочной железы человека МСГ7, и клетки первичной почки человека 293. В этом примере описано использование клеток Y1 и СНО.
Клетки Y1 представляют собой штамм клоногенных стероидсекретирующих клеток, полученных от опухоли мышиного коркового вещества надпочечника (Yasumura, Cancer Res. 26:529-536, 1966). Для данного эксперимента эти клетки были получены из банка клеток АТСС (АТСС ССL 79), а затем они были культивированы в среде HamF10, дополненной 15% лошадиной сывороткой (HS), 2,5 FBS, и 1% L-глутамином (среда роста для Y1).
СНО-DUKX - клетки представляют собой клоногенные мутантные клетки яичника китайского хомячка, в которых отсутствует активность дигидрофолатредуктазы (Urlaub G. и Chasin LA. PNAS 77:4216-4220, 1980). Эти клетки выдерживали в минимальной поддерживающей среде - альфа (МЕМ - α), дополненной 10% FВS и 1% L-глутамином (среда роста для СНО).
Культивирование всех клеток осуществляли при 37oС в 5% СО2, в условиях влажности.
Трансфекция с использованием фосфата кальция
Схема трансфекции, используемая в настоящем эксперименте, представляла собой модификацию опубликованного метода (Craham, Virology, 52:456, 1973). Приблизительно за 24 часа до трансфекции клетки засевали на чашки диаметром 100 мм при плотности 7•105 клеток на чашку (СНО-DUКХ) или 1•106 клеток на чашку (Y1). Для трансфекции к 0,5 мл трансфекционного буфера добавляли 10 мкг ДНК плазмидного вектора (рDαHFSHRX) для клеток СНО-DUKX и pNαHFSHRХ для клеток Y1), Трансфекционный буфер получали путем смешивания 4 грамма (г) NаCl; 0,185 г КСl; 0,05 г Na2HPO4; 0,5 г декстрозы, и 2,5 г HEPES в стериальной дистиллированной воде, и доведения объема до 500 мл, а рН до 7,5. К смеси трансфекционного буфера и ДНК добавляли 31 мкл 2 М CaСl2. Полученный раствор смешивали с помощью вибрационного смесителя, и на 45 минут при комнатной температуре для осаждения ДНК. После удаления культуральной среды осажденную ДНК наносили поверх клеток. После выдерживания при комнатной температуре в течение 20 минут добавляли 5 мл соответствующей среды роста и культивировали в течение 6 часов. Затем среду удаляли, и клетки встряхивали в течение 3,5 минут в 3-4 мл трансфекционного буфера, содержащего 15% глицерина. После этого клетки дважды промывали фосфатно-буферным раствором, а затем добавляли 10 мл среды роста. Приблизительно через 48 часов после трансфекции клетки СНО-DUКХ субкультивировали при индексе разведения 1:10, а затем добавляли селекционную среду. После трансфекции клетки Y1 культивировали в течение 72 часов, а затем субкультивировали при индексе разведения 1:5 в селективной среде. Селективная среда для клеток Y1 содержала среду роста для клеток Y1 с 80 мкг/мл С418. МТХ-резистентные колонии клеток СНО-DUКХ и G418-резистентные колонии клеток Y1, образовавшиеся примерно через 2-3 недели, собирали отделано, и культивировали до тех пор, пока число клеток не будет достаточным для криоконсервации и оценки на реактивность гормона.
Иллюстрация биореактивности рекомбинантного чел. ФСГ- рецептора в стабильно трансфецированных клетках СНО
Чтобы определить может ли кДНК - конструкция чел. ФСI-рецептора продуцировать биологически функциональный белок в стабильно трансфецированных клетках СНО, колонии МТХ - резистентных клеток СНО обрабатывали рекомбинантным чел. ФСГ, и измеряли уровни внутриклеточного цАРМ. Для анализа на уровне цАМР клетки субклонировали в 12-луночных планшетах при плотности 2,5•104 клеток на лунку в селективной среде для клеток СНО. Через 72-часового культивирования каждую лунку промывали 1,5 мл теплой ростовой среды. Затем в каждую промытую лунку добавляли 300 мкл бессыворотной ростовой среды, содержащей 0,1 мМ 3-изобутил-1-метилксантина (Sigma). После 15-минутного культивирования к среде в каждой лунке добавляли рекомбинантный чел. ФСГ так, чтобы конечная концентрация составляла приблизительно 335 нг (2413 мМЕ) на мл. После 30-минутного культивирования анализ завершали тем, что клетки подвергали четырем циклам быстрого замораживании - оттаивания. 50 мкл - аликвоту от каждого клеточного лизата вводили в 1,5 мл - пробирку для определения содержания белка. К каждому оставшемуся образцу лизата добавляли холодный этанол (300 мкл), а затем образцы переносили в отдельные 1,5 мл пробирки. Все образцы лизатов центрифугировали 15 минут при 13000 • г для удаления клеточного дебриса. Определение содержания полного растворимого белка осуществляли с использованием набора для анализа белков, полученного от Вio-Rad (кат 500-0002) в соответствии с инструкцией изготовителей. Обработанные этанолом образцы лизатов лиофилизовали в аликвотах 5-100 мкл и ресуспендировали в 100 мкл буфера для анализа, полученного в виде набора для анализа цАМР Dupont/NEN (Medical Product, кат. NЕК-033). Содержание кАМР в образцах ресуспендированных лизатов определяли в соответствии со схемой радиоиммуноанализа методом ацетилирования, которая прилагается к набору. Для этого анализа образцы не разводили. В большинстве клеточных линий СНО, трансфецированных чел. ФСГ- рецептором, более высокие уровни внутриклеточного цАМР обнаруживались в клетках после ФСГ-стимулирования, чем в контрольных клетках (нетрансфецированных клетках CHO-DUKХ и клетках СНО-DUKХ, трансфецированных СLH3AX SV2DHFRhα1VS). В среднем, ответ в этих клетках примерно в 16 раз превышал ответ в контрольных клетках.
Для анализа аффекта дозы использовали одну неклональную клеточную линию, СНОНFSHR 4Q-13. При этом повторяли процедуру, описанную в предыдущем абзаце, за исключением того, что клетки обрабатывали либо рекомбинантным чел. ФСГ, либо ЛГ в концентрации порядка 0-10 000 мМЕ/мл. Каждую дозу анализировали в трех дубликатах. Количество продуцируемого внутриклеточного цАМР выражали в наномоях (нМ) на миллиграмм (мг) растворимого белка, а кривую зависимости ответа от дозы строили для концентраций ФСГ и ЛГ. Эти кривые зависимости ответа от дозы для ФСГ и ЛГ показаны на фиг.5. Полученные результаты показали, что СНО - клеточная линия CHOHFSHR4Q-13 обнаруживала насыщаемое увеличение внутриклеточного цАМР в ответ на ФСГ-стимуляцию, но в ответ на ЛГ-стимуляцию этого увеличения не наблюдалась, 50% от максимального ФСГ-стимулирования (ED50) имело место при дозе 144 мМЕ/мл ФСГ. Поэтому кДНК чел. ФСГ-рецептора может быть использована для продуцирования биологически функционального чел. ФСГ-рецептора в СНО-клетках, которые опосредуют специфическим цАМР-ответ на ФСГ, и не реагируют на ЛГ.
Содержание ФСГ- рецептора в клеточной линий CHOHFSHR4Q-13 или в аналогичной линии, которая продуцирует рекомбинантый чел. ФСГ-рецептор или его ФСГ-связывающие фрагменты или мутанты, может быть увеличено путем постепенного увеличения MТX-концентрации. Это приводит к амплификации числа копий кДНК DHFR вместе с присоединенными последовательностями, которые включают в себя кДНК чел. ФСГ-рецептора, что косвенно способствует синтезу кодированных белков. Это может быть также осуществлено, если необходимо, для повышения чувствительности биоанализа. Кроме того, клетки млекопитающего, которые экспрессируют высокие уровни чел. ФСГ-рецептора или его ФСI-связывающих фрагментов или мутантов, могут быть также использованы для получения больших количеств белка чел. ФСГ-рецептора для терапевтических целей, либо для радиоиммуноанализа рецепторов.
Линия CHOHFSHR 4Q-13 или аналогичная линия может быть также использована в анализе для оценки in vitro биоактивности фармацевтических препаратов, содержащих ФСГ, или ФСГ-подобные вещества. Ген-"репортер", такой как люцифераза, может быть соответствующим образом сшит с элементом, ответственным за цАМР-ответ, и увеличение цАМР-уровней может быть косвенно измерено с использованием нерадиоактивного метода, например, с использованием биолюминесценции, в целях определения ФСГ-биоактивности.
Линия CHOHFSHR 4Q-13 была депонирована в АТСС 19 ноября 1991 года под номером допуска АТСС CRL 10921. Это депонирование было осуществлено в соответствий с требованиями Будапештского договора.
Иллюстрация биоактивности рекомбинантного чел. ФСГ-рецептора в стабильно трансфецированных клетках Y1 мышиного надпочечника.
Чтобы определить, что может ли кДНК-конструкция чел. ФСГ-рецептора продуцировать биологически функциональный белок в стабильно трансфецированных клетках Y1, колонии G418-безистентных клеток Y1 обрабатывали рекомбинантным чел. ФСГ, и культуральную среду анализировали на содержание прогестерона. Для анализа на прогестерон клетки субкультивировали в 6-луночных планшетах (35 мм диаметром каждая лунка) при плотности 4•105 клеток на лунку в селективной среде для Y1-клеток. Посла 2-дневного культивирования селективную среду удаляли и заменяли 3 мл среды НаmF 10, дополненной 5% лошадиной сывороткой, 0,8% околоплодной бычьей сывороткой (FBS), 1% L-глутамином, в 80 мкг/мл G418 (среда для анализа). В это время оценивали среднее число клеток на лунку для каждой клеточной линии путем удаления и подсчета клеток во трем тестируемым лункам. Затем клетки культивировали в течение 4 часов в 1 мл аналитической среды, содержащей 100 мМЕ/мл человеческого рекомбинантного ФСГ. После инкубирования чашки с культурой помещали на лед, а культуральную среду из каждой лунки переносили в отдельные стеклянные лабораторные пробирки (12•75). Пробирки, содержащие культуральную среду, помещали на 10 минут в баню с кипящей водой, а затем центрифугировали при 1100 • г при 4oС. Супернатанты приносили в чистые стеклянные лабораторные пробирки (12•75) и хранили в течение ночи при -20oС. После этого определяли уровни прогестерона с использованием готового продукта Serono Diagnostics Progesterone МАIА, 12274, поставляемого Ciba Corning, Medfield, МА. Анализ проводили в соответствии с инструкциями производителей, за исключением того, что образцы культуральной среды и прогестерона для стандартной кривой разводили в фосфатно-буферном растворе, содержащем 0,1% альбумин бычьей сыворотки и 0,6% азида натрия (вместо разведенного буфера, предлагаемого в наборе). Прогестерон для построения стандартной кривой получали от СаI Вiochem (кат. 5341) и перед использованием разводили до концентрации 15 мкг/мл в 100% этаноле. Маточный раствор хранили при -70oС. Конечные концентрации в разведениях прогестерона для стандартной кривой были такими, как рекомендовано в аналитическом наборе. Стандарты разведенного прогестерона были стабильными при 4oС в течение недели.
Несколько ФСГ-обработанных линий Y1, стабильно трансфецированных чел. ФСГ-рецептором, секретировали повышенные уровни прогестерона по сравнению с контрольными клетками (та же клеточная линия, но не обработанная ФСГ, нетрансфецированные клетки Y1, клетки Y1, трансфецированные CL Н3АХSV2NEOhα IVS). Одну неклональную линию, YIHFSHR4-38 выбирали для анализа зависимости ответа от дозы. В этом случае повторяли процедуру, описанную в предыдущем абзаце, за исключением того, что клетки обрабатывали разными концентрациями ФСГ, 0-100 мМЕ/мл. Каждую дозу дублировали. Количество прогестерона, продуцированного ФСГ-стимулированными клетками Y1, нормализовали для 1•106 клеток, и строили кривые зависимости ответа от концентрации ФСГ. Эти кривые представлены на фиг. 6. В данном эксперимента, 25-кратное увеличение прогестероновой активности наблюдалось при дозе 20 мМЕ/мл чел. рекомбинантного ФСГ. Линейный диапазон ФСГ составлял от 2,5 до 20 мМЕ/мл ФСГ, а ED50=6,4 мМЕ/мл ФСГ. Полученные результаты показали, что в клетках Y1, стабильно трансфецированных рекомбинантным чел. ФСГ-рецептором, наблюдается ФСГ-дозозависимое увеличение секреции прогестерона. Следовательно, при экспрессии в клетках Y1 мышиного надпочечника, рецептор чел. ФСГ является функционального активным.
Популяции клеток, происходящих от CHOHFSHR 4Q-13, или YIHFHR4-38- линий, или от аналогичных клеточных линий, могут быть использованы для разработки чувствительных in vitro анализов для ФСГ или ФСI-подобных веществ. Другие in vitro анализы ФСГ, используемые в настоящее время, например такие, как биоанализ ароматозы зернистых клеток и анализ ароматозы клеток Сертоли, требуют получения первичных клеточных культур от крыс при проведении каждого анализа. Тогда, как для биоанализов с применением новых клеток Y1 и СНО используются трансформированные стабильные клеточные линии. Благодаря этому новые методы осуществления in vitro биоанализов явно превосходят известные в настоящее время методы по простоте, точности и надежности.
Пример 4
Тестирование биологической активности in vitro ФСГ человека в клетках, стабильно трансфецированных рецептором ФСГ человека
Клетки млекопитающих, стабильно трансфецированные рецептором ФСГ (фолликуло-стимулирующего гормона) человека в соответствии с описанным в примере 3, были использованы для тестирования образцов на активность ФСГ. Подробности методов, использующих линии клеток СНО и Y1, описаны ниже.
Тесты на циклический АМФ
Резистентные к метотрексату клетки линии CHO-DUKX, стабильно трансфецированные геном рецептора ФСГ человека (т.е. клетки CHO-hFSHR), высевают в культуральную среду на 12-луночных планшетах при плотности 25 тысяч клеток на 1 лунку и культивируют в течение 48 часов при 37oС. Клетки каждой лунки промывают 3 мл подогретой культуральной среды и затем преинкубируют в течение 15 минут при 37oС в 400 мкл культуральной среды в отсутствие сыворотки, содержащей 0,1 мМ 3-изобутил-1-метилксантина (Sigma, St.Louis, МО). Высокоочищенные ФСГ или ЛГ (лютеинизирующий гормон) человека добавляют при конечной концентрации от 0,01 до 12000 миллиед./мл и затем продолжают инкубацию в течение 30 минут при 37oС. Тест заканчивают проведением четырех быстрых циклов "замораживание-оттаивание". Полученный в результате лизат разделяют на аликвоты по 50 мкл, которые центрифугируют при 4oС, 13000g в течение 15 минут. Надосадочную фракцию используют для определения белка с использованием набора реактивов BioRad Protein Assay kit. К оставшемуся лизату добавляют 300 мкл этанола и полученную смесь центрифугируют при 4oС, 13000g в течение 15 минут. Аликвоты (по 5-100 мкл) полученной надосадочной фракции клеточного лизата тестируют на присутствие цАМФ (циклический аденозинмонофосфат) с использованием набора реактивов DuPont/NEN Medical Products kit.
Тесты на прогестерон
Клетки Y1, стабильно трансфецированные рецептором ФСГ человека (клетки Y1-hFSHR), субкультивировали на 6-луночных планшетах при плотности 40 тысяч клеток на 1 лунку с использованием селективной для клеток Y1 культуральной среды. После двух дней культивирования селективную для клеток Y1 среду удаляли и заменяли 3 мл среды Ham's F10 с добавлением 5% кобыльей сыворотки, 0,8% плодной телячьей сыворотки, 1% L-глутамина и 80 мкг/мл G418. Через 24 часа культуральную среду удаляли и клетки дважды промывали в 2 мл тест-среды (среда Ham's F10 с добавлением 1 мг/мл бычьего сывороточного альбумина, 1% L-глутамина и 80 мкг/мл G418). Среднее число клеток в лунке оценивают путем отбора и прямого подсчета клеток из трех тест-лунок. Затем клетки культивируют в течение 4 часов в 1 мл тест-среды, содержащей от 0,01 до 2500 миллиед. /мл рекомбинатного ФСГ или ЛГ человека. После инкубации культуральную среду переносят в стеклянные пробирки, кипятят в течение 10 минут и центрифугируют при 1100g при 4oС. Уровни прогестерона определяют с использованием набора реактивов Serono Diagnostics Progesterone MAIA kit (получен от дистрибьютора Ciba Corning, Medfield, MA). Тест проводится в соответствии с рекомендациями производителя, за исключением того, что образцы культуральной среды и прогестерон, используемый для построения калибровочной кривой (Cal Biochem, La Jolla, CA), разводят в фосфатно-солевом буфере, содержащей 0,1% бычьего сывороточного альбумина и 0,6% азида натрия вместо разведения в том буфере, который входит в состав указанного набора реактивов.
Данные анализа зависимости от дозы ФСГ и ЛГ
Как показано на фиг.7 (A, B), и клетки линии CHO-hFSHR, и клетки линии Y1-hFSHR проявляют стремящееся к насыщению увеличение содержания внутриклеточного цАМФ и секретируемого прогестерона соответственно тогда, когда их культивируют в присутствии возрастающих концентраций рекомбинантного ФСГ человека. Однако ни та, ни другая клеточная линия никак не реагировала на ЛГ. Также происходило изменение морфологии клеток Y1-hFSHR: их эпителио-подобный фенотип изменялся на округлую форму в ответ на воздействие ФСГ. Сходные морфологические изменения были описаны для клеток Y1, стимулировавшихся действием АСТН (Yasumura et al., 1966, Cancer Res., 26, 529-535), а также для клеток Y1, которые были простимулированы TSH и микроинъецированы мРНК рецептора TSH (Parmentier et al., 1989, Science, 246, 1620-1622). Количество рекомбинантного ФСГ человека, необходимое для вполовину от максимальной (ED50) стимуляции выработки цАМФ в клетках CHO-hFSHR, составило 140 миллиед./мл, что существенно выше значения ED50 для признака уровня секреции прогестерона (4 миллиед./мл) в линии клеток Y1-hFSHR. Эти данные хорошо согласуются с ранее опубликованными данными (Fritz et al. , 1978, Can. J. Biochem., 56, 875-879; Fritz et al., 1978; Natl. Cancer Inst. Monogr., 48, 381-382): это указывает на то, что более высокие концентрации ФСГ необходимы для обусловливания максимального увеличения выработки цАМФ в изолированных культивируемых клетках Сертоли и что существенно меньшие концентрации необходимы для достижения максимального увеличения поздних проявлений, таких как транскрипция гена ароматазы и конверсии являющегося для нее субстратом андрогена в эстрадиол.
Пример 5
Конструирование мутантных генов рецепторов ФСГ человека, кодирующих внеклеточный домен (ECD)
Применение метода полимеразной цепной реакции (ПЦР) для конструирования мутантных вариантов ECD рецептора ФСГ
Способ формирования вектора, экспрессирующего внеклеточный домен (ECD) рецептора гонадотропина, был предложен Xie et al., 1990, J. Biol. Chem., 265, 21411-21414. Вкратце, метод полимеразной цепной реакции (ПЦР) в отношении перекрывающихся "выступов" (Но et al., 1989, Gene, 77, 51-59) был использован для отделения трансмембранного домена в составе рецептора LH-CG с образованием-фрагмента, который кодирует домен ECD, укороченный по остатку аланина-338. Специалист в данной области техники может легко использовать аналогичный подход с целью получения фрагмента, кодирующего домен ECD рецептора ФСГ, который бы был укорочен по остатку аргинина-349 в соответствии с последовательностью SEQ ID NO 2. Такой же способ может быть применен для формирования фрагментов ДНК, кодирующих меньшие по размеру фрагменты домена ECD рецептора ФСГ человека, для чего могут быть проведены изменения нуклеотидных последовательностей затравок в соответствии с 5'- и 3'-концевыми участками ДНК, кодирующих аминокислотную последовательность желаемой длины.
С другой стороны, расщепление рестриктазами в сочетании с использованием олигонуклеотидных кассет может быть использовано для получения мутантных вариантов, кодирующих различные варианты ECD. Примеры такого подхода описаны ниже.
Конструирование мутантного рецептора ФСГ человека с целью экспрессии полноразмерного домена ECD с использованием расщепления рестриктазами и кассетного мутагенеза
Мутантный вариант, соответствующий полному расшифрованному внеклеточному домену рецептора ФСГ человека, включает сигнальный сегмент секреции (от метионина-[17] до глицина-[1] согласно SEQ ID NO 2) и 349 аминокислотных остатков зрелого белка рецептора от цистеина-1 до аргинина-349 согласно последовательности SEQ ID NO 2. Общее число аминокислотных остатков, кодируемых фрагментом ДНК, используемым для экспрессирования в эукариотических клетках мутантного варианта составляет, таким образом, 366.
С целью конструирования 366-аминокислотного мутантного варианта домена ECD два фрагмента кДНК рецептора ФСГ человека - 5'-концевой 700-нуклеотидный XhoI/BamHI-фрагмент и срединный 734-нуклеотидный BamHI/-SphI-фрагмент (пример 2; фиг. 2.) - субклонировали в состав плазмиды pUC18-XhoI, предварительно расщепленной рестриктазами XhoI и SphI. Вектор pUC18-XhoI был сформирован путем конвертирования сайта рестрикции SmaI в составе полилинкера плазмиды pUC18 в XhoI-сайт с XhoI-линкерами. Плазмиду, несущую два фрагмента гена, кодирующего рецептор ФСГ человека, лигированные друг на друга с соблюдением правильной взаимоориентации, обозначили pHFSHR1.4xs. Эту плазмиду расщепляли рестриктазами EcoRV и SphI и полученный фрагмент длиной 3700 нуклеотидов очищали в геле.
Два комплементарных синтетических олигонуклеотида - muta3a и muta3b - конструируют таким образом, чтобы они кодировали аминокислоты от изолейцина-342 до аргинина-349 в соответствии с последовательностью SEQ ID NO 2, а также гексагистидиновый С-концевой "хвост" и стоп-кодон. После отжига эти олигонуклеотиды формируют кассету, которая может быть лигирована на 3700-нуклеотидный EcoRV/SphI-фрагмент из состава плазмиды pHFSHR1.4xs. В полученной в результате конструкции сохраняются сайты рестрикции EcoRV и SphI. В последовательности олигонуклеотидов вносят рестрикционный AseI-сайт, необходимый для скрининга конструкций, несущих данную синтетическую кассету. Полученную в результате кассету обозначают pHFSHR1.1XA. Секвенирование последовательности ДНК используют для подтверждения точности кодирования 366-аминокислотного домена ECD ФСГ человека плюс гексагистидинового "хвоста" и включения стоп-кодона ТАА. Понятно, что гексагистидиновый "хвост" включается только для того, чтобы облегчить очистку белка, т.е. точно такая же конструкция может быть создана без включения кодонов гистидина по участку, кодирующему С-концевую часть полипептида.
Конструирование меньших по размеру фрагментов домена ECD рецептора ФСГ человека путем "предоставления преимущества" имеющимся рестрикционным сайтам
Четыре мутантных варианта домена ECD рецептора ФСГ человека, обозначенные "а", "b", "с" и "d", конструируют на основе уникальных сайтов распознавания рестриктазами, имеющихся в полноразмерной последовательности кДНК, кодирующей рецептор ФСГ человека в соответствии с изображенным на фиг.8А. Конструирование мутантных вариантов рецептора ФСГ человека осуществляют путем субклонирования фрагментов кДНК их состава плазмиды hFSHRX, включающей соответствующую полноразмерную кДНК (фиг.2) в состав плазмиды рКВМ2. Плазмида рКВМ2 является производным от плазмиды pUC клонирующим вектором, имеющим полилинкерную последовательность, сконструированную таким образом, чтобы она включала уникальные рестрикционные сайты наряду со старт-кодоном и стоп-кодоном, в соответствии с показанным на фиг.8В. Субклонирование в состав полилинкерного участка плазмиды рКВМ2 обеспечивает наличие необходимых стоп-кодона и старт-кодона в каждой из создаваемых ДНК-конструкций.
Мутантный вариант "а" получают путем лигирования очищенного в геле 686-нуклеотидного XhoI/XbaI-фрагмента из состава hFSHRx на очищенную в геле плазмиду рКВМ2, обработанную рестриктазами XhoI и NheI. Подобным же образом мутантный вариант "b" получают путем лигирования очищенного в геле 759-нуклеотидного XhoI/SalI-фрагмента из состава hFSHRx на очищенную в геле плазмиду рКВМ2, обработанную рестриктазой XhoI. Мутантный вариант "с" получают путем лигирования очищенного в геле 966-нуклеотидного XhoI/BbsI-фрагмента из состава hFSHRx. Мутантный вариант "d" получают путем лигирования очищенного в геле 1074-нуклеотидного XhoI/NsiI-фрагмента из состава hFSHRx на очищенную в геле плазмиду рКВМ2, обработанную рестриктазами XhoI и PstI. Полученные в результате мутантные варианты "а", "b", "с" и "d" начинаются со старт-кодона сигнального сегмента (метионин-[17]) и оказываются укороченными по аминокислотным остаткам соответственно 206, 231, 302 и 335 согласно последовательности SEQ ID NO 2. Кодоны, контролирующие остановку трансляции, содержатся в составе полилинкера плазмиды рКВМ2. Секвенирование ДНК проводят в отношении всех мутантных вариантов с целью проверки ожидаемой структуры домена ECD.
Пример 6
Формирование клеточных линий, которые экспрессируют мутантные ECD-полипептиды рецептора ФСГ человека
Конструирование плазмидных векторов с целью экспрессирования мутантных вариантов ECD рецептора ФСГ человека
Для получения 366-аминокислотного мутантного варианта домена ECD рецептора ФСГ человека SphI-сайт плазмиды pHFSHR1.1XA может быть конвертирован либо в EcoRI-сайт, либо в XhoI-сайт путем обработки рестриктазой SphI, "затуплении" 3'-выступа первичных "липких концов" с применением ДНК-полимеразы Т4 или фермента Кленова ДНК-полимеразы I кишечной палочки и добавления в лигационную реакцию подходящих линкеров. После лигирования данную смесь обрабатывают подходящей рестриктазой (либо EcoRI, либо XhoI) и 1100-нуклеотидный фрагмент очищают в геле и встраивают по XhoI- или по EcoRI-сайту экспрессирующего вектора таким образом, чтобы была получена плазмида, такая как, например, показанная на фиг.3.
Подобным же образом мутантные варианты "а", "b", "с" и "d" могут быть вырезаны в виде XhoI-фрагментов, пригодных для встраивания в состав подходящих экспрессирующих векторов. Если выбранный экспрессирующий вектор не содержит в своем составе клонирующих сайтов, узнаваемых рестриктазами EcoRI или XhoI, то могут быть использованы линкеры, которые обеспечат конверсию либо концов фрагмента, либо клонирующего сайта в составе вектора в необходимый сайт. В одном из вариантов экспрессирующий вектор является пригодным для экспрессии в клетках млекопитающих: их организация близка к таковой, описанной в примере 2. В другом варианте экспрессирующим вектором является бакуловирусный вектор в соответствии с ранее описанным (Luckow & Summers, 1989, Virology, 170, 31-39). Также могут быть сформированы векторы и для других экспрессионных систем, таких как дрожжи и бактерии.
Экспрессия мутантных ECD-вариантов рецептора ФСГ человека в клетках млекопитающих
Векторы для клеток млекопитающих, экспрессирующие домен ECD рецептора ФСГ человека, используются в соответствии с описанным в примерах 2 и 3 с целью получения культуральных надосадочных фракций и клеток, содержащих биологически активный белок.
Экспрессия мутантных ECD-вариантов рецептора ФСГ человека в клетках насекомых
Бакуловирусные векторы, кодирующие домен ECD рецептора ФСГ человека, используют для совместной трансфекции вместе с линеаризованной ДНК, очищенной на материале генома вируса AcMNPV, вызывающего множественный полигедроз (полиэдроз) ядер у бабочки Autographa californica. Рутинные методы культивирования клеток насекомых и выработки вирусного титра осуществляются в соответствии с описанным у Саммерса и Смита (Summers & Smith, 1988, "A Manual of Methods for Baculovirus Vectors and Insect Cell Culture Procedures", Texas Agricult. Exper. Stat., Bull. N 1555, College Station, TX). Вектор, несущий ген ECD, и ДНК вируса AcMNPV используют в количестве 10 мкг и 1 мкг соответственно. Клетки Spodooptera frugiperda (Sf) (Американская коллекция типовых культур - Rockville, MD) трансфецируют с применением метода с фосфатом кальция (пример 3), а культуральную надосадочную фракцию собирали спустя 4 дня. Свежие монослойные культуры клеток Sf инфицируют серией десятикратных разведении культурального супернатанта и их накрывают 1,5%-ной низкоплавкой агарозой (SeaPlaque, FMC) в среде Грейса (Gibco) с добавлением 10% плодной телячьей сыворотки. После затвердевания этого покрытия агаровые чашки покрывают средой Грейса, включающей 10% плодной телячьей сыворотки, и культивируют в течение 4 дней при 27oС. После образования "бляшек" выделяют некоторые из рекомбинантных колоний (негативных по окклюзии). Проводят два круга очистки колоний. Очищенный рекомбинантнй вирус из этих колоний амплифицируют таким образом, чтобы получить вирионы для дальнейших инфекций. Структура рекомбинантного вируса подтверждается с применением анализа методами ПЦР и Саузерн-блоттинга. Культуральные надосадочные фракции, содержащие биологически активные фрагменты домена ECD рецептора ФСГ человека, получают путем высева клеток Sf в виде монослоев в колбах для культивирования тканей. Клетки Sf, культивировавшиеся в среде Грейса с добавлением 10% плодной телячьей сыворотки, инфицируют рекомбинантным вирусом и затем культивируют в течение 4 дней при 27oС.
Пример 7
Анализ параметров связывания ФСГ мутантными вариантами ECD рецептора ФСГ человека
Анализ связывания ФСГ с целью оценки активности белка ECD в кондиционированной культуральной среде и клеточных фракциях
Специфическое связывание с 125I-меченным ФСГ определяют для клеточного сгустка и фракций клеточного лизата, равно как и для кондиционированной культуральной среды. Образцы культуральной надосадочной фракции разводят серийно в гомогенизирующем буфере (25 М сахарозы, 0,05 М HEPES, рН 7,5, 5 мМ MgCl2 и 5 мМ CaCl2), содержащем 0,1% (в/о) бычьего сывороточного альбумина. В вариантах с клеточным сгустком и фракциями клеточного лизата 500 тысяч клеток суспендируют в 1 мл гомогенизационного буфера и затем гомогенизируют с помощью устройства "dounce". Суспензию центрифугируют при 16000g в течение 30 минут при 4oС. Одну 40-мкл аликвоту надосадочной фракции используют для определения белка (BioRad Protein Assay kit) и две 90-мкл аликвоты используют для анализа на связывание ФСГ. Клеточный сгусток ресуспендируют в 200 мкл гомогенизационного буфера и разделяют на 90-мкл аликвоты для анализа на связывание ФСГ.
В тесте на связывание 90 мкл тестируемого образца (которым является разбавленный культуральный супернатант, клеточный лизат или солюбилизованный клеточный сгусток), 10 мкл 125I-ФСГ (96000 имп/мин, 1,1 нМ) и 10 мкл воды или 1,2 мкМ рекомбинантного ФСГ человека объединяют в фальконовской полипропиленовой пробирке 12х75 мм. Полученную смесь инкубируют при 37oС в течение 45 минут. Раствор помещают на лед и добавляют 50 мкл 0,5%-ного (в/о) гамма-глобулинового буфера (в 50 мМ Трис - рН 7,35). Спустя 5 минут в каждый образец добавляют по 160 мкл 21%-ного (в/о) раствора PEG-8000 (в 50 мМ Трис - рН 7,25). Образцы оставляют на льду примерно на 1 час. Преципитат сгущают центрифугированием при 3000g. С целью снижения доли неспецифического связывания до менее чем 15% от уровня общего связывания проводят вторичную преципитацию. Отсасывают надосадочную фракцию и сгусток растворяют в 1 мл 0,1% (о/о) Тритон Х-100 в ФСБ, разбавляют 0,5 мл 0,5%-ного гамма-глобулинового буфера с последующим добавлением 1,5 мл раствора PEG-8000. Смесь оставляют на льду на 30 минут, затем центрифугируют при 3000g, а надосадочную фракцию удаляют отсасыванием. Сгустки обсчитывают на γ-счетчике. Показатели специфического связывания меченного 125I-ФСГ, выраженные в имп/мин, подсчитывают по величине общего связывания 125I-ФСГ за вычетом показателя неспецифического связывания.
Параметры специфического связывания 125I-ФСГ, определенные для фракций клеток с вариантами мутантных конструкций "а", "b", "с", "d" и 366-аминокислотного ECD рецептора ФСГ (пример 5), экспрессированных в клетках СНО, показаны в таблице. Клетки СНО, экспрессирующие полноразмерный рецептор ФСГ человека и нетрансфектированная исходная клеточная линия СНО включены в качестве контролей.
Полученные результаты показывают, что в случае мутантных вариантов "b", "с", "d" и 366 основная часть связывания 125I-ФСГ приходится на фракцию гомогенизированного клеточного лизата. В случае с мутантным вариантом "а" связывание 125I-ФСГ сходно с таковым, наблюдаемым в исходной клеточной линии СНО для большинства проанализированных клеточных фракций. Следовательно, вариант "а" либо нормально не экспрессируется, либо не обладает существенной активностью по связыванию ФСГ. В варианте с полноразмерным рецептором ФСГ основное связывание локализуется во фракции клеточного сгустка: это указывает на его обогащенность, как и ожидалось, ассоциированными с мембранами рецепторами.
Анализ по методу Скатчарда проводят с целью определения аффинности по связыванию ФСГ мутантных вариантов "b", "с", "d" и 366 в сравнении с полноразмерным рецептором. Полученные результаты показывают, что величины Kd для вариантов "с", "d" и 366 равны соответственно 1,15•10-10, 0,8•10-10 и 3,33•10-10, т. е. сходны с показателем Kd, определенным для полноразмерного рецептора - 2,27•10-10. Мутантный вариант "b" характеризуется приблизительно на порядок более высокой величиной Kd, составляющей 2,4•10-9.
Заключение, вырисовывающееся из проведенного анализа, указывает на то, что фрагменты домена ECD рецептора ФСГ человека, которые включают аминокислоты 1-231 в соответствии с SEQ ID NO 2, достаточны для связывания ФСГ с высоким уровнем аффинности. Однако фрагменты, которые состоят из аминокислот 1-302 согласно SEQ ID NO 2, проявляют наивысшие показатели аффинности, эквивалентные таковым, которые характерны для интактного полноразмерного рецептора.
Пример 8
Очистка мутантных вариантов ECD рецептора ФСГ человека
Очистка мутантных вариантов ECD рецептора ФСГ человека, включающих гексагистидиновый "хвост" (гексагистидил)
Для мутантных вариантов домена ECD рецептора ФСГ человека, сконструированных таким образом, чтобы по их С-концам находился гексагистидиновый "хвост", была применена аффинная очистка с использованием иммобилизационной металл-аффинной колонки. Колонка включает никель, присоединенный как хелатирующий агент к смоле, с которой связана нитрилтриуксусная кислота. Четыре из шести сайтов хелатирования на данной колонке заняты никелем, а два сайта остаются свободными и могут хелатироваться гистидином. Элюция обеспечивается либо снижением рН, либо добавлением имидазола. Кислые значения рН приводят к протонированию гистидина, в результате чего происходит его диссоциация от нитрилтриуксусной кислоты. Имидазол конкурирует с гистидином за нитрилтриуксусную кислоту, что также обеспечивает диссоциацию белка от смолы. Эффективность промывки и элюции нитрилтриуксусной кислоты контролируют с помощью анализа методом электрофореза в SDS-ПААГ с целью визуализации белков.
Очистка мутантных вариантов ECD рецептора ФСГ на ФСГ-аффинной колонке
С целью очистки мутантных полипептидов ECD рецептора ФСГ человека, не включающих гексагистидинового "хвоста", или для дальнейшей очистки мутантных вариантов, включающих гексагистидиновый "хвост", приготавливают аффинную смолу, на которой иммобилизован ФСГ. ФСГ ковалентно связывается на цианобромидной смоле по первичным аминам белка. С целью предотвращения разрушения колонки из-за диссоциации субъединиц ФСГ при жестких условиях промывки или элюции применяется метод формирования поперечных сшивок α- и β-субъединиц ФСГ перед тем, как ФСГ иммобилизуют на смоле. Предположительно поперечное сшивание происходит между первичными аминами и карбоксильными группами, которые находятся рядом друг с другом по типу того, как это имеет место в нековалентных солевых "мостиках", предположительно вовлеченных в формирование гетеродимера. Перекрестно сшитый материал затем отделяют и от реагентов, и от внемолекулярно сшитой ФСГ с применением метода гель-фильтрации, а эффективность перекрестного сшивания определяют с помощью электрофореза в SDS-ПААГ в условиях, которые бы обеспечивали диссоциацию несшитого перекрестным образом материала. Очищенный перекрестно сшитый материал затем закрепляют на цианобромидной смоле для использования в очистке рецептора.
Пример 9
Тестирование биологической активности in vitro мутантных вариантов ECD рецептора ФСГ человека в клетках, стабильно трансфецированных рецептором ФСГ человека
Клетки Y1-hFSHR (примеры 3 и 4) могут быть использованы для оценки биологической активности in vitro мутантных вариантов ECD рецептора ФСГ человека в тесте на конкуретное связывание с ФСГ человека. Применяется по существу та же процедура, которая была описана в примере 4 в связи с тестированием на прогестерон. Приготавливают серийные разведения мутантных полипептидов ECD рецептора ФСГ человека и добавляют к постоянной концентрации ФСГ (например, концентрации, которая в отсутствие антагониста обеспечивает 80% максимальной стимуляции в данном тесте). Биологически активный полипептид ECD рецептора ФСГ человека предотвращает индуцируемую ФСГ выработку прогестерона при эффективной концентрации и свыше ее, что определяется с помощью серийных разбавлений.
Пример 10
Тестирование биологической активности in vivo мутантных вариантов ECD рецептора ФСГ человека на модели крысы
Хорошо изученные прижизненные модели, основанные на самках и самцах крыс линии Sprague-Dawley, применяются для оценки биологической активности гонадотропинов: соответственно они пригодны и для тестирования активности мутантных вариантов ECD рецептора ФСГ человека.
Тестирование in vivo биологической активности мутантных вариантов ECD рецептора ФСГ человека с использованием самок крыс
Самкам крыс линии Sprague-Dawley в возрасте 25 дней внутрибрюшинно инъецировали ФСГ человека (5-10 ед.), ECD рецептора ФСГ человека, смесь ФСГ человека и мутантных вариантов ECD рецептора ФСГ человека (оптимальные соотношения определяют экспериментальным путем) или только наполнитель. Спустя 48 часов животных умерщвляли и у них выделяли яичники. Отбирали тканевые образцы и помещали их в 4%-ный формалин для последующего гистологического анализа.
Для морфометрического анализа яичники оставляли зафиксированными на 12 часов в 4%-ном формалине, заливали в парафин и готовили ультратонкие срезы толщиной 3 мкм. Последовательные срезы распластывали на предметных стеклах на каждые 50 мкм. Интервалы такого размера (50 мкм) были выбраны, исходя из диаметра ооцитов (80 мкм): в результате каждый фолликул может быть проанализирован без избыточности. Гистологические препараты окрашивали смесью гематоксилина и эозина. Нормальные и атретические (внепросветные) фолликулы подсчитывали, основываясь на следующих морфологических критериях: внешний вид ооцита, наличие слоя гранулезных клеток и число слоев гранулезных клеток в соответствии с критериями Вудруффа с соавт. (Woodruff et al., 1989, In "Growth Factors and the Ovary", ed. A.N. Hirschfield, pp. 291-295, New York, Plenum Press; Osman, 1985, J. Reprod. Fertil., 73, 261-270).
Для определения индекса пролиферации яичники, взятые у животных, которым перед этим вводили меченый 3Н-тамилин, фиксируют так же, как и нерадиоактивные образцы, и готовили ультратонкие срезы толщиной 3 мкм. Препараты погружали в авторадиографическую эмульсию, экспонировали в течение 2-4 недель при 4oС, проявляли и окрашивали. Затем подсчитывали количество ядер, содержащих гранулы серебра.
Диаметр фолликулов определяли с использованием анализатора изображения Bioquantтм. Проводили измерения в двух направлениях, находящихся под прямым углом друг к другу на уровне "мостика" гранулезных клеток, ведущего к кумулюсу и ооциту. Повторные измерения исключались потому, что изображение первого среза сохранялось в памяти компьютера и затем накладывалось на изображение последующего среза.
Размер фолликула является индикатором фертильности: размер фолликула увеличивается в размере в ходе созревания и становится готовым к овуляции, т.е., таким образом, является морфологическим маркером зрелого ооцита. Полученные результаты показывают, что яичники, обработанные наполнителем, и яичники, характеризующиеся оптимальным соотношением концентраций ФСГ и биологически активного полипептида ECD рецептора ФСГ, в основном содержат ооциты трофоплазматического роста (их диаметр составляет менее 250 мкм). При действии на животных чистого ФСГ отмечается присутствие как небольших фолликулов (250 мкм), так и крупных фолликулов (>500 мкм). Эти данные подтверждают, что домен ECD рецептора ФСГ человека обусловливает ослабление активности ФСГ.
Нормальное созревание фолликулов дополнительно контролируют путем введения в растущие фолликулы 3Н-тимидина. В препубертальных фолликулах после воздействия только наполнителя выявляется низкий уровень включения в пристеночные гранулезные клетки, клетки теки и клетки discus proligerus (т.е. клетки кумулюса и прилегающие к нему клетки). В этой группе помеченными оказались не все фолликулы. Воздействие ФСГ обусловливают стимуляцию роста фолликулов с согласованным усилением включения 3H-тимидина в гранулезные клетки и клетки теки (оболочечные клетки); однако при сочетании воздействия. ФСГ с ECD-доменом рецептора ФСГ включения меченого 3H-тимидина в гранулезные клетки и клетки теки не происходит. В противоположность воздействию "чистого" наполнителя, в варианте воздействия ФСГ большинство фолликулов, причем различного размера (стадии роста) включают радиоактивную метку. Морфологически крупные фолликулы у животных, на которых одновременно воздействовали ФСГ и ECD-доменом рецептора ФСГ, являются атретическими. Эти данные являются дополнительным подтверждением того, что домен ECD рецептора ФСГ человека является биологически активным и блокирует активность собственно ФСГ в модели in vivo.
Тестирование in vivo биологической активности мутантных вариантов ECD рецептора ФСГ человека с использованием самцов крыс
Неполовозрелым самцам крыс (возраст 21 день, вес - в пределах 45-50 г) подкожно инъецировали полипептид ECD рецептора ФСГ человека в течение 2 дней каждые 6 часов. Контрольным животным вводили только наполнитель. Эффективные дозы были определены экспериментальным путем. Спустя 2 дня после исходной инъекции у обездвиженных животных удаляли семенники, взвешивали их и приготавливали срезы для гистологического анализа.
Полученные данные показали, что введение крысам домена ECD рецептора ФСГ обусловливает дегенерацию семенниковой ткани и существенное замедление роста семенников. Напротив, у контрольных животных не отмечалось ни замедление роста семенников, не тканевая дегенерация в них. Эти данные показывают, что домен ECD рецептора ФСГ способен нейтрализовывать активность эндогенного ФСГ, который является необходимым для нормального роста и развития семенников в процессе полового созревания.
Пример 11
Фармацевтическое использование ECD рецептора ФСГ человека для лечения пациентов
Как уже обсуждалось в разделе "Подробное описание изобретения", очищенный препарат рецептора ФСГ человека может быть использован для связывания с эндогенным ФСГ и нейтрализации его активности. У пациентов-мужчин введение полипептида ECD человеческого рецептора ФСГ должно приводить к снижению интенсивности или блокировке сперматогенеза. У пациентов-женщин введение растворимых форм ECD человеческого рецептора ФСГ должно приводить к снижению или блокированию развития фолликулов и выработке эстрогенов. Это будет обусловливать инфертильность, т.е. такое воздействие можно использовать в качесте способа контрацепции. Другое терапевтическое применение может включать применение ECD рецептора ФСГ человека с целью снижения выработки эстрогенов яичниками. Это может быть ценным при лечения таких заболеваний, как рак молочной железы и эндометриоз. Полипептид ECD рецептора ФСГ также может быть использован для снижения числа развивающихся фолликулов в процессе проведения искусственного оплодотворения. Это может найти свое конкретное применение при лечении пациентов с диагнозом поликистоза яичников, которые склонны к развитию синдрома гиперстимуляции яичников.
Подходящие очищенные мутантные варианты ECD рецептора ФСГ человека приготавливают в виде фармацевтических композиций, предназначенных для введения пациентам. Примеры таких фармацевтических композиций описаны в разделе "Подробное описание изобретения".
Дозировки
Дозы лекарственного средства, предназначенные для введения пациенту, определяются в соответствии с клинической практикой и будут варьироваться в зависимости от таких факторов, как возраст пациента, рост, вес тела, пол, анамнез и общее состояние здоровья. Обычно желательным является введение реципиенту исходной дозы от примерно 300 мкг/кг до примерно 10 мг/кг (в отношении веса тела пациента), ежедневно или несколько раз (например, 3 раза) в неделю, хотя могут быть использованы и более высокие, и более низкие дозировки.
В частности, дозу определяют, основываясь на фармакологических параметрах выведения введенного мутантного варианта ECD рецептора ФСГ, для чего применяются стандартные фармакологические подходы, известные в данной области техники. Способы приготовления таких дозировок известны и являются очевидными для специалистов: см., например, A.R. Gennaro (ed.), "Remington's Pharmaceutical Sciences", 18th ed., Mack, Easton Pa, 1990.
Концентрация молекул по изобретению в фармацевтических композициях не является критическим параметром, но обычно находится в пределах от примерно 1 мкг/мл до примерно 20 мг/мл.
Мониторинг пациентов-мужчин по имеющемуся биологическому действию осуществляется с использованием таких критериев, как подсчет числа сперматозоидов, определение их подвижности и жизнеспособности. Наблюдение пациенток-женщин в связи с возможным биологическим действием связано с мониторингом развития фолликулов, для чего используется высокоразрешающая ультразвуковая сонография, а также контроль за содержанием эстрогенов в крови. Влияние введения биологически активных мутантных вариантов ECD рецептора ФСГ человека у мужчин должно проявляться в снижении числа сперматозоидов (олигозооспермии), снижении их подвижности, жизнестойкости и нарушении их морфологии, в то время как у пациенток-женщин результат такого воздействия связан со снижением уровня сывороточного эстрогена, подавлением развития фолликулов и отсутствием овуляций.
Список последовательностей приведен в конце описания.








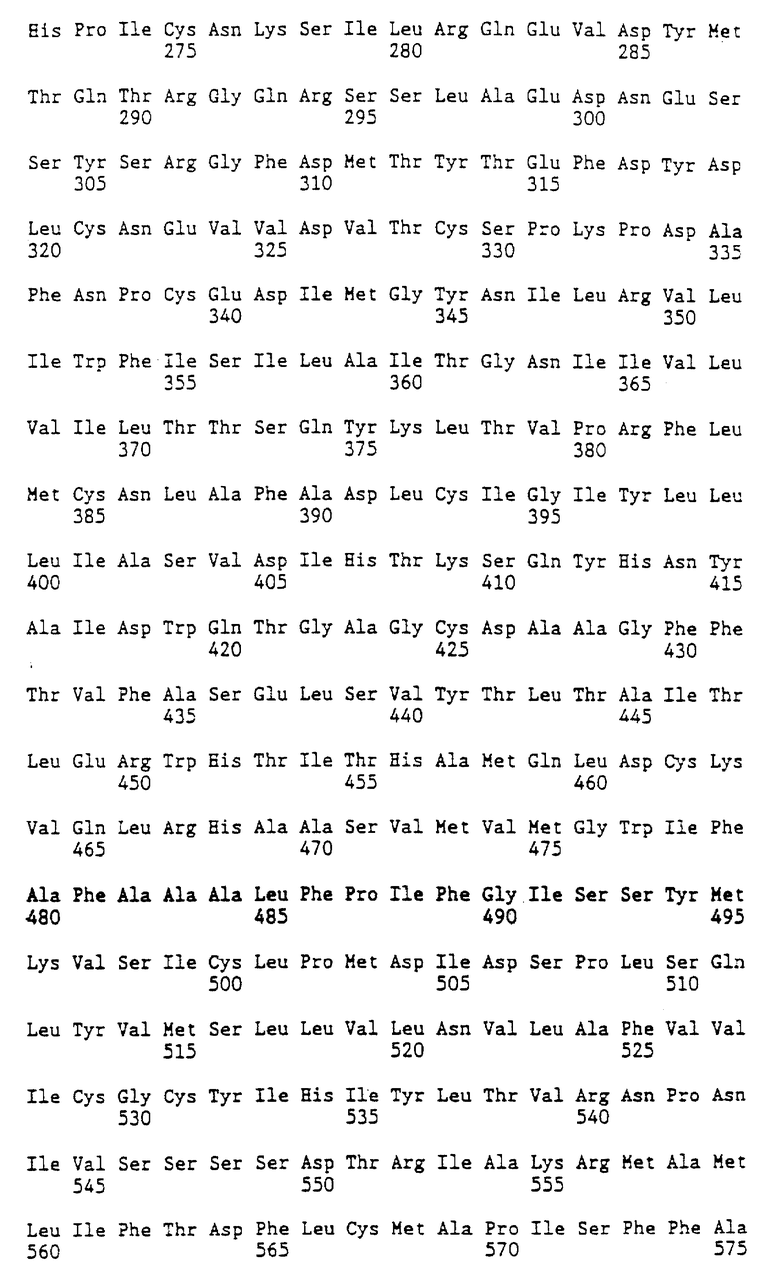

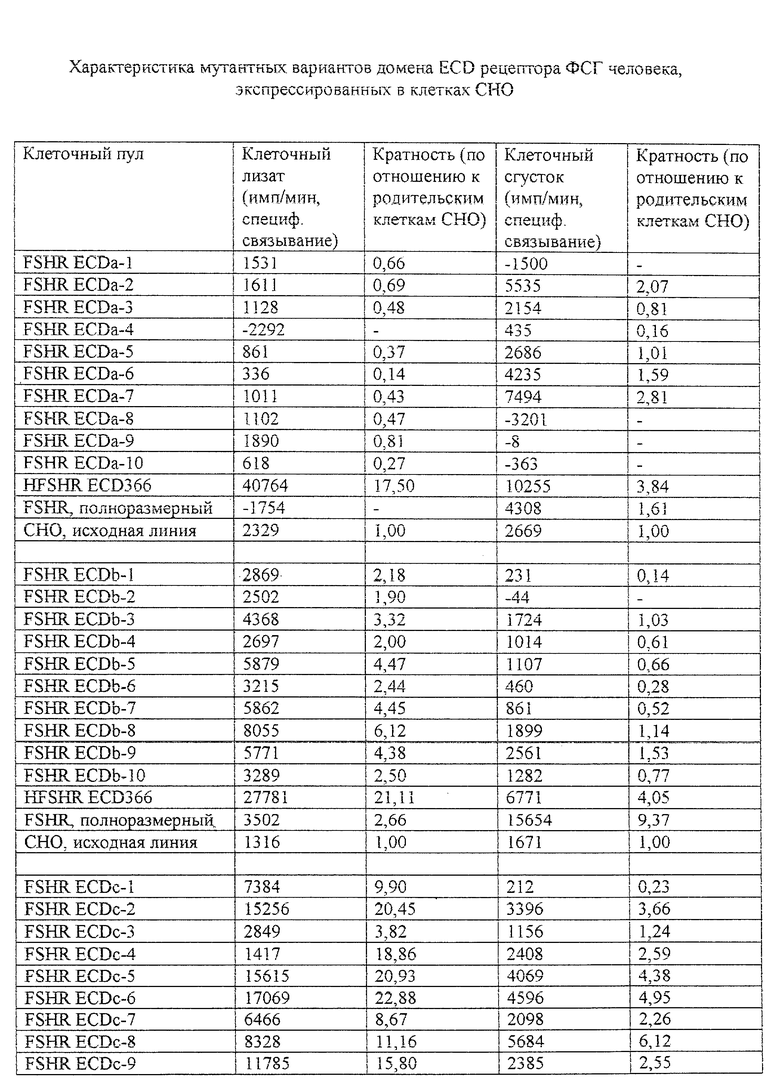
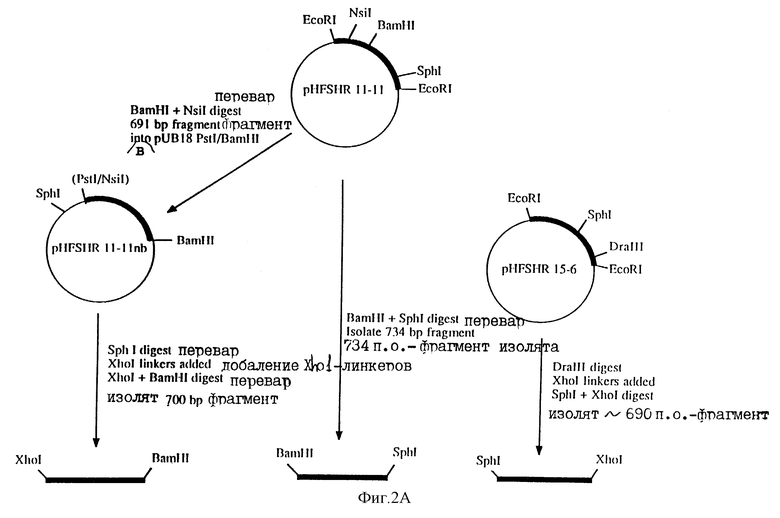
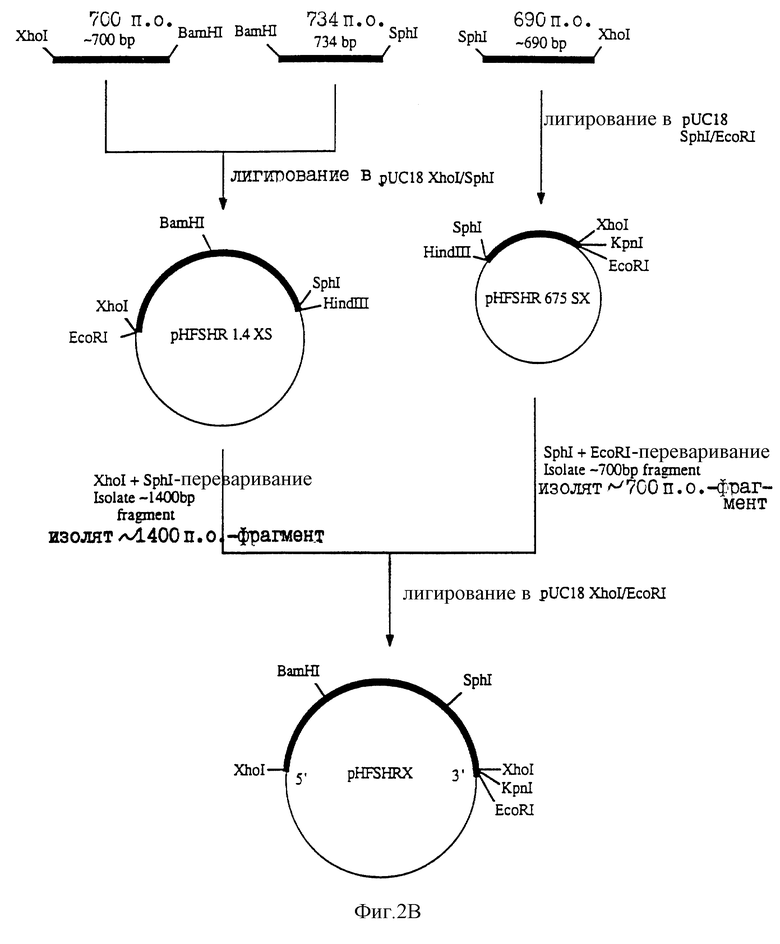
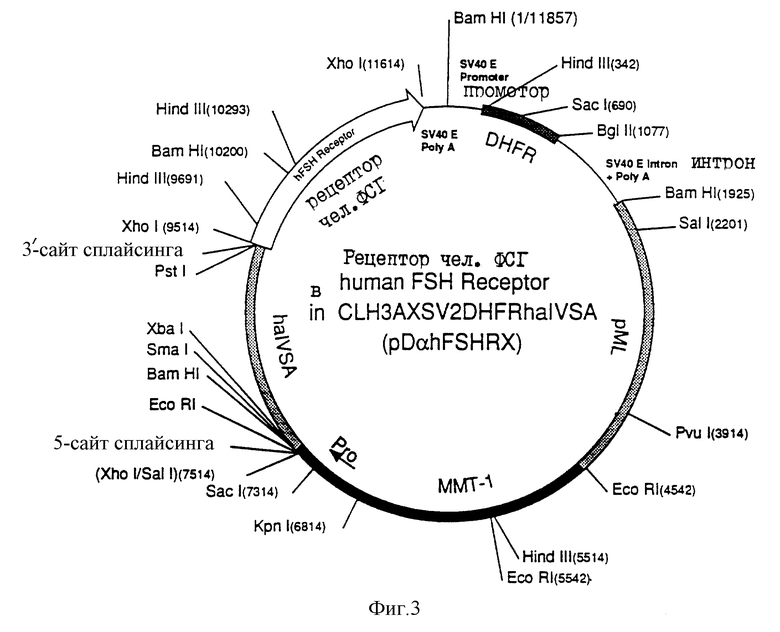
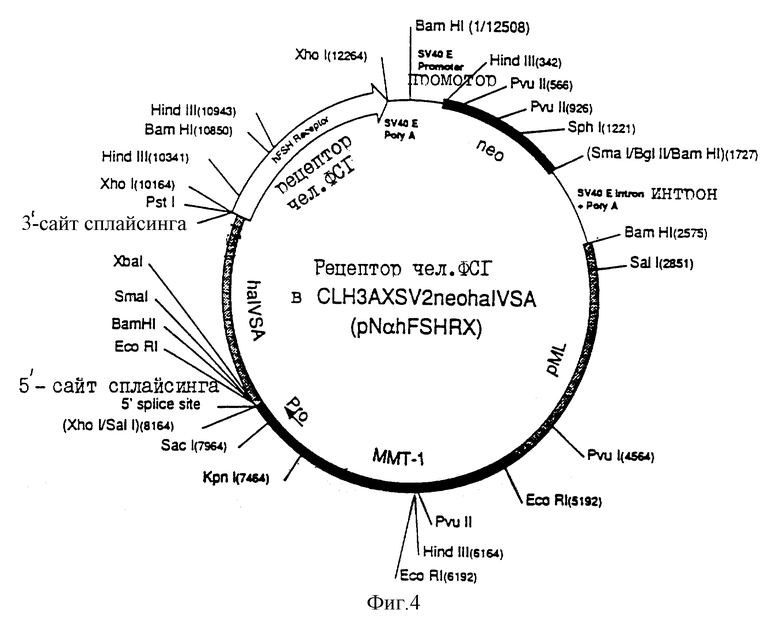
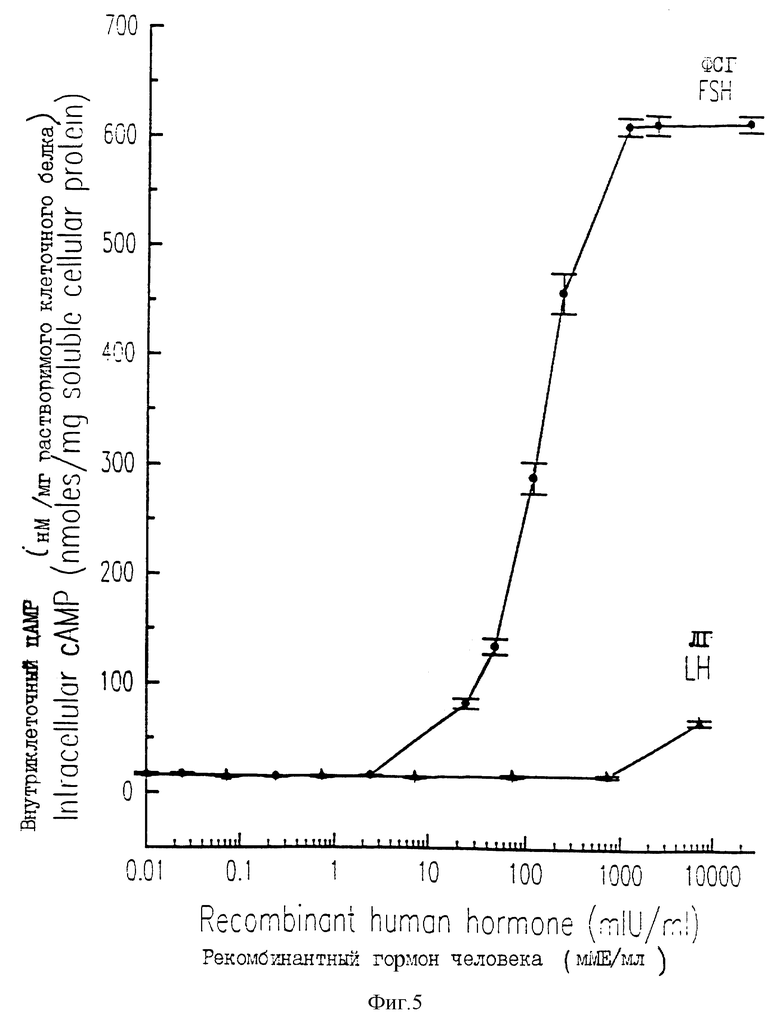
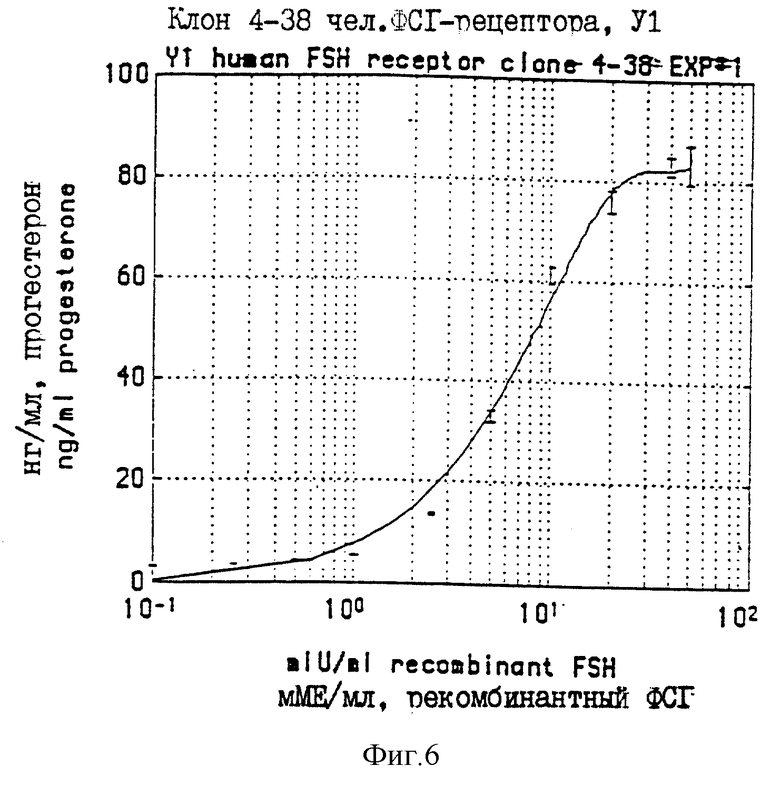
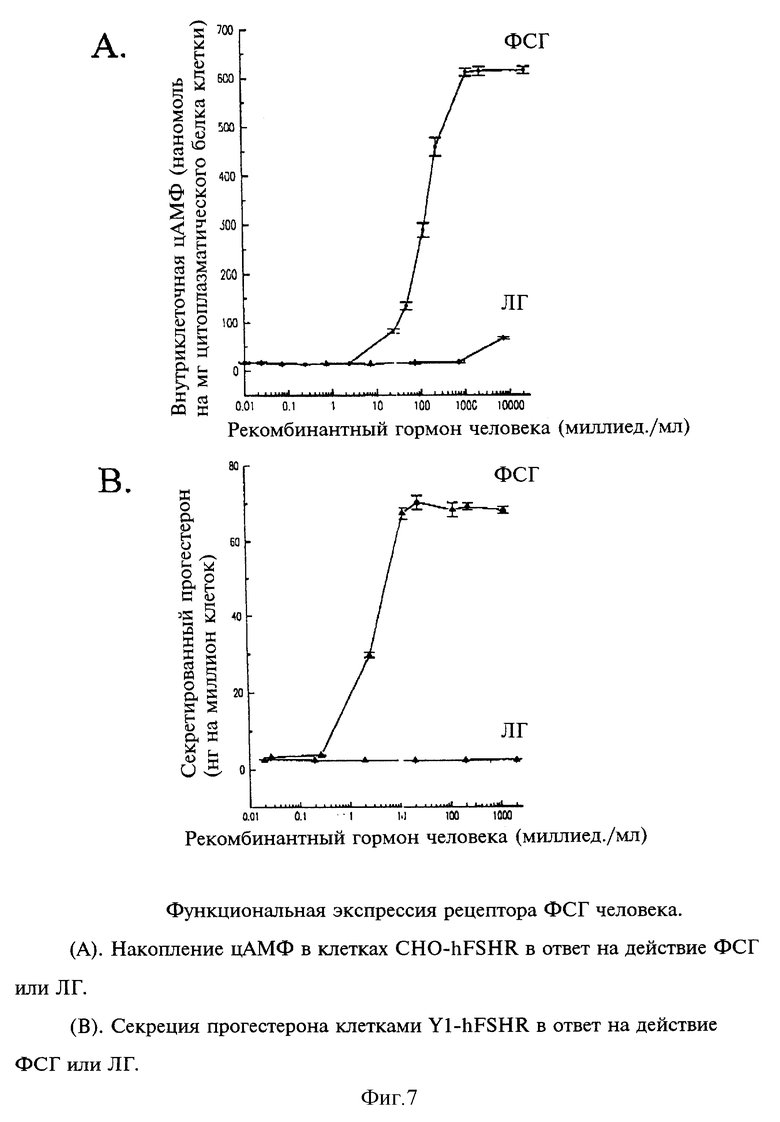

Изобретение относится к области молекулярной биологии и генетической инженерии и может быть использовано в фармацевтической промышленности, а также в медицинской практике с целью снижения эндогенной активности фолликулостимулирующего гормона (ФСГ). Путем скрининга кДНК-библиотеки определена полная нуклеотидная последовательность, кодирующая рецептор ФСГ человека. Включение этой последовательности в экспрессионный вектор и трансфекция полученным вектором клеток-хозяев позволили осуществить выделение и очистку функционально активной рекомбинантной формы рецептора. Наряду с полноразмерным полипептидом ФСГ-рецептора человека методом рекомбинантных ДНК получены укороченные с С-конца фрагменты, сохраняющие способность к связыванию ФСГ. Предложена фармкомпозиция для снижения эндогенной активности ФСГ, включающая в качестве активного начала рекомбинантный рецептор ФСГ человека или его активный фрагмент. 5 с.п. ф-лы, 8 ил., 1 табл.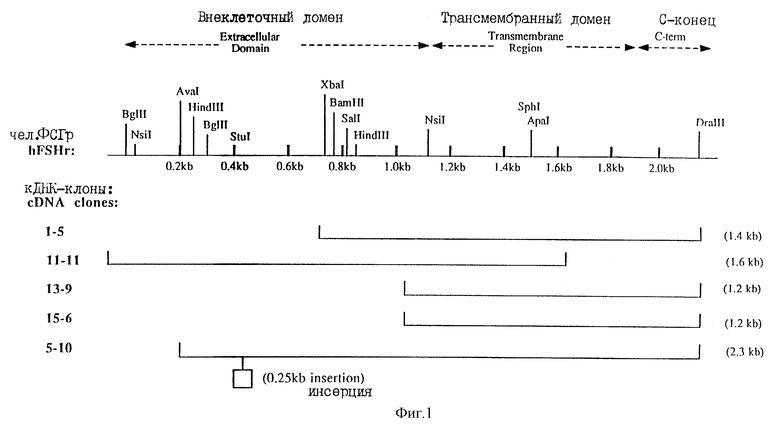
| SPRENGEL et al | |||
| Molecular Endocrinology, 1990, v.4, № 4, p.525-530 | |||
| WO 9013643 A (GENENTECH), 15.11.1990 | |||
| US 4921808 (SCHNEYER et al.), 01.05.1990. |
Авторы
Даты
2002-11-27—Публикация
1992-01-02—Подача