Заявленное техническое решение относится к новому антигену паразитических простейших рода Eimeria. Этот антиген может быть различным образом использован для защиты домашней птицы от кокцидиоза.
Кокцидиоз - это заболевание домашней птицы, которое вызывается паразитическими простейшими рода Eimeria. Оно встречается в больших хозяйствах, интенсивно занимающихся разведением домашней птицы. Ежегодно для химиотерапии заболевания только в одних США используется более 100 млн.долл. Развитие устойчивости к известным антикокцидиальным препаратам требует постоянной разработки новых лекарств, в то время как стоимость этих работ становится очень дорогой и, кроме того, возникает необходимость в уменьшении содержания остатков лекарственных препаратов в животной пище.
Протективный иммунитет к естественной кокцидиальной инфекции хорошо изучен. Показано, что контролируемое ежедневное введение в течение нескольких недель небольшого количества жизнеспособных ооцист вызывает развитие полного иммунитета к инфекции, вызванной нормальной вирулентной дозой возбудителя /Rose et al., Parasitology 73 : 25, 1976; Rose et al., Parasitology 88 : 199, 1984/. Создание приобретенной устойчивости к инфекции делает возможным разработку вакцины для развития иммунитета у молодых цыплят, при этом отпадает необходимость в химических кокцидиостатиках. Действительно этот подход был применен фирмой Sterwin Labaratories, Opelika, AL, разработавшей препарат КокцивакTM.
Имея в виду создание вакцины против кокцидиоза, Murray et al., заявка на Европейский Патент N 167443, приготовили экстракты из спорозоитов или спорулированных ооцист Eimeria tenella, которые содержали по крайней мере 15 полипептидов, многие из которых были ассоциированы с поверхностными белками спорозоитов. Инъекция этих экстрактов цыплятам уменьшала повреждения слепой кишки при последующем оральном введении вирулентных спорулированных ооцист E.tenella.
Вслед за этим Schenkel et al., Патент США N 4650676, получили моноклональные антитела к мерозоитам E.tenella. С помощью этих антител Schenkel et al. идентифицировали определенное количество антигенов, к которым были направлены эти антитела. Предварительная инкубация спорозоитов E.tenella с полученными антителами при дальнейшем введении таких спорозоитов в слепую кишку цыплят уменьшала количество повреждений по сравнению с контролем, когда для инъекции использовались необработанные спорозоиты.
С помощью технологии рекомбинантных ДНК Newman et al. /Заявка на Европейский Патент N 164176/ клонировали ген, кодирующий антиген мол. массы 25 кДа, который обнаруживается у спорозоитов E.tenella. Сыворотка цыплят, неоднократно иммунизированных убитыми спорозоитами E.tenella, преципитировали этот антиген в мембранных препаратах спорозоитов и иодированных препаратах спороцист. Затем Jenkins /Nucleic Acids Res, 16 : 9863, 1988/ описал кДНК, кодирующую участок поверхностного белка /мол. масса 250 кДа/ мерозоитов Eimeria acervulina. Экспрессию продукта, кодируемого этой кДНК, определяли с помощью антисыворотки и E.acervulina.
Совершенствование технологии рекомбинантных ДНК позволило разработать другой подход к проблеме, а именно создание субъединичной вакцины. Примеры таких вакцин приведены в заявках на Европейский патент N 324648, 337589 и 344808.
Настоящее изобретение относится к иммуногенным полипептидам, имеющим аминокислотную последовательность (1) (SEQ ID NO:1) (см в конце описания). и которые могут быть использованы для генерации иммунного ответа на антигены Eimeria, например у цыплят. Описываемый здесь белок - предшественник поверхностного антигена мерозоитов Eimeria имеет аминокислотную последовательность, соответствующую последовательности (1) (SEQ ID NO : 1).
Предпочтительным полипептидом согласно настоящему изобретению является иммуногенный полипептид, имеющий аминокислотную последовательность (1) (SEQ ID NO : 1), но утративший на N-конце аминокислотную последовательность, соответствующую сигнальному пептиду. Изобретение, кроме того, охватывает функционально эквивалентный полипептид аминокислотной последовательности SEQ ID NO : 1, в которой определенные аминокислотные участки заменены на другие, делетированы или вставлены, причем без существенного изменения иммуногенных свойств первоначального пептида.
Далее, данное изобретение охватывает ДНК, кодирующую целиком или часть белка - предшественника поверхностного антигена мерозоитов Eimeria, например ДНК нуклеотидной последовательности (A) (SEQ ID NO : 2) (см. в конце описания) или ДНК, соответствующую частям этой нуклеотидной последовательности, например ДНК нуклеотидной последовательности (B). Последовательность B аналогична (A) (SEQ ID NO : 2), но не имеет нуклеотидной последовательности, кодирующей сигнальный пептид. Кодон ATG предпочтительно добавляется к началу молекулы ДНК, входящей в состав более крупной молекулы, имеющей аминокислотную последовательность (A) (DEQ ID NO : 2). Эту операцию осуществляют хорошо известными методами. Кроме того, данное изобретение включает рекомбинантные векторы, содержащие указанные ДНК и обеспечивающие их экспрессию в совместимых организмах - хозяевах, и микроорганизмы, несущие такие векторы.
Далее, изобретение относится к способу получения указанных выше полипептидов, который предусматривает:
а/ культивирование микроорганизма, содержащего рекомбинантный вектор, несущий ДНК нуклеотидной последовательности, которая кодирует указанный полипептид, например ДНК нуклеотидной последовательности (A) (SEQ ID NO : 2) или ее фрагмент, например нуклеотидную последовательность (B), в условиях, обеспечивающих экспрессию этой ДНК или ее фрагмента и
б/ выделение рекомбинантного полипептида из культуры.
Кроме того, изобретение охватывает вакцину для защиты от кокцидиоза /например, человека или животных/, содержащую эффективное количество одного или более полипептидов, описанных выше, и физиологически подходящий носитель. Предпочтительно вакцина используется для защиты домашней птицы /например, цыплят и индюшат/. В других случаях это могут быть домашние животные, такие как кролики или овцы.
Изобретение включает и вакцины для защиты против кокцидиоза, которые содержат рекомбинантный вирус. В состав вируса входит последовательность ДНК, кодирующая указанный выше полипептид, и вирус способен обеспечить экспрессию этой последовательности. Кроме того, в состав вакцины входит подходящий физиологический носитель.
Далее, изобретение относится к способу защиты от кокцидиоза, заключающемуся в том, что эффективным количеством вакцины иммунизируют соответствующий организм, который чувствителен к кокцидиозу, например цыплят.
Полипептиды Eimeria, которые являются предметом настоящего изобретения, - это важные вакцинные антигены, поскольку они идентифицированы с помощью антител, содержащихся в сыворотке животных, иммунизированных против кокцидиоза и вследствие этого ставших иммунными. Поэтому, наиболее вероятно, что данные полипептиды сыграют существенную роль в защите домашней птицы от кокцидиоза.
Изобретение может быть понято более быстро с помощью рисунков, которые описаны ниже.
На фиг. 1 показана нуклеотидная последовательность молекулы к ДНК /1,2 кв/, которая кодирует белок - предшественник Eimeria распознаваемый с помощью специфических антител из иммунной сыворотки кроликов или цыплят. Как видно из фиг. 1, нуклеотидная последовательность указанного белка начинается с кодона ATG /A соответствует 68 нуклеотиду/ и заканчивается стоп - кодоном TAA /T соответствует 1013 нуклеотиду/, кодируя 315 аминокислот. Кроме того, на фиг. 1 показана аминокислотная последовательность белка - предшественника Eimeria, которая была предсказана на основе данной нуклеотидной последовательности. Для обозначения нуклеотидов и аминокислот используются стандартные буквенные коды, которые можно расшифровать с помощью обычного биохимического учебника; например см. Lehninger, Principles of Biochemistry, 1984, Worth Punlishers, Inc., New York, pp. 96, 798.
На фиг. 2 приведены результаты электрофоретического разделения различных белков мерозоитов Eimeria в полиакриламидном геле, содержащем додецилсульфат натрия /SDS/. На фиг. 2A показаны результаты иммуноблоттинга, т.е. взаимодействия препарата тотальных белков мерозоитов с контролем /а/ или специфическими антителами /б/. Стрелкой отмечена полоса, содержащая белок мол. массы около 23 кДа. Фиг. 2 B - это авторадиограмма, показывающая иммунопреципитацию поверхностных белков мерозоитов, меченных 125J, с контролем /a/ и специфическими антителами /b/. На фиг. 2 C показано разделение полной смеси белков, образовавшихся в результате трансляции in vitro poly /A/ РНК мерозоитов /c/, а также: результаты иммунопреципитации этих продуктов с антителами, отобранными с помощью клона 5-7 фага лямбда /b/; антителами, выделенными с помощью другого фагового клона, который продуцирует белки, взаимодействие с сывороткой к мерозоитам /a/; и с контрольными антителами, выделенными из сыворотки к мерозоитам с помощью нерекомбинантных фагов /d/. Полосы проявляли путем флуорографии. Положение маркеров мол. массы, /которая выражена в килодальтонах, кДа/, отмечено на рисунках справа.
На фиг. 3 показаны результаты Саузерн - блоттинга геномной ДНК спорулированных ооцист Eimeria tenella, которая была расщеплена рестриктазами Pvu II /линия 1/, Hinc II /линия 2/, Pst I /линия 3/, Sph I /линия 4/ или Sac I /линия 5/, с EcoR I - Фрагментом клона 5-7 в качестве пробы. Положения стандартных ДНК, имеющих известные размеры в кв. показаны справа.
На фиг. 4 приведено схематическое изображение плазмиды pDS56/RBSII /без указания масштаба/. Здесь и далее на фиг. 6, 8 и 10 символы B, E, H, P, D, X, и Xb обозначают сайты расщепления для рестриктаз BamH I, EcoR I, Hid III, Pst I, Sal I, Xho I и Xba I соответственно.  обозначает регулируемый элемент промотор/опиратор N 250PS N 250P29;
обозначает регулируемый элемент промотор/опиратор N 250PS N 250P29;  обозначает сайты связывания рибосом RBS II, RBSI (-1) или RBS II (-2); __→ обозначает кодирующие участки, находящиеся под контролем этих сайтов связывания рибосом;
обозначает сайты связывания рибосом RBS II, RBSI (-1) или RBS II (-2); __→ обозначает кодирующие участки, находящиеся под контролем этих сайтов связывания рибосом;  обозначает терминаторы to или T1, как показано;
обозначает терминаторы to или T1, как показано;  обозначен участок, необходимый для репликации плазмиды в E. coli /repl/;
обозначен участок, необходимый для репликации плазмиды в E. coli /repl/;  обозначены кодирующие области для хлорамфениколацетилтрансферазы /cat/ и β- лактамазы /bla/.
обозначены кодирующие области для хлорамфениколацетилтрансферазы /cat/ и β- лактамазы /bla/.
На фиг. 5 приведена полная нуклеотидная последовательность плазмиды pDS56/RBSII. На этой последовательности отмечены сайты расщепления, распознаваемые соответствующими рестриктазами, перечисленными в описании к фиг. 4. Аминокислотная последовательность представляет собой открытую рамку считывания, находящуюся под контролем сайта связывания рибосом RBSII.
На фиг. 6 схематически изображена плазмида pDS56/RBSII (-1) (без указания масштаба).
На фиг. 7 приведена полная нуклеотидная последовательность плазмиды pDS56/RBSII (-1). На этой последовательности отмечены сайты расщепления, распознаваемые рестриктазами, приведенными на фиг. 6. Аминокислотная последовательность представляет собой открытую рамку считывания, находящуюся под контролем сайта связывания рибосом RBSII (-1).
На фиг. 8 схематически изображена плазмида pDS56/RBSII (-2) /без указания масштаба/.
На фиг. 9 приведена полная нуклеотидная последовательность плазмида pDS56/RBSII (-2). На последовательности отмечены сайты расщепления, распознаваемые рестриктазами, приведенными на фиг. 8. Аминокислотная последовательность представляет с обой открытую рамку считывания, находящуюся под контролем сайта связывания рибосом RBSII (-2).
На фиг. 10 схематически изображена плазмида pDMI /без указания масштаба/. Символы и обозначения точно такие же, как на фиг. 4, только  обозначает области, кодирующие Lac -репрессор /lac I/ и неомицинфосфотрансферазу /neo/.
обозначает области, кодирующие Lac -репрессор /lac I/ и неомицинфосфотрансферазу /neo/.
На фиг. 11 /11a, b и c/ показана полная нуклеотидная последовательность плазмиды pDMI. 1. На этой последовательности отмечены сайты расщепления, распознаваемые рестриктазами, приведенными на фиг. 10. Показанная нуклеотидная последовательность включает открытые рамки считывания, кодирующие неомицинфосфотрансферазу (от Met до Phe) и lac-репрессор /от Met до Gln/. Пожалуйста, обратите внимание на обратную ориентацию этого гена.
На фиг. 12 схематически изображена плазмида pV C8 - TK - 7.5K. На этой схеме и на фиг. 13 и 15 аббревиатура ТК обозначает ген тимидинкиназы в вирусе вакцины; 7,5К обозначает промотор 7,5 К вируса вакцины, lac Z содержит регуляторные последовательности и кодируемую информацию для части N-концевого участка гена β- галактозидазы; ori обозначает область, необходимую для репликации ДНК в клетках E. coli, и AmpR обозначат ген β- лактамазы.
На фиг. 13 схематически изображена рекомбинантная плазмида pR3.
На фиг. 14 показаны полная нуклеотидная последовательность рекомбинантной плазмиды pR3. Приведенная нуклеотидная последовательность представляет собой открытую рамку считывания, находящуюся под контролем промотора 7.5 К вируса вакцины.
На фиг. 15 схематически изображена плазмида pR4. ML обозначает лидерную последовательность малярийного антигена.
Все процитированные работы полностью приведены в списке литературы.
Используемые в описании термины имеют следующее значение.
"Поверхностный антиген Eimeria - это белок с мол. массой около 23 кДа/ по данным электрофореза в полиакриламидном геле, содержащем SDS, SDS-PAGE/, который обнаруживается у Eimeria tenella на стадии мерозоитов. Этот белок образует in vivo в результате посттрансляционного процессинга продукта, который кодируется последовательностью кДНК, приведенной на фиг. 1.
"Белок - предшественник" - это протеин с мол. массой около 33 кДа /по данным SDS - PAGE/. Полагают, что in vivo в результате протеолитического расщепления этого белка образуется поверхностный антиген Eimeria. Нуклеотидная последовательность кДНК, колирующей белок - предшественник, и предсказанная на ее основе аминокислотная последовательность, приведены на фиг. 1.
"Иммуногенные полипептиды, имеющие аминокислотную последовательность (1) и способные индуцировать иммунный ответ против паразитических простейших рода Eimeria" - это полипептиды, обеспечивающие B - и/или T-клеточный протективный иммунитет по отношению к Eimeria, мерозоиты которых содержат описанный выше поверхностный антиген, соответствующий последовательностям иммуногенных полипептидов. Иммуногенные полипептиды могут быть самим по себе поверхностным антигеном зрелых мерозоитов Eimeria, свободным от других белков Eimeria, или фрагментами данного поверхностного антигена, способными специфическим связываться с антителами, которые обнаруживаются в сыворотке животных, инфицированных паразитическими Eimeria. Эти полипептиды соответствуют эпитопам описанного выше поверхностного антигена Eimeria, которые распознаются T- и B-клетками. Полипептиды, которые охватывает настоящее изобретение, кроме того, могут быть и функциональными эквивалентами данного поверхностного антигена мерозоитов Eimeria, и иметь аминокислотную последовательность, полученную на основе последовательности, приведенной на фиг. 1, путем замены определенных аминокислот, причем такого рода замены не оказывают значительного влияния на иммунологическую активность /другими словами, существенно не изменяют иммунореактивность и/или структуру антигенных детерминант/.
Примером фрагмента иммуногенного полипептида может служит полипептид, который имеет аминокислотную последовательность (1) /SEQ ID NO:1/ за исключением того, что эта последовательность утратила первые 20 - 100 аминокислотных остатков, представляющих собой последовательность сигнального пептида. Другой пример - это иммуногенный полипептид, который по данным электрофореза в полиакриламидном геле в присутствии SDS имеет мол. массу около 23 кДа. К предпочтительным фрагментам относятся следующие:
SNNQQTSV (2)(SEQ ID NO:3)
CGDEEDADEGTSQQASRRRRKPDTPAADK (3)(SEQ ID NO:4)
PNV (4)(SEQ ID NO:5)
RNKQIF (5)(SEQ ID NO:6)
NPWTGQEE (6)(SEQ ID NO:7)
RQSEE (7)(SEQ ID NO:8)
TRQTLE (8)(SEQ ID NO:9)
QDGKTAKEEVEGGKTHRRYKVKSSDPGYG (9)(SEQ ID NO:10)
TDEDG (10)(SEQ ID NO:11)
TGPHG (11)(SEQ ID NO:12)
ASQGK (12)(SEQ ID NO:13)
DDGKGNLVDGQGRK (13)(SEQ ID NO:14) and
TQPDTEFRSGPGDDEDDE (14)(SEQ ID NO:15).
Фрагменты, охватываемые данным изобретением, как и иммуногенный полипептид последовательности (1) (SEQ ID NO:1), способны индуцировать иммунный ответ различных организмов против кокцидиоза. Предпочтительно с этой целью используется домашняя птица, например цыплята. Известно, что в белках могут происходить аминокислотные замены, которые не оказывают существенного влияния на биологические и иммунологические свойства данных белков. Это явление, например, описано Neurath et al. в книге "Белки", Academic Press, New York /197/, в частности на стр. 14, где приведен фиг. 6. Наиболее частые замены аминокислот наблюдаются в случаях Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu, Asp/Gly /причем в обоих направлениях, т. е. например Ala замещается на Ser и наоборот/. Поскольку генетический код является вырожденным, могут существовать различные потенциально возможные нуклеотидные последовательности /функциональные эквиваленты/, которые способны кодировтаь аминокислотную последовательность (1) (SEQ ID NO:1). Кроме того, следует понимать, что заявляемые здесь нуклеотидные последовательности молекул ДНК и их фрагментов, встроенные в векторы, могут включать нуклеотиды, которые не являются частью действительно структурных генов, так же как и то, что рекомбинантные векторы, содержащие такие последовательности или фрагменты, способны направлять продукцию заявленных полипептидов в соответствующем организме - хозяине.
Последовательности ДНК, кодирующие пролипептиды, которые представляют собой функциональные эквиваленты поверхностного антигена мерозоитов Eimeria, могут быть получены без особых затруднений с помощью подходящих синтетических олигонуклеотидов путем сайт-специфического мутагенеза, направляемого затравкой, как это сделано на примере заявленной кДНК. Данный метод описан Morinaga et al. /Biotechnology, 2 : 636, 1984/.
Фрагменты или части поверхностного белкового антигена мерозоитов Eimeria или кодирующие их последовательности ДНК могут быть получены путем энзиматического расщепления более крупных молекул с помощью рестрикционных эндонуклеаз в случае ДНК и протеиназ в случае белков. Однако охватываемые настоящим изобретением фрагменты, не ограничиваются продуктами, которые получены в результате какого-либо энзиматического расщепления, но и включают в себя субпоследовательности, концевые участки которых не соответствуют каким-либо точкам энзиматического расщепления. Такие фрагменты могут, например, быть получены путем химического синтеза с помощью описанной здесь последовательности. ДНК - фрагменты могут быть получены и в результате синтеза неполностью комплементарных ДНК /кДНК/ на основе изолированных матричных РНК /мРНК/. Кроме того, фрагменты белка могут быть получены и в результате экспрессии соответствующих фрагментов ДНК, кодирующих эти белки. Такие белковые фрагменты могут использоваться согласно настоящему изобретению, если содержат достаточное число аминокислотных остатков, чтобы образовать антигенную детерминанту и/или обеспечить иммунореактивность. В целом, для этого нужно по крайней мере около 7-8 аминокислотных остатков. Как объяснено ниже, может возникнуть необходимость в соединении таких фрагментов с молекулой иммуногенного носителя для придания им иммунологической реактивности.
Под иммунологической реактивностью понимают как способность генерировать образование антител B-клетками /гуморальный иммунитет/, так и способность активировать T-клетки /клеточный иммунитет/. Заявленные полипептиды содержат B-клеточные и T-клеточные антигенные детерминанты /эпитопы/. Гуморальный иммунитет может быть продемонстрирован путем индукции образования антител B-клетками in vivo или in vitro. О клеточно-опосредованном иммунитете можно судить по активации T-клеток, например, увеличению синтеза T-клеточных белков или стимуляции B-клеток активированными T-клетками. Методы исследования обоих типов иммунитета хорошо известны.
Полипептиды, представляемые к защите в пределах материалов данной заявки, могут быть получены известными способами, например, с помощью технологии рекомбинантных ДНК, путем химического синтеза или выделены из тотальных препаратов белков Eimeria. При этом полипептид последовательности 1 /SEQ ID NO: 1/ и соответствующие фрагменты в значительной степени свободны от других белков, образуемых паразитическими простейшими рода Eimeria.
ДНК, необходимая для получения заявляемых белков, может быть химически синтезирована с помощью нуклеотидной последовательности SEQ ID NO:2 /кроме того, информация об этом приведена и на рисунках/. Такой метод химического синтеза может быть выбран из большого числа широкоизвестных методов, и например, представляет собой синтез ДНК на твердой подложке из фосфорамидита /Matteucci et al., J. Am. Chem. Soc. 103 : 3185, 1981/.
Альтернативный путь - это синтез кДНК на мРНК Eimeria. Матричную РНК можно изолировать из мерозоитов Eimeria обычными методами. Затем образцы мРНК могут быть использованы для образования двухцепочечной кДНК, как описано в кн. Maniatis et al. /Molecular Cloning: A Laboratory Manual, 1982, Cold Spring Harbor Laboratory, Cold Spting Harbor, NY/. Далее кДНК можно встроить в подходящий клонирующий вектор, который затем используют для трансформации соответствующего организма - хозяина /например E. coli/, чтобы получить библиотеку кДНК.
После этого проводят скрининг библиотеки кДНК, используя заявляемый клонированный ген или его фрагменты в качестве пробы. Такой ген или фрагменты с этой целью могут быть помечены, например путем ник-трансляции с помощью ДНК - полимеразы 1 в присутствии четырех дезоксирибонуклеотидов, один из которых содержит 32P в α- положении /Maniatis et al., см. предыдущую ссылку, стр. 109/. Кроме того, пробы могут быть получены путем олигонуклеотидного синтеза на основе известной последовательности кДНК поверхностного антигена Eimeria.
Несмотря на то, что для выделения мРНК в приведенных ниже примерах использовались простейшие Eimeria tenella, клонированные гены простейших этого вида могут быть использованы в качестве проб для выделения генов других видов Eimeria из-за гомологии последовательностей ДНК различных видов Eimeria.
ДНК Eimeria, которые выделены и идентифицированы согласно настоящему изобретению, встраивают в соответствующий вектор экспрессии, содержащий элементы, необходимые для транскрипции и трансляции встроенных генных последовательностей. Полезные клонирующие векторы могут содержать фрагменты хромосомальных, нехромосомальных и синтетических последовательностей ДНК, например широко известные бактериальные плазмиды, вирусные ДНК /например фаговые ДНК/, комбинированные ДНК плазмид и вирусов или фагов /например плазмиды, которые модифицированы для использования фаговой ДНК или других последовательностей контроля экспрессии/, а также плазмиды дрожжей. Специфические клонирующие векторы, которые могут быть использованы, включают, но не ограничиваются, pEV - vrf-плазмидами /pEV-vrf1, - 2 и 3, которые описаны Growl et al. , Gene 38 : 31, 1985/; SV 40; аденовирусами; векторами дрожжей; векторами лямбда - gt - WES-лямбда B; Charon 4A и 28, лямбда - gt-2; векторами на основе M 13, например pVC8, 9, 18 и 19, pBR313, 322 и 325; pAC105; pVA51; pACY177; pKH47; pACYC184; pUB110; pMB9; colE1; pSC101; pML21; RSF2124; pCR1 или RP4; векторами на основе вирусов куриной оспы, вирусов вакцины или других видов герпесвирусов.
Встраивание генов Eimeria в клонирующий вектор легко осуществляется, когда гены и соответствующий клонирующий вектор разрезаются одним и тем же /одними и теми же/ фрагментом /ферментами/ таким образом, что образуются комплементарные концы ДНК. Если это не может произойти, то необходимо модифицировать концы таким образом, чтобы образовались тупые концы ДНК /путем переваривания одноцепочечной ДНК/. Этого же результата достигают, надстраивая одноцепочечные концы с помощью подходящей ДНК - полимеразы. Далее осуществляют лигирование тупых концов с помощью фермента T4 ДНК-лигазы. Альтернативно, любой нужный участок ДНК можно получить, связывая нуклеотидные последовательности /линкеры/ с концами ДНК. Такие линкеры могут содержать специфические олигонуклеотидные последовательности, которые содержат сайты рестрикции. Расщепленный вектор и гены или фрагменты генов Eimeria могут быть модифицированы и в результате присоединения гомополимерных "хвостов", как описано Morrow /Methods in Enzymology, 68 : 3, 1979/.
Многие из клонирующих векторов, которые могут быть использованы в данном изобретении, содержат один или более маркеров, служащих для отбора нужных трансформантов, например гены устойчивости к ампициллину и тетрациклину в pBR322, ген устойчивости к ампициллину и ген β- галактозидазы в pUC8 ген устойчивости к ампициллину в pEV-vrf плазмидах. Селекция клеток - хозяев, трансформированных такими векторами, существенно облегчается в том случае, если клетки лишены активности, которая обеспечивается вектором.
Следует понимать, что нуклеотидные последовательности генов Eimeria, которые встраиваются в селективные сайты клонирующего вектора, могут включать нуклеотиды, не являющиеся частью действительно структурных генов. С другой стороны, гены могут содержать только какую-нибудь одну часть полного гена дикого типа. Все, что требуется в данном случае, это, чтобы фрагменты генов после введения в клонирующий вектор были способны направлять синтез в соответствующем организме - хозяине полипептида или белка, имеющего по крайней мере одну иммунореактивную и/или антигенную детерминанту поверхностного антигена Eimeria. Так, рекомбинантные векторы, содержащие ДНК с нуклеотидной последовательностью, которая кодирует белок, заявляемый в настоящем изобретении, могут быть получены следующим образом:
а/ ДНК нуклеотидной последовательности, кодирующей указанный белок, встраивают в вектор;
б/ данный вектор реплицируют в микроорганизмах и
в/ изолируют рекомбинантный вектор из микроорганизмов
Селекцию соответствующих клеток - хозяев осуществляют различными, хорошо известными методами, например основанными на совместимости клеток и выделяемого вектора, токсичности белков, кодируемых гибридной плазмидой, легкости определения нужного белка, характеристиках экспрессии, безопасности клеток - хозяев и их стоимости. Необходимо учитывать соотношение этих факторов и следует понимать, что не все клетки - хозяева одинаково эффективны для экспрессии определенной рекомбинантной молекулы ДНК.
Подходящие клетки - хозяева, которые могут быть использованы в настоящем изобретении, включают клетки растений, млекопитающих, дрожжей или бактерий, но не ограничены ими. Среди бактерий могут быть использованы Escherichia coli, Bacillus subtilis, Bacillus sterothermophilus и Actinomyces. В частности, можно применить штамм MC 1061 E. coli, описанный Casadabanetal. /J. Mol. Biol, 138 : 179, 1980/ или любой другой штамм E. coli K 12, содержащий плазмиду pRK248clta. Плазмида pRK248clts для использования в других штаммах E. coli K 12 описана Bernhard et al. /Meth. of Enzymol, 68 : 482, 1979/ и, кроме того, может быть получена из Американской коллекции типовых культур под каталожным номером АТСС 33766. Штамм MC 1061 E. coli можно приобрести коммерческим путем, например в лаборатории CLONTECH Inc., Palo Alto, СА, США, а также в Американской коллекции типовых культур под каталожным номером АТСС 53338. Плазмиды pDMI.1, pDS56/RBSII, - 1 или - 2 для использования в E. coli штамма M 15 описаны ниже.
Перенос рекомбинантного клонирующего вектора в клетки - хозяева осуществляют различными методами. В зависимости от выбранной системы вектор/клетка-хозяин такой перенос может произойти в результате трансформации, трансдукции, трансфекции, или электропорации. Затем модифицированные клетки - хозяева культивируют и белковый продукт экспрессии выделяют из культуры.
Трансформированные клоны, в которых образуется белок - предшественник поверхностного антигена Eimeria, идентифицируют путем скрининга при использовании сыворотки животных, иммунизированных препаратами спорозоитов или мерозоитов E. tenella, фиксированных глутаральдегидом. В примерах, описанных ниже, для отбора и характеристики генных продуктов используют кроличью сыворотку к мерозоитам E. tenella. Параллельно для независимо кДНК белка - предшественника поверхностного антигена мерозоитов применяют иммунологический скрининг с иммунной сывороткой цыплят.
Специфичность антисывороток, используемых для иммунологического скрининга или иммунопреципитации, можно увеличить с помощью модифицированного метода селекции антител, описанного Hall et al. /Nature 311 : 379, 1984/. Согласно данному методу, который более подробно раскрыт ниже, антитела, специфичные к белкам Eimeria, полученным при отборе соответствующих клонов, адсорбируют на фильтрах.
Выявление клонов, продуцирующих антигены Eimeria, можно осуществить каким-либо хорошо известным стандартным методом, например иммунопреципитацией, твердофазным иммуноферментным анализом /ELISA/ и радиоиммунологическим методом, которые описаны в литературе /см. например Monoclonal Antibodies and Hybridomas: A New Dimension in Biological Analyses, под редакцией Kennet et al., Plenum Press, New York, pp. 376 - 384, 1980
Рекомбинантные векторы, содержащие ДНК, которые кодируют вариантные полипептиды поверхностного антигена Eimeria, заявленного в объеме данного изобретения, могут быть получены с помощью хорошо известных методов, например путем сайт - специфического мутагенеза.
Большие количества рекомбинантных полипептидов Eimeria, охватываемых настоящим изобретением, могут быть получены при культивировании трансформированных микроорганизмов в ферментационном бульоне, содержащем необходимые питательные вещества, и подборе условий, обеспечивающих экспрессию рекомбинантной ДНК. Получаемые с помощью E. coli рекомбинантные полипептиды Eimeria обычно содержатся в цитоплазме бактериальных клеток или в бактериальных тельцах включения. Таким образом, для высвобождения белков необходимо разрушить внешнюю оболочку бактерий. Это достигается при ультразвуковой обработке клеток или при механической гомогенизации, например с помощью пресса Френча или гомогенизатора Голена /см. Charm et al., Meth. Enzymol. 22, 476 - 556, 1971/.
Разрушение клеток можно осуществить химическими или энзиматическими методами. Так, для интеграции мембран часто необходимы двухвалентные катионы, поэтому обработка клеток соответствующими хелатирующими агентами, например ЭДТА или ЭГДА, в достаточной степени обеспечивает их разрушение и высвобождение внутриклеточных белков. С этой же целью могут быть использованы ферменты, например лизоцим, который гидролизует пептидогликаны клеточной стенки.
Кроме того, применяют метод осмотического шока. Вначале клетки помещают в гипертонический раствор, где они теряют воду и сморщиваются. Последующий перенос клеток в гипотонический "шоковый" раствор вызывает быстрый приток воды в клетки и выброс из них нужных белков.
Высвобожденные из клеток белки Eimeria могут быть сконцентрированы преципитацией солями, например сульфатом аммония, ультрафильтрацией и другими хорошо известными методами. Дальнейшую очистку проводят с помощью традиционных способов очистки белков, которые включают гель-фильтрацию, ион-обменную хроматографию, препаративный диск - гель - электрофорез или электрофорез на бумаге /мембране/, изоэлектрофокусирование, фракционирование в органических растворителях при низкой температуре или встречное распределение, но не ограничиваются ими. Кроме того, белки очищают путем иммуноаффинной хроматографии.
Специальные методы очистки белков Eimeria, полученных в различных организмах, известны /см. например, Newman et al., заявка на Европейский патент N 164176/.
Заявленные в соответствии с настоящим изобретением белки и их фрагменты могут быть синтезированы каким-либо подходящим химическим методом, например ограниченным синтезом на твердой фазе, частичным синтезом на твердой фазе, конденсацией фрагментов или классическим синтезом в растворе. Твердофазный синтез, описанный Merrifield /J.Am. Chem, 85 : 2149, 1963/ предпочтителен.
Твердофазный синтез основан на использовании аминокислот, у которых защищены терминальные α- аминогруппы. Трифункциональные аминокислоты, имеющие подвижные боковые группы, тоже защищают соответствующим образом, чтобы предотвратить химическую реакцию в нежелательном участке в процессе сборки пептида. Защитные α- аминогруппы селективно удаляют, чтобы могла идти дальнейшая реакция на соответствующих концевых участках аминокислот. Условия удаления таких защитных групп подбирают таким образом, чтобы боковые цепи остались защищенными.
Известны многочисленные α- аминозащитные группы, которые используются при одноступенчатом синтезе пептидов. Они включают ацилзащитные группы /например формил, трифторацетил, ацетил/, ароматические уретановые группы [например бензилоксикарбонил /Cbz/ и замещенный бензилоксикарбонил], алифатические уретановые защитные группы [например t-бутилоксикарбонил /Вoc/, изопропилоксикарбонил, циклогексилоксикарбонил] и алкильные защитные группы /например, бензил, трифенилметил/. Предпочтительно использование Boc. Защитные группы боковых цепей, в частности для тирозина /Tyr/, включают тетрагидропиранил, трет-бутил, тритил, бензил, Cbz, 4-Br-Cbz и 2,6-дихлорбензил. Для защиты боковых цепей тирозина предпочтительно используется 2,6-дихлорбензил. Защитные группы боковых цепей, в частности для аспарагина /Asp/ включают бензил, 2,6-дихлорбензил, метил, этил и циклогексил. Предпочтительно использовать циклогексил. Защитные группы боковых цепей триптофана /Thr/ и серина /Ser/ включают ацетил, бензоил, тритил, тетрагидропиранил, бензил, 2,6-дихлорбензил и Cbz. Для защиты аминогрупп боковых цепей Thr и Ser предпочтительно использование бензила. Защитные группы боковых цепей аргинина /Arg/ включают нитрогруппы, Tos, Cbz, адамантилоксикарбонил или Boc. Предпочтительно использовать Tos. Аминогруппы боковых цепей лизина защищают с помощью Cbz, 2-Cl-Cbz, Tos или Boc. Предпочтительно использовать 2-Cl-Cbz. Выбор защитных групп боковых цепей основан на следующем. Эти защитные группы в процессе синтеза пептида остаются интактными и не расщепляются при удалении защитных групп концевых участков аминокислот. Защитные группы боковых цепей должны быть удалены после завершения синтеза всего пептида при подборе таких условий, которые не нарушают его целостности.
Обычно твердофазный синтез проводят, начиная с карбоксильных остатков аминокислот, присоединяя аминокислоты с защищенными α- аминогруппами /защищенными боковыми цепями/ к подходящей твердой подложке. При соединении с хлорметилированной или гидрометилированной смолой образуется эфирный мостик и образовавшийся пептид имеет свободную карбоксильную группу на C-концевом участке. В противоположность этому, при использовании бензилгидроаминной или n-метилбензгидриламинной смолы образуется амидная связь и полученный пептид имеет карбоксиамидную группу на C-концевом участке. Смолы коммерчески доступны и их приготовление описано в кн. "Solid Phase Peptide Synthesis" /2nd Edition, Pierce Chemical Co., Rockford, IL., 1984/.
C-концевая аминокислота, Arg, боковые цепи которой защищены Tos и α- аминогруппа защищена Boc, присоединяется к бензгидриламинной смоле с помощью различных активирующих агентов, например дициклогексилкарбодиимида /DCC/, N, N'-диизопропилкарбодиимида и карбонилдиимидазола. После соединения с подложкой из смолы защитная α- аминогруппа удаляется с помощью трифторуксусной кислоты /TPA/ или HCl в диоксане при температуре от 0 до 25oC. После введения метионина к TPA добавляют диметилсульфид, чтобы предотвратить возможную S-алкиляцию. После удаления защитной α- аминогруппы, оставшиеся защищенные аминокислоты одноступенчато, в определенном порядке взаимодействуют между собой с образованием нужной пептидной последовательности.
Для соединения аминокислот могут использоваться различные активирующие агенты, например DCC, N,N'-диизопропилкарбодиимид, бензотриазол-1-ил-окси-трис/диметиламино/-фосфониум гексафторофосфат /BOP/ и DCC-гидроксибензотриазол /HOBt/. Каждая защищенная аминокислота берется в избытке />2,5 эквивалентов/ и их соединение обычно происходит в DMF, CH2Cl2 или смеси этих компонентов. Полноту прохождения реакции соединения контролируют на каждой стадии с помощью нингидриновой реакции, как описано Kaiser et al. /Anal. Biochem., 334:595, 1970/. В тех случаях, когда выявляется неполное прохождение реакции, ее повторяют. Соединение аминокислот можно проводить автоматически на специальном синтезаторе, например Vega 250, Applied Biosystems или на каком-либо другом доступном оборудовании. После окончания полной сборки пептида, комплекс пептид-смола обрабатывают TPA/дитиоэтаном /для удаления защитных α- аминогрупп/ и затем расщепляют с помощью химических реагентов, например жидкой HF, в течение 1-2 ч при 0oC. В результате пептид отделяется от смолы и удаляются защитные группы боковых цепей.
Циклизация боковых цепей на твердой подложке требует ортогональной защиты, которая обеспечивает селективное расщепление функциональных боковых цепей кислых аминокислот /например Asp/ и щелочных аминокислот /например Lys/. 9-фторенилметил /OFm/ может быть использован для защиты боковых цепей Asp и 9-фторенилметоксикарбонил /Fmoc/ - для защиты боковых цепей Lys. В этих случаях боковые защитные группы комплекса Boc - защищенный - пептид - смола селективно удаляются с помощью пиперидина в DMF. Циклизация происходит на твердой подложке при использовании различных активирующих агентов, включая DCC, DCC/HOBt или BOP. Для расщепления комплекса циклизованный пептид - смола используют HF, как описано выше.
Очистку и скрининг синтетических белков осуществляют как описано выше для белков, полученных в результате генетической рекомбинации.
Белки Eimeria могут быть выделены путем экстрагирования мембранной фракции клеток. Таким образом получают тотальные препараты белков дикого типа. Необходимые моноклональные антитела можно получить как описано Kohler and Milstein /Nature, 256:495, 1975/, используя в качестве антигена синтетические или природные белки Eimeria. Данные методы могут быть применены для очистки поверхностного антигена Eimeria мол. массы 23 кДа, который является объектом данного изобретения.
Один или более заявленных белков могут быть использованы как составные компоненты вакцин в сочетании с физиологически подходящим носителем, например 0,01 - 0,1 М фосфатным буфером, имеющим нейтральный pH, или физиологическим раствором.
Усиленный иммунитет к кокцидиозу может быть генерирован одним из двух путей. Во-первых, к вакцине добавляют адъювант или иммуностимулятор. Во-вторых, заявленные белки могут быть использованы для иммунизации в форме комплекса больших размером; это может быть как соединение белков с помощью перекрестных связей, так и их конъюгация с подходящим носителем.
Возможные адъюванты для вакцинации включают Адъювант 65 /содержащий арахисовое масло, моноолеат маннида и моностеарата алюминия/; минеральные гели, например гидроксид алюминия, фосфат алюминия и алюминиевые квасцы; сурфактанты, например гексадецикламин, октадецикламин, лизолецитин, диметилдиоктадециламмониум бромид, N,N-диоктадецил-N,N'-бис/2-гидроксиметил/пропанодиамин, метоксигексадецилглицерин и различные многоатомные спирты; полианионы, например пиран, дестрансульфат, поли IC, полиакриловую кислоту и карбопол; пептиды, например мурамилдипептид, диметилглицин и туфтсин, а также масляные эмульсии, но не ограничиваются ими. Белки могут быть использованы и после включения в липосомы или другие микроносители.
Включение белков в липосомы означает, что высвобождение вакцины может происходить в течение продолжительного промежутка времени. С этой целью используют осмотический насос Альца.
Иммуногенность заявленных полипептидов, особенно более мелких фрагментов, может быть усилена за счет перекрестного связывания или соединения с иммуногенным носителем /макромолекулой, которая сама по себе вызывает иммунный ответ при введении в организм хозяина, и с которой данные белки или их фрагменты могут быть ковалентно связаны/. Перекрестное связывание или конъюгация с носителем может быть необходима, поскольку небольшие белковые молекулы иногда функционируют как гаптены /молекулы, которые способны связываться с антителами, но не могут вызвать иммунный ответ, т.е. они не иммуногенны/. Конъюгация таких фрагментов с иммуногенным носителем придает им иммуногенность; это явление обычно называют "эффектом носителя".
Подходящие носители включают, например белки и природные или синтетические полимерные вещества, такие как полипептиды, полисахариды, липополисахариды и др. Хорошим носителем является гликозид, называемый Quil A, который описан Morein et al. /Nature 308:457, 1984/. Особенно предпочтительно использование белковых носителей, которые включают сывороточные белки млекопитающих, например гаммаглобулин человека или быка, сывороточный альбумин человека, кролика или быка, метилированные или другие производные этих белков, а также гемоцианин моллюска фиссуреллы, но не ограничиваются ими. Кроме того, могут быть использованы и другие известные белковые носители. Предпочтительно, но не обязательно, чтобы белковый носитель был чужеродным по отношению к организму-хозяину, который иммунизируют для получения антител к белкам Eimeria.
Ковалентное связывание с белком - носителем осуществляют каким-либо хорошо известным методом, правильный выбор которого зависит от природы используемого носителя. Когда иммуногенный носитель представляет собой белок, белковые фрагменты, заявленные в данном изобретении, могут быть присоединены к нему, например с помощью водного раствора карбодиимидов, таких как дициклогексилкарбодиимид или глутаральдегид.
Сшивающие агенты, подобные указанным выше, могут быть использованы для перекрестного связывания белков и их фрагментов между собой без применения носителя. Такие перекрестно-связанные белки или их фрагменты обладают повышенной иммуногенностью.
Введение эффективного количества предложенной заявителем вакцины может защитить организм от кокцидиоза, например вызываемого E.tenella или другими видами Eimeria. Моноклональные антитела к антигенам E.tenella in vitro перекрестно реагируют с антигенами E.acervulina и E.maxima. Предпочтительно для иммунизации использовать домашнюю птицу, например цыплят, однако настоящее изобретение охватывает и другие живые организмы. В соответствии с изобретением может быть использовано любое эффективное количество вакцины, которое определяют традиционным экспериментальным путем с помощью описанных ниже методов. Для вакцинации в качестве эффективной дозы предпочтительно использовать 5-50 мкг препарата заявленных пептидов или их фрагментов на 1 кг веса иммунизируемого организма-хозяина, особенно дозу 25-50 мкг/кг. Первоначальную иммунизацию предпочтительно проводят через одну или несколько недель после бустерной инъекции. Можно использовать несколько бустерных инъекций. В основном, такие инъекции осуществляют в дозах 5-50 мкг/кг, предпочтительно 20-50 мкг/кг. Обычные методы иммунизации включают подкожный, внутрикожный, внутримышечный, оральный, анальный или метод in ovo, т.е. непосредственную иммунизацию эмбрионов. После одной или нескольких бустерных вакцинаций может развиться слабая кокцидиозная инфекция, которая усиливает защитные реакции организма.
Презентация заявленных антигенов кокцидий иммунной системе живых организмов, например цыплят, может осуществляться, кроме того, путем клонирования генов соответствующих антигенных белков в бактериях /например E. coli иди Salmonella/ или в вирусах /например поксвирусах или герпесвирусах/ и последующего введения живой векторной системы или при необходимости ее инактивированной формы в живой организм в результате орального приема, инъекций или каким-либо другим известным способом. Carbit et al. /в кн. Vaccines, Cold Spring Harbor Laboratory, с. 68-71, 1987/ описали использование E. coli, а Clements /Pathol. Immunopathol. Res. 6:137, 1987/ - использование Salmonella. Moss et al. /Ann.Rev.Immunol., 5:305, 1987/ посвятили свой обзор использованию векторных систем на основе рекомбинантных поксвирусов.
Вирус вакцины - представитель семейства поксвирусов - может быть использован для введения кокцидиальных антигенов в живые организмы и клеточные культуры. С этой же целью согласно настоящему изобретению может применяться и другой вирус, относящийся к поксвирусам, а именно вирус оспы кур. Однако было показано, что для аналитических исследований более подходит вирус вакцины, поскольку он размножается быстрее, чем вирус оспы кур и круг его хозяев не ограничен клетками кур. Большие количества гетерологичной ДНК могут быть встроены в геном вируса вакцины без ингибирования его инфекционности и процессов созревания /Smith et al., Gene 25: 21, 1983/. Многочисленные гетерологичные гены, встроенные в вирус, экспрессируются в инфицированных организмах и вызывают образование антител /Perkus et al., Science 229:981, 1985/.
Методика получения рекомбинантного вируса вакцины может быть откорректирована в точном соответствии с особенностями герпесвирусов и вируса оспы кур. Рекомбинантный вирус, содержащий ДНК нуклеотидной последовательности, кодирующей заявленный белок, может быть получен в результате:
а/ встраивания ДНК нуклеотидной последовательности, кодирующей указанный белок, в геном вируса без ингибирования его инфекционности и процессов созревания;
б/ амплификации указанного рекомбинантного вируса в клеточной культуре; и
в/ выделения рекомбинатного вируса из культуры и его очистки.
Использование рекомбинантных вирусов как носителей вакцины против кокцидиоза имеет особые преимущества, поскольку у вакцинированных цыплят развивается иммунитет как к антигенам кокцидий, так и к вирусному носителю /т.е. такие вакцины являются бивалентными/. Полезные свойства данных вакцин могут быть увеличены в еще большей степени за счет встраивания дополнительных генов в вирусный носитель. Например, в вирус вакцины вместе с генами антигенных белков кокцидий могут быть встроены участки генома вируса болезни Ньюкастла, и в результате при использовании одной вакцины возникает иммунитет и к болезни Ньюкастла, и к кокцидиозу и к вирусу оспы кур.
Введение живых векторных вакцин, охватываемых изобретением, можно осуществить любым известным методом, например методом "укола", который широко используется для вакцинации домашней птицы против вируса оспы кур. При этом перепонку крыла прокалывают острой иглой, которую предварительно обмакивают в вакцине. На кончике иглы находится небольшое ушко /как у игл швейных машин/, в котором задерживается капля вакцины. Альтернативный подход заключается в том, что живые вакцины инъецируют подкожно или внутрикожно в область перепонки крыла или в какой-либо другой участок тела.
Кроме того, живые рекомбинантные векторные вакцины могут быть добавлены в питьевую воду или распылены в воздухе, например вокруг цыплят, которые должны быть вакцинированы. Они могут быть введены с пищей, предпочтительно после защитного инкапсулирования /Balancou et al., Nature 322:373, 1986/ или инъецированы непосредственно в яйцеклетки /иммунизация in ovo/. Более поздний метод предусматривает введение вирусных вакцин прямо в эмбрионы, в частности эмбрионы кур /Sharma, Avian Dis 25:1155, 1985/.
За исключением специально оговоренных случаев, приведенные ниже процентные соотношения твердых веществ в составе твердых смесей, жидких веществ в жидких смесях и твердых веществ в жидких смесях приведены соответственно в единицах масса на массу, объем на объем и масса на объем. Более того, за исключением особых случаев, необязательно использовать именно те реагенты и оборудование, которые указаны ниже. Умелый исследователь может выбрать другие аналогичные реагенты и оборудование из числа известных.
Пример 1.
Выделение мерозоитов.
Мерозоиты E. tenella выделяют из слепой кишки 50 больных цыплят /3-недельного возраста, породы Hubbard Cross, полученных от службы птицеводства, French town, NJ, USA/ через 5 дней после введения спорулированных ооцит /50000 на одну особь/. Могут быть использованы аналогичные цыплята из других источников. Слепую кишку удаляют и промывают фосфатным буферным раствором /PBS/ 15 мин на магнитной мешалке. Эпителиальный дебрис частично удаляют низкоскоростным центрифугированием /50 g/ и непереваренные мерозоиты отделяют центрифугированием при 2000 g и 4oC в течение 10 мин. Осадок ресуспендируют в лизирующем буфере /8.29 г/ NH4Cl, 0,372 г/л Na2 ЭДТА, 1,0 г/л KHCO2, pH 7,6/ инкубируют на льду 30 мин. Мерозоиты собирают центрифугированием, отмывают в PBS, пропускают через колонку, содержащую 1,0 г найлонового волокна /Scryb Nylon Fiber, Fenwal Laboratories, Leerfield, II/ и собирают с помощью разделительной воронки. Затем мерозоиты центрифугируют, как описано выше, и замораживают при использовании сухого льда для изоляции РНК или дальнейшей очистки на диэтиламиноэтилцеллюлозе /DEAE, Whatman DE52, Whatman Bio Systems, Inc. , Clifton, NJ, USA/ с целью постановки Вестерн - блоттинга.
Для очистки на DEAE - целлюлозе примерно 1 • 109 мерозоитов наносят в PBS на 10-мл колонку и элюируют PBS. Мерозоиты собирают в первой 100-мл фракции, прошедшей через колонку и по существу свободной от эритроцитов и другого клеточного дебриса.
Иммунопреципитация 125J -меченных поверхностных белков.
Поверхностные белки очищенных мерозоитов метят J125 с помощью иодогенного метода /IODOGENTM method, Pierce Chemical Co./ или при использовании IODOBEADSTM /Pierce Chemical Co./. В последнем случае 4 IODOBEADSTM отмывают 3 раза в 0,2М фосфате натрия, pH 7,5 добавляют 1-3 мКи 125J-Na и инкубируют в течение 5 мин при комнатной температуре. В реакционный сосуд вносят очищенные мерозоиты /3 • 108/ в 200 мл PBS, pH 7,0, и продолжают инкубацию еще в течение 15 мин. На последних стадиях инкубирования добавляют фенилметансульфонилфторид / PMSF/ до конечной концентрации 5 мМ.
Меченые мерозоиты выделяют из инкубационной смеси путем центрифугирования при 12000 g в течение 30 с и солюбилизируют в 1 мл смеси 2%-ного додецилсульфата натрия /SDS/ и 1%-ного тритора X-100 в PBS, pH 7,0. Нерастворимый материал удаляют центрифугированием в течение 3 мин при 12000 g. Растворенные белки диализуют против 3 л PBS, pH 7,0, при 4oC, используя специальную отводную мембрану мол. массы 3,500 для удаления любой остаточной радиоактивности/свободного125J/. Меченные 125J белки/как правило включение метки составляет около 1,5 • 108 cpm на белок / до использования хранят при 4oC. Радиоактивность кислотонерастворимой фракции обычно составляет 95% от общей радиоактивности.
Кроличью антисыворотку к фиксированным с помощью глутаральдегида мерозоитам получают следующим образом.
Примерно 1 • 1089 очищенных мерозоитов суспендируют в 1%-ном растворе глутаральдегида в PBS и инкубируют при комнатной температуре в течение 5 мин. Фиксированные мерозоиты собирают центрифугированием при 2000 g в течение 5 мин, трижды отмывают в PBS и ресуспендируют в 1 мл PBS. Кроликов породы "Новозеландские белые" множественно иммунизируют в кожу спины 0,5 мл раствора фиксированных мерозоитов, эмульгированных с 0,5 мл полного адьюванта Фрейнда. Кролики получают две бустерные инъекции того же самого белка кокцидий в неполном адъюванте Фрейнда с интервалом в две недели. Через две недели после последней бустерной инъекции у кроликов из ушной вены забирают кровь и получают сыворотку, содержащую антитела, в результате центрифугирования коагулированных образцов крови при 2500 g в течение 15 мин.
Образцы меченых белков для иммунопреципитации /5 мл, 5 • 105cpm/ разводят в 100 мл IP -буфера /0,25% NP - 40, 20 мМ Tris - HCl, pH, 7,5, 0,15 М NaCl/, предварительно очищают инкубированием на льду в течение 20 мин с 5 мг белка А стафилококков /PansorbinTM, Calbiochem Corp., San Diego, CA/ и инкубируют в течение нескольких часов при 4oC с 5 - 10 мл сыворотки кролика, содержащей антитела к мерозоитам. Антительные комплексы собирают в результате второй инкубации на льду с 5 мг белка А стафилококков в течение 20 мин и центрифугирования в течение 15 с центрифуге "Эппендорф". Осадок 4 раза отмывают в IP - буфере и осажденные антителами мече ные белки элюируют из комплексов прогреванием при 100oC в течение 5 мин в буфере для нанесения образцов, который используется для проведения электрофореза в полиакриламидном геле в присутствии SDS /65 мМ Tris, pH 6,8, 0,5%-ный SDS, 5%-ный β- меркаптоэтанол, 10%-ный глицерин, 0,1% -ный бромфеноловый синий/. Электрофорез в полиакриламидном геле в присутствии SDS/SDS-PAGE/ осуществляют как описано Laemmli/Nature 227:680, 1970/.
Результаты, полученные при использовании кроличьей антисыворотки, подтверждают, используя иммунную сыворотку цыплят, полученную следующим образом.
Цыплят иммунизируют в результате повторного инфицирования жизнеспособными спорулированными ооцистами E.tenella /100000 ооцист, три раза с 2-недельными интервалами/. Кровь собирают путем сердечной пункции и сыворотку, содержащую антитела, отделяют от коагулированного дебриса последующим центрифугированием при 2500 в течение 5 мин.
Сравнительные исследования заключаются в том, что сыворотки кролика и цыплят, содержащие антитела к мерозоитам, используют для иммунопреципитации меченных 125J поверхностных белков мерозоитов Eimeria и для получения in vitro продуктов трансляции PHK мерозоитов, содержащей poly /A/. Затем преципитированные белки исследуют в SDS - PAGE и полученные результаты оценивают с помощью флуорографии при использовании стандартных реагентов по обычной методике.
Эти исследования показывают, что многие белки из обоих источников преципитируются обеими сыворотками. Таким образом, каждая сыворотка может использоваться для выявления генетических рекомбинантов, экспрессирующих белки Eimeria. Для удобства первой для описанного ниже скрининга используют сыворотку кролика, содержащую антитела к мерозитам. Однако иммунную сыворотку цыплят используют для параллельного скрининга библиотеки кДНК, как описано ниже. Это необходимо с целью идентификации белков, наиболее важных для генерации иммунного ответа у инифицированных организмов, поскольку только у цыплят в сыворотке образуются антитела в ответ на иммунонизацию живыми кокцидиями. Только у цыплят показана резистентность к таким организмам.
Для увеличения специфичности сыворотки кролика / содержащей антитела к мерозоитам/ по отношению к белкам Eimeria, сывороточные антитела выделяют, по-существу, как описано Hall et al/ /Nature, 311 : 379, 1984/. Говоря кратко, антитела, специфичные к белку - предшественнику, экспрессированному с помощью рекомбинатного фагового клона /см. ниже/, выделяют из сыворотки кролика, взаимодействующей с антигенами мерозоитов, как описано ниже.
Положительную культуру фага высевают на чашки с высокой плотностью и выращивают при 42oC в течение 3,5 ч. Экспрессию белка слияния индуцируют, накладывая на чашки нитроцеллюлозный фильтр, насыщенный 10 мМ изопропилтиогалактозидом /IPTG/, и инкубацию продолжают при 37oC в течение 6-8 ч. Фильтры с нанесенным антигеном отмывают в TBS /20мМ Tris - HCl, pH 8,0, 150 мМ NaCl / и инкубируют в течение 8-10 при 4oC с избытком сыворотки, содержащей антитела к мерозоитам, которую предварительно абсорбируют хозяйскими бактериями E. coli. Фильтры трижды отмывают TBS для удаления неспецифических антител.
Антитела, специфически связавшиеся на фильтрах с белком слияния, элюируют 2,0 мл 0,1М глицерина, pH 2,6, 0,15 М NaCl / 10 мин, 20oC/. Элюированные антитела немедленно нейтрализуют эквивалентным объемом 0,1 М Tris -HCl, pH 8,0/. Выделенные антитела /далее называемые "антителами, отобранными антигеном"/ используют для иммунопреципитации поверхностных меченых белков мерозоитов или полученных in vitro продуктов трансляции, а также в качестве проб для Вестерн - блоттинга тотальной белковой фракции мерозоитов. Контрольную сыворотку получают с помощью нерекомбинатного фага, используя методику отбора антителом.
Результаты Вестерн-блоттинга и иммунопреципитации при использовании антител, отобранных антигеном, приведены на фиг.2. Картину иммунопреципитации меченых белков получают путем флуорографии, как описано Bonner et al. /Eur. J. Biochem, 46:83, 1974/. Цифры с правой стороны рисунков показывает положение белков - маркеров мол. массы, которая выражена в килодальтонах.
Фиг. 2А показывает результаты иммуноблоттинга тотальной белковой фракции мерозоитов с контрольными антителами /а/ и антителами, отобранными антигеном /б/. На фиг. 2 В представлены результаты иммунопреципитации поверхностных белков мерозоитов, меченных 125J, с контрольными антителами /а/ и антителами, отобранными антигеном /б/.
Выделение мРНК мерозоитов и ее трансляции in vitro
Осадок замороженных мерозоитов, содержащий 1 • 109 - 1 • 1010 организмов, оттаивают в 10 мл TEL/SDS -буфера [0,2 М Tris-HCl, 0,1 M LiCl, 25 мМ ЭДТА, 1% /вес на объем /SDS, pH 8,8], содержащего 1 мМ дитиотреитола /DTT/ и 300 единиц РНКазина /Promeda Biotec, Medison, WI/ и гомогенизируют 10-12 ударами в покрытом тефлоном гомогенизаторе для измельчения тканей. Нерастворимый дебрис отделяют центрифугированием на холоду при 3000 g. Жидкий супернатант дважды экстрагируют смесью фенол : хлороформ : изоамиловый спирт /24: 24:1, объем на объем/, которую уравновешивают TEL -буфером. Жидкую фазу обрабатывают 100 мг/мл протеиназ К/37oC, 30 мин/, повторно экстрагируют эквивалентным объемом смеси фенол : хлороформ/1:1/ и осаждают нуклеиновую кислоту двумя объемами этанола на сухом льду в течение 1 ч или в течение ночи при - 20oC. Осадок, полученный в результате центрифугирования /1 ч, 10000 g ресуспендируют в TE -буфере/ 10 мМ Tris - HCl, pH 7,5, 2 мМ ЭДТА/ и центрифугируют через подушку из 4 мл CsCl/ 5,7 М CsCl, 0,1 М ЭДТА/ при 150000 g в течение 20 ч при 15oC. Осадок РНК повторно осаждают с помощью 0,2 М ацетата калия и 2,5 объемов этанола. Тотальную РНК пропускают через олиго-dT-целлюлозу для получения poly (A+) PHK, как описано Maniatis /см. выше, с. 197/. Обычно 1,9 мг тотальной РНК, полученной из 5 • 109 мерозоитов, содержит около 20 мкг poly (A+) PHK.
0,1 - 0,5 мкг мРНК используют для синтеза белка в условиях in vitro с помощью обработанного нуклеазой лизата ретикулоцитов кролика /Amersham Corp. , Arlington Heigths, IL, USA или Promeda Biotec/ с добавлением 10-20 мКи 35S-метионина на 20 мл реакционной смеси. Продукты трансляции in vitro анализируют методом иммунопреципитации после осуществления SDS - PAGE и выявляют путем флуорографии, как описано выше. Результаты исследований приведены на фиг. 2C.
На фиг. 2C показана картина преципитации полной смеси белков, полученной при трансляции in vitro poly (A+)-PHK мерозоитов. На линиях b, a и d можно видеть продукты трансляции, преципитированные антителами, отобранными с помощью рекомбинатного клона 5-7 фага λ /см. ниже; этот клон экспрессирует ген, кодирующий у Eimeria белок - предшественник мол. массы 33 кДа другого фагового клона, реагирующего с сывороткой, содержащей антитела к мерозоитам, а также с помощью нерекомбинатного клона dt 11 фага λ соответственно.
Следует обратить внимание, что основной белок примерной мол. массы 33 кДа виден на полосах a и b. Этот белок не выявляется в тотальной белковой фракции мерозоитов, которую обрабатывают антителами, отобранными антигеном /фиг. 2А, линия а/, однако белок мол. массы 23 кДа здесь виден /фиг. 2А линия b, отмечено стрелкой/. Белок мол. массы 23 кДа осаждается с помощью антител, отобранных антигеном, и из фракции белков мерозитов, меченных 125J /фиг. 2В, линия b/. Полученные результаты позволяют предположить, что белок - предшественник мол. массы 33 кДа может процессироваться путем протеолитического расщепленния в поверхностный антиген мол. м 23 кДа.
Получение библиотеки кДНК мерозоитов.
Двухцепочечную кДНК синтезируют 6 мкг poly /A+/-РНК мерозоитов, как описано Gubber et al. /Gene, 25 : 263, 1983/ обратную транскриптазу /BRL, Gaithersburg, MD, USA/, oligo (dT) - затравку, РНКазу H/BRL /и ДНК - полимеразу E. coli /New England Biolabs, Beverly, MA, USA/ для образования комплементарной цепи. Затем на двухцепочечной кДНК с помощью ДНК - полимеразы Т4 /BRL/ образуют тупые концы и после обработки метилазой EcoRI /New England Biolabs/ присоединяют EcoRI- линкеры /GGAATTCC, Collabarative Research Inc. Bedford, MA, USA/ согласно лабораторной методике.
После расщепления EcoRi кДНК франкционируют в Биогеле А-50М для удаления избытка линкерных молекул и кДНК меньшего размера, чем около 300 bp, как описано Huynh et al. /см. ниже/. Затем кДНК концентрируют преципитацией с помощью этанола.
Библиотеку кДНК конструируют в векторе λ gt11 /Stratagene Cloning Systems, San Diego, CA/ как описано Huynh et al. под редакцией D. Glover /DNA Cloning, vol. I: A Practical Approach, 1985, IRL Press, Washington, D.C., USA, pp. 49-78/. EcoRI- фрагменты кДНК лигируют с расщепленной EcoRI и дефосфорилированной ДНК λ t 11 /Stratagene Cloning Systems/ и образовавшуюся ДНК упаковывают в фаговый вектор с помощью набора GigapacKTM /Stratagene Cloning Systems/ согласно лабораторной методике.
Полученную библиотеку амплифицируют, рассевая фаг на хозяйских клетках Y1088. Процент рекомбинантов определяют по соотношению голубых и бесцветных бляшек на чашках с X-gal /Maniatis, см. выше, p.24/ в присутствии изопропилтиогалактозида /IPTG, Sigma Chemical Co./. Она составляет около 90%.
Иммунологический скрининг библиотеки кДНК.
Бактериофаг λ gt 11, содержащий библиотеку кДНК мерозоитов, рассеивают на газон хозяйских клеток Y1090 с плотностью около 10000 БОЕ λ gt 11 на чашку диаметром 150 мм. Шесть таких чашек инкубируют 3,5 ч при 42oC, затем на чашки накладывают нитроцеллюлозные фильтры, предварительно смоченные в 10 мМ IPTG для индуцирования экспрессии белка слияния β- -галактозидазы и еще раз инкубируют в течение 4-5 ч и более /иногда всю ночь/ при 37oC. Фильтраты удаляют с чашек и несколько раз последовательно промывают в TBS /20 мМ Tris-HCl, pH 8,0, 0,15 М NaCl/. Неспецифические участки связывания белка блокируют инкубацией в 20%-ной эмбриональной телячьей сыворотке /FCS/ в TBS в течение 1 ч при комнатной температуре.
Затем фильтры инкубируют в течение часа с кроличьей антисывороткой, содержащей антитела к мерозоитам, которую предварительно адсорбируют хозяйскими клетками Y1090 и разводят в соотношении 1:100 в TBS с 20% телячьей сыворотки. Неспецифические антитела удаляют последовательным отмыванием в TBS /один раз в TBS, содержащем 0,1% NP-40/. Затем фильтры инкубируют с конюъгатом пероксидазы и антител козы к иммуноглобулинам кролика /BioRad, Richmond, CA/, разведенным в соотношении 1:1000 в TBS, содержащем эмбриональную сыворотку, в течение 1 ч при комнатной температуре. Цветная реакция развивается при добавлении 4-хлор-1-нафтола /BioRad/, как описано в соответствующей инструкции.
Для скрининга используют и сыворотку иммунных цыплят. Такую сыворотку предварительно адсорбируют клетками Y1090 и используют в том же самом разведении, что и сыворотку кролика. В качестве вторых антител используют антитела кролика к иммуноглобулинам цыплят, а для выявления антител - конъюгат пероксидазы с антителами козы к иммуноглобулинам кролика. Отдельные бляшки изолируют при второй процедуре скрининга, используя описанные выше реагенты.
Один клон, названный λ 5-7, экспрессируют белок, который с высокой аффинностью реагирует с антителами из сыворотки кролика. Второй изолят, клон λ 1-5, идентифицированный с помощью иммунной сыворотки цыплят, достоверно содержит вставку кДНК того же самого размера, что и клон 5-7. Анализ последовательностей ДНК показывает, что эти фаговые клоны содержат гены, кодирующие один и тот же антиген мерозоитов.
Экспрессия кДНК клона λ 5-7 в E.coli.
Вставку гена 1,1 кв изролируют из клона 5-7 с помощью рестриктазы EcoRI и электрофореза в агарозном геле /Maniatis et al., см. выше, pp. 157-170/. EcoRI - концы восстанавливают с помощью полимеразы Кленова в присутствии dATP и dTTP и к обеим концам присоединяют Bam HI-линкеры /GGGATCCC/. Модифицированные фрагменты встраивают в каждый из трех векторов экспрессии pOS56/RBSII, pDS56/RBSII, -1 и pDS56/RBSII,-2 по сайту Bam HI. Эти три вектора описаны ниже. Плазмидами, содержащими вставки в обеих возможных ориентациях, трансформируют штамм M 15 E.coli, несущий совместную плазмиду pDMI.1 [методика трансформации описана Mandel et al. /J.Mol. Biol, 53 : 159, 1970/] . Штамм M 15 E.coli, несущий плазмиды pDS56/RBSII и pDMI.1 описаны в заявке на Европейский Патент N 316695.
Строение плазмид.
В целом плазмиды pDS56/RBSII, -1 и -2 содержат регулируемые промоторно/операторный элемент N 250 SN 250P29 и сайты связывания рибосом RBSII, RBSII /-1/ и RBSII /-2/ соответственно. Эти сайты связывания рибосом происходят из сайта связывания рибосом промотора PG25 фага Т5 E.coli /Заявка на Европейский Патент N 207459/ и получены с помощью технологии синтеза ДНК.
Для получения высокой эффективности экспрессии указанные выше плазмиды поддерживают в E.coli только в том случае, если промоторно /операторный элемент репрессирован связыванием lac - репрессора с оператором. Lac - репрессор кодируется геном lac I. N 250SN 250P29 может быть эффективно репрессирован только, когда к клетках присутствует достаточное количество молекул репрессора. Таким образом используют аллель lac Ig, которая содержит мутантный промотор, ответственный за увеличение экспрессии гена, кодирующего репрессор. Эта аллель lac Ig входит в состав плазмиды pDMI.1, как описано ниже.
Помимо гена lac I, плазмида pDMI. 1 содержит ген неомицинфосфонтрансферазы, который обеспечивает устойчивость бактерий к антибиотику канамицину и используется в качестве селективного маркера. pDMI.1 совместима с плазмидами pDS56/RBSII, -1 и -2. Клетки E.coli, которые трансформированы векторами экспрессии pDS56/RBSII, -1 и -2 должны содержать pDMI.1 для того, чтобы обеспечить стабильность вектора экспрессии в клетках - хозяевах. Индукция системы вызывается добавлением IPTG в питательную среду.
Плазмида pDS56/RBSII.
Участок плазмиды pDS56/RBSII, который находится между рестрикционными сайтами расщепления XbaI и XhoI и содержит область репликации и ген β- лактамазы /обеспечивающий устойчивость клеток к ампициллину/ /фиг. 4 и 5/, происходит из плазмиды pBR322 /Bolivar el al., Gene 2 : 95 - 113, 1977; Sutcliffe, cold Spring Xarbor Symp. Quant. Biol. 43 : 77 -90, 1979/. Однако ген β- лактамаза модифицирован удалением сайтов расщепления для ферментов рестрикции Hinc II и Pst I. Эти изменения последовательности ДНК не влияют на аминокислотную последовательность β- лактамазы. Остальные участки плазмиды содержит регулируемый промоторно /операторный элемент N 250PSOP29, следующий за сайтом связывания рибосом RBS II /который представляет собой часть EcoR I /Bam HI - фрагмента/, сайты расщепления для рестрикционных ферментов Sal I, Pst I и Hind III, терминатор фага λ E.coli /Schwarz et al., 272:410 - 414, 1978/, промотор свободного гена хлорамфениколацетилтрансферазы /Marcoli et al. , FEBS Letters, 110:11 - 14, 1980/ и терминатор T1 оперона rrn B.coli /Brosius et al., J. Mol. Biol., 148:107 -127, 1981/.
Плазмида p DS56/RBS II (-1).
Плазмида pDS56/RBS II (-1) /фиг. 6 и 7/ имеет такое же строение, как и плазмида pDS56/RBS II, но содержит сайт связывания рибосом RBS II (-1).
Плазмида pDS56/RBS II (-2).
Плазмида pDS56/RBS II (-2) /фиг. 8 и 9/ имеет такое же строение, как и плазмида pDS56/RBS II, но содержит сайт связывания рибосом RBS II (-2).
Эти три плазмиды различаются одним нуклеотидом, который следует за стартовым кодоном ATG и тем самым обеспечивается экспрессия белка во всех трех возможных рамок считывания.
Плазмида pDMI. 1
Плазмида pDMI. 1 /фиг. 10 и 11/ содержит ген неомицинфосфотрансферазы из транспозона Tn5 /Beck et al., Gene 19:327 - 336, 1982/, который обеспечивает устойчивость клеток E.coli к канамицину, и ген lac I /Farabough, Nature 274: 765 - 769, 1978/ с мутантным промотором If/Calos, Nature, 274:762 - 765, 1978/, кодирующий lac - репрессор. Более того, плазмида pDMI.1 содержит участок плазмиды pACYC184 /Chang and Cohen, J. Bacteriol, 134:1141 - 1156, 1978, который несет всю информацию, необходимую для репликации и стабильного переноса в дочерние клетки.
Следует понимать, что для осуществления данного эксперимента помимо указанных выше плазмид может быть использована любая другая подходящая система экспрессии в E.coli.
Трансформированные бактерии выращивают при 37oC на среде LB /Maniatis et al., см. выше, p/ 68/ и экспрессию белка индуцируют добавлением в среду 1 мМ IPTG. После одночасовой инкубации собирают 1-мл образцы и клетки осаждают центрифугированием. Осадок клеток обрабатывают, как описано Crowl et al., /см. выше/ и лизаты исследуют в SSS-PAGE. После окончания электрофореза белки в гелях окрашивают Кумасси ярко-синим или переносят на нитроцеллюлозные фильтры для последующего Вестерн - блоттинга /Towbin et. al., Proc. Natl. Acad. Sci. USA, 76: 4350, 1979; Burnetti, Anal. Biochem., 112:195, 1981/ при использовании кроличьей антисыворотки, содержащей антитела к мерозоитам, как описано выше.
Результаты исследований показывают, что молекула к ДНК 1,2 кв в одной ориентации во всех трех рамках считывания кодирует белок, имеющий примерную мол. массу 33 кДа /по данным SDS-PAGE/ и взаимодействующий с антисывороткой кролика, которая содержит антитела к мерозоитам.
Анализ последовательностей ДНК
В целом, выделение плазмидной ДНК в небольших объемах из 1 мл насыщенной ночной культуры бактерий осуществляют по методу Birnboim et al., Nucleic Acids Research, 7:1513, 1979/. В результате можно получить небольшое количество ДНК из бактериальной колонии для аналитических целей. Большие количества плазмидной ДНК получают из 1 о культур, следуя стандартной методике, используя центрифугирование в градиенте плотности CsCl /Maniatis et al., см. выше. р. 93/.
Последовательность ДНК 1,2 кв из вставки EcoRI кДНК клона λ 5 - 7 определяют следующим образом: разрезают вставку EcoRI, очищают путем гельэлектрофореза и лигируют в расщепленную EcoRI плазмиду pEV-vrf, описанную Crowl et al. , /Gene, 38:31, 1985/. Полученную плазмиду обозначают как pEV/ 5-7 и используют для амплификации вставки 1,2 кв кДНК с целью проведения гибридизационного анализа /как описано выше/ и в предварительных экспериментах по определению последовательности ДНК, следуя методу ZagursKy et al., /Gene Anal. Tech. 2:89, 1983/.
Для определения полной нуклеотидной последовательности ДНК вставку 1,2 кв кДНК в pEV/5-7 клонируют в одноцепочечном фаговом векторе M 13 mp 19, используя набор для клонирования BIO-RADTM M 13 и набор для секвенирования SEQUENASETM. Для расшифровки последовательности применяют метод терминации цепей, разработанной Sanger et al., /Proc. Natl. Acad. Sci., USA 74:5463, 1977/, следуя рекомендуемой методике, которая прилагается к набору SEQUENASETM /United States Biochemical Corp., Cleveland OH, USA/.
Полная нуклеотидная последовательность молекулы кДНК 1,2 кв из pEV/5-7, включая 5' и 3' нетранслируемые области, показана на фиг. 1.
Последовательность кДНК, предполагающая открытую рамку считывания с кодона ATG в 68 положении до стоп - кодона TGA в положении 1013 и кодирующая 315 аминокислотных остатков, приведена на фиг.1
Предлагаемый размер белка /33, 375D/, который кодируется этой последовательностью, соответствует размеру белкового продукта, полученного при трансляции in vitro мРНК мерозоитов и осаждаемого антителами, отобранными антигеном /см. фиг. 2 C, линию a/, а также размеру белка, который образуется при экспрессии кДНК векторами.
Анализ подсказанной аминокислотной последовательности белка, кодируемого вставкой кДНК λ 5-7 /фиг. 1/, показывает, что в зависимости от алгоритма, который был использован для предсказания последовательности, первые 20 /или от 75-го до 95-го/ амино-концевых аминокислотных остатков имеют сильные гидрофобные свойства. Это позволяет предложить, что они могут кодировать сигнальный пептид. Таким образом, последовательность сигнального пептида вероятно состоит из амино-концевых аминокислотных остатков, находящихся в пределах первых ста аминокислот всей последовательности кДНК λ 5-7. Это подтверждается тем фактом, что полипептид, полученный в результате трансляции in vitro мРНК мерозоитов и очищенный методом иммунопреципитации имеет мол. массу около 35 кДа в форме предшественника и около 23 кДа в форме зрелого белка. Как отмечалось выше, размер белка-предшественника хорошо согласуется с теоретическими размерами белка. Однако зрелый может, кроме того, представлять собой внутренний или N-концевой фрагмент молекулы предшественника. Точно определить терминальные аминокислоты можно известными методами.
Для многих участков полипептида с данной аминокислотной последовательностью можно определить области эпитопов, используя комбинированный подход, основанный на критерии гидрофильности согласно J.P. Hopp и K/R/ Woods /Proc, Natl. Acad. Sci, USA, 78:3824 - 3828, 1981/ и критерии вторичной структуры согласно P.Y.Chou и G.D.Fasman /Advances in Enzymology, 47:45 - 148, 1987/.
Следующие участки содержат возможные эпитопы, распознаваемые антителами:
S79 - V86 (SEQ ID NO:3)
C95 - K123 (SEQ ID NO:4)
P137 - V139 (SEQ ID NO:5)
R147 - F152 (SEQ ID NO:6)
N155 - E162 (SEQ ID NO:7)
R169 - E173 (SEQ ID NO:8)
T181 - E186 (SEQ ID NO:9)
Q196 - G225 (SEQ ID NO:10)
T239 - G243 (SEQ ID NO:11)
T252 - G256 (SEQ ID NO:12)
A265 - K269 (SEQ ID NO:13)
D276 - K289 (SEQ ID NO:14)
T298 - E315 (SEQ ID NO:15)
Дополнительно, Т-клеточные эпитопы можно установить путем теоретических обоснований, используя критерий амфифильности, разработанный BerzofsKy /Good et al. , Science, 235, 1059 - 1062, 1987/. Т-клеточные эпитопы образуются в результате процессинга антигенов /H.M. Grey and Chestnut, Immunol. Today, 6 : 101 - 106, 1985/, переносятся внутрь клеток /Schwartz A.L., Ann. Rev. Immun., 8 : 195 - 229, 1990/ и распознаются T-клеточным рецепторным комплексом. Хотя некоторые алгоритма использовались главным образом для идентификации антигенных сайтов класса II, из-за сходства пептидных взаимодействий классов II и I они, по-видимому, могут быть полезны и для идентификации пептидных мишеней для цитотоксических T-лимфоцитов /Feller и de la Cruz, Nature, 349 : 720 - 721, 1991/.
Дополнительно был установлен потенциальный сайт гликозилирования, локализованный в области расположения двадцатой аминокислоты, а именно аспарагина /D20/. Как известно, углеводородные группы определяют важные биологические свойства, например конформационную стабильность, устойчивость к протеазам, заряд и способность связывать воду. Однако следует заметить, что D20 является частью лидерной последовательности и таким образом может отсутствовать в зрелом белке. Для наиболее полного ознакомления с работами, показывающими важную роль углеводородных групп в процессах биологического распознавания, см. обзор J.C.Paulson, TIBS, 14 : 272 - 276, 1989.
Гибридизационный анализ.
ДНК изолируют из спорулированных ооцист (у которых предварительно удаляют цисты/ после их обработки трипсином и желчью и отмыванием в PBS, как описано ниже.
Материал, содержащий ооцисты /примерно 1•109 ооцист/ суспендируют в 20 мл 0,5 М ЭДТА, pH 8,0 и 0,5% саркозила (Sigma, St. Louis, MO, USA), обрабатывают протеиназой K (Boehringer-Mannheim, FRG) в дозе 1 мг/мл при 50oC в течение 2 ч, затем РНКазой (10 мг/мл) 1 ч при 37oC и снова протеиназой K 1 ч при 50oC. Белок удаляют двумя экстракциями фенолом, насыщенным 20 мМ Tris-HCl, pH 7,5 и 1 мМ ЭДТА /ТЕ/ и одной экстракцией смесью фенол-хлороформ /1: 1/. Водную фазу диализуют против большого объема ТЕ и концентрируют, осаждая этанолом. Выход ДНК обычно составляет 0,4 мг га 1 • 106 ооцист.
Паразитарную ДНК расщепляют различными рестрикционными эндонуклеазами по обычной лабораторной методике и полученные фрагменты ДНК разгоняют путем электрофореза в 0,8%-ной агарозе /40 В, 2,5 ч/ в буфере Ленинга /4,7 г NaH2PO4, 4,36 г трис-основания, 0,372 г Na2 ЭДТА на 1 л, pH 7,6/. Затем гель обрабатывают 0,25 М HCl в течение 30 мин и переносят на специальный фильтр (Zeta-Probe, BIO - RADTM/ в 0,4 М NaOH в течение ночи. Далее фильтрат нейтрализуют раствором 2X SSC (pH 6,8) и высушивают при 80oC в течение 1 ч под вакуумом.
Фильтр предгибридизируют в течение 3 ч при 65oC в буфере, содержащем 7% SDS, 1% BSA /Bochringer, фракция V/, 0,5 М NaHPO4, pH 7,2. Вставку кДНК EcoRI - гена 5-7 выделяют с помощью расщепления EcoRI из плазмиды pEV/5-7, разгоняют путем электрофореза в агарозном геле и метят путем случайного праймирования с помощью фрагмента Кленова в присутствии дезоксинуклеотидов, содержащих 32P. Меченую вставку освобождают от невключившихся нуклеотидов путем центрифугирования через колонку /BIO-RAD/, денатурируют и добавляют к раствору для гибридизации. После инкубации в течение 12 ч при 65oC фильтры трижды отмывают раствором 2x SSC/0,1%SDS и дважды - раствором 0,1 х SSC/0,1%SDS при 65oC. Геномные фрагменты ДНК, гибридизированные с пробой, определяют путем авторадиографии. Хотя авторы изобретения используют плазмиду pEV/5-7, понятно, что соответствующим образом может быть применен и любой другой эквивалентный вектор, содержащий вставку 1,2 кв кДНК λ 5-7 мерозоитов.
Результаты исследований приведены на фиг. 3, где можно видеть картину, полученную при расщеплении геномной ДНК спорулированных ооцист рестриктазами Pvu II(1), Hinc II(2), Pst I(3), Sph I(4) или Sac I(5).
Геномные фрагменты ДНК 6,5 и 3,6 кв определяют после расщепления с помощью Pvu II и Cac I /линии 1 и 5 соответственно/. Поскольку в клоне кДНК нет сайтов рестрикции для этих ферментов, максимальный размер гена Eimeria предположительно оценивается в 3,6 кв.
После расщепления с помощью Pst I /линия 3/ определяют три фрагмента. Два Pst I - сайта, предсказанные на основе последовательности кДНК, могут обеспечить расщепление с образованием внутреннего фрагмента 306 в. р. /слишком маленького, чтобы быть обнаруженным в этом Саузерн - блоттинге/ и два соединительных фрагмента. Появление третьего большого Pst I - фрагмента наилучшим образом объясняется наличием интрона, локализованного между внутренними Pst I - сайтами.
Набор фрагментов, образуемый при расщеплении Sph I /линия 4/, которая также имеет два сайта рестрикции в кДНК, не дает определенной информации. Небольшой внутренний Sph I - фрагмент 640 в.р., предсказанный на основе последовательности кДНК, не может быть определен в этом геле.
Расщепление ДНК с помощью Eco RI приводит к образованию геномного фрагмента 1,2 кв, соответствующего по размеру фрагменту кДНК. Двойное расщепление Hinc II и Eco RI приводит к образованию фрагмента 0,9 кв /не показан/.
При Нозерн - блоттинге /Alwine et al., Proc. Natl. Acad. Sci., USA, 74 : 5350, 1970/ содержащей poly /A/ м РНК мерозоитов 1,2 кв. фрагмент кДНК гена λ 5-7 гибридизируют с одноцепочечной м РНК на протяжении примерно 1,3 кв. На основании корреляции размеров ясно, что 5-7 клон, вместе с 5'-последовательностью из упоминаемого выше изолята I - 5 соответствует полной протяженности последовательности к ДНК с возможным исключением крайних 5 - нуклеотидов.
Пример 2. С целью разработки наиболее эффективного пути иммунизации цыплят антигеном 5-7 мерозоитов E. tenella 1,2 кв ДНК, описанную выше, клонируют в вирусе вакцины. Полученный таким образом рекомбинантный вирус вакцины используют в качестве субъединичной кокцидиозной вакцины для иммунизации цыплят.
Конструирование вектора.
Все используемые формы рекомбинантного вируса вакцины /rVV/ основаны на гомологичной рекомбинации в локусе вирусной тимидинкиназы /ТК/, как описано Macket et al., /Proc. Natl. Acad. Sci., USA, 79 : 7415, 1982/. ТК-локус был квартирован в Hind III J - фрагменте вируса вакцины /VV/ /Hruby et al., J. Virol. , 43 : 403, 1982/ и часть этого фрагмента секвенирована /Weir et al., J. Virol., 46: 530, 1983/.
Конструкция вектора для рекомбинанта pVC8 - ТК - 7.5К подробно описана в заявке на Европейский Патент N 344808. Кратко говоря, вектор содержит основную часть плазмиды pVC8, несущую ТК-ген вируса вакцины, разорванный промотором 7.5К VV /Venkatesan et al., Cell, 25 : 805, 1981/. В области направления транскрипции перед промотором конструируют множественный клонирующий сайт, чтобы обеспечить встраивание экспрессируемого гена. На фиг. 12 показано схематическое изображение плазмиды pVC8 - ТК - 7.5К.
Для создания конструкции Eco RI - фрагмент, кодирующий антиген мерозоитов 5-7, клонируют в полилинкерном Eco RI - сайте основного вектора, показанного на фиг.12. Конструкции, содержащие фрагмент в соответствующей ориентации, размножают и модифицируют, как описано ниже, чтобы делетировать находящийся внутри рамки считывания стартовый кодон, расположенный на 97 нуклеотидов выше от природного стартового кодона в 5-7 гене микрозоитов. С этой целью плазмиду расщепляют рестриктазами Sma I и Bgl II. После создания в сайте Bgl II тупых концов с помощью фрагмента Кленова в присутствии четырех дезоксирибонуклеотидов плазмиду повторно лигируют в конструкцию pR3 /фиг. 13/, несущую ожидаемую делецию, размножают и используют для рекомбинации с вирусом вакцины. На фиг. 14 приведена полная последовательность этой рекомбинантной плазмиды.
Кроме того, 5-7 ген мерозоитов встраивают в вектор для рекомбинации, который содержит лидерную последовательность Dral - Hind III малярийного антигена. Этот вектор, описанный в заявке на Европейский Патент N 344808, создан на основе вектора pVC8 - ТК - 7.5К, но в дополнение перед промотором 7.5К содержит последовательность малярийного антигена /190 кДа/. В области, смежной с этой последовательностью, конструируют множественный сайт для клонирования, чтобы встраивать ген, который необходимо экспрессировать. В результате образующийся с промотора 7.5 VV транскрипт может транслироваться с образованием белка, который на N - конце содержит лидерную последовательность малярийного антигена /190 кДа/. In vivo в результате процессинга при расщеплении сайта лидерной последовательности образуется белок. На фиг. 15 приведено схематическое изображение конструкции pR4, несущей 5-7 ген мерозоитов.
Конструирование рекомбинантного вируса вакцины.
Клетки CV1, высеянные на культуральные чашки площадью 8 см2, адаптируют к росту при 33oC и выращенные до состояния монослоя на 80-90% инфицируют температурочувствительным мутантом вируса вакцины tsN7 в дозе 0,1 бляшкообразующей единицы /БОЕ/ на клетку /Drillen, R. and Spehner, D., Virology, 131 : 385 - 393, 1983/. После двух часов инкубации при пермессивной температуре /33oC/ в CO2 - термостате /Kieny et al., Nature, 312 : 163, 1984/ клетки трансфицируют 0,25 мл кальций-фосфатного преципитата ДНК, как описано Weir et al. /Proc. Natl. Acad. Sci, USA, 79 : 1210 - 1214, 1982/. Кальций-фосфатный преципитат ДНК имеет следующий состав: 0,8% NaCl, 0,038% KCl, 0,0134 М Na2HPO4 • 2 H2O, 0,1% глюкозы, pH 7,0, 125 мМ CaCl2, а также 200 нг ДНК вируса вакцины дикого типа /штамм WR/ и 100 нг подходящей рекомбинантной плазмиды pR3 или pR4. Через 1 ч инкубации при комнатной температуре в чашки вносят дополнительную среду и инкубируют их в течение 2 ч при 39,5oC в атмосфере 5%-ного CO2. При этой температуре tsN 7 вирус не может реплицироваться и в результате происходит селекция вирусов, которые имеют рекомбинацию по крайней мере в локусе ts 7.
После инкубации в течение двух дней при 39,5oC клетки соскабливают с чашек и суспензию обрабатывают ультразвуком. Этот гомогенат затем используют для получения ТК-негативного /ТК-/ вируса путем титрования на ТК--клетках человека 143 в присутствии 30 мкг/мл бромдезоксиуридина /BUdR/. Бляшки собирают и вирус очищают из бляшек путем двухкратного посева и последующего отбора бляшек на ТК--клетках человека 143 в присутствии 30 мкг/мл BUdR. Собранный вирус затем помещают на CV1 - клетки в отсутствии BUdR. Рекомбинантный вирус вакцины R3.2 и R4.1 соответственно идентифицируют по наличию гена мерозоитов /1.2 кв кДНК/ в составе ТК-гена, расщепляя вирусную ДНК рестриктазой Hind III и сравнивая образец rVV ДНК с образцом ДНК вируса вакцины дикого типа, обработанной тем же самым ферментом. Если рекомбинация произошла, после электрофореза в 1%-ном агарозном геле положение фрагмента ДНК J Hind III должно быть изменен. Это и наблюдается в действительности. Изменение коррелирует с вычисленными данными, полученными методом дедукции исходя из размеров вставки.
Тест на экспрессию.
Для тестирования экспрессии 5-7 антигена мерозоитов рекомбинантным вирусом клетки CV1 инфицируют как rVV R3.2, так и rVV R4.1 и собирают через 48 ч. После центрифугирования клеток осадок солюбилизируют в буфере Лэммли для нанесения образцов /Nature, 227 : 680, 1970/ в присутствии β- меркаптоэтанола как редуцирующего агента. После кипячения в течение 5 мин образцы наносят на пластину с 12,5%-ным полиакриламидным гелем, содержащем SDS. После электрофоретического разделения белки переносят на нитроцеллюлозные фильтры /Trans-Blot, BIO-RAD/ в буфере для блоттинга, содержащем 25 мМ Tris-HCl, 0,19 М глицина, pH 8,3, и 20% /объем на объем/ метанола при постоянном напряжении 80 В в специальной камере для блоттинга /Transblot transfer cell, BIO-RAD Laboratories/ в течение 2 ч при 4oC /Towbin et al., Proc, Natl. Acad. Sci., USA, 76 : 4350 - 4354, 1979/.
Для иммунологического определения нитроцеллюлозные фильтры предварительно обрабатывают 5%-ным нежирным сухим молоком в TBS (20 мМ Tris-HCl, 150 мМ NaCl, доводят до pH 8/ в течение 45 мин и инкубируют 2 ч или ночь при комнатной температуре с разделенной 1 : 50 кроличьей сывороткой, содержащей антитела к E.tenella. Сыворотку разводят в TBS-буфера, в который добавлена эмбриональная телячья сыворотка /20%, объем на объем/. Затем фильтры три раза по 10 мин отмывают в TBS, содержащем 0,1% NP-40 и далее инкубируют 2 ч при комнатной температуре с аффинно-очищенными IgG козы к антителам кролика /H + L/, конъюгированными с пероксидазой /BIO-RAD/ в разведении 1 : 1000 в TBS с добавлением 5%-ного нежирного сухого молока /H + l обозначают тяжелые и легкие цепи IgG/. Затем блоты трижды отмывают, как описано выше. Связывание пероксидазного конъюгата выявляют, обрабатывая фильтры 0,018%-ным 4-хлоро-1-нафтолом в 6%-ном метаноле в H2O и 0,02%-ной /объем на объем/ H2O2. Реакцию останавливают, отмывая блок в избытке H2O.
Обнаружено, что сыворотка кролика, содержащая антитела к мерозоитам E. tenella, в реакции Вестерн-блоттинга /Towbin et al., см. выше/ взаимодействует с CV1-клетками, инфицированными rVVR3.2, причем с двумя отдельными белками мол.массы 33 и 23 кДа соответственно. В качестве контроля используют предварительно окрашенные низкомолекулярные стандарты для проведения SDS-PAGE фирмы BIO-RAD. CV1-клетки, зараженные вирусом вакцины дикого типа /WR/, не реагируют с кроличьей сывороткой, содержащей антитела к мерозоитам E. tenella. Размер белка мол.массы 33 кДа коррелирует с теоретически ожидаемыми равзмерами белка-предшественника, как показано на фиг. 2 C /линия b/. Белок меньшего размера мол.массы 23 кДа может обрабатываться в результате процессинга белка-предшественника, указанного выше, и его можно видеть в составе поверхностных белков мерозоитов /фиг. 2A и 2B, линия b/. Сходные результаты получены и при использовании клеток CV1, инфицированных rVVR4.1.
Дополнительно моет быть показано путем Вестерн-блоттинга, что иммунная сыворотка цыплят, инфицированых спорулированными ооцистами E.tenella, распознает 5-7 белки мерозоитов /33 кДа и 23 кДа/, экспрессируемые CV1-клетками, которые были инфицированы рекомбинантными вирусами вакцины R3.2 и R4.1 соответственно.
Получение вируса.
Вирус вакцины дикого типа (WR) размножается практически в клетках любого типа /Drillen et al., Virology, 28 : 843, 1978/ и это можно выявить непосредственно по образованию бляшек. В большинстве случаев для получения большого количества вирусов авторы используют клетки CV1.
Для заражения вирусом с клеток CV1, выращиваемых в культуральных флаконах объемом 175 см2 /например Falcon 3028/ и на 80-90% достигших состояния монослоя, сливают культуральную среду и клетки инкубируют в растворе PBS, содержащем вирус /0,1 БОЕ/мл, 0,01 мл/см2/, в течение 1 ч при комнатной температуре /20oC/. Затем добавляют свежую культуральную среду /0,2 мл/см2/ и флаконы инкубируют при 37oC в течение 2-3 дней, пока степень лизиса клеток не достигнет 80%. Полученный вирусосодежащий материал хранят непосредственно с клетками или культуральной средой в первоначально используемых культуральных флаконах при -30oC до очистки вируса.
Дальнейшую очистку проводят для получения вирусного препарата, свободного от специфических компонентов хозяйских клеток. Инфицированные клеточные культуры, которые хранились при -30oC, оттаивают и оставшиеся клетки снимают с поверхности флаконов потряхиванием или соскабливанием. Клетки и вирусы отделяют от среды центрифугированием /центрифуга Sorvall, ротор GSA/ при 5000 об/мин и 10oC. Осадок клеток с вирусными частицами ресуспендируют в TBS /10-20х объем осадка/ и центрифугируют, как описано выше. Затем осадок ресуспендирут в 10-кратном объеме RSB-буфера /10 мМ Tris-HCl, доведенный до pH 8,0, 10 мМ KCl, 1 Mg Cl2/.
Для лизиса оставшихся интактных клеток и высвобождения из них вируса, полученную суспензию обрабатывают ультразвуком /дважды, 10 с при 60 Вт при комнатной температуре в ультразвуковом дезинтеграторе, например Labsonic 1510 с 4 мм-зондом. Смесь затем центрифугируют в центрифуге типа Sorvall, ротор GSA, в течение 3 мин при 3000 об/мин и 10oC. Таким образом получают суспензию вируса, свободную от клеточных ядер и крупных "обломков" клеток. Супернатант осторожно удаляют, осадок ресуспендируют в RSB-буфере, обрабатывают ультразвуком и центрифугируют как описано выше.
Первый супернатант объединяют со вторым, наслаивают на 10 мл 35%-ной сахарозной подушки /в 10 мМ Tris-HCl, pH 8,0/ и центрируют в течение 90 мин при 14000 об/мин, используя ротор Beckman SW27, при 10oC. Супернатант сливают и осадок вирусных частиц ресуспендируют в 10 мл 10 мМ Tris-HCl, pH 8,0, обрабатывают ультразвуком для гомогенизации /дважды, в течение 10 с при комнатной температуре как описано выше/ и наслаивают на ступенчатый градиент для дальнейшей очистки.
Ступенчатый градиент содержит 5 мл-аликвоты сахарозы в 10 мМ Tris-HCl, pH 8,0, в следующих концентрациях: 20%, 25%, 30%, 35% и 40%. Градиент центрифугируют, используя ротор Beckman SW27 в течение 35 мин при 14000 об/мин и 10oC. В области 30-40%-ного градиента можно видеть несколько зон /полос/, содержащих вирусные частицы. Этот участок градиента извлекают, разводят в PBS и осаждают вирусные частицы центрифугированием /ротор Beckman SW 27/ в течение 90 мин при 14000 об/мин и 10oC. Осадок, содержащий практически исключительно вирусные частицы, ресуспендируют в PBS, чтобы концентрация вируса примерно составила 0,5 - 1 • 1011 БОЕ/мл. Полученный вирус используют в этой концентрации или дополнительно разводят в PBS.
Для определения концентрации и очистки собранного вируса используют два метода. Абсолютную концентрацию вирусных частиц определяют, измеряя оптическую плотность /OD/ вируссодержащего материала на спектрофотометре при длине волны 260 нм /OD260/. При этом 1 OD260 соответствует концентрации вируса около 1,2 • 1010 частиц в 1 мл /Joklik, Virology, 18 : 9, 1962/. Кроме того, концентрацию вируса определяют по титрованию на клеточной культуре /метод бляшек/, полагая, что только одна из 60 вирусных частиц способна инфицировать клетку.
С целью титрования вируса на культуре клеток, фибробласты куриных эмбрионов /CEF/ высевают на специальные чашки площадью 8 см2 /Falcon 3001/ с добавлением питательной среды для культивирования клеток. После того, как клетки достигнут состояния монослоя на 80-90%, среду удаляют, заменяют на 0,2 мл на разведенного в PBS вируссодержащего материала и оставляют на 1 ч при комнатной температуре. Готовят десятикратные разведения вируссодержащего материала. В каждую чашку вносят 2 мл полужидкой среды для культивирования клеток, содержащей 1% агарозы, и чашки оставляют на 16-24 в CO2-термостате при 37oC. Затем 2 мл полужидкой среды для культивирования клеток, содержащей 0,2% нейтрального красного, наслаивают на чашки для окрашивания живых клеток и чашки инкубируют дополнительно в течение 16-24 ч. Бесцветные бляшки далее подсчитывают под микроскопом.
Пример 3.
Иммунизация цыплят.
Чтобы определить, способен ли вектор rVV-R 3.2 вируса вакцины, несущий ген 5-7 мерозоитов, защитить цыплят при последующем введении спорулированных ооцист патогенного штамма E.tenella, проводят следующую вакцинацию.
Петушков породы WARREN, полученных на инкубаторной станции E.Wuethrich /Белп, Швейцария/ выдерживают в клетках с проволочным полом на производственной диете для выращивания бройлеров, преимущественно состоящей из кукурузы, пшеницы и соевых бобов. На 17-й день цыплятам инокулируют 3 • 108 БОЕ рекомбинантного вируса вакцины R3.2 в 100 мкл PBS, в то время как другие 50 мкл инъецируют подкожно в область перепонки крыла и еще 50 мкл вводят в мышцы груди. Эти процедуры осуществляют дважды с интервалам в одну неделю, но в одной группе последнюю инъекцию вируса заменяют на оральное введение 5000 спорулированных ооцист вирулентного штамма E.tenella /например T7 - 776/21/, чтобы стимулировать естественный контакт цыплят с инфекционными кокцидиями в полевых условиях. Через неделю после последней иммунизации у всех цыплят отбирают кровь для анализа и еще через неделю /45-ый день птицам вводят 50000 спорулированных ооцист E. tenella /например штамм T7 - 776/21/. Паразитические простейшие заканчивают цикл развития в течение 7 дней и на 52-й день у цыплят отбирают кровь, затем их умерщвляют и вскрывают. Удаляют инфицированную слепую кишку, подсчитывают повреждения, вызванные развитием паразитов, и ткань кишки гомогенизируют, чтобы определить количество ооцист. Более того, оценивают качество цыплят /ежедневную прибавку веса и потребление пищи/.
Эксперименты по защите цыплят.
Данные, приведенные в таблице, ясно показывают, что вакцинация рекомбинантным вирусом вакцины R3.2 оказывает значительный защитный эффект против тяжелой кокцидиальной инфекции. Количество повреждений уменьшается на 18%, а содержание ооцист в слепой кишке на 35% по сравнению с инфицированным контролем. Качество цыплят - наиболее важный экономический параметр - улучшается на 62% для ежедневной прибавки веса и на 56% для потребления пищи. Однако, когда последнюю вирусную инъекцию заменяют на введение ооцист /слабая кокцидиальная инфекция/, защита цыплят от кокцидиаза становится практически полной. Качество таких цыплят эквивалентно контрольным неинфицированным птицам, а количество повреждений, так же как и ооцист в слепой кишке, очень невелико. Так как одна инокуляция E.tenella никогда не показывала такую высокую степень защиты, авторы заключают, что вакцинация, основанная на использовании вируса, очень сильно праймирует иммунную систему цыплят, так что последующая слабая кокцидиальная инфекция может проявить бустерный эффект и в результате достигается эффективная иммунная защита от кокцидиоза.
Гуморальный статус цыплят.
Гуморальный статус цыплят анализируют непрямым ELISA и в дальнейшем используют Вестерн-блоттинг.
Вестерн-блоттинг проводят, как описано выше, за исключением того, что осуществляют одну дополнительную инкубацию до исследования образцов сыворотки цыплят. Эта дополнительная инкубация заключается в том, что фильтры обрабатывают гипериммунной сывороткой кролика, содержащей антитела к вирусу вакцины /2 ч при комнатной температуре, разведение 1 : 50/ для блокирования всех специфических вирусных белков.
Для непрямого ELISA используют третью генерацию мерозоитов E.tenella, полученных при культивировании в условиях in vitro на культуре клеток почки цыплят. В каждую лунку панелей для микротитрования вносят 3000 мерозоитов, растворенных в 100 мл натрий-карбонатно-бикарбонатного буфера /pH 9,6/ и инкубируют в течение ночи при 4oC. Панели трижды отмывали деионизированной водой и заполняют 200 мл блокирующего буфера /0,1 М Na2HPO4, pH доводят до 6,5 с помощью HCl, 1% BSA 0,5 г/л этилмеркуриттиосалицилата натрия/. Блокирование проводят в течение ночи при 4oC. От каждого цыпленка тестируют два образца сыворотки. Один образец отбирают неделю спустя после последней иммунизации, второй - сразу же перед умерщвлением. Готовят последовательные двухкратные разведения образцов в PBS, содержащем 3%-ное сухое молоко, начиная с разведения 1 : 50. Инкубирование продолжают в течение 4 ч при 37oC /100 мл/. Панели отмывают, как описано выше, затем добавляют 100 мл на лунку конъюгата антител козы к Ig(H + L) цыплят, меченного пероксидазой /1 : 2000 в PBS, содержащем 3%-ное сухое молоко/. Панели инкубируют при 37oC 2 ч. Комплексы антиген - антитело выявляют добавлением 100 мл ТМВ-субстрата. ТМВ-субстрат состоит из одной части ТМВ /0,24 г тетраметилбензидина, растворенного в 5 мл ацетона и доведенного до 50 мл метанолом/ и 20 частей субстрата /0,2 М лимонная кислота, pH 4,0, 275 мл/л 30%-ной H2O2/.
Реакцию останавливают 0,5 М H2O2 до того, как учитывают результаты реакции с помощью ELISA-ридера (Titertek Multiskan MCC/340, Flow Laboratories) при 450 нм.
После вакцинации цыплят рекомбинантными вирусами R3.2 и R4.1, по сравнению с контрольными птицами, иммунизированными низкими дозами спорулированных ооцист, ответное образование антител к мерозоитам кокцидий наблюдается только в течение недели. Средний титр антител в эксперименте составляет 1 : 100, а в контроле - более 1 : 1600. Это позволяет предположить, что эффективная защита и хорошее качество вакцинированных цыплят /см. таблицу и обсуждаемые выше результаты/ обеспечиваются эффективными механизмами клеточно-опосредованного иммунитета.
Чтобы подтвердить образование специфических антител к антигену мерозоитов 5-7, образцы крови с наивысшим титром антител в ELISA тестируют методом Вестерн-блоттинга, используя CV1-клетки, инфицированные rVV3.2 как источником антигена. Сыворотка распознает два белка мол.массы 33 и 23 кДа соответственно, показывая что произошла успешная иммунизация.
Специалистам, работающим в этой области, ясно, что на практике могут быть применены различные варианты и модификации данного изобретения, не изменяющие его сущности.
В приведенных в материалах заявки примерах настоящее изобретение описано лишь с целью иллюстрации и изобретение ограничивается только объемом притязаний, выраженным далее в формуле изобретения.
Краткая характеристика последовательностей
(1) Основные данные:
(i) Заявитель:
(A) Название фирмы: F. HOFFMANN-LA ROCHE, AG
(B) Улица: Гренцахерштрассе 124
(C) Город: Базель
( ) Кантон: Базель
(E) Страна: Швейцария
(F) Почтовый код: CH-4002
( ) Телефон: 061-688 24 03
(H) Телефакс: 061-688 13 95
(I) Телекс: 962292/965542
(ii) Название изобретения: вакцина против кокцидиоза
(iii) Количество последовательностей: 15
(iv) Форма, удобная для компьютерной обработки:
(A) Носитель: гибкий диск
(B) Компьютер: IBM PC совместимый
(C) Оперативная система: PC-DOS/MS-DOS
(D) Программа: Patent In Release # 1.0, Версия # 1.25 (EPO)
(v) Данные по настоящей заявке:
Номер заявки: 05052667 / 13 RU
(vi) Данные по предыдущей заявке:
(A) Номер заявки: US 07/729 099
(B) Конвенционный приоритет: 12 июля 1991.
(2) ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO:1:
(i) Характеристика последовательности:
(A) Длина: 315 аминокислот
(B) Тип: аминокислотная
(D) Топология: неизвестна
(ii) Молекулярный тип продукта: белок
(iii) Гипотетическая? Нет
(vi) Происхождение:
(A) Организм: Eimeria tenella
(D) Стадия развития: мерозоит
(xi) Строение последовательности SEQ ID NO:1 (см. в конце описания).
(2) ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO:2:
(i) Характеристика последовательности:
(A) Длина: 948 пар оснований
(B) Тип: нуклеиновая кислота
(C) Количество цепей: одна
(D) Топология: линейная
(ii) Молекулярный тип продукта: кДНК
(iii) Гипотетическая? Нет
(iv) Антисмысловая? Нет
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:2 (см. в конце описания).
(2) Информация о последовательности SEQ ID NO:3:
(i) Характеристика последовательности
(A) Длина: 8 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:3: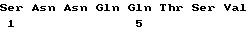
(2) ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТИ SEQ ID NO:4:
(i) Характеристика последовательности:
(A) Длина: 29 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:4:
(2) Информация о последовательности SEQ ID NO:5:
(i) Характеристика последовательности:
(A) Длина: 3 аминокислоты
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:5:
Pro Asn Val
1
(2) Информация о последовательности SEQ ID NO:6:
(i) Характеристика последовательности:
(A) Длина: 6 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(ii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:6: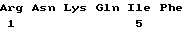
(2) Информация о последовательности SEQ ID NO:7:
(i) Характеристика последовательности:
(A) Длина: 8 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:7: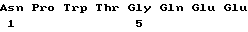
(2) Информация о последовательности SEQ ID NO:8:
(i) Характеристика последовательности:
(A) Длина: 5 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:8:
(2) Информация о последовательности SEQ ID NO:9:
(i) Характеристика последовательности:
(A) Длина: 6 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:9: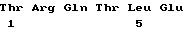
(2) Информация о последовательности SEQ ID NO:10:
(i) Характеристика последовательности:
(A) Длина: 30 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:10:
(2) Информация о последовательности SEQ ID NO:11:
(i) Характеристика последовательности:
(A) Длина: 5 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:11:
(2) Информация о последовательности SEQ ID NO:12:
(i) Характеристика последовательности:
(A) Длина: 5 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(i) Характеристика последовательности:
(A) Длина: 14 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: внутренний
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности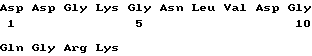
(2) Информация о последовательности SEQ ID NO:15:
(i) Характеристика последовательности:
(A) Длина: 18 аминокислот
(B) Тип: аминокислотная
(D) Топология: линейная
(ii) Молекулярный тип продукта: пептид
(iii) Гипотетическая? Да
(v) Тип фрагмента: C - терминальный
(vi) Происхождение:
(A) Организм: Eimeria tenella
(xi) Строение последовательности SEQ ID NO:15: о
о


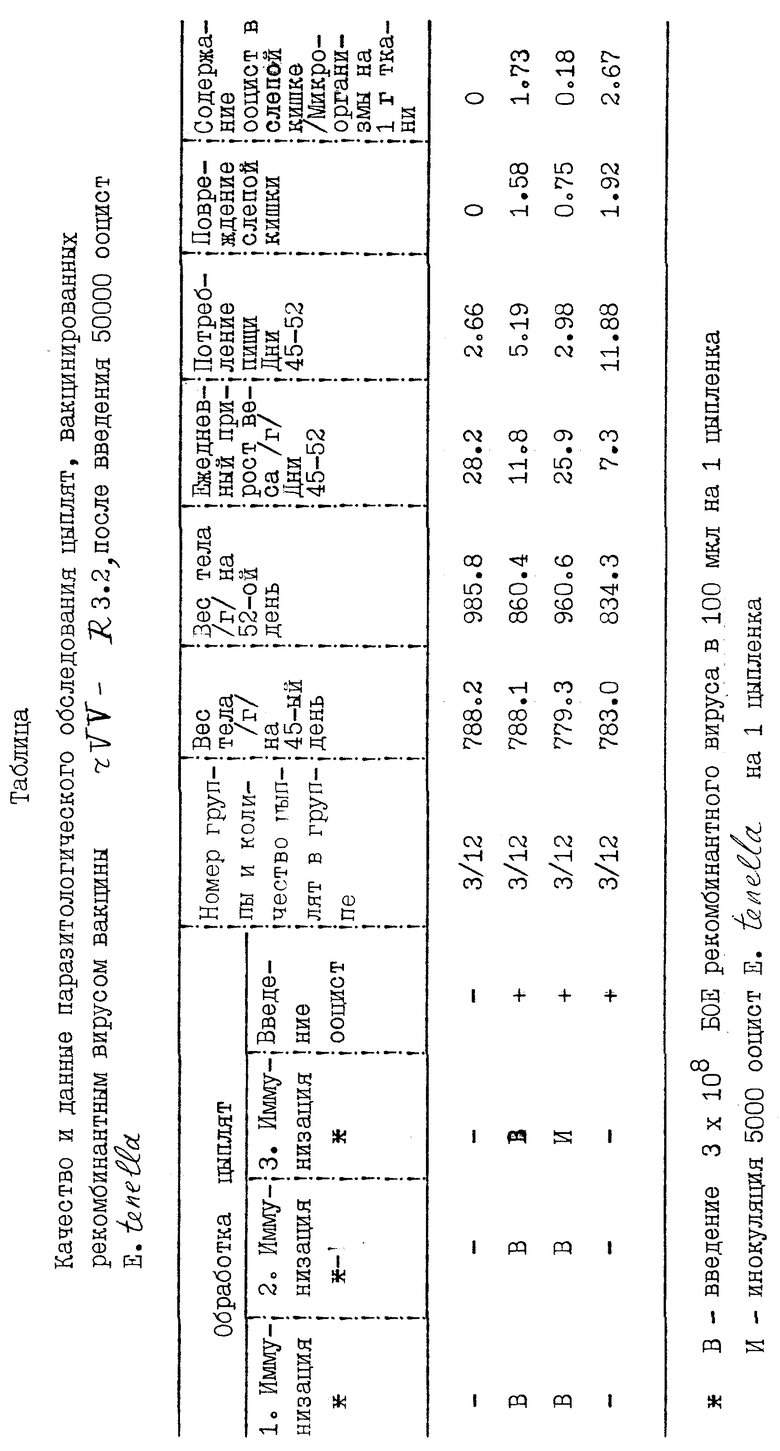





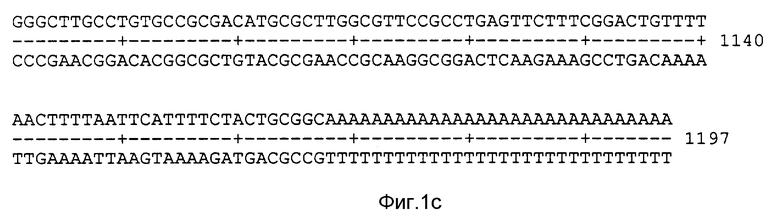
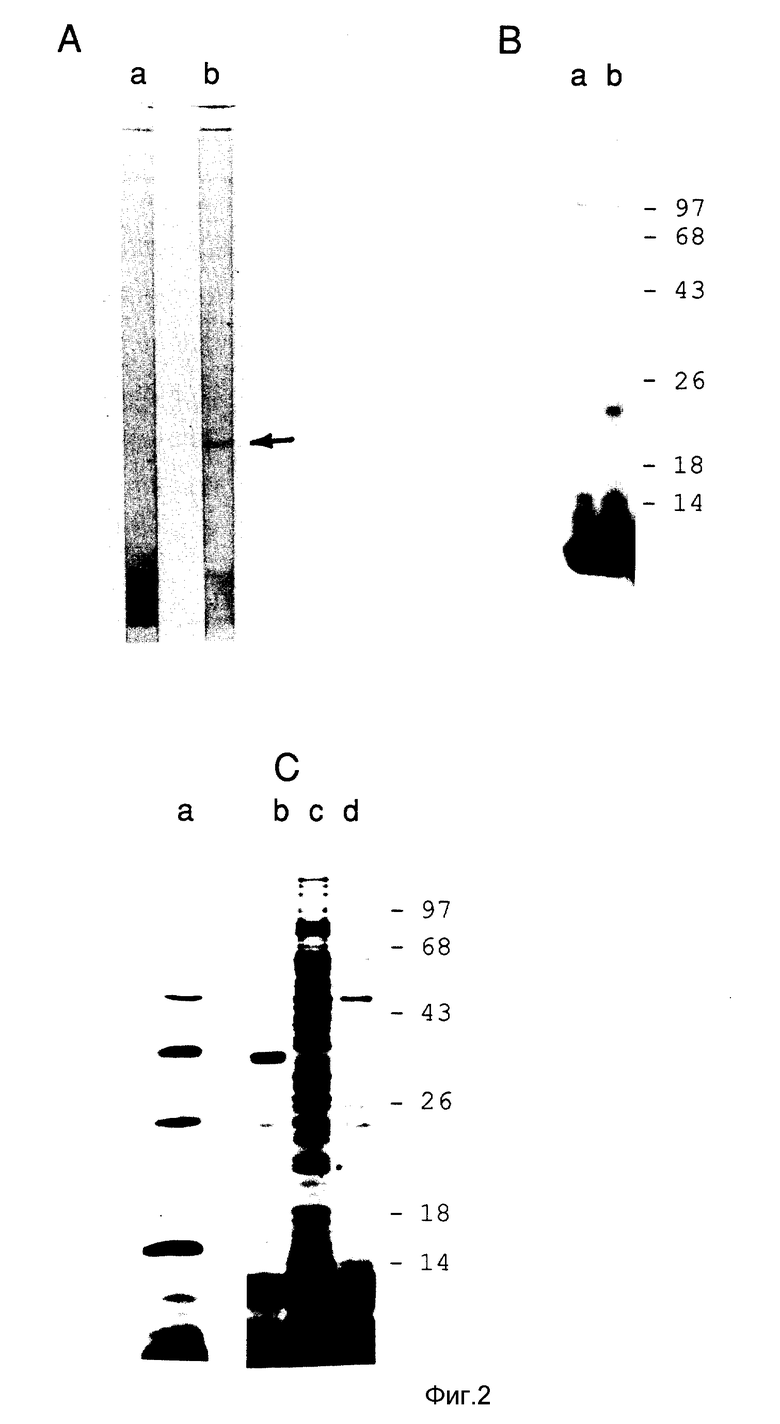
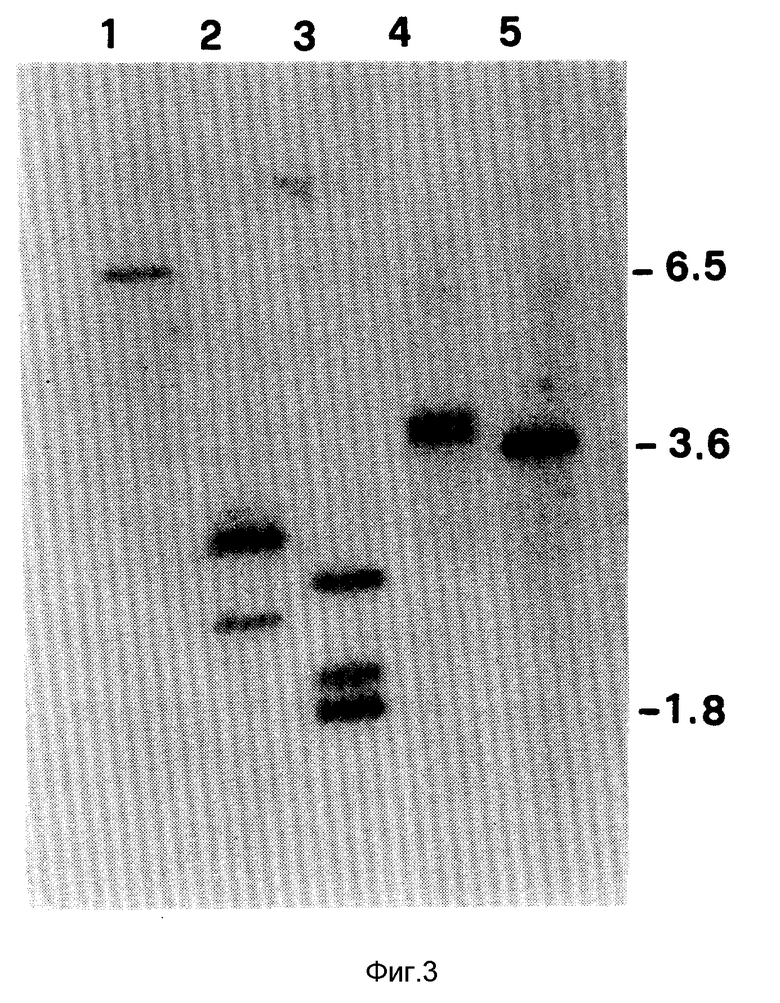
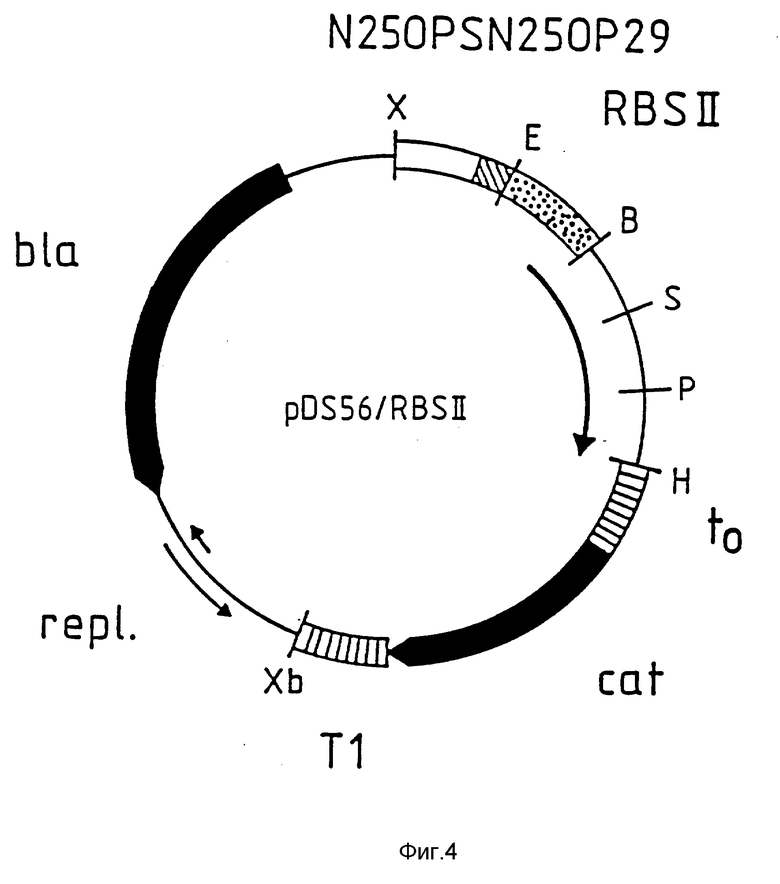



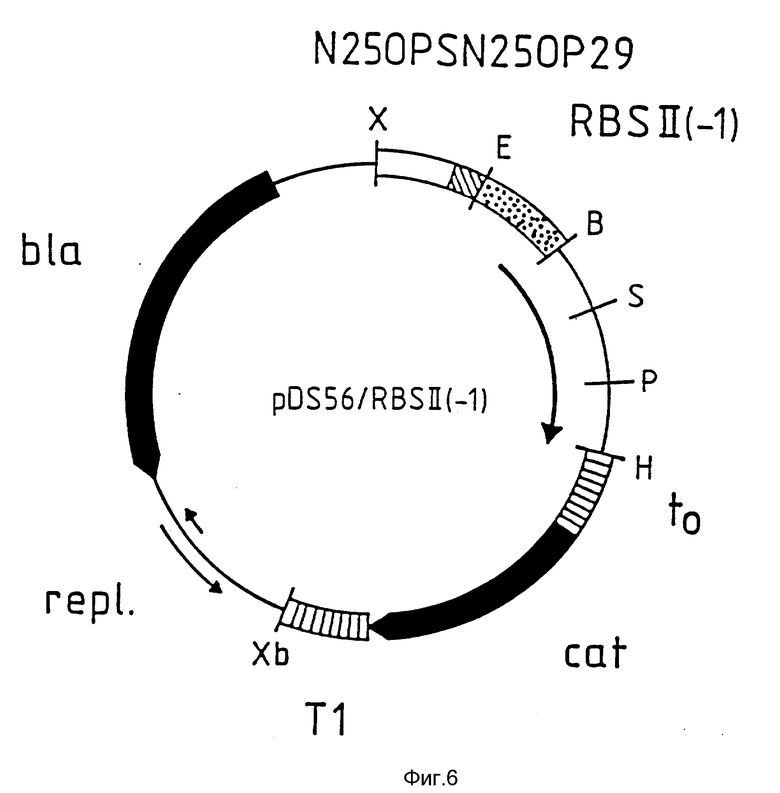



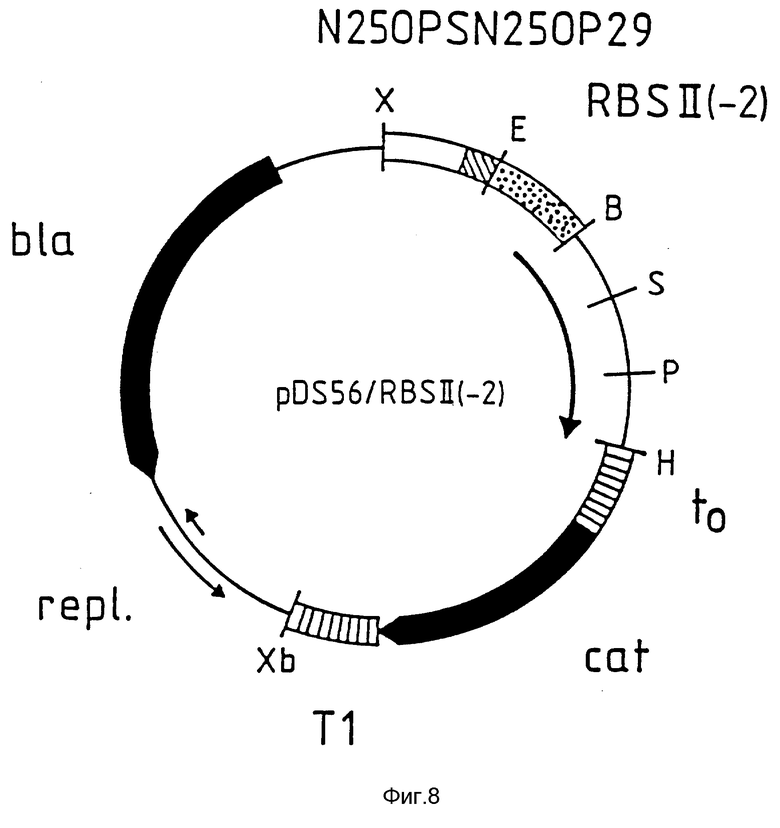



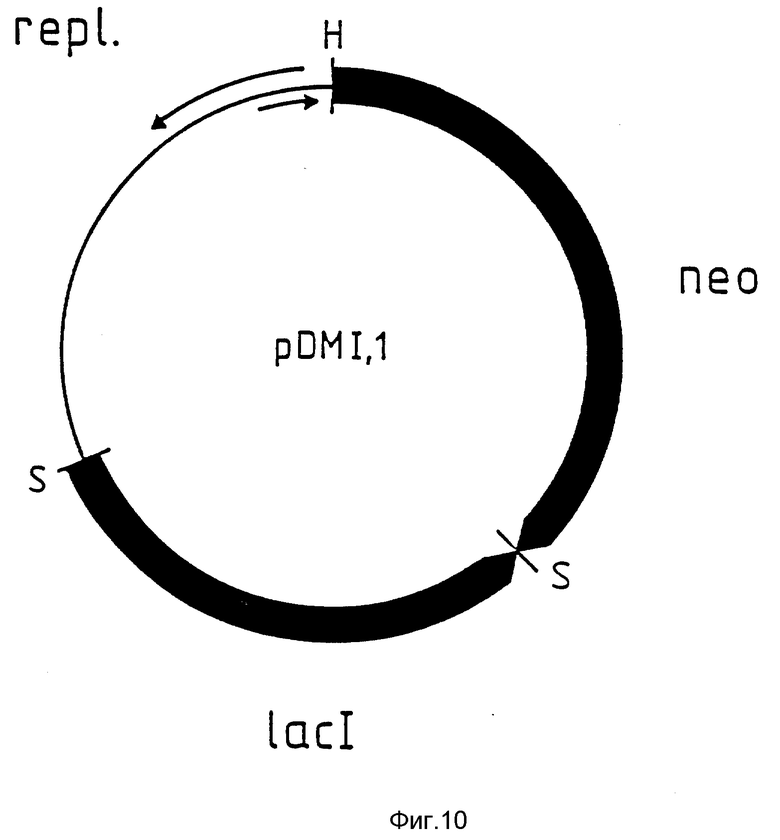



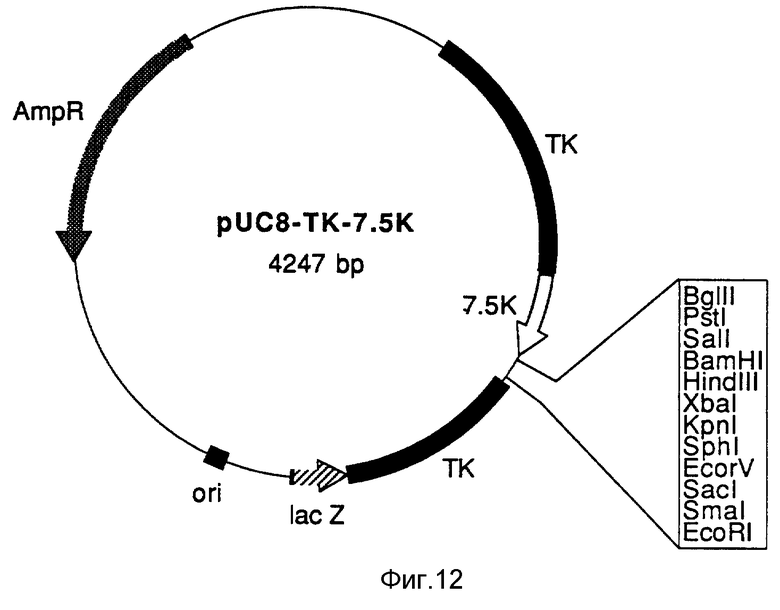
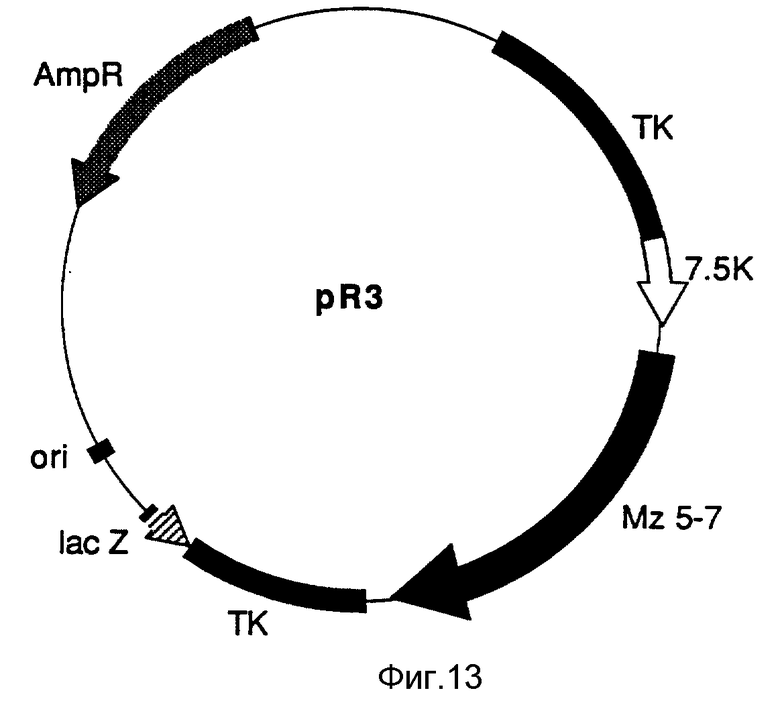



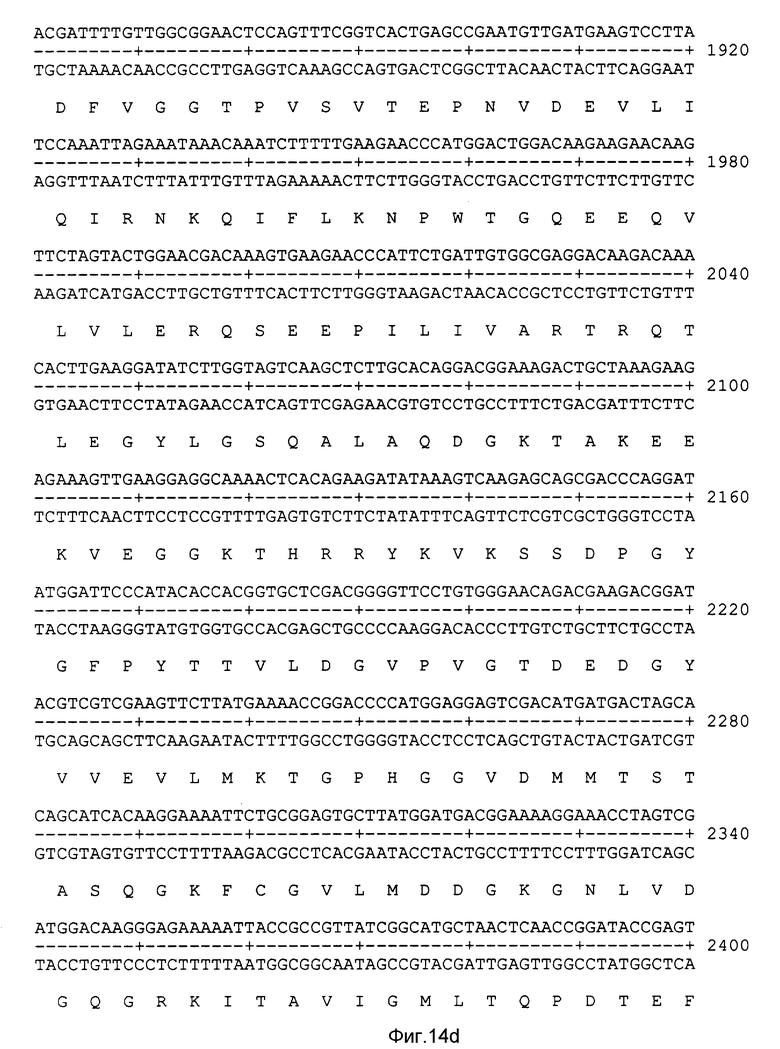




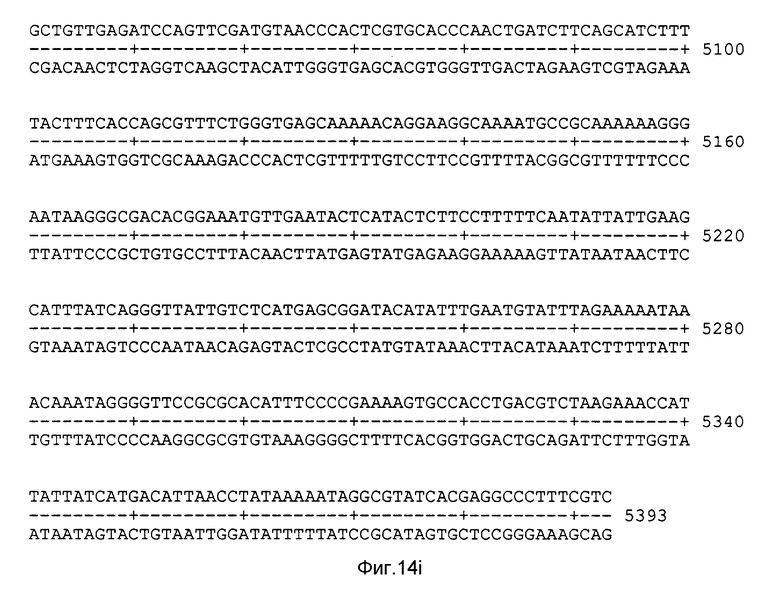
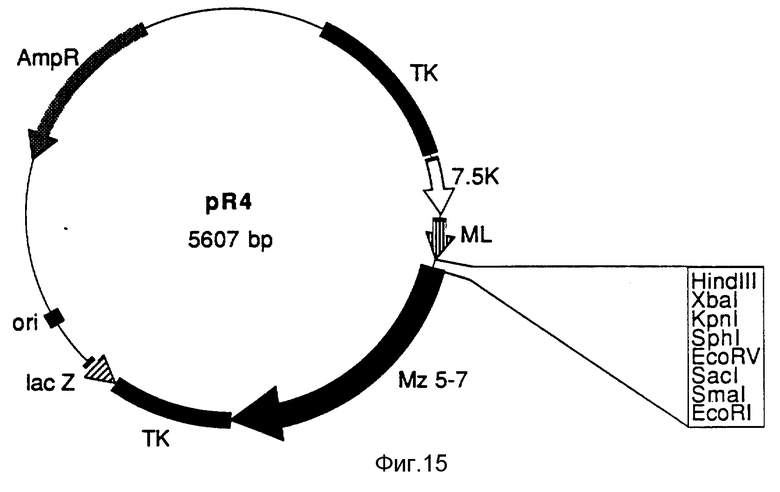
Изобретение относится к биотехнологии и ветеринарии и может быть использовано для защиты живых организмов от кокцидиоза. Фрагмент ДНК, кодирующий иммуногенный поверхностный полипептид мерозоитов Eimeria tenella молекулярной массы 33 кДа. При экспрессии этого фрагмента в клетках микроорганизмов образуется указанный иммуногенный полипептид. Фрагмент ДНК, кодирующий полипептид, встраивают в подходящий вектор. Вектором трансформируют клетки микроорганизмов. Выделяют целевую рекомбинантную ДНК из клеток, в которых произошла экспрессия полипептида. Целевой полипептид выделяют из культурной среды. Фрагмент ДНК, кодирующий данный полипептид, клонируют в подходящем векторе. Встраивают в плазмиду для рекомбинации, содержащую ген ТК вируса вакцины. Трансформируют культивируемые клетки полученной плазмидой рекомбинации температурочувствительным вирусом вакцины и вирусом вакцины дикого типа. Выращивают трансформированные клетки при повышенной температуре. Выделяют ТК-негативный вирус вакцины. Заражают им культивируемые клетки. Отбирают целевой рекомбинантный вирус вакцины по наличию гена мерозоитов. Вакцина содержит рекомбинантный вирус вакцины, содержащий фрагмент ДНК или иммуногенный поверхностный полипептид мерозоитов и физиологически приемлемый носитель. Изобретение позволяет получить важные вакцинные антигены, которые играют существенную роль в защите домашней птицы от кокцидиоза. 9 с.п. ф-лы, 1 табл. 15 ил.
2. Иммуногенный поверхностный полипептид мерозоитов Eimeria tenella молекулярной массы около 33 кДа, образующийся в результате экспрессии фрагмента ДНК, охарактеризованного в п. 1 формулы, в клетках микроорганизмов и имеющий следующую последовательность аминокислот, выведенную на основе последовательности ДНК, охарактеризованной в п.1 формулы
3. Иммуногенный поверхностный полипептид мерозоитов Eimeria tenella молекулярной массы около 23 кДа, образующийся в результате протеолитического расщепления иммуногенного поверхностного полипептида, охарактеризованного в п.2 формулы.
| ИНДУКЦИОННАЯ СИСТЕМА АВТОМАТИЧЕСКОГО | 0 |
|
SU344808A1 |
| ЛЕНТОПРОТЯЖНЫЙ МЕХАНИЗМ | 0 |
|
SU324648A1 |
| ЗАПИРАЮЩЕЕ УСТРОЙСТВО ПЕРИОДИЧЕСКОЙ ЗУБЧАТОЙ ПЕРЕДАЧИ | 0 |
|
SU164176A1 |
| SU 1396603 A1, 07.05.90. | |||
Авторы
Даты
1999-05-10—Публикация
1992-07-08—Подача