Изобретение относится к области ветеринарной вирусологии, в частности к способу диагностики оспы овец и оспы коз путем выявления специфических антигенов сэндвич методом твердофазного иммуноферментного анализа (ТФ ИФА) на основе моноклональных антител, и может быть использовано в научно-исследовательских институтах и ветеринарных лабораториях.
В настоящее время для обнаружения антигенов вирусов оспы овец и оспы коз в лабораторной практике используют следующие методы - реакцию диффузионной преципитации (Bhambani B.D., Krishnamurty D. An immunodiffusion test for laboratory diagnosis of sheeppox and goatpox // J. Соmр. Path. - 1963 - v.73 - p.394), реакцию прямой иммунофлюоресценции (Sarkar P., Singh S.P., Pandey А. К. , Kathuria B.K., Kumar S. Application of fluorescent antibody test in the diagnosis of sheep-pox, and study of sheep-pox virus multiplication in cell-culture. // Indian. J. Anim Sci. - 1980 - 50(5) - p.428-433) и непрямой ее вариант (OIE Manual of standards for diagnostic tests and vaccines. - 1996 - p.119-127); иммуноферментный анализ (ИФА) (Sharma. S., Negi B.S., Yabav M.R. , Shankar H., Pandey А.В. Применение ELISA для выявления антигенов и антител к вирусу оспы овец и коз. // Acta virol. - 1988 - v.32 - р.65-69:, Carn. V. M. An antigen trapping ELISA for the detection of capripoxvirus in tissue culture supernatant and biopsy samles. // J. of Virol. Meth. - 1995 - v.51 - p.95-102).
Реакция диффузионной преципитации обладает невысокой чувствительностью и продолжительна по времени.
Применение реакции как прямой, так и непрямой иммунофлюоресценции с использованием гипериммунных сывороток дает высокое фоновое неспецифическое окрашивание.
Наиболее оптимальным является ИФА с использованием моноспецифической сыворотки, предложенный Carn V. M. (1995 г.), который в отличие от ранее описанного Sharma S. et al. (1988 г.) позволил избавиться от неспецифического фонового окрашивания.
Суть метода, предложенного Carn V.M., состоит в следующем. Полистирол, используемый в качестве твердой фазы, сенсибилизируют поликлональными антителами, полученными при иммунизации кролика очищенным вирусом. Следующим шагом является контакт исследуемого антигена с антителами подложки. После чего для формирования "сэндвича" вносят моноспецифическую сыворотку, полученную к рекомбинантному белку "слияния" каприпоксвирусов на морских свинках. Детекцию образовавшегося комплекса антитело - антиген - антитело проводят антивидовым (анти - морская свинка) конъюгатом.
Целью настоящего изобретения является разработка способа диагностики оспы овец и оспы коз сэндвич методом твердофазного иммуноферментного анализа на основе моноклональных антител.
Указанная цель достигается тем, что для сенсибилизации твердой фазы используются моноклональные антитела клона 08,3, обладающие специфичностью к антигенной детерминанте полипептида молекулярной массы 36-40 кДа вируса оспы овец штамм "НИСХИ". Детекция образовавшегося комплекса моноклональное антитело - антиген проводится пероксидазным конъюгатом поликлональных антител, выделенных из гипериммунной сыворотки животных - реконвалесцентов.
Пример конкретного выполнения
При постановке сэндвич метода ТФ ИФА использовали 96-луночные панели для микрокультивирования.
Перец началом постановки метода готовили тест-панели. Для этого лунки панели сенсибилизировали моноклональными антителами в рабочем разведении на 0,01 М карбонатно-бикарбонатном рН 9,5 в течение 18 часов при 4oС. После чего содержимое лунок удаляли, лунки трехкратно промывали отмывочным буфером (ЗФР; 0,05% Твин 20) и блокировали свободные сайты сорбции полистирола путем инкубирования в лунках блокирующего буфера (ЗФР; 0,05% Твин 20, 1% БСА) в течение 30 мин при 37(±0,5)oС. Затем содержимое лунок удаляли, двукратно промывали отмывочным буфером и вносили в лунки вертикальных рядов по 0,2 см3 двукратных разведений контрольных (нормального и специфического) и исследуемых антигенов на блокирующем буфере. Через 1 ч инкубирования при 37(±0,5)oС и последующей трехкратной отмывки отмывочным буфером в лунки пластины вносили по 0,2 см3 специфического конъюгата в рабочем разведении на блокирующем буфере. Содержимое лунок инкубировали в течение 1 ч при 37(±0,5)oС. Лунки семикратно промывали отмывочным буфером, однократно ЗФР и вносили по 0,2 см3/лунку хромогенного субстратного раствора ABTS. После 30 мин инкубирования при комнатной температуре проводили учет и оценку результатов.
Учет и оценка результатов реакции проводится фотометрически.
При фотометрическом учете измеряют оптическую плотность хромогенного субстратного раствора при длине волны 405 нм. Реакцию считают положительной, если оптическая плотность хромогенного субстратного раствора в лунках, в которых предварительно инкубировали контрольный специфический и исследуемые антигены, в 2 и более раз превышает оптическую плотность в лунках, в которых предварительно инкубировали контрольный нормальный антиген.
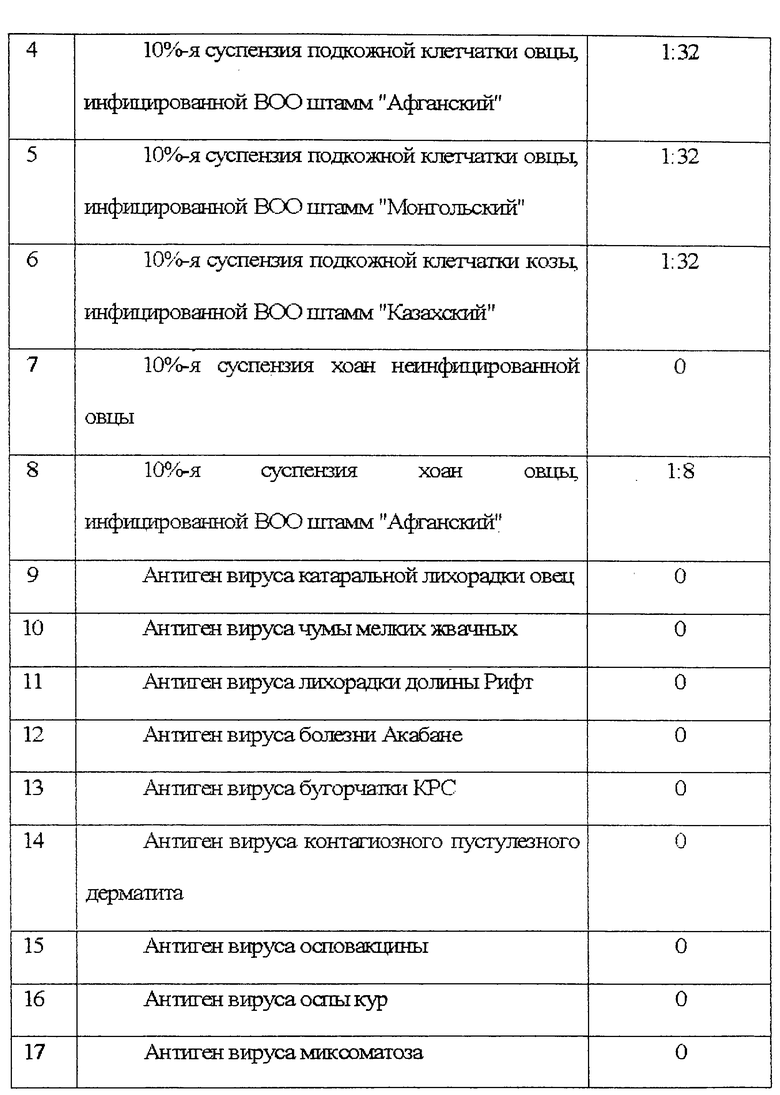
В работе по определению чувствительности и специфичности данного метода использовали гомологичные культуральные и органные антигены (подкожную клетчатку с мест оспенного поражения и хоаны инфицированных животных), гетерологичные антигены вирусов болезней мелких жвачных (катаральной лихорадки овец, чумы мелких жвачных, лихорадки долины Рифт, болезни Акабане) и родственные антигены вирусов бугорчатки КРС, контагиозного пустулезного дерматита, осповакцины, оспы кур, миксоматоза. Результаты по определению чувствительности и специфичности данного метода представлены в таблице.
Результаты исследований, представленные в таблице, свидетельствуют, что предлагаемый способ твердофозного иммуноферментного анализа на основе моноклональных антител позволяет проводить диагностику оспы овец и оспы коз и дифференцировать данное заболевание от других представителей семейства Poxviridae и гетерологичных возбудителей, вызывающих развитие инфекции с клинически сходной картиной.
Предлагаемый способ обладает высокой чувствительностью и специфичностью по сравнению с существующими методами. Он экспрессен, прост в использовании и может быть применен в научно-исследовательских институтах и ветеринарных лабораториях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБНАРУЖЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ К ВИРУСАМ ОСПЫ ОВЕЦ И ОСПЫ КОЗ МЕТОДОМ ДВУХФАЗНОГО ИНГИБИРОВАНИЯ ТВЕРДОФАЗНОГО ИММУНОФЕРМЕНТНОГО АНАЛИЗА НА ОСНОВЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2001 |
|
RU2202112C1 |
| СПОСОБ ДИАГНОСТИКИ ОСПЫ ОВЕЦ И ОСПЫ КОЗ ГИСТОХИМИЧЕСКИМ ИММУНОФЕРМЕНТНЫМ АНАЛИЗОМ НА ОСНОВЕ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ | 2003 |
|
RU2238565C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПЕРИММУННОЙ АНТИРАБИЧЕСКОЙ СЫВОРОТКИ | 2001 |
|
RU2196607C2 |
| СПОСОБ ЭКСТРЕННОЙ ЗАЩИТЫ ОВЕЦ ОТ ОСПЫ | 2001 |
|
RU2216352C2 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК MUS MUSCULUS - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, ИСПОЛЬЗУЕМЫХ ДЛЯ ДИАГНОСТИКИ ВИРУСНОЙ ГЕМОРРАГИЧЕСКОЙ БОЛЕЗНИ КРОЛИКОВ | 1992 |
|
RU2007452C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОСПЫ КОЗ | 2003 |
|
RU2245118C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОАКТИВНОЙ СПЕЦИФИЧЕСКОЙ К ВИРУСУ КЛАССИЧЕСКОЙ ЧУМЫ СВИНЕЙ СЫВОРОТКИ КРОВИ СВИНЕЙ | 2000 |
|
RU2183972C2 |
| Тест-система ИФА для серологической диагностики нодулярного дерматита крупного рогатого скота - Dermatitis nodularis bovum | 2016 |
|
RU2640192C1 |
| СПОСОБ И НАБОР ДЛЯ ОБНАРУЖЕНИЯ ВИРУСА ЛИХОРАДКИ ДОЛИНЫ РИФТ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 1994 |
|
RU2122210C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 1997 |
|
RU2115929C1 |

Изобретение относится к ветеринарной вирусологии, в частности к способу диагностики оспы овец и оспы коз. Способ предусматривает сенсибилизацию твердой фазы моноклональными антителами клона 08,3, обладающих специфичностью к антигенной детерминанте полипептида молекулярной массы 36-40 кДа вируса оспы овец штамма "НИСХИ". Детекция образовавшегося комплекса моноклональное антитело - антиген проводится пероксидазным конъюгатом поликлональных антител, выделенных из гипериммунной сыворотки животных реконвалесцентов. Способ позволяет повысить специфичность и чувствительность метода, а также позволяет экспрессно обнаруживать антигены вирусов оспы овец и оспы коз и дифференцировать их от возбудителей болезней, протекающих с клинически схожей картиной. 1 табл.
Способ диагностики оспы овец и оспы коз, включающий использование сэндвич метода твердофазного иммуноферментного анализа для выявления специфических антигенов, отличающийся тем, что для сенсибилизации твердой фазы используют моноклональные антитела клона 08.3, обладающие специфичностью к антигенной детерминанте полипептида молекулярной массы 36-40 кДа вируса оспы овец штамма "НИСХИ".
| CARN V.M | |||
| An antigen trapping ELISA for the detection of capripoxvirus in tissue culture supernatant and biopsy samples | |||
| J | |||
| of Virol | |||
| Meth., 1995, v | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| RAO T.V | |||
| et all | |||
| Evaluation of immunocap ture ELISA for diagnosis of goat pox J | |||
| Acta | |||
| Virol., 1997, Dec; 41(6) 345-8 | |||
| SARMA B.J | |||
| et all | |||
| Detection of sheep pox virus multiplication in sheep thyroid cells by acridine orange staining | |||
| Indian J | |||
| Exp | |||
| Biol., 1997, Mar; 15(3): 239-40 | |||
| RU 2121366, 10.11.1998 | |||
| ВАКЦИНА ПРОТИВ ОСПЫ ОВЕЦ | 1989 |
|
RU1614201C |
Авторы
Даты
2003-01-27—Публикация
2001-06-19—Подача