Область техники
Изобретение относится к производному 2-аминопропан-1,3-диола, которое может использоваться в качестве фармацевтических средств, в частности, иммуносупрессантов, их фармацевтическому применению и к промежуточному продукту для его синтеза.
Предпосылки изобретения
В WО94/08943 описаны производные 2-аминопропан-1,3-диола, включая гидрохлорид 2-амино-2-(2-(4-октилфенил)этил)пропан-1,3-диол, который может использоваться в качестве средства, подавляющего отторжение при трансплантации органов или костного мозга, или в качестве терапевтического средства при различных аутоиммунных заболеваниях, таких как псориаз, болезнь Бехчета и тому подобное, и ревматических заболеваниях. В WО96/06068 описано производное бензола, которое может использоваться в качестве средства, подавляющего отторжение при трансплантации органов или костного мозга, или в качестве терапевтического средства при различных аутоиммунных заболеваниях, таких как псориаз, болезнь Бехчета и тому подобное, и ревматических заболеваниях.
В J. Org. Chem., vol. 25, р. 2057-2059 (1960) рассмотрен 2-метиламино-2-(фенилметил или фенилметил, замещенный группой 2-метил, 3-метил, 4-метил, 4-метокси или 4-гидрокси)пропан-1,3-диол. В патенте США N 3660488 описан 2-амино-2-(п-хлорбензил)пропан-1,3-диол в качестве противорадиационного лекарственного препарата.
Целью настоящего изобретения является разработка более эффективного и высокобезопасного соединения в качестве средства, подавляющего отторжение при трансплантации органов или костного мозга, или в качестве терапевтического средства при различных аутоиммунных заболеваниях, таких как атонический дерматит, псориаз, артикулярный ревматизм и болезь Бехчета, фармацевтического средства, содержащего указанное соединение, и ключевого соединения для синтеза указанного соединения.
Заявители провели интенсивные исследования для достижения вышеуказанной цели и обнаружили, что из производных 2-аминопропан-1,3-диола, представленных общей формулой, описанной в WО94/08943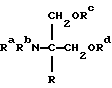
соединение, где в заместителе R данного соединения, п-фениленовая группа в углеродной цепи и фенильная группа на конце углеродной цепи замещены и в углеродной цепи между указанной п-фениленовой группы и фенильной группой атом углерода в α-положении п-фениленовой группы замещен карбонильной группой (эти соединения конкретно не описаны в указанном официальном журнале), обладает меньшей токсичностью, большей безопасностью и превосходным иммуносупрессивным действием, что и привело к созданию настоящего изобретения.
Сущность изобретения
Конкретно, настоящее изобретение относится к следующему.
(1) Производное 2-аминопропан-1,3-диола общей формулы (здесь и далее иногда указывается как соединение (I))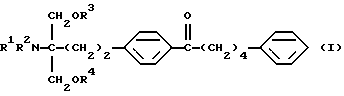
где R1, R2, R3 и R4 одинаковы или различны, и каждый представляет собой водород или ацил; его фармацевтически приемлемая соль добавления кислоты или гидрат,
(2) производное 2-аминопропан-1,3-диола в соответствии с вышеуказанным (1), которое представлет собой 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропан-1,3-диол (здесь и далее иногда указывается как соединение (I-а)), его фармацевтически приемлемая соль добавления кислоты или гидрат,
(3) фармацевтический препарат, содержащее производное 2-аминопропан-1,3-диола в соответствии с вышеуказанным (1) или (2), его фармацевтически приемлемая соль добавления кислоты или гидрат,
(4) иммуносупрессант, содержащий в качестве активного ингредиента производное 2-аминопропан-1,3-диола в соответствии с вышеуказанным (1) или (2), его фармацевтически приемлемая соль добавления кислоты или гидрат,
(5) средство, подавляющее отторжение, содержащее в качестве активного ингредиента производное 2-аминопропан-1,3-диола в соответствии с вышеуказанным (1) или (2), его фармацевтически приемлемую соль добавления кислоты или гидрат,
(6) средство для профилактики или лечения заболеваний "трансплантант против хозяина", содержащее в качестве активного ингредиента производное 2-аминопропан-1,3-диола в соответствии с вышеуказанным (1) или (2), его фармацевтически приемлемую соль добавления кислоты или гидрат,
(7) средство для профилактики или лечения аутоиммунных заболеваний или аллергических заболеваний, содержащее в качестве активного ингредиента производное 2-аминопропан-1,3-диола в соответствии с вышеуказанным (1) или (2), его фармацевтически приемлемую соль добавления кислоты или гидрат,
(8) фармацевтическая композиция, содержащая производное 2-аминопропан-1,3-диола в соответствии с вышеуказанным (1) или (2), его фармацевтически приемлемую соль добавления кислоты или гидрат и фармацевтически приемлемый носитель,
(9) 2-амино-2-(2-(4-(1-гидрокси-5-фенилпентил)фенил)-этил)пропан-1,3-диол (здесь и далее иногда указывается как соединение (II)), его производное, где аминогруппа и/или гидроксигруппа защищена(ы), или его соль,
(10) 2-амино-2-(2-(4-формилфенил)этил)пропан-1,3-диол (здесь и далее иногда указывается как соединение А), его производное, где аминогруппа и/или гидроксигруппа защищена(ы), или его соль.
Соединение по настоящему изобретению (I) представлено формулой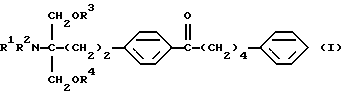
где каждый символ имеет значение, как указано выше, и характеризуется структурой, у которой в углеродной цепи во 2-положении скелета 2-аминопропан-1,3-диола п-фениленовая группа в указанной углеродной цепи и фенильная группа на конце указанной углеродной цепи замещены, и в углеродной цепи между указанной п-фениленовой группой и фенильной группой углерод в α-положении п-фениленовой группы замещен карбонильной группой. Благодаря такой особенности структуры соединения по настоящему изобретению обладают меньшей токсичностью, большей безопасностью и демонстрируют превосходное иммуносупрессивное действие.
Соединение (II) по настоящему изобретению представлено формулой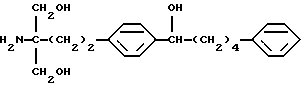
и соединение А по настоящему изобретению представлено формулой
Группы, представленные характеристическими символами в настоящем описании, объясняются следующим образом.
Ацил при R1, R2, R3 и R4 представляет собой алканоил с прямой или разветвленной цепью, содержащей от 1 до 6 атома углерода, таких как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил и гексаноил; алканоил с прямой или разветвленной цепью, содержащий от 2 до 6 атомов углерода, которые замещены фенилом, такие как фенилацетил и фенилпропионил; ароил, такой как бензоил; алкоксикарбонил, где алкоксигруппа представляет собой алкокси с прямой или разветвленной цепью, содержащая от 1 до 6 атомов углерода, такая как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, трет-пентилоксикарбонил и гексилоксикарбонил; и аралкилоксикарбонил, такой как бензилоксикарбонил.
Примеры фармацевтически приемлемых солей добавления кислоты настоящего соединения (I) включают соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, или соли с органическими кислотами, такими как уксусная кислота, малеиновая кислота, фумаровая кислота, бензойная кислота, лимонная кислота, янтарная кислота, винная кислота, яблочная кислота, миндальная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота и 10-камфорсульфоновая кислота. Настоящее производное может быть преобразовано до его солей с щавелевой кислотой с пролучением кристаллов. Соли соединения (II) и соединения А также включают вышеуказанные соли добавления кислот.
Примеры гидрата настоящего соединения (I) включают моногидрат, 1/2 гидрат, 1/5 гидрат, 2 гидрат и 3/2 гидрат. Настоящее изобретение также охватывает сольваты.
Аминозащитная группа соединения (II) и соединения А, которые могут использоваться в качестве промежуточных соединений в синтезе соединения по настоящему изобретению показана на примерах алифатического ацила, такого как формил, ацетил, пропионил, хлорацетил, дихлорацетил, трихлорацетил, трифторацетил, метансульфонил и этансульфонил; ароматического ацила, такого как фталоил, бензоил, п-нитробензоил, п-трет-бутилбензоил, п-трет-бутилбензолсульфонил, бензолсульфонил и толуолсульфонил; карбоната, такого как метоксикарбонил, этоксикарбонил, изопропоксикарбонил, трет-бутоксикарбонил, 2-цианэтоксикарбонил, 2,2,2-трихлорэтоксикарбонил, бензилоксикарбонил, п-нитробензилоксикарбонил, п-метоксибензилоксикарбонил, п-хлорбензилоксикарбонил, дифенилметоксикарбонил, метоксиметилоксикарбонил, ацетилметилоксикарбонил, фенилоксикарбонил, метилсульфонилэтилоксикарбонил и 2-триметилсилилэтоксикарбонил; аминозащитной группы, иной, чем ацил, такой как тритил, ди- или триалкилсилил, бензил и п-нитробензил.
Гидроксизащитная группа соединения (II) и соединения А, используемых в качестве промежуточного соединения для синтеза соединения по настоящему изобретению представлена низшим алкилом, который может быть замещен, таким как метил, этил, пропил, бутил, трет-бутил, пентил, гексил, метоксиметил и метоксиэтоксиметил; аллилом; аралкилом, который может быть замещен, таким как бензил, п-метоксибензил, трифенилметил и трис(п-метоксифенил)метил; тризамещенным силилом, таким как триметилсилил, триэтилсилил, трет-бутилдиметилсилил, три-трет-бутилсилил, метилдифенилсилил, этилдифенилсилил, пропилдифенилсилил и трет-бутилдифенилсилил; тетрагидропиранилом, тетрагидро-2-тиопиранилом, 2-тиоланилом; ацилом, таким как алифатический ацил, ароматический ацил, и алифатическим ацилом, замещенным ароматической группой, которые являются производными карбоновых кислот и сульфоновых кислот.
Примером алифатического ацила является низший алканоил, такой как формил, ацетил, пропионил, бутирил, валерил, пивалоил, карбоксиацетил, карбоксипропионил, трифторацетил, хлорацетил, метоксиацетил и феноксиацетил; карбонат, такой как метоксикарбонил, этоксикарбонил, изопропоксикарбонил, трет-бутоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2,2,2-трибромэтоксикарбонил и п-нитрофеноксикарбонил; сульфонил, такой как метансульфонил и этансульфонил.
Примером ароматического ацила является ароил, такой как бензоил, толуоил, нафтоил, нитробензоил и динитробензоил; сульфонил, такой как бензолсульфонил, толуолсульфонил, нафталинсульфонил, фторбензолсульфонил, хлорбензолсульфонил, бромбензолсульфонил и иодбензолсульфонил; и тому подобное. Примером алифатического ацила, замещенного ароматической группой, является арилалканоил, такой как фенилацетил, фенилпропионил и фенилбутирил.
Кроме того, две гидроксильные группы могут вместе образовывать циклическую ацеталь, такую как метиленацеталь, этилиденацеталь, изопропилиденацеталь, бензилиденацеталь, анизилиденацеталь и 2,4-диметоксибензилиденацеталь. Оксазолидин и оксазин могут быть получены с гидроксильной группой и аминогруппой.
В настоящем изобретении аминогруппа и/или гидроксильная группа соединения (I) может быть защищена данными защитными группами, и защищенное производное может быть использовано в качестве промежуточного соединения для синтеза соединения (I), и неожиданно, использовано в качестве фармацевтического средства как таковое.
Соединение (I) по настоящему изобретению может быть получено следующими способами.
Способ А
Соединение (I-а), где R1, R2, R3 и R4 обозначают водород в соединении (I), получают следующим способом. Конкретно, соединение А, где аминогруппа и/или гидроксильная группа защищены/защищена, подвергают взаимодействию с соединением формулы (III) [здесь и далее указано как соединение (III)]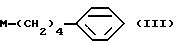
где М представляет собой металл, широко используемый в области синтетической органической химии, такой как литий, хлорид магния, бромид магния, йодид магния, медь, литиймедь и никель; и защитную группу удаляют, если необходимо, с получением соединения (II)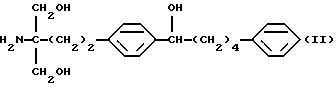
или его производного, где аминогруппа и/или гидроксильная группа защищены/защищена; с последующим окислением гидроксильной группы в α-положении фениленовой группы подходящим окислителем, и защитную группу удаляют, если необходимо, с получением соединения (I-a).
Примеры органического растворителя, используемого в реакции с соединением (III), включают тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан и ацетонитрил.
Температура настоящей реакции обычно составляет от -100 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Время настоящей реакции обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения реакции в вышеуказанных условиях или после удаления защитной группы(групп), если требуется, соединение (II) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры окислителя, используемого в реакции окисления соединения (II), включают хромовую кислоту-серную кислоту, оксид хрома(VI)-серную кислоту-ацетон (реактив Джонса), комплекс оксид хрома(VI)-пиридин (реактив Коллинза), дихромат (например, дихромат натрия, дихромат калия)-серную кислоту, хлорхромат пиридиния (РРС), диоксид марганца, диметилсульфоксид-электрофильно активированный реагент (дициклогексилкарбодиимид, уксусный ангидрид, (ди)фосфор пентаоксид, комплекс триоксид серы-пиридина, трифторуксусный ангидрид, оксалилхлорид, галоген), гипохлорит натрия, гирохлорит калия, бромит натрия, N-бромсукцинимид, N-хлорсукцинимид, N-бромацетамид, 2,3-дихлор-5,6-дициано-п-бензохинон, тетрахлор-п-бензохинон, тетрахлоробензохинон, азотную кислоту, тетраоксид диазота, безводную бензолселеновую кислоту, тетраоксидрутения, диоксид рутения-периодат натрия, бисхлорбис(трифенилфосфин)рутенийиодозилбензол или висмутат натрия.
Примеры растворителя, используемого в настоящей реакции, включают воду, уксусную кислоту, диэтиловый эфир, тетрагидрофуран, диоксан, ацетон, трет-бутиловый спирт, метиленхлорид, хлороформ, гексан, бензол, толуол или их смесь.
Температура настоящей реакции обычно составляет от 0 до 100oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Время настоящей реакции обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения реакции в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (I-а) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ В
Соединение (I), где R1, R2, R3 и R4 обозначают ацил, получено следующим способом. Конкретно, соединение (I-а) защищают, если требуется, и подвергают взаимодействию с ацилгалогенидом в присутствии основания с последующим удалением защитной(ых) группы(групп), если требуется, с получением производного, где соответствующая аминогруппа и/или гидроксильная группа ацилирована/ацилированы. По данному способу вместо соединение (I-а) соединение (II) подвергают взаимодействию и обрабатывают таким же образом с получением соединения (II), где аминогруппа и/или гидроксильная группа ацилированы/ацилирована. Соединение (I), где R1, R2, R3 и R4 обозначают ацил, обрабатывают кислотой или основанием с получением соединения (I-а).
Соединение А, которое используется как промежуточное соединение для синтеза соединения (I) по настоящему изобретению, может быть получено следующим способом.
Способ С
Соединение общей формулы (IV) [здесь и далее указано как соединение (IV)]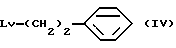
где Lv обозначает удаляемую группу, широко используемую в области синтетической органической химии, такую как галоген (фтор, хлор, бром, иод), метансульфонилокси, п-толуолсульфонилокси и трифторметансульфонилокси, и соединение общей формулы (V) [здесь и далее указано как Соединение (V)]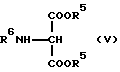
где R5 обозначает низший алкил, такой как метил, этил, пропил, изопропил, бутил и трет-бутил, или аралкил, такой как бензил, нитробензил, метоксибензил и метилбензил, R6 обозначает аминозащитную группу, широко используемую в области синтетической органической химии, такую как ацетил, бензоил, трет-бутоксикарбонил и бензилоксикарбонил, и два R5 в молекуле могут вместе образовывать кольцо, такое как диоксан, и R5 и R6 в молекуле могут вместе образовывать кольцо, такое как оксазолидин и оксазин, конденсируют в присутствии основания с получением соединения общей формулы (VI) [здесь и далее указано как соединение (VI)]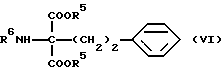
где R5 и R6 такие, как указано выше; сложноэфирные группы восстанавливают с подходящим восстановителем и вводят или удаляют защитную(ые) группу(группы), если требуется, с получением соединения общей формулы (VII) [здесь и далее указано как соединение (VII)]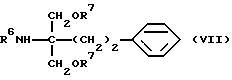
где R7 обозначает гидроксизащитную группу, широко используемую в области синтетической органической химии, такую как ацетил, бензоил, бензил, триметилсилил, трет-бутилдиметилсилил, метоксиметил, метоксиэтоксиметил и тетрагидропиранил, и R6 такой, как указано выше; полученное производное подвергают взаимодействию с дихлорметилметиловым эфиром в присутствии кислоты Льюиса, вводят или удаляют защитную(ые) группу(группы), если требуется, с получением соединения А или его N- и/или O-защищенных(ого) производных(ого).
Примеры основания, используемого при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллитий, гексаметилдисилазан лития, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен.
Примеры органического растворителя, используемого при конденсации, включают метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан и ацетонитрил.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Время реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (VI) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры восстановителя, используемого при восстановлении сложного эфира, включают, например, восстановитель, содержащий металл, такой как боргидрид натрия, боргидрид лития или литийалюминийгидрид, или диборан.
Примеры растворителя, используемого при восстановлении сложного эфира, включают, например, воду, метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, тетрагидрофуран, диоксан, диэтиловый эфир, диметиловый эфир этиленгликоля или их смесь.
Температура реакции восстановления сложного эфира обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Время реакции восстановления сложного эфира обычно составляет от 30 минут до 10 часов, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения восстановления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, целевое соединение может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры кислоты Льюиса, используемой в реакции с дихлорметилметиловым эфиром, включают хлорид алюминия, тетрахлорид титана, тетрахлорид олова, хлорид сурьмы (V), хлорид железа(III), трифторид бора, хлорид висмута (III), хлорид цинка и хлорид ртути (II).
Примеры органического растворителя, используемого в реакции с дихлорметилметиловым эфиром, включают тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, метиленхлорид, хлороформ, дихлорэтан, ацетонитрил, нитрометан и дисульфид углерода. Реакцию можно проводить без растворителя, когда необходимо.
Температура реакции с дихлорметилметиловый эфиром обычно составляет от -20 до 0oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Время реакции с дихлорметилметиловым эфиром обычно составляет от 30 минут до 24 часов, и может быть выбран более длительный или более короткий период проведения реакции, чем указанный период времени, если требуется.
После проведения взаимодействия с дихлорметилметиловым эфиром в вышеуказанных условиях или после удаления защитной группы, если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
В качестве других способов синтеза соединения А из соединения (VII) включены (1) способ, включающий реакцию Вильсмейера с использованием N,N-диметилформамида, N-метилформанилида, N-формилморфолина или N,N-диизопропилформамида, и галогенирующий агент, такой как фосфорилхлорид, фосген, оксалилхлорид, тионилхлорид, трифенилфосфинбромид или гексахлортрифосфаазатриет, и гидролиз, (2) способ, включающий взаимодействие с гексаметилентетрамином в присутствии кислотного катализатора (например, уксусная кислота, трифенилуксусная кислота) и гидролиз (способ Даффа), (3) способ, включающий реакцию сочетания моноксида углерода и хлористого водорода, или сочетания муравьиной кислоты и хлорсерной кислоты, тионилхлорида или оксихлорида фосфора в присутствии хлорида алюминия, используя хлорид меди (I) в качестве сокатализатора, когда необходимо (способ Гаттермана-Коха), (4) способ, включающий взаимодействие цианистого водорода и хлористоводородной кислоты (способ Гаттермана) и тому подобное.
Способ D
Используя в способе С соединение общей формулы (VIII) [здесь и далее указано как Соединение (VIII)]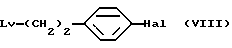
где Hal обозначает галоген, такой как хлор, бром или иод, Lv такая, как указано выше, вместо соединения (IV), получают соединение общей формулы (IX) [здесь и далее указано как соединение (IX)]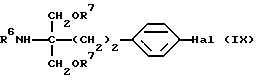
где R6, R7 и Hal такие, как указано выше; полученное соединение подвергают взаимодействию с формилирующим агентом в присутствии магния и подвергают гидролизу; и защитную(ые) группу(группы) удаляют, если необходимо, с получением соединения А или его N и/или O-защищенного производного.
Примеры формилирующего агента, используемого в настоящей реакции, включают формиат, такой как метилортоформиат, этилортоформиат, этилформиат или формиат лития, или формамид, такой как N-метилформанилид, N,N-диметилформамид, N-метил-н-(2-пиридил)формамид, 1-формилпиперидин, 4-формилморфолин или этоксиметиленанилин, полученный из этилортоформиата и анилина, фторформальдегид (FCHO), муравьиный ангидрид ((НСО)2О) и ангидрид уксусной и муравьиной кислот (НСООСОСН3).
Примеры органического растворителя, используемого в настоящей реакции, включают тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан и ацетонитрил.
Температура настоящей реакции обычно составляет от -100 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Время настоящей реакции обычно составляет от 30 минут до 2 дней, и может быть выбран более длительное или более короткий период проведения реакции, чем указанный период времени, если требуется.
После проведения реакции в вышеуказанных условиях или после удаления защитных(ой) группы(групп), если требуется, соединение А может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ Е
Соединение общей формулы (X) [здесь и далее указано как Соединение (X)]
где Y обозначает формильную группу или защищенный формильный эквивалент, такой как диметоксиметил, диэтоксиметил, этилендиоксиметил, пропилендиоксиметил, этилендитиометил или пропилендитиометил, Lv такая, как указано выше; подвергают конденсации в присутствии основания с соединением общей формулы (XI) [здесь и далее указано как соединение (XI)]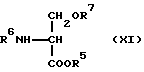
где R5, R6 и R7 такие, как указано выше; с получением соединения общей формулы (XII) [здесь и далее указано как соединение (XII)]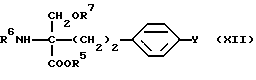
где R5, R6, R7 и Y такие, как указано выше; сложноэфирную группу подвергают восстановлению с подходящим восстановителем и вводят или удаляют защитную(ые) группу(группы), если необходимо, с получением соединения А или его N и/или O-защищенного производного.
Примеры основания, используемого при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллитий, гексаметилдисилазан лития, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен.
Примеры органического растворителя, используемого при конденсации, включают метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан и ацетонитрил.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XII) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры восстановителя, используемого при восстановлении сложного эфира, включают восстановитель на основе металла, такой как боргидрид натрия, боргидрид лития или литийалюминийгидрид, или диборан.
Примеры растворителя, используемого при восстановлении сложного эфира, включают воду, метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, тетрагидрофуран, диоксан, диэтиловый эфир, диметиловый эфир этиленгликоля или их смесь.
Температура реакции восстановления сложного эфира обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции восстановления сложного эфира обычно составляет от 30 минут до 10 часов, и может быть выбран более короткий или более длительный период реакции, если требуется.
После восстановления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ F
Соединение общей формулы (XIII) [здесь и далее указано как соединение (XIII)]
где R5 такой, как указано выше; подвергают конденсации в присутствии основания с соединением (X) с получением соединения общей формулы (XIV) [здесь и далее указано как Соединение (XIV)]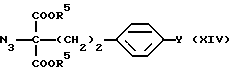
где R5 и Y такие, как указано выше; сложноэфирные группы и азидную группу подвергают восстановлению с подходящим восстановителем и вводят или удаляют защитную(ые) группу(группы), если необходимо, с получением соединения А или его N и/или O-защищенного производного.
Примеры основания, используемого при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллитий, гексаметилдисилазан лития, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло [5,4,0]ундец-7-ен.
Примеры органического растворителя, используемого при конденсации, включают метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан или ацетонитрил.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XIV) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры восстановителя, используемого при восстановлении сложного эфира, включают восстановитель на основе металла, такой как боргидрид натрия, боргидрид лития и литийалюминийгидрид или диборан.
Примеры растворителя, используемого при восстановлении сложного эфира, включают воду, метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, тетрагидрофуран, диоксан, диэтиловый эфир, диметиловый эфир этиленгликоля или их смесь.
Температура реакции восстановления сложного эфира обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный режим, если требуется.
Период реакции восстановления сложного эфира обычно составляет от 30 минут до 10 часов, и может быть выбран более короткий или более длительный период реакции, если требуется.
Примеры восстановителя, используемого при восстановлении азида, включают восстановитель на основе металла, такой как боргидрид натрия, боргидрид лития и литийалюминийгидрид и трифенилфосфин. Каталитическое восстановление с использованием переходного металла, такого как палладий-на-угле, оксид платины, никель Ренея, родий или рутений также эффективны.
Примеры растворителя, используемого при восстановлении азида, включают воду, метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диоксан, диметиловый эфир этиленгликоля, ацетон, этилацетат, уксусную кислоту, бензол, толуол, ксилол, диметилформамид, диметилсульфоксид или их смесь.
Температура реакции восстановления азида обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
После восстановления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ G
Соединение общей формулы (XV) [здесь и далее указано как Соединение (XV)]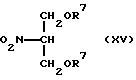
где R7 обозначает защитную группу для гидроксильной группы, широко используемую в области синтетической органической химии, такую как ацетил, бензоил, бензил, триметилсилил, трет-бутилдиметилсилил, метоксиметил, метоксиэтоксиметил или тетрагидропиранил, и два R7 могут вместе образовывать кольцо, такое как диоксан; подвергают конденсации в присутствии основания с соединением (X) с получением соединения общей формулы (XVI) [здесь и далее указано как соединение (XVI)]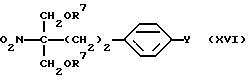
где R7 и Y такие, как указано выше; и нитрогруппу подвергают восстановлению с подходящим восстановителем и вводят или удаляют защитную(ые) группу(группы), если необходимо, с получением соединения А или его N и/или O-защищенное производное.
Примеры основания, используемого при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллитий, гексаметилдисилазан лития, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло [5,4,0]ундец-7-ен.
Примеры органического растворителя, используемого при конденсации, включают метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан или ацетонитрил.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XVI) может, быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры восстановителя, используемого при восстановлении нитро, включают восстановитель на основе металла, такой как боргидрид натрия, боргидрид лития или литийалюминийгидрид, переходной металл, такой как палладий-на-угле, оксид платины, никель Ренея, родий или рутений для каталитического восстановления, металл, такой как железо, цинк или олово.
Примеры растворителя, используемого при восстановлении нитрогруппы, включают воду, метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диоксан, ацетон, этилацетат, уксусную кислоту, бензол, толуол, ксилол, диметилформамид, диметилсульфоксид или их смесь.
Температура реакции восстановления нитрогруппы обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
После восстановления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ Н
Соединение общей формулы (XVTI) [здесь и далее указано как соединение (XVII)]
где М и Y такие, как указано выше; подвергают нуклеофильному присоединению соединения общей формулы (XVIII) [здесь и далее указано как соединение (XVIII)]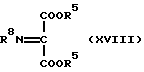
где R8 обозначает иминозащитную группу, широко используемую в области синтетической органической химии, такую как ацетил, бензоил или трет-бутоксикарбонил, бензилоксикарбонил, и R5 такое, как указано выше; с получением соединения общей формулы (VI-a) [здесь и далее указано как соединение (VI-a)]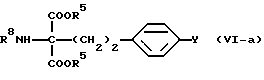
где R5, R8 и Y такие, как указано выше; сложноэфирные группы подвергают восстановлению с подходящим восстановителем и вводят или удаляют защитную(ые) группу(группы), если необходимо, с получением соединения А или его N и/или O-защищенного производного.
Примеры органического растворителя, используемого в присоединении, включают тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан или ацетонитрил.
Температура реакции прибавления обычно составляет от -100 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции прибавления обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения прибавления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (VI-a) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры восстановителя, используемого при восстановлении сложного эфира, включают восстановитель на основе металла, такой как боргидрид натрия, боргидрид лития или литийалюминийгидрид, или диборан.
Примеры растворителя, используемого при восстановлении сложного эфира, включают воду, метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, тетрагидрофуран, диоксан, диэтиловый эфир, диметиловый эфир этиленгликоля или их смесь.
Температура реакции восстановления сложного эфира обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции восстановления сложного эфира обычно составляет от 30 минут до 10 часов, и может быть выбран более короткий или более длительный период реакции, если требуется.
После восстановления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ I
Соединение (XVI) может быть также получено следующим способом.
Соединение (X) и соединение общей формулы (XIX) [здесь и далее указано как соединение (XIX)]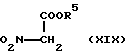
где R5 такое, как указано выше; подвергают конденсации в присутствии основания с получением соединения общей формулы (XX) [здесь и далее указано как соединение (XX)]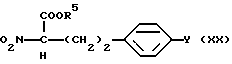
где R5 и Y такие, как указано выше; полученное производное подвергают конденсации в присутствии основания с формалином и защите гидроксильной группы, если необходимо, с получением соединения общей формулы (XXI) [здесь и далее указано как соединение (XXI)]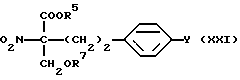
где R6, R7 и Y такие, как указано выше; сложноэфирную группу подвергают восстановлению с подходящим восстановителем и защите гидроксильной(ых) группы(групп), если необходимо, с получением соединения (XVI).
Примеры растворителя, используемого при конденсации, включают воду, метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан или ацетонитрил.
Примеры основания, используемого при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XX) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры растворителя, используемого при конденсации с формалином, включают воду, метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ или ацетонитрил.
Примеры основания, используемого при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XXI) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры восстановителя, используемого при восстановлении сложного эфира, включают восстановитель на основе металла, такой как боргидрид натрия, боргидрид лития или литийалюминийгидрид, или диборан.
Примеры растворителя, используемого при восстановлении сложного эфира, включают воду, метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, тетрагидрофуран, диоксан, диэтиловый эфир, диметиловый эфир этиленгликоля или их смесь.
Температура реакции восстановления сложного эфира обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции восстановления сложного эфира обычно составляет от 30 минут до 10 часов, и может быть выбран более короткий или более длительный период реакции, если требуется.
После восстановления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XVI) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ J
Производное (VI-a) может быть также получено следующим способом.
Соединение общей формулы (XXII) [здесь и далее указано как соединение (XXII)]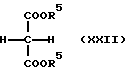
где R5 как указано выше; и соединение (X) подвергают конденсации в присутствии основания с получением соединения общей формулы (XXIII) [здесь и далее указано как соединение (XXIII)]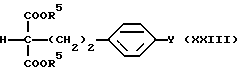
где R5 и Y такие, как указано выше; полученное производное подвергают взаимодействию в присутствии основания с аминирующим агентом общей формулы
H2N-Le (XXIV)
где Le обозначает удаляемую группу, такую как 2,4-динитрофенокси; и вводят или удаляют защитную(ые) группу(группы), если необходимо, с получением соединения (VI-а).
Примеры основания, используемого при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллитий, гексаметилдисилазан лития, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен.
Примеры растворителя, используемого при конденсации, включают воду, метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан или ацетонитрил.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XXIII) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры основания, используемые в реакции аминирования, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллитий, гексаметилдисилазан лития, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен.
Примеры растворителя, используемого в реакции аминирования, включают воду, метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан или ацетонитрил.
Температура реакции аминирования обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции аминирования обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После реакции аминирования в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (VI-а) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ К
В способах от способа Е до способа J, соединение (IV) или соединение (VIII) используют вместо соединения (X) с получением соединения (VII) или соединение (IX), соответственно.
Способ L
В способе С соединение (X) используют вместо соединения (IV) с получением соединения (VI-a).
Соединение (I-а) по настоящему изобретению может быть также получено следующим способом.
Способ М
Соединение общей формулы (XXV) [здесь и далее указано как соединение (XXV)]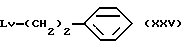
где Lv такое, как указано выше; подвергают взаимодействию с дихлорметилметиловым эфиром в присутствии кислоты Льюиса с получением соединения общей формулы (XXVI) [здесь и далее указано как соединение (XXVI)]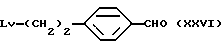
где Lv такое, как указано выше; полученное производное подвергают взаимодействию с соединением (III) с получением соединения общей формулы (XXVII) [здесь и далее указано как соединение (XXVII)]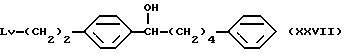
где Lv такое, как указано выше; полученное производное подвергают окислению с подходящим окислителем с получением соединения общей формулы (XXVIII) [здесь и далее указано как соединение (XXVIII)]
где Lv такое, как указано выше; полученное производное подвергают конденсации с соединением (V) в присутствии основания с получением соединения общей формулы (XXIX) [здесь и далее указано как соединение (XXIX)]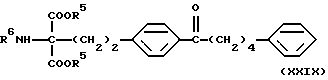
где R5 и R6 такие, как указано выше; карбонильную группу соединения (XXIX) подвергают защите и восстановлению восстановителем с получением соединения общей формулы (I-b) [здесь и далее указано как соединение (I-b)]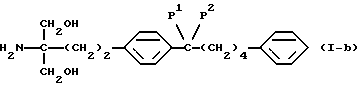
где Р1 и Р2 обозначают карбонилзащитную группу, широко используемую в области синтетической органической химии, такую как низший алкокси, такой как метокси, этокси, пропокси, изопропокси или бутокси, или Р1 и Р2 вместе образуют алкилендиокси, такой как этилендиокси, или его производное, где аминогруппа и/или гидроксильная группа защищены(на); и полученное производное подвергают удалению защиты с получением соединения (I-a).
Примеры кислоты Льюиса, используемой в реакции с дихлорметилметиловым эфиром, включают хлорид алюминия, тетрахлорид титана, тетрахлорид олова, хлорид сурьмы (V), хлорид железа (III), трифторид бора, хлорид висмута (III), хлорид цинка или хлорид ртути (II).
Примеры органического растворителя, используемого в реакции с дихлорметилметиловым эфиром, включают тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, метиленхлорид, хлороформ, дихлорэтан, ацетонитрил, нитрометан или дисульфид углерода. Реакцию можно проводить без растворителя, если требуется.
Температура реакции с дихлорметилметиловым эфиром обычно составляет от -20 до 0oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции с дихлорметилметиловым эфиром обычно составляет от 30 минут до 24 часов, и может быть выбран более короткий или более длительный период реакции, если требуется.
После реакции с дихлорметилметиловым эфиром в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры органического растворителя, используемого в реакции с соединением (III), включают тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метилен хлорид, хлороформ, дихлорэтан или ацетонитрил.
Температура настоящей реакции обычно составляет от -100 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период настоящей реакции обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения реакции в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XXVII) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры окислителя, используемого в окислении соединения (XXVII), включают хромовую кислоту серную кислоту, оксид хрома (VI)-серную кислоту-ацетон (реактив Джонса), комплекс оксид хрома (VI)-пиридин (реактив Коллинза), дихромат (например, дихромат натрия, дихромат калия)-серную кислоту, хлорхромат пиридиния (РРС), диоксид марганца, диметилсульфоксид - электрофильно активированный реагент (дициклогексилкарбодиимид, уксусный ангидрид, (ди)фосфор пентаоксид, комплекс триоксид серы-пиридина, трифторуксусный ангидрид, оксалилхлорид, галоген), гипохлорит натрия, гирохлорит калия, бромит натрия, N-бромсукцинимид, N-хлорсукцинимид, N-бромацетамид, 2,3-дихлор-5,6-дициано-п-бензохинон, тетрахлор-п-бензохинон, тетрахлор-о-бензохинон, азотную кислоту, тетраоксид диазота, безводную бензолселеновую кислоту, тетраоксид рутения, диоксид рутений-периодат натрия, бисхлорбис(трифенилфосфин)рутений-иодозилбензол или висмутат натрия.
Примеры растворителя, используемого в настоящей реакции, включают воду, уксусную кислоту, диэтиловый эфир, тетрагидрофуран, диоксан, ацетон, трет-бутиловый спирт, метиленхлорид, хлороформ, гексан, бензол, толуол или их смесь.
Температура настоящей реакции обычно составляет от 0 до 100oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Время настоящей реакции обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения реакции в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XXVIII) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры основания, используемые при конденсации, включают гидроксид натрия, метоксид натрия, этоксид натрия, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллитий, лития гексаметилдисилазан, триэтиламин, диизопропилэтиламин и 1,8-диазабицикло[5,4,0]ундец-7-ен.
Примеры органического растворителя, используемого при конденсации, включают метанол, этанол, трет-бутиловый спирт, тетрагидрофуран, диэтиловый эфир, диметиловый эфир этиленгликоля, диметилформамид, диметилсульфоксид, бензол, толуол, ксилол, диоксан, метиленхлорид, хлороформ, дихлорэтан или ацетонитрил.
Температура реакции конденсации обычно составляет от -20 до 150oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции конденсации обычно составляет от 30 минут до 2 дней, и может быть выбран более короткий или более длительный период реакции, если требуется.
После проведения конденсации в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, соединение (XXIX) может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Соединение (XXVIII), где Lv обозначает галоген, в частности, хлор или бром, также подвергают иодированию, используя иодид натрия, с последующим взаимодействием с соединением (V).
Защита карбонильной группы соединения (XXIX) может быть осуществлена методом, известным в области синтетической органической химии. Например, соединение (XXIX) обрабатывают этиленгликолем в присутствии кислотного катализатора, такого как паратолуолсульфоновая кислота, или низшим спиртом в присутствии кислоты, такой как хлористоводородная кислота или серная кислота, с получением соответствующего карбонилзащищенного производного.
Примеры восстановителя, используемого при восстановлении, включают восстановитель на основе металла, такой как боргидрид натрия, боргидрид лития или литийалюминийгидрид, или диборан.
Примеры растворителя, используемого при восстановлении, включают воду, метанол, этанол, 1-пропанол, 2-пропанол, трет-бутиловый спирт, тетрагидрофуран, диоксан, диэтиловый эфир, диметиловый эфир этиленгликоля или их смесь.
Температура реакции восстановления обычно составляет от -20 до 80oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции восстановления обычно составляет от 30 минут до 10 часов, и может быть выбран более длительный или более короткий период реакции, чем указанный период, если требуется.
После восстановления в вышеуказанных условиях или после удаления защитной(ых) группы(групп), если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Примеры реагента, используемого при удалении защиты, включают кислоту, такую как хлористоводородную кислоту, серную кислоту, уксусную кислоту или трифторуксусную кислоту, основание, такое как гидроксид натрия, гидроксид калия или гидроксид лития.
Примеры растворителя, используемого при удалении защиты, включают воду, метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, ацетон, тетрагидрофуран, диметиловый эфир этиленгликоля, диметилформамид или диметилсульфоксид.
Температура реакции удаления защиты обычно составляет от -20 до 100oС, и может быть выбрана более низкая или более высокая температура, чем указанный температурный интервал, если требуется.
Период реакции удаления защиты обычно составляет от 30 минут до 5 часов, и может быть выбран более короткий или более длительный период реакции, если требуется.
После удаления защиты в вышеуказанных условиях или после удаления защитной группы, если требуется, целевое производное может быть очищено методом, известным в области синтетической органической химии, таким как экстракция растворителем, перекристаллизация, хроматография или метод, использующий ионобменную смолу.
Способ N
Соединение (XXVI) может быть также получено взаимодействием соединения (VIII) с формилирующим агентом в присутствии магния с последующим гидролизом.
Способ О
Соединение (I-а) по настоящему изобретению может быть также получено взаимодействием и обработкой таким же образом, что и по способу Е, после конденсации соединения (XXVIII) с соединением (XI), тем же способом, что и по способу F после конденсации соединения (XXVIII) с соединением (XIII), тем же способом, что и по способу G после конденсации соединения (XXVIII) с соединением (XV), тем же способом, что и по способу I после конденсации соединения (XXVIII) с соединением (XIX), тем же способом, что и по способу J, после конденсации соединения (XXVIII) с соединением (XXII), соответственно.
Соединение (I) по настоящему изобретению обрабатывают в подходящем растворителе, таком как вода, метанол, этанол, диэтиловый эфир, тетрагидрофуран или диоксан, если необходимо, кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, уксусная кислота, малеиновая кислота, фумаровая кислота, бензойная кислота, лимонная кислота, щавелевая кислота, янтарная кислота, винная кислота, яблочная кислота, миндальная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота или 10-камфорсульфоновая кислота, с получением его соли добавления кислот. Когда полученными кристаллами соединения по настоящему изобретению являются ангидриды, кристаллы обрабатывают водой, водным растворителем или иным растворителем с получением гидратов, таких как моногидрат, 1/2 гидрат, 1/5 гидрат, дигидрат или 3/2 гидрат, или сольваты.
Соединение (I) по настоящему изобретению, его фармацевтически приемлемая соль добавления кислоты или гидрат могут быть использованы для профилактики и подавления отторжения, вызванного трансплантацией органа (печень, сердце, почки и т.д.) или костного мозга у животных одного вида или различных видов млекопитающих, включая человека, собаку, кошку, крупный рогатый скот, лошадь, свинью, обезьяну, крысу и т.д., и для профилактики и лечения различных аутоиммунных заболеваний или различных аллергических заболеваний. Конкретно, соединения по настоящему изобретению обладают фармацевтической активностью, такой как иммуносупрессивная активность или противомикробная активность, и поэтому могут использоваться для профилактики или лечения сопротивляемости к трансплантации или отторжения трансплантанта органов или тканей (таких как сердце, почки, печень, легкие, костный мозг, роговица, поджелудочная железа, intestinum tenue, конечность, мышца, нерв, жировая ткань, двенадцатиперстная кишка, кожа или клетки островка поджелудочной железы и т.д., включая ксено-трансплантацию, реакции "трансплантат против хозяина" при трансплантации костного мозга, аутоиммунных заболеваний, таких как ревматоидный артрит, системная красная волчанка, нефротоксическая синдромная волчанка, тиреоидит Хашимото, рассеянный склероз, миастения гравис, сахарный диабет I типа, острый приступ сахарного диабета II типа, нефротический синдром, стероид-зависимый и устойчивый к стероидам нефроз, ладонноподошвенное пустулезное высыпание, аллергический энцефаломиелит, глорумелонефрит и т.д., и инфекционных заболеваний, вызванных патогенными микроорганизмами.
Соединения по настоящему изобретению могут использоваться для лечения воспалительных, пролиферативных и гиперпролиферативных заболеваний кожи и кожных проявлений иммунологически-опосредованных заболеваний, таких как псориаз, псориазный артрит, атопическая экзема (атопический дерматит), контактный дерматит и другие экзематозные дерматиты, себоррейный дерматит, красный плоский лишай, пузырчатка, пузырчатый пемфигоид, врожденный буллезный эпидермолиз, крапивница, ангионевротический отек, васкулит, эритема, кожный эозинофильный лейкоцитоз, угревая сыпь, гнездная алопеция, эозинофильный фасцит и атеросклероз.
Более конкретно, соединения по настоящему изобретению могут использоваться при регенерации волос, таком как лечение женской или мужской структурной алопеции или старческой алопеции путем защиты от выпадения, генерации волос и/или стимуляции генерации роста волос.
Соединения по настоящему изобретению, кроме того, могут использоваться для лечения респираторных заболеваний, например, саркоидоза, пневмосклероза, идиопатической интерстиальной пневмонии и обратимой обструкции дыхательных путей, включая состояния, такие как астма, включая бронхиальную астму, младенческое удушье, аллергическую астму, наследственную астму, приобретенную астму и пылевую астму, в частности, хроническую или застарелую астму (например, поздняя астма и гиперчувствительность дыхательных путей), бронхит и тому подобное.
Соединения по настоящему изобретению могут также использоваться для лечения гепатопатии, связанной с ишемией.
Соединения по настоящему изобретению также показаны при некоторых заболеваниях глаз, таких как конъюктивит, кератоконъюктивит, кератит, весенний конъюктивит, увеит, связанный с болезнью Бехчета, герпетический кератит, коникальная роговица, дистрофия эпителиальной роговицы, кератолейкома, пузырчатка глаза, разъедающая язва роговицы (Морена), склерит, офтальмопатия Граве, тяжелое внутриглазное воспаление и тому подобное.
Соединения по настоящему изобретению также используются для профилактики или лечения воспаления слизистой или кровеносных сосудов (таких как лейкотриен В4-опосредованные заболевания, язва желудка, поражение сосудов, вызванное ишемическим заболеванием и тромбозом, ишемическое заболевание кишечника, воспалительное заболевание кишечника (например, болезнь Крона и язвенный колит, некротический энтероколит), или поражение кишечника, связанное с термическими ожогами.
Кроме того, соединения по настоящему изобретению, которые могут использоваться для лечения или профилактики почечных заболеваний, включая интерстинальный нефрит, синдром Goodpasture, гемолитический уремический синдром и диабетическая нефропатия; нервных заболеваний, выбранные из дерматомиозита, синдрома Гийена-Барре, болезни Меньера и радикулопатии; эндокринных заболеваний, включая гипертиреодизм и базедову болезнь; заболеваний крови, включая истинную эритроцитарную аплазию, апластическую анемию, гипопластическую анемию, идиопатическую тромбоцитопеническую пурпуру, аутоиммунную гемолитическую анемию, агрануломатоз и анеритоплазию; костных заболеваний, включая остеопороз; респираторных заболеваний, включая саркоидоз, фиброму легкого и идиопатическую интерстинальную пневмонию; кожных заболеваний, включая дерматоз, обычный витилиго, обычный ихтиоз, фотоаллергическая чувствительность и кожная Т клеточная лимфома; заболеваний кровеносной системы, включая атеросклероз, аотрит, полиартериит нодоза и миокардоз; коллагенового заболевания, включая склеродермию, гранулему Wegener и синдром Sjogren; ожирение; эозинофильного фасцита; периодонтального заболевания; нефторического синдрома; гемолитического уремического синдрома; и мышечной дистрофии.
Далее, соединения по настоящему изобретению показаны при лечении заболеваний, включая кишечные воспаления или аллергии, такие как болезнь Coeliac, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона или ульцерогенный колит; и пищевых аллергических заболеваний, симптоматические проявления которых отдалены от желудочно-кишечного тракта, например мигрень, ринит и экзема.
Соединения по настоящему изобретению также обладают регенерирующей печень активностью и/или активностью в усилении гипертрофии и гиперплазии гепатоцитов. Следовательно, они могут использоваться для лечения и профилактики гепатических заболеваний, таких как иммуногенные заболевания (например, хронические аутоиммунные заболевания печени, включая аутоиммунный гепатит, первичный билиарный цирроз печени и склеррозирующий холангит), частичная резекция печени, острый некроз печени (например некроз, вызванный токсинами, вирусный гепатит, шок или аноксия), вирусный гепатит типа В, не-А/не-В гепатит и цирроз.
Соединения по настоящему изобретению также показаны для применения в качестве антимикробных средств, и, таким образом, могут быть использованы при лечении заболеваний, вызванных патогенными микроорганизмами и тому подобное.
Далее, соединения по настоящему изобретению могут быть использованы при профилактике или лечении злокачественного ревматоидного артрита, амилоидоза, внезапного гепатита, синдрома Shy-Drager, пустулезного псориаза, болезни Бехчета, системной красной волчанки, эндокринной офтальмопатии, прогрессивного системного склероза, смешанного коллагеноза, синдрома дуги аорты, гранулематоза Вегенера, активного хронического гепатита, синдрома Эванса, сенной лихорадки, идиопатического гипопаратироидизма, аддисоновой болезни (аутоиммунное воспаление надпочечников), аутоиммунного орхита, аутоиммунного оофорита, холодового гемагглютинина, пароксимальной холодовой гемоглобинурии, пернициозной анемии, острой Т клеточной лейкемии, аутоиммунного атрофического гастрита, люпозного гепатита, тубулоинтестинального нефрита, мембранного нефрита, бокового амиотрофического склероза, ревматического жара, синдрома после инфаркта миокарда и симпатической офтальмии.
Соединения по настоящему изобретению обладают противогрибковой активностью и могут использоваться в качестве противогрибкового средства.
Более того, соединения по настоящему изобретению, их фармацевтически приемлемые соли добавления кислот или гидраты могут использоваться в сочетании с другим(и) иммуносупрессантом(ами), стероидом(ами) (преднизолон, метилпреднизолон, дексаметазон, гидрокортизон и тому подобное) или нестероидным кислотным противовоспалительным средством. В качестве другого иммуносупрессанта предпочтительными являются, в частности, выбранные из азатиоморфина, брехинара натрия, деоксиспергуалина, мизорибина, 2-морфолиноэтила микофенолята, циклоспорина, рапамицина, тарколимус моногидрата, лефлуномида и ОКТ-3.
Когда соединение (I) по настоящему изобретению, полученное таким образом, его фармацевтически приемлемая соль добавления кислоты или гидрат используются в качестве лечебного средства, соединение (I) смешивают с фармацевтически приемлемая носителем (например, эксципиентом, связующим, разрыхлителем, корригирующим средством, корригентами, эмульгаторами, разбавителями, солюбилизаторами и тому подобное) с получением фармацевтической композиции или фармацевтического препарата (таблетки, пилюли, капсулы, гранулы, порошки, сиропы, эмульсии, эликсиры, суспензии, растворы для инъекции, переливания или препараты для наружного применения), которые могут быть введены перорально или парентерально. Фармацевтическая композиция может быть получена в виде фармацевтического препарата обычным способом. В настоящем описании "парентерально" включают подкожную инъекцию, внутримышечную инъекцию, внутривенную инъекцию, внутрибрюшинную инъекцию, вливание и наружное введение (введение через кожу, в глаза, легкие, бронхи, нос, толстую кишку). Препарат для инъекции, такой как стерильная водная или масляная суспензия для инъекции, может быть получен, используя подходящее диспергирующее средство или увлажняющее средство и суспендирующее средство, в соответствии со способом, известным в данной области. Стерильным препаратом для инъекции может быть стерильный инъецируемый раствор или суспензия в не-токсичном разбавителе или растворителе для парентерального введения, такой как водный раствор. Примеры наполнителя и растворителя, которые могут быть использованы, включают воду, раствор Рингера, изотонический солевой раствор и тому подобное. При добавлении может быть обычно использовано стерильное нелетучее масло в качестве растворителя или растворителя для суспензии. С другой стороны, использовано любое нелетучее масло или жирная кислота, включая природное, синтетическое или полусинтетическое жирное масло или жирную кислоту, и природные, синтетические или полусинтетические моно-, ди- или триглицериды. Твердые дозированные формы для перорального введения включают вышеуказанные, такие как порошки, гранулы, таблетки, пилюли, капсулы и тому подобное. В этих дозированных формах активный ингредиент смешан по меньшей мере с одной добавкой, такой как сахароза, лактоза, целлюлозный сахар, маннит, мальтит, декстран, крахмалы, агар, аргинаты, кихинины, хитозан, пектины, смолу трагаканта, гуммиарабик, желатин, коллагены, казеин, альбумин, синтетические или полу-синтетические полимеры и глицериды. В эти дозированные формы могут быть добавлены обычные добавки, которыми могут быть инертные разбавители, смазывающие агенты, такие как стеарат магния, консерванты, такие как парабены и сорбиновая кислота, антиоксиданты, такие как аскорбиновая кислота, α-токоферол и цистеин, разрыхлители, связующие, вещества для повышения клейкости, буферы, подсластители, ароматизаторы, отдушки и тому подобное. На таблетки и пилюли может быть нанесено наружное покрытие. Жидкими средствами для перорального введения могут быть фармацевтически приемлемые эмульсии, сиропы, эликсиры, суспензии, растворы и тому подобное, которые могут содержать инертные разбавители (например, воду), которые обычно используются в данной области.
Наружное средство, приемлемое для соединения (I) по настоящему изобретению, его фармацевтически приемлемой соли добавления кислоты или гидрата, включает мазь, пасту, линимент, лосьон, пластырь, припарку, глазные капли, глазную мазь, суппозиторий, вещество для компресса, ингалянт, спрей, аэрозоль, лекарственное вещество в вязком носителе, наносимое кисточкой в горло, на кожу и т.п., капли для носа, крем, лейкопластырь, бляшку и тому подобное.
Наружное средство по настоящему изобретению содержит соединение по настоящему изобретению в виде смеси с органическим или неорганическим носителем или эксципиентам, и, например, может быть использовано в виде твердого, полутвердого или жидкого фармацевтического препарата.
Соединение по настоящему изобретению может быть смешано, например, с нетоксичным и фармацевтически приемлемым носителем, который представлет собой обычно используемое для получения наружного препарата для местного введения. Носитель, который может быть использован, включает воду, глюкозу, лактозу, гуммиарабик, желатин, маннит, пасту крахмала, магния трисиликат, тальк, кукурузный крахмал, кератин, коллоидный силикагель, картофельный крахмал, мочевину и другие носители, которые приемлемы для получения твердой, полу-твердой или растворенной композиции. Кроме того, могут быть добавлены адъювант, стабилизатор, загуститель, подкрашивающее вещество или ароматизирующее средство.
Соединение по настоящему изобретению в качестве активного ингредиента фармацевтической композиции может содержаться в количестве, достаточном для проявления желаемой активности, в зависимости от симптома или серьезности заболеваний. В случае лечения симптома и заболеваний, вызванных иммунным заболеванием, соединение по настоящему изобретению может быть введено путем наружного введения, аэрозольного или ректального введения в виде стандартной лекарственной композиции, которая содержат фармацевтически приемлемый и нетоксичный носитель, адъювант и эксципиент. При лечении обратимого обструктивного заболевания дыхательных путей соединение по настоящему изобретению предпочтительно вводят в легкие с помощью аэрозоля в виде, например, порошка или раствора.
Количество соединения по настоящему изобретению, которое может быть смешано с носителем, может меняться в зависимости от хозяина, подвергаемого обработке, и конкретной дозированной формы. Конкретная доза для конкретного пациента должна определяться в зависимости от различных факторов, таких как возраст, масса тела, полное состояние здоровья, пола, питания, время введения, пути введения, скорость экскреции, сочетание лекарственного препарата и серьезности конкретного заболевания, подвергаемого лечению.
Когда соединение по настоящему изобретению используют в виде мази, его содержание в мази составляет от 0,01 до 10 мас./мас.%. Мазевая основа, которая может быть использована, включает мяслянистую основу (природный воск, такой как белый пчелиный воск или карнаубский воск, нефтяной воск, такой как твердый парафин или микрокристаллический воск, углеводородный воск, такой как жидкий парафин, белый петролатум или желтый воск, plastibase, zeien 50 W, силикон, растительное масло, лард, говяжий жир, простая мазь или пластырь с олеатом свинца), мазевую основу эмульсионного типа (типа масло-в-воде (тип М/В), основу, такую как гидрофильная мазь или быстро впитывающийся крем, или типа вода-в-масле (тип В/М), основание, такое как гидрофильный вазелин, очищенный ланолин, аквахол, эуцелин, неозелин, абсорбтивную мазь, ланолин, холодный крем, гидрофильное plastibase (полимерная основа), вода - растворимое основание (мазь макрогол или solobase (масляная основа)) или мазевую основу суспензионного типа (лиогелевое основание, например, гидрогелевую основу, такую как не-жировая мазь, гельоснование или лосьон; или FAPG основание (суспензия микрочастиц алифатического спирта, такого как стеариловый спирт или цетиловый спирт в пропиленгликоле), и эти мазевые основы могут быть использованы сами по себе или в сочетании с не менее, чем с двумя основаниями.
Кроме того, когда соединение по настоящему изобретению используют в виде мази, его растворяют в солюбилизирующем и усиливающем абсорбцию средстве и прибавляют к вышеуказанной мазевой основе. Солюбилизирующее и усиливающее абсорбцию средство, которое используют, означает средство, в котором соединение по настоящему изобретению растворено в концентрации по меньшей мере не менее, чем 0,01 мас./мас.%, и которое может усиливать абсорбцию соединения по настоящему изобретению на коже, когда приготовлено в виде мази, и включает низший алкандиол (например, этиленгликоль, пропиленгликоль или бутиленгликоль), алкиленкарбонат (например, пропиленкарбонат или этиленкарбонат), эфир алкандикарбоновой кислоты (например, диметиладипат, диэтиладипат, диизопропиладипат, диэтилпимелат, диэтилсебацинатсебацат или дипропилсебацат), глицериновые эфиры высших алкановых кислот (например, монолаурат, дилаурат или трилаурат), глицериновые эфиры высших алкеновых кислот (например, моноолеат, диолеат или триолеат), алкиловые эфиры высших алкановых кислот (например, изопропилмиристат или этилмиристат), высший ненасыщенный спирт (например, гераниол или олеиловый спирт) или азациклоалкан (например, 1-додецилазациклогептан-2-он). Это солюбилизирущее и усиливающее абсорбцию средство может быть использовано само по себе или в смеси с не менее, чем с двумя средствами, и может быть добавлено в достаточном количестве для растворения соединения по настоящему изобретению. Количество обычно находится в интервале от 2 частей по массе до 200 частей по массе на одну часть по массе соединения по настоящему изобретению. Верхнее количество ограничивается только сохранением физико-химических свойств мази.
Мазь, которая содержит соединение по настоящему изобретению, может содержать, в дополнение к вышеуказанной мазевой основе, другие добавки, такие как эмульгатор (например, полиоксиэтиленовое гидрированное касторовое масло, моностеарат глицерина, сескволеат или лауромаркогол сорбитана); суспендирующее средство (например, полиэтиленгликоль, поливинилпирролидон или натрия карбоксиметилцеллюлоза); антиоксидант (например, фенол или
хинон); консерватор (например, эфир параоксибензойной кислоты); увлажнитель (например, глицерин, D-сорбит или пропиленгликоль); ароматизатор, окрашивающее вещество; антисептик; высшую алкеновую кислоту (например, олеиновую кислоту), и дополнительно другие лекарственные средства, которые могут использоваться для лечения кожных заболеваний. Когда соединение по настоящему изобретению используют в виде мази, мазь может быть получена смешиванием раствора, содержащего соединение по настоящему изобретению, с мазевой основой в соответствии с обычным методом. В способе получения препарата, к мазевой основе может быть одновременно добавлен не менее, чем один адъювант или вышеуказанная добавка. Таким образом, мазь может быть приготовлена растворением соединения по настоящему изобретению в солюбилизирующем и усиливающим абсорбцию средстве, смешиванием полученного раствора с мазевой основой, перемешиванием полученной смеси при нагревании и затем охлаждением полученной смеси.
Мазь, содержащая соединение по настоящему изобретению, может использоваться нанесением на обрабатываемую часть кожи от одного до нескольких раз (например, от одного до четырех раз) в день.
Паста или линимент, содержащий соединение по настоящему изобретению, могут быть получены, используя ту же основу и в соответствии с тем же способом, как указаны для вышеуказанной мази.
Лосьон, содержащий соединение по настоящему изобретению, подразумевает препарат, где активный ингредиент гомогенно диспергирован или, в некоторых случаях, частично растворен в жидкой среде, и может быть добавлен эмульгатор, если необходимо. В случае, когда соединение по настоящему изобретению используют в качестве лосьона, содержание может быть установлено от 0,01 до 10 мас./мас.% лосьона.
Жидкая среда, используемая в лосьоне, содержащем соединение по настоящему изобретению, включает воду, низший спирт, гликоль, глицерин или их смесь. Из них могут быть использованы все низшие спирты, которые не разлагают активный ингредиент и не раздражают кожу, и включают метанол, этанол, изопропиловый спирт, пропанол или бутанол. Гликоль включает этиленгликоль, пропиленгликоль, бутиленгликоль или их мононизшие эфиры. Из этих жидких сред наиболее предпочтительными являются вода, низший спирт или их смесь, поскольку эта среда улучшает абсорбцию активного ингредиента на коже. Количество этой жидкой среды предпочтительно составляет от 5 частей по массе до 1000 частей по массе на одну часть по массе соединения по настоящему изобретению.
К лосьону, содержащему соединение по настоящему изобретению, может быть добавлен солюбилизирующее и усиливающее абсорбцию средство, в котором растворен активный ингредиент в концентрации по меньшей мере не менее чем 0,01 мас. /мас. %, и которое может усиливать абсорбцию активного ингредиента на коже, когда оно входит в состав лосьона, и включает эфир алкандикарбоновой кислоты (например, диметиладипат, диэтиладипат, диизопропиладипат, диэтилпимелат, диэтилсебацат или дипропилсебацат) или алкиловый эфир высшей алкановой кислоты, например, изопропилмиристат или этилмиристат). Эти солюбилизирующие и усиливающие абсорбцию средства могут быть использованы сами по себе или в смеси с не менее, чем с двумя средствами, и количество обычно составляет от 5 частей по массе до 5000 частей по массе на одну часть по массе соединения по настоящему изобретению. Содержание солюбилизирующего и усиливающего абсорбцию средства желательно составляет от 1 до 30 мас./мас.%.
Эмульгатор для лосьона, содержащего соединение по настоящему изобретению, используют с целью диспергирования нерастворимого лекарственного препарата быстро и гомогенно в водном растворе, и он должен быть нетоксичным для человека, и включает фармацевтически приемлемые природные эмульгаторы и синтетические эмульгаторы. В качестве природного эмульгатора могут быть использованы различные эмульгаторы, производные из животных и растительных источников, и включают лецитин яичного желтка, лецитин сои или их гидрированные производные, фосфатидилхолин, сфингомиелин, гуммиарабик или желатин.
В качестве синтетическго эмульгатора могут быть использованы катионные, анионные или неионные поверхностно-активные вещества, и предпочтительно включают поверхностно-активное вещество на основе касторового масла, особенно НСО (полиоксиэтиленовое гидрированное касторовое масло), такое как НСО-60, НСО-50, НСО-40, далее, эфир полиоксиэтиленсорбита и алифатической кислоты, такой как полисорбат 80, эфир глицерина и алифатической кислоты, такой как глицерин монокаприлат, эфир полиэтилена и алифатической кислоты, такой как полиоксиэтилен 40 моностеарат, моно (или ди)глицерид алифатической кислоты со средней длиной цепи (например, моно (или ди)глицериды С6-С12 алифатической кислоты, такой как диглицерид каприловой кислоты, моноглицерид каприловой кислоты или диглицерид капроновой кислоты) или полиоксиэтилированный глицерид, такой как глицерид полиоксиэтилированной олеиновой кислоты.
Вышеуказанные эмульгаторы могут быть использованы как основной эмульгатор, и, если необходимо, в сочетании со вспомогательным эмульгатором. Вспомогательный эмульгатор представляет собой обычный и нетоскичный для человека, и включает холестерин, агар, гидроксид магния, метилцеллюлозу или пектин. Эти основной эмульгатор и вспомогательный эмульгатор могут быть, соответственно, использованы сами по себе или в сочетании с двумя или несколькими из них.
Эмульгатор входит в состав лосьона, содержащего соединение по настоящему изобретению, в количестве, достаточном для эмульгирования соединения по настоящему изобретению и других добавок, которые должны присутствовать, и предпочтительно составляет от 0,1 части по массе до 10 частей по массе на одну часть по массе соединения по настоящему изобретению.
С целью повышения вязкости, к лосьону, который содержит соединение по настоящему изобретению, может быть добавлен повышающий вязкость агент. Повышающий вязкость агент является обычным средством, которое представляет собой обычно добавляемое к жидкости для придания ей вязкости и является нетоксичным для человека, и включает карбоксиполиметилен. Повышающий вязкость агент используют, когда желателен лосьон с высокой вязкостью. Когда используют повышающий вязкость агент, содержание повышающего вязкость агента средство может меняться в зависимости от желаемой вязкости используемого лосьона и предпочтительно составляет от 0,01 до 5 мас./мас.%.
Лосьон, который содержит соединение по настоящему изобретению, может, кроме того, содержать солюбилизатор, который представляет собой соединение, используемое для солюбилизации активного ингредиента в водном растворе. Если необходимо, оно может дополнительно содержать другие добавки, которые используются для лосьона, такие как ароматизирующее средство, окрашивающее вещество, антисептик или высшую алкеновую кислоту, такую как олеиновая кислота, или другие лекарственные препараты, которые могут использоваться для лечения кожных заболеваний.
Лосьон, который содержит соединение по настоящему изобретению, может быть получен обычным методом, известным в данной области. Лосьон, который содержит соединение по настоящему изобретению, может быть использован путем нанесения на обрабатываемую часть кожи однократно или несколько раз (например, от одного до четырех раз) в день. Когда лосьон имеет низкую вязкость, он может быть нанесен путем наполнения сосуда для спрея композицией лосьона и распылением лосьона прямо на кожу.
В случае, когда соединение по настоящему изобретению используют в виде глазных капель или капель для носа, растворитель, который может быть использован, включает стерильную дистиллированную воду или, в частности, дистиллированную воду для инъекции. Концентрация активного производного обычно составляет от 0,01 до 2,0 мас./объем.%, и может быть повышена или понижена в зависимости от цели применения.
Глазные капли или капли для носа, которые содержат соединение по настоящему изобретению, могут, кроме того, содержат различные добавки, такие как буфер, изотонический агент, солюбилизирующее средство, консерватор, повышающий вязкость агент, хелатирующий агент, регулирующий рН агент или ароматизирующее средство.
Буфер включает, например, фосфатный буфер (например, дигидрофосфат натрия-гидрофосфат динатрия или дигидрофосфат калия-гидроксид калия), боратный буфер (например, борная кислота-боракс), цитратный буфер (например, цитрат натрия-гидроксид натрия), тартратный буфер (например, винная кислота-тартрат натрия), ацетатный буфер (например, уксусная кислота-ацетат натрия), карбонатный буфер (например, карбонат-цитрат натрия или натрия карбонат-борная кислота) или аминокислота (например, глутамат натрия или ε-аминокапроновая кислота).
Изотонический агент включает сахарид, таких как сорбит, глюкоза или маннит, полиоловый спирт, такой как глицерин или пропиленгликоль, соль, такая как хлорид или боракс натрия, или борная кислота и тому подобное.
Солюбилизирующий агент включает неионное поверхностно активное вещество, такое как моноолеат полиоксиэтиленсорбита (полисорбат 80), полиоксиэтиленмоностеарат, полиэтиленгликоль или полиоксиэтиленгидрированное касторовое масло и тому подобное. Консерватор включает, например, четвертичную аммониевую соль, такую как бензалконий хлорид, бензэтоний хлорид или цетилпиридиний хлорид, эфир парагидроксибензойной кислоты, такой как метил парагидроксибензоат, этил парагидроксибензоат, пропил парагидроксибензоат или бутил парагидроксибензоат, бензиловый спирт, фенетиловый спирт, сорбиновая кислота или их соль, тимерозал, хлорбутанол или дигидроацетат натрия.
Повышающий вязкость агент включает, например, поливинилпирролидон, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу или карбоксиметилцеллюлозу или их соль. Хелатирующее средство включает эдетат натрия или лимонную кислоту и тому подобное. Регулирующий рН агент включает хлористоводородную кислоту, лимонную кислоту, фосфорную кислоту, уксусную кислоту, винную кислоту, гидроксид натрия, гидроксид калия, карбонат натрия или бикарбонат натрия и тому подобное. Ароматизатор включает 1-ментол, борнеол, камфору (например, dl-камфора) или эвкалиптовое масло и тому подобное.
Когда соединение по настоящему изобретению используют в виде глазных капель, рН его может быть обычно установлен от около 4,0 до около 8,5, и когда используют в качестве капель для носа, рН может быть обычно установлен от около 4,0 до около 8,5.
При получении глазных капель и капель для носа, которые содержат соединение по настоящему изобретению, может использоваться метод, известный для каждого препарата, в зависимости от вида каждого препарата.
Когда соединение по настоящему изобретению используют в виде глазных капель, они могут содержать активный ингредиент в достаточном количестве, которое способно эффективно предохранять от воспаления глаз, и которое может меняться в зависимости от симптома или вида воспаления, и обычно составляет от около 5,0 до около 1000 мг на одно введение. Они могут быть введены один или несколько раз (например, от одного до четырех раз) в день.
Аэрозоль, содержащий соединение по настоящему изобретению, подразумевает фармацевтический препарат, который может быть нанесен в процессе лечения с помощью распыления раствора или суспензии активного ингредиента, используя давление сжиженного газа или газа под давлением, помещенного в тот же самый или в иной сосуд. Аэрозоль может быть получен растворением соединения по настоящему изобретению в очищенной воде, и, если необходимо, растворением или суспендированием тех же солюбилизирующих и усиливающим абсорбцию средств, как указано выше, в растворе, и, если необходимо, прибавлением добавок, таких как регулятор рН или антисептик, как указано выше, и затем герметическим закрыванием в сосуде с вентилем и пропеллентом под давлением.
Используемый пропеллент включает диметиловый эфир, сжиженный природный газ, диоксид углерода, газообразный азот, замещенный флон газ и другие обычные пропелленты.
Аэрозоль, который содержит соединение по настоящему изобретению, может, кроме того, содержать холодящие агенты, такие как 1-ментол, камфору, метилсалицилат и тому подобное.
Ингалянт или спрей, которые содержат соединение по настоящему изобретению, могут быть получены в соответствии с теми же способами, которые известны для аэрозоля, распылитель или ингалятор могут быть использованы для ингаляции или емкость для спрея может быть использована для распыления.
Когда соединение по настоящему изобретению используют в качестве суппозитория, суппозиторий может быть получен обычным методом, используя обычную основу для суппозитория, и активный ингредиент содержится в суппозитории в количестве, достаточном для проявления фармацевтического действия, которое может меняться в зависимости от возраста или симптомов пациента, и предпочтительно составляет от 0,1 до 60 мг.
Основой для суппозитория по настоящему изобретению является обычная основа, и включает масло и жир животного и растительного происхождения, такие как оливковое масло, кукурузное масло, касторовое масло, масло из семян хлопка, масло из ростков пшеницы, масло какао, говяжий жир, лард, шерстяной жир, черепаший жир, сквалан или гидрированное масло, масло и жир неорганического происхождения, такие как вазелин, белый вазелин, твердый парафин, жидкий парафин, безводный ланолин или силиконовое масло, воск, такие как масло жожоба, карнаубский воск, желтый пчелиный воск или ланолин, частично синтетические или полностью синтетический эфир глицерина и алифатической кислоты, такие как моно-, ди- и триглицериды алифатических кислот со средней и высокой длиной цели, таких как насыщенная алифатическая кислота с прямой цепью (например, лауриновая кислота, миристиновая кислота, пальмитиновая кислота или стеариновая кислота с прямой цепью), или ненасыщенная алифатическая кислота с прямой цепью (например, олеиновая кислота, линолеиновая кислота или линоленовая кислота). Примерами коммерчески доступных продуктов являются Witepsol [от Dynamitnobel Co.; включают смесь моно-, ди- и триглицеридов С12-С18 насыщенных алифатических кислот, более конкретно, серия Witepsol H (например, Witepsol Н5, Н12, Н19, Н32, Н35, Н37, Н39, Н42, Н175 или Н185), серия Witepsol W (например, Witepsol W25, W31, W35 или W45), серия Witepsol E (например, Witepsol Е75, Е76, Е79 или Е85) или серия Witepsol S (например, Witepsol S52, S55 или S58)]; Pharmasol (от Nippon Oils и Fats Co. ); Isocacao (jn Kao Co.); SB (от Kanegafuchi Chemical Co. и Taiyo Yusi Co.; включает смесь моно-, ди- и триглицеридов С12-С18 насыщенных алифатических кислот, более конкретно, SB-H, SB-E или SB-AM); Nopata (от Henkel AG.); Sapoyer (от Gatt fords Co.; включает смесь моно-, ди- и триглицеридов, С10-С18 насыщенных алифатических кислот, более конкретно, Sapoyer NA, Sapoyer OS, Sapoyer AS, Sapoyer BS, Sapoyer BM или Sapoyer DM); Masaesthalinum (от Dynamitnobel Co. ; включает смесь моно-, ди- и триглицеридов С10-С18 насыщенных алифатических кислот, более конкретно, Masaesthalinum А, АВ, В, ВВ, ВС, BCF, С, D, Е или BD и Masaesthalinum 299); или Migriol 810 или Migriol 812 (от Dynamitnobel Co.; включены триглицериды С8-С12 насыщенных алифатических кислот, более конкретно, одно или несколько из них могут быть необязательно включены, когда частично синтетические или полностью синтетические эфиры глицерина и алифатической кислоты, как указано выше). Кроме того, примерами могут быть другие синтетические продукты, такие как полиэтиленгликоль или полиоксиэтиленовый спирт. Основы используются в количестве от 25 до 99,9% по массе основы ко всей массе суппозитория.
В суппозиторий, содержащий соединение по настоящему изобретению, может быть добавлен, если необходимо, консерватор, стабилизатор, поверхностно-активное соединение, ароматизатор, регулятор рН или очищенная вода.
Суппозиторий, содержащий соединение по настоящему изобретению, может быть в различных формах, таких как ректальный суппозиторий, которое представляет собой твердый продукт при нормальной температуре, который плавится при температуре тела; мазевая или жидкая клизма, которые могут быть приготовлены растворением или диспергированием соединения по настоящему изобретению в жидкой основе; мягкая капсула для ректального введения или инъекция для ректального введения.
Приготовление суппозитория, который содержит соединение по настоящему изобретению, осуществляют, используя метод, известный в данной области.
Дозу для некоторых пациентов определяют в соответствии с возрастом, массой тела, общим состоянием здоровья, полом, питанием, временем введения, путем введения, путем очистки, сочетанием лекарственных препаратов, степенью состояния заболевания, от которого лечат пациента и другими факторами. Соединение по настоящему изобретению и его фармацевтически приемлемая соль, добавления кислоты проявляют низкую токсичность и могут быть безопасно использованы. Дневная доза изменяется в зависимости от состояния и массы тела пациента, вида соединения производного и пути введения и тому подобное, это, например, около 0,01-50 мг/человек/день, предпочтительно 0,01-20 мг/человек/день, для парентерального введения подкожным, внутривенным или внутримышечным путем, или чрезкожно, в глаза, легкие, бронхи, нос или толстую кишку, и около 0,01-150 мг/человек/день, предпочтительно 0,1-100 мг/человек/день для перорального введения.
Соединение А, которое может использоваться в качестве промежуточного соединения для синтеза соединения (I) по настоящему изобретению, также может использоваться в качестве промежуточного соединения для синтеза соединения общей формулы (II-а) [здесь и далее указано как соединение (II-а)], которое охватывает соединение (I) по настоящему изобретению,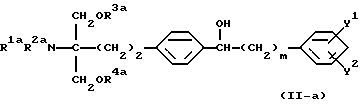
где m равно от 0 до 9, предпочтительно 4, и R1a, R2a, R3a и R4a одинаковы или различны, и каждый представляет собой водород, ацил (алканоил с прямой или разветвленной цепью, содержащий от 1 до 20 атомов углерода, такой как формил, ацетил, пропионил, бутирил, изобутирил, пентаноил, гексаноил, гептаноил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, гептадеканоил, октадеканоил, нонадеканоил, икозаноил и тому подобное; алканоил с прямой или разветвленной цепью, содержащий от 2 до 20 атомов углерода, который может быть замещен фенилом, такой как фенилацетил, фенилпропионил и тому подобное; ароил, такой как бензоил и тому подобное; алкоксикарбонил с прямой или разветвленной цепью, где алкоксигруппа содержит от 1 до 20 атомов углерода, такая как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, трет-пентилоксикарбонил, гексилоксикарбонил, гептилоксикарбонил, октилоксикарбонил, нонилоксикарбонил, децилоксикарбонил, ундецилоксикарбонил, додецилоксикарбонил, тридецилоксикарбонил, тетрадецилоксикарбонил, пентадецилоксикарбонил, гексадецилоксикарбонил, гептадецилоксикарбонил, октадецилоксикарбонил, нонадецилоксикарбонил, икозилоксикарбонил и тому подобное; аралкилоксикарбонил, такой как бензилоксикарбонил и тому подобное), или алкил (алкил с прямой или разветвленной цепью, содержащий от 1 до 20 атомов углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, нонадецил, икозил и тому подобное), или R3a и R4a могут быть соединены с помощью алкиленовой цепи, которая может быть замещена алкилом, содержащим от 1 до 4 атомов углерода, как указано выше, арил, такой как фенил и тому подобное, или аралкил, такой как бензил и тому подобное, и Y1 и Y2 одинаковы или различны, и каждый представляет собой водород, алкил, содержащий от 1 до 4 атомов углерода, как указано выше, алкокси, содержащий от 1 до 4 атомов углерода (метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, трет-бутокси и тому подобное), галоген (фтор, хлор, бром, иод) или гидроксильная группа, и в качестве промежуточного соединения для синтеза соединения общей формулы (1-е) [здесь и далее указано как соединение (1-е)]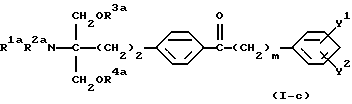
где m, R1a, R2a, R3a, R4a, Y1 и Y2 такие, как указано выше, которое получено окислением соединения (II-а) с подходящим окислителем. Соединение, где в углеродной цепи во 2-положении скелета 2-амино-1,3-пропандиола п-фениленовая группа в углеродной цепи и фенильная группа на конце углеродной цепи замещены и в углеродной цепи между указанной п-фениленовой группой и указанной фенильной группой атом углерода в α-положений п-фениленовой группы замещен карбонильной группой, которое представлено соединением (1-с), проявляет низкую токсичность и высокую безопасность, и может использоваться в качестве превосходного иммуносупрессанта, подобного соединению по настоящему изобретению. Соединение (II-а), которое может использоваться в качестве промежуточного соединения для синтеза соединения (1-е), также проявляет низкую токсичность и высокую безопасность, и может использоваться в качестве превосходного иммуносупрессанта, такого как соединение (1-е).
Соединение (II-a) и соединение (1-е) могут быть получены путем взаимодействия и обработки соединения общей формулы (XXX) [здесь и далее указано как соединение (XXX)]
где М, m, Y1 и Y2 такие, как указано выше, вместо соединения (III) в способе А, с амино- и/или гидрокси-защищенным соединением А в соответствии со способом А и способом В. Далее, путем взаимодействия и обработки тем же методом, используя алкилгалогенид вместо ацилгалогенида по способу В, может быть получено соответствующее амино- и/или гидроксиалкилированное производное. Более того, путем взаимодействия и обработки тем же методом, используя соединение (XXX) вместо соединения (III) в способе М может быть получено соответствующее соединение (1-е).
Полученные соединения (II-a) и соединение (1-е) могут быть преобразованы в их соль добавления кислот, гидрат и тому подобное тем же способом, что указан выше.
В соединении (II-a) соединение общей формулы (II-b) [здесь и далее указано как соединение (II-b)]
где R1, R2, R3 и R4 такие, как указано выше, является предпочтительным, и 2-амино-2-(2-(4-(1-гидрокси-5-фенилпентил)фенил)этил)пропан-1,3-диол является особенно предпочтительным. В соединении (1-е) соединение (I)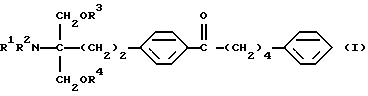
где R1, R2, R3 и R4 такие, как указано выше, является предпочтительным, и 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропан-1,3-диол является особенно предпочтительным.
Далее, вместо соединения (XXX) соединение общей формулы (XXXI) [здесь и далее указано как соединение (XXXI)]
М-(СН2)nСН3 (XXXI)
где n равно целому числу от 0 до 12, предпочтительно 6, и М, как указано выше, подвергают взаимодействию и обрабатывают с амино- и/или гидрокси-защищенным соединением А в соответствии со способом А и способом В [включающие способ взаимодействия и обработки тем же методом, используя алкилгалогенид вместо ацилгалогенида в способе В], или подвергают взаимодействию и обрабатывают, используя соединение (XXXI) вместо соединения (III) в способе М с получением соединения общей формулы (XXXII) или (XXXIII) [здесь и далее указано как соединение (XXXII) и соединение (XXXIII)]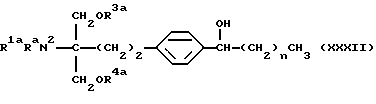
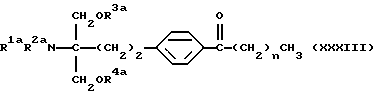
где R1a, R2a, R3a R4a и n такие, как указано выше.
Полученные соединения (XXXII) и соединение (XXXIII) соответственно демонстрируют меньшую токсичность и более высокую безопасность, и могут использоваться в качестве превосходного иммуносупрессанта, подобно соединению (I) по настоящему изобретению.
Краткое описание чертежей
На фиг. 1 графически представлены результаты экспериментального примера 12, где •••••• показывает результат для сравнительного соединения 1, - - - - показывает результат для сравнительного соединения 2 и ------- показывает результат для соединения (I-а) по настоящему изобретению.
На фиг. 2 графически представлены результаты экспериментального примера 13, где - - о - - показывает результат для контроля, --•-- показывает результат для сравнительного соединения 1 (10 мг/кг),  показывает результат для соединения 2 (10 мг/кг) и __▪__ показывает результат для соединение (I-а) по настоящему изобретению (10 мг/кг).
показывает результат для соединения 2 (10 мг/кг) и __▪__ показывает результат для соединение (I-а) по настоящему изобретению (10 мг/кг).
Наилучший метод осуществления изобретения
Настоящее изобретение здесь и далее подробно разъясняется иллюстративными примерами, которые не предназначены для ограничения настоящего изобретения. Из символов, используемых в формуле, Ас обозначает ацетил, Et обозначает этил, TBDMC обозначает трет-бутилдиметилсилил.
Рабочий пример 1. Синтез 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропан-1,3-диола
(1) Синтез диэтил 2-ацетамидо-2-(2-фенилэтил)малоната
К суспензии гидрида натрия (50,6 г) в диметилформамиде (1500 мл) прибавляли по каплям раствор диэтилацетамидомалоната (250 г) в диметилформамиде (200 мл) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 30 минут. 2-Фенилэтилбромид (156 мл) прибавляли по каплям и полученную смесь перемешивали в течение 7 часов при комнатной температуре. Реакционную смесь выливали в ледяную воду (1500 мл) и экстрагировали этилацетатом. Этилацетатный слой промывали водой, сушили над безводным сульфатом магния и растворитель отгоняли. Полученный остаток кристаллизовали из толуола с получением указанного в заголовке соединения (102 г) в виде белых кристаллов, точка плавления 115-117oС.
1H-ЯМР (CDCl3) δ: 1,25 (6Н, т, J=7,3 Гц), 1,97 (3Н, с), 2,48 (1Н, д, J= 11,2 Гц), 2,50 (1Н, д, J=9,2 Гц), 2,69 (1Н, д, J=9,2 Гц), 2,71 (1Н, д, J= 11,2 Гц), 4,19 (4Н, кв, J=7,3 Гц), 6,77 (1Н, с), 7,13-7,20 (3Н, м), 7,20-7,30 (2Н, м),
ИК(КВr): 3236, 1745, 1635 см-1,
MC(EI): 321 (М+),
элементный анализ: С17Н23NО5:
вычислено С 63,54; Н 7,21; N 4,36,
найдено С 63,44; Н 7,29; N 4,44.
(2) Синтез 2-ацетамидо-1,3-диацетокси-2-(2-фенилэтил)пропана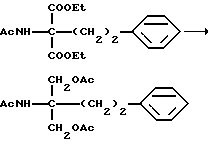
К раствору литийалюминийгидрида (11,8 г) в безводном тетрагидрофуране (1500 мл) по каплям прибавляли раствор диэтил 2-ацетамидо-2-(2-фенилэтил)малоната (50 г) в безводном тетрагидрофуране (300 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 2 часов. Насыщенный водный раствор сульфата натрия (150 мл) прибавляли по каплям для разложения литийалюминийгидрида. Осадок фильтровали через целит и растворитель отгоняли при пониженном давлении с получением бледно-коричневого маслянистого продукта. Его растворяли в пиридине (90 мл), добавляли уксусный ангидрид (70 мл) и смесь оставляли в течение ночи при комнатной температуре. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным водным раствором хлорида аммония, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток кристаллизовали из толуола с получением указанного в заголовке соединения (29,3 г) в виде белых кристаллов, точка плавления 116-117oС.
1H-ЯМР (СОСl3) δ: 1,96 (3Н, с), 2,09 (6Н, с), 2,20 (2Н, м), 2,64 (2Н, м), 4,35 (4Н, с), 5,69 (1Н, с), 7,10-7,20 (3Н, м), 7,20-7,30 (2Н, м),
ИК(КВr): 3315, 1732, 1652 см-1,
MC(EI): 321 (M+),
элементный анализ: C17H23NO5:
вычислено C 63,54; H7,21; N4,36,
найдено С 63,37; Н 7,30; N 4,35.
(3) Синтез 2-ацетамидо-1,3-диацетокси-2-(2-(4-формилфенил)этил)пропана
К раствору 2-ацетамидо-1,3-диацетокси-2-(2-фенилэтил)пропана (10 г) в безводном дихлорметане (150 мл) добавляли тетрахлорид титана (15,4 мл) и дихлорметилметиловый эфир (5,63 мл) в атмосфере азота при -15oС. Смесь перемешивали при комнатной температуре в течение 2 часов, выливали в ледяную воду и экстрагировали хлороформом. Хлороформный слой промывали водой, насыщенным водным раствором натрия, раствором гидрокарбоната и насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент; диизопропиловый эфир: этилацетат=1:1) с получением указанного в заголовке соединения (5,1 г) в виде белого твердого продукта, точка плавления 98-100oС.
1H-ЯМР (CDCl3) δ: 1,99 (3Н, с), 2,10 (6Н, с), 2,25 (2Н, м), 2,70 (2Н, м), 4,34 (4Н, с), 5,82 (1Н, с), 7,35 (2Н, д, J=7,9 Гц), 7,80 (2Н, д, J=7,9 Гц), 9,97 (1Н, с),
ИК(КВr): 3313, 3205, 3082, 1735, 1706, 1652 см-1,
MC(EI): 349 (М+),
элементный анализ: C18H23NO6•l/5 Н2О:
вычислено: С 61,25; Н 6,68; N 3,97,
найдено: С 61,40; Н 6,70; N 3,96.
(4) Синтез 2-ацетамидо-2-(2-(4-формилфенил)этил)пропан-1,3-диола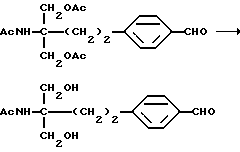
К раствору 2-ацетамидо-1,3-диацетокси-2-(2-(4-формилфенил)этил)пропана (3,4 г) в этаноле (100 мл) добавляли этоксид натрия (1,46 г) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь концентрировали, выливали в ледяную воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент; хлороформ: метанол = 9: 1) с получением указанного в заголовке соединения (1,7 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3) δ: 2,00 (2Н, м), 2,01 (3Н, с), 2,70 (2Н, м), 3,70-3,90 (4Н, м), 4,45 (2Н, ушир. с), 6,36 (1Н, с), 7,35 (2Н, д, J=7,9 Гц), 7,77 (2Н, д, J=7,9 Гц), 9,94 (1Н, с),
МС(ЕI): 265 (М+).
(5) Синтез 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-формилфенил)этил)пропана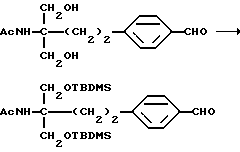
К раствору 2-ацетамидо-2-(2-(4-формилфенил)этил)gропан-1,3-диола (9,7 г) в диметилформамиде (150 мл) добавляли имидазол (5,36 г) и трет-бутилдиметилхлорсилан (11,9 г) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду (200 мл) и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат=4:1) с получением указанного в заголовке соединения (13,5 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (CDCl3) δ: 0,07 (12Н, с), 0,90 (18Н, с), 1,95 (3Н, с), 2,14 (2Н, м), 2,68 (2Н, м), 3,66 (2Н, д, J=9,9 Гц), 3,78 (2Н, д, J=9,9 Гц), 5,60 (1Н, с), 7,36 (2Н, д, J=7,9 Гц), 7,78 (2Н, д, J=7,9 Гц), 9,96 (1Н, с),
ИК (чистый): 3365, 3087, 2954, 1702 см-1,
MC(EI): 493 (М+),
элементный анализ: C26H47NO4Si2•l/5 H2O:
вычислено: С 62,78; Н 9,60; N 2,82,
найдено: С 62,59; Н 9,64; N 2,661.
(6) Синтез 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-гидрокси-5-фенилпентил)фенил)этил)пропана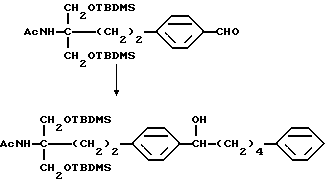
К раствору магния (0,27 г) в безводном тетрагидрофуране (5 мл) прибавляли по каплям раствор 1-бром-4-фенилбутана (2,35 г) в безводном тетрагидрофуране (5 мл) в атмосфере азота и смесь перемешивали в течение 1,5 часов. К этому раствору прибавляли по каплям раствор 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-формилфенил)этил)-пропана (1,2 г) в безводном тетрагидрофуране (15 мл) и смесь перемешивали в течение 1 часа. 3%-ную соляную кислоту выливали в реакционную смесь и смесь экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат=2:1) с получением указанного в заголовке соединения (1,27 г) в виде бесцветного прозрачного маслянистого продукта.
1H-ЯМР (CDCl3) δ: 0,06 (12Н, с), 0,90 (18Н, с), 1,20-1,80 (7Н, м), 1,87 (3Н, с), 2,05 (2Н, м), 2,50-2,60 (4Н, м), 3,61 (2Н, д, J=9,9 Гц), 3,72 (2Н, д, J=9,9 Гц), 4,55 (1Н, т, J=5,9 Гц), 5,50 (1H, с), 7,00-7,20 (9Н, м),
ИК (чистый): 3296, 3086, 3062, 1657 см-1,
MC(EI): 570 ((M-AcNH)+).
(7) Синтез 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропана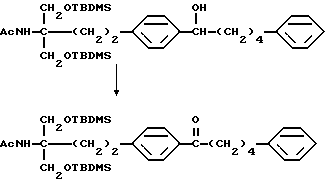
К раствору диметилсульфоксида (0,73 мл) в дихлорметане (8 мл) добавляли оксалилхлорид (0,23 мл) в атмосфере азота при -78oС, и затем 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-гидрокси-5-фенилпентил)фенил)этил)пропан (1,1 г) в дихлорметане (7 мл), и смесь перемешивали при указанной температуре в течение 1 часа. Затем добавляли триэтиламин (1,2 мл) и температуру смеси понижали до комнатной температуры. Реакционную смесь выливали в воду и смесь экстрагировали хлороформом. Хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат=4:1) с получением указанного в заголовке соединения (0,91 г) в виде бесцветного прозрачного маслянистого продукта.
1H-ЯМР (СDСl3) δ: 0,06 (12Н, с), 0,90 (18Н, с), 1,65-1,85 (4Н, м), 1,95 (3Н, с), 2,14 (2Н, м), 2,60-2,70 (4Н, м), 2,95 (2Н, т, J=7,3 Гц), 3,66 (2Н, д, J= 9,3 Гц), 3,78 (2Н, д, J=9,3 Гц), 5,58 (1Н, с), 7,10-7,20 (3Н, м), 7,20-7,30 (4Н, м), 7,84 (2Н, д, J=8,6 Гц),
ИК (чистый): 3313, 1741, 1684 см-1,
MC(EI): 568 ((M-AcNH)+),
элементный анализ: С36Н59НO4Si2•1/2Н2О:
вычислено: С 68,09; Н 9,52; N 2,21,
найдено: С 68,05; Н 9,54; N 2,19.
(8) Синтез 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)фенил) этил)пропан-1,3-диола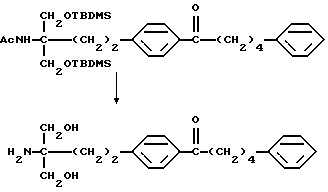
К раствору 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропана (0,9 г) в тетрагидрофуране (10 мл) добавляли раствор тетра-н-бутиламмоний фторида (1,2 г) в тетрагидрофуране (5 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении с получением 2-ацетамидо-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропан-1,3-диола в виде остатка. Полученный остаток растворяли в воде (5 мл), добавляли метанол (5 мл), тетрагидрофуран (3 мл) и моногидрат гидроксида лития (0,3 г). Смесь кипятили с обратным холодильником при нагревании в течение 1,5 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении с получением белого твердого продукта. Полученный белый твердый продукт перекристаллизовывали из этанола-этилацетата-гексана с получением указанного в заголовке соединения (220 мг) в виде белых кристаллов, точка плавления 126-127oС.
1H-ЯМР (СDСl3) δ: 1,60-1,80 (6Н, м), 2,00 (4Н, ушир. с), 2,60-2,75 (4Н, м), 2,95 (2Н, т, J=7,2 Гц), 3,50-3,65 (4Н, м), 7,10-7,15 (3Н, м), 7,20-7,25 (4Н, м), 7,86 (2Н, д, J=7,9 Гц),
ИК(КВr): 3349, 3290, 3025, 1678 см-1,
MC(EI): 355 (М+),
элементный анализ: С22H29NO3:
вычислено: С 74,33; Н 8,22; N 3,94,
найдено: С 74,17; Н 8,29; N 3,87.
Рабочий пример 2. Синтез 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропан-1,3-диола (другой способ)
(1) Синтез 4-(2-бромэтил)бензальдегида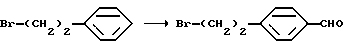
К раствору дихлорметилметилового эфира (62 мл) в метиленхлориде (400 мл) добавляли тетрахлорид титана (75 мл) в течение 10 минут в атмосфере азота при 4-5oС. Затем добавляли раствор фенетилбромида (85 мл) в метиленхлориде (50 мл) в течение 50 минут при 5-7oС и смесь перемешивали в течение 5 часов при градиентном повышении температуры смеси до комнатной температуры. К реакционной смеси добавляли воду (200 мл) в течение 1 часа и смесь экстрагировали хлороформом (200 мл). Хлороформный слой промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением коричневого маслянистого продукта (167 г). Полученный коричневый маслянистый продукт очищали колоночной хроматографией на силикагеле (элюент; гексан:этилацетат=20:1) с получением 4-(2-бромэтил)бензальдегида (32,3 г) в виде желтого твердого продукта, точка плавления 50-52oС.
1H-ЯМР (270 МГц/СDСl3) δ: 3,25 (2Н, т, J=7,3 Гц), 3,61 (2Н, т, J=7,3 Гц), 7,39 (2Н, д, J=7,9 Гц), 7,84 (2Н, д, J=7,9 Гц), 9,99 (1Н, с),
МС (EI) m/z 213 (M+).
(2) Синтез 1-[4-(2-бромэтил)фенил]-5-фенилпентан-1-ола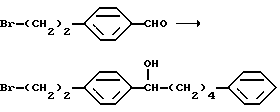
К раствору магния (4,4 г) в тетрагидрофуране (20 мл) добавляли дибромэтан (1,6 мл) в атмосфере азота и смесь перемешивали в течение 10 минут. К реакционной смеси добавляли раствор 1-бром-4-фенилбутана (38,8 г) в тетрагидрофуране (30 мл) в течение 30 минут и смесь перемешивали в течение 40 минут. Полученный реактив Гриньяра прибавляли по каплям к раствору 4-(2-бромэтил)бензальдегида (32,3 г) в тетрагидрофуране (250 мл) при охлаждении льдом в течение 30 минут и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония (200 мл) при охлаждении льдом и смесь экстрагировали этилацетатом (200 мл). Этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении с получением коричневого маслянистого продукта (70,5 г). Полученный коричневый маслянистый продукт очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат=10:1) с получением 1-[4-(2-бромэтил)фенил] -5-фенилпентан-1-ола (32 г) в виде желтого маслянистого продукта.
1H-ЯМР (270 МГц/CDCl3) δ: 1,30-1,90 (7Н, м), 2,59 (2Н, т, J=7,3 Гц), 3,15 (2Н, т, J= 7,3 Гц), 3,55 (2Н, т, J=7,3 Гц), 4,65 (1Н, дт, J-2,0, 5,3 Гц), 7,10-7,20 (5Н, м), 7,20-7,35 (4Н, м),
МС (EI) m/z 33((М-17)+).
(3) Синтез 1-[4-(2-бромэтил)фенил]-5-фенилпентан-1-она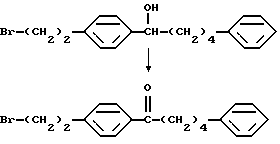
К раствору диметилсульфоксида (12,7 мл) в метиленхлориде (320 мл) добавляли раствор оксалилхлорида (7,7 мл) в метиленхлориде (320 мл) в течение 10 минут в атмосфере азота при от -68 до -65oС и смесь перемешивали при указанной температуре в течение 10 минут. Затем добавляли раствор 1-[4-(2-бромэтил)фенил]-5-фенилпентан-1-ола (20,7 г) в метиленхлориде (80 мл) при от -68 до -65oС в течение 20 минут и смесь перемешивали при указанной температуре в течение часа. Затем добавляли триэтиламин (41,6 мл) в течение 10 минут при указанной температуре и смесь перемешивали в течение 2,5 часов, градиентно понижая температуру смеси до 0oС. Реакционную смесь промывали водой (100 мл) и насыщенным солевым раствором (100 мл), сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением коричневого маслянистого продукта. Полученный коричневый маслянистый продукт очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат= 20: 1) с получением 1-[4-(2-бромэтил)фенил]-5-фенилпентан-1-она (18,2 г) в виде желтого маслянистого продукта.
1H-ЯМР (270 МГц/СDСl3) δ: 1,65-1,90 (4Н, м), 2,67 (2Н, т, J=7,3 Гц), 2,97 (2Н, т, J= 7,3 Гц), 3,22 (2Н, т, J=7,3 Гц), 3,59 (2Н, т, J=7,3 Гц), 7,15-7,20 (3Н, м), 7,20-7,35 (4Н, м), 7,90 (2Н, д, J=7,9 Гц),
МС (EI) m/z 345 (M+).
(4) Синтез 1-[4-(2-иодэтил)фенил]-5-фенилпентан-1-она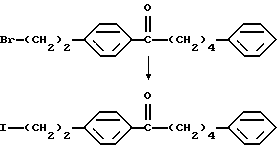
Раствор 1-[4-(2-бромэтил)фенил] -5-фенилпентан-1-она (18,2 г) и иодида натрия (9,5 г) в 2-бутаноне (180 мл) перемешивали при 60oС в течение 3,5 часов. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением коричневого маслянистого продукта (19,2 г). Полученный коричневый маслянистый продукт очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат=20:1) с получением 1-[4-(2-иодэтил)фенил]-5-фенилпентан-1-она (17,2 г) в виде желтого маслянистого продукта.
1H-ЯМР (270 МГц/СDСl3) δ: 1,65-1,85 (4Н, м), 2,67 (2Н, т, J=7,3 Гц), 2,97 (2Н, т, J= 7,9 Гц), 3,23 (2Н, м), 3,36 (2Н, м), 7,10-7,20 (3Н, м), 7,20-7,35 (4Н, м), 7,90 (2Н, д, J=8,6 Гц),
МС (EI) m/z 392 (М+),
ИК (чистый) см-1: 3025, 2935, 2858, 1684, 01571.
(5) Синтез диэтил 2-ацетамидо-2-{2-[4-(1-оксо-5-фенилпентил)фенил]этил} малоната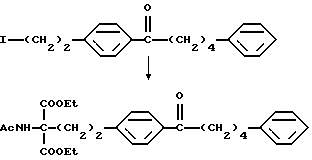
Раствор диэтил 2-ацетамидомалоната (30,6 г), этоксида натрия (7,6 г) и молекулярные сита ЗА (5,5 г) в этаноле (80 мл) перемешивали при комнатной температуре в течение 20 часов. Добавляли раствор 1-[4-(2-иодэтил)фенил]-5-фенилпентан-1-она (18,4 г) в тетрагидрофуране (60 мл) в течение 10 минут и смесь кипятили с обратным холодильником при нагревании в течение 15 часов. Реакционную смесь выливали в воду (200 мл) и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли при пониженном давлении с получением коричневого маслянистого продукта (40 г). Полученный коричневый маслянистый продукт очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат= 2:1) с получением диэтил 2-ацетамидо-2-{2-[4-(1-оксо-5-фенилпентил)фенил] этил}малоната (13,8 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (270 МГц/СDСl3) δ: 1,25 (6Н, т, J=7,3 Гц), 1,65-1,85 (4Н, м), 1,98 (3Н, с), 2,50-2,60 (2Н, м), 2,65-2,80 (4Н, м), 2,90-3,00 (2Н, м), 4,15-4,30 (4Н, м), 6,78 (1Н, с), 7,15-7,30 (7Н, м), 7,84 (2Н, д, J=8,6 Гц),
MC (EI) m/z 482 (М+1)+,
ИК (чистый) см-1: 3381, 2981, 2937, 1739, 1681, 1606.
(6) Синтез диэтил 2-ацетамидо-2-{ 2-[4-(1,1-этилендиокси-5-фенилпентил)фенил]этил}малоната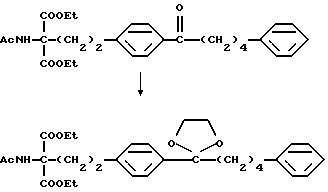
Раствор диэтил 2-ацетамидо-2-{ 2-[4-(1-оксо-5-фенилпентил)фенил] этил} малоната (13,5 г), этиленгликоля (3,1 мл) и п-толуолсульфоновой кислоты (0,53 г) в бензоле (135 мл) кипятили с обратным холодильником при нагревании в течение 20 часов с удалением воды с помощью насадки Дина-Старка. Реакционную смесь обрабатывали триэтиламином (2,4 мл) и добавляли этилацетат (200 мл). Смесь промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением бледно-желтого маслянистого продукта (15,9 г). Полученный бледно-желтый маслянистый продукт очищали колоночной хроматографией на силикагеле (элюент; гексан: этилацетат= 1:1) с получением диэтил 2-ацетамидо-2-{2-[4-(1,1-этилендиокси-5-фенилпентил)фенил] этил} малоната (14,1 г) в виде бесцветного прозрачного маслянистого продукта.
1H-ЯМР (270 МГц/СDСl3) δ: 1,25 (6Н, т, J=7,3 Гц), 1,30-1,45 (2Н, м), 1,50-1,60 (2Н, м), 1,85-1,95 (2Н, м), 1,98 (3Н, с), 2,45-2,60 (4Н, м), 2,65-2,65 (2Н, м), 3,70-3,75 (2Н, м), 3,95-4,00 (2Н, м), 4,15-4,30 (4Н, м), 6,77 (1Н, с), 7,05-7,25 (7Н, м), 7,33 (2Н, д, J=8,6 Гц),
МС (EI) m/z 525(M+),
ИК (чистый) см-1: 3410, 2942, 1739, 1683, 1496.
(7) Синтез 2-ацетамидо-2-{ 2-[4-(1,1-этилендиокси-5-фенилпентил)фенил] этил}пропан-1,3-диола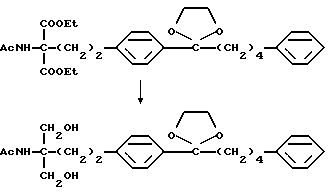
К раствору литийалюминийгидрида (2,0 г) в тетрагидрофуране (100 мл) прибавляли по каплям раствор диэтил-2-ацетамидо-2-{2-[4-(1,1-этилендиокси-5-фенилпентил)фенил] -этил} малоната (14,0 г) в тетрагидрофуране (50 мл) при 3-13oС в течение 30 минут и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси прибавляли по каплям насыщенный водный раствор сульфата натрия (27 мл) и смесь перемешивали при комнатной температуре в течение часа. Осадок фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением бесцветного прозрачного маслянистого продукта (11,7 г). Полученный бесцветный прозрачный, маслянистый продукт очищали колоночной хроматографией на силикагеле (элюент; хлороформ: метанол= 20: 1) с получением 2-ацетамидо-2-{2-[4-(1,1-этилендиокси-5-фенилпентил)фенил] этил} пропан-1, 3-диола (5,8 г) в виде бесцветного прозрачного маслянистого продукта.
1H-ЯМР (270 МГц/СDСl3) δ: 1,30-1,45 (2Н, м), 1,50-1,65 (2Н, м), 1,80-2,00 (4Н, м), 1,96 (3Н, с), 2,54 (2Н, м), 2,64 (2Н, м), 3,55-3,65 (2Н, м), 3,70-3,80 (2Н, м), 3,80-3,90 (2Н, м), 3,95-4,05 (2Н, м), 5,98 (1Н, с), 7,05-7,25 (4Н, м), 7,10-7,15 (3Н, м), 7,20-7,25 (7Н, м), 7,35 (2Н, д, J=8,6 Гц),
МС (EI) m/z 441 (М+),
ИК (чистый) см-1: 3323, 2945, 1652.
(8) Синтез 2-амино-2-{ 2-[4-(1-оксо-5-фенилпентил)фенил]этил}-пропан-1,3-диола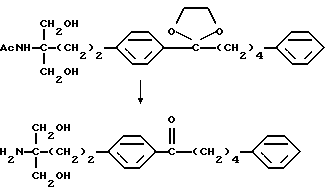
Раствор 2-ацетамидо-2-{2-[4-(1,1-этилендиокси-5-фенилпентил)-фенил]этил} пропан-1,3-диола (5,5 г), концентрированной соляной кислоты (7 мл) и воды (20 мл) в тетрагидрофуране (200 мл) кипятили с обратным холодильником при нагревании в течение 7 часов. Для смеси установливали рН 12 с помощью гидроксида натрия и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением желтого твердого продукта (4,7 г). Полученный желтый твердый продукт очищали колоночной хроматографией на силикагеле (элюент; хлороформ:метанол=9:1) с получением белого твердого продукта (3,76 г). Полученный белый твердый продукт кристаллизовали из этилацетата и полученные кристаллы перекристаллизовывали из этилацетата-этанола с получением 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропан-1,3-диола (2,34 г) в виде белых кристаллов, точка плавления 126-127oС.
1H-ЯМР (270 МГц/СDСl3) δ: 1,60-1,80 (6Н, м), 2,00 (4Н, ушир. с), 2,60-2,75 (4Н, м), 2,95 (2Н, т, J=7,2 Гц), 3,50-3,65 (4Н, м), 7,10-7,15 (3Н, м), 7,20-7,25 (4Н, м), 7,86 (2Н, д, J=7,9 Гц),
МС (EI) m/z 355 (М+),
ИК (чистый) см-1: 3349, 3290, 3025, 1678,
элементный анализ: C22H29NO3:
вычислено С, 74,33; Н, 8,22; N, 3,94,
найдено С, 74,35; Н, 8,38; N, 3,86.
Рабочий пример 3. Синтез 2-ацетамидо-1,3-диацетокси-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)пропана
2-Ацетамидо-2-(2-(4-(1-оксо-5-фенилпентил)фенил)этил)-пропан-1,3-диол растворяли в пиридине, добавляли уксусный ангидрид при охлаждении льдом и смесь оставляли при комнатной температуре. Реакционную смесь выливали в водный раствор хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой промывали водным раствором гидрокарбоната калия и насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле с получением 2-ацетамидо-1,3-диацетокси-2-(2-(4-(1-оксо-5-фенилпентил)фенил)-этил)пропана.
Пример получения 1. Синтез 2-амино-2-(2-(4-(1-оксо-6-фенилгексил)фенил)этил)пропан-1,3-диола
(1) Синтез 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-гидрокси-6-фенилгексил)фенил)этил)пропана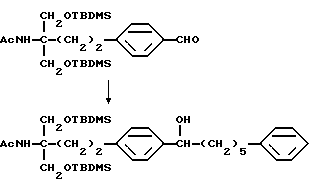
2-Ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-формилфенил) этил) пропан (3,0 г) и 1-бром-5-фенилпентан (4,1 г) подвергают взаимодействию и обрабатывают таким же образом, как в рабочем примере 1(6) с получением указанного в заголовке соединения (2,7 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3) δ: 0,06 (12Н, с), 0,84 (18Н, с), 1,20-1,80 (9Н, м), 1,87 (3Н, с), 2,04 (2Н, м), 2,49-2,56 (4Н, м), 3,61 (2Н, д, J=9,2 Гц), 3,72 (2Н, д, J= 9,2 Гц), 4,54 (1H, т, J=6,6 Гц), 5,50 (1H, с), 7,07-7,11 (5Н, м), 7,15-7,23 (4Н, м),
МС(ЕI): 584 ((M-AcNH+).
(2) Синтез 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-оксо-6-фенилгексил)фенил)этил)пропана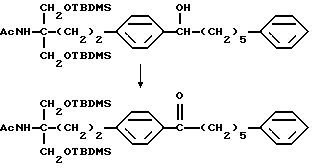
2-Ацетамидо-1,3-бис(трет-бутилдиметилилсилилокси)-2-(2-(4-(1-гидрокси-6-фенил] гексил)фенил)этил)пропан (2,2 г) подвергают взаимодействию и обрабатывают таким же образом, как в рабочем примере 1(7) с получением указанного в заголовке соединения (2,1 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3) δ: 0,06 (12Н, с), 0,83 (18Н, с), 1,35 (2Н, м), 1,54-1,75 (4Н, м), 1,89 (3Н, с), 2,06 (2Н, м), 2,53-2,62 (4Н, м), 2,86 (2Н, т, J=7,3 Гц), 3,60 (2Н, д, J=9,2 Гц), 3,71 (2Н, д, J=9,2 Гц), 5,52 (1H, с), 7,07-7,11 (3Н, м), 7,12-7,23 (4Н, м), 7,78 (2Н, д, J=8,6 Гц),
ИК (чистый): 3311, 2952, 2929, 1683, 1657 см-1,
MC(EI): 582 ((M-AcNH)+),
элементный анализ: C37H61NO4Si2•1/5 Н2O:
вычислено: С 68,96; Н 9,60; N 2,17,
найдено: С 68,99; Н 9,72; N 2,20.
(3) Синтез 2-амино-2-(2-(4-(1-оксо-6-фенилгексил)фенил)-этил)пропан-1,3-диола
2-Ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-оксо-6-фенилгексил)фенил)этил)пропан (2,0 г) подвергают взаимодействию и обрабатывают таким же образом, как в рабочем примере 1(8) с получением указанного в заголовке соединения (310 мг) в виде белого кристаллического вещества, точка плавления 118-120oС.
1H-ЯМР (СDС13) δ: 1,42 (2Н, м), 1,61-1,81 (6Н, м), 2,00-2,30 (4Н, ушир. с), 2,62 (2Н, т, J=7,3 Гц), 2,70 (2Н, м), 2,92 (2Н, т, J=7,3 Гц), 3,52 (2Н, д, J= 10,6 Гц), 3,61 (2Н, д, J=10,6 Гц), 7,14-7,18 (3Н, м), 7,19-7,29 (4Н, м), 7,86 (2Н, д, J=8,6 Гц),
ИК (КВr): 3352, 2933, 1676 см-1,
MC(EI): 369 (М+),
элементный анализ: С23Н31О3•Н2O:
вычислено: С 71,29; Н 8,58; N 3,61,
найдено: С 71,50; Н 8,32; N 3,58.
Пример получения 2. Синтез 2-амино-2-(4-(1-оксо-7-фенилгептил)фенил)этил)пропан-1,3-диола
(1) Синтез 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-гидрокси-7-фенилгептил)фенил)этил)пропана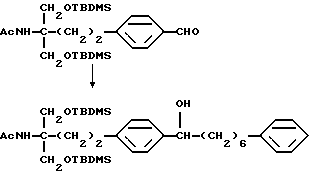
2-Ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2(2-(4-формилфенил)этил)пропан (3,0 г) и 1-бром-6-фенилгексан (3,1 г) подвергают) взаимодействию и обрабатывают таким же образом, как в рабочем примере 1(6) с получением указанного в заголовке соединения (2,6 г) в виде бледно-желтого маслянистого продукта.
1H-ЯМР (СDСl3) δ: 0,06 (12Н, с), 0,84 (18Н, с), 1,20-2,10 (16Н, м), 2,45-2,55 (4Н, м), 3,64 (2Н, д, J=9,2 Гц), 3,72 (2Н, д, J=9,2 Гц), 4,55 (2Н, т, J=6,6 Гц), 5,50 (1Н, с), 7,05-7,20 (9Н, м),
ИК (чистый): 3304, 3086, 3026, 2929, 1741 см-1,
MC(EI): 656 (М+).
(2) Синтез 2-ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-оксо-7-фенилгептил)фенил)этил)пропана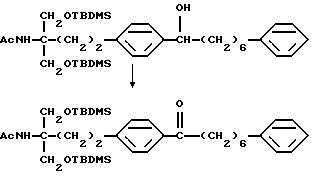
2-Ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-гидрокси-7-фенилгептил)фенил)этил)пропан (2,2 г) подвергают взаимодействию и обрабатывают таким же образом, как в рабочем примере 1(7) с получением указанного в заголовке соединения (1,8 г) в виде бесцветного прозрачного маслянистого продукта.
1H-ЯМР (СDСl3) δ: 0,06 (12Н, с), 0,84 (18Н, с), 1,25-1,35 (4Н, м), 1,50-1,75 (4Н, м), 1,89 (3Н, с), 2,07 (2Н, м), 2,50-2,65 (4Н, м), 2,85 (2Н, т, J=7,3 Гц), 3,60 (2Н, д, J=9,2 Гц), 3,71 (2Н, д, J=9,2 Гц), 5,52 (1Н, с), 7,05-7,15 (3Н, м), 7,18-7,24 (4Н, м), 7,79 (2Н, д, J=7,9 Гц),
ИК(чистый): 3313, 2929, 2856, 1684, 1606 см-1,
MC(EI): 596 ((M-AcNH)+),
элементный анализ: C38H63NO4Si2•1/5 H2O:
вычислено: С 69,40; Н 9,72; N 2,13,
найдено: С 69,12; Н 9,65; N 2,02.
(3) Синтез 2-амино-2-(2-(4-(1-оксо-7-фенилгептил)фенил)этил)-пропан-1,3-диола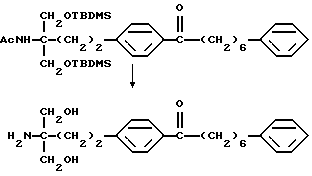
2-Ацетамидо-1,3-бис(трет-бутилдиметилсилилокси)-2-(2-(4-(1-оксо-7-фенилгептил)фенил)этил)пропан (1,8 г) подвергают взаимодействию и обрабатывают таким же образом, как в рабочем примере 1(8) с получением указанного в заголовке соединения (390 мг) в виде белого кристаллического вещества, точка плавления 121-122oС.
1H-ЯMP(CDCl3) δ: 1,30-1,45 (4Н, м), 1,55-1,75 (6Н, м), 2,00-2,20 (4Н, ушир. с), 2,60 (2Н, т, J=7,9 Гц), 2,71 (2Н, м), 3,52 (2Н, д, J=10,6 Гц), 3,61 (2Н, д, J=10,6 Гц), 7,13-7,20 (3Н, м), 7,20-7,30 (4Н, м), 7,86 (2Н, д, J=8,6 Гц),
ИК(КВr): 3288, 2929, 2854, 1676 см-1,
MC(EI): 383 (М+),
элементный анализ: С24Н33NО3•1/5 Н2O:
вычислено: С 74,46; Н 8,70; N 3,62,
найдено: С 74,54; Н 8,77; N 3,58.
Пример
1/5 Гидрат гидрохлорида 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)-фенил)этил)пропан-1,3-диола
К раствору 2-амино-2-(2-(4-(1-оксо-5-фенилпентил)фенил)-этил)пропан-1,3-диола (115,1 мг) в метаноле (10 мл) прибавляют раствор 4 М HCl/диоксан (0,085 мл) при комнатной температуре. Смесь оставляют стоять при комнатной температуре в течение ночи. Растворитель упаривают и полученные кристаллы промывают этилацетатом (30 мл). Полученные кристаллы сушат при пониженном давлении при 60oС в течение 3 часов с получением указанного в заголовке соединения (115,2 мг).
Температура плавления: 105-107oС.
Элементный анализ:
Вычислено для C22H29NO3•HCl•1/5H2О: С 66,80; Н 7,75; N 3,54.
Найдено: С 66,81; Н 7,76; N 3,61.
Пример препарата
(1) Таблетки
Получают таблетку, содержащую соединение по настоящему изобретению и имеющую следующий состав:
Соединение (I) - 1 мг
Лактоза - 90 мг
Кристаллическая целлюлоза - 25 мг
Стеарат магния - 4 мг
(2) Мягкая капсула (на капсулу)
Соединение (I) - 30 мг
Полиэтиленгликоль-300 - 300 мг
Полисорбат 80 - 20 мг
Способ получения
Полиэтиленгликоль-300 и полисорбат 80 добавляли к соединению по настоящему изобретению и смесь помещали в мягкую капсулу.
(3) Инъекции (на 10 мл в ампуле)
Соединение (I) - 0,03%
Полиэтиленгликоль-300 - 20%
Этанол - 60%
Дистиллированная вода для инъекций - количество до доведения объема в 10 мл
Способ получения
Этанол и полиэтиленгликоль-300 добавляли к соединению по настоящему изобретению и дистиллированную воду для инъекций добавляли до достижения общего объема.
Таким образом получали инъекции, содержащие 30 мг соединения по настоящему изобретению в ампуле (10 мл).
(4) 5% Мазь
Соединение по настоящему изобретению - 1 г
Гидрофильный петролатум - 19 г
Способ получения
Соединение по настоящему изобретению (1 г) растворяют в 19 г гидрофильного петролатума при нагревании при 60oС и смесь охлаждают, перемешивая, с получением мази, содержащий 5% соединения по настоящему изобретению.
(5) 5% Мазь
Соединение по настоящему изобретению - 1 г
Полимерная основа - 19 г
Способ получения
Соединение по настоящему изобретению (1 г) хорошо смешивают с 19 г пластиоснования (углеводородный гель) в ступке в течение 30 минут с получением мази, содержащий 5% соединения по настоящему изобретению.
(6) Суппозиторий
Соединение по настоящему изобретению - 30 мг
Witepsol H15 - 72,47 г
Способ получения
Witepsol H15 (72,47 г) измельчают при 40oС и прибавляют соединение по настоящему изобретению (30 мг). Смесь перемешивают для диспергирования соединения. Гомогенную смесь фильтруют в контейнер массой по 725 мг в каждый с целью получения суппозитория, содержащего 0,3 мг соединения по настоящему изобретению в 725 мг суппозитория.
(7) Глазные капли
Соединение по настоящему изобретению - 0,2 г
Поливиниловый спирт - 0,2 г
Полиоксиэтиленовое гидрированное касторовое масло 60 - 0,1 г
Гидрофосфат динатрия - 0,5 г
Гидрофосфат натрия - 0,1 г
Хлорид натрия - 0,8 г
Хлорид бензэтония - 0,007 г
Стерильная очищенная вода - количество до доведения объема в 100 мл
Способ получения
К 70 мл стерильной очищенной воды добавляют 0,2 г поливинилового спирта и смесь растворяют, нагревая при 70oС с перемешиванием. В растворе гомогенно диспергируют 0,1 г полиоксиэтиленового гидрированного касторового масла 60, и затем смесь охлаждают до комнатной температуры. В этом растворе растворяют 0,2 г соединения по настоящему изобретению, 0,5 г гидрофосфата динатрия, 0,1 г гидрофосфата натрия, 0,8 г хлорида натрия и 0,007 г хлорида бензэтония. К раствору добавляют стерильную очищенную воду до доведения общего объема в 100 мл с получением глазных капель, содержащих соединение по настоящему изобретению.
(8) Капли в нос
Соединение по настоящему изобретению - 0,4 г
Цитрат натрия - 0,2 г
Полисорбат 80 - 0,1 г
Глицерин - 2,6 г
Хлорид бензэтония - 0,007 г
Стерильная очищенная вода - количество до доведения объема в 100 мл
Способ получения
В 70 мл стерильной очищенной воды растворяют 0,4 г соединения по настоящему изобретению, 0,2 г цитрата натрия, 0,1 г полисорбата 80, 2,6 г глицерина и 0,007 г хлорида бензэтония. К полученному раствору добавляют стерильную очищенную воду до достижения общего объема 100 мл для приготовления капель для носа, содержащих соединение по изобретению.
(9) 2% Лосьон
Соединение по настоящему изобретению - 100 мг
Изопропилмиристат - 1 мл
Этанол - 4 мл
Способ получения
К 100 мг соединения по настоящему изобретению добавляют 1 мл изопропилмиристата и 4 мл этанола для растворения соединения при комнатной температуре для приготовления лосьона, содержащего 2% соединения по настоящему изобретению.
Действие и эффект настоящего изобретения подробно проиллюстрированы следующими экспериментальными примерами.
Для определения иммуносупрессивной активности могут быть определены различные иммунные реакции с использованием лимфоцитов мыши, крысы или человека. Иммуносупрессивная активность может быть определена с помощью, например, высокочувствительной реакции смеси аллогенных лимфоцитов (аллогенная МЛР) мыши, крысы или человека.
Аллогенная МЛР представляет собой бластогенез лимфоцитов, индуцированный смешанной культурой лимфоцитов, таких как клетки селезенки, клетки лимфоузла и лимфоциты периферической крови, полученные от двух особей, которые являются аллогенными и имеют различные антигены главного комплекса гистосовместимости. Аллогенная МЛР представляет собой явление, вызванное и отражающее различие в анигенах главного комплекса гистосовместимости доноров лимфоцитов, и явление бластогенеза лимфоцитов не развивается смешанной культурой лимфоцитов от монозиготных близнецов. Соответственно, аллогенная МЛР широко используется для отбора донор-реципиент при трансплантации органов.
Когда желательна аллогенная МЛР, может быть осуществлена однонаправленная МЛР, где лимфоциты одного из них применяют как клетки-стимуляторы при рентгеновском облучении или лечении митомицином С для ингибирования пролиферации, и, когда определен бластогенез лимфоцитов других (иммунокомпетентных клеток).
Далее, иммуносупрессивная активность может быть определена как активность в отношении ингибирования индукции цитотоксичных Т клеток, имеющих рестриктивное свойство антигена главного комплекса гистосовместимости в течение аллогенной МЛР.
Также, может быть определена иммуносупрессивная активность, помимо аллогенной МЛР, как активность в отношении ингибирования бластогенеза лимфоцитов, индуцированных стимуляцией различных митогенов таких как консанавалин А, фитогемагглютинин и митоген фитолакки американской, или как активность в отношении ингибирования пролиферации лимфоцитов, индуцированной цитокином (например интерлейкин 1, 2, 3, 4, 5 или 6), обладающих активностью в отношении усиления пролиферации или ускорения дифференциации лимфоцитов, таких как Т клетки или В клетки, или проявления такой функции. Кроме того, можно оценить иммуносупрессивную активность в соответствии с ингибированием продукции этих цитокинов из Т клеток или макрофагов.
Альтернативно активность может быть оценена как активность в отношении ингибирования индукции аллогенных клеточно-специфичных цитотоксичных Т клеток, индуцированных в клетках селезенки предварительно иммунизированной мыши, например, аллогенных клеток путем внутрибрюшинного, перорального, внутривенного, внутрикожного, подкожного или внутримышечного введения соединения мышам; как активность в отношении ингибирования продукции алогенного клеточно-специфичного антитела, полученного в сыворотке крови мышей, иммунизированных аллогенными клетками или тому подобное. Активность также может быть оценена как активность в отношении ингибирования отторжения при трансплантации органов, таких как аллогенные кожа, сердце, печень, почка и так далее, или реакции "трансплантат против хозяина" (ТпХР) и реакции "хозяин против трансплантата" (ХпТР) введением соединения крысе, собаке или тому подобное. Более того, активность может быть оценена как активность в отношении ингибирования реакции гиперчувствительности замедленного типа, адъювантого артрита, экспериментальных аллергических энцефаломиелитов, экспериментальных аутоиммунных увеитов или тому подобное, путем введения соединения мыши, крысе или тому подобное.
Более того, иммуносупрессивная активность может быть оценена как активность в отношении ингибирования, например, продукции анти-ДНК антител, продукции ревматоидных факторов, нефритов, патологической прилиферации лимфоцитов или белка в моче; или макробиотического действия путем введения соединения мыши MRL/lpr, мыши NZB/Wfi, мыши BXSB, мыши NOD и тому подобное, которые представляют собой самопроизвольную модель животных с аутоиммунными заболеваниями.
Экспериментальный пример 1 (Ингибирующее действие на реакцию "хозяин против трансплантата" у крыс)
У самцов WKAH крыс в возрасте от 4 до 5 недель удаляют селезенку и используют для приготовления однородной клеточной суспензии, используя среду RPMI1640 (содержащую канамицин сульфат в концентрации 60 мкг/мл, пенициллин G калий в концентрации 100 ед/мл, N-2-гидроксиэтилпиперазин-N'-2-этансульфат в концентрации 10 мМ, 0,1% бикарбонат натрия и L-глутамин в концентрации 2 мМ). После гемолитической обработки клетки промывают три раза средой RPMI1640 и устанавливают концентрацию в 5 х 107 клеток/мл с помощью физиологического раствора для инъекции. Вызывают реакцию "хозяин против трансплантата" (ХпТ реакция) путем введения 100 мкл суспензии клеток селезенки в подушечку правой задней ноги самцов крыс LEW в возрасте 4-5 недель. Через 4 дня после введения клеток удаляют правый и левый подколенные лимфоузлы и взвешивают их. Исследуемые соединения характеризуют по разнице в массе между правым и левым подколенным лимфоузлом и выражают в виде показателя реакции ХпТ. Кроме того, спустя 4 дня после введения клеток, из хвостовой вены крыс берут кровь и измеряют количество периферических лейкоцитов, используя автоматический гемоцитометр для животных (МЕК-5158, Nihonkouden Co., Ltd.). Исследуемые соединения вводят внутривенно или перорально ежедневно в течение 4 дней после инъекции клеток.
Экспериментальный пример 2 (Ингибирующее действие на реакцию "трансплантат против хозяина" у крыс)
Существуют два типа реакций "трансплантат против хозяина" (реакция ТпХ), которые представляют собой системную и местную реакции ТпХ. Системную реакцию ТпХ вызывают внутривенным введением циклофосфамида в концентрации 150 мл/кг самкам крыс (LEWxBN)F1 в возрасте 5 недель и внутривенным введением на следующий день 5х107 клеток селезенки самок крыс LEW в возрасте 5 недель. Исследуемые соединения характеризуют путем определения времени выживания после индукции системной реакции ТпХ. Местную реакцию ТпХ вызывают подкожной инъекцией 2х107 клеток селезенки 5-недельных самцов крыс LEW в подушечку правой задней ноги самок крыс (LEWxBN)F1 в возрасте 5 недель и через 7 дней удаляют подколенные лимфоузлы и взвешивают их. Исследуемые соединения вводят перорально ежедневно в течение 30 дней и 7 дней со дня инъекции клеток в случае системной реакции и местной реакции ТпХ, соответственно.
Экспериментальный пример 3 (Ингибирующее действие на продукцию антител против эритроцитов барана у крыс)
Четырех-шестинедельных самцов крыс F344 иммунизируют внутривенным введением 1х108 эритроцитов барана. Спустя 4 дня после иммунизации удаляют селезенку и подсчитывают количество антителпродуцирующих клеток против эритроцитов барана с помощью прямого анализа образования гемолитических бляшек, используя эритроциты барана и комплемент морской свинки. В этом случае также измеряют массу тела, массу влажных тимуса и селезенки и количество клеток селезенки. Исследуемые соединения вводят перорально ежедневно в течение 4 дней после дня иммунизации.
Экспериментальный пример 4 (Ингибирующее действие на адъювантный артрит у крыс)
Убитые туберкулезные бактерии (штамм R35H5v-l, 0,5 мг) суспендируют в качестве адъюванта в 0,1 мл жидкого парафина и вводят в основание хвоста 8-недельным самцам крыс LEW. После введения адъюванта вплоть до 21 дня наблюдают наличие или отсутствие или приступ артрита и определяют день приступа артрита и соотношение случаев приступа. Периодически измеряют увеличение подушечки правой задней ноги крысы, используя прибор для измерения объема ноги (ТК-102; Neuroscience Co. , Ltd.). На 21 день делают рентгенограмму задней ноги крысы, на основании которой оценивают степень деструкции сустава. Исследуемые соединения вводят перорально или внутривенно со дня инокуляции адъюванта ежедневно в течение 21 дня.
Когда исследуемое соединение не вводят, у всех 7 крыс, инокулированных адъювантом, на день 9,6±0,5 обнаруживают артрит, вместе с увеличением задних конечностей и деструкцией сустава.
Соединения по настоящему изобретению устраняют приступ и уменьшают соотношение случаев приступа адъювантного артрита в статистически значимой степени и значительно подавляют увеличение задних конечностей и деструкцию сустава путем введения их в количестве 0,1-10 мг/кг.
Экспериментальный пример 5 (Ингибирующее действие на коллаген-индуцированный артрит у крыс)
Семи-восьминедельным самцам крыс Sprague-Dawley подкожно вводят дробно, 5 частями, 1 мл эмульсии, которую готовят смешиванием 0,1 н. раствора уксусной кислоты, содержащий бычий коллаген типа II в концентрации 2 мг/мл с Freund's неполным адъювантом при объемном соотношении 1:1. Через 7 дней проводят реиммунизацию путем подкожной инъекции эмульсии коллагена, приготовленной таким же образом, в основание хвоста. Увеличение подушечки правой задней ноги крысы периодически измеряют, используя аппарат для измерения объема ноги (ТК-102; Neuroscience Co., Ltd.).
Дополнительно, спустя 10 и 21 дней после первичной иммунизации коллагеном, кровь собирают и измеряют титр антител против коллагена типа II в сыворотке методом ELISA. Исследуемые соединения вводят перорально или внутривенно ежедневно в течение 21 дня со дня первичной иммунизации.
Экспериментальный пример 6 (Ингибирующее действие на экспериментальный аллергический энцефаломиелит у крыс)
Самок крыс LEW в возрасте восьми недель иммунизируют подкожной инъекцией в подушечку правой ноги 0,1 мл эмульсии полного адъюванта Freund, содержащего 100 мкг основного миелинового белка (ОМБ), выделенного из спинного мозга морских свинок и 100 мкг убитых микобактерий туберкулеза Н37 RA. Таким образом оценивают соматические симптомы после иммунизации в соответствии со стандартами 6 уровней.
Оценка 0: Симптомы отсутствуют.
Оценка 1: Слабость хвоста.
Оценка 2: Слабость задних конечностей.
Оценка 3: Паралич только одной задней конечности.
Оценка 4: Паралич обеих задних конечностей.
Оценка 5: Недержание мочи или смерть.
Дополнительно, через 20 дней после иммунизации МБР, у крыс удаляют спинной мозг для приготовления среза ткани и проводят гистологическое исследование после окрашивания гематоксилин-эозином. Исследуемые соединения вводят перорально ежедневно в течение 20 дней после дня иммунизации.
Экспериментальный пример 7 (Ингибирующее действие на экспериментальный аутоиммунный увеит)
Самок крыс LEW в возрасте восьми недель иммунизируют подкожной инъекцией в подушечку правой задней ноги 0,1 мл эмульсии полного адъюванта Freund, содержащего 30 мкг растворимого антигена (р-антиген), выделенного из сетчатки быка, и 100 мкг погибших микобактерий туберкулеза Н37 RA.
После иммунизации периодически проверяют приступ и степень увеита. Степень увеита оценивают в соответствии со следующими стандартами.
Оценка 0: Воспаление отсутствует.
Оценка 1: Слабое, или легкое (гиперемия радужной оболочки глаза и появление эксудата в артериальной камере).
Оценка 2: Среднее (небольшое нагноение).
Оценка 3: Сильное (заметное нагноение и экзофтальм).
Дополнительно, через 15 дней после иммунизации р-антигеном, у крыс удаляют глазные яблоки для приготовления среза ткани и гистологического исследования после окрашивания гематоксилин-эозином.
Оценка 0: Отсутствие инфильтрации клеток, ассоциированных с воспалением.
Оценка 1: Незначительная инфильтрация.
Оценка 2: Слабая или легкая инфильтрация сетчатки.
Оценка 3: Средняя инфильтрация и частичная деструкция.
Оценка 4: Значительная инфильтрация и полная деструкция сетчатки.
Исследуемые соединения вводят перорально ежедневно в течение 15 дней после дня иммунизации.
Экспериментальный пример 8 (Влияние на выживание мышей MRL/lpr в виде модели спонтанной системной красной волчанки)
Соединение (I-а) вводят перорально 16-недельным мышам MRL/MpJ-lpr/lpr, у которых спонтанно развивается системная красная волчанка, в течение 28 дней в дозе 0,03, 0,1, 0,3 и 1 мг/кг. Используя погружающийся стержень AMES для анализа мочи (полученный от фирмы Bayer Sankyo Co., Ltd.), определяли белок в моче до введения (возраст 16 недель) и на 19-ой неделе возраста. Когда содержание белка в моче было 100 мг/кг (шкала; ++) или выше, считалось, что у мышей развилась протеинурия. Результаты представлены в виде оценочной шкалы в таблице.
Как ясно показывают представленные выше данные, соединение по настоящему изобретению заметно понижает протеинурию в прямой зависимости от дозы на модели мышей со спонтанно развитой системной красной волчанкой.
Экспериментальный пример 9 (Пролонгированное действие кожного трансплантата на аллогенный кожный трансплантат у крыс)
Полнослойный кожный трансплантат (1,5 х 1,5 см) четырехнедельного самца крысы WKAH или LEW имплантируют на участок спины четырехнедельного самца крысы F344 с помощью хирургических швов. Трансплантат покрывают стерильной марлей и перевязывают. На 5 день после имплантации повязку удаляют и кожный трансплантат ежедневно осматривают до отторжения. Полагают, что кожный трансплантат отторгается, когда 90% или более эпителия кожных трансплантатов показывает некроз и становится коричневым. Количество дней со дня пересадки до отторжения рассматривают как дни выживания трансплантата. Исследуемые соединения вводят внутрибрюшинно, внутривенно или перорально регулярно один раз в день в течение 14 дней.
Контрольной группе вводят только наполнитель, показатель времени выживания для трансплантации кожи крыс WKAH крысам F344 составляет 7,0±0,0 дней. Результаты, полученные при пероральном введении соединения (I-а) по настоящему изобретению в дозе 1 мг/кг или 10 мг/кг, показаны на фиг. 1. Соединение сравнения 1 представляет собой 2-амино-2-(2-(4-(4-фенилбутилокси)фенил)этил)пропан-1,3-диол, описанный в WО94/08943, соединение сравнения 2 представляет собой 2-амино-2-метил-2-(2-(4-(4-фенилбутилокси)фенил)бутанол, описанный в WО96/06068.
Как показано на фиг. 1, показатель времени выживания группы, получающей соединение по настоящему изобретению при трансплантации кожи крысы WKAH крысе F344, составляет 16,6±1,2 дней, и показатели времени выживания сравниваемого производного 1 и сравниваемого производного 2, составляют 11,9±0,7 дней и 15,6±1,4 дней, соответственно. Соединение по настоящему изобретению статистически значимо увеличивает время выживания трансплантата по сравнению с контрольной группой и группой соединения сравнения 1. Оно показывает пролонгирующее влияние, эквивалентное соединению сравнения 2.
Показатель времени выживания кожных трансплантатов крыс LEW крысам F344 составляет 8,2±0,4 дней, тогда как при введении соединения (I-а) по настоящему изобретению составляет 20 дней или более, таким образом показывая статистически значимый пролонгированный эффект по сравнению с контрольной группой, получавшей только наполнитель.
Экспериментальный пример 10 (Изменение массы тела на аллогенном кожном трансплантате у крыс)
Изменения массы тела крыс в экспериментальном примере 12 по исследованию аллогенного кожного трансплантата у крыс, после 13 дней последовательного многократного перорального введения 10 мг/кг исследуемых производных показано на фиг. 2.
Как показано на фиг. 2, группа, получавшая соединение по настоящему изобретению, показала естественное увеличение веса тела, как и контрольная группа, тогда как, группа, получавшая соединение сравнения 1, и группа, получавшая соединение сравнения 2, показали подавляющее влияние на увеличение массы тела, что характерно для заболеваний гастроинтестинальных органов и к тому же присуще заболеваниям, связанным с усвоением пищи. В результате есть опасность серьезных побочных эффектов, таких как нарушение в усвоении пищи, ввиду увеличения дозы и длительности периода последовательного введения, и в последующем, эмбриональные влияния. Для сравнения, группа, получавшая соединение по настоящему изобретению, показала подобное увеличение массы тела, как и контрольная группа, что указывает на то, что соединение по настоящему изобретению является высокобезопасным иммуносуппрессантом с уменьшенной токсичностью, и у него отсутствуют вышеуказанные побочные эффекты.
Экспериментальный пример 11 (Пролонгирующее действие на выживание трансплантата кардиального трансплантата на аллогенном кардиальном трансплантате у крыс)
Сердце самцов крыс WKAH в возрасте 10 до 14 недель гетеротопически трансплантировали в подкожную область шеи самцов крыс AC1/N в возрасте 10 до 14 недель, используя сосудистый анастомоз. Трансплантированное сердце считают отторгнутым в случае прекращения сердечных ударов, затем определяют время выживания. Исследуемые соединения вводят перорально многократно в течение 15 дней со дня трансплантации.
Экспериментальный пример 12 (Пролонгирующее действие на выживание ренального трансплантата на аллогенном ренальном трансплантате у собак)
Дворняжек и гончих собак используют в качестве доноров и реципиентов, соответственно, и затем изучают пролонгирующее действие на выживание трансплантированной почки, проводя хирургическую ренальную трансплантацию. После трансплантации у трансплантированных животных периодически берут кровь для измерения уровней сывороточного креатинина и азота мочевины крови (АМК).
Экспериментальный пример 13 (Ингибирование реакции бластогенеза клеток селезенки крысы, индуцированной стимуляцией консанавалином А)
Ингибирующее действие на реакцию бластогенеза клеток селезенки крысы, индуцированной стимуляцией консанавалином, изучают следующим способом.
У самцов крыс F344 в возрасте 4-10-недель удаляют селезенку. Удаленную селезенку вскрывают ножницами и фильтруют через среду RPMI1640, дополненную 10% ФСТ, используя сетку из нержавеющей стали, с получением однородной клеточной суспензии из клеток селезенки. После гемолитической обработки клетки селезенки пропускают через колонку и собирают неадгезированные клетки. Собранные найлон неадгезированные клетки (5 х 106 клеток/мл) культивируют в среда RPMI1640, содержащей 5 мкг/мл консанавалина А, 5 х 10-5 М 2-меркаптоэтанола и 10% ФСТ при 37oС в 5% CO2 - 95% воздухе в течение 72 часов. Добавляют 3H-тимидин 18,5 KBq/лунку и клетки культивируют в течение 4 часов. Клетки собирают на харвестере клеток и определяют радиоактивность клеток с помощью жидкостного сцинтилляционного счетчика, и используют в качестве показателя бластогенеза клеток селезенки крысы.
Соединения по настоящему изобретению показывают значение ИK50 (концентрация для ингибирования 50%) от около 1 нМ до около 50 нМ в реакции бластогенеза клеток селезенки крысы, индуцированного стимуляцией консанавалином А.
Промышленная применимость
Различными фамакологическими испытаниями, включенными в вышеуказанные экспериментальные примеры, и токсикологическими испытаниями доказано, что соединение (I) по настоящему изобретению, его фармацевтически приемлемая соль добавления кислоты и гидрат показывают высокую иммуносупрессивную активность без ингибирующего действия на увеличение массы тела, что связано с серьезными побочными эффектами, и могут использоваться в качестве превосходных иммуносупрессантов с небольшой токсичностью и высокой безопасностью. Более того, соединение (II) и соединение А по настоящему изобретению могут использоваться как промежуточные продукты для синтеза соединения (I), которое может использоваться в качестве иммуносупрессанта.
Настоящая заявка основана на патентной заявке 86255/1997, поданной в Японии, содержание которой включено здесь в качестве ссылки.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИННОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ЦЕЛЯХ | 2006 |
|
RU2433117C2 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ ТИОФЕНА, ПРОИЗВОДНОЕ БЕНЗОТИОФЕНА, ПРОИЗВОДНОЕ ТИЕНОБЕНЗОКСАЗЕПИНОНА, ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2197491C2 |
| СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TRPM8 | 2012 |
|
RU2563030C2 |
| БЕНЗИМИДАЗОЛЬНОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2008 |
|
RU2451017C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1999 |
|
RU2204387C2 |
| ПРОИЗВОДНОЕ АМИДА ИНДАЗОЛАКРИЛОВОЙ КИСЛОТЫ | 2008 |
|
RU2444515C2 |
| НОВОЕ АНТИТРОМБОТИЧЕСКОЕ СРЕДСТВО | 2010 |
|
RU2570426C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛОПИРИМИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE10 | 2011 |
|
RU2543386C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ЦИКЛИЧЕСКОГО АМИДА | 2001 |
|
RU2257384C2 |
| ПРОИЗВОДНЫЕ АЗОЛОВ | 2012 |
|
RU2622639C2 |


Описывается производное 2-аминопропан-1,3-диола общей формулы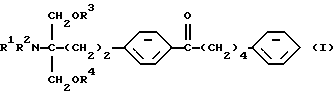
где R1, R2, R3 и R4 одинаковы или различны, и каждый обозначает водород или прямой или разветвленный алканоил, содержащий от 1 до 6 атомов углерода; его фармацевтически приемлемая соль добавления кислоты или гидрат; фармацевтическая композиция, обладающая иммуносупрессивной активностью; 2-амино-2-(2-(4-(1-гидрокси-5-фенилпентил)фенил)этил) пропан-1,3-диол или его производное, где аминогруппа защищена алифатической ацильной группой и/или гидроксигруппа защищена трет-бутилдиметилсилильной группой, а также 2-амино-2-(2-(4-формилфенил)этил)-пропан-1,3-диол, его производное, где аминогруппа и/или гидроксигруппа защищены алифатической группой и/или гидроксигруппа защищена трет-бутилдиметилсилильной группой. Ввиду небольшой токсичности, высокой безопасности и иммуносупрессивного действия, эти производные могут использоваться в качестве предупреждающих или подавляющих реакцию отторжения при пересадке органов и для профилактики или лечения различных аутоиммунных заболеваниях, различных аллергических заболеваний. 4 с. и 5 з.п. ф-лы, 2 ил., 1 табл.
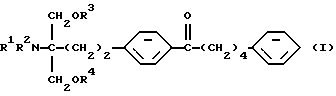
где R1, R2, R3 и R4 одинаковы или различны, и каждый обозначает водород или прямой или разветвленный алканоил, содержащий от 1 до 6 атомов углерода;
его фармацевтически приемлемая соль добавления кислоты или гидрат.
| WO 9606068 A1, 29.02.1996 | |||
| WO 9408943 A1, 28.04.1994 | |||
| ИММУНОСУПРЕССИВНАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1991 |
|
RU2084222C1 |
Авторы
Даты
2003-02-10—Публикация
1998-04-03—Подача