Изобретение относится к области микробиологии и биотехнологии и предназначено в целях специфической профилактики пастереллеза птиц.
В 1886 г. Л. Пастером впервые предложена вакцина, вызывающая у птиц специфический иммунитет против возбудителя "холеры" (пастереллеза). Известно, что вакцина живая, изготавливается она и в нашей стране (Вет. законодательство под общ. ред. А.Д. Третьякова. М.: Колос, 1972. Т.1. С.591. "Инструкция по изготовлению и контролю сухой авирулентной вакцины против пастереллеза птиц", утв. ГУВ МСХ СССР 27.05.1964 г.). Наряду с ней биопромышленность производит отечественные живые вакцины из штаммов "АВ" и "К" Краснодарской НИВС ("Наставление по применению...", утв. ГУВ Госагропрома СССР 27.05.1987 г. ). Поскольку живые вакцины вызывают у птиц нестерильный иммунитет, а также осложнения и даже реинфекцию, применение их экологически небезопасно и должно быть ограничено (Е.М. Кожевников, 1973, 1974, 1975; И. А. Болотников, 1982). Вместе с тем, за прошедший более вековой период предложено много вариантов убитой вакцины, но они поочередно отвергнуты практикой. В том числе и производство отечественных убитых вакцин в варианте на полную микробную клетку, заключенную посредством эмульгатора в водно-масляную эмульсию, прекращено с 01.01.1987 г. (Приказ 95 от 12.12.1996 г. ГУВ Госагропрома СССР). Их существенные недостатки: значительная вязкость, реактогенность, слабая иммуногенность. Известно, что для улучшения свойств убитых вакцин предложена менее вязкая и более стабильная эмульгирующая масляная основа - "Адъювант для противопастереллезной вакцины" (А.с. 1667868 от 08.04.1991 г. ). Кроме того, предложен и способ получения убитой противопастереллезной вакцины, в состав которой входят инактивированные пастереллы и этот же адъювант (Патент РФ 1839092 от 30.12.1993 г. Бюл. 48-47) - прототип. Существенным недостатком этого способа являются неточные условия стандартизации и выращивания микробной клетки контрольно-производственного штамма пастерелл при изготовлении и контроле вакцины, вследствие чего она неполноценна по антигенным и иммуногенным свойствам. Поскольку микроб весьма вариабелен, причем в природе ослабляет и усиливает (восстанавливает) свою вирулентность спонтанно, стандартизировать его штамм бактерий по существующим лабораторным методикам обычно не представляется возможным. Принято считать, что утрата или же восстановление вирулентности и, как правило, капсулы капсульного антигена (К-антигена), а также иммуногенности пастерелл сопровождается диссоциацией их микробной клетки, выявляемой по изменению колоний (S-, М-, R-формы и SR-переходная форма) (G.R. Carter. 1955, 1957, 1958, 1972; А. Н. Борисенкова, 1979). Однако условия диссоциации пастерелл почти не известны. Наряду с тем, что капсулу (К-антиген) выделяют как фактор патогенности и наиболее иммуногенную часть микробной клетки (И.В. Домарадский, 1971; А.Н. Борисенкова, 1979; М.А. Сидоров, Э.М. Агаева, 1982), взаимосвязь ее с вирулентностью микроба не всегда подтверждается (Р.Е. Curtis, C.E. Ollerhead, C. E. Ellis, 1980). Согласно же рекомендованному стандарту серовар штаммов бактерий возбудителя пастереллеза (Pasteurella multocida) принято выявлять и обозначать по капсульному (К-, буквой) и соматическому (0-, цифрой) антигенам микробной клетки (G.R. Carter, M.M. Chengappa, 1981). В итоге серологической идентификации микроорганизмов коллекции ВГНКИ ветпрепаратов, выделенных на территории южной и средней полосы бывшего государства СССР с глубиной прошедшего времени около 60 лет, а также микроорганизмов собственной коллекции, выделенных из эпизоотических очагов в южном регионе России, стало известно, что наиболее типичным возбудителем пастереллеза птиц являются бактерии Pasteurella multocida А:I серовара (В.В. Каширин, 1985, 1986, 1988). Однако даже наиболее капсулообразующий сильновирулентный штамм пастерелл А: I серовара, многократно проведенный через восприимчивый организм с учетом селективного отбора по S-форме колоний и предложенный нами в качестве контрольно-производственного (А.с. 1440025 от 22.07.1988 г.), оставался тем же вариабельным и вопрос о точности условий стандартизации микроорганизма так и не решен. В целях же восстановления капсулы, К-антигена, вирулентности и иммуногенности штаммов пастерелл в лабораторной практике по-прежнему продолжают заражать восприимчивые организмы (обычно по источнику происхождения бактерий) с последующей лиофилизацией выделенных микробных культур ("Вет. препараты". М., 1981, с.238). Однако при попытках восстановить биологические свойства штаммов пастерелл путем пассажа через восприимчивый организм получаемые результаты не идентичны и обычно не соответствуют своему стандарту по паспорту. Вполне очевидно, что условия биологического принципа восстановления (стандартизации) свойств штаммов пастерелл не известны и это сказывается проблематично на качестве изготовления, объективности контроля и эффективности применения убитых вакцин.
В предыдущей работе, заключающейся в повышении точности условий выявления и выделения пастерелл (Патент РФ 2005790 от 15.01.1994 г., Патент РФ 2051970 от 10.01.1996 г.), в объяснении феномена биполярности пастерелл при размножении в организме и трупах птиц (Ж. "Доклады Россельхозакадемии", 1996, 5, с.32-35), в установлении условий повышения (восстановления) вирулентности пастерелл (Патент РФ 2123531 от 20.12.1998 г.), показана взаимосвязанная инфекционная природа пастерелл в капсульном и бескапсульном вариантах микробной клетки в зависимости от температуры окружающей среды. Пастереллы при аппликации на слизистую верхних дыхательных путей, как основного места их природной локализации при бактерионосительстве и внедрения в парентеральную среду восприимчивого организма, быстро декапсулируют и каждый "биполяр" распадается на две коккобактерии. Коккобактерии, размножаясь в организме, выделяют капсульный антиген в окружающие ткани, но при температуре тела зараженного не капсулируются до конца инфекционного процесса. Инкапсуляция, биполярность и вирулентность пастерелл развиваются синхронно по мере остывания трупа до полного окоченения, после чего постепенно нарастает полиморфизм и ослабляется вирулентность бактерий. Ввиду морфо- и термолабильности пастерелл нами апробирован определенный стандарт условий биологического принципа восстановления свойств штаммов пастерелл. В итоге стал известен ответ на давний и весьма актуальный вопрос П.В. Сизова (1931) о "парадоксе вирулентности возбудителя пастереллеза" и о распространении заболевания в регионах обычно с теплым и умеренным климатом, причем особенно в период дождей и резких похолоданий. Вместе с тем считаем, что свойство морфо- и термолабильности пастерелл целесообразно использовать при получении маточных (посевных) бактерий и при выращивании их биомассы в капсульном и бескапсульном вариантах микробной клетки для приготовления и контроля убитой вакцины.
Задачей изобретения является получение убитой противопастереллезной вакцины на полную микробную клетку путем повышения точности условий стандартизации и выращивания штамма пастерелл, приготовления и применения антигена из капсульной и бескапсульной микробной клетки пастерелл.
Поставленная задача достигается тем, что в вакцину включают в равных частях по объему убитые пастереллы в капсульном и бескапсульном вариантах стандартизированной микробной клетки первой генерации после изоляции из организма птицы. С этой целью контрольно-производственным штаммом пастерелл, восстановленным по способу повышения вирулентности пастерелл (патент РФ 2123531 от 20.12.1998 г. ), заражает орально восприимчивый организм и из крови сердца в момент смерти зараженного отмывают в подогретом забуференном физрастворе хлористого натрия (рН 7,0; 35-40oС) маточные бескапсульные бактерии, а сразу же после остывания и окоченения трупа при 15-25oС (оптимум 20oС) окружающей среды (через 3-4 посмертных часа в зависимости от живой массы тела зараженного) - маточные капсульные бактерии, которые соответственно засевают в отдельности на подогретый до 37-38oС бульон Хоттингера (рН 7,2-7,4) и непрерывно культивируют на идентичной по качеству и температуре питательной среде. В 9-10-часовом возрасте каждой культуры пастерелл соответственно сливают по половине объема в отдельные стерильные емкости и постепенно охлаждают 2-3 ч при 15-25oС (оптимум 20oС) окружающей среды до полной инкапсуляции микробных клеток в состоянии покоя. В остывшие половины культур инкапсулированных и в непрерывно культивируемые половины культур бескапсульных пастерелл одновременно вносят формалин в конечной концентрации 0,3% и сразу же бактерии концентрируют центрифугированием. Сконцентрированную бакмассу соответственно капсульных и бескапсульных пастерелл объединяют в равных частях по объему и из полученного готовят рабочую взвесь вакцинного антигена в забуференном физрастворе хлористого натрия при 0,3%-ной концентрации формалина из расчета 30 млрд. м.к./мл. Рабочую взвесь антигена смешивают с известным масляным адъювантом в равном соотношении по объему и применяют в качестве вакцины.
Существенным отличием является то, что вакцина в качестве полноценного иммуногенного антигена задержит в равных частях по объему убитые пастереллы в капсульном и бескапсульном вариантах стандартизированной микробной клетки первой генерации после изоляции из организма птицы. Существенным отличием способа получения убитой вакцины является то, что контрольно-производственным штаммом пастерелл, восстановленным по способу повышения вирулентности пастерелл (патент РФ 2123531 от 20.12.1998 г.), заражают орально восприимчивый организм и из крови сердца в момент смерти зараженного отмывают в подогретом забуференном физрастворе хлористого натрия (рН 7,0; 35-40oС) маточные бескапсульные бактерии, а сразу же после остывания и окоченения трупа при 15-25oС (оптимум 20oС) окружающей среды (через 3-4 посмертных часа в зависимости от живой массы тела зараженного) - маточные капсульные бактерии, которые соответственно засевают в отдельности на подогретый до 37-38oС бульон Хоттингера (рН 7,2-7,4) и непрерывно культивируют на идентичной по качеству и температуре питательной среде. В 9-10-часовом возрасте каждой культуры пастерелл соответственно сливают по половине объема в отдельные стерильные емкости и постепенно охлаждают 2-3 ч при 15-25oС (оптимум 20oС) окружающей среды до полной инкапсуляции микробных клеток в состоянии покоя. В остывшие половины культур инкапсулированных и в непрерывно культивируемые половины культур бескапсульных пастерелл одновременно вносят формалин в конечной концентрации 0,3% и сразу же бактерии концентрируют центрифугированием. Сконцентрированную бакмассу соответственно капсульных и бескапсульных пастерелл объединяют в равных частях по объему и из полученного готовят рабочую взвесь вакцинного антигена в забуференном физрастворе хлористого натрия при 0,3%-ной концентрации формалина из расчета 30 млрд. м.к./мл, которую смешивают с известным масляным адъювантом в равном соотношении по объему и используют в качестве вакцины.
Сведения, подтверждающие возможность осуществления изобретения.
В исследованиях применяли типичный возбудитель пастереллеза птиц Pasteurella multocida A: 1 серовара, как наиболее распространенный и повсеместно вызывающий заболевание (по нашим данным в 89% случаев энзоотий). В частности, использовали известный контрольно-производственный штамм пастерелл ВГНКИ 55 (А.с. 1440025 от 22.07.1988 г.). Микроорганизм выделен в 1982 г. из трупа курицы при сверхостром течении болезни в одном из очагов пастереллеза на территории Ростовской области. Его свойства изучали посредством световой микроскопии и биологической пробы. Агглютинабельность его К-антигена изучали в реакции непрямой гемагглютинации (РНГА). В качестве лабораторной биомодели для заражения штаммом пастерелл использовали голубей и подрощенных цыплят живой массой тела 320-340 г. Препараты для микроскопии окрашивали по Гипсу, Романовскому-Гимза, Граму. Опытную вакцину получали с учетом морфологии и вирулентности пастерелл и агглютинабельности их К-антигена. При этом избранный нами прототип служил базовым вариантом совершенствования технологии биофабричного производства убитой вакцины, в который вносили свои изменения и дополнения. Поскольку возбудитель пастереллеза при естественном пути заражения птицы быстро утрачивает капсулу и в качестве бескапсульной коккобактерии продуцирует токсическое капсульное вещество в окружающие ткани и вызывает гибель организма, а при снижении температуры культивирования в трупе инкапсулируется вновь, то и изоляты маточных бактерий, антигены на полную микробную клетку (бактерины), а также опытную вакцину получали и изучали в соответствующих вариантах микробной клетки пастерелл. Иммуногенность экспериментальных биопрепаратов изучали на курах. Напряженность иммунитета у привитых кур определяли при внутримышечном заражении минимальной смертельной дозой (ЛД100) гомологичного штамма пастерелл в варианте микробной клетки, соответственно содержащейся в испытуемом биопрепарате. По результатам, полученным в биопробе, рассчитывали коэффициент иммунологической эффективности (КИЭ, %). По величине КИЭ (%) судили об иммуногенности экспериментальных биопрепаратов.
Пример 1
Получали маточные (посевные) пастереллы в бескапсульном варианте микробной клетки с наиболее выраженной патогенностью, выращенные в восприимчивом организме. С этой целью контрольно-производственный штамм пастерелл восстанавливали по способу повышения вирулентности пастерелл (патент 2123531 от 20.12.1998 г. ) и сразу же заражали орально голубя на слизистую в области небной щели. Заражающий материал - кровь из сердца трупа птицы, предельно остывшего при 15-25oС (оптимум 20oС) окружающей среды через 3-4 посмертных часа. Объемная доза заражающего материала при инфицировании голубя - 0,1 мл. С момента заражения и по момент гибели птицы через каждые 2 ч брали из подкрыльцовой вены пробы инфицированной крови, которыми в дозе 0,1 мл сразу же заражали внутримышечно интактных голубей на предмет уточнения патогенности гемокультуры бескапсульных пастерелл. В пятикратной повторности биопробы выяснено, что гемокультура бескапсульных пастерелл в своем возрастном порядке выделения от орально зараженной птицы различна по вирулентности. Так, пробы ее, взятые через 2 и 4 ч после заражения птицы, были непатогенные для интактных птиц (переболевали и оставались живы в течение 4 суток - срок наблюдений), а через 6 и 8 ч - слабовирулентные (птицы были угнетены и погибали в биопробе не ранее чем через 48 ч после заражения), через 10 и 12 ч - средневирулентные (птицы были угнетены и погибали в биопробе через 24-27 ч после заражения). Однако проба гемокультуры бескапсульных пастерелл из организма в момент его смерти, то есть через 12 ч 15 мин после заражения, вызывала гибель интактных птиц в течение 18-24 ч с выраженной клиникой пастереллеза, в связи с чем признана более вирулентной из числа изученных. Вирулентные бескапсульные микробные клетки, отмытые посредством центрифугирования от форменных элементов крови, морфологически не отличались в забуференном физрастворе хлористого натрия (рН 7,0) при 0-40oС окружающей среды в течение 5 ч с момента изоляции (диапазон температуры и срок наблюдений). Пастереллы из крови сердца в момент смерти орально зараженной птицы, отмытые в подогретом забуференном физрастворе хлористого натрия (рН 7,0; 35-40oС), являясь наиболее вирулентными в бескапсульном варианте микробной клетки, избраны в качестве маточных (посевных) бескапсульных бактерий.
Пример 2
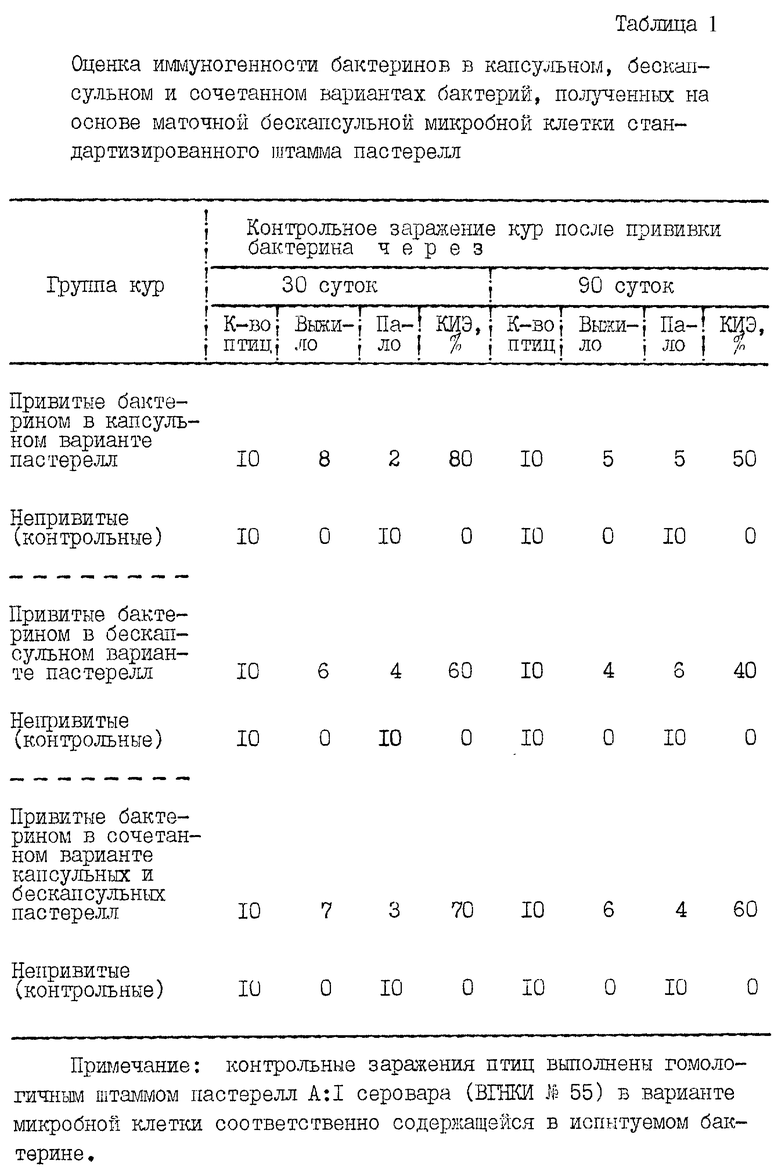
Применяли маточные бескапсульные пастереллы для приготовления и изучения бактеринов соответственно в капсульном, бескапсульном и сочетанном (капсульном и бескапсульном) вариантах микробной клетки. Так, из крови сердца в момент смерти орально зараженной птицы отмывали посредством центрифугирования в подогретом забуференном физрастворе хлористого натрия (рН 7,0; 35-40oС) маточные бескапсульные пастереллы, которые сразу же высевали на подогретый до 37-38oС бульон Хоттингера (рН 7,2-7,4) и при этой температуре окружающей среды непрерывно культивировали их в нужном объеме. В 9-10-часовом возрасте культуры пастерелл сливали половину ее объема, которую постепенно охлаждали в течение 2-3 ч при 15-25oС (оптимум 20oС) окружающей среды до полной инкапсуляции микробных клеток в состоянии покоя. В остывшую половину культуры инкапсулированных пастерелл и в непрерывно культивируемую половину культуры бескапсульных пастерелл одновременно вносили формалин в конечной концентрации 0,3% и сразу же бактерии концентрировали центрифугированием. Из сконцентрированной бакмассы соответственно капсульных и бескапсульных пастерелл в отдельности готовили их взвесь в забуференном физрастворе хлористого натрия (рН 7,0) при 0,3%-ной концентрации формалина из расчета 20 млрд. м.к./мл и изучали в качестве испытуемых бактеринов. Для получения испытуемого бактерина в сочетанном варианте микробной клетки объединяли в равных частях по объему сконцентрированную бакмассу соответственно капсульных и бескапсульных пастерелл и также готовили взвесь из расчета 20 млрд. м.к./мл. Бактерины изучали на контаминацию посторонней микрофлорой и стерильность. Неконтаминированные и стерильные бактерины изучали на безвредность и иммуногенность для кур. Кур прививали в области верхней трети шеи подкожно, дважды с интервалом 10 суток. Напряженность иммунитета у птиц устанавливали в биопробе при внутримышечном заражении ЛД100 гомологичного штамма пастерелл (в варианте микробной клетки, соответственно содержащейся в испытуемом бактерине) через 30 и 90 суток после прививок. Результаты этих исследований представлены в табл. 1. Установленное свидетельствует об иммуногенности испытуемых бактеринов. В целом КИЭ (%) на протяжении 90 суток после прививок бактеринов был равен от 40 до 90%. При этом бактерин в сочетанном варианте приготовления из капсульных и бескапсульных пастерелл, выращенных на основе маточной бескапсульной микробной клетки стандартизированного штамма, вызывал у кур более устойчивый иммунитет, равный по КИЭ (%) от 60 до 70% в течение 90 суток (срок наблюдений). Поэтому бактерин в таком варианте приготовления целесообразно применить для получения опытной вакцины против пастереллеза птиц.
Пример 3
Получали маточные (посевные) пастереллы в капсульном варианте микробной клетки с наиболее выраженной патогенностью, иммуногенностью и агглютинабельным К-антигеном, выращенные в восприимчивом организме. Поскольку пастереллы при температуре тела в живом организме без капсулы, а с момента гибели его и постепенного снижения температуры тела инкапсулируются, материалом для выделения и изучения капсульных бактерий служили пробы крови из сердца трупа птицы, которые брали в определенное посмертное время. С этой целью контрольно-производственный штамм пастерелл восстанавливали по способу повышения вирулентности пастерелл (патент РФ 2123531 от 20.12.1998 г.) и им в качестве гемокультуры бактерий, отобранной из сердца трупа голубя массой тела 320-340 г, постепенно остывшего при 20oС (оптимальный параметр) окружающей среды через 3 посмертных часа, в дозе 0,1 мл сразу же заражали орально аналогичного по массе тела интактного голубя на слизистую в области небной щели. В момент гибели зараженной птицы и соответственно через 3, 6 и 8 ч после смерти брали из сердца трупа, постепенно остывшего при 20oС окружающей среды, пробы крови с наличием выращенных в организме пастерелл. У этих бактерий выявляли капсулу, устанавливали патогенность и определяли вирулентность по общепринятым методикам. Кроме того, из испытуемых проб крови, сразу же после их взятия, соответственно изолировали пастереллы, которые высевали на агар Хоттингера, культивировали при 37-38oС. Из 12-часовых агаровых культур получали К-антигены, которые изучали на агглютинабельность в РНГА по методикам G. R. Carter (1955, 1965), А.Н. Борисенковой и И.А. Болотникова (1982). Об агглютинабельности К-антигена каждого испытуемого изолята пастерелл судили по предельному титру в РНГА. Наряду с этой работой готовили из таких же агаровых культур пастерелл бактерины, которые изучали на иммуногенность для кур. Кур прививали двукратно с интервалом 10 суток, подкожно в области верхней трети шеи, в дозе 20 млрд. убитых м.к./мл. Напряженность иммунитета у птиц устанавливали в биопробе против ЛД100 гомологичного штамма пастерелл и по полученным результатам рассчитывали КИЭ (%). По величине КИЭ (%) судили об иммуногенности бактеринов. В исследованиях установлено, что выращенные в организме птицы пастереллы отличаются в ее трупе на протяжении посмертного времени биологическими свойствами. Морфология пастерелл в препаратах, приготовленных из изучаемых проб крови, аналогична описанной в патенте РФ 2051970, опублик. 01.1996 г. При этом патогенность и вирулентность их аналогичны описанным в патенте РФ 2123531, опублик. 12.1998 г. Так, в случае заражения птицы естественным путем, например, орально, при живой массе тела 320-340 г и 20oС окружающей среды (оптимум) установили, что пастереллы выраженно инкапсулированы и при этом наиболее вирулентны в крови из сердца трупа с 3 по 4 посмертный час. Кроме того, К-антиген 12-часовых агаровых культур пастерелл, разных по сроку выделения из трупа орально зараженной птицы, например, в момент гибели организма, через 3 и 8 посмертных часа, отличался по агглютинабельности и титры в РНГА были 1:160, 1:640 и 1: 160 соответственно. При этом иммуногенность бактеринов, приготовленных из штамма пастерелл, выделенного из того же трупа в момент гибели птицы, через 3 и 8 посмертных часа, по КИЭ (%) соответствовала 40, 80 и 40%. Исходя из установленного, выраженно инкапсулированные и при этом наиболее вирулентные, иммуногенные, с агглютинабельным К-антигеном пастереллы отмывали от форменных элементов крови посредством центрифугирования в забуференном физрастворе хлористого натрия (рН 7,0) и изучали на изменчивость морфологии в зависимости от температуры окружающей среды. Выяснено, что отмытые и изолированные в забуференном физрастворе хлористого натрия (рН 7,0) инкапсулированные микробные клетки морфологически не изменялись при 0-40oС окружающей среды в течение 5 ч (диапазон и срок наблюдений). Результаты исследований воспроизведены при трехкратной постановке опыта. Таким образом, выраженно инкапсулированные, наиболее вирулентные и иммуногенные, с агглютинабельным К-антигеном микробные клетки стандартизированного штамма пастерелл, изолированные из крови сердца трупа птицы живой массой тела 320-340 г, постепенно остывшего через 3 ч после смерти при 20oС окружающей среды (оптимум), в подогретом забуференном физрастворе хлористого натрия (рН 7,0; 35-40oС) избраны в качестве маточных (посевных) в капсульном варианте.
Пример 4
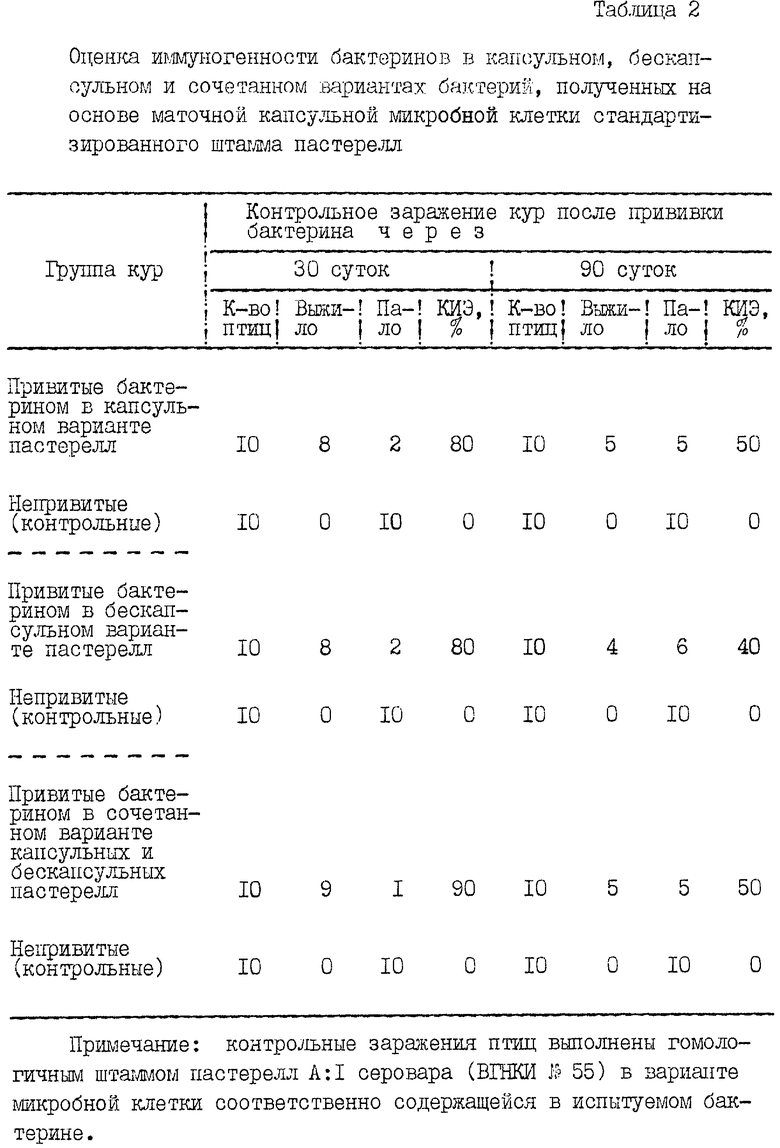
Применяли маточные капсульные пастереллы для приготовления и изучения бактеринов соответственно в капсульном, бескапсульном и сочетанном (капсульном и бескапсульном) вариантах микробной клетки. Так, из крови сердца трупа орально зараженной птицы живой массой тела 320-340 г, постепенно остывшего через 3 ч после смерти при 20oС окружающей среды (оптимум), отмывали посредством центрифугирования в подогретом забуференном физрастворе хлористого натрия (рН 7,0; 35-40oС) маточные капсульные пастереллы, которые сразу же засевали на подогретый до 37-38oС бульон Хоттингера (рН 7,2-7,4) и при этой температуре непрерывно культивировали их в нужном объеме. В 9-10-часовом возрасте культуры пастерелл сливали половину ее объема, которую постепенно, предельно охлаждали в течение 2-3 ч при 20oС окружающей среды (оптимум) до полной инкапсуляции микробных клеток в состоянии покоя. В остывшую половину объема культуры инкапсулированных пастерелл и в непрерывно культивируемую половину объема культуры бескапсульных пастерелл одновременно вносили формалин в конечной концентрации 0,3% и сразу же бактерии концентрировали центрифугированием. Из сконцентрированной бакмассы соответственно капсульных и бескапсульных пастерелл в отдельности готовили их взвесь в забуференном физрастворе хлористого натрия (рН 7,0) при 0,3%-ной концентрации формалина из расчета 20 млрд. м.к./мл и изучали в качестве испытуемых бактеринов. Для получения испытуемого бактерина в сочетанном варианте микробной клетки объединяли в равных частях по объему сконцентрированную бакмассу соответственно капсульных и бескапсульных пастерелл и также готовили взвесь из расчета 20 млрд. м.к./мл. Бактерины изучали на контаминацию посторонней микрофлорой и стерильность. Неконтаминированные и стерильные бактерины изучали на безвредность и иммуногенность для кур. Кур прививали в области верхней трети шеи подкожно, дважды с интервалом 10 суток. Напряженность иммунитета у птиц устанавливали в биопробе при внутримышечном заражении ЛД100 гомологичного штамма пастерелл (в варианте микробной клетки, соответственно содержащейся в испытуемом бактерине) через 30 и 90 суток после прививок. Результаты этих исследований приведены в табл.2. Установленное свидетельствует об иммуногенности испытуемых бактеринов. В целом КИЭ (%) на протяжении 90 суток после прививок бактеринов был равен от 40 до 90%. При этом бактерин в сочетанном варианте приготовления из капсульных и бескапсульных пастерелл, выращенных на основе маточной капсульной микробной клетки стандартизированного штамма, вызывал у кур более устойчивый иммунитет, равный по КИЭ (%) от 50 до 90% в течение 90 суток (срок наблюдений). Поэтому бактерин в таком варианте приготовления также целесообразно применить для получения опытной вакцины против пастереллеза птиц.
Пример 5
Готовили лабораторную серию опытной масляной убитой вакцины из пастерелл в капсульном и бескапсульном вариантах микробной клетки стандартизированного штамма бактерий и определяли безвредную оптимально-иммунизирующую дозу ее для кур. Маточные бескапсульные и маточные капсульные микробные клетки пастерелл получали на основе установленного, описанного в примерах 1 и 3. Их высевали в отдельности на подогретый до 37-38oС бульон Хоттингера (рН 7,2-7,4), непрерывно культивировали и соответственно засевали на идентичную по качеству и температуре культивирования питательную среду 1:10 по объему в нужном количестве. Половину объема каждой выращенной культуры бактерий 9-10-часового возраста сливали в отдельную стерильную емкость для постепенного, предельного охлаждения в течение 2-3 ч при 20oС (оптимум) окружающей среды до полной инкапсуляции микробных клеток в состоянии покоя. В остывшие половины культур инкапсулированных и в непрерывно культивируемые половины культур бескапсульных пастерелл одновременно вносили формалин в конечной концентрации 0,3% и сразу же бактерии концентрировали центрифугированием. Сконцентрированную бакмассу соответственно капсульных и бескапсульных пастерелл объединяли в равных частях по объему и из полученного готовили рабочую взвесь вакцинного антигена в забуференном физрастворе хлористого натрия при 0,3%-ной концентрации формалина. Рабочую взвесь антигена смешивали с известным масляным адъювантом (А.с. 1667868 от 08.04.1991 г.) в равном соотношении по объему, составляя испытуемые иммунизирующие дозы опытного биопрепарата из расчета на 5, 10, 15, 20 и 25 млрд. м.к./мл. В этих дозах соответственно прививали однократно, подкожно (в области верхней трети шеи) по 5 кур. При этом курам контрольной группы аналогично вводили забуференный физраствор хлористого натрия (рН 7,0) при 0,3%-ной концентрации формалина и в смеси с тем же масляным адъювантом 1:1 по объему в дозе по 1 мл. За вакцинированной и контрольной (невакцинированной) птицей вели клинические наблюдения 30 суток, после чего у нее определяли напряженность специфического иммунитета против ЛД100 гомологичного штамма пастерелл (в варианте микробной клетки, соответственно содержащейся в опытной вакцине) при внутримышечном заражении. Результаты биопробы учитывали 10 суток и рассчитывали КИЭ (%). Установлено, что КИЭ (%) по вышеперечисленным испытуемым дозам опытной вакцины для кур соответственно равен 0, 40, 80, 80 и 80% при 100% гибели птиц контрольной группы. Исходя из подученных результатов биопробы, а также с учетом результатов клинических наблюдений, патологоанатомического вскрытия и бактериологических исследований павших и вынужденно убитых кур, вышедших из опытов, в качестве безвредной оптимально-иммунизирующей дозы опытной масляной убитой вакцины избрана доза 15 млрд. м.к./мл.
Пример 6
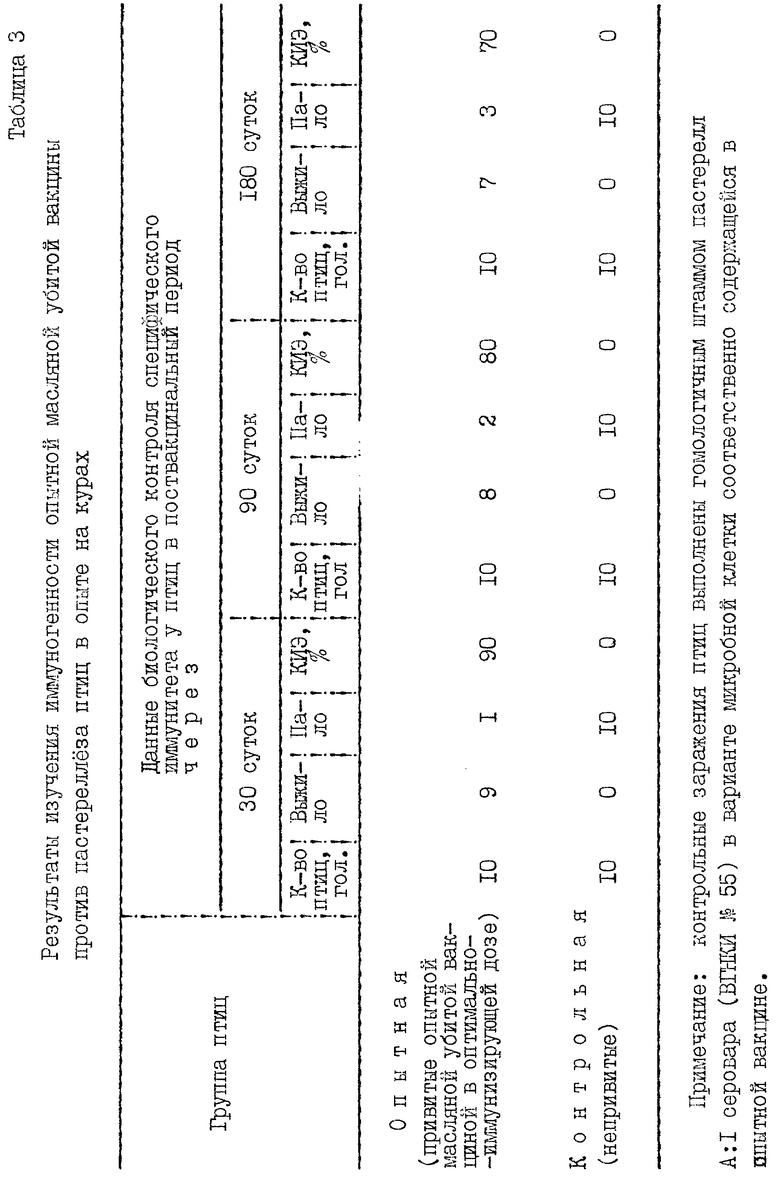
Готовили лабораторную серию опытной масляной убитой вакцины, как описано в примере 5, и изучали ее на иммуногенность в оптимально-иммунизирующей дозе 15 млрд. м.к./мл при двукратной (с интервалом 10 суток), подкожной (в области верхней трети шеи) прививке кур. Результаты исследований представлены в табл. 3. В итоге контрольных биопроб установлено, что напряженность противопастереллезного иммунитета у кур, выраженная через КИЭ (%), равна 90, 80 и 70% соответственно через 30, 90 и 180 суток (срок наблюдений).
Пример 7
Готовили три лабораторные серии опытной масляной убитой вакцины, как описано в примере 5, и в опыте на курах изучали их на иммуногенность в сравнении между собой и с авирулентной сухой вакциной против пастереллеза птиц из Пастеровского штамма. Кур трех опытных групп соответственно прививали опытной вакциной трех лабораторных серий. Вакцинацию птиц провели, как описано в примере 6. Кур одной контрольной группы прививали вакциной из Пастеровского штамма согласно Наставлению по ее применению. Кур другой контрольной группы не прививали (интактные). За поголовьем птиц всех групп ежедневно вели клинические наблюдения. Отмечено, что куры, привитые опытным биопрепаратом, в течение вторых суток после первой прививки были слабо угнетены. В последующее время поствакцинальные реакции организма опытных птиц не установлены. Вместе с тем, у кур, привитых авирулентной вакциной из Пастеровского штамма, на 2-5 сутки после первой прививки было выраженное угнетенное состояние организма, которое проходило к концу 7-8 суток. При этом у 4 (20%) из 20 привитых кур этой вакциной отмечались жажда, сонливость и, по причине синовита и артрита, хромота. Периодически эти признаки затухали и проявлялись вновь. Специфический иммунитет у опытных и контрольных птиц определяли в биопробе при внутримышечном заражении ЛД100 контрольно-производственного штамма пастерелл ВГНКИ 55 (в капсульном и бескапсульном вариантах микробной клетки сочетанно) соответственно через 30 и 90 суток после прививок (срок наблюдений). Результаты этих сравнительных исследований представлены в табл. 4. В целом КИЭ (%) на протяжении 90 суток после прививок опытной вакцины на примере трех лабораторных серий был равен от 70 до 90%. При этом КИЭ (%) по контрольной группе кур, привитых сухой вакциной против пастереллеза птиц из Пастеровского штамма, был равен от 50 до 70%. Полученные результаты исследований свидетельствуют, что опытная масляная убитая вакцина, приготовленная из пастерелл в капсульном и бескапсульном вариантах микробной клетки сочетанно, на примере трех лабораторных серий безвредна и иммуногенна для кур, а также экологически безопасна по сравнению с живой вакциной.
Провести же сравнение опытной масляной убитой вакцины с вакциной прототипа не представляется возможным, так как последняя не производится как не нашедшая практического применения. Вместе с тем предлагаемый вариант опытной убитой вакцины и способ ее получения содержат существенные отличия научно-практического значения и могут быть использованы в микробиологии, биотехнологии и в условиях современной биологической промышленности.

Изобретение относится к области микробиологии и биотехнологии. В вакцину включают в равных частях по объему убитые пастереллы в капсульном и бескапсульном вариантах стандартизированной микробной клетки первой генерации после изоляции из организма птицы. Для этого контрольно-производственным штаммом пастерелл, восстановленным по способу повышения вирулентности пастерелл, заражают орально восприимчивый организм и из крови сердца в момент смерти зараженного отмывают в подогретом забуференном физрастворе хлористого натрия (рН 7,0; 35...40oС) маточные бескапсульные бактерии, а сразу же после остывания и окоченения трупа при 15...25oС (оптимум 20oС) окружающей среды (через 3-4 посмертных часа в зависимости от живой массы тела зараженного) - маточные капсульные бактерии, которые соответственно засевают в отдельности на подогретый до 37...38oС бульон Хоттингера (рН 7,2-7,4) и непрерывно культивируют на идентичной по качеству и температуре питательной среде. В 9-10-часовом возрасте каждой культуры пастерелл соответственно сливают по половине объема в отдельные стерильные емкости и постепенно охлаждают 2-3 ч при 15...25oС (оптимум 20oС) окружающей среды до полной инкапсуляции микробных клеток в состоянии покоя. В остывшие половины культур инкапсулированных и в непрерывно культивируемые половины культур бескапсульных пастерелл одновременно вносят формалин в конечной концентрации 0,3% и сразу же бактерии концентрируют центрифугированием. Сконцентрированную биомассу соответственно капсульных и бескапсульных пастерелл объединяют в равных частях по объему и из полученного готовят рабочую взвесь вакцинного антигена в забуференном физрастворе хлористого натрия при 0,3%-ной концентрации формалина из расчета 30 млрд. м.к./мл. Рабочую взвесь антигена смешивают с известным масляным адъювантом в равном соотношении по объему и применяют в качестве вакцины. Вакцина безвредна, иммуногенна и экономически безопасна. 2 с.п. ф-лы, 4 табл.
| Способ приготовления противопастереллезной вакцины | 1990 |
|
SU1839092A1 |
| Ветеринарное законодательство/ Под ред | |||
| А.Д.ТРЕТЬЯКОВА | |||
| Инструкция по изготовлению и контролю сухой авирулентной вакцины против пастереллеза птиц, утв | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| - М.: Колос, 1972, т.1, с.591. | |||
Авторы
Даты
2003-02-27—Публикация
2000-12-18—Подача