Изобретение относится к новым производным 5-замещенным-1, 2, 4-тиадиазолила, действующих как ингибиторы ангиогенеза, и к их получению; кроме того, оно относится к содержащим их композициям, а также к их использованию в качестве лекарственного средства.
Ангиогенез, т.е. образование новых сосудов эндотелиальными клетками, играет огромную роль в различных физиологических и патофизиологических процессах. Развитие кровоснабжения существенно для роста, созревания и поддержания нормальных тканей. Оно также необходимо для заживления ран. Ангиогенез играет решающую роль при росте плотной опухоли и метастазах и вовлечен в различные другие патологические болезненные состояния, такие как неоваскулярная глаукома, диабетическая ретинопатия, псориаз и ревматические артриты. Эти патофизиологические состояния характеризуются усилением ангиогенеза, во время которого обычно находящиеся в состоянии покоя эндотелиальные клетки становятся активными, снижают внеклеточные матриксные барьеры, быстро размножаются и перемещаются, образуя новые сосуды. Для борьбы с ангиогенез-зависимыми заболеваниями будут очень полезны соединения, обладающие свойствами ингибирования ангиогенеза.
В данной области описано несколько соединений, ингибирующих ангиогенез, также называемые ангиостатиками, ангиоингибиторами или ангиогенными антагонистами. Например, гидрокортизон является хорошо известным ингибитором ангиогенеза (Folkman et al., Science 230:1375, 1985' "A new class of steroids inhibits angiogenesis in the presence of heparin fragment"; Folkman et al., Science 221:719, 1983. "Angiogenesis inhibition and tumor regression causer by heparin fragment in the presence of cortisone").
В европейском патенте 0398427, опубликованном 22 ноября 1990, описаны антириновирусные пиридазинамины, и в европейском патенте 0435381, опубликованном 3 июля 1991, описаны пиридазинамины, имеющие антипикорнавирусную активность. В европейском патенте 0429344, опубликованном 29 мая 1991, раскрыты производные аминопиридазина в качестве холинергических агонистов.
Соединения по настоящему изобретению отличаются от соединений, известных по предшествующему уровню техники, тем, что они всегда замещены тиадиазолильным фрагментом и в особенности тем, что данные соединения неожиданно обладают ангиогенез-ингибирующими свойствами.
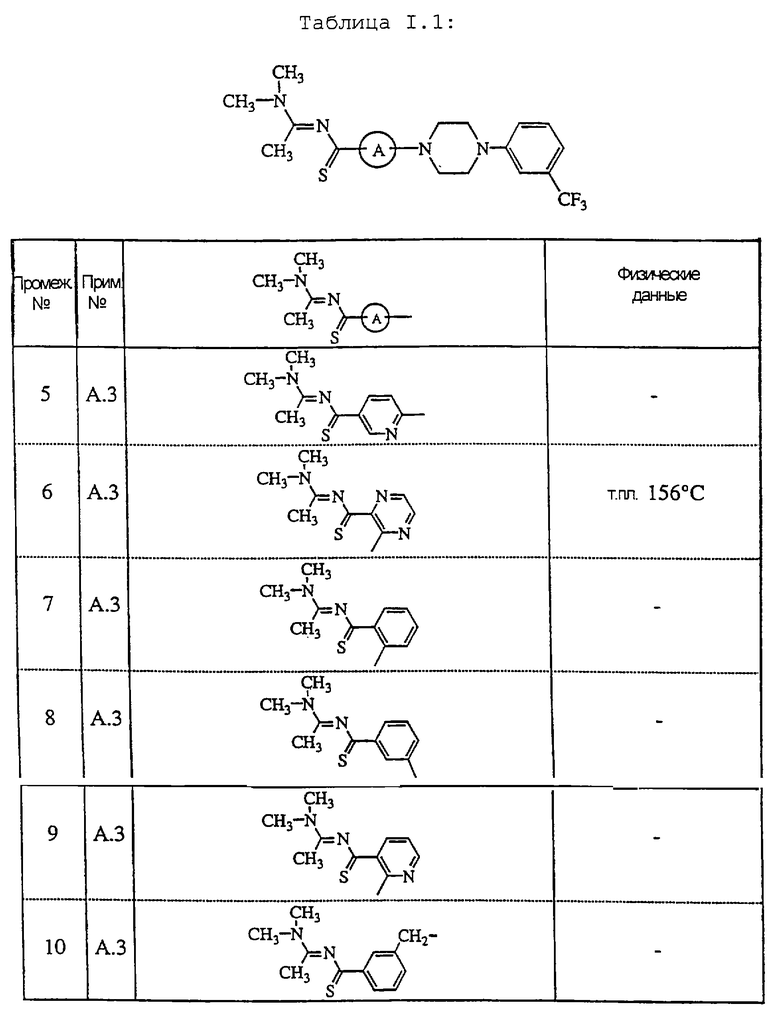
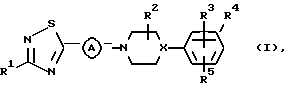
Данное изобретение относится к соединениям формулы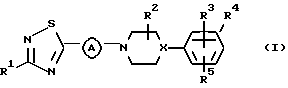
их N-оксидным формам, фармацевтически приемлемым кислотно-аддитивным солям и стереохимическим изомерным формам, где Х представляет СН или N;
R1 представляет водород, C1-6 алкил, C1-6 алкилокси, C1-6 алкилтио, амино, моно- или ди (C1-6 алкил) амино, Аr1, Ar1-NH-, С3-6 циклоалкил, гидроксиметил или бензилоксиметил;
R2 представляют водород, C1-6 алкил, амино, аминокарбонил, моно- или ди (C1-6 алкил) амино, C1-6 алкилоксикарбонил, C1-6 алкилкарбониламино, гидрокси или C1-6 алкилокси;
R3, R4 и R5, каждый, независимо выбран из водорода, галогена, C1-6 алкила, С1-6 алкилокси, трифторметила, нитро, амино, циано, азидо, С1-6 алкилокси, С1-6 алкила, C1-6 алкилтио, C1-6 алкилоксикарбонила или Het1;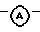 представляет Аr2, Ar2CH2- или Het2;
представляет Аr2, Ar2CH2- или Het2;
Аr1 представляет фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, C1-6 алкила, С1-6 алкилокси, тригалогенметила, амино или нитро;
Аr2 представляет фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбирают из галогена, C1-6 алкила, C1-6 алкилокси, тригалогенметила, амино или нитро;
Het1 представляет моноциклический гетероцикл, выбранный из оксазолила, изоксазолила, оксадиазолила, тиазолила, изотиазолила, тиадиазолила или оксазолинила; и каждый моноциклический гетероцикл необязательно может быть замещен по атому углерода С1-4 алкилом; и
Het2 представляет моноциклический гетероцикл, выбранный из фуранила, тиофуранила, оксадиазолила, тиадиазолила, пиридинила, пиримидинила или пиразинила; и каждый моноциклический гетероцикл необязательно может быть замещен по атому углерода 1 или 2 заместителями, каждый из которых независимо выбран из галогена, С1-4 алкила, С1-4 алкилокси, нитро или трифторметила.
Как использовано в предшествующих и нижеследующих определениях, галоген представляет собой обобщенное название для фтора, хлора, брома и йода; С1-4 алкил определяет линейные или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил, и т.п.; подразумевается, что C1-6 алкил включает С1-4 алкил и более высокие гомологи, содержащие от 5 до 6 атомов углерода, такие как, например, пентил, 2-метилбутил, гексил, 2-метилпентил и т.п.;
Примерами 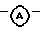 фрагмента являются
фрагмента являются
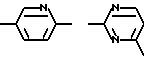
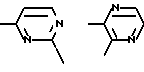
В любом случае, когда  представляет собой радикал формулы Ar2СH2, CH2 фрагмент в указанном радикале предпочтительно связан с атомом азота пиперидильного фрагмента, если Х представляет CH, или пиперазинильного фрагмента, если Х представляет собой азот.
представляет собой радикал формулы Ar2СH2, CH2 фрагмент в указанном радикале предпочтительно связан с атомом азота пиперидильного фрагмента, если Х представляет CH, или пиперазинильного фрагмента, если Х представляет собой азот.
Подразумевается, что отмеченные выше фармацевтически приемлемые кислотно-аддитивные соли включают терапевтически активные нетоксичные кислотно-аддитивные солевые формы, которые могут образовывать соединения формулы (I). Соединения формулы (I), обладающие основными свойствами, могут быть превращены в их фармацевтически приемлемые кислотно-аддитивные соли путем обработки вышеуказанной основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например хлорводородная или бромводородная кислота; серная; азотная; фосфорная и тому подобные кислоты; или органические кислоты, такие как, например, уксусная; пропионовая; гидроксиуксусная; молочная, пировиногродная, щавелевая, малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты.
Термин кислотно-аддитивные соли также включает гидраты и формы, представляющие аддукты с растворителем, которые могут образовывать соединения формулы (I). Примерами таких форм, например, являются гидраты, алкоголяты и т. п.
Термин стереохимически изомерные формы соединений формулы (I), как он использован ранее в данном описании, определяет все возможные соединения, образованные из одних и тех же атомов, связанных одной и той же последовательностью связей, но имеющих различные трехмерные структуры, которые не являются взаимозаменимыми, которые могут образовывать соединения формулы (I). Если не отмечено или не указано другого, химическое название соединения включает смесь всех возможных стереохимически изомерных форм, которые могут образовывать вышеуказанное соединение. Вышеуказанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимические изомерные формы соединений формулы (I), как в чистом виде, так и в виде смеси друг с другом, также включены в объем данного изобретения.
Некоторые соединения формулы (I) могут также существовать в виде таутомерных форм. Предполагается, что такие формы, хотя они подробно не отмечаются в выше приведенной формуле, также включены в область данного изобретения.
Подразумевается, что N-оксидные формы соединений формулы (I) включают такие соединения формулы (I), в которых один или несколько атомов азота окислены до так называемых N-оксидов.
В независимости от того, где далее будет использован термин "соединения формулы (I)", подразумевается, что он также включает фармацевтически приемлемые кислотно-аддитивные соли и все стереоизомерные формы.
Группа соединений, представляющих интерес, состоит из таких соединений формулы (I), в которых выполняется одно или более следующих ограничений:
а) Х представляет N;
в) R1 представляет водород, С1-6 алкил, амино или ди (C1-6 алкил) амино;
c) R2 представляет водород;
d) R3, R4 и R5, каждый, независимо выбран из водорода, галогена, C1-6 алкила, C1-6 алкилокси, трифторметила, нитро или C1-6 алкилоксикарбонила;
Особой группой соединений являются такие соединения формулы (I), в которых Х представляет N; R1 представляет водород, С1-4 алкил или ди (С1-4 алкил) амино; R2 представляет водород; R3, R4 и R5 каждый, независимо выбраны из водорода, галогена, С1-4 алкила, C1-4 алкилокси или трифторметила; и бивалентный радикал  представляет Аr2, Аr2CН2- или Het2, где Аr2 представляет фенил или фенил, замещенный 1 или 2 заместителями, каждый из которых независимо выбирают из галогена, C1-6 алкила, C1-6 алкилокси, тригалогенметила, амино или нитро; и Het2 представляет тиадиазолил, пиридинил, пиримидинил или пиразинил.
представляет Аr2, Аr2CН2- или Het2, где Аr2 представляет фенил или фенил, замещенный 1 или 2 заместителями, каждый из которых независимо выбирают из галогена, C1-6 алкила, C1-6 алкилокси, тригалогенметила, амино или нитро; и Het2 представляет тиадиазолил, пиридинил, пиримидинил или пиразинил.
Предпочтительной группой соединений являются такие соединения формулы (I), в котором Х представляет N, R1 представляет метил, R2 представляет водород, R3 и R4 представляют водород и R3 представляет трифторметил.
Более предпочтительной группой соединений являются такие предпочтительные соединения, в которых R5 представляет трифторметил, расположенный в 3-положении.
Наиболее предпочтительны:
1-[4-(3-метил-1,2,4-тиадиазол-5-ил)фенил]-4-[3-(трифторметил)фенил]пиперазин и 1-[5-(3-метил-1, 2, 4-тиадиазол-5-ил)-2-пиридинил]-4-[3- (трифторметил)фенил] пиперазин и их фармацевтически приемлемые кислотно-аддитивные соли, стереоизомерные формы или N-оксиды.
Соединения по настоящему изобретению могут быть в общем случае получены взаимодействием промежуточного соединения формулы (II) с промежуточным соединением формулы (III)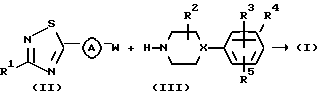
В предшествующей и последующих реакционных схемах W представляет подходящую реакционноспособную удаляемую группу, такую как, например, галоген, например фтор, хлор, бром, йод, или в некоторых случаях W может быть также сульфонилоксигруппой, например метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и тому подобной реакционноспособной удаляемой группой. Указанное взаимодействие проводят в соответствии с известными в данной области способами, такими как, например, перемешивание обоих реагентов в реакционно-инертном растворителе, например N,N-диметилформамиде, ацетонитриле, метилизобутилкетоне и т. п., предпочтительно в присутствии основания, например гидрокарбоната натрия, карбоната натрия или триэтиламина. Взаимодействие может быть удобно осуществлено при температуре в диапазоне от комнатной температуры до температуры кипения реакционной смеси с обратным холодильником.
Соединения формулы (I), в которых R1 представляет СН3, причем эти соединения, представленные формулой (I-а), могут быть также получены обработкой промежуточного соединения формулы (IV) с гидроксиламино-О-сульфоновой кислотой в реакционно-инертном растворителе, таком как, например, метанол или этанол, в присутствии основания, такого как, например, пиридин.
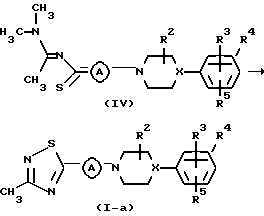
Соединения формулы (I) могут быть кроме этого получены преобразованием соединений формулы (I) друг в друга согласно известным в данной области реакциям преобразования групп.
Соединения формулы (I) также могут быть превращены в соответствующие N-оксидные формы в соответствии с известными в данной области способами превращения трехвалентного азота в его N-оксидную форму. Указанные реакции N-окисления можно, в общем случае, проводить взаимодействием исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочного или щелочноземельного металла, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота, или галогензамещенные бензолкарбопероксикислоты, например 3-хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидроксипероксиды, например трет-бутилгидропероксид. Подходящие растворители представляют собой, например, воду, низшие алканолы, например этанол и т.п., углеводороды, например толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например дихлорметан и смеси таких растворителей.
Исходные вещества и некоторые промежуточные соединения представляют собой известные соединения и коммерчески доступны или могут быть получены согласно обычным способам проведения реакции, в общем случае известным в данной области техники. Например, некоторые промежуточные соединения формулы (II), такие как 5-(4-фторфенил)-3-метил-1, 2, 4-тиадиазол, были описаны Yang-i Lin et al в J. Org. Chem., 45(19), p. 3750-3753 (1980) и некоторые промежуточные соединения формулы (III), такие как 1-[3-(трифторметил)фенил] пиперазин коммерчески доступны.
Промежуточные соединения формулы (II) могут быть получены взаимодействием соединений формулы (V), в которых W представляет подходящую удаляемую группу, как описано выше, с промежуточным соединением формулы (VI), необязательно в форме его кислотно-аддитивной соли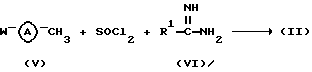
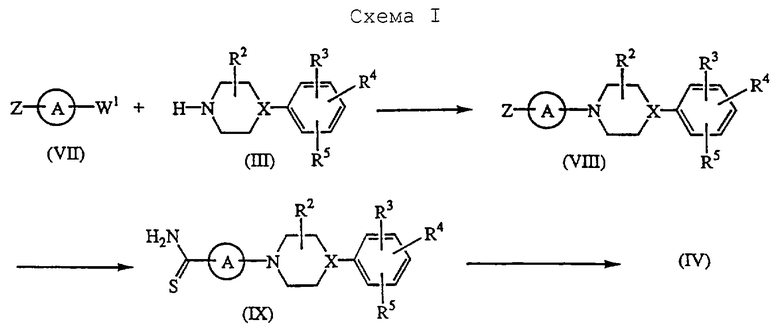
Промежуточные соединения формулы (IV) могут быть получены, как описано в схеме (I) (см. в конце описания).
В схеме I промежуточное соединение формулы (VII), в котором W1 представляет подходящую удаляемую группу, такую как галоген или сульфонилокси, и Z представляет циано или аминокарбонил, взаимодействует с промежуточным соединением формулы (III) при использовании известных в данной области способов, как описано выше для синтеза соединения формулы (I). Получаемые промежуточные соединения формулы (VIII) обрабатывают реагентом Лоуссона (Lawesson) в подходящем растворителе, таком как, например, толуол или пиридин, или обрабатывают Н2S в подходящем растворителе, таком как, например, N, N-диметилформамид, необязательно в присутствии триэтиламина. Впоследствии промежуточные соединения формулы (IX) обрабатывают N,N-диметилацетамидом диметилацеталем в реакционно-инертном растворителе, таком как, например, толуол или дихлорметан, таким образом, получая промежуточные соединения формулы (IV).
Соединения формулы (I) и некоторые промежуточные соединения могут иметь один или несколько стереогенных центров в их структуре, имеющих R или S конфигурации. Например, R1, R2, R3, R4 или R5 может быть C1-6 алкилом, имеющим стереогенный центр.
Соединения формулы (I), полученные по описанным выше способам, могут быть синтезированы в виде рацемических смесей энантиомеров, которые могут быть отделены друг от друга при помощи хорошо известных в данной области методов разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие формы диастереомерных солей взаимодействием с подходящей хиральной кислотой. Указанные формы диастереомерных солей впоследствии разделяют, например, селективной или фракционной кристаллизацией, а энантиомеры выделяют из них обработкой щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию при использовании хирального носителя. Подходящие хиральные носители представляют собой, например, полисахариды, в частности целлюлозу или производные амилозы. Коммерчески доступными хиральными носителями на основе полисахаридов являются ChiralCel СА, ОА, ОВ, ОС, OD, OF, OG, OJ и ОК и Chiralpak AD, AS, OP(+) и ОТ(+). Пригодными элюентами или подвижными фазами, используемыми в сочетании с указанными полисахаридными хиральными носителями, являются гексан и т.п., модифицированные спиртом, таким как, например, этанол, изопропанол и т.п. Вышеуказанные чистые стереохимические изомерные формы могут быть также получены из соответствующих чистых стереоизомерных форм подходящих исходных веществ, при условии, чтобы реакция проходила стереоспецифично. Предпочтительно, если требуется определенный стереоизомер, вышеуказанное соединение будет синтезировано стереоспецифичными способами получения. В этих способах выгодно использовать энантиомерно чистые исходные вещества.
Соединения формулы (I) имеют полезные фармакологические свойства, ингибируя ангиогенез, как in vivo, так и in vitro, как продемонстрировано в фармакологическом примере C.1.
С точки зрения их фармакологической активности соединения формулы (I), их фармацевтически приемлемые кислотно-аддитивные соли, стереохимически изомерные формы или их N-оксидные формы представляют собой ингибиторы ангиогенеза.
Следовательно, ингибиторы ангиогенеза полезны для борьбы или лечения заболеваний ангиогенез-зависимых, таких как, например, глазные неоваскулярные заболевания, неоваскулярная глаукома, диабетическая ретиопатия, ретролентальная фиброплазия, гемангиомы, ангиофибромы, псориаз, остеоартроз и ревматические артриты. Также ингибиторы ангиогенеза полезны для борьбы с ростом плотной опухоли, такой как, например, рак молочной железы, рак предстательной железы, меланома, рак почки, рак ободочной кишки, рак шейки матки и т.п.; и метастазах.
Следовательно, в настоящем изобретении раскрываются соединения формулы (I) для применения в качестве лекарственного средства, а также использование соединений формулы (I) для получения лекарственного препарата для лечения зависящих от ангиогенеза заболеваний.
С точки зрения полезности рассматриваемых соединений для лечения или профилактики ангиогенез-зависимых заболеваний в настоящем изобретении разработан способ лечения теплокровных животных, страдающих от таких заболеваний, вышеуказанный способ включает систематическое введение терапевтически эффективного количества соединения формулы (I), его N-оксида или его фармацевтически приемлемой кислотно-аддитивной соли.
Принимая во внимание их полезные фармакологические свойства, рассматриваемые соединения могут быть включены в рецептуру различных фармацевтических форм в целях их применения. Для получения фармацевтических композиций по данному изобретению эффективное количество определенного соединения в виде основания или кислотно-аддитивной соли, в качестве действующего ингредиента, смешивают в однородную смесь с фармацевтически приемлемым носителем, такой носитель может иметь самые разнообразные формы в зависимости от требуемой для введения формы приготовления. Эти фармацевтические композиции оптимальны в виде единичных лекарственных форм, подходящих предпочтительно для введения перорально, ректально или в виде парентеральной инъекции. Например, при получении композиций в виде пероральных лекарственных форм может быть использована любая обычная фармацевтическая среда, такая как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры или растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, вяжущие, дезинтегрирующие агенты и т.п. в случае порошков, гранул, капсул и таблеток. Благодаря легкости введения таблетки и капсулы представляют собой наиболее выгодные пероральные единичные лекарственные формы, в случае которых обычно используются твердые фармацевтические носители. Для парентеральных составов носитель обычно включает, по крайней мере в основной части, стерильную воду, хотя могут быть использованы и другие ингредиенты, например, для того, чтобы способствовать растворимости. Например, могут быть получены растворы для инъекций, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого и глюкозного раствора. Также могут быть получены суспензии для инъекций, в этом случае могут применяться подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, пригодных для подкожного введения, носитель при желании может включать агент, улучшающий проникновение, и/или подходящий смачивающий агент, при желании в сочетании в меньших пропорциях с приемлемыми добавками любой природы, с такими добавками, которые не оказывают значительного вредного воздействия на кожу. Указанные добавки могут способствовать проникновению через кожу и/или могут быть полезными для получения целевых композиций. Эти композиции могут вводиться различными путями, например, в виде чрескожного пластыря, точечно, в виде мази. Кислотно-аддитивные соли (I) из-за их высокой растворимости в воде по сравнению с формой основания обычно более пригодны для приготовления водных растворов.
В особенности удобно составлять рецептуру вышеуказанных фармацевтических композиций в виде единичной лекарственной формы для облегчения введения и равномерности дозирования. Единичная лекарственная форма, как это используется в описании и формуле изобретения, относится к физически дискретным единицам, пригодным в качестве единичных лекарственных форм, каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблетки (включая таблетки, с насечками и покрытые оболочкой), капсулы, гранулы, пакеты с порошками, брикеты, растворы или суспензии для инъекций, мерные чайные ложки, мерные столовые ложки и т.п., и их обособленные кратные дозы.
Для перорального введения фармацевтические композиции могут быть в виде твердых дозированных форм, например таблеток (как в формах только для глотания, так и для жевания), капсул или гелевых капсул, получаемых обычными способами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, клейстеризованный кукурузный крахмал, поливилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза и фосфат кальция); смазывающие агенты, например стеарат магния, тальк или диоксид кремния); дезинтеграторы (например, картофельный крахмал или натрий гликолят крахмала); или смачивающие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты способами хорошо известными в данной области техники.
Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий или могут представлять собой сухой продукт, соединяемый с водой или другим приемлемым носителем перед использованием. Такие жидкие препараты могут быть получены обычными методами, необязательно с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сорбитный сироп, метилцеллюлоза, гидроксипропилметилцеллюлоэа или гидрированные пищевые жиры); эмульгирующие агенты (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, жирные сложные эфиры или этиловый спирт); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота).
Фармацевтически приемлемые подсластители включают предпочтительно по крайней мере один интенсивный подсластитель, такой как сахарин, сахарин натрия или кальция, аспартам, ацесульфам калия, цикламат натрия, алитам, дигидрохальконовый подсластитель, монеллин, стевиосид, или сукралоза (4,1', 6'-трихлор-4,1', 6'-тридеоксигалактосахароза), предпочтительно сахарин, сахарин натрия или кальция, и при желании массовый подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальтоза, глюкоза, гидрогенизированный сироп глюкозы, ксилит, карамель или мед.
Интенсивные подсластители обычно используются в низких концентрациях. Например, в случае сахарина натрия концентрация может колебаться в диапазоне от 0,04 до 0,1% (вес/объем) в зависимости от общего объема окончательного состава, и предпочтительно составляет примерно 0,06% в составах с низкой дозой и примерно 0,08% в составах с высокой дозой. Массовые подсластители могут эффективно использоваться в высоких концентрациях, колеблющихся от примерно 10 до примерно 35%, предпочтительно от примерно 10 до 15% (вес/объем).
Фармацевтически приемлемые отдушки, которые могут маскировать горький привкус ингредиентов в составах с низкими дозами, предпочтительно представляют собой фруктовые отдушки, такие как вишневая, малиновая, черносмородиновая или земляничная отдушка. Сочетание двух отдушек может привести к очень хорошим результатам. Для составов с высокой концентрацией могут быть необходимы более сильные отдушки, такие как Caramel Chocolate отдушка, Mint cool отдушка, Fantasy отдушка и тому подобные фармацевтически приемлемые сильные отдушки. Каждая отдушка может присутствовать в конечных композициях в концентрациях, изменяющихся от 0,05 до 1% (вес/объем). Выгодно использовать сочетание указанных сильных отдушек. Предпочтительно используют отдушку, для которой в кислой среде композиции не происходит изменений или потери вкуса и цвета.
Соединения по данному изобретению могут быть введены в рецептуру в качестве депо препаратов. Такие долго действующие составы могут вводиться имплантацией (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, соединения могут быть введены в состав вместе с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле) или ионообменными смолами, или в качестве умеренно растворимых производных, например в виде умеренно растворимых солей.
Соединения по данному изобретению могут быть введены в составы для парентерального введения путем инъекции, обычно внутривенной, внутримышечной или подкожной инъекции, например болюс-инъекции или непрерывной внутривенной инфузии. Составы для инъекции могут представлять собой единичную лекарственную форму, например ампулы или контейнеры с несколькими дозами, с добавлением консерванта. Композиции также могут принимать такие формы, как суспензии, растворы или эмульсии в водных или масляных носителях, и могут содержать агенты для приготовления составов, такие как изотонирующие, суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка для смешивания перед использованием с подходящим носителем, например со стерильной водой, не содержащей бактериальных токсинов.
Соединения по данному изобретению также могут быть введены в составы для ректальных композиций, такие как суппозитории или удерживающиеся клизмы, например содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды.
Соединения по изобретению могут использоваться для интраназального введения, например, в виде жидкого аэрозоля, в виде порошка или в форме каплей.
Специалисты в данной области легко могут определить эффективное количество на основе результатов опытов, представленных ниже. В общем случае, предполагается, что эффективное количество будет составлять от 0,001 до 10,0 мг/кг веса тела, и в особенности от 0,01 до 1,0 мг/кг веса тела. Может быть удобным вводить необходимые дозы в виде двух, трех, четырех или более под-доз через подходящие интервалы в течение дня. Вышеуказанные под-дозы могут быть приготовлены в виде единичных лекарственных форм, например, содержащих от 0,01 до 500,0 мг и, в особенности, от 0,1 до 200,0 мг активного ингредиента на единичную дозу.
Нижеприведенные примеры приведены в целях иллюстрации.
Экспериментальная часть
Далее "ДМФА" обозначает N,N-диметилформамид, "ДХМ" обозначает дихлорметан, "ДИПЭ" обозначает диизопропиловый простой эфир и "ТГФ" обозначает тетрагидрофуран.
А. Получение промежуточных соединений
Пример А.1
а) Смесь 2-Хлор-4-метилпиримидил (0,07 моль) в тионилхлориде (100 г) перемешивали и нагревали при кипении с обратным холодильником в течение 16 часов. Растворитель упаривали, получая 2-хлор-4-[дихлор(хлортио)метил]пиримидин (промежуточное соединение 1).
в) Смесь гидрохлорида 1-иминоэтанамина (1:1) (0,08 моль) добавляли при 0oС при перемешивании к смеси промежуточного соединения 1 (0,07 моль) в ДХМ (300 мл). Гидроксид натрия (50%, 20 мл) добавляли по каплям при 0oС. Смесь перемешивали при 5oС в течение 1 часа. Добавляли воду (300 мл) и ДХМ (300 мл). Смесь разделяли на слои. Водный слой промывали дважды ДХМ. Объединенный органический слой высушивали, фильтровали и растворитель упаривали. Остаток очищали через силикагель на стеклянном фильтре (элюент: ДХМ). Собирали чистые фракции, растворитель упаривали, получая 3,5 г 2-хлор-4-(3-метил-1,2,4-тиадиазолил-5-ил) пиримидина (промежуточное соединение 2).
Пример А.2
а) Смесь 6-хлор-3-пиридинкарбоксиамида (0,11 моль), 1-[3-(трифторметил) фенил] пиперазина (0,11 моль) и карбоната натрия (0,22 моль) в ДМФА (300 мл) перемешивали в течение ночи при 120oС. Смесь выливали в ледяную воду (600 мл) и перемешивали в течение 1 часа. Осадок отфильтровывали и сушили. Часть этой фракции (4 г) растворяли в ДХМ и водном растворе NaHCO3. Смесь разделяли на слои. Водный слой экстрагировали ДХМ трижды. Объединенный органический слой сушили, отфильтровывали и растворитель упаривали до небольшого объема. Осадок отфильтровывали и сушили, получая 3,2 г 6-[4-[3-(трифторметил)фенил] -1-пиперазинил] -3-пиримидинкарбоксамида (промежуточное соединение 3).
в) Смесь промежуточного соединения 3 (0,013 моль) и реагентов Лоуссона (0,007 моль) в толуоле (130 мл) перемешивали и нагревали при кипячении с обратным холодильником в течение 2 часов. Смесь охлаждали. Добавляли воду (100 мл). Смесь перемешивали в течение 1 часа и слои разделяли. Водный слой экстрагировали толуолом трижды и один раз ДХМ. Объединенный органический слой сушили, фильтровали и растворитель упаривали, получая 7,3 г 6-[4-[3-(трифторметил)фенил]-1-пиперазинил]-3- пиримидинкарботиоамида (промежуточное соединение 4).
Пример А. 3
Смесь промежуточного соединения 4 (0,013 моль) и 1,1-диметокси-N,N-диметилэтанамина (0,021 моль) оставляли на ночь и затем использовали без дополнительной очистки, с получением N-[1-диметиламино)этилиден] -6-[4-[3-(трифторметил) фенил]-1-пиперазинил]-3- пиридинкарботиоамида (промежуточное соединение 5).
В таблице I.1 перечислены промежуточные соединения, которые были получены согласно примеру А.3.
В. Получение конечных соединений
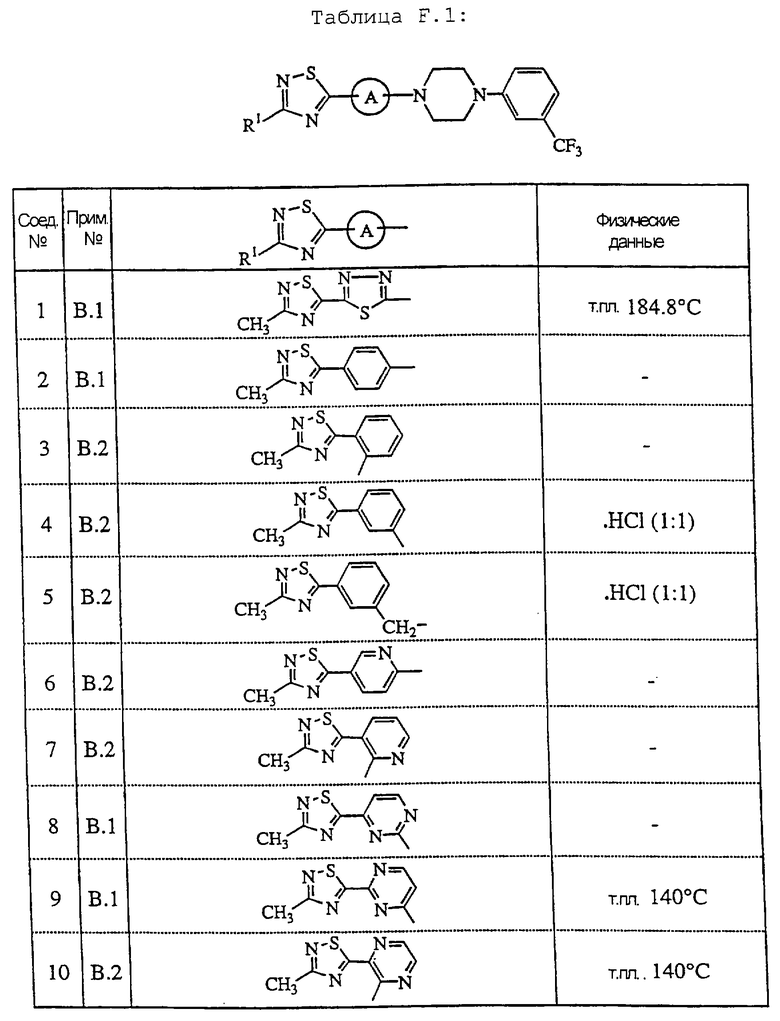
Пример В.1
Смесь 5-(4-фторфенил)-3-метил-1, 2, 4-тиадиазола (0,012 моль), 1-[3-(трифторметил)фенил] пиперазина (0,014 моль) и карбоната натрия (0,024 моль) в ДМФА (10 мл) перемешивали при 140oС в течение 24 часов, затем при 150oС в течение 24 часов, охлаждали, выливали в ледяную воду (200 мл) и перемешивали. Осадок отфильтровывали, поглощали ДХМ, сушили, фильтровали и упаривали растворитель. Осадок кристаллизовали из ДИПЭ. Осадок отфильтровывали и сушили, с получением 2,5 г (52%) 1-[4-(3-метил-1, 2, 4-тиадиазол-5-ил)фенил]-4-[3-(трифторметил)фенил]пиперазина (соединение 2).
Пример В. 2
Смесь гидроксиламин-О-сульфоновой кислоты (0,011 моль) в метаноле (15 мл) добавляли сразу к смеси промежуточного соединения 5 (0,01 моль) и пиридина (0,02 моль)в этаноле (40 мл). Смесь перемешивали при комнатной температуре в течение 90 минут. Растворитель упаривали. Осадок перемешивали при комнатной температуре в ДХМ, промывали водой и водным 0,1 н. раствором NaOH, сушили, фильтровали и упаривали растворитель. Осадок поглощали метанолом, отфильтровывали и сушили. Осадок поглощали ацетонитрилом (100 мл). Смесь перемешивали и кипятили до полного растворения и затем оставляли кристаллизоваться. Осадок отфильтровывали и сушили, получая 1,4 г (35%) 1-[5-(3-метил-1, 2, 4-тиадиазол-5-ил)-2-пиридинил]-4-[3- (трифторметил)фенил]пиперазина (соединение 8).
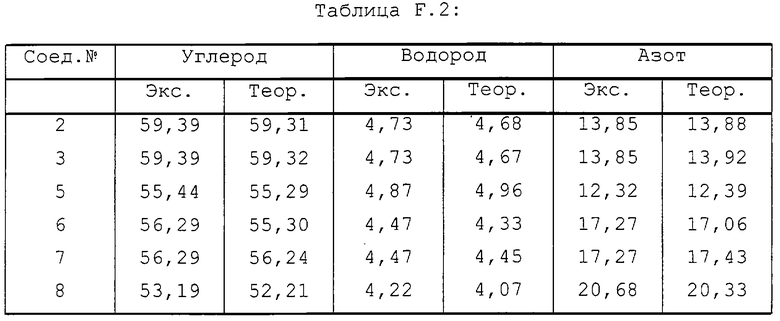
В таблице F.1 перечислены соединения, которые были получены согласно одному из приведенных выше примеров, и в таблице F.2 приведены экспериментальные (колонка, озаглавленная "экс.") и теоретические (колонка, озаглавленная "теор. ") данные элементного анализа для углерода, водорода и азота соединений, полученных ранее в экспериментальной части.
С. Фармакологические примеры
Пример С.1
Активность ингибирования ангиогенеза измеряли in vitro с использованием модели ангиогенеза на кольцах аорты крысы, описанной Nicolas, R.F. и Ottinetti в "Laboratory Investigation", vol. 63, р. 115, 1990. Способность соединений ингибировать образование микрососудов сравнивали с контрольными кольцами, обработанными носителем. Количественную оценку (область микрососуда) после 8 дней в культуре проводили с использованием системы анализа изображений, состоящей из светового микроскопа, CCD (устройство, контролируемое компьютером) камеры и автоматической, специально разработанной программы, анализирующей изображение, как описано в Nissanov, J., Tuman, R.W., Gruver, L. M. и Fortunate J.M. в "Laboratory Investigations", vol. 73 (#5), p. 734, 1995. Соединение тестировали при нескольких концентрациях для определения ингибирующей способности (IС50). Соединения 1, 2 и 6 характеризуются значениями IC50 < 10 нМ.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ТИАДИАЗОЛИЛ ПИРИДАЗИНА, ИНГИБИРУЮЩИЕ АНГИОГЕНЕЗ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1998 |
|
RU2194049C2 |
| МОНОЦИКЛИЧЕСКИЕ БЕНЗАМИДЫ ПРОИЗВОДНЫХ 3- ИЛИ 4-ЗАМЕЩЕННОГО 4-(АМИНОМЕТИЛ)ПИПЕРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЕЕ ПРИГОТОВЛЕНИЯ, ПРОИЗВОДНОЕ КАРБОНОВОЙ КИСЛОТЫ | 1998 |
|
RU2213089C2 |
| ХИНАЗОЛИНОНЫ, ИНГИБИРУЮЩИЕ ФАРНЕЗИЛТРАНСФЕРАЗУ | 1998 |
|
RU2205831C2 |
| 1,8-АННЕЛИРОВАННЫЕ ПРОИЗВОДНЫЕ ХИНОЛИНОНА, ЗАМЕЩЕННЫЕ N- ИЛИ C-СВЯЗАННЫМИ ИМИДАЗОЛАМИ, ИНГИБИРУЮЩИЕ ФАРНЕЗИЛТРАНСФЕРАЗУ | 1998 |
|
RU2204553C2 |
| ПРОИЗВОДНЫЕ БЕНЗИЛБИФЕНИЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, БИОЦИДНЫЙ СОСТАВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ БОРЬБЫ С МИКРООРГАНИЗМАМИ | 1999 |
|
RU2218333C2 |
| БЕНЗОТИЕНО [3,2-С]ПИРИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1999 |
|
RU2222542C2 |
| ТРИЦИКЛИЧЕСКИЕ Δ3-ПИПЕРИДИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1999 |
|
RU2230744C2 |
| АНТИБАКТЕРИАЛЬНЫЕ ХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ | 2007 |
|
RU2439058C2 |
| АНТИБАКТЕРИАЛЬНЫЕ ПРОИЗВОДНЫЕ ХИНОЛИНА | 2007 |
|
RU2446159C2 |
| ТИА(ДИА)ЗОЛЫ КАК БЫСТРО ДИССОЦИИРУЮЩИЕ АНТАГОНИСТЫ РЕЦЕПТОРА ДОПАМИНА 2 | 2008 |
|
RU2489431C2 |
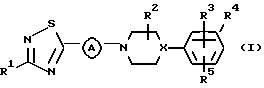
Изобретение относится к производным 1,2,4-тиадиазола, замещенным в 5-м положении, общей формулы I, в которой Х - N; R1 - C1-6 алкил; R2 - водород, R3, R4 и R5 каждый независимо выбран из водорода; трифторметила;  представляет Ar2, Ar2CH2- или Het2; Аr2 - фенил; Het2 - моноциклический гетероцикл, выбранный из тиадиазолила, пиридинила, пиримидинила или пиразинила, их N-оксидным формам, фармацевтически приемлемым кислотно-аддитивным солям и стереохимическим изомерным формам. Описаны также способы получения соединений, промежуточные продукты, используемые в синтезе, и способ получения промежуточного продукта. Соединения действуют как ингибиторы ангиогенеза, что позволяет найти им применение при лечении таких заболеваний, как диабетическая ретиопатия, ангиофиброма, псориаз, остеоартроз и др. 7 c. и 3 з.п. ф-лы, 3 табл.
представляет Ar2, Ar2CH2- или Het2; Аr2 - фенил; Het2 - моноциклический гетероцикл, выбранный из тиадиазолила, пиридинила, пиримидинила или пиразинила, их N-оксидным формам, фармацевтически приемлемым кислотно-аддитивным солям и стереохимическим изомерным формам. Описаны также способы получения соединений, промежуточные продукты, используемые в синтезе, и способ получения промежуточного продукта. Соединения действуют как ингибиторы ангиогенеза, что позволяет найти им применение при лечении таких заболеваний, как диабетическая ретиопатия, ангиофиброма, псориаз, остеоартроз и др. 7 c. и 3 з.п. ф-лы, 3 табл.
 (I)
(I)
их N-оксидные формы, фармацевтически приемлемые кислотно-аддитивные соли и стереохимически изомерные формы,
где Х - N;
R1 - C1-6 алкил;
R2 - водород;
R3, R4 и R5 каждый независимо выбран из водорода, трифторметила;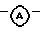 представляет Ar2, Ar2CH2 - или Het2, где Ar2 - фенил, Het2 - моноциклический гетероцикл, выбранный из тиадиазолила, пиридинила, пиримидинила или пиразинила.
представляет Ar2, Ar2CH2 - или Het2, где Ar2 - фенил, Het2 - моноциклический гетероцикл, выбранный из тиадиазолила, пиридинила, пиримидинила или пиразинила.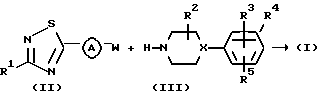
где X, R1 - R5 и  определены в п.1;
определены в п.1;
W представляет подходящую удаляемую группу;
или при необходимости соединения формулы (I) превращают друг в друга, следуя известным в данной области техники реакциям превращения, или, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую кислотно-аддитивную соль, или кислотно-аддитивную соль соединения формулы (I) превращают в форму свободного основания при помощи щелочи; и, если желательно, получают их стереохимически изомерные формы.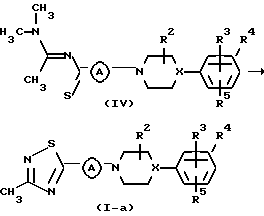
где радикалы X, R2 - R5 и  определены в п.1;
определены в п.1;
W представляет подходящую удаляемую группу,
или при необходимости соединения формулы (I) превращают друг в друга, следуя известным в данной области техники реакциям превращения, или, если желательно, соединение формулы (I) превращают в фармацевтически приемлемую кислотно-аддитивную соль, или кислотно-аддитивную соль соединения формулы (I) превращают в форму свободного основания при помощи щелочи, и, если желательно, получают их стереохимически изомерные формы.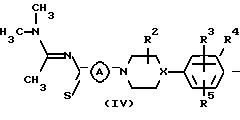
и его кислотно-аддитивная соль, N-оксидная форма или его стереохимически изомерная форма,
в которой X, R2-R5 и бивалентный радикал  определены в п.1.
определены в п.1.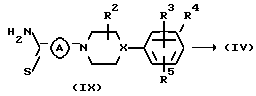
с последующим в случае необходимости превращением соединений формулы (IV) друг в друга, следуя известным в данной области техники реакциям превращения, или, если желательно, соединение формулы (IV) превращают в фармацевтически приемлемую кислотно-аддитивную соль, или кислотно-аддитивную соль соединения формулы (IV) превращают в форму свободного основания при помощи щелочи, и, если желательно, получают их стереохимические изомерные формы.
| ПРОИЗВОДНЫЕ АМИДОВ ТИАЗОЛИДИНКАРБОНОВЫХ КИСЛОТ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИВОАЛЛЕРГИЧЕСКОЙ И ПРОТИВОАСТМАТИЧЕСКОЙ АКТИВНОСТЬЮ И СПОСОБНОСТЬЮ СНИЖАТЬ ФАКТОР АКТИВАЦИИ ТРОМБОЦИТОВ | 1991 |
|
RU2030409C1 |
| Экономайзер | 0 |
|
SU94A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2003-02-27—Публикация
1998-06-22—Подача