Настоящее изобретение относится к трициклическим Δ3-пиперидинам, обладающим антагонистической активностью по отношению к центральным α2-адренорецепторам. Оно также относится к их получению, к композициям, включающим их, и к их применению в качестве лекарственных препаратов.
Известно, что антагонисты центральных α2-адренорецепторов увеличивают высвобождение норадреналина посредством блокирования пресинаптических α2-рецепторов, которые осуществляют ингибирующий контроль над высвобождением нейротрансмиттеров. Благодаря их способности увеличивать концентрацию норадреналина, α2-антагонисты могут использоваться в клинике для лечения или профилактики депрессии, когнитивных нарушений, болезни Паркинсона, сахарного диабета, сексуальной дисфункции и импотенции, повышения внутриглазного давления и заболеваний, связанных с нарушением энтерокинеза, так как все эти состояния связаны с дефицитом норадреналина в центральной или периферической нервной системе.
Соединения настоящего изобретения являются новыми и обладают специфичным и селективным связывающим сродством к различным известным подтипам α2-адренорецепторов, т.е. к α2A, α2B и α2с-адренорецепторам.
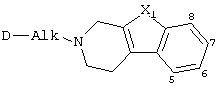
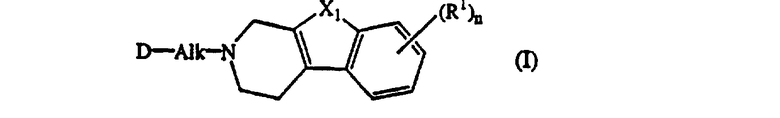
Настоящее изобретение относится к соединениям формулы
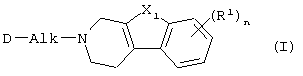
к их N-оксидным формам, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где:
Alk представляет C1-6алкандиил;
n равно 1 или 2;
X1 представляет -О-, -S-, -S(=O)- или -S(=O)2-;
каждый R1 независимо представляет водород, галоген, C1-6алкил, нитро, гидрокси или С1-4алкилокси;
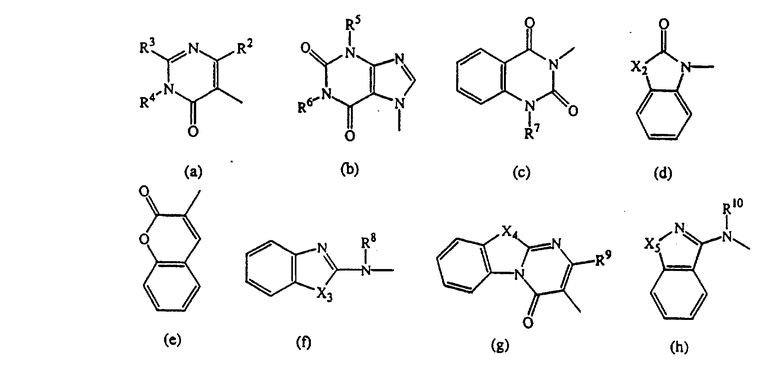
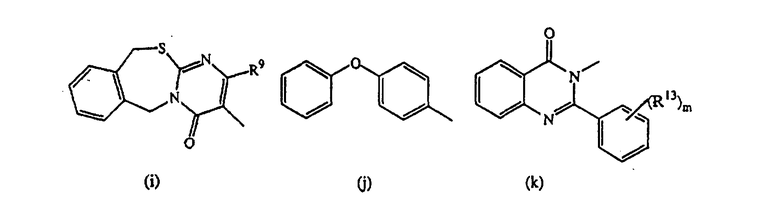
D представляет радикал формулы
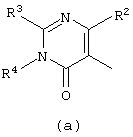
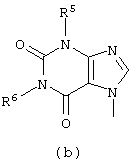
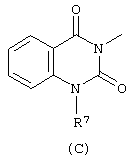
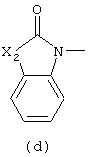
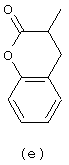
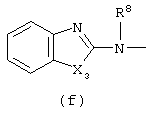
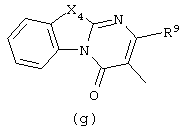
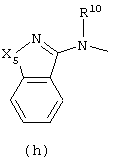
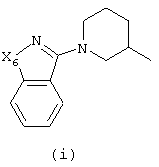
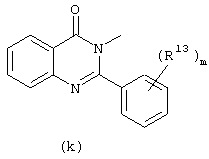
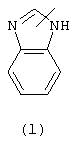
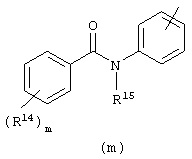
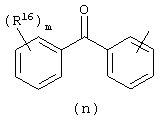
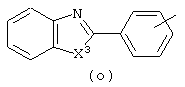
в которой
каждый m независимо равен 0, 1 или 2;
Х2 представляет -O- или -NR11-;
каждый Х3 независимо представляет -О-, -S- или -NR11-;
Х4 представляет -О-, -S-, -CH2-S- или -NR12-;
Х5 и Х6 каждый независимо представляют -CH2-, -О-, -S- или -NR11-;
R2 представляет водород, C1-6алкил, арил или арилС1-6алкил;
R3 представляет водород, C1-6алкил, C1-6алкилокси, C1-6алкилтио, амино или моно- или ди (C1-6алкил) амино;
R4, R5, R6, R7, R8, R9, R10, R11 и R15 каждый независимо представляет водород или C1-6алкил;
R12 представляет водород, C1-6алкил, С1-6алкилоксиС1-6алкил или пиридинилС1-6алкил;
R13, R14 и R16 каждый независимо представляет галоген или C1-6алкил;
R3 и R4, взятые вместе, могут образовывать бивалентный радикал -R3-R4- формулы
-СН2-СН2-СН2- (а-1)
-СН2-СН2-СН2-СН2- (а-2)
-СН=СН-СН2- (а-3)
-СН2-СН=СН- (а-4) или
-СН=СН-СН=СН- (а-5)
причем, один или два атома водорода в упомянутых радикалах от (а-1) до (а-5) каждый независимо может быть замещен галогеном, C1-6алкилом, арилС1-6алкилом, трифторметилом, амино, гидрокси, C1-6алкилокси или C1-10алкилкарбонилокси; или, когда возможно, два геминальных атома водорода могут быть замещены C1-6алкилиденом или арилС1-6алкилиденом; или
-R3-R4- может также представлять
-S-CH2-CH2- (а-6)
-S-CH2-CH2-CH2- (а-7)
-S-СН=СН- (а-8)
-NH-CH2-CH2- (а-9)
-NH-CH2-CH2-CH2- (а-10)
-NH-CH=CH- (а-11)
-NH-CH=N- (а-12)
-S-CH=N- (а-13) или
-СН=СН-O- (а-14)
один или, когда возможно, два или три атома водорода в упомянутых радикалах от (а-6) до (а-14) каждый независимо может быть замещен C1-6алкилом или арилом; и
арил представляет фенил или фенил, замещенный одним, двумя или тремя заместителями, выбранными из галогена, гидрокси, нитро, циано, трифторметила, C1-6алкила, C1-6алкилокси, C1-6алкилтио, меркапто, амино, моно- и ди (C1-6алкил) амино, карбоксила, C1-6алкилоксикарбонила и C1-6алкилкарбонила.
Использующийся в приведенных ранее определениях термин галоген объединяет фтор, хлор, бром и иод. Термин С1-4алкил обозначает линейные и разветвленные насыщенные углеводороды, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 1,1-диметилэтил, 2-метилпропил и т.п. Значения термина C1-6алкил включают С1-4алкильные радикалы и их высшие гомологи, имеющие 5 или 6 атомов углерода, такие как, например, пентил, гексил и т.п. Значения термина C1-10алкил включают C1-6алкильные радикалы и их высшие гомологи, имеющие от 7 до 10 атомов углерода, такие как, например, гептил, октил, нонил, децил и т.п. Термин С1-5алкандиил обозначает бивалентные алкандиильные радикалы с линейной или разветвленной цепью, имеющие от 1 до 5 атомов углерода, такие как, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил и т.п. Подразумевается, что термин C1-6алкандиил включает C1-5алкандиил и его высший гомолог, имеющий 6 атомов углерода, такой как, например, 1,6-гександиил и т.п. Термин C1-6алкилиден обозначает бивалентные алкилиденовые радикалы с линейной или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как, например, метилен, этилиден, 1-пропилиден, 1-бутилиден, 1-пентилиден, 1-гексилиден и т.п.
Подразумевается, что термин аддитивные соли в данном документе включает терапевтически активные формы аддитивных солей, которые (соединения формулы (I)) способны образовывать с соответствующими кислотами, такими как, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородная или бромистоводородная кислота; серная; азотная; фосфорная и другие кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, фумаровая, яблочная, виннокаменная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и другие кислоты.
Подразумевается, что термин фармацевтически приемлемые аддитивные соли, упоминающийся выше в данном документе, также включает формы аддитивных солей с терапевтически активным нетоксичным основанием, в частности, металлом или амином, которые способны образовывать соединения формулы (I). Упомянутые соли могут быть легко получены путем обработки соединений формулы (I), содержащих кислые атомы водорода, соответствующими органическими или неорганическими основаниями, такие соли, как, например, соли аммония, соли щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли органических оснований, например, бензатиновые, N-метил-D-глюкаминовые, гидрабаминовые соли, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п.
И наоборот, упомянутые солевые формы могут быть превращены в свободные формы кислот или оснований путем обработки соответствующим основанием или кислотой.
Термин аддитивная соль, как используется выше в данном документе, также включает сольваты, которые способны образовывать соединения формулы (I), и подразумевается, что упомянутые сольваты включены в объем настоящего изобретения. Примерами таких сольватов являются, например, гидраты, алкоголяты и т.п.
N-оксидные формы соединений формулы (I) включают такие соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида.
Термин стереохимически изомерные формы в данном документе обозначает все возможные изомерные формы, в которых могут находиться соединения формулы (I). Если не оговорено или не определено иначе, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, причем упомянутые смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры.
Некоторые из соединений формулы (I) могут также существовать в таутомерных формах. Имеется в виду, что такие формы, хотя они четко не указаны в вышеприведенной формуле, включены в объем настоящего изобретения.
Далее, когда дается ссылка на положение заместителя R1, используют следующую нумерацию:
Имеется в виду, что где бы он не использовался в данном документе, термин соединения формулы (I) включает также N-оксидные формы, фармацевтически приемлемые аддитивные соли и все стереоизомерные формы.
Особыми соединениями являются те соединения формулы (I), в которых D представляет радикал формулы (а), (b), (с), (d), (е), (f), (g), (h), (i), (j), (k) или (l); m равно 0; и арил представляет фенил, или фенил, замещенный галогеном или C1-6алкилом.
Соединениями, заслуживающими внимания, являются такие соединения формулы (I), в которых n равно 1, и R1 представляет водород, хлор, фтор, метил, метокси или нитро, в особенности когда R1 представляет водород, хлор, метил или метокси.
В том случае, если R1 отличается от водорода, то R1 подходящим образом связан с трициклической кольцевой системой в 6 или 7 положении.
Другой группой соединений, представляющих интерес, являются те соединения формулы (I), в которых Alk представляет метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил или 1,5-пентандиил.
Следующей группой соединений, представляющих интерес, являются соединения формулы (I), в которых D представляет радикал формулы (а), в которой R2 представляет арил или метил, и R3 и R4, взятые вместе, образуют бивалентный радикал формулы (а-5) или (а-8); или D представляет радикал формулы (b), в которой R5 и R6 представляют C1-6алкил, предпочтительно, R5 и R6 представляют метил; или D представляет радикал формулы (с), в которой R7 представляет водород; или D представляет радикал формулы (d), в которой Х2 представляет NR11-, и R11 представляет водород; или D представляет радикал формулы (е); или D представляет радикал формулы (f), в которой Х3 представляет -S- и R8 представляет водород или C1-6алкил, предпочтительно, R8 представляет метил; или D представляет радикал формулы (g), в которой Х4 представляет -CH2-S- или -NR12-, и R12 представляет С1-6алкилоксиС1-6алкил или пиридинилС1-6алкил, предпочтительно, R12 представляет этилоксиэтил или пиридинилметил; или D представляет радикал формулы (h), в которой Х5 представляет -О- или -S-, и R10 представляет водород; или D представляет радикал формулы (j); или D представляет радикал формулы (k), в который m предпочтительно равно 1, и R13 представляет галоген.
Особыми соединениями являются такие соединения формулы (I), в которых X1 представляет -О- или -S-.
Предпочтительными соединениями являются такие соединения формулы (I), в которых n равно 1, R1 представляет водород, хлор, фтор, метокси или метил, X1 представляет -О- или -S-, и D представляет радикал формулы (а), (b), (с), (d), (е), (f), (g), (h), (i), (j) или (k).
Более предпочтительными соединениями являются соединения формулы (I), в которых D представляет радикал формулы (а), (с), (d), (f) и (h); X1 представляет О или S; n равно 1; R1 представляет водород, галоген или метил, и является заместителем в 6 положении; и Alk представляет 1,2-этандиил, 1,3-пропандиил или 1,4-бутандиил.
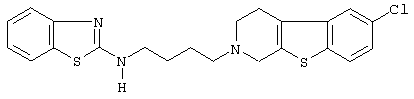
Наиболее предпочтительными соединениями являются соединения, изображенные ниже, или их N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы.
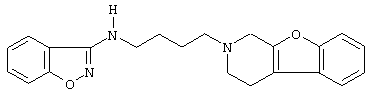
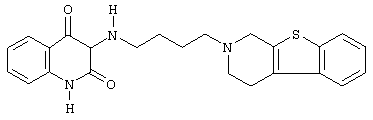
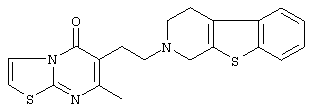
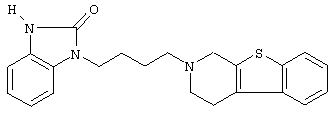
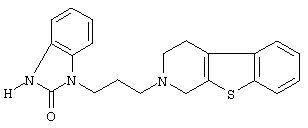
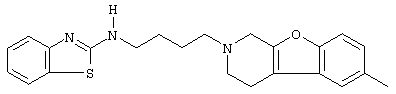
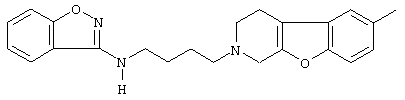
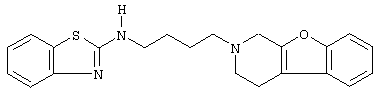
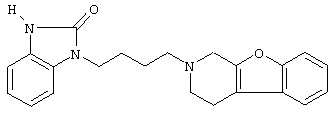
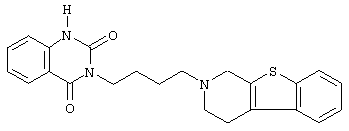
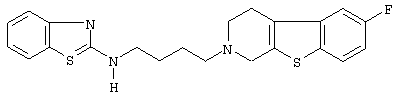
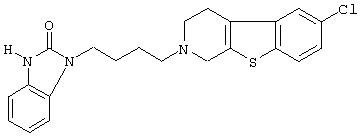
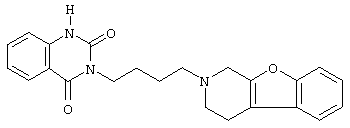
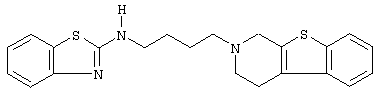
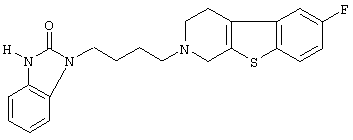
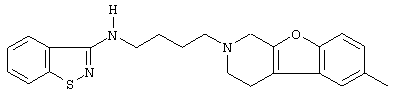
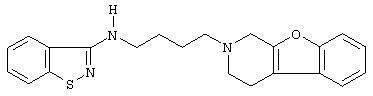
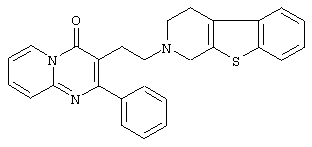
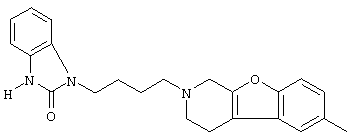
Как правило, соединения формулы (I) можно получить N-алкилированием промежуточного соединения формулы (II) алкилирующим реагентом формулы (III), следуя методике, описанной в ЕР-А-0037265, ЕР-А-0070053, ЕР-А-0196132 и ЕР-А-0378255. В частности, N-алкилирование может проводиться в инертном по отношению к реакции растворителе, таком как, например, метилизобутилкетон, N,N-диметилформамид или N,N-диметилацетамид, в присутствии основания, например, триэтиламина, карбоната натрия или бикарбоната натрия, и необязательно в присутствии катализатора, такого как иодид калия.
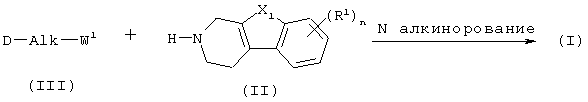
В промежуточном соединении (III) W1 представляет подходящую реакционноспособную уходящую группу, такую как галоген, например., хлор, бром или иод; сульфонилокси, например., метансульфонилокси, 4-метилбензолсульфонилокси.
В данной и следующих реакциях продукты реакции могут выделяться из реакционной среды и, при необходимости, дополнительно очищаться в соответствии с методиками, общеизвестными в данной области, такими как экстракция, кристаллизация, растирание и хроматография.
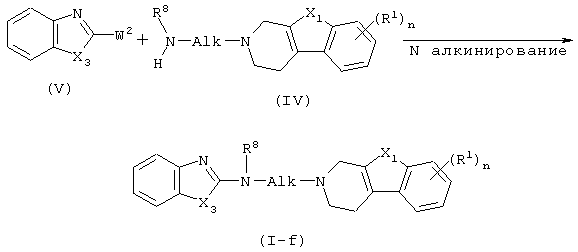
Соединения формулы (I), в которых D представляет радикал формулы (f), представленные формулой (I-f), могут быть получены N-алкилированием амина формулы (IV) промежуточным соединением (V), в котором W2 представляет подходящую реакционноспособную уходящую группу, такую как, например, галоген.
Характерный способ получения соединений формулы (I), в которых D представляет собой радикал формулы (j), и Alk представляет -(Alk’)p-СН2-, где Alk’ представляет С1-5алкандиил, и р равно 0 или 1, т.е. соединений, представленных формулой (I-j), включает восстановительное N-алкилирование промежуточного соединения формулы (II) альдегидным производным формулы (IV).
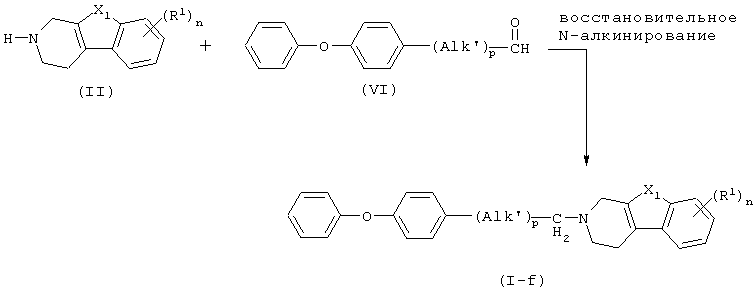
Упомянутая реакция восстановительного N-алкилирования может удобно осуществляться восстановлением смеси реагентов в подходящем растворителе, инертном по отношению к реакции, следуя известным в данной области приемам восстановительного N-алкилирования. В частности, для увеличения скорости реакции реакционную смесь можно перемешивать и/или нагревать. Подходящими растворителями являются, например, вода, метанол, этанол, 2-пропанол и т.п. Реакцию удобно проводить с использованием цианоборгидрида натрия, боргидрида натрия, муравьиной кислоты, или их солей, и подобных восстанавливающих агентов, или, альтернативно, в атмосфере водорода, необязательно при повышенных температуре и/или давлении, в присутствии подходящего катализатора, такого как, например, палладий на угле, платина на угле и т.п. Для предотвращения нежелательного дополнительного гидрирования некоторых функциональных групп в реагентах и продуктах реакции, может быть полезным добавлять к реакционной смеси подходящий агент, отравляющий катализатор, например, тиофен, хинолин-серу и т.п. В некоторых случаях может быть также полезно добавлять к реакционной смеси соль щелочного металла, такую как, например, фторид калия, ацетат калия и подобные им соли.
Соединения формулы (I) могут превращаться друг в друга с помощью известных в данной области реакций преобразования функциональных групп.
Соединения формулы (I) могут также превращаться в соответствующие N-оксидные формы с помощью известных в данной области методов превращения трехвалентного азота в его N-оксидную форму. Как правило, упомянутая реакция N-окисления может осуществляться путем взаимодействия исходного материала формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочноземельных металлов, например, пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота, или галоген-замещенная бензолкарбопероксикислота, например, 3-хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например, пероксиуксусная кислота, алкилгидропероксиды, например, трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например, этанол и т.п., углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например, дихлорметан, и смеси таких растворителей.
Ряд промежуточных соединений и исходных веществ являются промышленно доступными, или являются известными соединениями, которые могут быть получены в соответствии с известными в данной области методами.
Например, некоторые из промежуточных соединений формулы (III) и способы их получения описаны в ЕР-А-0037265, ЕР-А-0070053, ЕР-А-0196132 и ЕР-А-0378255.
Промежуточные соединения формулы (II), в которой Х представляет -О-, могут быть получены, как описано в Syn. Comm. (1995), стр.3883-3900 и J.Chem. Soc., 1965, стр.4939-4953; и с помощью методов, известных в данной области. Общая методика изображена на схеме 1.
Схема 1
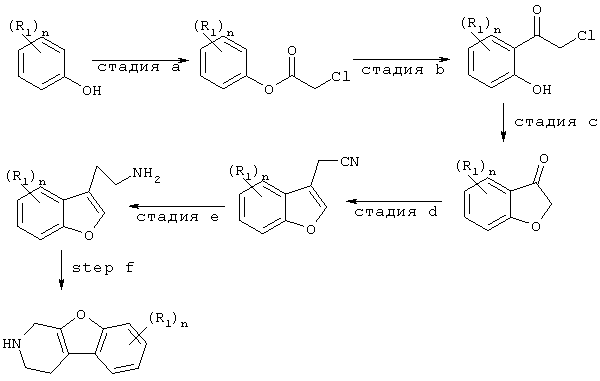
Промежуточные соединения формулы (II), в которой Х представляет -S-, могут быть получены в соответствии с J.Med.Chem., 1992, 35(7), стр.1176-1182, и с помощью методов, известных в данной области. Общая методика изображена на схеме 2.
Схема 2
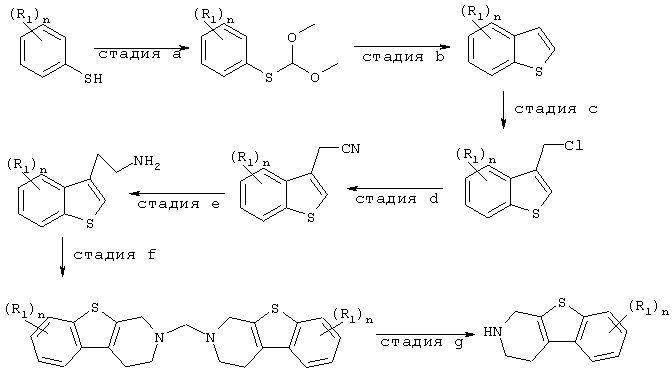 Альтернативно, промежуточные соединения формулы (II) могут быть получены в соответствии с Synth. Comm., 1995, стр.3883-3900, и с помощью методов, известных в данной области. Общая методика изображена на схеме 3.
Альтернативно, промежуточные соединения формулы (II) могут быть получены в соответствии с Synth. Comm., 1995, стр.3883-3900, и с помощью методов, известных в данной области. Общая методика изображена на схеме 3.
Схема 3
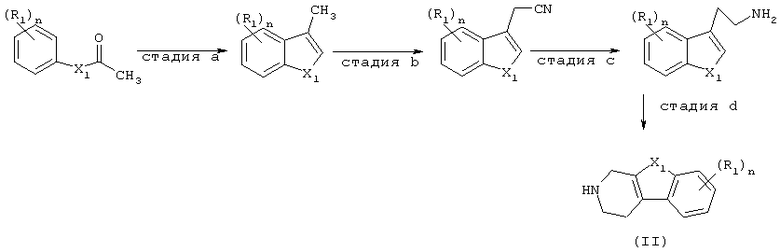
Промежуточные соединения формулы (III), в которых D представляет радикал формулы (h), представленные формулой (III-h), могут быть получены путем взаимодействия бензизоксазола или бензизотиазола формулы (VII), в которой W3 представляет подходящую уходящую группу, такую как, галоген, с аминоспиртовым производным формулы (VIII), в присутствии катализатора, такого как иодид калия. Обычно реакционную смесь перемешивают при повышенных температурах. Впоследствии подходящая уходящая группа, такая как галоген, например, хлор, может быть введена в полученное таким образом спиртовое производное с использованием известных в данной области методов, например, взаимодействия спирта с тионилхлоридом в таком растворителе, как хлороформ.
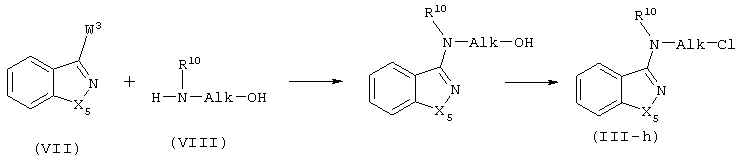
Некоторые соединения формулы (I) и некоторые промежуточные соединения настоящего изобретения содержат, по меньшей мере, один асимметричный атом углерода. Чистые стереохимически изомерные формы упомянутых соединений и упомянутых промежуточных соединений могут быть получены с помощью известных в данной области процедур. Например, диастереомеры могут разделяться с помощью физических методов, таких как избирательная кристаллизация или хроматографические приемы, например, противоточное распределение, жидкостная хроматография и подобные методы. Энантиомеры могут быть получены из рацемических смесей сначала превращением упомянутых рацемических смесей с помощью подходящих разрешающих агентов, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физического разделения указанных смесей диастереомерных солей или соединений с помощью, например, избирательной кристаллизации или хроматографических приемов, например, жидкостной хроматографии и подобных методов; и, наконец, превращения упомянутых разделенных диастереомерных солей или соединений в соответствующие энантиомеры.
Чистые стереохимически изомерные формы соединений формулы (I) могут быть также получены из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ, при условии, что промежуточные реакции происходят стереоспецифически. Следует иметь в виду, что чистые и смешанные стереохимически изомерные формы соединений формулы (I) включаются в объем данного изобретения.
Соединения формулы (I), их N-оксиды, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы блокируют пресинаптические α2-рецепторы на центральных норадренергических нейронах, увеличивая таким образом высвобождение норадреналина. Блокирование упомянутых рецепторов подавляет или облегчает ряд симптомов, связанных с дефицитом норадреналина в центральной или периферической нервной системе. Терапевтическими показаниями для применения соединений настоящего изобретения являются депрессия, когнитивные нарушения, болезнь Паркинсона, сахарный диабет, сексуальная дисфункция и импотенция, а также повышенное внутриглазное давление.
Было также показано, что блокирование α2-рецепторов в центральной нервной системе увеличивает высвобождение серотонина, который может вносить вклад в терапевтическое действие при депрессии (Maura et al., 1992, Naunyn-Schmiedeberg’s Arch. Pharmacol., 345:410-416).
Было также показано, что блокирование α2-рецепторов может вызывать увеличение концентрации внеклеточной DOPAC (3,4-дигидрофенилуксусной кислоты), которая является метаболитом допамина и норадреналина.
Ввиду полезности обсуждаемых соединений для лечения заболеваний, связанных с дефицитом норадреналина в центральной нервной системе, в особенности депрессии и болезни Паркинсона, настоящее изобретение предоставляет способ лечения теплокровных животных, страдающих от таких заболеваний, в особенности, от депрессии и болезни Паркинсона, упомянутый способ включает системное введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой аддитивной соли.
Соединения настоящего изобретения являются также потенциально полезными для лечения болезни Альцгеймера и деменции, так как известно, что α2-антагонисты способствуют высвобождению ацетилхолина (Tellez et al., 1997, J.Neurochem. 68:778-785).
В общем, предполагается, что ежедневное эффективное терапевтическое количество составляет приблизительно от 0,01 мг/кг до 4 мг/кг массы тела.
Таким образом, настоящее изобретение также относится к соединениям формулы (I), определенных в данном документе выше, для использования в качестве лекарственных препаратов. Далее, настоящее изобретение также относится к применению соединений формулы (I) в производстве лекарственных препаратов для лечения депрессии или болезни Паркинсона.
Ex vivo а также in vitro исследования рецепторной передачи сигнала и рецепторного связывания могут быть использованы для оценки α2 адренорецепторного антагонизма настоящих соединений. В качестве показателей блокады центрального α2-адренорецептора in vivo можно использовать восстановление утраты рефлекса выпрямления у крыс, наблюдаемое после внутривенной инъекции ксилазина, и ингибирование тремора, вызванного резерпином, у крыс.
Соединения настоящего изобретения также обладают способностью быстро проникать в центральную нервную систему.
С целью введения обсуждаемые соединения могут преобразовываться в различные готовые формы фармацевтических композиций, включающих фармацевтически приемлемый носитель, и в качестве активного ингредиента терапевтически эффективное количество соединения формулы (I). Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения в виде аддитивной соли или свободной формы кислоты или основания в качестве активного ингредиента объединяют в тесную смесь с фармацевтически приемлемым носителем, которая может принимать широкий ряд форм, в зависимости от формы препарата, требующейся для введения. Желательно, чтобы эти фармацевтические композиции были представлены в единичной дозированной форме, предпочтительно подходящей для введения перорально, чрескожно, или для парентеральной инъекции. Например, при получении композиций в виде дозированных форм для перорального введения, может использоваться любая из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п. в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазочные вещества, связующие вещества, разрыхляющие агенты и т.п.в случае порошков, пилюль, капсул и таблеток. Благодаря простоте введения таблетки и капсулы представляют собой наиболее преимущественные единичные дозированные формы для перорального введения, в этом случае, очевидно, применяются твердые фармацевтические носители. В случае композиций для парентерального введения, носитель обычно включает стерильную воду, по меньшей мере, она составляет большую часть, хотя могут быть включены и другие компоненты, например, способствующие растворимости. Например, могут быть получены растворы для инъекций, в которых носитель включает солевой или физиологический раствор, раствор глюкозы, или смесь этих растворов. Растворы для инъекций, содержащие соединения формулы (I), могут быть приготовлены в масле для обеспечения пролонгированного действия. Подходящими для этой цели маслами являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические эфиры глицерина и длинно-цепочечных жирных кислот, и смеси этих и других масел. Могут быть также получены суспензии для инъекций, в этом случае могут применяться соответствующие жидкие носители, суспендирующие агенты и т.п. В композициях, подходящих для чрескожного введения, носитель необязательно включает агент, увеличивающий проникание, и/или подходящий увлажняющий агент, необязательно в сочетании с подходящими добавками любой природы в незначительных количествах, эти добавки не должны оказывать каких-либо вредных воздействий на кожу. Упомянутые добавки могут облегчать введение в кожу и/или могут быть полезными для получения желаемых композиций. Данные композиции могут вводиться различными путями, например, в виде чрескожного пластыря, накладки, или в виде мази. Аддитивные соли соединения формулы (I) благодаря их повышенной растворимости в воде по сравнению с соответствующими свободными основными или формами свободных кислот, очевидно, являются более подходящими при получении водных композиций.
Особенно преимущественным является получение вышеупомянутых фармацевтических композиций в единичной дозированной форме для простоты введения и однородности дозировки. Единичная дозированная форма в описании и формуле изобретения данного документа относится к физически дискретным единицам, подходящим в качестве единичных доз, причем каждая единица содержит заданное количество активного ингредиента, рассчитанное для получения желательного терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с насечками и покрытые таблетки), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, емкости в чайную ложку, столовую ложку и т.п., и их разделенные множественные формы.
Следующие примеры предназначаются для иллюстрации настоящего изобретения.
Экспериментальная часть
Далее в данном документе термин КТ обозначает комнатную температуру, ТГФ обозначает тетрагидрофуран и ДИПЭ обозначает диизопропиловый эфир.
Получение промежуточных соединений
Пример А1
a) Смесь 3-хлор-1,2-бензизоксазола (0,08 моль), 4-амино-1-бутанола (0,24 моль) и KI (1 г) перемешивают 4 дня при 80°С. Реакционную смесь охлаждают, растворяют в CH2Cl2 и очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН 95/5). Чистые фракции собирают, и растворитель упаривают, получая 15,4 г (93%) 4-(1,2-бензизоксазол-3-иламино)-1-бутанола (промежут. соед.1).
b) Тионилхлорид (0,048 моль) охлаждают до 0°С. Добавляют по каплям раствор промежуточного соединения 1 (0,048 моль) в СНCl3 (20 мл) и реакционную смесь перемешивают в течение ночи при КТ. Растворитель упаривают. Остаток промывают водой. Реакционную смесь экстрагируют CH2Cl2. Отделенный органический слой сушат (МgSО4), фильтруют и растворитель упаривают, получая 10,4 г N-(4-хлорбутил)-1,2-бензизоксазол-3-амина (промежут. соед.2).
Пример А2
а) Реакция проходит в атмосфере N2. NaH 60% (0,17 моль) перемешивают в ТГФ (350 мл). Добавляют по каплям раствор диэтил(цианометил)фосфоната (0,17 моль) в ТГФ (150 мл) в течение ±20 мин (экзотермическое повышение температуры до 30°С). Смесь перемешивают 20 мин при КТ, затем охлаждают до 0°С. В течение 30 мин при 0°С добавляют по каплям раствор 5-метил-3-бензофуранона (0,15 моль) в ТГФ (350 мл). Реакционную смесь перемешивают в течение ночи при КТ, затем выливают в воду (1500 мл) и перемешивают. Смесь экстрагируют эфиром, ДИПЭ (2×), сушат (МgSO4), фильтруют и растворитель упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/гексан 50/50). Целевые фракции собирают и растворитель, упаривают, получая 21,2 г (82%) 5-метил-3-бензофуранацетонитрила (промежут. соед.3).
b) Смесь промежуточного соединения (3) (0,12 моль) в NН3/СН3ОН (400 мл) гидрируют, используя никель Ренея (3 г) в качестве катализатора. После поглощения Н2 (2 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают на силикагеле на стеклянном фильтре (элюент: CH2Cl2/(СН3ОН/NН3) от 98/2 до 96/4). Целевые фракции собирают и растворитель упаривают. Остаток (±2,1 г) растворяют в 2-пропаноле (500 мл) и превращают в соль хлористоводородной кислоты (1:1), используя HCl/2-пропанол. Смесь перемешивают при КТ. Растворитель упаривают. Остаток перемешивают в ДИПЭ, отфильтровывают и сушат, получая 24,4 г (96%) гидрохлорида 5-метил-3-бензофуранэтанамина (1:1) (промежут. соед.4).
c) Смесь промежуточного соединения (4) (0,0024 моль) в Н2О (2 мл), уксусной кислоты (2 мл) и 37% формальдегида (2 мл) перемешивают один час при 100°С. Реакционную смесь охлаждают и выливают в 1М NaOH (50 мл). Осадок отфильтровывают, промывают водой, затем растворяют в 1N HCl (100 мл). Смесь перемешивают 15 мин на подогретой водяной бане (80°С). Растворитель упаривают. Добавляют 2-пропанол. Растворитель упаривают. Остаток перемешивают в кипящем 2-пропаноне, затем оставляют охлаждаться до КТ при перемешивании. Осадок отфильтровывают и сушат, получая 0,40 г 1,2,3,4-тетрагидро-6-метилбензофуро[2,3-с]пиридина моногидрохлорид. моногидрата (промежут. соед.5).
Пример A3
a) Смесь 1,2,3,4-тетрагидро-[1]бензотиено[2,3-с]пиридина (0,02 моль), Nа2СО3 (5 г), KI (0,1 г) и 4-хлорбутаннитрила (0,025 моль) в ацетонитриле (50 мл) и метилбензоле (150 мл) перемешивают и нагревают с обратным холодильником в течение ночи, затем охлаждают, фильтруют и фильтрат упаривают. Остаток (масло) очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН 98/2). Чистые фракции собирают и растворитель упаривают, получая 5,2 г 3,4-дигидробензотиено[2,3-с]пиридин-2(1Н)-бутаннитрила (промежут. соед.6).
b) Смесь промежуточного соединения (6) (0,0195 моль) в NН3/СН3ОН (200 мл) гидрируют, используя никель Ренея (4 г) а качестве катализатора в присутствии раствора тиофена (4 мл). После поглощения Н2 (2 экв.) катализатор отфильтровывают через дикалит и фильтрат упаривают, получая 3,9 г 3,4-дигидробензотиено[2,3-с]пиридин-2(1Н)-бутанамина (промежут. соед.7).
Пример А4
a) Смесь 6-хлор-1,2,3,4-тетрагидро[1]бензотиено [2,3-с]пиридина (0,02 моль), 1,1-диметилэтил(4-хлорбутил) карбамата (0,02 моль), Na2СО3 (3,5 г) и KI (0,1 г) в 4-метил-2-пентаноне (300 мл) перемешивают и нагревают с обратным холодильником в течение ночи. Реакционную смесь охлаждают, фильтруют и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH 96/4). Целевые фракции собирают и растворитель упаривают, получая 5,2 г 1,1-диметилэтил[4-(6-хлор-3,4-дигидробензо [1] тиено[2,3-с]пиридин-2(1Н)-ил)бутил]карбамата (промежут. соед.8).
b) Смесь промежуточного соединения (8) (0,013 моль) в HCl/2-пропаноле (50 мл) и 2-пропаноле (100 мл) перемешивают и нагревают с обратным холодильником в течение 30 мин. Реакционную смесь охлаждают. Осадок (НСl соль) отфильтровывают и превращают в свободное основание, используя NH4OH. Смесь экстрагируют CH2Cl2. Отделенный органический слой сушат, фильтруют и растворитель упаривают. Остаток растирают в СН3СN/ДИПЭ, отфильтровывают и сушат, получая 2,2 г 6-хлор-3,4-дигидробензо[1]тиено[2,3-с]пиридин-2(1Н)-ил)бутанамина (промежут. соед.9).
Пример А5
а) Смесь 37% формальдегида (31 г) и ZnCl2 (10 г) в этилацетате (90 мл) и 12N НСl (190 мл) перемешивают при -10°C. HCl (газообразному) дают возможность барботировать через смесь до насыщения (при -10°С). При температуре <0°С добавляют по каплям 5-фторбензо[b]тиофен (0,35 моль). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Добавляют толуол (200 мл) и смесь энергично перемешивают. Органический слой отделяют, промывают водным раствором NaHCO3 и водой, сушат, фильтруют и растворитель упаривают. Остаток растирают в гексане, отфильтровывают и сушат, получая 58 г 3-(хлорметил)-5-фторбензо[b]тиофена (82,6%) (промежут. соед.10).
b) Смесь цианида натрия (0,33 моль) и октагидродибензо[b,k][1,4,7,10,13,16]гексаоксациклооктадецина (0,050 г) в диметилсульфоксиде (110 мл) перемешивают при 30°С. На протяжении 30 мин добавляют промежуточное соединение (10) (0,29 моль). Смесь оставляют охлаждаться до комнатной температуры при перемешивании. Затем реакционную смесь перемешивают в воде со льдом. Осадок отфильтровывают, промывают водой и растворяют в CH2Cl2. Органический раствор сушат, фильтруют и растворитель упаривают, получая 5-фторбензо[b]тиофен-3-ацетонитрил (промежут. соед.11).
c) Смесь промежуточного соединения (11) (0,29 моль) в NH3/СН3ОН (700 мл) гидрируют при 14°С, используя никель Ренея (5 г) в качестве катализатора в присутствии раствора тиофена (10 мл). После поглощения Н2 (2 экв.) катализатор отфильтровывают через дикалит и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/(CH3OH/NH3) 96/4). Целевые фракции собирают и растворитель упаривают. Остаток растворяют в ДИПЭ и превращают в соль хлористоводородной кислоты (1:1), используя НСl/2-пропанол. Осадок отфильтровывают, промывают ДИПЭ и сушат, получая 48,5 г гидрохлорида 5-фторбензо[b]тиофен-3-этанамина (1:1) (промежут. соед.12).
d) Смесь промежуточного соединения (12) (0,21 моль) в Н2О (190 мл), уксусной кислоты (190 мл) и 37% формальдегида (190 мл) перемешивают и нагревают с обратным холодильником в течение одного часа. Реакционную смесь оставляют охлаждаться до комнатной температуры, затем выливают в 4N NaOH (1200 мл) при перемешивании. Осадок отфильтровывают и растирают в СН3СN, отфильтровывают, промывают ДИПЭ и сушат, получая 21 г гидрохлорида 1,1’-метиленбис[6-фтор-1,2,3,4-тетрагидро-[1]бензотиено[2,3-с]пиридина (промежут. соед.13).
e) Смесь промежуточного соединения (13) (0,049 моль) в воде (1700 мл) и 12N НСl (285 мл) перемешивают и нагревают с обратным холодильником в течение одного часа. Осадок отфильтровывают, промывают CH3CN и ДИПЭ и сушат, получая 17,7 г гидрохлорида 6-фтор-1,2,3,4-тетрагидро-[1]бензотиено[2,3-с]пиридина (промежут. соед.13).
Пример А6
Реакция проходит в атмосфере N2. Раствор 1,2-дихлорэтандиоила (0,026 моль) в CH2Cl2 (60 мл) перемешивают при -60°С. Добавляют по каплям диметилсульфоксид (3,8 мл) при -60°С и смесь перемешивают в течение 10 мин. Раствор промежуточного соединения (1) (0,024 моль) в CH2Cl2 (120 мл) добавляют по каплям при -60°С и смесь перемешивают в течение одного часа при -60°С. Добавляют по каплям N,N-диэтилэтанамин (13,7 мл) и реакционную смесь перемешивают в течение 10 мин при -60°С, после чего оставляют нагреваться до комнатной температуры. Смесь выливают в воду (250 мл). Смесь перемешивают в течение 10 мин. Отделенный органический слой сушат, фильтруют и растворитель упаривают. Остаток растирают в гексане, отфильтровывают и сушат, получая 3,9 г 4-(1,2-бензизоксазол-3-иламино)бутаналя (80%) (промежут. соед.15).
В. Получение целевых соединений
Пример В1
а) Смесь гидрохлорида 1,2,3,4-тетрагидробензофуро[2,3-с]пиридина (1:1) (0,007 моль), 3-(2-хлорэтил)-2-метил-4Н-пиридо[1,2-а]-пиримидин-4-она (0,012 моль), Na2СО3 (0,015 моль) и KI (каталитическое количество) в 2-бутаноне (100 мл) перемешивают и нагревают с обратным холодильником в течение ночи. Реакционную смесь фильтруют горячей, и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/(СН3ОН/NН3) от 98/2 до 97/3). Наиболее чистые фракции собирают и растворитель упаривают. Остаток растворяют в 2-пропаноле и добавляют (Е)-2-бутендиовую кислоту (1 г). Смесь кипятят и затем перемешивают при КТ. Осадок отфильтровывают и сушат, получая 2,00 г (61%) 3-[2-(3,4-дигидробензофуро[2,3-с]пиридин-2(1Н)-ил)этил]-2-метил-4Н-пиридо[1,2-а]пиримидин-4-она (Е)-2-бутен-диоата (2:1) (соед.1).
Пример B1b
Смесь гидрохлорида 6-хлор-1,2,3,4-тетрагидро-[1]бензотиено[2,3-с]пиридина (1:1) (0,01 моль), 1-(4-хлорбутил)-1,3-дигидро-3-(1-метилэтенил)-2Н-бензимидазол-2-она (0,01 моль), Na2СО3 (3,5 г) и KI (0,1 г) в 2-бутаноне (200 мл) перемешивают и нагревают с обратным холодильником в течение ночи, затем охлаждают, фильтруют и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/(СН3ОН/NН3) 95/5). Целевые фракции собирают и растворитель упаривают. Остаток перемешивают в кипящей смеси HCl/2-пропанол. Добавляют ДИПЭ и смесь перемешивают. Осадок отфильтровывают, промывают ДИПЭ и сушат. Данную фракцию превращают в свободное основание, затем экстрагируют СН2Сl2. Отделенный органический слой сушат, фильтруют и растворитель упаривают. Остаток растворяют в 2-пропаноне и превращают в соль (Е)-2-бутендиовой кислоты (1:1). Осадок отфильтровывают, промывают ДИПЭ и сушат, получая 0,82 г 1-[4-(6-хлор-3,4-дигидробензотиено[2,3-с]пиридин-2(1Н)-ил)бутил]-1,3-дигидро-2Н-бензимидазол-2-она (Е)-2-бутендиоата (1:1) (соединение 21).
Пример В2
Смесь гидрохлорида 6-хлор-1,2,3,4-тетрагидро-[1]бензотиено[2,3-с]пиридина (1:1) (0,00057 моль), 7-(2-хлорэтил)-1,3-диметил-7Н-пурин-2,6-(1Н,3Н)-диона (0,100 г) и Nа2СО3 (0,100 г) в 2-бутаноне (2 мл) перемешивают в течение выходных при 100°С. Целевое соединение выделяют и очищают с помощью высокоэффективной жидкостной хроматографии на Kromasil немодифицированном силикагеле с частицами сферической формы (55 г, 60А, 5 мкм) (колонка: 2 см I.D.; элюент: СН2Сl2/(СН2Сl2/СН3ОН 90/10)/СН3ОН (0 мин) 100/0/0, (10,50 мин) 0/100/0, (12,50 мин) 50/0/50, (14,00 мин) 0/0/100, (15,01-20,00 мин) 100/0/0). Чистые фракции собирают, и растворитель упаривают, получая 0,070 г 7-[2-(3,4-дигидробензотиено[2,3-с]пиридин-2(1Н)-ил)этил]-1,3-диметил-1Н-пурин-2,6(3Н,7Н)-диона (соединение 7).
Пример В3
Смесь промежуточного соединения (9) (0,007), 2-хлорбензотиазола (0,01 моль) и Na2CO3 (2 г) в 2-этоксиэтаноле (50 мл) перемешивают и нагревают с обратным холодильником в течение 3 ч. Реакционную смесь охлаждают, фильтруют и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН 96/4). Чистые фракции собирают и растворитель упаривают. Остаток растирают в ДИПЭ/СН3СN, отфильтровывают, промывают ДИПЭ и сушат, получая 1,75 г N-2-бензотиазолил-6-хлор-3,4-дигидробензо[1]тиено[2,3-с]пиридин-2(1Н)-бутанамина (58,3%) (соединение 64).
Пример В4
Смесь 3,4-дигидро-7-метоксибензофуро[2,3-с]пиридин-2(1Н)-бутанамина (0,0055), 3-хлор-1,2-бензизотиазола (0,0089 моль) и NаНСО3 (0,01 моль) перемешивают в течение 1,5 ч при 120°С (плав.) Добавляют 1-бутанол (0,5 мл). Реакционную смесь охлаждают, затем растворяют в CH2Cl2 и очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/(СН3ОН/NН3) 98/2). Целевые фракции собирают и растворитель упаривают. Остаток растворяют в 2-пропаноне и превращают в соль хлористоводородной кислоты (1:2), используя HCl/2-пропанол. Смесь перемешивают при комнатной температуре. Осадок отфильтровывают и сушат, получая 1,60 г моногидрата моногидрохлорида N-(1,2-бензизотиазол-3-ил)-3,4-дигидро-7-метоксибензофуро[2,3-с]пиридин-2(1Н)-бутанамина (61%) (соединение 55).
Пример В5
Уксусную кислоту (0,005 моль) добавляют к моногидрату моногидрохлорида 1,2,3,4-тетрагидро-7-метоксибензофуро[2,3-с]пиридина (0,005 моль) в 1,2-дихлорэтане (30 мл). Добавляют промежуточное соединение (15) (0,005 моль) и смесь перемешивают до полного растворения. Добавляют NаВН(ОАс)3 (0,005 моль) и реакционную смесь перемешивают в течение выходных при комнатной температуре. Реакционную смесь разбавляют СН2Сl2 (100 мл), промывают 10% водным раствором NaOH, затем сушат (MgSO4), фильтруют и растворитель упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/(СН3ОН/NН3) 98/2). Целевые фракции собирают и растворитель упаривают. Остаток растворяют в 2-пропаноне и превращают в соль (Е)-2-бутендиовой кислоты (2:1), используя (Е)-2-бутендиовую кислоту (0,8 г). Смесь кипятят, затем оставляют охлаждаться до комнатной температуры при перемешивании. Осадок отфильтровывают и сушат, получая 1,50 г N-(1,2-бензизоксазол-3-ил)-3,4-дигидро-7-метоксибензофуро[2,3-с] пиридин-2(1Н)-бутанамина (68%) (соединение 65).
Пример В6
Смесь промежуточного соединения (7) (0,015 моль), 2-хлорбензотиазола (0,015 моль), Na2СО3 (3 г) и KI (каталитическое количество) в метилбензоле (150 мл) перемешивают и нагревают с обратным холодильником в течение ночи, затем охлаждают до 50°С. Реакционную смесь фильтруют и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/СН3ОН 95/5). Чистые фракции собирают и растворитель упаривают. Остаток кристаллизуют из СН3СN, отфильтровывают и сушат, получая 2,4 г N-2-бензотиазолил-3,4-дигидробензотиено[2,3-с]пиридин-2(1Н)-бутанамина (соединение 25).
Пример В7
Гидрохлорид 1,2,3,4-тетрагидробензофуро[2,3-с]пиридина (1:1) (0,01 моль) превращают в свободное основание, используя СН2Сl2/Н2О·NН4OН. Смесь упомянутого свободного основания, промежуточного соединения (2) (0,019 моль) и триэтиламина (0,015 моль) в N,N-диметилацетамиде (50 мл) перемешивают при 70°С в течение 48 ч. Растворитель упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: СН2Сl2/(СН3ОН/NН3) 98/2). Целевые фракции собирают и растворитель упаривают. Остаток растворяют в 2-пропаноле и обрабатывают (Е)-2-бутендиовой кислотой (1 г). Смесь кипятят, затем перемешивают при КТ. Растворитель упаривают. Остаток растворяют в 2-пропаноне, кипятят и затем перемешивают при КТ. Растворитель упаривают. Остаток растворяют в 2-пропаноле подкисляют смесью HCl/2-пропанол, перемешивают, и полученный осадок отфильтровывают и сушат, получая 0,70 г (16%) моногидрохлорида N-1,2-бензизоксазол-3-ил-3,4-дигидробензофуро[2,3-с]пиридин-2(1Н)-бутанамина (61%) (соединение 36).
Пример В8
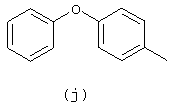
Исходное вещество гидрохлорид 1,2,3,4-тетрагидробензофуро[2,3-с]пиридина (1:1) (0,01 моль) подщелачивают, экстрагируют и растворитель упаривают, получая свободное основание (1,4 г, 0,008 моль). Смесь упомянутого свободного основания и 4-феноксибензальдегида (0,01 моль) в метаноле (150 мл) гидрируют, используя 10% Pd/C (1 г) в качестве катализатора в присутствии 4% тиофена (1 мл). После поглощения Н2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: CH2Cl2/ (СН3ОН/NН3) 98/2). Целевые фракции собирают и растворитель упаривают. Остаток растворяют в 2-пропаноле и превращают в соль (Е)-2-бутендиовой кислоты (1:1), используя (Е)-2-бутендиовую кислоту (1,2 г). Смесь кипятят, затем оставляют охлаждаться до КТ при перемешивании. Осадок отфильтровывают и сушат, получая 1,80 г (49%) 1,2,3,4-тетрагидро-2-[(4-феноксифенил)метил]бензофуро[2,3-с]пиридина (Е)-2-бутендиоата (1:1) (соединение 33).
Пример В9
Смесь гидрохлорида 1,2,3,4-тетрагидро-[1]бензотиено[2,3-с]пиридина (1:1) (0,01 моль) и феноксибензальдегида (0,01 моль) в метаноле (150 мл) гидрируют при 50°С, используя 10% Pd/C (1 г) в качестве катализатора в присутствии ацетата калия (2 г) и 4% тиофена (1 мл). После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат упаривают. Остаток кристаллизуют из СН3СN, отфильтровывают и упаривают. Данную фракцию (3 г) перемешивают в воде с небольшим количеством NH4OH и смесь экстрагируют CH2Cl2. Отделенный органический слой сушат (МgSO4), фильтруют и растворитель упаривают. Остаток кристаллизуют из СН3СN, отфильтровывают и сушат, получая 2,7 г 1,2,3,4-тетрагидро-2-[(4-феноксифенил)метил]бензотиено[2,3-с] пиридина (соединение 34).
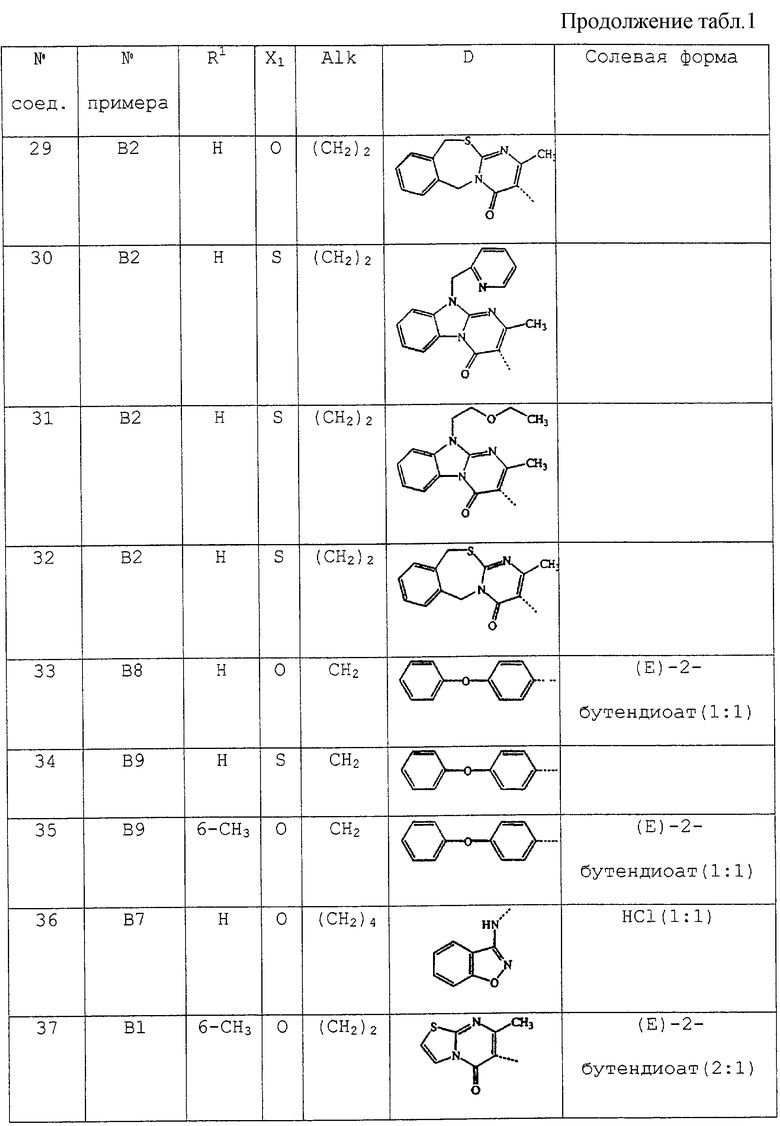
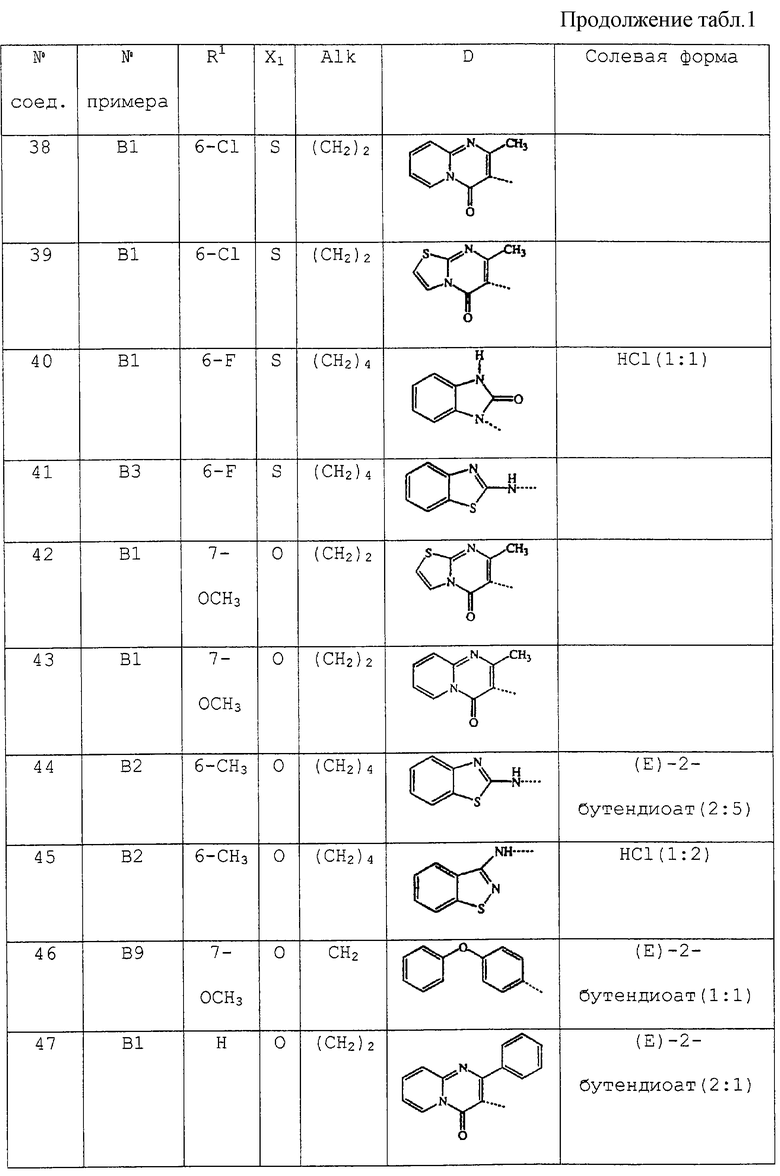
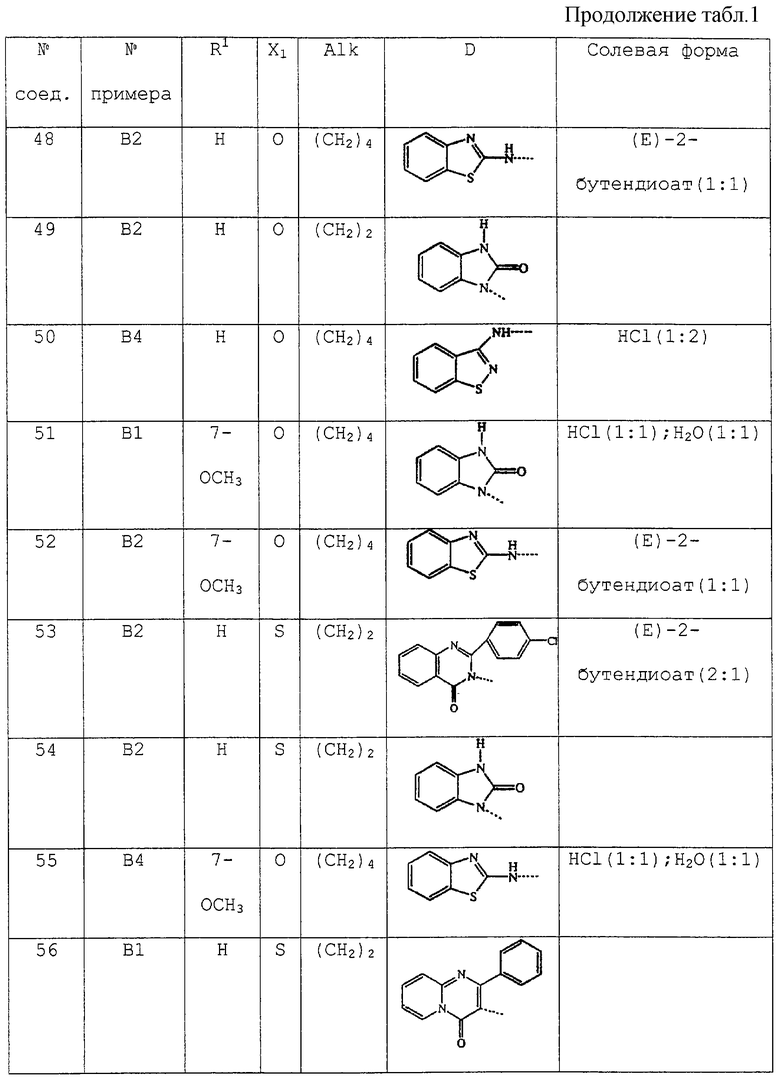
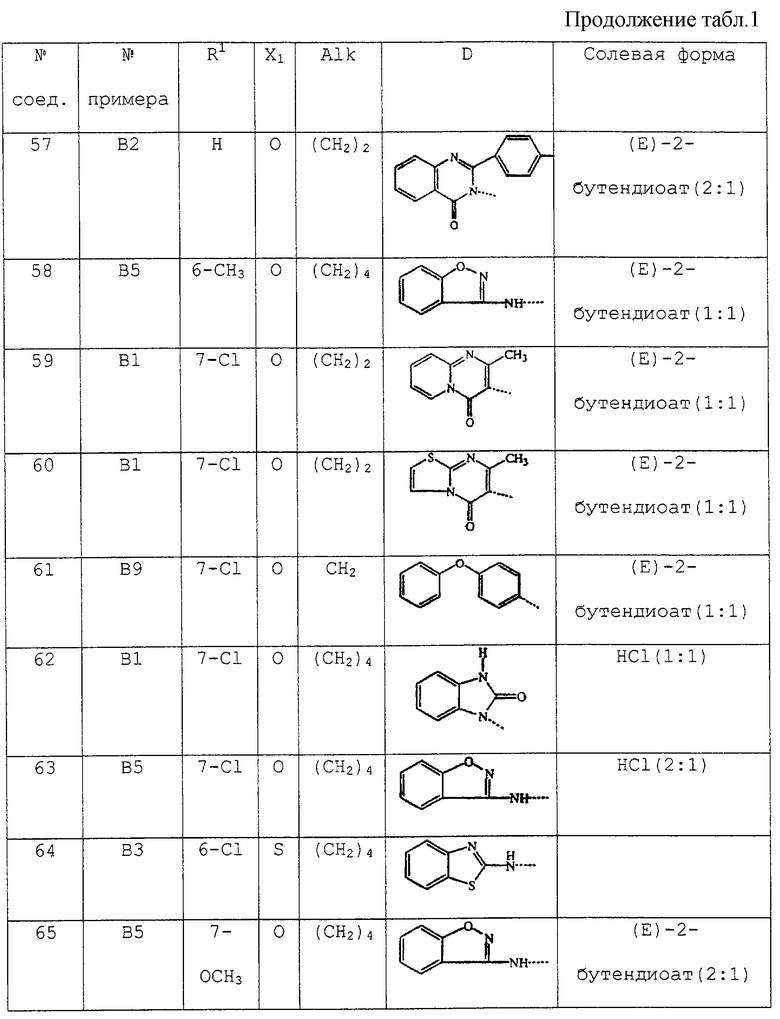
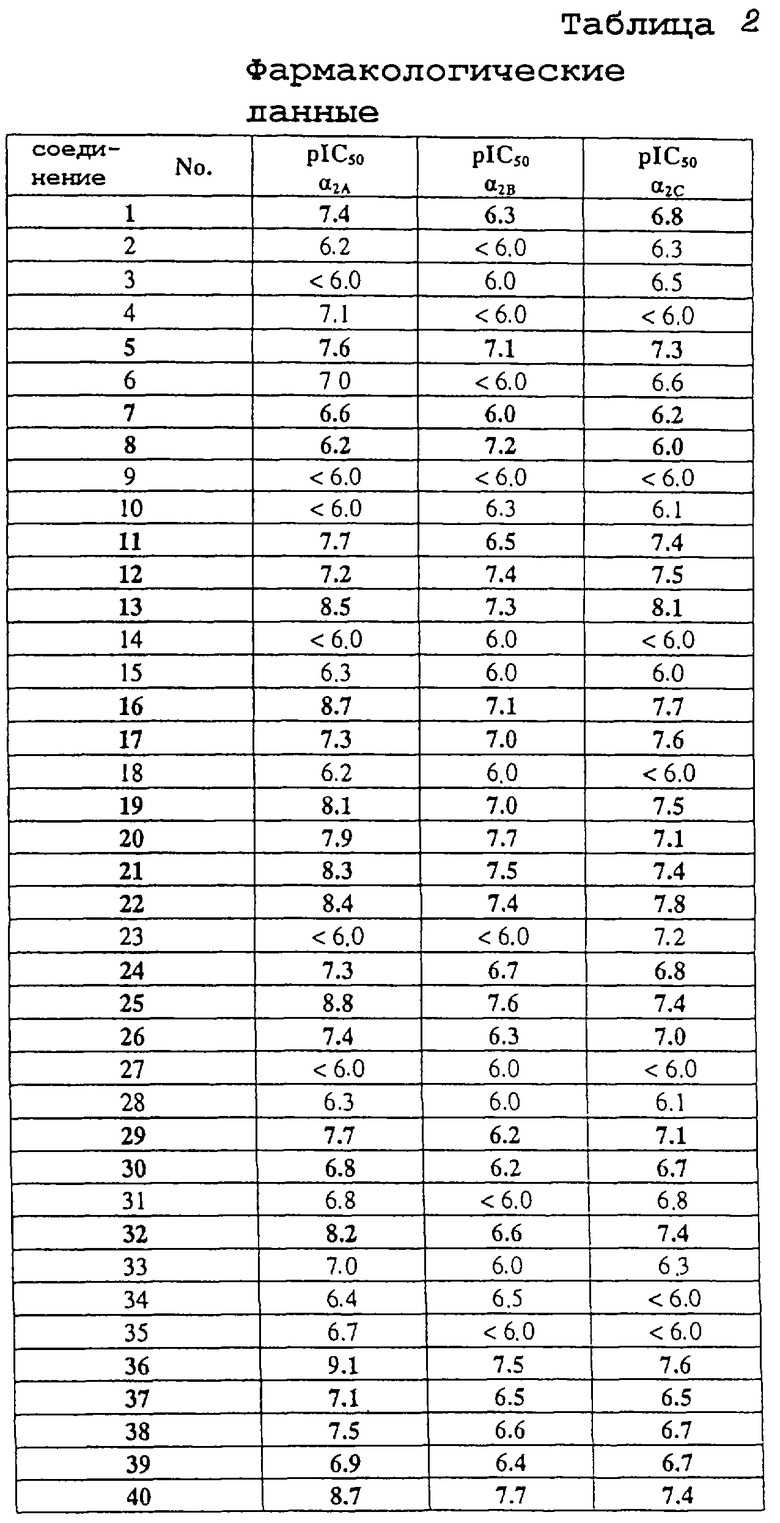
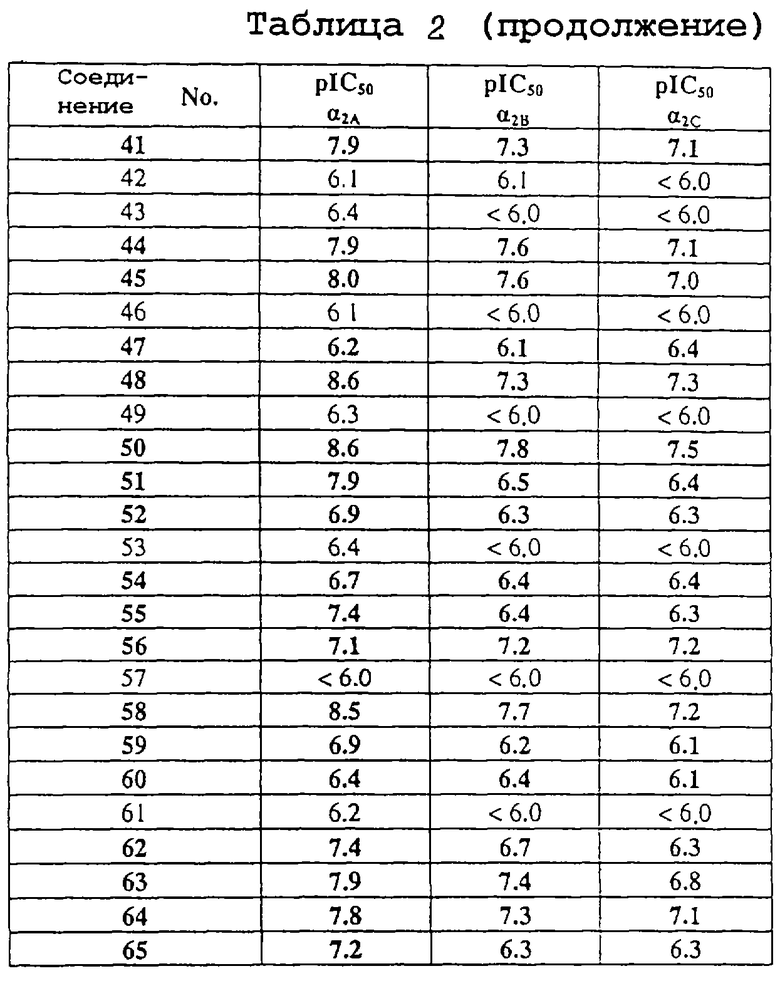
В таблице 1 перечислены соединения формулы (I), которые были получены в соответствии с одним из приведенных выше примеров.
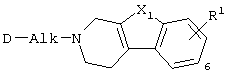
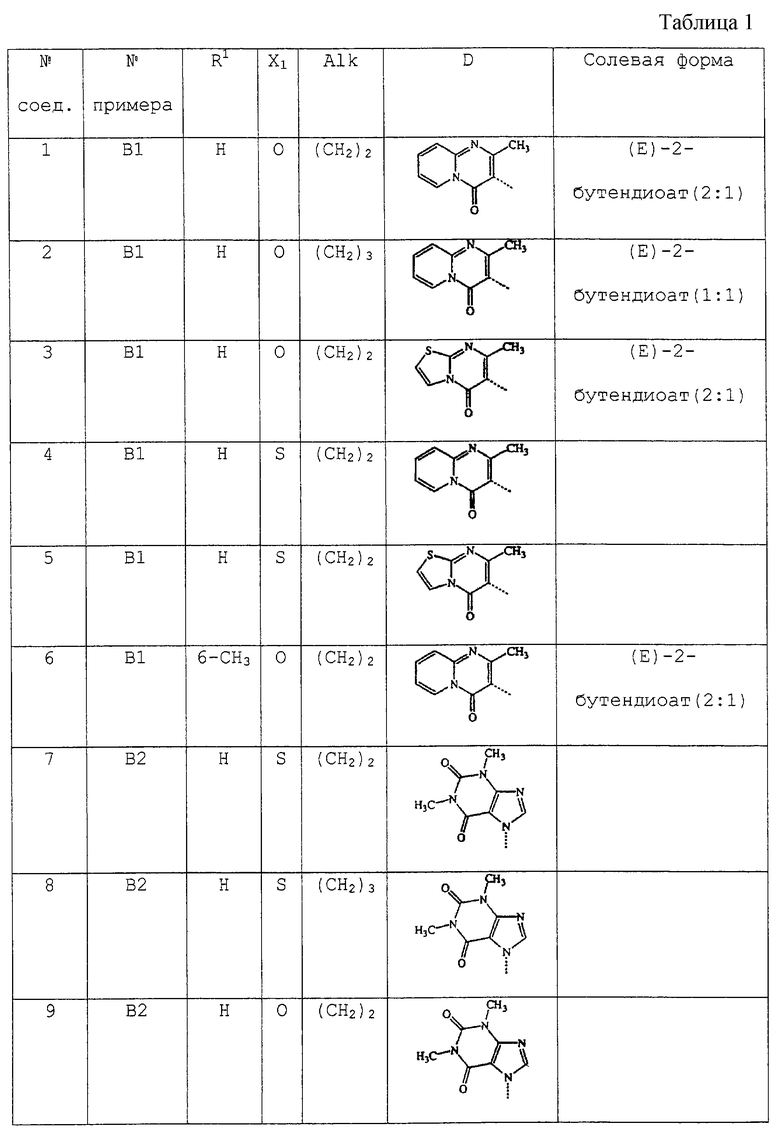
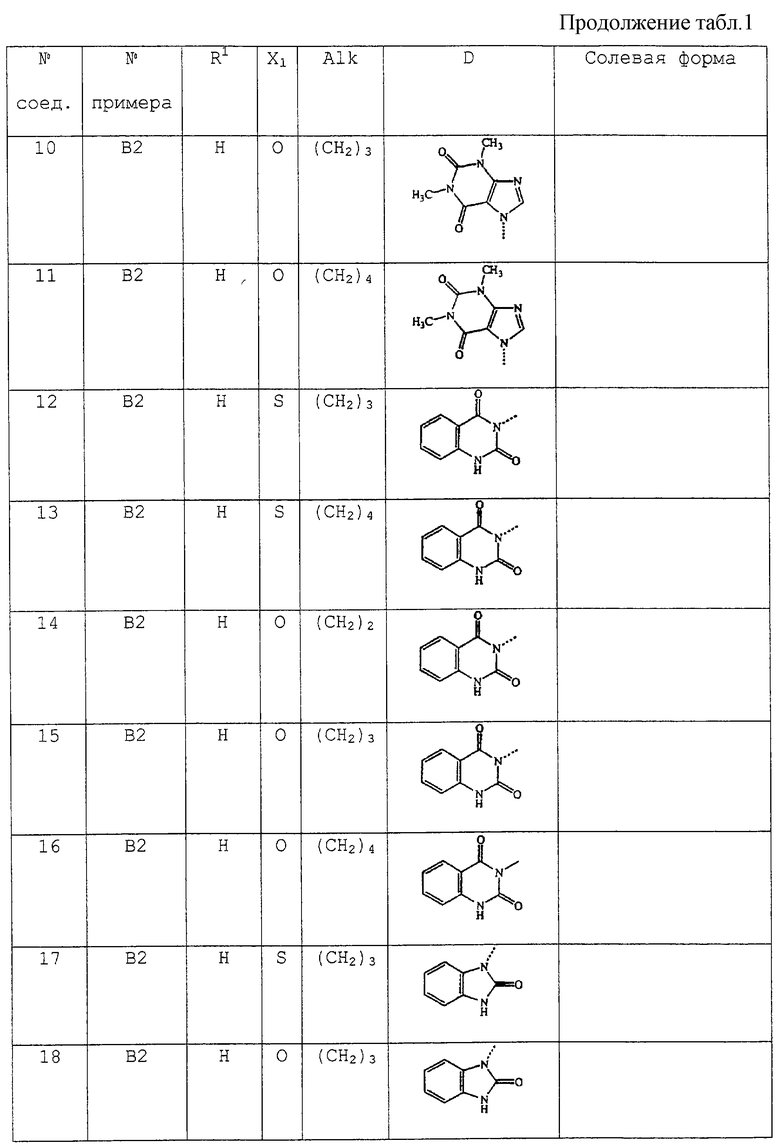
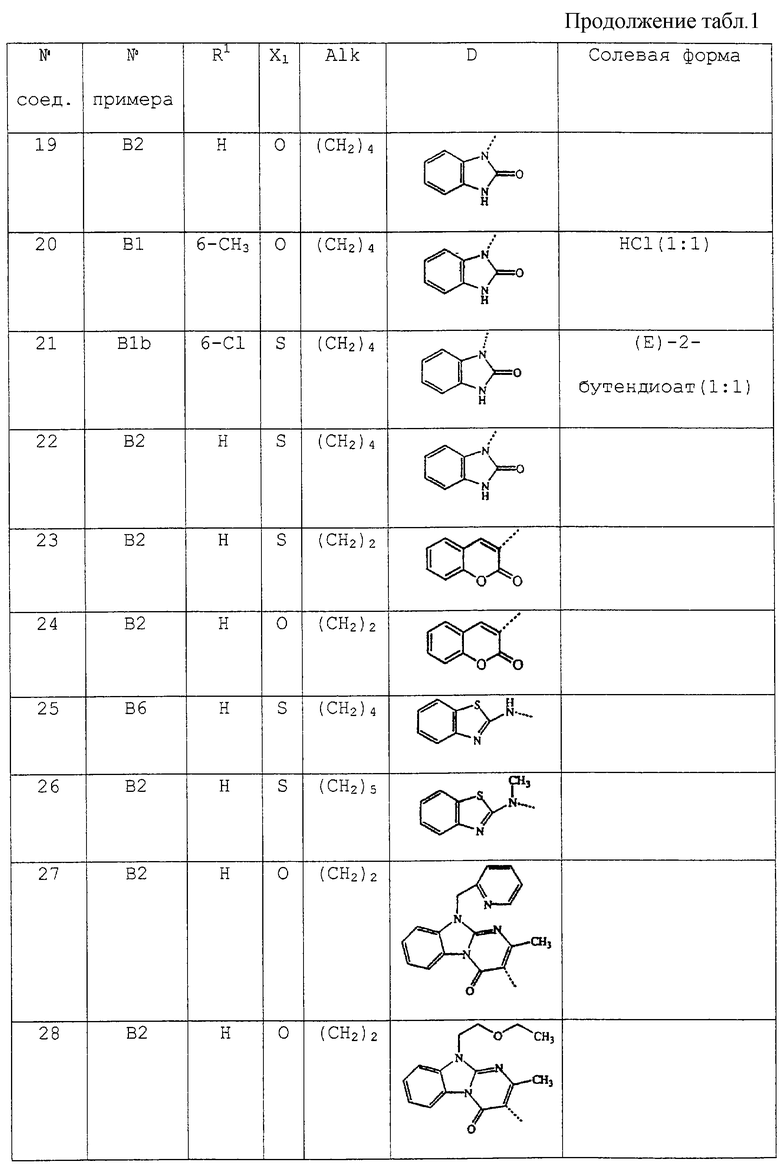
С. Фармакологические примеры
Пример C.1: Связывающее сродство к α2-рецепторам in vitro Взаимодействие соединений формулы (I) с α2-рецепторами оценивают в экспериментах in vitro по связыванию радиомеченных лигандов.
Как правило, низкую концентрацию радиомеченного лиганда с высоким связывающим сродством к конкретному рецептору инкубируют с образцом препарата ткани, обогащенным конкретным рецептором, или с препаратом клеток, экспрессирующих клонированные человеческие рецепторы, в буферной среде. В процессе инкубации радиомеченный лиганд связывается с рецептором. По достижении равновесия связывания, связанную с рецептором радиоактивность отделяют от несвязанной радиоактивности, и подсчитывают связанную с рецептором активность. Взаимодействие тестируемых соединений с рецептором оценивают в экспериментах по конкурентному связыванию. К инкубационной смеси, содержащей препарат рецептора и радиомеченный лиганд, добавляют различные концентрации тестируемого соединения. Связывание радиомеченного лиганда ингибируется тестируемым соединением пропорционально его связывающему сродству и концентрации.
В качестве радиомеченного лиганда для связывания с α2A-, α2B-, α2C- рецепторами использовали 3Н-рауволсцин и в качестве рецепторного препарата использовали клетки яичника китайского хомяка (СНО), экспрессирующие клонированные человеческие α2A-, α2B- и α2C- рецепторы.
Среди тестируемых соединений соединения №1, 5, 7, 8, 11, 12, 13, 16, 17, 19, 24, 28, 29, 20, 32, 33 и 36 ингибировали каждый из трех рецепторов более чем на 50% в тестируемой концентрации, варьируемой от 10-6 до 10-9 М.
D. Примеры композиций
"Активный ингредиент" (А. И.), используемый во всех этих примерах, относится к соединению формулы (I), его фармацевтически приемлемой аддитивной соли или стереохимически изомерной форме.
Пример D.1: Капсулы
20 г А. И., 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидного диоксида кремния и 1,2 г стеарата магния интенсивно перемешивают вместе. Полученную смесь впоследствии заполняют в 1000 подходящих твердых желатиновых капсул, каждая из которых содержит 20 мг А. И.
Пример D.2: Таблетки, покрытые пленкой
Получение сердцевины таблетки
Смесь 100 г А. И., 570 г лактозы и 200 г крахмала хорошо перемешивают и затем увлажняют с помощью раствора 5 г додецилсульфата натрия и 10 г поливинилпирролидона приблизительно в 200 мл воды. Влажную порошкообразную смесь просеивают, сушат и вновь просеивают. Затем добавляют 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все вместе хорошо перемешивают и прессуют в таблетки, получая 10000 таблеток, каждая из которых содержит 10 мг активного ингредиента.
Нанесение покрытия
К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы в 150 мл дихлорметана.
Затем добавляют 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. Расплавляют 10 г полиэтиленгликоля и растворяют в 75 мл дихлорметана. Последний раствор добавляют к первому и затем добавляют 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной окрашенной суспензии, и все вместе гомогенизируют. Сердцевины таблеток покрывают полученной таким образом смесью в устройстве для нанесения покрытия.
Пример D.3: Раствор для перорального введения
9 г метил 4-гидроксибензоата и 1 г пропил 4-гидроксибензоата растворяют в 4 л кипящей очищенной воды. В 3 л этого раствора растворяют вначале 10 г 2,3-дигидроксибутандиовой кислоты и затем 20 г А. И. Последний раствор объединяют с оставшейся частью первого раствора и затем добавляют 12 л 1,2,3-пропантриола и 3 л 70% раствора сорбита. 40 г натрий сахарина растворяют в 0,5 л воды и добавляют 2 мл малиновой и 2 мл крыжовниковой эссенции. Последний раствор объединяют с первым, добавляют воду в количестве, достаточном для получения объема 20 л, получая раствор для перорального введения, содержащий 5 мг активного ингредиента на чайную ложку (5 мл). Полученным раствором заполняют подходящие емкости.
Пример D.4: Раствор для инъекции
1,8 г метил 4-гидроксибензоата и 0,2 г пропил 4-гидроксибензоата растворяют приблизительно в 0,5 л кипящей воды для инъекции. После охлаждения приблизительно до 50°С добавляют при перемешивании 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г А. И. Раствор охлаждают до КТ и добавляют воду для инъекции в количестве, достаточном для получения объема 1 л, получая раствор, содержащий 4 мг/мл А. И. Раствор стерилизуют фильтрованием и заполняют им стерильные контейнеры.
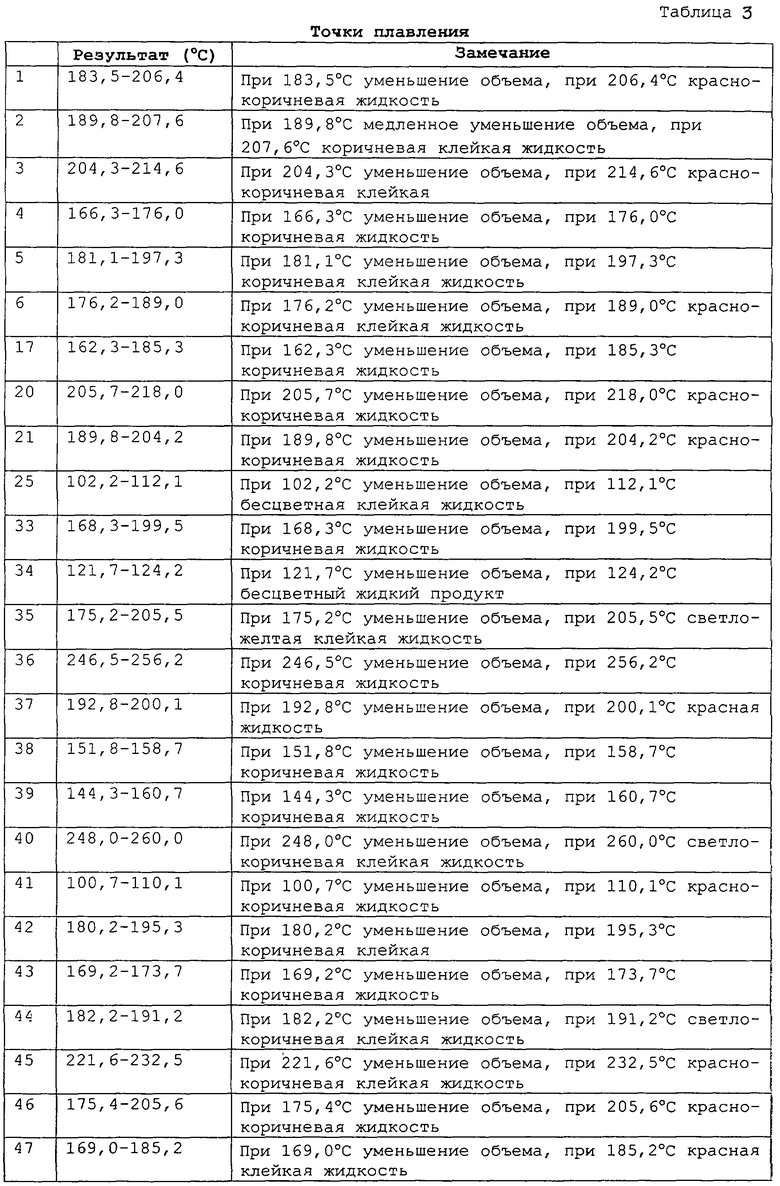
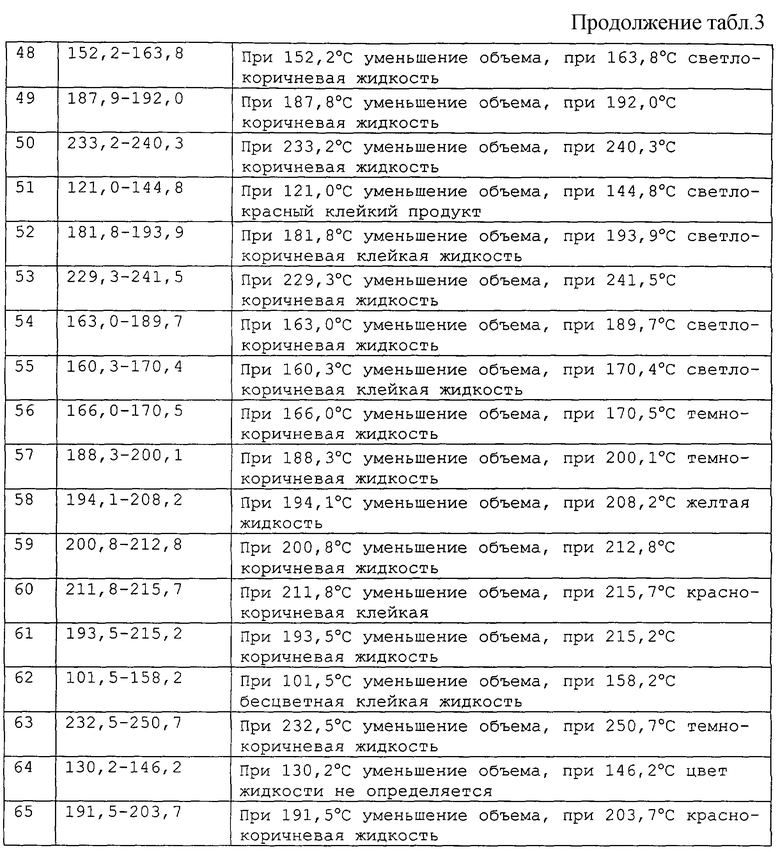
Результаты даны в табл. 2, 3.
Настоящее изобретение касается соединений формулы (I), в которой Alk представляет C1-6алкандиил; n равно 0 или 1; Х представляет -O- или -S-; R1 представляет галоген, C1-6алкил, или С1-4алкилокси; D представляет радикал формул (a)-(k). Изобретение также относится к способу получения этих соединений и к фармацевтической композиции для лечения заболеваний, в которых показана антагонистическая активность по отношению к центральному α2-адренорецептору. Технический результат – получены новые соединения, обладающие ценными биологическими свойствами. 5 с. и 7 з.п. ф-лы, 3 табл.
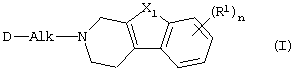
его N-оксидная форма, фармацевтически приемлемая аддитивная соль или стереохимически изомерная форма, в указанной формуле
Alk представляет C1-6алкандиил;
n равно 0 или 1;
X1 представляет -О- или -S-;
каждый R1, замещающий атом водорода, присоединенный к ароматическому кольцу, независимо представляет галоген, C1-6алкил или С1-4алкилокси;
D представляет радикал формулы
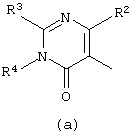
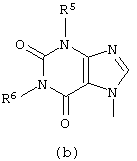
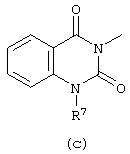
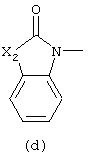
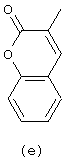
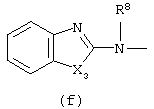
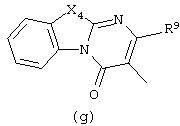
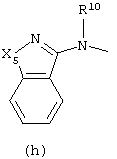
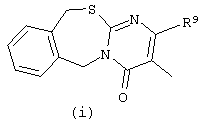
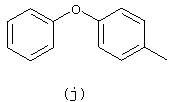
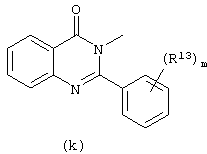
в которых каждый m независимо равен 0 или 1;
X2 представляет -NR11-;
Х3 представляет -S-;
Х4 представляет -NR12-;
Х5 представляет -О- или -S-;
R2 представляет C1-6алкил, арил или арилС1-6алкил;
R3 и R4, взятые вместе, могут образовывать бивалентный радикал -R3-R4-формулы -СН=СН-СН=СН- (а-5) или -S-CH=CH- (а-8);
R5, R6, R7, R8, R9, R10 и R11 каждый независимо представляет водород или C1-6алкил;
R12 представляет C1-6алкилоксиC1-6алкил или пиридинилC1-6алкил;
R13 представляет галоген;
арил представляет собой фенил или фенил, замещенный галогеном или C1-6алкилом.
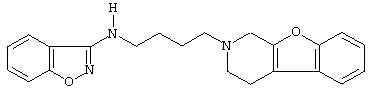
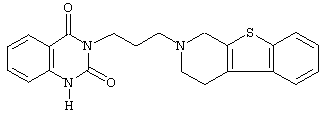
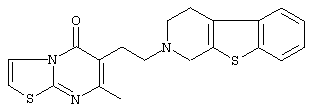
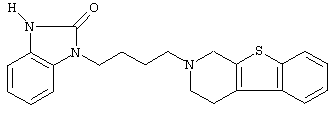
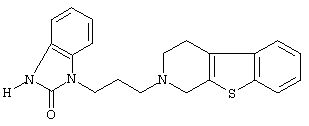
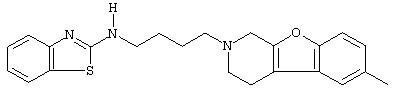
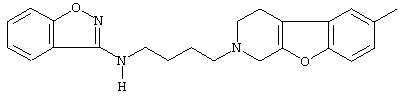
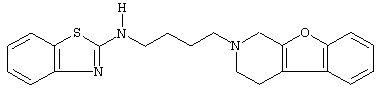
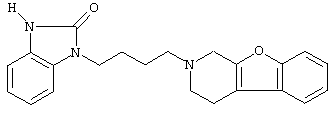
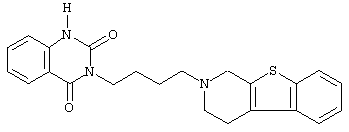
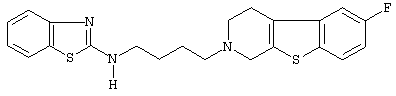
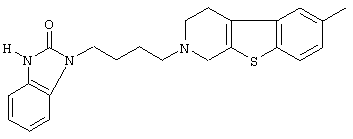
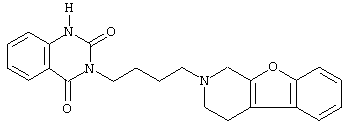
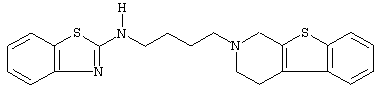
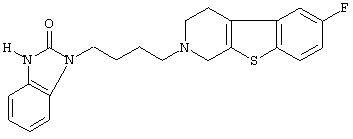
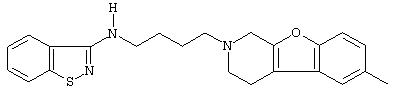
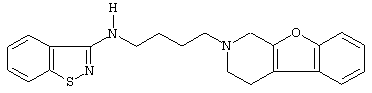
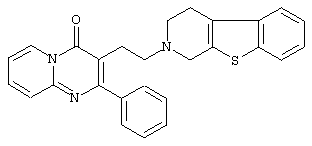
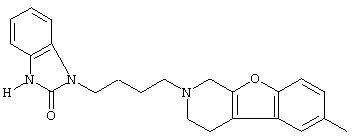
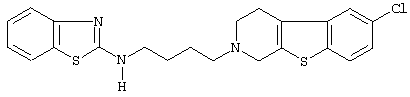
или его N-оксидную форму, фармацевтически приемлемую аддитивную соль или стереохимически изомерную форму.
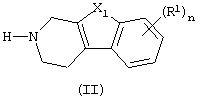
где X1, n и R1 имеют значения, определенные в п.1, алкилирующим реагентом формулы (III):
D-Alk-W1,
где W1 представляет подходящую уходящую группу, и D, Alk имеют значения, определенные в п.1, в инертном по отношению к реакции растворителе, в присутствии основания и необязательно в присутствии катализатора с получением соединения формулы (I); и, необязательно, превращение соединений формулы (I) друг в друга с помощью известных в технике преобразований, и, далее, при желании, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль с помощью обработки кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или, наоборот, превращение кислотно-аддитивной солевой формы в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, при желании, получение их стереохимически изомерных форм или N-оксидов.
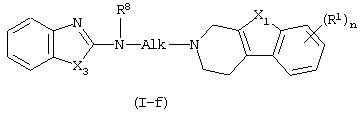
в которой Х3, X1, Alk, R1 R8 и n имеют значения, определенные в п.1, характеризующийся тем, что включает N-алкилирование амина формулы (IV)
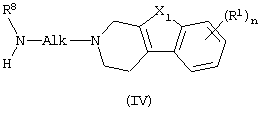
где Alk, X1, n, R1 и R8 имеют значения, определенные в п.1, промежуточным соединением формулы (V)
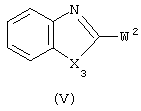
где W2 представляет подходящую уходящую группу, и X3 имеет значения, определенные в п.1, с образованием, таким образом, соединения формулы (I-f); и необязательно, превращение соединений формулы (I) друг в друга с помощью известных в технике преобразований, и, далее, при желании, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль с помощью обработки кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или, наоборот, превращение кислотно-аддитивной солевой формы в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, при желании, получение их стереохимически изомерных форм или N-оксидов.
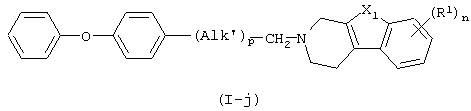
в которой Alk’ представляет С1-5алкандиил;
X1, n, R1 имеют значения, определенные в п.1,
характеризующийся тем, что включает восстановительное N-алкилирование промежуточного соединения формулы (II)
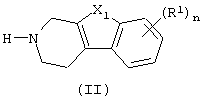
в которой X1, R1 и n имеют значения, определенные в п.1,
альдегидным производным формулы (VI)
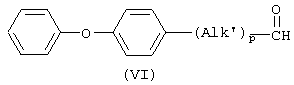
в которой Alk’ имеет значения, указанные выше, р равно 0 или 1, восстановлением смеси реагентов в подходящем инертном к реакции растворителе, в соответствии с известными в технике приемами восстановительного N-алкилирования, с образованием соединения формулы (I-j); и, необязательно, превращение соединений формулы (I) друг в друга с помощью известных в технике преобразований, и, далее, при желании, превращение соединений формулы (I) в терапевтически активную нетоксичную кислотно-аддитивную соль с помощью обработки кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или, наоборот, превращение кислотно-аддитивной солевой формы в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, при желании, получение их стереохимически изомерных форм или N-оксидов.
| Производные 1,2,3,4-тетрагидробензофуро[3,2-с]-пиридина или хлоргидрат, обладающие рядом свойств анальгетиков и антагонистов морфина | 1980 |
|
SU926914A1 |
| 0 |
|
SU206225A1 | |
| WO 8912447 A1, 28.12.1989. | |||
Авторы
Даты
2004-06-20—Публикация
1999-10-01—Подача