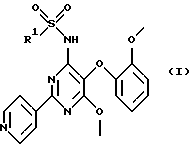
Настоящее изобретение относится к гетероциклическим сульфонамидам и их применению в качестве лекарственных средств. Более конкретно настоящее изобретение относится к соединениям формулы (I)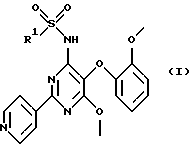
где R1 обозначает гетероциклический фрагмент, выбранный из пиридила и тиазолила, где этот гетероциклический фрагмент необязательно может быть замещен (низш.)алкилом или (низш.)алкенилом; и их фармацевтически приемлемым солям.
Настоящее изобретение также относится к фармацевтической композиции, включающей соединение формулы (I) и фармацевтически приемлемый носитель и/или адъювант.
Настоящее изобретение также относится к применению таких соединений для приготовления лекарственных средств, предназначенных для лечения и/или профилактики болезней, связанных с аномальным сосудистым тонусом и эндотелиальной дисфункцией.
Настоящее изобретение также относится к способам получения соединений формулы (I).
Кроме того, настоящее изобретение относится к способу профилактического и/или терапевтического лечения болезней, связанных с аномальным сосудистым тонусом и эндотелиальной дисфункцией, который предусматривает введение соединения формулы (I) человеку или животному.
Сульфонамиды по настоящему изобретению являются ингибиторами эндотелиальных рецепторов. Вследствие этого они могут применяться для лечения болезней, связанных с аномальным сосудистым тонусом и эндотелиальной дисфункцией. В ЕР 0713875 и ЕР 0799209 описаны сульфонамидные производные в качестве ингибиторов эндотелиальных рецепторов. Однако соединения по настоящему изобретению обладают высокой антагонистической активностью in vitro и для них характерны неожиданно высокие уровни в плазме после перорального введения.
Следующие определения приведены с целью иллюстрации и, если не указано иное, служат для обозначения объема различных понятий, применяемых при описании изобретения.
Понятие "(низш.)алкил" обозначает одновалентный насыщенный алифатический углеводородный радикал с разветвленной или прямой цепью, включающий от 1 до 7 атомов углерода, предпочтительно от 1 до 4 атомов углерода. В качестве дополнительных примеров этого понятия можно привести такие радикалы, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и т.п.
Понятие "(низш.)алкенил" обозначает (низш.)алкильную группу, включающую одну или большее количество двойных связей в алкиленовой цепи.
Понятие "фармацевтически приемлемые соли" обозначает соли соединений формулы (I) с неорганическими или органическими кислотами, такими как соляная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, паратолуолсульфоновая кислота и т.п., которые являются нетоксичными для живых организмов. Они также включают соли с неорганическими или органическими основаниями, такие как соли щелочных металлов, например соли натрия и калия, соли щелочно-земельных металлов, например, соли кальция и магния, соли N-метил-D-глутамина и соли аминокислот, например аргинина, лизина и т. п.
Более конкретно настоящее изобретение относится к соединениям приведенной выше формулы (I), в которых R1 обозначает гетероциклический фрагмент, выбранный из пиридила и тиазолила, где этот гетероциклический фрагмент необязательно может быть замещен (низш.)алкилом или (низш.)алкенилом. Понятие "(низш. )алкил" предпочтительно обозначает метил, этил, н-пропил, изопропил, н-бутил, втор-бутил или трет-бутил, более предпочтительно метил, этил или изопропил, еще более предпочтительно метил или изопропил, наиболее предпочтительно метил. Понятие "(низш.)алкенил" предпочтительно обозначает винил, 1-пропенил, аллил, изопропенил, 1-бутенил, 2-бутенил или 3-бутенил, более предпочтительно винил, 1-пропенил, аллил и изопропенил, наиболее предпочтительно изопропенил.
Предпочтительными гетероциклическими фрагментами в R1 являются 2-пиридил и 2-тиазолил, наиболее предпочтительно 2-пиридил. Согласно предпочтительному варианту осуществления гетероциклические фрагменты в R1 замещены (низш. )алкилом или (низш.)алкенилом, предпочтительно (низш.)алкилом.
Особенно предпочтительными фрагментами R являются 5-метилпиридин-2-ил, 5-изопропилпиридин-2-ил, 5-изопропенилпиридин-2-ил и 5-метилтиазол-2-ил. Более предпочтительными являются 5-метилпиридин-2-ил, 5-изопропилпиридин-2-ил и 5-изопропенилпиридин-2-ил. Еще более предпочтительными являются 5-метилпиридин-2-ил и 5-изопропилпиридин-2-ил. Наиболее предпочтительным является 5-метилпиридин-2-ил.
Особенно предпочтительными соединениями формулы (I) являются: [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-метилпиридин-2-сульфоновой кислоты, [6-метокси-5-(2-метоксифенокси) -2-пиридин-4-илпиримидин-4-ил] амид 5-изопропилпиридин-2-сульфоновой кислоты, [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-изопропенилпиридин-2-сульфоновой кислоты и [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-метилтиазол -2-сульфоновой кислоты.
Наиболее предпочтительными соединениями формулы (I) являются: [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-метилпиридин-2-сульфоновой кислоты и [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-изопропилпиридин-2-сульфоновой кислоты, наиболее предпочтительным является [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-метилпиридин-2-сульфоновой кислоты.
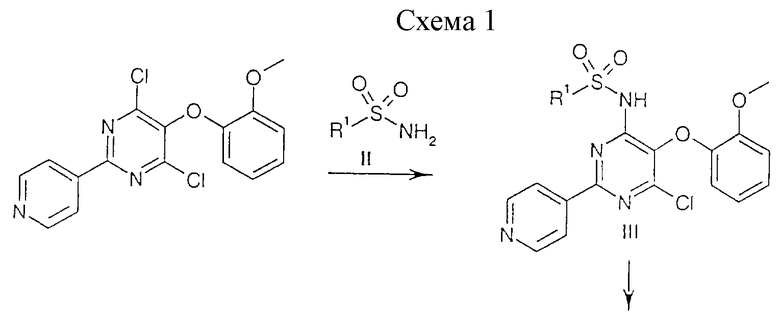
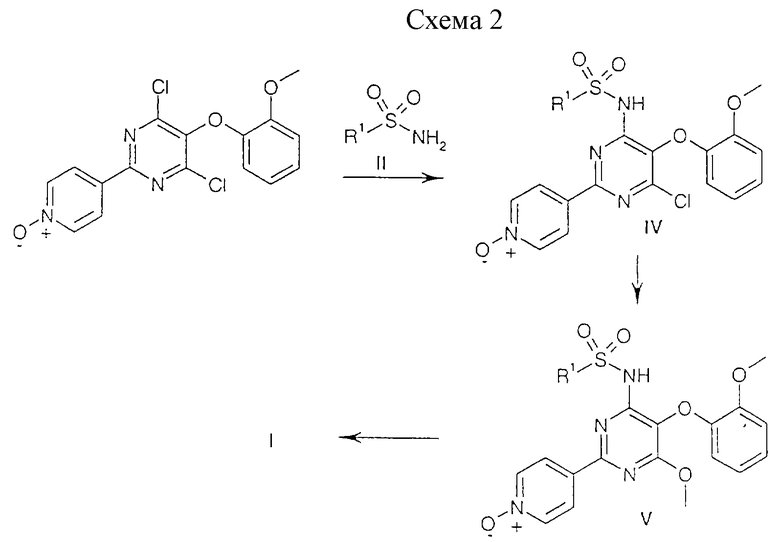
Соединения общей формулы (I) могут быть с помощью методов, аналогичных хорошо известным методам, или с помощью описанных ниже процессов, которые обобщены на приведенных ниже схемах 1 и 2:
4,6-Дихлор-5-(2-метоксифенокси)-2-(пиридин-4-ил)пиримидин (описанный в ЕР 0799209) может быть превращен в промежуточный продукт общей формулы (III) согласно процессу, представленному на реакционной схеме 1, путем взаимодействия соответствующего сульфонамида общей формулы (II), где R1 имеет значения, указанные в п.1, в пригодном растворителе, таком как ДМСО или ДМФ, при комнатной температуре или при повышенной температуре и в присутствии приемлемого основания, такого как карбонат калия.
Соответствующие сульфонамиды в вышеописанной реакции также могут применяться в форме их предварительно полученных натриевых или калиевых солей.
Соединения формулы (III) затем могут быть превращены в соединения общей формулы (I) обработкой метилатом натрия в таком растворителе, как метанол (см. схему в конце описания).
Гетероциклические сульфонамиды общей формулы (II) либо являются уже описанными в литературе и их получают по аналогии с хорошо известными методами, и/или они могут быть получены из соответствующих меркаптопроизводных по аналогии с хорошо известной последовательностью реакций, включающих окисление с помощью Сl2 в кислой водной среде, такой как разбавленный водный раствор НСl, с получением соответствующих сульфонилхлоридов, которые могут быть превращены в сульфонамиды с помощью жидкого аммиака или водного раствора гидроксида аммония. Соответствующие натриевые или калийные соли могут быть получены обработкой алкоксидом натрия или калия в соответствующем растворителе, таком как метанол.
В альтернативном варианте соединения общей формулы (I) могут быть получены согласно процессу, приведенному на реакционной схеме 2, с использованием в качестве исходного продукта 4-[4,6-дихлор-5-(2-метоксифенокси)пиримидин-2-ил] пиридин-1-оксида (полученного согласно методу, описанному в ЕР 0799209) по аналогии с хорошо известной последовательностью реакций, приведенной на схеме 1, с получением соединений общей формулы (V).
Восстановление пиридин-N-оксидов, т. е. соединений общей формулы (V), может быть осуществлено с использованием такой системы реагентов, как TiCl4/NaI по аналогии с методом, который описан в Chem. Ber. 123, 647 (1990), или триалкилсилилхлорида (например, трет-бутилдиметилсилилхлорида), в присутствии приемлемого основания, такого как триэтиламин, и ацетонитрила в качестве растворителя. Другие методы дезоксигенирования пиридин-N-оксидов хорошо известны и включают, например, каталитическое гидрирование или восстановление с помощью восстановителей, таких как трехвалентные соединения фосфора или металлы в кислоте (см. схему 2).
Промежуточные продукты приведенной выше формулы (III) и формулы (V), в которых R1 имеет значения, указанные выше при описании схемы 1, предпочтительно в которых R1 обозначает 5-метилпиридин-2-ил или 5-изопропилпиридин-2-ил, и их фармацевтически приемлемые соли являются новыми и также представляют собой объект настоящего изобретения.
Ингибирующее действие соединений формулы (I) в отношении рецепторов эндотелина может быть продемонстрировано с помощью описанных ниже анализов.
I. Ингибирование связывания эндотелина с рекомбинантными человеческими ЕТА-рецепторами, экспрессируемыми в зараженных бакуловирусом клетках насекомых
кДНК, кодирующую человеческие ЕТA-рецепторы из плаценты человека, клонировали (М. Adachi, Y-Y. Yang, Y. Furuichi и С. Miyamoto, BBRC 180, 1265-1272) и экспрессировали в системе бакуловирус - клетка насекомого. Зараженные бакуловирусом клетки насекомого из ферментера объемом 23 л центрифугировали (3000xg, 15 мин, 4oС) через 60 ч после заражения, повторно суспендировали в Трис-буфере (5 мМ, рН 7,4, 1 мМ MgCl2) и вновь центрифугировали. После дополнительного повторного суспендирования и центрифугирования клетки суспендировали в 800 мл этого же буфера и сушили вымораживанием при -120oС. Клетки разрушались после оттаивания суспензии в этой гипотонической буферной смеси. После повторения цикла сушки вымораживанием/оттаивания суспензию гомогенизировали и центрифугировали (25000xg, 15 мин, 4oС). После суспендирования в Трис-буфере (75 мМ, рН 7,4, 25 мМ MgCl2, 250 мМ сахароза) аликвоты объемом 1 мл (содержание протеина примерно 3,5 мг/мл) хранили при -85oС.
Для анализа связывания высушенные вымораживанием препараты мембран подвергали оттаиванию и после центрифугирования при 20oС и 25000xg в течение 10 мин повторно суспендировали в буфере для анализа (50 мМ Трис-буфер, рН 7,4, содержащий 25 мМ MnCl2, 1 мМ ЭДТК и 0,5% бычьего сывороточного альбумина). 100 мкл этой суспензии мембран, содержащих 70 мкг протеина, инкубировали с 50 мкл125I-эндотелина (удельная активность 2200 Ки/ммоль) в буфере для анализа (25000 импульсов/мин, конечная концентрация 20 пМ) и 100 мкл буфера для анализа, содержащего различные концентрации тестируемого соединения. Инкубацию осуществляли при 20oС в течение 2 ч или при 4oС в течение 24 ч. Разделение свободных и связанных с мембраной радиолигандов осуществляли с помощью фильтрации через фильтр из стекловолокна. Данные об ингибирующей активности соединений формулы (I), определенной с помощью этого теста, представлены таблице 1 в виде значений IC50, т.е. в виде концентрации [нМ], необходимой для 50%-ного ингибирования специфического связывания 125I-эндотелина.
II. Ингибирование индуцируемых эндотелином сокращений в выделенных кольцах аорты крысы
Кольца длиной 5 мм нарезали из грудного отдела аорты взрослых крыс линии Wistar-Kyoto. Эндотелий удаляли осторожным соскабливанием внутренней поверхности. Каждое кольцо погружали при 37oС в 10 мл раствора Кребса-Хенселейта в отдельной бане при аэрации газовой смесью 95% О2 и 5% СО2. Оценивали изометрическое растягивание колец. Кольца растягивали с помощью предварительного растягивающего усилия, равного 3 г. После инкубации в течение 10 мин с тестируемым соединением или с носителем добавляли кумулятивные дозы эндотелина-1. Активность тестируемого соединения определяли по обнаруживаемому сдвигу вправо графика зависимости доза-активность для эндотелина-1 в присутствии различных концентраций антагониста. Этот сдвиг вправо (или "отношение доз", ОД) соответствует частному, полученному в результате деления значений ЕС50 эндотелина-1 в присутствии антагониста и без антагониста, где значение ЕС50 представляет собой концентрацию эндотелина, необходимую для сокращения, составляющего половину от максимального.
Соответствующее значение рА2, которое представляет собой меру активности тестируемого соединения, вычисляли по величине "отношения доз" DR для каждой отдельной зависимости активности от дозы с помощью компьютерной программы с использованием приведенного ниже уравнения:
pA2=log(OД-l)-log -(концентрации антагониста)
Значение EC50 эндотелина-1 в отсутствии тестируемых соединений составляет 0,3 нМ.
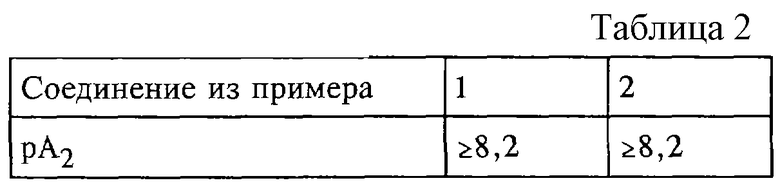
Значения рА2, полученные при применении соединений формулы (I), представлены в таблице 2.
III. Фармакокинетические характеристики антагонистов рецептора эндотелина
Фармакокинетические характеристики вновь синтезированных антагонистов рецептора эндотелина оценивали с использованием крыс линии Wistar. Тестируемые соединения растворяли в ДМСО в концентрации 5 мг/мл и вводили перорально через желудочный зонд в дозе 1 мл/кг веса тела, что соответствует 5 мг/кг веса тела. Для каждого тестируемого соединения использовали по две крысы. Образцы крови брали из ретроорбитального синуса у одной крысы через 1 и 5 ч после обработки, а у второй крысы через 3 и 7 ч после обработки. Кроме того, с помощью сердечной пункции у обеих крыс через 24 ч брали последний образец крови. Кровь собирали на ЭДТК-NaF. Плазму получали центрифугированием при 2000xg при +4oС в течение 15 мин. Образцы плазмы анализировали в отношении продукта, связанного с активным лекарством, с помощью биологического анализа, основанного на конкурентном связывании тестируемых соединений и [125I] -эндотелина-1 на рекомбинантных ЕТA-рецепторах. Количественную оценку образцов плазмы осуществляли путем сравнения с калибровочной кривой, полученной с помощью введения в плазму контрольных крыс известных концентраций тестируемых соединений.
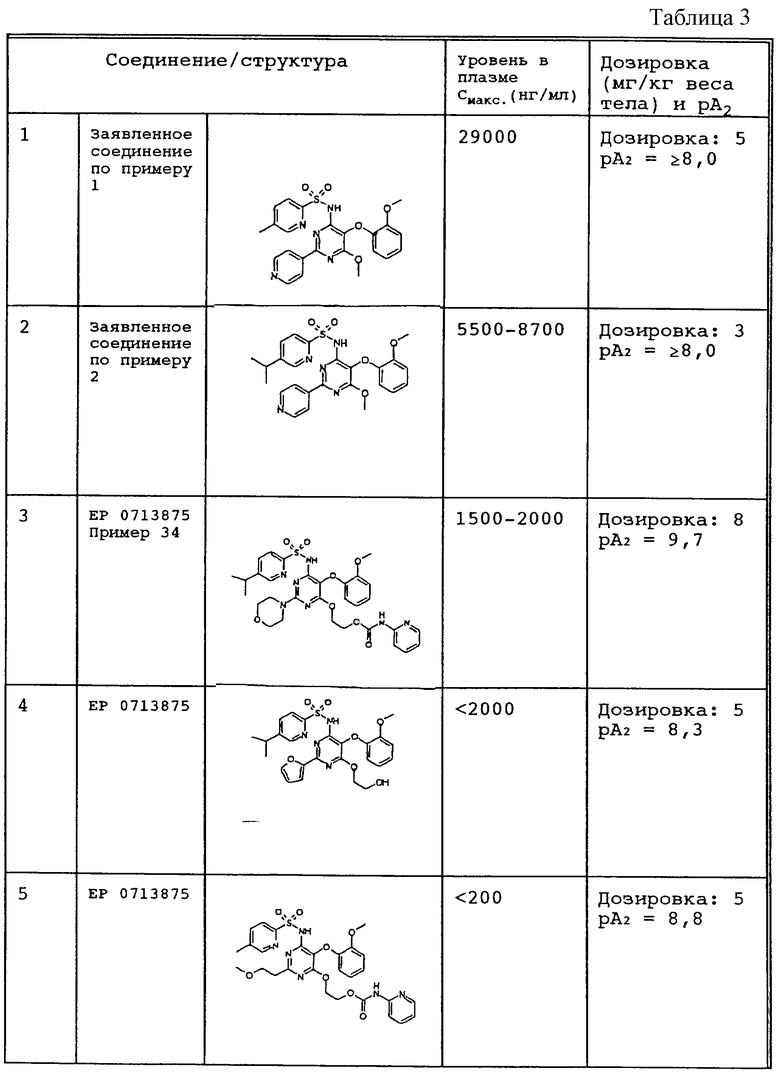
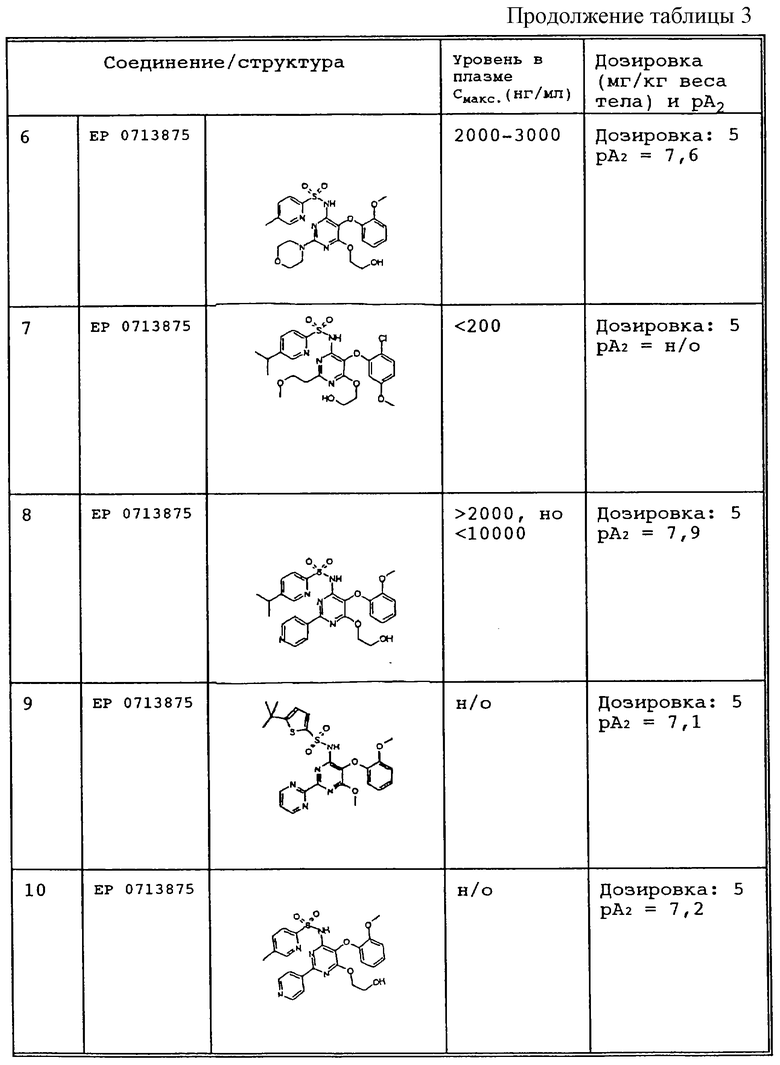
В противоположность известным соединениям неожиданно было установленно, что заявленные соединения одновременно удовлетворяют всем требованиям, необходимым для достижения клинической эффективности, то есть в дополнение к значению рА2, равному по крайней мере 8, заявленные соединения обладают существенно более высоким уровнем в плазме по сравнению с известными продуктами (ЕР 0713 875).
Некоторые данные обобщены в таблице 3.
С учетом их способности ингибировать связывание эндогенного эндотелина соединения формулы (I) могут применяться в качестве лекарственных средств, предназначенных для лечения болезней, связанных с аномальным сосудистым тонусом и эндотелиальной дисфункцией.
Следовательно, областью применения соединений формулы (I) может являться сердечная недостаточность (острая и хроническая), системная и легочная гипертензия, острый ишемический коронарный синдром, стенокардия, почечная недостаточность (острая и хроническая), трансплантация органа (например, печени, сердца, почки), вызванная циклоспорином нефротоксичность, ангиоспастическое заболевание (субарахноидное кровоизлияние, а также геморрагический и негеморрагический удар, синдром Рейно), периферическое артериальное окклюзивное заболевание, предупреждение рестеноза после стентангиопластики или ангиопластики с использованием баллона, септический шок или множественное нарушение органа, происходящее при интенсивной терапии, астма, хроническое обструктивное легочное заболевание, язва желудка и двенадцатиперстной кишки, цирроз печени, панкреатит (острый и хронический), воспалительное заболевание кишечника, фиброз, атеросклероз, ожирение, глаукома, аденома предстательной железы, мигрень, дисфункция пещеристой ткани, кроме того, соединения формулы (I) могут представлять собой вспомогательное средство при терапии рака, а также при других нарушениях, связанных с активностями эндотелина.
Соединения формулы (I) также могут вводиться в сочетании с гипотензивными лекарственными средствами, антиаритмическими средствами, средствами против стенокардии, антитромботическими средствами и с агентами, снижающими уровень липидов, а также антиоксидантами.
Соединения общей формулы (I) по изобретению также могут быть дериватизированы на функциональных группах с получением производных, представляющих собой пролекарства, которые обладают способностью превращаться обратно в исходные соединения in vivo.
Кроме того, под объем настоящего изобретения подпадают любые физиологически приемлемые эквиваленты соединений общей формулы (I), которые обладают способностью образовывать исходные соединения общей формулы (I) in vivo.
Как отмечалось ранее, объектом настоящего изобретения также являются лекарственные средства, содержащие соединение формулы (I), а также способ приготовления таких лекарственных средств, который предусматривает получение на основе одного или нескольких соединений формулы (I) и при необходимости одной или нескольких других терапевтически ценных субстанций предназначенной для введения галеновой формы.
Фармацевтические композиции могут вводиться перорально, например в форме таблеток, филмтаблеток, драже, желатиновых капсул с твердым или мягким покрытием, растворов, эмульсий или суспензий. Введение также может быть осуществлено ректально, например, с использованием суппозиториев; местно или чрескожно, например с помощью мазей, кремов, гелей или растворов; или парентерально, например внутривенно, внутримышечно, подкожно, внутритрахейно или трансдермально, с использованием, например, инъецируемых растворов. Кроме того, введение может осуществляться подъязычно или в виде офтальмологических препаратов или в виде аэрозолей, например, в форме спрея.
Для приготовления таблеток, филмтаблеток, драже или желатиновых капсул с твердым покрытием соединения по настоящему изобретению могут быть смешаны с фармацевтически инертными неорганическими или органическими эксципиентами. Примеры приемлемых эксципиентов для таблеток, драже или желатиновых капсул с твердым покрытием включают лактозу, кукурузный крахмал или его производные, тальк или стеариновую кислоту или ее соли.
Приемлемыми эксципиентами для применения в желатиновых капсулах с мягким покрытием являются, например, растительные масла, воски, жиры, полутвердые или жидкие полиолы и т.д.; однако в зависимости от природы действующих веществ в некоторых случаях для приготовления желатиновых капсул с мягким покрытием эксципиенты вообще не применяются.
Для приготовления растворов или сиропов эксципиенты, которые могут использоваться, включают, например, воду, полиолы, сахарозу, инвертный сахар и глюкозу.
Эксципиенты, которые могут применяться для инъецируемых растворов, включают, например, воду, спирты, полиолы, глицерин и растительные масла.
В суппозиториях и препаратах для местного и чрескожного применения в качестве эксципиентов могут применяться, например, природные или гидрогенизированные масла, воски, жиры и полутвердые или жидкие полиолы.
Фармацевтические композиции также могут включать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, одоранты, соли для изменения осмотического давления, буферы, агенты для нанесения покрытия или антиоксиданты, Как указывалось выше, они также могут содержать другие терапевтически ценные агенты.
Необходимо, чтобы все адъюванты, применяемые для приготовления препаратов, были нетоксичными.
Предпочтительным путем введения является внутривенный, внутримышечный или пероральный. Наиболее предпочтительным путем введения является пероральный. Дозы, содержащие эффективные количества соединений формулы (I), зависят от природы конкретного действующего вещества, возраста и особенностей пациента и пути введения. В целом для применения предлагаются дозы примерно 0,01-10 мг/кг веса тела в день.
Следующие примеры служат для иллюстрации предпочтительных вариантов осуществления настоящего изобретения, но не направлены на ограничение объема изобретения. В применяемых сокращениях МеОН обозначает метанол, AcOEt обозначает этилацетат, ДМФ обозначает диметилформамид, КТ обозначает комнатную температуру, ЖХВР обозначает жидкостную хроматографию высокого разрешения, ТСХ обозначает тонкослойную хроматографию, ISN обозначает масс-спектрометрию с ионизаций ионным пучком - отрицательная форма, EI обозначает масс-спектрометрию с ионизаций электронным ударом и М обозначает молекулярную массу.
Пример 1
а) К раствору, содержащему 6,9 г натрия в МеОН (300 мл), добавляли при КТ 14,52 г [6-хлор-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амида 5-метилпиридин-2-сульфоновой кислоты, и смесь кипятили с обратным холодильником в течение 5 дней до завершения реакции по данным ТСХ. Реакционную смесь концентрировали в вакууме до половины объема, при этом неочищенный продукт осаждался в виде натриевой соли. Его отфильтровывали под вакуумом и сушили в глубоком вакууме. Твердое вещество растворяли в воде, после чего раствор подкисляли, добавляя уксусную кислоту. Осадившийся свободный сульфонамид экстрагировали Мe2Сl2. Органический слой сушили над MgSO4, концентрировали на роторном испарителе и образовавшееся кристаллическое твердое вещество отфильтровывали. Затем его сушили в глубоком вакууме в течение 12 ч при 120oС, получая требуемый [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амид 5-метилпиридин-2-сульфоновой кислоты в виде кристаллов белого цвета. tпл 225-226oС. MC-ISN, m/e 478,2 (М-1 рассчитанная для C23H2lN5О5S1:478).
C23H21N5О5S1: Рассчитано: С 57,61; Н 4,41; N 14,61; S 6,69. Обнаружено: С 57,56; Н 4,38; N 14,61; S 6,83.
Получение исходного продукта:
б) 11,3 г 4,6-дихлор-5-(2-метоксифенокси)-2-пиридин-4-ил) пиримидина и 19,66 г калиевой соли 5-метилпиридил-2-сульфонамида (полученной согласно методу, описанному в ЕР 0799209) растворяли в ДМФ (255 мл) в атмосфере аргона. Раствор перемешивали в течение 2 ч при 40o С до завершения реакции по данным ТСХ. Реакционную смесь охлаждали до КТ и растворитель удаляли в глубоком вакууме. Остаток суспендировали в воде (850 мл), добавляли уксусную кислоту (85 мл) и смесь перемешивали при КТ в течение 30 мин. Осадившееся твердое вещество собирали фильтрацией и сушили в глубоком вакууме при 60oС в течение 16 ч, получая [6-хлор-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амид 5-метилпиридин-2-сульфоновой кислоты в виде кристаллов желтого цвета. tпл 177-179oС. MC-ISN, m/e 482,2 (М-1 рассчитанная для C22H18ClN5О5S1:482).
Пример 2
а) По аналогии с процессом, описанным в примере 1а), из [6-хлор-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амида 5-изопропилпиридин-2-сульфоновой кислоты и NaOMe получали [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-изопропилпиридин-2-сульфоновой кислоты в виде кристаллов светло-желтого цвета. tпл 195-197oС. MC-ISN, m/e 506,2 (М-1 рассчитанная для С25Н25N5О5S1:506).
C25H25N5O5S1: Рассчитано: С 59,16; Н 4,96; N 13,80; S 6,32. Обнаружено: С 58,99; Н 4,90; N13,83; S 6,37.
Получение исходного продукта:
б) По аналогии с процессом, описанным в примере 1б), из 4,6-дихлор-5-(2-метоксифенокси)-2-пиридин-4-ил)пиримидина и калиевой соли 5-изопропилпиридил-2-сульфонамида (полученной согласно методу, описанному в ЕР 0799209) получали [6-хлор-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амида 5-изопропилпиридин-2-сульфоновой кислоты в виде кристаллического твердого вещества коричневого цвета.
Пример 3
а) Раствор, содержащий 0,156 г [6-метокси-5-(2-метоксифенокси)-2-(1-оксипиридин-4-ил)пиримидин-4-ил] амида 5-изопропенил-2-сульфоновой кислоты в ацетонитриле (2 мл), обрабатывали при КТ 0,025 мл TiCl4, а затем 0,135 г йодида натрия, после чего перемешивали при КТ в течение 20 ч. Добавляли еще 0,1 мл TiCl4 и смесь кипятили с обратным холодильником в течение 1 ч, после чего добавляли еще 0,1 мл TiCl4 и смесь продолжали кипятить с обратным холодильником в течение 3 ч до завершения реакции по данным ЖХВР-анализа. Реакционную смесь охлаждали до КТ, концентрировали на роторном испарителе, остаток растворяли в AcOEt, промывали водой, сушили над NaSO4 и, наконец, упаривали в вакууме. Остаток очищали с помощью препаративной тонкослойной хроматографии, используя в качестве системы растворителей AcOEt/MeOH (9:1), получая требуемый [6-метокси-5-(2-метоксифенокси) -2-пиридин-4-илпиримидин-4-ил] амид 5-изопропенилпиридин-2-сульфоновой кислоты в виде твердого вещества светло-желтого цвета. MC-ISN, m/e 504,2 (М-1 рассчитанная для C25H23N5О5S1:504).
Получение исходного продукта:
б) К раствору калиевой соли 5-изопропилпиридин-2-сульфонамида (синтез которой описан в ЕР 799209) в воде (10 мл) добавляли при КТ 1,2 г КМnО4 и затем смесь кипятили с обратным холодильником в течение 30 мин. Смесь охлаждали до КТ, подкисляли разбавленной НСl и продукт экстрагировали AcOEt. Органический слой промывали водой, сушили над Na2SO4 и концентрировали в вакууме, получая амид 5-(1-гидрокси-1-метилэтил)пиридин-2-сульфоновой кислоты в виде масла желтого цвета. MC-EI, m/e 216 (М рассчитана для C8H12N2О3S: 216).
в) Раствор, содержащий 0,1 г амида 5-(1-гидрокси-1-метилэтил)пиридин-2-сульфоновой кислоты в СF3СО2 (2 мл) кипятили с обратным холодильником в течение 20 ч. Затем растворитель удаляли под вакуумом, получая амид 5-изопропенилпиридин-2-сульфоновой кислоты в виде практически чистого твердого вещества белого цвета. MC-EI, m/e 198 (М рассчитанная для C8H10N2О2S:198).
Соответствующую калиевую соль получали из сульфонамида обработкой трет-бутилатом калия в МеОН.
г) По аналогии с процессом, описанным в примере 1б), из 4-[4,6-дихлор-5-(2-метоксифенокси)пиримидин-2-ил] пиридин-1-оксида (синтез которого описан в ЕР 799209) и калиевой соли 5-изопропенилпиридин-2-сульфонамида получали [6-хлор-5-(2-метоксифенокси)-2-О-оксипиридин-4-ил)пиримидин-4-ил] амид 5-изопропенил-2-сульфоновой кислоты в виде твердого вещества светло-желтого цвета. MC-ISN, m/e 524,3 (М-1 рассчитанная для C24H20ClN5О5S:524).
д) По аналогии с процессом, описанным в примере 1а), из [6-хлор-5-(2-метоксифенокси)-2-(1-оксипиридин-4-ил)пиримидин-4-ил] амида 5-изопропенилпиридин-2-сульфоновой кислоты и метоксида натрия получали [6-метокси-5-(2-метоксифенокси)-2-(1-оксипиридин-4-ил)пиримидин-4-ил] амид 5-изопропенилпиридин-2-сульфоновой кислоты в виде твердого вещества светло-желтого цвета. MC-ISN, m/e 520,2 (М-1 рассчитанная для С25H23N5O6S:520).
Пример 4
а) Суспензию, содержащую 0,4 г [6-метокси-5-(2-метоксифенокси)-2-(1-оксипиридин-4-ил)пиримидин-4-ил] амида 5-метилтиазол-2-сульфоновой кислоты в ацетонитриле (5 мл), последовательно обрабатывали при КТ 1,12 мл триэтиламина и 1,243 г трет-бутилдиметилсилилхлорида. Смесь перемешивали в течение 5 мин при КТ, значение рН доводили до нейтрального (добавлением триэтиламина), а затем нагревали до температуры дефлегмации в течение 60 ч. Реакционную смесь охлаждали до КТ и концентрировали на роторном испарителе. Остаток растворяли в CH2Cl2, а затем последовательно промывали уксусной кислотой и водой. Органический слой сушили над MgSO4 и растворитель удаляли в вакууме. Остаток вносили на колонку из силикагеля, используя смесь AcOEt/MeOH (4:1) в качестве элюента. После объединения очищенных фракций и концентрирования в вакууме получали требуемый [6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амид 5-метилтиазол-2-сульфоновой кислоты в виде твердого кристаллического вещества бежевого цвета. MC-ISN, m/e 484,2 (М-1 рассчитанная для C21H19N5О5S1:484).
Получение исходного продукта:
б) 2,23 г 5-метилентиазолидин-2-тиона (полученного согласно методу, описанному в: Liebigs Ann. Chem., 1985, 58-64) растворяли в 36%-ном водном растворе НС1 (150 мл), охлаждали до -20oС и барботировали раствор Сl2 в течение 0,5 ч, поддерживая температуру на уровне ниже -20oС. Затем добавляли простой эфир (400 мл, охлажденный до -15oС) и после перемешивания в течение 5 мин слои разделяли. Органический слой обрабатывали жидким NH3(200 мл) и смеси давали медленно нагреться до КТ. Растворитель удаляли под вакуумом, получая амид 5-метилтиазол-2-сульфоновой кислоты в виде беловатого твердого вещества. MC-EI, m/e 178 (М рассчитанная для С4Н6N2О2S2:178).
Соответствующую калиевую соль получали из сульфонамида обработкой трет-бутилатом калия в МеОН.
г) По аналогии с процессом, описанным в примере 1б), из калиевой соли 5-метилтиазол-2-сульфонамида и 4-[4,6-дихлор-5-(2-метоксифенокси)пиримидин-2-ил] пиридин-1-оксида получали [6-хлор-5-(2-метоксифенокси)-2-(1-оксипиридин-4-ил)пиримидин-4-ил]амид 5-метилтиазол-2-сульфоновой кислоты в виде твердого вещества светло-желтого цвета. MC-ISN, m/е 504 (М-1 рассчитанная для C20H16N5O5S2:504).
д) По аналогии с процессом, описанным в примере 1а), из [6-хлор-5-(2-метоксифенокси)-2-(1-оксипиридин-4-ил)пиримидин-4-ил] амида 5-метилтиазол-2-сульфоновой кислоты и метоксида натрия получали [6-метокси-5-(2-метоксифенокси)-2-(1-оксипиридин-4-ил)пиримидин-4-ил]амид 5-метилтиазол-2-сульфоновой кислоты в виде твердого вещества светло-желтого цвета. MC-ISN, m/е 500,1 (М-1 рассчитанная для С21Н19СlN5О6S2:500).
Пример А
Таблетки, содержащие следующие ингредиенты, могут быть приготовлены общепринятым методом:
Ингредиенты, мг на таблетку:
Соединение формулы (I) - 10,0-100,0
Лактоза - 125,0
Кукурузный крахмал - 75,0
Тальк - 4,0
Стеарат магния - 1,0
Пример Б
Капсулы, содержащие следующие ингредиенты, могут быть приготовлены общепринятым методом:
Ингредиенты, мг на капсулу
Соединение формулы (I) - 25,0
Лактоза - 150,0
Кукурузный крахмал - 20,0
Тальк - 5,0
Пример В
Инъецируемые растворы могут иметь следующий состав:
Соединение формулы (I) - 3,0 мг
Желатин - 150,0 мг
Фенол - 4,7 мг
Вода для инъекций - До 1,0 мл
Пример Г
500 мг соединения формулы (I) суспендируют в 3,5 мл Myglyol 812 и 0,08 г бензилового спирта. Этой суспензией заполняют контейнер, снабженный дозирующим клапаном. Через клапан под давлением в контейнер вносят 5,0 г фреона 12. Фреон растворяют в смеси Myglyol-бензиловый спирт встряхиванием. Этот контейнер для распыления содержит примерно 100 однократных доз, которые могут вводиться каждая по отдельности.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-(гетероциклилсульфонамидо)-5-метокси-6-(2-метоксифенокси)-2-фенил- или пиридилпиримидины в качестве антагонистов рецептора эндотелина и фармацевтическая композиция | 2000 |
|
RU2224757C2 |
| СУЛЬФОНАМИДЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1995 |
|
RU2162084C2 |
| СУЛЬФОНАМИДЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1995 |
|
RU2151767C1 |
| ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛСУЛЬФОНАМИДОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2163598C2 |
| СУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1996 |
|
RU2173317C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОБЕНЗОДИАЗЕПИН-2-ОНА ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ НАРУШЕНИЙ | 2003 |
|
RU2315764C2 |
| СУЛЬФАМИДЫ И ИХ ПРИМЕНЕНИЕ | 1997 |
|
RU2192257C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2284997C2 |
| МОДУЛЯТОРЫ АДЕНОЗИНОВЫХ РЕЦЕПТОРОВ | 2001 |
|
RU2277911C2 |
| БЕНЗОЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНА ИЛИ ИХ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С АКТИВНОСТЬЮ ЭНДОТЕЛИНА | 1992 |
|
RU2086544C1 |


Изобретение относится к 4-гетероциклилсульфонамидил-6-метокси-5-(2-метоксифенокси)-2-пиридилпиримидиновым производным формулы I, в которых R1 обозначает гетероциклический фрагмент, выбранный из пиридила и тиазолила, где этот гетероциклический фрагмент необязательно может быть замещен (низш. )алкилом или (низш.)алкенилом; и их фармацевтически приемлемые соли, которые являются ингибиторами рецепторов эндотелина и вследствие этого могут применяться для лечения болезней, связанных с аномальным сосудистым тонусом и эндотелиальной дисфункцией. 2 с. и 7 з.п. ф-лы, 3 табл.
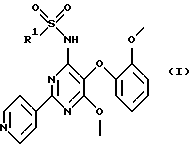
в которой R1 обозначает гетероциклический фрагмент, выбранный из пиридила и тиазолила, где этот гетероциклический фрагмент необязательно может быть замещен (низш.)алкилом или (низш.)алкенилом,
и его фармацевтически приемлемые соли.
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амид 5-метилпиридин-2-сульфоновой кислоты,
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амид 5-изопропилпиридин-2-сульфоновой кислоты,
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амид 5-изопропенилпиридин-2-сульфоновой кислоты и
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил]амид 5-метилтиазол-2-сульфоновой кислоты.
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-метилпиридин-2-сульфоновой кислоты,
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-изопропилпиридин-2-сульфоновой кислоты и
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-изопропенилпиридин-2-сульфоновой кислоты.
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-изопропилпиридин-2-сульфоновой кислоты.
[6-метокси-5-(2-метоксифенокси)-2-пиридин-4-илпиримидин-4-ил] амид 5-метилпиридин-2-сульфоновой кислоты.
| ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИЛИ ИХ СОЛИ С КИСЛОТАМИ ИЛИ ОСНОВАНИЯМИ | 1990 |
|
RU2049784C1 |
| Способ получения производных 1,4-дигидропиридина | 1984 |
|
SU1303025A3 |
| Способ получения отвержденных полиэфирмалеинатов | 1978 |
|
SU713875A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
Авторы
Даты
2003-04-10—Публикация
2000-02-28—Подача