Изобретение относится к способу получения алкиленгликолей реакцией алкиленоксида с водой в присутствии каталитической композиции.
Алкиленгликоли, в особенности моноалкиленгликоли, вызывают постоянный коммерческий интерес. Например, моноалкиленгликоли используются в композициях антифризов, в качестве растворителей и в качестве исходных веществ в производстве полиалкилентерефталатов, например для волокон или бутылок.
Известно получение алкиленгликолей путем жидкофазного гидролиза алкиленоксидов. Гидролиз осуществляют без катализатора путем добавления большого избытка воды, например от 20 до 25 молей воды на моль алкиленоксида, или с меньшим избытком воды в каталитической системе. Предполагается, что эта реакция является реакцией нуклеофильного замещения, посредством которого происходит раскрытие кольца алкиленоксида, причем вода действует как нуклеофил. Поскольку образующийся вначале моноалкиленгликоль также действует как нуклеофил, как правило, образуется смесь моноалкиленгликоля, диалкиленгликоля и более высокомолекулярных алкиленгликолей. Для того, чтобы повысить селективность по моноалкиленгликолю, необходимо подавить вторичную реакцию между первичным продуктом и алкиленоксидом, которая конкурирует с гидролизом алкиленоксида.
Одним из эффективных способов подавления вторичной реакции является увеличение относительного количества воды, присутствующей в реакционной смеси. Хотя эта мера улучшает селективность в отношении образования моноалкиленгликоля, она создает проблему, которая заключается в том, что для выделения продукта требуется удалить большие количества воды.
Были предприняты значительные усилия, чтобы найти альтернативу для увеличения селективности реакции без необходимости использования больших количеств воды. Обычно эти усилия были сосредоточены на подборе более активных катализаторов гидролиза, и были найдены различные катализаторы.
Были исследованы как кислотные, так и щелочные катализаторы гидролиза, и в результате стало очевидно, что использование кислотных катализаторов повышает скорость реакции без значительного влияния на селективность, в то время как при использовании щелочных катализаторов обычно получают более низкие селективности по отношению к моноалкиленгликолю.
Известно, что некоторые анионы, например бикарбонат (гидрокарбонат), бисульфит (гидросульфит), формиат и молибдат, проявляют хорошую каталитическую активность с точки зрения конверсии алкиленоксида и селективности по моноалкиленгликолю. Однако, когда соли этих анионов используются в качестве катализатора в гомогенной системе, при обработке продукта реакции путем дистилляции возникает проблема из-за того, что соли плохо растворимы в гликоле, и имеется тенденция к тому, что он станет полутвердым.
Высокую конверсию, хорошую селективность и низкое соотношение вода/алкиленоксид можно получить по способу, описанному в европейском патенте А 0156449. Согласно этому документу, гидролиз алкиленоксидов проводят в присутствии повышающего селективность вещества, содержащего металлат-анионы, предпочтительно твердого материала, содержащего электроположительные комплексообразующие центры, имеющие сродство к металлат-анионам. Указанный твердый материал предпочтительно представляет собой анионообменную смолу, и металлат-анионы представляют собой анионы молибдата, вольфрамата, метаванадата, гидропированадата и пированадата. Сложность этого способа состоит в том, что поток продукта, содержащего алкиленгликоль, содержит также значительное количество металлат-анионов, вытесненных с электроположительных комплексообразующих центров твердого материала, содержащего металлат-анионы. Для того, чтобы уменьшить количество металлат-анионов в потоке продукта, содержащего алкиленгликоль, этот поток приводят в контакт с твердым материалом, содержащим электроположительные комплексообразующие центры, связанные с анионами, которые могут замещаться указанными металлат-анионами.
Было предложено упростить методику выделения продукта путем использования нерастворимых в воде солей ванадиевой и молибденовой кислот. Однако с этими солями, содержащими металлат-анионы, полученные селективности значительно ниже, чем с водорастворимыми металлатами.
В патенте Японии А 57-139026 описан способ осуществления реакции алкиленоксида с водой в присутствии галогенсодержащей анионообменной смолы и диоксида углерода.
В Российском патенте С-2001901 указано, что предыдущий способ имеет тот недостаток, что в реакционной смеси образуются карбонаты, которые трудно отделить от гликолей вследствие близости их температур кипения. В этой патентной публикации описано изобретение, относящееся к осуществлению реакции гидролиза алкиленоксида в одном или в ряду последовательных "экструзионных реакторов" (непрерывная реакция) в присутствии "анионита" (анионообменной смолы, содержащей группы четвертичного аммония) в бикарбонатной форме и диоксида углерода. Существенное отличие от предыдущего, японского патента очевидно заключается в использовании бикарбонатной формы анионообменной смолы вместо ее галогенной формы. И еще, в Российском патенте обязательным является добавление диоксида углерода в исходную смесь.
Согласно международной заявке WO 95/20559 присутствие диоксида углерода в исходной смеси ухудшает каталитическое действие ионообменных смол, содержащих группы четвертичного аммония и обменивающих ионы бикарбоната. В этом документе описан способ получения алкиленгликолей, в котором алкиленоксид реагирует с водой в присутствии каталитической композиции, содержащей твердый материал, имеющий один или более электроположительных центров, которые координируются с одним или более анионами, отличными от металлат-анионов или анионов галогенов, при условии, что, когда твердый материал представляет собой анионообменную смолу, содержащую группы четвертичного аммония, и анион представляет собой бикарбонат, процесс осуществляется при практически полном отсутствии диоксида углерода.
Недостаток, который имеют обычные анионообменные смолы, заключается в их ограниченной устойчивости к нагреванию. При практическом осуществлении процесса гидролиза алкиленоксида согласно международной заявке WO 95/20559 с каталитическими композициями на основе обычных органических ионообменных смол, содержащих ионы четвертичного аммония, было найдено, что при жестких условиях реакции (высокая температура и/или длительная эксплуатация катализатора) селективность обычных катализаторов на основе ионообменных смол имеет тенденцию к значительному ухудшению, в то время как их активность даже возрастает.
Известны макроциклические хелатообразующие соединения - см., например, J. March, in Advanced Organic Chemistry; Reactions, Mechanisms and Structures, 4th Edition, 1992, pp. 82-87 and 363-364. Они обладают свойством образовывать комплексы с положительными ионами (катионами), хотя они могут также образовывать комплексы с нейтральными молекулами. Они имеют структуру правильных органических циклов, содержащих несколько гетероатомов, таких как кислород, азот или сера. Они могут быть моноциклическими, бициклическими или циклами более высокого порядка. Связывание катионов в этих комплексах является результатом ион-дипольного притяжения между гетероатомами и положительными ионами. Таким образом, число гетероатомов в молекуле определяет прочность связывания, а размер и форма полости определяют, какие ионы (или нейтральные молекулы) могут быть связаны. Макроцикл называется "хозяином" и ион - "гостем". Способность молекул "хозяина" связывать молекулы "гостя", зависящая от их формы и размера, часто является весьма специфичной, что позволяет "хозяину" извлекать один определенный катион или молекулу из смеси.
Лучшими из известных макроциклических хелатообразующих соединений являются те, в которых все или большинство гетероатомов являются атомами кислорода, в частности такими соединениями являются краун-эфиры, в которых кольцевая структура является двумерной (моноциклической), и криптанды, в которых кольцевая структура является трехмерной (бициклической, трициклической и т. д. ). Когда полость макроцикла является сферической, молекула называется сферандом. Другими, более экзотическими типами хелатообразующих соединений являются каликсарены, криптофаны, гемисферанды и понданды.
Краун-эфиры обычно обозначаются по общему числу атомов в их молекуле и числу гетероатомов в кольце плюс заместители, если они присутствуют. Примерами являются 12-краун-4 (I), 15-краун-5 (II) и дициклогексано-18-краун-6 (III). Примером каликсарена является 4-трет.-бутилкаликс(4)арен (V).



Краун-эфиры использовались в качестве катализаторов межфазного переноса, т. е. для введения реагирующего аниона гидрофильного соединения в органическую фазу, где он может реагировать с субстратом. Например, соль, подобная KCN, превращается действием дициклогексано-18-краун-6 в новую соль (IV), которая содержит тот же самый анион CN-, но у которой катион намного больше, и его положительный заряд распределен в большем объеме и, следовательно, является гораздо менее сконцентрированным. Этот более крупный катион имеет значительно большее сродство к органическим растворителям. Хотя KCN обычно нерастворим в органических растворителях, его комплекс с краун-эфиром растворим во многих из них, делая возможными его реакции в органической фазе.
В патенте США 4645817, эквивалентном европейскому патенту В 0159643, описан способ для получения содержащего гидроксильную группу продукта алкоксилирования органической карбоновой кислоты, который включает реакцию органического соединения, содержащего, по крайней мере, одну карбоксильную группу, с алкиленоксидом посредством реакции алкоксилирования в присутствии катализатора межфазного переноса. Этот катализатор может содержать основное соединение щелочного металла, которое было подвергнуто комплексообразованию с краун-эфиром. Здесь краун-эфир используется для фазового переноса катализатора алкоксилирования, содержащего основной щелочной металл.
В данной работе было обнаружено, что независимо от какого-либо каталитического эффекта или эффекта фазового переноса, который дают макроциклические хелатообразующие соединения, они могут образовывать комплексы с хорошим эффектом с катализаторами гидролиза алкиленоксидов как в гомогенных, так и в гетерогенных системах. В гомогенных системах они имеют преимущество в том, что обеспечивают более легкое разделение и рециркуляцию, а в гетерогенных системах они обеспечивают намного большую термостабильность, чем все, известные прежде.
Следовательно, данное изобретение предлагает способ получения алкиленгликолей реакцией алкиленоксида с водой в присутствии каталитической композиции, содержащей макроциклическое хелатообразующее соединение, которое образует комплекс с ионным соединением, анион которого является каталитически эффективным в условиях реакции.
Макроциклическое хелатообразующее соединение предпочтительно выбирают из группы, состоящей из краун-эфиров и криптандов.
Каталитически эффективный анион предпочтительно выбирают из группы, состоящей из галогенидов, карбоксилатов, имеющих от 1 до 20 атомов углерода, гидрокарбоната, бисульфита, гидрофосфата и металлатов.
Соответствующий катион может быть катионом щелочного металла, щелочноземельного металла или аммония. Выбор катиона не имеет решающего значения для каталитического эффекта аниона. С другой стороны, поскольку каждое макроциклическое соединение является селективным для одного или очень ограниченного числа катионов, выбор катиона будет определять выбор макроциклического соединения (соединений), которое предпочтительно следует использовать. Так, когда катион представляет собой натрий или кальций, подходящим краун-эфиром является 15-краун-5(1,4,7,10,13-пентаоксациклопентадекан), для лития - это либо 15-краун-5, либо 12-краун-4(1,4,7,10-тетраоксациклододекан) и для калия - это 18-краун-6 (1,4,7,10,13,16-гексаоксациклооктадекан).
Количество каталитического аниона, используемого в способе настоящего изобретения, обычно составляет от 0,001 до 1, предпочтительно от 0,01 до 0,1 моль на моль алкиленоксида, присутствующего в реакторе.
Следует понимать, что относительное количество макроциклического хелатообразующего соединения и ионного соединения, используемых для образования каталитической композиции, будет зависеть от выбранных конкретных катиона и аниона. Так, когда используется одновалентный катион с одновалентным анионом, относительное количество макроцикла и каталитического аниона будет соответственно эквимолярным (молярное отношение 1:1). Однако, если используется двухвалентный катион (например, Ва2+) с одновалентным анионом (например, с формиатом НСОО-), относительные молярные количества используемых каталитического аниона и макроциклического хелатообразующего соединения будут соответственно равны 2:1. И в некоторых случаях - когда один катион удерживается более чем одной макроциклической молекулой - может быть предпочтительным молярный избыток макроциклического соединения, например молярного отношения 1: 2 или 1:3. Количества как макроцикла, так и анионного соединения, которые находятся в избытке по сравнению с количеством, необходимым для образования каталитической композиции, не приносят особого вреда для реакции гидролиза, но они не дают никакого преимущества.
Комплексы согласно этому изобретению можно получить простым добавлением двух компонентов этих комплексов, т.е. макроциклического хелатирующего соединения к соли в требуемой относительной концентрации к растворителю, в котором оба они растворимы. Подходящим растворителем является вода или этиленгликоль, так как вода является реагентом в реакции гидролиза этиленоксида и этиленгликоль является продуктом этой реакции.
Как указано выше, когда комплексы используются согласно настоящему изобретению в качестве катализаторов гидролиза этиленоксида в гомогенной реакционной системе, их основное преимущество по сравнению с катализаторами, не являющимися комплексами, относится к стадии выделения после реакции. В данном случае этот комплексный гомогенный катализатор можно выделить относительно легко, потому что комплекс растворим в исходной смеси, также как и в продукте. После выделения комплекс можно возвратить в процесс или его можно регенерировать. С целью регенерации исходный макроцикл можно извлечь, например, путем адсорбции на промытом кислотой оксиде алюминия или диоксиде кремния с последующим элюированием летучим углеводородом или при помощи неионного соединения, которое имеет большее сродство к данному макроциклическому соединению. Примерами таких неионных соединений являются ацетонитрил (патент США 3997562), нитрометан (европейский патент В 0013444), диметилкарбонат и диметилоксалат (европейский патент В 0000218). Связь макроцикла с неионным соединением можно разорвать путем отгонки (дистилляции при пониженном давлении) неионного соединения, после которой остается чистый макроцикл.
Как указано выше, когда комплексы согласно этому изобретению используются в гетерогенной системе, т.е. на инертном носителе, их главное преимущество заключается в значительно более высокой термостабильности по сравнению с термостабильностью ионообменных смол.
Поэтому в предпочтительном варианте настоящего изобретения комплексные катализаторы иммобилизованы на поверхности или введены в инертный твердый носитель. Предпочтительно носитель выбирают из групп неорганических оксидов и органических полимеров. Предпочтительными примерами неорганических оксидов являются диоксид кремния, оксид алюминия, диоксид титана и диоксид циркония. Предпочтительными примерами органических полимеров являются полистиролы и полиакрилаты. Различные сополимеры и продукты поликонденсации также можно использовать в качестве инертного твердого носителя.
Способ иммобилизации макроциклов и, в частности, краун-эфиров путем введения их в смолы, такие как AMBERLITE XAD-7 и AMBERCHROM CG-71ms, описан в статье Horwitz et al. Anal. Chem. 63, 1991, 522-525 (AMBERLITE и AMBERCHROM - это торговые марки). Способ ковалентного связывания макроциклов, таких как краун-эфиры, с силикагелем описан в патенте США 4943375.
Способы введения макроциклов в полимеры были суммированы в обзорной статье S. Smid and R. Sinta, озаглавленной "Macroheterocyclic Ligands on Polymers", в сборнике Topics of current Chemistry, ed. F.L. Boschke, Springer Verlag Berlin, Vol. 121, 1984, 105-156. Способы включения краун-эфиров в полимерную сетку путем поликонденсации с формальдегидом описаны в статье Blasius et al., J. Chromatography 97, 1974, 89-97, и в статье Т. Hayashita et al. Anal. Chem. 62, 1990, 2283-2287. Способы сополимеризации краун-эфиров с винильными мономерами, такими как стирол, описаны в работе S. Kopolow et al., J. Macromolecules, 4, 1971, 359-360 и 6, 1973, 133-142.
Специально изготовленные краун-эфиры, иммобилизованные на/или в различных твердых носителях, таких как полистиролы, полиакрилаты или кремнеземы, в настоящее время продаются под торговым названием Superlig фирмой "IBC Advanced Technologies Inc.", American Fork, Utah, USA.
Каталитическая композиция согласно данному изобретению может быть получена путем добавления раствора ионного соединения к твердому материалу, содержащему хелатообразующий макроцикл. Например, когда твердый материал представляет собой полистирол с макроциклом типа краун-эфира и каталитически активный анион представляет собой формиат, каталитическую композицию можно получить в одну стадию путем добавления к твердому носителю водного раствора формиата щелочного металла, такого как формиат калия, с последующей промывкой водой.
Алкиленоксиды, используемые в качестве исходного вещества в способе этого изобретения, определяются как обычно, т.е. они представляют собой соединения, в молекулах которых имеется вицинальная оксидная (эпоксидная) группа.
Особенно подходящими являются алкиленоксиды общей формулы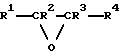
в которой R1, R2, R3 и R4 независимо представляют атом водорода или необязательно замещенную алкильную группу, имеющую от 1 до 6 атомов углерода. Любая алкильная группа, обозначаемая как R1, R2, R3 и/или R4, предпочтительно имеет от 1 до 3 атомов углерода. В качестве заместителей могут присутствовать неактивные группы, такие как гидроксильные группы. Предпочтительно R1, R2 и R3 представляют водород и R4 представляет незамещенную C1-С3-алкильную группу и более предпочтительно R1, R2, R3 и R4 представляют атомы водорода.
Примерами подходящих алкиленоксидов являются этиленоксид, пропиленоксид, 1,2-эпоксибутан, 2,3-эпоксибутан и глицидиловый спирт. Этиленоксид и пропиленоксид имеют особенно важное значение в промышленности.
Как упомянуто выше, предпочтительно проводить гидролиз алкиленоксидов без использования избыточных количеств воды. В способе согласно настоящему изобретению количества воды в пределах от 1 до 15 молей на моль алкиленоксида являются вполне приемлемыми, при этом количества воды в пределах от 1 до 6 моль на моль алкиленоксида являются предпочтительными. В способе этого изобретения высокие селективности по отношению к моноалкиленгликолю часто достигаются уже тогда, когда в реакцию подается только от 4 до 5 молей воды на моль алкиленоксида.
Процесс этого изобретения может быть проведен периодическим способом. Однако, особенно в промышленном масштабе, предпочтительно проводить процесс непрерывно.
Для того, чтобы получить адекватное соотношение величин выхода и времени, рекомендуется проводить процесс при повышенной температуре и давлении.
Подходящие температуры реакции обычно находятся в интервале от 80 до 200oС, при этом температуры в пределах от 90 до 150oС являются предпочтительными. Давление реакции обычно выбирают в пределах от 200 до 3000, предпочтительно от 200 до 2000 кПа. В случае периодического процесса выбранное давление реакции предпочтительно создается при помощи инертного газа, такого как азот. При желании можно использовать смеси газов, например в некоторых случаях оптимальной является смесь диоксида углерода и азота.
Следующие примеры иллюстрируют настоящее изобретение.
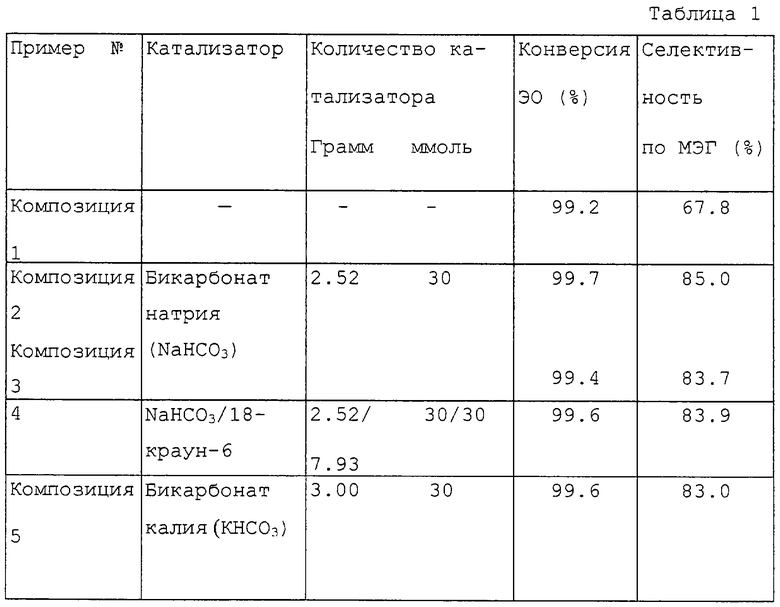
Примеры 1-16, гомогенные катализаторы
В автоклав на 250 мл загружали катализатор (соль щелочного металла или смесь соли щелочного металла с краун-эфиром) и воду (100 г; 5,55 моль). Незанятое пространство реактора продували 3 раза азотом, и устанавливали начальное давление 900 кПа. Смесь нагревали до 100oС. Этиленоксид (ЭО) (44 г; 1 моль) медленно добавляли при перемешивании (500 об/мин). Реакционную смесь непрерывно перемешивали в течение 5 часов при 100oС. В конце опыта отбирали пробу для анализа методом газожидкостной хроматографии.
Результаты представлены в таблице 1.
Обработка реакционных смесей.
Сырые реакционные смеси из сравнительных примеров 2 и 3, в которых в качестве катализатора использовали растворенный бикарбонат натрия, и из примера 4, в котором в качестве катализатора использовали бикарбонат натрия в комплексе с краун-эфиром, выпаривали при пониженном давлении (90oС; 1,5 кПа; около 60 минут). После испарения воды в реакционных смесях из сравнительных примеров 2 и 3 происходило образование твердого продукта из каталитической соли NаНСО3. В противоположность этому смесь, полученная в примере 4, была гомогенной. Дальнейшее выпаривание (110oС; 1,5 кПа; около 90 минут) для удаления моноэтиленгликоля (МЭГ) в сравнительных примерах 2 и 3 привело к образованию густой неприятного вида суспензии, тогда как остаток после дистилляции реакционной массы примера 4, где использован катализатор с краун-эфиром, снова был полностью гомогенным.
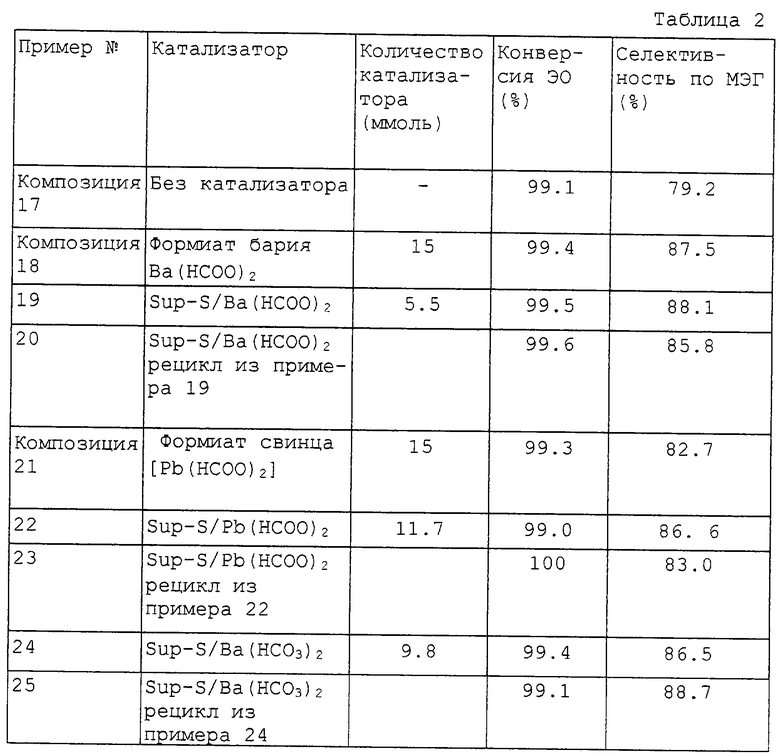
Примеры 17-25, гетерогенные катализаторы (с макроциклическим комплексообразующим агентом на твердом носителе)
Получение катализатора
Комплексообразующий макроцикл, иммобилизованный на твердом носителе (диоксиде кремния), под названием Superlig 512-Silica (сокращенно Sup-S) был получен от фирмы "IBC Advanced Technologies Inc." (American Fork, Utah, USA) (номер партии 971230YK-4-56; емкость, т.е. содержание макроцикла, 0,23 ммоль/г). На Superlig были получены комплексы формиата бария и формиата свинца.
Формиат бария Ва(НСОО)2 на Superlig 512-Silica
70 г Superlig 512 (на диоксиде кремния; 16,1 ммоль макроцикла) добавляли к раствору 71,75 г (1 ммоль) гидрата формиата лития (HCOOLi Н2О), 5 г (0,02 моль) формиата бария Ва(НСОО)2 и 4 мл (0,1 моль) муравьиной кислоты (НСООН) в 1 л воды. Эту смесь осторожно перемешивали в течение 24 часов. Твердый катализатор отфильтровывали, промывали водой (3 • 150 мл) и сушили при 100oС в вакуумном сушильном шкафу в течение 64 часов. В результате получили материал, содержащий 1/08 мг/г бария.
Формиат свинца Рb(НСОО)2 на Superlig 512-Silica
70 г Superlig 512 (на диоксиде кремния; 16/1 ммоль макроцикла) добавляли к раствору 71,75 г (1 моль) гидрата формиата лития (HCOOLi Н2O), 5 г (0,02 моль) формиата свинца и 4 мл (0,1 моль) муравьиной кислоты (НСООН) в 1 л воды. Эту смесь осторожно перемешивали в течение 24 часов. Твердый катализатор отфильтровывали, промывали водой (3 • 130 мл) и сушили при 100oС в вакуумном сушильном шкафу в течение 64 часов. В результате этого получили материал, содержащий 3,46 мг/г свинца.
Бикарбонат бария Ва(НСО3)2 на Superlig 512-Silica
Бикарбонат бария был иммобилизован на Superlig с помощью трехстадийного способа.
Стадия 1: 50 г Superlig 512 (диоксид кремния; 11,5 ммоль макроцикла) добавляли к раствору 4 г (19,2 ммоль) BaCl2 в 200 мл метанола. Смесь перемешивали в течение двух суток при комнатной температуре. Superlig фильтровали, промывали метанолом и твердое вещество сушили в течение ночи в вакуумном сушильном шкафу. В результате получили материал, содержащий 2,08 г (10 ммоль) BaСl2.
Стадия 2: 3 г (40,5 ммоль) NаНСО3 растворяли в 140 мл воды и 130 мл метанола. Добавляли комплекс BaCl2/Superlig, и смесь перемешивали при комнатной температуре в течение 24 часов. Смесь фильтровали и промывали водой.
Стадия 3: комплекс после частичного обмена (Superlig/BaCl2-Ba(НСО3)2) загружали в колонку и пропускали через нее раствор 4 г NаНСО3 в 100 мл воды и 100 мл метанола (часовая объемная скорость жидкости 1,1 л/л•ч). Superlig промывали водой и сушили в течение ночи в вакуумном сушильном шкафу. В результате этого получали материал, не содержащий хлора и содержащий 2,54 г (9,8 ммоль) Ва(НСО3)2. Гидролиз этиленоксида (ЭО) периодическим способом при 100oС.
Конверсию этиленоксида (ЭО) в моноэтиленгликоль (МЭГ) проводили как описано в примерах 1-17, за исключением того, что использовали мольное отношение вода/ЭО, равное 8,35.
Рецикл гетерогенного катализатора.
После завершения гидролиза ЭО периодическим способом сырую реакционную смесь охлаждали и твердый катализатор отфильтровывали, промывали водой (3 • 150 мл) и сушили в вакуумном сушильном шкафу в течение ночи.
Результаты показаны в таблице 2.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЕЙ | 2008 |
|
RU2467995C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЕЙ | 2006 |
|
RU2410370C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЕЙ И КАТАЛИТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ | 1999 |
|
RU2233261C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЕЙ | 1999 |
|
RU2222522C2 |
| КАТАЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЯ С РЕЦИКЛОМ РЕАКТОРНОГО ПРОДУКТА | 2001 |
|
RU2267478C2 |
| СПОСОБ ГИДРОЛИЗА АЛКИЛЕНОКСИДОВ С ИСПОЛЬЗОВАНИЕМ ДОБАВКИ, СТАБИЛИЗИРУЮЩЕЙ КАТАЛИЗАТОР | 1999 |
|
RU2230728C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНКАРБОНАТОВ | 2006 |
|
RU2410380C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЯ | 2008 |
|
RU2480446C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЯ | 2009 |
|
RU2490247C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЕНГЛИКОЛЯ | 2008 |
|
RU2477718C2 |

Изобретение относится к способу получения алкиленгликолей, используемых в композициях антифризов, в качестве растворителей и исходных веществ в производстве полиалкилентерефталатов. Способ включает реакцию алкиленоксида с водой в присутствии каталитической композиции, содержащей макроциклическое хелатообразующее соединение, связанное в комплекс с ионным соединением, анион которого является каталитически эффективным в условиях реакции. Как правило, макроциклическое хелатообразующее соединение выбирают из группы, включающей краун-эфиры и криптанды, и оно иммобилизовано на поверхности или введено в инертный твердый носитель, выбранный из группы, включающей неорганические оксиды - диоксид кремния, оксид алюминия, диоксид титана, диоксид циркония и органические полимеры - полистиролы и полиакрилаты. Обычно анион выбирают из группы, включающей галогениды, карбоксилаты, имеющие от 1 до 20 атомов углерода, гидрокарбонат, бисульфит, кислый фосфат и металлаты. Как правило, алкиленоксид представляет собой этиленоксид и алкиленгликоль представляет собой этиленгликоль. Процесс можно проводить как в гомогенной, так и в гетерогенной системах. Способ в гомогенных системах обеспечивает легкое отделение и рециркуляцию катализатора, а в гетерогенных системах позволяет повысить термостабильность катализатора, 6 з.п. ф-лы, 2 табл.
| RU 2001901 C1, 30.10.1993 | |||
| US 4160116 А, 03.07.1979 | |||
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| US 4645817 А, 24.02.1987 | |||
| УСТРОЙСТВО ДЛЯ ПРЕДОТВРАЩЕНИЯ ЗАСЫПАНИЯ ВОДИТЕЛЯ ТРАНСПОРТНОГО СРЕДСТВА | 1991 |
|
RU2023601C1 |
Авторы
Даты
2003-05-10—Публикация
1998-10-29—Подача