ОБЛАСТЬ ТЕХНИКИ.
Изобретение относится к медицине и медицинской технике, а именно к челюстно-лицевой хирургии, стоматологии, онкостоматологии, травматологии, и может быть использовано для лечения, восстановления, коррекции, замещения или устранения повреждений, деформаций, диспропорций или дефектов развития костей лицевого скелета, челюстно-лицевых костей, костей мозгового черепа или иных костей или хрящей, имеющих травматические или иные дефекты или повреждения или поражения опухолевыми или дегенеративно-дистрофическими процессами различной этиологии, восстановления функций зубочелюстной системы, или изменения формы или размеров различных отделов лица.
УРОВЕНЬ ТЕХНИКИ.
Известен способ изготовления и использования имплантатов (эндопротезов) из аутокости, обычно из ребра, этого же пациента. Однако этот способ травматичен для пациента и не пригоден для замещения или восстановления у него тонкостенных плоских или фасонных поверхностных костей или хрящей челюстно-лицевой или черепно-мозговой области головы. Поэтому интенсивно разрабатываются новые способы замещения поврежденной или деформированной костной ткани имплантатами (эндопротезами) из чужеродных костей или из искусственно созданных материалов.
Известен способ приготовления и использования костных брефотрансплантатов для замещения костных дефектов, по которому используют цельную анатомическую кость, прошедшую насыщение антибактериальным составом [1].
Известен способ пластики дефекта кости путем его заполнения измельченной эмбриональной костной тканью свиньи или крупного рогатого скота с размерами костных фрагментов 0,5-2,5 мм в объеме, заполняющем костный дефект [2].
Известен способ получения и применения костной керамики, обедненной окисью кальция, при котором разделанные на куски пористые кости подвергают минерализации для удаления всех органических составляющих с последующим спеканием минерализованной костной матрицы до образования керамики, причем для удаления окиси кальция из минерализованной костной матрицы ее подвергают вымыванию деминерализованной водой при 10-80oС в течение времени от 4 часов до 7 дней [3].
Общими недостатками использования полученных по данным способам имплантатов (эндопротезов) является неудовлетворительная совместимость инородной ткани с тканями пациента и невозможность замещения или восстановления относительно больших по площади тонкостенных плоских или фасонных поверхностных костей или хрящей челюстно-лицевой или черепно-мозгового области головы.
Известно применение в челюстно-лицевой, черепно-мозговой или эстетической хирургии и стоматологии металлических имплантатов из титана, золота или иных инертных металлов или сплавов. Однако они не только дороги и не всегда совместимы с мягкими и твердыми тканями пациентов, но и обычно выделяются темными пятнами под тонкой кожей на лице или голове, требуют жесткой механической фиксации, обладают большим весом и приводят к резкому переохлаждению (иногда отморожению) имплантированной области при пониженной (минусовой) температуре воздуха из-за высокой теплопроводности металла.
Для устранения этих технических недостатков изготавливают и используют металлические имплантаты с поверхностными открытыми порами [4] или имплантаты на основе перфорированной сетчатой титановой ленты с напыленным слоем биокерамики (гидроксиапатит, биоситалл) с одной или двух сторон [5]. Однако данные имплантаты очень сложны в изготовлении и также недостаточно хорошо совместимы с твердыми и мягкими тканями пациента и часто ими отторгаются.
Известен набор унифицированных заготовок биосовместимых остеопроводящих ячееистых апатитосиликатных имплантатов для восстановления и замещения костных дефектов в челюстно-лицевой и хирургической стоматологии, включающий элементы подбородочного отдела, угол нижней челюсти правого и левого исполнения, спинку носа, тело нижней челюсти правого и левого исполнения, левую и правую скуловые кости, в которых содержание синтетического гидроксиапатита или костного гидроксиапатита животного происхождения или гидроксиапатита в смеси с другими более растворимыми фосфатами кальция 40-60 мас.%, температурный интервал спекания и порообразования 800-1200oС, объемная масса 800-1200 кг/м3, средний размер ячеек (пор) 300 мкм, общая пористость 40-60%, водопоглощение (фармакологическая емкость) 35-50%, прочность на сжатие не менее 10 МПа [6].
Техническими недостатками имплантатов на основе гидроксиапатита [Са5(РO4)3ОН] является не всегда удовлетворительная совместимость с тканями пациента, относительно низкая прочность материала и невозможность его использования для замещения тонкостенных плоских или фасонных поверхностных костей или хрящей челюстно-лицевой или черепно-мозгового области головы, поскольку подобные имплантаты со временем полностью рассасываются.
Известно, в частности, что керамику, содержащую в своем составе более 95% оксида алюминия, называют корундовой, свойства и качества которой определяется рядом факторов, включая вид используемого сырья и добавок, их количественным соотношением, режимом и условиями осуществления технологического процесса ее изготовления [7].
Известны керамические материалы на основе глинозема (окиси алюминия) и имплантаты для хирургии по утвержденному в 1981 г. международному стандарту ИСО 6474-81 [8], имеющие химический состав: Аl2О3 - не менее 99,5%, SiO2 и щелочные окислы металла не более 0,1%, плотность не менее 3,9 г/см3, прочность на изгиб 400 МПа, средний размер зерна не более 7 мкм. Данные керамические материалы и изготовленные из него имплантаты обладают свойствами удовлетворительной биосовместимости и стабильности в человеческом организме, поэтому они в свое время были рекомендованы Международной Организацией по Стандартизации для изготовления суставных заменителей и костных прокладок.
Однако физико-химические свойства керамического материала по ИСО 6474-81 и известные в то время композиции и технологические способы изготовления монолитных керамических имплантатов методом их формования из порошкообразного природного глинозема (белой глины) под гидростатическим давлением с последующим обжигом позволяли изготавливать из данного материала только массивные объемные имплантаты (суставные заменители и костные прокладки) относительно простой геометрической формы для замещения или устранения дефектов или деформаций массивных округлых суставных или скелетных костей, что не удовлетворяло возрастающие требования к качеству имплантируемых керамических материалов. В частности одним из существенных недостатков керамических изделий из глинозема, полученных по ранее известным технологиям, является техническая сложность получения тонкостенных имплантатов сложной формы под гидростатическим давлением, их пониженная прочность и повышенная усадка (более 10-11%) при обжиге. В 1994 г. международный стандарт ИСО 6474-81 (1981 г.) был аннулирован.
В 1994 г. Международной Организацией по Стандартизации была утверждена редакция нового международного стандарта ISO 6474, 1994-02-01 [9], где было рекомендовано изготавливать имплантационные керамические материалы из оксида алюминия высокой чистоты с прокаливающей добавкой оксида магния для их использования в качестве костных прокладок, костных заменителей и компонентов ортопедических суставных протезов.
Химический состав материала по ISO 6474 1994-02-01: основной материал оксид алюминия Al2O3 высокой чистоты - более 99,5%, прокаливающая добавка оксид магния МgО - не более 0,3%, пределы примесей в виде общего количества оксида кремния SiO2 + оксида кальция СаО + оксидов щелочных металлов не более 0,1%. Размер зерна материала по ISO 6474, 1994-02-01 не более 7,0 мкм, предел прочности на изгиб не менее 150 МПа. Данный материал рекомендован ISO 6474 1994-02-01 для имплантатов, применяемых при высоких нагрузках (опорные поверхности, заменители суставов), и для имплантатов, применяемых при низких нагрузках (имплантаты верхне-челюстно-лицевые и для среднего уха).
Имплантаты из материала по ISO 6474, 1994-02-01 обычно получают путем приготовления керамической композиции из смеси ультрадисперсного точно фракционированного порошка высокочистого оксида алюминия и прокаливающей добавки в виде порошка оксида магния, формования методом прессования и спекания.
Введение прокаливающей добавки в ультрадисперсный порошок высокочистого оксида алюминия требует дополнительного диспергирования оксида магния и длительного перемешивания смеси.
Ультрадисперсный порошок оксида алюминия высокой чистоты обычно получают плазмохимическими методами и он очень дорог, а формование имплантатов методом прессования позволяет получать только толстостенные массивные изделия простой геометрической, чаще всего сферической или цилиндрической, формы. При этом установлено, что получаемые подобным образом имплантанты и эндопротезы из-за их повышенной твердости частиц исходного сырья и получаемого керамического материала практически невозможно подвергать механической обработке и, соответственно, невозможно подгонять их размеры по индивидуальным особенностям пациента. Поэтому изготовляемые из высокочистого оксида алюминия имплантаты дороги, недоступны широким кругам пациентов и в настоящее время на практике применяются преимущественно только в качестве заменителей суставов и толстостенных массивных имплантатов и эндопротезов простой геометрической формы и стандартных типоразмеров.
Наиболее близким по технической сущности и достигаемому при использовании результату (прототипом) является керамический эндопротез, полученный путем приготовления шликера (керамической суспензии) из керамического материала, заливку шликера в гипсовую форму и обжиг эндопротеза, характеризующийся тем, что эндопротез изготавливают из керамического материала содержащего 98,4-99,4 маc.% оксида алюминия Аl2О3 и 0,6-1,6 маc.% оксида магния МgО, затем эндопротез покрывают слоем фторопласта и проводят термообработку [10] (прототип).
Техническими недостатками данных эндопротезов является их недостаточная биосовместимость и недостаточная прочность, обусловленная повышенным содержанием оксида магния, образующего в межкристаллических зонах эфтектические смеси с пониженной прочностью, а также невозможность изготовления из керамического материала данного состава тонкостенных эндопротезов и имплантатов сложной геометрической формы для хирургии по индивидуальным размерам пациента.
ЗАДАЧИ И ТЕХНИЧЕСКИЙ РЕЗУЛЬТАТ.
Задачами изобретения и требуемым техническим результатом, достигаемым при использовании изобретения, является создание и применение в челюстно-лицевой хирургии, стоматологии, онкостоматологии, травматологии эндопротезов (имплантатов) из нового биосовместимого керамического материала, повышение экономичности и технологичности изготовления керамических эндопротезов (имплантатов) из доступного дешевого сырья при одновременном повышении качественных показателей и прочности керамического материала эндопротезов и надежности фиксации эндопротезов (имплантатов) со сложной анатомической формой поверхности и требуемыми прочностными и качественными показателями керамического материала эндопротезов (имплантатов) и обеспечение возможности изготовления тонкостенных индивидуальных эндопротезов сложной геометрической формы.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ.
Поставленные задачи решаются и требуемый технический результат от использования изобретения достигается тем, что СОГЛАСНО ИЗОБРЕТЕНИЮ эндопротез (имплантат) из керамического материала для восстановления, коррекции, замещения или устранения дефектов, повреждений или деформаций челюстно-лицевых или черепно-мозговых костей или хрящей изготовлен из керамического материала, содержащего оксид алюминия в альфа-фазе глинозема, содержащего не менее 99,5 маc.% оксида алюминия, 0,15-0,4 маc.% оксида магния, не более 0,1 маc.% оксида кремния и не более 0,05 маc.% оксида железа, при этом керамический материал эндопротеза имеет монолитную структуру без открытой пористости и водопоглощения.
Объемная масса (плотность) керамического материала эндопротеза составляет 3,79-3,98 г/см3, прочность керамического материала эндопротеза на изгиб составляет 150-750 МПа, прочность на сжатие составляет 1500 - 7500 МПа, коэффициент Пуассона 0,22-0,23, коэффициент термического расширения (72-78)•10-7 1/oС, удельное объемное сопротивление 1014 Ом/см, диэлектрическая проницаемость при частоте 1010 Гц 9,4-9,8, тангенс угла диэлектрических потерь при частоте 1010 Гц 3•10-4, температура плавления керамического материала 2040oС, а средний размер зерна корунда керамического материала составляет 0,5-15,0 мкм.
Материал имеет белый или бело-желтоватый или бело-сероватый цвет и его получают на основе размолотого в водной среде до среднего размера частиц 0,5-3,5 мкм глинозема, содержащего не менее 99,5 маc.% оксида алюминия, в том числе не менее 93 маc.% оксида алюминия в альфа-фазе, путем приготовления керамической суспензии плотностью 2,2-2,8 г/см3, формования в гипсовые формы или формования на органической пене или формования с выгораемым наполнителем или формования путем вспенивания керамической суспензии, сушки, спекания-карбонизации при температуре 1150-1250oС и обжига в окислительной среде при температуре 1750-1790oС.
Эндопротез выполнен с анатомической формой или анатомическим профилем поверхности, идентичным или аналогичным анатомической форме или анатомическому профилю поверхности восстанавливаемой, коррегируемой или замещаемой челюстно-лицевой, черепно-мозговой кости или хряща или их поврежденных, коррегируемых или замещаемых частей.
В частности, эндопротез выполнен с анатомической формой или анатомическим профилем поверхности, идентичными или аналогичными анатомической форме или анатомическому профилю поверхности нижней челюсти или угла нижней челюсти или суставного отростка с углом нижней челюсти или альвеолярного отростка или малярной (скуловой) кости или ментальной подбородочной кости или нижне-бокового края глазницы или бокового края глазницы или дна глазницы или кости паранозальной области или скуловой кости или скулоальвеолярного гребня или спинки носа или кончика носа или ушного завитка или их поврежденных, коррегируемых или замещаемых частей или иных костей или хрящей.
Кроме этого эндопротез выполнен перфорированным и содержит средства фиксации его положения на костной или хрящевой ткани или в мягкой ткани, выполненные, например, в виде отверстий или выступов или впадин или пористой поверхности или в виде слоя из пенокерамического материала идентичного химического состава, расположенного со стороны контакта эндопротеза после его имплантации с костной или хрящевой тканью и имеющего открытую пористость 60-90%, макропоры размером 0,1-10 мм и микропоры в стенках маркопор 0,0001-0,1 мм.
Пенокерамику изготавливают из содержащего оксид алюминия в альфа-фазе глинозема, включающего не менее 99,5 маc.% оксида алюминия, 0,15-0,45 маc.% оксида магния, не более 0,1 маc.% оксида кремния и не более 0,05 маc.% оксида железа, путем размола глинозема в водной среде до среднего размера частиц 0,5-3,5 мкм, приготовления керамической суспензии плотностью 2,2-2,8 г/см3, формования на органической пене или формования с выгораемым наполнителем или формования вспениванием керамической суспензии на клейканифольной эмульсии, спекания-карбонизации при температуре 1150-1250oС и обжига в окислительной среде при температуре 1750-1790oС.
Поставленные задачи решаются и требуемый технический результат достигается также тем, что СОГЛАСНО ИЗОБРЕТЕНИЮ в наборе керамических эндопротезов (имплантатов) для восстановления, коррекции, устранения или замещения дефектов челюстно-лицевых или черепно-мозговых костей или хрящей эндопротезы изготовлены из керамического материала, содержащего не менее 99,5 маc.% оксида алюминия, 0,15-0,4 маc.% оксида магния, не более 0,1 мас.% оксида кремния и не более 0,05 маc.% оксида железа.
Керамический материал эндопротезов имеет монолитную структуру без открытой пористости и водопоглощения, объемная масса (плотность) керамического материала эндопротезов составляет 3,79-3,98 г/см3, прочность керамического материала эндопротезов на изгиб составляет 150-750 МПа, прочность керамического материала эндопротезов на сжатие составляет 1500-7500 МПа, а размер зерна корунда керамического материала эндопротезов составляет 0,5-15,0 мкм, при этом эндопротезы выполнены с анатомической формой или анатомическим профилем поверхности, идентичными или аналогичными анатомической форме или анатомическому профилю поверхности нижней челюсти, угла нижней челюсти, суставного отростка с углом нижней челюсти, альвеолярного отростка или малярной скуловой кости, ментальной подбородочной кости, нижнебокового края глазницы, бокового края глазницы, дна глазницы, кости паранозальной области, кости скуловой кости, кости скулоальвеолярного гребня, спинки носа, кончика носа, ушного завитка или иных челюстно-лицевых или черепно-мозговых костей или хрящей или их отдельных частей или иных костей или хрящей.
При этом эндопротезы изготовлены из керамического материала, полученного на основе размолотого в водной среде до среднего размера частиц 0,5 - 3,5 мкм глинозема, содержащего не менее 99,5 маc.% оксида алюминия, в том числе не менее 93 маc.% оксида алюминия в альфа-фазе, путем приготовления шликера (керамической суспензии) плотностью 2,2 - 2,8 г/см3, формования в гипсовые формы, спекания-карбонизации при температуре 1150-1250oС и обжига в окислительной среде при температуре 1750-1790oС, эндопротезы выполнены перфорированными и имеют белый или бело-желтоватый или бело-сероватый цвет.
Кроме этого эндопротезы содержат средства фиксации их положения на костной или хрящевой ткани или в мягкой ткани, выполненные в виде отверстий или выступов или впадин или пористой поверхности со стороны контакта с костной или хрящевой тканью или в виде слоя из пенокерамического материала идентичного химического состава, расположенного со стороны контакта эндопротеза после его имплантации с костной или хрящевой тканью и имеющего открытую пористость 60-90%, макропоры размером 0,1-10 мм и микропоры в стенках маркопор 0,0001-0,1 мм, полученного путем вспенивания керамической суспензии из размолотого глинозема на клейканифольной эмульсии или путем формования на органической пене, сушки, спекания-карбонизации при температуре 1150-1250oС и обжига.
ПЕРЕЧЕНЬ ФИГУР ЧЕРТЕЖЕЙ.
Раскрытие изобретения поясняется чертежами, на котором изображены отдельные частные варианты исполнения эндопротезов по изобретению.
На фиг.1 изображен вид сбоку эндопротеза суставного отростка с углом нижней челюсти левого исполнения, который содержит прикрепляемый к кости выступ клиновидной формы (позиция 1), поверхность которого (позиция 2) выполнена пористой или пенокерамической, а на фиг 2 - его вид спереди.
На фиг.3 изображен вид спереди эндопротеза альвеолярного отростка прямого, а на фиг.4 - его вид сверху.
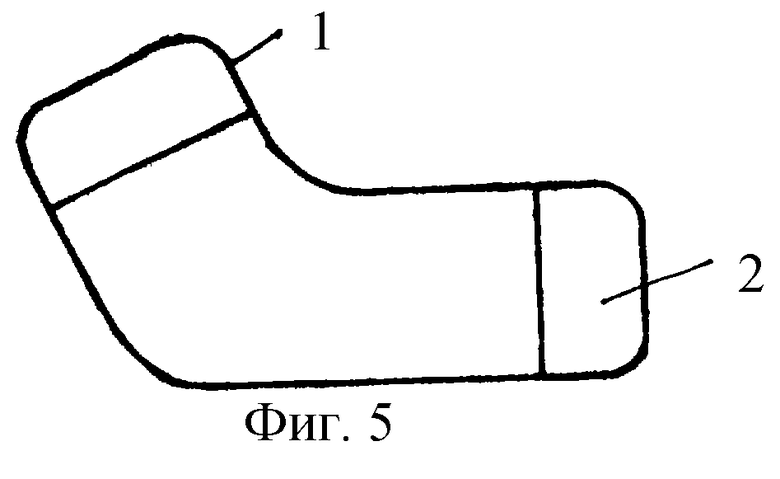
На фиг. 5 изображен вид сбоку эндопротеза паранозальной области левого исполнения, который содержит прикрепляемый к кости выступ (позиция 1), поверхность которого (позиция 2) выполнена пористой или пенокерамической, а на фиг.6 - его вид сверху.
На фиг.7 изображен вид сбоку эндопротеза кости паранозальной области левого исполнения, а на фиг.8 - его вид сверху.
На фиг. 9 изображен вид спереди эндопротеза ментальной (подбородочной) области, а на фиг.10 - его вид сверху.
На фиг.11 изображен вид спереди эндопротеза малярной (скуловой) области левого исполнения, а на фиг.12 - его вид сверху.
На фиг. 13 изображен вид сбоку эндопротеза области скулоавеолярного гребня, а на фиг.14 - его вид сбоку.
На фиг. 15 изображен вид снизу эндопротеза дна глазницы левого исполнения, а на фиг.16 - его вид сбоку.
На фиг.17 изображен вид спереди эндопротеза спинки и кончика носа, а на фиг.18 - его вид сверху.
На фиг. 19 изображен вид спереди эндопротеза альвеолярного отростка закругленного, а на фиг.20 - его вид сверху.
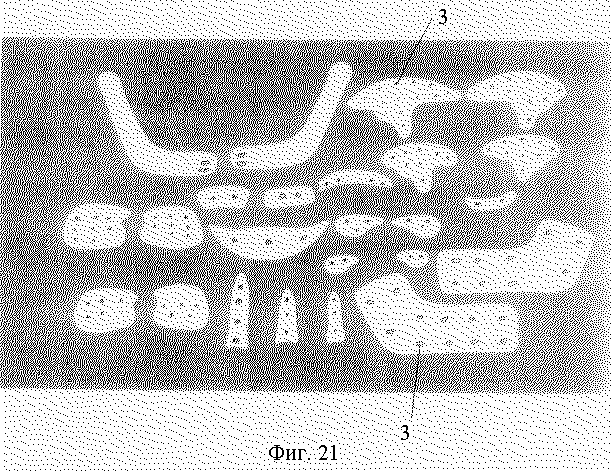
На фиг. 21 изображена фотография набора эндопротезов с анатомической формой или анатомическим профилем поверхности идентичными или аналогичными анатомической форме или анатомическому профилю поверхности (в правом и левом исполнении, большой и малой форм) угла нижней челюсти, суставного отростка с углом нижней челюсти, альвеолярного отростка прямой или закругленной формы, малярной скуловой области, ментальной подбородочной области, дна глазницы, паранозальной области, скулоальвеолярного гребня, спинки и кончика носа, выполненных перфорированными с отверстиями (позиция 3).
Все изображенные на фигурах чертежей и фотографии отдельные примеры исполнения эндопротезов могут изготавливаться левого или правого исполнения (зеркальной симметрии) для имплантации, соответственно с правой или левой стороны пациента, большого или малого стандартных типоразмеров или индивидуальных размеров конкретного пациента, с анатомической формой или анатомическим профилем поверхности, идентичными или аналогичными анатомической форме или анатомическому профилю замещаемой, восстанавливаемой или коррегируемой кости или хряща или их отдельных поврежденных или деформированных частей.
Раскрытие изобретения поясняется на примере раскрытия примеров изготовления эндопротезов и примерами экспериментального и клинического исследования эффективности использования эндопротезов по изобретению, доказывающие промышленную осуществимость изобретения и возможность реализации изобретения промышленным способом.
Были изготовлены опытные эндопротезы (имплантаты) и с ними были проведены все требуемые для медицинских изделий санитарно-химические испытания, токсиколого-гигиенические и клинические испытания.
Керамические эндопротезы изготавливалась из глинозема путем приготовления шликера (керамической суспензии), формования, сушки и спекания.
При этом экспериментально установлено, что керамический материал эндопротезов требуемого по изобретению качества можно получить только на основе содержащего не менее 93 маc.% оксида алюминия в альфа-фазе глинозема при наличии в исходном глиноземе и получаемом керамическом материале не менее 99,5 маc. % оксида алюминия, предпочтительно 99,5-99, 85 маc.% оксида алюминия, 0,15-0,4 маc. % оксида магния, не более 0,1 маc.% оксида кремния и не более 0,1 маc.% оксида железа, предпочтительно не более 0,05 маc.% оксида железа, не более 0,1 маc.% суммы оксидов натрия и калия в пересчете на оксид натрия, например, на основе глинозема марки ГЛМК по ТУ-48-5-200-79 производства АО "Бокситогорский Глинозем" Ленинградской области или ГОСТ 30559-98.
Экспериментально установлено, что для получения монолитного керамического материала без открытой пористости и водопоглощения требуемого качества и прочностных показателей глинозем соответствующего состава для активизации поверхности его частиц и оптимального формообразования необходимо предварительно размалывать с получением ультрадистерсной полифракционной керамической суспензии на основе глинозема, содержащего не менее 99,5 маc.% оксида алюминия, в том числе не менее 93 маc.% оксида алюминия в альфа-фазе, приготовлять шликер плотностью 2,2-2,8 г/см3, формовать заготовки эндопротезов в гипсовые формы, сушить, спекать при температуре 1150-1250oС и обжигать в окислительной среде при температуре 1750-1790oС.
Экспериментально установлено также, что для получения керамического материала требуемого качества содержащий оксид алюминия в альфа-фазе глинозем соответствующего состава для активизации поверхности его частиц, оптимального формообразования, снижения усадки при обжиге и спекании, а также для улучшения качественных показателей необходимо предварительно размалывать в водной среде до среднего размера частиц 0,5-3,5 мкм, формовать эндопротезы в гипсовые формы с получением уплотненного поверхностного слоя, сушить, обжигать и спекать по указанным выше технологическим параметрам.
При этом экспериментально установлено, что предварительное спекание при температуре 1150-1250oС позволяет изготавливать заготовки эндопротезов, которые можно обрабатывать механическими способами для придания им требуемой формы и размеров, предварительного контроля качества структуры материала и целостности его поверхности, а окончательный обжиг при температуре 1750-1790oС позволяет получать готовые эндопротезы требуемого качества и размеров.
Экспериментально установлено также, что в качестве исходного материала, для изготовления эндопротезов (имплантатов) по изобретению целесообразно использовать глинозем марки ГЛМК по ТУ-48-5-200-79 производства АО "Бокситогорский Глинозем" Ленинградской области или глинозем аналогичного качества или по ГОСТ 30559-98.
Результаты всесторонних испытаний эндопротезов (имплантатов) из нового керамического материала на основе глинозема показали, что получаемый керамический материал и эндопротезы (имплактаты) из него по токсиколого-гигиеническим и санитарно-химическим показателям отвечают всем требованиям, предъявляемым к медицинским изделиям аналогичного назначения.
Были проведены исследования биоинертности и биосовместимости эндопротезов (имплантатов) с плотной, пористой и комбинированной структурой из данного керамического материала. Объектом исследования являлись керамические имплантаты, изготовленные из керамики методом шликерного литья в гипсовые формы.
В опытах были использованы 72 животных, разделенных на две серии. Количество животных на срок наблюдения - 4. Сроки выведения животных из эксперимента: 1, 2, 3, 4 недель и 2, 3, 4, 5, 6 месяца. Электронно-микроскопическое исследование применяли с целью детального изучения контакта керамических импдантатов с костной тканью. Исследование проводили на сканирующем электронном микроскопе ISM - 840 A (Jeol, Япония). Для элементного анализа и формирования карт распределения элементов использовали энергодисперсионный анализатор AN 10/85S (Link Analitical, Англия). При проведении исследования были использованы наиболее информативные и современные методы исследования с объемом материала, достаточным для обоснованности следующих выводов.
В эксперименте на животных доказана биоинертность и биосовместимость по отношению к костной ткани имплантатов из керамического материала заявляемого состава и технологии изготовления.
В ходе исследования ни на одном сроке наблюдения за лабораторными животными не наблюдалось формирования соединительно-тканной капсулы вокруг имплантатов, выявлено отсутствие на всех сроках наблюдения как местной, так и общей воспалительной реакции на имплантируемые керамические образцы.
Определена реакция костной ткани лабораторных животных на пересаженные в них керамические имплантаты и установлено, что при интрамедуллярной имплантации керамического монолитного стержня в бедренную кость крысы вокруг него наблюдалось образование костной капсулы к 3 месяцам. За время наблюдения костная ткань последовательно преобразовывалась в новообразованную губчатую кость, а затем в пластинчатую, плотно контактирующую с имплантатом. При этом ни на одном сроке не было выявлено образования элементов соединительной ткани (фибробластов, коллагеновых волокон и клеточных структур) между костной тканью и керамикой.
При интрамедуллярной имплантации стержня из комбинированной керамики в бедренную кость крысы со стороны плотной части (так же, как и в первой серии) наблюдалось образование костной капсулы к 3 месяцам; костная ткань последовательно преобразовывалась в новообразованную губчатую кость а затем в пластинчатую с ее плотным контактом с имплантатом. Со стороны пористой части со второй недели отмечалось врастание новообразованных костных балок глубоко в поры имплантата с последующей перестройкой в зрелую костную ткань. При этом, так же как и в первой серии эксперимента, ни на одном сроке наблюдения не наблюдалось образования элементов соединительной ткани (фибробластов, коллагеновых волокон и клеточных структур) между костной тканью и керамикой.
Объем проведенного исследования и полученные положительные результаты позволили сделать вывод о возможности проведения клинической апробации имплантатов из аналогичной керамики, керамические эндопротезы из материала данного состава пригодны для применения в травматологии, ортопедии, реконструктивной онкологии, челюстно-лицевой хирургии и могут применяться в клинической практике на основании совместимости с мягкими и костной тканями, биоинертности и биосовместимости, нетоксичности, а также простоты стерилизации на воздухе при 180oС.
Клинические испытания данного керамического материала и керамических эндопротезов (имплантатов) по изобретению были проведены в установленном порядке. Керамические имплантаты были использованы для возмещения дефектов и устранения деформации костей лицевого и мозгового черепа у 12 больных (3 женщины и 9 мужчин) в возрасте от 20 до 62 лет. У 3 больных дефекты нижней челюсти, скуловой кости явились следствием оперативного вмешательства по поводу опухолей, у остальных больных деформация костей лицевого скелета, лобных костей возникла в результате травмы, перенесенного в детстве остеомиелита нижней челюсти, либо была врожденным пороком развития.
Обследование больных перед операцией включало: рентгенографию костей лицевого и мозгового отдела черепа в специальных проекциях; компьютерную томографию головы; фотографирование, общеклиническое исследование - клинический анализ мочи и крови, биохимические анализы крови, ЭКГ, флюорография грудной клетки, консультации специалистов при наличии сопутствующей патологии.
Все оперативные вмешательства выполнялись под общим обезболиванием. У 12 больных было выполнено 14 оперативных вмешательства. В 5 случаях оперативное вмешательство по введению керамического эндопротеза (имплантата) осуществлялось со стороны полости рта, т.е. в условиях инфицированного воспринимающего ложа. В послеоперационном периоде всем больным проводилась с профилактической целью антибактериальная терапия.
У всех прооперированных больных удалось возместить дефект и полностью или частично устранить деформацию, т.е. получить хороший или удовлетворительный эстетический эффект от проведенного лечения. Каких-либо реакций на керамический имплантат в раннем послеоперационном периоде и в отдаленные сроки после операции (до 1,5 лет) не наблюдалось.
В результате проведенных данных клинических испытаний было установлено, что керамический материал и изделия из него отвечают всем предъявляемым к ним медицинским и техническим требованиям. Они рекомендованы к производству и использованию в медицинской практике и в настоящее время готовится их промышленное производство для широкого использования в медицинской практике.
Клинические испытания новых керамических эндопротезов в клинике челюстно-лицевой хирургии и стоматологии в установленном порядке для исследования новых применяемых в стоматологии материалов при выполнении операций с целью возмещения дефектов, устранения деформаций, замещения костных структур, возникших в результате травмы и воспалительных процессов, показали, что образцы керамических эндопротезов и элементов костей челюстно-челюстной области все медицинские испытания выдержали и могут быть рекомендованы для организации их производства и применения в медицинской практике. При этом было проведено 31 оперативное вмешательство у больных с повреждениями лицевого скелета, в том числе с деформациями и дефектами всех зон лица, причем осложнений ни в одном случае не было выявлено. Установлено, что эндопротезы устойчивы к нагрузке, эффективны при замещении дефектов и устранении деформаций в области лицевого скелета с хорошим косметическим и функциональным результатом и могут быть показаны для реконструктивной челюстно-лицевой хирургии.
Клинические испытания опытных образцов эндопротезов в клинике челюстно-лицевой хирургии и стоматологии для 32 пациентов в возрасте от 17 до 53 лет с повреждениями лицевого скелета, в том числе с деформациями и дефектами средней и нижней зоны лица показали, что эндопротезы устойчивы к нагрузкам, полноценно замещают дефекты и устраняют деформации в области лицевого скелета, не вызывают осложнений, показаны для применения в реконструктивной челюстно-лицевой хирургии и могут быть рекомендованы для их серийного производства и применения в медицинской практике.
Результаты всесторонних испытаний керамического материала имплантата показали, что используемый керамический материал и эндопротезы из него по токсиколого-гигиеническим и санитарно-химическим показателям отвечают всем требованиям, предъявляемым к медицинским изделиям аналогичного назначения.
Клинические исследования подтвердили возможность использования эндопротезов и имплантатов из нового керамического материала для целого ряда заболеваний, в частности при микрогении, вторичной деформации нижней челюсти после перенесенного в детстве остеомиелита и ожога, деформации лобной области с западением в результате компрессионного перелома лобной кости. Послеоперационный период у всех пациентов протекал без осложнений и был достигнут хороший косметический результат.
В результате проведенных данных клинических испытаний, было установлено, что керамический материал и изделия по изобретению отвечают всем предъявляемым к ним медицинским и техническим требованиям. Они рекомендованы к производству и использованию в медицинской практике и в настоящее время готовится их промышленное производство для широкого использования в медицинской практике на производственной базе заявителя изобретения - ООО "Научно-производственный центр медицинской керамики (Санкт-Петербург).
Это доказывает возможность реализации изобретения промышленным способом, возможности решения поставленных задач и достижения требуемого технического результата.
Изложенные выше подробные описания особенностей изготовления и применения нового керамического материала на основе глинозема и конструктивных особенностей эндопротезов по изобретению не оставляют никаких сомнений в их осуществимости - все элементы отдельных технических приемов изготовления и использования эндопротезов известны в медицинской технике, хорошо освоены современной техникой изготовления керамических материалов и медицинской практикой.
В частности реализация отдельных технологических операций может быть осуществлена по известным специалистам и широко применяемым в практике изготовления керамических изделий отдельным технологическим приемам, описанным, например, в книге Балкевич В.Л. "Техническая керамика". М. Стройиздат, 1984.
При изготовлении пористого и пенообразного керамического материала могут применяться известные специалистам и широко применяемые в практике отдельные технологические приемы изготовления пористых и вспененных материалов, описанные, например, в книге О. Г. Тараканова, И. В. Шамова и В.Д. Альперна "Наполненные пенопласты", М.: Химия, 1989, 216 с., где подробно рассмотрены технологии производства наполненных композиционных материалов, содержащих твердые наполнители.
Керамические эндопротезы по изобретению могут изготавливаться из доступного и дешевого исходного отечественного глинозема промышленным способом, причем для их изготовления не требуется импортного дорогостоящего сырья или специального оборудования.
Источники информации
1. Заявка РФ 93040884, A 61 F 2/28, опубл. 1996.07.27.
2. Заявка РФ 99117208, A 61 F 2/28, опубл. 2001.06.10.
3. Заявка РФ 97108964, A 61 L 27/00, опубл. 1999.06.20.
4. Заявка ФРГ 3224265, A 61 L 27/00, патент РФ 2035192, опубл. 1995.05.20.
5. Патент РФ 2157245, A 61 L 27/00, опубл. 2000.10.10.
6. Патент РФ 2074672, A 61 L 27/00, опубл. 1997.03.10.
7. Балкевич В.Л. Техническая керамика. М.: Стройиздат, 1984, с. 98-118.
8. Международный стандарт ИСО 6474-81, 1981, 5 стр.
9. Международный стандарт ISO 6474 1994-02-01, 1994 г., 6 стр.
10. Патент РФ 2007971, A 61 F 2/28, опубл. 1994.02.28. (прототип).
| название | год | авторы | номер документа |
|---|---|---|---|
| КЕРАМИЧЕСКИЙ МАТЕРИАЛ НА ОСНОВЕ ГЛИНОЗЕМА, ИЗДЕЛИЕ ИЗ КЕРАМИЧЕСКОГО МАТЕРИАЛА (ВАРИАНТЫ) И СПОСОБ ИХ ИЗГОТОВЛЕНИЯ | 2002 |
|
RU2224548C2 |
| СПОСОБ КОНТУРНОЙ ПЛАСТИКИ, ВОССТАНОВЛЕНИЯ, КОРРЕКЦИИ, УСТРАНЕНИЯ ИЛИ ЗАМЕЩЕНИЯ ДЕФЕКТОВ, ПОВРЕЖДЕНИЙ ИЛИ ДЕФОРМАЦИЙ КОСТНОЙ ИЛИ ХРЯЩЕВОЙ ТКАНИ И ИМПЛАНТАТ ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2002 |
|
RU2218895C1 |
| КЕРАМИЧЕСКИЙ ЭНДОПРОТЕЗ СУСТАВА | 2001 |
|
RU2203636C2 |
| СПОСОБ УСТРАНЕНИЯ КОМБИНИРОВАННЫХ ДЕФЕКТОВ ВЕРХНЕЙ ЧЕЛЮСТИ С ИСПОЛЬЗОВАНИЕМ ИНДИВИДУАЛЬНОГО ЭНДОПРОТЕЗА | 2024 |
|
RU2831787C1 |
| КЕРАМИЧЕСКИЙ ЭНДОПРОТЕЗ ГОЛЕНОСТОПНОГО СУСТАВА | 2001 |
|
RU2204965C2 |
| ПЛАСТИНА ДЛЯ ПЛАСТИКИ ПОСТТРАВМАТИЧЕСКИХ ДЕФЕКТОВ И ДЕФОРМАЦИЙ ДНА ГЛАЗНИЦЫ | 2011 |
|
RU2512785C2 |
| Способ реконструкции сложных дефектов челюстно-лицевой области | 2018 |
|
RU2696533C1 |
| ИМПЛАНТАТ ДЛЯ ПЛАСТИКИ ПОСТТРАВМАТИЧЕСКИХ ДЕФЕКТОВ И ДЕФОРМАЦИЙ ДНА И СТЕНОК ГЛАЗНИЦЫ | 2011 |
|
RU2487726C1 |
| ИМПЛАНТАТ-ЭНДОПРОТЕЗ ДЛЯ ЗАМЕЩЕНИЯ ОБЪЕМНОГО КОСТНОГО ДЕФЕКТА НИЖНЕЙ ЧЕЛЮСТИ | 2012 |
|
RU2491899C1 |
| Эндопротез нижней челюсти | 2016 |
|
RU2610533C1 |











Изобретение относится к медицине и медицинской технике. Изобретение обеспечивает повышение экономичности и технологичности изготовления эндопротезов из доступного дешевого сырья при одновременном повышении качественных показателей прочности, надежности фиксации. Эндопротез изготовлен из полученного на основе глинозема керамического материала, содержащего не менее 99,5 мас.% оксида алюминия, 0,15-0,4 мас.% оксида магния, не более 0,1 мас.% оксида кремния и не более 0,05 мас.% оксида железа, причем КМЭ имеет монолитную структуру без открытой пористости и водопоглощения, плотность керамического материала составляет 3,80-3,98 г/см3, прочность на изгиб составляет 150-750 МПа. Эндопротезы набора изготовлены из керамического материала, содержащего не менее 99,5 мас.% оксида алюминия, 0,15-0,4 мас.% оксида магния, не более 0,1 мас.% оксида кремния и не более 0,05 мас.% оксида железа. 2 с. и 15 з.п. ф-лы, 21 ил.
| СПОСОБ ИЗГОТОВЛЕНИЯ КЕРАМИЧЕСКОГО ЭНДОПРОТЕЗА | 1991 |
|
RU2007971C1 |
| RU 2051692 C1, 10.01.1996 | |||
| RU 2053737 C1, 10.02.1996. | |||
Авторы
Даты
2003-05-27—Публикация
2002-05-23—Подача