Часть работы, осуществленной в процессе разработки этого изобретения, была проведена с использованием фондов правительства США. Правительство США имеет определенные права на это изобретение.
Перекрестная ссылка на родственные заявки
Рассматриваемая заявка является частичным продолжением заявки США 07/408036, поданной 15 сентября 1989 г.
Область изобретения
Настоящее изобретение относится к области микробиологии и технологии вакцин и касается разработки вакцины, способной придавать иммунитет к инфекции Streptococcus группы В.
Уровень техники
Бактерии рода Streptococcus известны как агенты, являющиеся причиной заболеваний людей и животных. Streptococci были подразделены на иммунологические группы на основании наличия специфических углеводных антигенов на их клеточных поверхностях. К настоящему времени известны группы (Davis, B.D. et al. , In: Microbiology, 3-rd. Edition, p. 609, (Harper and Row, 1980). Streptococci находятся среди наиболее общих и важных бактерий, вызывающих болезни людей. Хотя Streptococci группы В связаны с заболеваниями животных (таких, как маститы у скота), Streptococcus agalactiae (Streptococci группы J) рассматривают как наиболее общую причину неонатального сепсиса новорожденных в CLIA и считают, что он ответственен более чем за 6000 смертных случаев ежегодно (Hill, H.R. et al., Sexually Transmitted Diseases Mс Graw Hill, pp. 397-407). Streptococcus группы B является также важным патогеном у поздних менингитов у младенцев, послеродовых эндометритов и инфекций у взрослых с ослабленным иммунитетом (Patterson, M. J. et al., Bact. Rev. 40: 774-792 (1976)).
Хотя этот организм и чувствителен к антибиотикам, высокая скорость развития и быстрое наступление сепсиса у новорожденных и менингита у младенцев приводит к высокой степени заболеваемости (50%) и смертности (20%) (Baker, C. J. et al., New Eng. J. Med. (Editorial) 314(26): 1702-1704 (1986); Baker, C.J. et al., J. Infect. Diс. 136: 137-152 (1977)).
Streptococcus группы В является обычным компонентом нормальной вагинальной флоры и флоры толстой кишки человека. Хотя наиболее частый способом инфицирования новорожденных является интранатальный из вагинальных колоний, описаны такие случаи нозокомиальных (внутрибольничных) заражений в родильных домах. (Patterson, M.J. et al., Bact. Rev. 40: 774-792 (1976)). Однако лишь у небольшого процента младенцев, зараженных Streptococcus группы В, развивается серьезная инфекция. Роли как факторов хозяина, так и бактериальных вирулентных детерминант в переходе от колонизации к инфекции не совсем понятны.
Считают, что некоторые протеины Streptococcus группы В играют роль в вирулентности и иммунитете (Ferrieri, P., Rev. Infect. Dis. 10:S363 (1988)). В 1075 г. Lancefield определил С протеины Streptococcus группы В по их способности вызывать защитный иммунитет (Lancefield, P.С. et al., J. Exp. Mеd. 142: 165-179 (1975)). Известно, что эта группа протеинов содержит некоторые различные полипептиды н антигенные детерминанты. С учетом этих открытий попытки предотвратить инфекции Streptococcus группы В были направлены на использование профилактических антибиотиков и разработку вакцин против Streptococcus группы В (Baker, C.J. et al., Rev. of Infeс. Dis. 7:458-467 (1985), Baker, С.J. et al., New Eng. J. Med. 3l4(26): 1702-1704 (1986)). Полисахаридные вакцины против Streptococcus группы В описаны Kasper, D.L. (патент США 4207414 и заменяющий патент CШA PE31672 и патент CШA 4324887, 4356263, 4367221, 4367222 и 4367223), Carlo D.J. (патент США 4413057, Европейская патентная публикация 38265) и Yavordios. D. et al., (Европейская патентная публикация 71515), причем все эти ссылки включены сюда для сведения.
За исключением небольшой субпопуляции младенцев, у которых как материнская колонизация Streptococcus группы В, так и другие факторы перинатального риска можно определить, использование профилактических антибиотиков не оказалось практичным или эффективным в предотвращении большинства случаев (Boyer, K. M. et al. New Eng. J. Mеd. 314(26):1665-1669 (1986)). Интранатальная хемопрофилактика не достигает широкого применения по следующим причинам:
(1) не было возможности идентифицировать материнскую колонизацию Streptocoocus группы В быстрым, надежным и дешевым способом;
(2) около 40% неонатальных случаев наблюдается в обстановках низкого риска;
(3) не считалось практичным проверять и/или лечить всех матерей или новорожденных в потенциальной группе риска; и
(4) профилактика за счет антибиотиков, по-видимому, не осуществима в отношении поздно диагносцируемых менингитов (700 случаев за год в США) или послеродовых эндометритов (45000 случаев ежегодно) (Baker, C.J. et al., New Eng. J. Mеd. (Editorial) (314:1702-1704 (1986)).
Депозит микроорганизмов
Плазмиды pJMSI и pJMS23 являются производными плазмиды рUX12, которая содержит ДНК, способную кодировать антигенные протеины Streptococci, которые можно использовать в способе настоящего изобретения. Плазмида pUX12 является производной плазмиды pUC12. Плазмиды pJMS1 и pJMS23 были депонированы 15 сентября 1989 г. в Американской Коллекции Типовых Культур, Rockville, MD, и им присвоены обозначения АТСС 40659 и АТСС 40660 соответственно.
Краткое содержание изобретения
Streptococcus agalactiae являются наиболее частой причиной сепсиса новорожденных в США и ответственны за 6000-10000 смертных случаев за год. Хотя типоспецифическая полисахаридная капсула Streptococcus группы В является иммуногенной и содержит важные протективные антигены, клинические испытания полисахаридной вакцины показали малую степень ответа (Baker, C.J. et al., New Eng. J. Med. 319: 1180/(1980); Insel, R.A. et al., New Eng. J. Med. (Editorial) 319(18):1219-1220 (1988)).
Рассматриваемое изобретение относится к разработке коньюгатной вакцины против Streptococcus группы В (то есть, Streptococcus agalactiae), которая использует протективный антиген, экспрессированный с гена, клонированного из Streptococcus группы В. Эта новая коньюгатная вакцина имеет преимущества как в плане выработки зависимой от Т-клеток защиты за счет адьювантного протеина носителя, и также обеспечивает дополнительные защитные эпитопы, которые присутствуют на клонированном протеине Streptococcus группы В (Insel, R.A. et al. , New Eng. J. Med. (Editorial 319(18): 1219-1220 (1988); Baker, C.J. et al., Rev. of Infec. Dis. 7:458-467 (1985)).
Более подробно, в изобретении получена коньюгатная вакцина, способная придавать хозяину иммунитет к инфекции Streptococcus группы В, которая включает
(а) полисахарид, коньюгированный с (b) протеином, где как полисахарид, так и протеин являются характеристическими молекулами Streptococcus группы В и где протеин является производным альфа-антигена С протеина, который поддерживает способность вызывать выработку защитных антител против Streptococcus группы В.
Изобретение относится также к способу предотвращения или ослабления инфекции, вызванной Streptococcus группы В, который включает введение индивидууму, предположительно рискующему подвергнуться такой инфекции, эффективного количества коньюгатной вакцины изобретения, которое обеспечит иммунитет хозяина против этой инфекции.
Далее изобретение относится к способу предотвращения или ослабления инфекции, вызванной Streptococcus группы В, который включает введение беременной женщине эффективного количества коньюгатной вакцины изобретения, которое обеспечивает иммунитет к инфекции у нерожденного потомства женщины.
Изобретение обеспечивает также способ предотвращения или ослабления инфекции, вызванной Streptococcus группы В, который включает введение индивидууму, подверженному или предположительно рискующему подвергнуться такой инфекции, эффективного количества антисыворотки, полученной при экспонировании второго индивидуума коньюгатной вакцине изобретения, так что обеспечивается иммунитет хозяина к инфекции.
Краткое описание чертежей
Фиг. 1 представляет модификации рUC12 для создания плазмиды pUX12.
Фиг. 2 представляет рестрикционную и транскрипционную карту плазмиды pUX12.
Фиг. 3 представляет модификации, которые проделаны с pUX12 для получения +1 считывающей рамки плазмиды pUX12+1(A) и которые приводят к получению -1 считывающей рамки плазмиды pUX12-1(G). (В) представляет конструкцию, которая дополнительно способна привести к получению -1 считывающей рамки плазмиды.
Фиг. 4 представляет результат исследования защиты мышей за счет использования кроличьей антисыворотки против S1 и S23. Защита наблюдается для мышей, инокулированных анти-S1 антисывороткой (р менее 0,002) или анти-S23 антисывороткой (р менее 0,022). Из-за размера использованного образца эта разница в наблюдаемых статистических значениях между S1 и S23 экспериментов незначительна. На фиг. 4 количество выживших мышей на полное количество тестированных изображено как доля над каждым прямоугольником.
Фиг. 5 представляет последовательную стратегию и рестрикционную эндонуклеазную карту для bca. Частичная рестрикционная эндонуклеазная карта охватывает участок pJMS23 от Nde1 I сайта до Sry 1 I сайта, расположенного у нуклеотида 3594, для которого определяют нуклеотидную последовательность bca и фланкирующий участок. Открытая считывающая рамка изображена открытым прямоугольником. Транспозон Tn5Seql мутации (треугольники служат для примирования нуклеотидной последовательности в обоих направлениях от каждой из вставок. Участок последовательности, полученный из олигонуклеотидных праймеров (открытые вставки) и гнездовые делении (заполненные стрелки) также представлены. Сайты расщепления рестрикционными эндонуклеазами имеют следующие сокращения: A, Alu; I, B, Bsm, I; F, Fok I; H, HincII; N, NdeI; S, StyI, bp, пары оснований.
На фиг. 6 представлен нуклеотид (послед. IД 14) и полученная аминокислотная последовательность (послед. IД 15) bca и фланкирующие участки. ДНК нить представлена 5' до 3', а нуклеотиды перечислены на верхней строчке, начиная от 78 пар оснований в обратном направлении от открытой считывающей рамки. Определенная аминокислотная последовательность для открытой считывающей рамки расположена ниже последовательности нуклеиновой кислоты. Содержание G+G 40% и использование кодона аналогичны другим стрептококковым генам (Hollingshead, S. K. et al., J.Biol. Chem. 261:1677-1686 (1986)). Отличительные особенности включают - 10(TATAAT) промоторный консенсусный сайт, сайт рибосомного связывания (RBS), сигнальную последовательность, повторяющийся участок I, С конец с терминальным кодоном (ТАА) в положении 3161 и два участка с диадной симметрией, которые являются потенциальными транскрипционными терминаторами.
Фиг. 7, представленный двумя прямоугольниками (А и В), которые демонстрируют гомологичность с предполагаемыми сигнальными последовательностями и С-терминальным мембранным якорем С протеинового альфа-антигена соответственно. Прямоугольник 7А: 1 конец С протеина альфа-антигена наверху линии (последоват. IД 16) и проведено сравнение со следующими грамположительными сигнальными последовательностями (соответствующие коды перечислены для каждых чисел последовательности): последовательность 2 (послед. IД 17), С протеиновый бета-антиген (S15330, STRBAGBA) и для четырех М протеинов Streptococcus группы А; последовательность 3 (послед. IД 18), ennX (STRENNX); последовательность 4 (послед. IД 19) emm 24 (STREMM 24), последовательность 5 (послед. IД 20), MI (S00767), последовательность 6 (послед. IД 21), S01260. Лизиновые (К) и аргининовые (R) остатки предшествуют подчеркнутому гидрофобному участку и изображены жирным шрифтом, так же как сериновый (S) и треониновый (Т) остатки, предшествующие вероятному сайту сигнала расщепления. Возможный сайт расщепления для альфа сигнала следует после валина в положении 41; однако альтернативные сайты расщепления существуют в положениях 53-56. Прямоугольник В: С-конец альфа-антигена протеина С представлен в верхнем ряду (последовательность I) (Посл. IД 22) и сравнивается с последующими якорными пептидами грамположительной мембраны: последовательность 2 (посл. IД 23), М5 (А28616), М6(А26297) и М24(А28549); последовательность 3 (посл. IД 24), ennX(STREENX); последовательность 4 (посл. IД 25), S00128. STRPROTG, и А26314; последовательность 5 (поcл. IД 26), apg (A24496); последовательность 6 (посл. IД 27), аrр 4 (S05568) и emm 49 (STRM49NX, STRMM24) и последовательность 7 (посл. IД 28), еmm12 (STR12M), M5, M6, M24, emml2, emm49 и ennX все представляют М протеины; arp4 представляет связывающий протеин Streptococcus группы А. S00128, STRPROTG, spg и A26314 представляют IgG связывающие протеины Streptococcus группы G. Последовательность 8 (посл. IД 29) иллюстрирует мембранный якорь для бета-антигена, который не содержит фрагмента PPFFXXAA (посл. IД 1). Расположенные выше участки включают лизиновые остатки (К), предшествующие LRXTGE (посл. IД 2) фрагменту (очерчен), гидрофобный участок (подчеркнут) с PPFFXXAA (посл. IД 1) консенсусом (очерчен и подчеркнут) и концевая аминокислота - аспарагиновая кислота (Д) или аспарагин (N).
На фиг. 8 представлено сравнение клонированных и нативных генных продуктов bca. Поверхностные протеины штамма А909 Stroptococcus группы В (типа 1а/C) и клон альфа-антигена протеина С pJMS23-1 были проанализированы с помощью электрофореза в SDS/PAGE (здесь и далее - электрофорез в натрийдодецилсульфат/полиакриламидном геле) и Вестерн-блоттинга и были зондированы альфаантиген-специфическим моноклональным антителом 4G8. Окончания стрелок показывают пример различия между протеинами. Молекулярные маркеры (в кДа) представлены справа.
На фиг. 9 представлена схема открытой считывающей рамки bca. Сумма структурных отличий открытой считывающей рамки альфа-антигена С протеина основана на анализе аминокислотной последовательности, полученной из нуклеотидной последовательности bca. Цифры над прямоугольниками указывают положения нуклеотидов, а цифры под ними указывают на аминокислотные остатки зрелого протеина внутри открытой считывающей рамки.
Подробное описание предпочтительных вариантов
Значимость и клинические перспективы
Материнская иммунопрофилактика вакциной против Streptococcus группы В была предложена в качестве потенциального способа защиты от инфекции как матери, так и младенца при переносе антител во время родов (Baker, C.J. et al. , New Eng. J. Med. (Editorial) 314(26):1702"1704 (1986); Baker, C.J. et al. , New Eng. J. Med. 319:1180 (1988); Baker, C.J. et al., J. Inf. Dis. 7: 458 (1985)). Как и в случае с другими инкапсулированными бактериями, подверженность инфекции коррелирует с отсутствием типоспецифических антител (Kasper, D.L. et al., J.Clin. Invest. 72:260-269 (1983), Kasper. D.L. et al. , Antibiot. Chemother. 35: 90-100 (1985)).
Отсутствие опсонически активных типоспецифических анти-капсулярных антител против Streptococcus группы В является фактором риска для развития болезни после колонизации Streptococcus группы В (Каsреr, D.L. et al., J. Infec. Dis. 153: 407-415 (1986)).
Одним из подходов является вакцинация очищенными типоспецифическими капсулярными полисахаридами. Способы получения таких вакцин и использования таких вакцин для иммунизации против Streptococcus группы В раскрыта Kasper, D. L. (патент США 4207414, и возобновленный патент США РЕ31672, и в патентах США 4324887, 4356263, 4367221, 4367222 и 4367223), Carlo D.J., (патент США 4413057 и Европейская патентная публикация 38265) и Yavordios, D. et al. (Европейская патентная публикация 71515), все они включены сюда до ссылке.
Хотя полисахаридные капсулы Streptococcus группы В хорошо охарактеризованы и, как было показано, играют роль как в вирулентности, так и в иммунитете (Kasper, D.L. J. Infect. Dis. 153:407 (1986)), эти капсулярные компоненты, как было обнаружено, меняют свою иммуногенность в зависимости как от специфического капсулярного типа, так и от факторов иммунной системы хозяина (Baker, C. J. et al., Rev of Infect. Dis. 7:458-467 (1985)). Недавно завершенные клинические испытания по оценке капсулярной полисахаридной вакцины против Streptococcus группы В показали общую реакцию в 63% и показали, что такая вакцина не является оптимально иммуногенной (Baker, C.J. et al., New Eng. J. Med. 319(18): 1180-1185 (1988)).
Различие в иммуногенности наблюдалось также для капсулярных полисахаридов других бактерий. Так например, вакцина против менингококковых капсул типа С высоко активна, тогда как менингококковая группы В полисахаридная вакцина не является иммуногенной (Каsреr, D.L et al., J. Infec. Dis. 153: 407-415 (1986)). Т-клеточные независимые функции иммунной системы хозяина часто требуются для поддержания реакции антител на полисахаридные антигены. Отсутствие Т-клеточной независимой реакции на полисахаридные агенты может быть ответственно за низкие уровни антител против Streptococcus группы В, которые присутствуют у матерей, у детей которых впоследствии развивается инфекция Streptococcus группы В. Кроме того, дети до 18 и 24 месячного возраста обладают слабо развитой иммунной реакцией на Т-клеточные независимые антигены.
Детерминанты вирулентности и иммунитета у Streptococcus группы В
Существует пять серотипов Streptoooccus группы В, которые имеют общую группу специфического полисахаридного антигена. Однако антитело группового антигена не является защитным в опытах на животных. Lancefield вначале классифицировал Streptococcus группы В на четыре серотипа (Ia, Ib, II и III), используя пенициллиновую методику. Была последовательно определена композиция и структура уникальных типоспецифических капсулярных полисахаридов для каждого из серотипов (Jennings, H.J. et al., Bioch. 22: 1258-1264 (1983), Kasper, D.L. et al., J. Infec. Dis 153:407-415 (1986), Wessels, M.R. et al., Trans As. Amer.Phys. 98:384-391 (1985)). Wilkinson определил пятый серотип, Iс, определив протеиновый антиген (вначале названный Ibc протеином), присутствовавший во всех штаммах серотипа Ib и в некоторых штаммах типа Iа капсул (Wilkinson, H. W.J.Bacteriol. 97: 629-634 (1969), Wilkinson, et al., Infect. and Immun. 4: 596-604 (1971)). Этот протеин, как было обнаружено позднее, меняется по преобладанию в различных серотипах Streptococcus группы В, но отсутствует в серотипе Iа (Jonson, D. R. et al., J. Clin. Microbiol 19: 506-510 (1984)).
Недавно изменили номенклатуру классификации Streptococcus группы В только по капсулярным типоспецифическим полисахаридам и пятый капсулярный тип также был описан как тип IV (Pritсhard, D.G. et al., Rev. Infec. Dis. 10(8): 5367-5371 (1988)). Поэтому типирование штаммов Streptococcus группы В более не основано на антигенном Ibc протеине, который теперь носит название С протеина. Штамм типа Iс в новой классификации называется серотипом Iа на основании его композиции капсулярного полисахарида, с дополнительной информацией, что он также содержит С протеин.
Иммунологические, эпидемиологические и генетические данные позволяют предположить, что типоспецифическая капсула играет важную роль в иммунитете против инфекций Streptococcus группы В. Состав и структура типоспецифичоского капсулярного полисахаридов и их роль в вирулентности и иммунитете были предметам интенсивных исследований (Ferrieri, P. et al., Infec. Immun. 27: 1023-1030 (1980), Krause, P.M., et al., J. Exp. Med. 142:165-179 (1975), Levy, N. J., et al., J. Infec. Dis. 149:851-860 (1984), Wagner, B. et al., J. Gen. Microbiol. 118:95-105 (1980), Wessels, M.R. et al. Trans. Assoc. Amer. Phys. 98:384-391 (1985)).
Существует противоположная версия относительно структурного устройства типоспецифических и группы В стрептококковых полисахаридов на клеточной поверхности относительно иммунологически важных детерминант внутри типоспецифических полисахаридов и относительно механизмов определяемой капсулой вирулентности Streptococcus группы В (Kasper, D.L. et al., J. Infec. Dis. 153: 407-415 (1986)). Для изучения роли капсул в вирулентности Rubens et al. использован транспозонный мутагенез для создания изогенного штамма типа III Streptococcus группы В, который не имел капсулы (Rubens, С.E., et. al., Proc. Natl, Acad. Sci. США 84:7206-7212 (1987)). Они продемонстрировали, что потеря экспрессии капсулы приводит к значительной потере вирулентности в модели на новорожденных крысах. Однако вирулентность клинических изолятов с аналогическим капсулярным составом меняется в широких пределах. Это дает возможность предположить, что другие бактериальные факторы вирулентности, помимо капсул, играют роль в патогенезе Streptococcus группы В.
Ряд протеинов и других бактериальных продуктов был описан в Streptococcus группы В, роль которых в вирулентности и иммунитете до сих пор не была установлена, CAMP (Christine Atking-Muc Peterson) фактор, пигмент (вероятно, каротеноид), R антиген, Х антиген, анти-фагоцитные факторы и слабо определенные "пульмонарные токсины" (Ferrieri, P. et al., J. Ехр. Med. 151: 56-68(1980) Ferrieri, P. et al., Rev. Inf. Dis. 10(2):1004-1071 (1988); Hill, H.R. et al., Sexually Transmitted Diseases, McGraw-Hill, pp. 397-407). С протеины обсуждаются далее.
Изогенные штаммы Streptococcus группы В, лишенные гемолизина, не демонстрируют снижения вирулентности в моделях на новорожденных Крысах (Weiser, J. N. et al., Infec. and Immun. 55:2314-2316 (1987)). Как гемолизин, так и нейраминидаза не всегда присутствуют в клинических изолятах, связанных с инфекцией. CAMP фактор представляет внеклеточный протеин Streptococcus группы В, с молекулярным весом 23500 дальтон, что в присутствии стафилококкового бета-токсина (сфингомиелиназа) приводит к лизису мембран эритроцитов. Ген для САМР фактора Streptococcus группы В недавно было клонирован и экспрессирован в Е. coli (Schneewind O, et al., Infec. and Immun. 56:2174-2179 (1988)). Роль (если она существует) CAMP фактора, Х и R антигенов и других факторов, перечисленных ранее, в патогенезе Streptococcus группы В не раскрыта в известных работах (Fehrenbach, F.J. et al., В Bacterial Protein Toxins, Gustav Fisher Verlag Stuttgart (1988); Hill, H.R. et al., Sexually Transmitted Diseases pp. 397-407 (1984)).
С протеины (протеин) представляют группу антигенов протеина, связанных с клеточной поверхностью протеиновых антигенов Spectrococcus группы В, которые были исходно экстрагированы из Spectrococcus группы В Wilkinson et al., (Wilkinson, H.W. et al., Bacterial 97:629-634 (1969), Wilkinson H.W. et. al. , Infek. And Immun. 4:596-604 (1971)).
Они использовали горячую соляную кислоту (НСl) для того чтобы экстрагировать клеточные стенки, и трихлоруксусную кислоту (ТАС) для осаждения протеиновых антигенов. Были описаны две антигенно различные популяции протеинов С:
(1) Группа протеинов, которые чувствительны к деградации под действием пепсина, но не трипсина, и называемая либо TR (трипсин-устойчивая), либо альфа (α).
(2) Другая группа протеинов Streptococcus группы В, которые чувствительны к деградации как под действием пепсина, так и трипсина, и называемая TS (трипсин-чувствительная), или бета (β)
(Bevanger, L. et al. , Acta Path. Microbiol. Scand. Sect. B. 87:51-54(1979),
" " " " " " 89:205-209(1981),
" " " " " " 91:231-234(1983),
Bevanger, L. et al., Acta Path. Microbiol. Scand. Sect. B. 93:113-119 (1985),
" " " " " " " 93:121-124 (1985),
Johnson, D.R., et al., J.Clin. Microbiol. 19:506-510(1984),
Russell-Jones, G.J. et. al., Exp. Med. 160:1476-1484(1984).
В 1975 г. Lancefield et al. использовал исследования по защите мышей антисывороткой, выработанной у кроликов для определения функциональности С протеинов для их способности придавать защитный иммунитет против штаммов Streptococcus группы В, содержащих аналогичные протеиновые антигены (Lancefield, R. C.J. Exp. Med. 142:165-179 (1975)). Многочисленные исследователи получили неочищенные препараты антигенных протеинов из Streptococcus группы В, которые были названы С протеинами, за счет химической экстракции из клеточных стенок либо НСl, либо детергентами
(Bevanger, L. et al., Acta Path. Microbiol.Sc.Sect. В 89:205-209(1981)
" " " " " 93:113-119(1985)
Russel-Jones, G.J. et al., J. Exp. Med. l60: 1476-1484 (1984),
Valtonen, M. V. et al. Micrbiol. PathI: 191-204 (1986),
Wilkinson, H.W. et al., Infec. and Immun. 4:596-604 (1971).
Сообщаемые размеры для этих антигенов варьируются от 10 до 190 кДа, а отдельные виды протеинов не были выделены или охарактеризованы (Ferrieri, R. et al., Rev. Inf. Dis. 10(2):1004-1071 (1988)).
В результате скринирования защитной антисывороткой С протеины можно детектировать примерно в 60% клинических изолятов Streptococcus группы В, и они найдены во всех серотипах, но с различной частотой (Johnson, D.R. et al., J. Clin. Microbiol. 19:506-510 (1984)). Отдельная группа Streptococcus группы В изолятов может содержать как TR, так и TS антигены, или только один из них, или ни одного из этих антигенов. За исключением способности частично очищенных антигенов вызывать защитный иммунитет, роль этих антигенов в патогенезе не была исследована. Ин виво исследования со штаммами Streptococcus группы В, которые содержат С протеины, представили некоторые доказательства того, что С протеины могут быть ответственны за устойчивость к опсонизации (Rayne, N.R. et al., J. Inf. Dis. 151:673-681 (1985)) и С протеины могут иншбировать внутриклеточный киллинг Streprococcus группы В после фагоцитоза (Rayne, N.R. et al. , Infect. and Immmun. 55:1243-1251 (1987)). Было показано, что этот тип штаммов Streptococcus группы В, содержащий С протеины, более вирулентен в модели по сепсису у новорожденных крыс (Ferrieri. R. et al., Infect. Immun. 27: 1023-1032 (1980), Ferrieri, R. et al. Rev. Infect. Dis. 10(2): 1004-1071 (1988)). Так как не существует генетических данных для С протеинов, изогонные штаммы, не содержащие С протеинов, не были ранее изучены. Существует доказательство того, что один из TS или β, С протеинов связывается с IgA (Russel-Jones et al., J. Exp. Med. 160:1476-1484 (1984)). Роль (если она имеет место) того, что связывание IgA С протеинами оказывает влияние на вирулентность, однако, не раскрыта.
В 1986 г. Valtonen et al. выделил Streptococcus группы I протеины из культур надосадочных жидкостей, которые обеспечивали защиту мышей в этих экспериментах (Valtonen, M.V. Microbiol. Path I:191-204 (1986)). Они идентифицировали и частично очистили устойчивый к трипсину Streptococcus группы В протеин с молекулярным весом 14000 дальтон. Антисыворотка, вырабатываемая к этому протеину у кроликов, защищает мышей против последующего заражения типом Ib Streptococcus группы В (89% защиты). Этот протеин по определению Lancefield является С протеином.
Однако если антисыворотку, выработанную против этого протеина, используют для иммуноосаждения экстрактов антигенов Streptococcus группы В, обнаружено, что ряд более высокомолекулярных протеинов оказывается реакционноспособным. Это предполагает, что протеин с мол. весом 10000 может представлять общий эпитоп нескольких протеинов Streptococcus группы В или что он является продуктом деградации, обнаруженным в надосадочных жидкостях культур Streptococcus группы В. Разница в размерах С протеинов, выделенных как из бактериальных клеток, так и из надосадочных жидкостей, предполагает, что С протеины могут представлять семейство генов и сохранять антигенное разнообразие в качестве механизма для защиты против иммунной системы.
Интервал сообщавшихся молекулярных весов и трудности, с которыми приходится сталкиваться при выделении отдельных С протеинов, аналогичны проблемам, с которыми встретились многие исследователи при выделении М протеина Streptococcus группы А
(Dale, J.B. et al., Infec. and Immun. 46(1): 267-269 (1984),
Fischetti V.A. et al., J. Exp. Med. 144: 32-53 (1976),
" " " 146: 1108-1123 (1977)).
Был клонирован и секвенирован ген для М протеина, и было обнаружено, что он содержит ряд повторных ДНК последовательностей (Hollingshead, S.K. et al. , J. Biol. Chem. 261: 1677-1686 (1986), Scott J.R., et al., Proc. Natl. Acad. Sci. США 82:1822-1826(1986), Scott, J.R. et al., Infec. and Immun. 52: 609-612 (1986)). Эти повторяющиеся последовательности могут быть ответственны за посттранскрипционный процессинг, который приводит к разнообразию размеров получаемых М протеинов. Непонятен механизм, за счет которого это происходит. Интервал молекулярных весов, описанных для С протеинов Streptococcus группы В может объяснятьсятакими же процессами.
Cleat et al. попытался клонировать С протеины за счет использования двух препаратов антивысоротки против Streprococcus группы В, полученных от Bevanger (α и β) для скринирования библиотеки ДНК Streptococcus группы В в E. coli (Bevanger, L. et al., Acta Path. Microbiol. Immunol. Scand. Sect. B 93: 113-119 (1985), Cleat, P. H. et al., Infect. and Immun. 55(5): 1151-1155 (1987), которые включены сюда по ссылке). Эти исследователи описали два клона, которые продуцируют протеины, которые связываются с антистрептококковыми антителами. Однако они не смогли определить, имеют ли клонированные протеины способность вызывать образование защитных антител, либо превосходство этих генов коррелирует со штаммами Streptococcus группы В, которые, как известно, содержат С протеин. Роль клонированных генных последовательностей в вирулентности Streptococcus группы В не исследована. Так как С протеины определяют по их способности вызывать образование защитных антител, эта работа не смогла предоставить доказательств того, какой из клонов кодирует С протеин.
Коньюгатная вакцина изобретения
В настоящем изобретении преодолены обсуждавшиеся ранее недостатки известных ранее вакцин против Streptococcus группы В в результате разработки коньюгатной вакцины, в которой капсулированный полисахарид ковалентно связан с основной цепью протеина. Этот подход поддерживает выработку реакции антител, зависимых от Т-клеток, на антигены капсулярного полисахарида и позволяет обойти требования Т-клеточной независимости для продуцирования антител (Baker C. J. et al., Rev of Infec. Dis. 7:458-467 (1985), Kasper. D.L. et al., J. Infec. Dis. 153: 407-415 (1986)), причем эти ссылки включены сюда для сведения.
В коньюгатной вакцине антигенная молекула, такая как капсулярный полисахарид Streptococcus группы В (обсуждавшийся ранее), ковалентно связан с протеином "носителя" или полипептидом. Связь эта служит для повышения антигенности коньюгированной молекулы. Способ создания коньюгатных вакцин из антигенных молекул и протеина "носителя" или полипептида, известен специалистам (Jacob, С.O., et al., Eur. J. Immunol. 16:1057-1062 (1986); Parker, J.M.R. et al., In: Modern Approaches to Vaccines, Chanock, R.M. et al., eds. pp. 133-138, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1983); Zurawski, V. R. et al., J. Immunol. 121:122-129 (1978); Klipstein, F.A. et al. , Infect. Immnm. 37:550-557 (1982); Bessler, W.G. Immunobiol. 170: 239-244 (1985); Posnett, D. N. et al., J. Biol. Chem. 263: 1719-1725 (1988); Chose, А. С. , et al., Molec. Immunol. 25: 223-230 (1988); все они включены сюда по ссылке.
Модель прототипа для коньюгированных вакцин была разработана против Hemophilus influenzae (Anderson, P, Infec. and Immun. 39: 223-238 (1983); Chu, С, et al., Infect. Immun. 40: 245-256 (1983); Lepow, M, Pediat. Infect. Dis. J. 6: 804-807 (1987), и эту модель можно использовать при создании новых вакцин настоящего изобретения. Дополнительные способы получения такой коньюгатной вакцины раскрыты Anderson, P.W. et al. в Европейской патентной публикации 245045; Anderson, P. W. et al., патент CШA 4673574 и 4761283; Frank, R et al. , патент США 4789735; Европейская патентная публикация 206852; Gordon L.K. патент США 4619828; и Beachey, Е.Н. патент США 4284537, причем все они включены сюда по ссылке.
Основные протеиновые цепи для коньюгированных вакцин, таких как Hemophilus influenzae вакцина, использовали протеины, которые не разделяли антигенных свойств с мишеневым организмом, из которого получены бактериальные капсулярные полисахариды (Ward, J. et al., In: Vaccines, Plotkin, S.A. et al., eds. Saunders, Philadelphia p. 300 (1988)).
Напротив, коньюгатная вакцина настоящего изобретения использует иммуногенные протеины Streptococcus группы В в качестве основной цепи для коньюгатной вакцины. Считают, что такой подход приводит к получению более эффективных вакцин (Insel, R. A. et al., New Eng. J. Med. 319(18):1219-1220 (1988)).
Коньюгат, протеин-полисахаридная вакцина настоящего изобретения, является первой, специфически характеризующей протеины Streptococcus группы В, которую можно использовать в коньюгатных вакцинах. Любой протеин, который является характеристичным для Streptococcus группы В, можно использовать в качестве протеина в коньюгатной вакцине настоящего изобретения. Однако предпочтительно использовать С протеин Streptococcus группы В для этой цели. Как более подробно обсуждается далее, плазмиды pJMS1 и pJMS23 содержат ДНК, которая кодирует Streptococcus С протеин. Наиболее предпочтительные С протеины это те, которые получены в результате экспрессии таких ДНК в бактерии.
Как было указано ранее, настоящее изобретение относится к клонированию и экспрессии генов, которые кодируют защитные антигены протеина Streptococcus группы В. Такие протеины предпочтительно используют в качестве основной цепи протеина, с которой можно коньюгировать один или более из полисахаридов Streptococcus группы В для создания коньюгатной вакцины против этих бактерий. В другом варианте один или более из протеинов, описанных здесь, можно коньюгировать со структурой полисахарида Streptococcus группы В.
Роль этих протеинов в вирулентности и иммунитете Streptococcus группы В можно использовать для разработки дополнительной терапии против инфекции Streptococcus группы В. Выделение и характеризация этих генов бактериального происхождения позволяет осуществлять манипуляции с генными продуктами для оптимизации как адьювантных, так и антигенных свойств полипептидного скелета/носителя коньюгатной вакцины.
Генетические исследования С протеина
Таким образом, настоящее изобретение относится к клонированию С протеинов Streptococcus группы В, к их роли в вирулентности и иммунитете и к их способности служить иммуногеном для коньюгатной вакцины против Streptococcus группы В.
Несмотря на большое количество доступной литературы по клонированию в многих группах Streptococci лишь ограниченные генетические манипуляции были осуществлены для группы В Streptococcus (Macrina, F.L., Ann. Rev. Microbiol. 38: 193-219 (1984), Wanger, A. R. et al., Infec. and Immun. 55:1170-1175 (1967)).
Наиболее широко используемой методикой для Streptococcus группы В была разработка Тn916 и его использование в транспозонном мутагенезе (Rubens, C. E. , Prос. Natl. Acad. Sci. USA 84:7208-7212 (1987), Wanger, A.R. et al., Res. Vet, Sci. 38:202-208 (1986)).
Однако так как, по-видимому, более чем один ген С протеинов и защитная антисыворотка связываются с несколькими протеинами, скринирование на предмет С протеиновых гонов за счет транспозонного мутагенеза непрактично.
В настоящем изобретении осуществляют клонирование С протеинов (и любых других протеинов, которые вовлечены в вирулентность Streptococcus группы В или которые влияют на иммунитет хозяина к Streptococcus группы В) за счет использования нового плазмидного вектора. Для этой цели желательно использовать клонирующий вектор, который можно быстро скринировать на экспрессию протеинов, которые связываются с природно выработанными антителами к Streptococcus группы В. Так как такие антитела являются гетерологичными поликлональными антителами, а не моноклональными антителами, необходимо, чтобы был использован вектор, который можно легко скринировать из множества позитивных клонов для идентификации генов, представляющих интерес.
Ряд методик был доступен для скринирования клонов, экспрессирующих антигены, которые связываются со специфической антисывороткой (Aruffo, A, et al. , Proc. Natl. Acad. Sci. USA 84:8573-8577 (1987)). Наиболее широко используемая система λgt11 была разработана Yong and Davis (Huynh, T.V. et al. , B: DNA Cloning, A Practical Approach. Vol. 1 (Glover, D.M., Ed.) IRL Press. , Wasington, pp. 49-78 (1985); Wong, W.W. et al., J. Immunol. Methods 82: 303-313 (1985).
Эти методики позволяют быстро скринировать клоны, экспрессируемые лизогенным фагом, продукты которого выделяются при лизисе фага. Обычно встречающиеся с этой системой проблемы включают требование субклонирования ДНК фрагментов в плазмидные векторы для детального эндонуклеазного рестрикционного картирования, приготовление зондов и ДНК секвенирование. Кроме того, получение ДНК из фаговых источников затруднительно и ограничено числом потенциально позитивных клонов, которые можно изучать эффективно. И наконец, получение экстрактов неочищенного протеина из клонированных генов проблематично в фаговых векторных хозяевах.
Для того чтобы обойти эти проблемы, в настоящем изобретении предложен плазмидный вектор, который был разработан для скринирования клонированной бактериальной хромосомной ДНК для экспрессии протеинов, и, таким образом, далее относится к разработке и использованию эффективного клонирующего вектора, который можно быстро скринировать на экспрессию протеинов, которые связываются с природно выработанными антителами к Streptococcus группы В.
Этот вектор получают в результате модификации обычно используемого плазмидного клонирующего вектора, pUC12 (Messing et al. , Gene 19: 269-276 (1982); Norrander, J. of al., Gene 26:101-106 (1983); Vieira J. et al. Gene 19: 259-268 (1982).
Настоящее изобретение относится к описанному далее вектору и его функциональным эквивалентам.
Используя эту систему, плазмидными клонами можно легко манипулировать, их можно картировать рестрикционныии эндонуклеазами и изучать последовательности их ДНК вставок, полученные зонды и генные продукты без необходимости проводить субклонирование. pUC12 представляет собой плазмиду в 2,73kb с большим числом, копия, которая содержит ColЕ1 источник репликации, устойчивость к ампициллину и полилинкер в lacZ гене (Ausubel, F.M, et al., Current Topics in Molecular Biology; Greene Publ. Assn./Wiley Interscionce, NY (1987).
Были осуществлены некоторые модификации в полилинкере рUC12 (Aruffo, A, et al. , Proc. Nat1. Acad. Sci. USA, 84:8573-8577(1987). Окончательный план изменений pUC12 состоял в модификации полилинкера, чтобы в нем содержались идентичные, но не липкие, BstXIсайты для клонирования, чтобы добавить "заполняющий" ("stuffer") фрагмент, чтобы обеспечить легкость выделения линейной плазмиды хозяина и обеспечить экспрессию из lac промотора во всех трех трансляционных считывающих рамках.
Для того чтобы обеспечить сайт для встраивания чужой ДНК о высокой эффективностью и свести к минимуму возможность самолигирования плазмиды, к полилинкеру добавляют инвертные, нелипкие BstXI концы. Как видно на фиг.1, pUC12 вначале разрезают BamHl (стадия I), а затем плазмиду смешивают с двумя синтетическими олигонуклеотидными адапторами, которые частично комплементарны: 15-мерный (GATCСATTGTGCTGG) (посл. IД 3) и 11-мерный (GTAACACGACC) (послед. IД 4) (стадия 2). Когда адапторы лигированы в pUC12, создают два новых BstXI сайта, но при этом сохраняют исходные BamHI сайты (стадия 3). Затем плазмиду обрабатывают полинуклеотидкиназой и лигируют до получения замкнутой кольцевой плазмиды (стадия 4). Если эту плазмиду обработать BstXI, полученные концы окажутся идентичными и нелипкими (оба имеют выступающие GTGT фрагменты) (стадия 5).
Вторую модификацию в полилинкере осуществляют для того чтобы обеспечить выделение линейной плазмиды для клонирования без загрязнений из частично разрезанной плазмиды, которая способна к самолигированию. Тупой конец, 365 пар оснований (bp) FnuD2 фрагмент получают из плазмиды рСДМ. Эту кассету или "заполняющий" фрагмент, который не содержит BstXI сайта, тупым концом лигируют с двумя синтетическими олигонуклеотидами, которые частично комплементарны: 12-мерный (ACАСGАGАТТТС) (посл. IД 5) и 8-мерный (CTCTAAAG) (стадия 6). Полученный фрагмент с адаптерами содержит 4bр выступающие концы (АСАС), которые комплементарны концам модифицированной pUC12 плазмиды, представленной на стадии 5. Модифицированную pUC12 плазмиду лигируют с рСДМ вставкой с адаптерами; полученная конструкция, названная pUC12, представлена на фиг. 2. Плазмиду pUC12 можно воссоздать из плазмид pJMS1 или pJMS23 за счет иссечения введенных последовательностей Streptococcus ДНК. В другом варианте ее можно получить рекомбинантными методами (или за счет гомологичной рекомбинации), используя плазмиду pUC12.
Так как плазмиду pUX12 следует использовать в качестве вектора экспрессии, предпочтительно далее модифицировать полилинкер таким образом, чтобы он содержал все три потенциальные считывающие рамки для lac промотора. Эти изменения позволяют корректировать трансляционную считывающую рамку для клонированных генных фрагментов с частотой один из шести. Так например, клонированный фрагмент может встраиваться в вектор в одной из двух ориентации и в одну из трех считывающих рамок. Для создания +1 считывающей рамки, pUX12 плазмиду разрезают рестрикционным энзимам EcoRI, который разрезает по уникальному сайту в полилинкере. Однонитевые 5' липкие концы заполняют, используя 5'-3' полимеразную активность Т4 ДНК полимеразы, и два тупые конца лигируют. Это приводит к потере EcoRI сайта, и созданию нового XmnI сайта (фиг. 3А). Эту конструкцию подтверждают, демонстрируя потерю EcoRI сайта и подтверждая наличие нового XmnI сайта в полилинкере. Кроме того, секвенирование двунитевой ДНК на +1 модифицированной pUX12 плазмиде осуществляют, используя стандартные праймеры секвенирования (Ausubel, F.M. et al., Current Topics in Molecular Biology; Greene Publ. Assn./Wiley Interscience, NY (1987).
ДНК последовательность демонстрирует дополнительно 4 пары оснований до полилинкера и подтверждает модификацию pUX12 до +1 считывающей рамки. Эту плазмиду называют pUX12+1.
Для того чтобы сконструировать -1 считывающую рамку, pUX12 вектор разрезают рестрикционным энзимом SacI, который разрезает по уникальному сайту полилинкера pUX12. Однонитевые 3' липкие концы снова разрезают до тупых концов, используя 3'-5' экзонуклеазную активность Т4 полимеразы, и полученные тупые концы лигируют. Полученная последовательность должна не содержать SacI сайта, хотя при этом в ней и создается новый FnuD2 сайт (фиг. 3В). Однако рестрикционное картирование рUX12-1 плазмид показывает, что хотя SacI сайт и отсутствует, сайта FnuD2 нет. Кроме того, SmaI/XmaI сайты на полилинкере также больше не присутствуют. Некоторые потенциальные pUX12-1 конструкции были секвенированы из мини-препаратов двунитевой ДНК. Из шести секвенированных модифицированных плазмид в одной не обнаружилось десяти нуклеотидов, за счет чего создалась -1 считывающая рамка (фиг. 3С). Это дает возможность предположить, что Т4 ДНК полимераза имеет дополнительную экзонуклеазную активность, и повторно вырезает дополнительную двунитевую часть полилинкера. Тем не менее, полученная плазмида имеет -1 считывающую рамку. Эту плазмиду называют рUX12-1.
Использование pUX12 векторов при клонировании антигенных протеинов Streptococcus группы В обсуждается подробно далее в примерах. Короче, ДНК, полученные из Streptococcus группы В, или комплементарные таким ДНК, вводят в pUX12, pUX12+1 или pUX12-1 векторы и трансформируют в Escherichia coli. Клонированные ДНК экспрессируют в E. coli, а клеточный лизат тестируют для определения того, содержит ли он какие-либо протеины, способные связываться с антисывороткой к Streptococcus группы B.
Существует ряд потенциально интересных модификаций pUX12, которые могут повысить ее применимость. Так например, lac промотор можно заменить на другой промотор, источник репликации можно модифицировать для получения меньшего числа копий вектора и можно изменить маркер устойчивости к лекарству.
Любой вектор, способный обеспечить нужную генетическую информацию для целевых клеток хозяина, можно использовать для обеспечения генетических последовательностей, кодирующих производные альфа-антигена настоящего изобретения в клетке хозяина. Так например, в дополнение к плазмидам такие векторы включают линейные ДНК, космиды, транспозоны и фаги.
Клетка-хозяин не ограничена лишь Е. coli. Любой бактериальный или дрожжевой (например, S. cerevisiae) хозяин, который способен экспрессировать производные настоящего изобретения, можно использовать в качестве подходящего хозяина. В. Subtilis и Streptococcus группы В можно использовать в качестве хозяев. Способы клонирования в таких хозяев известны. Так например, для грамположительных хозяев, см. Harwood, C.R. et al., "Molecular Biological Methods for Bacillus" Wiley Interscience, New York, 1991) для описания методов ведения культур, генетического анализа плазмид, методов генного клонирования, использования транспозонов, фагов и интеграционных векторов для осуществления мутагенеза и конструирования генных слияний, и способов определения генной экспрессии. Подходящие хозяева доступны из таких центров, как American Type Culture Collection (Rockwille, Maryland, USA) and Bacillus Genetic Stock Center (Ohio State Uhiv. Columbus OH, USA).
Настоящее изобретение относится к вакцинам, содержащим полисахарид (такой как капсулярный полисахарид), который является характеристикой Streptococcus группы В, коньюгированной с протеинам, который также является характерным для Streptococcus группы В. "Полисахарид" и "протеин" в таких коньюгатных вакцинах могут быть идентичны молекуле, которая является характеристичной для Streptococcus группы, или они могут быть функциональными производными таких молекул.
Для целей настоящего изобретения полисахарид Streptococcus группы В является любым группы В-специфическим или типоспецифическим полисахаридом. Предпочтительно, чтобы такой полисахарид был таким, который при введении млекопитающему (животному или человеку) вызывал бы выработку антител, которые способны реагировать со Streptococcus группы В. Примеры предпочтительных полисахаридов настоящего изобретения включают капсулярный полисахарид Streptococcus группы В или его эквиваленты. Для целей настоящего изобретения можно использовать любой протеин, который будучи введен млекопитающему (животному или человеку) либо приводит к выработке антител, которые способны реагировать с протеином, экспрессируемым Streptococcus группы В, либо повышает иммуногенность полисахарида по стимуляции выработки антител к полисахариду Streptococcus группы В. Примеры предпочтительных протеинов настоящего изобретения включают С протеины Streptococcus группы В или их эквиваленты.
Примеры функциональных производных пептидных антигенов включают фрагменты природного протеина, такие как N-терминальный фрагмент, С-торминальный фрагмент или фрагменты внутренних последовательностей альфа-антигена протеина С Streptococcus группы В, которые сохраняют свою способность вызывать выработку защитных
антител против Streptococcus группы В. Термин функциональное производное может также включать варианты природного протеина (такие протеины имеют изменения в аминокислотной последовательности, но сохраняют способность вызывать иимуногенность, вирулентность или антигонные свойства, такие же, как у природных молекул), например, варианты альфа-антигена, о котором речь идет далее, который содержит меньше внутренних повторов, нежели имеет нативный альфа-антиген, и/или измененную фланкирующую последовательность.
Пептидный антиген, который коньюгирован с полисахаридом в вакцине настоящего изобретения, может быть пептидом, кодирующим нативную аминокислотную последовательность альфа-антигена как закодированную на плазмиде pJMS23 (с сигнальной пептидной последовательностью или без нее), или может быть функциональным производным нативной последовательности. Нативный альфа-антиген С протеина Streptococcus группы В, как он закодирован на pJMS23, содержит открытую считывающую рамку из 3060 нуклеотидов и кодирует предшественник протеина в 108705 дальтон. Расщепление предполагаемой сигнальной последовательности 41 аминокислоты приводит к получению зрелого протеина в 104106 дальтон. N-терминальный участок в 20417 дальтон, альфа-антигена не демонстрирует гомологии с ранее описанной последовательностью протеина, и после него следует серия из девяти тандемных повторяющихся единиц, которые составляют вплоть до 74% зрелого протеина. Каждая из повторяющихся единиц (обозначаемых здесь как "R") идентична другим и состоит из 82 аминокислот с молекулярной массой 8665 дальтон, которая кодируется 246 нуклеотидами. Размер повторяющихся звеньев соответствует наблюдаемым различиям в размерах в гетерогенной "лестнице" альфа С протеинов, природно экспресоированных Streptococcus группы В. С-терминальный участок альфа антигена содержит фрагмент якорного домена мембраны, то есть большее количество грамположительных поверхностных протеинов. Крупный участок идентичных повторяющихся звеньев в этом гене (называемом bca геном, для альфа-антигена С протеина Streptococcus группы В) определяет защитные эпитопы и монет быть использован для создания разнообразия функциональных производных альфа-антигена, которые могут найти применение в вакцинах настоящего изобретения.
Предпочтительно, чтобы последовательность таких функциональных производных альфа-антигена содержала 1-9 копий 82 аминокислотного повтора (246 нуклеотидов), которые начинаются у аминокислоты 679 ДНК последовательности на фиг. 6 (как использовано здесь; частичный повтор, который обозначен как повтор 9', также может быть использован в этом плане). Функциональное производное может не содержать 185 аминокислотную 5' фланкирующую последовательность (555 нуклеотидов), которая обнаружена в нативном протеине перед повторяющейся последовательностью, или оно может сохранять эту последовательность и/или в этом производном может отсутствовать С-терминальная якорная последовательность из 48 аминокислот (246 нуклеотидов), или оно может сохранять эту последовательность. Функциональное производное может быть N-терминальным фрагментом, который предшествует началу повторяющегося (повторяющихся) звена (звеньев) альфа-антигена, или функциональное производное может быть только С-терминальным фрагментом, который следует после конца повторяющегося (повторяющихся) звена (звеньев) альфа-антигена, или функциональное производное может быть гибридом N-терминального фрагмента и С-терминального фрагмента без копий "R" звеньев, как будет указано далее. Амино-терминальная последовательность нативного альфа-антигена может содержать (а может и не содержать) сигнальную последовательность. Либо амино-терминальная последовательность, либо карбокси-терминальная последовательность альфа-антигенов могут быть использованы в коньюгатных вакцинах настоящего изобретения с одной или более копий (или без них) последовательности, которая повторяется в ядре нативного протеина альфа-антигена.
В том смысле, как здесь использован, "R" представляет одну копию повтора из 82 аминокислот, которая начинается у аминокислоты 679 ДНК последовательности альфа-антигена на фиг. 6, "RX представляет "X" тандемных копий этого повтора, соединенных в тандем по карбоксильному концу одного R звена с амино-терминальным концом соседнего R звена, "N" представляет 5' аминокислотную фланкирующую последовательность, которая находится в последовательности, представленной на фиг. 6, с сигнальной последовательностью или без нее; если сигнальная последовательность отсутствует, "N" представляет 185 аминокислотную 5' фланкирующую последовательность, которая существует в природном протеине, как представлено на фиг. 6; если сигнальная последовательность присутствует, "N" представляет 226 аминокислотную 5' фланкирующую последовательность, как представлено на фиг. 6. "С" представляет 48 аминокислотную С-терминальную якорную последовательность, как представлено на фиг. 6.
Используя эти определения, можно сконструировать виды производных нативного протеина по способу настоящего изобретения, приведенные в конце описания.
Более 10 повторяющихся R звеньев, включая, например, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 звеньев можно сконструировать аналогичным способом. Кроме того, фрагменты R, N или С можно использовать в таких фрагментах, повышая функциональную способность производного вызывать образование защитных антител против Streptococcus группы В, пли, если такой фрагмент придает конструкции другое нужное свойство, такое, как сигнал секреции или сигнал локализации мембраны.
Альфа-антигены из других штаммов Streptococcus группы В можно получить таким же способом, причем небольшие изменения в последовательностях протеинов, таких как N-конец, или С-конец или R повтор, не должны менять биологических свойств и функциональной способности вызывать выработку защитных антител. Так например, альфа-антигены Streptococcus группы В, выделенные из различных штаммов Streptococcus группы В и содержащие те же повторяющиеся звенья, но различные N-терминальные аминокислотные последовательности, также входят в объем изобретения.
Пептиды настоящего изобретения либо кодирующие нативный протеин, либо его функциональные производные, коньюгируют с углеводным фрагментам Streptococcus группы B любым способом, при котором сохраняется способность этих протеинов индуцировать защитные антитела против Streptococcus группы В.
Гетерогенность вакцины можно обеспечить за счет смешивания специфических коньюгированных видов. Так например, вакцинный препарат может содержать одну или более из копий пептидных форм, коньюгированных с углеводом, или могут быть получены такие препараты вакцин, которые содержат более одной формы вышеуказанных функциональных производных и/или нативную последовательность, причем каждый коньюгирован с использованным здесь полисахаридом. Коньюгаты, включающие пептид (как например, один из пептидов, представленных в примерах под 1-43), можно смешать с коньюгатами, включающими любые другие пептиды (такие как, например, из группы по 1-43), чтобы получить "компаундированную" коньюгатную вакцину. Мультивалентную вакцину можно также получить в результате смешивания группы В-специфических коньюгатов, приготовленных так, как указано ранее, с другими протеинами, такими как токсин дифтерии или токсин столбняка, и/или другими полисахаридами, используя известные специалистам способы.
Гетерогенность вакцины можно также обеспечить, используя препараты Streptococcus группы В из хозяев Streptococcus группы В (особенно в Streptococcus agalactine), которые были трансформированы рекомбинантной конструкцией настоящего изобретения так, что стрептококковый хозяин экспрессирует протеин альфа-антигена или его функциональное производное. В таких случаях гомологичность рекомбинаций, между генетическими последовательностями, кодирующими повторяющееся R звено, приведет к спонтанной мутации хозяина, так, что популяция хозяев легко создается, и такие хозяева экспрессируют широкий круг антигенных функциональных производных альфа-антигена в вакцинах настоящего изобретения. Такие спонтанные мутации обычно приводят к делеции R звеньев или их частей, хотя могут также происходить мутации других участков альфа-антигена.
В том смысле, как здесь использован полисахаридный протеин, является "характеристическим" для бактерии, если он практически аналогичен по структуре или последовательности молекуле, которая природно связана с бактерией. Этот термин включает как молекулы, которые являются специфическими для организма, так и молекулы, которые, хотя и присутствуют в других организмах, вносят вклад в вирулентность или антигенность бактерий у хозяев-животных или человека.
Вакцина настоящего изобретения может придавать устойчивость к Streptococcus группы В либо за счет пассивной иммунизации, либо за счет активной иммунизации. В одном из вариантов пассивной иммунизации вакцину вводят хозяину (то есть человеку или млекопитающему) добровольцу, и выработанную антисыворотку выделяют, и вводят реципиенту, у которого подозревают наличие инфекции, вызываемой Streptococcus группы В.
Возможность метить антитела или фрагменты антител токсиновыми метками обеспечивает дополнительный способ лечения инфекций Streptococcus группы В, если проводят этот тип пассивной иммунизации. В этом варианте антитела или фрагменты антител, которые способны распознавать антигены Streptococcus группы В, метят молекулами токсина перед тем, как их вводят пациенту. Если такая молекула - производное токсина, связывается с клеткой Streptococcus группы В, токсиновый фрагмент вызывает гибель клетки.
В другом варианте вакцину вводят женщине (во время или перед беременностью или родами) в момент времени и в количестве, достаточном, чтобы вызвать продуцирование антисыворотки, которая служит защитой как для женщины, так и для плода или новорожденного (за счет пассивного включения антител через планцету).
Таким образом, настоящее изобретение обеспечивает средства для предотвращения или ослабления инфекции Streptococcus группы В, или организмами, которые имеют антигены, которые могут быть распознаны и связаны антисывороткой против полисахарида и/или протеина коньюгатной вакцины. В том смысле, как здесь использован, говорят, что вакцина предотвращает или ослабляет заболевание, если ее введение индивидууму приводит либо к полному, либо частичному ослаблению (то есть подавлению) симптомов или состоянии, связанных с болезнью, или к полному или частичному иммунитету индивидуума к болезни.
Введение вакцины (или антисыворотка, образование которой она вызывает) может служить либо "профилактической", либо "терапевтической" цели. Если ее вводят профилактически, соединение (соединения) вводят до проявления каких-либо симптомов инфекции Stroptococcus группы В. Профилактическое введение соединения (соединений) служит для предотвращения или ослабления любого последующего заражения. Если вводят в терапевтических целях, соединение (соединения) вводят после определения симптомов острой инфекции. Терапевтическое введение соединения (соединений) служит для ослабления любой острой инфекции.
Противовоспалительные агенты настоящего изобретения, таким образом, могут вводиться как до установления инфекции (с тем, чтобы предотвратить или ослабить предполагаемую инфекцию), так и после начала острой инфекции.
Говорят, что композиция "фармакологически приемлема", если она переносится реципиентом. Говорят, что агент вводят в "терапевтически эффективном количестве", если вводимое количество физиологически значимо. Агент является физиологически значимым, если его присутствие приводит к заметному изменению в физиологии реципиента. Как следует понимать специалистам, если вакцину настоящего изобретения вводить индивидууму, она может представлять собой композицию, которая может содержать соли, буферы, адьюванты или другие вещества, которые желательны для улучшения эффективности композиции. Адьювантами являются вещества, которые можно использовать для специфического усиления специфической иммунной реакции. Обычно адьювант и композицию смешивают перед введением в иммунную систему или вводят отдельно, но в один и тот же сайт животного, подлежащего иммунизации. Адьюванты можно разделить на несколько групп на основании их состава. Эти группы включают масляные адьюванты (например, полную или неполную среду Фреунда), минеральные соли (например, AlK(SO4)2, AlNa(SO4)2, AlNH4(SO4), двуокись кремния, каолин и уголь), полинуклеотиды (например, поли IС и поли AU кислоты) и некоторые природные вещества (например, воск D из Mycobacterium tuberculosis, а также как вещества, найденные в Corynebacterium parvum или Bordetella pertussis и в членах рода Brucella). Среди веществ, наиболее полезных в качестве адьювантов, находятся такие сапонины, как, например, Quil A (Superfos A/S, Denmark). Примеры материалов, подходящих для использования в композициях вакцин, приведены в Remington's Pharmaceutical Science (Osol, A. Ed. Mac. Publishing CO, Easton, PA, pp. 1324-1341 (1980).
Терапевтические композиции настоящего изобретения можно вводить парентерально в виде инъекций, быстрых вливаний, интраназально, за счет поглощения через кожу или перрорально. Эти композиции можно в другом варианте вводить внутримышечно или внутривенно. Композиции для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примеры неводных растворителей включают пропиленгликоль, полиэтиленгликоль, такие растительные масла, как оливковое, и такие органические сложные эфиры для инъекций, как этилолеат. Носители или плотные повязки можно использовать для повышения кожной проницаемости и усиления абсорбции антигена. Жидкие дозированные формы для перорального введения могут включать липосомный раствор, содержащий жидкую дозированную форму. Подходящие формы для суспендирования липосом включают эмульсии, суспензии, растворы, сиропы и эликсиры, содержащие инертные разбавители, используемые специалистами, такие как очищенная вода. Кроме инертных разбавителей такие композиции могут такие включать адьюванты, смачивающие агенты, эмульгаторы и суспендирующие агенты, подслащивающие агенты, вкусовые добавки или отдушки.
Для определения времени иммунизации существует множество различных способов, если используют режим многочисленных введений. Можно также использовать композиции настоящего изобретения, более чем одну, для того, чтобы повысить уровень и разнообразие экспрессии иммуноглобулинового репертуара, экспрессируемого иммунизованным животным. Обычно, если иммунизацию проводят не в один прием, введение вакцины осуществляют с промежутком в один или два месяца.
В соответствии с настоящим изобретением "эффективное количество" терапевтической композиции" - это такое количество терапевтической композиции, которого достаточно для достижения нужного биологического эффекта. Обычно доза должна обеспечить эффективное количество композиции, которое меняется в зависимости от таких факторов, как возраст, состояние, пол и степень заболевания животного или человека, если оно наблюдается, и других переменных, которые может установить специалист.
Антигенные препараты настоящего изобретения можно вводить либо отдельной дозой, либо в нескольких дозах эффективного количества. Эффективные количества композиций настоящего изобретения могут меняться от 0,01 до 1 мкг/мл в одной дозе, более предпочтительно от 0,1 до 5 мкг/мл в дозе, и еще более предпочтительно от 10 до 300 мкг/мл в дозе.
После общего описания изобретения то же самое можно более легко понять со ссылкой на следующие примеры, которые приведены только в целях иллюстрации и не должны ограничивать изобретение, если нет таких указаний.
Пример 1.
Эффективность клонирования векторов рUX12
Несколько экспериментов были проведены для того, чтобы тестировать эффективность клонирования векторов рUX12 и для определения, правильно ли транскрибируются модифицированные считывающие рамки. Результаты этих экспериментов кратко суммированы далее:
I. Для клонирования ДНК фрагмента в рUX12 три конструкции, pUX12 (исходную, "нулевую" конструкцию считывающей рамки), рUX12+1 и рUX12-1 смешивают в эквимолярных концентрациях. Затем плазмиды разрезают BstXI для отщепления заполняющего фрагмента в полилинкере. Заполняющий фрагмент выделяют из плазмиды, используя либо агарозу с низкой температурой плавления, либо градиент ацетата калия (Aruffo, A. et al., Proc. Natl. Acad. Sci. USA 84: 8573-8577 (1987), Ausubel, F.M. et al., Current Topics in Molecular Biology; Greene Publ. Assn./Wiley Inter-science, NY (1987)).
ДНК, подлежащую клонированию, разрезают рестрикционным энзимом, который дает тупые концы (можно использовать любой такой рестрикционный энзим). При необходимости двунитевую ДНК с сигнальными нитевыми концами можно модифицировать, создавая тупые концы. Тупые концы ДНК фрагментов смешивают с двумя синтетическими олиговуклеотидными адаптерами. Это те же 12и и 8и меры, которые были использованы при получении заполняющих фрагментов. Модифицированные ДНК фрагменты выделяют из невключенных синтетических олигонуклеотидов на градиенте ацетата калия. Эти фрагменты затем лигируют в семейство линейных pUX12 плазмид и используют для трансформации E. coli.
Для проверки того, что pUX12 векторы самолигируются с низкой частотой в условиях, оптимизированных для клонирования вставок с адаптерами, второй устойчивый к лекарству маркер клонируют в pUX12. Как представлено на фиг. 1, рUX12 содержит ген β-лактамазы и обладает устойчивостью к ампициллину (ampR). Резоном для клонирования второго маркера было сравнение отношения клонов, которые содержат как маркеры устойчивости к там pUX12 плазмидам, которые самолигируются в типичных условиях клонирования и поэтому лишь экспрессируют устойчивость к ампициллину. Ген устойчивости к тетрациклину (tetR) из плазмиды рВР322 был клонирован в полилинкер pUX12 с описанными ранее адаптерами. Исследовали группу тестовых лигирований для установления оптимальной концентрации олигонуклеотидного адаптера на концах фрагментов и отношение модифицированной вставки к линейной pUX12 плазмиде для лигирования и трансформации. Используя tetR ген в качестве маркера, мы смогли определить параметры клонирования с тем, чтобы более 99% трансформантов, отобранных на содержащих ампициллин пластинах, также содержали tetR маркер. Таким образом, частота. самолигирования в этой системе очень низка, и нет необходимости в скринировании на присутствие вставки в полилинкере перед скринированием библиотеки в pUX12.
2. Для подтверждения положения трансляционной считывающей рамки в полилинкере pUX12 структурный ген, последовательность которого и продукт которого известны и который не содержит собственного промотора, был клонирован.
Для этой цели был выбран мутант tox структурного гена, содержащегося на плазмиде (Costa J.J., et al., J. Bacteriol. 148 (1): 124-130 (1981), Michel, J. L. et al., J. Virol. 42:510-518 (1982). Эту плазмиду, рАВС402, одновременно обрабатывают рестрикционными эндонуклеазами АраI и Hind III (Bishai, W.R. et al., J. Bacteriol. 169:1554-1563 (1987), Bishai, W.R. et al., J. Bacteriol. 169: 5140-5151 (1987).
ApaI сайт находится внутри структурного гена вблизи N-терминала и Hind Iii сайт расположен непосредственно вне С-терминала tox гена. Этот 1,2 kb рестрикционный фрагмент был выделен из оставшихся 4,1 kb вектора рАВС402, с использованием агарозы с низкой температурой плавления.
Для создания тупых концов для клонирования tox фрагмент обрабатывают Т4 ДНК полимеразой. Экзонуклеазная активность полимеразы повторно разрезает ApaI 3' концы, и полимеразная активность заполняет 5' выступ по Hind III сайту (Maniatis, Т, et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, NY (1982)).
Этот очищенный фрагмент с тупыми концами лигируют со смесью pUX12, которая содержит все три считывающие рамки. Отдельные трансформанты статистически отбирают и скринируют рестрикционным картированием для определения ориентации и считывающей рамки вставок. Кроме того, нуклеотидные последовательности участков полилинкер/адаптер/вставка определяют. Все шесть потенциальных ориентаций и комбинаций считывающих рамок были идентифицированы. И наконец, экстракты из этих клонов были скринированы с использованием Вестернблоттов, зондированных антисывороткой к токсину дифтерии (Blake, M.S., et al. , Anal. Biochem. 136: 175-179 (1984), Murphy, J.R., et al., Curr. Topics Microbiol., and Immun. 118: 235-251 (1985).
Протеины, родственные с реактивным токсином, были лишь детектированы из клонов, которые содержали структурный ген в правильной ориентации и считывающую рамку. Эту плазмиду назвали pUDTAH-t причем ДНК последовательность полилинкора и начало tox структурного гена представлены в таблице 1. Изображенная последовательность является ДНК последовательностью начала tox структурного гена в pUDTAH-1. ATG представляет стартовый сигнал для транскрипта (lacZ'), GAT начинает модифицированный полилинкер pUX12, а GCC начинает правильную трансляционную считывающую рамку для tох' гена.
Пример 2.
Выделение хромосомной ДНК из Streptococcus группы В
Для осуществления очистки хромосомной ДНК из Streptococcus группы В, хромосомную ДНК выделяют из штамма А909 Streptococcus группы В (Lancefield, R. C., J. Exp. Med. 142:165-179(1975)) по способу Hull et al. (Hull, R.A. et al. Infect, and Immun. 33: 933-938 (1981) модифицированному Rubens et al. (Rubens, C. E., et al. Proc. Natl. Acad. Sci. USA 84: 720'-7212 (1987) (обе работы включены сюда по ссылке). Короче говоря, для превращения А909 (Iа/с) штамма Streptococcus группы В в протопласты используют метанолизин. Полученный поверхностный экстракт, как обнаружилось, содержит множество протеинов, которые иммунореактивны с защитной антисывороткой, вырабатываемой против интактных бактерий. Нерастворимые протеиновые фракции частично очищают, используя обычную хроматографию на колонке. Две фракции, включая одну с высокой концентрацией видов 14 кДа, используют для иммунизации кроликов. Антисыворотка, которая выработалась против частично очищенных протеинов Streptococcus группы В, как оказалось, способна обеспечивать пассивную защиту в анализе на вирулентность у мышей против гетерологичных капсульного типа Streptococcus группы В, которые содержали С протеины.
ДНК Streptococcus группы В выделяют центрифугированием в градиенте с плавающей плотностью цезийхлорида (CsCl), и хромосомную ДНК диализуют против ТАЕ буфера, рН 8,0 (Maniatis, T., et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Рrеss, Cold Spring Harbor, NY (1982)).
Штамм А909 Streptococcus группы B имеет капсулы типа I, экспрессирует С протеины и ранее был использован в изучении С протеинов Valtonen, M.V. et al., Microbiol. Path. 1: 191-204 (1986)).
Это также такой штамм Streptococcus группы В, который был использован при приготовлении защитной антисыворотки для скринирования.
Выход хромосомных ДНК Streptococcus группы В составляет в среднем от 3 до 5 мг на каждые 500 мл ночной культуры Streptococcus группы В. Очищенные ДНК переваривают отдельно 24 обычно используемыми рестрнкционными эндонуклеазами и полученные фрагменты обрабатывают на 1,0% агарозном геле. Был выбран широкий круг энзимов, включающий те, которые имеют уникальные свиты на полилинкерах, обычно используемых при клонировании векторов. Окрашивание Этидиумбромидом (EtBr) геля показывает, что все рестрикционные энзимы дают распределение по размерам отдельных фрагментов ДНК Strерtососсus группы В. Это предполагает, что ДНК Streptococcus группы В не модифицированы ни одним из тестированных рестрикционных энзимов.
Для определения того, существуют ли какие-либо ингибиторы, блокирующие лигирование ДНК, перевары рестрикционных эндонуклеаз, описанных ранее, осаждают этанолом, помещают в буфер для лигирования и инкубируют в течение ночи при 14oС ДНК лигазой. Эти образцы снова обрабатывают на 1,0% агарозном геле и окрашивают EtBr. Полученные рестрикционные картины показывают широкое распределение по молекулярным весам. Поэтому можно считать, что не существует ингибирования лигирования ДНК Streptococcus группы В.
Пример 3.
Получение библиотеки ДНК Streptococcus группы В
Получение библиотеки хромосомных ДНК Streptococcus группы В в pUX12 и их трансформация в Е. coli осуществляется следующим образом. Для расщепления хромосомной ДНК Streptococcus группы В для клонирования были выбраны четыре рестрикционные энзима, которые дали широкое распределение рестрикционных фрагментов по размерам. Вектор pUX12 и адаптор наиболее эффективны, если клонируют фрагменты с тупыми концами. Выбранные энзимы распознают четыре сайга пар оснований и оставляют тупые концы. ДНК Streptococcus группы В частично переваривают отдельно AluI, FunD2 HaeIII и RsaI.
Полученные фрагменты смешивают, очищают фенол/хлороформ, этанольным осаждением и снова суспендируют в лигирующий буфер (Maniatis, Т. et al., Molecular Cloning, A Laboratory Manual (1982). Один мкг фрагментов ДНК Streptococcus группы В смешивают с 3 мкг 12-мера и 2 мкг 8-мера олигонуклеотидными адапаторами. Добавляют три мкл Т4 ДНК лигазы (600 ед., New England Biolabs), и реакционную смесь поддерживают при 14oС в течение ночи. Свободные линкеры отделяют из фрагментов ДНК Streptococcus группы В на ацетате калия с градиентом скорости (Aruffo, et al. , Proc. Natl. Aсad. Sci. A 84:8573-3577 (1987)).
pUX12 плазмиду, содержащую все три трансляционные считывающие рамки переваривают BstXI и заполняющий фрагмент удаляют, используя агарозный гель с низкой температурой плавления. Библиотеку Streptococcus группы В приготавливают, смешивая 10 нг адаптированных фрагментов Streptococcus группы В со 100 нг линейного pUX12 вектора в 100 мкл лигирующего буфера, к которому добавляют 0,1% Т4 ДНК лигазы. Реакцию лигирования всю ночь поддерживают при температуре 14oС, а затем используют для трансформирования МС1061 штамма Е. сoli на пластинах, содержащих ампициллин (Ausubel, F.M. Current Topics in Molecular Biology (1987)). Шестнадцать полученных трансформантов выделяют, выращивают в течение ночи на LB и минипрепаративно выделяют плазмидную ДНК. Плазмидную ДНК переваривают BamHI и обрабатывают на 1,0% агарозном геле. Все скринированные плазмиды содержат вставки в pUX12 векторе, и средний размер вставок составляет 1,4 kb. До сих пор плазмидная ДНК, полученная более чем из 200 клонов, была скринирована и только один клон, как оказалось, не содержит вставки в полилинкере.
Пример 4.
Характеризация защитной антисыворотки, которую используют при скринировании библиотеки
Как обсуждалось ранее, С протеины были частично очищены различными способами и защитную антисыворотку получили несколько исследователей (Bevanger, L. et al., Acta. Path. Microbiol. Scand. Sect. B. 93:113-119 (1985), Russel-Jones G. J. et al., J. Exp. Med. 160: 1476-1484 (1984), Wilkinson, H.W. et al., Infec. and Imnun. 4: 596-604 (1971)).
Был проведен ряд экспериментов для повторения работы Valtonen, Kasper and Levy, которые выделили 14000 м.в. протеин из надосадочной жидкости Streptococcus группы В, которая обеспечивала выработку защитных антител (Valtonеn, M.V. et al., Microbiol. Path. 1:191-204(1982)), которые включены сюда по ссылке. Этот эксперимент выявил, что если протеолитический ингибитор надосадочных жидкостей культур Streptococcus группы В добавляют до концентрирования и выделения С протеинов (Wong, W.W. et al., Immunol. Methods 82: 303-313 (1985)), в надосадочной жидкости больше не остается протеина с м. в. 14000. Это указывает на то, что этот протеин возникает за счет протеолитического расщепления С протеинов с более высоким молекулярным весом в надосадочных жидкостях культур Streptococcus группы В.
Пример 5.
Оптимизация условий для скринирования по экспрессии в вектор на основе плазмиды
Как обсуждалось ранее, наиболее часто используемые векторы для определения экспрессии основаны на λgtII (Young, R.A. et al., Proc. Natl. Acad. Sci. USA 80: 1194-1198 (1983)).
Мы смогли повысить чувствительность определения экспрессии из рUX12 плазмидного вектора за счет комбинации двух описанных ранее процедур для скринирования антител бактериальных колоний клонов. Траноформанты из библиотеки культивируют в течение ночи, и полученные колонии переносят на нитроцеллилозные фильтры (Bio-Rad). Эти колонии подвергают лизису, помещая фильтры в атмосферу, насыщенную хлороформом (CHCl3) в закрытых контейнерах на 30 минут. Затем фильтры помещают в лизисный буфер и инкубируют в течение ночи по способу Helfman et al. (Helfman, D.M., et al., Proc. Natl. Aсad. Sci. USA 80: 31-45 (1983)). Скринирование антител ведут, используя коммерчески полученный Е. coli лизат (отношение 1:200) и коньюгированную пероксидазу хрена, афинно очищенный козлиный антикроличий IgG (отношение 1:3000) в наборе для экспресс биоанализа, полученного в Bio-Rad Labboratories. В результате предварительной обработки колоний хлороформом и ночного инкубирования с ДНК-азой и лизоцимом, описанным ранее, оказывается возможным снизить отношение первично необходимых антител с 1:500 до 1:5000.
Пример 6.
Начальный анализ позитивных клонов и их протеиновых продуктов
Библиотеку хромосомных ДНК Streptococcus группы В в рUX12 векторе скринируют с вышеописанной защитной анти-С протеиновой сывороткой. Библиотека Streptococcus группы В содержит фрагмент среднего размера 1,4 kb. Трансформанты скринируют, как указано ранее, а затем субклонируют и снова скринируют с антисывороткой трижды. Из 20000 скринированных клонов оказалось 35 независимо выделенных клонов, которые реагировали с защитной антисывороткой. Эти клоны обозначили S1-S35, и плазмиды, содержащие клоны, обозначили pJMS1-pJMS35. Размеры этих клонов составили от 0,9 до 13,7 kb, а средний размер был равен 4,5 kb.
Плазмидную ДНК выделили из клонов с помощью минипрепаративной техники, а вставки контролировали рестрикционными эндонуклеазами. Четырнадцать из клонов можно подразделить на три группы на основании содержания вставок одинаковых размеров и общего характера картирования рестрикционной эндонуклеазой. Клоны S1 и S23, обсуждавшиеся ранее, как оказалось, относятся к различным группам.
При дальнейшем сравнении характера рестрикционных картин отдельных клонов оказалось возможным идентифицировать 24 клона, которые содержат общие рестрикционные фрагменты.
Были приготовлены экстракты клонов, проведен Вестернблоттинг, и зондирование сывороткой использовали для скринирования библиотеки. Были идентифицированы шесть классов размеров антигенов протеина (А-F). Объединяя результаты картирования рестрикционными эндонуклеазами и результаты Весторнблоттинга, оказалось возможным классифицировать 24 из 35 клонов в 6 различных типов антигенов протеинов (таблица 2). Эту предварительную классификацию провели лишь для того, чтобы грубо оценить потенциальное число вовлеченных генов. Было обнаружено, что размер S1 составляет 3,5 кДа, и он принадлежит к антигеновой протеиновой группе А; тогда как S23 имеет размер 13,7 кДа и принадлежит к антигеновой протеиновой группе Д.
Когда Вестернблотты экстрактов клонов зондировали антисывороткой к штамму Streptococcus группы В, который не экспрессирует С протеины, только одна группа из клонов оказалась позитивной (группа протеина В). Это указывает на то, что основная часть позитивных клонов экспрессирует протеины, которые являются уникальными для штаммов, которые содержат С протеины; эти протеины не являются общими для всех штаммов Streptococcus группы В.
Пример 7.
Характеризация клонированных генных последовательностей
Реальное число С протеинов, которые экспрессируются Streptococcus группы В, не было определено. Недавние иммунологические исследования Brady et al., характеризующие типирующую антисыворотку для протеинов С из С.Д.С. привели к идентификации четырех отдельных антигенов (Brady, I.J. et al., J. Infeс. Dis. 158(5): 965-972 (1988)). Предварительные генетические и иммунологические характеристики предполагаемых С протеиновых клонов Streptococcus группы В дают возможность предположить, что четыре из пяти генов кодируют протеины, которые присутствуют в штаммах Streptococcus группы В, которые, как известно, содержат С протеины. Были проведены две группы экспериментов для определения того, представляют ли клонированные генные продукты С протеины.
Как обсуждалось ранее, исследования С протеинов определили два фенотипа: одна группа протеинов, которая чувствительна к деградации под действием пепсина, но не трипсина (обозначаемая TR или α), и другая группа протеинов, которая чувствительна к деградации под действием как пепсина, так и трипсина (называемая TS или β) (Johnson, D.R. et al., J. Clin. Microbiol. 19:506-510 (1984), Rusael-Jones G.J. et al., J. Exp. Mеd. 160:1476-1484 (1984)).
Типирующую антисыворотку (α и β) используют для скринирования клонированных генных продуктов по Востернблоттам (Bovanger, L. et al., Acta Path. Microbiol. Scand. Sect. B. 87: 51-54 (1979); тот же, там же В. 89:205-209 (1981); тот же, там же В. 91:231-234 (1983); тот же, там же В. 93:113-119 (1985); тот же, там же В. 93: 121-124 (1985), которые включены сюда по ссылке.
α-типирующая сыворотка идентифицирует протеин группы D, а β-типирующая сыворотка идентифицирует протеин группы А. Эти протеины переваривают пепсином и трипсином. Протеин группы D чувствителен к пепсину, но не к трипсину, а протеин группы А чувствителен как к пепсину, так и трипсину. Эти результаты согласуются с предшествующими исследованиями и подтверждают, что по крайней мере два из С протеиновых генов были клонированы.
Наиболее важным и характеристическим свойством С протеинов является их способность обеспечивать выработку антител против штаммов Streptococcus группы В и экспрессировать С протеины. Можно использовать несколько подходов для получения антисыворотки против клонированных генных продуктов. Так, например, лизаты клонов Е. coli можно непосредственно вводить кроликам для определения того, содержит ли лизат протеины, способные обеспечить выработку антител к какому-либо из введенных протеинов Е. coli или протеинов Streptococcus группы В. Полученную антисыворотку можно предварительно абсорбировать с лизатом Е. coli перед тем, как тестировать эту антисыворотку, для уменьшения числа перекрестно-реагирующих антител. Такой лизат можно использовать для уменьшения числа перекрестно-реагирующих антител как в блоттах колоний, используемых для скринирования клонов по экспрессии, так и Вестернблоттов, используемых для изучения как клеточных экстрактов Streptococcus группы В, так и частично очищенных протеинов Streptococcus группы В.
Представительные клоны из групп протеинов A, В, и D обрабатывают ультразвуком и вводят кроликам для выработки антисыворотки против клонированных антигенов протеинов Streptococcus группы В (Lancefield. R.C. et al., J. Exp. Mеd. 142: 165-179(1975) Valtonеn, M.V., et. al., Microbiol. Path. 1:191-204 (1966)).
Контрольным кроликам вводят E.coli, которые содержат pUX12 без вставки в полилинкер. Эту антисыворотку предварительно адсорбируют Е. coli лизатом и скринируют вначале по Вестернблоттам против экстрактов клонов в библиотеке. Поэтому оказывается возможным определить, существуют ли перекрестно-реагирующие эпитопы между этими клонами и подтвердить, что эти антисыворотки направлены против клонированных протеинов, идентифицированных во время предварительного раунда скринирования.
В другом варианте предварительно адсорбированную антисыворотку можно тестировать в опытах на мышах. В этой классической модели мышам вводят внутрибрюшинно кроличью антисыворотку (Lancefield, R.C. et al., J. Exp. Med. 142: 165-179 (1975)).
На следующий день им снова внутрибрюшинно вводят ЛД90 живых Streptococcus группы В, которые, как известно, содержат С протеины. Конечной точкой является гибель мышей через 48 часов.
Для проверки иммуногенности протеинов, экспрессируемых клонированными генными последовательностями, Е. сoli клетки, содержащие pJMS1 и pJMS23, выращивают и используют для получения клеточных экстрактов. Затем эти экстракты используют для иммунизации кроликов. Антисыворотку, выработанную в ответ на иммунизацию S1 и S23 экстрактами тестируют, используя модель защиты мышей.
Когда проводят эксперимент на модели защиты мышей, оказывается, что антисыворотка, выработанная из клонов, представляющих протеины группы А и группы D (S1 и S23 соответственно), является защитной. Антисыворотка из клона, представляющего протеин группы С, не обладает защитными свойствами, и контрольная антисыворотка также не продемонстрировала защиты. Антисыворотка, выработанная против клонов, экспрессирующих протеины группы С, также связывается с протеинами, экстрагированными из штаммов Streptococcus группы В, которые не содержат С протеина. Поэтому эта группа клонов не кодирует С протеинов. Итак, пять из шести клонов по кодируют протеины, которые являются уникальными для штаммов Streptococcus группы В, которые экспрессируют С протеины.
Начальный биохимический, иммунологический и функциональный анализы двух групп клонов демонстрируют то, что по крайней мере дваС протеиновые гена (S1 и S23) были успешно клонированы. Это первая демонстрация того, что отдельный полипептидный генный продукт, клонированный из Streptococcus группы В, может обеспечить выработку защитного иммунитета. Антитела к S1, как было обнаружено, способны связываться с двумя полосами А909 экстракта на 50 и 60 кДа. Антитела к S23, как было обнаружено, способны связываться с регулярно повторяющимися группами полос поверхностного экстракта Streptococcus группы В, с молекулярным весом от более 180 кДа до 40 кДа. Моноклональное антитело, полученное из А909 экстракта, демонстрирует тот же самый повторяющийся характер иммунореактивности. Это указывает на то, что один эпитоп распознается в протеинах с различным молекулярным весом и дает возможность предположить существование регулярно повторяющейся структуры. Протеины, распознаваемые S1 антисывороткой, подвержены деградации под действием пепсина и трипсина, тогда как те, которые распознаются S23 антисывороткой, подвержены разложению под действием пепсина, но не трипсина. Этот эксперимент показывает, что протеины, частично очищенные из Streptococcus группы В и экспрессированные из клонированных генов Streptococcus группы В, представляют альфа- и бета-антигены С протеина Streptococcus группы В.
35 потенциальных С протеиновых клонов, описанных раньше, можно оценить как генетически, так и иммунологически для определения числа генов, которые присутствуют. Кроме того, выделение этих клонов позволяет идентифицировать гены, которые придают защитный иммунитет против инфекции Streptococcus группы В. По-видимому, защитная антисыворотка, которую используют для получения исходных клонов, также детектирует протеины, отличные от С протеинов. Использование таких других протеинов в терапии инфекции Streptoсoссus группы В также входит в объем настоящего изобретения. Так как основной целью настоящего изобретения является выделение и идентификация протеинов, связанных с иммунитетом, антисыворотку, полученную против протеинов, экспрессируемых этими клонами, можно изучать на моделях защиты мышей. То гены, которые экспрессируют защитные протеины, являются предпочтительными протеинами для коньюгатной вакцины.
Как обсуждалось ранее, начальное скринирование хромосомных ДНК Streptococcus группы В в библиотеке векторов E.coli/pUX12 защитной антисывороткой приводит к получению 35 независимо выделенных клонов. Комбинируя данные, полученные при картировании рестрикционными эндонуклеазами клонированных фрагментов, и Вестернблотты протеиновых экстрактов из этих клонов, оказывается возможным достаточно чувствительно калссифицировать 24 из 35 клонов на 6 различных групп протеиновых антигенов (таблица 2). Это позволяет определить потенциальное количество выделенных генов.
Для дальнейшей характеристики таких клонов предпочтительно используют блотты колоний для определения того, которые из клонов имеют общие ДНК последовательности. Для таких блоттов одну колонию каждого из клонов помещают в ячейку микротитровальной чашки, содержащей LB бульон, и культивируют в течение ночи при 37oC. Контрольные колонии включают штамм хозяина - E.coli и штамм E. coli, который содержит pUX12. После культивирования в течение ночи эти культуры переносят на нитроцеллюлозный фильтр и на пластинку агара, содержащего ту же самую культуральную среду. Эти пластины культивируют в течение 8 часов при 37oC и нитроцеллюлозный фильтр, содержащий свежевыращенные колонии, приготавливают для скринирования на предмет ДНК-ДНК гибридизации. Зонды приготавливают из ДНК вставок Streptococcus группы В в рUX12 библиотеке. Минипрепарационную методику используют для получения плазмидной ДНК из этих клонов. Полилинкер в рUX12 содержит как BamHI, так и BstXI сайт с каждой стороны вставки; поэтому вставку Streptococcus группы В иссекают из плазмиды либо ВаmНI, либо ВamXI. К счастью, хромосомная ДНК Streptococcus группы В содержит немного BamHI сайтов, и многие из вставок удаляются из вектора в одном фрагменте в результате переваривания BаmНI. Для выделения плазмидного вектора из вставок используют агарозу с низкой температурой плавления. Вставки вырезают из агарозного геля и непосредственно метят статистическим примированием, а затем меченые вставки используют для зондирования блоттов колоний. Это дает возможность идентифицировать клоны, которые содержат последовательности ДНК.
Таким образом, на основании информации, полученной из блоттов колоний, описанных ранее, 35 клонов располагают по группам, которые содержат ДНК последовательности. Эти группы картируют многочисленными рестрикционными эндонуклеазами для определения родственной связи одного клона с другими в этой области ДНК. Так как плазмида-хозяин, pUX12, содержит уникальные рестрикционные эндонуклеазные сайты, которые присутствуют только в полилинкере, можно осуществить много рестрикционных картирований, используя плазмидные мини-препараты ДНК, без необходимости отдельного выделения вставок. Комбинируя данные по блоттам колоний с подробным рестрикционным картированием, оказывается возможным достичь разумной оценки числа вовлеченных генетических локусов. Если некоторые группы клонов не представляют целиком интересующие гены, может оказаться необходимым использовать эти клоны для выделения других, более полных копий генов из хромосомной библиотеки. Однако так как исходные выделенные 35 клонов дают широкое распределение по размерам, по-видимому некоторые представляют полную открытую считывающую рамку.
Перед проведением генетического анализа антисыворотку предпочтительно приготавливают против клонированных генных продуктов и используют в модели защиты мышей для определения способности этой антисыворотки защищать против инфицирования Streptococcus группы В (Lancefiеld, R.C. et al., J. Еxp. Mеd. 142: 165-179 (1975). Valtonen, M.V. et al., Microb. Path. 1:91-204 (1986)).
Тот клон, экспрессированный протеин которого способен обеспечивать выработку защитных антител, является предпочтительным кандидатом для использования в коньюгатной вакцине. Клоны же, экспрессированные протеины которых не способны вызвать выработку защитных антител, можно проанализировать далее для определения того, являются ли они кандидатами для вакцин. Так как С протеины связаны с мембранами, неспособность протеина, экспрессированного клоном, обеспечить выработку антител может отражать тот факт, что протеин может быть нестабилен в Е. сoli, и в векторе с большим числом копий. Эта проблема возникает при клонировавши других мембранных протеинов как группы А, так и группы В Streptococcus (Kehoe, М. et al., Kehoe, M. et al., Infect, and Inmun. 43:804-810 (1984), Schneewind, O. et al., Infect. and Immun. 56: 2174-2179 (1988)).
Некоторые из 35 клонов, выделенных в предварительных исследованиях, демонстрируют слабую морфологию колоний. Кроме того, некоторые из этих клонов нестабильны и, как было обнаружено, не содержат части вставки ДНК Streptococcus группы В из pUX12 полилинкера. Существует несколько методик, которые можно использовать для стабилизации этих клонов, включая: клонирование в вектор с малым числом копий или после промотора, который можно регулировать по принципу обратной связи; выращивание клонов при 30oС вместо 37oС; клонирование в вектор, который был адаптирован для накопления мембранных протеинов. Кроме того, можно трансформировать плазмиды в хозяина - Е. coli, рсnB, который ограничивает число копий рBR322 полученный плазмид, подобно pUX12 (Lopilato, J. et al., Mol. Gen. Genet. 205:285-290 (1986)), которая включена сюда по ссылке.
Неспособность клона экспрессировать протеин, который вызывает образование защитных антител, может также указывать на то, что экспрессированный протеин не содержит эпитопа, который важен для такой защиты. Это может быть в случае, если полный ген не был клонирован, или не может быть экспрессирован в E. coli. Может также быть проблемой, если существует пост-трансляционный процессинг С протеинов Streptococcus группы B, но не для генов
С протеина, клонированных в E. сoli. Может оказаться необходимым или исключить субклонированием полный ген или перенести его в альтернативного хозяина, где он может быть экспрессирован.
Неспособность клона экспрессировать протеин, который вызывает выработку защитных антител, может также указывать на то, что антитела, выработанные за счет антигенов, продуцируемых в Е. coli, могут отличаться от тех, которые вырабатываются животными за счет нативных С протеинов Streptococcus группы В. Кроме того, подвергнутые лизису бактериальные экстракты, используемые для иммунизации кроликов, содержат ряд E.coli протеиновых антигенов. Поэтому может оказаться необходимым получить антисыворотку для тестирования в модели на животных из частично очищенных генных продуктов, вместо той, которая получена из целого организма.
Любые клонированные протеины Streptococcus группы В, которые способны обеспечить выработку защитных антител, можно называть С протеинами. Антисыворотка, полученная для этой группы экспериментов, также может использоваться для локализации этого протеина.
Пример 8.
Картирование, характеризация и секвенирование генов С протеина
Для дальнейшей характеристики генов С протеина тонкую структуру генетической карты клонов генов С протеина, описанных ранее, можно получить и определить их ДНК последовательности. Такое картирование предпочтительно осуществляют, используя геномные Саузернблотты. Определяя ДНК последовательности генов С протеинов, можно определить структуру генов, включая их рибосомные связывающие сайты, потенциальные промоторы, сигнальные последовательности и любые необычные повторяющиеся последовательности. ДНК последовательности предпочтительно сравнивают с библиотекой известных ДНК последовательностей, чтобы увидеть, не гомологичны ли они с другими генами, которые уже были охарактеризованы. Кроме того, последовательности протеинов С протеинов можно определить из ДНК последовательностей их генов. Часто бывает возможно предсказать структуру, функции и клеточное расположение протеина по анализу его протеиновой последовательности.
Геномные Сфузернблотты таким образом предпочтительно используют для определения того, связаны ли какие-либо гены. Для этой методики хромосомные ДНК Streptococcus группы В переваривают отдельно с несколькими различными рестрикционными эндонуклеазами, которые идентифицируют последовательности, содержащие шесть или более пар оснований. Цель состоит в получении более крупных сегментов хромосомной ДНК, которые могут содержать более одного гена. Отдельные эндонуклеазные перевары обрабатывают затем на агарозном геле и переносят на нитроцеллюлозу. Затем Саузернблотты зондируют мечеными вставками, полученными из вышеуказанной библиотеки. Если два клона не кажутся родственными по блоттам колоний или эндонуклеазному картированию, связанному с аналогичными хромосомными полосами, это указывает на то, что либо они являются частью одного и того же гена, или они являются двумя генами, которые близко связаны на хромосоме. В любом случае существует несколько способов выделить клонированием эти более крупные генные сегменты для дальнейшего изучения. Один из способов состоит в получении космидной библиотеки Streptococcus группы В и скринировании на предмет гибридизации с одним из представляющих интерес зондов. Если получают клон, который содержит два или более из представляющих интерес генов, его можно картировать эндонуклеазами и изучить для экспрессии защитных антигенов, как уже было указано для описанных клонов.
Идентификация вышеописанных клонов позволяет определить их ДНК последовательности. Если эти клоны расположены на pUX12 плазмиде, можно использовать секвенирование двунитевой ДНК обратной трианскриптазой до последовательности из олигонуклеотидных праймеров, полученных для полилинкера. Этот способ использовали раньше для характеризации рUX12 плазмиды, и он является быстрым путем для секвенирования множества дополнительных олигонуклеотидных праймеров для секвенирования гена, который крупнее 600 пар оснований. Поэтому ДНК секвенирование для генов С протеина предпочтительно осуществляют за счет субклонирования в М13, секвенирующую систему однонитевой ДНК (Ausubel, F.M. et al. Current Topics Molecular Biology (1987)).
Выделение ДНК последовательностей из С протеинов обеспечивает существенную информацию относительно структуры, функций и регуляции генов и их протеиновых продуктов. Как обсуждалось ранее, гетерогенность размеров С протеинов, выделенных многими исследователями, и их кажущееся антигенное разнообразие дает возможность предположить, что возможны либо семейство генов, либо посттранскрипционный механизм модификации протеиновых продуктов генов С протеинов (Ferrieri, R., et al., Infec. Immun 27:1023-1032 (1980), М протеин Streptococcus группы А обсуждался ранее как пример такого явления (Scott, J. R. et al., Proc. Natl. Aсad. Sci. USA 82:1822-1826 (1985)). Хотя ДНК последовательность М протеина не демонстрирует гомологичности с хромосомной ДНК Streptococcus группы В при гибридизации, возможны структурные гомологи между их ДНК последовательностями (Hollingshead, S.K., et al., J. Biol. Chem. 261: 1677-1686 (1986), Scott, J.R., et al., Proc. Natl. Aсad. Sci. USA 82:1822-1826 (1985); Scott, R., et al., Infect. and Immun. 52:609-612 (1986)).
ДНК последовательности С протеинов предпочтительно сравнивают с библиотекой известных ДНК последовательностей. Кроме того, аминокислотные последовательности, полученные из ДНК последовательностей сравнивают с библиотекой известных аминокислотных последовательностей.
Пример 9.
Преобладание генов С протеина
Для определения преобладания генов С протеинов хромосомные ДНК из клинических и лабораторных изолятов различных серотипов Streptococcus группы В зондируют на геномных Саузернблоттах генами С протеинов. Кроме того, сравнение фенотипической экспрессии определенной методикой осаждения, с генетической композицией, представленной ДНК-ДНК гибридизацией, осуществляют для получения информации относительно регуляции экспрессии генов С протеинов. Зонды генов С протеинов используют для скринирования хромосомной ДНК от других типов Streptococcus и других бактериальных патогенов.
Зонды получают и метят генов С протеинов изолятов Streptococcus группы В, которые включают большинство исходных типирующих штаммов, использованных Lancefield (Lancefield, R.C., et al., J. Exp. Mod. l42:l65-179 (1975). Блотты колоний 24 клинических и лабораторных изолятов Streptococcus группы В скринируют, используя микротитровальную методику, описанную ранее. Способность различных штаммов гибридизоваться с С протеиновыми генами сравнивают затем с фенотипическими характеристиками этих организмов по связыванию с типирующей антисывороткой, направленной против С протеинов. Таким образом оказывается возможным определить, какой из штаммов содержит какие-либо или все С протеиновые гены и могут ли некоторые штаммы содержать молчащие или скрытые копии этих генов.
Те штаммы, которые гибридизуются с С протеиновыми генными зондами на блоттах колоний, затем скринируют, используя геномные Саузернблотты для определения размера, структуры и расположения их С протеиновых генов. Хромосомные ДНК, выделенные из тех штаммов Streptococcus группы В, которые демонстрируют связывание на блоттах колоний, переваривают рестрикционными эндонуклоазами, обрабатывают на агарозном геле и осуществляют блоттинг на нитроцеллюлозе. Таким образом, оказывается возможным определить, существуют ли различия в положении и размерах этих генов в различных серотипах Streptococcus группы В и сравнить клинические (то есть потенциально верулентные) изоляты с лабораторными штаммами (и с теми, которые колонизованы клинически, но не связаны с инфекцией).
Зонды генов С протеинов также предпочтительно использовать для скринирования других стрептококковых штаммов и различных патогенных бактерий. Стрептококковые штаммы, как известно, включены в другие протеины, связанные с вирулентностью, включая М и G протеины (Fahnestock, S.R., et al., J.Bact. 167(3): 870-880 (1986), Heath, D.G., et al., Infect, and Immun. 55:1233-1238 (1987), Scott, J.R. et al., Infect, and Immun. 52:609-6l2 (1986), Walker, J. A. еt al., Infect, and Immun. 55:1184-1189 (1987)).
Подлежащие тестированию штаммы вначале скринируют, используя блотты колоний для определения того факта, имеют ли они гомологичные последовательности с генными зондами С протеинов. Затем приготавливают Саузернблотты с хромосомными ДНК бактериальных штаммов, которые оказались позитивными в тестах на блоттах колоний. Затем эти блотты зондируют С протеиновыми генами как участок С протеина для локализации и определения участков гомологичности, таких, которые служат в качестве мембранного якоря, связывается с Fс участком иммуноглобулинов или разделяет участки гомологичности с другими генами, которые имеют аналогичные функции в других бактериях.
Пример 10.
Модификация С протеиновых генов Streptococcus группы B
Ряд свойств, потенциально связанных с вирулентностью, был приписан С протеинам, включая устойчивость к опсонизации и ингибирование внутриклеточного киллинга после фагоцитоза (Рауne, N.R. et al., J. Infect. Dis. 151: 672-681 (1985), Payne, N. R. , еt al. , Infect, and Immun. 55:1243-1251 (1987)).
Для лучшего понимания роли С протеинов в вирулентности, конструируют изогенные штаммы, в которых гены С протеина индивидуально подверглись мутации. Эти штаммы тестируют на вирулентность в модели с новорожденными крысами (Zeligs, B. J. et al., Infec. And Immun. 37:255-263 (1982)). Для создания изогенных штаммов можно использовать два метода для оценки роли С протеинов в вирулентности Streptococcus группы В. Предпочтительно использовать транспозонный мутагенез с самоконьюгативным транспозоном Тn316. В другом варианте можно использовать сайтнаправленный мутагенез. Отсутствие эффективных способов генетической манипуляции в Streptococcus группы В делает необходимым разработку новых генетических методик для модификации генов в Streptococcus группы В и создания изогенных штаммов для изучения вирулентности (Lopilato, J. et al., Mol. Gen. Genet. 205:285-290 (1986)).
Транспозонный вставочный мутагенез является общепринятой методикой для конструирования изогенных штаммов, которые отличаются по экспрессии антигенов, связанных с вирулентностью, и его использование в Streptococcus группы В подробно описано (Caparon, M.G., et al., Proc. Natl. Acad. Sci. USA 84: 8677-8681 (1987), Rubens, С. E. , et al., Proc. Natl. Acad. Sci. USA 84: 7208-7212 (1987), Wanger, A.R. Res. Vet. Sci. 38:202-208 (1985), Weiser J.N. Trans. Assoc. Amer. Phys. 98:384-391 (1985), которые включены сюда по ссылке). Рubens et al. продемонстрировали применимость Tn916 в исследованиях капсул Streptococcus группы В (Rubens C.E., Proc. Natl. Aсad. Sci. USA 84: 7208-7212 (1987).
Самоконьюгирующийся транспозон можно получить из Streptococcus faecalis. В Streptococcus группы В, как было указано ранее (Wanger, A.R., Rev. Vet. Sci. 38: 202-208(1985)). Штаммы отбирают на предмет приобретения маркера устойчивости к антибиотикам, и скринируют блотты колоний на отсутствие экспрессии С протеинов, что определяется по специфической антисыворотке, полученной как указано ранее. Изоляты, которые по-видимому не экспрессируют С протеины, можно далее картировать, используя геномные Саузернблотты для локализации вставок внутри гонов С протеинов. Исходный Tn916 штамм содержит tetR; однако недавно в Tn9l6 было клонирован маркер устойчивости к эритромицину (Rubens, С.Е. et al., Plasmid 20:137-142(1988)). Необходимо показать, что после мутагенеза с Tn916 только одна копия транспозона содержится в мутантном штамме и что транспозон локализован внутри гена С протеина.
Применение такой методики для делеwии генов С протеина в Streptococcus группы В является простым, если гены С протеинов существенны для выживания Streptococcus группы В. Однако были описаны штаммы Streptococcus группы В, которые не содержат никаких детектируемых С протеинов, и, что необычно для бактериальных вирулентных детерминант, являются существенными генами для выживания ин витро. Дополнительное использование Tn916, которое можно поэксплуатировать, состоит в идентификации потенциальных регуляторных элементов генов С протеинов.
В тех случаях, когда желательны специфически определенные мутации, или если ген С протеина существенен для жизнеспособности Streptococcus группы В, можно использовать методику сайтнаправленного мутагенеза (например, для получения кондиционных мутантов). Таким образом, сайтнаправленный мутагеноз можно использовать для генетического анализа протеинов Streptococcus группы В. Одна проблема, которая задержала разработку этой методики для Streptococous группы B, состоит в трудности трансформирования Streptococcus группы В. Было показано, что электропорация является ценной для введения ДНК в бактерии, которые затруднительно трансформировать другим путем (Shigekawa, K. et al. Biotech. 6:742-751(198). Условия трансформирования Streptococcus группы В за счет электропорации можно использовать для того, чтобы обойти это препятствие. Таким образом возможно вводить гены С протеинов в штаммы Streptococcus группы В, которые не экспрессируют С протеины. Для встраивания генов нативных или подвергшихся мутации С протеинов в штаммы Streptococcus группы В можно использовать любой из нескольких подходов. Так например, маркер устойчивости к лекарству можно встроить в клоны генов С протеина в pUX12 маркер устойчивости к лекарству, который можно экспрессировать в Streptococcus группы В, но который обычно там отсутствует, предпочтителен. Этот модифицированный pUX12 протеиновый клон трансформируют в Streptococcus группы В, используя электропорацию (Shigekawa, К. et al., BioTech. 6: 742-751 (1988)).
Так как плазмида pUX12 не может реплицироваться в Streptococcus группы В, те штаммы, которые обладают фенотипом устойчивости к лекарству по-видимому могут сделать за счет гомологической рекомбинации между гоном С протеина на хромосоме GB хозяина и мутированным С протеином, содержащимся в pUX12 плазмиде. Эти мутанты скринируют, как указано ранее. Если в реципиентном штамме нет гомологичных последовательностей, возможно сконструировать вектор с геном С протеина, вставленным в известный стрептококковый ген, то есть нативный маркерный ген устойчивости к лекарству из Streptococcus группы В. После электропорации такую плазмидную конструкцию можно интегрировать в хромосому за счет гомологичной рекомбинации.
В другом варианте модифицированные гены С протеина можно вводить в хромосому Streptococcus группы В за счет встраивания генов в самоконьюгирующийся транспозон Тn916 и введения модифицированных транспозонов путем скрещивания из Streptococcus faeсalis. Эту методику используют для успешной модификации Tn916 геном эритромицина, и встраивают этот ген в хромосому Streptococcus группы В (Rubens С.E., et al., Plasmid 20:137-142 (1988). Необходимо показать, что после мутагенеза Tn916 только одна копия транспозона содержится в мутантном штамме и что этот транспозон расположен внутри гена С протеина.
Пример 11.
Оценка роли С протеинов в вирулентности Streptococcus группы В
Первоначальные исследования, в которых сравнивают штаммы Streptococcus группы В, которые содержат и не содержат С протеины, включают изоляты, о которых не было известно, что они изогенны (Ferrieri, R. et al., Rev. Inf. Dis. 10(2):1004-1071 (1988)).
Поэтому было невозможно определить, связаны ли различия в наблюдаемой вирулентности с С протеинами или с какими-либо другими вирулентными детерминантами. Конструирование изогенных штаммов, содержащих либо интактные гены С протеинов, либо делеции генов С протеинов, позволяет определить роли С протеина в вирулентности. Штаммы предпочтительно тестируют на новорожденных крысах на предмет вирулентности и на модели защиты мышей относительно их иммунологических характеристик. Вторым важным тестом вирулентности является способность гена сохранять вирулентность на протяжении реверсии аллельной замены в мутантном штамме. Встраивая гены С протеина в штаммы Streptococcus группы В, которые либо не содержат гена, либо которые содержат инактивированные гены С протеина, имеется возможность определить эффект С протеина за счет определения вирулентности полученной конструкции в вышеупомянутых животных моделях.
Изогенные штаммы Streptococcus группы В, в которых гены С протеинов индивидуально подверглись мутации, можно создать, используя либо транспозонный мутагенез, либо сайтнаправленный мутагенез. Такие штаммы предпочтительно охарактеризованы по геномным Саузернблоттам, для определения того одна лишь вставка присутствует на хромосоме. Положение этих вставок можно определить, используя методики структурного генетического картирования, которые обсуждались ранее. Затем изогенные штаммы тестируют на вирулентность в модели на новорожденных крысах (Zeligs, B.J. et al., Infect. and Immun. 37: 255-263 (1982)).
Транспозонный мутагенез позволяет идентифицировать гены, включенные в регуляцию экспрессии С протеинов. Так например, штаммы, несущие гены протеинов С дикого типа, которые, как обнаружено, более не экспрессируют С протеины после транспозонного мутагенеза и в которых транспозон не расположен в структурном гене С протеина, содержат мутации в последовательностях, включенных в регуляцию экспрессии генов С протеинов. Этот подход используют успешно для характеризации mry локуса в Streptococcus группы А, который включен в регуляцию М протеина (Caparon, M.G. et. al., Proc. Natl. Acad. Sci. USA 84: 8677-8681(1987), Robbins J.C. et. al., J. Bacteriol. 169:5633-5640 (1987)). Такие способы можно также использовать для получения штаммов, которые сверхэкспрессируют С протеины или которые продуцируют С протеины с измененной вирулентностью или иммунитетом.
Пример 12.
Локализация С протеинов Streptococcus группы В и оценка их способности связываться с иммуноглобулинами Lancefield и другие показали, что антитела к С протеинам связываются с внешними мембранами Streptococcus группы В (Lancefield P. С. , et al., J. Exp. Med. 142:165-179 (1975), Wagner, В., et al., J. Gen, Microbiol. 118:95-105 (1980)).
Это предполагает, что С протеин представляет собой внешний мембранный протеин. С протеины можно также выделить из надосадочных жидкостей культур Streptococcus группы В, что указывает, что эти протеины могут либо быть секретированы Streptococcus группы В, либо в большом количестве потеряны с клеточной поверхности. Последовательности ДНК и протеина, полученные из генов С протеинов, оказались жизнеспособными при определении структуры и функций С протеинов. Одной потенциальной вирулентной детерминантой, обычно описываемой для С протеинов, является способность связываться с иммуноглобулином, IgА (Ferrieri, R., et al., Rev. Inf. Dis. 10(2):1004-1071 (1988) Russel-Jones, G.J. et al., Exp. Med. 160:1467-1475 (1984)).
Для локализации детерминант клеточной поверхности, которые определяются специфическим антителом, используют иммуноэлектронную микроскопию. Антисыворотку, выработанную против клонов С протеинов Streptococcus группы В, инкубируют со штаммами Streptococcus группы В, которые содержат С протеины. Для определения антигена на клеточной поверхности используют Ferritin коньюгированный козлиный антикроличий igG, как было указано ранее (Rubens, C.E. , et al., Proc. Natl. Acad. Sci. USA, 84:7208-7212 (1987), Wagner, B. et al. , J. Gen. Microbiol. 118:95-105 1980)).
Простое определение способности С протеинов связываться с иммуноглобулинами можно оценить, используя Вестернблотты. Клеточные экстракты как от E. coli клонов, содержащих гены С протеинов, так и штамма Streptococcus группы В, которые содержат С протеины, можно обработать на SDS-PAGE и получить блотты на нитроцеллюлозе. Контроль включает экстракты E.coli, содержащие дикого типа pUX12 плазмиду, штаммы Streptococcus группы В, которые не содержат гены С протеина, и изогенные штаммы Streptococcus группы В, в которых гены С протеинов были инактивированы. Вестернблотты можно зондировать индивидуально мечеными иммуноглобулинами, например IgG, IgM, IgA, и их компонентами, например, Fc или F(ab)2 фрагментами (Heat, D.G. et al., Infect, and Immun. 55:1233-1238 (1987), Russel-Jones et al., J. Exp. Med. 160:1467-1475 (1984)).
Иммуноглобулины предпочтительно иодировать, используя либо иодоген, либо хлорамин Т.
Более специфичный способ определения способности С протеинов связываться с иммуноглобулинами и их компонентами включает выделение С протеинов и их использование непосредственно в анализе на связывание (Fachnestock S.R. et al. , J. Bact. 167(3):870-880 (1986), Heat, D.G. et al., Infect. and Immun. 55: 1233-1238 (1987)). Используя последовательность протеина, можно выделить С протеин. Кроме того, так как возможно также экспрессировать гены С протеинов в Е.соli, можно сконструировать штаммы Е.coli, которые избыточно продуцируют С протеины, и за счет этого получить более крупные количества С протеинов для очистки.
Пример 13.
Использование клонированных антигенов С протеинов Streptococcus группы В в коньюгатной вакцине
Вышеописанные защитные антигены С протеинов Streptococcus группы В тестируют по их потенциалу в коньюгатной вакцине. Для оценки этого потенциала клеточные экстракты Е.coli, содержащие pJMS1 или pJMS23, приготавливают, как было указано ранее, и используют для иммунизации кроликов. Полученную антисыворотку тестируют в модели летальности мышей по ее способности защищать мышей от инфекции Streptococcus группы В штамма Н36В. Штамм Н36В содержит С протеин Streptococcus группы В. В качестве контроля определяют способность антисыворотки защищать мышей против инфекции Streptococcus штамма 515 (который не содержит С протеина). Результаты этого эксперимента представлены на фиг. 4.
Пример 14.
Последовательность альфа-антигена С протеина и его повторяющихся звеньев
Как было указано ранее, Streptococcus agalactine (Streptococcus группы В (GBS)) является важным патогеном в сепсисе и менингитах новорожденных, послеродовых эндометритах и инфекциях взрослых, в частности в диабетах, и у хозяев с нарушенный иммунитетом (Bakеr, C.J. et al. Infections Diseases of the Fetus and Newborn Infant, Remington, J.S. et al., Saunders, Philadelphia, (1990) pp. 742-811)).
Лучше всего изученные GBS вирулентные детерминанты являются типоспецифическими капсулярными полисахаридами, которые существенны для патогенеза (Rubens, С.E. ef al., Proc. Natl. Acad. Sci. USA 84:7208-7212 (1987); Wеssels, M.R., et al., Proc. Natl. Acad. Sci. USA 86:8983-8987 (1989)).
Роль GBS поверхностных протеинов в инфицировании понятна меньше (Ferrieri, P. Rev. Infect. Dis. S363-S366 (1988); Michel, J.L., et al., in Genetics and Molecular Biology of Streptococci, Lactocoсci, and Enterococci, Dunny, G.M. et al., eds., Am. Soc. Microbiol., Washington (1991), pp. 214-218).
С протеины являются ассоциированными с поверхностью антигенами, которые экспрессируются большинством клинических изолятов капсулярного типа. Iа, Ib и II, как известно, играют роль как в вирулентности, так и в иммунитете (Johnson, D.R., et al., J. Clin. Microbiol. 19:506-510 (1984); Madoff, L.C., et al. , Infect. Immun. 59:2638-2544 (1991). Два С протеиновых антигена, альфа и бета, были описаны биохимически и иммунологически (Michel, J.L. et al. , in Genetics and Molecular Biology of Streptococci, Lactococci, and Entercoссi, Dunny, G. M. et al. , eds., Am. Soc. Microbiol., Washington (1991), pp. 214-218).
В 1975 г. Lancefield et al., (Lancefield, R.C. et al., J. Exp. Med. 142: 165-179 (1975)) показал, что антитела, выработанные против С протеинов у кроликов, защищают мышей при заражении GBS, содержащими С протеины. Моноклональное антитело к альфа-антигену (4G8), которое индуцирует опсоновый киллинг GBS и защищает мышей от летального заражения GBS, было описано (Madoff, L.C. et al., Infect. Immun. 59:204-210 (1991), включено сюда по ссылке). Как было показано ранее, ген, кодирующий альфа- и бета-антигены, был клонирован и экспрессирован в E.coli. Было показано, что антитела, выработанные против клонов как альфа, так и бета, кодируют различные с протеины, которые определяют уникальные защитные эпитопы (Michel, J.L. et al., Infect. Immun. 59: 2023-2028 (1991)).
Альфа- и бета-протеины являются независимо экспрессруемыми и антигенно различными протеинами.
С протеин бета-антигена, который специфически связывается с IgA сывороткой человека, был клонирован (Michel, J. L.l at al., Infect. Immun. 59: 2023-2028 (1991); Cleat P.H. at al., Infect. Immun. 55:1151-1155 (1987) и секвенирован (Нeden, L. -O., et al., Eur. J. Immunol. 21:1481-1490 (1991); Jerlstrom, P. G. at al., Mol. Microbiol. 5:843-849 (1991)). Однако роль бета-антигена и IgA связывания в вирулентности неизвестна. Исследования Ferrieri et al. (Payne, N.R. et al., Infect. Immun. 151: 672-681 (1985); Payne N. R. , et al., Inf. Immun. 55:1243-1251 (1987)) показали, что штаммы GBS, содержащие С протеины, устойчивы к фагоцитозу и ингибируют внутриклеточный киллинг. Опсонофагоцитный киллинг в присутствии альфа-антиген-специфичного моноклонального антитела (4G8) непосредственно коррелирует с возрастанием молекулярной массы альфа-антигена и с количеством альфа-антигенов, экспрессируомых на поверхности бактериальных клеток (Madoff, L.C., et al., Infect. Immun. 59:2638-2644(1991)). В GBS штаммы, экспрессирующие альфа-антиген, оказываются устойчивыми к киллингу за счет полиморфоядерных лейкоцитов в отсутствие специфического антитела; однако эта устойчивость не зависит от размера альфа-антигена.
Полная нуклеотидная последовательность bca и фланкирующих участков, сообщаемая здесь, обеспечивает информацию относительно размера, структуры и состава гена альфа-антигена. Интересной особенностью как нативного, так и клонированного генных продуктов альфа-антигена является то, что они демонстрируют протеиновую гетерогенность за счет экспрессирования повторяющейся "лестницы" протеинов, отличаясь примерно на 8000 Да (Madoff, L.C., et al., Infect. Immun. 59:2638-2644 (1991); Michel, J.L. et al., Infect. Immun. 59:2023-2023 (1991).
Так как защитное моноклональное антитело 4G8 связывается с повторяющимся участком, этот участок определяет защитный эпитоп (Madoff, L.C. Infect. Immun. 59:2023-2028 (1991)).
Более мелкие тандемно повторенные последовательности, кодирующие иммунодоминантные эпитопы, как сообщалось, имеются во многих патогенах, но их не связывали с протеиновой гетерогенностью, наблюдаемой в альфа-антигенах (Enеs, V., et al., Science 225:628-630 (1984); Fishetti, V.A., et al., Rev. Infect. Dis. 10 (Supp 2):S356-S359 (1988); Pereira, M.E., et al., J. Exp. Med. 174:179-191 (1991); Fiachetti, V.A., et. al., in Genetics and Molecular Biology of Streptococci, Lactococci, and Enterococci, Dunny et. al., eds. Am. Soc. Microbiol., Washington (1991), pp. 290-294; Dailey. D.C., et al., Infect. Immun. 59:2083-2088 (1991); vonEichel-Streiber, C., et al., Gene 96: 107-113 (1990)).
Хотя максимальный размер молекулы альфа-антигена различен среди штаммов GBS, эта протеиновая гетерогенность является постоянной отличительной чертой (Madoff, L.C. Infect. Immun. 59:2633-2644 (1991)).
Нуклеотидная последовательность bca содержит девять идентичных 246-нуклеотидных тандемных повторяющихся звеньев. Оценка размера пептипа, кодируемого каждым из этих повторов, составляет 8665 Да и коррелирует с интервалами, обнаруженными в гетерогенном построении "лестницы" альфа-антигена. Аминокислотная последовательность, полученная из ДНК последовательности, выявляет как значительную гомологию, так и важные различия между альфа-антигеном и другими стрептококковыми протеинами (Heden, L.-O., et al., Eur. J. Immunol. 21: 1481-1490 (1991); Jerlstrom, P.G., et al., Mo1. Microbiol. 5: 843-849 (1991); Fischetti, V.A., et al., in Genetics and Molecular Biology of Streptococci, lactococci, and Enterocooci, Dunny et al., Am. Soc. Microbiol., Washington (1991), pp. 290-294).
Повторяющиеся звенья альфа-антигена предполагают возможный механизм фенотипичного и генотипичного разнообразия и представляют природные сайты для генной перестройки, которая может создавать антигенное разнообразие.
Материалы и методы
Бактериальные штаммы, плазмиды, транспозоны и среды.
Были описаны GBS штамм А909 (тип Ia/c) (Lancefield, R.C., et al., J. Exp. Med. 142:165-179 (1975), E. coli штаммы МС 1061 и ДК1 (Ausubel, F.M. et al. , Current Protocols in Mol. Biology, Wiley, New York (1990)), pCNB (Lopilato, J. et al., Mol. Gen. Genetic 205:285-290 (1986), ДН5α (производное ДН1; GIBCO(BRL) и NK-8032; Е.coli плазмиды и клоны pUX12, pUC12 и pJMS23, и транспозон Tn5seq1 (Miсhel, J.L., et al., Infect. Immun. 59: 2023-2028 (1991)). Плазмиду pGEM-7Zf(-) получили от Promega Madison, WI, USA. Дополнительные клоны pJMS23 (pJMS23-l, -7, -9 и -10) описаны далее. Среда для выращивания GBS и E.coli и антибиотики для селекции были описаны (Michel, J.L., et al., Infect. Immun. 59:2023-2028 (1991)).
ДНК Процедуры и стретегия секвенирования нуклеотидов
Стандартные процедуры получения плазмидной ДНК, синтеза и очистки олигонуклеотидов, картирование рестрикционными эндонуклеазами, электрофорез в агарозном геле и Саузернблоттинг описаны у (Ausubel, F.M., et al., Current Protocols in Molecular Biology, Wiley, New York (1990)).
Рестрикционные эндонунлеазы и другие энзимы для манипулирования с ДНК (такие как ДНК-аза, РНК-аза и лигаза) были получены от New England Biolabs and Boehringer Manneheim.
В транопозонном мутагенезе использовали лямбда- Tnseq1 (Nag, D.K. et al. , Gene 64:135-145 (1988)).
В нуклеотидном секвенировании двунитевой ДНК использовали плазмиды, содержащие транспозонные Tnseq1 вставки, используя праймеры Sp6 или Т7 промоторов для секвенирования в двух направлениях, синтетические олигонуклеотидные праймеры и "гнездные" делеции, используя Еrаsе-а-Ваsе (Promega, Madison, WI, USA; Henikoff, S. Gene 28:351 (1984)). Всего 12 праймеров приготавливают для получения последовательности в обоих направлениях для областей фланкирующего ген повторяющегося участка. Секвенирование участка повторяющейся ДНК завершают гнездной делецией, создаваемой экзонуклеазой III. Во всех секвенированиях используют набор для секвенирования, версия 2, в соответствии с указаниями изготовителей для двухнитевого секвенирования (United States Biochemical).
Аденозин 5'-(α[35S)тиотрифосфат получают от Amersham. Набор GenAmpPCR с AmpliTaq полимеразой используют в соответствии с указаниями изготовителей (Perkin-Elmer/Cetus).
Субклоны pJCS23-I, pJM323-7 и pJMS23-10 получают для транспозонного мутагенеза для того, чтобы пометить более мелкие участки в bca (Michel, J.L. , et al., Infects Immun. 59:2023-2028 (1991)). Субклон pJMS23-1 содержит 5,9 kb HindIII фрагмент в рUX12; pJMS23-7 содержит 2,8 kb AluI фрагмент из pJMS23-1, лигированный в HincII сайт в полилинкере pUC12; и pJMS23-10 является BsaBI/SmaI двойным переваром рестрикционной эндонуклеазой pJMS23-7, что дает 2,3 kb вставку, содержащую повторяющийся участок. Для "гнездных" делеций AluI фрагмент из pJMS23-1 лигируют в SmaI сайт на pGЕM-7Zf(-) для создания pJMS23-9. Гнездные делеции конструируют в прямом направлении от HindIII и Nsi I сайтов и в обратном направлении от EcoRI и Sph I сайтов. Размеры субклонов, мутантов и делеций, использованных для секвенирования были подтверждены картированием рестрикционными эндонуклеазами и/или PCR с праймерами для pUC12 полилинкера и для Tn5seqI (Sp6 и Т7).
В анализе данных использовали компьютер отдела молекулярной биологии при Массачусетской общей больнице (Бостон) с программным обеспечением Genetic Computer Groups (Madison WI) версия 7 и сеть BLAST национального центра биотехнологической информации национального института здравоохранения (Bethesda, MD).
Моноклональные антитела, SDS/PAGE и Вестерн-иммуноблоттинг.
Экстракты GBS и E.coli протеинов, SDS/PAGE, иммуноблоттинг и зондирование моноклональным антителом 4G8 альфа-антигена осуществляют по способу Madoff, L. C. et al., Infect. Immun 59:2638-2644 (1991), там же 59:2638-2644 (1991), то же 59:204-210 (1991) и Michel. J.L. at al., Infect. Immun. 59: 2023-2028 (1991).
Результаты
Нуклеотидная последовательность bca. Субклоны pMS23, которые кодируют bca локус из GBS штамма А909 (тип IА/С) и экспрессируют альфа-антиген в Е. coli, используют для определения последовательности bca (Michel. J.L., et al. , Infect. Immun. 59:2023-2028 (1991)). Как часто бывает в случае, когда грамположительные гены клонируют в E.сoli, многие из субклонов оказываются нестабильными (Schneewind et al., Infect Immun. 56:2174-2179 (1988)). Эта проблема усложняется в bca большим участком ДНК с повторяющимися последовательностями, которые обеспечивают множество фиксированных сайтов для гомологических рекомбинаций.
Сами по себе гомологические рекомбинации могут целенаправленно использовать преимущество создания популяции рекомбинантных хозяев, которые экспрессируют различные функциональные производные альфа-антигена. Такая популяция должна быть смесью альфа-антигенов и их функциональных производных и может быть использована в вакцинах настоящего изобретения для получения широкого круга последовательностей альфа-антигена, против которых хозяин может направить иммунную реакцию.
Для проверки того, кодирует ли pJM323 полный нативный ген без делеций, Саузернблотты геномной ДНК из А909 зондируют генными фрагментами из клона. Не обнаружено различий в рестрикционных клетках bca между А909 и pJMS23. Получают полную нуклеотидную последовательность bca независимо для обоих штаммов, исполвзуя три подхода: транспозонный мутагенез Tn5seqI, синтетические олигонуклеотидные праймеры и гнездные делеции за счет экзонуклеазы III (фиг. 5).
Полная нуклеотидная последовательность bca локуса и полученная аминокислотная последовательность для отдельной открытой считывающей райки представлены на фиг. 6. Структурный ген состоит из 3063 нуклеотидов, кодирует 1020 аминокислот и имеет расчетную молекулярную массу 108705 Да. Существует прокариотная промоторная консенсусная последовательность (ТАТААТ) в обратном направлении (при -10) от инициирующего кодона (Doi, R.H., et al., Microbiol. Rev. 50: 227-243 (1986)). Не существует чистых гомологов на -35 участке, в предположении размещения 5-19 оснований в обратном направлении от -10 участка (Hawley, D.K., et al., Nucleic Acid Res. 11:2237-2255 (1983)).
Вероятный рибосомный связывающий сайт, фланкирующий 5' конец bса является AGGAGA (Shine J. et al., Proc. Natl. Acad. Sci. USA 71:1342-1346 (1974); Gold, L. et al., Annu. Rev. Microbiol. 38:365-403 (1981)).
В прямом направлении от ТАА кодона терминации находятся два участка с диадной симметрией, которые могут функционировать как терминаторы транскрипции (Brendel, et al., Nucleic Acid Rev. 12:4411-4127 (1984)).
Полученная аминокислотная последовательность зрелого пептида bca предсказывает рКa= 4,49, что близко к экспериментальному значению как для нативного, так и для клонированного альфа-антигена С протеинов. Альфа-антиген не содержит цистеина, а только один метионин у кодона инициирования. Альфа-антиген богат пролином (11% в зрелом протеине), но не демонстрирует XPZ звена, идентифицированного в бета-антигене С протеина GBS (Heden, L.-O. et al., Еur. J. Immunol. 21:1481-1490 (1991); Jerlstrom, P.G., et al., Mol. Microbiol. 5: 843-849 (1991)) или повторных звеньев пролина, описанных для М протеина стрептококков группы А (Fischetti, V.A., et al., Mol. Microbiol. 4: 1603-1605 (1990)).
Определенная сигнальная последовательность bса и гомологи
В качестве протеина, связанного с клеточной поверхностью, альфа-антиген может использовать сигнальную последовательность, подлежащую экспорту из цитоплазмы. BLAST поиск идентифицировал пять грамположительных поверхностных протеинов с гомологией к первым 41 аминокислотам альфа-антигена (фиг. 7А). На основании структур, описанных для других грамположительных сигнальных последовательностей, кажется, что первые 41 аминокислот альфа-антигена содержат сигнальную последовательность (vonHeijne G. Eur. J. Biochem. 133: 17-21 (1983); vonHeijne G. et al., FEBS Lett. 244:439-446 (1989)). Существует большая доля аргининовых и лизиновых остатков вблизи N конца, с последующим гидрофобным участком, серином в положении 36 и валином в положении 41. Другие возможности являются расщеплениями после валина в положении 54 или любой из аланиновых остатков в положениях 55 и 56, которые следуют после серина в положении 52. Предположив, что сигнальная последовательность расщепляется после аминокислоты 41, зрелый протеин должен содержать 979 аминокислот с молекулярной массой 104106 Да. Это предполагает, что сигнальная последовательность кодируется 123 нуклеотидами, что составляет до 4% гена и имеет молекулярную массу 4616 Да. Дальнейшая поддержка сигнальной последовательности этого размера следует из сравнения Вестернблоттингом размеров нативного и клонированного альфа-антигенов, зондированных моноклональным антителам 4G8. Как представлено на фиг. 8, каждая из "ступенек" альфа-антигенной протеиновой "лестницы" из клона pJMS23 несколько больше, нежели для нативного протеина из GBS A909, что предполагает, что эта сигнальная последовательность может не быть процессирована в Е.coli, как это было бы в GBS. Разность в размерах составляет около 4 кДа, что соответствуетболее короткой (41 аминокислота), нежели более длинной (53-55 аминокислот) сигнальной последовательности в bca.
Анализ N-конца в bca
После предположительной сигнальной последовательности существует участок из 185 аминокислот перед повторяющимися последовательностями. N-терминальный участок содержит 555 нуклеотидов, что составляет 18% гена, и кодирует полипептид с предсказанной молекулярной массой 20417 Да. Компьютерный поиск сравнения первичной нуклеотидной последовательности и полученной аминокислотной последовательности во всех шести считывающих рамках N-конца bca c последовательностями в банке генов (GenBank и Swiss-Prot, используя сеть BLAST программ, не обнаружил гомологов, что предполагает, что этот участок гена по-видимому ранее не был секвенирован или не была описана последовательность нуклеиновых кислот или аминокислот.
Участок повторяющихся звеньев bсa
Начиная с аминокислоты 679 ДНК последовательности, существует девять крупных тандемных повторяющихся звеньев с идентичными структурами нуклеиновых кислот и аминокислот, которые охватывают 74% гена. Размер и повторяющийся характер этого участка bca проиллюстрированы на фиг. 9. Каждое повторяющееся звено состоит из 246 нуклеотидов, кодирующих 82 аминокислоты с расчетной молекулярной массой 8665 Да. Полный повторяющийся участок содержит 749 аминокислот и состоит из девяти идентичных повторяющихся звеньев и частично повторяющееся звено обозначено 9'. Расчетная молекулярная масса этого участка составляет 79053 Да.
Определение начала и конца повтора несколько спорно.
Так, определение начинается с N-конца, начиная с первого кодона, который был в открытой считывающей рамке. При желании повторяющиеся звенья можно также определить как начинающиеся вне рамки или начинающиеся со стороны С-конца. BLAST компьютерный поиск гомологов нуклеиновых кислот и производных аминокислот не показывает значительной совместимости для повторяющихся звеньев. Поэтому эти повторяющиеся звенья по-видимому уникальны для альфа-антигена и отличаются по размеру и структуре от тех, которые описаны для других стрептококковых протеинов (Heden, L.-O., et al., Eur. J. Immunol. 21: 1481-1490 (1991); Jerlstrom, P.G., et al., Mol. Microbiol. 5:843-849(1991); Fischetti, V. A. et al., in Genetics and Molecular Biology of Streptococci, Lactococci, and Enterococci, Dunny et al., eds. Am. Soc. Microbiol., Washington (1991), pp. 290-294; Yother, J., et al., J. Bacteriol. 174: 601-609 (1992)).
С-терминальный якорь bca и гомологов
После повторяющихся звеньев следует небольшой С-терминальный участок, содержащий 148 нуклеотидов и составляющий 4,4% гена. Этот участок кодирует 45 аминокислот с расчетной молекулярной массой 4672 Да. BLAST поиск на предмет аминокислотных гомологов, идентифицирующих поверхностные протеины класса грамположительных с общим мембранным якорным звеном (фиг. 7В), включая М протеины Streptococcus группы В и IgG, связывающие протеины из обоих групп А и G Streptococcus (Wren, B.W., Mol. Microbiol. 5:797-803 (1991)). Аминокислотный состав С конца является характеристичным для пептидного мембранного якоря, включая гидрофильный участок с лизином перед LPXTGE (посл. IД и 2) звено (фиг. 7В)(Fishetti, V.A., Mol. Microbiol. 4:1603-1605 (1990)).
После него следует гидрофобный участок с консенсусом PPFFXXAА (посл. IД I), где Х обозначает гидрофобную аминокислоту. И наконец, существует гидрофильный хвост, который заканчивается аспарагиновой кислотой, которая, предположительно, простирается в цитоплазму клетки.
Анализ нуклеотидной последовательности и определенный протеин альфа-антигена
На фиг. 9 проиллюстрированы 4 различных участка внутри открытой считывающей рамки bca, как определено из нуклеотидной и полученной аминокислотной последовательностей. График гидрофобности аминокислотной последовательности показывает, что предположительная сигнальная последовательность должна быть короткой, с гидрофильным N-концом, с последующим гидрофобным участком и должна кончаться в гидрофильном участке, тогда как С-пептидный мембранный якорь содержит гидрофобный wall-spanning домен и небольшой гидрофильный хвост (Engelman, D. M. , et al. Annu. Rev. Biophys., Biophys. Chem. 15:321-353 (1986); Kyte, J., et al., J. Mol. Biol. 157: 105-132 (1982)).
Нативный альфа-анитген демонстрирует лестницу полипептидов с регулярно повторяющимися интервалами, что также видно с клонированным генным продуктом (фиг. 8). Размер отдельных повторов в bca может кодировать полипептид 8665 Да, что соответствует размеру разностей в протеиновой лестнице. Для поиска возможного механизма, создающего протеиновую гетерогенность, bca нуклеотид и полученную РНК и протеиновые последовательности исследуют. Анализ нуклеотидной последовательности bca не показал кодонов внутри повторяющихся участков, которые могли бы вызывать раннее окончание трансляции. Кроме того, аминокислотная последовательность повторяющегося участка была скринирована с помощью Genetic Computer Groups программы на предмет потенциальных сайтов протеолитического расщепления. Уникальный сайт внутри каждого повтора оказался чувствительным к рН 2,5 что представлено аспарагиновой кислотой с последующим пролином. Однако эти сайты были также обнаружены в N-конце. Хотя альфа-антиген относительно устойчив к трипсину, существует множество трипсиновых потенциальных сайтов расщепления в этой последовательности и, наконец, моделируя РНК-последовательность и третичную структуру, не удается идентифицировать участки внутри повторов, которые могли бы быть вовлечены в процесс саморасщепления за счет РНК.
Обсуждение
Два биологических свойства, идентифицированных для альфа-антигена, GBS представляет способность противостоять опсомофагоцитозу в отсутствии специфического антитела и экспрессию эпитопов, которые вызывают выработку защитных антител (Madoff, L.C. et al., Infect. Immun. 59:2636-2644 (1991); Lancefield, R.C., et al., J. Bxp. Med. 142:165-179 (1975); Payne, N.R., et al., J. Infect. Dis. 151: 672-681 (1985); Payne, N.R., et al., Infect. Immun. 55: 1243-1251 (1987)). Анализ последовательности альфа-антигена показывает четыре различных структурных домена. Предположительная N-терминальная сигнальная последовательность и С-териинальный мембранный якорь подтверждают гипотезу о том, что альфа-антиген является протеином, связанным с поверхностью мембраны. Эти свойства, наряду с повторяющимся звеном, свойственны ряду грамположительных протеинов, которые, как считают, вовлечены в патогенез бактериальных инфекций (Fischetti, V.A., et al., in Genetica and Molecular Biology of Streptococci, Lactococci, and Enterococci, Dunny et al. des. Am. Soc. Microbiol., Washington (1991), pp. 290-294).
Последовательность альфа-антигена определяет крупные, идентичные тандемные повторы, составляющие 74% гена и не демонстрирующие гомологичности с описанными ранее протеиновыми или нуклеиновокислотными последовательностями. Однако ряд протеинов, связанных с вирулентностью, содержит множество повторяющихся элементов. M протеин Streptococcus группы А, который является антифагоцитныи, содержит защитные эпитопы и демонстрирует вариабельность в размере антигена и презентации, содержит два протяженных тандемных участка и один нетандемный повторяющийся участок, занимающие почти две трети гена (Fischetti, V.A., Rev. Infect. Dis. S356-R359 (1988); Hollingshead, S.K., et al. , J. Biol. Chem. 26l:l677-1686 (1986); Haanes, E.J., et al., J. Bacteriol. 171:6397-6408 (1989)).
Отдельные повторы меньше в М протеине, нежели в альфа-антигене и размер их составляет от 21 до 81 пары оснований. Кроме того, существует различие между повторяющимися звеньями на концах участка повторов, хотя то, которые находятся в середине, почти идентичны. Пневмококковый поверхностный протеин А содержит участок, содержащий вплоть до 10 повторяющихся сегментов из 20 аминокислот каждый (Yother, J. et al., J. Bacteriol. 174:601-609 (1992). Как М протеин, так и пневмококковый поверхностный протеин А, демонстрируют антигенную вариабельность и изменения в размере протеин/гена, хотя это происходит за счет повторяющихсяДНК последовательностей в их структурных генах (Fishetti, V.A., et al., in Genetics and Molecular Biology of Streptococci, Lactococci, and Enterococci, Dunny et al., eds. Am. Soc. Microbiol. Washington (1991), pp. 290-294; Yother, J. et al., J. Bacteriol. 174:601-609 (1992); Haanes, E.J., et al., J. Bacteriol. 171:6397-6408 (1989)).
Другие грамположительные гены с повторяющимися звеньями, включают гены гликотрансферазы из Streptococcus sorblnus и Streptococcus mutans (Ferretti, J. J. et al. , J. Bacteriol. 169:4271-4278 (1987); Shirosa, Т. et al., J. Bacteriol. 170:810-816 (1988)). Иммунодоминантные эпитопы, связанные с повторяющимися последовательностями, были идентифицированы в ряде других патогенов, включая Rickettsia rickettsii, Trichomonas vaginalis, and Clostridium difficile (Dailey, D.C., et al., Infect. Immun. 59: 2083-2088 (1991); Anderson, B. E. , et al., Infect. Immun. 58:2760:2769 (1990); vonEichel-Streiber, C., et al., Gene 96:107-113 (1990)).
Повторы, найденные в альфа-антигенах, уникальны по трем причинам:
(i) они крупнее, чем те, которые найдены для гругих грамположительных поверхностных протеинов,
(ii) они идентичны по уровню нуклеиновых кислот и нет расхождения,
(iii) размер протеина, кодируемого повторяющимися звеньями, соответствует "лестнице", наблюдаемой у нативных и клонированных альфа-антигенов.
Обнаружение крупных тандомных повторяющихся звеньев вызывает много вопросов о генотипной и фенотипной вариабельности альфа-антигена. Если зондируют Вестерн-иммуноблотты 4G8 моноклональным антителам, как нативный, так и клонированный альфа-антиген демонстрируют регулярную лестницу протеинов, варьирующуюся примерно на 7 кДа, а размер альфа-антигена варьируется в зависимости от штамма (Madoff, L. C. , et al., Infect. Immun. 59:2638-2644 (1991)). Картирование рестрикционными эндонуклеазами исходного альфа-антигена клона pJMS23 демонстрирует множество Sty фрагментов около 270 пар основания (Michel, J. L. infect, Immun. 59:2023-2028 (1991)). Так как штамм А909 содержит только одну копию bca, было предположено, что эти фрагменты могут быть ответственны за гетерогенность протеина. Нуклеотидные последовательности подтверждают повторяющуюся природу гена, но не идентифицируют механизм протеиновой "лестницы".
Так как для нативного и клонированного протеина наблюдают многочисленные размеры и так как нет доказательства семейства генов, мы постулируем, что такое образование лестницы происходит за счет механизма, общего как для Е. coli, так и для GBS, и/или осуществляется за счет свойства, специфического для альфа-антигена. Вестернблотты на тn5 транспозонных вставочных мутациях внутри повторяющегося участка все еще демонстрируют образование лестницы, что показывает, что С конец не требуется для гетерогенности, что дает возможность предположить, что либо N конец, либо повторяющийся участок определяют образование лестницы.
Исследования альфа-антигена среди GBS изолятов с использованием моноклонального антитела показывает, что максимальный размер молекул альфа-антигена постоянен для данного изолята, но меняется в широких пределах среди различных изолятов (Madoff, L.C., et al., Infect. Immun. 59:2638-2644 (1991)).
Тандемные повторяющиеся звенья могут обеспечить удобные фиксированные сайты рекомбинации для делении или дубликации повторяющегося участка. Делеции приведут к уменьшению размера гена и могут произойти во время ДНК репликации за счет неравного перекрывания неспаренных темплатных проскальзываний, которые должны наблюдаться в рамке (Harayama, S. et al., J. Bacteriol. 173: 7540-7548 (1991)). Публикация ДНК может быть механизмом умножения мутаций внутри повтора и создания антигенного разнообразия. Однако у нас нет доказательств того, что вариации размеров протеинов альфа-антигена сопровождаются антигенным разнообразием и экспрессией различных защитных или опсонных эпитопов.
Девять полных тандемных повторов в альфа-антигене из А909 идентичны на уровне нуклеиновых кислот, что демонстрирует высокую консервативность структуры. Это предполагает, что дубликация, вызываемая повторами, является новым событием и что существуют свойства внутреннего характера для повторов, которые поддерживают их целостность, или что их структуры существенны для гена. Саузернблотты геномной ДНК из штаммов GBS, содержащих альфа-антиген, зондированные альфа-антигенспецифичными ДНК, демонстирируют вариабельность в размере генов среди штаммов. Для поиска механизма генотипного разнообразия среди штаммов необходимо клонировать и секвенировать bса из других фенотипичных вариантов, и определить филогенное родство среди содержащих С протеин штаммов GBS (Michel, J. L. , et al., in Genetics and Molecular Biology of Streptococci, Lactococci, and Enterococci, Dunny, G.M., et al., eds., Am. Soc. Microbiol., Washington (1991), pp. 214-218; Michel, J.L., et al., Infect. Immun. 59: 2023-2026 (1991); Cleat, P.H., et al., Infect. Immun. 55: 1151-1155 (1987); Heden, L.-O. et al., Eur, J. Immunol. 21:1481-1490 (1991); Lindahl, G. at al., Eur. J. Immunol. 20:2241-2247 (1990)).
Поэтому в заключение можно сказать, что Востернблотты как нативного альфа-антигена, так и клонированного генного продукта, демонстрируют регулярный лестничный характер гетерогенных полипептидов. Нуклеотидная последовательность bсa локуса имеет открытую считывающую рамку из 3060 нуклеотидов, кодирующих предшественник протеина в 108705 Да. Расщепление предполагаемой сигнальной последовательности из 41 аминокислоты приводит к получению зрелого протеина в 104106 Да. 20417-ДаN-терминальный участок альфа-антигена показывает отсутствие гомологичности с ранее описанными протеиновыми последовательностями, и за ним следует серия из девяти тандемных повторяющихся звеньев, что составляет вплоть до 74% зрелого протеина. Каждое из повторяющихся звеньев идентично и состоит из 82 аминокислот с молекулярной массой 8665 Да, которые кодированы 246 нуклоотидами. Размер повторяющихся звеньев соответствует различиям в наблюдаемых размерах гетерогенной лестницы альфа С протеинов, экспрессируемых GBS. С-терминальный участок альфа-антигена содержит мембранный якорный доменовый фрагмент, который одинаков для ряда грамположительных поверхностных протеинов. Крупный участок идентичных повторяющихся звеньев в Bbcа определяет защитные эпитопы, и его структуру можно изменить для конструирования защитных вакцин, которые направлены на фенотипическое и генотипическое разнообразие альфа антигена.
Пример 15.
Вакцина, содержащая альфа-антиген С протеина и функциональное производное, содержащее по крайней мере одно нативное повторяющееся звено.
Вышеописанные защитные функциональные производные альфа-антигена С протеина (такие, как протеиновые фрагменты N, C, N-C, R1, R2, R3, R4, R5, R6, R7, R8, R9, N-R1, N-R2, N-R3, N-R4, N-R5, N-R6, N-R7, N-R8, N-R9, R1-C, R2-C, R3-C, R4-C, R5-C, R6-C, R7-C, R8-C, R9-C, N-R1-C, N-R2-C, N-R3-C, N-R4-C, N-R5-C, N-R6-C, N-R7-C, N-R8-C или N-R9-С) можно получить рекомбинантным способом, используя рокомбинантные методы, аналогичные тем, которые описаны ранее для клонирования и экспрессии нативного альфа-антигена Streptococcus группы В и бета-антигена в таком хозяине, как E.coli. Можно использовать любую методику синтеза целевой последовательности функционального производного альфа-антигена, включая те, которые были описаны ранее для рекомбинантной продукции этих протеинов, и те, которые описаны Williams J.I. в патенте США 5089406 "(Method of Producing a Gene Cassete Coding for Polypeptides with Repeating Amino Acid Sequences" and McPherson, M.J. ed. Directed Mutagenesis, A Partial Approach" IRL Press, New York, 1991.
Рекомбинантно экспрессированные вышеописанные функциональные производные защитных альфа-антигенов протеина С (например, протеиновые фрагменты, N, C, N-C, R1, R2, R3, R4, R5, R6, R7, R8, R9, N-R1, N-R2, N-R3, N-R4, N-R5, N-R6, N-R7, N-R8, N-R9, R1-C, R2-C, R3-C, R4-C, R5-C, R6-C, R7-C, R8-C, R9-C, N-R1-C, N-R2-C, N-R3-C, N-R4-C, N-R5-C, N-R6-C, N-R7-C, N-R8-C, или N-R9-C) можно выделить при желании из рекомбинантного хозяина или среды, используя методики, известные специалистам, а затем тестировать по их потенциалу в коньюгатной вакцине.
Каждый вид пептидов можно тестировать отдельно или в сочетании с другими пептидами. Для оценки их потенциала клеточные экстракты Е.celi, содержащие рекомбинантные плазмиды, приготавливают, как указано ранее, и используют для иммунизации кроликов. Полученную антисыворотку тестируют в модели на летальность у мышей по их способности защищать мышей от инфицирования штаммом Н36В Streptococcus группы В. Штамм Н36В содержит С протеин Streptococcus группы В. В качестве контроля способность антисыворотки защищать мышей от инфицирования штаммом 515 Streptococcus (который не содержит С протеина), определяют.
Аналогичный анализ можно использовать для оценки коньюгированной формы, где пептид коньюгирован с полисахаридом Streptococcus группы В, используя вышеуказанную методику, известную специалистам. Предпочтительно, чтобы это был капсидный полисахарид Streptococcus группы В. Коньюгаты используют также для иммунизации кроликов. Полученную антнсыворотку тестируют на модели летальности мышей по их способности защищать мышей от инфекции штаммом Н36В Streptococcus группы В. Штамм Н36В содержит С протеин Streptococcus группы В. В качестве контроля определяют способность антнсыворотки защитить мышей от инфекции Streptococcus штаммом 515 (который по содержит С протеина).
Хотя все вышеизложенное относится к конкретным предпочтительным вариантам, следует понимать, что настоящее изобретение этим не ограничивается. Специалистам должны быть очевидны различные модификации, которые можно осуществить для раскрытых вариантов, и что такие модификации также должны входить в объем настоящего изобретения.
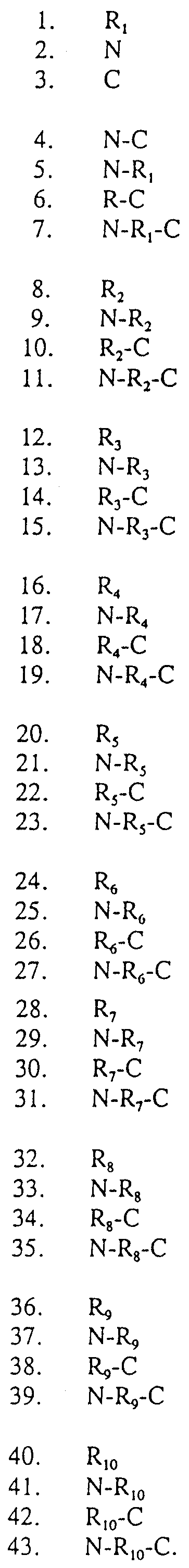












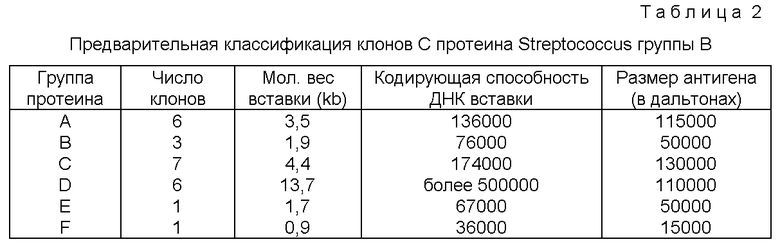
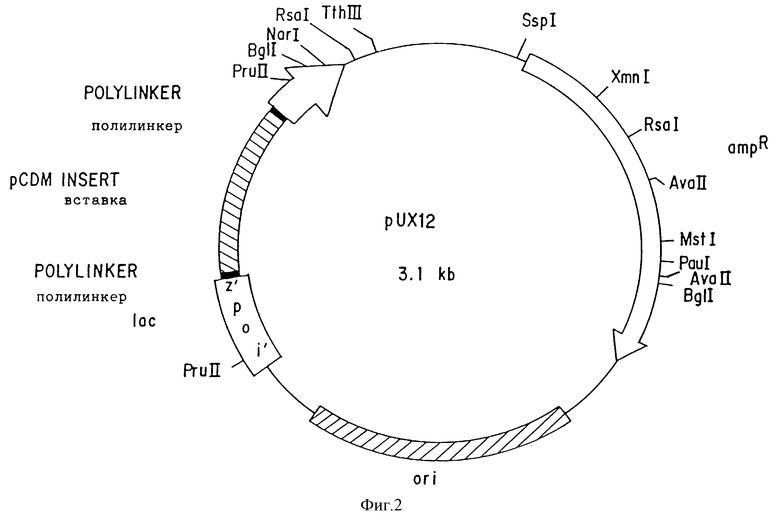
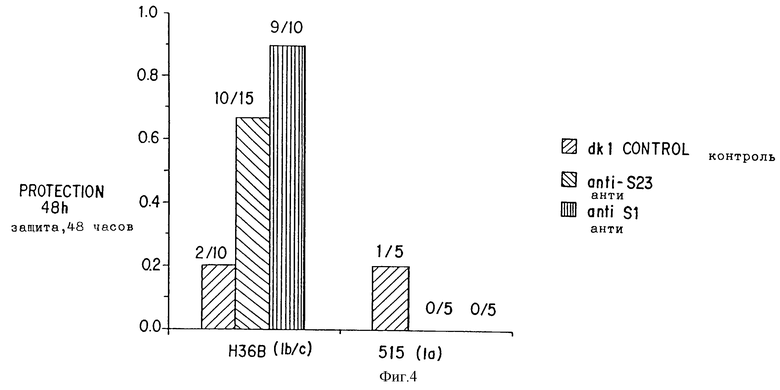
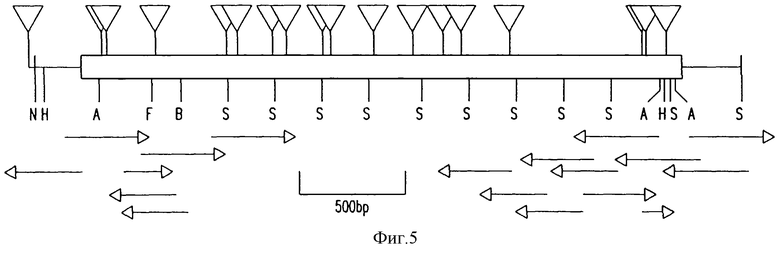
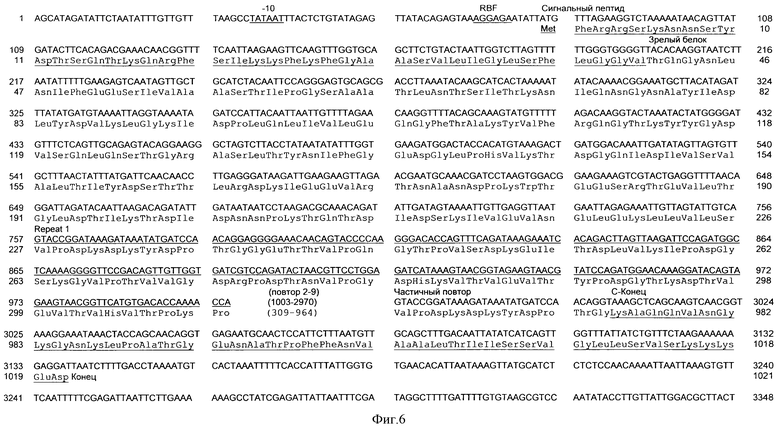



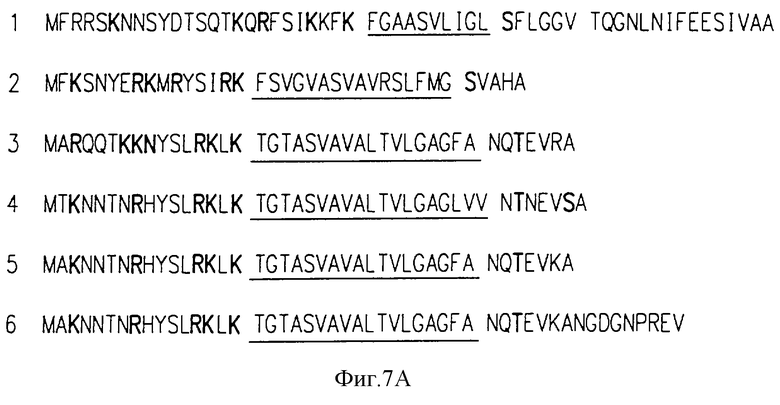



Изобретение относится к области биотехнологии и может быть использовано для получения конъюгированной вакцины, способной создавать иммунитет к инфекции Streptococcus группы В. Для получения С белка альфа-антигена Streptococcus группы В или его функционального производного используют рекомбинантную молекулу ДНК. Данная ДНК кодирует антиген, выбранный из группы N, C, N-C, Rx, N-Rx, Rx-C, N-Rx-C и N-R9`-C, где N - 5 фланкирующая аминокислотная последовательность, а в Rx, х - целое число и является числом повторяющихся копий последовательности из 82 аминокислот, R9` - последовательность аминокислот, состоящая из комбинации последовательности R9 с дополнительно частично повторяющейся последовательностью, кодируемой частью НП в положениях 1003-1035. Функциональное производное антигена выбирают из группы N, C, R1, R2, R3, R4, R5, R6, R7, R8, R9, R9` и Rx, или N-C, N-R1 до N-Rx, или R1-C до Rx-C, или N-R1-C до N-R9-C, при этом производное включает по крайней мере 10 повторяющихся R-единиц. Рекомбинантная ДНК способна экспрессировать белок, его фрагмент или его производное в бактериальных клетках, при этом нуклеотидная последовательность ДНК может быть оперативно связана с промотором. Для экспрессии белка в клетке используют плазмидный вектор. Использование изобретения позволяет получать вакцину, способную придавать пациенту иммунитет к инфекции, вызываемой Streptococcus группы В. 2 с. и 7 з.п. ф-лы, 13 ил., 2 табл.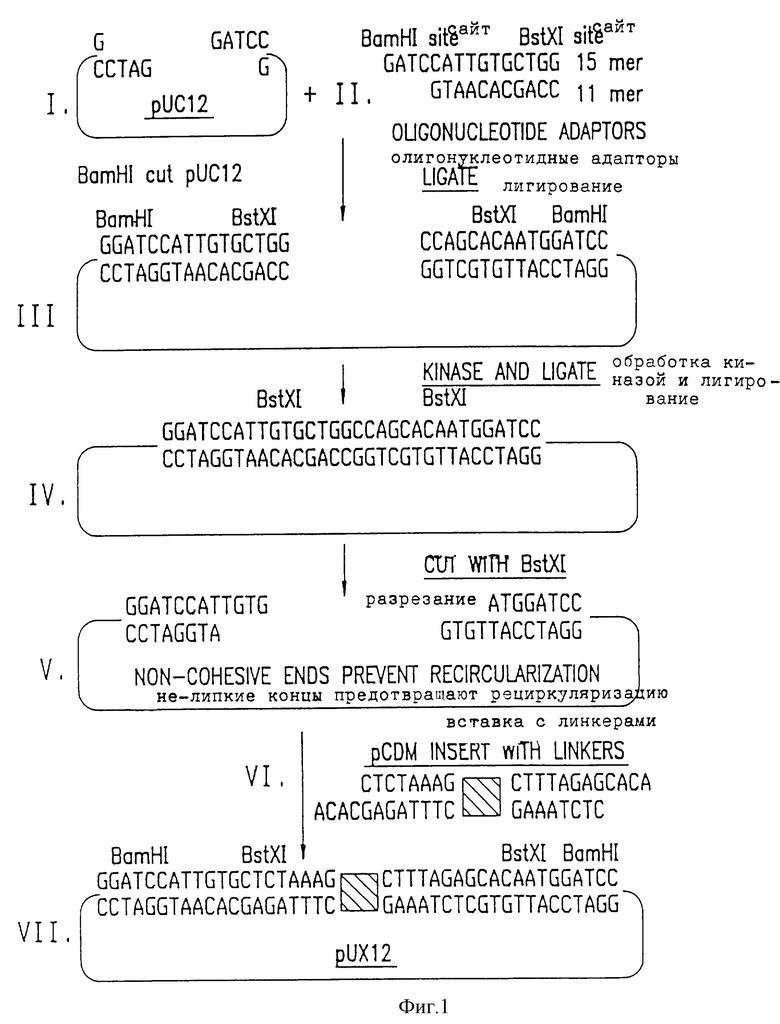
| J | |||
| MICHEl et al., J | |||
| Inf | |||
| Immun., v.59, №6, 1991, р.2023-2028 | |||
| WO 8706267 А, 22.10.1987. |
Авторы
Даты
2003-07-27—Публикация
1993-11-02—Подача