Настоящее изобретение относится к функциональным протеин-тирозин-киназным химерам, которые обладают способностью "переключать" функции иммунной системы. В частности настоящее изобретение относится к регуляции лимфоцитов, макрофагов, натуральных клеток-киллеров или гранулоцитов путем экспрессии в указанных клетках химерных молекул, которые активируют эти клетки для ответа на мишени, распознаваемые указанными химерами. Настоящее изобретение также относится к функциональным протеин-тирозин-киназным химерам, которые способны направлять терапевтические клетки на специфическое распознавание и разрушение клеток, инфицированных специфическим инфекционным агентом, самого инфекционного агента, опухолевой клетки или аутоиммунногенной клетки. Более конкретно, настоящее изобретение относится к продуцированию протеин-киназных химер, способных активировать цитотоксические T-лимфоциты на распознавание и лизис клеток, экспрессирующих белки ВИЧ-оболочки. Поэтому настоящее изобретение также относится к лечению заболеваний, таких как СПИД (синдром приобретенного иммунодефицита), вызываемых вирусом ВИЧ.
Предшествующий уровень техники
В основе ряда иммунологических явлений лежит распознавание антигена Т-клетками посредством T-клеточного рецептора. T-клетки регулируют так называемый клеточный иммунитет. Функции клеточного иммунитета заключаются в разрушении клетками иммунной системы чужеродных тканей или инфицированных клеток. Существует несколько видов T-клеток, а именно, клетки-"хелперы" и клетки-"супрессоры", которые модулируют иммунный ответ, и цитотоксические клетки (или клетки-"киллеры"), которые способны непосредственно разрушать аномальные клетки.
T-клетка, которая распознает уникальный антиген, находящийся на поверхности других клеток, и связывается с ним, становится активированной, после чего она может размножаться, и если эта T-клетка является цитотоксической клеткой, то она может разрушить связанную клетку.
Аутоиммунные заболевания характеризуются продуцированием антител, которые реагируют с хозяйской тканью, либо иммунных эффективных T-клеток, которые являются аутореактивными. В некоторых случаях аутоантитела могут продуцироваться благодаря нормальному иммунному ответу, опосредованному T- и B-клетками, активированными чужеродными факторами или микроорганизмами, которые содержат антигены, перекрестно реагирующие с аналогичными соединениями в тканях организма. Примерами клинически релевантных аутоантител могут служить антитела против ацетилхолиновых рецепторов при миастении (myasthenia gravis) и антитела против ДНК, эритроцитов и тромбоцитов при системной красной волчанке.
ВИЧ и иммунопатогенез
В 1984 году было обнаружено, что этиологическим фактором, вызывающим СПИД, является ВИЧ. С тех пор определение СПИДа несколько раз пересматривалось в целях установления критериев, которые должны быть учтены при диагностике СПИДа. Однако несмотря на отклонения в диагностических параметрах, "наименьшим общим знаменателем" при диагностике СПИДа является ВИЧ-инфицирование с последующим развитием устойчивых симптомов, свидетельствующих о генерализации патологического процесса и возникновении заболеваний, характерных для СПИДа, таких как вторичные инфекции, опухоли и неврологические расстройства (Harrison's Principles of Internal Medicine, 12th ed., MoGraw Hill (1991)).
ВИЧ представляет собой ретровирус человека группы лентивирусов. Известны четыре ретровируса человека, принадлежащие к двум различным группам, а именно T-лимфотропные ретровирусы человека (возбудители лейкоза) типа 1 (HTLV-1) и типа 2 (HTLV-2), и вирусы иммунодефицита человека ВИЧ-1 и ВИЧ-2. Первые два вируса являются трансформирующими вирусами, тогда как два последних являются цитопатическими вирусами.
ВИЧ-1 был идентифицирован как наиболее распространенный возбудитель СПИДа, поражающий людей во всем мире. Гомология последовательностей ВИЧ-1 и ВИЧ-2 составляет примерно 40%, причем ВИЧ-2 является более близко родственным некоторым членам группы вирусов иммунодефицита обезьян (SIV). См. Curran J. et al. , Science, 329: 1357-1359 (1985); Weiss E. et al., Nature, 324: 572-575 (1986).
Помимо обычных ретровирусных генов (env, gag и pol) ВИЧ имеет еще шесть дополнительных генов, ответственных за репликацию и другие биологические функции вирусов. Как было установлено ранее, общим критерием СПИДа является глубокая иммуносупрессия, главным образом, супрессия клеточно-опосредованного иммунитета. Указанная иммуносупрессия приводит к заболеваниям, вызываемым условно-патогенными агентами, в частности к возникновению некоторых инфекций и опухолей.
Было установлено, что главной причиной иммунологических нарушений при СПИДе является количественная и качественная недостаточность в субпопуляции лимфоцитов, образующихся в тимусе (T-лимфоцитов), а именно популяции T4. Эта субпопуляция клеток может быть определена фенотипически благодаря присутствию на их поверхности молекулы CD4, которая, как уже было продемонстрировано, является рецептором для ВИЧ (Dalgleish et al., Nature, 312: 763 (1984)). Хотя клетки T4 являются главным типом клеток, инфицированных вирусом ВИЧ, однако, в принципе, любая клетка человека, экспрессирующая молекулу CD4 на своей поверхности, может связываться с ВИЧ и быть инфицированной этим вирусом.
Обычно CD4+-T-клеткам приписывают роль хелпера/индуктора благодаря их функции, заключающейся в передаче активационного сигнала B-клеткам, или индуцирования T-лимфоцитов, несущих реципрокный маркер CD8 с образованием цитотоксичных/супрессорных клеток (Reinherz & Schlossman, Cell, 19: 821-827 (1980); Goldstein et al., Immunol. Rev. 68: 5-42 (1982)).
Посредством определенного аминокислотного участка вирусной оболочки (gp120) ВИЧ специфически и с высокой степенью аффинности связывается с частью V1-области молекулы CD4, расположенной близ N-конца этой молекулы. После связывания вирус сливается с мембраной клетки-мишени и интернализуется. После интернализации вирус использует обратную транскриптазу для транскрипции своей геномной РНК в ДНК, которая интегрируется в клеточную ДНК и присутствует в ней в течение всей жизни клетки в качестве "провируса".
Этот провирус может оставаться латентным либо он может быть активирован, и тогда происходит транскрипция интегрированной вирусной ДНК с образованием мРНК и геномной РНК, что приводит к синтезу белков и сборке новых вирусных частиц, которые отпочковываются от клеточной поверхности. Хотя точный механизм, посредством которого вирус вызывает гибель клетки, пока не установлен, однако имеется предположение, что в основе этого механизма лежит активная репликация и отпочкование вируса от клеточной поверхности, что приводит к разрыву плазматической мембраны клетки и нарушению осмотического равновесия.
В процессе инфицирования в организме хозяина вырабатываются антитела вирусных белков, включая главные капсидные гликопротеины gp120 и gp41. Однако несмотря на включение этого гуморального иммунитета, заболевание, вызываемое вирусом прогрессирует, и приводит к летальной иммуносупрессии, характеризующейся множеством условно-патогенных инфекций, паразитемией, деменцией и смертью. Недостаточное для прекращения развития болезни продуцирование противовирусных антител является одним из самых тревожных и внушающих беспокойство аспектов процесса инфицирования, а поэтому проведение вакцинации на основе стандартных методик не предвещает положительных результатов.
В повышении эффективности гуморального ответа на вирусы иммунодефицита могут сыграть роль два фактора. Во-первых, аналогично другим РНК-вирусам (в частности, другим ретровирусам), вирусы иммунодефицита обнаруживают высокую частоту мутаций в ответ на иммунологический контроль хозяина. И, во-вторых, гликопротеины оболочки, сами по себе, являются в высокой степени гликозилированными молекулами, представляющими новые эпитопы, подходящие для высокоаффинного связывания с антителом. "Слабая" антигенная мишень, которой является вирусная оболочка, дает возможность хозяину немного ограничивать вирусную инфекцию путем продуцирования специфических антител.
Клетки, инфицированные вирусом ВИЧ, экспрессируют на своей поверхности гликопротеин gp120. Этот гликопротеин опосредует явления слияния, происходящие между CD4+-клетками посредством реакции, аналогичной процессу внедрения вируса в неинфицированные клетки, что приводит к образованию короткоживущих многоядерных гигантских клеток. Образование синцития зависит от прямого взаимодействия капсидного гликопротеина gp120 с белком CD4 (Dalgleish и др. , см. выше; Klatzman D. и др., Nature, 312: 763 (1984); Mc Dougal J.S. и др. , Science: 231: 382 (1986); Sodroski, J. и др., Nature, 322: 470 (1986); Lifson J.D. и др., Nature, 323: 725 (1986); Sodrosky J. и др., Nature, 321: 412 (1986)).
Свидетельством того, что CD4-gp120-связывание ответственно за вирусную инфекцию клеток, несущих CD4-антиген, было установление того факта, что между gp120 и CD4 образуется комплекс (Mc Dougal и др., см. выше). Другими исследователями было показано, что клеточные линии, которые не являлись инфективными для ВИЧ, превращались в инфицируемые клеточные линии после трансфекции и экспрессии кДНК-гена CD4 человека. Maddon и др., Cell, 46: 333-348 (1986).
Несколькими группами исследователей были предложены и успешно продемонстрированы in vitro терапевтические программы, основанные на использовании растворимого CD4 в качестве пассивного агента для восприпятствования вирусной адсорбции и синцитий-опосредованной клеточной трансмиссии (Denn et al., Nature, 3321: 82-84 (1988); Fisher et al., Nature, 331: 76-78 (1978); Hussey et al. , Nature, 331: 78-81 (1988); Smith et al., Science, 238: 1704-1707 (1987); Traunecker et al., Nature, 331: 84-86 (1988)); а затем были получены гибридные белки иммуноглобулинов CD4, имеющие более продолжительный период полужизни и невысокую биологическую активность (Capon et al., Nature, 337: 525-531 (1989); Traunecker et al., Nature, 339, 68-70 (1989); Byrn et al., Nature, 344: 667-670 (1990); Zeltlmeissl et al., DNA Cell Biol 9: 347-353 (1990)). Хотя CD4-иммунотоксиновые конъюгаты или белки слияния обнаруживают сильную цитотоксичность против инфицированных клеток in vitro (Chadhary et al. , Nature, 335: 369-372 (1988); Till et al., Science, 242: 1166-1168 (1988)), однако латентность синдрома иммунодефицита вряд ли позволит добиться эффективного снятия вирусной нагрузки с помощью лишь одного курса терапии, а антигенность чужеродных белков слияния будет, вероятно, ограничивать их переносимость при лечении, требующем введения многократных доз. Испытания, проведенные на обезьянах, зараженных SIV, показали, что растворимый CD4, при его введении животным, не обнаруживающим заметной CD4-цитопении, может снижать титр вируса SIV и улучшить in vitro-измерение миелоидного потенциала (Watanabe et al., Nature, 337: 267-270 (1989)). Однако после прекращения обработки наблюдалось быстрое восстановление вирусного титра, что дает основание предположить, что для предупреждения прогрессирующего ослабления иммунной системы может оказаться необходимым длительное введение.
Протеин-тирозин-киназы, ассоциированные с рецепторами клеточной поверхности
Первоначальным стимулом для внедрения клеточных эффекторных программ в иммунную систему часто является распознавание клетками лигандных кластеров. Из известных рецепторов, способных к передаче активационных сигналов после агрегации, являются B-клеточные и T-клеточные рецепторы для антигена (De Franco, 1992, Eur. J. Biochem., 210: 381-388; Weiss, 1991, Annu, Rev. Genet. 25: 487-510), члены семейств иммуноглобулиновых (IgG и IgE) Fc-рецепторов (Fanger et al., 1989, Immunol. Tooay 10: 92-99; Ravetch & 1991, Annu. Rev. Immunol. , 9: 457-492), и ряд дополнительных рецепторов, включая CD2, CD4, CD8 и CD28, находящихся на поверхности T-клеток (Yokoyama & Shevach, 1989. Year. Immunol. , 4: 110-146), CD19, CD20, CD21 и CD40 на B-клетках (Clark & Ledbetter, 1989, Adv. Cancer. Res., 52: 81-149), и CD44, CD45 и CD58, присутствующие на моноцитах (Webb et al., 1990, Science 249: 1295-1297). Кроме того, большое число белков, связанных с фосфолипидом, стимулируют клеточную активацию зависимым от антигенного рецептора образом при их перекрестном связывании на поверхности T-клеток (Balk & Terhorst, 1989, Immunol. Ser. 45: 411-416; Kroczek et al. , 1986, Nature 322: 181-184; Yel et al., 1987, J. Immunol., 138: 91-97; Yokoyama & Shevach 1989, Year Immunol., 4: 110-146).
До сих пор остается неясным, каким образом простое физическое явление, такое как агрегация, приводит к явно детектируемому физиологическому сигналу. Введение клеточных эффекторных программ, опосредованных T-клеточными и B-клеточными рецепторами для антигена и различными формами Fc-рецептора, может быть имитировано путем перекрестного связывания химерных белков, несущих внутриклеточные домены отдельных цепей рецепторных комплексов (Irving & Weiss, 1991, Cell 64: 891-901; Kolanus et al., 1992, EMBO, J. 11: 4861-4868; Letourneur & Klausner, 1991, Proc. Natl. Acad. Sci. USA 88; 8905-8909; Letourneur & Klausner, 1992, Science 255: 79-82; Romeo & Seed, 1991, Cell 64: 1037-1046; Wagener et al., 1992, Cell 68: 83-95). Очевидно, что минимальный элемент, необходимый для эффективного "запуска", требует присутствия филогенетически консервативной (Reth, 1989, Nature 338: 383-384) пептидной последовательности, содержащей два тирозиновых остатка, разделенных 10 или 11 остатками и включенных в гидрофильное, обычно кислотное окружение ("контекст") (Romeo et al., 1992, Cell 68: 889-897; Irving et al., 1993, J. Exp. Meo. 177, 1093-1103). Образование рецепторных кластеров, несущих указанный элемент, способствует активации каскада событий, для которого, вероятно, главным является активность протеин-тирозин-киназы (PTK); причем ингибиторы PTK блокируют ранние события при B- и T-клеточной активации, такие как мобилизация кальция, с последующим высвобождением цитокинов и пролиферацией клеток (June et al., 1990, J. Immunol., 144: 1591-1599; Lane et al., 1991, J. Immunol. , 146: 715-722; Mustelin et al., 1990, Science, 247: 1584-1587; Stanley et al., 1990, J. Immunol., 145: 2189-2198). Хотя более отдаленные последствия рецепторной активации различаются в зависимости от типа клеток, однако ранние события для клеток от разных гематопоэтических линий дифференцировки поразительно схожи между собой. Например быстрое возрастание PTK-активности наблюдалось после перекрестного связывания B-клеточного рецептора для антигена (Gold et al., 1990, Nature 345: 810-813; Campbell & Sefton, 1990, EMBO J. 9: 2125-2131), T-клеточного рецептора для антигена (June, C.H., et al., 1990, Proc. Natl. Acad. Sci. USA 87: 7722-7726; June, C. H. et al. , 1990, J. Immunol. 144: 1591-1599), и высокоаффинный IgE-рецептор (Eiseman & Bolen, 1992, Nature 355: 78-80; Li et al., 1992, Mol. Cell, Biol. 12: 3176-3182), причем все они в качестве своих ранних мишеней фосфорилирования имеют γ -изоформу фосфатидилинозитол-специфической фосфолипазы C (Carter et al., 1991, Proc. Natl. Acad. Sci. USA 88: 2745-2749; Li et al., 1992, Mol. Cell. Biol. 12: 3176-3182; Park et al., 1991, J. Biol. Chem. 266: 24237-24240; Park et al., 1991, Proc. Natl. Acad. Sci USA, 88: 5453-5456; Secrist et al., 1991, J. Biol. Chem., 266: 12135-12139; Wiess et al. , 1991, Annu. Rev. Genet. 25: 487-510), которая непосредственно активируется путем тирозин-фосфорилирования (Nishibe et al., 1990, Science 250: 1253-1256).
Все известные в настоящее время активные PTK, ассоциируемые с рецепторами клеточной поверхности, делятся на два класса: ферменты, принадлежащие к семейству киназ, являющихся продуктами протоонкогенов Src, и ферменты, принадлежащие к недавно охарактеризованным киназам Syk. К первому классу относятся: Fyn-киназа, которая, как было показано, ассоциируется с T-клеточным рецептором (Gassman et al., 1992, Eur. J. Immunol. 22: 283-286; Samelson et al., 1990, Proc. Natl. Acad. Sci. USA. 87: 4358-4362); киназы Lyn, Fyn, Blk и Sck, которые, как было показано, ассоциируются с B-клеточным IgM-рецептором (Burkhardt et al., 1991, Proc. Natl. Acad. Sci. USA 88: 7410-7414; Campbell & Sefton, 1992, Mol, Cell, Biol. 12: 2315-2321; Yamanashi et al. , 1991, Science 251: 192-194); и киназы Lyn и Yes, которые, как было показано, ассоциируются с высокоаффинным IgE-рецептором (Eiseman & Bolen, 1992, Nature 355: 78-80; Hutchcroft et al., 1992, Proc. Natl. Acad. Sci. USA 89: 9107-9111; Hutchcroft, J. E. et al., 1992, J. Biol. Chem. 267: 8613-8619). Механизм наблюдаемой ассоциации пока точно не установлен, однако существует предположение, что внутриклеточные домены цепей рецепторного комплекса могут физически ассоциироваться с семейством Src-киназ (Clark et al., 1992, Science 258: 123-126; Timson Gauen et al., 1992, Mol. Cell. Biol. 12: 5438-5446). Причем до сих пор неясно, являются ли эти ассоциации прямыми или непрямыми.
В настоящее время одно из самых убедительных свидетельств важной роли, которую играют киназы семейства Scr в активации клеток, было получено в результате исследований Fyn-Lck-киназ в T-клетках. Сверхсинтез Fyn в трансгенных мышах приводит к получению антигенгиперреактивного фенотипа T-клеток, тогда как сверхсинтез каталитически неактивной формы блокирует пролиферацию, опосредованную T-клеточным рецептором (Cooke et al., 1991, Cell 65: 281-291). Тимусные T-клетки, выделенные от мутантных мышей, у которых отсутствует Fyn-киназная активность, обнаруживали глубокий дефицит в способности к увеличению пролиферации в ответ на обработку форболовым сложным эфиром в комбинации либо с антителом против CD3, либо с конкавалином A (Appleby et al., 1992, Cell 70: 751-763; Stein et al., 1992, Cell 70: 741-750). T-клетки селезенки, выделенные от этих мышей, обнаруживали менее сильное, но также значительное ослабление ответной клеточной активации (Appleby et al., 1992, Cell 70: 751-763; Stein et al., 1992, Cell 70: 741-750).
В T-клетках, киназа Lck непрямо ассоциируется с T-клеточным рецептором (TCR) посредством корецепторов CD4 и CD8 (Rudd et al., 1988, Proc. Natl. Acad. Sci. USA 85: 5190-5194; Shaw et al., 1989, Cell 59: 627-636; Turner et al. , 1990, Cell 60: 755-765; Veillette et al., 1988, Cell 55: 301-308). Сверхэкспрессия Lck в антиген-реактивной клеточной линии потенцирует восприимчивость рецептора таким же образом, что и в случае Fyn (Abraham & Veilette, 1990, Mol, Cell, Biol, 10: 5197-5206; Davidson et al., 1992, J. Exp. Med. 175: 1483-1492; Luo & Sefton, 1992, Mol, Cell, Biol. 12: 4724-4732). В модели CD4-зависимой мышиной T-клеточной гибридомы восстановление антиген-специфической хелперной функции может быть достигнуто только с помощью молекул CD4, способных взаимодействовать с Lck (Glaichenhaus et al., 1991, Cell 64: 511-520).
Однако самое убедительное доказательство прямого участия киназы Lck в передаче сигнала, опосредованной рецептором для антигена, было получено в результате исследований мутантных клеточных линий, в которых отсутствует Lck. Были исследованы две такие линии; одна из них происходила от T-клеточной линии лейкоза человека Turkat (Goldsmith & Weiss, 1987, Proc. Natl. Acad. Sci. USA 84: 6879-6883; Straus & Weiss 1992, Cell 70: 585-593), а другая происходила от клона мышиных цитотоксических T-клеток CTLL-2 (Karnitz et al., 1992, Mol, Cell, Biol, 12: 4521-4530). Обе эти Lck-негативные мутантные линии были дефектными в отношении TCR-опосредованной передачи сигнала, и комплементация любой мутантной линии путем трансфекции с помощью Lck-экспрессирующей плазмиды приводит к восстановлению чувствительности к раздражителям перекрестного связывания TCR (Karnitz et al., 1992. Mol. Cell. Biol. 12: 4521-4530; Straus & Weiss 1992, Cell 70: 585-593).
Недавно было показано, что члены нового семейства тирозин-киназ, первоначально представленные как киназы, близкородственные или идентичные киназам Syk (Taniguchi et al., 1991, J. Biol. Chem. 266: 15790-15796) и PTK 72 (Zioncheck et al., 1986, J. Buiol. Chem. 261: 15637-15643; Zioncheck et al., 1988, J. Bioll. Chem. 263: 19195-19202), ассоциируются с рецепторами клеточной поверхности. Хотя точного доказательства, что PTK 72 и Syk являются идентичными, представлено не было, однако имеются вполне определенные данные о том, что эти киназы имеют одинаковые распределения в тканях (тимусе и селезенке), молекулярные массы и лабильность в отношении протеолиза. Было показано, что PTK 72 ассоциируется с B-клеточным IgM-рецептором (Hutchcroft et al., 1992, Proc. Natl. Acad. Sci. USA 89: 9107-9111; Hutchcroft, J.E. et al. , 1992, J. Biol. Chem. , 267: 8613-8619), и фосфорилируется после перекрестного связывания рецептора с анти-IgM (Hutchcroft et al., 1991, J. Biol. Chem. 266: 14846-14849). Было продемонстрировано, что после перекрестного связывания поверхностного IgM имеет место сопутствующая активация фермента, измеренная по аутофосфорилированию и фосфорилированию экзогенного фрагмента белка (Hutchcroft et al., 1992, Proc. Natl. Acad. Sci. USA 89: 9107-9111; Hutchcroft, J. E. et al., 1992, J. Biol. Chem. 267: 8613-8619). Было также обнаружено, что PTK 72 ассоциируется с высокоаффинным рецептором IgE в базофильной клеточной линии лейкоза крыс (Hutchcroft et al., 1992, Proc. Natl. Acad. Sci. USA 89: 9107-9111; Hutchcroft, J.E., et al., 1992, J. Biol. Chem. 267: 8613-8619).
Второй член семейства Syk, а именно ZAP-70, представляет собой, как было показано, протеин-тирозин-киназу (PTK), ассоциирующуюся с дзета-цепью T-клеточного рецептора после перекрестного связывания рецептора (Chan et al., 1991, Proc. Natl. Acad. Sci. USA 88: 9166-9170). Хотя экспрессия ZAP-70, Fyn или Lck в клетках COS приводит к небольшому увеличению полного клеточного тирозинфосфата, однако коэкспрессия ZAP-70 с Lck либо с Fyn приводит к резкому увеличению уровня фосфорилирования по остаткам тирозина (Chan et al., 1992, Cell 71: 649-662). Причем, если также присутствует химера "CD8-дзета-цепь", то в этом случае химера становится фосфорилированной, а киназа ZAP-70 является ассоциированной с ней (Сhan et al., 1992, Cell 71: 649-662). До сих пор остается неясным, активирует ли киназа ZAP-70 семейства киназ Src и/или наоборот; и кроме того, остается неясным, почему коэкспрессия киназ в клетках COS приводит к заметной конститутивной активации. Тем не менее активное ассоциирование ZAP-70 с перекрестно связанным T-клеточным рецептором (TCR) дает основание предположить, что эта протеин-тирозин-киназа (PTK) играет определенную роль в передаче рецепторного ответа.
В отличие от киназ семейства Src киназы Syk и ZAP-70 содержат два домена SH2 и не имеют сайта N-концевого миристилирования (Taniguchi et al., 1991, J. Biol. Chem. 266: 15790-15796; Chan et al., 1992, Cell 71: 649-662). Естественно предположить, что механизм ассоциации киназы-рецептора предусматривает связывание двух доменов SH2 с двумя тирозинами мотивов запуска антигенного рецептора после их фосфорилирования. Однако это предположение пока еще остается только гипотезой.
Краткое описание изобретение
Настоящее изобретение иллюстрирует возможность создания химер между внутриклеточным доменом протеин-тирозин-киназной молекулы и внеклеточным доменом, способным к распознаванию мишени. В частности образование химерных кластеров, несущих Syk- или ZAP-70-киназные последовательности, стимулирует мобилизацию кальция. Агрегацию лишь Syk-химеры или коагрегация химер, несущих Fyn- или Lck- и ZAP-70-киназы, являются достаточными для инициации цитолитической эффекторной функции. Такая эффекторная функция облегчает специфическое распознавание и деструкцию нежелательных клеток-мишеней, например патогенов, инфицированных патогенами клеток, опухолевых клеток или аутоиммунных клеток.
В соответствии с настоящим изобретением, может быть сконструирован любой член используемых химерных молекул. Например, образование химер, состоящих из внутриклеточной части соответствующим образом сконструированной молекулы антитела, позволяет специфически переключать потенциал распознавания мишени клетками иммунной системы и направлять его на антиген, распознаваемый внеклеточной частью антитела. Таким образом, благодаря присутствию в химерах антитела, способного распознавать определенную антигенную детерминанту на поверхности патогена, клетки иммунной системы, вооруженные химерами, могут реагировать на присутствие патогена в соответствии с эффекторной программой, присущей их линии дифференцировки, например хелперные T-лимфоциты могут направить свою цитотоксическую активность против мишени, а B-лимфоциты могут быть активированы для синтеза антител. Макрофаги и гранулоциты могут осуществлять свои эффекторные программы, включая высвобождение цитокинов, фагоцитоз и генерирование реактивного кислорода. Аналогичным образом, в случае присутствия антительной части, способной распознавать опухолевые клетки, иммунная система будет направлена преимущественно на опухолевые клетки. В случае присутствия антитела, способного распознавать иммунные клетки, обладающие нежелательной реактивностью по отношению к своим собственным детерминантам, эти аутореактивнные клетки будут мишенью для селективного лизиса.
В вышеуказанных примерах описание антителосодержащих химер является лишь данью традиции, и объем настоящего изобретения не ограничивается использованием только антителосодержащих химер, т.е. настоящее изобретение может быть с успехом осуществлено с применением внеклеточных доменов, не происходящих от антитела. Например, если внеклеточная часть является рецептором для вирусов, бактерий или паразитов, то клетки, "вооруженные" такими химерами, будут специфически направлены против клеток, экспрессирующих вирусные, бактериальные или паразитические детерминанты. Преимущество этого метода по сравнению с использованием антител заключается в том, что нативный рецептор для патогена может обладать чрезвычайно высокой селективностью или аффинностью по отношению к патогену, в результате чего повышается степень специфичности иммунного ответа. Аналогичным образом для удаления тех клеток иммунной системы, которые обладают нежелательной реактивностью по отношению к собственному антигену, может оказаться достаточным присоединять антиген (либо в качестве интактного белка в случае терапии для элиминации B-клеток, либо в качестве главного комплекса гистосовместимости (ГКГС) в случае терапии для элиминации T-клеток) к внутриклеточным цепям протеин-тирозин-киназы, в результате чего иммунный ответ будет специфически направлен против клеток, обладающих нежелательной реактивностью по отношению к своим собственным детерминантам.
Еще одной целью использования химер является контроль клеточных популяций, образующихся in vivo после проведения других видов генной инженерии. Например предлагалось использовать опухоль-инфильтрующие лимфоциты или натуральные клетки-киллеры (NK-клетки), которые осуществляли бы свои цитотоксические функции в месте локализации опухоли. Настоящее изобретение дает удобный способ регуляции числа и активности таких лимфоцитов и клеток, не удаляя их из организма пациента для in vitro-амплификации. Таким образом, поскольку внутриклеточные домены химерных рецепторов опосредуют пролиферативные ответы клеток, то координация внеклеточных доменов с помощью ряда агрегирующих факторов, специфических для внеклеточных доменов (например, антитело, являющееся специфическим для внеклеточного домена), будет приводить к пролиферации клеток, несущих данные химеры.
Хотя конкретные варианты осуществления настоящего изобретения предусматривают использование химер, содержащих протеин-тирозин-киназы семейства Syk или семейств Syk и Src, однако для целей, раскрываемых в настоящей заявке, может быть использована любая тирозин-киназа, имеющая функции, аналогичные функциям указанных молекул. Отличительными признаками предпочтительных молекул-"стимуляторов" иммунных клеток являются их способность к автономной экспрессии; их способность присоединяться к внеклеточному домену (прямо или посредством трансмембранного домена) так, чтобы полученная в результате химера присутствовала на поверхности терапевтической клетки; и способность инициировать клеточные эффекторные программы после вторичной агрегации со сталкиванием с целевым лигандом.
В настоящее время наиболее распространенным методом доставки химер к клеткам иммунной системы является определенный вид генной терапии. Однако восстановление клеток иммунной системы с использованием химерных рецепторов путем смешивания клеток с соответствующим образом солюбилизированных очищенных химерных белков может также приводить к образованию сконструированной клеточной популяции, способной реагировать на мишени, распознаваемые внеклеточным доменом химер. Аналогичные методы были использованы, например, для введения интактного рецептора ВИЧ, а именно CD4, в эритроциты в терапевтических целях. В этом случае сконструированная клеточная популяция не способна к самовосстановлению.
Настоящее изобретение относится к функциональным упрощенным протеин-тирозин-киназным химерам, которые обладают способностью к переключению функции иммунной системы. Более конкретно, настоящее изобретение относится к регуляции лимфоцитов, макрофагов, натуральных клеток-киллеров или гранулоцитов путем экспрессии в указанных клетках химер, которые стимулируют клетки на ответ, направленный против мишеней, распознаваемых этими химерами. Настоящее изобретение также относится к способу, позволяющему направлять клеточный ответ против инфекционного агента, опухолевых, или раковых клеток, или аутореактивных клеток. Способ, позволяющий направлять клеточный ответ у млекопитающих и предусматривающий введение указанному млекопитающему эффективного количества терапевтических клеток, способных к распознаванию и разрушению инфекционного агента, опухолевой, раковой или аутореактивной клетки.
В другом варианте настоящее изобретение относится к способу, позволяющему направлять клеточный ответ против инфекционного агента и предусматривающему введение терапевтических клеток, способных к распознаванию и разрушению указанного агента, где указанным агентом является специфический вирус, бактерии, протозойные или грибки. А более конкретно, указанный способ направлен против таких агентов как ВИЧ и Pneeuocystis carinii.
Для лечения ВИЧ-инфекции пациенту вводят эффективное количество цитотоксических T-лимфоцитов, экспрессирующих химерный рецептор и обладающих способностью к специфическому распознаванию и лизису клеток, инфицированных вирусом ВИЧ, а также циркулирующим вирусом.
Таким образом, в одном из вариантов своего осуществления настоящее изобретение относится к способу, позволяющему направлять клеточный ответ против ВИЧ-инфицированных клеток и предусматривающему введение пациенту эффективного количества цитотоксических T-лимфоцитов, способных к специфическому распознаванию и лизису клеток, инфицированных ВИЧ.
В другом варианте своего осуществления настоящее изобретение относится к химерным рецепторным белкам, направляющим цитотоксические T-лимфоциты на распознавание и лизис ВИЧ-инфицированных клеток. В еще одном варианте настоящее изобретение относится к хозяйским клеткам, трансформированным вектором, содержащим химерные рецепторы.
Эти и другие варианты настоящего изобретения, не ограничивающие его объема, будут очевидны из нижеследующего подробного описания изобретения.
В этом подробном описании приводятся ссылки на различные методики, известные специалистам по молекулярной биологии и иммунологии. Публикации и другие материалы, содержащие описания этих известных методик, вводятся во всей своей полноте в настоящее описание посредством ссылки.
Известными работами, в которых описаны общие принципы технологии рекомбинантных ДНК, являются: Watson, J. D. et al., Molecular Biology of Gene, Volumes I and II, the Benjamin/Cumming Publishing Company, Inc., publisher, Menlo Park, CA (1987); Darnell, J.E. et al., Molecular Cell Biology, Scientific American Books, Inc., Publisher, New York, N.Y. (1986); Lewin, B.M., Genes II, John Wiley & sons, publishers, New York, N.Y. (1985); Old, R.W., et al. , Principles of Gene Manipulation: An Introduction to Genetic Engineering, 2d edition, University of California Press, publisher, Berkeley, CA (1981); Maniatis, T. , et al., Molecular Cloning: A Laboratory Manual, 2nd Ed. Cold Spring Harborg Laboratory, publisher Cold Spring Harbor, NY (1989); Current Protocols in Molecular Biology, Ausubel et al., Wiley Press, New York, NY, (1989).
Определения
Термин "клонирование" означает использование техники рекомбинации in vitro для введения конкретного гена или другой ДНК-последовательности в векторную молекулу. Для успешного клонирования нужного гена необходимо использовать методы, предусматривающие генерирование ДНК-фрагментов для встраивания этих фрагментов в векторные V молекулы; введение сконструированной ДНК-молекулы в хозяйскую клетку, в которой эта молекула может реплицироваться; и отбор клона, содержащего целевой ген из хозяйских клеток-реципиентов.
Термин "кДНК" означает комплементарную или копийную ДНК, продуцированную из РНК-матрицы с помощью РНК-зависимой ДНК-полимеразы (обратной транскриптазы). Таким образом, "ДНК-клон" означает двухцепочечную ДНК-последовательность, комплементарную нужной РНК-молекуле и содержащуюся в векторе клонирования.
Термин "кДНК-библиотека" означает коллекцию рекомбинантных ДНК-молекул, содержащих кДНК-вставки, соответствующие ДНК-копиям мРНК, экспрессируемой клеткой во время изготовления кДНК-библиотеки. Такая кДНК-библиотека может быть получена известными методами, описанными, например, в руководстве Маниатиса и др. (Maniatis et al., Molecular Cloning: A Laboratory Manual, см. выше). Для этого сначала из клеток организма, из генома которого необходимо клонировать нужный конкретный ген, выделяют РНК. Для целей настоящего изобретения предпочтительно использовать клеточные линии лимфоцитов млекопитающих, а лучше человека. В соответствии с настоящим изобретением наиболее предпочтительным вектором является штамм WR вакцинного вируса (вируса коровьей оспы).
Термин "вектор" означает ДНК-молекулу, происходящую, например, от плазмиды, бактериофага или вируса млекопитающего или насекомого, в которую могут быть встроены или клонированы ДНК-фрагменты. Вектор может содержать один или несколько уникальных рестрикционных сайтов и может обладать способностью к автономной репликации в определенном хозяине или организме-переносчике так, чтобы клонированная последовательность могла репродуцироваться. Таким образом, "экспрессирующий ДНК-вектор" представляет собой любой автономный элемент, способный регулировать синтез рекомбинантного пептида. Такими экспрессирующими ДНК-векторами являются бактериальные плазмиды и фаги, а также плазмиды и вирусы млекопитающих и насекомых.
Термин "в основном чистый" означает соединение, например белок, полипептид, или антитело, которое, в основном, не содержит свойственных ему природных примесей. Обычно соединение считается в основном чистым, если содержание нужного соединения в данном материале составляет, по крайней мере, 60%, более предпочтительно, по крайней мере, 75%, а наиболее предпочтительно, по крайней мере, 90% от всего материала. Чистота данного материала может быть измерена стандартными методами, например с помощью колоночной хроматографии, электрофореза в полиакриламидном геле или ВЭЖХ-анализа. В отношении нуклеиновой кислоты понятие "в основном чистый" означает последовательность, сегмент или фрагмент нуклеиновой кислоты, непосредственно соединенные (т.е., ковалентно связанные) с обеими кодирующими последовательностями (т.е. с одной у 5'-конца и одной у 3'-конца), с которыми они непосредственно соединены в природном геноме организма, от которого происходит ДНК настоящего изобретения.
Термин "функциональное производное" означает "фрагменты", "варианты", "аналоги" или "химические производные" молекулы. Под понятием "фрагмент" молекулы, например, любой из ДНК-последовательностей настоящего изобретения, подразумевается любая нуклеотидная субпопуляция молекулы. Под понятием "вариант" такой молекулы подразумевается природная молекула, которая является, в основном, аналогичной полной молекуле или его фрагменту. Под понятием "аналог" молекулы подразумевается не встречающаяся в природе молекула, которая, в основном, аналогична полной молекуле или его фрагменту. Молекула считается "в основном аналогичной" другой молекуле, если аминокислотные последовательности обеих молекул являются, в основном, одинаковыми. В основном аналогичные аминокислотные молекулы обладают, в основном, одинаковыми биологическими активностями. Таким образом, при условии, что две молекулы обладают аналогичной активностью, они могут рассматриваться как "варианты", даже если одна из молекул содержит дополнительные или отсутствующие в другой молекуле аминокислоты либо если аминокислотные последовательности этих молекул не являются идентичными. В соответствии с настоящим описанием молекула называется "химическим производным" другой молекулы в том случае, если она содержит дополнительные химические группы, которые обычно не являются частью этой молекулы. Эти группы могут улучшать растворимость молекулы, ее абсорбцию, период биологической полужизни и т.п. Альтернативно, эти группы могут снижать токсичность молекулы, устранять или ослаблять нежелательное побочное действие молекулы, и т.п. Группы, способные опосредовать такие эффекты, раскрываются например, в Remington Pharmaceutical Sciences, 16th et., Mack Publishing Co., Easton, Penn. (1980).
Аналогичным образом, понятие "функциональное производное" гена химерного рецептора настоящего изобретения включает в себя "фрагменты", "варианты" или "аналоги" гена, которые могут быть "в основном аналогичными" по своей нуклеотидной последовательности и которые кодируют молекулу, обладающую активностью, аналогичной активности протеин-тирозин-киназной химеры.
Таким образом, используемый в настоящем описании термин "протеинтирозин-киназный химерный белок" также означает любые функциональные производные, фрагменты, варианты, аналоги или химические производные, которые могут быть, в основном, аналогичными химерам "дикого типа" и которые обладают такой же активностью (т.е. которые имеют активность, составляющую, по крайней мере, 10%, предпочтительно 40%, более предпочтительно 70%, а наиболее предпочтительно 90% от активности рецепторной химеры дикого типа). Под понятием "активность" функционального производного химерного рецептора подразумевается способность к специфическому связыванию (его внеклеточной частью) с целевым агентом или клеткой, с последующим разрушением (опосредованным его внутриклеточной частью) этого агента или клетки; причем указанная активность может быть определена с помощью любого из нижеописанных анализов.
ДНК-последовательность, кодирующая химеры настоящего изобретения или их функциональные производные, может быть подвергнута рекомбинации с использованием векторной ДНК в соответствии со стандартной техникой, предусматривающей затупление концов или формирование липких концов с помощью ступенчатых разрывов для лигирования, гидролиз рестриктирующими ферментами для получения соответствующих концов, заполнение "липких" концов, если это необходимо, обработку щелочной фосфатазой во избежание нежелательного сцепления; и лигирование с помощью соответствующих лигаз. Техника осуществления указанных манипуляций описана Маниатисом и др. (см. выше) и хорошо известна специалистам.
Молекула нуклеиновой кислоты, такая как ДНК, считается "способной экспрессировать" полипептид в том случае, если она содержит нуклеотидные последовательности, регулирующие транскрипцию и трансляцию и являющиеся "правильно соединенными" с нуклеотидными последовательностями, которые кодируют полипептид. "Правильное соединение" последовательностей является таким соединением, при котором регуляторные ДНК-последовательности и предполагаемая экспрессируемая последовательность сцеплены таким образом, что это способствует экспрессии гена. Конкретная природа регуляторных областей, необходимых для осуществления экспрессии гена, может варьироваться от организма к организму, однако в основном эти области представляют собой промоторную область, которая у прокариотов содержит промотор (который регулирует инициацию РНК-транскрипции), а также ДНК-последовательности, которые при транскрипции в РНК индуцируют сигнал инициации синтеза белка. Указанные области обычно включают в себя 5'-некодирующие последовательности, участвующие в инициации транскрипции и трансляции, такие как TATA-бокс, кэпирующая последовательность, CAAT-последовательность и т.п.
Если необходимо, некодирующая область у 3'-конца генной последовательности, кодирующей белок, может быть получена вышеописанными методами. Эта область может быть сохранена для регуляторных последовательностей терминации транскрипции, таких как последовательность терминации и полиаденилирования. Таким образом, сохранение 3'-области, которая в природных условиях является сцепленной с ДНК-последовательностью, кодирующей белок, может способствовать индуцированию сигнала терминации транскрипции. Если в экспрессирующей хозяйской клетке такие сигналы терминации транскрипции являются недостаточно функциональными, то эта область может быть заменена на функциональную 3'-область.
Следует указать, что две ДНК-последовательности (такие, как промоторная последовательность и последовательность, кодирующая протеин-тирозин-киназную химеру) считаются правильно сцепленными в том случае, если природа связи между этими двумя ДНК-последовательностями:
(1) не приводит к мутации со сдвигом рамки;
(2) не оказывает неблагоприятного действия на способность промоторной последовательности регулировать транскрипцию последовательности гена химерного рецептора; или
(3) не оказывает неблагоприятного действия на способность последовательности гена химерного рецептора транскрибироваться под контролем промоторной области.
Причем промоторная область считается правильно сцепленной с ДНК-последовательностью в том случае, если этот промотор способен осуществлять транскрипцию этой ДНК-последовательности. Таким образом, для синтеза белка необходимы транскрипционные и трансляционные сигналы, распознаваемые соответствующим хозяином.
В настоящем изобретении рассматривается синтез протеин-тирозин-киназного химерного белка (или его функционального производного) либо в прокариотических, либо в эукариотических клетках; при этом предпочтительными являются эукариотические клетки (а особенно лимфоциты человека).
В соответствии с настоящим изобретением антитела могут быть получены любым из существующих способов. Например клетки, продуцирующие рецепторный химерный белок или его функциональное производное, могут быть введены животному для получения сыворотки, содержащей поликлональные антитела, способные связываться с химерным белком.
В предпочтительном варианте осуществления этого метода антитела настоящего изобретения являются моноклоналльными антителами. Такие моноклональные антитела могут быть получены с использованием гибридомной технологии (Kohler et al. , Nature 256: 495 (1975); Kohler et al., Eur. J. Immunol. 6: 511 (1976); Kohler et al., Eur. J. Immunol. 6: 292 (1976); Hammerling et al., B "Monoclonal Antibodies and T-Cell Hybridomas, Elsevier, N.Y., pp. 563-684 (1981)). В общих чертах указанные процедуры предусматривают иммунизацию животного химерным антигеном. Спленоциты от таких животных экстрагируют и подвергают слиянию с соответствующей миеломной клеточной линией. Для
целей настоящего изобретения может быть использована любая миеломная клеточная линия. После слияния полученные клетки гибридомы селективно поддерживают в HAT-среде, а затем клонируют с использованием лимитирующего разведения, как описано Wands, J. P. и др. (Gastroenterology 80: 225-232 (1981)). Затем клетки гибридомы, полученные посредством такой селекции, анализируют для идентификации клонов, которые секретируют антитела, способные связываться с химерой.
Антитела настоящего изобретения могут быть также поликлональными или, предпочтительно, область-специфическими поликлональными антителами.
Антитела против химеры настоящего изобретения могут быть использованы для мониторинга количества химерного рецептора (или клеток, несущих химерный рецептор) у пациента. Такие антитела удобны для использования в стандартных иммунодиагностических анализах, хорошо известных специалистам, например таких, как "сэндвич"-анализы, а в частности прямой, обратный, и одновременный "сэндвич"-анализы. Эти антитела могут быть использованы в любых комбинациях, которые могут быть выбраны без излишнего экспериментирования самим специалистом для осуществления иммуноанализов нужной специфичности, чувствительности и точности.
Описание основных принципов иммунологии приводится в следующих известных работах: Essential Immunology, Sixth Ed., Blackwell Scientific Publication, Publisher, Oxford (1988); Kimball, J.W., Introduction to Immunology, Second Ed., Macmillan Publishing Co., Publisher, New York (1986); Roitt, I., et al. , Immunology, Gower Medical Publishing Ltd., Publisher, London, (1985); Campbell, A., "Monoclonal Antibody Technology", B Burdon, R., et al., eds., Laboratory Techniques in Biochemistry and Molecular Biology, Volume 13, Elsevier, Publisher, Amsterdam (1984); Klein, J., Immunology: The Science of Self-Nonself Discrimination, John Willey & Sons, Publisher, New York (1982); Kennett R., et al., eds., Monoclonal Antibodies, Hydridoma: A New Dimention In Biologicak Analyses, Plenum Press, Publisher, New York (1980).
Термин "обнаружение" (или "детекция") означает определение присутствия или отсутствия данного вещества или его количественную оценку. Этот термин относится к использованию материалов, композиций и методов настоящего изобретения для качественных и количественных измерений.
С использованием техники антиидиотипического скрининга может быть осуществлено выделение других гибридом, секретирующих моноклональные антитела такой же специфичности, что и антитела, описанные выше. Вкратце, антиидиотипическое антитело представляет собой такое антитело, которое "узнает" уникальные детерминанты, присутствующие на антителах, продуцируемых нужным клоном. Антиидиотипические антитела могут быть получены путем иммунизации животных того же самого штамма, который служит источником моноклонального антитела, с использованием целевого моноклонального антитела. Иммунизированные животные будут распознавать и реагировать на идиотипические детерминанты иммунизирующего антитела путем продуцирования антител к этим идиотипическим детерминантам (антиидиотипические антитела).
Для репликации гибридные клетки могут быть культивированы in vitro и in vivo. Высокий уровень продуцирования in vivo делает этот метод культивирования более предпочтительным. Короче говоря, клетки от отдельных гибридных штаммов внутрибрюшинно инъецируют примированным пристаном мышам BAL B/c для продуцирования асцитной жидкости, содержащей высокие концентрации нужных моноклональных антител. Моноклональные антитела изотипа IgM или IgC могут быть выделены из культуральных супернатантов с использованием методов колоночной хроматографии, хорошо известных каждому специалисту.
Антитела настоящего изобретения являются особенно подходящими для использования в иммуноанализах, где они могут быть в жидкой фазе или связанными с твердофазным носителем. Кроме того, антитела, используемые в этих иммуноанализах, могут быть подвергнуты детектируемому мечению различными способами.
Существует множество различных меток и способов мечения, хорошо известных специалистам. Примерами различных типов меток, которые могут быть использованы в настоящем изобретении, но которыми не ограничивается объем изобретения, могут служить ферменты, радиоизотопы, флюоресцентные соединения, хемилюминесцентные соединения, биолюминесцентные соединения и хелатные металлосодержащие комплексы. Любой средний специалиста может выбрать и другие подходящие метки или найти их с помощью рутинного экспериментирования. Кроме того, связывание этих меток с антителами может быть осуществлено с использованием стандартной техники, хорошо известной среднему специалисту.
Один из способов, с помощью которого может быть осуществлено детектируемое мечение антител настоящего изобретения, заключается в связывании антитела с ферментом. Этот фермент, в свою очередь, при его экспонировании субстратом, будет реагировать с субстратом так, что в результате будут продуцироваться химические группы, которые могут быть обнаружены, например, спектрофотометрически или флюорометрически. Примерами ферментов, которые могут быть использованы для детектируемого мечения антител, являются: мелатдегидрогеназа, стафилококковая нуклеаза, дельта-V-стероид-изомераза, дрожжевая алкогольдегидрогеназа, альфа-глицерофосфат-дегидрогеназа, триозофосфатизомераза, биотинилированная пероксидаза, пероксидаза хрена, щелочная фосфатаза, аспарагиназа, глюкозооксидаза, β-галактозидаза, рибонцуклеаза, уреаза, каталаза, глюкозо-VI-фосфат-дегидрогеназа, глюкоамилаза и ацетилхолин-эстераза.
Присутствие обнаружимо меченных антител может быть также определено путем мечения антител радиоактивным изотопом, который может быть затем детектирован с использованием гамма-счетчика или сцинтилляционного счетчика. Примерами конкретных изотопов, которые могут быть использованы в целях настоящего изобретения, являются: 3H, 125I, 32P, 35S, 14C, 51Cr, 36Cl, 57Co, 58Co, 59Fe и 75Se.
Связывание обнаружимо меченных антител может быть также определено путем мечения антител флюоресцентным соединением. При этом если флюоресцентно меченное антитело экспонировать светом собственной длины волны, то его присутствие может быть обнаружено благодаря флюоресценции красителя. Среди наиболее распространенных флюоресцентных соединений, используемых для мечения антител, являются флюоресцеин, изотиоцианат, родамин, фикоэритрин, фикоцианин, аллофикоцианин, о-фтальдегид, и флюорескамин.
Антитела настоящего изобретения могут быть также подвергнуты обнаружимому мечению с использованием флуоресцирующих металлов, таких как 152Eu, или других элементов серии лантанидов. Эти металлы могут быть связаны с молекулой антитела посредством групп, образующих хелатный металлокомплекс, таких как диэтилэнтериаминопептауксусная кислота (DTPA) или этилендиаминтетрауксусная кислота (EDTA).
Детектируемое мечение антител может быть также осуществлено путем их связывания с хемилюминесцентным соединением. Присутствие хемилюминесцентно меченных антител может быть затем обнаружено путем детекции люминесценции, индуцируемой в процессе химической реакции. Примерами подходящих хемилюминесцентных соединений для мечения являются люминал, изолюминол, сложный эфир акридиния, полученного путем термического крекинга, имидазол, соли акридиния, сложный эфир щавелевой кислоты и диоксетан.
Аналогичным образом для мечения антител настоящего изобретения может быть использовано биолюминесцентное соединение. Биолюминесценция представляет собой тип хемилюминесценции, наблюдаемой в биологических системах, в которых эффективность хемилюминесцентной реакции повышается благодаря присутствию каталитического белка. Присутствие биолюминесцентного антитела может быть обнаружено путем детекции люминесценции. Подходящими биолюминесцентными соединениями, которые могут быть использованы для мечения антител, являются люциферин, люциферазный экворин.
Антитела и в основном очищенный антиген настоящего изобретения идеально подходят для изготовления набора. Такой набор может включать в себя контейнер, разделенный перегородками, в который могут быть помещены один или несколько сосудов, таких как флаконы, пробирки и т.п., причем каждый из них содержит отдельные элементы, используемые в анализе.
Существует много типов анализов, которые могут быть воплощены в виде набора, например конкурентный и неконкурентный анализы. Типичными примерами анализов, в которых могут быть использованы антитела настоящего изобретения, является радиоиммуноанализ (РИА), иммуноферментный анализ (ИФА), твердофазный иммуноферментный анализ (ELISA) и иммунометрический или "сэндвич"-анализы.
Термин "иммунометрический анализ" или "сэндвич"-анализ означает одновременный, прямой и обратный сэндвич-анализ. Эти термины хорошо понятны каждому специалисту. При этом следует отметить, что антитела настоящего изобретения могут быть использованы в других вариантах и типах анализов, которые уже существуют или которые будут разработаны в будущем. И все они входят в объем настоящего изобретения.
В предпочтительном варианте осуществления анализа важно, чтобы в инкубационной среде присутствовали определенные "блокаторы" (обычно добавляемые с мечеными растворимыми антителами). Эти "блокаторы" добавляют для гарантии того, чтобы неспецифические белки, протеаза или человеческие антитела к мышиным иммуноглобулинам, присутствующие в экспериментальном образце, были не способны к специфическому связыванию или разрушению антител, находящихся на твердофазном носителе, или радиоактивно меченных индикаторных антител, что позволяет избежать ложноположительных или ложноотрицательных результатов. Поэтому правильный отбор "блокаторов" будет способствовать повышению специфичности анализов, описанных в настоящем изобретении.
Было установлено, что в качестве "блокаторов" может быть использован ряд непрелевантных (т.е. неспецифических) антител, которые принадлежат к тому же классу или подклассу (изотипу), что и антитела, используемые в анализе (например IgG1, IgC2a, IgM, и т.п.). Концентрация "блокаторов" (обычно 1-100 мкг/мкл) является важным параметром для поддержания их собственной чувствительности до тех пор, пока не будет ингибироваться любое нежелательное воздействие перекрестно реагирующих друг с другом белков в сыворотке человека. Кроме того, необходимо оптимизировать буферную систему, содержащую "блокаторы". Предпочтительными буферами являются буферы на основе слабых органических кислот, такие как имидазол, HEPPS, MORS, TES, ADA, ACES, HEPES, PIPES, Трис, и т. п. , при физиологических интервалах pH. Несколько менее предпочтительными буферами являются неорганические буферы, такие как фосфат, борат или карбонат. И наконец, в буфер, который содержит "блокаторы", должны быть добавлены известные ингибиторы протеазы (обычно в концентрации 0,01-10 мкг/мл).
Существует множество твердофазных иммуноадсорбентов, которые обычно используются в аналогичных целях и которые могут быть использованы в настоящем изобретении. Хорошо известными иммуноадсорбентами являются стекло, полистирол, полипропилен, декстран, найлон или другие материалы, которые могут быть использованы в форме пробирок, шариков, планшетов для микротитрования, изготовленных из этих материалов или покрытых этими материалами и т.п. Иммобилизованные антитела могут быть либо ковалентно, либо физически связаны с твердофазным иммуноадсорбентом с использованием известной техники, такой как ковалентное связывание посредством амидной или сложноэфирной связи либо путем абсорбции. Специалистам известны и многие другие подходящие твердофазные иммуноадсорбенты и методы иммобилизации на них антител либо эти иммуноадсорбенты могут быть получены путем простого рутинного экспериментирования.
Для in vitro, in vivo, или in situ диагностики такие метки как радионуклиды могут быть связаны с антителами настоящего изобретения либо непосредственно, либо посредством функциональной группы. Промежуточной группой, которая часто используется для связывания радиоизотопов, присутствующих в виде металлических катионов, с антителами, является диэтилентриаминпентауксусная кислота (DTPA). Типичными примерами металлических катионов, которые могут быть связаны таким образом, являются 99mTc, 123I, 111I, 97Pu, 67Cu, 67Ga и 68Ga. Антитела настоящего изобретения могут быть также мечены нерадиоактивными изотопами в целях проведения диагностики. Элементами, особенно подходящими для этих целей, являются 157Gp, 55Mn, 162Dy, 52Cr и 56Fe.
Антиген настоящего изобретения может быть выделен, в основном, в чистом виде с использованием антител настоящего изобретения. Таким образом, в одном своем варианте настоящее изобретение относится к в основном чистой протеин-тирозин-киназой химере, причем указанный антиген отличается тем, что он распознается антителами настоящего изобретения и связывается с ними. В другом своем варианте настоящее изобретение относится к способу выделения или очистки химерного рецепторного антигена путем образования комплекса указанного антигена с одним или несколькими антигенами, направленными против химерного рецептора.
В основном чистые химерные антигены настоящего изобретения могут быть, в свою очередь, использованы для обнаружения или измерения антител против химеры в образце, таком как сыворотка или моча. Таким образом, один из вариантов настоящего изобретения относится к способу обнаружения присутствия или оценки количества антитела против протеин-тирозин-киназного антигена в образце, заключающемуся в том, что образец, содержащий антитело к химерному антигену, подвергают контакту с обнаружимо меченным химерным рецептором, а затем осуществляют детекцию указанной метки. При этом следует отметить, что могут быть также использованы иммунореактивные фракции и иммунореактивные аналоги указанных химер. Термин "иммунореактивная фракция" означает любую часть химерного антигена, которая обнаруживает эквивалентный иммунный ответ на антитело, направленное против химерного рецептора. Термин "иммунореактивный аналог" означает белок, который отличается от рецепторного химерного белка одной или несколькими аминокислотами, но который, при этом, обнаруживает эквивалентный иммуноответ на антитело настоящего изобретения.
Под термином "специфически распознает и связывается" подразумевается, что антитело распознает полипептид химерного рецептора и связывается с ним, но при этом оно почти не распознает другие неродственные молекулы, присутствующие в образце, например в биологическом образце, и не связывается с ними.
Термин "аутоиммуногенная клетка" означает клетку, продуцирующую антитела, которые реагируют с тканью хозяина; или иммунные эффекторные T-клетки, которые являются аутореактивными; причем, указанные клетки содержат антитела против ацетилхолиновых рецепторов (что приводит, например, к миастении) или аутоантитела против ДНК, эритроцитов и тромбоцитов (что приводит, например, к красной волчанке).
Термин "терапевтическая клетка" означает клетку, трансформированную химерой настоящего изобретения таким образом, что она приобрела способность распознавать и разрушать конкретный инфекционный агент; клетку, инфицированную конкретным агентом; опухолевую или раковую клетку; или аутоиммунногенную клетку; при этом предпочтительно, чтобы такими терапевтическими клетками были клетки гематопоэтической системы.
Термин "инфекционный агент-мишень" означает любой инфекционный агент (например вирус, бактерия, протозойный микроорганизм или грибок), распознаваемый терапевтической клеткой, несущей химерный рецептор. Термин "клетка-мишень" означает любую хозяйскую клетку, распознаваемую терапевтической клеткой, несущей химерный рецептор; причем такими клетками-мишенями могут быть, без ограничений, хозяйские клетки, инфицированные вирусом, бактерией, протозойным микроорганизмом или грибком, а также опухолевые или раковые клетки и аутоиммуногенные клетки.
Термин "внеклеточный" относится, по крайней мере, к части молекулы, находящейся на клеточной поверхности. Термин "внутриклеточный" относится, по крайней мере, к части молекулы, находящейся в цитоплазме терапевтической клетки. Термин "трансмембранный" относится, по крайней мере, к части молекулы, которая пронизывает плазматическую мембрану. Используемые в настоящем описании термины "внеклеточная часть", "внутриклеточная часть" и "трансмембранная часть" могут включать в себя флакирующие аминокислотные последовательности, которые простираются в примыкающие клеточные компартменты.
Термин "олигомеризовать" означает получить комплекс с другими белками с образованием димеров, тримеров, тетрамеров или других олигомеров более высокого порядка. Такие олигомеры могут быть гомоолигомерами или гетероолигомерами. Термин "олигомеризующая часть" означает область молекулы, которая стимулирует образование комплекса (т.е. олигомера).
Термин "цитолитический" означает "способный разрушать клетку (например клетку, инфицированную патогеном, опухолевую клетку или раковую клетку, либо аутоиммуногенную клетку)", или "способный разрушать инфекционный агент (например вирус)".
Термин "вирус иммунодефицита" означает ретровирус, который в том случае, когда он является вирусом дикого типа, способен инфицировать Т4-клетки приматов-хозяев и имеет вирусный морфогенез и морфологические свойства, характерные для подсемейства лентивирусов. Этот термин, без ограничений, включает в себя: все варианты ВИЧ и SIV, а именно, ВИЧ-1, ВИЧ-2, SIVmac, SIVagm, SIVmnd, SIVsmm, SIVman, SIVmand и SIVcp2.
Термин "МНС-независимый" означает, что клеточный цитолитический ответ не требует присутствия МНС-антигена класса 11 на поверхности клетки-мишени.
Термин "функциональное производное, передающее цитолитический сигнал", означает функциональное производное (как определено выше), которое обладает активностью, составляющей, по крайней мере, 10%, предпочтительно 40%, более предпочтительно 70%, а наиболее предпочтительно, по крайней мере, 90% от биологической активности молекулы дикого типа. Указанное "функциональное производное, передающее цитолитический сигнал", может действовать путем непосредственной передачи сигнала терапевтической клетке на разрушение связанного с рецептором агента или клетки (например, в случае внутриклеточной части химерного рецептора), либо оно может действовать опосредованно путем стимулирования олигомеризации с передающими цитолитический сигнал белками терапевтической клетки (например, в случае трансмембранного домена). Такие производные могут быть проанализированы на эффективность, например с использованием in vitro-анализа, описанного ниже.
Термин "функциональное производное, связывающееся с оболочкой ВИЧ" означает функциональное производное (как определено выше), способное связываться с любым белком оболочки вируса ВИЧ. Функциональные производные могут быть идентифицированы, например, с использованием in vitro-анализов, описанных ниже.
Терапевтическое применение
Трансформированные клетки настоящего изобретения могут быть использованы для лечения ряда заболеваний. Современные методы введения таких терапевтических клеток используют при адаптивной иммунотерапии или терапии путем переноса клеток. Эти методы позволяют возвращать трансформированные клетки иммунной системы в кровоток. Rosenberg S.A., Scientific American, 62 (May 1990); Rosenberg et al., The New England Journal of Medicine, 323 (9):570 (1990).
Фармацевтические композиции настоящего изобретения могут быть введены любому животному, на которого соединения настоящего изобретения оказывают благоприятное действие.
Настоящее изобретение, в основном, предназначено для человека, однако, оно может быть также использовано и для лечения других животных.
Подробно описание изобретения
Сначала приводится описание чертежей.
На фиг. 1A схематически показана диаграмма, иллюстрирующая организацию рецептор-киназных гибридных белков настоящего изобретения. На фиг. 1B показаны результаты проточной цитометрии для CD16/7/дзета, CD16/7/Lck, CD16/7/Fyn (T), CD16/7/Syk, и CD16/7/ZAP-70, экспрессированных вакцинными рекомбинантами в клетках Jurkat. На фиг. 1C показан анализ на in vitro киназную активность иммуноосажденных C 16/7/дзета (негативный контроль), CD16/7/Lck, CD16/7/Fyn (T), CD16/7/Syk и CD16/7/ZAP-70; при этом низкомолекулярные виды, присутствующие Fyn-химерном иммунопреципитате пока еще не были идентифицированы.
На фиг. 2 показан цитолитический кальциевый ответ, индуцированный перекрестным связыванием киназных химер в TCR-негативных клетках Jurkat (TCR-T-клеточный рецептор). На фиг. 2 показана относительная внутриклеточная концентрация кальция положительной популяции (измеряемая как отношение флюоресценции Indo-1-фиолетового к голубому). Клетки Jurkat, инфицированные вакцинными рекомбинантами, экспрессирующими различные гибридные белки, экспонировали антителом (mАb) 3G8 против CD16, а затем конъюгированными с фикоэритрином козьими F(ab')2-антителами против мышиных иммуноглобулинов IgG, в период времени 0. Химеры на основе дзета-цепи TCR и FcR11B2 служили в качестве позитивного и негативного контроля соответственно.
На фиг. 3 показан предварительный "запуск" кальциевого ответа на TCR-положительных клетках, экспрессирующих уккиназную химеру. Инфицирование и анализ осуществляли, как описано выше для фиг. 2. Основная часть клеток, экспрессирующих Syk-химеру, обнаруживала высокое отношение фиолетовой флюоресценции к синей флюоресценции перед добавлением первичного антитела.
На фиг. 4A и 4B показан анализ на противогибридомный лизис. На фиг. 4A приводится процент 51Cr-хромата, высвобожденного из гибридомных клеток-мишеней, который представлен как функция отношения эффекторных клеток (CTL), экспрессирующих киназную химеру) к клеткам-мишеням; при этом клетки, экспрессирующие рецепторные химеры, несущие внутриклеточные домены дзета-цепи TCR и FcR11B2, служили в качестве позитивного и негативного контроля соответственно. На фиг. 4B проиллюстрирована специфичность лизиса (отсутствие неспецифического цитолиза). Клетки BW5147 (не содержащие поверхностного антитела против CD16) нагружали 51Cr-хроматом и экспонировали клетками CTL, экспрессирующими киназные химеры, в условиях, аналогичных условиям, используемым для параллельного образца нагруженных хроматом клеток 3G8 (экспрессирующих антитело против CD16). От клеток BW5147 детектируемого высвобождения хроматата не наблюдалось.
На фиг. 5A, 5B и 5C показано, что коэкспрессия ZAP-70 и Fyn или Sck способствует индицированию цитолиза и снижению латентности кальциевого ответа. CTL были одновременно инфицированы вакцинными рекомбинантами, экспрессирующими указанные химеры, и проанализированы на цитолитический потенциал или мобилизацию кальция. Этот анализ дал заниженную оценку эффективности химер, поскольку измерения фракции клеток, экспрессирующих обе химеры, не были независимыми (фракция клеток, экспрессирующая, по крайней мере, одну из химер, была использована для нормализации активности). На фиг. 5A проиллюстрирован анализ на цитолиз с использованием CTL, экспрессирующих пары CD16/7/киназных химер. На фиг. 5B проиллюстрирован кальциевый ответ TCR-негативных клеток, экспрессирующих пары CD16/7/киназных химер. На фиг. 5C проиллюстрирован анализ на цитолиз CTL, коэкспрессирующих CD4/CD7/Fyn-химеры и CD16/CD7/ZAP-70-химеры. CD16/7/дзета-химеры служили в качестве позитивного контроля, а CD16/7/FcR11B2 служили в качестве негативного контроля.
На фиг. 6A и 6B показано, что химеры, несущие киназные делеции или точечные мутации, неэффективны в отношении мобилизации кальция и переориентированного цитолиза. Были сконструированы варианты гибридного белка, негативного в отношении киназной активности, с помощью делеций (в случае Syk) и точечной мутации (в случае ZAP-70) и проанализированы на кальциевый ответ и цитолиз. На фиг. 6A проиллюстрирован кальциевый ответ в TCR-негативных клетках. На фиг. 6B проиллюстрирован анализ на перенаправленный цитолиз.
На фиг. 7A, 7B и 7C показано, что химеры, полученные на основе киназы Syk человека, являются, в основном, эквипотентными (т.е., равносильными) химерам, полученным на основе киназы Syk свинья. На фиг. 7A изображена последовательность Syk человека по сравнению с последовательностью Syk свиньи; первые 11 и последние 7 остатков определены с помощью праймерных последовательностей. На фиг. 7B проиллюстрирован анализ на мобилизацию кальция для TCR-негативных клеток, экспрессирующих химеры на основе Syk человека. На фиг. 7C проиллюстрирован анализ на перенаправленный цитолиз CTL, экспрессирующих химеры на основе Syk человека.
На фиг. 8 показаны изменения в образце фосфорилирования тирозина после перекрестного связывания химерных киназ. Клетки Jurkat, негативные в отношении T-клеточного рецептора для антигена и экспрессирующие указанные химеры или пары химер, обрабатывали антителом против CD16 и вторым козьим антителом против мышиных иммуноглобулинов IgG, после чего клетки лизировали, фракционировали на полиакриламидном геле, переносили на нитроцеллюлозу и зондировали антителом против фосфотирозина. Дорожки, обозначенные "+", представляют экстракты от клеток, подвергнутые перекрестному связыванию, а дорожки, обозначенные "-", относятся к клеткам, которые подвергались непосредственному лизису без предварительной обработки "вторым" антителом. Контрольные дорожки относятся к аналогично обработанным TCR-негативным клеткам, экспрессирующим CD16/7-гибридный белок, который не содержал внутриклеточный домен. Справа, для сравнения, показано влияние обработки TCR-положительных клеток Jurkat антителом против CD3 (с инфицированием или без инфицирования вирусом коровьей оспы дикого типа). Заметно выдающиеся полосы в окрестности 100 кДа с левой стороны панели соответствуют ожидаемым молекулярным массам киназных химер.
На фиг. 9 показано тирозин-фосфорилирование фосфолипазы C-γ1 после агрегации химер. PL C-1 иммунопреципитировали из клеток, подвергнутых перекрестному связыванию с антителом, и полученные иммунопреципитаты фракционировали на геле, переносили на нитроцеллюлозу и зондировали с использованием антитела против фосфотирозина. Значительное увеличение в фосфорилировании PL C-γ1 наблюдалось после агрегации химер Syk, тогда как после коагрегации химер Fyh и ZAP-70 наблюдалось более ограниченное, но все же легко заметное увеличение фосфорилирования.
На фиг. 10A и 10B проиллюстрированы in vitro-анализы на киназную активность. Клетки, экспрессирующие химерные киназы, подвергали антитело-опосредованному перекрестному связыванию с химерами, после чего киназы подвергали иммунопреципитации и полученные иммунопреципитаты оценивали на фосфорилирование эндогенного субстрата. На фиг. 10A проиллюстрировано сравнение активности иммуноосажденных киназных химер за период инкубирования 10 минут с использованием иммунопреципитатов, выделенных из перекрестносвязанных (+) клеток и из клеток, не связанных перекрестно (-). На фиг. 10B показан период ассимиляции фосфатной метки в эндогенные субстраты с помощью Syk-киназной химеры с перекрестным связыванием (+) или без перекрестного связывания (-).
Активация T-клеток тирозин-киназой, образующей кластер
Ниже приводится описание конкретных вариантов осуществления настоящего изобретения. В этом описании показано, что нерецепторные киназы активируются путем простого образования кластеров. Были сконструированы искусственные рецепторные киназы, в которых внутриклеточные домены состояли из полных последовательностей киназ семейств Src или Syk и которые были исследованы на возможные последствия агрегации путем внешнего стимулирования перекрестного связывания. Между активностями киназ семейств Syk и Src были выявлены следующие явные различия: перекрестное связывание Src не приводит к значительной активации, тогда как перекрестное связывание с Syk приводит к появлению свободных ионов внутриклеточного кальция, и соответственно, к цитолитическому потенциалу. Неспособность химер ZAP-70 индуцировать опосредованные дистальным рецептором программы может быть преодолена путем образования кластера между химерой ZAP-70 и химерой Fyn либо Lck. Примеры, представленные ниже, приводятся лишь в иллюстративных целях и не должны рассматриваться как некое ограничение изобретения.
Конструирование протеин-тирозин-киназных химер и иллюстрация их эффективности
Генные гибриды, кодирующие белки, схожие с рецепторными киназами на клеточной поверхности, конструировали путем добавления ДНК-фрагмента, кодирующего внеклеточный домен молекулы CD16, к короткому спейсерному сегменту, кодирующему околомембранный и трансмембранный домены CD7, соединенные, в свою очередь, с полными кодирующими последовательностями тирозин-киназ Sck человека (Kaga et al., 1986, Eur. J. Immunol. 16:1643-1646), Fyn (T) мыши (Cooke & Perlmutter, 1989, New. Biol. 1: 66-74), Syk свиньи (Taniguchi et al. , 1991, I. Biol. Chem. 266:15790-15796), и ZAR-70 человека (Chan et al., 1992, Cell 71: 649-662) (фиг. 1A). Полученные в результате трехкомпонентные генные гибриды вводили в рекомбинантные вирусы осповакцины путем гомологической рекомбинации и селекции на коэкспрессию opt-генного продукта в E.coli. Инфицирование клеток рекомбинантами приводили к эффективному продуцированию на клеточной поверхности всех четырех киназных химер (фиг. 1B). Иммунопреципитация полученных белковых химер с антителами против CD16 выявила присутствие молекул с ожидаемой массой, которые обнаруживали активность в in vitro-анализе на фосфорилирование (фиг. 1C).
Затем мы проводили исследования для того, чтобы определить, происходит ли перекрестное связывание гибридных белков, которое позволяло бы аккумулировать свободный внутриклеточный кальций таким же образом, как это наблюдается в случае гибридных белков, полученных на основе внутриклеточных доменов T-клеточного рецептора для антигена. Для этого мы инфицировали различные клетки рекомбинантами вакцинного вируса и измерили относительную концентрацию цитоплазматического кальция после перекрестного связывания внеклеточных доменов с антителами. Были проведены спектрофлюориметрические (суммарной популяции) измерения и измерения методом проточной цитометрии (отдельных клеток) с использованием клеток, нагруженных красителем Indo-1 (Grynkiewicz et al,. 1985, J. Biol. Chem. 260: 3440-3450; Rabinoviteh et al. , 1986, J. Immunol. 137: 952-961). Анализы путем проточной цитометрии осуществляли исходя из данных, полученных от клеток, чья поверхностная экспрессия CD16, определенная по интенсивности флюоресценции фикоэритрина, находится в относительно узком определенном диапазоне. Хотя внутри этого диапазона иногда наблюдаются небольшие изменения в средней интенсивности флюоресценции (обусловленные различием в коренном распределении химер, продуцируемых клетками), однако этот способ дает нам возможность сопоставить ответы от клеток, несущих приблизительно такое же число рецепторов. На фиг. 2 проиллюстрированы анализы данных, полученных от клеток, являющихся мутантными вариантами T-клеточной линии лейкоза человека Jurkat, в которых отсутствовал T-клеточный рецептор для антигена (Weiss & Stobo, 1984, J. Exp. Meo, 160: 1284-1299). В этих клетках ни химера Lck ни химера Fyn не обладают способностью к мобилизации кальция после перекрестного связывания. В нескольких экспериментах образование кластеров гибридных белков Lck приводило к небольшому снижению концентрации остаточного кальция по отношению к негативному контролю, т.е., гибридному белку, полученному на основе внутриклеточного домена FcR11B2 низкоаффинного рецептора lgG (Kolanus et al., 1992, EMBO J. 11: 4861-4868). Агрегация гибридных белков, полученных на основе обеих ZAP-70 и Zyk, оказалась в высокой степени эффективной в стимуляции высвобождения свободных ионов цитоплазматического кальция, приблизительно такой же эффективной, как и агрегация аналогичной химеры, несущей внутриклеточный домен дзета-цепи T-клеточного рецептора. В случае химер, полученных на основе обеих киназ ZAP-70 и Syk, наблюдалась небольшая задержка кальциевого ответа по сравнению со временем начала мобилизации кальция, стимулируемого дзета-химерой. В клетках, положительных по T-клеточному рецептору (фиг. 3), поточная оценка Syk-химер была частично смешанной вследствие высокой остаточной концентрации свободных ионов кальция, что позволяет сделать предположение о конститутивном "включении" кальциевого регуляторного аппарата.
Внедрение химер в цитолитическую T-клеточную линию позволило затем оценить способность гибридных белков "вводить в действие" эффективную функцию. В этом анализе в качестве клеток-мишеней использовали гибридомы против CD16, которые продуцируют на своей поверхности антитело IgG против CD16 (Fleit et al., 1982, Proc. Natl. Acad. Sci. USA 79: 3275-3279; Shen et al., 1989, Mol. Immunol 26: 959-969). Клетки гибридомы подвергали мечению путем введения 51Cr-хромата и совместному осаждению с эффекторными клетками, полученными путем инфицирования аллоспецифической цитотоксической линии T-лимфоцитов (CTL) человека рекомбинантами вакцинного вируса, продуцирующими гибридные белки на основе CD16/CD7/киназы. Продуцирование химерных рецепторных киназ стимулирует связывание инфицированных клеток CTL с клетками-мишенями, и если эти инфицированные клетки являются компетентными, то они разрушают указанные клетки-мишени, причем этот процесс оценивают путем измерения уровня высвобождения включенного 51Cr-хромата. Относительную активность "вооруженных" клеток CTL определяют путем сравнения отношения эффекторов к клеткам-мишеням, необходимого для достижения данного процента высвобождения 51Cr. На фиг. 4A показано, что CTL, продуцирующие химерные рецепторы, содержащие киназы Lck или Fyn(T) семейства Src, или киназу ZAP-70 семейства Syk, не способны опосредовать цитолиз мишеней-гибридом против CD16. Однако клетки CTL, продуцирующие киназную химеру, сконструированную на основе белкового продукта Syk, обнаруживали, в основном, такую же эффективность, как и клетки CTL, продуцирующие химеру, состоящую из CD16, лигированного аналогичным образом с внутриклеточным доменом дзета-цепи T-клеточного рецептора. Цитолитическая активность, стимулируемая CD16/CD/7/киназными химерами, не может быть приписана неспецифическому высвобождению цитотоксических гранул, поскольку совместное осаждение нерелевантной нагруженной хромом мишени с "вооруженными" киназой клетками CTL не приводит к детектируемому высвобождению хрома (фиг.4B).
Это различие между Syk- и ZAP-70-активностями в анализе на цитолиз было довольно неожиданным, если принять во внимание сходство в активностях этих двух химер в анализе на кальциевый ответ. Учитывая уже известный факт, что совместная экспрессия нехимерных киназы ZAP-70 и киназы семейства Src приводит к активации в клетках COS (Chan et al., Cell 71:649-662), мы провели оценку относительной способности химерных киназных пар индуцировать цитолиз. CTL-эффекторы были совместно инфицированы рекомбинантными вакцинными вирусами, кодирующими химеры ZAP-70 и Sck, химеры ZAP-70 и Fyn (T), или химеры Sck и Fyn (T). На фиг. 5A показано, что ко-экспрессия химер ZAP-70 и Fyn (T), или химер ZAP-70 и Sck обеспечивала клетки CTL активностью, являющейся, в основном, эквипотентной активности клеток CTL, экспрессирующих только CD16/CD7/Syk-киназы химеры, т.е. активности, которая, в свою очередь, равносильна активности, наблюдаемой для CD16/CD7/дзета-химер. Коэкспрессия химер Sck и Fyn (T) не позволяет перенацеливать значительный цитолитический потенциал против анти-CD16-клеток-мишеней (фиг. 5A). Оценка способности к мобилизации кальция клеток, коинфицированных парами гибридных киназных белков, показала, что коэкспрессия химер на основе киназы ZAP-70 и киназы семейства Src способствует увеличению скорости, с которой происходит мобилизация кальция в ответ на перекрестное связывание рецепторов и что коэкспрессия химер Sck и Fyn (T) не приводит к значительной аккумуляции свободного внутриклеточного кальция (фиг.5B). Для дальнейшего исследования роли Fyn-химеры в активации ответа, индуцированного коагрегацией, мы получили Fyn-химеру, состоящую из внеклеточного и трансмембранного доменов CD4, слитых с Fyn таким же способом, что и CD16-химеры. На фиг.5C показано, что эффективность этой химеры в отношении направленного цитолиза в данном анализе в 10-20 раз меньше, чем CD16-химера, что дает основание предположить, что ассоциирование химерных киназ играет важную роль в активации. Однако цитолитическая активность клеток, экспрессирующих эти две химеры, значительно выше, чем активность, наблюдаемая для клеток, экспрессирующих лишь химеру ZAP-70. Принимая во внимание относительно высокий уровень киназной экспрессии в этой системе, нельзя исключить тот факт, что остаточная активность отражает спонтанную случайную ассоциацию химеры CD4/Fyn с CD16/ZAP-70.
Для того, чтобы убедиться в том, что активация, наблюдаемая в анализах на кальциевый ответ и цитолиз, может быть приписана непосредственно релевантной киназной активности и не является следствием пассивной ассоциации киназ с присутствущими элементами трансдукции сигнала, опосредованная агрегация которых инициирует затем активационный ответ, нами были сконструированы киназонегативные варианты рецепторынх химер на основе Syk свиньи и ZAP-70 человека. На фиг.6 показано, что рецепторные химеры, в которых отсутствует, в основном, весь киназный домен (в случае Syk) либо присутствует точечная мутация, отменяющая фосфотрансферазную активность (в случае ZAP-70), не обладают киназной активностью in vitro и не обладают способностью опосредовать мобилизацию кальция после перекрестного связывания или опосредовать перенацеленный рецептором цитолиз. Поскольку взаимодействие Syk свиньи с клеточным аппаратом человека не может быть идентичным взаимодействию Syk человека, нами были также сконструированы аналогичные белковые химеры на основе Syk человека после выделения последовательностей Syk человека посредством PCR с использованием праймеров, соответствующих амино- и карбоксиконцам белковой последовательности свиньи. На фиг. 7A показано, что Syk свиньи и человека являются поразительно схожими белками, как это было предположено исходя из анализа PCR-продуктов, соответствующих областям киназы и вторым SH2-доменам (Chan et al., 1992, Cell 71: 649-662). В соответствии с этим в анализах на высвобождение кальция и цитолиз химерные рецепторные белки на основе Syk человека ведут себя, в основном, аналогично конструкциям, происходящим от свиньи (фиг. 7B b 7C).
Для того, чтобы установить, приводит ли агрегация химерных тирозин-киназ к значительному изменению количественного содержания фосфотирозин-белков, негативные по T-клеточному рецептору клетки инфицировали вакцинными рекомбинантными, кодирующими химерные киназы. Внеклеточные домены химер подвергали перекрестному связыванию с антителами и полные клеточные лизаты активированных клеток фракционировали с помощью электрофореза, переносили на мембрану и анализировали с использованием антитела, распознающего фосфотирозин. Лизаты получали путем разрушения клеток в неиногенных детергентных в присутствии ванадата с EDTA или без EDTA либо путем лизиса в присутствии додецилсульфата натрия с последующей ультразвуковой обработкой для удаления высвобожденной ДНК. В каждом случае образцы фосфотирозин-белков отличались друг от друга, и лизаты, полученные с ванадатом, но без EDTA, обнаруживали дополнительные молекулы, не присутствующие в лизатах, полученных лишь в ДСН, что дает основание предположить, что EDTA может ингибировать постлизисное действие тирозин-киназ и фосфотаз. Было обнаружено, что использование прямого лизиса в ДСН приводит к более репродуцируемым путем тирозинфосфорилирования белка, чем лизис неионогенными детергентами в присутствии EDTA и ванадата. На фиг. 8 показано, что агрегация химер, несущих Syk, ZAP-7- или Fyn + ZAP-70, приводит к индуцированию или усилению фосфорилирования некоторых белковых молекул, мигрирующих одновременно с белками, обнаруживающими повышенное фосфорилирование после перекрестного связывания рецептора с антигеном. В частности типы полос, полученных в результате образования кластера химеры Syk, очень схожи с типами полос, индуцированных антителом против CD3 в положительных по T-клеточному рецептору клетках (фиг.8). Среди них имеется белок с массой приблизительно 150 кДа, который продуцируется путем агрегации химеры Syk, а также путем коагрегации химер Fyn и ZAP-70. В предварительных экспериментах было замечено, что этот фосфобелок мигрирует одновременно с фосфолипазой C-γ (данные не приводятся).
Для того, чтобы установить, какое влияние оказывает образование химерных киназных комплексов непосредственно на PLC-γ, химеры подвергали перекрестному связыванию, а PLC-γ подвергали преципитации со смесью моноклональных антител и полученные иммунопреципитаты анализировали на присутствие фосфотирозиловых белков. На фиг. 9 показано, что образование Syk-кластеров приводит к значительному увеличению содержания тирозинфосфата в PLC-γ, тогда как перекрестное связывание Fyn + ZAP-70-химер приводит к менее резкому, но легко обнаруживаемому увеличению тирозинфосфата. Клетки, экспрессирующие лишь Fyn-химеру, обнаруживают незначительный базальный уровень фосфорилирования PLC-γ, который не увеличивается после агрегации рецептора (фиг.9). Однако до сих пор не известно, фосфорилируются ли одни и те же тирозиновые остатки в случае Syk, Fyn, или ZAP-70 + Fyn. Поскольку клетки, экспрессирующие Fyn-химеры, не обнаруживают ни остаточной, ни индуцированной мобилизации кальция, то фосфотирозиновый сигнал, наблюдаемый в этих клетках, может быть приписан утилизации других сайтов на PLC-γ, чем те, которые опосредуют активацию фосфолипазы.
Для выяснения причин изменения характера тирозинфосфорилирования нами были предприняты предварительные попытки оценить активность различных киназ после образования кластеров в in vitro-анализе на аутофосфорилирование. Химеры подвергали агрегации, иммунопреципитации и оценке на их способность к включению фосфатной метки в белковые молекулы, присутствующие в иммунопреципитате. На фиг. 10A показано, что в этих условиях, при проведении киназного анализа в течение 10 минут, какого-либо увеличения киназной активности после перекрестного связывания обнаружено не было. Хотя в этом анализе увеличение меченого фосфата продолжалось в течение периода времени до 30 минут, однако факторы, ограничивающие рост активности, так и не были выяснены; в частности наблюдаемая кинетика может регулироваться скоростью диссоциации иммунных комплексов с диффузией киназы в неутилизованный субстрат. В попытке проконтролировать этот эффект, а также для максимизации чувствительности анализа нами были проведены оценки Syk-киназной активности с предварительным перекрестным связыванием или без него в течение очень короткого периода времени от 5 до 30 секунд; однако и в данном случае какого-либо заметного увеличения киназной активности обнаружено не было (фиг. 10B). Хотя в настоящее время мы не можем исключить возможность продемонстрировать увеличение активности с использованием соответствующего субстрата, однако индуцированного агрегацией увеличения Syk-химерной активности не наблюдалось также и при использовании нами для измерения киназной активности экзогенного пептидного субстрата (замена Y 19 K остатков 6 - 20 cdc 2).
Возможные механизмы
Механизм, с помощью которого простое физическое явление, а именно агрегация рецептора, приводит к передаче обнаружимого химического сигнала клетками иммунной системы, остается пока неясным. Предварительные исследования показали, что киназы семейства Src могут ассоциироваться со многими важными активируемыми агрегацией рецепторами иммунной системы и что перекрестное связывание таких рецепторов часто приводит к увеличению киназной активности. Совсем недавно было обнаружено, что родственные киназы Syk и ZAP-70 ассоциируются стабильно (в случае Syk) либо временно (в случае ZAP-70) с B- и T-клеточными рецепторами для антигена, соответственно, и, по крайней мере, в случае Syk, было установлено, что перекрестное связывание рецептора приводит к увеличению киназной активности.
В этой работе было показано, что в клетках, в которых отсутствует T-клеточный рецептор, к кальциевому ответу приводит агрегация киназ семейства Syk, но не агрегация киназ Sck или Fyn семейства Src. Очевидно, что этот ответ не обусловлен непрямой ассоциацией с другим T-клеточным рецептором или другими компонентами передачи сигнала, поскольку мутанты, являющиеся негативными по киназной активности, не могли индуцировать кальциевый ответ. Для индукции специфического цитолиза достаточно агрегации химер, содержащих киназу Syk, тогда как для индукции аналогичного цитолиза химерой ZAP-70 требуется еще и участие киназы семейства Src. До сих пор остается неясным, которая из киназ семейства Syk играет более важную роль в активации T-клеток: обе киназы ZAP-70 и Syk экспрессируются в T-клетках, включая клеточные линии, используемые в данном исследовании, и, по крайней мере, одна восприимчивая T-клеточная линия человека содержит Syk, а не ZAP-70, как было установлено путем оценки конкретных продуктов PCR-амплификации. Характер повышения тирозин-фосфорилирования белка, наблюдаемого после образования кластера Syk-химеры, очень похож на характер фосфорилирования, наблюдаемого после перекрестного связывания T-клеточного рецептора для человека.
Одна простая модель активации клеток иммунной системы нерецепторными тирозин-киназами заключается в том, что агрегация ассоциированных с рецептором киназ приводит к активации либо путем физического ассоциирования (например путем образования активных киназных димеров), либо путем ферментативного взаимодействия (например путем перекрестного фосфорилирования), после чего активированный фермент воздействует на ключевые внутриклеточные субстраты, необходимые для мобилизации кальция и синтеза инозитолфосфата. Подтверждение для этой последовательности событий может быть найдено в исследованиях, сообщающих об увеличении активности ассоциированной с рецептором киназы после перекрестного связывания рецептора (например Bolen
et al. , 1991, Adv. Cancer Res. 57: 103-149; Byrk-hardt et al., 1991, Proc. Natl. Acad. Sci. USA 88: 7410-7414; Eiseman & Bolen, 1992, Nature 355: 78-80; Hutchcroft et al., 1992, Proc. Natl. Acad. Sci. USA 89: 9107-9111/ J. Biol. Chem. 267: 8613-8619; Tsygankov et al., 1992, J. Biol. Chem., 267: 18259-18262; Wong et al., 1992, Oncogene 7: 2407-2415). Однако в большинстве случаев сообщаемые изменения киназной активности являются весьма скромными и явно контрастируют с резкими изменениями характера фосфорилирования белка, наблюдаемого in vivo. Поскольку при использовании in vitro-анализа в качестве способа определения киназной активности трудно с полной уверенностью исключить активацию посредством слабых аллостерических взаимодействий, то мы не можем сделать однозначную оценку относительной роли киназной активации в инициации трансдукции сигнала. Однако представленные в настоящей заявке данные позволяют предположить, что индуцированное агрегацией перераспределение фермента и субстрата может быть важным фактором в нацеливании имеющейся активности против соответствующей физиологической мишени.
Агрегация химер, полученных на основе киназ семейства Syk, приводит к кальциевому ответу, который возникает с небольшой задержкой, но который по амплитуде аналогичен ответу, наблюдаемому после агрегации дзета-рецепторных химер в клетках, не содержащих эндогенный T-клеточный рецептор. Более длительная задержка в появлении свободных ионов кальция наблюдалась после перекрестного связывания химеры ZAP-70, и эта задержка могла быть, в основном, отменена перекрестным связыванием химер ZAP-70 и Fyn. Объяснение наблюдаемой латентности пока еще не найдено. Поскольку перекрестное связывание способствует ускорению мобилизации кальция, то возникает желание приписать эту задержку относительной неэффективности химеры ZAP-70 для опосредованной агрегацией аутоактивации. Однако такую же важную роль могут играть другие факторы, и прикрепление киназ ZAP и Syk к клеточной поверхности может фактически служить препятствием для активации в отличие от нормального процесса; например при нормальном течении событий киназы семейства Syk мгновенно пополняются для рецепторных кластеров, активируются, а затем высвобождаются, диффундируя в свои субстраты, причем непрерывное связывание киназного домена с плазматической мембраной может ограничиваться путем затруднения доступа к субстрату и/или путем ограничения амплификации сигнала вследствие неспособности химерных рецепторов функционировать в качестве каталитического центра для активации киназы.
Второй специфической особенностью кальциевого ответа было то, что положительные в отношении T-клеточного рецептора клетки, экспрессирующие химеры на основе Syk человека или свиньи, обнаруживали высокую базовую концентрацию свободных ионов, кальция, что позволяет сделать предположение о самопроизвольном "запуске" высвобождения кальция. Для рецепторотрицательных клеток аналогичного явления не наблюдалось. Этот результат противоречит обычно наблюдаемым явлениям, где негативные в отношении T-клеточного рецептора мутанты T-клеточных опухолевых линий человека являются обычно сверхчувствительными к экзогенно вводимым триггерным молекулам. Тот очевидный факт, что в процессе спонтанной активации необходим T-клеточный рецептор, может иметь два взаимосвязанных объяснения. Одно из них заключается в том, что химерная Syk-хиназа может конститутивно воздействовать на внутриклеточные домены T-клеточного рецептора, создавая фосфотирозин-мишени для SH2-доменов рецепторной химеры, что приводит к внутриклеточной агрегации посредством мультивалентной мостиковой связи T-клеточного рецептора и, тем самым, к стимулированию активации киназы. Другое возможное объяснение заключается в том, что негативная в отношении T-клеточного рецептора линии клеток может иметь более низкие уровни мембрано-ассоциированной киназы, чем те, которые необходимы для активации Syk, либо потому, что глобальная регуляторная цепь приводит к снижению de novo-синтеза гипотетической киназы, либо потому, что отсутствие антигенного рецептора приводит к разрегулированию направленной внутриклеточной миграции.
Имеются сообщения, что в B-клетках, Syk-киназа конструктивно ассоциируется с внутриклеточными элементами рецептора IgM для антигена (Hutchcroft et al. , 1992, Proc. Natl. Acad. Sci. USA 89:9107-9111; Hutchcroft et al., 1992, J, Bio. Chem. 267:8613-8619). Точный механизм такого ассоциирования пока неясен, однако, возможно, что фосфотирозин не требуется для взаимодействия SH2-доменов Syk с тирозин-триггерным мотивом, присутствующим в цитоплазматическом домене цепей рецепторов mb-1 и B29. Основанием для такого предположения является отчасти сообщение о том, что продукт BCR гена области локализации сайта инициации реаранжировки в хромосоме "Philadelphia" связывается с рядом SH2-доменов фосфотирозин-независимым образом (Pendergast et al. , 1991, Cell 66:161-171; Muller et al., 1992, Mol, Cell. Biol. 12:5087-5093). В этом случае, однако, возможно, что критическую роль в этом взаимодействии играют остатки фосфотреонина. Альтернативно, Syk может ассоциироваться с внутриклеточными мотивами рецептора IgM посредством уникальной области, расположенной между элементами SH2 Syk и каталитическим доменом. Возможно и третье объяснение, которое заключается в том, что для пополнения функционально важных уровней Syk во внутреннюю поверхность плазматической мембраны требуется лишь очень небольшое количество тирозин-фосфорилированного пептида, а поэтому такой низкий уровень тирозинфосфата трудно поддается детекции.
Хотя необходимость киназы семейства Src для активации в B-клетках точно не установлена, однако методами соматической генетики или генетики микроорганизмов было показано, что в T-клетках две киназы, а именно Sck и Fyn (T) играют важную роль (Appleby et al., 1992, Cell 70: 751-763; Karnitz et al., 1992, Vol. Cell. Biol. 12: 4521-4530; Stein et al., 1992, Cell 70: 741-750; Straus & Weiss, 1992, Cell 70: 585-593). До сих пор мы окончательно не установили предшествует ли действие этих киназ действию киназ семейства Syk или следует за ним. Одна из гипотез, объясняющая действие ZAP-70 в T-клетках, заключается в том, что агрегация рецептор-ассоциированной киназы семейства Src, способствующая кратковременному фосфорилированию рецепторных цепей, приводит, в свою очередь, к ассоциации ZAP-70, и последующей клеточной активации. Начальное фосфорилирование рецепторных цепей, о котором предполагается в этой модели, должно отличаться от стабильного фосфорилирования дзета, наблюдаемого в течение более продолжительного времени после перекрестного связывания рецептора.
В мышиных T-клетках небольшая часть T-клеточных рецепторных комплексов содержит дзета-родственную молекулу, называемую "эта" (Baniyash et al., 1988, J. Biol. Chem. 263: 9874-9878), которая представляет собой альтернативно сплайсированную форму (Clayton et al., 1991, Proc. Natl. Acad. Sci. USA 88: 5202-5206). "Эта" отличается от "дзеты" своим карбоксильным концом и не содержит наиболее удаленный из шести тирозинов, присутствующих в мышиной "дзета"-молекуле (Jin et al., 1990, Proc. Natl. Acad. Sci. USA 87: 3319-3323). Хотя фосфорилирование дзета-цепи дзета-дзета-изоформ мышиных TCR может быть легко обнаружено после антитело-опосредованного перекрестного связывания рецептора, однако фосфорилирование "эта"-цепи TCR, при аналогичных условиях, обнаружено не было (Bauer et al., 1991, Proc. Natl. Acad. Sci. USA 88: 3842-3846). Для стабильного фосфорилирования дзета-цепи, очевидно, требуются две близко расположенные друг к другу дзета-цепи, поскольку TCR-изоформы, несущие дзета-эта-гетеродимеры не фосфорилируются после перекрестного связывания с рецептором (Bauer et al., 1991, Proc. Natl. Acad. Sci. USA 88: 3842-3846). Несмотря на различия в фосфорилировании, клеточные линии, несущие TCR-изоформы, состоящие лишь из "эта"-гомодимеров, функционально не отличаются от клеточных линий, несущих лишь "дзета"-гомодимеры (Bauer et al., 1991, Proc. Natl. Acad. Sci. USA 88: 3842-3846). Так, например, фосфорилирование "дзета", наблюдаемое через 30 минут после антитело-опосредованной агрегации рецептора, не коррелировало с активацией. Отдельные исследования, проведенные для оценки времени прохождения аккумуляции фосфотирозиновых фосфопротеинов после TCR-агрегации, показали, что молекулами, наблюдаемыми ранее всего, являются два белка массой 135 и 100 кДа, первоначальное фосфорилирование клеток обнаруживается через 5 и 15 секунд после перекрестного связывания, соответственно, а полумаксимум фосфорилирования в обоих случаях наблюдается приблизительно через 30 секунд и предшествует временам достижения полумаксимума мобилизации кальция и образования инозитолфосфата (June et al., 1990, Proc. Natl. Acad. Sci USA 87: 7722-7726; June et al. , 1990, J. Immunol. 144: 1591-1599). В противоположность этому скорость фосфорилирования "дзета" является значительно более медленной, что приводило к полумаксимальной замене приблизительно через 3 - 5 минут после стимуляции, явно наблюдаемой после аккумуляции кальция и высвобождения инозитолфосфатов (June et al., 1990, Proc. Natl. Acad. Sci. USA 87: 7722-7726; June et al., 1990, J. Immunol., 144: 1591-1599).
Таким образом, если эта двухступенчатая модель правильна, то фосфорилирование по тирозину, необходимое для пополнения ZAP-70 во внутреннюю поверхность плазматической мембраны, должно быть более быстрым или даже мгновенным событием, чем то, которое наблюдалось в вышеописанных исследованиях. Недавно было высказано предположение, что тирозин-фосфорилирование с соответствующим быстрым (примерно 15 с) началом может быть обнаружено на дзета- и CD3-эпсилон-цепи после перекрестного связывания рецепторов (Wange et al., 1992, J. Biol. Chem. 267:11685-11688), и что 70 кДа-белок, несущий тирозин-фосфат, может быть обнаружен в форме ассоциации с обеими дзета- и эпсилон-цепями. Однако до сих пор еще не выяснено, является ли стабильная ассоциация с фосфорилированными рецепторными цепями необходимым предварительным условием для успешной активации T-клеток.
Однако, вообще говоря, имеющиеся результаты дают основание предположить, что киназы семейства Syk действуют на эффекторный аппарат T-клеток более прямым способом, чем киназы семейства Src. Все возрастающее число данных позволяет предположить, что киназы семейства Src могут ассоциироваться с рядом молекул клеточной поверхности, которые не являются членами семейства антигенных/Fc-рецепторов, включая CD2 (Bell et al., 1992, Mol. Cell. Biol. 12: 5548-5554), CD23 (Sugie et al., 1991, Proc. Natl. Acad. Sci. USA 88:9132-9135), CD36 (Huang et al., 1992, J. Biol Chem. 267:5467-5473), бета-цепь рецептора 11-2 (Ha akeya et al., 1991, Science, 252:1523-1528), и различные фосфатидилинозитол-"заякоренные" белки (Stefanova et al., 1991, Science, 254: 1016-1019; Thomas & Samelson, 1992, J. Biol. Chem. 267:12317-12322), некоторые из которых, как известно, требуют дополнительного присутствия антигенного рецептора для стимуляции активации в T-клетках. Простым объяснением такого требования может быть то, что триггерные мотивы на антигенном рецепторе действуют как субстраты для киназ семейства Sre, способствуя последующему "причаливанию" киназ семейства Syk, за которым, вероятно, следует некоторая модификация события, стимулирующего их активацию. Учитывая трудность установления, какая именно цепь ответственна за фосфорилирование и активацию, можно также предположить, что триггерные мотивы играют лишь временную роль и действуют как каталитический центр для рекрутинга (т.е. обновления), активации и высвобождения эффекторных киназ.
Киназы семейства Src широко распределены по негематопоэтическим линиям дифференцировки, и недавно проведенные исследования с использованием Fyn-негативных мышей показали, что Fyn играет определенную роль в поддержании длительного потенциирования; при этом феномен упрощенной синаптической передачи, очевидно, лежит в основе начальной консолидации ассоциативной памяти (Grant et al., 1992, Science, 258:1903-1910). В случае, если аналогичные пути активации опосредуются киназами семейства Src других типов клеток, то оказывается, что киназы семейства Syk могут быть также более широко распределены по экстрагематопоэтическим компартментам.
Экспериментальные методы
Конструирование химер.
Целые кодирующие области киназ Lck человека (Koga et al., 1986, Eur. J. Immunol, 16:1643-1646), Fyn (T) мыши (Cooker Derlmutter, 1989, New. Biol. 1: 66-74) Syk свиньи (Taniguch; et al., 1991, J. Biol. Chem. 266:15790-15796) и ZAP-70 человека (Chan et al., 1992, Cell 71:649-662) присоединяли к внутриклеточному домену химерного трансмембранного белка, состоящего из внеклеточного домена CD16, соединенного с коротким стеблеобразным сегментом, и трансмембранного домена CD7. Внутриклеточный домен CD7 был усечен в области терминации переноса путем добавления Mlu-сайта. Различные киназы модифицировали с использованием Mlu-сайта в соответствующей рамке считывания для осуществления экспрессии гибридного трехкомпонентного белка. Последовательность Syk свиньи получали путем обратной транскрипции и полимеразноцепной реакции (PCR) полной РНК лимфоцита свиньи с использованием праймеров, несущих соответствующие рестрикционные сайты. Последовательности ZAP-70 были получены аналогичным образом из кДНК-библиотеки T-клеток человека с помощью PCR. Несколько изолятов были параллельно секвенированы, и для каждой киназы, путем замены рестрикционных фрагментов, были получены кодирующие и не содержащие мутаций последовательности. Полученные кодирующие последовательности вставляли в экспрессирующий вектор вакцинного вируса ниже 5'--->3') от последовательностей CD16/CD7. Киназу Syk человека выделяли из кДНК-библиотеки природных клеток-киллеров и из библиотеки клеток Daudi с использованием праймеров, соответствующих концам последовательности свиньи. Прямой праймер имеет последовательность:
ATG GCA GAC AGT GCC AAC CAC TTG CCC TTC TTC T, а обратный праймер имеет последовательность:
CGC GGG GCG GCC GCT TTA ATT CАC CАC GTC GTA GTA GTA.
После первоначальной амплификации, выявившей наличие полос ожидаемых размеров, осуществляли реамплификацию (10 циклов) с использованием удлиняющего праймера, y 5'-конца, имеющего последовательность:
CGC GGG ACG CGT ACC ATG GCA GAC AGT GCC AAC,
что позволяло лигировать фрагмент с Mlu 1-рестриктированным вектором.
Анализ на мобилизацию кальция
Проточный цитометрический и объемный спектрофотометрический анализы проводили на клетках, экспрессирующих рекомбинантные киназы, с использованием чувствительного к кальцию флюорофора 1ndo-1, как описано выше (Remeo & Seed, 1991, Cell. 64:1037-1046); Remeo et al., 1992, Cell. 68:889-897). Короче говоря, клетки мутантной сублинии J PT 3. T3.5 Jurkat (Weiss & Stodo, 1984, J. Exp, Med. 160:1284-1299) инфицировали рекомбинантными вакцинными вирусами в течение одного часа в бессывороточной IMDM, при множественности заражения, равной 10, и инкубировали в течение 3 - 9 часов в IMDM, содержащей 10% FBS. Клетки собирали путем центрифугирования и ресуспендировали при 3•106/мл в полной среде, содержащей 1 мМ ацетометоксиэфир Indo-1 (Qrynkiewicz et al., 19825, J. Biol. Chem. 260:3440-3450) (Molecular Probes, Eugene, OR), а затем инкубировали в течение 45 минут при температуре 37oC. Клетки, покрытые Indo-1, осаждали и ресуспендировали при 1•106/мл в бессывороточном IMDM, а затем хранили в темноте при комнатной температуре. Клетки анализировали на свободные ионы кальция путем одновременного измерения фиолетового и синего флюоресцентного излучения с помощью проточной цитометрии (Rabinovitch и др., 1986, J. Immunol. 137:952-961). Для инициации потока кальция к клеточной суспензии добавляли либо неконъюгированное моноклональное антитело 3G8 (против CD16) (при 1 мкг/мл), с последующим добавлением 10 мкг/мл конъюгированного с фикоэритрином (PE) Fab 02-козьего антитела против мышиных IgG при времени O, либо PE-конъюгированное антитело против CD4 (Leu 3a, Beckton Dikinson), с последующим добавлением неконъюгированного "второго" антитела. Гистограммы отношения фиолетового/синего излучения получали от PE-положительной (инфицированной) клеточной популяции, которая обычно представлена 40 - 80% клеток. Отношение фиолетового/синего излучения перед добавлением антитела использовали для установления нормализованного начального отношения, принимаемого за единицу.
Анализ на цитолиз лимфоцита
CD8+ CD4- HLA B44-рестриктированную цитолитическую линию HLA B44 (WH3) поддерживали в IMDM, содержащей 10% человеческую сыворотку со 100 U/мл 1L-2, и периодически стимулировали облученными (3000 рад) моноядерными клетками, имеющими гаплотип HLA B44. Клетки инфицировали рекомбинантным вакцинным вирусом при множественности заражения приблизительно 10 в бессывороточной среде в течение одного часа, а затем инкубировали в полной среде в течение трех часов. После этого клетки собирали путем центрифугирования, и ресуспендировали при плотности 1•107/мл. 100 мкл клеток добавляли в каждую лунку для микротитрования с U-образным дном, которая содержала 100 мкл/лунку полной среды. Затем клетки подвергали двукратному ступенчатому серийному разведению. Две лунки для каждого образца не содержали лимфоцитов, что позволяло измерять спонтанное высвобождение хрома и полное поглощение хрома. Аликвоту 106 клеток-мишеней 3G8 10-2 (Shen и др., 1989, Mol. Immunol. 26: 959-969) центрифугировали и ресуспендировали в 50 мкл стерильного 51Cr хромата натрия (1 м Ки/мл, Du Pont) в течение одного часа при температуре 37oC, периодически перемешивали, а затем три раза промывали PBS. В каждую лунку добавляли 100 микролитров меченых клеток, ресуспендированных в среде при 105/мл. Планшет для микротитрования центрифугировали при 750хg в течение 1 минуты, и инкубировали в течение 4 часов при температуре 37oC. По окончании периода инкубирования клетки в каждой лунке ресуспендировали путем мягкого пипетирования, образец удаляли для определения полного числа клеток с включенной радиоактивной мягкой, а планшет для микротитрования центрифугировали при 750хg в течение 1 минуты. 100 мкл-аликвоты супернатанта удаляли и подсчитывали в сцинтилляционном счетчике гамма-излучения. В отношение эффектор/мишень были внесены поправки на процент инфицированных эффекторных клеток (обычно>70%).
Конструирование мутантных киназных химер
Вариант гибридного белка, негативного по отношению к киназе Syk свиньи, конструировали путем расщепления химер ферментами StuI и NotI (NotI расположен непосредственно y 3'-(карбокси)конца), заполнения NotI-сайта и лигирования обоих концов. Полученная последовательность соединяла первые 298 остатков Syk свиньи с 4 дополнительными остатками (GPRL), расположенными перед сайтом терминации. Точечную мутацию (K369G) в ATP-сайте связывания ZAP-70 создавали путем инсерции двухцепочечного олигонуклеотидного фрагмента между Ball- и Ear1-сайтами, расположенными между нуклеотидными остатками 1319 и 1345 верхней нити последовательности, описанной Chan et al., (1992, Cell 71: 649-662). Полученные последовательность кодировала в остатке 369 глицин вместо лизина.
Иммунопреципитация и киназный анализ
Приблизительно 2•106 клеток HeLa S3 инфицировали в течение одного часа в бессывороточной среде DME рекомбинантным вакцинным вирусом при множественности заражения, равной приблизительно 10. Через 5 часов после инфицирования клетки собирали, дважды промывали фосфатнобуферным солевым раствором и лизировали в 1% Тритоне X-100, 0,15 M хлориде натрия (NaCl), 0,02 M HEPES при pH-7,3, 5 мМ ЭДТК, 5 мМ NaF, 0,2 M MNAVO3, 10 мкг/мл leu-пептине, 10 мкг/мл протинина, и 1 мМ PMSF. После 10-минутного инкубирования на льду ядро клетки удаляли путем центрифугирования, а гибридные белки CD16 подвергали иммунопреципитации с антителом BMA209/2 и протеин-A-сефарозой. Смолу, нагруженную гибридным белком, три раза промывали лизирующим буфером с последующей конечной промывкой 20 мМ HepeS при pH=7,3. К каждому образцу добавляли 10 мкл киназного буфера (20 мМ Hepes при pH=7,3, 10 мМ MgCl2, 10 мМ MnCl2), содержащего 10 мкКи [ γ-32P]ATP(>3000 Ки/мМ). Реакционные смеси оставляли для инкубирования при комнатной температуре на 10 минут, а затем терминировали путем добавления 20 мкл 2X буфера для загрузки образца (4% ДСН, 100 мМ Трис (pH=6,8), 20% глицерина, и 10% β-меркаптоэтанол). После кипячения образцов в течение 3 минут аликвоты прогоняли на 4 - 15% градиентном геле. Анализы на киназу с использованием растворимого пептидного субстрата, соответствующего положениям 6 - 20 cdc 2, в которых tyr 20 был заменен на lys, осуществляли в соответствии с рекомендациями изготовителя (UB1).
Иммуноблот-анализ на фосфорилирование протеин-тирозина
TCR-негативные клетки 3,5-инфицировали рекомбинантными вирусными штаммами (множественность заражения, равная, по крайней мере, 10) в течение одного часа. Затем клетки инкубировали в течение 8 - 12 часов при температуре 37oC, центрифугировали, промывали и ресуспендировали в бессывороточной среде, модифицированной по методу Исков, при плотности клеток 107/мл. Аликвоты клеток инкубировали с mAb против CD16 (3G8, Medarex или BMA209/2, Behringwerke) при 1 мкг антитела на 2 - 3•106 клеток. После этого стимулированные образцы инкубировали с 3 - 5 кратным избытком аффинно-очищенного антитела против мышиного иммуноглобулина IgG (Southern Biotechnology) в течение 5 минут. Затем клетки были обработаны в соответствии с методами Secrist, J.P., Burns, L. A. , Karnitz. L., Koretzky. G.A. и Abraham. R.T. (J. Biol. Chem. 268, 5886-5893, 1993), с небольшими модификациями. Инкубирование завершали путем добавления ДСН до конечной концентрации 1% и образцы кипятили в течение 3 минут. ДНК фрагментировали путем обработки ультразвуком в течение 1 минуты с использованием Heat Systems Ultrasonics, Inc., добавляли 2X буфер для образца, а аликвоты, соответствующие 105 - 2,5•105 клеткам, отделяли на полиакриламидном геле, после чего белки переносили на нитроцеллюлозу (Schleicher и Schuells BA45) с помощью полусухого электроблоттинга (Hoefer). Фильтры блокировали в течение 1 часа в солевом растворе, забуференном Трис, с использованием 0,05% Твин-20 (TBST), содержащем 1,5% овальбумин цыпленка (Sigma), после чего промывали в TBST, переносили в раствор, содержащий антифосфотирозиновое антитело 4G10 (UB1) при разведении 1:10000, а затем инкубировали в течение 1 - 2 часов при 22oC. После промывок TBST фильтры инкубировали в TBST и в течение одного часа разводили 1:5000 антимышиным конъюгатом с пероксидазой хрена. Фосфорилированные белковые полосы обнаруживали с помощью хемилюминесценции (ECL, Amerchat). Время экспонирования варьировалось от 2 секунд до 5 минут.
Конструирование химер на основе IgG1 человека: протеин-тирозин-киназы
Могут быть получены химерные молекулы, которые включают в себя внеклеточный домен молекулы антитела, специфического для клетки-мишени, и внутриклеточный домен протеин-тирозин-киназы (например, киназы, описанной выше). Для получения такой молекулы последовательности тяжелой цепи IgG1 человека получали путем присоединения последовательностей в домене CH3 к кДНК-фрагменту, происходящему от 3' конца трансмембранной формы мРНК антитела. 3'-концевой фрагмент получали с помощью полимеразно-цепной реакции, используя в качестве субстрата библиотеку кДНК лимфоидной ткани и олигонуклеотидов, имеющих последовательности:
CGC GGG GTG ACC GTG CCC TCC AGC AGC TCG GGC
и CGC GGG GAT CCG TCG TCC AGA GCC CGT CCA GCT CCC CGT CCT GGG CCT CA,
соответствующие 5'- и 3' - концам нужным ДНК-фрагментов, соответственно. 5'-олигонуклеотид является комплементарным сайту в домене CH1 IgG1 человека, а 3'-олигонуклеотид является комплементарным сайту, расположенному непосредственно y 5'-конца последовательностей, кодирующих трансмембранный домен. PCR-продукт гидролизовали ферментами Bst XI и Bam HI, и лигировали между Bst XI- и Bam HI-сайтами полусинтетического гена антитела IgG1, несущего вариабельные и константные области. После инсерции Bst XI-Bam HI-фрагмента, амплифицированные части конструкции помещали выше Smal-сайта в CH3 путем обмена рестрикционных фрагментов для того, чтобы в результате PCR-реакции была получена только часть, находящаяся между Smal-сайтом и 3'-олиго.
Для создания IgG1-химерного рецептора человека ген тяжелой цепи, оканчивающийся в Bam HI-сайте, присоединяли к нужному внутриклеточному домену киназы с помощью стандартной техники. Уровни продуцирования химерного рецептора могут быть определены с помощью проточной цитометрии. Повышение продуцирования может быть достигнуто путем совместной экспрессии плазмиды, кодирующей кДНК легкой цепи антитела.
Для создания одной транскрипционной единицы, которая позволяет экспрессировать тяжелые и легкие цепи от одного промотора, плазмиду, кодирующую бицистронную мРНК, создавали из последовательностей, кодирующих тяжелые и легкие цепи, и 5'-нетранслируемой части мРНК, кодирующей регуляторный белок 78 кД глюкозы, известный еще как grp78 или BiP. Последовательности grp78 получали с помощью полимеразно-цепной реакции геномной ДНК человека с использованием праймеров, имеющих последовательности:
CGC GGG CGG CCG CGA CGC CGG CCA AGA CAG CAC
и CGC GTT GAC GAG CAG CCA GTT GGG CAG CAG CAG
y 5'- и 3' - концов соответственно. Полимеразно-цепные реакции с этими олигонуклеотидами осуществляли в присутствии 10%-ного диметилсульфоксида. Фрагмент получали с помощью полимеразно-цепной реакции и переваривали ферментами Not 1 и Hinc II, а затем вставляли между NotI- и Hpal-сайтами ниже последовательностей, кодирующих IgG1 человека. После этого последовательности, кодирующие кДНК легкой каппацепи IgG1 человека, вводили ниже лидера grp78, с использованием HincII-сайта, и другого сайта в векторе. Экспрессирующая плазмида, полученная в результате этих манипуляций, включала в себя: полусинтетический ген тяжелой цепи, за которым следовали лидерные последовательности grp78, а за этими последовательностями были расположены кДНК последовательности легкой каппа-цепи, за которыми находились сигналы полиаденирования, происходящие от ДНК-фрагмента SV40. Ранее нами было показано, что трансфекция COS-клеток этой экспрессирующей плазмидой давала заметное увеличение экспрессии детерминантов тяжелой цепи по сравнению с трансфекцией плазмиды, кодирующей только лишь детерминанты тяжелой цепи.
Для создания бицистронного гена, включающего в себя химеру тяжелой цепи/рецептора, и легкую цепь, последовательности тяжелой цепи, расположенные выше, могут быть заменены любым химерным геном тяжелой цепи/рецептора, описанным ниже.
После конструирования, IgG1-тирозин-киназные химеры могут быть клонированы в экспрессирующий вектор, введены в клетку-хозяина и проанализированы с помощью любого из анализов, описанных выше (например, с помощью анализа на мобилизацию кальция или на цитолизис).
Конструирование CD4-тирозин-киназных химер
Могут быть продуцированы химерные молекулы, которые включают в себя внеклеточный домен молекулы CD4 и внутриклеточный домен протеин-тирозин-киназы (например, киназы, описанной выше). Для продуцирования такой молекулы была выделена последовательность, кодирующая тирозин-киназу (например, кДНК) (как описано выше). Затем эту последовательность присоединяли к внеклеточному домену сконструированной формы CD4, имеющей Bam HI-сайт непосредственно ниже трансмембранного домена (Aruffo et al., Proc. Natl. Acad. Sci. США, 84: 8573-8577 (1987); Zettlemeissl et al., DNA Cell. Biol., 9347-9353 (1990)), используя стандартную технику. Для образования этого гибридного белка Bam HI-сайт может быть встроен в последовательность при соответствующей локализации (также с помощью стандартной техники). Гибриды венов вводили в плазмиду, экспрессирующую вакцинный вирус (как описано выше), а затем вставляли в геном вакцинного штамма WR путем гомологичной рекомбинации и отбирали для культивирования в микрофеноловой кислоте (Falkner et al., J. Virol., 65: 1849-1854 (1988); Boyle и al., Gene 65:123-128 (1988)). Проточный цитометрический анализ использовали для оценки экспрессии с помощью вакцинных рекомбинантов тирозин-киназных гибридных CD4-белков на клеточной поверхности. Иммунопреципитацию клеток, инфицированных вакцинными рекомбинантнами, использовали для подтверждения результатов (как описано выше).
Эффективность CD4-химер может быть проанализирована с помощью анализа на мобилизацию кальция или анализа на цитолиз, описанных в настоящей заявке. В одном из конкретных примеров создавали модель "мишень: эффекторная система", основанную на CD4-распознавании комплекса gp120/gp41 оболочки ВИЧ. Клетки HeLa инфицировали рекомбинантными вакцинными вирусами, экспрессирующими gp120/gp41 (Chakrabart; et al., Nature, 320: 535-537 (1986); Earl. et. al., J. Virol, 64:2448-2451 (1990)), и метили 51Cr. Эти меченые клетки инкубировали с клетками линии аллоспецифических (CD8+ Cd4-) цитотоксических T-лимфоцитов, которые были инфицированы вакцинными рекомбинантами, экспрессирующими CD4-тирозинкиназные химеры, и оценивали на специфический лизис.
Для того, чтобы проверить, может ли вакцинная инфекция стимулировать искусственное распознавание клетками CTL, были осуществлены аналогичные эксперименты по цитолизу с использованием клеток-мишеней, инфицированных вакцинными рекомбинантами, экспрессирующими фосфатидилинозитов-связанную форму CD16 (CD16p1), меченную 51Cr, и с использованием CTL, инфицированных контрольными рекомбинантами, экспрессирующими CD16-химеры.
В другом примере наиболее подходящими клетками для экспрессии CD4-тирозин-киназы химер были нейтрофильные гранулоциты, которые имеют очень короткое время жизни (≈4 часа) в кровотоке и являются в высокой степени цитолитичными. Инфицирование нейтрофилов вирусом ВИЧ, как правило, не приводит к высвобождению вируса, и обилие этих клеток (наиболее распространенных из лейкоцитов) должно облегчить иммунную защиту организма-хозяина. Другим подходящим вариантом для клеток-хозяев являются зрелые T-клетки, т.е. популяция клеток, которая в настоящее время является наиболее доступной для ретровирусной инженерии (Rosenberg, S.A. Sci. Am., 262:62-69 (1990)). С помощью рекомбинантных 1L-2, T-клеточные популяции могут относительно легко размножаться в культуре, а размноженные популяции обычно имеют ограниченное время жизни при повторной инфузии (Rosenberg et al., N. Engl. J. Med. 323:570-578 (1990)).
При соответствующих условиях распознавание ВИЧ клетками, экспрессирующими CD4-химеры, также должно обеспечивать митогенное стимулирование, что допускает возможность динамического ответа "вооруженной" клеточной популяции на вирусную нагрузку. Хотя в настоящем описании мы сконцентрировали свое внимание на поведение гибридных белков в цитолитических T-лимфоцитах, однако экспрессия химер в хелперных лимфоцитах также может служить ВИЧ-мобилизованным источником цитокинов, которые могут противодействовать коллапсу субпопуляции хелперных клеток при СПИДе. Появившиеся недавно описания нескольких схем для разработки способов защиты от инфекции не на стадии проникновения вируса, а на других стадиях (Friedman et al., Nature, 335:452-454 (1988); Green et al. , Cell. 58: 215-223 (1989); Malim et al., Cell, 58:205-214 (1989); Trono et al. , Cell, 59:113-120 (1989); Buonocore et al., Nature, 345: 625-628 (1990)), дают основание предположить, что клетки, несущие CD4-химеры, могут быть сконструированы в целях предотвращения продуцирования вируса путем экспрессии соответствующих агентов, имеющих внутриклеточный участок действия.
Способность к передаче сигналов T-лимфоцитам посредством автономных химер также влечет за собой способность к регуляции in vivo лимфоцитов, полученных путем ретровирусного конструирования. Перекрестная сшивка, опосредованная, например, специфическими антителами IgM, сконструированными для удаления комплемент-связывающих доменов, может способствовать увеличению числа лимфоцитов in situ, тогда, как обработка аналогичными специфическими антителами IgG (например, распознающими аминокислотные модификации, сконструированные в химерной цепи) может селективно истощать сконструированную популяцию. Ранее, нами было установлено, что анти-CD4 антитела IgM не требуют дополнительного перекрестного связывания для мобилизации кальция в клетках Jurkat, экспрессирующих CD4-химеры. Способность регулировать клеточные популяции, не прибегая к повторной экстракорпоральной амплификации, может значительно расширить границы и повысить эффективность имеющихся способов использования генетически сконструированных T-клеток.
Другие варианты осуществления изобретения
Для создания других химер, состоящих из внутриклеточных последовательностей киназных белков, кДНК или геномные последовательности, кодирующие внеклеточный домен рецептора, могут быть наделены рестрикционным сайтом, введенным непосредственно перед выбранным внеклеточным доменом. Фрагмент внеклеточного домена, оканчивающийся в рестрикционном сайте, может быть затем присоединен к последовательностям протеин-киназы. Типичные внеклеточные домены могут происходить от рецепторов, которые распознают комплемент, углеводы, вирусные белки, бактерии, протозойные организмы, многоклеточные паразиты или белки, индуцированные этими паразитами. Аналогичным образом лиганды или рецепторы, экспрессированные патогенами или опухолевыми клетками, могут быть присоединены к протеин-киназным последовательностям для индуцирования непосредственного иммунного ответа против клеток, несущих рецепторы, распознающие указанные лиганды.
Для идентификации минимальных протеин-киназных последовательностей необходимых для цитолиза, могут быть получены с использованием стандартной техники серии делеционных мутантов с последовательно возрастающими делециями во внутриклеточном домене киназы. Эти делеционные мутанты были проанализированы на эффективность с помощью анализов, описанных выше. Подходящими внутриклеточными доментами для протеин-киназы Syk были, например, аминокислоты 336 - 628 последовательности Syk свиньи и аминокислоты 338 - 630 последовательности Syk человека.
Хотя настоящее изобретение описано выше на конкретных примерах его осуществления, однако следует иметь в виду, что в него могут быть внесены дополнительные модификации, в связи с чем подразумевается, что настоящее изобретение не ограничивается изложенными вариантами его осуществления и что возможны отклонения от них в пределах существа и объема изобретения, определенных в нижеследующей формуле изобретения.
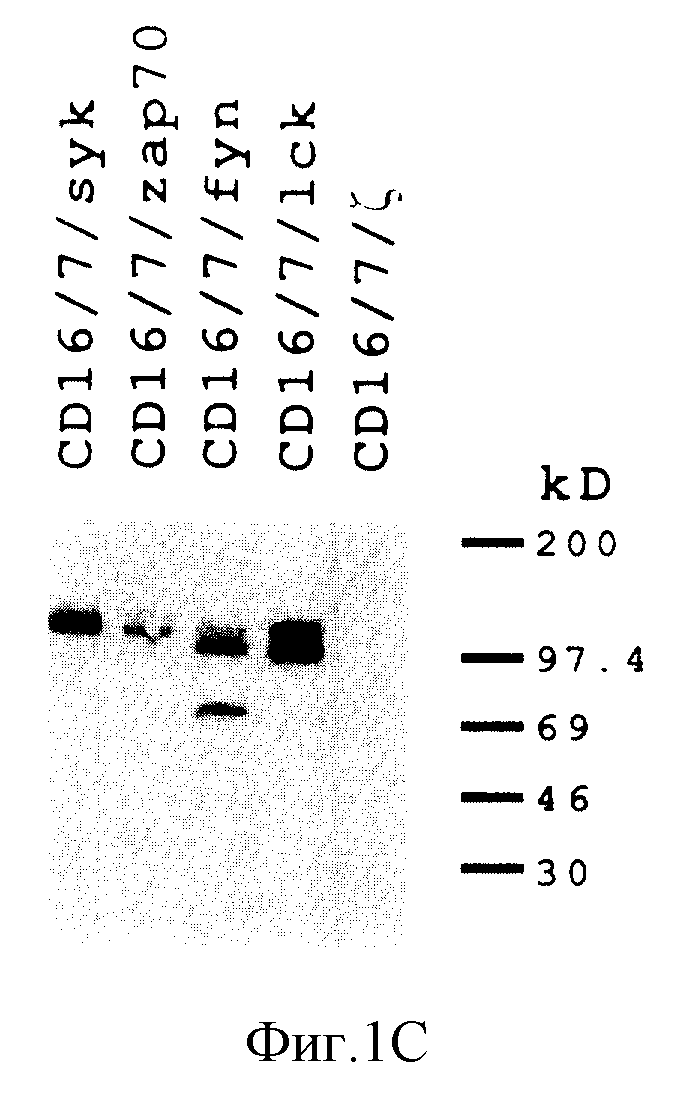
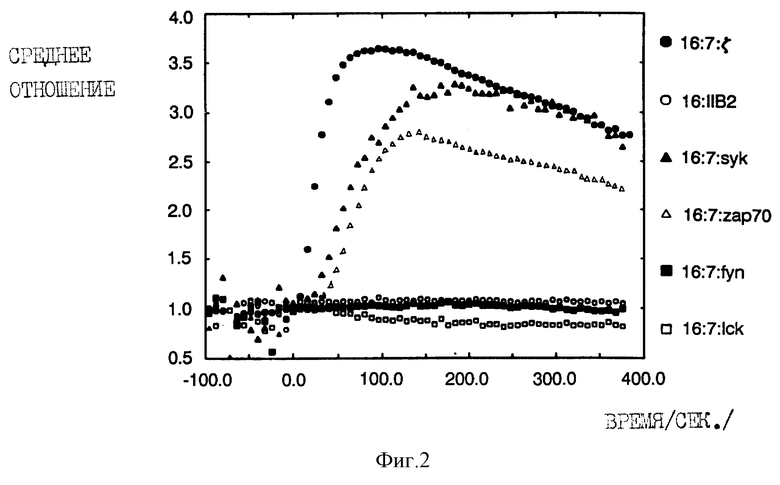
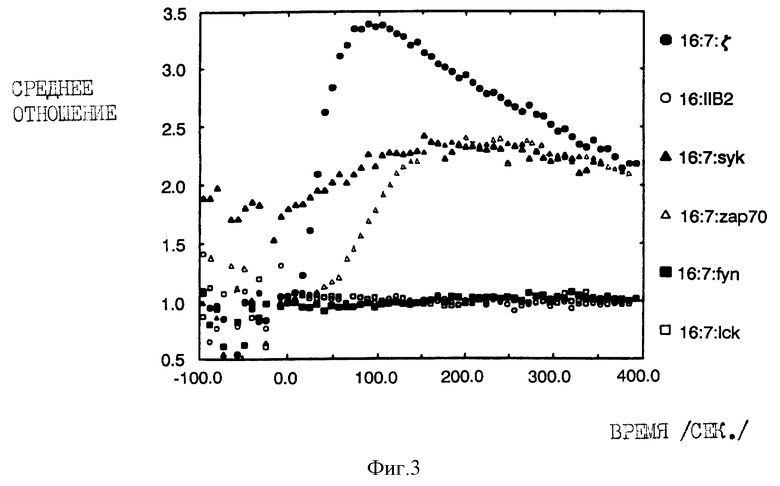
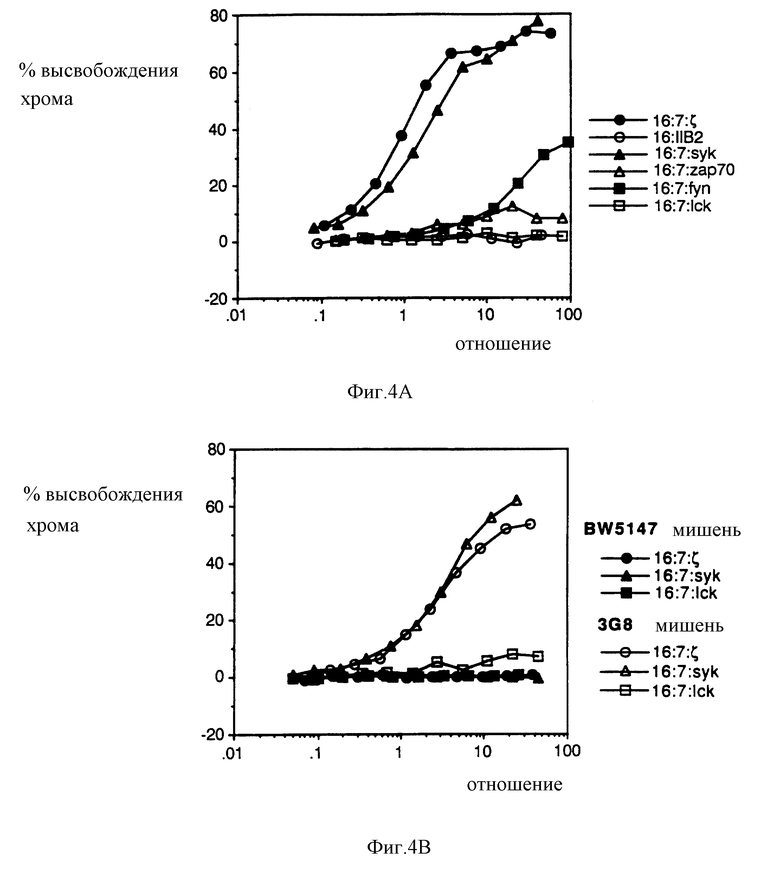
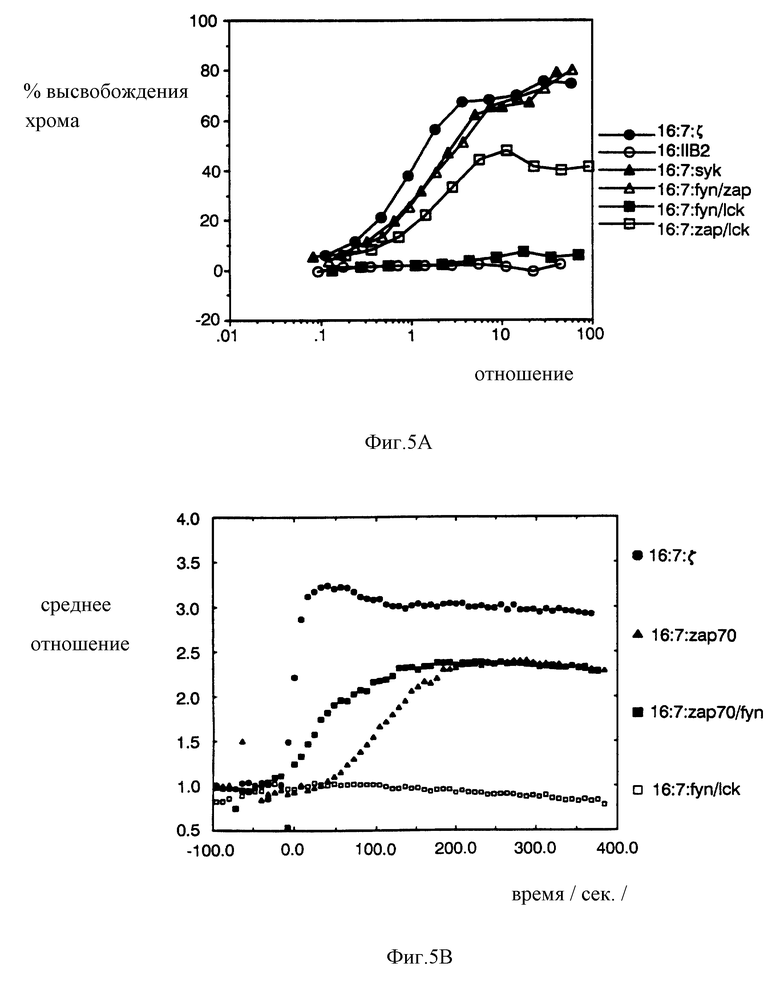
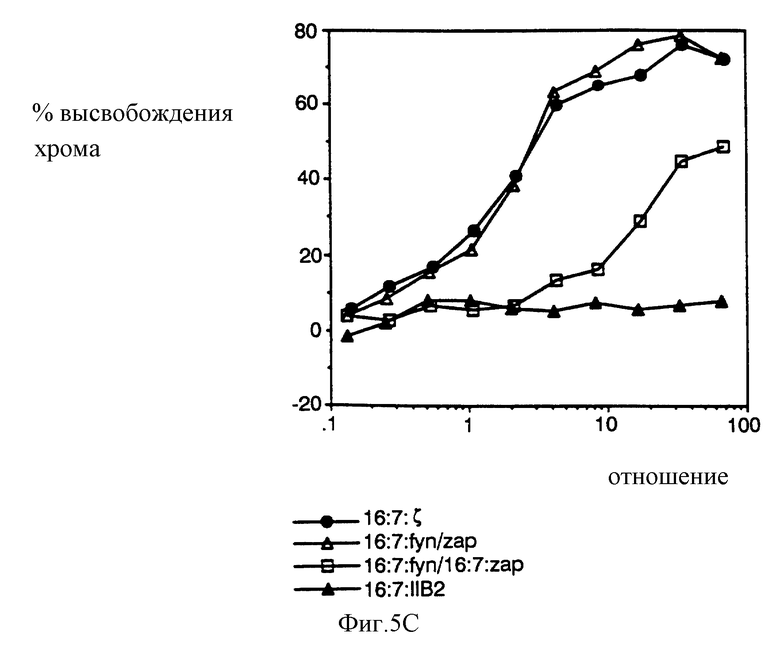
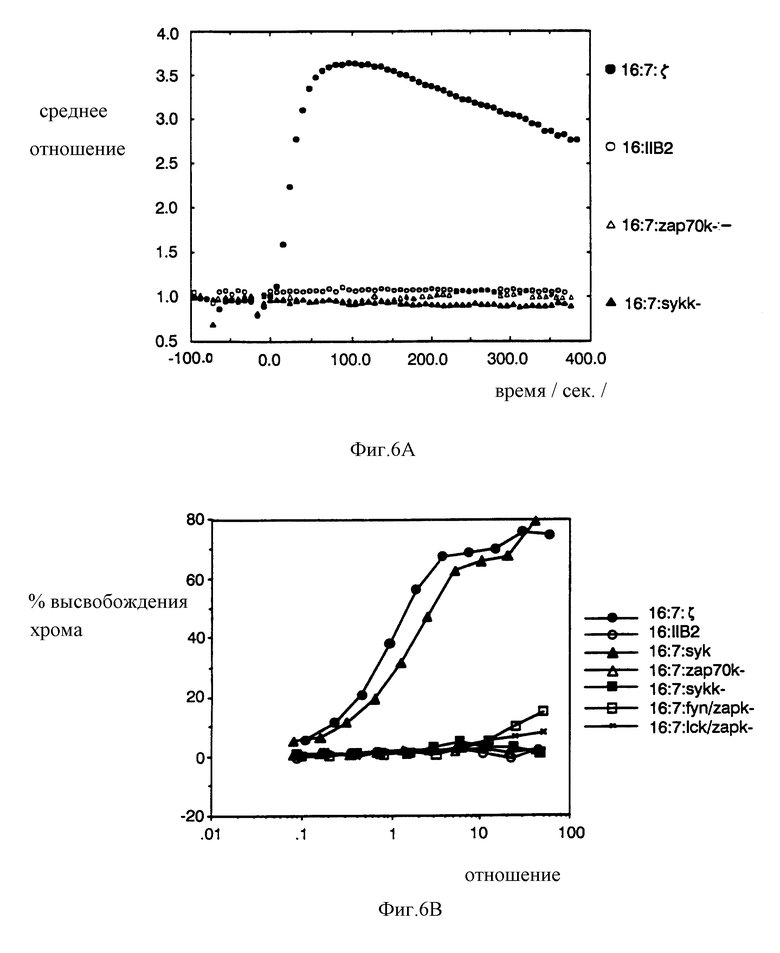

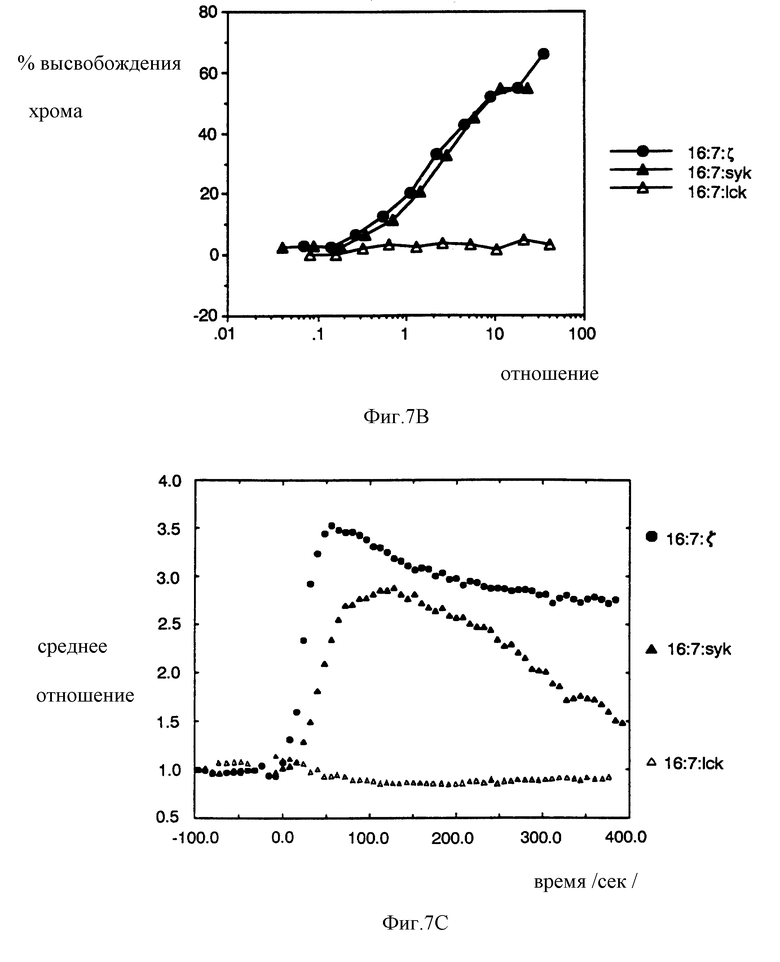
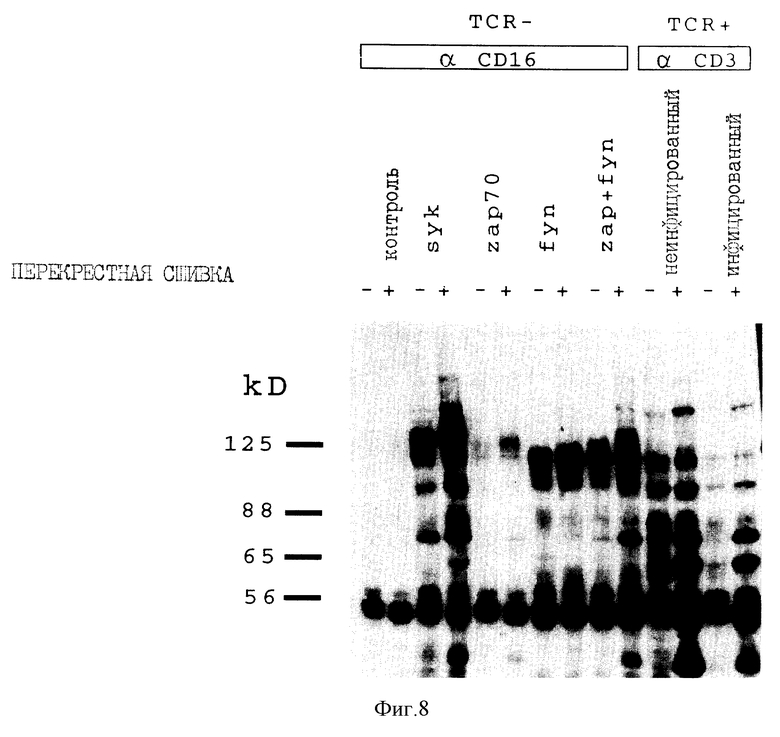
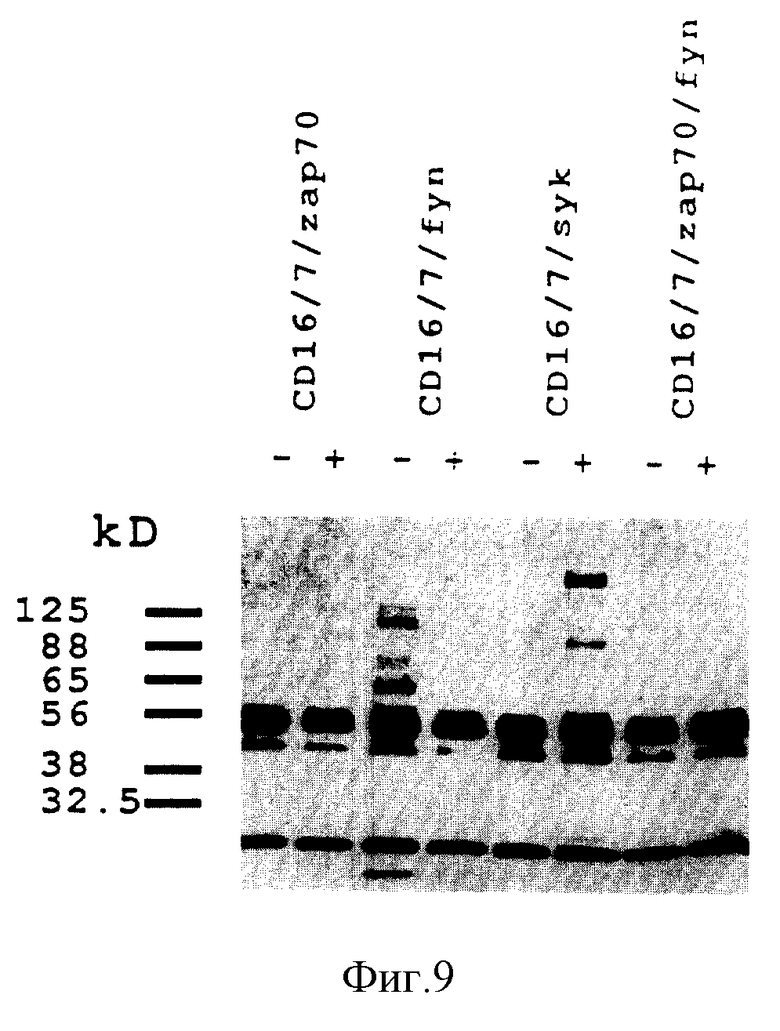
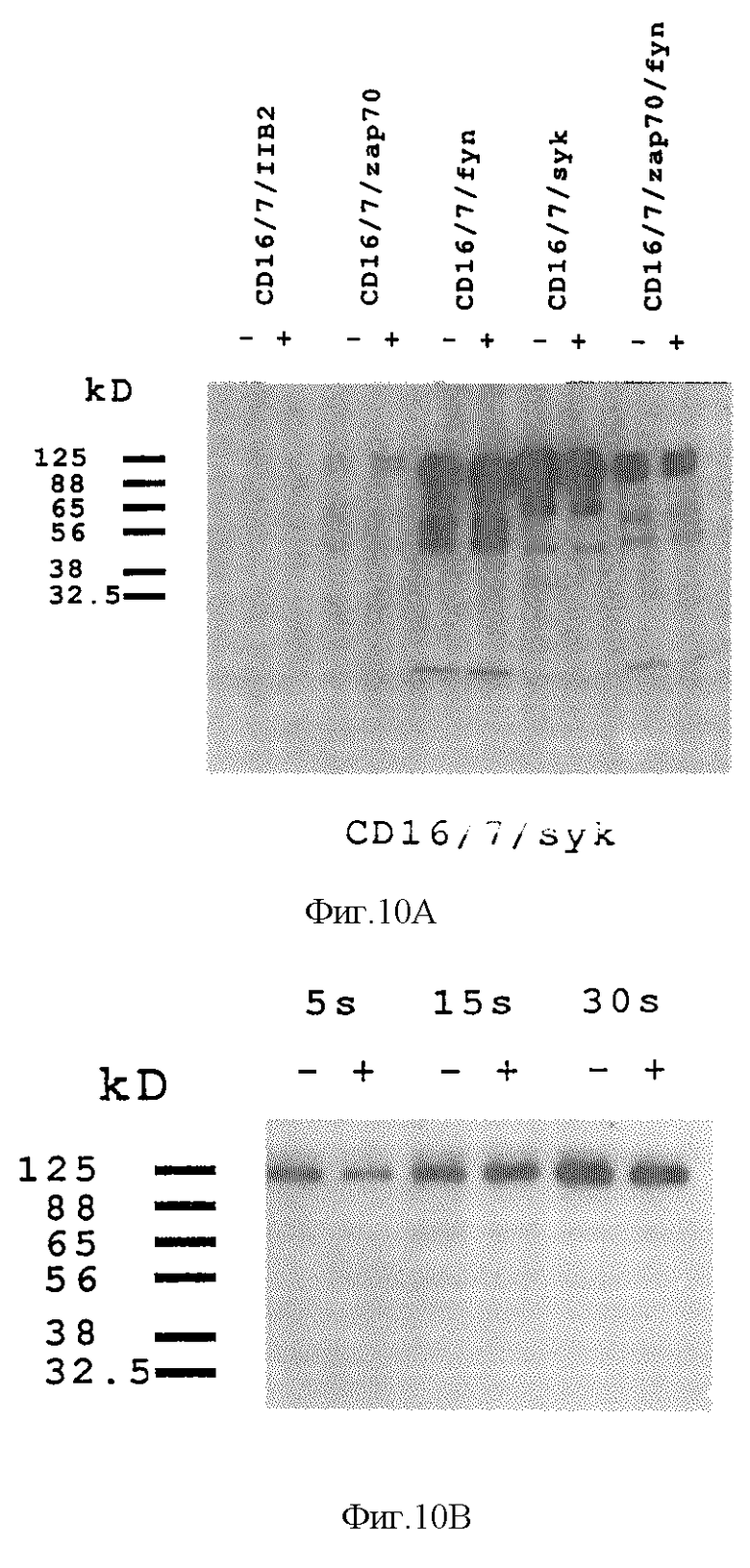
Изобретение относится к генной инженерии. Белковый химерный рецептор содержит внутриклеточную и внеклеточную части. Представлена внутриклеточная часть с аминокислотной последовательностью Syk человека или Syk свиньи, приведенной в описании. Внутриклеточная часть способна передавать сигнал рецептору на разрушение связанной с ним клетки-мишени или инфекционного агента мишени. Внеклеточная часть содержит в себе часть CD 4, связывающуюся с оболочкой вируса ВИЧ. Представлена ДНК, кодирующая белковый химерный рецептор. Изобретение позволяет специфически переключать потенциал распознавания мишени клетками иммунной системы и направлять его на антиген, распознаваемый внеклеточной частью антитела. 2 c. п. ф-лы, 10 ил.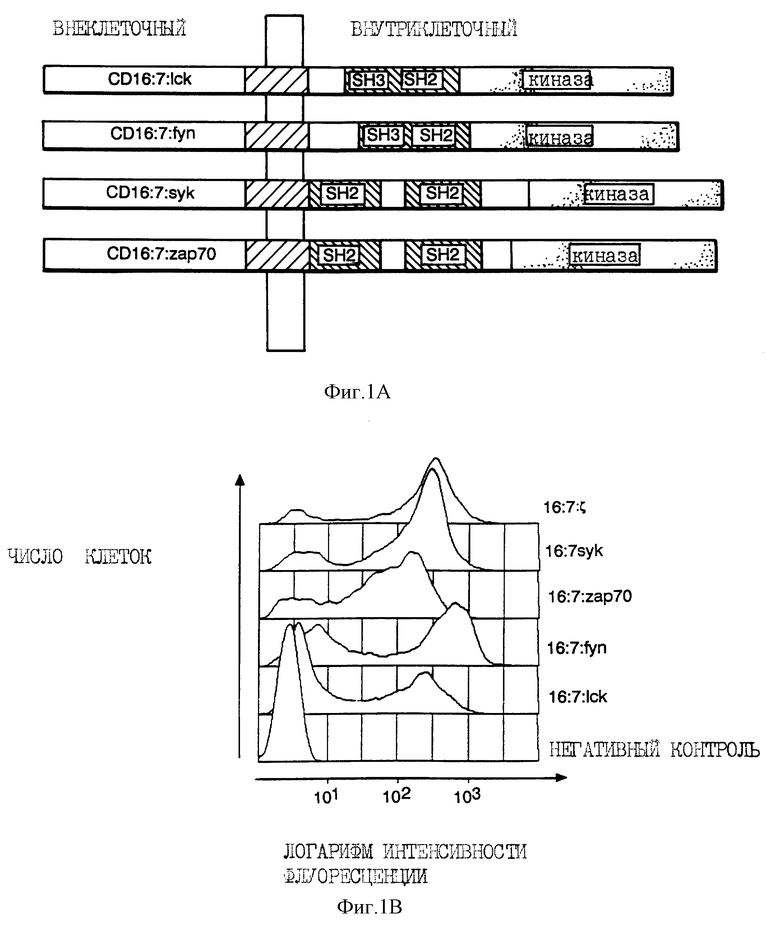
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Фрагмент дезоксирибонуклиновой кислоты, кодирующий промотор SP6 РНК-полимеразы | 1990 |
|
SU1759873A1 |
Авторы
Даты
2000-10-27—Публикация
1994-06-14—Подача