Область техники, к которой относится изобретение
Изобретение относится к жировой эмульсии (масло/вода) для медицинского применения, которое содержит лекарственное средство, применяемое для введения ингаляцией.
Предпосылки создания изобретения
Известен метод применения лекарственного средства человеком, который включает образование мелкодисперсного тумана аэрозольных частиц из раствора, содержащего лекарственное средство, с помощью ингалятора, такого как небулайзер, и с помощью которого указанный аэрозольный туман вдыхается через назальную или ротовую полость.
Для осуществления указанного метода лекарственное средство должно быть предварительно растворено в воде, но в некоторых случаях, когда лекарственное средство трудно растворимо в воде, указанное лекарственное средство должно быть солюбилизировано с помощью поверхностно-активного вещества или др. Однако если даже при солюбилизации поверхностно-активным веществом удается вводить терапевтический раствор в виде ингалянта, получаемого при использовании ингалятора, такого как небулайзер, его не так просто вводить этим путем, поскольку раствор может вызвать раздражение или образовать пену.
Другой известный способ ингаляционной терапии включает растворение лекарственного средства в жировой эмульсии, имеющей везикулы относительно крупного размера, известные как липидные микросферы, который вводится с использованием ингалятора, такого как небулайзер [e.g. JP Kokai H5-70346, JP Kokai H5-124965, JP Kokai H8-301762] . Однако поскольку такие жировые эмульсии обладают сравнительно высокой вязкостью и диаметр эмульсионных везикул составляет в среднем 0,2~0,4 мкм, частицы в таком мелкодисперсном аэрозольном тумане могут иметь средневзвешенный аэродинамический диаметр (СВАД, MMAD) 0,5~5 мкм, и в этой связи достижение ими легочных альвеол может быть поставлено под вопросом, даже при использовании ингалятора, такого как "небулайзер. Еще одним недостатком таких эмульсий является: то, что из-за большого размера эмульсионных везикул, такие эмульсии нельзя стерилизовать фильтрованием с помощью мембранного фильтра с размером пор 0,22 мкм.
Раскрытие изобретения
Целью настоящего изобретения является создание фармацевтической композиции, оптимизированной для введения лекарственного средства, в частности слаборастворимого в воде лекарственного средства, методом ингаляции.
Авторы настоящего изобретения обнаружили в результате многочисленных исследований, что мельчайшая жировая эмульсия (масло/вода), содержащая дисперсию жировой эмульсии с размером частиц порядка десятка нанометров, очень хорошо подходит для ингаляции лекарственных средств, что легло в основу настоящего изобретения.
В этой связи настоящее изобретение относится к жировой эмульсии для использования методом ингаляции, которая имеет вид жировой (масло/вода) эмульсии, включающей частицы жировой эмульсии, состоящие по существу из масляного компонента, эмульгатора и лекарственного средства, диспергированного в воде, так что средний диаметр частиц в указанной жировой эмульсии находится в диапазоне 5~ 100 им (далее он будет обозначаться как ингалянт по настоящему изобретению) или к лиофилизированной композиции указанных ингредиентов для использования методом ингаляции. Кроме того, настоящее изобретение включает метод ингаляционного введения жировой эмульсии, когда указанная жировая эмульсия представляет жировую эмульсию масло/вода, включающую частицы жировой эмульсии, состоящие по существу из масляного компонента, эмульгатора и диспергированного в воде лекарственного средства, так что средний диаметр частиц в указанной жировой эмульсии находится в диапазоне 5~100 им, или способ введения лиофилизированной композиции указанных ингредиентов путем ингаляции.
Ниже настоящее изобретение поясняется более детально.
Масляный компонент, который может быть использован в настоящем изобретении, конкретно не ограничивается, и это может быть масляный компонент, используемый при изготовлении фармацевтических препаратов, которые включают, не ограничиваются нижеследующими: растительное масло, животное масло, нейтральный липид (моно-, ди-, или тризамещенный глицерид), синтетический липид и стериновое производное. В частности, растительное масло включает соевое масло, хлопковое масло, рапсовое масло, кунжутное масло, кукурузное масло, арахисовое масло, сафлоровое масло и др; животное масло включает, в числе других, рыбий жир; нейтральный липид включает триолеин, трилинолеин, трипальмитин, тристеарин, тримиристин, триарахидонин и др; синтетический липид включает, среди прочих, азон; стериновое производное включает холестерилолеат, холестериллинолеат, холестерилмиристат, холестерилпальмитат, холестериларахидат и др. Указанные компоненты могут использоваться каждый сам по себе или в сочетании двух или более видов. Предпочтительный масляный компонент включает триглицериды и растительные масла, включенные в композицию в преобладающем количестве. Для целей практически всех исследований предпочтительно использовать соевое масло, и особенно предпочтительно использовать высокоочищенное соевое масло (предпочтительно с содержанием глицеридного компонента в 99 весовых % или более).
Уровень указанного масляного компонента в ингалянте по настоящему изобретению варьирует в зависимости от вида масла и других компонентов и составляет в типичном случае 0,1~30 вес/объем %, предпочтительно 1~20 вес/объем %.
Эмульгатор, который может использоваться в рамках настоящего изобретения, конкретно не ограничивается, он должен быть фармацевтически приемлемым и может представлять собой, например, фосфолипид или неионный сурфактант. Фосфолипид включает, не ограничиваясь приведенным списком, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилинозит, фосфатидилсерин, фосфатидилглицерин, сфингомиелин и лецитин. Могут также использоваться гидрогенизированные фосфолипиды. Неионный сурфактант включает полиалкиленгликоли (например, полиэтиленгликоль со средним молекулярным весом 1000~10000, предпочтительно 4000~ 6000), полиоксиалкиленовые сополимеры (например, сополимер полиоксиэтилена и полиоксипропилена со средним молекулярным весом 1000~20000, предпочтительно 6000~ 10000), полиоксиалкиленовые производные гидрогенизированного касторового масла (например, гидрогенизированное касторовое масло-полиоксиэтилен(20)-эфир, do(40)-эфир, do(100)-эфир и др.) и полиоксиалкиленовые производные касторового масла (например, касторовое масло-полиоксиэтилен (20)-эфир, d(40)-эфиp, d(100)-эфиp и др). Указанные ингредиенты могут использоваться сами по себе или в сочетании двух или более видов. Предпочтительный эмульгатор включает, в числе других, фосфатидилхолин яичного желтка, лецитин яичного желтка и соевый лецитин. Для целей практического использования предпочтительны лецитин яичного желтка и соевый лецитин.
Уровень указанного эмульгатора, применяемого в ингалянте по настоящему изобретению, варьирует в зависимости от вида эмульгатора и других компонентов, но может быть приемлем в диапазоне 0,05-40 вес/объем %, предпочтительно 0,1~20 вес/объем %.
Весовое соотношение масляного компонента к эмульгатору (масло/эмульгатор) составляет 0,1~20, предпочтительно 0,4~6,0 и более предпочтительно 0,8~1,2 (в особенности 1).
Лекарственное средство, которое можно использовать в рамках настоящего изобретения, конкретно не ограничивается, но предпочтительно, это должно быть лекарство, которое легче растворяется в липиде, чем в воде. В качестве таких лекарственных средств следует отметить так называемые липидорастворимые и водонерастворимые лекарственные средства. В их число входят лекарственные средства для центральной нервной системы, лекарственные средства для периферической нервной системы, лекарственные средства для сенсорных органов, лекарственные средства для сердечно-сосудистой системы, лекарственные средства для дыхательной системы, гормоны, лекарственные средства для мочеполовой системы, лекарственные средства для анальных заболеваний, витамины, лекарственные средства для лечения заболеваний печени, лекарственные средства против подагры, ферменты, антидиабетические лекарственные средства, иммуносупрессоры, цитоактиваторы, противоопухолевые лекарственные средства, радиоактивные лекарственные средства, антиаллергенные лекарственные средства, антибиотики, химиотерапевтические препараты, биологические средства и экстракорпоральные диагностические средства.
С целью конкретизации могут быть указаны следующие лекарственные средства.1.
Стероидные лекарственные средства
Дексаметазон, прендизолон, бетаметазон, беклометазона пропионат, триамцинолон, гидрокортизон, флудрокортизон и прастерон, их соли и их липидорастворимые производные.
2. β-адренергические агонисты
Прокатерол, орципреналин, изопротеренола гидрохлорид, пирбутерол, тербуталин, гексопреналин, фенотерола гидробромид, гексопреналина сульфат, тербуталина сульфат, сальбутамола сульфат, оксипреналина сульфат, формотерола фумарат, изопреналина гидрохлорид, пирбутерола гидрохлорид, прокатерола гидрохлорид, мабутерола гидрохлорид и тулобутерол, а также их соли и липидорастворимые производные.
3. Производные ксантина
Дипрофиллин, проксифиллин, аминофиллин и теофиллин, их соли и их липидорастворимые производные.
4. Антибиотики
Пентамидина изетионат, цефменоксим, канамицин, фрадиомицин, эритромицин, йозамицин, тетрациклин, миноциклин, хлорамфеникол, стрептомицин, мидекамицин, амфотерицин В, итраконазол и нистатин, а также их соли и липидорастворимые производные.
5. Другие
Ипратропиума бромид, метилэфедрина гидрохлорид, триметохинола гидрохлорид, кленбутерола гидрохлорид, окситропиума бромид, фултропиума бромид, метоксифенамина гидрохлорид, хлорпреналина гидрохлорид-натрий-кромогликат.
Уровень введения лекарственного средства в ингалянт по настоящему изобретению варьирует в зависимости от вида лекарства и других компонентов, но в целом составляет в диапазоне от 0,05-20 вес/объем %.
Кроме указанных, в состав настоящего изобретения могут быть введены дополнительный эмульгатор и/или стабилизатор эмульсии. Дополнительные эмульгаторы и/или стабилизатор эмульсии включает насыщенные или ненасыщенные жирные кислоты, содержащие 6~22 атомов углерода, линейноцепочечные или с разветвленной цепью, такие как стеариновая кислота, олеиновая кислота, линолевая кислота, пальмитиновая кислота, линоленовая кислота, миристиновая кислота и др, а также их соли [например, соли щелочного металла (соли натрия, соли калия и др), соли щелочноземельных металлов (соли кальция и др.)]; первичные или вторичные алифатические амины, содержащие 2~22 атома углерода, такие как этаноламин, пропиламин, октиламин, стеариламин, олеиламин и др; основные аминокислоты, такие как лизин, гистидин, орнитин, аргинин и др; стерины, такие как холестерин, холестанол и др; и заряженные вещества, такие как фосфатидиновая кислота, ганглиозид, стеариламин и др. Указанные компоненты могут использоваться сами по себе или в соответствующей комбинации двух или более видов.
Уровень введения указанных веществ зависит от предполагаемой цели использования композиции, и составляет в основном не более, чем 2 вес/объем %, предпочтительно не более 1 вес/объем %.
В дополнение к сказанному, в композицию могут быть введены фармацевтически приемлемые добавки, такие как антиоксидант, консервант, средство для поддержания изотоничности раствора, буфер, стабилизатор и др., а также адъюванты и питательные компоненты. Конкретно, в этой связи можно отметить бензойную кислоту, аскорбиновую кислоту и токоферол. В целом, эти компоненты добавляются в нужном количестве, однако их содержание не должно превышать 10 вес/объем %.
Средний диаметр частиц в жировой эмульсии по настоящему изобретению составляет 5~100 нм, предпочтительно 5~70 нм, более предпочтительно 10~50 нм. Также предпочтительно, чтобы указанная жировая эмульсия содержала не менее 90% частиц с размером, укладывающимся в диапазон 5~100 нм.
Частицы жировой эмульсии ингалянта по настоящему изобретению диспергируются в воде, и вода при этом может представлять собой, например, водопроводную воду, очищенную, дистиллированную воду, воду для инъекций, а также электролитный раствор, такой как физраствор или раствор глюкозы.
Ингалянт по настоящему изобретению может быть высушен вымораживанием с образованием лиофилизированной композиции. При изготовлении ее в виде лиофилизата в композицию предпочтительно вводят соответствующий наполнитель для защиты частиц лиофилизированной жировой эмульсии, и/или так называемой лиофилизированной лепешки. Такие наполнители включают сахариды, предпочтительно дисахариды, и, конкретно, мальтозу, трегалозу и сахарозу. Особенно предпочтительной является мальтоза.
Уровень введения указанного наполнителя в ингалянт по настоящему изобретению варьирует в зависимости от вида наполнителя и других компонентов, и составляет в пределах 1~30 вес/объем%, предпочтительно 3~20 вес/объем%.
Ингалянт по настоящему изобретению может быть получен при использовании известной технологии для создания сверх-тонкоизмельченной жировой эмульсии, например, липидных наносфер [e.g. JP Kokai h2-203, JP Kokai H1-143826, JP Kokai H1-249716] . Типичный способ включает добавление в соответствующих количествах лекарственного средства, эмульгатора и других дополнительных компонентов к заданному количеству масляного компонента, не обязательно при нагревании смеси с целью гомогенизации, затем добавление соответствующего количества воды и эмульгирование всей смеси с использованием обычного эмульгирующего аппарата, такого как гомомиксер, гомогенизатор, ультразвуковой гомогенизатор, Microumdizer (торговое название), Nanomizer (торговое название), (Ultimizen) (торговое название) или гомогенизатор Manton-Gaulin, под давлением с получением частиц заданного размера. Эмульгирование может быть осуществлено в две разных стадии, а именно: стадии предварительного эмульгирования и окончательного эмульгирования.
Ингалянт по настоящему изобретению можно стерилизовать фильтрованием с помощью мембранного фильтрата 0,22 мкм.
Лиофилизированный ингалянт по настоящему изобретению может быть получен при лиофильном высушивании указанного ингалянта по настоящему изобретению с применением традиционной процедуры (см, например, РСТ WO 92/07552, JP Kokai H5-43450, JP Kokai Н6-157294]. Так, например, ингалянт по настоящему изобретению стерилизуют и распределяют по ампулам. Затем ампулы подвергают предварительному замораживанию при температуре от примерно -40o до -20oС в течение 2 часов, при этом первичное высушивание проводят при пониженном давлении при температуре 0o~ 10oС, а вторичную стадию лиофилизации - при пониженном давлении и температуре примерно 15o~25oс. Последующая процедура обычно включает пропускание газа азота и закрывание ампул, содержащих лиофилизированный ингалянт по настоящему изобретению.
Ингалянт по настоящему изобретению может быть введен человеку через носовую или ротовую полость при получении вдыхаемых аэрозольных частиц с помощью устройства, способного образовывать соответствующий аэрозольный туман с приемлемым для введения в определенные сайты размером частиц (в верхние дыхательные пути, бронхиолы, периферические воздухоносные пути или альвеолы) или для достижения терапевтической цели (для лечения воспаления или бронходилатации). Устройство, применяемое для образования аэрозольных частиц ингалянта по настоящему изобретению конкретно не ограничивается, это должно быть устройство, способное образовывать аэрозольные частицы диаметром 0,5~50 мкм, но предпочтительно это устройство должно быть приспособлено для образования аэрозольного тумана, включающего частицы со средневзвешенным аэродинамическим диаметром 0,5~ 5 мкм, в особенности 1~2 мкм. В качестве конкретных примеров такого устройства можно указать небулайзеры под давлением и ультразвуковые небулайзеры. В этой связи настоящее изобретение относится к небулайзеру, включающему ингалянт по настоящему изобретению. Ингалянт по настоящему изобретению может также изготавливаться в виде вдыхаемого аэрозольного препарата, включающего ингалянт по настоящему изобретению.
Лиофилизированная композиция по настоящему изобретению может вводиться в организм человека через дыхательный путь с использованием ингалятора, такого как небулайзер, после ее восстановления произвольным приемлемым раствором (восстанавливающей средой), с помощью перемещивания или без него. Восстанавливающая среда, которую можно использовать в рамках такого способа, включает, в числе других компонентов, водопроводную воду, очищенную воду, дистиллированную воду, воду для инъекций, а также электролитный раствор, такой как физраствор, глюкозный раствор, стандартную инфузию и питьевую воду. Объем восстанавливающей среды конкретно не ограничивается, но в приемлемом варианте составляет 0,5~2 объема раствора препарата до лиофилизации или не более 500 мл. Таким образом, подготовка небулайзера, включающего лиофилизированную форму ингалянта по настоящему изобретению, также входит в область настоящего изобретения.
Кроме того, лиофилизированная композиция по настоящему изобретению можно микронизировать и затем вдыхать в мелкодисперсной форме с помощью соответствующего ингалятора, такого как спин-ингалятор (spinhaler) или диск-ингалятор (diskhaler). В этой связи, настоящее изобретение охватывает порошковый ингалянт, включающий лиофилизированную композицию по настоящему изобретению.
С помощью соответствующего ингалятора ингалянт по настоящему изобретению способен доставлять включенное в везикулы жировой эмульсии лекарственное средство даже в легочные альвеолы, так что в зависимости от эффективности внутрисосудистой миграции частиц жировой эмульсии, он при желании может применяться, например, для оказания системного эффекта.
Лучший способ осуществления настоящего изобретения
Приведенные ниже примеры и опытные примеры даны для целей дальнейшего пояснения настоящего изобретения.
Пример 1
К 5 мг холестерилантрацен-9-карбоксилата (ХА), - флуоресцирующего производного холестерина, взятого в качестве ложного лекарственного средства, добавляют 500 мг очищенного лецитина яичного желтка, 500 мг очищенного соевого масла, 9 мл дистиллированной воды для инъекцией 220 мг глицерина (Японская фармакопея), и указанную смесь обрабатывают ультразвуком в ультразвуковом гомогенизаторе с пробоотборником (Branson Sonifier Model 185, он же будет использоваться и в дальнейшем) при охлаждении льдом-водой в течение 60 минут. Полученная таким образом ХА-содержащая жировая эмульсия выглядит светло-желтой и прозрачной. После разбавления эмульсии дистиллированной водой для инъекций до объема 10 мл, ее фильтруют через мембранный фильтр с размером пор 0,22 мкм с получением стерильного препарата, которым затем в атмосфере газа азота в ламинарном шкафу заполняют ампулы для инъекций, по 2,0 мл на ампулу, получая ингалянт по настоящему изобретению. Средний диаметр частиц в указанной жировой эмульсии ингалянта составляет, по результатам анализа методом рассеяния света на частицах (Otsuka Electronics, DLS-700; то же применимо к дальнейшему изложению), 30,2 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии представляют собой однородные шарообразные наносферы, тогда как липидная бислойная структура наподобие липосомы не наблюдается.
Пример 2
К 2 мг амфотерицина В (противогрибковое средство) добавляют 500 мг соевого лецитина, 300 мг олеата холестерила и 10 мл дистиллированной воды для инъекций, и с помощью ультразвукового гомогенизатора с пробоотборником смесь обрабатывают ультразвуком при охлаждении льдом-водой в течение 60 минут. Полученная таким образом жировая эмульсия, содержащая амфотерицин В, имеет желтый цвет и выглядит прозрачной. Далее эмульсию стерилизуют фильтрованием через мембранный фильтр с диаметром пор 0,22 мкм и наполняют ею в атмосфере газа азота в ламинарном шкафу ампулы для инъекций, по 2,0 мл на ампулу, с получением ингалянта по настоящему изобретению. Средний диаметр частиц в указанной жировой эмульсии ингалянта составляет, по результатам анализа методом рассеяния света на частицах, 40,2 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии представляют собой однородные шарообразные наносферы и в них отсутствует липидная бислойная структура наподобие липосомы.
Пример 3
К 100 мг гвайазулена (противовоспалительного средства) добавляют 400 мг очищенного лецитина яичного желтка, 270 мг триолеина и 10 мл физраствора, и с использованием ультразвукового гомогенизатора с пробоотборником смесь озвучивают при охлаждении льдом-водой в течение 40 минут. Полученная таким образом жировая эмульсия, содержащая гвайазулен, имеет голубой цвет и выглядит прозрачной. Эмульсию стерилизуют фильтрованием через мембранный фильтр с размером пор 0,22 мкм и в атмосфере газа азота в ламинарном шкафу наполняют ею ампулы для инъекций, по 2,0 мл на ампулу, с получением ингалянта по настоящему изобретению. Средний диаметр частиц в указанной жировой эмульсии ингалянта составляет, по результатам анализа методом рассеяния света на частицах, 22,1 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии представляют собой равномерные шарообразные наносферы, и в них отсутствуют липидные бислойные структуры наподобие липосом.
Пример 4
К 1 мг беклометазона пропионата (стероид) добавляют 400 мг очищенного лецитина яичного желтка, 270 мг триглицерида жирной кислоты со средней длиной цепи и 10 мл дистиллированной воды для инъекций, и с использованием ультразвукового гомогенизатора с пробоотборником смесь обрабатывают ультразвуком при охлаждении льдом-водой в течение 50 минут. Полученная таким образом жировая эмульсия, содержащая беклометазона пропионат, имеет светло-желтый цвет и выглядит прозрачной. Эмульсию стерилизуют фильтрованием через мембранный фильтр с диаметром пор 0,22 мкм и наполняют ею в атмосфере газа азота в ламинарном шкафу ампулы для инъекций, по 2,0 мл на ампулу, с получением ингалянта по настоящему изобретению. Средний диаметр частиц в указанной жировой эмульсии ингалянта составляет, по результатам анализа методом рассеяния света на частицах, 35,2 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии представляют собой однородные шарообразные наносферы, и в них отсутствуют липидные бислойные структуры наподобие липосом.
Пример 5
К 50 мг циклоспорина А (иммуносупрессора) добавляют 500 мг очищенного лецитина яичного желтка, 500 мг очищенного соевого масла, 9 мл дистиллированной воды для инъекций и 220 мг глицерина (Японская фармакопея) и с использованием ультразвукового гомогенизатора с пробоотборником смесь обрабатывают ультразвуком при охлаждении льдом-водой в течение 60 минут. Полученная таким образом жировая эмульсия, содержащая циклоспорин А, имеет светло-желтый цвет и выглядит прозрачной. Указанную эмульсию разбавляют дистиллированной водой для инъекций до объема 10 мл и фильтруют ее через мембранный фильтр с диаметром пор 0,22 мкм, после чего указанным стерильным фильтратом наполняют ампулы для инъекций в атмосфере газа азота в ламинарном шкафу, по 2,0 мл на ампулу, с получением ингалянта по настоящему изобретению. Средний диаметр частиц в указанной жировой эмульсии ингалянта составляет, по результатам анализа методом рассеяния света на частицах, 40,2 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии представляют собой однородные шарообразные наносферы и в них отсутствуют липидные бислойные структуры наподобие липосом.
Пример 6
К 1 мг дексаметазона пальмитата (стероид) добавляют 400 мг соевого лецитина, 400 мг триолеина и 10/дистиллированной воды для инъекций и с использованием ультразвукового гомогенизатора с пробоотборником смесь обрабатывает ультразвуком при охлаждении льдом-водой в течение 50 минут. Полученная таким образом жировая эмульсия, содержащая дексаметазона пальмитат, имеет светло-желтый цвет и выгладит прозрачной. Эмульсию стерилизуют фильтрованием через мембранный фильтр с диаметром пор 0,22 мкм и наполняют ею в атмосфере газа азота в ламинарном шкафу ампулы для инъекций, по 2,0 мл на ампулу, с получением ингалянта по настоящему изобретению. Средний диаметр частиц в указанной жировой эмульсии ингалянта составляет, по результатам анализа методом рассеяния света на частицах, 29,6 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии представляют собой однородные шарообразные наносферы, и в них отсутствуют липидные бислойные структуры наподобие липосом.
Пример 7
К 1 г дифенгидрамина (антигистаминное средство) добавляют 40 г соевого лецитина, 40 г триолеина и 1 мл 10% мальтозы, после чего указанную смесь эмульгируют на гомогенизаторе Мантон-Гулена (Мантон-Гулена). Полученная таким образом жировая эмульсия, содержащая дифенгидрамин, имеет цвет от слегка желтовато-белого до желтовато-белого и выглядит прозрачной. Средний диаметр частиц в указанной жировой эмульсии составляет, по результатам анализа методом рассеяния света на частицах, 38,9 нм. Указанную эмульсию стерилизуют фильтрованием через мембранный фильтр с диаметром пор 0,22 мкм и наполняют ею ампулы для инъекций, по 2,0 мл на ампулу, в ламинарном шкафу с последующей лиофильной сушкой, что дает лиофилизированный вариант ингалянта по настоящему изобретению. Лиофилизированный ингалянт восстанавливают разбавлением дистиллированной водой для инъекций, и средний диаметр частиц в указанной жировой эмульсии определяют методом рассеяния света на частицах. Получают в результате значение 40,1 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии представляют собой однородные шарообразные наносферы, и в них отсутствуют липидные бислойные структуры наподобие липосом.
Пример 8
К 1 г преднизалона (стероид) добавляют 60 г соевого лецитина, 50 г трилинолеина и 1 л 10% мальтозы, после чего указанную смесь эмульгируют на гомогенизаторе Manton-Gaulin. Полученная таким образом жировая эмульсия, содержащая преднизолон, имеет белый цвет и выгладит прозрачной. Средний диаметр частиц в указанной жировой эмульсии составляет, по результатам анализа методом рассеяния света на частицах, 37,5 нм. Указанную эмульсию стерилизуют фильтрованием через мембранный фильтр с диаметром пор 0,22 мкм и наполняют ею ампулы для инъекций по 2,0 мл на ампулу в ламинарном шкафу с проведением впоследствии лиофильной сушки, что дает лиофилизированный вариант ингалянта по настоящему изобретению. Указанный лиофилизированный ингалянт восстанавливают разбавлением дистиллированной водой для инъекций и определяют средний диаметр частиц указанной жировой эмульсии в анализаторе методом рассеяния света на частице. Результат составляет 33,3 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии включают однородные шарообразные наносферы, и в них отсутствуют липидные бислойные структуры наподобие липосом.
Пример 9
К 1 г амфотерицина В (противогрибковое средство) добавляют 50 г соевого лецитина, 50 г триолеина и 1 л 10% трегалозы, после чего указанную смесь гомогенизируют в гомогенизаторе микрофлуидайзерного типа (М110-Е/Н). Полученная таким образом жировая эмульсия, содержащая амфотерицин В, имеет желтый цвет и выгладит прозрачной. Средний диаметр частиц в такой жировой эмульсии составляет по данным определения размера частиц методом рассеяния света на частицах 32,9 нм. Полученную эмульсию стерилизуют фильтрованием через мембранный фильтр с диаметром пор 0,22 мкм и наполняют ею ампулы для инъекций, по 2,0 мл на ампулу, в ламинарном шкафу с проведением впоследствии лиофильной сушки, что дает лиофилизированный вариант ингалянта по настоящему изобретению. Такой лиофилизированный ингалянт восстанавливают разбавлением дистиллированной водой для инъекций и определяют средний диаметр частиц указанной жировой эмульсии в анализаторе методом рассеяния света на частицах. Результат составляет 35,5 нм. Данные трансмиссионной электронной микроскопии показывают, что частицы указанной жировой эмульсии включают однородные шарообразные наносферы, и в них отсутствуют липидные бислойные структуры наподобие липосом.
Пример 10
Лиофилизованный ингалянт по настоящему изобретению (125 г), полученный в Примере 9, микронизируют до получения частиц диаметром 0,5≈4 мкм и наполняют ими твердые капсулы, по 0,25 г на капсулу. С помощью этой процедуры получают 500 капсул, содержащая каждая по 1,25 мг амфотерицина В. Капсулам придают проникающую способность при помощи ингалятора-пульверизатора (JP Koho S63-6024), благодаря которому содержимое может вдыхаться.
Пример 11
К 0,2 г тулобутерола (β2-адренергический агонист) добавляют 50 г лецитина яичного желтка, 50 г рапсового масла 1 л 10% сахарозы, после чего полученную смесь эмульгируют на гомогенизаторе микрофлуидайзерного типа (М110-Е/Н). Полученная таким образом жировая эмульсия, содержащая тулобутерол, имеет желтовато-белый цвет и выглядит прозрачной. Средний диаметр частиц в указанной жировой эмульсии составляет, по данным определения их размера методом рассеяния света на частицах, 36,6 нм. Указанную эмульсию стерилизуют фильтрованием через мембранный фильтр с диаметром пор 0,22 мкм и наполняют ею ампулы для инъекций, по 2,0 мл на ампулу, в ламинарном шкафу с последующим проведением лиофильной сушки, что дает лиофилизироваиный вариант ингалянта по настоящему изобретению. Указанный лиофилизированный ингалянт затем восстанавливают разбавлением дистиллированной водой для инъекций и определяют средний диаметр частиц в указанной жировой эмульсии в анализаторе методом рассеяния света на частицах. Результат составляет 38,7 нм. Данные трансмиссионной электронной микроскопии показывают, что указанная жировая эмульсия включает однородные шарообразные наносферы и не содержат липидные бислойные структуры наподобие липосом.
Пример 12
Полученный в примере 11 лиофилизированный ингалянт по настоящему изобретению (250 г) микронизируют с получением частиц диаметром 0,5≈4 мкм и наполняют ими твердые капсулы, по 0,5 г на капсулу. С помощью этой процедуры получают 1000 капсул, содержащих каждая по 0,5 мг тулобутерола. Указанные капсулы применяют для вдыхания с помощью ингалятора-пульверизатора (jp koho S63-6024), благодаря которому и осуществляется ингаляция.
Опытный пример 1
Определение средневзвешенного аэродинамического диаметра (СВАД, MMAD) и его распределение (I)
Ингалянт по настоящему изобретению, приготовленный по процедуре Примера 1 и содержащий ХА, используют в качестве испытуемого образца, а в качестве контрольного образца применяют известную жировую эмульсию со средним диаметром частиц 0,2 мкм, в которую был включен ХА. Контрольный образец получают при добавлении 9 мл дистиллированной воды для инъекций к смеси 5 мг ХА, 100 мг очищенного соевого масла и, 12 мг очищенного лецитина яичного желтка, после чего добавляют 220 мг глицерина (Японская фармакопея) и далее гомогенизируют всю смесь с использованием ультразвукового гомогенизатора с пробоотборником при охлаждении льдом-водой и доводят объем полученной эмульсии до 10 мл с помощью дистиллированной воды для инъекций.
Измерение средневзвешенного аэродинамического диаметра и его распределение проводят на приборе Andersen's Cascade Impactor (приведен в фармакопее США), который распределяет частицы на различные фракции на основе различия их инерционных свойств при вдыхании аэрозоля с постоянной скоростью.
В этом эксперименте корпус небулайзера [Medical Device Approval (55B) 1329; то же имеется в виду и далее] присоединяют к компрессору модели Nissho [Medical Device Approval (55B) 1270; то же имеется в виду и далее] в первом положении и каждый образец распыляют со скоростью течения 6 л/мин в течение 80 минут для создания тумана аэрозольных частиц. Полученные таким образом аэрозольные частицы втягивают вакуумным насосом со скоростью 28,3 л/мин и разделяют на разные фракции. Аэрозольные частицы, осевшие в каждой фракции, промывают метанолом и восстанавливают и затем измеряют интенсивность флуоресценции для оценки количества лекарственного средства. Результаты приведены на фиг. 1.
Как видно из фиг. 1, опытный образец приводит к получению больших количеств лекарственного препарата во фракциях от 0 до 2,1 нм в сравнении с контрольным образцом, с достоверной разницей при р<0,01. В частности, в то время как контрольный образец незначительно осаждался во фракциях до 2,1 мкм, примерно 70% от общего количества лекарственного средства находится именно в этих фракциях. Вероятно, это происходит потому, что частицы с меньшим средневзвешенным аэродинамическим диаметром получаются при снижении диаметра частиц жировой эмульсии. Между двумя группами не было обнаружено достоверного различия при р<0,05 во фракциях с размером >2,1 мкм ≈ ≤ 9 мкм. Было также подтверждено, что общее количество восстановленного лекарственного средства во всех фракциях примерно в 3 раза выше в испытуемом образце, чем в контрольном образце.
Средневзвешенный аэродинамический диаметр представляет собой очень важный фактор, определяющий способность лекарственного средства достигнуть целевого ме ста и осесть на нем. У людей средневзвешенный аэродинамический диаметр частиц, входящих в воздушные пути, равен 1≈10 мкм, известно также, что диаметр аэрозольных частиц, в особенности в диапазоне 2≈5 мкм, является оптимальным для того, чтобы лекарственное средство достигло дыхательный путей и осело в них (в бронхах до конечных бронхиол) и что частицы, способные достигнуть лежащих глубже альвеол, должны иметь диаметр 1≈2 мкм (JP Forum Vol.4, 1, 1995). Как нетрудно увидеть из результатов указанного Опытного примера 1, испытуемый образец в сравнении с контрольным образцом значительно обогащен фракцией аэрозольных частиц с диаметром не более 2,1 мкм, и в связи с этим ингалянт по настоящему изобретению легко создает аэрозольные частицы диаметром 1≈2 мкм, которые трудно получать с помощью обычной жировой эмульсии. Таким образом, можно предположить, что более глубокую доставку лекарственного средства в альвеолы, которая не может быть осуществлена с помощью традиционной жировой эмульсии, сейчас можно провести в соответствии с настоящим изобретением.
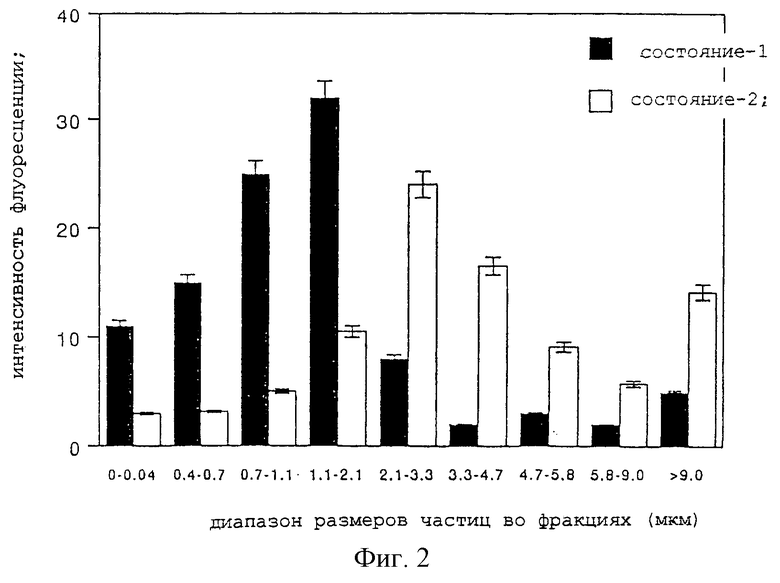
Опытный пример 2
Определение средневзвешенного аэродинамического диаметра (СВАД, MMAD) и его распределение (II)
С использованием ингалянта из Примера 1 настоящего изобретения, содержащего ХА в качестве опытного образца, измеряют средневзвешенный аэродинамический диаметр частиц и его распределение при варьировании условий распыления из небулайзера. Так, распыление проводилось в том случае, когда резиновая пробка на корпусе небулайзера была в закрытом состоянии (состояние-1; то же самое относится к опытному образцу Примера 1) или в том случае, когда резиновая пробка находилась в открытом состоянии (состояние-2). В целом, признано, что мелкие аэрозольные частицы получают в случае состояния-1, в то время, как в условиях состояния-2 получают крупнозернистые частицы. Как и в Опытном примере 1, измерения проводили с использованием прибора Anderson's Cascade Impactor, компрессора модели Nissho и корпуса небулайзера, а скорости потока воздуха в компрессоре при вакуумном отсосе были те же самые, что и в Примере 1. Аэрозольные частицы, осевшие в каждой фракции, промывают метанолом, восстанавливают, и количество лекарственного средства оценивают при измерении интенсивности флуоресценции. Результаты приведены на фиг.2.
Как видно из фиг.2, опытный образец дает мелкие аэрозольные частицы с пиком распределения в диапазоне 1,1≈2,1 мкм в состоянии-1 и сравнительно крупнозернистые аэрозольные частицы с пиком в диапазоне 2,1-3,3 мкм в условиях состояния-2. Как отмечалось выше, средневзвешенный аэродинамический диаметр представляет собой важный фактор, определяющий способность лекарственного средства достичь целевого сайта и осесть в нем. Считается, что у людей для целей достижения лекарственным средством дыхательных путей и осаждения в них (в бронхах до терминальных бронхиол) оптимально использовать частицы с диаметром в диапазоне, в частности 2≈5 мкм, тогда как частицы, способные достигнуть лежащих глубже альвеол, должны иметь диаметр 1≈2 мкм. При этом некоторые лекарственные средства предназначены для достижения бронхов в качестве мишени действия, тогда как другие поглощаются из легочных альвеол с оказанием последующего системного эффекта, и оптимальный средневзвешенный аэродинамический диаметр аэрозольных частиц должен соответствовать механизму действия каждого лекарственного средства. Указанный эксперимент показал, что диаметр аэрозольных частиц опытного образца может быть скорректирован при селективном использовании для распыления состояния-1 или состояния-2, определенно указывая на то, что настоящее изобретение применимо как в отношении лекарственного средства, воздействующего на бронхи, так и к лекарственному средству, вводимому с целью оказания системного эффекта.
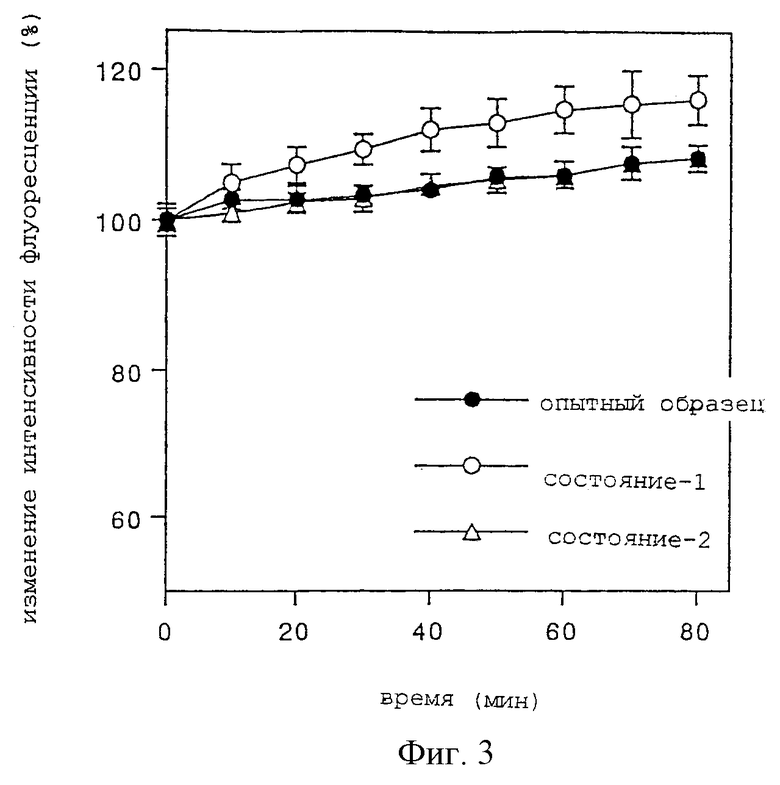
Опытный пример 3
Эксперимент по концентрированию раствора при распылении из небулайзера
В качестве опытного образца используют содержащий ХА ингалянт по настоящему изобретению, а в качестве контрольного образца-1 используют ту же ХА-содержащую жировую эмульсию с размером частиц 0,2 мкм (диаметр), что и в Опытном примере 1. В качестве контроля-2 используют физиологический раствор.
Пробы оценивают по содержанию в небулайзере остаточного раствора после 80 минут распыления при подсоединении корпуса небулайзера к компрессору модели Nissho, работающему со скоростью течения 6 л/мин. Остаточные концентрации в опытном образце и контрольном образце-1 определяют флуорометрией ХА, тогда как остаточную концентрацию в контрольном образце-2 определяют при измерении концентрации натрия электродным методом. Результаты приведены на фиг.3.
Как видно из данных фиг.3, в опытном образце отмечается по существу тот же уровень концентрации, как и в контрольном образце-2, тогда как контрольный образец-1 показывает значительно большую оставшуюся концентрацию. Данные о повышении концентрации во всех образцах, по всей видимости, указывает на влияние процесса испарения воды. С другой стороны, можно полагать, что значительно большая концентрация в контрольном образце-1 указывает на то, что образуются и рассеиваются аэрозольные частицы одной воды с диаметром 0,2 мкм, но не содержащие частиц жировой эмульсии. Это можно понять только на основании результатов Опытного примера 1, в соответствии с которыми в лекарственном средстве содержатся в очень небольшом количестве аэрозольные частицы диаметром не выше 2,1 мкм. Таким образом, можно полагать, что при распылении из небулайзера ингалянта, состоящего из жировой эмульсии с диаметром частиц 0,2 мкм, образуются аэрозольные частицы с диаметром не выше, чем 2,1 мкм, но эмульсионные частицы с диаметром 0,2 мкм не образуют крупных фракций. С другой стороны, опытный образец демонстрирует по существу то же самое повышение концентрации, что и в контрольном образце-2, и это позволяет предположить, что в незначительном количестве образуются аэрозольные частицы, состоящие только из воды.
Опытный пример 4
Опыт по стерилизации фильтрованием
В качестве опытного образца используют ингалянт из Примера 1 по настоящему изобретению, содержащий ХА, а в качестве контрольного образца используют жировую эмульсию отключением ХА, имеющую тот же размер частиц (диаметр 0,2 мкм), что в Опытном примере 1.
В эксперименте, проводимом с использованием прибора для фильтрования под давлением, включающем мембранный фильтр с размером пор 0,22 мкм (ацетатцеллюлоза + нитроцеллюлоза; Миллипор, MF Millipore), фильтруют 10 мл каждого образца и определяют количество фильтрата и процент восстановления лекарственного средства. Результаты показаны в таблице 1.
Как видно из Таблицы 1, для стерилизации контрольного образца вряд ли применима процедура фильтрования, тогда как опытный образец можно успешно простерилизовать фильтрованием.
Опытный пример 5
Эксперимент по чрезлегочному введению у кроликов (-1)
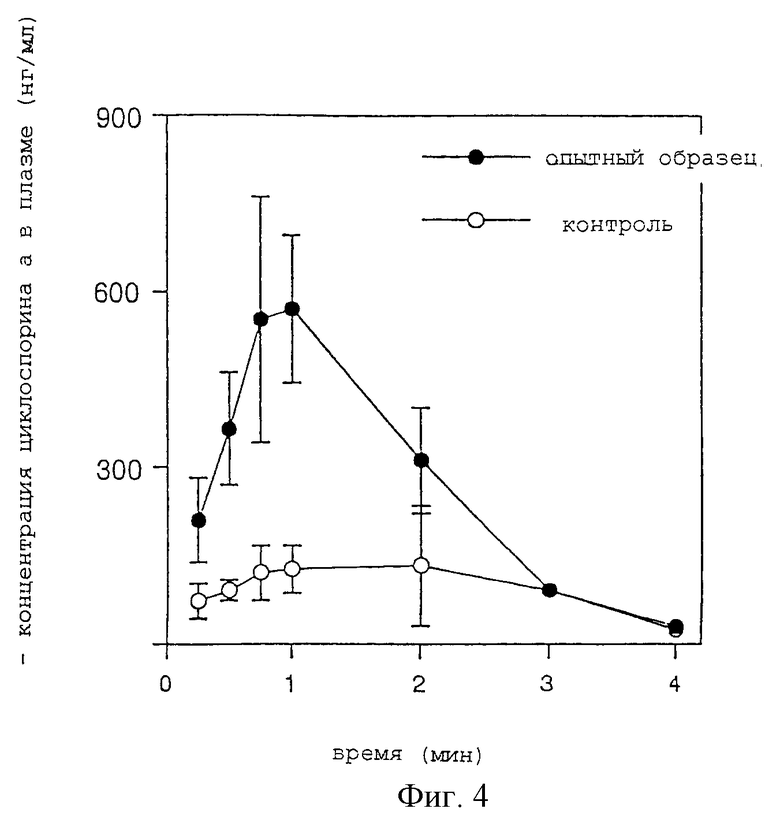
От шести 9-недельных кроликов-самцов (Kbs: JW) получают под анестезией трахеи, соединяют их с Y-образной канюлей и поддерживают животных на вспомогательном дыхании с помощью респиратора. В условиях вспомогательного дыхания ингалянт из Примера 5 по настоящему изобретению служит в качестве опытного образца, а в качестве контрольного образца используется жировая эмульсия с тем же диаметром частиц в 0,2 мкм, что и в Опытном примере 1, в которую включен циклоспорин А, оба образца вводят в дозе 5 мг/кг в течение примерно 30 минут при распылении с помощью компрессора модели Nissho и соединенного с ним корпуса небулайзера. После окончания ингаляции отсоединяют канюлю и зашивают раны, оставшиеся после канюлировании. Затем отбирают кровь из ушной вены с некоторыми интервалами и с помощью флуоресцентного поляризационного иммуноанализа (ФПИА, FPIA) отслеживают временные характеристики изменения концентрации циклоспорина А в плазме. Результаты показаны на фиг.4.
Как видно из фиг.4, концентрация циклоспорина А в плазме постоянно выше в группе введения опытного образца, чем в контрольной группе, с различием примерно в 3 раза, отмечаемого по данным кривой концентрация-время (AUC). Таким образом, поскольку поступление вдыхаемого лекарства в большой круг кровообращения зависит от способности лекарственного средства достигнуть альвеолы, существенно, что контрольная жировая эмульсия с диаметром 0,2 мкм с трудом доставляет лекарственные средства в альвеолы. В случае ингалянта по настоящему изобретению, как можно увидеть уже из результатов Опытного примера 1, лекарственное средство, включенное в аэрозольные везикулы, способно достигнуть альвеол. Эксперимент по чрезлегочному введению препарата кроликам показывает, что ингалянт по настоящему изобретению, при использовании его в качестве опытного образца, обладает высокой способностью достигать альвеолы.
Опытный пример 6
Эксперимент по чрезлегочному введению кроликам (-2)
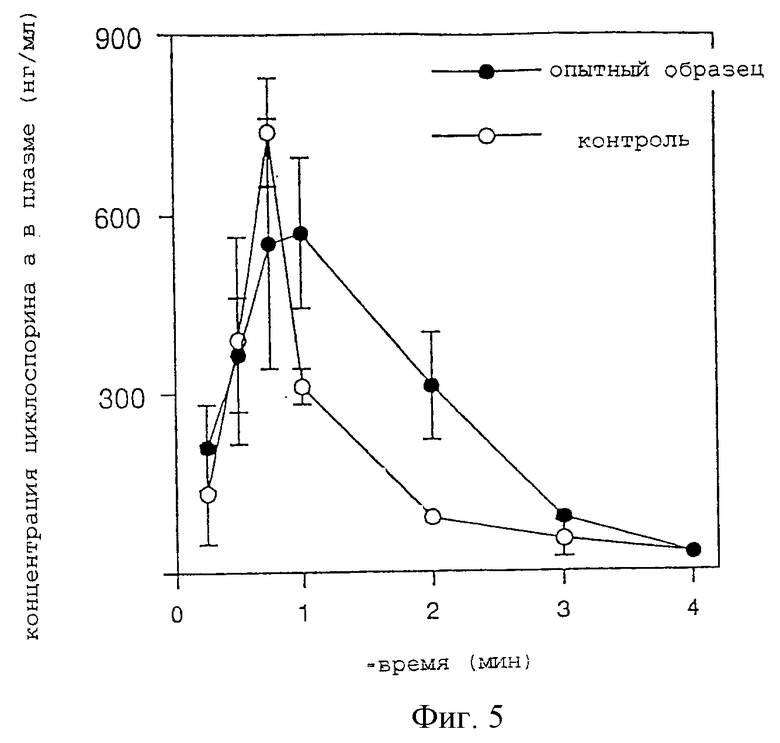
От шести 9-недельных кроликов-самцов (Kbs: JW) получают под анестезией трахеи и соединяют с Y-образной канюлей и поддерживают животных на вспомогательном дыхании с помощью респиратора. В условиях вспомогательного дыхания ингалянт из Примера 5 по настоящему изобретению, используемый в качестве опытного образца, и ингалянт, выполняющий функцию контрольного образца, который включает циклоспорин А, солюбилизированный Твином-80, вводят в дозе 1 мг/кг, каждый, в течение примерно 30 минут при распылении с использованием компрессора модели Nissho и соединенного с ним корпуса небулайзера. После окончания ингаляции отсоединяют канюлю и зашивают рану, полученную при ее введении. Затем из ушной вены с некоторыми интервалами времени отбирают кровь для отслеживания методом флуоресцентного поляризационного иммуноанализа (FPIA, ФПИА) изменения концентрации циклоспорина А в плазме. Результаты показаны на фиг.5.
Как видно из фиг.5, AUC не выявляет различий в уровне при р<0,05 между группой введения опытного образца и контрольной группой. В течение 2 часов обе группы были практически сравнимы по концентрационной кривой в плазме, однако через 3 часа концентрация в плазме у опытной группы незначительно снизилась в сравнении с контрольной группой. Таким образом, ингалянт по настоящему изобретению, применяемый в качестве опытного образца, превосходит солюбилизированный сурфактантом контрольный образец по таким характеристикам, как медленное и пролонгированное высвобождение в плазме.
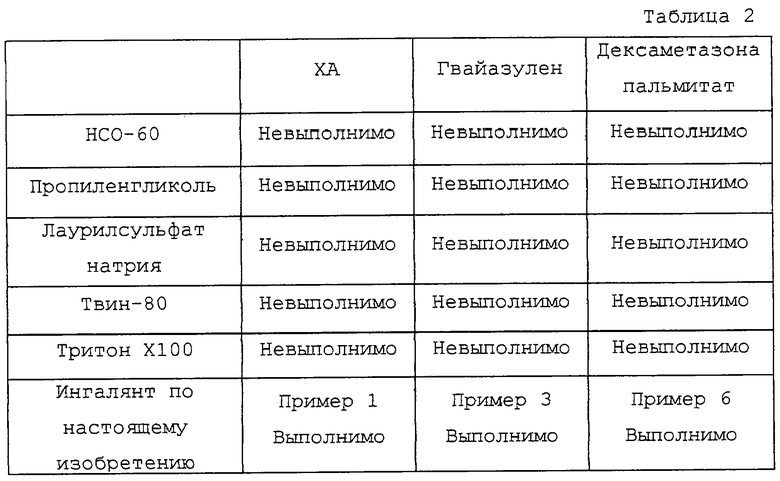
Опытный пример 7
Влияние способствующей солюбилизации концентрации сурфактанта на распыляемость
Образцы ХА, гвайазулена и дексаметазона пальмитата, солюбилизированные (каждый) с использованием НСО-60, пропиленгликоля, лаурилсульфата натрия, Твина-80 или Тритона X100, сравнивают по способности распыляться из небулайзера с ингалянтами из примеров 1, 3 и 6 по настоящему изобретению. Результаты приведены в таблице 2.
Из данных таблицы 2 видно, что все растворы, приготовленные с использованием сурфактанта или солюбилизатора, с трудом поддаются распылению из-за образования пены в корпусе небулайзера.
Опытный пример 8
Измерение кинетической вязкости
Содержащий ХА ингалянт по настоящему изобретению, приготовленный по процедуре Примера 1, используют в качестве опытного образца, а в качестве контрольного образца используют жировую эмульсию с включением также ХА и с тем же диаметром частиц 0,2 мкм, что и в Опытном примере 1.Кинетическую вязкость опытного и контрольного образцов измеряют с помощью капиллярного вискозиметра (n= 10). Поскольку измеряемые вязкости сравнительно близки по значению к вязкости воды, в качестве стандартного раствора используют воду.
Кинетическая вязкость воды составляет 1,0038 мм2/сек. при 20oС. Результаты приведены в таблице 3.
Из таблицы 3 видно, что кинетическая вязкость опытного образца ниже, чем у контрольного образца. По этой причине ингалянт по настоящему изобретению может при использовании небулайзера или другого подобного устройства легко образовывать мелкие аэрозольные частицы.
Эффекты настоящего изобретения
В качестве эффектов настоящего изобретения могут быть, среди прочих, использованы следующие:
(1) Ингалянт по настоящему изобретению имеет низкую вязкость и не образует в значительной степени пены в небулайзере или другом подобном устройстве; он легко создает туман аэрозольных частиц с помощью подходящего ингалятора, такого как небулайзер.
(2) С помощью подходящего ингалятора ингалянт по настоящему изобретению легко образует туман тонких аэрозольных частиц, достаточно мелких, для того, чтобы достигать альвеол; ингалянт не создает проблем для контроля размера аэрозольных частиц.
(3) Ингалянт по настоящему изобретению может быть использован при желании достигнуть системного эффекта при легочном способе введения. Поэтому он не ограничен только местным введением в дыхательный тракт, бронхи, альвеолы и т.д. Кроме того, для указанного ингалянта можно также ожидать длительное действие и улучшенную биологическую доступность.
(4) Он может быть простерилизован фильтрованием с использованием мембранного фильтра с размером пор 0,22 мкм. В этой связи, настоящее изобретение применимо для термолабильных лекарственных средств, которые не могут быть простерилизованы автоклавированием.
Краткое описание чертежей
На фиг. 1 показано количество лекарственного средства в каждой из фракций, отличающихся по размеру аэрозольных частиц. Абсцисса изображает диапазон размеров частиц во фракциях (мкм), и ордината изображает интенсивность флуоресценции. Зачерненные колонки изображают ингалянт по настоящему изобретению, а белые колонки обозначают контроль.
На фиг. 2 показано количество лекарственного средства в каждой из фракций, отличающихся по размеру аэрозольных частиц. На абсциссе показан диапазон размеров частиц во фракциях (мкм), и ордината изображает интенсивность флуоресценции. Зачерненная колонка соответствует состоянию-1, а белая колонка - состоянию-2.
На фиг. 3 показана временная зависимость концентрации распыляемого раствора. Абсцисса изображает время (мин.), и ордината изображает интенсивность флуоресценции -•- обозначает опытный образец (ингалянт по настоящему изобретению); -о- обозначает контрольный образец-1; и Δ отображает контрольный образец-2 (физраствор).
На фиг. 4 приведены результаты эксперимента по чрезлегочному введению лекарственного средства кроликам. На абсциссе показано время (часы), а на ординате - концентрация циклоспорина А в плазме (нг/мл);  обозначает ингалянт по настоящему изобретению и -о- обозначает контрольный ингалянт.
обозначает ингалянт по настоящему изобретению и -о- обозначает контрольный ингалянт.
На фиг.5 показаны результаты эксперимента по чрезлегочному введению лекарственного средства кроликам. На абсциссе показано время (часы), а на ординате - концентрация циклоспорина А в плазме (нг/мл);  обозначает ингалянт по настоящему изобретению; -о- обозначает контрольный ингалянт.
обозначает ингалянт по настоящему изобретению; -о- обозначает контрольный ингалянт.


Изобретение относится к области фармации и касается жировой эмульсии для ингаляции. Изобретение заключается в том, что указанные препараты представлены в виде необязательно лиофилизированных жировых эмульсий, являющихся жировыми эмульсиями типа масло/вода, в которых частицы жировой эмульсии, содержащие в качестве обязательных ингредиентов масляный компонент, эмульгатор и лекарственное средство, диспергированы в воде, при этом частицы жировой эмульсии имеют средний диаметр в диапазоне от 5 до 100 нм. Изобретение обеспечивает создание фармацевтической композиции, оптимизированной для введения слаборастворимого в воде лекарственного средства методом ингаляции. 10 з.п.ф-лы, 3 табл., 5 ил.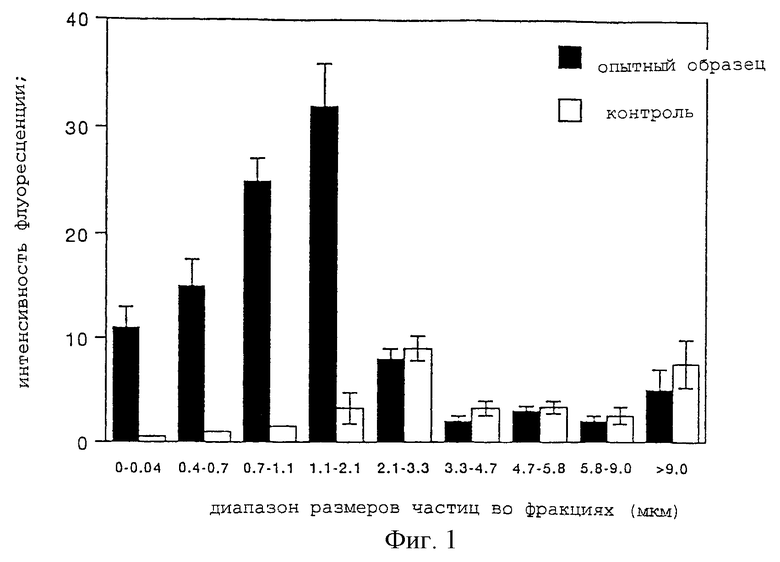
| ЛИОФИЛИЗИРОВАННЫЙ ПРЕПАРАТ ЖИРОВОЙ ЭМУЛЬСИИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2097025C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДСТАВЛЯЮЩАЯ МИКРОЭМУЛЬСИЮ С БИОЛОГИЧЕСКИ АКТИВНЫМ МАКРОМОЛЕКУЛЯРНЫМ МАТЕРИАЛОМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1989 |
|
RU2122403C1 |
| АЭРОЗОЛЬНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, БАЛЛОНЧИК ДЛЯ ХРАНЕНИЯ И ДОСТАВКИ ФАРМАЦЕВТИЧЕСКОЙ АЭРОЗОЛЬНОЙ КОМПОЗИЦИИ, СПОСОБ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ, СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ | 1993 |
|
RU2120285C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНОЕ ЦИКЛОСПОРИНА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2126263C1 |
Авторы
Даты
2003-09-20—Публикация
1999-03-03—Подача