Область изобретения
Настоящее изобретение в общих чертах относится к области электроники и электронным сетям и схемам, так же как к компонентам и узлам таких сетей или схем.
Предшествующий уровень техники
Прототипы, которые можно рассматривать как предпосылки настоящего изобретения, а также изготовления или экспериментальных методик, описываемых далее, перечислены ниже в конце описания.
Упоминание данных ссылок будет сделано путем указания данных номеров из приведенного выше списка.
Предпосылки изобретения
Миниатюризация микроэлектронных и логических схем при существующей в настоящее время технологии достигает практических и теоретических пределов. Различные конструкторские и операционные соображения, такие как теплоотвод, гетерогенность, соединимость, так же как существующие фотолитографические технологии, ограничивают практический размер минимальных имеющихся в настоящее время изделий, электронных компонентов на основе полупроводников до примерно 0,25-0,3 мкм. Очевидно, что дальнейшая миниатюризация электронных компонентов должна включать новые подходы и новые концепции для изготовления электронных компонентов и логических схем.
Нанометровая электроника заставляет рассматривать два фундаментальных вопроса: рабочие принципы соответствующих электронных компонентов и схемы для изготовления таких компонентов и их интеграции в полезные схемы.
Ряд операционных принципов был предложен на основании эффектов заряда [1-6], что становится все более обещающим по мере того, как уменьшаются размеры устройств. Конструирование цепей в наномасштабе невозможно осуществить с помощью существующих микроэлектронных технологий. В частности, соединение элементов проводами и электрическое соединение с макроскопическим миром становятся все более проблематичными. Молекулярные процессы распознавания и самосборки молекул в надмолекулярные образования можно использовать для конструирования сложных структур [5]. Однако соединение электронных материалов с такими структурами или придание им электронной функциональности до сих пор не было достигнуто.
Нуклеиновые кислоты обладают свойствами самосборки, что можно использовать для создания сетей из волокон нуклеиновых кислот [27. 30]. ДНК уже была использована как организатор наноструктур при сборке коллоидных частиц в макроскопические кристаллоподобные агрегаты [14, 15] и для задания формы структурам из полупроводниковых наночастиц [16, 17].
Словарь
Далее будут использованы некоторые термины и эти термины и их значения в контексте настоящего изобретения следующие.
Нуклеотидная цепь - последовательность нуклеотидов. Эти нуклеотиды могут быть рибонуклеотидами, дезоксирибонуклеотидами или другими рибонуклеотидными производными, различными синтетическими, т.е. не встречающимися в природе нуклеотидами, например пептидной нуклеиновой кислотой (PNA), а также любыми сочетаниями вышеуказанных соединений. Нуклеотидная цепь может быть одноцепочечной, двухцепочечной или многоцепочечной.
Волокно - удлиненный нитеподобный компонент. Волокно может иметь полимерный или сополимерный скелет или может включать отрезки различных полимеров или сополимеров, связанных друг с другом. Волокно может быть химически модифицировано за счет нанесения на него одного или более из веществ или частиц. Волокна настоящего изобретения включают, по крайней мере, одну нуклеоткдную цепь. Волокна настоящего изобретения могут также состоять только из нуклеотидных цепей.
Связывание - термин, который относится сразу ко всем типам взаимодействий, которые связывают вместе две или более молекулы, вещества, частицы, надмолекулярные структуры и т. д. или приводят к связыванию их с твердым субстратом. Связывание может быть ковалентным или нековалентным (нековалентное связывание может включать одно или более из ионных взаимодействий, гидрофобных взаимодействий, Ван-дер-Ваальсовых взаимодействий, химическую сорбцию и т. д. ). Производное от этого термина (т.е. "связь", "связанный" и т.д.) будет иметь значения, соответствующие термину "связывание" в зависимости от синтаксиса.
Взаимодействие - нековалентное связывание двух молекулярных объектов. Производное от этого термина (т.е. "взаимодействовать", "взаимодействующий" и т.д.) будет иметь значения, соответствующие термину "взаимодействие" в зависимости от синтаксиса.
Функционализированная нуклеотидная цепь - нуклеотидная цепь, которая была химически или физически модифицирована или присоединена с веществом, молекулой, кластером атомов или молекул или частицами, нанесенным на нее, что придает нуклеотидной цепи электрические или электронные свойства. Такие вещества или частицы могут быть связаны с нуклеотидной цепью различными взаимодействиями (например, могут быть химически нанесены на цепь, могут образовывать с ней комплекс в результате различных химических взаимодействий, могут быть ассоциированы с цепью за счет электростатических или гидрофобных взаимодействий, и т. д.) Вещества или частицы могут быть связаны с нуклеотидной цепью на основании общих химических свойств цепи или могут быть связаны с нуклеотидной цепью последовательность-специфическим образом. Примерами таких веществ, молекул, кластеров или частиц могут служить: металл, например, что приводит к образованию проводящей нуклеотидной цепи; различные полупроводниковые материалы, что может привести к образованию проводников (или резисторов), электронных р/n переходов и др.; молекулы, кластеры молекул или частицы, которые могут быть ассоциированы с нуклеотидной цепью, с образованием функциональных логических соединений между нуклеотидными цепями и т. д. В зависимости от типа связанных веществ или частиц электрические или электронные свойства, придаваемые нуклеотидным цепям, могут быть свойства проводимости, изоляции, селекции, переключения, электрического усиления, и т.д.
Функционализированное волокно - волокно, которое было химически или физически модифицировано, или прикреплено к веществам, кластерам атомов или молекул или частицам, нанесенным на него, что придает электрические или электронные свойства волокну или его части. Примером функционализированного волокна является волокно, нуклеотидная цепь которого функционализирована.
Узел - точка соединения двух или более волокон друг с другом. Примеры соединений можно увидеть на фиг.2 (см. далее описание, относящееся к этой фигуре).
Сеть - геометрическая одномерная, двумерная или трехмерная структура, которая включает, по крайней мере, одно волокно и может включать другие компоненты, такие как частицы, молекулы, например белки, другие макромолекулы и надмолекулярные комплексы и т.д. Термин "сеть" может относиться к геометрической структуре волокон и соединений между ними. Этот термин можно также использовать иногда как обозначающий "функционализированную сеть" (см ниже).
Функционализированная сеть - сеть, включающая, по крайней мере, одно функционализированное волокно. Фукционализированная сеть обладает свойствами, определяемыми наряду с другими ее геометрией, типом соединений и узлами между различными волокнами, природой нанесенных или образующих с ней комплекс веществ или частиц и т.д.
Электронная функциональность (или электронно-функциональный) - свойство компонента, которое позволяет ему служить в качестве электронного компонента.
Контактный компонент - проводящий субстрат, который может быть сделан из металла или любого другого проводящего материала или покрыт металлом или таким проводящим материалом, который служит для соединения указанной сети с внешними электронными или электрическими компонентами или схемами, служа, таким образом, в качестве входного/выходного (I/O) контакта с внешними компонентом или схемами. Контактные компоненты связаны с сетью, с одной стороны, и электрически связаны с внешними компонентами или схемами, с другой стороны. Термин "контактный компонент" может иногда обозначаться здесь также как "электрод".
Провод - в контексте настоящего изобретения - функционализированное волокно со связанным с ним веществом или частицами, которые обеспечивают электропроводность волокна. Провода являются проводящими компонентами, которые могут соединять между собой два или более участка сети, могут соединять сеть с электродом, соединять две сети и т.д. Провод может составлять полную длину функционализированного волокна или может составлять только часть длины функционализированного волокна, причем другая часть служит основанием для различного типа электронных компонентов, например диода, электрического переключателя, и т.д.
Изолятор - компонент сети, который действует как барьер для электропроводности.
Проводник - компонент сети, который обеспечивает перенос через него зарядов.
Переключатель - двух- или многотерминальный компонент, в котором проводимость между любой парой концов можно включить или выключить контрольным сигналом, создавая, например, потенциал на другом конце, свет, давление, химическую реакцию, нагрузку и т.д.
Электронный компонент - любой компонент, который может составлять часть электронной сети, отличающийся от провода или простого соединения между проводами (простым соединением является такое соединение, целью которого является только обеспечение связи между волокнами или функционализированными волокнами). Электронным компонентом может быть проводник, изолятор, переключатель, транзистор, диод, светоизлучающий диод, конденсатор, индуктор и др.
Компонент сети - термин, собирательно относящийся как к проводу, так и к электронному компоненту.
Внешняя схема, внешний компонент - электронная или электрическая схема или электронный или электрический компонент, соответственно расположенные электрически вне сети, обычно включают известные ранее электрические или электронные компоненты, включая стандартные твердотельные микроэлектронные компоненты.
Linker - агент (молекула, комплекс молекул, надмолекулярная структура, макромолекула, агрегат, коллоидная частица, молекулярный кластер и т.д.), который обеспечивает физическую связь между компонентами сети или между сетью и контактным компонентом. Линкеры могут содержать химические группы для ковалентного и нековалентного связывания (например, комплексообразования или сорбции и др.) с компонентами сети или контактным компонентом. Примерами линкеров являются: белок, связывающий нуклеиновую кислоту; синтетические молекулы со связывающей способностью в отношении определенных последовательностей нуклеиновых кислот; короткие, одноцепочечные или многоцепочечные последовательности нуклеиновых кислот (например, олигонуклеотиды), например, имеющие "липкие концы" и модифицированные с другого конца таким образом, чтобы обеспечить связывание с контактным компонентом; группа, включающая один член связывающей пары для связывания с другой группой или компонентом, содержащим другой член связывающей пары (связывающая пара является парой молекул, которые специфически взаимодействуют друг с другом, такой как антиген-антитело, рецептор-лиганд, биотин-авидин, сахар-лектины, нуклеотидная последовательность комплементарная последовательность и т.д.).
Комплексообразующий агент - агент, который используют для связывания компонентов сети друг с другом. Связывание может быть ковалентным или нековалектным. Примерами комплексообразующих агентов являются: белки со специфической связывающей способностью в отношении последовательности нуклеиновых кислот; олигонуклеотиды; синтетические молекулы, которые могут связываться с двумя компонентами; и т.д. Примером использования комплексообразующего агента является связывание конца волокна нуклеиновой кислоты с коллоидной частицей или связывание двух волокон нуклеиновых кислот друг с другом с целью создания узла.
Сущность изобретения
Настоящее изобретение использует свойства распознавания молекул и процесс самосборки последовательностей нуклеиновых кислот и других компонентов. Эти свойства используют для создания сетей на основе волокон с геометрией, определяемой типом схемы связей между нуклеотидными цепями волокон. Волокна могут быть сделаны из нуклеотидных цепей. В другом варианте волокна могут быть сделаны из веществ, отличающихся от нуклеотидных цепей, но включающих одну или более из нуклеотидных цепей, и могут быть соединены с другими сетевыми компонентами через такие цепи. Волокна могут быть полностью или частично а priori проводящими, но обычно бывают химически или физически модифицированы таким образом, что обладают электрической или электронной функциональностью. Функционализированная сеть может включать проводники, переключатели, диоды, транзисторы, конденсаторы, резисторы и т.д.
Настоящее изобретение обеспечивает в первом своем аспекте электронную сеть, по крайней мере, с одним сетевым компонентом, причем эта сеть имеет геометрию, определяемую, по крайней мере, одним волокном, включающим одну или более из нуклеотидных цепей.
Компонентом сети может быть проводник, например провод, или электронный компонент.
Волокна настоящего изобретения могут образовывать соединения, в которых один сегмент нуклеотидной цепи одного волокна связан с другим нуклеотидным сегментом другого волокна последовательность-специфическим взаимодействием. В другом варианте соединения могут быть образованы между нуклеотидными цепями различных волокон, молекулой, кластером атомов или молекул или частицей, которые связаны с каждой из нуклеотидных цепей в соединении. Такая молекула, кластер или частица могут быть связаны с нуклеотидными цепями через линкеры, связанные с указанной молекулой, кластером или частицей.
Соединение может быть также образовано модифицированными нуклеотидами, например, модифицированными таким образом, чтобы обеспечить ковалентное связывание, по крайней мере, одного нуклеотида одной цепи с нуклеотидом другой цепи. Примером такой модификации может служить добавление серы или аминового остатка, карбоксильной группы или активного сложного эфира. Химическая модификация нуклеотида может также обеспечить связывание цепи с линкером, связывание с частицей, связывание с электронным компонентом сети и т.д. Нуклеотидную цепь можно также модифицировать, связывая с ней один член связывающей пары для связывания с другим компонентом, включающим другой член связывающей пары. Связывающая пара состоит из двух молекул или фрагментов, которые обладают специфическим сродством друг к другу. Такие связывающие пары включают биотип - авидин, биотин - стрептавидин, рецептор - лиганд, dig - antidig, антиген - антитело, сахар - лектины, нуклеотидная последовательность - комплементарная последовательность, нуклеотидная цепь и нуклеотидсвязывающий белок. Обычно, по крайней мере, одна нуклеотидная цепь сети содержит одно или более из веществ, или, по крайней мере, один кластер атомов или молекул или частицу, связанные с ней или образующие с ней комплекс, так что образуется, по крайней мере, один электрический или электронный компонент со свойствами, которые основаны на характеристиках переноса электрических зарядов указанного одного или более из веществ, или, по крайней мере, одного кластера атомов или молекул или частицы.
Электронный компонент в сети электрически соединен с, по крайней мере, одним волокном и сконструирован либо на цепи нуклеиновой кислоты, которая была химически или физически модифицирована путем нанесения на нее одной или более из молекул, кластеров атомов или молекул, или частиц, для придания цепи электронной функциональности, либо сконструирован молекулой, кластером атомов или молекул или частицей, расположенными в соединении между двумя или более цепями нуклеиновых кислот различных волокон, что придает указанному соединению электронную функциональность. Электронная функциональность основана на характеристиках переноса электрических зарядов одной или более из молекул, кластеров атомов или молекул или частиц. Электронная функциональность может также иногда зависеть от геометрии узла.
Сеть обычно соединена с контактными компонентами (электродами), которые служат как входной/выходной (I/O) контакт между сетью и внешней электронной схемой или компонентом.
В соответствии с одним из вариантов настоящего изобретения волокна имеют нуклеотидный скелет, который был химически или физически модифицирован путем нанесения на него или включения в него одной или более из молекул, кластеров атомов или молекул или частиц для придания электронной функциональности. Волокна, которые, кроме того, включают одну или более из нуклеотидных цепей, могут быть также в основном сделаны (иначе, чем их нуклеотидные цепи) из различных веществ, таких как проводящие или полупроводящие полимеры, другие полимеры, которые были модифицированы для придания им электрической или электронной функциональности (например, путем нанесения на них молекул, кластеров атомов или молекул или частиц) или углеродных нанотрубок.
Молекулы, кластеры атомов или молекул или частиц, используемые либо для химических, либо для физических модификаций волокон или внутри соединений между волокнами, могут обычно включать или могут быть сделаны из одного или нескольких атомов металлов, что придает характеристики переноса зарядов на указанный кластер или частицу.
Скелет сети настоящего изобретения включает кислые волокна, которые собраны так, что образуют сеть на основании специфических взаимодействий их последовательностей с другими волокнами или специфического связывания с другими компонентами. Таким образом, можно создать сети с практически бесконечным разнообразием геометрических структур.
Вещества или частицы могут быть связаны с волокнами на основании их общих (полных) химических свойств. Обычно это обеспечивает практически гомогенное нанесение вещества или частиц вдоль волокна. Специфическим вариантом такого гомогенного связывания веществ или частиц является создание электропроводящего провода на скелете из нуклеотидных цепей, например, когда проводящим веществом является металл, как раскрыто далее. В другом варианте вещества или частицы могут быть связаны с нуклеотидной цепью последовательность специфическим или домен-специфическим образом в различных участках волокон, а именно способом, который зависит от последовательности нуклеотидов на данных участках цепей нуклеиновых кислот.
Последовательность-специфическое или домен-специфическое нанесение веществ на различные участки нуклеотидной цепи можно осуществить целым рядом способов. Например, олигонуклеотид, a priori связанный с некоторым электронно-функциональным веществом или частицей, можно выполнить так, чтобы он связывался с участком цепи с комплементарной последовательностью. Аналогично можно также связать различные типы веществ или частиц последовательность-специфическим или домен-специфическим образом с многоцепочечным (например, двухцепочечным) волокном из нуклеиновых кислот. Этого можно достичь, например, используя последовательность-специфический комплексообразующий агент, который идентифицирует и связывается со специфическим сайтом двухцепочечной цепи нуклеиновых кислот. Комплексообразующим агентом может быть олигонуклеотид, образующий с двухцепочечной цепью трехцепочечную структуру; белок, например ДНК-связывающий белок, распознающий специфический двухцепочечный домен; и многие другие.
С помощью последовательность-специфического или домен-специфического связывания различные типы веществ можно связать с различными участками конкретного волокна или сети волокон.
Частицы, например коллоидные частицы или полимеры, можно связать с одним или более из волокон, обычно с помощью комплексообразующих агентов или линкеров. Отложения таких частиц можно использовать для образования электронных компонентов, например одноэлектронных транзисторов (SET).
Геометрия сети определяется волокнами. При создании сети можно использовать свойства химической комплементарности и распознавания молекул, используя процесс самосборки. Волокна можно собрать с образованием сети последовательность-специфических взаимодействий нуклеотидной цепи с комплементарными последовательностями. Это можно использовать для образования различных соединений (например, Т- или Х-соединений, как представлено на фиг. 2 к др.). Специфическое молекулярное распознавание между цепями нуклеиновой кислоты линкерами или комплексообразующими агентами (линкеры и комплексообразующие агенты могут быть олигонуклеотидами или множеством других молекул, макромолекул, надмолекулярных структур или частиц) можно использовать для связывания цепей нуклеиновых кислот с контактными компонентами или с другими компонентами сети, например частицами, расположенными в соединениях между волокнами.
В одном из аспектов настоящего изобретения предложено соединение между двумя или более проводниками микроэлектронной сети, где каждый из проводников имеет концевой сегмент, ближайший к соединению, включающий нуклеотидную цепь, связанную с другой цепью внутри соединения.
В другом аспекте настоящего изобретения предложен способ получения электронной сети, включающий:
(a) обеспечение структуры, включающей, по крайней мере, один электропроводящий контактный компонент;
(b) присоединение линкера к, по крайней мере, одному контактному компоненту;
(c) осуществление контакта указанной структуры с, по крайней мере, одним волокном, включающим, по крайней мере, одну нуклеотидную цепь с последовательностью, способной связываться с линкером, и позволяющую осуществить связывание указанных последовательностей с указанным линкером;
(d) электрическую или электронную функционализацию, по крайней мере, одной нуклеотидной цепи путем нанесения на нее или путем образования с ней комплекса, по крайней мере, одного из веществ или частиц, придающих электрическую или электронную функциональность этому волокну.
Следует отметить, что порядок стадий в описанном выше способе не является принципиальным и может быть изменен. Например, стадия (с) может предшествовать стадии (b) или стадия функционализации (d) может предшествовать стадии (с).
Иногда сеть может быть сформирована сразу путем смешивания всех компонентов в среде, а затем предоставления компонентам возможности осуществить самосборку специфическим образом на основании свойств, которые заранее приданы компонентам. Волокна могут быть сконструированы так, чтобы иметь специфические последовательности нуклеиновых кислот, чтобы обеспечить их гибридизацию с комплементарными последовательностями других волокон. Аналогично, можно сформировать частицы со связанным с ними специфическим последовательность-распознающим или домен-распознающим комплексообразующим агентом, чтобы обеспечить связывание с цепями нуклеиновых кислот последовательность-специфическим или домен-специфическим образом. Например, можно создать кластеры или частицы с тремя различными связанными с ними олигонуклеотидами, которые затем свяжутся с концами трех различных нуклеотидных цепей с образованием соединения между тремя волокнами, содержащими коллоидные частицы. Аналогично для того чтобы обеспечить связывание сети с контактными компонентами специфическим образом, последовательность-распознающие или домен-распознающие линкеры можно иммобилизовать на контактных компонентах и осуществить их контакт с собираемой сетью.
В других случаях сеть можно создавать последовательным образом, например, вначале образуя субсетевую структуру, включающую часть компонентов полной сети, а затем недостающие компоненты (например, волокна, частицы и т.д.) можно последовательно добавлять до тех пор, пока сеть не будет создана полностью. Субсетевые структуры могут быть, например, частицами с присоединенными к ним несколькими олигонуклеотидами, структурами с разветвленными волокнами и т.д. Постепенная сборка может быть также основана на свойствах самосборки нуклеотидных цепей и комплексообразующих агентов и линкеров, которые связываются с нуклеотидными цепями последовательность-специфическим или домен-специфическим образом. Более того, возможно также, особенно в случае сетей со сложными структурами, вначале подготовить множество субсетевых структур, а затем скомбинировать их для образования полной сети.
Как должно быть очевидно специалистам, созданию сети может способствовать перемешивание среды, в которой формируется сеть, создание направленных потоков жидкости для ориентации волокон, чтобы соединить их с расположенными ниже по течению сетевыми компонентами по их другим концам, применение других способов смешения и т. д. При создании проводов настоящего изобретения электрический потенциал между двумя концами волокна, на котором этот провод сформирован, можно увеличить и обеспечить направленное нанесение проводящего вещества, например металла.
Нуклеотидные цепи, которые могут быть a priori одноцепочечными, двухцепочечными или многоцепочечными, можно создать и реплицировать различными способами, включая методики рекомбинантных ДНК, включающие продуцирование и репродуцирование волокон нуклеиновых кислот "синтезирующими" клетками, например микроорганизмами; иначе волокна можно получить синтетически, синтезируя нити, а затем объединяя их в более крупные волокна. Волокна можно создать с помощью различных методов амплификации, например, с помощью полимеразной цепной реакции (ПЦР) и т.д.
Волокна, сконструированные из нуклеотидных цепей и других веществ, можно создать различными способами. Обычно волокно не из нуклеиновой кислоты (например, полученное из проводящего полимера или представляющее собой нанотрубку) можно создать и ковалентно связать с обоих концов со специфическими нуклеотидными цепями. Такое волокно, включающее ненуклеотидное волокно, связанное с двух концов с нуклеотидной цепью, можно использовать как таковое при конструировании сети. Волокно можно удлинить, связывая с другими отрезками нуклеотидов, связывая с объединенным нуклеотид-ненуклеотидным волокном для получения более длинных волокон с чередующимися нуклеотидными цепями и ненуклеотидными отрезками и т.д.
Как будет понятно, вместо того, чтобы связывать цепь с концом ненуклеотидного волокна, можно связать только предшественник, а затем цепь синтезировать in situ, начиная с предшественника.
Отрезки ненуклеотидного волокна обычно a priori бывают проводящими или полупроводяшими, например, выполненными из проводящего или полупроводящего полимера или сополимера или проводящих нанотрубок. В таких случаях может не понадобиться никакой дополнительной функционализации отрезков ненуклеотидных волокон. Однако отрезки ненуклеотидных волокон могут быть a priori сделаны непроводящими и могут быть затем функционализированы, чтобы стать электрически или электронно функциональными, путем легирования или путем химического или физического нанесения на них различных молекул, кластеров или частиц, например тех, которые описаны выше.
В дополнительном аспекте в изобретении предложено соединение между электронным компонентом электронной сети и электропроводящим контактным компонентом, включающее нуклеотидную цепь, присоединенную к одному из электронных компонентов или к контактному компоненту и связанную бимолекулярным взаимодействием с линкером, присоединенным к другому из двух компонентов.
И еще в одном аспекте изобретения предложен сетевой компонент, как определено выше. Примерами сетевых компонентов, которые можно создать в соответствии с настоящим изобретением, являются переключатель, биполярный транзистор, одноэлектронный транзистор, транзистор с полевым эффектом, диод, конденсатор, резистор, проводник, светоизлучающий диод, изолятор, индукционная катушка.
Хотя вышеуказанные сетевые компоненты применимы в сетях настоящего изобретения, некоторые из них иногда могут быть использованы в различных применениях. Их малый размер по сравнению с соответствующими известными ранее компонентами позволяет использовать их в различных применениях, в которых требуется малый размер и низкое энергопотребление. Конкретным примером такого компонента является провод.
Провод настоящего изобретения можно изготовить очень тонким и можно с успехом использовать в применениях, где требуются тонкие провода, например в качестве затвора в полупроводниковом полевом транзисторе (FET) для очень быстрого переключения такого транзистора. Скорость переключения FET зависит в значительной степени от ширины (иногда специалисты используют термин "длины") провода в FET, выполняющего роль затвора. Провод в соответствии с настоящим изобретением может быть сделан примерно на два порядка величины меньше, чем известные провода затворов FET, и соответственно, используя провод настоящего изобретения, можно обеспечить быструю модуляцию в FET, более быструю, чем до сих пор была возможна. FET, включающий провод настоящего изобретения в качестве затвора, также составляет один из аспектов настоящего изобретения.
Далее настоящее изобретение будет проиллюстрировано следующим подробным описанием и последующими примерами со ссылками на прилагаемые чертежи. Специалистам должно быть ясно, что настоящее изобретение не ограничено конкретными описанными вариантами, но скорее применимо к полному объему изобретения, как раскрыто выше, а именно к созданию сети и компонентов этой сети, путем использования свойств самосборки волокон нуклеиновых кислот и путем нанесения веществ или частиц на волокна или образования комплексов веществ или частиц с волокнами, используя процесс самосборки, управляемый молекулярным распознаванием, для придания волокнам или узлам между волокнами электронной функциональности.
Краткое описание чертежей
Фиг.1А представляет матрицу контактных компонентов и линкеров для связывания с сетью настоящего изобретения, с одной стороны, и соединения с внешней электронной схемой или компонентами, с другой стороны.
Фиг. 1В иллюстрирует вариант иммобилизации олигонуклеотидных линкеров на контактных компонентах.
Фиг. 2 представляет примеры соединений между цепями нуклеиновых кислот (шесть примеров представлены на фиг. 2A-2F, которые разъясняются далее в тексте).
Фиг. 3А представляет способ формирования и функционализации цепи нуклеиновых кислот в провод, причем проводящим материалом является серебро (скелет провода состоит из нуклеотидов).
Фиг. 3В демонстрирует возможную вольт-амперную характеристику для провода, сформированного, как проиллюстрировано на фиг.3А, которая зависит от направления сканирования напряжения (представлено стрелками на кривых).
Фиг. 4 представляет способ формирования провода на нуклеотидном скелете, причем электронным материалом является полифениленвинилен (PPV).
Фиг. 5 представляет ряд примеров функционализированных нуклеотидных цепей, состоящих из р/n перехода (фиг.5А-5С), плавного р/n перехода (фиг.5D) и биполярного n-р-n транзистора (фиг.5Е).
Фиг. 6 представляет способ формирования одноэлектронного транзистора (SET) в соответствии с одним из вариантов изобретения.
Фиг. 7 представляет иллюстрацию молекулярного переключателя в соответствии с одним из вариантов изобретения.
Фиг. 8А представляет два примера волокон в соответствии с вариантами настоящего изобретения, включающими как нуклеотидные цепи, так и ненуклеотидные отрезки.
Фиг.8В является схематическим представлением волокна-предшественника для получения волокна в соответствии с вариантом настоящего изобретения, где скелет волокна создан в основном не на нуклеиновых кислотах и где цепи нуклеиновых кислот образуют только сегменты скелета.
Фиг. 9 иллюстрирует способ создания двух олигонуклеотидных цепей с обоих концов политиофенового волокна.
Фиг. 10 иллюстрирует способ присоединения производных олигонуклеотидов к карбоксильным группам, созданным на концах ненуклеотидных волокон.
Фиг. 11 представляет способ преобразования концевых групп углеродных нанотрубок с использованием производных олигонуклеотидов с аминогруппами.
Фиг. 12А и 12В представляют полупроводник FET в соответствии с вариантом настоящего изобретения, изображенный в плоскости (фиг.12А) и его поперечное сечение (фиг.12В).
Фиг. 13 представляет схему синтеза олигонуклеотида в соответствии с примером 1(А).
Фиг. 14 представляет флуоресцентно-меченый λ-ДНК отрезок между двумя золотыми электродами (темные полосы), находящимися на расстоянии 16 мкм.
Фиг. 15А и 15В представляют изображение, полученное с помощью атомного микроскопа (AFM), серебряного провода на ДНК-матрице, соединяющего два золотых электрода, расстояние между которыми 12 мкм, в размере поля 1,5 мкм (фиг.15А) и 0,5 мкм (фиг.15В).
Фиг. 16А представляет две вольт-амперные характеристики (I-V кривые) для серебряного провода, полученного по способу примера 9. Стрелки указывают направление сканирования напряжения. Сплошной линией на кривых представлены повторные сканы и это демонстрирует стабильность образцов. Отмечается асимметрия I-V кривых, соответствующая двум направлениям сканирования.
Фиг.16В представляет кривые I-V для различных серебряных проводов, в которых рост серебра более интенсивен, нежели на фиг.16А. Более интенсивный рост серебра приводит к меньшему плато для тока для порядка 0,5 вольт, и более низкое сопротивление (13 МОм по сравнению с 30 МОм на фиг.16В). При пропускании через провод более сильных токов плато исчезает и характеристика становится омической (пунктирная линия) во всем интервале измерений.
Фиг.17 представляет AFM изображение результата связывания коллоидных частиц золота с биотин-модифицированными нуклеотидами.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Создание сети обычно начинается с обеспечения матрицы контактных компонентов, которые обеспечивают I/О контакт. между сетью и внешним контуром или внешним компонентом. Иллюстрация одного из вариантов матрицы контактных компонентов 100 представлена на фиг 1А. Каждый из контактных компонентов 102 обычно представляет металлический электрод, имеющий соединяющую с сетью контактную площадку 104 и контактную площадку 106, соединяющую с внешней схемой, связанные соединительным участком 108.
В качестве подготовительной стадии для создания сети соединяющие контактные площадки обрабатывают, чтобы обеспечить их связывание с линкерами 110, например, производными олигонуклеотидов. (Один из вариантов иммобилизации линкерного олигонуклеотида на контактном компоненте представлен на фиг. 1В и описан далее). Подготовленные предварительно линкеры 110 можно затем присоединить к контактной площадке 104, обычно различные ликеры к каждой контактной площадке. Линкеры 110, представленные схематически в увеличенном размере справа от центральной части 112 матрицы, можно иммобилизовать на контактных площадках 104, например, струйной печатью, например, способом, описанным далее в примерах. Таким образом, отдельный линкер 110 может быть присоединен к каждой из контактных площадок 104. Каждый из линкеров 110 может обладать селективной связывающей способностью в отношении различных специфических последовательностей нуклеиновых кислот, причем эта особенность представлена различными формами на концах линкеров.
Сеть функционализированных волокон, включающая провода (как здесь определено и описано с помощью примеров далее) и множество других сетевых компонентов, сформированных на соединениях или у соединений между волокнами, можно затем соединить с матрицей; специфическое связывание последовательностей нуклеиновых кислот в волокнах сети с линкерами, иммобилизованными на контактных компонентах, приводит к специфической схеме соединений сети с контактными компонентами. В другом варианте цепи нуклеиновых кислот волокна можно сначала сделать специфическими для связывания с линкерами и при необходимости осуществить функциокализацию сети, т.е. образование электронно функциональных компонентов, создание проводов и т.д. в сформированной сети на основе нуклеиновых кислот. В другом варианте можно вначале закрепить некоторые структуры субсетей на матрице контактных компонентов, а на последующей стадии или одновременно обеспечить связывание субсетей друг с другом с образованием полной сети. Примеры субсетевых структур включают несколько волокон, соединенных вместе, частицы или кластеры атомов или молекул с присоединенными к ним несколькими волокнами нуклеиновых кислот и т.д. Опять же, волокна могут быть a priori электрически или электронно функциональными (полностью или частично), или функционализацию можно осуществить после создания сети.
На фиг.1В схематически представлен один из вариантов иммобилизации олигонуклеотида на контактном компоненте. Молекулы биотина 120 и 122 связаны, одна с олигонуклеотидом 124, а другая с содержащим серу фрагментом 126. Молекула биотина 122 иммобилизована на контактном компоненте 128 через содержащий серу фрагмент 126, а затем, когда молекулы стрептавидина 130 вводят в среду, за счет них происходит образование комплексообразующего агента 132, который является надмолекулярным комплексом, включающим биотин и стрептавидин, который иммобилизует олигонуклеотид 124 на контактном компоненте 128.
Олигонуклеотид 124 можно модифицировать на последующей стадии функционализации в сетевой компонент, такой как проводник, диод, транзистор и т.д., способом, который раскрыт далее. В другом варианте они могут служить в качестве линкеров для связывания концевого сегмента нуклеотидной цепи волокна.
Важными компонентами сети настоящего изобретения являются соединения, которые выполняют различные функции. Некоторые примеры соединений представлены на фиг. 2. На фиг.2А представлено соединение 200, сформированное между двумя одноцепочечными волокнами нуклеиновой кислоты 202 и 204. Узел в этом специфическом примере образован путем гибридизации конца 206 терминальной последовательности волокна 204 и комплементарной последовательности 208 волокна 202. Такой узел может служить Т-образным разветвлением между волокнами нуклеиновых кислот, которые затем могут быть трансформированы в функционализированные соединяющие соединения в результате нанесения электропроводящего вещества на волокна 202 и 204, например, описанным далее способом.
Другой тип соединения 210 представлен на фиг 2В. Соединение образуется за счет комплексообразующего агента 212, который может быть коллоидной частицей, белком, молекулой другого типа, надмолекулярной структурой и т.д. В этом случае соединение образуется между одноцепочечным волокном 214 и другим одноцепочечным волокном 216. Однако следует учитывать, что такое соединение может быть также создано между двумя двухцепочечными волокнами. Комплексообразующий агент может быть связан с волокнами различными способами. Связывание может быть ковалентным и нековалентным. Примерами нековалентного связывания являются ионные взаимодействия, гидрофобные взаимодействия, взаимодействия за счет Ван-дер-Ваальсовых сил и т.д. Комплексообразующий агент сам может быть также сложной молекулярной структурой, например, он может быть сформирован из двух или более молекул или макромолекул со связывающим сродством друг к другу, причем по крайней мере, один из них связан с каждым из волокон 216 и 214. Примерами таких сложных молекулярных структур могут служить различные молекулы, которые могут связываться друг с другом, например антитело-антиген, лиганд-рецептор, биотин-авидин, и многие другие.
Конкретный пример такой комплексной молекулярной структуры представлен на фиг. 1В. Хотя эта сложная молекулярная структура, которая представляет собой комплекс биотин-стрептавидин, представлена в роли иммобилизующего олигонуклеотид на электроде агента, ту же самую комплексную молекулярную структуру можно использовать для создания соединения между волокнами нуклеиновых кислот (т.е. каждое волокно нужно модифицировать, связав его с биотином, а затем из двух авидиновых фрагментов можно образовать комплекс за счет одного стрептавидина).
Другой пример соединения 220 представлен на фиг.2С. В этом случае комплексообразующий агент 222 связывает вместе два волокна 224 и 226. Комплексообразующий агент и способ его взаимодействия с волокнами нуклеиновой кислоты могут быть аналогичны комплексообразующему агенту 212 на фиг.2В.
Два других примера соединений представлены на фиг.2D и 2Е, Эти соединения 230 и 240 образованы между тремя и четырьмя цепями нуклеиновых кислот соответственно, причем каждая из них является двухцепочечной. Такие соединения можно получить в результате гибридизации или ферментативного синтеза, как раскрыто далее в примерах.
Другой тип соединения 250 представлен на фиг.2F. В этом случае комплексообразующий агент 252, например коллоидная частица, связывает вместе множество волокон, в этом конкретном случае четыре 253-256, каждое из которых связано своим концом с комплексообразуюшим агентом 252. Связывание каждого из волокон 253-256 с частицей 252 можно осуществить с помощью непосредственной ассоциации, используя медиаторы, такие
как специфически связывающие белки, любым из способов, раскрытых в связи с фиг.2В и 2С и т.д.
В дальнейшем будут описаны несколько примеров изготовления проводов и электронных компонентов и функционализированных сетей настоящего изобретение. Следует понимать, что они являются только примерами вариантов изобретения и возможны различные модификации описанных вариантов, причем все они попадают в объем настоящего изобретения, как здесь определено.
Обращаясь далее к фиг.3А, видно, что она представляет способ создания провода в соответствии с одним из вариантов настоящего изобретения, который в данном конкретном случае является проводом, созданным на нуклеотидном скелете. В данном случае провод сформирован между двумя электродами 300, обычно выполненными из металлов или покрытыми металлами, такими как золото, платина, серебро и т. д. Электроды 300, которые можно вначале обработать способом, который облегчает связывание с линкером, смачивают по отдельности раствором, содержащим либо молекулы линкера 302 либо 304, каждый из которых состоит из производного одноцепочечного олигонуклеотида ("Олиго А" и "Олиго В" соответственно) с дисульфидной группой. Когда эти линкеры нанесены на электроды 300, в соответствующих условиях дисульфидная группа связывается с электродами 300, образуя линкеры 306 и 308 соответственно (стадия (а)). Затем электроды 300 смачивают раствором нуклеотидных цепей, например, двухцепочечного волокна ДНК 310 с липкими концами, комплементарными последовательностям олигонуклеотидов в линкерах 306 и 308. Электроды 300 разводят друг от друга на расстояние, примерно равное длине волокон нуклеиновых кислот 310, за счет чего каждый конец волокна нуклеиновой кислоты 310 связывается с комплементарным ему олигонуклеотидом в одном из линкеров 306 и 308, с образованием мостика 312 между двумя электродами 300 (стадия (b)). Регулируя концентрацию олигонуклеотида 310 в среде, можно регулировать количество таких мостиков между электродами. После гибридизации связывание линкеров с волокнами нуклеиновых кислот можно усилить ковалентным связыванием этих двух друг с другом путем лигирования одноцепочечных разрывов.
Иногда, особенно в тех случаях, когда волокно 310 длинное и поэтому практически невозможно обеспечить гибридизацию по обоим его концам, просто полагаясь на диффузию, цепочку 310 можно соединить с одним электродом, а затем за счет направленного потока жидкости от первого электрода ко второму электроду заставить волокно нуклеиновой кислоты вытянуться таким образом, чтобы его конец достиг второго электрода.
Очевидно, что для того, чтобы избежать сворачивания волокон нуклеиновых кислот и для обеспечения нужного связывания, иногда необходим выбор соответствующих растворов.
Стадия функционализации волокна для целей создания металлического провода начинается в соответствии с конкретно иллюстрируемым вариантом со стадии обмена ионами, которая включает экспонирование волокна раствору, содержащему ионы серебра (Аg+), в щелочных условиях, в результате чего ионы серебра заменяют ионы натрия или другие ионы, обычно связанные с нуклеотидной цепью, и образуют комплекс с отрицательно заряженными волокнами (стадия (с)). Таким образом получают волокно нуклеиновой кислоты 314 с нанесенными на него ионами серебра 316. Следует отметить, что можно использовать не только ионы серебра, но и широкий круг ионов других металлов, включая, например, кобальт, медь, никель, железо, золото и т.д. Более того, на волокна нуклеиновых кислот можно также нанести агрегаты металлов, комплексы или кластеры, например коллоидное золото, коллоидное серебро и т.д., за счет разнообразия различных взаимодействий. Стадия обмена ионами обычно включает промывку волокон деиониpированной водой, а затем вымачивание их в растворе ионов металла или агрегатов металла.
На следующей стадии (стадия (d)) волокно подвергают действию восстанавливающего агента, например гидрохинона, что приводит к восстановлению ионов металла in situ до металлического серебра. На ряде участков зародышеобразования образуется металлический осадок, например, металлическое серебро. После промывки дистиллированной водой волокна с участками зародышеобразования 318 подвергают контакту с раствором реагента, содержащего ионы металла и восстанавливающий агент, например гидрохинон, в кислых условиях. В этих условиях ионы превращаются в металлический металл только на участках зародышеобразования и в результате происходит рост центров зародышеобразования, приводящий к формированию проводящего провода 320 (стадия (е)).
Следует отметить, что центры зародышеобразования серебра можно усилить с помощью химического нанесения золота или других металлов. Аналогично, центры зародышеобразования золота можно усилить путем нанесения золота, серебра или других металлов.
Сформированный таким образом провод 320 можно подвергнуть различным обработкам после изготовления, которые могут включать, например, термообработку, предназначенную для увеличения толщины и гомогенности проводов; пассивационную обработку с целью создания непроводящего слоя вокруг провода, например, обрабатывая его алкантиолом; электрохимическое или фотохимическое наращивание провода за счет полимеров на проводах и т.д.
Фиг. 3В иллюстрирует типичную вольт-амперную характеристику для провода, сформированного в соответствии с процедурой, проиллюстрированной на фиг.3А. Как видно, кривые нелинейны и асимметричны по отношению к нулевому смещению. Формы кривых зависят от направления сканирования, как показано стрелками на фиг. 3А. При приближении к нулевому значению напряжения с больших положительных или отрицательных смещений ток исчезает почти линейно с напряжением. Образуется плато нулевых значений тока с очень большим дифференциальным сопротивлением. При более сильных смещениях провод снова становится проводящим с другим канальным сопротивлением. Такая исторически зависимая вольт-амперная характеристика может придать проводу свойства логического элемента или элемента памяти.
Очевидно, что аналогичным способом, mutatis mutandis, можно получить волокна, представленные на фиг. 3А. Может только понадобиться необходимая стадия функционализации по отношению к терминальным или промежуточным нуклеотидным цепям.
На фиг. 4 представлен способ создания провода в соответствии с другим вариантом настоящего изобретения. Здесь снова провод создают на нуклеотидном скелете. Как было указано ранее со ссылкой на вариант, представленный на фиг.3А, аналогичная процедура, mutatis mutandis, может следовать в отношении волокна такого типа, который представлен на фиг.8А. В этом варианте в отличие от того, что представлено на фиг.3А, наносимым материалом является не металл, a PPV (полифениленвинилен). Электроды 400 могут быть такими же, что и электроды 300, изображенные на фиг.3А. Первые две стадии способа (стадии (а) и (b)) практически идентичны соответствующим стадиям на фиг.3А (идентичные компоненты представлены ссылочными номерами с одинаковыми последними двумя цифрами, что и у соответствующих компонентов фиг.3А, например 402 одинаков с 302, 404 - с 304 и т.д.). Сформированный мостик 412 может быть усилен аналогично вышеописанному путем ковалентного связывания волокна 410 с линкерами 406 и 408, в результате чего образуется полное волокно 414, соединяющее два электрода (стадия (с)).
Затем осуществляют контактирование раствора, включающего молекулы npe-PPV [26] 416, с волокном 414, и, будучи положительно заряженным, пре-PPV 414 образует комплекс с отрицательно заряженной ДНК мостика 414 (стадия (d)). На следующей стадии образец промывают, сушат и, наконец, нагревают в вакууме, например, до температуры около 300oС в течение примерно 6 часов, что приводит к выделению тетрагидротиофеновых групп и хлористоводородной кислоты из каждого повторяющегося звена, в результате чего получают люминесцентный PPV компонент (стадия (е)).
Для превращения PPV в проводник этот полимер легируют агентами, которые либо вызывают дефицит электронов (дырки), либо создают дополнительные электроны. Легирование можно осуществить множеством известных способов, например, обрабатывая парами серной кислоты, добавляя пары галоидной кислоты (например, НСl, НВr), используя додецилбензолсульфоновую кислоту, используя камфорсульфоновую кислоту, или другими способами. Степень легирования определяет проводимость провода.
Вместо PPV или в дополнении к нему в соответствии с настоящим изобретением можно использовать многие другие полимеры. Они включают различные полимеры с положительно заряженными боковыми группами, а также полимеры с положительно заряженными группами в скелетной цепи или полимеры с распознающими группами, способными связываться с волокнами нуклеиновых кислот. Другим примером полимера является полианилин (PANI). Эти полимеры включают такие, у которых существует дефицит электронов (полимеры р-типа), либо избыток электронов (полимеры n-типа). В дополнение аналогичным способом, mutatis mutandis, с волокном можно связать другие типы проводящих веществ (вещества р-типа или n-типа).
Используя олигонуклеотиды, связанные с различными веществами, которые могут придавать электронную функциональность, можно точно регулировать свойства электронных компонентов, собранных на волокне нуклеиновой кислоты. Например, два нуклеотида, один из которых содержит последовательность, которая обеспечивает гибридизацию со специфическим участком волокна, и связан с веществом р-типа, а другой содержит последовательность, обеспечивающую гибридизацию с соседним участком волокна, связанным с веществом n-типа (полимер с избытком электронов), связывают с волокном, и таким образом можно создать n/р переход, который, например, служит диодом. Другим примером может служить создание р-n-р или n-р-n типа биполярного транзистора.
Примеры некоторых функциональных компонентов, которые можно сформировать на нуклеотидной цепи, представлены на фиг.5. На фиг.5 р/n переход сформирован веществом р-типа 510, связанным с одним нуклеотидом 512, который в этом конкретном примере представляет поли-С, и веществом n-типа 514, связанным с другой олигонуклеотидной последовательностью 516, в данном конкретном случае поли-А. Эти олигонуклеотиды связаны с комплементарными последовательностями 518 и 520 соответственно на нуклеотидном волокне 522, и после присоединения образуется р/n переход. На фиг.5А р/n переход образован на одноцепочечном сегменте волокна 522. Аналогично такой переход можно сформировать на двухцепочечном волокне 524 (см. фиг.5В), например, вначале удаляя часть одной цепочки, например, ферментативным расщеплением (для экспонирования соседних сегментов 526 и 528, а затем гибридизуя их с олигонуклеотидами 530 и 532, несущими на себе вещества р-типа и n-типа, соответственно.
Оставшуюся часть волокна можно, например, обработать таким образом, чтобы сформировать провод, такой как описан выше со ссылкой на фиг.3 или 4, и соответственно диод (р/n переход) 534 формируется с проводящими проводами (С) 536 и 538 с расположенными с обоих концов диода (фиг.5С). Для того чтобы обеспечить невозможность осаждения проводящего вещества на участок р/n перехода, материалы, составляющие переход, можно вначале соединить и только потом остальную часть волокна обработать описанным выше способом для создания проводящего провода.
На фиг. 5D схематически представлена другая структура, которая в этом случае состоит из двух проводящих проводов (С), сформированных на двух периферических участках волокна 540 и 542, которые обрамляют участок волокна, который был трансформирован в плавный р/n переход 544. Этот пример перехода состоит из участков, которые сильно легированы 546 и 548 (ррр и nnn), участков, которые умеренно легированы 550 и 552 (рр и nn) и участков, которые только слегка легированы 554 и 556 (р и n).
Другая функционализированная структура представлена на фиг.5Е. Эта структура представляет собой соединение, которое имеет Т-образное разветвление 560, и путем превращения участка соединения в n-р-n биполярный переход 562, как показано (или переход р-n-р) и путем превращения оставшихся участков волокон 564, 566 и 568 в провода можно получить биполярный транзистор.
Специфические нанесения различных веществ можно также осуществить способами, отличными от гибридизации. Например, для этой цели можно использовать различные молекулы, например белки, которые способны распознавать специфические домены, даже без необходимости "раскрытия" двухцепочечных или многоцепочечных нуклеотидных цепей.
Р-n переходы можно также получить в соответствии с настоящим изобретением в волокнах типа, который проиллюстрирован на фиг.8А, которые состоят из нуклеотидных цепей, присоединенных к отрезкам ненуклеотидного волокна, выполненного из полупроводящего полимера. Если полупроводящий полимер относится к р-типу, тогда полимер n-типа можно нанести на сегмент нуклеотидной цепи, соседний с сегментом полупроводникового волокна, способом, аналогичным способу, представленному на фиг.5. Аналогично р-n переход можно создать, нанеся полимер р-типа на сегмент нуклеотидной цепи, соседний с последовательностью полупроводникового волокна n-типа.
На фиг.6 представлен способ конструирования одноэлектронного транзистора (SET). Частицу 600 выполняют такой, чтобы она связывалась с тремя различными нуклеотидами 602, 604 и 606. Один из куклеотидов связан с частицей 600 через крупный непроводящий комплексообразующий агент 608, например, через белок или надмолекулярную структуру (цель этого будет объяснена далее). В группе трех электродов 610 каждый из электродов связан с одним из волокон 612, 614 и 616 (которые могут быть нуклеотидным волокном, волокном типа проиллюстрированного на фиг. 8А и другими), каждое из которых имеет отличающийся липкий конец, комплементарный последовательности в одном из нуклеотидов 602, 604 и 606. "Одетую" нуклеотидами частицу подвергают контактированию с рядом электродов и, обеспечивая условия для гибридизации, создают структуру 620, состоящую из электродов 610, связанных с частицей 600 через три мостика, каждый из которых состоит из одного из волокон 612, 614 и 616 и одного из олигонуклеотидов 602, 604 и 606 соответственно. Волокна 612, 614 и 616 могут быть сделаны такими, чтобы ковалентно связываться с олигонуклеотидами 602, 604 и 606 соответственно с образованием составных волокон 622, 624 и 626.
Частицы подвергают пассивации, например, обрабатывая щелочным тиолом, октадецилтиолом, додецилтиолом и т.д. для создания изолирующего слоя 630 для изоляции коллоидной частицы от окружающей среды и чтобы избежать отложения металла на коллоидной частице на последующей стадии. Затем из волокон 622, 624 и 626 формируют провода, например, описанным выше способом, в результате чего создают SET.
В SET провод 622 служит затвором, и для его правильного функционирования предпочтительно высокое сопротивление между ним и частицей 600, и эту цель достигают за счет комплексообразующего агента 608. В обычных условиях частица 600 представляет для тока большое сопротивление, но когда потенциал на затворе изменяется, создаваемое электростатическое поле снижает энергию активации, необходимую для зарядки или для удаления заряда с коллоидной частицы и в результате возникает ток между проводами 624 и 626.
Как должно быть очевидно, описанный здесь способ конструирования SET приведен лишь в качестве примера. Одним из альтернативных способов является формирование вначале частицы с присоединенными к ней волокнами, а затем связывание волокон с электродами, например, с помощью олигонуклеотидных линкеров. Как должно быть ясно специалистам, существуют и другие альтернативные способы конструирования SET в соответствии с настоящим изобретением.
Фиг.7 является иллюстрацией молекулярного переключателя, который основан на обратимом фотопреобразовании. Молекулярный фрагмент, такой как бис-тиофеновые производные гексафторциклопентена или малеимида (фиг.7А и 7В соответственно) связывают с сетями. Полимерные группы (Р1 и Р2 (которые могут быть одинаковы или различны)), которые могут содержать распознающие группы, которые могут быть последовательность-селективными или последовательность-неселективными, присоединяют к обоим тиофеновым фрагментам за счет ковалентных или нековалентных взаимодействий с образованием разрушенного сопряженного полимера. Полимеры Р1 и Р2 каждый соединены с различными волокнами (Р1 и Р2 соответственно не показаны). После облучения светом соответствующей длины волны (λ) происходит фотоциклизация тиофенов с двойной связью гексафторциклопентена или малеимида, при этом образуется сопряженный полимерный провод, который электрически связывает Р1 и Р2. Фотовозбуждение циклизованного переключателя приводит к процессу ретроциклизации и новому разрушению сопряжения вдоль полимерной цепи.
Переключающий световой сигнал можно обеспечить из внешнего источника света или можно обеспечить внутри за счет внутреннего источника света.
Фиг. 8А схематически представляет другие варианты волокон в соответствии с настоящим изобретением; если волокна, представленные на фиг.3А и 4, имели нуклеотидный скелет, волокна, представленные на фиг.8А, имеют скелет, который представляет композитную структуру, состоящую как из нуклеотидных сегментов, так и из ненуклеотидных сегментов. На фиг.8А представлены два варианта волокон, волокно 700 и волокно 710. Волокно 700 имеет как основную часть отрезок ненуклеотидного волокна 702, концы которого связаны с двумя нуклеотидными цепями 704 и 706. Ненуклеотидный отрезок волокна 702 может быть полимером, проводящим, полупроводящим или непроводящим или может быть нанотрубкой, например нанотрубкой на углеродной основе.
Волокно 710 состоит из нескольких отрезков ненуклеотидных волокон 712, 714, 716, соответственно соединенных нуклеотидными цепями 718 и 720 и обрамленных двумя терминальными последовательностями нуклеотидных цепей 722 и 724. При таком составе волокон олигонуклеотидные цепи служат в качестве распознающих групп для связывания с олигонуклеотидными цепями других волокон. Предпочтительно, чтобы отрезки ненуклеотидных волокон (702 волокна 700 к 712, 714 и 716 волокна 710) были сделаны из проводящего или полупроводящего материала. Использование таких ненуклеотидных сегментов облегчает конструирование различных электронных компонентов. Такие вещества могут быть молекулярными, макромолокулярными или немолекулярными (гетерогенными) по природе и могут быть сделаны из олигомеров и полимеров тиофенов, пирролов, анилинов, ацетиленов, фениленов, комплексов металлов (таких как соединенные аксиально порфирины, комплексы платины и т.д.) и нанотрубок, например нанотрубок на основе углерода.
Как схематически представлено на фиг.8В, в такие отрезки ненуклеотидных волокон можно селективно ввести активные группы (R1 и R2) по их терминальным сайтам. R1 и R2 могут быть одинаковы или различны и могут представлять -NH2, СО2Н, -CO2R'-Br-B(ОН)2 и многие другие.
Олигонуклеотиды, содержащие комплементарные фрагменты, могут быть ковалентно связаны с этими активными терминальными группами. Например, можно получить политиофен с двумя карбоксильными группами с двух концов, как представлено на фиг.9. К этим карбоксильным группам можно присоединить производные нуклеотидов, содержащие аминогруппы, используя различные способы, один из которых представлен на фиг.9, используя EDC за счет образования активных сложных эфиров по карбоксильным группам способом, представленным на фиг.10, где "R" представляет проводящий провод.
Аналогичный подход можно использовать для выбранного способа изменения терминальных групп углеродных нанотрубок, используя аминопроизводные олигонуклеотидов. Углеродные нанотрубки могут иметь карбоксильные группы у обоих своих терминальных концов (Wong et al., Nature, 394:52, 1998). К этим концам можно присоединить аминопроизводные олигонуклеотидов за счет присоединения по активному эфиру, как видно на фиг.11.
Для присоединения олигонуклеотидов к волокну можно использовать различные другие способы присоединения, такие как использование взаимодействий ион металла-лиганд, использование комплексов металл-металл, способы гетероприсоединения под действием катализатора - ионов металлов, и т.д.
Фиг. 12 является схематической иллюстрацией FET в соответствии с настоящим изобретением. FET 800 включает исток электрод 802, сток электрод 804, расположенные с двух концов полупроводниковой матрицы 806. Провод затвора 808, соединенный с электродом затвора 810, расположен в углублении 812 внутри полупроводниковой матрицы 806. Длина затвора в полупроводниковом FET определяет в значительной степени максимальную частоту, с которой может работать FET. Более короткие затворы минимизируют время пролета электронов под затвором и, следовательно, обеспечивают более высокие рабочие частоты. Так как размеры FET помимо затвора не являются критическими, именно параметры затвора представляют основную проблему для массового производства более быстродействующих FET. FET, изготовленные в соответствии с настоящим изобретением, предлагают решение этой проблемы. FET, кроме затвора, могут быть изготовлены с помощью обычных литографических и полупроводниковых процессов и методик, и тогда затвор может быть сформирован путем растягивания волокна нуклеиновой кислоты между электродами, а затем это волокно может быть металлизировано, как указано выше. Таким образом, можно легко получить затворы менее 0,1 мкм, что обеспечивает дешевое массовое производство быстродействующих FET.
Далее настоящее изобретение будет проиллюстрировано следующими примерам.
ПРИМЕРЫ
Пример 1. Создание линкеров
(a) Линкеры на дисульфидной основе
Стекло с контролируемым размером пор (CPG), видоизмененное дисульфидными группами, используют для синтеза (начиная с 3' конца) олигонуклеотида со свободным 5' сайтом. Этот олигонуклеотид получают, используя обычный ДНК синтезатор (см. схему на фиг.13).
(b) Линкеры на основе тиола
Линкеры получают по способу (а) выше и дисульфидную связь расщепляют, получая свободный тиол.
(с) Линкеры на основе комплекса биотин-стрептавидин
Биотиновый фрагмент присоединяют к олигонуклеотиду, содержащему специфическую последовательность, как известно per se. Биотин-олигонуклеотид соединяют через стрептавидин с другой молекулой, содержащей биотиновый фрагмент с одной стороны (cм. также фиг.1В) и тиол или дисульфидную группу с другой стороны.
(d) Линкеры на основе репрессоров
Белок, связывающий нуклеиновую кислоту, такой как lac репрессор, ковалентно присоединяют к тиольной группе. Синтезируют ДНК последовательность, имеющую липкие концы и содержащую мишеневую последовательность, с которой связан репрессор. ДНК последовательность соединяют с репрессором через мишеневую последовательность.
(е) Линкеры на основе тиофосфатов
Конструирование олигонуклеотидной последовательности (начиная с ее 3' конца) осуществляют, используя обычный ДНК синтезатор, причем содержащие тиофосфаты нуклеотиды используют вместо фосфатсодержащих нуклеотидов.
(f) Линкеры на основе искусственных сайт-специфических фрагментов
Синтетический сайт-специфический фрагмент, такой как, например, Rh(Phen)2Phi, который, как известно, связывает 5'-pyr-pyr-pur-3 последовательность [26] (рyr=пиримидин, рur=пурин), ковалентно связывают с тиольной группой.
Пример 2/ Присоединение линкера к электроду
(а) Смачивание микропипеткой
Электроды смачивают растворами соответствующих линкеров, например, используя пипетки или микропипетки, или любые жидкостные диспенсеры. Такие жидкостные диспенсеры могут быть фиксированы на манипуляторе, который может контролироваться с помощью компьютера. На каждый из электродов можно наносить линкеры различного типа. Кроме того, различные типы линкеров можно наносить одновременно или последовательно на различные электроды.
(b) Струйная печать
Для селективного нанесения различных линкеров на различные электроды используют методики? похожие на струйную печать чернилами. Используя такую методику, можно достичь высокой точности, разрешения и повысить производительность, облегчая крупномасштабное производство.
(с) Ab-inito синтез электрод-линкер
(с1) Иcпользование селективных маскирующих методик
Хорошо разработанная используемая для синтеза ДНК технология может быть использована для ab-inito получения ряда комплексных структур электрод-линкер. Например, инертный субстрат, состоящий из набора электродов, частично покрывают инертным покрытием, получая два типа электродов: электроды с покрытием (А) и электроды без покрытия (В). Субстрат обрабатывают раствором тиола, связанного с последовательностью нуклеиновой кислоты, что служит начальной точкой для синтеза ДНК. Благодаря инертному покрытию только электроды В, т.е. электроды без покрытия, прореагируют с тиолом. Используя стандартные методики синтеза ДНК, на В электродах получают заранее определенную последовательность. Затем субстрат промывают и замаскированные электроды обнажают с последующим селективным покрытием В электрода. Эта процедура позволяет получать два типа электродов, которые отличаются друг от друга типом связанных с ними линкеров. Та же самая методика с несколько более сложными стадиями (несколько стадий маскировки и удаления маскировки) позволяет изготавливать различные субстраты, содержащие много различных электродов с различными связанными с ними линкерами.
(с2) Использование фотометодик для удаления защитных групп
Этот подход использует фотолабильные группы для защиты начальной точки синтеза ДНК. Инактивированные группы в начальной точке синтеза не способны реагировать с нуклеотидами. Используя селективное облучение с помощью маски, и/или световода, и/или любого другого адресного источника света, активации различных выбранных электродов достигают в результате фотоудаления защитных групп с выбранных электродов.
(с3) Использование блокаторов
Используя маскирующую методику ((с) выше) получают набор электродов для синтеза олигонуклеотидов. После того как синтез ДНК последовательности завешается на одном наборе электродов, концевую группу присоединяют к олигонуклеотиду, обеспечивающему их инертность. Далее можно синтезировать другие последовательности на других электродах, которые получают в соответствии с предыдущей стадией, но которые становятся активными на этой стадии. Следует отметить, что набор линкеров, сконструированный на предыдущей стадии, не затрагивается благодаря блокаторам, присоединенным к их концевым точкам.
(с4) Печать электродов
Линкеры присоединяют к проводящим шарикам, таким как золотые коллоидные частицы. Затем коллоидные частицы распределяют контролируемым образом для образования проводящих металлических площадок с присоединенными к ним линкерами. Распределение можно осуществить различными способами, изложенными выше, или любым другим удобным способом.
Вышеуказанные методики можно использовать отдельно или в любом сочетании с другими методиками.
Пример 3. Конструирование сетей - создание соединений
(а) Создание разветвленной последовательности
Стабильное разветвленное ДНК соединение, состоящее из четырех ветвей, создают, используя, например, следующие последовательности:
Тщательное планирование последовательностей позволяет создавать сложные соединения в соответствии с необходимой структурой. Такую разветвленную последовательность можно присоединить к двухцепочечным волокнам, используя способы, известные per se.
(b) Создание ветвей с помощью ферментативных реакций
Белок rесA из бактерии E.coli катализирует рекомбинацию и конструирование гибрида со спаренными основаниями для соединения двух молекул ДНК. Он может соединять специфическим образом одноцепочечную ДНК с двухцепочечной ДНК при условии, что существует гомологичность между одноцепочечной и двухцепочечной ДНК. ДНК-связывающие белки могут удлинять одноцепочечную ДНК и облегчать ДНК отжиг за счет случайных столкновений. Можно также достичь специфических контактов пар оснований между двумя отдельными дуплексами с образованием четырехцепочечной структуры, которая выстраивается через химические фрагменты, экспонированные в бороздках двух спиралей. Аналогично rесА белок может вызвать специфические контакты между одноцепочечными и двухцепочечными ДНК за счет распознавания комплементарной последовательности "снаружи" без необходимости раскрытия двойных цепочек и экспонирования их одноцепочечной последовательности. Существует также возможность рекомбинации трехцепочечных и четырехцепочечных спиралей. Четыре ДНК цепочки могут также претерпеть "переключаемое спаривание" в точке соединения с образованием соединения с перекрещивающимися цепочками (так называемая структура Holliday). Затем существует возможность создать так называемые гетеродуплексы, которые представляют собой участки на рекомбинантных ДНК молекулах, где две цепочки не точно комплементарны. Однако разветвляющееся соединение может мигрировать до своей равновесной точки спаривания комплементарных оснований. Полностью рекомбинантные дуплексы образуются при стерических перегруппировках. Использование rесА белка для создания Holliday структур in vitro хорошо известно (см, например, B. Alberts, et al., Molecular Biology of the Cell, 3rd Ed. Garland Publishing Inc., New York, 1994). Другой фермент, rесВС из E.coli бактерий обладает как расплетающей, так и нуклеазной активностями и поэтому может катализировать раскрытие одноцепочечной ДНК со свободным концом, что позволяет rесА белку начать реакцию спаривания. Для поэтапного создания сети важен тот факт, что rесВС инициирует расплетание только на ДНК, которая содержит свободный конец дуплекса. Затем он перемещается вдоль ДНК от свободного конца, расплетая и снова заплетая ДНК по мере продвижения. Так как он расплетает ДНК быстрее, чем снова заплетает ее в дуплексной ДНК создаются "пузырьки" или петли одноцепочечных участков. Затем rесА белок можно связать с отрезком, сделанным rесВС в специфической последовательности, 5'-GCTGGTGG-3', в одной из одиночных цепочек, и инициировать обмен ДНК цепочки с другой ДНК. Специфическую последовательность отрезка можно создать заранее с помощью синтеза искусственной рекомбинантной ДНК (см В. Alberts et al., supra и L. P. Adams et al. The Biochemistry of the Nucleic Acids, 11th Ed., Chapman & Hale, 1992).
(с) Использование белков, связывающих нуклеиновую кислоту
Двум или более из специфических ДНК связывающих белков предоставляют возможность взаимодействовать с двумя или более из ДНК цепочек. Присоединение таких связывающих белков дает возможность создавать соединения между различными ДНК цепочками.
Пример 4. Присоединение сети к субстрату
Закрепление сети на субстрате можно осуществить, используя различные ДНК связывающие протеины. Например, репрессоры из бактерий (например, lac-penpeccop или λ-репрессор), которые могут связываться как с субстратом (таким как пластиковый субстрат), так и с ДНК, тем самым соединяя их. Такое связывание стабилизирует сеть и не затрагивает ее электрической функциональности.
Пример 5. Создание интегральной схемы
Интегральная схема (IC) состоит из субстрата, такого как силикон, производные силикона, двуокись кремния, производные двуокиси кремния, органические полимеры или любые другие вещества, способные действовать в качестве подложки для обеспечения механической фиксации или стабилизации сети. Субстрат может выполнять электрическую функцию.
Типичный пример создания IС описан далее.
Пример 6. Пассивация стеклянного субстрата
Стеклянный субстрат погружают в дымящуюся азотную кислоту (100% HNO3) на 10 мин, промывают деионизированной водой (DI), затем погружают в 1н. раствор NaOH еще на 10 минут и снова промывают деионизированной водой. Очищенное стекло тщательно сушат, затем погружают примерно на 12 ч в раствор алкилтрихлорсилана (октилтрихлорсилан, третбутилтрихлорсилан и т.д.) в тетрахлорэтане (1: 5 об/об). Затем стеклянную пластину осторожно промывают несколько раз тетрахлорэтаном и изопропанолом и тщательно сушат.
Пример 7. Изготовление электродов
Электроды изготавливают в соответствии с одним из следующих способов. Используют стандартную фото-, электронную или рентгеновскую литографию на субстрате с последующим нанесением проводящего вещества (например, металла). В другом варианте можно сначала нанести проводящее вещество и создавать схему после. (ii) Сборка электродов на поверхности. Нанесение схемы на поверхность стекла, используя полиэлектролиты, такие как полиэтиленимин, полиспирты, поликислоты, полипиридины и т.д., или другие лигирующие агенты, такие как монослой тиода (созданный из органических соединений, содержащих тиольные и силановые фрагменты на противоположных участках молекулярного скелета) с последующей фиксацией электропроводящих компонентов, таких как коллоидное золото, что позволяет осуществить сборку проводящих электродов на субстрате.
Пример 8. Электрическая функционализация сетей на основе нуклеиновых кислот - проводящих проводов на основе металлов
(i) Соответствующую часть сети экспонируют раствору, содержащему ионы соответствующего металла, и таким образом происходит обмен ионами по фосфатным группам ДНК скелета, экспонированным раствору. В некоторых условиях может также происходить взаимодействие ионов внутри ДНК.
(ii) Затем полученный после обмена ионами комплекс ДНК восстанавливают с помощью восстанавливающего агента, такого как гидрохинон.
Циклы (i) и (ii) можно повторять в последовательном порядке до тех пор, пока не будет получен проводящий провод. В другом варианте создание проводящего металлического провода включает следующие стадии как отдельные процессы: или в связи со стадиями (i) и (ii), или объединенные с одной или более из следующих методик.
(iii) Соответствующую часть сети после обмена ионами экспонируют метастабильной смеси восстанавливающего агента и ионов металла. Восстановление происходит только на поверхности металлических кластеров, образовавшихся на стадиях (i) и (ii), и, таким образом, промежуток между металлическими кластерами перекрывается мостиком за счет процесса нанесения металла.
(iv) ДНК сеть после обмена ионами или частично обработанная ДНК сеть подвергается электрохимической обработке, в результате чего ионы, нанесенные на ДНК полиэлектролит, превращаются в металлический проводник. Кроме того, электрохимический процесс вдоль молекулы ДНК способствует вертикальному росту металлического провода вдоль него.
(v) Фотохимическое нанесение металла из его соответствующей ионной формы для создания металлического провода.
(vi) Кластеры или коллоиды адсорбируют на ДНК сети, используя последовательность-селективные компоненты, например специфические последовательности, которые способны связываться со специфическими сайтами на ДНК, или не последовательность-специфическими связывающими агентами, например полиэлектролитами, претерпевающими электростатические взаимодействия с ДНК. Эти кластеры и/или коллоиды служат катализаторами указанных выше процессов (iii)-(v).
(vii) дефекты в гранулярных проводах, сформированных одним или более из вышеуказанных методов, можно отжечь, используя различные способы, такие как процесс термического отжига, электроосаждение и т.д.
Примером изготовления функционализированной серебром сети служит следующий:
(i) ДНК сеть, фиксированную на субстрате, экспонируют основному раствору ионов серебра (рН 10,5, NH4OH, 0,1 М AgNО3). После того как происходит обмен ДНК полиэлектролита с ионами серебра, субстрат тщательно промывают деионизированной водой (DI) и сушат.
(ii) Фиксированную на субстрате сеть ДНК с нанесенным серебром экспонируют основному раствору гидрохинона (0,05 М), рН 5 в качестве восстанавливающего агента. Стадии (i) и (ii) повторяют последовательно до тех пор, пока не образуется электропроводящий провод.
(а) Дополнительные процессы
Стадию (iii) осуществляют после одного или более (i)+(ii) циклов.
(iii) ДНК сеть с нанесенными кластерами металлического серебра (после осуществления циклов (i) и (ii)) и после окончательной промывки деионизированной водой экспонируют кислотному раствору гидрохинона (цитратный буфер, рН 3,5, 0,05 М гидрохинона) и AgNO3 (0,1 М). Цикл (iii) заканчивают, когда ширина провода достигает нужного размера. Этот процесс можно сделать светочувствительным и, таким образом, можно также контролировать, меняя условия освещения.
(b) Электрохимическое осаждение для усовершенствованного процесса
(iv) Для улучшения коэффициента формы металлического проводника используют электрохимический процесс. Для этой цели предварительную обработку щелочным тиолом осуществляют до (i)+(ii) процессов. Это обеспечивает инертность металлических электродов в отношении электрохимического осаждения металла. После одного или более (i)+(ii) циклов электроды, соединенные ДНК проводами, покрытыми металлом, присоединяют к электрическому источнику с регулируемым током и смещением и соответствующую часть ДНК сети экспонируют раствору ионов металла (различные концентрации в соответствии с конкретным протоколом). Промежутки между проводящими доменами заполняются в результате электрохимического осаждения металла.
(c) Фотохимическое осаждение для улучшенного процесса
Для улучшения коэффициента формы металлического проводника фотохимический процесс осуществляют способом, сходным с описанным выше электрохимическим процессом, но используя для управления процессом фотохимические реакции. Например, металлизацию ДНК сети можно осуществить, используя донор электронов (триэтаноламин, щавелевую кислоту, DTT и т.д.), фотосенсибилизатор (комплексы Ru-полипиридин, частицы полупроводниковые ксантеновые красители, частицы, такие как TiO2, CdS и т.д.), электронные реле, такие как различные соли бипиридиния и ионы соответствующих металлов или комплексы металлов. Фотосенсибилизатор преобразует поглощенную световую энергию в термодинамический потенциал за счет процесса передачи электронов, включающего доноры электронов и акцепторы электронов в любой возможной последовательности. Восстановленный акцептор электронов действует как электронное реле и заряжает металлические кластеры/коллоиды электронами. Заряженные кластеры/коллоиды действуют в качестве катализаторов для восстановления ионов металлов, тем самым вызывая рост металлического проводника.
(d) Кластеры золота, содержащие золото молекулы и/или коллоиды, используемые в качестве центров зародышеобразования
(vi) Вместо осуществления первых (i)+(ii) циклов соответствующую часть ДНК сети экспонируют раствору золотых кластеров, молекул или частиц, предварительно покрытых (частично) катионными тиолами (такими как пиридиниевый щелочной тиол). Золотые частицы адсорбируются на ДНК скелете за счет образования ионных пар и наращивания провода достигают, используя одну или более из вышеуказанных методик.
(е) Процессы отверждения
(vii) Дефекты гранулярного провода, полученного одним из или комбинацией вышеуказанных методик, отжигают, используя различные процессы, такие как процессы термического отжига (в атмосфере водорода (10% H2 в N2), 300oC в течение нескольких часов).
Пример 9. Соединение двух электродов проводящим проводом, сформированным на ДНК матрице, и свойства такого провода.
(а) Создание провода
На фиг.3А представлена ДНК матричная сборка металлического провода. Покровное стекло вначале пассивируют против случайного ДНК связывания. Затем два параллельных золотых электрода наносят на покровное стекло, используя стандартные микроэлектронные методики. Затем один золотой электрод смачивают микронного размера капелькой водного раствора, содержащего специфическую последовательность олигонуклеотида из 12 оснований, содержащую дисульфидную группу, присоединенную с 3' конца. Аналогично второй электрод помечают другой олигонуклеотидной последовательностью. После промывки образец покрывают раствором λ-ДНК примерно 16 мкм длиной с двумя липкими концами по 12 оснований, которые комплементарны олигонуклеотидам, присоединенным к золотым электродам. Поток, перпендикулярный к электродам, вызывает вытяжение ДНК, обеспечивая ее гибридизацию с двумя олигонуклеотидами, связанными с удаленной поверхностью. Растяжение ДНК между двумя электродами можно также осуществить в обратном порядке, когда гибридизацию и лигирование производных олигонуклеотидов, содержащих дисульфид с длинной молекулой ДНК, осуществляют до ее нанесения на образец. Оба способа работают одинаково хорошо. На фиг.14 представлено соединение двух золотых электродов мостиком флуоресцентно-меченой λ-ДНК. Наблюдение за изгибанием ДНК молекулы под действием перпендикулярного потока продемонстрировало, что она присоединена только к электродам. Подготовка образца завершается удалением растворов.
Измерения в двух направлениях, осуществленные на этих образцах, доказали, что растянутая ДНК молекула оказалась практически изолятором с сопротивлением выше 1013 Ом. Изолирующий характер ДНК находится в соответствии с проведенными ранее спектроскопическими измерениями скорости переноса электронов [18] . Для придания электрической функциональности металлическое серебро направленно наносят вдоль ДНК молекулы. Трехступенчатый процесс химического осаждения основан на селективной локализации ионов серебра вдоль ДНК за счет Ag+/Na+ ионообмена [19] и образования комплексов между серебром и ДНК основаниями [19, 22] . Ag+/Na+ ионообмен контролируют по затуханию флуоресцентного сигнала меченой ДНК. Процесс заканчивают, когда достигают полного затухания. После промывки закомплексованную с ионами серебра ДНК восстанавливают, используя основной гидрохиноновый раствор. Эта стадия приводит к образованию нанометрического размера агрегатов металлического серебра, связанных со скелетом ДНК. Эти агрегаты серебра служат локализованными в пространстве участками зародышеобразования для последующего наращивания провода. Процесс обмена ионами в высшей степени селективен и ограничен только матрицей ДНК. Агрегаты серебра, связанные с ДНК, затем "развивают" в значительной степени схоже со стандартной фотографической процедурой, используя кислотную смесь гидрохинона и ионов серебра в условиях низкой освещенности [24, 25, 42-37]. Кислотные растворы гидрохинона и ионов серебра метастабильны, но спонтанное отложение металла обычно происходит очень медленно. Присутствие металлических катализаторов (таких как серебряные участки зародышеобразования на ДНК) значительно ускоряет процесс. В таких условиях эксперимента осаждение металла поэтому происходит только вдоль ДНК скелета, оставляя пассивированное стекло практически чистым от серебра. Процесс заканчивают, когда следы металлического провода становятся четко наблюдаемыми в дифференциальном интерференционном контрастном (DIC) микроскопе. Металлический провод точно соответствует полученному ранее флуоресцентному изображению ДНК скелета. Строение, размеры и свойства проводимости металлического провода воспроизводимы и определяются условиями "развития".
Результаты
Изображения, полученные с помощью атомного микроскопа (AFM), отрезка 10 нм шириной и 12 мкм длиной представлены на фиг.15А и фиг.15В. Как хорошо видно, провод включает зерна диаметром 30-50 нм, расположенные вдоль скелета.
Для изучения характеристик переноса электронов этих проводов были измерены две кривые I-V в двух направлениях при комнатной температуре с использованием HP анализатора параметров с внутренним сопротивлением 1013 Ом и разрешением
по току 10 фА. На фиг.16А представлены кривые I-V для серебряного провода, изображенного на фиг.15А и 15В. Кривые существенно нелинейны и асимметричны по отношению к нулевой линии. Формы кривых зависят от направления сканирования напряжения, указанного стрелками на фиг.16А. При приближении к нулевым значениям напряжения с больших положительных или отрицательных смещений ток исчезает почти линейно с напряжением. Тогда образуется нулевое по току плато с дифференциальным сопротивлением больше, чем 1013 Ом. При больших смещениях провод снова становится проводящим с дифференциальным сопротивлением несколько ниже, чем при исходной полярности смещения. Повторные измерения в том же направлении сканирования (сплошные кривые на фиг.16А) приводят к получению воспроизводимых I-V кривых. Длина нулевого плато для различных проводов может меняться от долей вольта до примерно 10 вольт.
Сплошной линией на фиг.12В представлена, например, I-V кривая для другого провода, в котором серебро нарастало на ДНК более интенсивно. В результате плато уменьшилось до величины 0,5 вольт. Пропуская через провод более сильные токи, плато обычно можно исключить, достигая омических характеристик (пунктирная линия на фиг.16B) с сопротивлением, меняющимся от 1 до 30 МОм, в зависимости от процесса нанесения серебра.
Пример 10. Нанесение золота на олигонулеотидное волокно.
Для усиления центров зародышеобразования практически любого металла можно использовать золотой усиливающий агент.
Раствор золотого усиливающего агента можно приготовить следующим образом.
30 мкл раствора KSCN (из исходного раствора, приготовленного из 60 мг KSCN, растворенного в 1 мл Н2О) добавляют к 240 мкл Н2О и тщательно перемешивают. 30 мкл раствора KAuCl4 (из исходного раствора, приготовленного при растворении 23 мг KAuCl2 в 1 мл Н2О) добавляют к раствору KSCN и перемешивают. В течение нескольких секунд цвет меняется от темно-оранжевого до очень светло-оранжевого, а затем добавляют 60 мкл раствора гидрохинона (из исходного раствора, полученного при растворении 55 мг гидрохинона в 10 мл H2O) и все тщательно перемешивают.
Золотой усиливающий агент можно с успехом использовать для наращивания золота на практически любом металле. Скорость роста можно варьировать от 100 нм за несколько часов до 100 нм в минуту, заменяя некоторое количество воды фосфатным буфером, рН 8.
Пример 11. Проводящие провода на основе органических сопряженных полимеров
(i) соответствующую часть сети экспонируют раствору, содержащему катионный сегмент, способный образовывать сопряженный полимер за счет химического превращения или катионный несопряженный полимер, способный превращаться в сопряженный в результате химического превращения, или катионный сопряженный полимер. Процесс обмена ионами происходит по фосфатным группам ДНК скелета, экспонированным раствору.
(ii) Комплекс ДНК после обмена ионами обрабатывают в соответствии с природой органических веществ, которые связаны с полианионным скелетом. Электрическая функциональзация достигается либо за счет предыдущего процесса, либо в результате последующего процесса легирования. Легирование можно осуществить за счет обычных восстановительных процессов, в процессах протонирования-депротонирования, электрохимическими способами или фотохимическими способами. Кроме того, можно использовать последовательность-селективный процесс между ДНК скелетом и блоками вышеуказанных проводящих проводов на основе органического сопряженного полимера для создания проводов с хорошо определенной структурой, электрическими градиентами сродства и р/n переходами.
I. PPV (полифенилен виниленовый) проводящий провод изготавливают следующим образом.
(i) ДНК сеть, фиксированную на субстрате, экспонируют раствору пре-PPV водорастворимого полимера. После замены ДНК полиэлектролита пре-PPV полимером субстрат тщательно промывают и сушат.
(ii) Пре-PPV полимер, нанесенный на ДНК сеть, фиксированную на субстрате, обрабатывают в вакуумной печи (например, 1-6 бар, 300oС, 6 ч).
(iii) Полученный люминесцентный PPV полимер легируют, используя обычные методики до тех пор, пока не проявляется проводимость.
II. Альтернативный способ изготовления PPV проводящего провода следующий.
(i) ДНК сеть, фиксированную на субстрате, экспонируют раствору дихлорида бис-(тетрагидротиофений)-р-ксилилена. После того как происходит замена ДНК полиэлектролита на дихлорид бис-(тетрагидротиофений)-р-ксилилена, субстрат тщательно промывают и сушат.
(ii) Дихлорид бис-(тетрагидротиофений)-р-ксилилена, нанесенный на ДНК сеть, фиксированную на субстрате, полимеризуют в основном растворе с образованием пре-PPV полимера, прикрепленного к ДНК скелету.
(iii) Пре-PPV полимер, нанесенный на ДНК сеть, фиксированную на субстрате, обрабатывают в вакуумной печи (1-6 бар, 300oС, 6 ч).
(iv) Полученный люминесцентный PPV полимер легируют обычными способами до тех пор, пока не проявляется проводимость.
III. Изготовление PANI (полиамин) проводящего провода осуществляют следующим образом.
(i) ДНК сеть, фиксированную на субстрате, экспонируют раствору растворимого в кислоте PANI полимера. После замены ДНК полиэлектролита PANI полимером, субстрат тщательно промывают и сушат.
(ii) Полученный PANI полимер легируют, используя обычные методики до тех пор, пока не проявляется проводимость.
IV. Альтернативный способ изготовления PANI проводящего провода следующий.
(i) ДНК сеть, фиксированную на субстрате, экспонируют раствору ионов алюминия. После замены ДНК полиэлектролита ионами алюминия субстрат осторожно промывают и сушат.
(ii) ДНК скелет с нанесенными ионами алюминия окисляют, используя раствор окисляющего агента, такого как ионы пероксидисульфата, получая полианилиновый полимер. Полученный PANI полимер легируют, используя обычные методики до тех пор, пока не проявляется проводимость.
V. Альтернативный способ изготовления PANI проводящего провода следующий.
(i) ДНК сеть, фиксированную на субстрате, экспонируют раствору коротких олигомеров PANI (> 1 повторяющегося звена). После замены ДНК полиэлектролита PANI олигомером субстрат тщательно промывают и сушат.
ii) Ионы PANT олигомера, нанесенные на ДНК скелет, окисляют, используя раствор окисляющего агента, такого как ионы пероксидисульфата, получая полианилиновый полимер. Полученный PANT полимер легируют, используя обычные методики, до тех пор, пока не проявляется проводимость.
Пример 12. Изготовление изоляторов
Изоляторы можно сконструировать на электрически функционализированных частях сети, таких как провода и соединения между проводами и компонентами.
А. Изоляция металлических компонентов (включая металлические провода)/
(1) Металлические компоненты можно электрически изолировать от их окружения, используя поверхностно-активные агенты, состоящие из изолирующей основы, такие как алкильные группы, присоединенные к таким связывающим с поверхностью группам, как тиольная или дисульфидная группа. Связывающая с поверхностью группа связывается с поверхностью металла, тем самым образуя плотный "двумерный" слой электрически не проводящих молекул на поверхности металла. Этот слой представляет собой электрический барьер, а именно изолятор.
(2) Селективное окисление и другие способы получения производных, которые позволяют образовать непроводящие слои и контакты из электрически изолирующих барьеров также.
В. Изоляция неметаллических компонентов (включая провода на основе сопряженных полимеров
Создают изолирующие слои, которые могут осуществлять самосборку на поверхности неметаллических компонентов, используя процессы молекулярного распознавания, основанные на комплементарных взаимодействиях. Например на положительно заряженные полимеры, такие как PANI, можно нанести покрытие и изолировать их от их окружения, используя полианионный полимер боковыми группами с длинными алкильными цепочками.
Пример 13. Присоединение содержащих золото молекул или частиц к специфическим нуклеотидам
ДНК основания модифицируют, присоединяя спейсерное плечо, соединенное с химически активной группой, к специфическим сайтам в основаниях. Для акцепторных сайтов и достаточно длинных спейсерных плеч такие модификации не затрагивают ферментативного механизма, оставляя ДНК молекулы совместимыми с рекомбинантными ДНК методиками. Одной из таких модификаций является присоединение меченного биотином основания. На фиг.17 представлено AFM изображение результата такой манипуляции. В этом случае последний нуклеотид в длинной ДНК молекуле заменен меченным биотином нуклеотидом. Затем матрицу погружают в раствор, содержащий стрептавидином покрытые 5 нм частицы коллоидного золота, в результате чего происходит специфическое присоединение этих коллоидных частиц к модифицированным основаниям. Так как у стрептавидина имеются четыре связывающих сайта для биотина, покрытие коллоидом может также служить как соединение между мечеными ДНК молекулами. Соединение между двумя ДНК молекулами представлено также на фиг.17. Для введения метки можно также использовать группы, отличные от биотина. Некоторые примеры включают тиол, dig и амин.
Пример 14. Создание одноэлектронного транзистора (SET)
Далее изложены основные стадии создания (SET).
1. Пассивацию субстрата осуществляют в соответствии с примером 6.
2. Создают золотой электрод в соответствии с определением с помощью стандартных методик, например, как раскрыто в примере 7. Для простого случая одного SET нужны всего лишь три электрода.
3. Синтез линкеров, например, осуществляют в соответствии с примером 1(а). Линкеры обычно создают из коротких (например, содержащих 12 оснований) производных олигонуклеотидов с дисульфидными группами по их 3' концу. Для случая одного SET предпочтительны линкеры с тремя различными последовательностями.
4. Линкеры создают таким образом, чтобы они взаимодействовали с электродами за счет своих дисульфидных групп. Каждый электрод соединен с отличающимся линкером в соответствии с примером 2.
5. Три различных линкера с дисульфидными группами присоединяют к одной и той же золотой частице нанометрического размера по их дисульфидным группам, а один из линкеров присоединяют с помощью крупного образующего мостик агента, что создает значительный барьер между коллоидом и этим линкером.
6. Три двухцепочечные ДНК молекулы длиной в несколько микрон, содержащие липкие концы, комплементарные концам линкеров на частице золота, гибридизуют и лигируют с линкерами, присоединенными к коллоиду, с образованием соединения, состоящего из трех ветвей с коллоидом в точке разветвления. Эти три ДНК молекулы содержат также липкие концы, комплементарные трем линкерам, присоединенным к электродам со сторон, противоположных частице золота.
7. Создание сети завершают, позволяя молекулам двухцепочечной ДНК присоединиться к частице золота для гибридизации с тремя линкерами на электродах, с последующим лигированием ников.
8. Электрическую функционализацию осуществляют на следующих стадиях.
a) Частицу золота покрывают слоем щелочного тиола, чтобы использовать как изолирующий барьер и пассивационный слой против осаждения металла.
b) Цепи ДНК покрывают металлом для создания проводящих проводов, например, по способу примера 8. Эти провода электрически слабо соединены с частицей золота через изолирующий барьер слоя щелочного тиола, причем один провод, соединен через крупный мостиковый агент, который еще слабее соединен с частицей.
с) На фиг.6 представлено конечное устройство, состоящее из частицы золота, соединенной проводами с тремя электродами через изолирующие барьеры.
Теперь ток между двумя электродами можно модулировать за счет небольшого напряжения, прилагаемого к третьему электроду (тому, который очень слабо соединен с частицей). Таким образом, цепь действует как SET. SET можно изготовить как часть более сложной схемы, в которой электроды заменены функционализированными компонентами сети.
Следует учитывать, что последовательность стадий для получения SET можно изменить, например стадия 6 может предшествовать стадии 4, и т.д.
Пример 15. PPV функционализированное волокно как источник света
Способ, раскрытый в примере 11, можно использовать до стадии I (ii) и включая ее. Полученный PPV компонент отличается сильной люминесценцией, а его ширина значительно меньше 100 нм. Создание PPV компонента между электродами с соответствующими рабочими функциями приводит к созданию электролюминесцентного устройства.



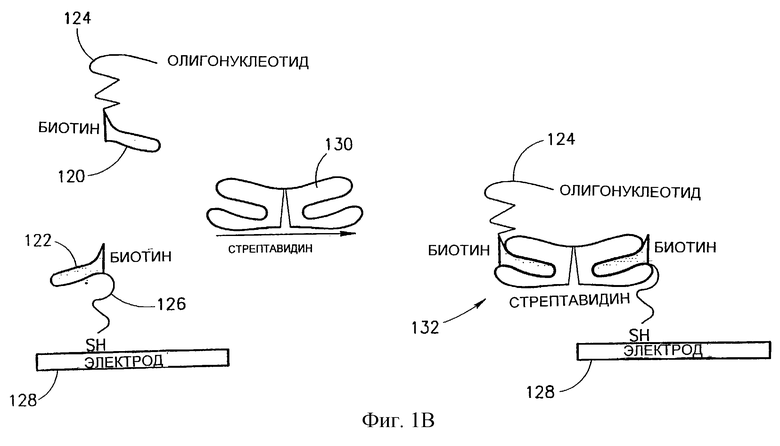
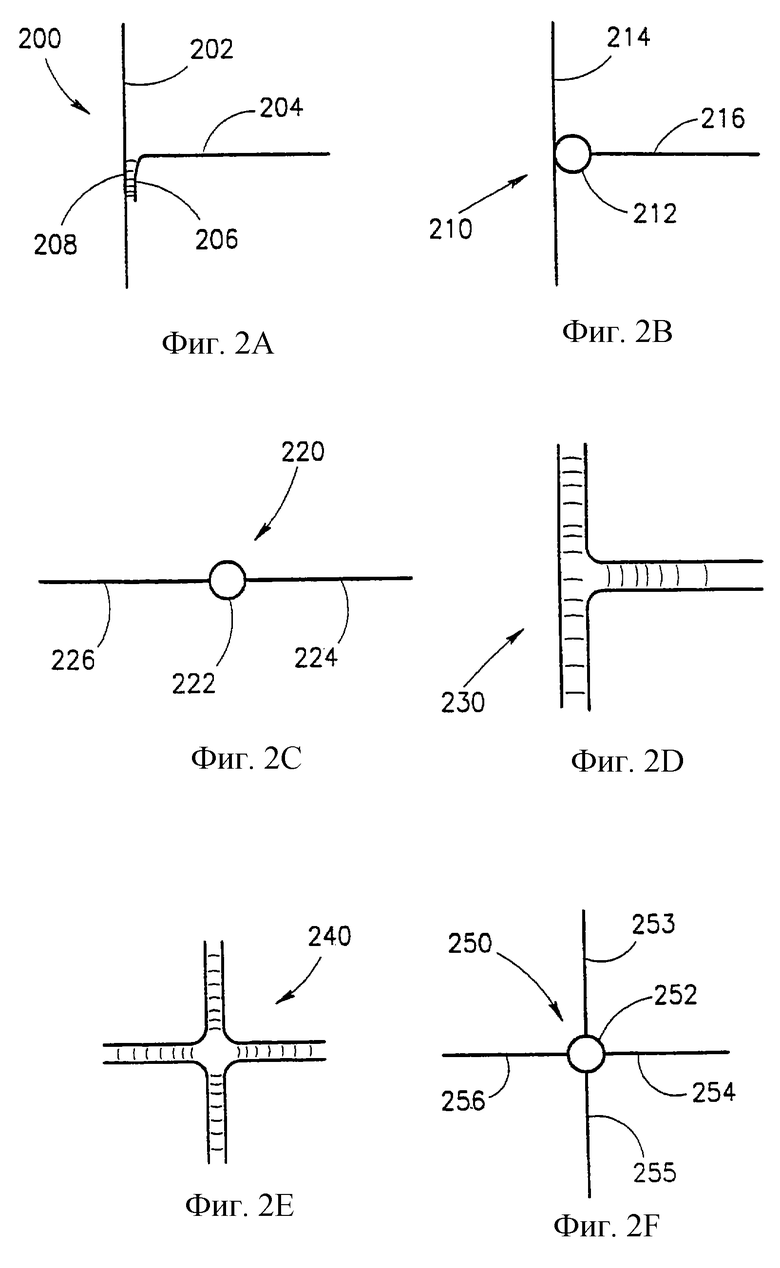
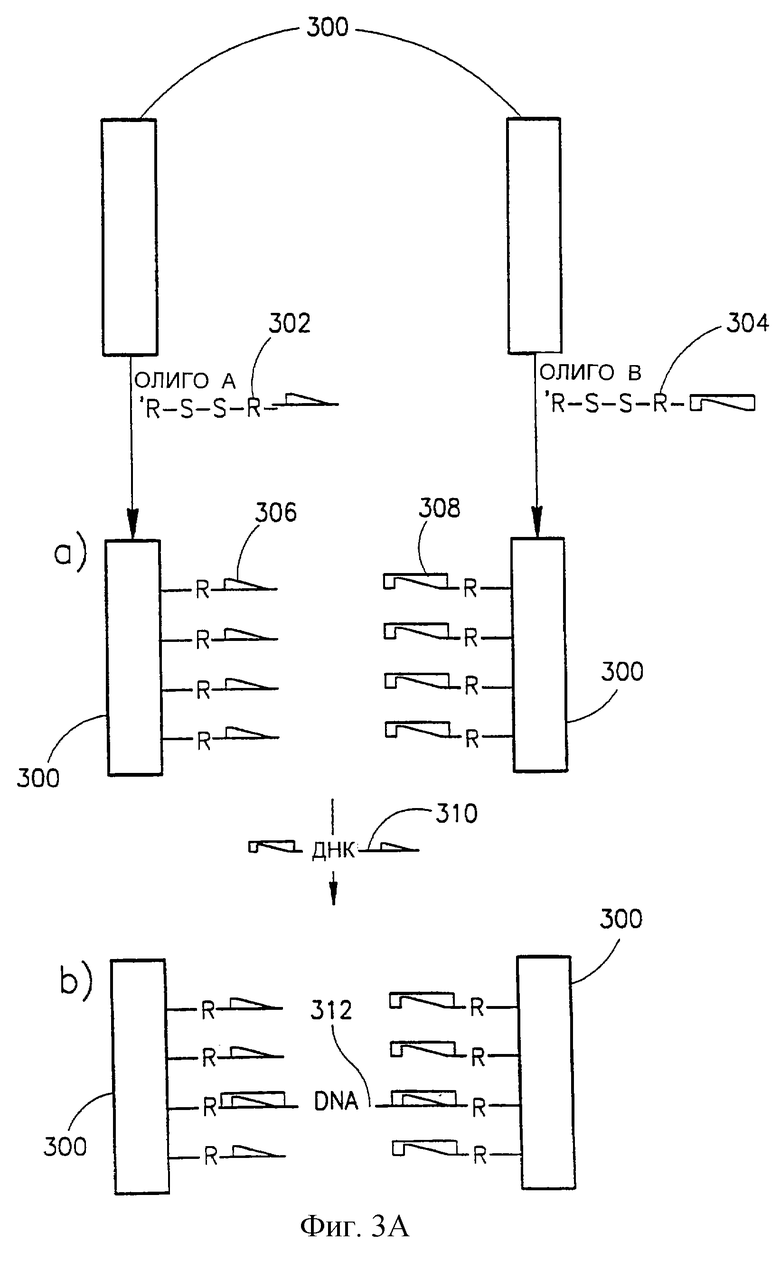
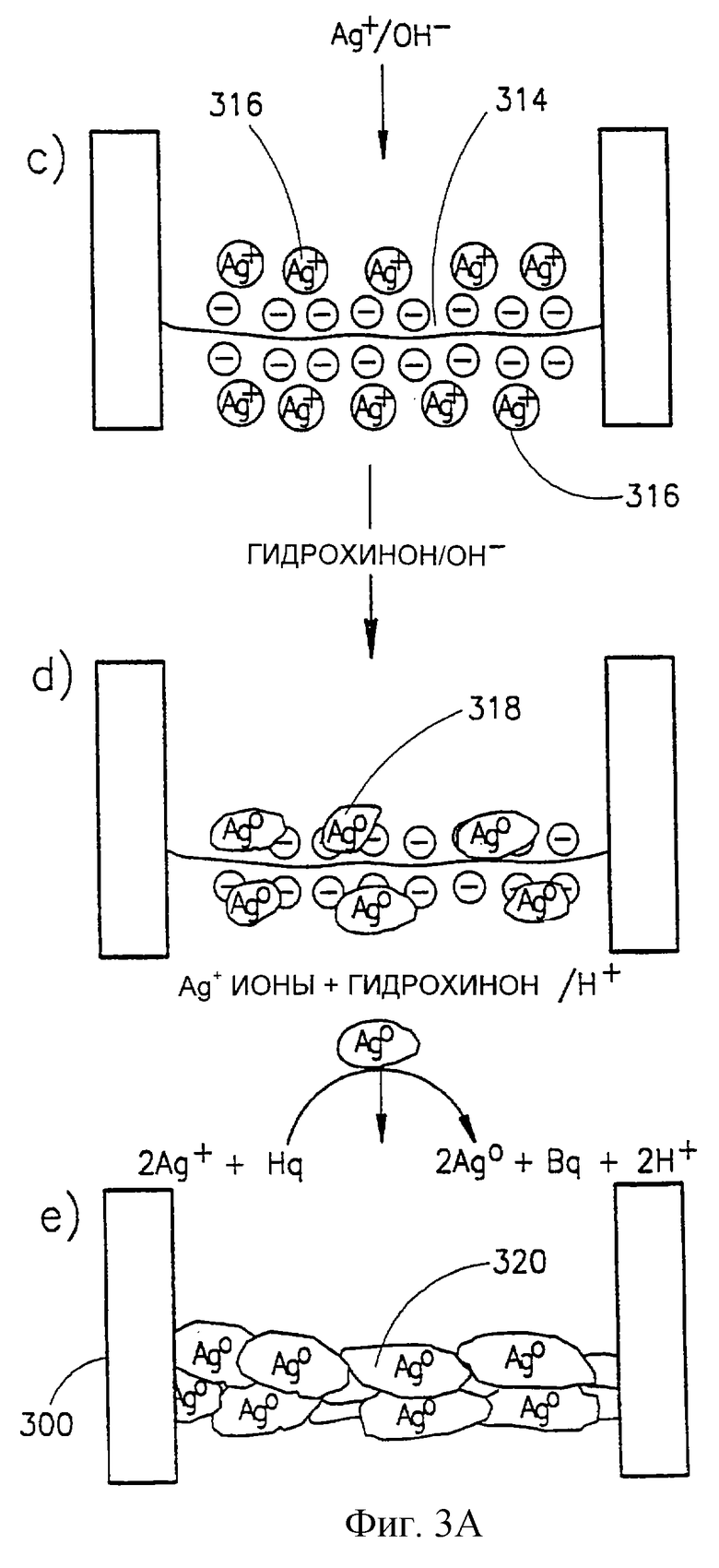

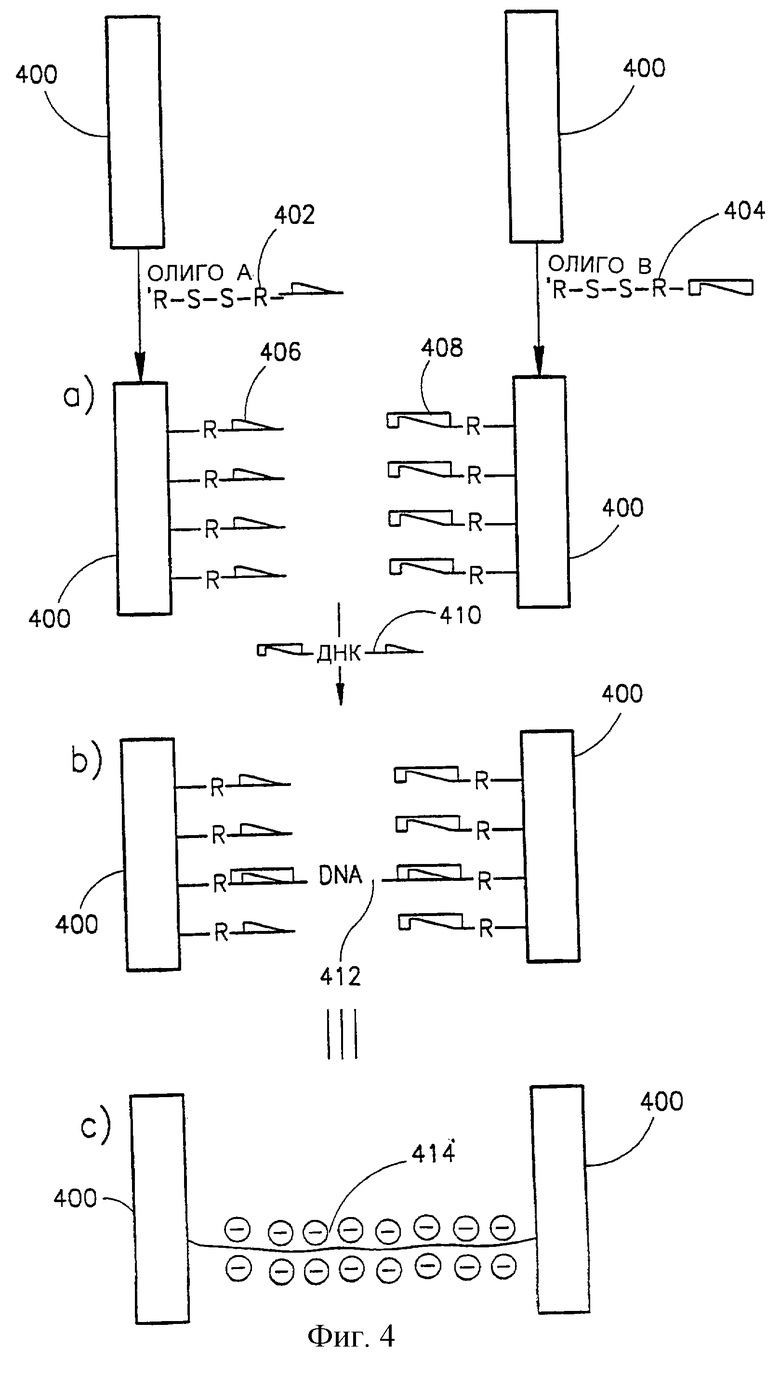
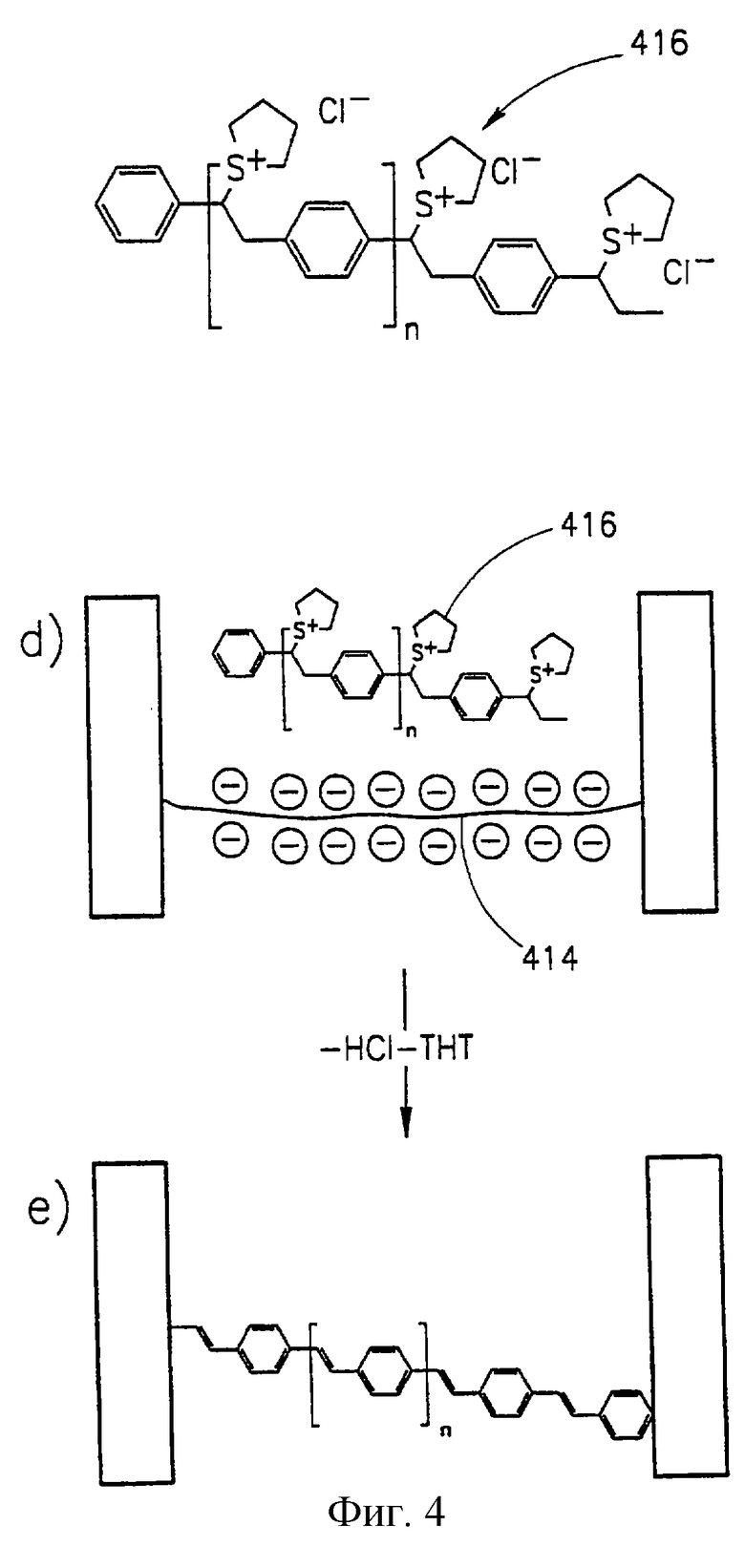
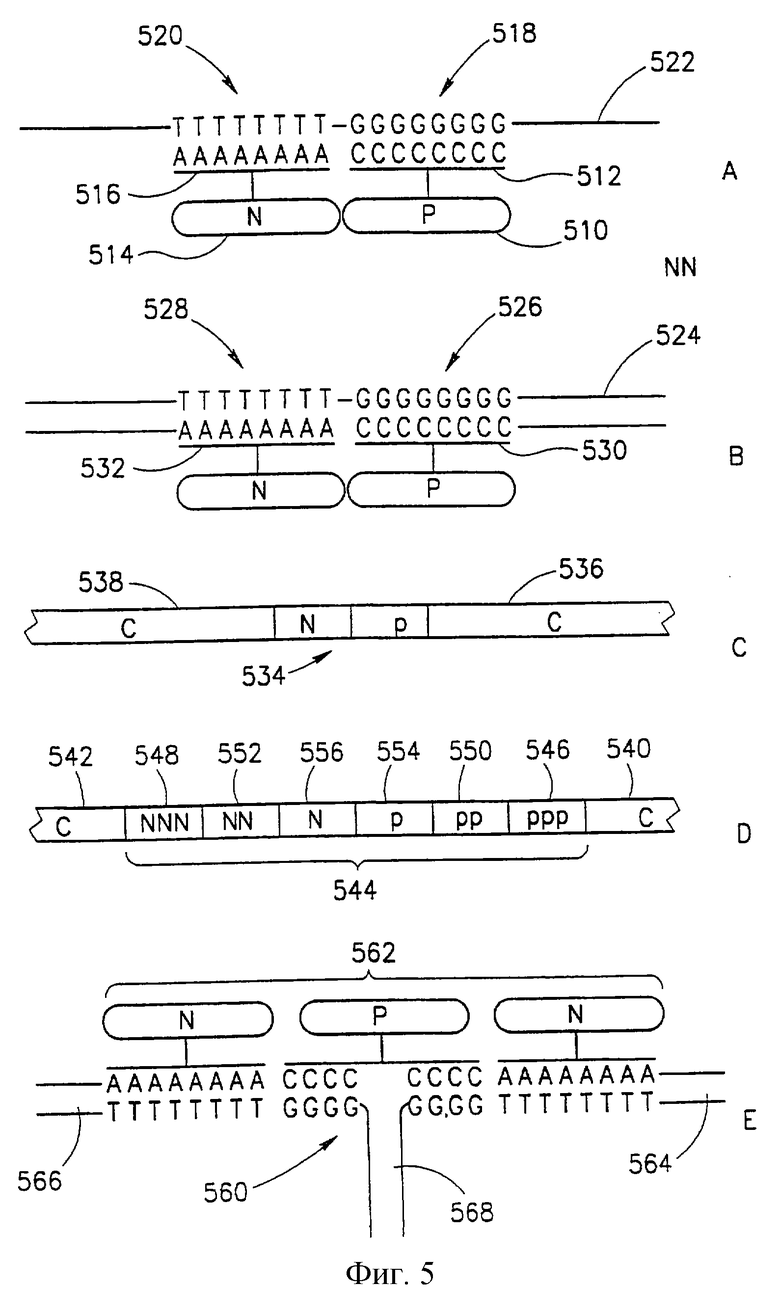



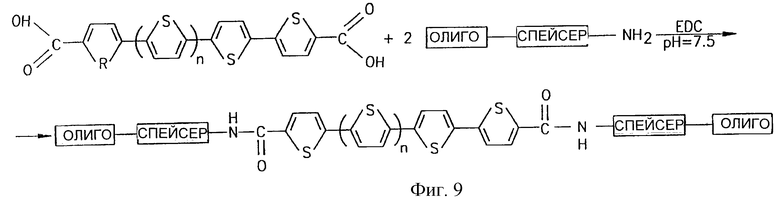





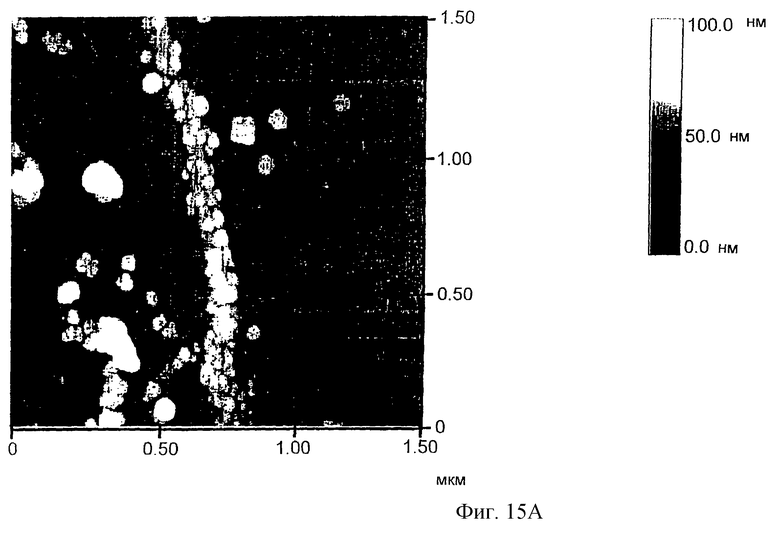
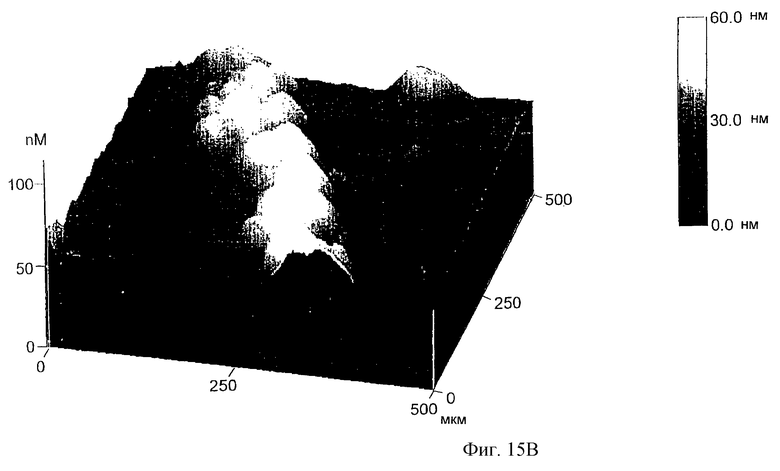

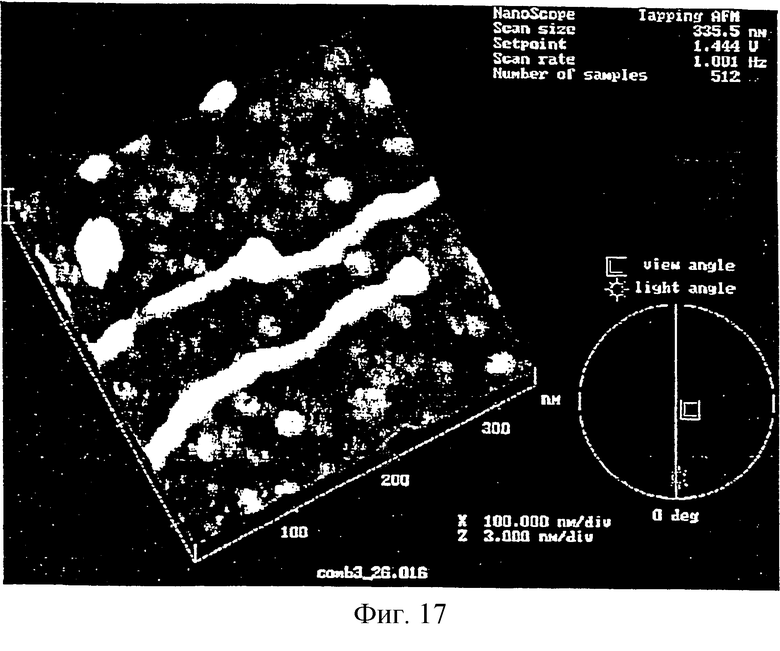
Использование: электроника. Сущность изобретения: электронная сеть создана на волоконном скелете путем связывания или комплексообразования электронно-функциональных веществ со скелетом нуклеиновых кислот. Скелет включает волокна с нуклеотидными цепями. Сборка волокон в сеть основана на взаимодействиях участков нуклеотидных цепей различных волокон. Техническим результатом изобретения является миниатюризация микроэлектронных и логических схем. 3 с. и 29 з.п. ф-лы, 17 ил.
| US 5561071 A, 01.10.1996 | |||
| Alivisatos A.P | |||
| et al | |||
| Organization of nanocrystal molecules using DNA | |||
| NATURE, V 382, 1996, p.p.609-611 | |||
| US 5089545 A, 18.02.1992 | |||
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
Авторы
Даты
2003-09-27—Публикация
1998-07-14—Подача