Настоящее изобретение относится к рецепторам, принадлежащим к суперсемейству рецепторов TNF/NGF, и к регулированию их биологических функций. К суперсемейству рецепторов TNF/NGF принадлежат рецепторы факторов роста некроза опухолей р55 - и р75 (TNF-R), рецептор лиганда FAS (называемый также FAS/AP01 или FAS-R, и обозначаемый далее FAS-R) и другие рецепторы. Более конкретно, настоящее изобретение относится к новым белкам, которые связываются с внутриклеточными доменами (1C) р55- и p75-TNF-R и FAS-R (обозначаемыми далее р551С, р751С и FAS-1C, соответственно), и которые обладают способностью модулировать функции р55- и р75-TNF-рецепторов, а также FAS -рецептора. Одним из таких белков, способных связываться с р551С интактного p55-TNF-R, является сам р551С в виде молекулы р551С или ее части, например, так называемого "домена смерти" р551С. Таким образом, настоящее изобретение также относится к новым TMF-ассоциированным эффектам, которые могут быть индуцированы в клетках внутриклеточным доменом p55-TNF (р551С) или его частью лиганд (TNF)-независимым образом. Кроме того, настоящее изобретение относится к получению и использованию указанных новых белков, связывающихся с р55- и p75-TNF-R, и белков, связывающихся с FAS-R, которые в настоящем описании именуются р551С-, р751С- и FAS -1C-связывающими белками.
В другом аспекте, настоящее изобретение также относится к новым растворимым олигомерным TNF-R, олигомерным FAS-R и олигомерным рецепторам, представляющим собой смесь TNF-R и FAS-R; к использованию этих рецепторов, и к способам их получения.
Предпосылки создания изобретения
Фактор некроза опухолей (THF-α) и лимфотоксин (TNF-β) (обозначаемые далее TNF-α и TNF-β, соответственно) представляют собой многофунциональные цитокины, образуемые, главным образом, мононуклеарными фагоцитами, и обладающие множественным действием на клетку (Wallach, D. (1986), в "Interferon 7 (Ion, Gresser, eo.), pp.83-122, Academic Press, London; и Beutler & Cerami (1987)). Действие обоих указанных цитокинов, TNF-α и TNF-β инициируется посредством их связывания со специфическими рецепторами клеточной поверхности. Очевидно, что некоторые действия этих цитокинов благоприятно влияют на организм, то есть, они могут, например, разрушать опухолевые или вирус-инфицированные клетки и усиливать антибактериальную активность гранулоцитов. В этом случае TNF обеспечивают защиту организма от опухолей и инфекционных агентов, а также способствует заживлению ран. Таким образом, TNF может быть использован в качестве противоопухолевого агента, который связывается со своими рецепторами на поверхности опухолевых клеток и тем самым инициирует события, приводящие к гибели этих опухолевых клеток. TNF может быть также использован в качестве противоинфекционного средства.
Однако оба эти фактора, т.е. TNF-α и TNF-β, обладают также неблагоприятным действием. Было показано, что сверхпродуцирование TNF-α может играть важную роль в патогенезе некоторых заболеваний. Так, например, в настоящее время уже известно, что действие TNF-α, главным образом на сосудистую сеть органа, вызывает симптомы септического шока (Tracey et al., 1986). При некоторых заболеваниях, TNF может также вызывать резкое снижение массы тела (кахексию) в результате подавления активности адипоцитов и провоцирования анорексии, а поэтому фактор некроза опухолей TNF-α имеет также название кахексин. Сообщалось также, что TNF опосредует разрушение тканей при ревматических заболеваниях (Beutler & Cerami, 1987) и является главным медиатором отторжения, наблюдаемого в реакциях "трансплантант против хозяина" (Piquet и др. 1987). Кроме того, известно, что TNF участвует в процессе воспаления и опосредует многие другие заболевания.
Два отличающихся друг от друга и независимо экспрессируемых рецептора р55- и p75-TNF-R, которые специфически связываются с TNF-α и TNF-β инициируют и/или опосредуют биологические функции вышеуказанных TNF. Эти два рецептора имеют структурно отличающиеся внутриклеточные домены, что позволяет предположить, что они передают разные сигналы (см., Hohnman и др., 1989; Engelmann и др., 1990; Brockhaus и др., 1990; Leotscher и др., 1990; Schall и др., 1990; Nophar и др., 1990; Smith и др., 1990; и Heller и др., 1990). Однако клеточные механизмы, например различные белки и возможно другие факторы, участвующие в передаче внутриклеточного сигнала р55- и р75-TNF-R, пока еще не выявлены (ниже впервые описываются новые белки, способные связываться с р751С и р551С). Но именно такая передача сигналов, которая происходит обычно после связывания лиганда (т.е. TNF-α или ТМР-β) с рецептором, ответственна за инициацию каскада реакций, которые, в конце концов, приводят к наблюдаемому клеточному ответу на TNF.
Что касается вышеупомянутого цитоцидного действия TNF, то в большинстве клеток, изученных до настоящего времени, это действие стимулируется, главным образом, рецептором p55-TNF. Антитела против внеклеточного домена (домен, связывающийся с лигандом) р55-TNF-R, могут сами по себе быть стимуляторами цитоцидного эффекта (см., ЕР 412486), который коррелирует с эффективностью перекрестного связывания рецептора с антителами, и который является, очевидно, первой стадией процесса передачи внутриклеточного сигнала. Кроме того, исследования, проведенные методом мутаций (Brackebuch и др., 1992, Tartaglia и др., 1993), показали, что биологическая функция p55-TNF-R зависит от целостности его внеклеточного домена, что дает основания предположить, что инициация трансдукции внутриклеточного сигнала, индуцирующая цитоцидное действие TNF, происходит в результате объединения двух или нескольких внутриклеточных доменов р55-TNF-R. Кроме того, TNF (α и β) пфигутствует в виде гомотридимера, и, как было предположено, индуцирует p55-TNF-R -опосредованную передачу внутриклеточных сигналов благодаря своей способности к связыванию и перекрестному сшиванию с рецепторными молекулами, т.е. к созданию агрегации с рецептором. Ниже, в настоящей заявке, будет описано, каким образом р551С и р55DD могут ассоциироваться друг с другом, и индуцировать лиганд-независимым способом, TNF-ассоциированные эффекты в клетках.
Другим членом суперсемейства TNF/NGF-рецепторов является рецептор FAS (FAS-R), который называют также FAS-антигеном, и который представляет собой белок клеточной поверхности, экспрессируемый в различных тканях, и обладающий гомогией с рядом рецепторов клеточной поверхности, включая TNF-R и NGF-R, FAS-R опосредует гибель клеток по типу апоптоза (Iton. и др., 1991), и служит, очевидно, в качестве негативного селектора аутореактивных Т-клеток, т.е. в процессе созревания Т-клеток, FAS-R опосредует апоптоз Т-клеток, распознающих аутоантигены. Было также обнаружено, что мутации в гене FAS-R (1 pr) вызывают нарушение лимфопролиферации у мышей, которые имеют сходную с человеческой картину такого аутоиммунного заболевания, как системная красная волчанка (SLE) (Watanabe-Fukunaga и др., 1992). Лигандом для FAS-R является, очевидно, молекула, ассоциируемая с клеточной поверхностью, и несомая, среди прочих, Т-клетками-киллерами (или цитотоксическими Т-лимфоцитами - CTL), а поэтому, когда такие CTL контактируют с клетками, несущими FAS-R, они способны индуцировать апоптоз FAS-R-несущих клеток. Кроме того, было получено моноклональное антитело со специфичностью к FAS-R, которое обладало способностью индуцировать апоптоз клеток, несущих FAS-R, включая мышиные клетки, трансформированные кДНК, кодирующей FAS-R человека (Iton и др., 1991).
Было также обнаружено, что помимо Т-лимфоцитов, имеются и другие нормальные клетки, которые экспрессируют FAS-R на своей поверхности, и которые могут быть уничтожены путем стимуляции этого рецептора. Было высказано предположение, что нерегулируемая индукция такого процесса цитолиза приводит, при некоторых заболеваниях, к разрушению тканей организма, например, к деструкции клеток печени при остром гепатите. Поэтому разработка способов ограничения цитотоксической активности FAS-R может привести к получению методов терапии, имеющих важное значение.
И наоборот, поскольку было также обнаружено, что некоторые злокачественные клетки и ВИЧ-инфицированные клетки несут FAS-R на своей поверхности, то антитела против FAS-R, или FAS-R-лиганда могут быть использованы для стимуляции FAS-R-опосредованных цитотоксических эффектов, что позволит получить средство уничтожения указанных злокачественных или ВИЧ-инфицированных клеток (см., Iton. и др., 1991). Кроме того, получение других способов усиления цитотоксической активности FAS-R может также иметь важное терапевтическое значение.
Уже давно назрела необходимость в получении способа модуляции клеточного ответа к TNF (α или β) FAS-R-лиганду. Так, например, в патологических процессах, упомянутых выше, где происходит сверхсинтез TNF или FAS-R-лиганда, желательно ингибировать TNF- или PAS-R-лиганд-индуцированные цитоцидные эффекты; а в других ситуациях, например при заживлении ран, желательно стимулировать действие TNF, либо, в случае опухолевых или ВИЧ-инфицированных клеток, желательно стимулировать FAS-R-опосредованный ответ.
Авторами настоящего изобретения было разработано несколько способов (см., например, заявку на Европейский патент ЕР 186833, ЕР 308078, ЕР 398327 и ЕР 412486) регулирования нежелательных эффектов TNF путем ингибирования связывания TNF с его рецепторами с помощью антител против TNF или путем использования растворимых TNF-рецепторов (являющихся, в основном, растворимыми внеклеточными доменами рецепторов) для конкурирования на связывание TNF со TNF-рецепторами, ассоциированными с клеточной поверхностью. Кроме того, исходя из того, что для получения TNF-индуцированного клеточного ответа необходимо связывание TNF со своими рецепторами, авторами настоящего изобретения были разработаны способы (см., например ЕРО 568925) регулирования действия TNF путем модулирования активности TNF-рецепторов. В частности, в ЕРО № 568925 описан способ модуляции трансдукции сигнала и/или гидролиза в TNF-R, в результате чего пептиды или другие молекулы могут взаимодействовать либо с самим рецептором, либо с эффекторными белками, взаимодействующими с рецептором, осуществляя тем самым модуляцию нормального функционирования TNF-R. В ЕРО 568925 также описываются конструирование и характеризация различных мутантных р55-TNF-рецепторов, имеющих мутации во внеклеточном, трансмембранном и внутриклеточном доменах p55-TNF-R. Таким образом, области, находящиеся в вышеуказанных доменах р55-TNF-R, были идентифицированы как главные области функционирования рецептора (т.е. связывания с лигандом TNF) с последующей трансдукцией сигнала и внутриклеточной передачей сигнала, приводящих, в конечном счете, к TNF-эффекту, наблюдаемому на клетках. Кроме того, в этом патенте описан ряд методов выделения и идентификации белков, пептидов и других факторов, которые способны связываться с различными областями в вышеуказанных доменах TNF-R, причем указанные белки, пептиды и другие факторы могут участвовать в регуляции или модуляции активности TNF-R. В ЕРО 568925 также раскрываются способы выделения и клонирования ДНК-последовательностей, кодирующих указанные белки и пептиды; способы конструирования экспрессирующих векторов для продуцирования этих белков и пептидов; и способы получения антител или их фрагментов, которые взаимодействуют с TNF-рецепторами или с вышеуказанными белками и пептидами, связывающимися с различными областями TNF-R. Однако в ЕРО 568925 отсутствуют какие-либо описания белков и пептидов настоящего изобретения, которые связываются с внутриклеточными доменами TNF-R (например, p55-TNF-R), a также отсутствуют какие-либо описания способа выделения и идентификации таких белков или пептидов с использованием дрожжевой двухгибридной системы. Кроме того, до сих пор также не были описаны белки или пептиды, способные связываться с внутриклеточным доменом FAS-R.
Таким образом, для ингибирования действия TNF или FAS-R-лиганда необходимо уменьшить количество или активность TNF-R, или FAS-R на поверхности клетки, тогда как для стимуляции действия TNF или FAS -R-лиганда необходимо увеличить количество или активность TNF-R или FAS-R. Для этой цели недавно авторами настоящего изобретения были секвенированы и проанализированы промоторы р55-TNF-R и p75-TNF-R, в результате чего было установлено, что ряд их ключевых "мотивов" имеют последовательности, характерные для различных факторов регуляции транскрипции; а поэтому, в сущности, экспрессия TNF-R может регулироваться на уровне их промотора, т.е. может быть достигнуто ингибирование транскрипции, инициируемой промотором, в целях снижения числа рецепторов, либо усиление транскрипции, инициируемой промотором, в целях увеличения числа рецепторов (см., 1L 104355 и 1L 109633, и их соответствующие, еще не опубликованные Европейский патент и РСТ-патент). О соответствующих исследованиях, относящихся к регулированию FAS -R на уровне промотора FAS-R-гена, пока еще не сообщалось.
Кроме того, следует также отметить, что хотя, как известно, рецепторы фактора некроза опухолей (TNF) и их структурно родственный рецептор FAS-R (стимулятор в клетках), после стимуляции лейкоцит-продуцированными лигандами, проявляют деструктивную активность, что приводит к их собственному разрушению, тем не менее, механизмы такой стимуляции остаются все еще малопонятными. Мутационные исследования показали, что FAS-R и Р55-TNF-рецептор (р55-R), передающие сигналы цитотоксичности, имеют в своих внутриклеточных доменах особые области (Brackebush и др. 1992; Tartaglia и др., 1993; Iton и Nagata, 1993). Эти области ("домены смерти") имеют сходные последовательности. Такие "домены смерти" обоих FAS-R и р55-R имеют тенденцию к самоассоциации. Самоассоциация этих доменов, очевидно, стимулирует агрегацию этих рецепторов, которая является необходимой для инициации передачи сигнала (как показано ниже, а также как описано Song и др., 1994; Wallach и др.; 1994; Boldin и др., 1995), и при высоких уровнях экспрессии рецептора может приводить к стимуляции лиганд-независимой передачи сигнала (как показано ниже, и как описано Boldin и др., 1995).
Таким образом, до появления настоящего изобретения не было каких-либо сообщений о получении белков, которые могут регулировать действие лигандов, принадлежащих к суперсемейству TNF/NGF (например, действие TNF или FAS-R-лиганда на клетки), опосредуя передачу внутриклеточного сигнала, управляемую, по всей вероятности, внутриклеточными доменами (1C) рецепторов, принадлежащих к суперсемейству рецепторов TNF/NGF, (таких как TNF-рецепторы), а именно внутриклеточными доменами р55- и p75-TNF-R (p551C и р751С, соответственно), а также FAS-1C.
В соответствии с этим, одной из целей настоящего изобретения является получение белков, обладающих способностью связываться с внутриклеточными доменами TNF-R, и FAS-R, причем, эти белки, как предполагается в настоящее время, участвуют во внутриклеточной передаче сигнала, инициируемой посредством связывания TNF с его рецепторами, или связывания FAS-лиганда с его рецепторами.
Другой целью настоящего изобретения является получение антагонистов (например, антител) против указанных белков, связывающихся с внутриклеточным доменом (1C-связывающее антитело), которые, если это необходимо, могут быть использованы для ингибирования передачи сигнала, в том случае, если такие 1C-связывающие белки являются позитивными эффекторами сигнала (т.е. индуцируют передачу сигнала), либо они могут быть использованы для усиления передачи сигнала, в том случае, если такие 1C-связывающие белки являются негативными эффекторами сигнала (т.е., ингибируют передачу сигнала).
Еще одной целью настоящего изобретения является использование таких 1C-связывающих белков для выделения и характеризации других белков или факторов, которые могут, например, участвовать в последующих процессах передачи сигнала, и/или для выделения и идентификации других рецепторов, участвующих в предшествующем процессе передачи сигнала, с которыми связываются эти 1C-связывающие белки (например, другие TNF-R или родственные рецепторы), и следовательно, за функции которых эти белки также ответственны.
Кроме того, целью настоящего изобретения является использование вышеупомянутых 1C-связывающих белков в качестве антигенов для продуцирования поликлональных и/или моноклональных антител против этих белков. Полученные таким образом антитела могут быть, в свою очередь, использованы для очистки новых 1C-связывающихся белков из различных источников, таких, как клеточные экстракты или трансформированные клеточные линии.
Эти антитела могут быть также использованы в диагностических целях, например, для идентификации расстройств, связанных с нарушением клеточных функций, опосредуемых рецепторами, принадлежащими к суперсемейству рецепторов TNF/NCP.
Другой целью настоящего изобретения является получение фармацевтических композиций, содержащих вышеуказанные 1С-связывающие белки, и фармацевтических композиций, содержащих антагонисты 1C-связывающих белков, для лечения или профилактики TNF-индуцированных или FAS-лиганд-индуцированных состояний; причем указанные композиции могут быть использованы для усиления действия TNF или FAS-лиганда, либо для ингибирования действия TNF или FAS -лиганда в зависимости от природы вышеуказанного 1C-связывающего белка или его антагониста, содержащегося в данной композиции.
Кроме того, в соответствии с еще одной целью настоящего изобретения, в настоящем описании раскрываются другие способы элиминации или ингибирования эндогенно образуемого или экзогенно введенного TNF или FAS-R-лиганда посредством использования растворимых олигомерных TNF-рецепторов, олигомерных FAS-рецепторов, или олигомеров, представляющих собой смесь TNF-рецепторов и FAS-рецепторов. В этой связи следует отметить, что была предпринята одна попытка выделить и продуцировать с помощью техники рекомбинантных ДНК TNF-связывающий белок, названный ТВР-1, который, как было показано, обладал способностью ингибировать действие TNF. Антагонизм указанного белка был определен путем измерения снижения цитотоксической активности TNF, а также путем измерения уровня его ингибирования связывания TNF со своими рецепторами (ЕР 308378). Как было обнаружено, ТВР-1 обеспечивает защиту клеток от токсического действия TNF при концентрациях в несколько нанограммов на один миллилитр и противодействует связыванию TNF-α и TNF-β с клетками при одновременном введении этого белка с указанными цитокинами. Последующее исследование механизма, по которому действует ТВР-1, выявило, что ТВР-1 не взаимодействует с клеткой-мишенью, а скорее всего блокирует функцию TNF путем специфического связывания с TNF, конкурируя, тем самым, с его рецептором.
Позднее, с использованием другого метода очистки было обнаружено пфигутствие двух активных компонентов, одним из которых является ТВР-1, а другим является второй TNF-связывающий белок, названный нами ТВР-11 (впервые описан в ЕР 398327). Оба эти белка обеспечивали защиту клеток от цитоцидного in vitro - действия TNF, и оба белка связывались с TNF-β менее эффективно, чем TNF-α. Хотя в анализе, проведенным с помощью электрофореза в ПААГ с ДСН, было установлено, что белки ТВР-1 и ТВР-11 имеют очень близкие молекулярные массы, однако, их можно отличить друг от друга по отсутствию иммунологической перекрестной реактивности, по различию N-концевых аминокислотных последовательностей и по различию аминокислотного состава.
Однако вышеупомянутые TNF-связывающие белки являются мономерными и способны связываться лишь с одним мономером гомотримера TNF, натурального лиганда, в результате чего этот TNF все еще остается активным (т.е. неполностью нейтрализованным) благодаря тому, что у этого тримера имеется еще два активных мономера, не связанных TNF-связывающими белками. Кроме того, до сих пор не были описаны растворимые FAS-R (растворимые белки, связывающиеся с FAS-R-лигандом), способные связываться с лигандом для FAS-R, который, как известно, представляет собой гомотримерную молекулу, ассоциированную с клеточной поверхностью.
Так называемый "домен смерти (клеток)" рецептора р55-TNF (обозначенного р55-1С) был описан в работе Tartaglia и др. (1993), однако, в этой работе не показано (как это сделано в настоящей заявке), что р55-1С и его "домен смерти" являются самоассоциирующимися, и эта самоассоциация ответственна, главным образом, за передачу сигнала, приводящего к индуцированию цитотоксического воздействия на клетку. Кроме того, в этой публикации ничего не сообщается в возможности продуцирования растворимых олигомерных TNF-рецепторой или растворимых олигомерных FAS-рецепторов, а также умалчивается о других TNF-ассоциированных эффектах, индуцируемых р55-1С или его фрагментами, например, о таких эффектах как индуцирование экспрессии гена 1L-8, которые рассматриваются в настоящем изобретении. В другой работе, опубликованной после подачи настоящей заявки, раскрывается способность к агрегации (т.е. к самоассоциации) р55-1С, но также ничего не упоминается ни о получении растворимых олигормерных TNF-рецепторов и FAS-рецепторов, ни о других TNF-ассоциированных эффектах, индуцируемых лиганд-независимым способом р55-1С или его фрагментами, раскрываемыми в настоящей заявке.
Краткое описание изобретения
При работе над настоящим изобретением мы обнаружили новые белки, способные связываться с внутриклеточным доменом р55-TNF-рецептора (р551С-связывающие белки), р75-TNF-рецептора (р751С-связывающие белки), и FAS-рецептора (FAS-1C-связывающие белки). Эти р551С, р751С и FAS-1С-связывающие белки могут действовать как медиаторы или модуляторы эффекторного действия TNF или FAS-R-лиганда на клетки путем опосредования или модуляции внутриклеточной передачи сигнала, которая происходит после связывания TNF с р55- и/или р75-TNF-R или связывания FAS -R-лиганда на клеточной поверхности. Кроме того, было неожиданно обнаружено, что р551С и FAS-1C обладают способностью к самоассоциации, и что фрагменты р551С и FAS-1C одинаково способны связываться с р55-1С, особенно с так называемыми "доменами смерти (клеток)" (DD), находящимися во внутриклеточных доменах (1C) этих рецепторов, т.е. р55DD и FAS-DD. Таким образом, р55-1С и FAS-1C и их фрагменты также представляют собой белки, способные связываться с р551С и FAS-1C, а поэтому они могут быть модуляторами действия TNF или FAS-R-лиганда на клетки.
Кроме того, в соответствии с настоящим изобретением была более полно раскрыта природа связывания одного из новых белков (обозначенного в настоящем описании белком 55.11) с внутриклеточным доменом р55-TNF-рецептора (см. Пример 1).
Более того, в другом своем аспекте, настоящее изобретение основано на обнаружении того факта, что внутриклеточный домен рецептора p55-TNF (р55-1С); область, содержащаяся в нем (так называемый "домен смерти" р55-1С); а также внутриклеточный домен рецептора FAS/APO1 (FAS-1C); и область, содержащаяся в нем (так называемый "домен смерти" FAS-1C), обладают способностью к самоассоциации. В соответствии с этим, можно, с помощью стандартной техники рекомбинантных ДНК, сконструировать растворимый олигомерный TNF-рецептор, который является гибридным продуктом, содержащим, у одного своего конца, по крайней мере, два внеклеточных домена TNF-рецептора, и у другого своего конца, по крайней мере, два из вышеуказанных самоассоциирующихся внутриклеточных доменов или их фрагментов, где в результате такой самоассоциации образуется олигомер, имеющий, по крайней мере, два гибридных продукта, соединенных вместе. Таким образом, указанный растворимый олигомерный TNF-рецептор способен связываться с двумя мономерами натурального гомотримера TNF, и как таковой эффективно нейтрализует активность TNF. Нейтрализация активности TNF является желательной во всех вышеупомянутых условиях, где наблюдается продуцированное эндогенно или введенное экзогенно чрезмерное количество TNF, приводящее к нежелательным побочным эффектам. Кроме того, эффективное связывание TNF с растворимыми олигомерными рецепторами настоящего изобретения может также служить для связывания экзогенно добавленного TNF и его последующего желательного прологнированного высвобождения в условиях, при которых введение TNF оказывает благоприятное действие, например при опухолевой терапии. Аналогичным образом, с использованием стандартной техники рекомбинантных ДНК, может быть сконструирован олигомерный FAS-рецептор, являющийся гибридным продуктом, содержащим, по крайней мере, два внеклеточных домена FAS-рецептора на одном своем конце, и по крайней мере, два вышеуказанных самоассоциирующихся внутриклеточных домена или его фрагментов, где в результате такой самоассоциации образуется олигомер, имеющий, по крайней мере, два гибридных продукта, соединенных вместе. Таким образом, указанный олигомерный FAS -R способен связываться с двумя мономерами натурального гомотримера FAS-R-лиганда, и эффективно нейтрализовать активность FAS-R-лиганда. Нейтрализация активности FAS-R-лиганда является желательной во всех вышеупомянутых ситуациях, где избыточное количество этого лиганда ассоциируется с нежелательными побочными эффектами. Аналогичным образом, если принять во внимание недавние сообщения, указывающие на возможную связь между TNF и FAS-R-лиганд-индуцированными воздействиями на клетки, а следовательно, на возможную их географическую ассоциацию на клеточной поверхности, где они связываются со своими рецепторами, то становится очевидным, что с помощью стандартной техники рекомбинантных ДНК можно сконструировать смешанный олигомерный рецептор, обладающий специфичностью как к TNF, так и к FAS-R-лиганду. Такой смешанный олигомер должен представлять собой смесь вышеуказанных гибридных продуктов, содержащих, по крайней мере, один внеклеточный домен TNF-рецептора и, по крайней мере, один внеклеточный домен FAS-рецептора у своего одного конца, и, по крайней мере, два вышеупомянутых самоассоциирующихся внутриклеточных домена или их фрагментов у своего другого конца, где в результате такой самоассоциации образуется смешанный олигомер, имеющий, по крайней мере, два таких гибридных продукта, соединенные вместе. Таким образом, указанный смешанный олигомер способен связываться в одно и то же время, по крайней мере, с одним мономером TNF и с одним мономером FAS-R-лиганда, способствуя, тем самым, снижению или эффективной нейтрализации активности TNF и FAS-R-лиганда ни клеточной поверхности в условиях, при которых, как указано выше, избыточные количества этих двух цитокинов ассоциируются с нежелательными побочными клеточными эффектами. Как указывалось выше, FAS-R-лиганд, в основном, ассоциирован с клеточной поверхностью, а в недавних публикациях также описаны формы TNF, ассоциированные с клеточной поверхностью. Поэтому указанные смешанные олигомеры TNF/FAS-R являются особенно эффективными для нейтрализации активности TNF и FAS-R-лиганда на клеточной поверхности.
В соответствии с этим настоящее изобретение относится к ДНК-последовательности, кодирующей белок, способный связываться с одним или несколькими внутриклеточными доменами одного или нескольких рецепторов, принадлежащих к суперсемейству рецепторов фактора некроза опухолей/фактора роста нервной ткани (TNF/NGF).
В частности, настоящее изобретение относится к ДНК-последовательности, выбранной из группы, включающей в себя:
а) кДНК-последовательность, происходящую от области, кодирующей нативный белок, связывающийся с внутриклеточным доменом TNF-R;
b) ДНК-последовательности, способные к гибридизации с ДНК а) в условиях умеренной жесткости, и кодирующие биологически активный белок, который связывается с внутриклеточным доменом TNF-R;
с) ДНК-последовательности, которые являются вырожденными по отношению к ДНК-посдедовательностям, определенным в а) и b), в результате вырожденности генетического кода, и которые кодируют биологически активный белок, связывающийся с внутриклеточным доменом TNF-R.
Настоящее изобретение также относится к ДНК-последовательности, выбранной из группы, включающей в себя:
а) кДНК-последовательность, происходящую от области, кодирующей нативный белок, связывающийся с внутриклеточным доменом FAS-R;
b) ДНК-последовательности, которые способны к гибридизации с кДНК (а) в умеренно строгих условиях, и которые кодируют биологически активный белок, связывающийся с внутриклеточным доменом FAS-рецептора;
с) ДНК-последовательности, которые являются вырожденными по отношению к ДНК-последовательностям, определенным в а) и b), в результате вырожденности генетического кода, и которые кодируют биологически активный белок, связывающийся с внутриклеточным доменом FAS-R.
В конкретных вариантах своего осуществления, настоящее изобретение относится к ДНК-последовательностям, кодирующим белки, которые связываются с внутриклеточным доменом р55-TNF-рецептора, р75-TNF-рецептора и FAS-рецептора, например, к ДНК-последовательностям, кодирующим белки, обозначенные 55.1; 55.3; 55.11; 75.3; 75.16; F2; F9 и DD11.
Настоящее изобретение также относится к белкам, их аналогам или производным, кодированным любой из вышеуказанных последовательностей настоящего изобретения, и способным связываться с одним или несколькими внутриклеточными доменами одного или нескольких TNF-рецепторов или FAS-рецептора. Варианты этого аспекта настоящего изобретения включают в себя белки, обозначенные 55.1, 55.3, 55.11, 75.3, 75.16, F2, F9 и DD11, их аналоги и их производные.
Настоящее изобретение также относится к векторам, кодирующим вышеуказанные белки настоящего изобретения, и содержащим вышеуказанные ДНК-последовательности настоящего изобретения; причем указанные векторы способны экспрессироваться в соответствующих аукариотических или прокариотических клетках-хозяевах. Кроме того, настоящее изобретение относится к трансформированным эукариотическим или прокариотическим клеткам-хозяевам, содержащим указанные векторы; и к способу продуцирования белков, их аналогов или производных настоящего изобретения путем культивирования таких трансформированных клеток-хозяев в условиях, подходящих для экспрессии указанных белков, с последующей пост-трансляционной модификацией указанных белков, если это необходимо, и экстракцией экспрессированного белка, его аналога или производного из культуральной среды указанных трансформированных клеток или из клеточных экстрактов указанных трансформированных клеток.
В другом своем аспекте, настоящее изобретение относится к антителам или к их активным производным или фрагментам, специфичным к белкам, аналогам и производным белков настоящего изобретения.
В еще одном своем аспекте, настоящее изобретение относится к использованию ДНК-последовательностей настоящего изобретения или белков настоящего изобретения, кодируемых этими последовательностями; причем это использование предусматривает осуществление, в частности, следующих способов:
i) способа модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-рецептор или FAS-рецептор, заключающегося в обработке указанных клеток одним или несколькими белками, выбранными из группы, включающей в себя белки, аналоги и производные настоящего изобретения, и белки р551С, р55DD FAS-1C или FAS-DD, их аналоги или производные, где все указанные белки способны связываться с внутриклеточным доменом и модулировать активность TNF-R или FAS-R, а указанная обработка клеток предусматривает введение в эти клетки одного или нескольких белков, их аналогов или производных в форме, подходящей для внутриклеточного введения; либо указанная обработка предусматривает введение в эти клетки ДНК-последовательности, в форме подходящего экспрессирующего вектора, кодирующей указанный один или указанные несколько белков, их аналогов или производных;
ii) способ модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, заключающегося в обработке этих клеток антителами, их активными производными или фрагментами настоящего изобретения;
iii) способа модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, заключающегося в обработке этих клеток олигонуклеотидной последовательностью, кодирующей последовательность, являющуюся антисмысловой, по крайней мере, к части последовательности настоящего изобретения; либо олигонуклеотидной последовательностью, кодирующей последовательность, являющуюся антисмысловой по отношению к последовательности р551С, р55DD, FA5-1C или FAS-DD); причем указанная олигонуклеотидная последовательность способна блокировать экспрессию, по крайней мере, одного из белков, связывающихся с внутриклеточным доменом TNF-R или FAS-R;
iv) способа модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, предусматривающего:
а) конструирование рекомбинантного вектора, происходящего от вируса животных, и несущего последовательность, кодирующую белок вирусной поверхности, который способен связываться со специфическим рецептором клеточной поверхности, и последовательность, выбранную из олигонуклеотидной последовательности, кодирующей последовательность, являющуюся антисмысловой, по крайней мере, к части последовательности настоящего изобретения, и олигонуклеотидной последовательности, кодирующей последовательность, являющуюся антисмысловой по отношению к последовательности р551С, р55DD, FAS-1C или FAS-DD; причем при введении в указанные клетки указанного вируса, указанная олигонуклеотидная последовательность способна блокировать экспрессию, по крайней мере, одного из белков, связывающихся с внутриклеточным доменом TNF-R или FAS-R; и
b) инфицирование указанных клеток вектором, определенным в а);
v) способ модуляции действия TNF или FAS-R-лиганда на клетки, несущие TNF-R или FAS-R, заключающегося в обработке этих клеток соответствующим вектором, кодирующим рибозиму, имеющую последовательность, специфичную к последовательности, выбранной из мРНК-последовательности, кодирующей белок, аналог или производное настоящего изобретения, и мРНК-последовательности, кодирующей р551С, р55DD, FAS-1C или FAS-DD); причем указанная последовательность рибозимы способна взаимодействовать с мРНК-последовательностью, а также способна расщеплять указанную мРНК-последовательность, что приводит к ингибированию экспрессии белка, аналога или производного настоящего изобретения или к ингибированию экспрессии р551С, р55DD, FAS-1C или FAS-DD;
vi) способа обработки опухолевых клеток или ВИЧ-инфицированных клеток или клеток, подверженных другим заболеваниям, предусматривающего:
а) конструирование рекомбинантного вектора, происходящего от вируса животных, и несущего последовательность, кодирующую белок вирусной поверхности, который обладает способностью связываться с рецептором поверхности опухолевой клетки или рецептором поверхности ВИЧ-инфицированной клетки, или который обладает способностью связываться с другим рецептором поверхности клетки, подверженной другим нарушениям; и последовательность, выбранную из последовательности настоящего изобретения, кодирующей белок, аналог или производное настоящего изобретения, и последовательности, кодирующей р551С, р55DD, FAS-1C, FAS-DD, или их биологически активный аналог или производное; причем указанный белок, аналог или производное настоящего изобретения, или р551С, p55DD, FAS-1C, FAS-DD или их аналог или производное, при введении в указанные опухолевые или ВИЧ-инфицированные клетки или клетки с другими нарушениями, обладают способностью к уничтожению этих клеток;
b) инфицирование указанных опухолевых клеток или ВИЧ-инфицированных клеток или клеток с другими нарушениями вектором, определенным в (а);
vii) способа, выделения и идентификации белков, факторов или рецепторов, способных связываться с белками настоящего изобретения, связывающимися с внутриклеточным доменом, где указанный способ предусматривает осуществление аффинной хроматографии, в которой указанный белок настоящего изобретения связывают с матриксом для аффинной хроматографии, и этот связанный белок подвергают контакту с клеточным экстрактом, после чего белки, факторы или рецепторы из этого клеточного экстракта, которые связываются с указанным связанным белком, элюируют, выделяют и анализируют;
viii) способа выделения и идентификации белков, способных связываться с белками настоящего изобретения, связывающихся с внутриклеточным доменом, где указанный способ предусматривает получение дрожжевой двухгибридной системы, в которой последовательность, кодирующую указанный белок, связывающийся с внутриклеточным доменом, несет один гибридный вектор, а последовательность, происходящую из библиотеки кДНК или геномной ДНК, несет второй гибридный вектор, после чего, векторы, используемые для трансформации дрожжевых клеток-хозяев, выделяют с последующей экстракцией второго гибридного вектора для получения последовательности, кодирующей белок, который связывается с указанным белком, связывающимся с внутриклеточным доменом; и
ix) способа выделения и идентификации белка, способного связываться с внутриклеточными доменами TNF-рецепторов или FAS-рецепторов, предусматривающего осуществление Саузерн-гибридизации в нестрогих условиях с последующим PCR-клонированием, в котором последовательность настоящего изобретения или ее часть используют в качестве зонда для гибридизации с последовательностями из библиотеки кДНК или библиотеки геномной ДНК, имеющего, по крайней мере, частичную гомологию с указанными последовательностями, а затем указанные гибридизированные последовательности подвергают амплификации и клонированию с помощью полимеразной цепной реакции (PCR), в результате чего получают клоны, кодирующие белки, обладающие, по крайней мере, частичной гомологией к указанным последовательностям настоящего изобретения.
Настоящее изобретение также относится к фармацевтической композиции для модуляции действия TNF или FAS-лиганда на клетки, содержащей в качестве активного ингредиента любой один компонент из следующих компонентов: i) белок настоящего изобретения, или такой белок, как р551С, р55DD, FAS-1C или FAS-DD, его биологически активные фрагменты, аналоги, производные или их смеси; (ii) рекомбинантный вектор, происходящий от вируса животного, и кодирующий вирусный поверхностный белок, способный связываться с рецепторами TNF-R или FAS-R-DD несущих клеток или опухолевых клеток, и последовательность, кодирующую белок, аналог или производное настоящего изобретения, или последовательность, кодирующую р551С, p55DD, FAS-1C или FAS-DD; (iii) рекомбинантный вектор, происходящий от вируса животного, и кодирующий вирусный поверхностный белок, определенный выше в (ii) и олиго-нуклеотидную последовательность, кодирующую последовательность, являющуюся антисмысловой по отношению к последовательности р551С, р55DD, FAS-1С или FAS-DD; и iv) вектор, кодирующий рибозиму с последовательностью, способной взаимодействовать с мРНК-последовательностью, кодирующей белок, аналог или производное настоящего изобретения, или с мРНК-последовательностью, кодирующей р551С, p55DD, FAS-1C или FAS-DD.
В конкретном варианте вышеуказанных аспектов настоящее изобретение относится к использованию р55-1С или ДНК, кодирующей р55-1С. Этот вариант изобретения основан на обнаружении того факта, что р55-1С может лиганд(TNF)-независимым образом индуцировать в клетках другие TNF-ассоциированные эффекты. В соответствии с этим настоящее изобретение относится к способу индуцирования TNF-ассоциированных эффектов в клетках или тканях, предусматривающему обработку указанных клеток одним или несколькими белками, их аналогами или производными, где указанные один или несколько белков, выбирают из белков, все из которых являются самоассоциирующимися внутриклеточными доменами p55-TNF-R (р55-1С) или их частями, способными к самоассоциации и индуцированию TNF-эффекта в клетках лиганд (TNF)-независимым образом; причем указанная обработка клеток предусматривает введение в эти клетки указанных одного или нескольких белков, их аналогов или производных в форме, подходящей для внутриклеточного введения, либо введение к эти клетки ДНК-последовательности, кодирующей указанные один или несколько белков, их аналогов или производных, в виде подходящего вектора, несущего эту последовательность, и способного вводить эту последовательность в указанные клетки так, чтобы эта последовательность могла экспрессироваться в этих клетках.
Вариантами вышеуказанного способа настоящего изобретения являются:
i) способ, где указанную обработку клеток осуществляют путем трансфекции указанных клеток рекомбинантным вектором на основе вируса животного; причем указанный способ включает в себя следующие стадии:
а) конструирование рекомбинантного вирусного вектора, несущего последовательность, кодирующую вирусный поверхностный белок (лиганд), способный связываться со специфическим рецептором на поверхности указанных обрабатываемых клеток; и вторую последовательность, кодирующую белок р55-1С или его фрагменты, аналоги и производные, где указанный белок, при его экспрессии в указанных клетках, способен к самоассоциации и индуцированию одного или нескольких TNF-ассоциированных эффектов; и
b) инфицирование указанных клеток вектором (а);
ii) способ, где указанным TNF-эффектом, индуцируемым в указанных клетках, является индуцирование экспрессии гена 1L-8, а указанным вектором является вектор, несущий последовательность, кодирующую, в основном, весь указанный р55-1С, его фрагменты, аналоги и производные, которые, при их экспрессии в клетках, способны к самоассоциации и передаче сигнала для индуцирования экспрессии указанного гена 1L-8;
iii) способ обработки опухолевых или вирус-инфицированных клеток, или способ усиления антибактериального действия гранулоцитов, где указанный вирусный вектор несет последовательность, кодирующую вирусный лиганд, способный связываться со специфическим рецептором на поверхности указанных опухолевых клеток, вирус-инфицированных клеток или гранулоцитов, и последовательность, кодирующую указанный р55-1С, его фрагменты, аналоги и производные, которые при экспрессии в указанных опухолевых клетках, вирус-инфицированных клетках или гранулоцитах, индуцируют TNF-ассоциированные эффекты, приводящие к гибели этих клеток;
iv) способ обработки опухолевых клеток, где указанный р55-1С, его фрагменты, аналоги или производные, при экспрессии в опухолевых клетках, индуцируют экспрессию 1L-8, которая вызывает цитолиз указанных опухолевых клеток благодаря их хемотаксической активности, притягивающей гранулоциты и другие лимфоциты к опухолевым клеткам и приводящей, тем самым, к гибели опухолевых клеток.
В этом своем аспекте настоящее изобретение также относится к внутриклеточному домену р55-R (р55-1С) его фрагментам, аналогам и производным, используемым для обработки клеток путем индуцирования в этих клетках TNF-ассоциированных эффектов; и к следующим его вариантам:
v) р55-1С, его части, аналоги и производные для использования в обработке клеток путем индуцирования в них экспрессии гена 1L-8.
vi) р55-1С, его части, аналоги и производные для использования в обработке опухолевых клеток путем индуцирования в них экспрессии гена 1L-8, приводящей к гибели этих опухолевых клеток.
Кроме того, в этом аспекте настоящее изобретение относится к фармацевтической композиции для обработки клеток путем индуцирования в них TNF-ассоциированных эффектов, где указанная композиция содержит р55-1С, его фрагменты, аналоги, и все их производные в качестве активного ингредиента, и фармацевтически приемлемый носитель; а также к следующим вариантам этой фармацевтической композиции:
i) фармацевтическая композиция для обработки клеток путем индуцирования в них TNF-ассоциированных эффектов, содержащая в качестве активного ингредиента рекомбинантный вектор, происходящий от вируса животного, и кодирующий р55-1С, его фрагменты, аналоги, и все их производные, и белок, способный связываться с поверхностным белком на обрабатываемых клетках;
ii) фармацевтическая композиция для обработки опухолевых клеток, введение которой приводит к индуцированию экспрессии 1L-8, и последующей гибели опухолевых клеток.
В другом своем аспекте настоящее изобретение относится к растворимому олигомерному рецептору фактора некроза опухолей (TNF-R), состоящему, по крайней мере, из двух самоассоциированных гибридных белков, каждый из которых имеет а) на одном своем конце TNF-связывающий домен, выбранный из внеклеточного домена TNF-R, его аналогов или производных; причем указанный внеклеточный домен, его аналоги или производные не способны к нежелательной самоассоциации и способны связываться с TNF; и b) на другом своем конце, самоассоциирующийся домен, выбранный из (i) в основном полного внутриклеточного домена р55-ТХР (р55-1С), простирающегося примерно от аминокислотного остатка 206 до примерно аминокислотного остатка 426 нативной молекулы р55-TNF-рецептора (р55-R);
(ii) "домена смерти" р55-1С, простирающегося примерно от аминокислотного остатка 328 до примерно аминокислотного остатка 426 нативного p55-R; (iii) в основном, полного внутриклеточного домена рецептора FAS/APO1 (FAS-1C); iv) "домена смерти" FAS-1C; и v) аналогов, фрагментов, или производных любого из (i)-(iv), обладающих способностью к самоассоциации, где указанные, по крайней мере, два самоассоциирующиеся белка подвергаются самоассоциации только в указанных концах (b), а у своих концов (а) эти белки способны связываться, по крайней мере, с двумя мономерами TNF, причем каждый из концов (а) способен связываться с одним мономером TNF; и, кроме того, настоящее изобретение относится к солям и функциональным производным указанного растворимого олигомерного TNF-R.
Варианты этого аспекта настоящего изобретения включают в себя все комбинации вышеуказанных концов (а) с концами (b), так, например, к этим вариантам относится растворимый олигомерный TNF-R, содержащий в качестве внеклеточного домена внеклеточный домен р55-R, а в качестве самоассоциирующегося внутриклеточного домена домен р55-1С.
Кроме того, настоящее изобретение относится к способу получения растворимого олигомерного TNF-R, предусматривающему:
а) конструирование экспрессирующего вектора, кодирующего любой один из указанных гибридных белков, где ДНК-последовательность каждого из указанных концов гибридного белка получают из клонированных ДНК-последовательностей, кодирующих, в основном, полный внеклеточный домен TNF-R, его аналоги или производные; и из клонированных ДНК-последовательностей, кодирующих, в основном, полный р55-1С, "домен смерти" р55-1С, FAS-1С, "домен смерти" FAS-1С, и все их аналоги и производные; и полученные концы лигируют друг с другом, образуя последовательность гибридного белка, которую затем вставляют в указанный вектор под контроль последовательностей, регулирующих транскрипцию и трансляцию;
b) введение вектора (а) в соответствующую хозяйскую клетку, в которой экспрессируется указанный гибридный белок; и
с) очистку гибридного белка, экспрессированного в указанных клетках-хозяевах; причем указанный гибридный белок подвергается самоассоциации до, в течение, или после процесса очистки, в результате которой получают растворимый олигомерный TNF-R.
Кроме того, настоящее изобретение относится к вектору, кодирующему вышеуказанные гибридные белки, используемые в вышеописанном способе настоящего изобретения; к клеткам-хозяевам, содержащим этот вектор; а также к фармацевтической композиции, включающей в себя растворимый олигомерный TNF-R, его соли или функциональные производные и любые их смеси в качестве активного ингредиента в сочетании с фармацевтически приемлемым носителем. Аналогично, в соответствии с настоящим изобретением, растворимый олигомерный TNF-R, его соли, функциональные производные и любые их смеси могут быть использованы для ингибирования нежелательного действия TNF в клетках млекопитающих, а в частности для лечения состояний, обусловленных избыточным пфигутствием эндогенно образованного или экзогенно введенного TNF; либо, альтернативно, они могут быть использованы для длительного поддержания благоприятного действия TNF в клетках млекопитающих при экзогенном введении TNF.
В соответствии с вышеописанным аспектом настоящего изобретения следует также указать, что можно сконструировать растворимый олигомерный рецептор FAS/APO1 (FAS-R), который может быть использован для ингибирования нежелательного действия FAS-лиганда. Поэтому в еще одном аспекте, настоящее изобретение относится к растворимому олигомерному рецептору FAS/APO1 (FAS-R), состоящему, по крайней мере, из двух самоассоциированных гибридных белков, каждый из которых имеет (а) у одного своего конца, домен, связывающийся с FAS-лигандом, выбранный из внеклеточного домена FAS-R, его аналогов при производных, неспособных к самоассоциации и способных связываться с FAS-лигандом; и в) у другого своего конца, самоассоциирующийся домен, выбранный из (i) в основном, полного внутриклеточного домена p55-TNF-R (р55-1С), простирающегося примерно от аминокислотного остатка 206 до примерно аминокислотного остатка 426 нативной молекулы р55-TNF-R (р55-R); (ii) "домена смерти" р55-1С, простирающегося примерно от аминокислотного остатка 328 до примерно аминокислотного остатка 426 нативного р55-R;
(iii) в основном полного внутриклеточного домена рецептора FAS/APO1 (FAS-1C); (ivv "домена смерти" FAS-1C; и (v) аналогов и производных любого из (i)-(iv), обладающих способностью к самоассоциации, где указанные, по крайней мере, два самоассоциирующиеся белка подвергаются самоассоциации только в указанных концах (b), и имеют указанные концы (а), способные связываться, по крайней мере, с двумя мономерами FAS-лиганда, причем, каждый из концов (а) способен связываться с одним мономером FAS-лиганда; и, кроме того, настоящее изобретение относится к солям и функциональным производным указанного растворимого олигомерного FAS-рецептора.
В соответствии с этим аспектом настоящее изобретение также относится к способу получения растворимого олигомерного FAS-R, предусматривающему:
а) конструирование экспрессирующего вектора, кодирующего один из дюбых указанных гибридных белков, где ДНК-последовательность каждого из указанных концов гибридного белка получают из клонированных ДНК-последовательностей, кодирующих, в основном, полный внеклеточный домен FAS-R, его аналоги или производные; и из клонированных ДНК-последовательностей, кодирующих, в основном, весь р55-1С, "домен смерти" р55-1С, FAS-1c, "домен смерти" FAS-1С, все их аналоги и производные; и полученные концы лигируют вместе, образуя последовательность гибридного белка, которую затем вставляют в указанный вектор под контроль транскрипционных и трансляционных регуляторных последовательностей;
b) введение вектора (а) в соответствующую хозяйскую клетку, в которой экспрессируется указанный гибридный белок;
с) очистку гибридного белка, экспрессированного в указанных клетках-хозяевах, причем указанный гибридный белок подвергается самоассоциации до, во время, или после процесса очистки, в результате которой получают растворимый олигомерный FAS-R.
Кроме того, настоящее изобретение относится к вектору экспрессии, содержащему последовательность, кодирующую растворимый олигомерный FAS-R, используемый в вышеописанном способе; к клеткам-хозяевам, содержащим указанный вектор; и к фармацевтическим композициям, включающим в себя растворимый олигомерный FAS-R, его соли или функциональные производные, или любые их смеси в качестве активного ингредиента в сочетании с фармацевтически приемлемыми носителями. Аналогично, настоящее изобретение относится к растворимому олигомерному FAS-R, его солям, или функциональным производным или любым их смесям, которые могут быть использованы для ингибирования нежелательного действия FAS-лиганда в клетках млекопитающих, а в частности, для лечения состояний, обусловленных избыточным пфигутствием эндогенно образованного или экзогенно введенного FAS-лиганда.
Аналогично вышеприведенному описанию, касающемуся олигомерных рецепторов TNP и олигомерных рецепторов FAS, можно также сконструировать смешанные олигомеры, способные специфически связываться как с TNF, так и с FAS-R-лигандом. Таким образом, настоящее изобретение также относится к смешанным олигомерным TNF-R/FAS-R, состоящим, по крайней мере, из двух самоассоциированных гибридных белков, один из которых выбирают из любых вышеуказанных TNF-специфических гибридных белков, а другой выбирают из любых вышеуказанных FAS-R-лиганд-специфических гибридных белков, в результате чего получают смешанный олигомер, имеющий, по крайней мере, один внеклеточный домен TNF-R, и, по крайней мере, один внеклеточный домен FAS-R, соединенные вместе благодаря самоассоциации между внутриклеточными доменами или их фрагментами, гибридизированными с каждым из этих внеклеточных доменов. Эти смешанные олигомерные рецепторы конструируют путем получения, как описано выше, олигомерных TNF-рецепторов и олигомерных FAS-рецепторов, их последующего смешивания, а затем отбора, стандартными способами, тех олигомеров, которые способны к специфическому связыванию с FAS-R-лигандом и TNF. Другой способ получения смешанных олигомерных рецепторов заключается в котрансфекции подходящих клеток-хозяев векторами (описанными выше), кодирующими любой из TNF-специфических гибридных белков (растворимых TNF-рецепторов), и кодирующими любой из FAS-R-лиганд-специфических гибридных белков (растворимых FAS-рецепторов); очистки экспрессированных гибридных белков, которые подвергаются самоассоциации до, во время, и после очистки, в результате которой получают олигомерные рецепторы; и последующего отбора с помощью стандартной техники тех олигомерных рецепторов, которые обладают способностью связываться с TNF и FAS-R-лигандами.
Аналогичным образом могут быть получены фармацевтические композиции, содержащие смешанные олигомерные рецепторы, их соли или функциональные производные, или любые их смеси в качестве активного ингредиента в сочетании с фармацевтически приемлемым носителем. Кроме того, настоящее изобретение относится к смешанным олигомерным рецепторам, их солям или функциональным производным или любым их смесям, которые могут быть использованы для ингибирования нежелательного действия TNF и FAS-R-лиганда в организме млекопитающих, а в частности для лечения состояний, обусловленных избыточным пфигутствием эндогенно образованных или экзогенно введенных TNF и FAS-R-лиганда; либо, альтернативно, они могут быть использованы для длительного (пролонгированного) поддержания благоприятного действия TNF и/или FAS-R-лиганда в тканях млекопитающих при экзогенном введении TNF и/или FAS-R-лиганда (в растворимой форме).
Другие аспекты и варианты настоящего изобретения будут также очевидны из нижеприведенного подробного описания изобретения.
При этом следует отметить, что используемые в настоящем описании термины "модуляция действия TNF на клетки" и "модуляция действия FAS-лиганда на клетки" подразумевают обработку как in vitro так и in vivo.
Краткое описание чертежей
На фиг.1a-d схематически изображена неполная и предварительная нуклеотидная последовательность кДНК-клонов, кодирующих р551С- и р751С-связывающие белки, и выведенная аминокислотная последовательность белка 55.11, где на фиг.1(а) изображена последовательность (SEQ ID NO: 9) клона 55.11, кодирующая р551С-связываютий белок 55.11; на фиг.1(b) изображена частичная и предварительная последовательность (SEQ ID NO: 10 и SEQ ID NO: 11) клона 75.3, кодирующая р751С-связывающий белок 75.3; и на фиг.1(с) изображена частичная и предварительная последовательность (SEQ ID NO: 12 и SEQ ID NO: 13) клона 75.16, кодирующая р751С-связывающий белок р75.16 (все указанные последовательности описаны в Примере 1); а на фиг.1(d) изображена выведенная аминокислотная последовательность белка 55.11 (SEQ ID NO: 14), полученная, исходя из нуклеотидной последовательности, изображенной на фиг.1(а), и описанная в Примере 1,
На фиг.2 проиллюстрирован Нозерн-блот-анализ, который выявил пфигутствие 55.11-специфический мРНК в ряде тестированных клеточных линиях, как описано в Примере 1.
На фиг.3А и 3В представлены авторадиограммы, иллюстрирующие in vitro - связывание белка, кодируемого 55.11 - кДНК, с GST-гибридными белками, содержащими части р55-1С; где на фиг.3А проиллюстрировано связывание полнораэмерного белка 55.11 (55.11 - full) с различными GST-гибридкыми белками; а на фиг.3В проиллюстрировано связывание части 55.11, сцепленной с октапептидом FLAG, с различными GST-гибридными белками (все они описаны в Примере 1).
На фиг.4 схематически иллюстрируется сравнение выведенной аминокислотной последовательности 55.11 человека (SEQ ID NO: 14)с последовательностями родственных белков, происходящих от низших организмов: YHR027c (дрожжи; SEQ ID NO: 15), SEN3 (дрожжи; SEQ ID NO: 16), A. thaliana (растение, SEQ ID NO: 17) и С.elegans (нематода; SEQ ID NO: 18), как представлено в Примере 1.
На фиг.5 показан Вестерн-блот, окрашенный поликлональной антисывороткой против МВР, и иллюстрирующий самоассоциацию р551С, где Вестерн-блот получали из ДСН-ПААГ-геля, на котором проводили электрофорез взаимодействующих бактериально продуцированных химерных белков р551С-МВР и р551С-GST (дорожки 1-4) или контроля (взаимодействие между химерным белком р551С-МВР и одним GST (дорожки 5-8); при этом взаимодействие между химерными белками (и контроля) проводили на глутатион-агарозных шариках до осуществления электрофореза на ПААГ с ДСН, как описано в Примере 2.
На фиг.6 представлены фазово-контрастные микрофотографии, иллюстрирующие цитотоксическое действие полноразмерного р551С в клетках HTta1, трансфецированных экспрессирующим вектором, кодирующим этот р551С (правая панель); и ингибирование этого цитотоксического действия в случае, если экспрессия вектора блокируется путем обработки клеток тетрациклином (левая панель), как описано в Примере 2.
На фиг.7 проиллюстрирована лиганд-независимая стимуляция цитоцидного эффекта в клетках HeLa, трансфецированных полноразмерным р55-R, его внутриклеточным доменом, или частями внутриклеточного домена, включая "домен смерти", где:
i) в самой крайней части фиг.7 схематически показаны различные ДНК-молекулы, кодирующие полноразмерный р55-R, его внутриклеточный домен и фрагменты внутриклеточного домена, которые были встроены в вектор, с помощью которого трансфецировали клетки HeLa.
ii) левый и средний столбцы графика иллюстрируют экспрессию рецептора TNF в клетках HeLa для каждого из типов рецептора, показанных в самой левой части фиг.7, при этом левый столбец представляет количества рецептора в нг/кл. образца, а средний столбец графика представляет количества рецептора, выраженные в единицах радиоиодированного TNF, связанного с трансфецированными клетками; и
iii) правый столбец иллюстрирует вариабельность клеток HeLa, экспрессирующих различные типы рецепторов;
и где: во всех графиках незаштрихованные прямоугольники представляют клетки, трансфецированные в пфигутствии тетрациклина, а заштрихованные прямоугольники представляют клетки, трансфецированные в отсуствии тетрациклина (все указанные варианты описаны в Примере 2).
На фиг.8 проиллюстрировано лиганд-независимое индуцирование экспрессии гена 1L-8 в клетках HeLa, трансфецированных полноразмерным р55-R или его внутриклеточным доменом (р551С), где на панели А проиллюстрирован Нозерн-блот-аналилиз РНК, экстрагированной из клеток HeLa, обработанных или необработанных TNF (две левые дорожки, обозначенные "контроль" и "TNF"), и РНК, экстрагированной из клеток HeLa, трансфецированных векторами, кодирующими р55-R, р55-1С или контрольный белок, люциферазу (остальные дорожки, обозначенные "р55-1С", "Р55-R", и "Luc", соответственно); при этом в каждом случае клетки были трансфецированы в пфигутствии (+) или в отсутствии (-) тетрациклина (поэтому для трансфецированных клеток имеются две дорожки); и где на панели В проиллюстрировано окрашивание 18S рРНК метиленовым голубым в каждом из образцов клеток HeLa, показанных на панели А (все вышеуказанные варианты описаны в Примере 2).
На фиг.9 (А и В) графически проиллюстрировано лиганд-независимое стимулирование цитоцидного эффекта в клетках HeLa, трансфецированных р55В, или его фрагментами, или FAS-1C, где на фиг.9А представлены результаты для p55R, или их фрагментов, а на фиг.9В представлены результаты для FAS-1C. Слева, на панелях А и В, схематически изображены части р55R или FAS-1C, используемые для трансфекиии, а справа на этих панелях графически представлены экспериментальные результаты (все указанные варианты описаны в Примере 2).
На фиг.10 схематически изображена частичная и предварительная нуклеотидная последовательность (SEQ ID NO: 19 и SEQ ID NO: 20) кДНК-клона (обозначенного "F2"), который кодирует белок, способный связываться с р551С и FAS-1C, как описано в Примере 3.
На фиг.11 схематически изображена частичная и предварительная нуклеотидная последовательность (SEQ ID NO: 21-23) кДНК-клона (обозначенного F9), которая кодирует белок, способный связываться с р551С и FAS-1C, как описано в Примере 3.
На фиг.12 схематически изображена частичная и предварительная нуклеотидная последовательность (SEQ ID NO: 24) кДНК-клона (обозначенного DD 11), которая кодирует белок, способный связываться с р551С, а в частности р55DD и FAS-1C, как описано в Примере 3.
Подробное описание изобретения
В одном из своих аспектов настоящее изобретение относится к новым белкам, которые обладают способностью связываться с внутриклеточным доменом рецепторов, принадлежащих к суперсемейству TNF/NGF, таким, как рецепторы TNF (TNF-R) и рецептор FAS (FAS-R), и которые, поэтому, являются медиаторами или модуляторами этого суперсемейства рецепторов, например, TNF-R и FAS-R, играя определенную роль, например, в передаче сигналов, инициируемой посредством связывания TNF с рецептором TNF и FAS-лиганда с рецептором FAS. В качестве примеров могут служить белки, которые связываются с внутриклеточным доменом p55-TNF-R (p551C), такие, как белки, обозначенные в настоящем описании 55.1, 55.3 и 55.11 (Пример 1), а также белки, кодируемые кДНК-клонами F2, Р9 и DD11 (Пример 3); белки, которые связываются с внутриклеточным доменом p75-TNF-R, (p751C), такие, как белки, обозначенные 75.3 и 75.16 (Пример 1); и белки, которые связываются с внутриклеточным доменом FAS-R (FAS-1C), такие, как белки, кодируемые кДНК-клонами F2, Р9 и DD 11 (Пример 3). Было установлено, что белки 55.1 и 55.3 представляют собой части или фрагменты внеклеточного домена р55-TNF-R (p551C); а другие белки, а именно 55.11, 75.3 и 75.16, не были вообще описаны до настоящего изобретения (75.3, 75.16), либо они были описаны (55.11, см., Khan и др., 1992), но об их функциях или других свойствах, в частности, о способности связываться с TNF-R ничего не сообщается (см. ниже, Пример 1). Новые белки, кодируемые кДНК-клонами F2, F9 и DD 11 также представляют собой белки, которые ранее не были описаны, т.е. их последовательности отсутствуют в банках данных с ДНК ("GENEBANK") или в банках данных о аминокислотных последовательностях ("PROTEIN BANK").
Таким образом, настоящее изобретение относится к ДНК-последовательности, кодирующим указанные белки, и к белкам, кодируемым этими ДНК-последовательностями.
Кроме того, настоящее изобретение также относится к ДНК-последовательностям, кодирующим биологически активные аналоги и производные этих белков, и к аналогам и производным, кодируемым этими последовательностями. Получение указанных аналогов и производных осуществляют стандартными методами (см., например Sambrook и др., 1989), где в ДНК-последовательностях, кодирующих эти белки, могут быть делегированы, добавлены или заменены один или несколько кодонов, так, чтобы полученный в результате аналог имел изменение, по крайней мере, в одной аминокислоте по сравнению с нативным белком. Приемлемыми аналогами являются такие аналоги, которые сохраняют, по крайней мере, свою способность к связыванию с внутриклеточным доменом рецептора, принадлежащего к суперсемейству рецепторов TNF/NGF, таких, как FAS-R, или TNF-R, например, р551С, р751С, или FAS-1C, или которые могут опосредовать любое другое связывание или ферментативную активность, например, такие аналоги, которые связываются с р55, р751С или FAS-1C, но которые не передают сигнал, т.е. не связываются с другим нижерасположенным рецептором, белком или другим фактором, или не катализируют сигнал-зависимую реакцию. Таким образом, могут быть продуцированы аналоги, которые обладают так называемым преобладающим негативным эффектом, а именно аналоги, которые являются дефектными либо в отношении связывания, например, с р551С, р751С или FAS-1C, либо в отношении последующей передачи сигнала после связывания. Эти аналоги могут быть использованы, например, для ингибирования действия TNF или FAS-лиганда путем конкуренции с натуральными 1C-связывающими белками. Аналогичным образом могут быть продуцированы так называемые доминантно-позитивные аналоги, которые обладают способностью усиливать действие, например, TNF или FAS-лиганда. Эти аналоги должны иметь аналогичные или даже лучшие 1C-связывающие свойства, а также аналогичную или даже лучшую способность к передаче сигнала, чем натуральные 1C-связывающие белки. Аналогичным образом производные могут быть получены путем стандартных модификаций боковых групп одного или нескольких аминокислотных остатков белков или путем конъюгирования белков с другой молекулой, например с антителом, ферментом, рецептором и другими молекулами, хорошо известными специалистам.
Новые белки, связывающиеся с внутриклеточным доменом TNF-R и FAS-R, например, белки 55.1, 55.3, 55.11, 75.3, 75.16, а также белки, кодированные кДНК-клонами Р2, F9 и DD11 (обозначаемых далее F2, F9 и DD11), могут быть использованы в различных целях, например:
i) Они могут быть использованы для имитации или усиления функции TNF или FAS-R-лиганда в тех случаях, когда усиленное действие TNF или FAS-R является желательным, например при противоопухолевой, противовоспалительной или анти-ВИЧ терапии, где необходимо достичь TNF- или FAS-R-лиганд-индуцированной цитотоксичности. В этих случаях белки, например, белки, связывающиеся с р551С, такие, как 5.1, 55.3, а также F2, Р9 и DD11, и непосредственно сам р551С (см. ниже, и Пример 2), а также "домен смерти" р551С (р55DD), который усиливает действие TNF; либо белки F2, Р9 и DD11, а также FAS-1C и FAS-DD, которые усиливают действие FAS-R-лиганда, т.е. обладают цитотоксическим действием, могут быть введены в клетку с использованием стандартной техники, известной per se. Так, например, поскольку эти белки являются внутриклеточными и поскольку желательно, чтобы они были введены только в те клетки, где предпочтительно индуцировать действие TNF или FAS-R-лиганда, то для специфического введения этих белков в клетки необходимо использовать определенную систему. Одним из способов конструирования такой системы является создание рекомбинантного вируса животного, например, вируса, происходящего от вируса коровьей оспы, для получения ДНК, из которой могут быть взяты и последовательно введены два гена: ген, кодирующий лиганд, который связывается с белками клеточной поверхности, экспрессированными клетками, например, такими, как белок gр120 вируса СПИД'а (ВИЧ), который специфически связывается с некоторыми клетками (СD4-лимфоцитами и родственными клетками лейкозов) либо ген, кодирующий другой лиганд, который специфически связывается с клетками, несущими TNF-R или FAS-R, так, чтобы рекомбинантный вирусный вектор был способен к связыванию клеток, несущих TNF-R или FAS-R; и ген, кодирующий новый белок, связывающийся с внутриклеточным доменом, или белок р551С, р55DD, FAS-1C или FAS-DD. Таким образом, белок на поверхности вируса, связывающийся с клеточной поверхностью, будет специфически направлять этот вирус на опухолевую клетку или на другую клетку, несущую TNF-R или FAS-R, после чего последовательность, кодирующая белок, связывающийся с внутриклеточным доменом, или последовательность, кодирующая р551С, р55DD, FA8-1C или FAS-DD, будет введена в клетки с помощью этого вируса, а после ее экспрессии в этих клетках будет индуцироваться усиление действия TNF или FAS-R-лиганда, что приведет к гибели опухолевых клеток, или других клеток, несущих TNF-R или FAS-R, уничтожение которых было бы желательным. Конструирование такого рекомбинантного вируса животных может быть осуществлено с использованием стандартной техники (см., например, Sambrook и др., 1989). Другая возможность введения указанных белков в клетки может быть реализована путем введения последовательностей этих новых белков или р551С, p55DD, FAS-1C или FAS-DD в форме олигонуклеотидов, которые могут быть абсорбированы клетками и экспрессированы в них.
ii) Они могут быть использованы для ингибирования действия TNF или FAS-R-лиганда, например, в случаях разрушения ткани в результате септического шока, реакции отторжения типа "трансплантат против хозяина", или острого гепатита, где необходимо блокировать TNF-индуцированную внутриклеточную передачу сигнала TNF-R или FAS-R-лиганд индуцированную внутриклеточную передачу сигнала FAS-R. В этом случае можно, например, ввести в клетки, с помощью стандартной техники, олигонуклеотиды, имеющие антисмысловые кодирующие последовательности для этих новых белков, или антисмысловые кодирующие последовательности для р551С, P55DD, PAS-1C или FAS -DD, которые могли бы эффективно блокировать трансляцию мРНК, кодирующих эти белки, и тем самым блокировать их экспрессию, что, в конечном счете, привело бы к ингибированию действия TNF или FAS-R-лиганда.
Такие олигонуклеотиды могут быть введены в клетки с использованием вышеописанного вируса; причем второй последовательностью, содержащейся в этом вирусе, должна быть олиго-нуклеотидная последовательность. Другим способом является использование антител против указанных белков, которое приведет к ингибированию их способности к внутриклеточной передаче сигнала. Возможно, что эти новые белки имеют внеклеточный домен и внутриклеточный домен, при этом внутриклеточный домен связывается с TNF-R- или FAS-R-связывающим доменом, и тогда антитела, генерированные против их внеклеточных доменов, могут быть использованы для блокирования TNF или FAS-R-ассоциированных функций.
Еще одним способом ингибирования действия TNF или FAS-S-лиганда является недавно разработанный метод с использованием рибозимов. Рибозимы представляют собой каталитические молекулы РНК, которые специфически расщепляют РНК (т.е. обладают свойством автокатализа). Рибозимы могут быть сконструированы для расщепления нужных РНК, например, мРНК, кодирующих новые белки настоящего изобретения, или мРНК, кодирующие р551С, р55DD, FAS-1C или FAS-DD. Такие рибозимы должны иметь последовательность, специфичную для выбранной мРНК, а также должны обладать способностью к взаимодействию с ней (комплементарное связывание) с последующим расщеплением этой мРНК, что должно, в конечном счете, приводить к снижению (или полному подавлению) экспрессии белка, который необходимо ингибировать, причем уровень снижения экспрессии зависит от уровня экспрессии рибозимы в клетке-мишени. Для введения рибозимов в выбранные клетки (например, в клетки, несущие TNF-R или FAS-R) может быть использован любой подходящий вектор, например, плазмида, вирусные векторы животных (ретровирусы), и векторы, которые обычно используются в этих целях (см. выше, где вирус имеет, в качестве второй последовательности, кДНК, кодирующую выбранную последовательность рибозима).
Кроме того, могут быть сконструированы рибозимы, имеющие множество мишеней (многоцелевые рибозимы), которые могут быть использованы, например, для ингибирования экспрессии одного или нескольких белков настоящего изобретения и/или р551С, р55DD, FAS-1C или FAS-DD (обзор методом и т.п., посвященных рибозимам, см. Chen et al., 1992; Zhao & Pick, 1993; Shore et al., 1993; Joseph & Burke, 1993; Shimayama et al., 1993; Cantor et al., 1993; Barinaga, 1993; Crisell et al., 1993; Koizumi et al., 1993).
iii) Они могут быть использованы для выделения, идентификации и клонирования других белков, способных связываться с ними, например других белков, участвующих в процессе передачи сигнала, которые находятся ниже от внутриклеточного домена TNF-R или FAS-R. В этом случае, указанные варианты, а именно ДНК-последовательности, кодирующие эти белки, могут быть использованы в дрожжевой двухгибридной системе (см. Пример 1), в которой последовательность этих белков может быть использована в качестве "приманки" для выделения, клонирования и идентификации из библиотек кДНК или геномной ДНК других последовательностей ("добычи"), кодирующей белки, которые могут связываться с этими новыми белками, связывающимися с внутриклеточным доменами TNF-R или FAS-R. Аналогичным способом может быть также определено могут ли конкретные белки настоящего изобретения, а именно белки, которые связываются с р551С, р75С или FAS-1C, связываться с другими рецепторами суперсемейства рецепторов TNF/NGF. Например, недавно сообщалось (Schwalb и др., 1993; Baens к др., 1993, Crowe и др., 1994), что помимо р55- и p75-TNF-R, существуют и другие рецепторы TNF. В соответствии с этим, используя дрожжевую двухгибридную систему, можно точно проверить, обладают ли белки настоящего изобретения способностью к специфическому связыванию с этими другими TNF-рецепторами или другими рецепторами суперсемейства TNF/NGF. Кроме того, этот способ может быть также использован для определения, обладают ли белки настоящего изобретения способностью связываться с другими известными рецепторами, в активности которых они могут играть функциональную роль.
iv) Эти новые белки могут быть также использованы для выделения, идентификации и клонирования других белков того же самого класса, т.е. белков, связывающихся с внутриклеточными доменами TNF-R или FAS-R или с функционально родственными рецепторами, и участвующими во внутриклеточной передаче сигнала. В этом случае может быть использована вышеописанная дрожжевая двухгибридная система, либо может быть использована недавно разработанная (Wilks и др., 1989) система с применением нестрогой Саузерн-гибридизации с последующим PCR-клонированием. В публикации Wilks и др. описываются идентификация и клонирование двух предполагаемых протеин-тирозин-киназ с использованием нестрогой Саузерн-гибридизации с последующим клонированием посредством PCR, исходя из известной последовательности "мотива" киназы предполагаемой киназной последовательности. В соответствии с настоящим изобретением этот метод может быть применен с использованием последовательностей новых белков для идентификации и клонирования белков, родственных белкам, связывающимся с внутриклеточным доменом TNF-R, FAS-R или родственного рецептора (рецепторов суперсемейства TNF/NGF).
v) В еще одном варианте новые белки настоящего изобретения могут быть использованы в методах аффинной хроматографии для выделения и идентификации других белков или факторов, с которыми они способны связываться, например других рецепторов, родственных TNF-R, (рецепторам суперсемейства TNF/NGF) или других белков или факторов, участвующих в процессе передачи сигнала. В этом случае белки настоящего изобретения могут быть отдельно связаны с матриксом, используемом для аффинной хроматографии, а затем подвергнуты контакту с клеточными экстрактами или выделенными белками или факторами, которые подозреваются в участии в процессе передачи внутриклеточного сигнала. После проведения аффинной хроматографии другие белки или факторы, которые связываются с новыми белками настоящего изобретения, могут быть проэлюированы, выделены и охарактеризованы.
vi) Как указывалось выше, новые белки настоящего изобретения могут быть также использованы в качестве иммуногенов (антигенов) для продуцирования антител против них. Эти антитела могут быть также использованы для очистки новых белков либо из клеточных экстрактов, либо из продуцирующих их трансформированных клеточных линий. Кроме того, эти антитела могут быть также использованы в диагностических целях идентификации расстройств, связанных с аномальным функционированием системы TNF или FAS-R-лиганда, например, клеточных эффектов, индуцированных сверхактивными или малоактивными TNF или FAS-R-лигандами. Так, например, в случае, когда такие расстройства связаны с недостаточным функционированием системы передачи внутриклеточного сигнала, в которой участвуют новые белки, указанные антитела могут служить важным диагностическим инструментом.
При этом следует отметить, что выделение, идентификация и характеризация новых белков настоящего изобретения могут быть осуществлены с помощью хорошо известных стандартных методов скрининга. Так, например, один из таких методов скрининга (метод с получением двойного дрожжевого гибрида, как описано ниже в Примерах 1 и 3) был использован для идентификации новых белков настоящего изобретения. Как описано выше и ниже, могут быть использованы другие хорошо известные методы, такие, как аффинная хроматография, ДНК-гибридизация, и т.п. для выделения, идентификации и характеризации новых белков настоящего изобретения, или для выделения, идентификации и характеризации других белков, факторов, рецепторов и т.п., обладающих способностью связываться с новыми белками настоящего изобретения или с рецепторами, принадлежащими к семейству рецепторов TNF/NGF.
Что касается вышеупомянутых антител, то термин "антитело", используемый в настоящем описании, означает поликлональные антитела, моноклональные антитела (mAb), химерные антитела, антиидиотипические антитела (анти- 1d), против антител, которые могут быть помечены в растворимой или связанной форме, а также к их фрагментам, полученным с использованием известной техники, такой, как ферментативное расщепление, пептидный синтез или техника рекомбинантных ДНК, и т.п.
Поликлональные антитела представляют собой гетерогенные популяции молекул антител, полученных из сыворотки животных, иммунизированных антигеном. Моноклональные антитела представляют собой, в основном, гомогенную популяцию антиген-специфических антител, которые имеют, в основном, аналогичные эпитопсвязывающие сайты. Моноклональные антитела могут быть получены известными методами. См., например, Kohier & Milstein, Nature, 256: 495-497 (1975); патент США №4376110; Ausubel et.al., eds., Harlow & Lane ANTIBODIES, A LABORATORY MANUAL, Gold Spring Harbor Laboratory (1988); u Colligan et al., eds., Current Protocols in Immunology, Creene publishing Assoc. & Wiley Interscience N. Y., (1992, 1993), причем содержимое этих работ вводится в настоящее описание посредством ссылки. Указанными антителами могут быть любые иммуноглобулины классов 1qG, 1gМ, 1qЕ, 1gA, gild, и любых их подклассов. Гибридомы, продуцирующие моноклональные антитела настоящего изобретения могут быть культивированы in vitro, in situ или in vivo. Возможность продуцирования высокого титра моноклональных антител in vivo или in situ делает этот метод особенно предпочтительным.
Химерные антитела представляют собой молекулы, состоящие из разных частей, происходящих от разных видов животных, например, такие молекулы, которые имеют вариабельную область, происходящую от мышиных mAb, и константную область, происходящую от человеческого иммуноглобулина. Химерные антитела используют, главным образом, для снижения иммуногенности и для увеличения выхода при продуцировании, например, такие химерные человек/мышиные mAb могут быть использованы в тех случаях, когда мышиные mAb имеют повышенные выходы из гибридом, но обладают повышенной иммуногенностью для человека. Химерные антитела и способы их получения являются известными и описаны в литературе (Cabilly et al., Proc.Natl.Acad. Sci.USA 81: 3273-3277 (1984); Morrison et al., Proc. Natl. Acad. Sci. USA 81: 6851-6855 (1984); Boulianne et al., Nature 312: 643-646 (1984); Cabilly et al., заявка на Европейский патент 125023 (опубликованная 14 ноября 1984); Neuberger et al., Nature 314: 268-270 (1985); Morrison et al. Заявка на Европатент 173494 (опубл. 5 марта 1986) Taniguichi et al., заявка на Европейский патент 173494 (опубликованная 5 марта 1986), Neuberger et al., PCT заявка WO 8601533 (опубликованная 13 марта 1986); Kudo и др. заявка на Европейский патент 184187 (опубликованная 11 июня 1986); Sahagan et al., J. Immunol. 137: 1066-1074 (1986); Robinson и др. заявка на Международный патент WO 8702671 (опубликованная 7 мая 1987); Liu et al., Proc. Natl.Acad. Sci. USA 84: 3439-3443 (1987); Sun et al., Proc. Natl.Acad. Sci. USA 84: 214-218 (1987); Better et al., Science 240: 1041-1043 (1988); и Harlow & Lane, ANTIBO DIES: A LABORATORY MANUAL (см. выше). Все указанные работы вводятся в настоящее описание посредством ссылки.
Антиидиотипическое (анти-1d) антитело представляет собой антитело, распознающее антигенные детерминанты, в основном ассоциированные с антигенсвязывающим центром антитела. Идиотипическое антитело может быть получено путем иммунизации животного того же вида и генетического типа (например, мышиной линии), что и источник mAb, моноклональные антителом, к которому продуцируют анти-1d антитело. Иммунизированные животные могут распознавать и реагировать на идиотипические детерминанты иммунизирующего антитела путем продуцирования антител к указанным идиотипическим детерминантам (анти-1d антител). См., например, патент США 4699880, который вводится в настоящее описание посредством ссылки.
Антиидиотипическое антитело может быть также использовано в качестве "иммуногена" для индуцирования иммунного ответа у другого животного, продуцирующего так называемое анти-антиидиотипическое антитело. Это анти-антиидиотипическое антитело может быть по своим антигенным детерминантам идентичным исходному mAb, которое индуцирует антиидиотипическое антитело. Таким образом, путем использования антител к идиотипическим детерминантам mAb могут быть идентифицированы другие клоны, экспрессирующие антитела идентичной специфичности.
В соответствии с этим моноклональные антитела, продуцированные против 1C-связывающих белков, их аналогов или производных настоящего изобретения или против р551С, р55DD, FAS-DD 1C, FAS-DD, их аналогов или производных могут быть использованы для генерирования антиидиотипических антител у соответствующих животных, такие, как мыши BALB/c. Клетки селезенки от этих иммунизированных мышей используют для продуцирования анти-1d гибридом, секретирующих анти-1d mAb. Кроме того, эти анти-1d mAb могут быть конъюгированы с носителем, таким, как гемоцианин лимфы улитки (KLH), и использованы для иммунизации других мышей BALB/c. Сыворотки этих мышей будут содержать анти-антиидиотипические антитела, обладающие связывающими свойствами исходного mAb, специфичного к эпитопу вышеуказанного 1C-связывающего белка, его аналогов или производных, а также р551С, р55DD, FAS-1C или FAS-DD, их аналогов или производных.
Таким образом, анти-1d mAb имеют свои собственные идиотипические эпитопы или "идиотипы", структурно сходные с оцениваемым эпитопом, таким, как белок-α GPB.
Термин "антитело", используемый в настоящем описании, означает также интактные молекулы и их фрагменты, например такие, как Fab и F(ab')2, которые способны связываться с антигеном. Fab- и F(ab')2 -фрагменты представляют собой часть интактного антитела без Fc-фрагмента, и более быстро выводятся из кровотока и обладают меньшим тканенеспецифическим связыванием, чем интактное антитело (Wahl et al., J. Nucl. Med. 24: 316-325 (1983).
При этом следует отметить, что Fab-, F(ab')2 - и другие фрагменты, применяемые в настоящем изобретении, могут быть использованы для обнаружения и количественной оценки 1C-связывающих белков или р551С, р55DD, FAS-1С или FAS- DD в соответствии с методами, описанными в настоящей заявке для интактных молекул антитела. Обычно эти фрагменты получают путем протеолитического расщепления с использованием таких ферментов, как папаин (для продуцирования Fab-фрагментов) или пепсин (для продуцирования F(ab')2-фрагментов).
Считается, что антитело "способно связываться" с молекулой в том случае, если оно способно вступать в специфическую реакцию с этой молекулой, в результате которой эта молекула связывается с антителом. Термин "эпитоп" означает часть любой молекулы, способной связываться с антителом, которая может распознаваться этим антителом. Эпитопы или "антигенные детерминанты" обычно состоят из химически активных групп поверхности молекул, таких, как группы аминокислотных остатков или боковые полисахаридные цепи, и имеют специфическую пространственную структуру, а также специфический заряд.
"Антиген" представляет собой молекулу или ее часть, способную связываться с антителом и способную, кроме того, индуцировать у животного вырабатывание антител, способных связываться с эпитопом этого антигена. Антиген может иметь один или несколько эпитопов. Под понятием "специфическая реакция антигена" подразумевается, что этот антиген может реагировать при высоком уровне селективности с соответствующим ему антителом и не может реагировать со многими другими антителами, продуцированными другими антигенами.
Антитела, включая фрагменты антител, применяемые в настоящем изобретении, могут быть использованы для количественного или качественного обнаружения 1C-связывающих белков или р551С, p55DD, FAS-1C, FAS-DD в образце, или для обнаружения пфигутствия клеток, которые экспрессируют 1C-связывающие белки настоящего изобретения или белки р551С, р55DD, FAS-1C, и FAS-DD. Это обнаружение может быть осуществлено с помощью иммунофлуоресцентной техники с использованием флуоресцентно меченных антител (см. ниже) в сочетании с методами оптической микроскопии, проточной цитометрии, или флуорометрии.
Антитела (или их фрагменты), применяемые в настоящем изобретении, могут быть использованы гистологически в иммунофлуоресцентной или иммуноэлектронной микроскопии для in situ - обнаружения 1C-связывающих белков настоящего изобретения или р551С, р55DD, FAS-1C, FAS-DD. In situ - Детекция может быть осуществлена путем взятия гистологического образца у пациента и введения меченного антитела настоящего изобретения в такой образец. Антитело (или его фрагмент) предпочтительно вводить путем нанесения или покрытия этим меченным антителом (или его фрагментом) биологического образца. Используя такой метод, можно определить не только пфигутствие 1C-связывающих белков или р551С, р55DD, FAS-1C, FAS-DD, но также и оценить распределение этих белков в исследуемой ткани. Любому специалисту совершенно очевидно, что с использованием настоящего изобретения можно модифицировать любые гистологические методы широкого ряда (например, методы окрашивания) для осуществления такой in situ детекции.
Указанные анализы на пфигутствие 1C-связывающих белков настоящего изобретения или р551С, p55DD, FAS-1C, FAS -DD обычно осуществляют путем инкубирования биологического образца, такого, как физиологическая жидкость, тканевый экстракт, свежесобранные клетки, например лимфоциты или лейкоциты, или клетки, которые были инкубированы в тканевой культуре, в пфигутствии детектируемого меченного антитела, способного к идентификации 1C-связывающих белков или р551С, р55DD, FAS- 1C, FAS-DD, и последующего обнаружения этого антитела любым из имеющихся стандартных способов.
Биологический образец может быть иммобилизован на твердофазном носителе, таком, как микроцеллюлоза или другой твердофазный носитель, способный иммобилизовывать клетки, частицы клеток или растворимые белки. Этот носитель может быть затем промыт соответствующими буферами, а после этого обработан детектируемым меченым антителом в соответствии с настоящим изобретением, как указано выше. Твердофазный носитель может быть затем еще раз промыт буфером для удаления несвязанного антитела. После этого количество связанной метки на указанном твердом носителе или подложке может быть определено стандартными методами.
Термины "твердофазная подложка", "твердофазный носитель", "твердый носитель", "твердая подложка", "подложка" или "носитель" означает любую подложку или любой носитель, способные связываться с антигеном или антителами. Хорошо известными подложками или носителями являются стекло, полистирол, полипропилен, полиэтилен, декстран, найлон, амилазы, натуральные и модифицированные целлюлозы, полиакриламиды, габбро и магнетит. По своей природе, этот носитель может быть растворимым до определенной степени, либо нерастворимым в зависимости от целей настоящего изобретения. Материал для носителя может иметь фактически любую конфигурацию, при условии, что иммобилизованная на нем молекула способна связываться с антигеном или антителом. Так, например, подложка или носитель может иметь сферическую в виде шариков) и цилиндрическую (в виде внутренней поверхности лабораторной пробирки) конфигурацию, или представлять собой внешнюю поверхность стержня. Альтернативно, поверхность носителя может быть плоской, такой, как лист, полоска, и т.п. Предпочтительными носителями являются полистироловые шарики. Однако при этом следует отметить, что путем рутинного экспериментирования, любой специалист может самостоятельно подобрать подходящие носители для связывания антитела или антигена.
Связывающая активность данного антитела, описанного выше, может быть определена известными методами. При этом каждый специалист посредством рутинного экспериментирования может определить рабочие и оптимальные условия анализа для каждого конкретного случая.
В каждом конкретном случае анализа могут быть дополнительно осуществлены другие стадии, такие как промывка, размешивание, фильтрация и т.п., если это необходимо.
Один из способов получения детектируемого меченного антитела настоящего изобретения предусматривает связывание этого антитела с ферментом с последующим проведением иммуноферментного анализа (ИФА). Этот фермент, в свою очередь, может быть подвергнут затем взаимодействию с соответствующим субстратом, так, чтобы в результате этой реакции с субстратом продуцировалась химическая молекула или группа, которая могла бы быть обнаружена методами спектрофотометрии, флуорометрии или путем визуального наблюдения. Ферментами, которые могут быть использованы для получения детектируемого меченного антитела, являются (но не ограничиваются ими) малатдегидрогеназа, стафилококковая нуклеаза, стероид-S-изомераза, дрожжевая алкогольдегидрогеназа, альфа-глицерофосфат-дегидрогеназа, триозофосфатизомераза, пероксидаза хрена, щелочная фосфатаза, аспарагиназа, глюкозооксидаза, бета-галактозидаза, рибонуклеаза, уреаза, каталаза, глюкозо-6-фосфат-дегидрогеназа, глюкоамилаза и ацетилхолинэстераза. Детекция антитела может быть осуществлена колориметрическими методами, в которых используется хромогенный субстрат для фермента. Детекция может быть также осуществлена путем визуального сравнения степени ферментативной реакции субстрата со стандартами, изготовленными аналогичным образом.
Детекция может быть также осуществлена с использованием любого другого иммуноанализа. Так, например, радиоактивно меченные антитела или их фрагменты могут быть обнаружены по R-РТРазе с использованием радиоиммунологического анализа (РИА). Хорошее описание РИА приводится Work Т. и др. (Laboratory Technigues and Biochemistry in Molecular Biology; Noeth Holland Publishing Company NY (1978) со ссылкой на главу под названием " An Introduction to Radioimmune Assay and Related Technigues", Chard Т.; указанная работа вводится в настоящее описание посредством ссылки. Радиоактивный изотоп может быть обнаружен с помощью гамма-счетчика, сцинтилляционного счетчика, или с помощью авторадиографии.
В соответствии с настоящим изобретением антитело может быть также помечено флуоресцентным соединением. При этом, если флуоресцентно меченное антитело подвергнуть световому облучению с соответствующей длиной волны, то пфигутствие этого антитела может быть обнаружено благодаря флуоресценции. Наиболее распространенными соединениями, применяемыми для флуоресцентного мечения, являются изотиоцианат флуоресцеина, родамин, фикоэритрин, пикоцианин, аллофикоцианин, о-фтальдегид, и флуорескамин.
Антитело, для его обнаружения, может быть также помечено с использованием флуоресцирующих металлов, таких, как Е или других металлов ряда лантанидов. Эти металлы могут быть связаны с антителом посредством групп, образующих хелатные комплексы металлов, например, таких групп, как диэтилентриаминпентауксусная кислота (ЕТРА).
Для своего обнаружения антитело может быть также помечено путем его связывания с хемолюминисцентным соединением. Пфигутствие такого хемилюминесцентно-меченого антитела может быть затем обнаружено по наличию люминесценции, продуцируемой в результате химической реакции. Примерами подходящих хемилюминесцентных соединений-меток являются люминол, изолюминол, термоустойчивый сложный эфир акридиния, имидазол, соли акридиния и сложный эфир акридиния и щавелевой кислоты.
Аналогичным образом, биолюминесцентное соединение также может быть использовано для мечения антитела настоящего изобретения. Биолюминесценция является одним из видов хемилюминесценции, наблюдаемой в биологических системах, где каталитический белок усиливает эффективность хемилюминесцентной реакции. Пфигутствие биоллюминесцентного белка может быть обнаружено по наличию люминесценции. Подходящими для мечения биолюминесцентными соединениями являются люциферин, люцифераза и экуорин.
Молекула антитела настоящего изобретения может быть адаптирована для использования в иммунометрическом анализе, известным под названием "двухслойного" (или "двухстадийного") анализа или "сэндвич"-анализа. В типичном иммунометрическом анализе определенное количество немеченного антитела (или его фрагмента) связывают с твердой подложкой или с твердым носителем и добавляют определенное количество детектируемого меченного растворимого антитела, после чего анализируют на пфигутствие и/или определяют количество тройного комплекса, образующегося между антителом, иммобилизованном на твердофазном носителе, антигеном и меченным антителом.
Обычно и предпочтительно иммунометрический анализ представляет собой "прямой" анализ, в котором антитело, связанное с твердофазным носителем, сначала подвергают контакту с тестируемым образцом для экстракции антигена из этого образца посредством образования двойного комплекса "антитело на твердофазном носителе - антиген". После инкубирования в течение соответствующего периода времени твердый носитель промывают для удаления остатков жидкого образца, включая непрореагировавший антиген, если таковой имеется, и подвергают контакту с раствором, содержащим неизвестное количество меченного антитела (которое функционирует как "репортерная молекула"). После второго периода инкубирования, во время которого меченное антитело образует комплекс с антигеном, связанным с твердой фазой посредством немеченного антитела, твердый носитель промывают второй раз в целях удаления непрореагировавшего меченного антитела.
В "сэндвич"-анализе другого типа, который также может быть применен в антигенам настоящего изобретения, используют так называемый "одновременный" и "обратный" анализы. Одновременный анализ предусматривает одну стадию инкубирования, поскольку антитело, связанное с твердым носителем, и меченное антитело добавляют к тестируемому образцу одновременно. После завершения стадии инкубирования, твердый носитель промывают для удаления остатков жидкого образца и неконъюгированного меченного антитела. Затем пфигутствие меченного антитела, связанного с твердым носителем, определяют так же, как и в "прямом" анализе, описанным выше.
В "обратном" анализе сначала добавляют раствор меченного антитела к жидкому образцу, а затем после соответствующего периода инкубирования, добавляют немеченное антитело, связанное с твердым носителем. После второго инкубирования твердую фазу промывали стандартным способом для удаления остатков тестируемого образца и раствора непрореагировавшего меченного антитела. Определение меченного антитела, связанного с твердым носителем, осуществляют как в "одновременном" и "прямом" анализах.
Новые белки настоящего изобретения, после их выделения идентификации и характеризации любым из стандартных методов скрининга, например, методом с использованием дрожжевого двойного гибрида, аффинной хроматографии и других известных методов, могут быть затем продуцированы стандартными методами рекомбинантных ДНК (см., например, Sambrook и др., 1989), в которых подходящие эукариотические или прокариотические клетки-хозяева трансформируют соответствующими эукариотическими или прокариотическими векторами, содержащими последовательности, кодирующие белки. В соответствии с этим настоящее изобретение также относится к указанным экспрессирующим векторам и трансформированным клеткам-хозяевам. Как упоминалось выше, к этим белкам также относятся их биологически активные аналоги и производные, а поэтому настоящее изобретение также относится к векторам, кодирующим аналоги этих белков; и к трансформированным клеткам-хозяевам, продуцирующим эти аналоги. Производные указанных белков получают путем стандартной модификации белков или их аналогов, продуцируемых трансформированными клетками-хозяевами.
В другом своем аспекте настоящее изобретение относится к использованию отдельного внутриклеточного домена p55-TNF-R (р551С) или FAS-R (FAS-1C) или их так называемых "доменов смерти" (p55DD) или FAS-DD), соответственно, в качестве агентов для усиления действия TNF или FAS-R-лиганда на клетки, независимо друг от друга (см. Пример 2). Если в данных клетках, например, в раковых или ВИЧ-инфицированных клетках, необходимо генерировать TNF- или FAS-R-лиганд-индуцируемый цитотоксический эффект, то в эти клетки могут быть введены р551С, р55DD или FAS-DD с использованием вышеописанной методики (см. выше п.(i)) с применением рекомбинантного вируса животных (например, вируса коровьей оспы). Кроме того, в настоящем изобретении могут быть использованы нативные р551С, р55DD, FAS-1C или FAS-DD, их биологически активные аналоги, производные или фрагменты, причем все они могут быть получены методами, описанными выше.
Аналогичным образом, настоящее изобретение также относится к специфическому блокированию TNF-эффекта или FAS-R-лигандного действия путем ингибирования активности р551С, р55DD, PAS-1C или FAS-DD, например, путем введения в клетки антисмыслового олигонуклеотида, приводящего к блокированию экспрессии р551С, р55DD, PAS-1C или FAS-DD.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим рекомбинантные векторы на основе вирусов животных, кодирующие белки, связывающиеся с внутриклеточным доменом рецептора TNF или FAS (включая р551С, р55DD, FAS-1C и FAS-DD), а также кодирующие вирусные поверхностные белки, способные специфически связываться с поверхностными белками клеток-мишеней (например, раковых клеток), в результате чего указанные векторы обеспечивают направленную инсерцию последовательностей белков, связывающихся с внутриклеточным доменом, в нужные клетки.
В другом своем аспекте, настоящее изобретение относится, в частности, к эффектам самоассоциации внутриклеточного домена р55-TNF-рецептора (р55-1С, см. Пример 2). Примером таких эффектов, которые обычно опосредуются связыванием TNF со своим рецептором и которые имитируются сигналпередающей активностью самоассоциирующихся р55-1С или их частей, является индуцирование экспрессии гена, кодирующего 1L-8.
Интерлейкин-8 (1L-8) представляет собой цитокин, принадлежащий к подклассу хемокинов, обладающих выраженной хемотаксической активностью, и, как было показано, играющий важную роль в хемотаксисе гранулоцитов и клеток других типов, ассоциированных с рядом патологических состояний (см., например, Endo и др., 1994; Sekido и др., 1993; Harada и др., 1993; и Ferrick и др., 1991).
Фактор некроза опухолей (TNF) обладает полезной активностью, и поэтому он может быть использован непосредственно для разрушения опухолевых клеток и вирус-инфицированных клеток либо для усиления антибактериальной активности гранулоцитов. Однако, как указывалось выше, TNF также обладает нежелательной активностью, и в этих случаях его активность желательно блокировать, включая те случаи, когда используются повышенные дозы TNF, например при противораковой, противовирусной и антибактериальной терапии.
В соответствии с этим желательно разработать метод, который позволял бы регулировать активность TNF либо получить такое соединение, которое было бы способно имитировать полезную активность TNF в клетках или тканях, нуждающихся в специальной обработке.
В соответствии с настоящим изобретением было обнаружено, что самоассоциирующийся внутриклеточный домен р55-Р (р55-1С) может, лиганд-независимым способом, имитировать ряд эффектов ТМР, например, "домен смерти" р55-1С может индуцировать цитотоксические эффекты в клетках, а р55-1С может индуцировать экспрессию гена 1L-8. Таким образом, используя р55-1С, можно имитировать функцию TNF по сайт-направленному механизму, т.е. можно вводить р55-1С только в те клетки или ткани, которые нуждаются в обработке.
Одним из примеров вышеупомянутых методов может служить специфическая трансфекция (трансформация) опухолевых клеток или злокачественной ткани ДНК-молекулой, кодирующей р55-1С или его фрагмент, который может не только индуцировать цитотоксические эффекты на этих клетках или тканях, но и также усиливать эти эффекты путем ко-индукции 1L-8, которая будет приводить к аккумуляции в области этих клеток или тканей гранулоцитов или других лимфоцитов, которые, в свою очередь, могут способствовать разрушению опухолевых клеток или ткани. Этот метод позволяет избежать необходимости введения больших доз TNF, ассоциируемых с нежелательными побочными эффектами.
С использованием стандартной техники рекомбинантных ДНК могут быть получены различные участки р55-1С и определено, какая именно область ответственна за каждый TNF-индуцированный эффект. Например, было установлено, что "домен смерти" ответственен за цитотоксичность (Пример 2), и были получены различные другие конструкции, содержащие части р55-1С, которые (вместе с частью или полным "доменом смерти") могут быть ответственны за другие TNF-эффекты и которые могут быть использованы, лиганд-независимым образом, после их самоассоциации, в целях индуцирования указанных эффектов, например, индуцирования экспрессии 1L-8.
Следует отметить, что последовательность р55-1С, участвующая в индуцировании других TNF-ассоциированных эффектов (например индуцирование 1D-8), может отличаться от последовательности, которая ответственна за цитотоксичность, т.е. она может не иметь, или иметь только часть "домена смерти", и иметь другие "мотивы", происходящие из других участков внутриклеточного домена, либо она сама может быть последовательностью этих других отличительных признаков последовательности (последовательностью другого "мотива"), участвующих в индуцировании других эффектов.
В соответствии с этим, как подробно описано выше и ниже, могут быть получены экспрессирующие векторы, содержащие указанные области р55-1С, их аналоги или производные, и экспрессированы в клетках-хозяевах, а затем очищены и проанализированы на их активность. В этом методе могут быть получен ряд фрагментов р55-1С, обладающих одним или несколькими TNF-ассоциированными эффектами, и эти фрагменты могут быть использованы различным способом для лечения патологических состояний любого ряда, например, вирусных инфекций, бактериальных инфекций, опухолей, и т.п. Во всех указанных случаях специфическая активность этих фрагментов может быть усилена путем совместного введения (или ко-трансфекции) фрагмента р55-1С, ответственного за индуцирование экспрессии гена 1L-8, что приведет к желательной хемотаксической активности 1L-8 и усилению деструкции клеток или тканей, которые необходимо разрушить.
Таким образом, не прибегая к системному введению TNF, можно индуцировать его полезные эффекты путем специфического введения всего р55-1С или его фрагмента в клетки или ткани, предназначенные для обработки.
р55-1С может быть специфически введен в клетки или ткани для их разрушения с использованием любого из вышеупомянутых способов. Так, например, один из этих способов предусматривает конструирование рекомбинантного вируса животного (например, происходящего от вируса коровьей оспы), в ДНК которого вводят два следующих гена: ген, кодирующий лиганд, который связывается с белками клеточной поверхности, специфически экспрессируемыми клетками, например белком gр120 вируса СПИД'а, который специфически связывается с некоторыми клетками (CD4-лимфоцитами и родственными клетками лейкоза); либо другой лиганд, который специфически связывается с клетками, несущими TNF-R, и благодаря которому рекомбинантный вирусный вектор может связываться с такими TNF-R-несущими клетками; и ген, кодирующий р55-1С или его фрагмент. Таким образом, экспрессия белка, связывающегося с клеточной поверхностью, на поверхности вируса будет специфически направлять этот вирус на опухолевую клетку или на другую TNF-R- несущую клетку, в результате чего последовательность, кодирующая р55-1С или его фрагмент, будет, с помощью этого вируса, введена в клетки, и последующая экспрессия этой последовательности в указанных клетках приведет к усилению TNF-эффекта, способствующего гибели опухолевых или других TNF-R-несущих клеток, которые необходимо уничтожить, либо индуцирующего, например экспрессию 1L-8, приводящей к гибели этих клеток. Конструирование указанного рекомбинантного вируса животного может быть осуществлено с использованием стандартной техники (см., например, Sambrook и др., 1989). Другой способ предусматривает введение последовательностей р55-1С или их фрагментов в виде олигонуклеотидов, которые могут быть абсорбированы клетками и экспрессированы в них.
Настоящее изобретение также относится, в частности, к фармацевтическим композициям, содержащим вышеуказанные рекомбинантные вирусные векторы, кодирующие р55-1С или его фрагменты, а также кодирующие поверхностный вирусный белок, способный специфически связываться с поверхностными белками клеток-мишеней (например, раковых клеток), в результате чего указанный вектор обеспечивает инсерцию последовательности р55-1С или его фрагментов в указанные клетки.
В другом своем аспекте настоящее изобретение относится к новым синтетическим TNF-рецепторам, которые являются растворимыми и обладают способностью к олигомеризации с образованием димерной, а возможно и более высокого порядка мультимерной TNF-рецепторной молекулы, каждая мономерная часть которой способна связываться с мономером TNF. Нативный TNF представляет собой гомотример, содержащий три активных TNF-мономера, каждый из которых способен связываться с одной молекулой рецептора; тогда как природные рецептора TNF представляют совой мономеры, каждый из которых способен связываться только с одним мономером гомотримерноц TNF-молекулы. Таким образом, если TNF связывается с TNF-рецепторами на клеточной поверхности, то он способен связываться с тремя рецепторными молекулами, что приводит к образованию TNF-рецепторных кластеров, которые, очевидно, инициируют процесс передачи сигнала, приводящий, в конечном счете, к индуцированию наблюдаемых TNF-эффектов.
Хотя TNF обладает множеством полезных эффектов, таких, как способность к разрушению нежелательных клеток, например, опухолевых клеток или вирус-инфицированных клеток, а также к усилению антибактериальной активности гранулоцитов, однако, при этом TNF обладает множеством нежелательных эффектов, например, таких, которые приводят к тяжелым заболеваниям, включая аутоиммунные расстройства, ревматоидный артрит, реакцию отторжения типа "трансплантат против хозяина" (отторжение трансплантата) и септический шок; причем подозревается, что TNF является главной причиной патологической деструкции тканей. TNF может также вызывать чрезмерную потерю массы организма (кахексию) путем подавления активности адипоцитов. Кроме того, даже при введении TNF в целях использования его полезной активности, например, при лечении различных злокачественных опухолей или вирусных заболеваний, применяемые дозы TNF часто оказываются достаточно высокими и вызывают у пациента ряд нежелательных цитотоксических побочных эффектов, например деструкцию здоровой ткани.
Поэтому во всех вышеуказанных случаях, где действие TNF является неблагоприятным, желательно использовать эффективный ингибитор TNF. Было разработано множество TNF-блокирующих агентов, включая растворимые белки, обладающие способностью связываться с TNF и ингибирующие связывание TNF с его рецепторами и тем самым ингибирующие цитотоксическое действие TNF (см. ЕР 308378, ЕР 398327 и ЕР 568925). Однако эти TNF-связывающие белки или растворимые TNF-рецепторы являются мономерными, а, значит, каждый из них способен связываться лишь с одним из мономеров гомотримера TNF. Поэтому блокирование функции TNF этими белками не может быть полным, поскольку каждая молекула TNF, связанная с мономерным рецептором, имеет еще два свободных TNF-мономера, которые способны связываться с TNF-рецепторами клеточной поверхности и тем самым способствовать неблагоприятному воздействию TNF на клетки.
Поэтому для решения проблемы, связанной с блокированием функции TNF, в соответствии с настоящим изобретением был разработан метод, позволяющий сконструировать гибридные белки, а именно растворимые олигомерные TNF-рецепторы, которые обладают способностью связываться, по крайней мере, с двумя мономерами нативной гомотримерной молекулы TNF. В соответствии с этим методом, указанные растворимые олигомерные рецепторы TNF связываются со своим TNF-лигандом с более высокой авидностью, чем известные ранее полученные растворимые TNF- связывающие белки или рецепторы. Так, например, если растворимый TNF-рецептор настоящего изобретения был получен в форме димера, то он способен связываться с двумя мономерами тримера TNF, что приводит к более полной и более продолжительной нейтрализации TNF вследствие более низкой скорости диссоциации димерных растворимых рецепторов из TNF. Кроме того, эти растворимые олигомерные рецепторы являются также более крупными молекулами, чем их мономерные аналоги, а поэтому, с фармацевтической точки зрения, они обладают большим преимуществом из-за вероятности того, что их выведение из организма будет более медленным.
Предпосылкой для разработки растворимых олигомерных рецепторов TNF настоящего изобретения было обнаружение того факта, что внутриклеточный домен р55-TNF-рецептора обладает способностью к самоаасоциации, а также того факта, что в этом внутриклеточном домене (р55-1С) имеется участок, так называемый "домен смерти", который также обладает способностью к самоассоциации, и который непосредственно, лиганд-независимым образом, может вызывать цитотоксические эффекты на клетках (см. Пример 2). Используя такое свойство к самоассоциации внутриклеточного домена (р55-1С) и его "домена смерти", можно, с помощью стандартной техники рекомбинантных ДНК, сконструировать гибридный белок, содержащий, в основном, весь внеклеточный домен TNF-рецептора, такого, как рецептор р75-R, или р55-R, а предпочтительно р55-R, и сшитый с ним, в основном, весь внутриклеточный домен (р55-1С) или его "домен смерти". Таким образом, можно сконструировать новый гибридный продукт, который на своем одном конце имеет TNF-связывающий домен, т.е. внеклеточный домен рецептора, а на своем другом конце, имеет внутриклеточный домен, или его "домен смерти", способный к самоассоциации. В соответствии с этим, указанный продукт будет обладать способностью к олигомеризации благодаря самоассоциации между двумя его (а возможно и более) внутриклеточными доменами или "доменами смерти", что приведет к образованию олигомеров (или, по крайней мере, димеров), содержащих, по крайней мере, два домена, связывающихся с TNF.
Кроме того, в соответствии с настоящим изобретением было также обнаружено, что рецептор FAS/APO1 имеет самоассоциирующийся внутриклеточный домен, включая самоассоциирующийся "домен смерти", обладающий определенной гомологией с р55-1С и его "доменом смерти" (Пример 2). Поэтому в соответствии с настоящим изобретением можно сконструировать растворимые олигомерные TNF-рецепторы путем гибридизации внеклеточного домена TNF-рецептора (описанного выше) с внутриклеточным доменом или "доменом смерти" FAS/APO1-рецептора.
В обоих вышеуказанных случаях олигомерные TNF-рецепторы настоящего изобретения являются растворимыми благодаря лишь тому, что они имеют растворимый внеклеточный домен рецептора ТИР и растворимый внутриклеточный домен или его "домен смерти" либо рецептора p55-TNF, либо рецептора FAS/APO1, т.е. они не содержат трансмембранный (нерастворимый) домен какого-либо из указанных рецепторов.
Подробное описание конструирования вышеуказанных олигомерных рецепторов TNF настоящего изобретения приводится ниже, в Примере". Однако при этом следует отметить, что после конструирования олигомерных рецепторов TNF настоящего изобретения может возникнуть ситуация, ранее не описанная, при которой внеклеточный домен рецептора TNF окажется способным к самоассоциации, и такая ситуация может быть нежелательной, поскольку она будет препятствовать способности олигомерного рецептора связываться с двумя или более мономерами гомотримерной молекулы TNF, либо она может приводить к менее оптимальному связыванию этих мономеров TNF. Поэтому во избежание таких ситуаций можно с помощью стандартной техники рекомбинантных ДНК модифицировать внеклеточный домен TNF-рецептора, например, путем делеции или замещения одной или нескольких аминокислотных остатков, содержащихся в самоассоциирующейся области, в целях предупреждения возможной самоассоциации. Такая модификация внеклеточного домена TNF-рецептора является поэтому также частью настоящего изобретения, а модифицированные таким образом домены являются аналогами или производными внеклеточного домена рецептора TNF. Аналогичным образом самоассоциирующийся внутриклеточный домен (1C) или его "домен смерти" (DD) рецептора р55-DD или рецептора FAS/APO1, используемый в олигомерных рецепторах TNF настоящего изобретения, также может быть аналогом или производным натурального домена, т.е. он может представлять собой любую модификацию последовательности р55-1С или ее фрагментов, включая "домен смерти" (р55-DD) или любую модификацию последовательности внутриклеточного домена (FAS-1C) или его фрагментов рецептора FAS/APO1, включая "домен смерти" (FASDD), при условии, что в результате этих модификаций образуется самоассоциирующийся продукт.
Аналогичным образом после продуцирования и очистки растворимые олигомерные рецепторы TNF, их аналоги или производные могут быть затем модифицированы стандартными химическими средствами для образования солей и функциональных производных в целях изготовления фармацевтических композиций, содержащих TNF-рецепторы настоящего изобретения в качестве активных ингредиентов.
Для продуцирования растворимых олигомерных TNF-рецепторов настоящего изобретения из существующих клонов полного рецептора TNF получают ДНК-последовательности, кодирующие внеклеточный домен рецептора TNF, и таким же образом получают ДНК-последовательности, кодирующие внутриклеточный домен или его "домен смерти" рецептора TNF, а также внутриклеточный домен или его "домен смерти" рецептора FAS/APO1 (см. Пример 2 и Пример 5). Затем ДНК-последовательность нужного внеклеточного домена лигируют с ДНК-последовательностью нужного внутриклеточного домена или его части, содержащей "домен смерти", и полученный таким образом гибридный продукт встраивают (и лигируют) в соответствующий экспрессирующий вектор под контроль промотора или других регулирующих экспрессию последовательностей. После создания такого экспрессирующего вектора, этот вектор вводят в подходящие клетки-хозяева (т.е. эти клетки трансформируют, трансфецируют, и т.п. этим вектором), и после экспрессии указанного вектора в этих клетках получают гийридный продукт настоящего изобретения, который представляет собой растворимую самоассоциирующуюся молекулу рецептора TNF. Затем продуцированные таким образом молекулы выделяют из клеток-хозяев с помощью стандартной техники, и получают в качестве конечного продукта растворимые олигомерные рецепторы TNF.
В предпочтительном варианте гибридные последовательности, кодирующие внеклеточный домен и внутриклеточный домен или его часть, получают с помощью РСД-методики с использованием олигонуклеотидов, специфических к данным целевым последовательностям, копируемым из клонов, кодирующих полную TNF-рецепторную молекулу. При этом можно использовать и другой способ, который заключается в выделении нужных участков, кодирующих внеклеточный домен и внутриклеточный домен посредством рестриктирующих эндонуклеаз с последующим сплайсингом известным способом для их объединения, без модификации или с модификацией концов рестрикционных фрагментов для гарантии правильности лигирования нужных фрагментов рецептора (т.е. внеклеточного и внутриклеточного его доменов или их частей). Полученные таким образом гибридные продукты затем вставляют в выбранный вектор экспрессии.
Аналогично настоящее изобретение также относится к растворимым олигомерным FAS/APO1 (FAS)-рецепторам, содержащим внеклеточный домен FAS/APO1 -рецептора и самоассоциирующийся внутриклеточный домен р55-R (рр55-1С) его "домен смерти" (р55DD, либо самоассоциирующийся внутриклеточный домен FAS/APO1-рецептора (FAS-1C) или его "домен смерти" (FASDD), или любые их аналоги или производные (см. выше). Ниже в Примере 5 приводится подробное описание конструирования этих растворимых олигомерных FAS-рецепторов, где в качестве исходного материала использовали имеющуюся клонированную полноразмерную последовательность, кодирующую рецептор FAS и соответствующие олигонуклеотиды для PCR-продуцирования нужных внеклеточного и внутриклеточного доменов с последующим их лигированием для получения гибридного продукта, который затем встраивали в нужный экспрессирующий вектор. Как подробно описано выше и ниже, для продуцирования нужных растворимых олигомерных FAS-рецепторов могут быть использованы как прокариотические, так и эукариотические клетки-хозяева, а после продуцирования этих рецепторов они могут быть очищены и использованы в качестве активных ингредиентов в фармацевтических композициях.
Вышеуказанные растворимые олигомерные FAS-рецепторы настоящего изобретения предназначены для эффективного блокирования FAS-лиганда, который может также существовать в виде тримера (аналогично TNF, см. выше), причем каждый из олигомерных рецепторов настоящего изобретения способен связываться с двумя или более FAS-лигандами, и тем самым нейтрализовывать их активность. Известно, что FAS-лиганд является, в основном, лигандом, ассоциированным с клеточной поверхностью, но он может также существовать и в растворимой форме. В любом случае олигомерные FAS-рецепторы настоящего изобретения способны связываться, по крайней мере, с двумя мономерами этого лиганда, и тем самым способствовать более эффективной (чем мономерные FAS-рецепторы) нейтрализации активности FAS-лиганда. FAS-лиганд, а следовательно, и активация FAS-рецептора играет значительную роль в возникновении ряда патологических состояний, а в частности, состояний, связанных с повреждением печени (например, апоптоз гепатоцитов), включая повреждения печени, связанные с гепатитом, а также аутоиммунных состояний, включая разрушение (апоптоз) лимфоцитов у ВИЧ-инфицированных пациентов (см., например, Ogasawara и др., 1993; Cheng. и др., 1994). Поэтому растворимые олигомерные FAS-рецепторы настоящего изобретения предназначены для блокирования активности FAS-лиганда, и могут быть использованы в качестве активного ингредиента в фармацевтических композициях для лечения таких FAS-лиганд-ассоциированных патологических состояний.
Аналогичным образом, настоящее изобретение также относится к растворимым олигомерным рецепторам, обладающих аффинностью связывания обоих TNF и FAS-R-лиганда, и представляющих собой так называемые "смешанные" олигомерные рецепторы TNF-R/FAS-R. Эти смешанные олигомерные рецепторы содержат, по крайней мере, один внеклеточный домен TNF-R, и по крайней мере, один внеклеточный домен FAS-R, которые объединяются в олигомерном рецепторе благодаря тому, что каждый из них пфигоединен к одному из вышеупомянутых самоассоциирующихся р551С, р55-DD, FAS1C или PASDD.
Эти смешанные олигомерные рецепторы могут быть получены путем: а) продуцирования любого из вышеуказанных гибридных продуктов, которые содержат внеклеточный домен рецептора TNF-R (p75-TNF-R или предпочтительно p55-TNF-R), сшитый с любым одним из самоассоциирующихся доменов р55-1С и FAS-1C, или любым одним из самоассоциирующихся "доменов смерти" р55DD и FASDD, или любой его самоассоциирующейся частью, аналогом или производным; b) продуцирования любого из вышеуказанных гибридных продуктов, которые содержат внеклеточный домен FAS-R, сшитый с любым одним из самоассоциирующихся р551С: FAS-1C, p55DD и FASDD, либо с любыми его частями, аналогами или производными; и с) смешивания любого из TNF-специфических гибридных продуктов а) с любым из FAS-R-лиганд-специфических гибридных продуктов (b) и получения (после стандартных процедур отбора и очистки) олигомерных (димеров или олигомеров более высокого порядка) рецепторов, содержащих по крайней мере оба внеклеточных домена TNF-R и FAS-R, которые связаны между собой благодаря способности к самоассоциации сшитых с ними областей 1C или DD.
Для получения вышеуказанных смешанных олигомерных рецепторов можно использовать и другой метод, который заключается в ко-трансформации подходящих клеток-хозяев вышеупомянутыми экспрессирующими векторами, один из которых кодирует TNF-специфические FAS-R-гибридные продукты, а другой кодирует FAS-R -лиганд-специфические FAS-R-гибридные продукты. После экспрессии этих разных гибридных продуктов в клетках-хозяевах смешанные олигомерные (TNF-R/FAS-R) рецепторы могут быть получены посредством стандартных процедур очистки и отбора.
Ценность этих смешанных по своей аффиности олигомерных рецепторов заключается, в первую очередь, в том, что они нейтрализуют оба TNF и FAS-R-лиганда, в том случае, если наблюдается их чрезмерная эндогенная экспрессия, либо в том случае, если после их экзогенного введения, они пфигутствуют в слишком больших количествах. Недавно проведенные наблюдения указывают на вероятность того, что между функциями FAS-R-лиганда (обычно ассоциированного с клеточной поверхностью) и TNF-α (который также может быть ассоциирован с клеточной поверхностью) существует синергизм. Поэтому в некоторых случаях желательно нейтрализовать оба эти лиганда в одном и том же месте клеточной поверхности, т.е. так, чтобы рецептор со смешанной аффинностью мог блокировать связывание TNF со своим рецептором и связывание FAS -R-лиганда со своим рецептором одновременно. В соответствии с этим рецепторы со смешанной аффиностью могут быть использованы в качестве активного ингредиента в композициях, предназначенных для лечения таких состояний (см. выше), при которых активность TNF и FAS-R-лиганда является нежелательной.
Аналогично, в соответствии с приведенным выше описанием, относящимся к растворимым олигомерным TNF-R и FAS-R, и смешанным TNF-R/FAS-R - олигомерам настоящего изобретения, можно также продуцировать растворимые олигомерные рецепторы других видов или смешанные рецепторы, происходящие от других видов рецепторов, а в частности, от любых других членов суперсемейства TNF/NGF. В этом случае любые внеклеточные домены различных рецепторов могут быть пфигоединены к вышеупомянутым самоассоциирующимся внутриклеточным доменам или их фрагментам, либо к любым другим внеклеточным доменам членов суперсемейства, которые также обладают способностью к самоассоциации.
Экспрессия любого из вышеупомянутых белков настоящего изобретения может быть осуществлена в эукариотических клетках (например, в клетках дрожжей, насекомых или млекопитающих) с использованием соответствующих экспрессирующих векторов. Для этих целей может быть применен любой из известных методов.
Так, например, ДНК-молекулы, кодирующие белки, полученные вышеописанным способом, могут быть встроены в специально сконструированные экспрессирующие векторы в соответствии со стандартной техникой (см. Sambrook и др., 1989). Двухцепочечную ДНК лигируют с плазмидными векторами путем гомополимерного наращивания цепи или путем рестрикционного сшивания с использованием синтетических ДНК-линкеров или техники лигирования по затупленным концам. Для лигирования ДНК-молекул используют ДНК-лигазы, а нежелательные участки соединения устраняют путем обработки щелочной фосфатазой.
Для осуществления экспрессии нужного белка экспрессирующий вектор должен также содержать специфические нуклеотидные последовательности, которые способны регулировать транскрипцию и трансляцию и которые пфигоединяют к ДНК, кодирующей нужный белок, так, чтобы могла осуществляться экспрессия гена с последующим продуцированном нужного белка. Для того чтобы данный ген мог транскрибироваться, прежде всего, необходимо, чтобы этому гену предшествовал промотор, который распознается РНК-полимеразой и с которым эта полимераза связывается, инициируя, таким образом, процесс транскрипции. Существуют различные промоторы, которые действуют с разной эффективностью (сильные и слабые промоторы). Для прокариоритеческих и эукариотических клеток используются разные промоторы.
Промоторы, которые могут быть использованы в целях настоящего изобретения, являются либо конститутивными (нерегулируемыми) промоторами, например промотор int бактериофага Δ, промотор bla гена β-лактамазы рВР322, и промотор CAT гена хлорамфениколацетилтрансферазы рРР325, и т.п., либо индуцируемыми промоторами, такими, как прокариоритические промоторы, включая главные правый и левый промоторы бактериофага Δ (РL, и РR), промоторы trp, recA, lacZ, lacJ, ompF, и gal, E.coli, или trp-lac-гибридный промотор, и т.п. (Glick В.Р. (1987)). Для достижения высоких уровней экспрессии гена в прокариотических клетках, помимо использования сильных промоторов, обеспечивающих продуцирование высоких количеств мРНК, необходимо также использовать сайты связывания с рибосомой для гарантии эффективной трансляции мРНК. В качестве примера может служить последовательность Шайна-Дальгарно (последовательность SD), предваряющая инициирующий кодон и комплементарная 3' - концу последовательности 16S -РНК.
Для эукариотических хозяев могут быть использованы различные транскрипционные и трансляционные регуляторные последовательности в зависимости от природы хозяина. Эти последовательности могут происходить от вирусных источников, таких, как аденовирус, вирус коровьей папилломы, обезьяний вирус или т.п., где регуляторные сигналы ассоциируются с конкретным геном, который обладает высоким уровнем экспрессии. В качестве примеров могут служить промотор ТК вируса герпеса, ранний промотор вируса SV 40, промотор дрожжевого гена gа14 и т.п. Регуляторные последовательности инициации транскрипции могут быть выбраны так, чтобы они позволяли осуществлять репрессию и активацию экспрессии генов в целях ее модуляции.
ДНК-молекулу, имеющую нуклеотидную последовательность, кодирующую гибридные белки настоящего изобретения, вводят в вектор, имеющий соответствующим образом пфигоединенные транскрипционные и трансляционные регуляторные последовательности, способные интегрировать нужные генные последовательности в клетки-хозяева. Клетки, которые были стабильно трансформированы введенной ДНК, могут быть отобраны путем введения одного или нескольких маркеров, позволяющих проводить отбор клеток-хозяев, содержащих данный экспрессирующий вектор. Маркер может обеспечивать фототрофию ауксотрофным хозяевам, резистентность к биоциду, например, к антибиотикам или к тяжелым металлам, таким, как медь, и т.п. Селектируемый ген-маркер может быть либо непосредственно пфигоединен к экспрессируемой генной ДНК-последовательности, либо введен в ту же самую клетку путем ко-трансфекции. Для оптимального синтеза белков настоящего изобретения могут быть также введены дополнительные элементы. Такими элементами являются транскрипционные промоторы, энхансеры, и сигнал терминации. Векторы экспрессии кДНК, вводящие указанные элементы, описаны Okayama Н. (1983).
В предпочтительном варианте осуществления настоящего изобретения введенную ДНК-молекулу встраивают в плазмиду или вирусный вектор, способный к автономной репликации в клетке-реципиенте. При отборе конкретной плазмиды или вирусного вектора важными факторами являются: легкость распознавания и отбора клеток-реципиентов, содержащих данный вектор, из клеток, не содержащих этого вектора; число копий вектора, которое необходимо получить в данном конкретном хозяине; и тот факт, является ли желательным использовать "челночный" вектор, способный реплицироваться в клетках-хозяевах различных типов.
Предпочтительными прокариотическими векторами являются плазмиды, например, плазмиды, способные реплицироваться в E.coli, такие, как рВР322, Co1E1, puC101, рАСУС 184, и т.п. (см. Maniatis и др.), 1982; Sambrook и др., 1989); плазмиды бацилл (Bacillus), такие, как рС194, рС221, рТ127, и т.п. (Gryczan Т. 1982); плазхмиды Streptomyces, включая p1J101 (Kendall, K.J. и др., 1987); бактериофаги Streptomyces, такие, как ⊘С31 (Chater, K.F. и др., в: Sixth International Simposium on Actinomycetales Biology, (1986); и плазмиды Pseudomonas, (John, J.F и др., 1986; и Izaki K., 1978). Предпочтительными эукариотическими плазмидами являются BPV, вирус коровьей оспы, Sv40, 2-микронное кольцо и т.п., или их производные. Эти плазмиды хорошо известны специалистам (Botstein D. и др., 1982; Broach J.R. &: The Molecular Biology of the Yeast Saccharomyces; Life Cede and Inheritance (1981); Broach J.R. (1982); Bollon D.P. et al., (1980); Maniatis Т., В: Cell Biology: A Comprehensive Treatise. Vol.3; Gene Expression, (1980); u Sambrook et al., 1989).
После получения вектора или ДНК-последовательности, содержащей конструкцию, предназначенную для экспрессии, эта ДНК-конструкция может быть введена в соответствующую клетку-хозяина любым из подходящих способов, например, путем трансформации, трансфекции, конъюгации, слияния протопластов, электропорации, осаждения фосфатом кальция, непосредственной микроинъекции, и т.п.
Клетки-хозяева, используемые в настоящем изобретении, могут быть прокариотическими или эукариотическими. Предпочтительными прокариотическими хозяевами являются бактерии, такие, как Е.coli, Стрептомицеты, Псевдомонады, Сальмонеллы, Serrata и т.п. Наиболее предпочтительными прокариотическими хозяевами являются E.coli. Из бактериальных хозяев особый интерес представляют штамм Е.coli К12 294 (АТСС 31446), E.coli. X1776 (АТСС 31537), E.coli W3110 (F-, лямбда-, прототрофный (АТСС 27325)), и другие энтеробактерии, такие, как Salmonella typhimurium или Serratis marcescens и различные виды Pseudomonas. B таких условиях белок не будет гликозилирован. Прокариотические хозяева должны быть совместимыми с репликоном и регуляторными последовательностями в экспрессирующей плазмиде.
Предпочтительными эукариотическими хозяевами являются клетки млекопитающих, например клетки человека, обезьян, мышей, и клетки яичника китайского хомячка, поскольку они обеспечивают посттрансляционную модификацию белковых молекул, включая правильную ее укладку или гликозилирование в нужных сайтах. Дрожжевые клетки также способны осуществлять посттрансляционную модификацию пептидов, включая гликозилирование. Для продуцирования нужных белков в дрожжевых клетках существует ряд методов с применением технологии рекомбинантных ДНК, где используются сильные промоторы и высококопийные плазмиды. Дрожжевые клетки распознают лидерные последовательности на клонированных генных продуктов млекопитающих, и секретируют пептиды, несущие лидерные последовательности (т.е. пре-пептиды).
После введения вектора клетки-хозяева культивируют в селективной среде, используемой для отбора на рост векторсодержащих клеток. Экспрессия клонированных генных последовательностей приводит к продуцированию нужных белков.
Очистку рекомбинантных белков осуществляют любым из известных методов, обычно применяемых для этой цели, например путем экстракции, преципитации, хроматографии, электрофореза или т.п. Предпочтительным способом очистки белков настоящего изобретения является аффинная хроматография с использованием моноклональных антител против TNF-рецептора, иммобилизованных на гелевом матриксе, содержащемся в колонке. Для этого неочищенные препараты, содержащие рекомбинантный белок, пропускают через колонку. Белок связывается с колонкой с помощью специфических антител, тогда как неочищенные белки будут проходить через колонку. После промывки белок элюируют из геля путем изменения рН или ионной силы.
Как указывалось выше, термин "соли" относится к солям, образованным карбоксильными группами, и к кислым солям пфигоединения аминогрупп белковой молекулы, которые получают известными методами. Солями карбоксильной группы являются неорганические соли, например натриевые и кальциевые соли, а также соли, образованные органическими основаниями, например аминами, такими, как триэтаноламин, аргинин, или лизин. Кислыми солями пфигоединения являются, например, соли минеральных кислот и соли органических кислот.
Термин "функциональные производные", используемый в настоящем описании, относится к производным, которые могут быть получены путем модификации функциональных групп, пфигутствующих в качестве боковых цепей на аминокислотных остатках, или N- или С-концевых групп методами, хорошо известными специалистам, при этом все такие производные входят в объем настоящего изобретения при условии, что они являются фармацевтически приемлемыми, т.е. они сохраняют активность исходного белка и не наделяют токсическими свойствами содержащие их композиции. Такими производными являются алифатические сложные эфиры или амиды карбоксильных групп, и N-ацильные производные свободных аминогрупп, или O-ацильные производные свободных гидроксильных групп, образованные ацильными группами (например, алканоильной или карбоциклической ароильной группами).
Термин "фракции", используемый в настоящем описании, относится к любой части или фрагменту рецептора (его внутриклеточному или внеклеточному доменам), или белка, связывающегося внутриклеточным доменом рецептора, где указанные части или фрагменты сохраняют биологическую активность данного рецептора или белка.
Как указывалось выше, настоящее изобретение также относится к различным фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и различные вышеописанные активные ингредиенты настоящего изобретения или их соли, функциональные производные, или любые их смеси. Эти композиции могут быть использованы в любых из условий, описанных в настоящей заявке, например, в условиях сверхпродуцирования эндогенных TNF, например, при септическом шоке, кахексии, реакции отторжения по типу "трансплантат против хозяина", аутоиммунных заболеваниях, таких, как ревматоидный артрит, и т.п. Способ введения композиций настоящего изобретения может быть любым способом, приемлемым для введения подобных агентов, и зависит от цели и условий введения, так, например, если используемая композиция предназначена для ингибирования действия TNF, то она может быть введена внутривенно, например в случае септического шока, или путем местной инъекции, например, в случае ревматоидного артрита (например, в колено), или непрерывно, путем вливания, и т.п. Композиции настоящего изобретения могут быть также использованы в случае TNF-интоксикации, вызванной экзогенным введением слишком высоких количеств (передозировкой) TNF, например, при противораковой или противовирусной терапии.
Фармацевтические композиции настоящего изобретения получают путем смешивания белка или его производных с физиологически приемлемыми носителями, стабилизаторами и наполнителями, и изготавливают в виде лекарственной формы, например, путем лиофилизации в фармацевтических флаконах. Количество активного соединения, необходимое для введения, зависит от способа введения, конкретного заболевания, и состояния пациента. Так, например, местная инъекция при воспалении в случае ревматоидного артрита потребует меньшего количества активного ингредиента на массу тела, чем внутривенное вливание в случае септического шока.
Другие аспекты настоящего изобретения будут очевидны из нижеследующих примеров.
Более подробно настоящее изобретение изложено в нижеследующих примерах, не ограничивающих, однако, объема настоящего изобретения, и проиллюстрировано сопровождающими его фигунками.
Пример 1
Клонирование и выделение белков, связывающихся с внутриклеточными доменами рецепторов р55- и р75-TNF
Для выделения белков, взаимодействующих с внутриклеточными доменами р55- и р75-TNF-рецепторов (р551С и р75 1C), была использована дрожжевая двухгибридная система (Fields & Song, 1989). Эта двухгибридная система представляет собой генетический анализ с использованием дрожжевых клеток, проводимый для детекции специфических взаимодействий "белок-белок" in vivo путем восстановления эукариотического транскрипционного активатора, такого, как GAL4, имеющего два отдельных домена: "ДНК-связывающий домен" и "домен активации"; причем при экспрессии этих доменов и их связывания друг с другом образуется репарированный белок GA L 4, обладающий способностью связываться с вышерасположенной активирующей последовательностью, которая, в свою очередь, активирует промотор, контролирующий экспрессию "репортерного" гена, такого, как lacZ или H1S3, и эту экспрессию репортерного гена можно легко наблюдать в культивируемых клетках. В этом анализе гены для кандидатов взаимодействующих белков клонировали в отдельных экспрессирующих векторах. В одном экспрессирующем векторе последовательность одного белка-кандидата клонировали в соответствующей фазе с последовательностью ДНК-связывающего домена GAL4, в результате чего получали гибридный белок с ДНК-связывающим доменом GAL4, а в другом векторе последовательность второго белка-кандидата клонировали в той же фазе с последовательностью домена активации GAL4, в результате чего получали гибридный белок с доменом активации GAL4. Затем эти двухгибридные векторы ко-трансформировали в дрожжевой штамм, имеющий "репортерный" ген lacZ или H1S3, регулируемый вышерасположенными сайтами связывания GAL 4. В результате этого лишь трансформированные клетки-хозяева (котрансформанты), в которых экспрессируются два гибридных белка, способные связываться друг с другом, будут экспрессировать репортерный ген. В случае использования репортерного гена lacZ, клетки-хозяева, экспрессирующие этот ген, будут окрашиваться в синий цвет при добавлении в культуру Х-qal. Поэтому синий цвет колоний будет указывать на то, что два клонированных белка-кандидата способны взаимодействовать друг с другом.
Используя указанную двухгибридную систему, внутриклеточные домены р551С и р751С клонировали отдельно в вектор pGBT9 (несущий ДНК-связывающую последовательность GAL 4; поставляется фирмой CLONTECH, USA, см. ниже), в результате чего получали гибридные белки с ДНК-связывающим доменом GAL 4 (аналогичным образом внутриклеточный домен PAS-1C и часть р551С, а именно 55DD были клонированы также в pGBT9 и использованы для выделения других 1C-связывающих белков, см. ниже Пример 3). Для клонирования р551С и р751С в pGBT9, были использованы клоны, кодирующие полноразмерные кДНК-последовательности p55-TNF-R (Schall и др., 1990) и p75-TNF-R (Smith и др., 1990), из которых были вырезаны внутриклеточные домены следующим образом: с помощью ферментов EcoRl и Sall вырезали р551С, после чего EcoRl-Sall-фрагмент, содержащий последовательность р551С, выделяли стандартным способом и вставляли в вектор, рестриктированный, в области сайта множественного клонирования (MCS), ферментами EcoRl и Sall. р751С вырезали с использованием ферментов BspH1 и Sall, после чего BSpH1 - Sall-фрагмент, содержащий р751С-последовательность, выделяли стандартным способами, и застраивали фрагментом Кленова, в результате чего получали фрагмент, который вставляли в вектор pGBT9, ресктриктированный ферментом Smal и Sall.
Затем вышеописанные гибридные (химерные) векторы ко-трансфецировали (отдельно, одну ко-трансфекцию осуществляли с использованием р551С-гибридного вектора, и одну с использованием р75-гибридного вектора) вместе кДНК-библиотекой от клеток HeLa человека, клонированной в вектор pGAD GH, несущий домен активации GAL4, в дрожжевой штамм НF7с (все вышеуказанные векторы, pGBT9 и pGAD GH, несущий кДНК-библиотеку клеток HeLa, а также дрожжевой штамм получали из Clontech Laboratories, Inc., USA, как часть MATCHHMAKER Two-Hybrid System, # PT1265-1). Ко-трансфецированные дрожжи отбирали на их способность к росту в среде, не содержащей гистидин (His--среда), при этом растущие колонии указывали на положительные трансформанты. Затем отобранные дрожжевые клоны анализировали на их способность экспрессировать ген lacZ, т.е. на их LACZ -активность, путем добавления Х-gal в культуральную среду, которая подвергается катаболизму с образованием окрашенного синим цветом продукта при участии β-галактозидазы, фермента, кодируемого геном lacZ. Таким образом, появление голубых колоний указывает на пфигутствие активного гена lacZ. Для того, чтобы ген lacZ был активен, необходимо, чтобы в трансформированных клонах активатор транскрипции GAL4 пфигутствовал в активной форме, а именно, чтобы ДНК-связывающий домен GAL4, кодируемый одним из вышеуказанных гибридных векторов, был правильно пфигоединен к домену активации GAL 4, кодируемому другим гибридным вектором. Такая комбинация возможна лишь в том случае, когда два белка, соединенные с каждым из доменов GAL4, способны к стабильному взаимодействию (связыванию) друг с другом. Таким образом, His+ - и голубые (LACZ+) колонии, которые были выделены, являются колониями, ко-трансфецированными вектором, кодирующим р551С, и вектором, кодирующим белковый продукт, происходящий от клеток HeLa человека, и способный стабильно связываться с р551С, или колониями, трансфецированными вектором, кодирующим Р751С, и вектором, кодирующим белковый продукт клеток HeLa, способный стабильно связываться с р751С.
Из вышеуказанных дрожжевых His+, LACZ+ -колоний выделяли плазмидную ДНК, и вводили путем электропорации в штамм НВ101 E.coli в соответствии со стандартной техникой, после чего осуществляли отбор Leu+- и ампициллин-устойчивых трансформантов, т.е. трансформантов, несущих гибридный вектор pGADCGH, который содержит AmpR - и Leu2 -кодирующие последовательности. Поэтому указанные трансформанты представляют собой клоны, несущие последовательности, кодирующие новые идентифицированные белки, способные связываться с р551С и р751С. Затем из этих трансформированных E.coli выделяли плазмидную ДНК и проводили повторное тестирование путем:
а) повторной трансформации этих клеток исходными гибридными плазмидами, содержащими внутриклеточный домен (гибридной плазмидой рGТВ9, несущей последовательность р551С или р75-1С) путем встраивания в дрожжевой штамм НР7, как описано выше. В качестве контроля для ко-трансформации плазмидами, кодирующими р551С-связывающий белок или р751С-связывающий белок, использовали векторы, несущие последовательности, несущие нерелевантный белок, например, рАСТ-ламин или один pGBT9. Затем ко-трансформированные дрожжи тестировали на рост на одной His--среде, или на среде с различными уровнями 3-аминотриазола; и
с) повторной трансформации плазмидой ДНК или исходных гибридных плазмид, и контрольных плазмид, описанных в (а), в дрожжевые клетки-хозяева штамма SFУ526, и последующего определения LACZ+-активности (эффективности образования β-gal, т.е. развития голубой окраски).
Результаты вышеописанных тестов показали, что характер роста колоний в HLs- -среде идентичен характеру LACZ активности, о чем свидетельствовала окраска колоний, т.е. His+-колонии были также LACZ+. Кроме того, LACZ-активность в жидкой культуре (предпочтительные культуральные условия) оценивали после трансфекции гибридов, содержащих ДНК-связывающий домен и домен активации GAL4, в дрожжевые клетки & РУ526, которые обладают лучшей LACZ индуцибельностью активатором транскрипции GAL4, чем клетки-хозяева дрожжевого штамма HF-7.
Результаты осуществления вышеуказанных ко-трансфекций представлены ниже в Таблице 1, из которой видно, что обнаруженные белки способны связываться с р551С или р751С, а именно белки, обозначенные 55.1.1, которые связываются с р551С; и 75.3 и 75.16, которые связываются с р751С. Все указанные р551С - и р751С-связывающие белки являются аутентичными белками человека, кодируемыми кДНК-последовательностями, происходящими из кДНК-библиотеки клеток HeLa, и сшитыми с последовательностью домена активации GAL4 в плазмиде pGAD GH в вышеописанной дрожжевой двухгибридной системе анализа.
Интересно отметить, что было также обнаружено, что сами фрагменты р551С, а именно белки, обозначенные 55.1 и 55.3, способны связываться с р551С. Этот факт обсуждается также ниже, в Примере 2.
В вышеприведенной Таблице представлены следующие плазмиды и гибрид, кодирующий ДНК-связывающий домен GAL4 и домен активации GAL4:
Гибриды, содержащие ДНК-связывающий домен:
pGBT9-1С55: полноразмерный внутриклеточный домен р55-TNF-R (р551С)
рАСТ-ламин: нерелевантный белок - ламин
PGBT9: один вектор
pGBT9-1С75: полноразмерный внутриклеточный домен р75-TNF-R (p751C)
Гибрид, содержащий домен активации;
55.1 и 55.3 соответствуют фрагментам внутриклеточного домена p55-TNF-R.
55.11: новый белок, ассоциирующийся с р55-TNF-R
75.3 и 75.16: новые белки, ассоциирующиеся с p75-TNF-R.
Вышеуказанные клонированные кДНК, кодирующие новые р551С и р751С-связывающие белки, а именно 55.11, 75.3 и 75.16, были затем секвенированы с использованием стандартных методом секвенирования ДНК. Частичные последовательности всех указанных последовательностей, кодирующих белок, показаны на фиг.1а-с, где на фиг.1(а) показана последовательность кДНК, кодирующая белок 55.11; на фиг.1(b) показана частичная кДНК-последовательность, кодирующая белок 75.3; а на фиг. (с) показана частичная последовательность кДНК, кодирующая белок 75.16. На фиг.1(d) показана аминокислотная последовательность белка 55.11, выведенная из нуклеотидной последовательности, изображенной на фиг.1(а).
Однако при этом следует отметить, что о последовательности кДНК, кодирующей белок 55.11, также сообщалось Khan. и др. (1992) в их исследованиях, посвященных кДНК-последовательностям головного мозга человека, и направленных на разработку нового быстрого и точного способа секвенирования и физического и генетического картирования кДНК головного мозга человека. Однако Khan и др. ничего не сообщают о функциях или о каких-либо других свойствах белка, кодируемого 55.11-кДНК-последовательностью, поскольку такой функциональный и другие анализы не были целью исследований Khan и его сотрудников.
Анализ и характеризация белка 55.11
а) Общая методика и материалы
i ) Клонирование кДНК 55.11
После анализа (например, Нозерн-анализа, см. ниже) кДНК белка 55.11 было выявлено, что вышеуказанная кДНК белка 55.11, клонированная двухгибридным методом скрининга, представляет собой лишь частичную кДНК белка 55.11, имеющую нуклеотиды 925-2863 (см. фиг.1(а)), которые кодируют аминокислоты 309-900 (см. фиг.1(d)). Остальная часть 55.11-кДНК (нуклеотиды 1-924 (фиг.1(а), которые кодируют аминокислоты 1-308 (фиг.1(d)) была получена стандартными методами, а именно путем PCR-клонирования из кДНК-библиотеки фетальной печени человека (более подробно см. ниже). Полную нуклеотидную последовательность 55.11 (фиг.а)) определяли в обоих направлениях методом дидезокси-терминации цепи.
ii) Двухгибридный метод анализа на экспрессию β-галактозидазы
Тест на экспрессию β-галактозидазы осуществляли как описано выше, за исключением того, что вместо вектора pGAD-GH, содержащего домен активации Gа14, использовали вектор pVP16, который содержал домен активации VP16. Нумерация остатков в белках, кодируемых кДНК-вставками, была такой же, как в банке данных pGAD-GH. Делеционные мутации продуцировали с помощью PCR, а точечные мутации продуцировали с помощью олигонуклеотид-направленного мутагенеза (Kunkel, 1994).
iii) Нозерн-анализ
Полную РНК выделяли с использованием ТR1 REAGENT (Molecular Research Center, Inc., Cincinnati, Oh., USA.) затем денатурировали в формальдегид/формамидном буфере, подвергали электрофорезу на агарозном/формальдегидном геле и блокировали на мембрану CeneScreen Plus (Dupont, Wilmington, DE., USA) в 10х SS РЕ-буфере с использованием стандартной техники. Блоты гибридизировали с частичной кДНК белка 55.11 (см. выше, нуклеотиды 925-2863), подвергали радиоактивному мечению с использованием набора для рандомизированного праймирования (Bcehringer Mannheim Biochemica, Mannheim, Germany) и промывали в жестких условиях. Авторадиографию осуществляли в течение 1 недели.
iv) Экспрессия кДНК белка 55.11 в клетках HeLa и связывание белка 55.11 с белками, проставляющими собой гибрид глутатион-S-трансферазы с р55-1С
Получали гибриды глутатион-S-трансферазы (GST) с р55-1С (GST-p551C) и с р551С, усеченным ниже аминокислоты 345 (GST-p551C345), и адсорбировали на глутатион-агарозные шарики, как описано ниже в Примере 2 (см. также Smith & Corcoran, 1994; Frangioni & Neel, 1993). кДНК белка 55.11 (нуклеотиды 1-2863, т.е., кДНК полноразмерного 55.11), FLAG-55.11 и люциферазы экспрессировали в клетках HeLa. FLAG-55.11 представляют собой фрагмент белка 55.11, простирающийся между аминокислотными остатками 309 и 900 (частичная кДНК-последовательность белка 55.11 (нуклеотиды 925-2863), первоначально клонированная методом двухгибридного скрининга), и N- сшитый с октапептидом FLAG (Eastman Kodak, New Haven, ct. U.S.А.). Экспрессию гибридных белков осуществляли с использованием тетрациклин-регулируемого экспрессирующего вектора (HtTA-1) в клоне клеток HeLa, который экспрессирует тетрациклин-регулируемый трансактиватор (см. ниже. Пример 2, и Gossen & Bujard, 1992). Метаболическое мечение экспрессированных белков с помощью [35S] Met и [35S] Cys (Dupont, Wilmington, De. USA; Amersham, Buckinghamshire, England ), лизис клеток HeLa, иммунопреципитацию, и связывание меченных белков с GST-гибридными белками осуществляли как описано ниже (Пример 2), за исключением того, что в буфере для лизиса клеток вместо 0,1% Nonidet P-40 пфигутствовал 0,5% Nonidet P-40. Иммунопреципитацию 55.11. и FLAG-55.11 проводили с использованием кроличьей антисыворотки (разведенной 1:500), продуцированной против GST-гибридного белка, содержащего область 55.11, простирающуюся между аминокислотами 309 и 900, и мышиного моноклонального антитела против октапептида FLAG (М2; Eastman Kodak; 5 мкг/мл клеточного лизата).
о) Связывание белка 55.11 с р55-1С в трансформированных дрожжах
Это исследование было предпринято для выявления природы связывания между 55.11 и р551С, а в частности для выявления областей этих белков, участвующих в связывании. Для этого была применена двухгибридная методика, описанная выше, где различные полноразмерные и делеционные мутанты р551С (см. также ниже. Пример 2) в конструкциях "ДНК-связывающего домена" были использованы в качестве "приманки" для связывания с "добычей", являющейся неполным белком 55.11, кодируемым в конструкциях, в которых эта неполная 55.11-последовательность (остатки 309-900, первоначально выделенные) была пфигоединена к "домену активации" в векторах GAL4AD и VP16AD. Кроме того, были сконструированы различные делеционные мутанты 55.11, которые были лигированы с "доменом активации" в векторе GAL4AD (например, мутанты 55.11, имеющие лишь остатки 309-680 и 457-900). Связывание различных конструкций со "связывающим доменом" с различными конструкциями с "доменом активации" исследовали в трансфецированных дрожжевых клетках SFУ526. Связывание оценивали с помощью анализа на экспрессию β-галактозидазы, проведенного двухгибридным методом с использованием мембранного фильтра. Нерелевантные белки SNF1 и SNF4 служили в качестве контроля для конструкций со "связывающим доменом" и "доменом активации", соответственно; "пустые" векторы (т.е. не содержащие Ga14 (pGAD-CH) и VP16 (рVР16) служили в качестве негативного контроля для конструкций с "доменом активации"; а "пустой" Gа14-вектор (pGBT9) служил в качестве негативного контроля для конструкций со "связывающим доменом". Результаты анализа представлены ниже в Таблице 2, где символы "+++" и "++" указывают на развитие яркой окраски через 20-60 минут после начала анализа, соответственно (положительные результаты связывания); а символ "-" означает отсутствие окраски через 24 часа после начала анализа (отрицательные результаты). Пустое пространство в Таблице 2 означает, что анализ на связывание не проводили).
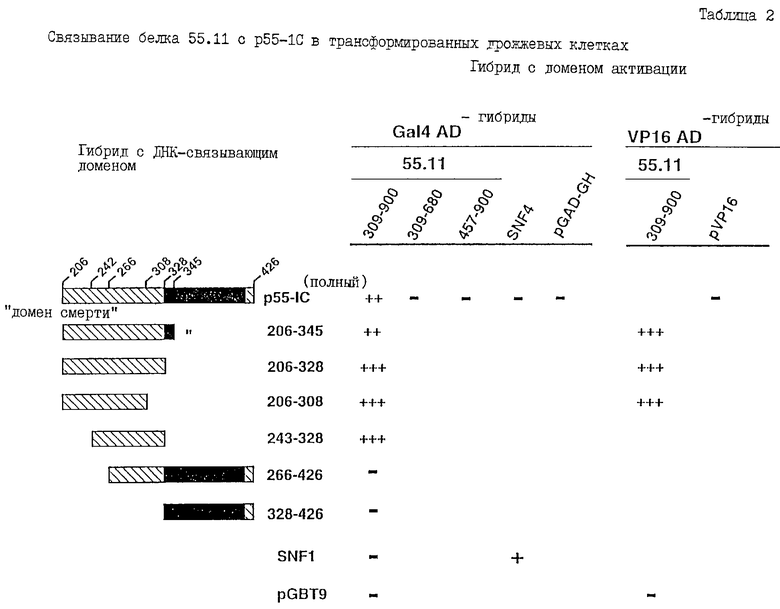
Из результатов, представленных в вышеприведенной Таблице 2, можно сделать вывод, что 55.11 связывается с р55-1С в сайте, который не относится к "домену смерти" (остатки 328-426) р55-1С.
Белок 55.11 связывался с укороченным р55-1С, из которого был делетирован "домен смерти" (конструкция 206-328 в Таблице 2), более эффективно, чем с полным р55-1С. Кроме того, этот белок даже связывался с более укороченным по С-концу р55-1С (конструкция 206-308), а также с конструкцией, из которой были удалены "домен смерти" и мембрано-проксимальная часть р55-10 (конструкция 243-328). Однако белок 55.11 не связывался с конструкцией, которая была укорочена по N-концу до аминокислоты 266 (Таблица 2). Эти данные свидетельствуют о том, что сайт связывания для 55.11 расположен в области, простирающейся между остатками 243 и 308 р55-1С, и что N-конец этого сайта связывания находится между остатками 243 и 266.
Перенос кДНК для белка 55.11 из первоначального клонированной конструкции "добычи", которая содержала домен активации GaL4, в конструкцию "добычу", содержащую домен активации Р16, не снижал эффективность связывания белка 55.11 с р55-1С (Таблица 2). Таким образом, структура (или структуры), участвующие в этом связывании, очевидно, находится в молекуле 55.11 и не включают в себя сайт слияния 55.11 с доменом активации.
Однако связывания 55.11 с р55-1С не происходит даже при ограниченном усечении белка 55.11 в его С (55.11-конструкция 309-680)-конце или N-конце (55.11-конструкция 457-900). (Остаток 309 является первым остатком в белке 55.11, кодируемым частичным кДНК-клоном, первоначально выделенным при двухгибридном скрининге).
Наблюдаемое связывание между 55.11 и р55-1С является, очевидно, специфическим, поскольку 55.11 не связывался с другими белками, включая три рецептора семейства рецепторов TNF/NGF (р75-R, FAS/APO1 и CD40), и с такими белками, как ламин и циклин % (данные не приводятся). При этом следует отметить, что из других проанализированных TNF/NGF-рецепторах белков были также протестированы те их части, которые содержали внутриклеточные домены: FAS-R человека (остатки 175-319), CD40 (остатки 216-277) и p75-TNF-R (остатки 287-461), и ни один из них не связывался с 55.11 (данные не приводятся).
с) Нозерн-анализ РНК от нескольких клеточных линий с использованием 55.11-кДНК в качестве зонда и клонирование полноразмерной 55.11-кДНК
Исследуемыми клеточными линиями были клетки HeLa, СЕМ, Jurkat и НерG2, происходящие от эпителиальной карциномы человека, острого лимфобластного Т-клеточного лейкоза, острого Т-клеточного лейкоза, и гепатоцеллюлярной карциномы, соответственно. Сначала выделенную 55.11-кДНК (нуклеотиды 925-2863) использовали в качестве зонда. Образцы состояли из 10 мкг РНК на дорожку. Результаты Нозерн-анализа показаны на фиг.2, на котором воспроизведен Нозерн-блот.
Таким образом, из фиг.2 видно, что в результате Нозерн-анализа, проведенном для нескольких клеточных линий с использованием 55.11-кДНК в качестве зонда, был выявлен один гибридизирующийся транскрипт, примерно 3 kb, который был крупнее чем кДНК (2 вb) от первоначально выделенной 55.11-кДНК. Используя олигонуклеотидные праймеры, которые соответствовали последовательности 55.11, мы клонировали с помощью PCR, 5'-простирающуюся последовательность, длина которой составляла 1 kb. Сумма длин этого 5'-простирающегося участка и первоначально клонированной кДНК-последовательности равна приблизительно длине этого 55.11-транскрипта. 3 kb-кДНК, которая включала в себя обе эти части, эффективно экспрессировалась в клетках HeLa (см. ниже) с образованием белка длиной примерно 84 кДа, что позволяет предположить, что эта 3 кb-кДНК содержит сайт инициации трансляции.
d) In vitro - связывание белка 55.11 с GST-гибридными белками, содержащими области р55-1С
Для того чтобы убедиться в том, что 55.11 действительно могут связываться с р55-1С, и что дрожжевые белки не участвуют в этом связывании, было исследовано in vitro - взаимодействие GST-р55-1С-гибридных белков, продуцированных бактериями, с белком, кодированным 3 kb - 55.11 - кДНК (полноразмерным 55.11), и продуцированным трансфецированными клетками HeLa. В этом исследовании кДНК для полноразмерных белков 55.11, FLAG-55.11 (остатки 309-900 белка 55.11, кодированного первоначально клонированной частичной кДНК, и слитого, в своем N-конце, с октапептидом FLAG), и люциферазы (контроль) экспрессировали в трансфецированных клетках HeLa, и метаболически метили [35S] Met и [35S] Cys. С GST были гибридизированы следующие белки: полноразмерный р55-1С (GST-р55-1С) и р55-1С, усеченный по С-концу до аминокислоты 345 (GsT-p55-1C345) в целях удаления "домена смерти" (см. Таблицу 2). Один GST служил в качестве контроля. Лизаты трансфецированных клеток подвергали иммунопреципитации с антителами против белка 55.11 в том случае, если для связывания с GST-гибридными белками использовали полноразмерный 55.11; или с антителами против октапептида PLAG в том случае, если для связывания с GST-гибридными белками использовали FLAG-55.11-гибридный продукт. Белки анализировали с помощью электрофореза на полиакриламидном геле с ДСН (ДСН-ПААГ: 10% акриламид), а затем подвергали авторадиографии.
На фиг.3А и 3В представлены авторадиограммы вышеуказанных ДСН-ПААГ-гелей, где на фиг.3А проиллюстрировано связывание полноразмерного белка 55.11 (55.11-full) с различными GST-гибридными белками; а на фиг.3В проиллюстрировано связывание Flag-55.11-гибридного продукта с различными GST-гибридными белками. На фиг.3А, на самой крайней дорожке справа, показан контрольный иммунопреципитат лизатов клеток, трансфецированных только одним полноразмерным 55.11 и иммунопреципитированных антителами против 55.11 (антитела α55.11). На фиг.3В на самой крайней дорожке справа показан контрольный преципитат лизатов клеток, трансфецированных лишь одним FLAG-55.11 и иммунопреципитированных антителами против FLAG (антитела α FLAG).
Таким образом, из фиг.3А и 3В видно, что белок, кодированный кДНК полноразмерного 55.11, может экспрессироваться в клетках Не La и связываться с гибридными белками, содержащими полный р55-1С (GST-р551С) или усеченный р55-1С, в котором отсутствует большая часть "домена смерти" (GST-p551C345) (фиг.3А). Полноразмерный белок 55.11 не связывался с одним GST (контроль). Аналогичным образом белок, экспрессированный в клетках HeLa и кодированный первоначально клонированной частичной кДНК для 55.11, гибридизированного с октапептидом FLAG (FLAG-55.11), связывался in vitro с GST -p551C и GST-p551C345, но не связывался с GST (фиг.3В). Приведенные выше результаты являются также дополнительным доказательством того (см. выше, п.(b)), что 55.11 связывается с участком p551C, расположенным выше "домена смерти", т.е. в области р55-1С, которая расположена ближе к трансмембранному домену.
Кроме того, вышеописанное исследование также продемонстрировало, что в соответствии с настоящим изобретением могут быть успешно продуцированы антитела против 55.11 (фиг.3А).
е) Сравнение выведенной аминокислотной последовательности белка 55.11 человека с последовательностями родственных белков, пфигутствующих в низших организмах, и особенности последовательности белка 55.11
Как упоминалось выше, в соответствии с настоящим изобретением была клонирована и секвенирована кДНК для полноразмерного белка 55.1 (см. нуклеотидную последовательность на фиг.1(а)), и из этой кДНК-последовательности была выведена полноразмерная аминокислотная последовательность 55.11 (см. аминокислотную последовательность на фиг.1(d)). Исследования последовательностей, имеющихся в банке данных (GenBank TM/ /ЕМВ1 DataBank), показали, что части последовательности 55.11-кДНК человека (per. №№Т03659, 19559 и F0128) и их мышиный гомолог (per. №№Х80422 и 231147) были уже определены в процессе произвольного секвенирования кДНК-библиотек. кДНК-последовательность (входящий №18247), которая кодирует белок человека в 596 аминокислот, пфигутствующий в культурах клеток гепатомы НС10 человека, аналогична последовательности, кодирующей белок 55.11. Однако в белке этой гепатомы отсутствует N-концевая часть (аминокислоты 1-297), соответствующая таковой в 55.11, и кроме того, этот белок отличается от 55.11 в областях, соответствующих остаткам 297-377 и остаткам 648-668 в 55.11. Исследования последовательностей, имеющихся в банке данных, также выявили, что белки, пфигутствующие в Saccharomyces cerevisiae (дрожжи), Arabidopsis thaliana (растение Резушка Таля) и Caenorhabditis elegans (гельминты). Таким образом, очевидно, что 55.11 осуществляет эволюционно консервативную функцию. В дрожжах пфигутствуют два известных белка (открытая рамка считывания УНР027с и SEN3), ДНК-последовательности которых подобны ДНК-последовательности 55.11. Размер обеих этих последовательностей также близок размеру 55.11. Последовательность УНР027с стала известной лишь благодаря секвенированию геномного клона, тогда как последовательность SEN3 была клонирована как кДНК. Сайты в 55.11, которые аналогичны сайтам в SEN3, коррелируют по своей идентичности с сайтами в УНР027с, хотя, очевидно, большая схожесть наблюдается между 55.11 и УНР027с, чем между 55.11 и SEN3. Имеющиеся данные (хотя только частичные) о ДНК-последовательностях для белков Arabidopsis thaliana и Caenorhabditis elegans ясно показывают, что эти белки схожи с 55.11, как и белок УНР027с дрожжей. Из этих четырех белков, природа которых была выявлена к настоящему времени, лишь один белок, а именно белок дрожжей SEN3 имеет ограниченную гомологию с 55.11.SEN3 был идентифицирован как дрожжевой эквивалент субъединицы р112 активатора протеосомы 20S (протеолитическая центральная часть (кор) протеосомы 26S Rechsteiner и др., 1993; DeMartino и др. 1994) (М.Р.Culbertson и М.Hockstrasser, личное сообщение).
На фиг.4 схематически проиллюстрировано сравнение выведенной аминокислотной последовательности 55.11 человека с последовательностями вышеупомянутых родственных белков, пфигутствующих в низших организмах. Последовательностями, сравниваемыми на фиг.4, являются последовательности аминокислот, предсказанных для: 55.11-кДНК (см. фиг.1(d)); открытая рамка считывания (УНР027с) в космиде, происходящей из 8-й хромосомы Saccnaromyces cerevisiae (нуклеотиды 21253-24234, номер допуска 10399); кДНК белка saccharomyces cerevisiae (номер допуска 06321); частичная кДНК белка растения Arabidopsis thaliana (резушка Таля) (номер допуска Т21500) и частичная кДНК белка нематоды Caenorhabditis elegans (номер допуска 27396). На фиг.4 последовательность "КЕКЕ" в 55.11 отмечена сплошной линией, а последовательность AYAGS(х)8 LL отмечена пунктирной линией. Сравнительный анализ первичных структур последовательностей проводили с использованием программ P1LEUP и PRETTYBOX пакета GCG. "Бреши", введенные для максимизации сравнения, обозначены точками.
Что касается отличительных признаков различных последовательностей или мотивов, пфигутствующих в последовательности 55.11 человека, были сделаны следующие наблюдения. В белке, кодированном в 55.11-последовательностью, за исключением повторяющейся последовательности "КЕКЕ", которая между Lys 614 и GLu 632 (подчеркнута на фиг.4), "мотивов" консервативной аминокислотной последовательности обнаружено не было. Такие последовательности "КЕКЕ", которые пфигутствуют во многих белках, включая протеасомные субъединицы и белки - "наставники" (chaperonins), которые могут стимулировать ассоциацию белковых комплексов (Realini - и др., 1994). Последовательность AyAGS(x)8LL 11 появляется в последовательности белка 55.11 два раза (в сайтах 479 и 590, см. фиг.4), однако какая-либо функциональная роль этой последовательности не была установлена.
f) Отличительные признаки последовательности области р55-1С, участвующей в связывании с белком 55.11
Как описано выше (см. пп. (b) и (d)), белок 55.11 связывается с областью р55-1С, расположенной между остатками 243 и 308 (N-конец этого связывающего сайта находится между остатками 243 и 266), и находящейся выше "домена смерти" и ближе к трансмембранному" домену p55-TNF-R. Эта область в р55-1С, с которой связывается белок 55.11, имеет высокое содержание пролиновых, сериновых и треониновых остатков. Однако эта область не содержит обогащенных пролиновых "мотивов" RРМ1 и RPМ2, пфигутствующих в некоторых других цитокиновых рецепторов (О'Neal Yulee, 1993). В области, которая простирается между остатками 243 и 266 и делеция которой приводит к отсутствию связывания р55-R с 55.11 (см. выше, пп (а) и (b), и Таблица 2), за двумя сериновыми остатками и двумя треониновыми остатками следуют пролиновые остатки, что делает их потенциальными сайгами для фосфорилирования МАР-киназой, CDС2 и другими пролиннезависимыми киназами (Seqer и Krebs, 1995), фосфорилирование в этом сайте рецепторов может влиять на их связывание с белком 55.11.
Принимая во внимание вышеуказанные данные, относящиеся к белку 55.11 и его связыванию с р55-1С, можно сделать вывод, что в соответствии с настоящим изобретением обнаружен новый белок, который связывается с определеной областью, расположенной выше "домена смерти" р55-1С. Это связывание должно оказывать влияние на TNP-опосредованные активности, за исключением индуцирования гибели клеток. Как было показано ранее, область, с которой связывается 55.11, участвует в индуцировании синтазы окиси азота (Tartaglia и др., 1993), и, очевидно, участвует в активации нейтральной сфингомиелиназы фактором некроза опухоли (Wiegmann и др., 1994). Таким образом, возможно, что ассоциация (связывание) белка 55.11 с внутриклеточным доменом p55-TNF-R. (p551C) оказывает влияние или участвует в (i) передаче сигнала для указанных выше или других TNF-эффектов; (ii) укладке или процессинге белка (как предполагается, исходя из схожести 55.11 с субъединицей протеасомы 26S); или ( iii) регуляции активности или экспрессии p55-TNF-R.
Пример 2
Способность к самоассоциации внутриклеточного домена р55-TNF-рецептора (р551С), его способность вызывать гибель клеток и его другие отличительные признаки и функции; и внутриклеточный домен родственных рецепторов FAS/APO1
Как указывалось выше, в Примере 1, было обнаружено, что внутриклеточный домен р55-Т Г-Р (р551С) способен связываться с самим собой, и кроме того, было установлено, что фрагменты р551С, а именно белки 55.1 и 55.3, также способны связываться с р551С.
Известно, что связывание TNF с р55-TNF-Е приводит к цитоцидному действию на клетки, несущие этот рецептор. Кроме того, антитела против внеклеточного домена этого рецептора могут сами стимулировать это действие в соответствии с эффективностью перекрестного сшивания рецептора этими антителами.
Кроме того, мутационные исследования (Tartaglia и др., 1993; Brackebuch и др., 1992) показали, что функция р55-R зависит от целостности его внутриклеточного домена. Поэтому есть основания предположить, что инициация передачи сигнала для цитоцидного эффекта TNF происходит в результате ассоциации двух или нескольких внеклеточных доменов р55-R (р55-1С), вызываемой агрегации рецепторов. Результаты, полученные в соответствии с настоящим изобретением, подтверждают этот вывод и свидетельствуют о том, что экспрессия внутриклеточного домена р55-R в клетках без трансмембранного или внутриклеточного домена стимулирует гибель этих клеток. Было показано, что такие свободные внутриклеточные домены р55-В способны к самоассоциации, что, очевидно, является причиной их способности функционировать независимо от TNF. Тот факт, что передача сигнала полноразмерным р55-R зависит от стимуляции TNF, отражает, как предполагается, активность трансмембранного или внеклеточного домена рецептора, которая способствует снижению или предупреждению этой самоассоциации.
Способность внутриклеточного домена р55-R, (р55-1С) к самоассоциации была обнаружена случайно при попытке клонировать эффекторные белки, которые взаимодействуют с этим рецептором (см. выше. Пример 1). Для этих целей был применен вышеописанный "двухгибридный" метод. При этом было обнаружено, что помимо нового белка 55.11 ассоциируется (связывается) с р55-1С, и было также обнаружено, что три других клонированных кДНК клеток HeLa содержат кДНК-последовательности, кодирующие части внутриклеточного домена р55-R, что означает, что р55-1С обладает способностью к самоассоциации. Два этих клона были идентичными и содержали вставку, которая кодирует аминокислоты 328-426 (эти клоны были обозначены клоном 55.1, кодирующим белковый фрагмент 55.1 р551С). Третий клон содержал более длинную вставку, кодирующую аминокислоты 277-426 (этот клон был обозначен клоном 55.3, кодирующим белковый фрагмент 55.4 р551С).
Кроме того, мы проводили оценку in vitro -взаимодействия между двумя продуцированными в бактериях химерами р551С, одна из которых была гибридизирована с мальтозосвязывающим белком (МВР), а другая была гибридизирована с глутатион-5-трансферазой (GST). Эти химеры были сконструированы, клонированы и экспрессированы стандартными методами. После их экспрессии, проводили оценку самоассоциации внутриклеточного домена р55-R (р551С) путем анализа взаимодействия вышеуказанных бактериально продуцированных химерных белков GST-1C55(Mr=51 кДа) и МВР-1С55 (Mr=67 кДа) друг с другом. Для этого равные количества химеры GST-1С55 (образцы дорожек 1-4 на фиг.5) или одной GST (образцы дорожек 5-8 на фиг.5) иммобилизовывали на глутатион-агарозных шариках ( Sigma), а затем инкубировали с тем же самым количеством МВР-1С55-гибридного белка в одном из следующих буферных растворов:
i) буфер 1 (20 мМ Тфиг-HCl, рН 7,5, 100 мМ KlC, 2 мМ CaCl2, 2 мМ MgCl2, 5 мМ DTT, 0,2% Тритон Х100, 0,5 мМ PMSF, 5% Глицерин). Этот буфер был использован для образцов дорожек 1 и 5 на фиг.5.
ii) буфер 1, содержащий 5 мМ EDTA вместо MgCl2. Этот буфер использовали для образцов дорожек 2 и 6 на фиг.5.
iii ) буфер 1, содержащий 250 мМ вместо 100 мМ KCl. Этот буфер использовали для образцов дорожек 3 и 7 на фиг.5.
iv ) буфер 1, содержащий 400 мМ вместо 100 мМ KCl. Этот буфер использовали для образцов дорожек 4 и 8 на фиг.5.
После инкубирования с вращением в течение 2 часов при 4°С шарики промывали этими же буферами, а затем кипятили в ДСН-ПААГ-буфере с последующим электрофорезом в ПААГ. Белки на геле подвергали Вестерн-блотированию на нитроцеллюлозную мембрану, которую затем окрашивали поликлональной антисывороткой против MBP. Указанный окрашенный Вестерн-блот изображен на фиг.5 (образцы на дорожках 1-8, описанные выше).
Из фиг.5 видно, что химера р551С-МВР связывается с химерой p551C-GST (дорожки 1-4) независимо от пфигутствия двухвалентных катионов, и даже при достаточно высокой концентрации соли (0,4 М KCl). Отсюда можно сделать вывод, что р551С обладает способностью к авидной самоассоциации.
Для оценки функциональной роли этой способности р55-1С к самоассоциации, мы предприняли попытку экспрессировать р55-1С в цитоплазме клеток, являющихся восприимчивыми к цитоцидному действию TNF. Принимая во внимание тот факт, что р55-1С, в свою очередь, может быть цитотоксичным, мы выбрали индуцибельный тип экспрессии, использовав для этого недавно разработанную строго регулируемую тетрациклин-контролируемую экспрессирующую систему млекопитающего (Gossen и Boujard 1992). Экспрессия р55-1С приводила к массовой гибели клеток (фиг.6, правая панель). У погибающих клеток наблюдается разрыхление клеточной поверхности, как это происходит при TNF-киллинге клеток. Трансфекция р55-1С-конструкции в клетки в пфигутствии тетрациклина, который заметно снижает уровень экспрессии рНD10-3-регулируемых конструкций вплоть до 105-кратного снижения, все-таки приводит к гибели некоторых клеток, хотя и в значительно меньшей степени, чем это наблюдается в отсутствие тетрациклина (фиг.6, левая панель). В противоположность этому клетки, трансфецированные контрольной конструкцией, содержащей кДНК люциферазы, не обнаруживали каких- либо признаков гибели (результаты не приводятся).
Способность р55-1С стимулировать гибель клеток, при его экспрессии без трансмембранного или внеклеточного доменов рецептора, лишний раз свидетельствует о том, что этот домен участвует в передаче сигнала. Кроме того, этот факт указывает на то, что ни одна из других частей рецептора не играет непосредственной роли в такой передаче сигнала. Исследования влияния мутаций, включая мутации, рассматриваемые в настоящем изобретении, на функцию р55-1С показали, что для этой функции наиболее важной областью является область, простирающаяся между аминокислотными остатками 326 и 407. Эта область обнаруживает заметное сходство с последовательностями внутриклеточных доменов двух других рецепторов, являющихся эволюционно родственными рецептору p55-TNF, а именно FAS-рецептора (Itoh др., 1991; Oehm и др., 1992), который также способен передавать цитоцидный сигнал; и CD40 - рецептора (Stamenkovic и др., 1989), который способствует усилению роста клеток; поэтому последовательность этой области, очевидно, содержит консервативный мотив, который играет одну из главных ролей в передаче сигнала. Поскольку не имеется похожих известных "мотивов", характерных для ферментативной активности, то, очевидно, эта область передает сигнал опосредованным образом, т.е., возможно, она служит в качестве "стыковочно-приемного" сайта для передающих сигнал ферментов или для белков, передающих стимулирующие сигналы для этих ферментов. Все р55-1С, FAS-рецептор и CD 40 могут быть стимулированы антителами против их внеклеточного домена. Эта стимуляция должна, как было показано, коррелировать со способностью антител к перекрестному связыванию с рецепторами. Поэтому, очевидно, что передача сигнала инициируется в результате взаимодействия двух или более внутриклеточных доменов, индуцируемого посредством агрегации внеклеточных доменов. Участие в таком взаимодействии рецепторов с последующей передачей сигнала было также установлено путем исследования (Brackebuch и др., 1992), показавшего, что экспрессия рецепторов, лишенных своих функций путем мутации их внутриклеточного домена, имела "доминирующее негативное" действие на функцию ко-экспрессированных нормальных рецепторов. Агрегация p55-R в ответ на действие TNF позволяет предположить, что она происходит пассивно и обусловлена лишь тем фактом, что каждая из молекул TNF, которая является гомотримером, может связываться с двумя или с тремя рецепторными молекулами. Однако данные, полученные в результате осуществления настоящего изобретения, дают основания предположить, что этот процесс протекает несколько по другому типу.
Тенденция р55-1С к самоассоциации свидетельствует о том, что этот домен играет активную роль в своей индуцированной агрегации. Кроме того, эта активность р55-1С является, очевидно, достаточной для инициации передачи сигнала, поскольку, при его экспрессии независимо от остальной части рецепторной молекулы, он может стимулировать гибель клетки в отсутствие TNF или любых других внешних стимулов. Тем не менее, при его экспрессии в качестве полноразмерного рецептора, этот р55-TNF-R не передает сигнал, если он не стимулирован TNF. Поэтому можно сделать вывод, что при активации р55-TNF-рецептора, TNF, фактически преодолевает некоторые ингибирующие механизмы, предупреждающие спонтанную ассоциацию внутриклеточных доменов, и это ингибирование обусловлено связыванием р55-1С с остальной частью рецепторной молекулы. Ингибирование может быть обусловлено ориентацией, придаваемой внутриклеточному домену трансмембранным: и внеклеточным доменом; связыванием некоторых других белков с рецептором; или, что вероятнее всего, ограничением количества рецепторов, которые могут находиться в плазматической мембране. Разумеется, что этот механизм регуляции должен быть достаточно эффективным, так как, по некоторым оценкам, связывание даже только одной TNP-молекулы с клеткой является достаточным для стимуляции ее гибели.
Спонтанная передача сигналов, независимо от лиганда, может привести к значительному нарушению процесса, регулируемого этим рецептором. Самым известным примером этого служит прекращение регуляции рецепторов фактора роста. Так, например, в неконтролируемом росте опухолевых клеток важную роль играют мутации, в результате которых инициация передачи сигнала становится спонтанной, например, мутации, вызывающие спонтанную агрегацию рецепторов. Хорошо известно, что TNP-эффекты, при их избыточном индуцировании играют важную роль в патологии многих заболеваний. Способность свободных внутриклеточных доменов (р551С) р55-TNF-рецептора к независимой от TNF передаче сигнала может вносить свой вклад в такие патологические явления. Вполне возможно, например, что цитопатическое действие некоторых вирусов и других патогенов обусловлено непрямой их цитоцидной активностью, а протеолитическим расщеплением внутриклеточного домена р55-TNF-рецептора, приводящим к TNF-подобному цитотоксическому эффекту.
Для более точного выявления области (или областей) в р551С, ответственной за его способность к самоассоциации, а поэтому за его лиганд-независимую цитотоксичность, а также для определения, имеются ли в других родственных членах семейства TNF/NGF-рецепторов (например, FAS-R) внутриклеточные домены со способностью к самоассоциации и к лиганд-независимому действию, были проведены тщательные исследования, описанные ниже.
а) Общие методы и материалы
i) Двухгибридный скрининг и двухгибридный тест на экспрессию β-галактозидазу
кДНК-вставки, кодирующие р55-1С и его делеционные мутанты, FAS-1C и различные другие белки (см. Таблицу 3) клонировали с помощью РСЦ из полноразмерных кДНК, клонированных ранее в нашей лаборатории, или из коммерчески приобретенных кДНК-библиотек. Экспрессию β-галактозидазы в дрожжах (репортерный штамм FУ526; Bartel и др., 1993), трансформированных указанными кДНК в векторах. pGBT-9 и pGAD-СН (конструкции с ДНК-связывающим доменом (DBD) и доменом активации (AD), соответственно) оценивали с помощью теста в растворе (guarente, 1983); а также проводили анализ на фильтрах для качественной оценки тех же самых результатов (не показано). Двухгибридный скрининг (Fields и Song 1989) закупленной Gа14-А1 -меченной кДНК-библиотеки клеток HeLa (Clontech, Palo Alto, Ca., U.S.А.) для белков, которые связываются с внутриклеточным доменом р55-R (р55-1С) осуществляли с использованием репортерного дрожжевого штамма НF7с в соответствии с рекомендациями производителя. Положительность выделенных клонов оценивали по (а) прототрофии трансформированных дрожжей в отношении гистидина при их культивировании в пфигутствии 5 мМ 3-аминотриазола; (b) экспрессии β-галактозидазы; и с) тесту на специфичность (взаимодействие с SNF4 и ламином, слитым с Ga14 DBD).
ii) Самоассоциация in vitro р55-1С-гибридных белков, продуцированных в бактериях
Глутатион-S-трансферазу (GST) и гибридный белок "глутатион-S-трансфераза - р55-1С (GST-p55-1C) продуцировали, как описано в литературе (Frangioni и Neel, 1993; Ausubel и др., 1994). Мальтозосвязывающие (МВР) гибридные белки получали с использованием вектора pMA1cR1 (New England Biolabs ) и очищали на колонке с амилозной смолой. Взаимодействие МВРР- и GST-гибридных белков исследовали путем последовательного инкубирования глутатион-агарозных шариков с GST- и МВРР-гибридными белками (5 мкг белка/20 мкл шариков; первое инкубирование проводили в течение 15 минут, а второе в течение 2 часов, оба при 4°С). Инкубирование с МВР-гибридными белками осуществляли в буферном растворе, содержащем 20 мМ Тфиг-HCl, рН 7,5, 100 мМ KCl, 2 мМ CaCl2, 2 мМ MgCl2, 5 мМ дитиотреитола, 0,2% Тритона Х100, 0,5 мМ фенил-метил-сульфонилфторида и 5% (по объему) глицерина; если это было необходимо, в том же самом буфере, содержащем 0,4 М KCl, или 5 мМ EDTA вместо MgCl2. Ассоциирование МВР-гибридных белков оценивали с помощью электрофореза в полиакриламидном геле с ДСН (10% акриламида) белков, связанных с глутатион-агарозными шариками, и последующего Вестерн-блоттинга. Блоты зондировали с использованием кроличьей антисыворотки против МВР (продуцированной в нашей лаборатории) и козьего антикроличьего иммуноглобулина, конъюгированного с пероксидазой хрена.
iii) Индуцированная экспрессия р55-рецептора и его фрагментов в клетках HeLa
Клетки Не La, экспрессирующие тетрациклин-контроллируемый трансактиватор, разработанный Gossen и Bujard (клон HtTA-1 (Gossen и Bujard, 1992)), культивировали в модифицированной по способу Дульбекко среде Игла, содержащей 10% фетальную телячью сыворотку, 100 мк/мл пенициллина, 100 мкг/мл стрептомицина и 0,5 мг/мл неомицина. кДНК-вставки, кодирующие р55-R или его фрагменты, вводили в тетрациклин-контроллируемый экспрессирующий вектор (pUHD 10-3, любезно предоставленный H.Bujard). Клетки трансфецировали экспрессионной конструкцией (5 мкг ДНК/6 см чашку) методом осаждения фосфатом кальция (Ausubel и др., 1994). Результаты кратковременной экспрессии трансфецированных белков оценивали через соответствующие промежутки времени после трансфекции в пфигутствии или в отсутствие тетрациклина (1 мкг/мл). Клоны клеток, стабильно трансфецированных р55-1С-кДНК человека в векторе ptHA 10-3, подтверждали путем трансфекции кДНК в клетки HtTA-1 в пфигутствии тетрациклина вместе с плазмидой, несущей резистентность к гигромицину, и последующего отбора на клоны, резистентные к гигромицину (200 мкг/мл). Экспрессию кДНК получали путем удаления тетрациклина, который в других случаях постоянно пфигутствовал в среде для роста клеток.
iv) Оценка TNF-подобных эффектов, стимулированных индуцированной экспрессией р55-R и его фрагментов
Влияние индуцированной экспрессии рецептора и TNF на жизнеспособность клеток оценивали методом поглощения нейтрального красного (Wallach, 1984). Индуцирование экспрессии гена 1L-8 оценивали методом Нозерн-анализа. РНК выделяли с использованием ТР1 PEAGENT (Molecular Research Center, Inc.), затем денатурировали в формальдегид/формамидном буфере, подвергали электрофорезу на агарозном/формальдегидном геле, и блокировали на мембрану Gene Screen Plus (Du Pont) в 10 х РЕ-буфере с использованием стандартной техники. Фильтры гибридизировали с 1L-8-кДНК-зондом (Matsushima и др., 1988) (нуклеотиды 1-392), подвергали радиоактивному мечению с использованием набора для произвольного праймирования ( Bcehringer Manheim Biochemica Mannheim, Germany), и промывали в жестких условиях в соответствии с инструкциями производителя. Авторадиографию осуществляли в течение 1-2 дней.
v) Оценка экспрессии рецептора TNF
Экспрессию TNF-рецептора в образцах 1×106 клеток оценивали путем измерения связывания TNF, меченного С [1251] по ранее описанному методу с использованием хлорамина-Т (Holtmann и Wallac, 1987). Был также проведен анализ EL1SA, осуществленный, как описано в литературе для количественной оценки растворимых TNF-рецепторов (Aderka и др., 1991), за исключением того, что для лизиса клеток (70 мкл/106 кл.) и для разведения тестируемых образцов использовали буфер R1РА (10 мМ Тфиг-HCl, рН 7,5, 150 мМ NaCl, 1% NP-40,1% дезок-сихолат, 0,1% ДСН, и 1 мМ EDTA). Растворимая форма р55-R, выделенная из мочи, служила в качестве стандарта.
о) Мутационный анализ внутриклеточного домена p55-R (р55-1С) для определения областей р55-1С, участвующих в самоассоциации
Как указывалось выше, р55-1С обладает способностью к самоассоциации, и имеются такие области р55-1С, которые сами способны связываться с полноразмерным р55-1С. В частности, был идентифицирован один из фрагментов р55-1С (обозначенный белковым фрагментом 55.1 в Примере 1, см. выше), который способен к прочному связыванию с полноразмерным р55-1С; при этом после секвенирования этого фрагмента было установлено, что он расположен между аминокислотными остатками 328 и 426 р55-TNF-рецептора и находится в р55-1С. Кроме того, было установлено (см. ниже), что вышеуказанная область, а именно фрагмент 55.1 сам способен к самоассоциации и стимуляции цитотоксических эффектов на клетках. Поэтому эта область р55-1С была названа "доменом смерти", который расположен между аминокислотными остатками 328-426 р55-R человека, а по всей вероятности, состоит из аминокислотных остатков, находящихся между примерно остатком 328 и 414.
Тот факт, что "домен смерти" в р55-1С способен к самоассоциации, был обнаружен случайно. После скрининга кДНК-библиотеки клеток HeLa с использованием двухгибридной техники (см. выше, Пример 1) в целях выявления последовательностей, кодирующих белки, которые связываются с внутриклеточным доменом этого рецептора, было обнаружено среди кДНК, продукты которых специфически связывались с гибридным белком "внутриклеточный домен - GALA DBD)", несколько клонов (например, 55.1 и 55.3), непосредственно кодирующих области внутриклеточного домена р55-R (р55-1С; отмечен звездочками в Таблице 3).
С использованием двухгибридного теста для оценки степени специфичности при самоассоциации р55-1С и для более точного определения области, участвующей в этой самоассоциации, были получены следующие данные (таблица 3): а) самоассоциация р55-1С ограничивается областью, находящейся в "домене смерти". Ее N-конец расположен между остатками 328 и 344, а ее С-конец расположен вблизи остатка 404 и несколько выше от С-конца (как указано в литературе) этого домена (остаток 414). (b) Делеция мембране проксимальной области р55-1С, расположенной выше "домена смерти", способствует усилению самоассоциации, что дает основание предположить, что эта область оказывает ингибирующее действие на ассоциацию, с) Мышиный р55-1С способен к самоассоциации, а также к связыванию с "доменом смерти" р55-R человека. d) Исследования самоассоциации внутриклеточных доменов трех других рецепторов, принадлежащих к семейству TNF/GF-рецепторов, а именно рецептора FAS/APO1 (FAS-R), CD40 (Fields u Song 1989) и p75-TNF-рецептора (Smith и др., 1990), показали, что FAS-1C, который передает цитоцидный сигнал с помощью определенной последовательности -"мотива", родственного "домену смерти" р55-R, способен к самоассоциации, и до нескоторой степени к ассоциации с р55-1С. Однако CD40-1С, который обеспечивает передачу рост-стимулирующих сигналов (даже несмотря на то, что он также содержит последовательность, похожую на "домен смерти"), и р75-1С, который структурно не похож на р55-1С, не имеют тенденцию к самоассоциации, и не связываются с р55-1С или FAS-1C.
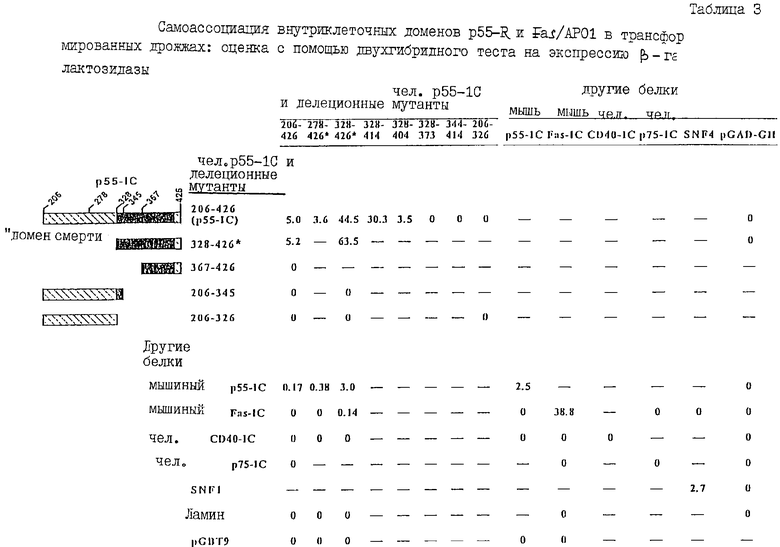
В вышеприведенной Таблице 3 проиллюстрирован количественный анализ взаимодействия Gа14-гибридных конструкций, включающих в себя следующие белки: внутриклеточный домен человека р55-R и его различные делеционные мутанты (остатки были пронумерованы, как в работе Loetscher и др. (1990); мышиные внутриклеточные домены р55-R (остатки 334-454; пронумерованы как в работе Goodwin и др., 1991); мышиный FAS/APO1 (FAS 1C, остатки пронумерованы как в работе Watanabe - Fukanaga и др., 1992); чел. CD40 (CD40-1C, 216-277, остатки пронумерованы, как в работе, Stamenccvic и др., 1989); и чел. р75-TNF-рецептор (р75-1С, 287-461, остатки пронумерованы как в работе Smcth и др., 1990). SNF1 и SANF4 были использованы в качестве позитивных контролей для ассоциации (Fild и Sond 1989), а ламин был использован в качестве негативного контроля (Bartel и др., 1993). Белки, кодируемые Gа14-AD-конструкциями (pGPT9), даны в вертикальной столбце, а белки, кодируемые Ga14-А1-конструкциями (pGAD-CH), даны горизонтально. Два делеционных мутанта, отмеченные звездочками, были клонированы путем двухгибридного скрининга кДНК-библиотеки клеток BeLa (Clontech, PalO Alto, Ca., U.S.А.) с использованием р55-1С, клонированного в pGBT9, в качестве "приманки". В этом скрининге четыре из около 4×106 исследованных кДНК-клонов оказались положительными. При этом было установлено, что три из этих клонов соответствуют участкам кДНК для р55-R человека (два идентичных клона, кодирующие остатки 328-426, и один клон, кодирующий остатки 277-426). Четвертый клон, как было обнаружено, кодировал неизвестный белок. Данные о экспрессии β-галактозидазы были получены как средние значения из анализов двух независимых трансформантов, и представлены как количество β-галактозидазного продукта (единицу активности определяли как ОП420×103/ОП600 дрожжевой культуры, а реакционное время дано в минутах. Предел детекции в данном анализе составлял 0,05 ед. Отклонения между дубликатными образцами, во всех случаях, составляли менее 25% от среднего значения (не определяли).
In vitro тест на взаимодействие бактериального гибридного белка "р55-1С-глутатион- S -трансфераза (GST)" с гибридным белком "р55-1С-мальтозосвязывающий белок (МВР)" подтвердил, что р55-R способен к самоассоциации, и исключил участие дрожжевых белков в этом связывании (см. выше). На указанную самоассоциацию не оказывали влияния ни повышенные концентрации соли, ни EDTA (см. выше).
Для оценки функциональной роли самоассоциации "домена смерти" мы исследовали механизм, по которому индуцированная экспрессия р55-R или его фрагментов влияет на клетки, восприимчивые к TNF-цитотоксичности. Результаты этого анализа показаны на фиг.7, на котором проиллюстрирована лиганд-независимая стимуляция цитоцидного эффекта в клетках HeLa, трансфецированных p55-R, его внутриклеточным доменом (р55-1С) или его фрагментами (включая "домен смерти").
На фиг.7 схематически показаны различные ДНК-молекулы, кодирующие различные типа TNF-рецепторов, включенных в векторы, которыми были трансфецированы клетки HeLa (с левого края фиг.7); экспрессия (левый и средний столбцы); а также жизнеспособность (правый столбец) клеток HeLa, экспрессирующих кратковременно различные полноразмерные белки p55-R, р55-1С, или фрагменты р55-1С, либо в качестве контроля, люцеферазу (luc) (каждый из них показан с левой стороны фиг.7), при этом экспрессию осуществляли с использованием тетрациклин-контроллируемого экспрессирующего вектора. Незаштрихованные прямоугольники (в левом, среднем и правом столбцах) на фиг.7 соответствуют клеткам, трансфецированным в пфигутствии тетрациклина (1 мкг/мл), который ингибирует экспрессию; а заштрихованные прямоугольники (в левом, среднем и правом столбцах) на фиг.7 соответствуют клеткам, трансфецированным в отсутствие тетрациклина. Экспрессию TNF-рецептора оценивали через 20 часов после трансфекции с использованием ELISA, и антител против внеклеточного домена рецептора (см. схематическую иллюстрацию на левой стороне фиг.7), а также путем определения связывания радиоактивно меченного TNF с клетками (средний столбец). Цитоцидный эффект трансфецированных белков оценивали через 48 часов после трансфекции. Данные приводятся для 1-3 экспериментов с аналогичными количественными результатами, где каждую конструкцию использовали в дубликате. "ND" = " не определяли".
Таким образом, из фиг.7 видно, что при использовании экспрессирующего вектора, осуществляющего строго контролируемую экспрессию трансфецированных кДНК с помощью тетрациклин-регулируемого трансактиватора (Gossen и Bujard, 1992), простое увеличение экспрессии р55-R в клетках HeLa посредством кратковременной экспрессии трансфецированной кДНК, кодирующей полноразмерный рецептор, приводит к массивной гибели клеток. При экспрессии лишь одного р55-1С наблюдалась даже более высокая цитотоксичность. Значительный уровень цитотоксичности наблюдался также при экспрессии лишь части р55-1С, содержащей, в основном, "домен смерти" (остатки 328-426), в клетках HeLa. С другой стороны, экспрессия фрагментов р55-1С, в которых отсутствует "домен смерти" или содержится лишь его часть (или экспрессия гена люциферазы, используемого как нерелевантный контроль), не оказывала какого-либо действия на жизнеспособность клеток. Цитотоксичность р55-1С была, кроме того, подтверждена использованием клеток, стабильно трансформированных его кДНК. Эти клетки продолжали свой рост в случае, когда не индуцировалась экспрессия р55-1С, но при экспрессии р55-1С, клетки погибали (см. выше).
с) Другие функции внутриклеточного домена р55-TNF-рецептора
Для того, чтобы определить, стимулируются ли другие функции TNF самоассоциацией внутриклеточного домена, включающего "домен смерти", мы проанализировали действие повышенной экспрессии полноразмерного рецептора (p55-R) и экспрессии внутриклеточного домена рецептора 9р55-1С) на транскрипцию интерлейкина-8 (1L-8), которая, как известно, активируется TNF (Matsushima и др., 1988). Результаты этого исследования представлены на фиг.8, на котором проиллюстрировано лиганд-независимое индуцирование экспрессии гена 1L-8 в клетках HeLa, трансфецированных р55-R или р55-1С с использованием тетрациклинконтроллируемой конструкции (см. также "Общие методы и материалы, и Пример 1). На панели А фиг.8 проиллюстрирован Нозерн-блот-анализ (см. выше, главу "Общие методы и материалы) РНК (7 мкг/дорожка), экстрагированной из клеток HeLa (HT а-1), необработанных ("контроль") или обработанных ("TNF") TNF (500 мк/мл, 4 часа), или клеток HTta-1 через 24 часа после трансфекции (в пфигутствии или в отсутствие тетрациклина) кДНК для р55-1С ("р55-1С"), р55-R ("Р55-R"), или люциферазы ("LUC"). На панели В фиг.8 проиллюстрирован Нозерн-блот-анализ, где проводили окрашивание IS.S-pPHK метиленовым синим в каждом из образцов, показанных на панели А фиг.8.
Таким образом, как видно из фиг.8, трансфекция клеток HeLa тетрациклин-контроллируемой конструкцией, содержащей р55-R-кДНК, индуцировала транскрипцию 1L-8. В клетках, трансфецированных кДНК для р55-1С, наблюдалось даже более сильное индуцирование. В обоих случаях индуцирование происходило только при отсутствии тетрациклина в среде роста, что свидетельствует о том, что это индуцирование является результатом экспрессии трансфецированного р55-R или р55-1С. Трансфекция клеток кДНК люциферазы, используемой в качестве контроля, не оказывала какого-либо влияния на транскрипцию гена 1L-8.
Исходя из вышеуказанных результатов, очевидно, что простое увеличение экспрессии p55-R или даже экспрессии только его внутриклеточного домена (р55-1С) является достаточным для индуцирования лиганд (TNF)-независимой цитотоксичности и других эффектов, включая также увеличение экспрессии гена 1L-8 в клетках. Индуцирование этих эффектов, по всей вероятности, обусловлено самоассоциацией внутриклеточного домена р55-R (р55-1С). Поскольку, как указывалось выше, очевидно, что после самоассоциации р55-1С его "домен смерти", в первую очередь, ответственен за передачу сигнала, то возможно, что индуцирование внутриклеточных процессов, приводящих к стимуляции цитотоксичности в клетках, а также других эффектов, например, индуцирование экспрессии гена 1L-8, опосредовано другими областями р55-1С после их самоассоации. Поэтому вполне возможно, что различные области р55-1С ответственны за различные TNF-индуцированные эффекты (например, цитотоксичность и индуцирование экспрессии гена 1L-8) в клетках, где указанные эффекты стимулируются в ответ на внутриклеточную передачу сигнала после самоассоциации р55-1С.
Тот факт, что р55-1С способен индуцировать лиганд (TNF) - независимую стимуляцию других внутриклеточных эффектов, например, индуцирование экспрессии гена 1L-8, означает, что р55-1С или его специфические фрагменты могут быть использованы в качестве высокоспецифического инструмента для осуществления нужных эффектов в клетках или тканях, не прибегая, при этом к обработке этих клеток или тканей TNF. При многих патологических состояниях (например, злокачественные опухоли) обработка клеток фактором некроза опухолей (TNF), особенно в высоких дозах, может приводить к нежелательным побочным эффектам, системно индуцированным TNF после его связывания со своим рецептором. Благодаря настоящему изобретению было установлено, что р55-1С может имитировать другие специфические TNF-индуцированные эффекты (помимо цитотоксичности), например, индуцирование 1L-8, что открывает возможность клетко- или тканеспецифического введения р55-1С или его специфических фрагментов, которые способны к передаче сигнала для индуцирования желательных специфических внутриклеточных эффектов, например, индуцирование 1L-8, и тем самым дает возможность избежать возникновения побочных эффектов, часто наблюдаемых в процессе TWF-обработки.
d) Лиганд-независимая стимуляция цитоцидных эффектов в клетках НеЬа, индуцированная внутриклеточными доменами и "доменами смерти" p55-TNF-R и PAS-R (FAS/APO1)
Что касается цитотоксической активности внутриклеточных доменов р55 TNF-R, и FAS-R (р551С и FAS-1C), то в соответствии с настоящим изобретением было также обнаружено, что р551С, его "домен смерти" (р55DD) и FAS-1C обладают способностью к лиганд-независимой стимуляции цитоцидного эффекта в клетках HeLa. Для этого клетки HeLa были трансфецированы экспрессирующими векторами, содержащими различные конструкции либо их полноразмерного p55-TNF-R, его фрагментов, включая р551С и р55DD, либо из PAS-1C. В одном из экспериментов, клетки HeLa были котрансфецированы конструкциями, содержащими р55-TNF-R (p55-R) и FAS-1C (более подробно, эти конструкции и их получение описаны выше). Результаты этого исследования представлены на фиг.9 (А и В), где на левой стороне панелей А и В фиг.9 схематически показаны конструкции, использованные для трансфекции клеток HeLa; в двух средних столбцах этих панелей (второй и третий слева) графически представлены результаты экспрессии рецептора TNF или FAS; а в первой части панелей графически представлены результаты исследования жизнеспособности трансфецированных клеток. На фиг.9А представлены результаты для трансфецированных клеток HeLa, экспрессирующих (при кратковременной экспрессии) полноразмерный p55-R, р55-1С или его фрагменты, либо, в качестве контроля, люциферазу (LUC), причем во всех случаях использовали вектор тетрациклин-контролируемой экспрессии. На фиг.9В представлены результаты для трансфецированных клеток HeLa, экспрессирующих (при кратковременной экспрессии) лишь один FAS-1C или вместе с р55-R; причем эти результаты были получены с использованием вектора тетрациклин-контролируемой экспрессии. На диаграмме, изображенной на фиг.9А и 9В, незаштрихованные прямоугольники соответствуют клеткам, трансфецированным в пфигутствии тетрациклина (1 мкг/мл), который ингибирует экспрессию, а заштрихованные прямоугольники соответствуют клеткам, трансфецированным в отсутствии тетрациклина. Экспрессию рецептора TNF оценивали через 20 часов после трансфекции посредством анализа ELISA с использованием антител против внеклеточного домена рецептора (см. левую часть панелей), и путем определения связывания радиоактивно меченного TNF с клетками (средние части панелей). Цитоцидный эффект трансфецированных белков оценивали через 48 часов после трансфекции. Данные приводятся из 1-3 экспериментов с аналогичными количественными результатами, где каждую конструкцию тестировали два раза. "ND" означает "не определяли". Из результатов, представленных на фиг.9А и 9В, видно, что при экспрессии лишь одного р551С наблюдалась даже более высокая цитотоксичность. Значительный уровень цитотоксичности также наблюдался при экспрессии лишь "домена смерти" (р55DD). В противоположность этому, экспрессия фрагментов р551С, в которых отсутствовал "домен смерти" или содержался лишь его фрагмент, не влияла на жизнеспособность клеток. Экспрессия FAS-1C не приводила к значительной цитотоксичности, но при этом она усиливала цитотоксичность ко-экспрессированного р55-R.
Пример 3
Другие белки, обладающие способностью связываться с внутриклеточными доменами p55-TNF-R или FAS-R
С использованием методики, описанной выше в Примере 1 были выделены и идентифицированы еще три белка, способные связываться с р551С или FAS-1C.
На фиг.10-12 схематически изображена частичная и предварительная нуклеотидная последовательность кДНК-клонов, обозначенных Р2, Р9 и DD 11, соответственно.
Клоны F2 и F9 были выделены путем скрининга библиотеки мышиных эмбрионов с использованием мышиного FAS-1C в качестве "приманки". На фиг.10 схематически показана частичная нуклеотидная последовательность из F2-кДНК, которая была секвенирована. На фиг.11 схематически показана частичная нуклеотидная последовательность из 1724 оснований от F9-КДНК, которая была секвенирована. Анализ связывающей способности белков, кодируемых клонами F2 и F9 (Р2 и F9, соответственно), показал, что:
а) F2 сильно взаимодействует с р551С и р55DD человека и с FAS-1C мыши, но при этом он слабо взаимодействует с нерелевантными(контрольными) белками SNF1 и ламином, а также с релевантным (т.е. рассматриваемым в настоящем изобретении) белком FAS-1C человека;
b ) F9 сильно взаимодействие с чел. р 55-1С и мышиным FA-1C но слабо взаимодействует с чел. РА-1С (релевантный белок) и нерелевантными (т.е. не относящимися к настоящему изобретению) белками SNF1 и ламином;
с) Ни один из F2 и F9 не взаимодействует с чел. р751С, pGBT9 ("пустой" вектор- "приманка") или чел. CD-40.
Кроме того, исследования банков данных для генов и белков ("Gene Bank" и "Prcteinbank") показали, что F2 и F9 являются новыми белками.
Такими образом, F2 и F9 представляют собой новые белки, специфично связывающиеся с FAS-1C и р551С.
Клон DD11 был выделен путем скрининга HeLa-библиотеки человека с использованием в качестве "приманки" р55DD) На фиг.12 схематически показана частичная нуклеотидная последовательность из 425 оснований от DD11-кДНК, которая была секвенирована.
Клон DD11 имеет длину приблизительно 800 нуклеотидов. Полноразмерный транскрипт, длина которого составляет приблизительно 12 кb, был зондирован с использованием этого клона. Анализ связывающей способности белка, кодированного клоном DD11, показал, что DD11 сильно взаимодействует с р55DD (аминокислоты 326-414) (см. фиг.9) и не взаимодействует с делеционными мутантами этого домена, например, с "а.к.326-404". DD11 также взаимодействует с мышиным и чел. FAS-1C, и до некоторой степени с ламином. Однако DD 11 не взаимодействует ни с SNF1, ни с pGBT9 ("пустой" вектор-"приманка"). Кроме того, он не был обнаружен ни в одном из банков данных ("Gene Bank" и "Proteinbank"). таким образом DD 11 представляет собой белок, специфически связывающийся с р551С (р551DD) и FAS-1C.
Пример 4 Конструирование растворимых димерных рецепторов TNF
Исходя из данных, полученных выше в Примере 2, на основании которых было установлено, что внутриклеточный домен p55-R (р55-1С) и его часть ("домен смерти"), а также внутриклетоный домен FAS/APO1 и его часть (также именуемая "доменом смерти"), похожая на "домен смерти" р55-1С, обладают способностью к самоассоциации, стало очевидным, что можно сконструировать новые TWF-рецепторы, которые способны к самоассоциации (агрегации), и которые являются растворимыми. Такими рецепторами могут быть гибридные белки, содержащие, в основном, весь внеклеточный домен p55-R, соединенный, в основном, с полным внутриклеточным доменом или его "доменом смерти" p55-R или FAS/APO1. Такие конструкции не содержат трансмембранный домен p55-R (FAS/AP01), а поэтому они являются растворимыми. Кроме того, благодаря способности к самоассоциации внутриклеточных доменов или их "доменов смерти" эти гибридные конструкции будут обладать способностью к олигомеризации с образованием, по крайней мере, димеров (а возможно и мультимеров более высокого порядка) p55-R. В соответствии с этим, такие димерные TNF-рецепторы (p55-R) будут способны связываться, по крайней мере, с двумя мономерами натурального гомотримера TNF, и тем самым образовывать растворимый TNF-рецептор, связывающийся с высокой степенью авидности со своим лигандом (гомотримерным TNF).
Исходя из вышеуказанного, могут быть сконструированы четыре типа р55-TNF-рецепторных гибридных белков, каждый из которых обладает способностью к олигомеризации и является растворимым:
i) Гибридный продукт, образованный между внеклеточным доменом р55-В, (ЕС55) и внутриклеточным доменом р55-R (р55-1С);
ii) Гибридный продукт, образованный между ЕС55 и "доменом смерти" р55-1С (DD55);
iii) Гибридный продукт, образованный между ЕС55 и внутриклеточным доменом FAS/APO1 (1CFAS); и
iv) Гибридный продукт, образованный между ЕС55 и "доменом смерти" 1CFAS (DDFAS).
В каждом из вышеуказанных гибридных белков, способность к связыванию с мономером TNF обеспечивается ЕС55-частью белка, тогда, как олигомеризация (или, по крайней мере, димеризация) каждого из указанных типов белков обеспечивается его "хвостовой" частью, являющейся любой из областей р551С, DD55, 1CFAD или DDFAS.
Для конструирования вышеуказанных гибридных белков может быть использована стандартная техника рекомбинантных ДНК, которая в настоящее время широко используется специалистами (см. например, Sambrook и др., (1989) Molecular Cloning A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.). Для этих целей может быть использован любой подходящий экспрессирующий вектор (система клонирования или плазмида, предназначенная для экспрессии выбранной инсертированной ДНК), который происходит от бактерий, бактериофагов, или вирусов животных, и в который может быть введена, в одну или несколько стадий, ДНК, кодирующая EС55 и один из "хвостов", являющихся р55-1С, DD 55, 1CFAS или DDPAS. Инсертированная таким образом ДНК, кодирующая каждый из гибридных белков, может быть помещена под контроль различных регуляторных последовательностей системы клонирования или плазмиды, например, таких, как промоторы, сайты связывания с рибосомой, сайты связывания факторов транскрипции, и т.п. Выбор таких регулирующих экспрессию последовательностей зависит от типа выбранного экспрессирующего вектора, а следовательно от типа клетки-хозяина (эукариотической или прокариотической), а которой желательно экспрессировать гибридные белки настоящего изобретения. Предпочтительными клетками-хозяевами (а следовательно, и экспрессирующими векторами) являются эукариотические клетки, а в частности, клетки млекопитающих.
ДНК-молекула, кодирующая каждый из вышеуказанных гибридных белков, может быть получена и инсертирована в экспрессирующий вектор нижеследующих процедур;
а) Сначала, с использованием стандартной техники, конструируют серию олигонуклеотидов для использования в полимеразной цепной реакции, где указанными олигонуклеотидами являются;
1) АСС ATG GGC СТС ТСС АСС GTG (EC55, смысловой), SEQ ID NO: 1;
2) ACGC GTC GAC TGT G,QT G.CC TGA QTC СТС (ЕС55, антисмысловой), SEQ ID NO: 2;
3) ACGC GTC GAC CGC TAG CAA CGG TGG AAG (1C55, смысловой), SEQ ID NO: 3;
4) TCA TCT GAG AAG ACT GGG (1C55, антисмысловой), SEQ ID NO: 4;
5) ACGC GAG GAC AAG AGA AAG GAA СТА CAG (1CFA, смысловой), SEQ ID NO: 5;
6) СТА GAC CAA GCT TTG GAT (1CFA, антисмысловой), SEO ID NO: 6;
7) ACCC CTC CAC CCC CCC ACC CTC TAC CCC (DD55; смысловой), SEQ ID NO: 7;
8) ACGC GTC GAC GAT CTT CAC TTG ACT AAA (DDFA, смысловой), SEQ ID NO: 8.
b) Плазмиды, содержащие клоны полноразмерного р55-R, и FAS/APO1-рецептора, и полученные в нашей лаборатории (см. также одновременно рассматриваемую заявку ЕР568925 и Примеры 1-3 настоящей заявки), подвергают нижеследующим манипуляциям с получением ДНК-фрагментов, которые кодируют каждый из гибридных белков, и которые затем лигнруют в вышеуказанный выбранный экспрессирующий вектор;
i) Для получения ДНК-фрагмента, кодирующего ЕС55, который является компонентом всех четырех гибридных белков, осуществляют РСК на плазмиде, несущей кДНК чел. р55, с использованием вышеуказанных олигонуклеотидов №№1 и 2 (размер фрагмента составляет 640 п.о.).
ii) Для получения гибридного продукта ЕС55-1С55, осуществляют PCR на плаэмиде, несущей кДНК чел. р55, с использованием олигонуклеотида НФ 3 и 4, в результате чего получают ДНК-фрагмент, кодирующий 1С55 (размером 677 п.о.), который затем смешивают с ЕС55, гидролизованным ферментом Sall, и лигируют по тупым концам в любой экспрессирующий вектор под контроль соответствующего промотора. Ориентацию последовательности ЕС55-1С55, инсертироаанный в вектор, проверяют путем рестрикционного гидролиза и путем секвенирования.
iii) Для получения гибридного продукта ЕС55-1С FA продуцируют 1CFAS с помощью PCR на плазмиде, несущей кДНК для FAS, с использованием олигонуклеотида №№5 и 6, в результате чего получают фрагмент (размером 448 п.о.), который затем разрезают ферментом Sall и смешивают с ЕС55, разрезанным ферментом Sall, после чего лигируют по тупым концам в экспрессирующий вектор под контроль соответствующего промотора. Ориентацию инсертированного EC55-1CFAS в векторе проверяют путем рестрикционного гидролиза и секвенирования.
iv) Для получения гибридного продукта ЕС55-DD55 продуцируют ДНК-фрагмент, содержащей DD 55-последовательность, с помощью PCR на кДНК, кодирующей чел.р55, и с использованием олигонуклеотида №№7 и 4. Полученный продукт размером 314 п.о. разрезают ферментом Sall и смешивают с ЕС55, разрезанным DD11, после чего лигируют по тупым концам в экспрессирующий вектор млекопитающего. Ориентацию инсертированного продукта ЕС55-DD55 в векторе проверяют путем рестрикционного гидролиза и секвенирования.
v) Для получения гибридного продукта ЕС55-DD FAS продуцируют ДНК-фрагмент, кодирующий DDFAS с помощью PCR на FAS-кДНК с использованием олигонуклеотида №№6 и 8. Полученный продукт размером 332 п.о. разрезают ферментом Sall и смешивают с ЕС55, гидролизованным all, после чего лигируют по тупым концам в экспрессирующий вектор млекопитающего. Ориентацию инсертированного продукта EC55-DDFAS в векторе проверяют путем рестрикционного гидролиза и секвенирования.
После конструирования вышеописанных экспрессирующих векторов они могут быть введены, в целях их экспрессии, в подходящие клетки млекопитающих (например, клетки яичника китайского хомячка (СНО), или клетки почки обезьяны (COS)) с использованием стандартных методов. Экспрессированные таким образом гибридные белки могут быть очищены стандартными методами (см. одновременно рассматриваемые заявки ЕР308378; ЕР 398327; и ЕР568925). Очищенные гибридные белки могут быть затем проанализированы на их способность к олигомеризации (и степень такой олигомеризации, т.е. способность белков образовывать димеры или мультимеры более высокого порядка), а также на их способность связываться с TNF (и аффинность или авидность такого связывания).
Пример 5
Конструирование растворимых димерных рецепторов FAS/APO1
Способом, аналогичным способу, описанному в Примере 4, могут быть продуцированы четыре типа гибридных FAS/АРO1-белков, каждый из которых обладает способностью к олигомеризации и является растворимым; а именно:
i) Гибридный продукт, образованный между внеклеточным доменом FAS/APO1 (EC FAS) и внутриклеточным доменом р55-1С;
ii) Гибридный продукт, образованный между ЕС FAS и "доменом смерти" р55-1С (DD 55);
iii) Гибридный продукт, образованный между ЕС FAS и внутриклеточным доменом FAS/APO1 (1C FAS); и
iv) Гибридный продукт, образованный между ЕС FAS и "доменом смерти" 1C FAS (DD FAS).
В каждом из вышеуказанных гибридных белков способность к связыванию с лигандом FAS обеспечивается ЕС FAS-частью белка, тогда как олигомеризация (или, по крайней мере, димеризация) каждого из указанных типов гибридных белков обеспечивается его "хвостовой" частью, являющейся любой из областей р55-1С, DD55, 1C FAS, или DD FAS.
Конструкции ДНК-фрагментов, кодирующих вышеуказанные гибридные белки, и экспрессирующие векторы, содержащие эти конструкции, могут быть получены, как описано в Примере 4, за исключением того, что при этом должны использоваться другие подходящие олигонуклеотиды (не показаны), после чего эти конструкции могут быть использованы для получения фрагмента ЕС FAS, предназначенного для лигирования с любой из вышеуказанных "хвостовых" частей. После этого экспрессирующие векторы могут быть введены в подходящие клетки-хозяева, и полученные в результате экспрессии гибридные белки могут быть очищены и проанализированы на их способность к олигомеризации (и степень такой олигомеризации, т.е. на способность этих белков образовывать димеры или мультимеры более высокого порядка), а также на их способность связываться с FAS-лигандом (и аффинность или авидность такого связывания).
Пример 6
Конструирование растворимых олигомерных "смешанных" рецепторов TNF/FAS
В целях получения олигомерных рецепторов, обладающих "смешанной" аффинностью, т.е. сродством двум лигандам, TNF и FAS-R-лиганду, вышеупомянутые гибридные белки (Примеры 4 и 5) могут быть использованы в нижеследующих процедурах:
i) получение гибридного продукта, описанного в Примере 4, и содержащего внеклеточный домен TNF-R (р75 TNF или р55-TNF-R), соединенный с одним из: р55-1С, FAS-1C, p55DD, или FASDD;
ii) получение гибридного продукта, описанного в Примере 5 и содержащего внеклеточный домен FAS-R, соединенный с одним из: р551С, FAS-1C, р55DD, или PAS-DD; и
iii) смешивание любого одного из гибридных продуктов (i) с любым одним из гибридных продуктов (ii) для получения нового димерного (или олигомерного более высокого порядка) рецептора, который содержит оба внеклеточных домена TNF-R и FAS-R, соединенные посредством их -1C или -DD-областей.
В вышеуказанных процедурах гибридные продукты (i) и (ii) могут быть получены отдельно, а именно, в результате их выделения из трансформированных клеток, в которых они были продуцированы, а затем эти продукты могут быть смешаны in vitro с образованием рецепторов со "смешанной" аффинностью. Альтернативно клетки-хозяева могут быть трансфецированы векторами, несущими последовательности, кодирующие гибридные белки обоих типов; причем в этом случае рецепторы со "смешанной" аффинностью могут быть получены непосредственно из ко-трансфецированных клеток. Фактически, олигомеризация гибридных продуктов с образованием олигомерных рецепторов может происходить в клетках во время или после процедуры очистки, в результате чего могут быть получены гибридные продукты, экспрессированные в клетках. Для специфического отбора рецепторов со "смешанной" аффинностью может быть применен любой известный метод, например аффинная хроматография, в которой для выявления рецепторов, имеющих внеклеточные домены обоих типов, используют, в последовательных хроматографических стадиях, антитела против внеклеточных доменов TNF-R и FAS-R.
Ссылки
REFERENCES
Aderka, D., Englemann, H., Homik, V., Skornick, Y., Levo, Y., Wallach, D. and Kushtai, G. (1991) Cancer Res. 51, 5602-5607.
Baens et al. (1993) Genomics 16: 214-218.
Barinaga, M. (1993) Science 2621512-4.
Bartel, P.L., Chien, C.T., Stemglanz, R. and Fields. S. (1993) Bio Techniques 14, 920-924.
Berger, J., Hauber, J., Hauber, R., Geiger, R. and Cullen, B.R. (1988) Gene 66, 1-10.
Beutler, В. and Cerami, C. (1987) NEJM, 316: 379-385.
Boldin, M.P. et al. (1995) J. Biol. Chem. 270, 337-341.
Bollon, D.P. et al. (1980) J. Clin. Hematol. Oncol. 10, 39-48.
Botstein, D. et al. (1982) Miami Wint. Smyp. 19, 265-274.
Brakebusch, С. et al. (1992) EMBO J., 11: 943-950.
Broach, J.R. (1981) in: The Molecular Bioiogy of the Yeast Saccharomyces: Life Cycle and Inheritance. Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y. 445-470.
Broach, J.R. (1982) Cell 28, 203-204.
Brockhaus, M. et al. (1990) Proc. Natl. Acad. Sci. USA, 87: 3127-3131.
Cantor, G.H. et al. (1993) Proc. Natl. Acad. Sci. USA 90: 10932-6.
Chater, K.F. et al. (1986) in: Sixth International Symposium on Actinomvcetales Biology, Akademiai Kaido, Budapest, Hungary, 45-54.
Chen, C.J. et al. (1992) Ann N.Y. Acad. Sci. 660: 271-3.
Cheng, J., Zhou, Т., Liu, C. Shapiro. J.P. Brauer, M., Kiefer, M.C., Barr, P.J. and Mountz, J.D. (1994) Science 263, 1759-1762.
Crisell, P. et al., (1993) Nucleic Acids Res. (England) 21 (22): 5251-5.
Crowe, P.D. et al., (1994) Science, 264: 707-709.
Current protocols in molecular biology (Ausubel, F.M., Brent, R., Kingston, R.E., Moore, D.D., Seidman, J.G., Smith, J.A., Struhl, K., Albright, L.M., Coen, D.M. & Varki, A., eds.), (1994) pp.8.1.1-8.1.6 and 16.7-16.7.8, Greene Publishing Associates, Inc. and Wiley & Sons, Inc., New York.
DeMartino, G.N., Moomaw, C.R., Zagnitko, O.P., Proske, R.J., Chu-Ping, M., Afendis, S.J., Swaffield, J.C. and Slaughter, C.A. (1994) J. Biol. Chem. 269, 20878-20884.
Dirks, W., Wirth, M. and Hauser, H. (1993) Gene 128, 247-249.
Endo, H., Akahoshi, Т., Nishimura, A., Tonegawa, M., Takagishi, K., Kashiwazaki, Matsushima, K. and Kondo, H. (1994) Clin. Exp. Immunol. 96, 31-35.
Engelmann, H. et al. (1990) J. Biol. Chem., 265: 1531-1536.
Ferrick, M.R., Thurau, S.R., Oppenheim, M.H., Herbort, C.P., Ni, M., Zachariae, C.P., Matsushima, K. and Chan, C.C. (1991) Invest. Ophthalmol. Vis. Sci. 32, 1534-1539.
Fields, S. and Song, O. (1989) Nature, 340: 245-246.
Frangioni, J.V. and Neel, B.G. (1993) Anal. Biochem. 210, 179-187.
Click, B.R. (1987) J. Ind. Microbiol. 1, 277-282.
Goodwin, R.G., Anderson, D., Jerzy, R., David, Т., Brannan, C.I., Copeland, N.G., Jenkins, N.A. and Smith, C.A. (1991) Mol. Cell Biol. 11, 3020-3026.
Gossen, M. and Boujard, H. (1992) Proc. Natl. Acad. Sci. USA, 89: 5547-5551.
Gryczan, T. (1982) The Molecular Biology of the Bacilli. Academic Press, N.Y. 307-329.
Guarente, L. (1983) in Methods Enzymol. 101, 181-191.
Harada, A., Sekido, N., Kuno, A., Akiyama, M., Kasahara, Т., Nakanishi, I., Mukaid, and Matsushima, K. (1993) Int. Immunol. 5, 681-690.
Heller, R.A. et al. (1990) Proc. Natl. Acad. Sci. USA, 87: 6151-6155.
Hohmann, H.-P. et al. (1989) J. Biol. Chem., 264: 14927-14934.
Holtmann, H. and Wallach, D. (1987) J. Immunol. 139, 1161-1167.
Itoh, N. et al. (1991) Cell 66: 233.
Itoh, N. and Nagata. S. (1993) J. Biol. Chem. 268, 10932-7.
Izaki, К. (1978) Jpn. J. Bacteriol. 33, 729-742.
John, J.F. et al. (1986) Rev. Infect. Dis. 8, 693-704.
Joseph, S. and Burke, J.M. (1993) J. Biol. Chem. 268: 24515-8.
Kendall, K.J. et al (1987) J. Bacteriol 169, 4177-4183.
Khan, A.S. et al. (1992) Nature Genetics, 2: 180-185.
Koizumi, M. et al. (1993) Biol. Pharm. Bull (Japan) 16, (9): 879-83.
Kunkel, T.A. (1994) in: Current protocols in molecular biology, pp.8.1.1-8.1.6 (Ausubel, F.M. et al., eds.) Greene Publishing Associates, Inc. and Wiley & Sons. Inc., New York.
Loetscher, H., Pan, Y-C.E., Lahm, H.-W, Gentz, R., Brockhaud, M., Tabuchi, H. and Lesslauer, W. (1990) Cell, 61: 351-359.
Maniatis, T. et al. (1982) Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory, Cold Spring Harbor.
Maniatis, T. (1980) in: Cell Biology: A Comprehensive Treatise Vol.3: Gene Expression. Academic Press, N.Y. 563-608.
Matsushima, K., Morishita, K., Yoshimura, Т., Lavu, S., Kobayashi, Y., Lew, W., Appella, E., Kung, H.F., Leonard, E.J. and Oppenheim, JJ. (1988) J. Exp. Med. 167, 1883-1893.
Nophar, Y. et al. (1990) EMBO J., 9: 3269-3278.
Oehm, A. et al. (1992) J. Biol. Chem. 267: 10709.
Ogasawara, J., Watanabe-Fukunaga, R., Adachi, M., Matsuzawa, A., Kasugai, Т., Kitamura, Y., Itoh, N., Suda, T. and Nagata, S. (1993) Nature 364, 806-809.
Okayama, H. (1983) Mol. Cell Biol. 3, 280.
O'Neal, K.D. and Yu-Lee, L.Y. (1993) Lymphokine Cytokine Res. 12, 309-312.
Piquet, P.F. t al. (1987) J. Exp. Med., 166: 1280-89.
Realini, C., Rogers, S.W. and Rechsteiner, M. (1994) FEBS Lett 348, 109-113.
Rechsteiner, M., Hoffman, L.and Dubiel, W. (1993) J. Biol. Chem. 268, 6065-6068.
Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual. Cold Spring HarborLaboratory Press. Cold spring Harbor. NY.
Schall, T.J. et al. (1990) Cell, 61: 361-370.
Schwalb et al. (1993) J. Biol. Chem. 268 (14):9949-54.
Seger, R. and Krebs, E.G. (1995) FASEB J. in press.
Sekido, N., Mujaida, N., Harada, A., Nakanishi, I., Watanabe, Y., Matsushima, K. (1993) Nature 365, 654-657.
Shimayama, Т. et al., (1993) Nucleic Acids Symp; Ser. 29: 177-8
Shore, S.K. et al. (1993) Oncogene 8: 3183-8.
Smith, C.A., David, Т., Anderson, D., Solam, L., Beckmann, M.P., Jerzy, R., Dower, S.K., Cosman, D. and Goodwin, R.G. (1990) Science, 248: 1019-1023.
Smith, D.B. and Corcoran, L.M. (1994) in: Current protocols in molecular biology, pp. 16.7.1-16.7,8 (Ausubel, F.M. et al., eds.) Greene Publishing Associates, Inc. and Wiley & Sons, Inc. New York.
Song, H.Y. et al. (1994) J. Biol. Chem. 269, 22492-22495.
Stamenkovic. I., dark, E.A. and Seed, B. (1989) Embo J. 8: 1403-1410.
Tartaglia, L. A., Ayres, TM, Wong, G.H. and Goeddel, D.V. (1993) Cell, 74: 845-853.
Tracey, J.T. et al. (1987) Nature, 330: 662-664.
Wallach, D. (1984) J. Immunol. 132, 2464-9.
Wallach, D. (1986) in: Interferon 7 (Ion Gresser, ed.), pp.83-122, Academic Press, London Wallach, D. et al. (1994) Cytokine 6, 556.
Watanabe-Fukanaga, R., Brannan, C.I., Itoh, N., Yonehara, S., Copeland, N.G., Jenkins, N.A. and Nagata, S. (1992) J. Immunol. 148, 1274-1279.
Watanabe-Fukunaga, R. et al. (1992) Nature, 156, 314-317.
Wiegmann, К., Schutze, S., Machleidt, Т., Witte, D. and Kronke, M. (1994) Cell 78, 1005-1015.
Wilks, A.F. et al. (1989) Proc. Natl. Acad. Sci. USA, 86: 1603-1607.
Zhao, J.J. and Pick, L. (1993) Nature (England) 165: 448-51.

























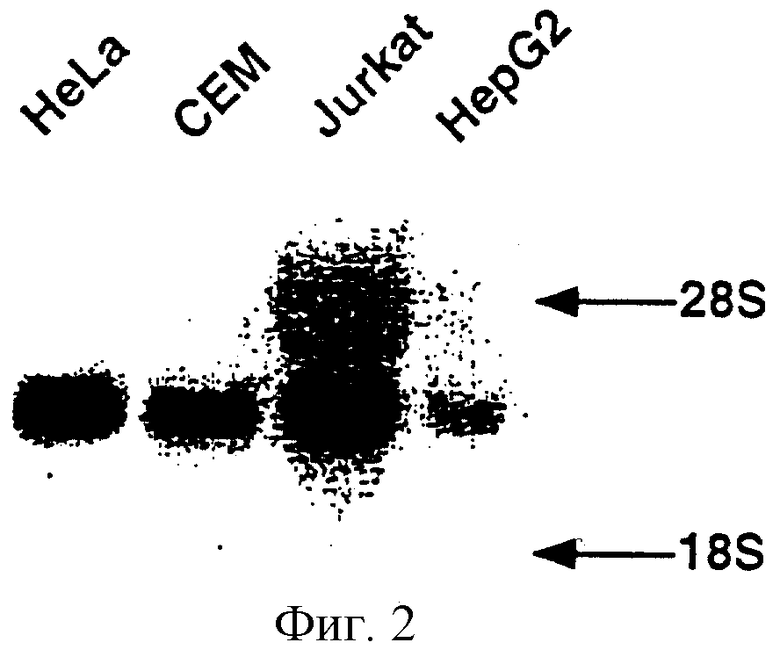
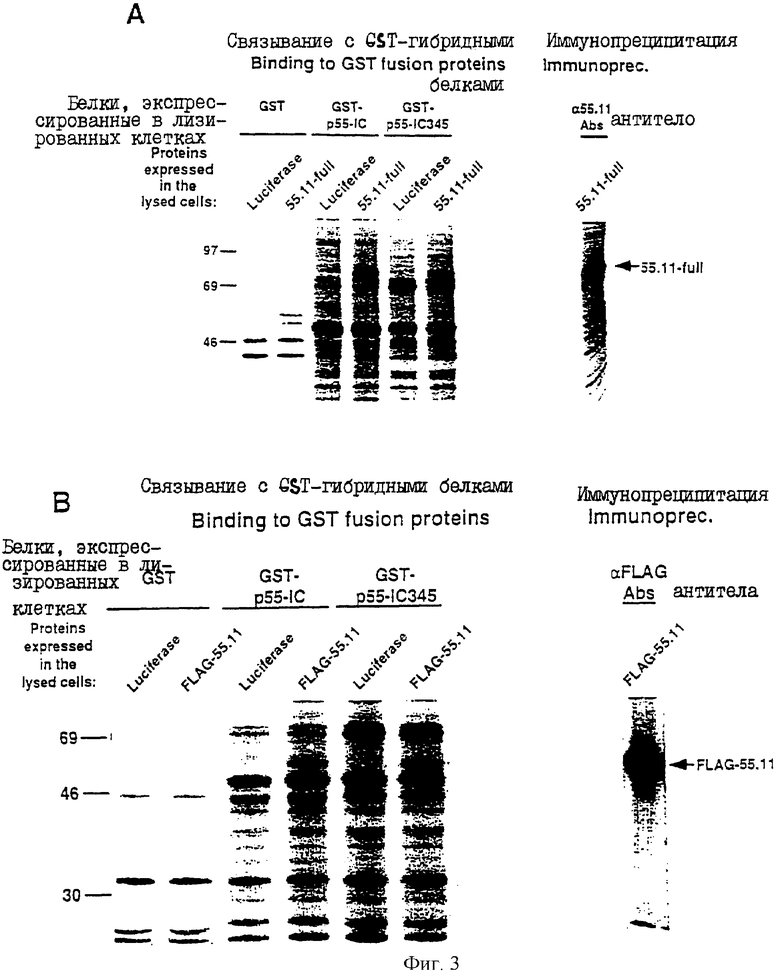
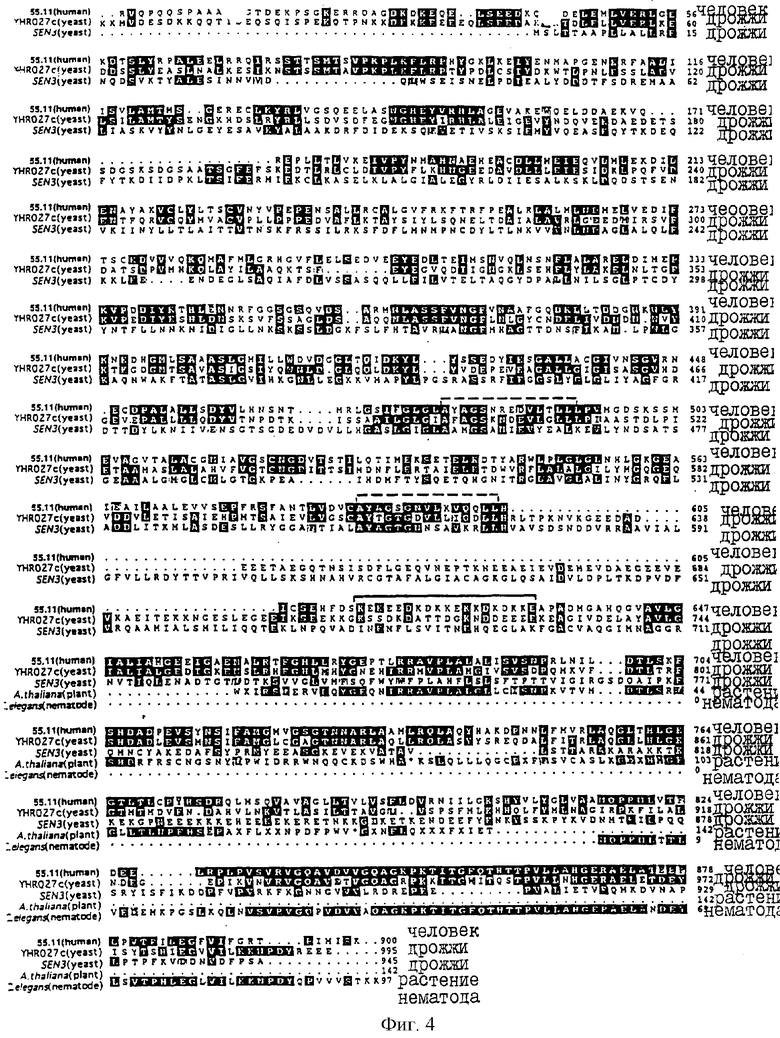
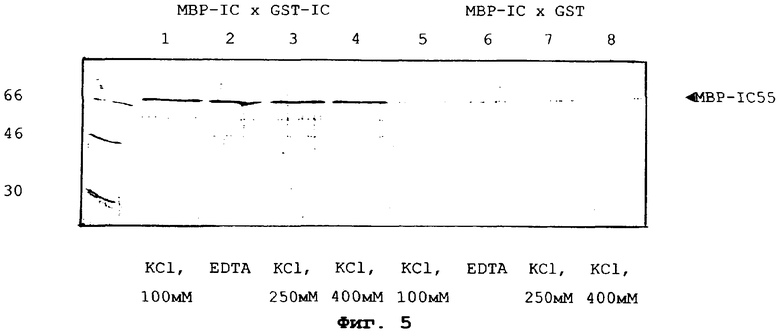
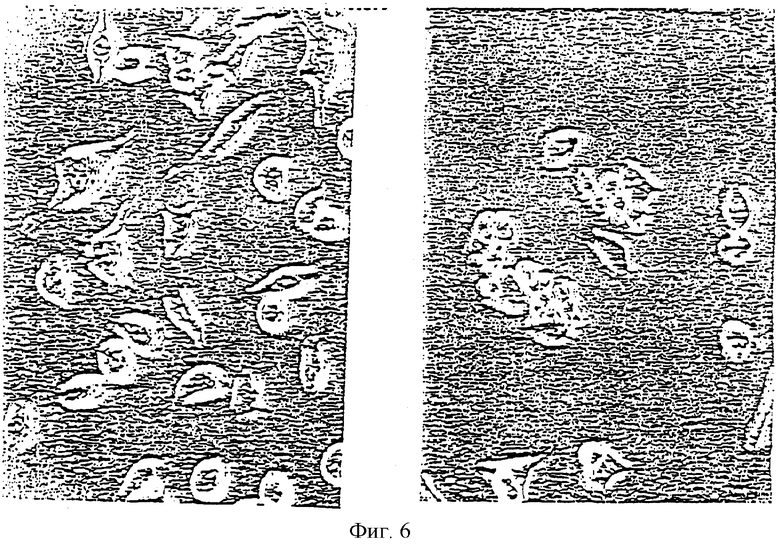
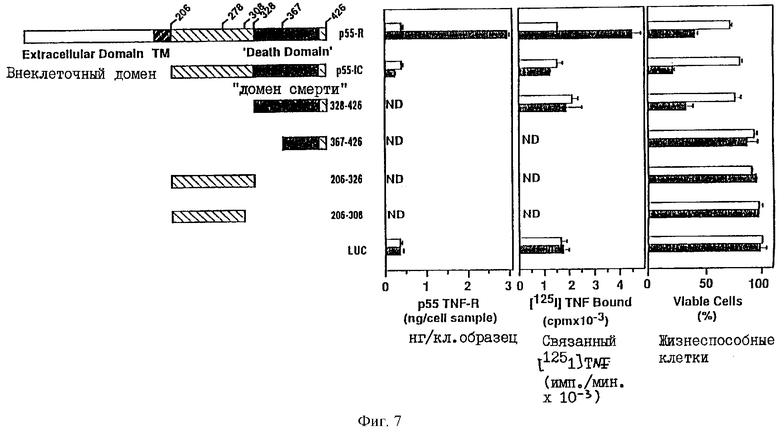
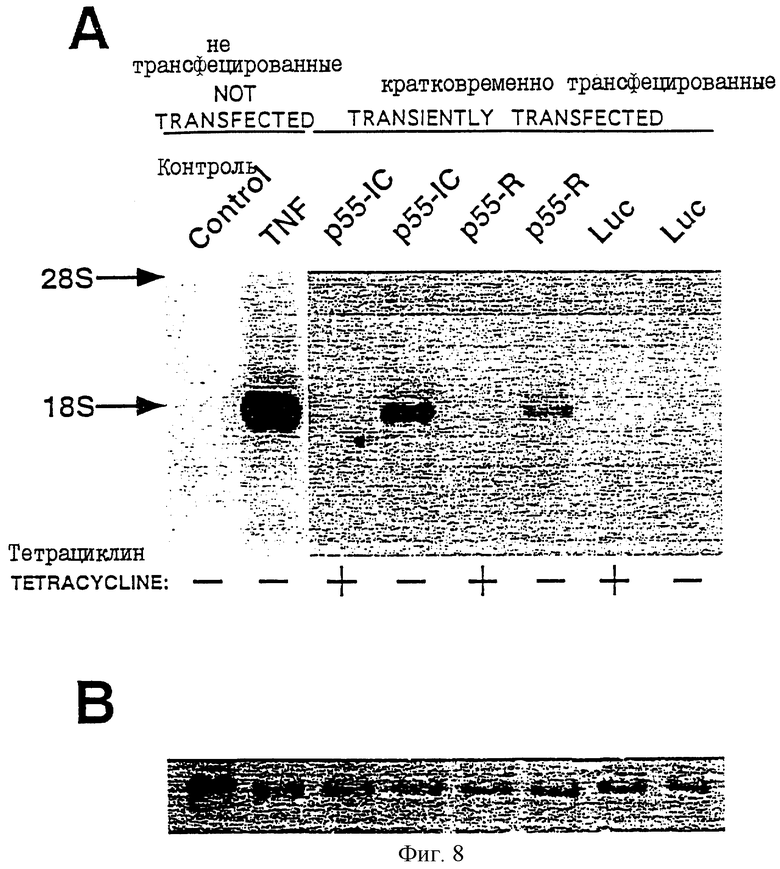
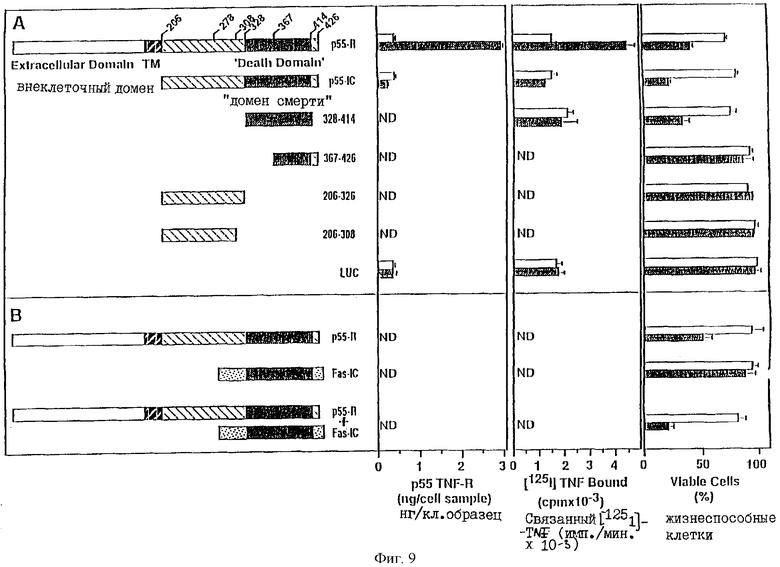



Изобретение относится к области молекулярной биологии и генетической инженерии и может быть использовано в медицине при лечении заболеваний, связанных с передачей TNF-сигнала. При использовании двухгибридной дрожжевой системы выявлены последовательности ДНК, кодирующие полипептиды (55.1 и 55.3), которые обладают способностью связываться с внутриклеточным доменом р-55 (р-551С) TNF-рецептора. Установлено, что названные полипептиды представляют собой фрагменты аминокислотной последовательности р-55IС, соответственно, от 328 до 426 и от 277 до 426 остатка. В результате встраивания фрагментов ДНК с кодирующей полипептид 55.1 или 55.3 последовательностью в состав экспрессирующего вектора и трансформации им подходящих клеток-хозяев получены рекомбинантные формы названных полипептидов. Применение настоящего изобретения обеспечивает возможность модулирования функции интактного р-55 TNF-рецептора. 4 с. и 5 з.п. ф-лы, 12 ил., 3 табл.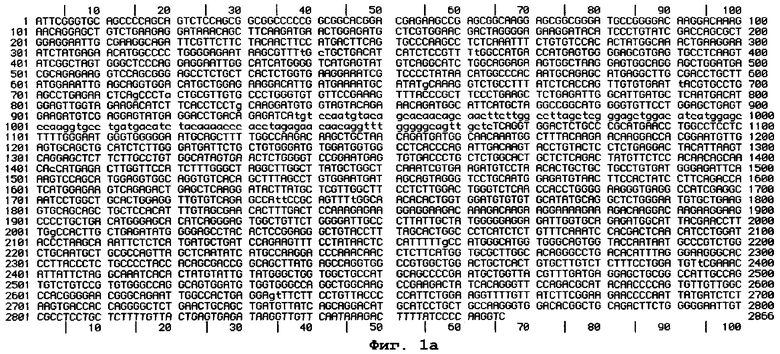
| Устройство для управления телескопом на альтазимутальной монтиолвке | 1974 |
|
SU510691A1 |
| M | |||
| LEWIS et al | |||
| Proc | |||
| Nath | |||
| Acad | |||
| Sci | |||
| USA, v.88, pp.2830-2834, 1991 | |||
| D.V.BANNER et al | |||
| Cell | |||
| Способ подготовки рафинадного сахара к высушиванию | 0 |
|
SU73A1 |
Авторы
Даты
2006-04-10—Публикация
1995-05-11—Подача