Изобретение относится к области пищевой и медицинской промышленности, в частности к способу получения иммуностимулятора из нервной ткани морских гидробионтов, дополнительно обладающего антиоксидантной и холинэргической способностью. Полученный предлагаемым способом иммуностимулятор может применяться как биологически активная добавка к пище (перорально) и как лечебное инъекционное средство для людей и животных.
Известен способ получения биологически активного вещества, обладающего иммуностимулирующим действием (Патент SU 1487815, А 61 К 35/74, приоритет от 17.08.83. Способ получения биологически активного вещества, обладающего иммуностимулирующим действием. Ив-Мари Паж. Кристин Вандерховен.), путем выращивания бактерий с последующим лизисом полученной биомассы и отделением лизата от нелизированных бактерий, отличающийся тем, что, с целью повышения активности целевого продукта, из бактерий используют штаммы Klebsiella pneumoniae CNCM 58.5 и Escherichia coli серовара 0119: В 14 CNCM 62.23. выращивание каждого штамма осуществляется раздельно, лизис биомасс проводят до остаточной концентрации 1000 бактериальных клеток/мл и менее с помощью гомологичных бактериофагов при множественности заражения 0,02-0,1 и полученные лизаты объединяют.
Известен способ получения иммуностимулятора из тимуса (Патент РФ 1112606 A1, 6 A 61 К 38/22, приоритет от 27.04.82. Способ получения иммуностимулятора из тимуса. Морозов В.Г., Хавинсон В.Х., Сидорова Н.Д., Константинов В. Л. , Чайка О.В., Говорова Н.Ф.), включающий очистку сырья, измельчение с последующим выделением целевого продукта, отличающийся тем, что, с целью увеличения активности и выхода целевого продукта, после очистки сырья его замораживают и измельченное сырье экстрагируют 5-6 объемами 3%-ного раствора уксусной кислоты, содержащего хлористый цинк при соотношении хлористого цинка и уксусной кислоты 1:1000 в течение 48-72 ч, затем отделяют надосадочную жидкость и выделяют целевой продукт осаждением пятью объемами ацетона при t=(-3)-(-5)oС, полученный осадок экстрагируют водой при pH 6-7 и комнатной температуре в течение 1-3 ч.
Известен способ получения биологически активных пептидов из животного сырья (Патент РФ 94042209 A1, 6 A 61 К 38/17, приоритет от 24.11.94. Способ получения биологически активных пептидов из животного сырья. Мельников Н.В., Кулагин В. Ф. , Юсупов В. Г. ), включающий измельчение органов или тканей крупного рогатого скота, экстракцию уксусной кислотой и выделение целевого продукта из экстракта с последующей доочисткой ультрафильтрацией, отличающийся тем, что после экстракции сырье подвергают замораживанию при температуре минус 5-20oС с последующим оттаиванием и осветлением экстракта, а заключительную очистку проводят методом ультрафильтрации на мембранах с порогом пропускания 10 кДа.
Известен способ получения иммуностимулятора (Патент РФ 1522485, 5 А 61 К 35/30, приоритет от 23.13.87. Способ получения иммуностимулятора. Хавинсон В. Х. , Морозов В.Х., Хмельницкая Н.М., Серый С.В.) путем очистки сырья, замораживания, измельчения, экстракции 3%-ным раствором уксусной кислоты с добавлением хлористого цинка, фильтрования, обработки надосадочной жидкости ацетоном, отделения осадка, растворения и лиофилизации целевого продукта, отличающийся тем, что, с целью повышения специфической активности целевого продукта, в качестве сырья используют миндалины человека, а экстракцию проводят в 20-25 объемах уксусной кислоты.
Известен способ получения иммуностимулятора (Патент РФ 2091073 С1, 6 А 61 К 35/60, приоритет от 27.12.94. Способ получения иммуностимулятора. Сафонова Г.М., Петров В.Ф., Колчанова Н.А., Фарцейгер А.Г. и др.), включающий замораживание сырья, измельчение, экстрагирование 3%-ным раствором уксусной кислоты с добавлением хлористого цинка, фильтрование, отделение надосадочной жидкости и выделение целевого продукта, отличающийся тем, что в качестве сырья используют молоки лососевых рыб, экстрагирование проводят в течение 24-48 ч с последующими ультра- и диафильтрацией экстракта в растворе 0,9% хлорида натрия с pH 6,0-6,5 через пористый материал с пределом разделения 5000 Да.
Наиболее близким техническим решением является способ получения иммуностимулятора (Патент РФ 2091072 С1, 6 А 61 К 35/60, приоритет от 10.03.93. Сафонова Г. М., Петров В.Ф., Колчанова Н.А., Фарцейгер А.Г. и др.). Способ, использующий в качестве сырья ганглии кальмара, замораживание сырья, его измельчение, экстрагирование 3%-ным раствором уксусной кислоты с добавлением хлористого цинка, фильтрование, отделение надосадочной жидкости и выделение целевого продукта, отличающийся тем, что надосадочную жидкость подвергают последовательной стерилизующей фильтрации через мембранные фильтры с размерами пор 0,8; 0,45: 0,22 мкм в стерильных условиях. Очищенный стерильный фильтрат концентрируют в 5,5 раз на ультрафильтрацонной установке через пористый материал с пределом разделения 1000-5000 Да с последующей очисткой в подщелоченной до рН 9-10 воде, повторным концентрированием на том же пористом материале и стерилизацией.
К недостаткам способа-прототипа относится то, что не определено верхнее значение молекулярной массы препарата (хотя и указывается 10000 Да), оно ограничивается стерилизующей фильтрацией на фильтрах с наименьшим размером пор в 0,22 мкм, что соответствует 2200000 Да (2200 кДа) (Свенсон К., Уэбстер П. Клетка. М.: Мир, 1980, - с.303), и предназначен не для ограничения препарата по молекулярной массе, а для отделения клеток, осколков клеток и микроорганизмов. Недостатком способа-прототипа является отсутствие технологической операции по отделению веществ с молекулярной массой более 10000-15000 Да, что приводит к присутствию в препарате высокомолекулярных примесей, снижающих активность препарата, и проявлению аллергического эффекта. Этот недостаток не дает возможности пройти все фармакологические испытания препарата и получить разрешение Минздрава на его применение в качестве лекарственного средства.
Вторым недостатком способа-прототипа является то, что устанавливается нижний предел молекулярной массы 1000-5000 Да. То есть, если применяется ультрафильтрация с пределом разделения 5000 Да, то удаляются вещества с молекулярной массой от 1000 до 5000 Да. Происходит потеря высокоактивных пептидов с молекулярной массой от 2000 до 5000 Да. По данным авторов многих патентов, разработчиков пептидных биологически активных препаратов, полученных методом кислотной экстракции, наиболее активными являются вещества пептидной природы (цитомедины) с молекулярной массой от 2000 до 10000 Да (Морозов В.Г., Хавинсон В. Х. Новый класс биологических регуляторов многоклеточных систем - цитомединов. //Успехи современной биологии. Т. 96, вып.3, 1983, - с.339-352; Анисимов В.Н., Хавинсон В.Х., Морозов В.Г. Роль пепетидов в регуляции гомеостаза: 20-летний опыт исследования. /Успехи современной биологии. Т. 113, вып. 6, 1993, - с.752-762; Морозов В.Г., Хавинсон В.Х. Роль клеточных медиаторов (цитомединов) в регуляции генетической активности // Известия академии наук СССР, серия биолог., М., 4, 1985, - с.581-587).
Ограничение высокомолекулярных веществ в препарате необходимо не только для получения продукта с наибольшей активностью, но и для обеспечения антиаллергенного эффекта, поскольку известно, что при инъекционном применении вещества белковой природы с молекулярной массой более 15 кДа, могут вызывать аллергический шок. К недостаткам способа-прототипа можно также отнести сложный и трудоемкий процесс предварительной последовательной стерилизующей фильтрации через фильтры с размерами пор 0,8; 0,45 и 0,22 мкм на начальном этапе технологического процесса, а затем снова переход к нестерильным условиям.
Задача, решаемая изобретением, - расширение сырьевой базы, упрощение способа получения иммуностимулятора, повышение активности и расширение сферы применения препарата.
Сущность изобретения заключаются в следующем:
замороженное сырье (нервную ткань головоногих моллюсков: кальмаров, каракатиц, осьминогов; мозг морских млекопитающих: белух, кашалотов, китов, моржей, ларги, нерпы, лахтака, акибы; мозг рыб: лососевых, осетровых, тресковых, сельдевых, камбаловых, окуневых) размораживают, измельчают, экстрагируют 3%-ным раствором уксусной кислоты с добавлением хлористого цинка, центрифугируют, отделяют надосадочную жидкость и выделяют целевой продукт путем ультрафильтрации и диафильтрации, которые проводят в две стадии на двух мембранах с различным пределом разделения по молекулярной массе; на первой стадии надосадочную жидкость, содержащую целевое вещество, подвергают ультрафильтрации на мембране с пределом разделения 10000-15000 Да; на второй стадии фильтрат, прошедший через поры мембраны с пределом разделения 10000-15000 Да, подвергают ультрафильтрации на мембране с пределом разделения 1000 Да. Раствор с целевым веществом от 1000 до 10000-15000 Да задерживается мембраной и концентрируется.
На заключительной стадии проводят стерилизующую фильтрацию концентрированного раствора с целевым веществом через мембрану с величиной пор 0,05-0,22 мкм, готовый продукт высушивают.
Новым в заявляемом техническом решении является то, что:
I) надосадочную жидкость (раствор с целевым веществом) подвергают фильтрации и диафильтрации в две стадии на двух мембранах с различным пределом разделения, обеспечивающих точное ограничение нижнего и верхнего предела молекулярной массы иммуностимулятора.
1 стадия - выделение целевого продукта проводят на мембране с пределом разделения 10000-15000 Да. Вещества с молекулярной массой менее 10000-15000 Да проходят через мембрану, а вещества с молекулярной массой более 10000-15000 Да задерживается мембраной, раствор при этом концентрируется в 15-20 раз. Далее, с целью наиболее полного перехода низкомолекулярной фракции (целевого вещества) в фильтрат, концентрат разбавляют водой в 3-4 раза и снова пропускают через ту же мембрану (диафильтрация). Раствор с веществами более 10000-15000 Да, не прошедший через мембрану при диафильтрации (концентрат) - удаляют.
2 стадия - раствор с целевым веществом (фильтрат) подвергают ультрафильтрации через мембрану с пределом разделения 1000 Да. На этом этапе низкомолекулярные примеси с молекулярной массой менее 1000 Да удаляются из целевого раствора, а вещества с молекулярной массой выше 1000 Да при этом задерживаются мембраной и концентрируются в 10-12 раз. С целью наибольшей очистки препарата от низкомолекулярных примесей раствор с целевым веществом (концентрат) разбавляют водой в 3-4 раза и проводят диафильтрацию. Таким образом, очищенный концентрат содержит низкомолекулярные пептиды с молекулярной массой от 1000 до 10000-15000 Да. При применении данного способа получения препарата в одну стадию отделяются все балластные вещества с молекулярной массой более 10000-15000 Да, во вторую - все примеси менее 1000.
II) Новым в способе является также то, что стерилизующая фильтрация применяется только на заключительном этапе, и осуществляется одним приемом через мембрану с размером пор 0,05-0,22 мкм.
Таким образом, преимуществом заявляемого способа получения иммуностимулятора по сравнению с прототипом являются:
1. Получаемый иммуностимулятор содержит в своем составе низкомолекулярные пептиды с молекулярной массой от 1000 до 10000-15000 Да;
2. Не требуется предварительная многоступенчатая стерилизующая фильтрация через фильтры с диаметром пор 0,8; 0-45 и 0,22 мкм;
3. Не требуется доочистка препарата в подщелоченной воде и повторная стерилизация.
В заявляемом способе применение ультрафильтрации на мембране 10000-15000 Да позволяет полностью избавиться от высокопептидных и белковых примесей, снижающих активность препарата и вызывающих аллергию, и получить препарат, обладающий высокой иммуностимулирующей активностью и дополнительно проявляющий антиоксидантную и холинэргическую способность.
Сущность способа поясняется примерами.
Пример 1.
10 кг замороженных ганглий кальмара размораживают до температуры минус 4oС в центре брикета и измельчают на электромясорубке. Экстракцию измельченных ганглий проводят в 50 л 3%-ного раствора уксусной кислоты с добавлением 50 г хлористого цинка. Время экстракции составляет 42 ч при периодическом перемешивании в течение 15 мин через каждые 1,5 ч. Экстракционную массу центрифугируют на центрифуге при 5000 об/мин в течение 20 мин. Надосадочную жидкость, которая является раствором с целевым веществом, отделяют и подвергают ультрафильтрации на мембране с пределом разделения 15000 Да. Раствор с целевым веществом (вещества с молекулярной массой менее 15000 Да) проходит через поры мембраны, вещества с молекулярной массой более 15000 Да задерживаются мембраной, при этом раствор концентрируется в 20 раз. Затем концентрат разбавляют водой в 3 раза и на той же мембране проводят диафильтрацию. Полученный концентрат удаляют в отходы, а раствор с целевым веществом, прошедший через поры мембраны (фильтрат) с веществами менее 15000 Да пропускают через ультрафильтрационную мембрану с пределом разделения 1000 Да для отделения неактивных низкомолекулярных примесей с молекулярной массой менее 1000 Да. Вещества с молекулярной массой менее 1000 Да проходят через поры мембраны и удаляются из раствора, а раствор с целевым веществом при этом концентрируется в 10 раз. Затем его разбавляют водой в три раза и проводят диафильтрацию. Фильтрат - раствор с веществами менее 1000 Да удаляют в отходы. Раствор с целевым веществом от 1000 до 15000 Да (концентрат) стерильно фильтруют на мембране с размером пор 0,05 мкм, разливают в стерильных условиях в ампулы с последующей лиофильной сушкой. Выход иммуностимулятора составил 105 г.
Пример 2
5 кг замороженного мозга осьминога размораживают до температуры минус 4oС в центре брикета и измельчают на мясорубке. Экстракцию измельченных ганглий проводят в 25 л 3%-ного раствора уксусной кислоты с добавлением 25 г хлористого цинка. Время экстракции - 46 ч при периодическом перемешивании в течение 10 мин через каждый час. Экстракционную массу центрифугируют на центрифуге при 4500 об/мин в течение 20 мин. Надосадочную жидкость, которая является раствором с целевым веществом, отделяют и подвергают ультрафильтрации на мембране с пределом разделения 10000 Да. Раствор с целевым веществом (веществами молекулярной массой менее 10000 Да) проходят через поры мембраны, а вещества более 10000 Да задерживается мембраной, при этом происходит концентрация раствора в 15 раз. Затем концентрат разбавляют водой в 3 раза и проводят диафильтрацию на той же мембране. Концентрат удаляют в отходы. Фильтрат (раствор с веществами менее 10000 Да) подвергают ультрафильтрации на мембране с пределом разделения 1000 Да. Вещества с молекулярной массой менее 1000 Да проходят через поры мембраны и удаляются из раствора, а раствор с целевым веществом (веществами 1000-10000 Да) при этом концентрируется в 12 раз. Концентрат в 4 раза разводят водой и проводят диафильтрацию на той же мембране. Фильтрат - раствор с веществами менее 1000 Да удаляют в отходы, а концентрированный раствор с целевым веществом молекулярной массой 1000-10000 Да стерильно фильтруют на мембранах с размером пор 0,22 мкм, разливают в стерильных условиях во флаконы с последующей лиофильной сушкой. Выход препарата составил 51 г.
Пример 3
9 кг замороженного мозга кеты размораживают на воздухе до температуры минус 4oС в центре брикета и измельчают. Экстракцию измельченного мозга проводят в 45 литрах 3%-ного раствора уксусной кислоты с добавлением 45 г хлористого цинка. Время экстракции составляет 36 ч при периодическом перемешивании в течение 15 мин через каждые 1,5 ч. Экстракционную массу центрифугируют на центрифуге при 5000 об/мин в течение 20 мин. Надосадочную жидкость, являющуюся раствором с целевым веществом, отделяют и подвергают ультрафильтрации через мембрану с пределом разделения 10000 Да. Раствор с целевым веществом (веществами молекулярной массой менее 10000 Да) проходит через поры мембраны, а раствор, не прошедший через мембрану (с веществами более 10000 Да), при этом концентрируется в 18 раз. Затем этот концентрат разбавляют водой в 4 раза и проводят диафильтрацию на той же мембране. Концентрат удаляют в отходы. Фильтрат - раствор с целевым веществом молекулярной массы менее 10000 Да, (прошедший через поры мембраны), подвергают ультрафильтрации через мембрану с пределом разделения 1000 Да. Вещества с молекулярной массой менее 1000 Да проходят через поры фильтра и удаляются из раствора, а вещества с молекулярной массой от 1000 до 10000 Да (целевой продукт) задерживаются мембраной, раствор при этом концентрируется в 10 раз. Затем концентрат с целевым веществом разводят водой в 3 раза и на той же мембране подвергают диафильтрации. Раствор с веществами менее 1000 Да (фильтрат) удаляют в отходы. Раствор с целевым веществом молекулярной массой 1000-10000 Да (концентрат) подвергают стерилизующей фильтрации через мембрану с размером пор 0,05 мкм, разливают в ампулы в стерильных условиях с последующей лиофильной сушкой. Выход препарата составил 92 г.
Пример 4
10 кг замороженного мозга ларги размораживают на воздухе до температуры минус 4oС в центре брикета и измельчают на электромясорубке. Экстракцию измельченного мозга ларги проводят в 50 литрах 3%-ного раствора уксусной кислоты с добавлением 50 г хлористого цинка. Время экстракции 48 ч при периодическом перемешивании в течение 15 мин через каждый час. Экстракционную массу центрифугируют на центрифуге при 5000 об/мин в течение 25 мин. Надосадочную жидкость, являющуюся раствором с целевым веществом, отделяют и подвергают ультрафильтрации на мембране с пределом разделения 15000 Да. Раствор с веществами менее 15000 Да проходит через поры мембраны (фильтрат), а вещества с молекулярной массой более 15000 Да задерживаются мембраной, при этом раствор концентрируется в 20 раз. Концентрат (раствор с веществами более 15000 Да) разбавляют водой в 4 раза и повторно пропускают через мембрану 15000 Да (диафильтрация). Концентрат удаляют в отходы. Фильтрат (раствор с веществами менее 15000 Да) подают на ультрафильтрационную колонку с мембраной 1000 Да. Вода с веществами менее 1000 Да проходит через поры мембраны и удаляется в отходы. Раствор с целевым веществом молекулярной массой от 1000 до 15000 Да при этом концентрируется в 10 раз. Концентрат подвергают стерилизующей фильтрации через мембрану с размером пор 0,22 мкм, разливают во флаконы в стерильных условиях с последующей лиофильной сушкой. Выход препарата составил 100 г.
Пример 5
7 кг замороженного мозга белухи размораживают на воздухе до температуры минус 4oС в центре брикета и измельчают. Экстракцию измельченного мозга проводят в 35 литрах 3%-ного раствора уксусной кислоты с добавлением 35 г хлористого цинка в течение 40 ч при периодическом перемешивании в течение 15 мин через каждые 2 ч. Экстракционную массу центрифугируют при 4000 об/мин в течение 25 мин. Надосадочную жидкость, являющуюся раствором с целевым веществом, отделяют и подают на ультрафильтрационную установку для разделения на мембране с пределом разделения 10000 Да. Раствор с целевым веществом (веществами менее 10000 Да) проходит через поры мембраны, а раствор с веществами более 10000 Да (не прошедший через поры), при этом концентрируется в 18 раз. Затем концентрат разбавляют водой в 3 раза и на той же мембране подвергают диафильтрации. Концентрат удаляют в отходы. Фильтрат (раствор с целевым веществом молекулярной массой менее 10000 Да) подвергают ультрафильтрации на мембране с пределом разделения 1000 Да. Вещества с молекулярной массой менее 1000 Да проходят через поры мембраны и удаляются в отходы, при этом раствор с целевым продуктом (веществами с молекулярной массой от 1000 до 10000 Да) концентрируется в 10 раз. Затем концентрат на той же мембране подвергают диафильтрации, предварительно разбавив его в 3 раза водой. Фильтрат - раствор с примесями менее 1000 Да удаляют в отходы. Концентрат (раствор с веществами молекулярной массы от 1000 до 10000 Да) подвергают стерилизующей фильтрации на мембранах с размером пор 0,05 мкм, разливают в стерильных условиях в ампулы с последующей лиофильной сушкой. Выход препарата составил 70 г.
Были проведены физико-химические и иммунологические исследования иммуностимулятора, полученного по способу-прототипу, произведенному на предприятии-патентообладателе, и иммуностимуляторов, полученных по заявляемому способу.
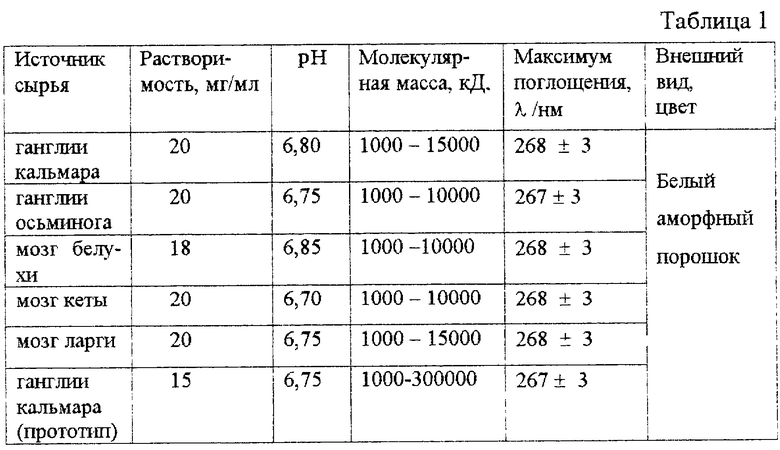
1. Исследования физико-химических свойств иммуностимуляторов: молекулярную массу определяли методом электрофореза в полиакриламидном геле и гель-фильтрационной хроматографией; максимум поглощения оптической плотности растворов иммуностимуляторов концентрацией 1 мг/см3 определяли на спектрофотометре UV-260 фирмы Shimadzu в области длин волн от 250 до 300 нм; рН растворов определяли на рН-метре-миливольтметре-673; определение растворимости устанавливали по фармакопейной статье (Государственная фармакопея СССР, 1970).
Физико-химические свойства препаратов представлены в таблице 1 и 2.
Как следует из материалов таблицы 1, препарат, полученный по способу-прототипу, имеет самую низкую растворимость. По-видимому это связано с наличием в препарате высокомолекулярных веществ, обладающих меньшей способностью к растворению чем низкомолекулярные вещества. При добавлении 10%-ного раствора трихлоруксусной кислоты к 1%-ному раствору препарата, полученному по способу-прототипу, появляется осадок, что говорит о наличии в последнем белковых включений.
Гель-хроматографическими исследованиями и электрофорезом в полиакриламидном геле установлено, что иммуностимулятор, полученный по способу-прототипу, представляет собой вещества с молекулярной массой от 1000-5000 до 300000 Да и выше.
Иммуностимуляторы, полученные заявляемым способом, представляют собой вещества с молекулярной массой от 1000 до 10000 Да или от 1000 до 15000 Да. Отсутствие в этих препаратах высокомолекулярных белковых компонентов подтверждается тем, что при добавлении к 1%-ному раствору препарата 10%-ного раствора трихлоруксусной кислоты раствор препарата остается прозрачным.
Аминокислотный состав иммуностимуляторов, полученных из нервной ткани гидробионтов заявляемым способом, определяли на аминокислотном хроматографе "Hitachi-AAA-835".
Результаты исследований приведены в таблице 2.
Характерной особенностью аминокислотного состава иммуностимуляторов, полученных по заявляемому способу, является то, что в них преобладают аспарагиновая и глутаминовая кислоты. В сумме они составляют от 35,0 до 37,7% от суммы всех аминокислот. По мнению некоторых авторов, именно эти аминокислоты играют важную роль в работе иммунной системы и в проведении нервных импульсов (Кудряшов Ю.Б., Гончаренко Е.Н. Современные проблемы противолучевой химической защиты организма //Радиационная биология. Радиоэкология. - 1999. - Т. 39, 2-3. - С.197-211) (Пархоменко И.М., Граевская Е.Э., Гонсалес Г.М. Влияние мидийного гидролизата МИГИ-К на адаптивный ответ у стволовых клеток костного мозга мышей. // Радиационная биология. Радиоэкология. 1999. - Т.39, 2-3. - С.310-312).
2. Исследование иммунологических свойств иммуностимуляторов.
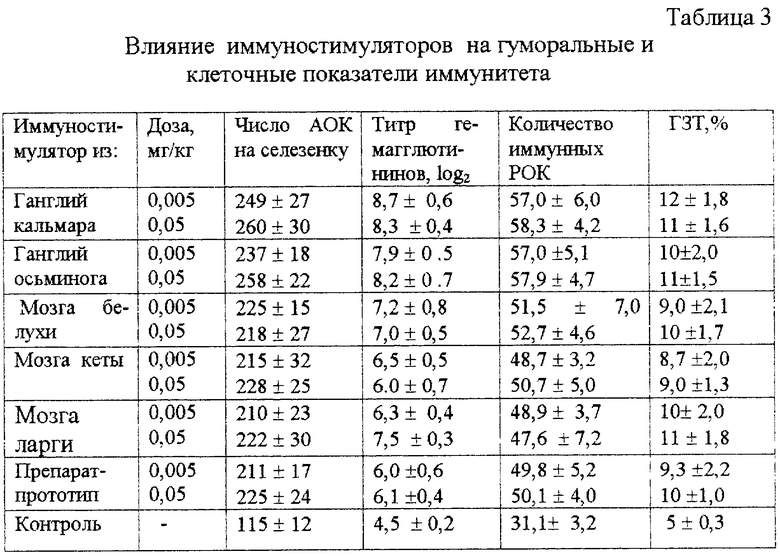
Иммунологическую активность препаратов изучали в соответствии с "Правилами доклинической оценки безопасности фармакологических свойств" в Московском НИИ питания РАМН, Пермской государственной фармацевтической академии и НИИ эпидемиологии и микробиологии СО РАМН г.Владивостока. Опыты выполнены на 260 мышах линии СВА, 90 крысах-самцах линии Вистар и 90 морских свинках. Было исследовано влияние иммуностимуляторов, полученных из нервной ткани гидробионтов на гуморальный и клеточный иммунный ответ по изменению: числа антителообразующих клеток (АОК) в селезенке, количества розеткообразующих клеток (РОК) в селезенке, титра гемагглютининов, гиперчувствительности замедленного типа.
Иммуностимуляторы вводили животным однократно внутрибрюшинно из расчета 0,005 мг на 1 кг массы тела (терапевтическая доза) и в количестве 0,05 мг/кг (десятикратная доза), или скармливали животным вместе с кормом в тех же дозах. При инъекционном применении препарат растворяли в 0,9%-ном растворе хлористого натрия и вводили по 0,1 мл. Контрольной группе вводили внутрибрюшинно по 0,1 мл 0-9%-ного раствора хлористого натрия. Результаты эксперимента приведены в таблице 3.
Из материалов таблицы следует, что самые высокие иммунологические показатели проявляют препараты, полученные из нервной ткани головоногих моллюсков, полученные по заявляемому способу. Особенно высокие показатели установлены у препарата из ганглий кальмара, его показатели на 83-140% превышают показатели контрольных животных. Иммуностимуляторы, полученные из мозга белухи, кеты и ларги, а также иммуностимулятор, полученный из ганглий кальмара по способу-прототипу, имеют одинаковые иммунологические показатели - от 44 до 100% выше, чем показатели контрольных животных.
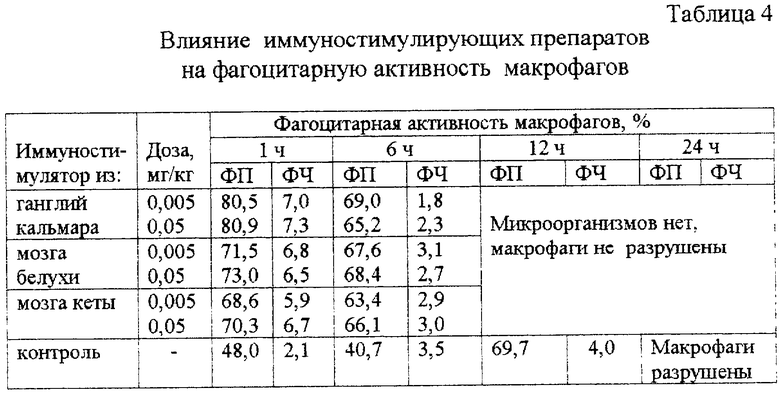
В таблице 4 приведены данные по влиянию иммуностимулирующих препаратов, полученных по предлагаемому способу, на фагоцитарную активность макрофагов животных. Об активности препаратов судили по изменению фагоцитарного показателя (ФП - число фагоцитирующих клеток) и фагоцитарного числа (ФЧ - среднее число микробов, поглощенных одним макрофагом) по сравнению с контролем. Время наблюдения 1, 6, 12 и 24 часа. В качестве объекта фагоцитоза был взят Y. Pseudotuberculosis
Как следует из данных таблицы 4, при применении иммуностимулирующих препаратов, полученных предлагаемым способом, резко увеличивается фагоцитарная активность макрофагов опытных животных, причем резкого различия в активности препаратов не наблюдается. Самым активным является препарат из ганглий кальмара- его активность на 10-15% выше других препаратов. Увеличение дозы в 10 раз не оказывает значимого влияния на изменение активности препаратов.
При применении иммуностимуляторов в фагоцитарный процесс вовлекается уже в первые часы наблюдения большее, чем в контроле, количество макрофагов и значительно увеличивается число микроорганизмов, поглощенных одним макрофагом. Кроме того, под действием всех препаратов, полученных из нервной ткани гидробионтов, отмечается более полное и раннее завершение фагоцитарного процесса в макрофагах по сравнению с контролем.
На модели генерализованной инфекции, развивающейся в результате заражения большой дозой E.coli (млн. микробных клеток), была изучена способность иммуностимулирующих препаратов, полученных по заявляемому способу, защищать инфицированных животных. Инфицированные животные контрольной группы погибали в течение 3-х дней. Гибель последних составила 100%. Выживание опытных животных, которым скармливали иммуностимуляторы, составило: от 69,7 до 87,1%.
3. Исследование антиоксидантной и холинэргической активности. Об антиоксидантной активности препарата судили по изменению перекисного окисления липидов (ПОЛ) сыворотки крови людей, определение проводили по накоплению малонового альдегида (МДА) флюорометрическим методом (Семенов В.Я., Ярош А.М. //Укр. биохим. журн. - 1985. - Т.57. - С.50-52). Холинэстеразную (ХЭ) активность определяли в сыворотке крови людей колориметрическим методом Эллмана (Allaman G. H. L., Countney R.D., Anders V.D., Feather K.M. //Biochem Pharmacol. - 1961. - Vol.7. - P.88-95) с использованием в качестве субстрата ацетилтиохолина йодида (ICN, США). Известно, что в осуществлении трофической функции нервной системы велика роль холинергических систем, что проявляется в регуляции биохимических процессов клеток, функции их генетического аппарата, биомембран, системы циклических нуклеотидов, биосинтетических процессов (Голиков Н. С., Долго-Сабуров В.Б., Елаев Н.Р., Кулешов А.И.. Холинэргическая регуляция биохимических систем клетки. - М.: Медицина, 1985).
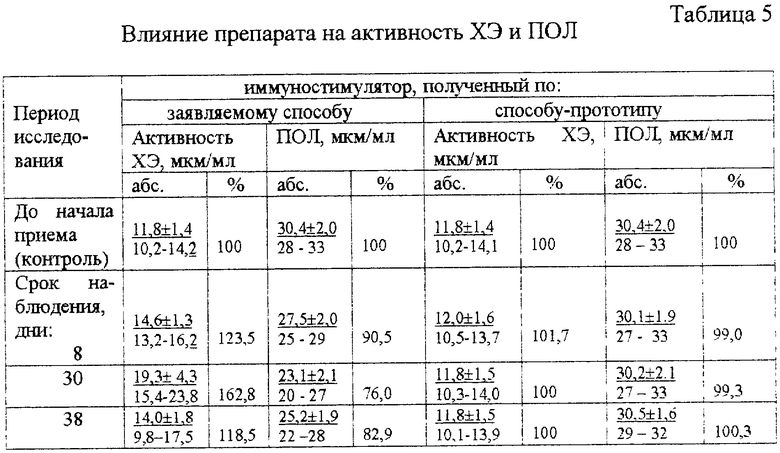
Оценку активности ХЭ и ПОЛ проводили у 20 практически здоровых людей в возрасте от 26 до 45 лет до приема препарата (контроль), в течение 10-дневного курса и через 1 месяц после прекращения приема препарата. Препарат применяли как добавку к пище из расчета 1,5 мг на человека три раза в день в течение 10 дней (Романенко В.А., Ковалев Н.Н., Еникеева Н.А. Эпштейн Л.М. Влияние биологически активной пищевой добавки из морских гидробионтов на холинэргическую активность и перекисное окисление липидов сыворотки крови человека. // Вопросы питания, 2000, 5, - с.17-19).
Результаты исследований приведены в таблице 5.
В результате исследования установлено, что исходно ПОЛ у обследованных оказался повышенным до 30,4 мкм/мл (норма 21-22 мкм/мл), что, по-видимому, связано с сезонными колебаниями этого показателя и с работой обследуемых, связанной с психоэмоциональными нагрузками. Под влиянием препарата, полученного по заявляемому способу, в течение всего срока наблюдения отмечается снижение ПОЛ сыворотки крови до значений, близких к норме. Также установлено четко выраженное повышение активности ХЭ сыворотки крови; ее "пик" (увеличение на 62,8%) сохранялся в течение всего периода наблюдения, постепенно понижаясь.
Полученные данные свидетельствуют о четко выраженной холинэргической и антиоксидантной активности заявляемого иммуностимулятора, в то время как препарат, полученный по способу-прототипу, такой активностью не обладает.
Таким образом, иммуностимулятор, полученный по заявляемому способу, имеет четко ограниченные пределы молекулярной массы, обладает более высокой иммунологической активностью по сравнению с иммуностимулятором, полученным по способу-прототипу, и дополнительно обладает антиоксидантной и холинэргической способностью.
Источники информации
1. Патент SU 1487815, А 61 К 35/74, приоритет от 17.08.83. Способ получения биологически активного вещества, обладающего иммуностимулирующим действием. Ив-Мари Паж, Кристин Вандерховен.
2. Патент РФ 1112606 A1, 6 A 61 К 38/22, приоритет от 27.04.82. Способ получения иммуностимулятора из тимуса. Морозов В.Г., Хавинсон В.Х., Сидорова Н.Д., Константинов В.Л., Чайка О.В., Говорова Н.Ф.
3. Патент РФ 94042209 A1, 6 A 61 К 38/17, приоритет от 24.11.94. Способ получения биологически активных пептидов из животного сырья. Мельников Н.В., Кулагин В.Ф., Юсупов В.Г.
4. Патент РФ 1522485, 5 A 61 K 35/30, приоритет от 23.11.87. Способ получения иммуностимулятора. Хавинсон В.Х., Морозов В.Х., Хмельницкая Н.М., Серый С.В.
5. Патент РФ 2091073 С1, 6 А 61 К 35/60, приоритет от 27.12.94. Способ получения иммуностимулятора. Сафонова Г. М., Петров В.Ф., Колчанова Н.А., Фарцейгер А.Г. и др.
6. Патент РФ 2091072 С1, 6 А 61 К 35/60, приоритет от 10.03.93. Способ получения иммуностимулятора. Сафонова Г. М., Петров В.Ф., Колчанова Н.А., Фарцейгер А.Г. и др.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения иммуностимулятора пептидной природы (Варианты) и БАД на его основе | 2016 |
|
RU2635625C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСТИМУЛЯТОРА | 2014 |
|
RU2563816C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСТИМУЛЯТОРА | 1993 |
|
RU2091072C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ВОДОРАСТВОРИМЫХ ПЕПТИДОВ, ОБЛАДАЮЩИХ АНТИОКСИДАНТНОЙ АКТИВНОСТЬЮ | 2022 |
|
RU2809011C1 |
| Способ получения гидролизата молочных белков | 1990 |
|
SU1839085A1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО БЕЛКОВОГО КОНЦЕНТРАТА, ОБОГАЩЕННОГО ПАНКРЕАТИЧЕСКОЙ РИБОНУКЛЕАЗОЙ А, АНГИОГЕНИНОМ И ЛИЗОЦИМОМ, ИЗ МОЛОЧНОГО УЛЬТРАФИЛЬТРАТА | 2001 |
|
RU2204262C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСТИМУЛЯТОРА | 1994 |
|
RU2091073C1 |
| МЕМБРАННЫЙ СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА НА ОСНОВЕ ПЕПТИДОВ ТИМУСА ТЕЛЯТ | 2016 |
|
RU2648468C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА, ОБЛАДАЮЩЕГО КОЛЛАГЕНОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 1996 |
|
RU2096456C1 |
| ПЕПТИДСОДЕРЖАЩАЯ ФРАКЦИЯ ИЗ СЕЛЕЗЕНКИ МЛЕКОПИТАЮЩИХ, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2033796C1 |

Изобретение относится к пищевой и медицинской промышленности, в частности к способу получения иммуностимулятора из нервной ткани морских гидробионтов. Сущность изобретения заключается в следующем: замороженное сырье (нервную ткань головоногих моллюсков: кальмаров, каракатиц, осьминогов; мозг морских млекопитающих: белух, кашалотов, китов, моржей, ларги, нерпы, лахтака, акибы; мозг рыб: лососевых, осетровых, сельдевых, тресковых, камбаловых, окуневых) размораживают, измельчают, экстрагируют 3%-ным раствором уксусной кислоты с добавлением хлористого цинка, центрифугируют, отделяют надосадочную жидкость и выделяют целевой продукт путем ультрафильтрации и диафильтрации, которые проводят в две стадии на двух мембранах с различным пределом разделения по молекулярной массе. Иммуностимулятор, полученный по предлагаемому способу, имеет четко ограниченные пределы молекулярной массы 1000 - 10000-15000 Да, обладает более высокой иммунологической активностью по сравнению с иммуностимулятором, полученным по способу-прототипу, и дополнительно обладает антиоксидантной и холинэргической способностью. 1 з.п. ф-лы, 5 табл.
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСТИМУЛЯТОРА | 1993 |
|
RU2091072C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОСТИМУЛЯТОРА | 1994 |
|
RU2091073C1 |
| RU 94045342 А1, 20.10.1996. | |||
Авторы
Даты
2004-01-27—Публикация
2002-07-03—Подача