ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
ОБЛАСТЬ ИСПОЛЬЗОВАНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится, в основном, к области технологии получения рекомбинантов. В частности, оно касается вопроса упрощения и повышения эффективности способов получения рекомбинантных аденовирусов. Кроме того, предложены новые составы и способы использования структур аденовируса р53, включая способы восстановления нормальных функций р53 и подавления роста клеток с отклоненными от нормы р53.
ОПИСАНИЕ УРОВНЯ ТЕХНИКИ
Современные методы лечения рака, включающие радиационную терапию, хирургию и химическую терапию, характеризуются ограниченной эффективностью. Только рак легких убивает в Соединенных Штатах более 140000 человек ежегодно. Недавно для установленной возрастной группы смертность от рака легких превысила смертность от рака груди у женщин. Хотя введение в жизнь программы борьбы с курением снизило темпы распространения курения, уровень смертности от рака легких останется высоким даже в 21-м веке. Развитие новых терапевтических методов лечения рака легких будет зависеть от проникновения в механизм биологии рака легких на молекулярном уровне.
В настоящее время установлено, что разновидности рака вызываются, по крайней мере частично, генетическими отклонениями, которые проявляются или в повышенной экспрессии одного или более генов, или в экспрессии отклоненного от нормы или мутантного гена или генов.
Например, во многих случаях, как известно, экспрессия онкогенов вызывает развитие рака. "Онкогены" - это генетически измененные гены, чей мутированный продукт экспрессии каким-то образом нарушает нормальное функционирование клетки или управление этим процессом (Spandidos et al., 1989).
Большинство из изученных на настоящий момент онкогенов получили определение "активированных" в результате мутации, часто точечной мутации, в кодирующей области нормального клеточного гена, то есть "протоонкогена", результатом чего является замещение аминокислоты в протеиновом продукте, экспрессия которого претерпела изменение. Этот продукт с видоизмененной экспрессией проявляет отклоненные от нормы биологические функции, которые оказывают влияние на протекание процесса образования опухолей (Travali et al. , 1990). He проявляющие себя мутации могут развиваться при различных обстоятельствах, например в результате химического мутагенеза или ионизирующей радиации. Целый ряд онкогенов или онкогенных семейств, включая ras, myc, neu, raf, erb, src, fms, jun, abl, в настоящее время уже идентифицированы и в различной степени описаны (Travali et al., 1990, Bishop, 1987).
Как установлено, при нормальном росте клетки протоонкогены, стимулирующие рост, сбалансированы генами-супрессорами, сдерживающими рост новообразований. Некоторые факторы могут внести дисбаланс во взаимодействие этих двух сил, ведущий к состоянию, предполагающему образование опухолей. Одним из таких факторов является мутация в генах-супрессорах новообразований (Weinberg, 1991).
Одним из важных генов-супрессоров новообразований является ген, кодирующий клеточный протеин, р53, который представляет собой ядерный фосфопротеин kD 53 (замещенный в цикле фосфопротеин kD 53), который управляет клеточной пролифератией (процессом разрастания клеток). Мутации, происходящие с геном р53, и потеря аллельного гена на хромосоме 17р, где этот ген размещен, представляют собой одни из наиболее распространенных видоизменений, идентифицированных в злокачественных новообразованиях человека. Протеин р53 обладает высокой степенью сохранности в процессе эволюции и проявляется в наиболее нормальных тканях. Было продемонстрировано, как природный р53 должен быть вовлечен в управление клеточным циклом (Mercer, 1992), в процесс транскрипционного регулирования (Fields et al., 1990, and Mietz et al., 1992), в репликации DNA (Wilcock and Lane, 1991, and Bargonetti et al., 1991) и в возбуждение апоптоза (Yonish - Rouach et al., 1991, and Shaw et al., 1992).
Известны различные мутантные аллельные гены р53, в которых единственное базовое замещение ведет к синтезу протеинов, которые имеют совершенно другие характеристики, определяющие закономерности роста, что в конечном счете ведет к злокачественным новообразованиям (Hollstein et al., 1991). Действительно, было установлено, что ген р53 является наиболее часто мутированным геном при раке у человека (Hollstein et al., 1991; Weinberg, 1991) и, в частности, ассоциируется с теми разновидностями рака, возникновение которых связано с сигаретным дымом (Hollstein et al., 1991; Zakut - Houri et аl., 1985). Чрезмерная экспрессия р53 в опухолях груди также была документально подтверждена (Casey et al., 1991).
Одним из аспектов, привлекающих наибольшее внимание генной терапии рака, является использование генов-супрессоров, таких как р53, для лечения опухолей. Было установлено, что трансфекция (заражение клеток чужеродной нуклеиновой кислотой, например вирусной) природного гена р53 в определенного типа опухолевых клетках рака груди и легких может восстановить управление процессом подавления роста в клеточных линиях (Casey et al., 1991, Takahasi et аl. , 1992). Хотя трансфекция DNA не является жизнеспособным средством введения DNA в клетки пациентов, эти результаты служат демонстрацией того, что внедрение природного гена р53 в раковые клетки, содержащие мутированный р53, может стать эффективным методом лечения, если будут разработаны усовершенствованные способы внедрения гена р53.
В настоящее время ведется изучение проблемы и создаются системы внедрения гена, которые могут быть применены в генной терапии для подавления роста опухоли. Средства на основе вируса для трансфекции гена вызывают особый интерес благодаря способности вирусов инфицировать действительно живые клетки. Налицо способ, в котором вирусный генетический материал перемещается самостоятельно. В этой связи уже были отмечены некоторые успешные решения, например воспроизведение ретровирусных векторов (направленных на вирусы), разработанных для доставки внедряемых генов. Однако существуют серьезные проблемы, связанные с использованием ретровирусных векторов в генной терапии. Поскольку их эффективность зависит от наличия ретровирусных рецепторов на клетках-мишенях, их трудно сконцентрировать и обеззаразить, и, кроме того, они могут эффективно внедряться только в размножающиеся клетки (репликационные клетки).
Недавно были предложены аденовирусные векторные системы для использования в некоторых протоколах перемещения определенных генов, однако, современные методы приготовления аденовирусов-рекомбинантов имеют недостатки, которые заключаются в следующем. Эти методы основаны на трансфекции вирусов экспрессии и аденовирусных плазмидов в клетках-хозяевах и последующей реакции розеткообразования на зараженных клетках. При этом данные методы трансфекции имеют промежуточное звено в виде фосфата кальция.
Такие методы осуществления трансфекции неэффективны и их типичным результатом является низкий уровень воспроизведения вирусов.
Поэтому остается очевидной необходимость в разработке новых методов внедрения генов-супрессов подавления роста новообразований, таких как р53, в клетки в качестве средств для восстановления функции подавления роста. Большой интерес вызывают также способы приготовления вирусов-рекомбинантов, которые исключают трансфекцию с промежуточным звеном в виде фосфата кальция и присоединение агарозы для реакции розеткообразования.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к изложенным выше проблемам создания эффективных способов получения аденовирусов-рекомбинантов, таких, например, как аденовирус р53, и эффективных средств, с помощью которых возможно восстановление функции р53, воздействующих на клетку с видоизмененным р53.
Получены векторы аденовируса-рекомбинанта и вирионы; предложены способы использования этих составов, с целью доставки природной экспрессии р53 в клетки с отклоненными от нормы функциями р53, какими являются раковые клетки. Кроме того, еще одним существенно новым признаком изобретения является упрощенный протокол воспроизведения аденовируса-рекомбинанта, благодаря использованию трансфекции DNA с промежуточным звеном липосомы с последующим цитопатогенным эффектом, т. е. патогенным воздействием вируса на культуру ткани, и предпочтительно исследованиями цепной реакции полимеризации (PCR).
Более того, использование этого нового метода образования и воспроизведения аденовирусов-рекомбинантов показало, что другие гены могут быть инкорпорированы в бином вириона. Эти гены могут включать гены - супрессоры новообразований, например ген ретинобластомы (rb), невосприимчивые онкогены, т. е. anti-с-mус и anti-k ras, и другие гены, несущие ответственность за управление процессом роста при генной терапии рака.
Используя настоящее изобретение, изобретатели продемонстрировали замечательный эффект в управлении ростом метастазa. Было показано, что аденовирус - рекомбинант Ad5CMV - р53 значительно снижает интенсивность роста измененных клеток. Вирус подавлял онкогенность инфицированных вирусом клеток Н 358. Кроме того, он предотвращал рост ортотопического рака легких, когда вирус вводился внутритрахеально, следуя за внутритрахеальной инокуляцией клеток Н226Вr.
Подавление онкогенности также наводит на мысль о том, что даже временной экспрессии высокого уровня протеина р53 может быть достаточно для возбуждения эффекта, уничтожающего опухолевые клетки.
В одном из вариантов осуществления данное изобретение касается векторных структур для введения природных генов р53 в клетки-мишени, причем существует подозрение, что данные клетки-мишени содержат мутированные или отклоненные от нормы гены р53, включающие раковые клеточные группы.
Эти варианты изобретения предусматривают приготовление экспрессии гена или единицы транскрипции, в которой ген располагается под контролем промотора, а упомянутая единица внедряется в аденовирусный вектор вместе с аденовирусом-рекомбинантом. Данное изобретение обладает новизной и оригинальностью решения проблемы по нескольким причинам. Во-первых, ранее существовало мнение, что вирус р53 не может воспроизводиться в "упаковывающих" клетках, например, таких, которые используются для получения аденовирусов, из-за их возможной токсичности; во -вторых, ЕIB аденовируса оказывает влияние на р53 и этим самым отрицательно влияет на его функции; в третьих, получив возможность к воспроизведению, аденовирус р53 обнаруживает неожиданную способность к эффективному подавлению роста различных раковых клеток, и наконец, онкогенность клеток рака легких была подавлена благодаря лечению с помощью Ad5CMV-p53, но не с помощью контрольного вируса.
Все эти моменты указывают на то, что новый метод доставки протеина р53 и способ его приготовления обнаруживают поразительную терапевтическую эффективность. Таким образом, настоящее изобретение касается аденовирусных векторных структур, которые вовлекаются за счет использования аденовируса в процесс переноса генов-супрессоров роста новообразований, например р53, нечувствительных онкогенов и других генов при терапевтическом лечении рака у человека. В одном из вариантов изобретения показаны рекомбинантные аденовирусные вирионы или частицы, инкорпорирующие такие векторы, и их фармакологические составы, которые содержат рекомбинантную вставку, имеющую область экспрессии, кодирующую природный р53, посредством которого векторы получают возможность создавать условия для проявления р53 (экспрессии р53) в метастатических клетках человеческого организма. Область экспрессии р53 в векторе может содержать последовательность геномов, но для упрощения можно предположить, что более предпочтительно использование последовательности cDNA р53, так как это легко доступно для анализа уровня техники в данной области и проще в управлении процессом. Рекомбинантная вставка вектора должна также включать провоцирующую область и сигнал полиаденилации (polyadenilation), например SV40 или сигнал полиаденилации гена протамина.
В предпочтительных вариантах изобретения предполагается, что может возникнуть необходимость в создании сильного, существенного (структурного) промотора, например промотора цитомегаловируса (CMV), вирусного LTR, RSV, промогора SV40 или промотора, ассоциированного с генами, которые проявляются на высоких уровнях в клетках млекопитающих, например в факторе-1 элонгации или в промоторах актина. В настоящее время наиболее предпочтительным промотором считается промотор IE вируса цитомегалии (CMV).
Ген р53 cDNA может быть введен в аденовирус-рекомбинант, в соответствии с настоящим изобретением, простым включением или добавлением кодирующей последовательности р53 в вирусный геном, который испытывает недостаток в Е1В. Однако в качестве предпочтительных аденовирусов следует рассматривать дефектные вирусы репликаций, в которых вирусный ген, существенный для репликации и/или "упаковывания" был удален из аденовирусной векторной структуры, давая возможность зоне экспрессии р53 переместиться на свое место. Любой ген, в дополнение к Е1В, то ли существенный, например Е1А, Е2, Е4, то ли несущественный, например Е3, для репликации, может быть удален и замещен р53.
В частности, предпочтительными являются те векторы и вирионы, в которых области Е1А и Е1В векторов аденовируса удалены, а зона экспрессии р53 внедрена на их место, что показано в качестве примера на структуре генома на фиг. 1.
Технологические процессы приготовления репликационных дефектных аденовирусов хорошо известны из уровня техники, что подтверждается приведенными в данном описании аналогами Ghoss-Choudhury и Graham (1987); McGrory et al. (1988), и Gluzman et al. (1982), перечисленными в ссылках на использованную литературу. Кроме того, хорошо известно, что могут быть использованы различные клеточные линии с целью воспроизведения аденовирусов-рекомбинантов, при этом их воспроизведение может продолжаться до тех пор, пока существует возможность дополнения дефекта репликации, если таковой присутствует. Предпочтительной клеточной линией является клеточная линия 293 человека, но существуют также и другие клеточные линии, приемлемые для репликации, например могут быть использованы в предпочтительном случае экспрессии Е1А и Е1В. Причем клетки могут воспроизводиться как на пластмассовых чашках, так и в культуре суспензии, чтобы получить запасы культуры вирусов.
Изобретение не ограничивается вирусами с недостающим звеном Е1 и клетками с экспрессией Е1. Действительное в связи с настоящим изобретением могут быть использованы другие дополняемые комбинации вирусов и клеток-хозяев, причем этот процесс дополнения (замещения) будет длиться до тех пор, пока вектор р53 не останется без Е1В. Могут быть использованы клетки с экспрессией Е2 и вирус, теряющий функциональное звено Е2 точно так же, как и клетки с экспресией Е4 и вирус, теряющий функциональное звено Е4 и т.д. В том случае, если несущественный для репликации ген удаляется или замещается, каковым, например, является ген Е3, такой дефект нет надобности отдельно укомплектовывать с помощью клетки-хозяина.
Что касается природы векторов аденовирусов и вирионов, то для успешного их использования в связи с настоящим изобретением решающим фактором является только удовлетворение требований, связанных с отсутствием в векторах аденовирусов и вирионах E1В. Может быть использован любой аденовирус из 42 известных различных серотипов или подгрупп A-F. Аденовирус типа 5 подгруппы С является предпочтительным стартовым материалом для получения цельного репликационно-дефектного вектора аденовируса для использования в методике, предлагаемой настоящим изобретением. Аденовирус типа 5 выбран потому, что в связи с этим аденовирусом человека накоплен значительный объем биохимической и генетической информации, и, кроме того, он традиционно применяется для большинства структур, использующих аденовирус в качестве вектора.
Дополнительными объектами настоящего изобретения являются новые сегменты DNA р53 или векторы экспрессии, а также рекомбинантные клетки-хозяева, которые инкорпорируют аденовирусный вектор р53, приготовленный в соответствии с настоящим изобретением. Сегменты DNA в соответствии с настоящим изобретением должны, в основном, содержать, в направлении 5'-3' транскрипции, промотор цитомегаловируса 1Е, структурный ген для природного человеческого р53 и ранний сигнал полиаденилации SV40. Рекомбинантная, содержащая аденовирус клетка-хозяин должна представлять собой эукариотическую клетку-хозяин или клетку млекопитающего, такую как, например, клетка 293, или такой клеткой может быть клетка с дефектом в гене р53, которая была инфицирована аденовирусом в соответствии с изобретением.
Следующие примеры осуществления изобретения касаются фармацевтических составов, содержащих аденовирус-рекомбинант, который кодирует природный р53, рассеянных в фармакологически допустимых растворах или буферных смесях. Предпочтительные фармакологически допустимые растворы включают нейтральные физиологические растворы, защищенные фосфатом, лактатом, трис (Tris) и т.п. Безусловно существует стремление очистить аденовирус до такой степени, чтобы существенно освободить его от нежелательных загрязнений, таких, например, как дефектные, создающие помехи аденовирусные частицы или эндотоксины и другие пирогены, чтобы этот аденовирус не вызывал побочных реакций в организме животного или человека, получающего векторную структуру. Предпочтительными средствами очистки вектора является создание условий для использования градиентов плавучей плотности, например центрифугирование хлорида цезия в градиенте плотности.
Последующие варианты.
Последующие варианты создания изобретения относятся к способу возбуждения экспрессии р53 или восстановления экспрессии природного протеина р53 в клетках, испытывающих дефицит в природном протеине р53. Для выполнения этой задачи следует обеспечить контакт клетки, несущей мутацию р53, с некоторым количеством аденовирусов-рекомбинантов, которые в соответствии с изобретением способны заставить проявиться экспрессии природного р53 в клетке. Это может быть осуществлено путем введения физиологически эффективного количества фармацевтического состава, содержащего аденовирус, в организм животного или человека, который поражен клетками с дефектным р53, каковыми, например, являются раковые клетки. Поэтому настоящее изобретение относится также к эффективным способам лечения раковых заболеваний человека, а именно рака груди и рака легких.
Еще в одном варианте осуществления изобретения аденовирус р53 с выраженной экспрессией р53 используется для предотвращения раковых заболеваний и даже для подавления роста метастазов. В одном из вариантов использования изобретения рекомбинантный аденовирус с проявляющейся экспрессией р53 используется для подавления бесконтрольного роста клеток, которые имеют мутации гена р53. В предпочтительных вариантах аденовирус с проявляющейся экспрессией р53 подавляет онкогенность и рост только клеток Н358, но никаких других, что может быть использовано в качестве индикатора функции р53.
В следующем варианте использования изобретения вирус с выраженной экспрессией р53 используется для предотвращения ортотопического роста опухоли легких при введении вируса внутритрахеальным способом. Вирус Ad5CMV показал обнадеживающие результаты в испытаниях на безволосых мышах. Вирус подавлял онкогенность пораженных вирусом клеток Н358, клеток которые нормально производят значительные опухолевые массы. Введение вируса также предотвращало ортотопический рост опухоли легких при введении вируса внутритрахеальным способом, сопровождающим внутритрахеальную инокуляцию клеток Н226Вr, подтверждая воздействие Ad5CMV-p53 in vitro на клетки рака легких. Онкогенность клеток рака легких подавлялась только посредством лечения Ad5CMV-p53, но не контрольным вирусом Ad5/RSV/GL2, что указывает на терапевтическую эффективность протеина р53. Специалистам, компетентным в данной области знаний, должно быть очевидно, что в соответствии с настоящим изобретением предполагаются и другие методы доставки вируса.
Поскольку все признаки данного изобретения представлены использованием структур р53, в связи с восстановлением нормальной функции клетки и для использования при лечении рака, существует предположение, что данное изобретение применимо, в основном, для любой ситуации, когда есть намерение достичь высокого уровня экспрессии протеина, подавляющего рост в клетке-мишени или клетке-хозяине путем использования аденовирусов-рекомбинантов. Например, в контексте моделей для лечения рака, касающихся формы, но не содержания, изобретением предлагается частный вариант, в дополнение к замещению р53, который представляет собой введение гена (rb) ретинобластомы, (с-mуc или с-ras) нечувствительных (антисенсорных) онкогенов и других генов, имеющих отношение к терапии рака человека.
Следует отметить, что, поскольку используемый вектор аденовируса является дефектной репликацией, он не сможет повториться (размножиться) в таких клетках, которые являются раковыми и которые обязательно инфицируются. Итак, при продолжении лечения определенной группы пациентов, например пациентов, которые вступили в начальную стадию терапии рака, для них может потребоваться повторное внедрение вируса после определенного периода времени, например через 6 месяцев или через год.
Векторы аденовируса по настоящему изобретению находят также применение в вариантах осуществления изобретения, которые непосредственно не связаны с генной терапией. Альтернативные варианты использования включают, например, анализы in vitro и исследования мутагенезиса различных генов р53 и рекомбинантное получение протеинов для использования, например, в воспроизведении антитела или в других вариантах. В вариантах изобретения, которые не связаны с терапевтическими способами лечения человека, включая все те, которые касаются дальнейшего определения активности р53 на молекулярном уровне, могут быть использованы другие соответствующие вирусы для переноса р53 в клетку. Вирусы, относящиеся к семейству герпес-вирусов, например герпес-симплекс - вирус (HSV), Эпштейн - Барр - вирус (EBV), цитомегаловирус (CMV), а также вирусы инфекционного бульбарного паралича (PRV) могут послужить доказательством данного суждения.
Отдельным аспектом настоящего изобретения является упрощение способа получения любого из типов аденовирусов-рекомбинантов благодаря исключению использования неэффективного способа трансфекции с применением в качестве промежуточного звена фосфата кальция и трудоемкой реакции розеткообразования. В соответствии с настоящим изобретением, чтобы получить аденовирус-рекомбинант, следует просто ввести плазмид аденовируса и вектор экспрессии в подходящую клетку-хозяин путем трансфекции с промежуточным звеном липосомы, а затем проанализировать культивированную клетку-хозяин на предмет присутствия цитопатогенного эффекта (СРЕ), который является показателем осуществления гомологической рекомбинации и получения вируса.
Новый способ отличается увеличением эффективности трансфекции первого этапа, который способствует лучшему протеканию второго, который эффективно проявляется на этапе цитопатогенного эффекта (СРЕ).
Предпочтительным составом для использования в трансфекции с промежуточным звеном липосомы является DOTAP (N-[1-(2,3-дидеоилокси)пропил]-N,N,N-триметиламмониумметисульфат), который доступен для приобретения на коммерческом рынке. Цитопатогенный эффект (СРЕ) является признаком, который поддается непосредственному наблюдению. Он может оцениваться путем использования метода фазово-контрастной микроскопии. Цитопатогенный эффект (СРЕ) характеризует морфологические признаки цитотоксичности аденовируса, которая начинается со сморщивания инфицированной клетки, за счет лизирующего влияния, и завершается образованием литической бляшки. Отличительной особенностью данного метода является то, что воспроизведение вируса обязательно дает о себе знать после 10-14 дней инкубационного периода. Это является значительным преимуществом по сравнению с трансфекцией, использующей в качестве промежуточного звена фосфат кальция и последующую реакцию розеткообразования, при которой требуется, по крайней мере, 14, а обычно минимум до 21 дня, хотя зачастую этот срок вырастает до нескольких недель, прежде чем могут быть оценены результаты.
В некоторых примерах осуществления способ по изобретению может быть использован в связи с аденовирусными плазмидами, которые являются репликационно-дефектными вместе с клеткой-хозяином, которая дополняет дефект, как показано на примере плазмид с недостающим Е1 и клеток 293. Аденовирусные плазмиды с недостающими функциональными Е1А и Е1В, которые инкорпорируют зону экспрессии р53, используются для описания примера осуществления способа по данному изобретению. Однако любые зоны экспрессии могут быть инкорпорированы в аденовирусе-рекомбинанте подобным образом. Отдельные методологические аспекты могут при желании меняться. Однако предполагается, что в определенных случаях должна быть предпочтительной среда MEM.
Данные новые методы могут быть скомбинированы с цепными реакциями полимеризации (PCR) для подтверждения наличия правильно рекомбинированного вируса.
Цепная реакция полимеризации (PCR) хорошо известна из уровня техники, см. патент США N 4683195, приведенный в качестве аналога. Чтобы получить возможность использования PCR в соответствии с настоящим изобретением, следует получить DNA из надосадочной жидкости клеток, проявляющих цитопатогенный эффект, и подвергнуть анализу DNA с использованием цепной реакции полимеризации (PCR), в которой участвуют две пары первичных элементов, один - специфический вектор экспрессии, другой - аденовирусный геном-специфическая DNA.
Вектор или вводимая специфическая DNA - (по определению) генный сегмент, который является частью DNA, кодирующей полипептид или генный сегмент RNA, который стремится к выражению своей экспрессии, как это проиллюстрировано DNA-экспрессией р53, mRNA и получением ротеина. Специфическая DNA генома аденовируса может являться любой частью генома, проявляющей свою экспрессию при управлении процессом воспроизведения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Частью настоящего описания являются чертежи, которые включены для дополнительного раскрытия определенных аспектов изобретения. Изобретение может быть лучше понято при обращении к одному или целому ряду приведенных чертежей в сочетании с подробным описанием отдельных вариантов осуществления изобретения.
На фиг. 1 дана схема образования аденовируса-рекомбинанта р53. Кассета экспрессии р53 была введена между Хbа I и Сlа I участками pXCJL. 1. Вектор экспрессии р53 (рЕС53) и рекомбинантный плазмид (pJM17) были подвергнуты котрансфекции в клетках 293. Зараженные клетки выдерживались в среде до тех пор, пока не проявлялся цитопатогенный эффект. Идентификация вновь образованных аденовирусов-рекомбинантов р53 (Ad5CMV - р53) производилась на пробах цепной реакции полимеризации (PCR) DNA с использованием матриц DNA, приготовленных из надосадочной жидкости, обработанной протеиназой К и экстрактом фенола.
На фиг. 2А показана карта, применяемая для структурных исследований DNA Ad5CMV-p53. Карта DNA генома AdCMV-p53 с местами расположения кассет экспрессии р53, первичных материалов цепной реакции полимеризации (PCR) и ограничивающих участков. Размер генома около 35,4 kb, разделенные на 100 ячеек карты (1 M.U. (ячейка карты) = 0,35 kb). Кассета экспрессии заняла место зоны Е1 (1,3 -9,2 M.U.) генома Ad5. Первичный элемент 1 сосредоточен в первом интроне, расположенном вниз по траектории движения промотора главного гена 1Е цитомегаловируса (CMV) человека. Первичный элемент 2 сосредоточен в зоне раннего сигнала полиаденилации SV40. Оба эти элемента, расположенные в 15-20 bp от ввода cDNA p53 на двух концах, определяют продукт 1,40 kb цепной реакции полимеризации (РСК). Первичные элементы 3 и 4 сосредоточены в 11 ячейке карты (M.U.) и 13,4 ячейке карты (M.U.) генома Ad5 соответственно и определяют специфический продукт 0,86 kb цепной реакции полимеризации (РСК) генома вируса.
На фиг. 2В показаны пробы геля агарозы продукта цепной реакции полимеризации (PCR). Две пары первичных элементов (параметров), которые определяют фрагменты DNA 1,4 kb (р53) и 0,86 kb (Ad5), были использованы в каждой реакции. В каждой реакции были использованы матрицы DNA: плазмид рЕС53 (1-я полоса), DNA Ad5/RCV/GL2 (2-я полоса), никаких DNA (3-я полоса) и DNA Ad5CMV-р53 (4-я полоса). Полоса с обозначением (M) соответствует генам-маркерам молекулярного веса.
На фиг.2С показано картирование ограничения DNA Ad5CMV-p53. Образцы DNA, очищенной от CsCl - градиента Ad5CMV - р53, были классифицированы по признаку отсутствия энзима (U), Hind III (Н) (задний, задняя нога туши). Ваm HI (В), Eco RI (Е) и Сlа I (С) соответственно и проанализированы на 1% геле агарозы. Дорожка с обозначением (M) соответствует генам-маркерам молекулярного веса.
На фиг.3А, 3В, 3С и 3D показаны результаты наблюдения цитопатогенных эффектов на клетках 293, полученных с помощью аденовируса-рекомбинанта. На фиг.3А, 3В, 3С и 3D даны серии фазовых контрастных изображений (х 400) клеток 293. На фиг.3А, 3В, 3С и 3D даны четыре фотографии одной фигуры, показанной на странице. Фигура 2А - перед трансфекцией, фигура 3В - отрицательный контрольный результат на 12-й день после трансфекции, фигура 3С - появление цитопатогенного эффекта (СРЕ) на 12-й день после трансфекции, фигура 3D - полное проявление цитопатогенного эффекта (СРЕ) на 14-й день после трансфекции.
На фиг. 4А, 4В, 4С и 4D дана иммунология клеток, инфицированных аденовирусами-рекомбинантами. На фиг.4А, 4В, 4С и 4D показаны серии иммунологических изображений клеток Н358. На фиг.4А, 4В, 4С и 4D даны 4 фотографии фигуры, представленной на одной странице. Проявление способности к инфицированию в клетках Н358. Клетки Н358 были инфицированы Ad5CMV-p53 или Ad5/RCV/GL2 в 50 PFU/клетка в течение 24 часов. Питательная среда была использована единственно в качестве смоделированной инфекции. Инфицированные клетки были проанализированы с помощью иммуноокрашивания. На фиг.4А представлены результаты испытаний смоделированной инфекции с помощью антитела anti-p53. На фиг. 4В показаны клетки, инфицированные контрольным Ad5/RSV/GL2 и испытанные с помощью антитела anti-p53. На фиг.4С даны инфицированные клетки Ad5CMV-p53, испытанные с помощью несвязанного антитела (МОРС - 21). На фиг.4D показана клеточная инфекция Ad5CMV, испытанная антителом anti-p53. В качестве антитела anti-p53 был использован Pab 1801, а для окрашивания применяли авидино-биотиновый метод.
На фиг.5А показано сравнение относительного уровня экспрессии экзогенного р53 в клетках Н358 с помощью геля SDS - PAGE, окрашенного в голубой цвет (Coomassie - blue). Образцы клеток Н358, которые были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 в 30 PFU/клетка, препарировались в течение 24 и 72 часов после инфицирования. Испытывались образцы пробы SDS -PAGE, окрашенной в голубой цвет (Coomassie - blue), с целью определения относительного содержания протеина. Полосы 1 и 4 содержат образцы клеток, инфицированных Ad5/RSV/GL2. Полосы 2 и 3 содержат образцы клеток, инфицированных двумя индивидуальными группами Ad5CMV-р53 через 24 часа после инфицирования. Полосы 5 и 6 - это образцы Ad5CMV-p53 - инфицированной клетки, собранные через 72 часа после инфицирования. Полоса 7 - это образец Н358 с моделированным инфицированием через 72 часа после инфицирования. Полоса М - это предварительно окрашенные гены-маркеры молекулярного веса в kDa (GIBCO - BRL).
На фиг.5В дан блотированный Western анализ геля, размещенного на полосе, идентичной той, которая принадлежит SDS-PAGE на фиг.5А. Относительные уровни экспрессии р53 были исследованы Western блотированием с использованием anti-р53. Первичные антитела были моноклональными антителами против протеина р53 (Pab 1801, Оncogene Science Inc.) и (β-актина (Amersham Inc.). HRP-конъюгированное вторичное антитело и ECL-проявитель были получены из вирусинфицированных клеток Н358, прошедших Western блотирование (Amersham Inc.). Отпечаток, полученный Western блотированием, на фиг.5В, имеет эквивалентную методику восстановления и лечения, что и у тех, которые представлены на фиг. 5А.
На фиг.6А и В показано время протекания экспрессии р53, определенное Western блотированием. Множественные чашки клеток Н358 были инфицированы Ad5CMV при 10 PFU/клетка. Клеточные лизаты были приготовлены в установленные моменты времени после инфицирования. Western блотирование было испытано с помощью антител анти-р53 и анти-актина одновременно. Полосы с отметкой С представляют отрицательные результаты. Гистограмма показывает относительные количества р53, определенные с помощью денситометра.
На фиг.7А показана кривая роста вирусинфицированных клеток рака легких у человека в клеточных линиях Н358. Клетки были засеяны в количестве 10 клеток на чашку (60 мм), при этом в процессе участвовали 6 чашек на одну клеточную линию. Через 24 часа клетки были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 m.о.i. (множественность инфицирования, т.е. PFU/клетка). После инфицирования клетки подсчитывались ежедневно в течение 6 дней. Кривые роста представляют данные, полученные при наблюдении четырех отдельных исследований.
На фиг.7В показана кривая роста вирусинфицированных клеток рака легких у человека в клеточных линиях Н322. Клетки были засеяны в количестве 105 клеток на чашку (60 мм), при этом в процессе участвовали 6 чашек на одну клеточную линию. Через 24 часа клетки были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 m.о.i. (множественность инфицирования, т.е. PFU/клетка). После инфицирования клетки подсчитывались ежедневно в течение 6 дней. Кривые роста представляют данные, полученные при наблюдении четырех отдельных исследований.
На фиг.7С показана кривая роста вирусинфицированных клеток рака легких у человека в клеточных линиях Н460. Клетки были засеяны в количестве 105 клеток на чашку (60 мм), при этом в процессе участвовали 6 чашек на одну клеточную линию. Через 24 часа клетки были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 m. о. i. (множественность инфицирования, т.е. PFU/клетка). После инфицирования клетки подсчитывались ежедневно в течение 6 дней. Кривые роста представляют данные, полученные при наблюдении четырех отдельных исследований.
На фиг. 8 показана схема последовательности операций при исследовании Ad5CMV - р53 в ортотопической модели рака легких. Дозировка и методика лечения безволосых мышей, зараженных клетками Н226Вr и вирусами, представлены в указанной схеме.
На фиг. 9А, 9В, 9С и 9D показаны образцы средостений, легких мышей, прошедших лечение, и контрольных мышей. Фиг.9А, 9В, 9С и 9D - это фотографии одной фигуры. Особь была принесена в жертву в конце 6-недельного периода, наступившего после прекращения лечения. Ткани легкого и средостения были иссечены для изучения опухолевого формообразования. На фиг.9А показан образец медиастинального блока от нормальной безволосой мыши. На фиг.9В дан образец медиастинального блока из мыши, которая была подвергнута лечению с помощью переносчика фосфатно-солевого буферного раствора (PBS). На фиг.9С показан образец медиастинального блока от мыши, прошедшей курс лечения Ad5CMV-р53. На фиг.9D представлен образец медиастинального блока, взятого от мыши, прошедшей курс лечения Ad5/RSV/GL2. Стрелки указывают на опухолевые массы.
ДЕТАЛЬНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
А. ЯВЛЕНИЯ, ПРОИСХОДЯЩИЕ НА МОЛЕКУЛЯРНОМ УРОВНЕ, ПРИ РАЗВИТИИ РАКА ЛЕГКИХ.
Исследования, проведенные авторами настоящего изобретения, идентифицировали принципиально важные явления на молекулярном уровне, ведущие к появлению и прогрессированию рака. Это дало возможность изобретателям разработать новые методы восстановления известных нормальных функций протеина до такой степени, когда фенотип, вызывающий раковые новообразования, может быть подавлен in vivo.
Наиболее распространенные гистологии рака легких (80%) объединены под названием "рак легких с вовлечением значительного количества клеток (NSCLC)" и включают сквамозный рак, аденокарциному и неидентифицированную форму рака с обширным вовлечением пораженных клеток. Накоплен большой банк данных, касающихся молекулярной биологии рака легких, которые основаны на изучении не так часто встречающейся формы рака легких с вовлечением небольшого числа клеток (SCLC). SCLC может быть отличен от NSCLC по нейроэндокринным признакам клеток. SCLC очень чувствителен к химической терапии, но быстро возобновляется после прохождения пациентом курса лечения. NSCLC также может служить моделью для других форм эпителиального рака, вызванного канцерогенными веществами. Научные достижения, полученные в результате создания настоящего изобретения, могут быть использованы для лечения других форм эпителиального рака.
Накоплен богатый опыт, подтверждающий тот факт, что процессу злокачественных трансформаций предшествует генетическая парадигма. Основные патологические изменения, происходящие в раковых клетках, касаются доминантных онкогенов и генов-супрессоров новообразований. Доминантные онкогены имеют альтернативы в классе генов, названные протоонкогенами, которые участвуют в принципиально важных функциях нормальных клеток, включая сигнальную трансдукцию и транскрипцию. Первостепенной важности модификации в доминантных онкогенах, которые обеспечивают возможность трансформации, включают точечные мутации, трансформации, реклассификации и амплификации (расширения, усиления). Гены - супрессоры новообразований - необходимы для осуществления гомозиготной утраты функций за счет мутации и удаления или комбинирования последних, с целью получения трансформаций. Некоторые гены - супрессоры новообразований - предназначены для осуществления процессов управления разрастанием клеток путем регулирования трансплантации. Модификация экспрессии доминантных онкогенов и генов-супрессоров, по всей вероятности, влияет на определенные характеристики клеток, которые способствуют возникновению злокачественного фенотипа.
Несмотря на увеличение накопленных знаний о механизмах, происходящих в процессе трансформаций, испытывающих опосредствованное влияние онкогенов, недостаточное развитие получили терапевтические методы лечения, действие которых должно быть направлено специально на онкогены и их продукты, служащие мишенью для воздействия на них при лечебном процессе. Первоначально исследования в этой области были сосредоточены на доминантных онкогенах, поскольку они первыми требовали описания. Исследования процесса переноса DNA - промежуточного гена продемонстрировали механизм приобретения злокачественного фенотипа нормальными клетками в результате переноса DNA от злокачественных опухолей человека.
В. Р53 И МУТАНТЫ Р53 В РАКОВЫХ НОВООБРАЗОВАНИЯХ.
Р53 известен как ген-супрессор опухолевых новообразований (Montenarh, 1992). Высокие уровни его были обнаружены во многих клетках, трансформированных химическим онкогенезом, ультрафиолетовой радиацией и различными вирусами, включающими SV40. Ген р53 представляет собой часто встречающуюся мишень мутируюшей инактивации в большом разнообразии опухолевых новообразований человека, и уже документально подтверждено, что он является наиболее часто встречающимся мутированным геном в традиционных раковых новообразованиях (Mercer, 1992). Он мутируется более чем в 50% рака легких с довольно обширным вовлечением клеток (NSCLC) (Hollestein et al., 1991) и в большом количестве других новообразований.
Ген р53 кодирует фосфопротеин аминовой кислоты -375, который может формировать комплексы с протеинами-хозяевами, например обширный Т-антиген и Е1В. Протеин обнаружен в нормальных клетках и тканях, но в концентрациях, которые незначительны в сравнении с трансформированными клетками или тканями опухолевых новообразований. Интересен тот факт, что природный р53, как было установлено, играет важную роль в процессе регулирования роста клеток и их делении. Чрезмерная экспрессия природного р53, как выяснилось, в некоторых случаях подавляет пролифератию в клеточных линиях опухолевых новообразований человека. Так, р53 может действовать как негативный регулятор клеточного роста (Weinberg, 1991) и может непосредственно подавлять бесконтрольный рост клеток или выполнять эту функцию опосредованно, активизируя гены, которые подавляют этот рост. Отсутствие природного р53 или лишение его активности может способствовать возникновению процесса трансформации.
Однако некоторые исследования указывают на то, что присутствие мутантного гена р53 может оказаться необходимым для полной экспрессии трансформирующего потенциала гена. Хотя признано, что природный ген р53 является чрезвычайно важным регулятором роста для многих типов клеток, играют роль также его генетические и биохимические признаки. Миссенс-мутации являются обычными для гена р53 и существенными для трансформирующей способности онкогена. Единственное генетическое изменение, подсказанное точечными мутациями, может создать канцерогенный р53. Однако известно, что в отличие от других онкогенов точечные мутации р53 встречаются, по крайней мере, в 30 отдельных кодонах, часто создавая доминантные аллельные гены, которые способствуют образованию смещений в фенотипе клетки без репозиции до гомозиготы. Кроме того, многие из этих доминантных негативных аллельных генов иногда переносятся в организме и передаются в линию зарождения инфекции. Различные мутантные аллельные гены могут переходить из минимально дисфункционального состояния в состояние чрезвычайно проникающих, доминантных негативных аллельных генов (Weinberg, 1991).
Casey и его коллеги показали, что трансформация DNA, кодирующая природный р53 в двух клеточных линиях рака груди человека, восстанавливает функцию управления подавлением роста в таких клетках (Casey et al., 1991). Подобный эффект был также продемонстрирован на трансфекции природного, но не мутантного, р53 в клеточных линиях рака легких человека (Takahasi et al., 1992). Р53 проявляет доминантные признаки по сравнению с мутантным геном и может произвести отбор против пролифератии после трансфекции в клетке с мутантными генами. Нормальная экспрессия подверженного трансфекции гена р53 не воздействует на рост клеток с эндогенным р53. Таким образом, такие структуры могут восприниматься нормальными клетками без побочных эффектов.
Исходя из изложенного можно заключить о возникновении возможности лечения рака, имеющего отношение к р53, природным р53 путем уменьшения количества раковых клеток. Однако исследования, приведенные выше, далеки от практического применения, хотя бы потому, что трансфекция DNA не может быть использована для внедрения DNA в раковые клетки в организме больного.
С. МЕТОДЫ ГЕННОЙ ТЕРАПИИ
Разработано несколько экспериментальных методов применения генной терапии, но они все имеют значительные нeдocтaтки (Mulligan, 1993). Как указывалось выше, существует целый ряд основных методов трансфекции, в которых DNA, содержащая интересующий нас ген, вводится в клетки не биологическим путем, а, например, путем физического или химического проникновения через клеточную оболочку. Естественно, такие методы ограничены клетками, которые могут быть временно извлечены из организма и в состоянии перенести цитотоксичность лечения, т. е. лимфоциты. Липосомы, или протеиновые конъюгаты, образованные определенными липидами, амфофильными пептидами, могут быть использованы для трансфекции, но эффективность интегрирования гена остается все еще низкой, порядка одного случая интеграции на 1000-1000000 клеток, а экспрессия зараженного гена часто ограничивается днями в разрастающихся клетках и неделями в неразрастающихся клетках. Поэтому совершенно очевидно, что метод трансфекции не может считаться подходящим для лечения рака.
Второй метод основывается на естественной способности вирусов проникать в клетки, внедряя в них свой собственный генетический материал. Ретровирусы имеют преимущество в качестве векторов для переноса генов, благодаря своей способности внедрять свои гены в геном-хозяин, перенося большое количество чужеродного генетического материала, инфицируя широкий спектр специфических групп клеток, которые выстраиваются в специфические клеточные линии. Однако существуют три основные проблемы, препятствующие практическому использованию ретровирусных векторов. Первое - ретровирусное инфицирование зависит от доступности вирусных рецепторов на поверхности мишени. Второе - ретровирусы эффективно интегрируют только в репликационные клетки. Наконец, последнее - ретровирусы трудно сконцентрировать и обеззаразить.
D. АДЕНОВИРУСНЫЕ СТРУКТУРЫ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В ГЕННОЙ ТЕРАПИИ
Аденовирусы человека - это опухолевые вирусы двунитевой DNA с размерами генома около 36 kb (TOOZA, 1981). Аденовирусы были широко изучены и описаны в качестве модельной системы для эукариотической генной экспрессии, что заставляет воспринимать их как привлекательную систему для использования аденовирусов в качестве системы для переноса генов. Такую группу вирусов легко выращивать и использовать, при этом они проявляют широкий круг хозяев in vitro и in vivo. В литически инфицированных клетках аденовирусы способны отсечь синтез протеина-хозяина, направляя клеточные механизмы на синтез большого количества вирусных протеинов и получение обильного количества вирусов.
Зона Е1 генома включает Е1А и Е1В, которые кодируют протеины, ответственные за регулирование транскрипции вирусного генома и некоторых клеточных генов. Экспрессия Е2, включающая Е2А и Е2В, обеспечивает синтез вирусных репликационных функций, например DNA-связанного протеина, DNA-полимеразы и окончательного протеина, что создает почву для репликации. Продукты гена Е3 предупреждают цитолиз, вызываемый цитотоксичными Т-клетками, и фактор некроза опухоли и играют важную роль для вирусного воспроизведения.
Функции, ассоциированные с протеинами Е4, включают репликацию DNA, экспрессию последнего гена и отсечение клетки-хозяина. Продукты последнего гена включают большинство протеинов капсида вириона, при этом они проявляются только после того, как большая часть производства единственного главного транскрипта из основного последнего промотора будет выполнена. Последний основной промотор (MLP) проявляет высокую эффективность в процессе последней фазы инициирования (Stratford - Perricaudet and Perricaudet, 1991a).
Поскольку только небольшая часть вирусного генома требуется in cis (Tooza, 1981), аденовирус - производные векторы предлагают отличный потенциал для замещения обширных фрагментов DNA при использовании связи с такими клеточными линиями, как для клеток 293. Ad5-тpaнcфopмиpoвaннaя клеточная линия мезонефроса (первичной почки) (Graham et al., 1977) была создана для обеспечения основных вирусных протеинов in trans. Изобретатели, таким образом, показали, что данные характеристики аденовирусов продемонстрировали хорошие предпосылки для их использования с целью прицельного попадания в раковые клетки in vitro (Grunhaus & Horwitz, 1992).
Особые преимущества аденовирусной системы для переноса инородных протеинов в клетку включают:
(1) способность к замещению относительно больших фрагментов вирусной DNA с помощью чужеродной DNA;
(2) структурную стабильность аденовирусов-рекомбинантов;
(3) безопасность аденовирусного назначения для человека;
(4) отсутствие каких бы-то ни было известных ассоциаций аденовирусной инфекции с раком или злокачественными образованиями;
(5) способность к получению высоких титров при использовании вируса рекомбинанта при лечении;
(6) высокую эффективность аденовируса.
Еще одним преимуществом аденовирусных векторов, по сравнению с ретровирусами, являются высокие уровни экспрессии гена. Кроме того, репликация аденовируса не зависит от репликации гена-хозяина, что выгодно отличает его применение от применения ретровируса. Поскольку аденовирусные трансформирующие гены в зоне Е1 могут быть свободно удалены и при этом обеспечивать существование векторов эффективной экспрессии, существует мнение, что онкогенный риск от аденовирусных векторов сводится к минимуму и не принимается в расчет (Grunhaus & Horwitz, 1992).
В основном, аденовирусные системы переноса генов основываются на рекомбинантном сконструированном аденовирусе, который представляет собой репликацию, не укомплектованную за счет отсутствия части ее генома, например Е1, но при этом сохраняющую еще способность к инфицированию. Относительно большое количество чужеродных протеинов может быть проявлено, если в аденовирусном геноме осуществить дополнительные удаления. Например, аденовирусы, неукомплектованные в обеих зонах Е1 и Е3, способны переносить до 10 kb чужеродной DNA и могут быть выращены до высоких титров в клетках 293 (Stratford - Perricaudet & Perricaudet, 1991a). Кроме того, была отмечена также удивительно продолжительная экспрессия трансгенов, сопровождающая аденовирусное инфицирование.
Способ переноса гена с помощью аденовируса недавно был изучен в качестве средства переноса гена-посредника в эукариотические клетки живых организмов. Например, при лечении мышей с редким рецессивным генетическим расстройством - орнитозным транскарбамилаза-дефицитом (Ornithine transcarbamylase, OTC) - было обнаружено, что аденовирусные структуры могут быть использованы для снабжения нормальными (OTC) энзимами. К сожалению, экспрессия нормальных уровней (OTC) была достигнута только в 4 из 17 примеров (Stratford - Perricaudet et al., 1991b). Поэтому дефект был только частично исправлен у большинства мышей, что не привело ни к физиологическим, ни к фенотипическим изменениям, а значит, такие результаты оставляют мало надежды на возможность использования аденовирусных векторов в терапии рака.
Попытки использовать аденовирус при переносе гена для регулятора трансмембранной проводимости при фиброзно-кистозной дегенерации (CFTR) в легочный эпителий хлопковых крыс также имели только частичный успех без возможности получения биологической активности перенесенных генов в эпителии животных (Rosenfeld et al., 1992). И опять-таки эти исследования продемонстрировали перенос гена и экспрессию протеина CFTR в клетках легочных дыхательных путей (воздуховодов), но не подтвердили никакого физиологического эффекта. В 1991 г. научная статья авторов Rosenfeld et al. показала легочную экспрессию α-1-антитрипсин-протеина, которая опять-таки не дала физиологического эффекта. Авторы этой статьи пришли к выводу, что уровни экспрессии, которую они наблюдали, составляют всего 2 процента от того уровня, который требуется для защиты легкого человека, т.е. эти уровни намного ниже тех, которые способны дать физиологический эффект.
Ген для человеческого α1-антитрипсина был введен в печень нормальных крыс путем интрапортальной инъекции, где наблюдалась его экспрессия, результатом чего было обнаружение секреции веденного человеческого протеина в плазме этих крыс (Jaffe et al., 1992). Однако полученные уровни не были достаточно высоки, чтобы оказать какое-либо терапевтическое воздействие.
Итак, данные результаты не подтверждают того, что аденовирус в достаточной степени способен направить экспрессию достаточного протеина в рекомбинантных клетках на получение релевантного физиологического эффекта, и поэтому они не высказывают предположения об использовании потенциальных возможностей аденовирусной системы для лечения рака. Кроме того, в существовавшем до настоящего времени уровне техники бытовало мнение, что р53 не может быть инкорпорирован в упакованную клетку, такую, которую они использовали для получения аденовируса, так как она могла быть токсичной. То, что Е1В аденовируса присоединяется к р53, было воспринято как еще одна причина того, что технологии аденовируса и р53 не могут сочетаться.
Е. СТРУКТУРЫ АДЕНОВИРУСА Р53 И ПОДАВЛЕНИЕ ОПУХОЛЕВЫХ НОВООБРАЗОВАНИЙ
Настоящее изобретение предлагает генную терапию рака с новым и более эффективным вектором подавления опухолевых новообразований. Данный рекомбинантный вирус использует преимущества аденовирусных векторов, такие как высокие титры, широкий диапазон поражения, эффективная трансдукция и неспособность интегрировать в клетки-мишени. В одном из примеров осуществления изобретения получают репликационно-дефектный, не требующий помощника независимый аденовирус, который способствует проявлению экспрессии природного р53 (Ad5CMV-p53) под управлением человеческого цитомегаловирусного промотора.
Контрольные функции на векторах экспрессии часто обеспечиваются вирусами, когда хотят достичь экспрессии в клетках млекопитающих. Например, обычно используемые промоторы являются производными от полиомы, аденовируса 2 и вакуолизирующего обезьяньего вируса 40 (SV40). Ранние и поздние промоторы вируса SV40 являются особенно часто применяемыми, так как они оба легко получаются из вируса в виде фрагмента, который содержит SV40-вирусный источник репликации. Меньшие или большие SV40-фрагменты могут быть также использованы при условии, что включено приблизительно 250 bp последовательности, простирающейся от участка Hind III по направлению к участку Bg II, сосредоточенному в вирусном источнике репликации. Кроме того, возникает также возможность, и часто желаемая, использования промотора или контрольных последовательностей, нормально ассоциированных с включенной генной последовательностью, при условии, что такие контрольные последовательности совместимы с системами клетки-хозяина.
Источник репликации может быть обеспечен структурой вектора, чтобы включить экзогенный источник, такой, например, который может быть производным от SV40 или других (например, полиомы, адено, VSV, BPV) вирусных источников, или может быть снабжен механизмом хромосомной репликации клетки-хозяина. Если вектор интегрируется в хромосому клетки-хозяина, этого бывает достаточно.
Структура и воспроизведение предпочтительного аденовируса р53 представлены в виде графической схемы на фиг.1. В связи с этим был разработан улучшенный протокол для воспроизведения и идентификации аденовируса-рекомбинанта (будет описано ниже). После идентификации аденовирус-рекомбинант р53 был структурно подтвержден анализами цепной реакции полимеризации (PCR), как показано на фиг.2. После изоляции и подтверждения структуры аденовирус р53 был использован для инфицирования клеточной линии Н358 рака легких человека, которая имела гомозиготное удаление гена р53. Отпечатки (реплики) Western показали, что экзогенный протеин р53 проявил экспрессию на высоком уровне (фиг. 4 и 5), а пик его экспрессии пришелся на 3-й день после инфицирования (фиг.6).
Было также показано в клеточной линии Н322 точечной мутации р53, что мутант р53 был отрегулирован с понижением уровней экспрессии экзогенного р53. В качестве экспериментального контрольного элемента был использован вирион Ad5/RSV/GL2, который имел структуру, похожую на структуру Ad5CMV-p53. Этот вирус содержал CDNA-люциферазу, произведенную LTR-промотором вируса Rous-саркомы в кассете экспрессии вириона. Ни экспрессии р53, ни изменения в экспрессии актина не было обнаружено в клетках, инфицированных Ad5/RSV/GL2 вириона. Рост клеток Н358, инфицированных Ad5CMV-р53, был в большей степени подавлен, по сравнению с неинфицированными клетками или клетками, инфицированными контрольным вирионом (фиг.7А). Рост клеток Н322 был также в большой степени подавлен вирионом р53 (фиг.7В), в то время как рост клеток Н460 раковых опухолей человека, содержащих природный р53, испытывал меньшее влияние (фиг.7С).
Ad5CMV-p53 оказал сильное подавляющее воздействие на рост клетки рака легких in vitro. Подавление роста не было столь очевидно, когда клетки были инфицированы Ad5CMV-p53 при MOI (множественности инфицирования) ниже чем 1 PFU/клетка, а при MOI выше чем 100 PFU/клетка цитотоксичность наблюдалась даже у контрольного вируса Ad5/RSV/GL2. В наших исследованиях оптимальной дозой для изучения возрастного состава популяции было значение 10 - 50 PFU/клетка. В диапазоне этой дозы подавление роста клетки было показательно для протеина р53 с проявленной экспрессией р53.
Испытания, проведенные на безволосых мышах, продемонстрировали, что способность к образованию опухолей в клетках Н358, пролеченных Ad5CMV-p53, была значительно снижена. В экспериментальной модели с мышами ортотопического рака легких человека онкогенные клетки Н226Вr с точечной мутацией были введены внутритрахеально за три дня до начала лечения вирусом. Внутритрахеальная инстилляция Ad5CMV-p53 предупреждала формирование опухолей в данных модельных системах, предполагающих, что модифицированный аденовирус является эффективным вектором для промежуточного переноса и экспрессии генов-супрессоров опухоли на уровне раковых клеток человека и что вирус Ad5CMV-p53 впоследствии может быть усовершенствован до получения терапевтического средства с целью использования его в генной терапии рака.
Ad5CMV-p53 является посредником при получении высокого уровня экспрессии гена р53 в клетках рака легких человека, что продемонстрировано Western-блотированными анализами. Экзогенный протеин р53 был почти в 14 раз обильнее, чем эндогенный природный р53 в клетках Н460, и почти в два - четыре раза обильнее, чем β-активный внутренний контроль в клетках Н358. Высокий уровень экспрессии может быть объяснен присутствием высокоэффективного переносчика гена, сильного промотора цитомегаловируса (CMV), приводящего в движение р53-CDNA, и аденовирусного El-усилителя, активизирующего транскрипцию CDNA-р53. Продолжительность экспрессии р53 после инфицирования составила более 15 дней в клетках Н358. Однако наблюдалось быстрое затухание экспрессии по истечении 5 дней после инфицирования. Анализы цепной реакции полимеризации на образцах DNA на инфицированных клетках Н358 показали снижение уровня вирусной DNA с уменьшенным уровнем протеина, указывающим на потерю вирусной DNA в процессе непрерывного роста раковых клеток in vitro.
Понижение экспрессии р53 также может явиться результатом клеточной аттенуации промотора цитомегаловируса, который контролирует степень экспрессии р53, поскольку явление отсечения промотора цитомегаловируса - промежуточной клетки-хозяина уже известно (Dai et al., 1992). Аденовирусные векторы представляют собой неинтегрированные векторы - переносчики генов и поэтому длительность экспрессии гена зависит от целого ряда факторов, включающих клетки-хозяева, перенесенные гены и соответствующие промоторы. Кристалл и соисполнители показывали низкий уровень экспрессии гена -регулятора трансмембранной проводимости в фиброзно-кистозных дегенерациях в клетках эпителия хлопковой крысы, что обнаруживало себя через 6 недель после инфицирования (Rosenfeld et al., 1992). Лаборатория Perricaudet продемонстрировала минимальную экспрессию гена - минидистрофина в mdx мышце мыши, которая длилась более трех месяцев после инфицирования. Скоротечные экспрессии высокого уровня природного протеина р53, наблюдавшиеся в настоящем исследовании, могут иметь обнадеживающие результаты, вызывающие снижение возможных побочных влияний на нормальные клетки, сопровождающие in vivo лечение с помощью Ad5CMV-p53.
Раскрытые в данном описании результаты указывают на то, что аденовирус-рекомбинант р53 обладает свойствами подавления опухолей, при этом он осуществляет эти действия за счет восстановления функции протеина р53 в раковых клетках. Эти результаты дают возможность заявить об использовании вириона Ad5CMV-р53 в качестве терапевтического средства для лечения рака.
F. УЛУЧШЕННЫЙ ПРОТОКОЛ ДЛЯ ВОСПРОИЗВЕДЕНИЯ И ИДЕНТИФИКАЦИИ АДЕНОВИРУСА-РЕКОМБИНАНТА
Аденовирус-рекомбинант как новая система переноса гена имеет много сфер потенциального применения в генной терапии и для создания вакцин. Воспроизведение вируса-рекомбинанта является поэтому важным биологическим инструментом на молекулярном уровне. Существующие способы воспроизведения аденовирусов-рекомбинантов используют преципитацию фосфата кальция в качестве промежуточного звена при трансфекции клетки 293 с последующими реакциями розеткообразования на зараженных клетках. Эффективность трансфекции, связанная с этим методом, требует улучшения, а сама процедура должна быть упрощена.
В техническом уровне до создания изобретения воспроизведение аденовируса -рекомбинанта обычно проводилось за счет трансфекции с промежуточным звеном фосфата кальция. Этот процесс вовлекает проявляющие экспрессию клетки в векторную или плазмидную DNA в фосфате кальция в течение нескольких часов перед быстрой шоковой терапией, например в течение одной минуты в 15-процентном глицероле. Данные методы страдают значительным недостатком, который заключается в том, что только низкие уровни DNA инкорпорируются в клетке, т. е. эти методы являются малоэффективным средством трансфекции. На вирусное воспроизведение было также указано появлением бляшек, которые в поле зрения выглядели светлыми круглыми зонами вокруг лизированных клеток, что обнаруживает клеточный лизис, вызванный воспроизведением вируса.
Настоящим изобретением предложен новый способ получения аденовируса, который значительно повышает эффективность трансфекции, а также упрощает селекцию. В соответствии с изобретением установлено, что соединение трансфекции с промежуточным звеном липосомы, например трансфекции с промежуточным звеном DOTAP, с наблюдением цитопатогенного эффекта (СРЕ) ведет как к повышению эффективности, так и к быстрому и упрощенному процессу определения объекта. В предложенном способе перенос гена с помощью промежуточного звена - DOTAP-липосомы - используется для переноса вектора экспрессии и плазмида рекомбинации в клетки 293. Зараженные клетки, вместо присоединения к 0,5-процентной агарозе для получения реакции розеткообразования, длительное время выдерживаются в питательной среде для получения цитопатогенного эффекта (СРЕ).
В двух исследованиях, использующих новый метод, 2 лунки из 24 лунок чашки Петри и 3 чашки из пяти 60-миллиметровых чашек обнаружили цитопатогенный эффект на 10-й и 12-й день после трансфекции соответственно. Напротив, при использовании метода преципитации фосфата кальция, ни один вирус-рекомбинант не был получен в трех пробах при участии в котрансфекции двадцати 60-миллиметровых чашек на каждый эксперимент. Использование проб CAT в клеточных линиях HepG2 & HeLa трансфекция с промежуточным звеном DOTAP показало в пяти складках повышенную активность CAT по сравнению с трансфекцией с промежуточным звеном фосфата кальция.
Исключение формирования накладки агарозы после котрансфекции также упрощало процесс. Конечная цель исследования, воспроизведение вируса, становится более понятной и легче достижимой благодаря возможности непосредственного наблюдения за цитопатогенным эффектом (СРЕ), вместо идентификации розеток, что обычно было лишено наглядности и трудно осуществимо после 10-14 дней инкубационного периода. Фиг. 3 показывает культуру клетки с цитопатогенным эффектом в сравнении с клеточной культурой, у которой отсутствует цитопатогенный эффект (СРЕ).
Изобретатели также разработали способ быстрого определения титров аденовируса с использованием цепной реакции полимеризации (PCR). Непосредственная проба PCR на образцах DNA из надосадочной жидкости клеточной культуры с цитопатогенным эффектом (СРЕ) обычно использует две пары первичных элементов: одну, предназначенную для усиления специфического включения, другую - для усиления вирусных геном-специфических последовательностей. Изобретатели показали, что аденовирусы, выделенные в среде клеточной культуры, способны определяться в процессе цепной реакции полимеризации, таким образом позволяя приготовить матрицы DNA, использовав ничтожно малое количество, около 50 мкл, надосадочной жидкости.
Идентификация специфических включений и вирусных геном - специфических последовательностей DNA, вытекающих из усиления цепной реакции полимеризации, может быть определена, например, с помощью пробы, полученной из PCR-усиленного продукта на гелях агарозы. Пучки волокон (полосы хромосом) соответствуют специфическим включениям DNA и вирусным геном-специфическим DNA. Кроме того, исходные элементы могут быть идентифицированы, благодаря сравнению с соответствующими стандартными маркерами.
Там, где цепная реакция полимеризации используется для усиления специфических включений и вирусных геном-специфических генных продуктов, может быть впервые получена возможность приготовить исходное средство для получения последовательности, которая должна быть усилена. Эффективное и избирательное усиление достигается путем использования двух пар первичных элементов: одна - для усиления определенного участка специфического продукта включения, другая - для определения сегмента вирусного геном-специфического продукта. Только для примера, кассета для экспрессии р53 была сконструирована с человеческим цитомегаловирусным (CMV) промотором и ранним сигналом полиаденилации SV40. Первая группа исходных элементов должна включать исходный элемент, сконцентрированный в первом интроне, расположенном вниз по ходу перемещения промотора главного гена IE цитомегаловируса (CMV) человека, тогда как другой первичный элемент первой группы исходных элементов должен быть сосредоточен в раннем сигнале полиаденилации SV40. При идеальных условиях оба этих первичных элемента располагаются на расстоянии 15-20 базовых пар от включения cDNA, которым в иллюстративном примере является р53.
Должен быть установлен определенный продукт цепной реакции полимеризации (PCR), например cDNA р53 1,40 kb. В качестве примера, вторая группа исходных элементов может быть сконцентрирована в районе 11 M.U. (ячейка карты) и 13,4 M. U. (ячейка карты) генома Ad5 для того, чтобы определить 0,86 kb вирусного геном-специфического продукта цепной реакции полимеризации.
Селекция исходного элемента хорошо известна тем, кто следит за уровнем техники в данной области. Существует возможность конструирования первичных элементов для усиления отобранных участков до последовательностей DNA, чья последовательность базовой пары известна. Первичные элементы гибридизируются до DNA и выступают в роли начальных участков для синтеза участков гена. Исходные элементы нуклеотидов предназначены для связывания на отдельных участках на противоположных дуплексных штаммах, таким образом определяя вводимую последовательность в качестве участка, который должен быть усилен. Молекулы нуклеиновой кислоты, которые являются первичными элементами, должны, в основном, включать, по меньшей мере, последовательность 10-базовой пары, которая должна соответствовать сегменту DNA, предназначенному для выполнения усилительной функции. Размер 10-базовой пары выбирается в качестве главного нижнего предела, для указанных размеров менее чем 10 баз не могут активно гибридизироваться, а наступление стабилизации может стать проблемой. Лучшими вариантами могут считаться размеры 15-20, которые используются в предпочтительных вариантах. В варианте, показанном на фиг.1, используются размеры 19 и 20 базовых пар.
G. ПАЦИЕНТЫ И ПРОТОКОЛЫ ЛЕЧЕНИЯ
Изобретатели предполагают, что региональная доставка аденовирусных р53 генных структур в клетки рака легких больных формой рака, имеющей отношение к р53, например неоперабельной, закупоривающей эндобронхиальной формой рака, окажется эффективным способом доставки терапевтически эффективного гена, способного противостоять клинике заболевания. Имеется предположение, что такой подход к решению проблемы является значительным усовершенствованием в развитии терапевтических способов лечения раковых заболеваний, которые основаны на попытках убить или удалить последнюю раковую клетку. Поскольку скрытая потенция раковой клетки является установленным фактором, эффективное ее уничтожение всегда составляло проблему.
Существует мнение, что поглощение аденовирусных структур клетками NSCL должно снизить степень разрастания этих клеток. Это должно продлить промежуток времени, когда больное легкое может оставаться в расширенном состоянии, предотвратить возобновление роста эндобронхиальной опухоли и продлить жизнь больного.
Больные с рецидивом неоперабельной эндобронхиальной опухоли, которая частично или полностью закрывает дыхательные пути и которая безуспешно подвергалась или не может быть подвергнута наружной радиотерапии, были выбраны для протокола лечения предлагаемым способом. Существующие терапевтические способы лечения в таких условиях предлагают только кратковременное облегчение. Большинство пациентов получили рецидивы, несмотря на лучевую радиотерапию. Существует возможность введения брахитерапевтического катетера и назначения дополнительной адиотерапии. Больные, получившие такое лечение, могли прожить в среднем 6 месяцев. Больные, для которых брахитерапевтическое лечение оказалось неэффективным, также были отобраны для получения генной терапии. Опухоль может быть удалена из дыхательных проходов с помощью лазера или биопсийных щипцов. Это может быть выполнено в сочетании с вводом аденовирусных структур, уменьшая таким образом объем, который должен быть введен. Назначение вирусных структур не должно препятствовать назначению пациентам других паллиативных средств, если опухоль прогрессирует.
Включены следующие примеры, демонстрирующие предпочтительные варианты осуществления изобретения. Специалисты в данной области должны принять к сведению, что технологические приемы показаны в примерах, которые соответствуют способам, раскрытым изобретением, чтобы дать представление об их осуществлении в соответствии с изобретением и, таким образом, показать осуществимость изобретения в его предпочтительных вариантах. Однако исходя из принципов раскрытия данного изобретения специалисты должны отдавать себе отчет в том, что на практике способы по данному изобретению могут быть осуществлены с использованием эквивалентной замены некоторых признаков с достижением аналогичного результата, оставаясь при этом в рамках сущности изобретения, выраженной в изложении его формулы.
ПРИМЕР 1
Структура вектора экспрессии р53.
Настоящий пример описывает структуру вектора экспрессии р53. Данный вектор сконструирован и используется для замещения зоны Е1 (1,3-9,2 M.U.) генома Ad5 аденовирусного штамма и получения структуры аденовирусного вириона, описанного в примере 2.
Кассета экспрессии р53, показанная на фиг.1, содержащая промотор цитомегаловируса (CMV) человека (Boshart et al., 1985), p53 cDNA и ранний сигнал полиаденилации SV40, была установлена между участками Xba I & Cla I pXCJLI (описано Dr. Frank, L.Graham, Mc Master University, Canada). Размер генома составляет около 35,4 kb, разделенные на 100 карточных ячеек (1 M.U. (карточная ячейка) = 0,35 kb). Кассета экспрессии р53 заместила зону Е1 (1,3-9,2 M.U.) генома Ad5.
Первичный элемент 1 имеет последовательность 5'-GGCCCACCCCCTTGGCTTC -3' (SEQ ID NO: 1) и сосредоточен в первом интроне вниз по движению промотора главного гена 1Е цитомегаловируса человека (Boshart et аl., 1985). Первичный элемент 2 имеет последовательность 5' - TTGTAACCATTATAAGCTGC - 3' (SEQ ID NO: 2) и сосредоточен в раннем сигнале полиаденилации SV40. Оба первичных элемента, 15-20 bp от включения cDNA р53 на обоих концах определяют продукт цепной реакции полимеризации 1,40 kb. Первичный элемент 3 имеет последовательность 5'-TCGTTTCTCAGCAGCTGTTG-3' (SEQ ID NO:3) и первичный элемент 4 имеет последовательность 5' ATCTGAACTCAAAGCGTGG-3 (SEQ ID NO:4) и расположены в 11 M.U. и 13,4 M.U. генома Ad5 соответственно, которые пределяют продукт 0,86 kb вирусной геном-специфической цепной реакции полимеризации.
ПРИМЕР 2
Образование и воспроизведение аденовируса-рекомбинанта р53.
Данный пример описывает способ, применяемый для образования помощник-независимого рекомбинантного аденовируса, проявляющего экспрессию р53. Молекулярный алгоритм, примененный для получения аденовируса-рекомбинанта, основан на том факте, что благодаря лимиту упаковки (дозировки) аденовируса pJM17 может формировать вирус самостоятельно. Поэтому гомологические рекомбинации между векторным плазмидом экспрессии р53 и pJM17 в инфицированной клетке позволит получить результат в виде жизнеспособного вируса, который может быть упакован только в клетках, в которых созданы условия для экспрессии протеинов. В данном примере клетки 293 используются в качестве клеток-хозяев для воспроизведения вирусов, которые содержат замещения кассет экспрессии гетерологической DNA в зонах Е1 и Е3.
Этот процесс требует котрансфекции DNA в клетках 293. Трансфекция широко определяет эффективность вирусного воспроизведения. Способ, использованный для трансфекции DNA в клетках 293 до создания настоящего изобретения, обычно включал использование фосфата кальция/копреципитации DNA (Graham & van der Eb, 1973). Однако этот способ совместно с розеткообразованием относительно трудно осуществим и обычно заканчивается малой эффективностью воспроизведения вирусов. Как показано на этом примере, трансфекция и последующая идентификация инфицированных клеток были значительно усовершенствованы благодаря использованию способа трансфекции с промежуточным перемещающим звеном липосомы, при идентификации зараженных клеток с помощью цитопатогенного эффекта (СРЕ).
Клеточные линии 293 выдерживались в несколько измененной питательной среде Dulbecco с 10% инактивированной с помощью нагревания лошадиной сывороткой. Вектор экспрессии р53 и плазмид pJM17 (Mс Grory et al., 1988) для гемологической рекомбинации были подвергнуты котрансфекции в клетках 293 с помощью метода трансфекции с промежуточным звеном DOTAP согласно протоколу исполнения (Boehringer Mannheim Biochemicals, 1992). Схематически это изображено на фиг.1.
Клетки 293 (проход 30, 60% - пересечение) были заражены за 24 часа до трансфекции или в 60-миллиметровых чашках, или в 24-луночных чашках Петри. Клетки в каждой лунке были подвержены трансфекции с помощью 30 мл DOTAP, 2 мг вектора экспрессии р53 и 3 мг плазмиды pJM17. После трансфекции клетки получали питание в виде среды MEM каждые 2-3 дня до тех пор, пока не появлялся цитопатогенный эффект.
ПРИМЕР 3
Подтверждение идентичности аденовируса-рекомбинанта.
Данный пример иллюстрирует новый способ исследования цепной реакции полимеризации (PCR) для подтверждения идентичности рекомбинантных вирионов, сопровождающих процесс котрансфекции соответствующей клеточной линии.
Слои надосадочной жидкости клеточной культуры (от 50 до 370 мл ) были собраны из участвовавших в исследованиях чашек Петри, обработаны протеиназой К (50 мг/мл) с 0,5% SDS и 20 mM EDTA) при 56oС в течение 1 часа с помощью фенолхлороформа, а нуклеиновые кислоты были выведены в осадок с помощью этанола. Осадок DNA был повторно суспендирован в 20 мл dH2О и использован в качестве матрицы для усиления цепной реакции полимеризации (PCR). Относительные локализации первичных элементов цепной реакции полимеризации (PCR) и их последовательности показаны на фиг.1 и обозначены: SEQ ID NOS: 1,2,3 и 4 соответственно. Первичные элементы специфических включений DNA определяют продукт 1,4 kb цепной реакции полимеризации ( PCR), a вирусные геном-специфические первичные элементы определяют продукт 0,86 kb цепной реакции полимеризации (PCR). Цепные реакции полимеризации проводились в объеме 50, содержащем 4mM MgCl2, 50 mM KCl, 1,1% тритона Х-100, 200 каждой из dNTP, 10 mM Tris-Cl (pH 9,0), 2 каждого первичного элемента и 1,0 единица Tag-полимеразы (Promega). Реакции проводились при 94oС в течение 0,5 мин, 56oС в течение 0,5 мин, 72oС в течение 1 мин на протяжении 30 циклов.
Чтобы упростить процесс идентификации вновь воспроизведенного рекомбинантного вируса, был разработан способ осуществления непосредственно цепной реакции полимеризации (PCR) на образцах DNA, взятых из надосадочной жидкости клеточной культуры. Слои (50 или 370) надосадочной жидкости клеточной среды с цитопатогенным эффектом были обработаны протеиназой К и фенол/хлороформ/экстрактом. После этанолового осаждения образцы DNA были проанализированы с использованием цепной реакции полимеризации (PCR), в которой принимали участие две пары первичных элементов, с целью усиления специфических последовательностей включений и вирусных геном-специфических последовательностей. Мишени первичных элементов цепной реакции полимеризации и их последовательности показаны на фиг.1. Первичные элементы 1,2,3 и 4 представлены с помощью SEQ ID NO:1,2,3,4 соответственно.
В результате включение cDNA 1,4 kb и фрагмент вирусного генома 0,86 kb были усилены из вектора экспрессии (положительный результат) и образцов DNA положительной клеточной культуры (фиг. 2В, полоса 1 и 4 соответственно). Только фрагмент 0,86 kb был усилен из образца DNA вируса Ad5/RSV/GL2 (отрицательный результат, полоса 2). Никаких усиленных полос, пучков волокон не было обнаружено при цепных реакциях полимеризации (PCR), которые использовали необработанный положительный надосадочный слой клеточной культуры (3-я полоса).
Эти результаты указывают на то, что аденовирусы, секретированные в клеточной культурной среде, могут быть определены цепной реакцией полимеризации (РСК), используя всего лишь 50 надосадочной жидкости среды клеточной культуры для приготовления матриц DNA. Полученные результаты должны позволить разработать количественный метод при использовании данного способа с целью определения аденовирусных титров, что обычно получают с помощью метода розеток.
Природная последовательность cDNA р53 в вирусе Ad5CMV-p53 была подтверждена посредством дидеокси-DNA-последовательности на CsCl-gradient-очищенной вирусной DNA. Контрольный вирус Аd5/RSV/GL2, полученный подобным способом, имеет структуру, подобную Ad5CMV-p53, зa исключением вирусного промотора Rous-саркомы и cDNA люциферазы, которые были использованы в его кассете экспрессии.
Аденовирус-рекомбинант, который несет ген E.coli b-галактозидазы (LacZ), Ad5CMV-LacZ, имеет структуру, подобную Ad5CMV-p53 и был получен на основании исследований Dr. Frank L. Graham.
Вирусная биомасса, титр и инфицирование.
Индивидуальные клоны Ad5CMV-p53, Ad5/RSV/GL2 и Ad5CMV - LacZ - вирусов были получены путем обеззараживания бляшек (розеток) по методу Graham & Prevec (1991). Одиночные вирусные клоны были воспроизведены в клетках 293. Культурная среда клеток 293, обнаруживающая законченный цитопатогенный эффект, была собрана и центрифугирована при 1000 х g в течение 10 мин. Собранные надосадочные массы были расслоены и размещены для хранения при температуре -20oС в качестве штамма (биомассы). Вирусные титры были определены в результате реакции розеткообразования (Graham and Prevec, 1991). Инфицирование клеточных линий было произведено путем добавления вирусных растворов (0,5 мл на 60-миллиметровую чашку) к клеточным монослоям и создания условий инкубационного периода при комнатной температуре в течение 30 минут с кратковременными встряхиваниями через каждые 5 минут. Этот процесс сопровождался добавлением культурной среды и возвращением инфицированных клеток в инкубатор при 37oС.
Эффективность передачи гена аденовируса-рекомбинанта также была исследована на примере использования Ad5CMV - LacZ в целом ряде клеточных линий, например Н226Вr, Н322, Н460, HeLa, HepG2, LM2 и Vero. С помощью окраски Х-геля все клеточные линии были окрашены: 97-100% - в голубой цвет после инфицирования Ad5CMV-LacZ при MOI 30 PFU/клетка.
ПРИМЕР 4
Экспрессия гена р53, направляемая Ad5CMV, в клетках рака легкого человека.
Этот пример раскрывает способ использования аденовируса-рекомбинанта р53 с целью инфицирования клеток рака легких человека с помощью гомозиготного удаления гена р53. Результаты показывают, что рост этих клеток и экспрессия мутанта р53 были подавлены, обнаруживая потенциал вириона Ad5CMV-p53, проявляющего признаки агента, способного контролировать состояние метастатических клеток.
Монослои инфицированной клетки были подвергнуты иммуногистохимической обработке, которая заключалась в том, что эти слои были зафиксированы 3,8-процентным формалином и обработаны 3-процентным Н2О2 в метаноле в течение 5 минут. Иммуногистохимичесхие анализы были осуществлены с использованием набора Vectastain Elite (Vector, Burlmgame, CA). В качестве первичного антитела использовали антитело РАb 1801 anti-p53 (Oncogene Science, Manhasset, NY); MOPC-21 (Organon Teknica Corp., West Chester, PA) использовался в качестве отрицательной контрольной группы. В качестве второго антитела использовали avidin labeled antimouse IgG (авидин - меченый антимышиный иммуноглобулин G) (вектор). Biotinylated horseradish peroxidase ABC complex reagent (комплексный АВС реактив блотированной периксидазы хрена) был использован в качестве определителя антиген - антитело - комплекса. Наконец, клетки после обесцвечивания препарата были докрашены Harris-гематоксилином (Sigma) и установлены с помощью уплотняющего материала - Цитосила-60 (Stephens Scientific, Riverdale, NJ).
Иммуногистохимические анализы инфицированных клеточных линий были произведены с целью исследования экспрессии in situ-экспрессии р53, возбужденной промотором цитомегаловируса (CMV) вируса Ad5CMV-p53. В клеточной линии Н358, которая имела гомозиготное удаление р53, ген р53 был перенесен с эффективностью 97-100 %, как показали иммуногистохимические анализы, когда клетки были инфицированы Ad5CMV-р53 при множественности инфицирования 30-50 розетки формирующих единиц ( PFU/клетка) (фиг.4).
Высокая эффективность переноса аденовируса-рекомбинанта была подтверждена Ad5CMV -LacZ, вирусом, который несет ген LacZ, трансформированный промотором 1E CMV (цитомегаловируса) человека. При множественности инфицирования человека 30-50 PFU/клетка все клетки подвергались исследованию, включая HeLa, HepG2, LM2, и клеточные линии рака NSCLC человека показали 97-100% позитивный результат для b-галактозидаза-актвности с помощью Х-гелевого окрашивания. Эти результаты указывают на то, что аденовирусные векторы представляют собой эффективное средство для доставки гена в раковые клетки человека.
Western-блотирующие анализы были осуществлены на всех клеточных лизатах, приготовленных путем растворения клеток монослоев в чашках, с помощью буферного образца SDS-PAGE (0,5 мл на 60-миллиметровую чашку) после промывания клеток фосфатно-солевым буферным раствором (PBS). Для анализов SDS-PAGE линии были загружены лизатами эквивалентно 5х104 клеткам (10-15 мл). Протеины были перенесены к HybondТM-ECL - мембране (Amersham, Arlington Heights, IL). Мембраны были заблокированы 0,5% сухим молоком в фосфатно-солевом буферном растворе и проведены исследования с помощью первичных антител: мышиного античеловеческого р53 моноклонального антитела РАb 1801 и мышиного античеловеческого β-активного моноклонального антитела (Amersham), промыты и исследованы с помощью вторичного антитела, а именно кроличьего антимышиного гамма-глобулина G, связанного пероксидазой хрена (horseradish peroxidase - conjugated rabbit antimouse IgG) (Pierce Chemical Co., Rockfоrd, IL). Мембраны были разработаны в соответствии с усиленным хемилюминесцентным протоколом. Относительные количества экзогенного р53 с выраженной экспрессией были определены денситомером (Molecular Dynamics Inc., Sunnyvale, CA).
Western-блоты показали что экзогенный протеин р53 проявил свою экспрессию на высоких уровнях (фиг.5А, полосы 2,3 и 5,6). Пик протеина наблюдался на 3-й день после инфицирования (фиг.6, внедрения от 0,5 дня до 3-х дней). В качестве контрольного элемента был разработан вирион, структура которого напоминает рекоминант Ad5CMV-p53 по примеру 1. Вирион содержит cDNA-люциферазу, приведенную в активное состояние промотором LTR вируса Rous-саркомы в кассете экспрессии вириона. Ни экспрессии р53, ни изменения в экспрессии актина не было обнаружено в клетках, инфицированных вирионом Ad5/RSV/GL2.
Аденовирус-рекомбинант был использован для инфицирования трех линий рака легких NSCLC:
- клеточной линии Н358, которая имеет гомозиготное удаление гена р53,
- клеточной линии Н322, которая имеет точечную мутацию гена р53 в кодоне 248 (от G до Т), и
- клеточной линии Н460, которая имеет природный ген р53.
Степень роста клеток NSCLC человека была определена исходя из инокуляции Н322 и Н460 (1•105) или Н358 (2•105) в 60-миллиметровых чашках за 24 часа до вирусного инфицирования. Клетки были инфицированы вирусом при множественности инфицирования 10 PFU/клетка. Культурная среда была использована для контроля смоделированной инфекции. Матричные культуры каждой клеточной линии с различными видами обработки подсчитывались ежедневно с 1-го по 6-й день после инфицирования.
Рост клеток Н358, инфицированных Ad5CMV-p53, был значительно подавлен, по сравнению с неинфицированными клетками или с клетками, инфицированными контрольным вирионом (фиг.7А). Рост клеток Н322 был также в большой степени подавлен вирионом р53 (фиг.7В), тогда как клетки Н460 рака легких человека, содержащие природный р53, были подвергнуты воздействию в меньшей степени (фиг. 7С). Рост клеток Н358, инфицированных вирусом Ad5CMV-p53, был подавлен на 79%, в то время как неинфицированные клетки или клетки, инфицированные контрольным вирусом, подавлены не были. Рост клеточной линии Н322, которая имела точечную мутацию, был подавлен на 72% посредством Ad5CMV-p53, тогда как рост клеточной линии Н460, содержащей природный р53, был подавлен меньше (подавление роста составило 28%).
Результаты указывают на то, что аденовирус-рекомбинант обладает свойствами подавления роста злокачественных новообразований, благодаря восстановлению функций протеина р53 в клетках опухолевых новообразований.
ПРИМЕР 5
Использование Ad5CMV-p53 при лечении клеток с р53-дефицитом.
Настоящий пример касается использования аденовируса-рекомбинанта р53 при восстановлении функции подавления роста опухолевых клеток in vitro и осуществления таким образом лечения заболеваний, связанных со злокачественным или метастатическим ростом клеток. Он описывает некоторые из способов по данному изобретению, которые предполагается использовать при лечении рака с помощью аденовирусной генной терапии.
Клетки Н358 были инфицированы Ad5CMV-p53 и Ad5/RSV/GL2 при множественности инфицирования (MOI) 10 PFU/клетка. Одинаковое количество клеток было обработано средой, смоделированной в качестве инфекции. Через 24 часа после инфицирования обработанные клетки были собраны и дважды промыты фосфатно-солевым буферным раствором (PBS). Для каждого из видов обработки три миллиона (3•106) клеток в объеме 0,1 мл были подкожно введены каждой из безволосых мышей (Harlan Co., Houston, TX). Для каждого из видов обработки было использовано по 5 особей. Мыши были облучены (300 cGy, 60Co) перед инъекцией и обследовались еженедельно после инъекции. Опухолевые новообразования были обнаружены в конце шестинедельного периода, а объем опухоли был определен на основе использования модели сферы со средним диаметром опухоли, полученным в виде корня квадратного из величины произведения диаметров поперечного сечения.
Чтобы определить эффект подавления онкогенности с помощью Ad5CMV-p53, безволосые мыши были инфицированы подкожно клетками Н358 (клетка рака типа NSCLC человека), чтобы вызвать злокачественные новообразования. Каждая мышь получила одну инъекцию клеток, которые были инфицированы Ad5CMV-p53 или Ad5/RSV/GL2 при 10 PFU/клетка в течение 24 часов. Клетки Н358, обработанные только средой, были использованы в качестве контрольных с ложным инфицированном. Опухоли, которые первоначально прощупывались, на 14-й день после инъекции были индуцированы только смоделированными или контрольными вирусинфицированными клетками, как показано в табл.1.
Как показано в табл.1, у мышей, которые получили клетки, обработанные Ad5CMV-p53, опухолевые новообразования не развивались. Опухоли в конце 6-недельного периода имели 4-10 мм в диаметре. Это исследование начиналось с 5 особями на группу. Одна мышь в каждой из групп исследований с Ad5CMV-p53 или Ad5/RSV/GL2 не участвовала и не смогла завершить цикл исследований. Ранние смерти наступили, предположительно, от нозокомиальной инфекции.
ПРИМЕР 6
Ad5CMV-p53 в лечении рака легких.
Настоящий пример касается использования аденовируса-рекомбинанта р53 для восстановления функции подавления роста клеток новообразований in vivo и лечения таким образом злокачественных опухолей у животных. На данном примере наблюдается несколько путей осуществления изобретения с целью его использования для лечения рака методом генной терапии, использующей аденовирус в качестве промежуточного звена-посредника.
Эффективность Ad5CMV-p53 для подавления онкогенности была повторно доказана на мышиной модели ортотопического рака легких человека. Поскольку клетки Н358 и Н322 в данной модели не вызывают опухолевых новообразований, в исследовании использовалась клеточная линия Н226Вr. Эта клеточная линия имела происхождение от сквамозного рака легких и метастазировала от легкого до мозга. Н226Вr имеет точечную мутацию (от АТС до GTC) в экзоне 7, кодона 254, гена р53 и является онкогенной в организме мыши.
Процедура тестирования в мышиной модели ортотопического рака легких человека ранее уже была описана (Georges et al., 1993). В двух словах, безволосые мыши были предварительно облучены (300 cGy, 60Со), после этого привиты внутритрахеальной инстилляцией клеток Н226Вr. Каждая мышь получила 2•106 клеток в объеме 0,1 мл PBS (фосфатно-солевого буферного раствора). Через три дня после прививки 10 мышей на группу обрабатывались 0,1 мл вируса или среды-носителя (PBS) путем внутритрахеальной инстилляции 1 раз в день в течение двух дней. Использовалась дозировка вируса Ad5CMV-p53 или Ad5/RSV/GL2 5•107 на одну особь. Мыши были умерщвлены в конце 6-недельного периода. Опухолевые новообразования были изучены следующим образом. Ткани легкого и средостения были иссечены и определены размеры опухоли. Новообразования были подтверждены гистологическими анализами иссечения опухолевой массы.
Облученные безволосые мыши были привиты клетками Н226Вr 2•106 на одну особь путем внутритрахеальной инстилляции. Через три дня после прививки каждая из мышей (8-10 мышей на группу) прививалась 0,1 мл или Ad5CMV-p53, или Ad5/RSV/GL2, или носителем (PBS) (фосфатно-солевым буферным раствором) путем внутритрахеальной инстилляции один раз в день в течение двух дней. Дозировка вируса составляла 5•107 ( PFU) нa мышь. Опухолевые новообразования были исследованы в конце 6-недельного периода путем иссечения тканей легкого и средостения и определены размеры опухолей. Схема процедуры исследования показана на фиг.7 с представлением образцов иссечения на фиг.8. Обнаруженные опухоли были подтверждены гистологическими анализами. Данные измерений опухолей представлены в табл.2.
Только 25% мышей, обработанных Ad5CMV-p53, получили сформировавшиеся опухоли, тогда как в группе мышей, обработанных носителем или Ad5/RSV/GL2 (контрольная группа) опухоли получили 70-80% инфицированных мышей. Средний размер опухоли для группы Ad5CMV-p53 был значительно меньше, чем для контрольных групп. Эти результаты указывают на то, что Ad5CMV-p53 может предохранить Н226Вr от формирования опухолевых новообразований в мышиной модели ортотопического рака легких человека.
ПРИМЕР 7
Ad5CMV-р53 в лечебных схемах.
Естественно, что модели лечения, разработанные для животных, должны применяться как часть исследований, предшествующих клиническим назначениям, как показано на примерах 5 и 6. Поэтому больные, которым было установлено показание на лечение с помощью переноса гена посредством аденовируса, могут быть исследованы на присутствие антител, действие которых направлено против аденовируса. При наличии антител и при установившейся аллергической реакции больного на какие-либо фармакологические или естественные средства, может быть назначено применение опытных доз порядка от 103 до 106 аденовируса-рекомбинанта под пристальным клиническим наблюдением.
Для назначения человеку при лечении рака с использованием Ad5CMV-p53 аденовирус-рекомбинант, проявляющий экспрессию р53 под контролем соответствующих промоторов/усиливающих элементов, например промотора CMV (цитомегаловируса), должен быть приготовлен и обеззаражен, в соответствии с методикой, одобренной организацией по надзору за продуктами питания и лекарственными средствами (FDA). Такая методика включает, но не ограничивается, центрифугирование в градиенте плотности хлорида цезия с последующими испытаниями на эффективность и чистоту.
Сложилось мнение, что существует два способа лечения с помощью аденовируса р53, непосредственное или локальное назначение или более общее лечение. Данные методы дают результаты только при лечении многообразия злокачественных опухолей, которые известны как имеющие отношение к р53-мутациям. Что касается общего лечения, то, как было доказано на опытах, достаточно обыкновенной внутривенной инъекции, чтобы инфицировать введенным вирусом ткани, расположенные на расстоянии от места введения лекарства (Stratford - Perricaudet et al., 1991b). Таким образом, вирусное инфицирование с помощью внутривенной инъекции можно рассматривать как способ, удобный для лечения всех злокачественных опухолей, имеющих отношение к р53. Вирус может быть назначен больным как внутривенно в виде любого фармакологически допустимого раствора, так и в виде инфузий в течение какого-то промежутка времени. Откровенно говоря, существует глубокое убеждение в том, что для получения ожидаемого эффекта количество назначенных действующих вирусных частиц должно быть порядка от 1•1010 до 5•1012.
Кроме того, там где речь идет о раке легких, при желании может быть использован метод более прямого физического воздействия аденовируса-рекомбинанта на клетки-мишени, аналогичный внутритрахеальному назначению регулятора трансмембранной проводимости при фиброзно-кистозной дегенерации (Rosenfeld et al. , 1992). Результатом такого метода может быть доставка аденовируса-рекомбинанта р53 поближе к тому месту, где концентрируются клетки-мишени.
Более подробно предпочтительные протоколы лечения могут быть разработаны в соответствии со следующим алгоритмом. Вначале больной может быть подвергнут бронхоскопии для выяснения степени поражения. Методом эндоскопии должна быть извлечена как можно большая часть опухоли. Предварительная бронхоскопия должна проводиться под местным или общим наркозом. Трансбронхиальная аспирационная игла (21g) Stifcortm (с жестким сердечником) должна быть проведена в биопсийный канал бронхоскопа. К сохранившимся участкам опухоли затем может быть подведен малый объем аденовируса р53 в количестве 10 мл или меньше.
В любом случае, если даже примененного аденовируса окажется недостаточно для возникновения репликационного эффекта, сам по себе вирус на организм человека никакого пагубного воздействия не окажет. Тем не менее больные во время лечения должны находиться в стационаре, по меньшей мере, в течение 48 часов для наблюдения за возможным возникновением острой или отдаленной во времени побочной реакции. Хотя вопросу эффективного и безопасного применения аденовируса с дефицитом репликации в качестве носителя при переносе гена в человеческом организме было уделено внимание в прошлом (Rosenfeld et al., 1992; Jaffe et al., 1992), дозировка аденовируса, назначаемая для ввода в организм, должна серьезно исследоваться, с целью дальнейшего уменьшения возможностей возникновения побочных эффектов.
Существуют различные критерии, которые следует принимать во внимание при оценках существования необходимости в ответной реакции и существования токсичности. Для решения вопроса определения токсичности, прежде чем приступить к курсу терапевтического лечения, следует сфотографировать ложе опухоли, измерить ее наибольший диаметр и перпендикуляр. Размер опухоли определяется как произведение диаметров. Имея эти данные можно рассчитать степень рецедива опухоли.
Время до прогрессирования в развитии болезни может быть также измерено, начиная от первого обследования с обнаружением уменьшения опухолевой массы до получения очевидных признаков прогрессирования. Прогрессирование в развитии болезни определяется как увеличение на <SE>=> 25 % суммы произведений диаметров измеренных новообразований. Больной должен пройти, по крайней мере, два курса терапевтического лечения, прежде чем появятся показания на прогрессирование болезни. Наблюдения над больными должны оцениваться с момента занесения в протокол (историю болезни).
Последующие исследования должны включать все действия (назначения) терапевтического лечения рака, включая определение клинических анализов и взятие биопсий для стандартных и молекулярных биологических анализов, в которых может быть исследована структура экспрессии различных генов р53. Эти анализы могут также представить данные о количестве клеток, которые восприняли перенесенный ген, а также об относительной эффективности просмотра in vivo. Основываясь на полученных данных, могут быть внесены нужные корректировки в ход лечения. Эти корректировки могут включать структуры аденовируса, которые используют различные промоторы или изменения в количестве PFU множественности инфицирования), введенных с целью обеспечения уверенности в том, что инфицированы все или большинство клеток опухолей без нефизиологической чрезмерной экспрессии рекомбинантных генов.
Установлено, что экспрессия экзогенных генов, перенесенных in vivo аденовирусами, может существовать в течение продолжительного времени. Терапевтически эффективная, продолжительная во времени экспрессия экзогенных генов, переносимых вирусами, должна быть направлена на больного организмом (природой) самого больного. Гены-маркеры ограничены в своем влиянии определением терапевтически релевантной продолжительности экспрессии гена, так как уровни экспрессии, необходимые для исправления любого данного генетического нарушения, значительно отличаются от уровня, требуемого для основательного лечения другой болезни.
Хотя составы и способы по данному изобретению были описаны, ссылаясь на предпочтительные примеры осуществления, специалистам, имеющим опыт в данной области знаний, совершенно очевидно, что возможны варианты в составах, способах и в приемах или в последовательности приемов способов, описанных выше, без отступления от сущности, изложенной в формуле изобретения. Более конкретно, из данною описания изобретения вытекает, что определенные посредники-носители, которые могутг иметь как химическую, так и физиологическую природу, заменяются посредниками, описанными в данном изобретении и проявляющими идентичный или похожий эффект. Все подобные замещения должны быть в рамках признаков формулы изобретения. Все защищенные формулой изобретения продукты и способы могут быть осуществлены без дополнительных экспериментальных исследований.
ПЕРЕЧЕНЬ ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Представленный перечень ссылок охватывает технический уровень, использованный изобретателями при создании изобретения. Информация, представленная в перечне, приведена в качестве аргументации при обоснованиях существенности признаков изобретения.
Bargonetti et al. (1991), Cell, 65:1083-1091.
Boeheringer Mannhein Biochemicals (1992). Использование DOTAP для осуществления высокоэффективных трансфекций. BMBiochemica 9(1): 17.
Bochart M. et al. ( 1985). Очень эффективный усилитель располагается вверх по ходу перемещения самого раннего гена цитомегаловируса человека. Сеll, 41:521-530.
Bishop (1987), Science, 235:305-311.
Cusey. G Lo-Hueh M., Lopez M.E., Vogelstem,B,.& StanbridgeE.J. (1991). Подавление роста клеток рака груди путем внедрения природного гена р53. Oncogene, 6:1791-1797.
Dai et al. (1992), Proc.Natl.Acad. Sci. 89:10892-10895.
Fields et al. (1990), Science, 249:1046-1049.
Georges et al. (1993), Cancer Res, 53:1743-1746.
Ghosh - Choudhury and Graham (1982), Biochem.Biophys.Res.Comm.147:964-973. Glurman и другие (1982) в разработке эукариотических вирусных векторов (GluzmanY. Ed. ), pp. 187-192, Cold Spring Harbor Press.Cold Spring Harbor, New-York.
Graham F.L. & A.J. van der Eb.(1973) Новая технология проведения исследований способности к инфицированию ДНК 5- аденовируса человека. Virology, 52: 456-467. Graham F.L. J.Siniley,W.C.Russel & R.Nairn (1977). Характеристики клеточных линий человека, трансформированных ДНК из человеческого аденовируса типа 5. J.Gen. Virol., 36:59-72.
Crunhaus A. & Horwitx M.S.( 1992), Аденовирусы, используемые в качестве клональных векторов. Semin. Virology, 3:237-2542.
Hollstein M. ,Sidransky D.,Vogelstein B.& Harris C (1991).Мутации р53 в человеческих раковых новообразованиях. Science, 253:49-53.
Jaffe et аl. (1992), Hаturе Genetics, 1:372-378.
Le Gal et al. (1993), Science, 259:988-990.
McGrory W. J. et al. (1988). Простой способ исправления ранних мутаций зоны инфекционных человеческих аденовирусов типа 5. Virology, 163:614-617.
Мerser W.E (1992). Регулирование клеточного цикла и протеин р53 - супрессор роста злокачественного новообразования. Critic. Rev. Eucar. Gene Express, 2: 2:51-263.
Mietz et al. (1992), EMBO, 11:5013-5020.
Montenarh M. (1992), Биохимические, иммунологические и функциональные аспекты супрессоров роста/онкопротеинов p53. Critic. rev. Onco., 3:233-256.
Mulligan.(1993), Science 260-926.
Ragot et al.(1993), Nature, 361:647-650.
Rosenfeld et al. (1991), Science, 232:431-434.
Rosenfeld et al. (1992), Cell, 68:143-155.
Shaw et al., 89:4495-4499.
Spandidos et al. (1989), J.Pathol., 157:1-10.
Stratford-Perrucaudet. L. & Perrucaudet (1991a), Перенос гена в организме жинотных: надежды, связанные с использованием аденовирусов, р.51-61 in.
O. Cohen-Haguenauer & Boiron (Eds). Пepeнoc человеческого гена, Editions John Libbey Euronext, France.
Stratford - Perricaudet et al. (1991b), Hum. Gene Ther. 1:241-256.
Takahashi T. , Carbone-D., Takahashi T., Nau M.M.,Hida T., Linnoila I., Ueda R. & Mannal J.D. (1992). Природный р53, но не мутант р53, подавляет рост клеток рака легких, характеризующихся множественными генетическими дефектами, 1992. Cancer Res., 52:2340-2342.
Tooza J. (1981).Молекулярная биология вирусов ДНК новообразований, 2-e доп. Cold Spring Harbor Laboratory, Cold Spring Harbor, New York.
Travali et al. (1991). FASEB, 4:3209-3214.
Yonish et al. (1991), Nature, 352:345-347.
Weinberg R. A (1991). Ген - супрессор новообразований. Science, 254: 1138-1145.
Wilcock et al. (1991). Nature, 349:429-431.
Zakut-Houri et al. (1985). EMBO J.,4:1251-1255.
Zhang et al. (1993). BioTechniques in press.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
1.Общая информация:
(i) Заявитель:
А. Имя: "БО ОВ РИДЖЕНТ, ДЗЕ ЮНИВЕРСИТИ OB TEKЗAC СИСТЕМ"
В. Стрит(Адрес): 201 Вест Севенс(7-я) Стрит
С. Сити: (Город) Остин
D. Стейт (Штат): Техас
E Кантри (Страна): США
F. Почтовый индекс: (ЗИП) 78701
G. Телефон (512): 499-4452
H. телефакс (512): 499-4523
(ii) Изобретатели: Занг, Вей - Вей, Pот, Джек А.
(iii) Название изобретения:
Аденовирус-pекомбинант р53
СПОСОБЫ и СОСТАВЫ
(iv) КОЛИЧЕСТВО ПОСЛЕДОВАТЕЛЬНОСТЕЙ: 4
(v) Cоответствующий адрес:
(А) Адресат: Арнольд, Вайт & Деки
(B) Адрес: АЯ 4433
(C) Город: Хьюстон (D)
Штат: Техас
(Е) Страна: США
(F) Почтовый индекс: 77210
(vi) Форма, читаемая на компьютере:
А. Тип носителя: дискета
В. Компьютер: IBM. PC-совместимый
С. Операционная система: PC-DOS/MS-DOS,ASCII
D. Программное обеспечение: PATENTIN RELEASE # 1.0,VERSION #1.25
(vii) Данные о заявке, находящейся на рассмотрении:
А. Номер заявки: неизвестен
В. Дата подачи: в соответствии с вытекающими обстоятельствами
С. Классификация: неизвестна
(viii) Ранее поданная заявка:
А. Номер заявки: USSEN 09/145826
В. Дата подачи: 29 октября 1993 г.
С. Классификация: неизвестна
(ix) Информация о патентном поверенном/агенте
А. Имя: Барбара С. Китчел
В. Регистрационный номер: 33928
С. Ссылка на документ об уплате пошлины: UTFC350P
(х) информация о каналах связи:
А. Телефон: (512) 418-3000
B. Телефакс: (512) 474-7577
С. Телекс: 79-0924
2. ИНФОРМАЦИЯ О ПОСЛЕДОВАТЕЛЬНОСТЯХ:
SEQ ID NO: I:
i. Характеристики последовательности:
A. Длина: 20
В. Тип: Нуклеиновая кислота
С. Цепь ДНК: Одиночная
D. Топология: Линейная
ii. Молекулярный тип:
iii. Описание последовательности: SEQ ID NO:1:
GGCCCACCCCCTTGGCTTC
SEQ ID NO: 2:
i. Характеристики последовательности:
А. Длина: 20
В. Тип: Нуклеиновая кислота
С. Цепь ДНК: Одиночная
D. Топология: Линейная
ii. Мoлeкуляpный тип:
iii. Описание последовательности: SEQ ID NO:2:
TTGTAACCATTATAAGCTGC
SEQ ID NO:3:
i. Характеристики последовательности:
А. Длина: 20
В. Тип: Нуклеиновая кислота
С. Цепь ДНК: Одиночная
D. Топология: Линейная
ii. Молекулярный тип:
iii. Описание последовательности: SEQ ID NO:3:
TCGTTTCTCAGCAGCTGTTG
SEQ ID NO:4:
i. Характеристики последовательности:
А. Длина: 20
В. Тип: Нуклеиновая кислота
С. Цепь ДНК: Одиночная
D. Топология: Линейная
ii. Молекулярный тип:
iii. Описание последовательности: SEQ ID NО:4:
CATCTGAACTCAAAGCGTGG
АДЕНОВИРУС-РЕКОМБИНАТ Р53
СПОСОБЫ И СОСТАВЫ
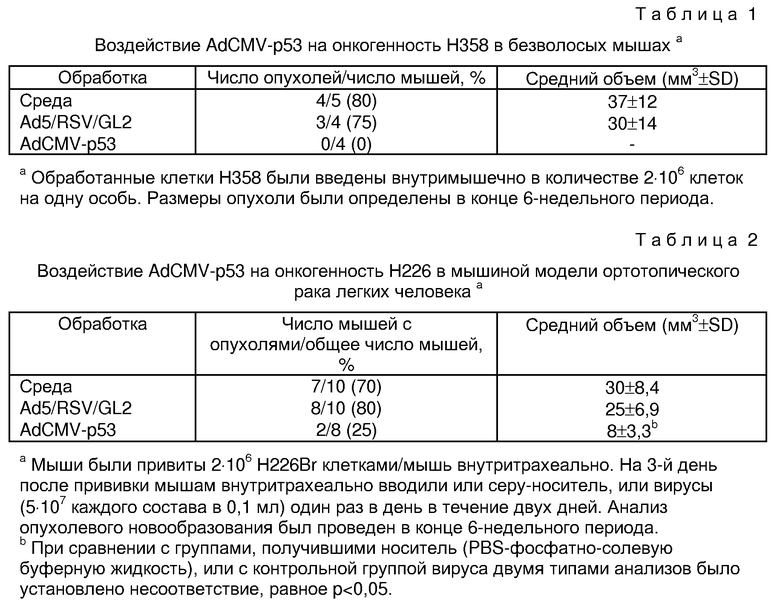
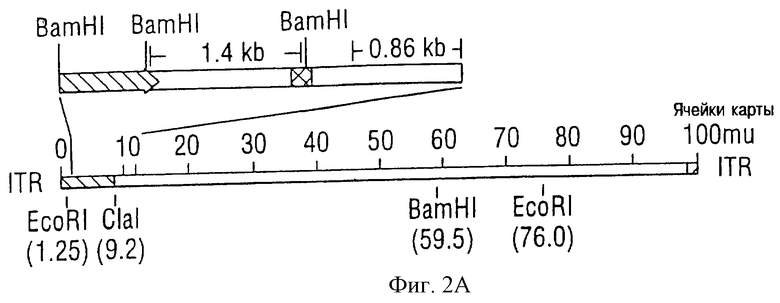


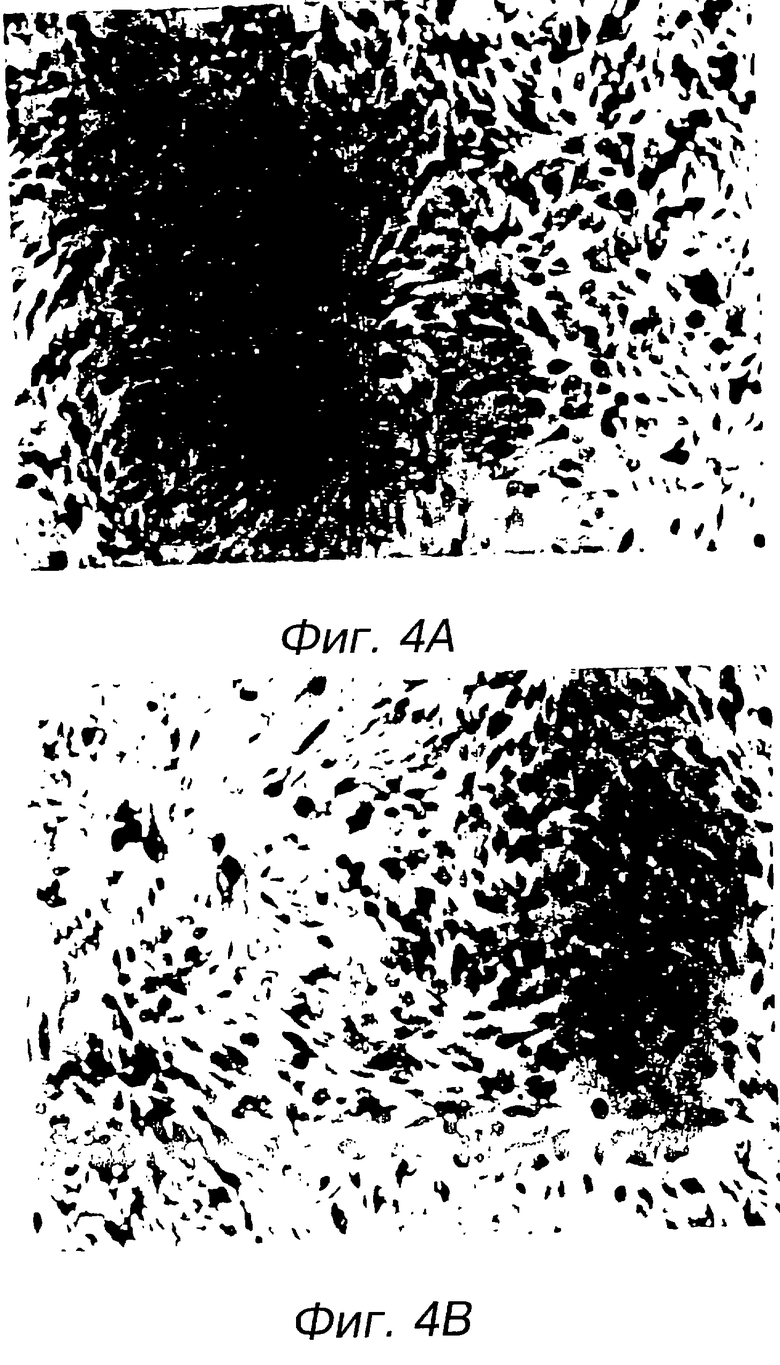
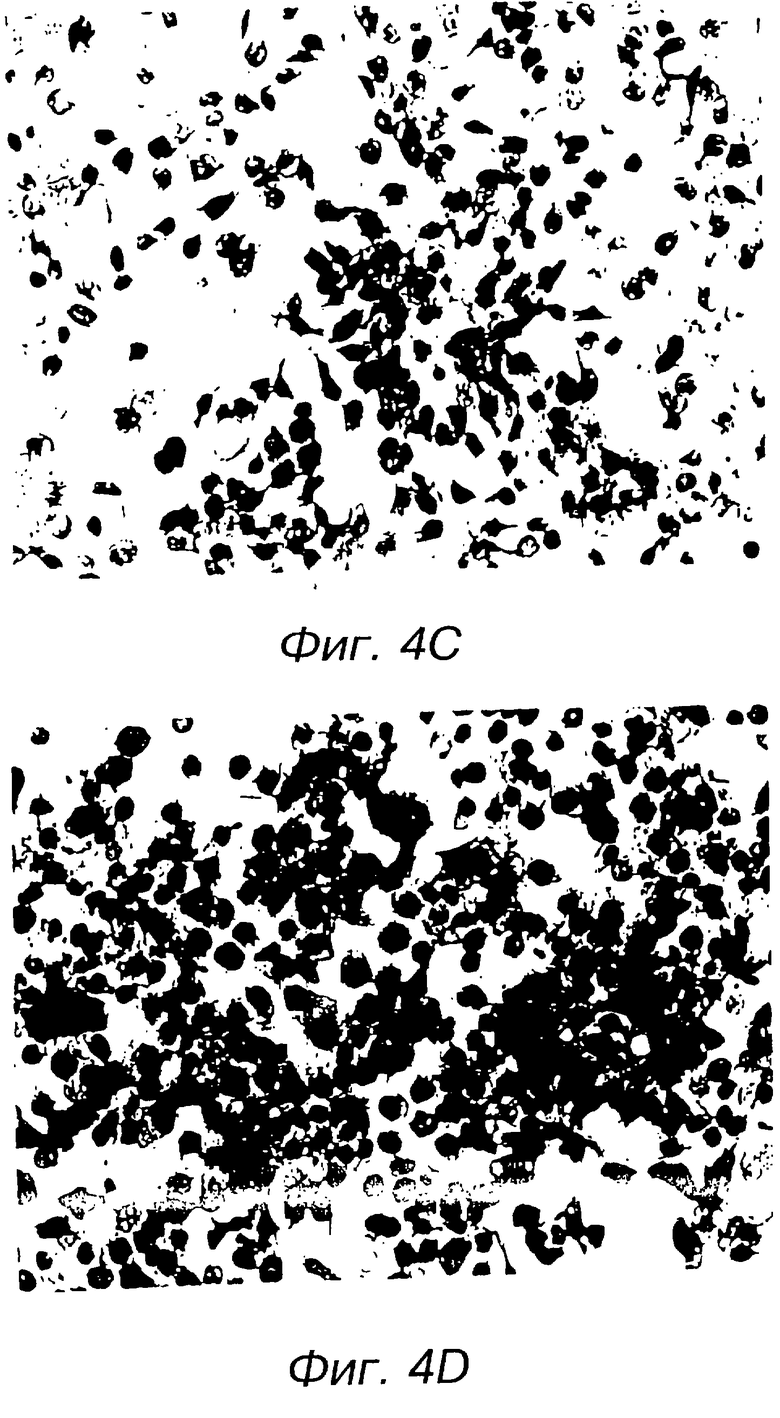
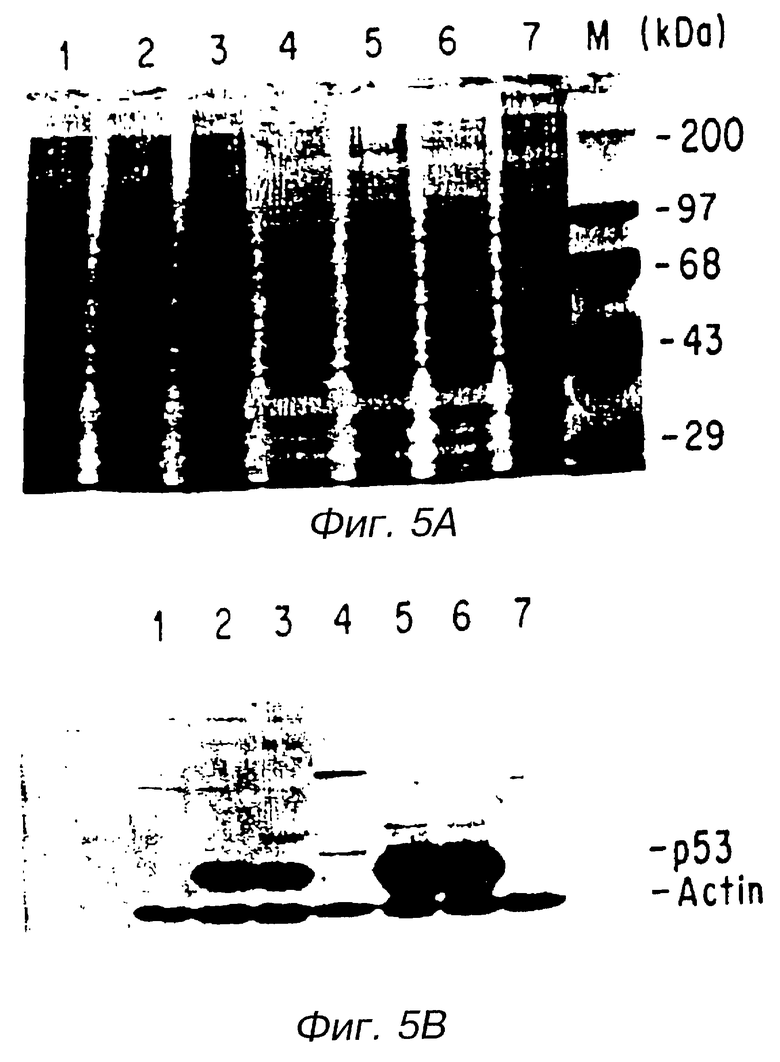
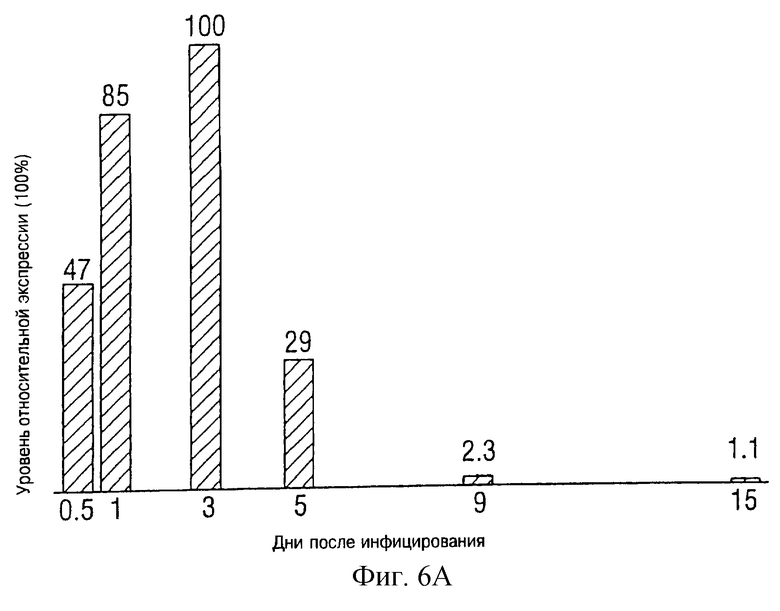

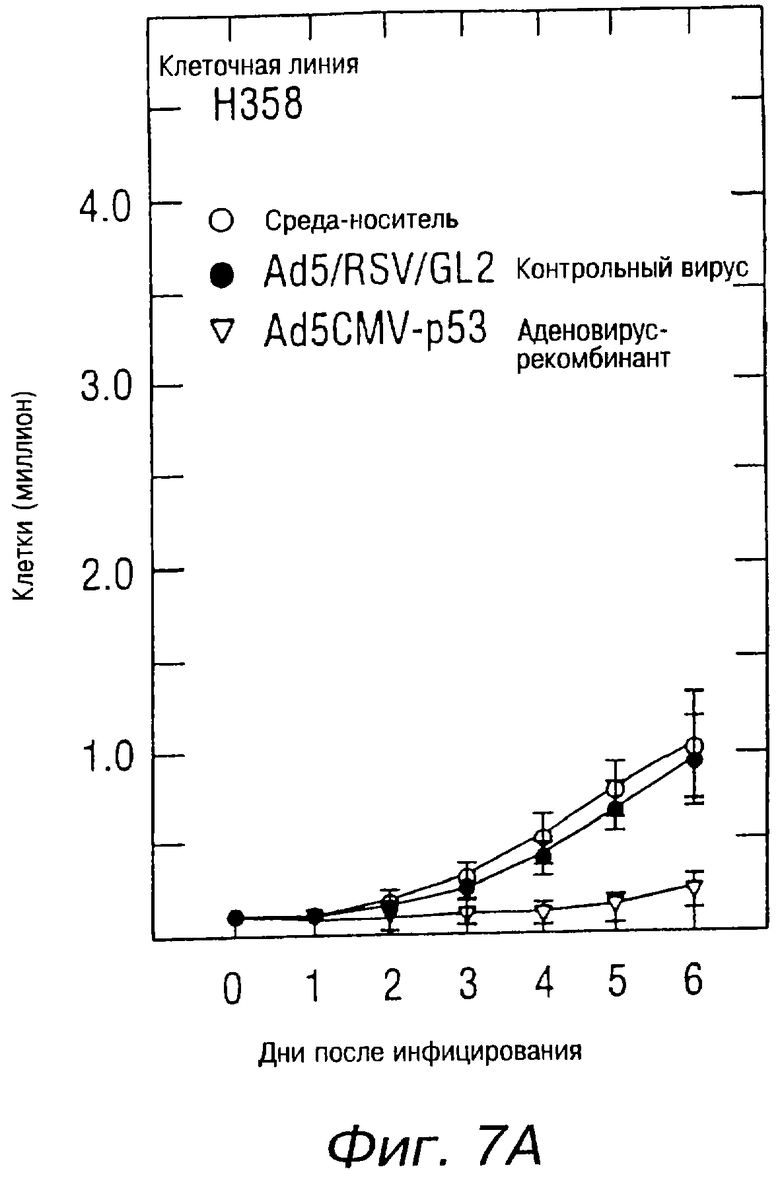
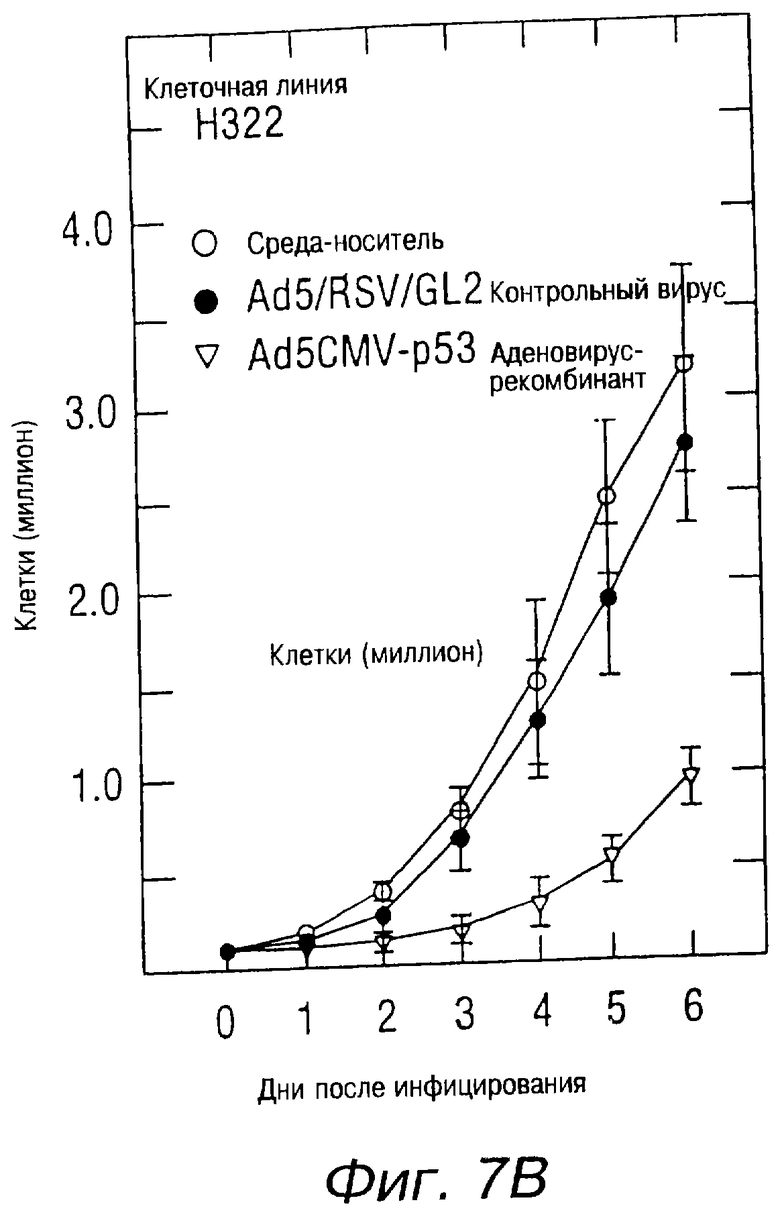
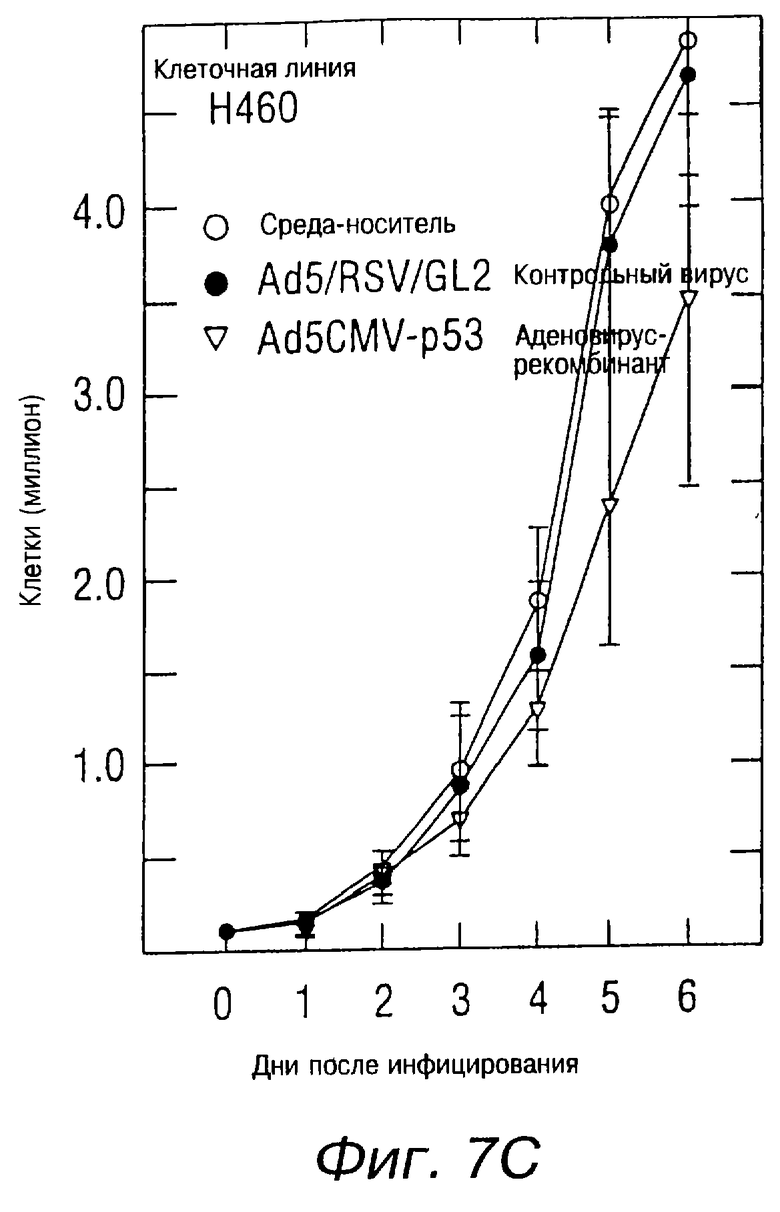
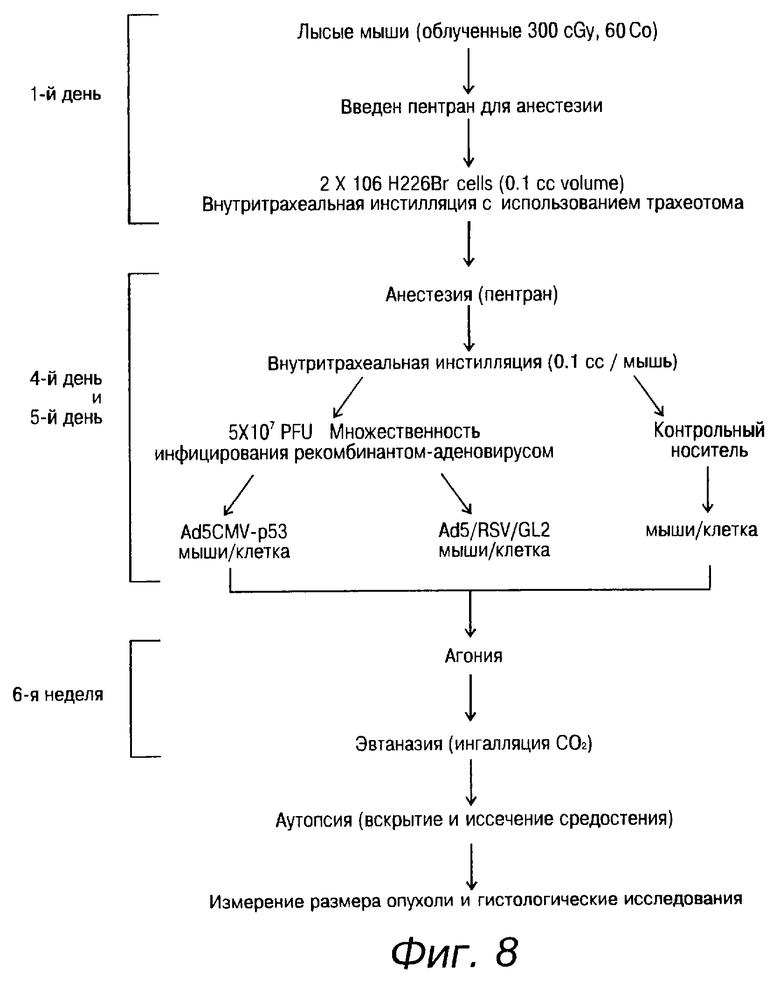
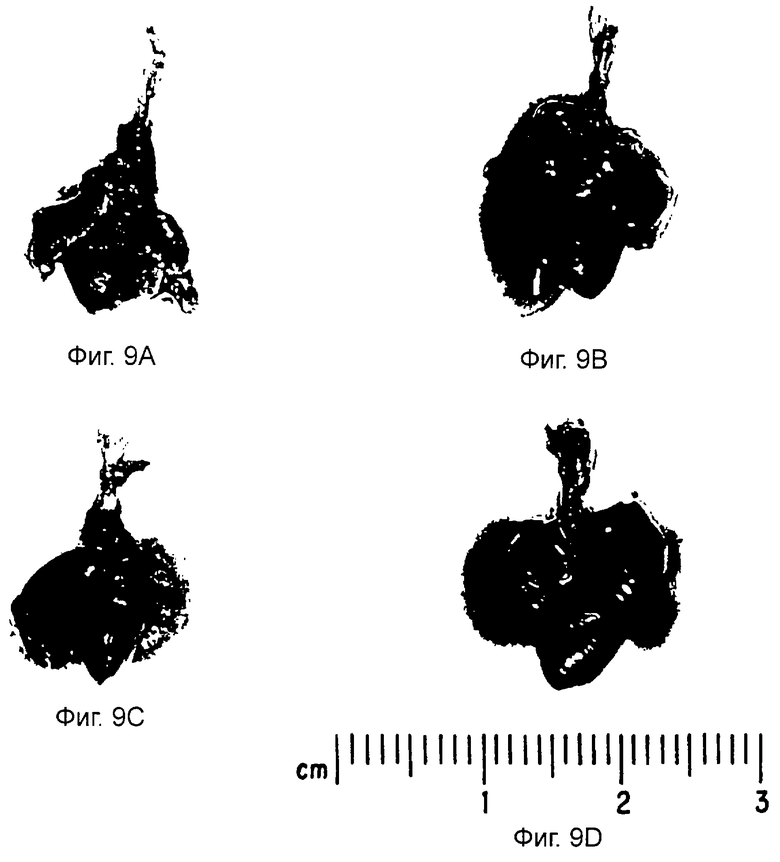
Изобретение относится к генной инженерии. Предложен адновирус-рекомбинант, включающий аденовирусный вектор, который содержит природный ген р53, экспрессирующий в клетках млекопитающих протеин р53. Эффект повышения уровня протеина р53 в организме используется в способе восстановления функции протеина р53 в опухолевой клетке. Изобретение позволяет предотвращать рост опухолевых клеток. 4 c. и 30 з.п. ф-лы, 24 ил., 2 табл.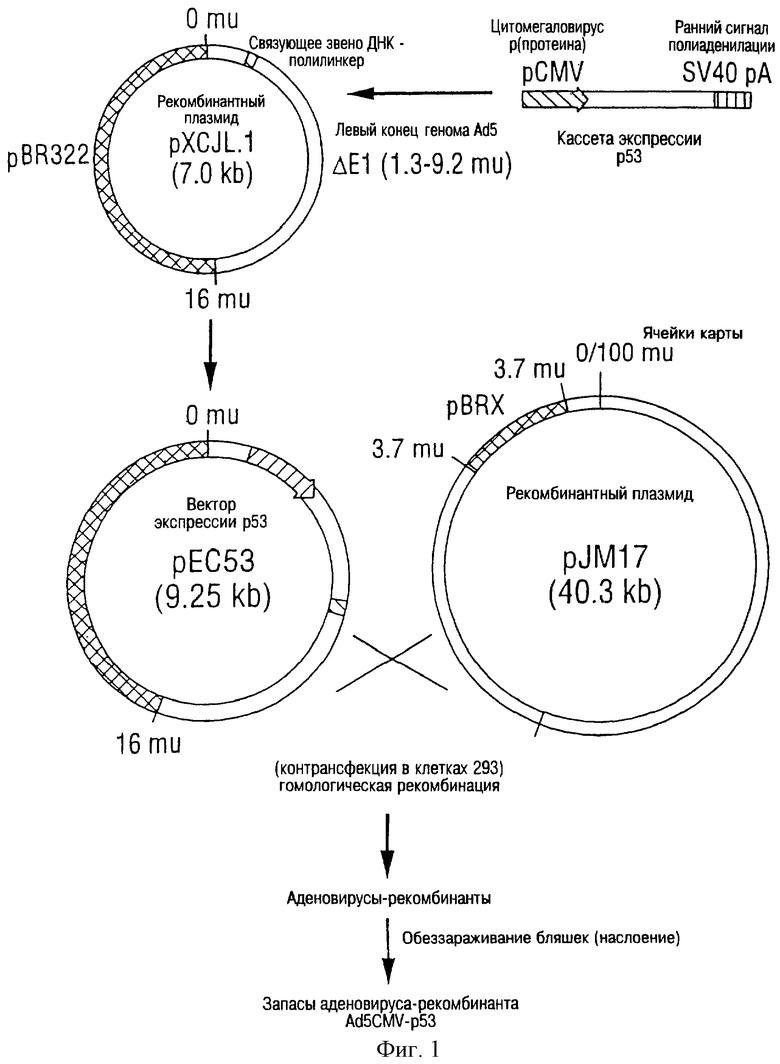
| WO 9511984 А2, 04.05.1995 | |||
| US 5252479, 12.10.1993. |
Авторы
Даты
2004-01-27—Публикация
1994-10-28—Подача