Изобретение относится к области медицинской промышленности и касается производства вирусных вакцин, в частности инактивированной очищенной вакцины клещевого энцефалита.
Известны способы получения очищенной вакцины клещевого энцефалита путем зонального ультрацентрифугирования вируссодержащего продукта в градиенте плотности сахарозы [1. Авторское свидетельство СССР N 660389, С 12 N 7/04, С 12 К 5/00. Опубл. 28.02.1980. Б.И. №8; 2. Патент SU №1318149. Опубл. 15.06.1987, Б.И. №22].
Недостатками этих способов являются длительность процесса, низкий выход целевого продукта (антигена вируса клещевого энцефалита) и неполная очистка вакцины от балластных примесей.
Наиболее близким аналогом заявляемого изобретения является способ получения очищенной вакцины клещевого энцефалита, который предусматривает очистку от балластных веществ с помощью ультрафильтрации с последующей гель-фильтрацией на макропористом стекле [3. Ляпустин В.Н. Автореферат диссертации на соискание ученой степени докт. биол. наук. Москва, 1993. Прототип]. Способ-прототип получения вакцины обладает низкой эффективностью и производительностью, при этом часть антигена теряется в результате необратимой сорбции на пористом стекле. Известный способ не позволяет очистить антиген вируса клещевого энцефалита от вредных примесей до требуемых нормативами параметров. В качестве вредных примесей получаемая вакцина содержит формальдегид, феноловый красный, канамицин, чужеродные белки мозга мыши, куриного эмбриона, что вызывает частые аллергические реакции при ее использовании и ограничивает область применения, особенно при вакцинации детей, людей пожилого возраста и лиц с ослабленной иммунной системой.
Задачей изобретения является повышение степени очистки вакцины от вредных примесей с одновременным концентрированием действующего начала - антигена вируса клещевого энцефалита (АВКЭ).
Поставленная задача решается путем очистки полуфабриката методом жидкостной хроматографии с использованием слабого анионообменника в градиенте концентрации галогенидов щелочных металлов. Активные фракции антигена вируса клещевого энцефалита элюируют при эффективном значении рН стартового и элюирующего буфера, преимущественно при рН>7,5 ед. В качестве элюирующего буфера может быть использован стартовый буфер с добавлением более 0,1 М галогенидов щелочных металлов, например KCl, и/или NaCl, и/или КВr. Перечисленные признаки достаточны, чтобы получить более высокую степень очистки, чем степень очистки по способу-прототипу. Зоны элюирования антигена определяют любым известным методом, однако наиболее эффективен метод иммуноферментного анализа (ИФА), причем для элюировання целесообразно выбирать активные фракции антигена вируса клещевого энцефалита с изоэлектрическими точками со значениями 7,8 и 10,3. При необходимости элюированные фракции антигена объединяют и подвергают дополнительной очистке путем гель-фильтрации на сорбенте, способном поглощать низкомолекулярные примеси. В результате получают вакцину, сохраняющую эффективность при многократном разбавлении действующего начала.
Способ может быть осуществлен следующим образом. Полуфабрикат загружают в хроматографическую колонку, заполненную слабым анионообменником, элюируют стартовым буфером несорбируемые примеси и выделяют активную фракцию антигена вируса с изоэлектрической точкой 10,3. Затем включают линейный градиент элюирующего буфера, в качестве которого используют стартовый буфер с рН>7,5, добавляя к нему галогениды щелочных металлов с концентрацией более 0,1 М, и элюируют активную фракцию с изоэлектрической точкой 7,8. Активные фракции антигена вируса определяют методом иммуноферментного анализа. Элюированную фракцию с изоэлектрической точкой 7,8 или эту же фракцию, объединенную с элюированной фракцией с изоэлектрической точкой 10,3, подвергают при необходимости дополнительной очистке путем гель-фильтрации на сорбенте, способном поглощать низкомолекулярные примеси, например, типа Sephadex. В очищенную субстанцию добавляют стабилизатор (человеческий альбумин) и адъювант (гидроокись алюминия).
Способ позволяет проводить выделение иммуногенных фрагментов вируса клещевого энцефалита и их концентрирование практически из любого полуфабриката инактивированной вакцины, например, приготовленной на штамме "205" или "Софьин". Способ пригоден также для очистки низкотитражных (некондиционных) партий промышленной вакцины, что позволяет экономить ценный биологический материал. Важным преимуществом заявленного способа получения очищенной вакцины является то, что он позволяет выделить антигенные белки вируса практически в чистом виде. Незначительные примеси человеческого сывороточного альбумина служат одновременно стабилизатором выделенных антигенных белков.
Предлагаемый способ получения очищенной вакцины клещевого энцефалита поясняется следующими примерами.
Пример 1. Хроматографическую колонку ХК 26/20 заполняют слабым анионообменником типа "DЕAE Sepharose Fast Flow" или аналогичным на высоту слоя 16 см и уравновешивают стартовым буфером со значением pH 8,4 ед. с линейной скоростью потока 70 см/ч. В колонку через систему "суперпетля" загружают 180 куб. см полуфабриката вакцины и элюируют несорбируемые примеси в течение 25 минут. Далее элюируют сорбируемые примеси элюирующим буфером путем создания линейного градиента галогенидов щелочных металлов с изменением концентрации от 0 до 100%. В качестве элюирующего буфера обычно используют стартовый буфер + 1 М Nad. Методом ИФА определяют зону вырезания активной фракции и собирают фракцию антигена вируса клещевого энцефалита с изоэлектрической точкой 7,8. Полученную фракцию можно дополнительно подвергнуть второй стадии очистки методом гель-фильтрации с использованием хроматографической колонки. Эту стадию осуществляют на сорбенте, способном поглощать низкомолекулярные примеси, например Sephadex G-25 F. Зоны вырезания и контроль активности фракций также определяют методом ИФА. В очищенную субстанцию по известным методикам добавляют стабилизатор (человеческий альбумин) и адъювант (гидроокись алюминия). Полученная очищенная вакцина клещевого энцефалита объемом 40 мл обладает повышенной в 4 раза активностью (по методу ИФА) по сравнению с вакциной, полученной по способу-прототипу.
Пример 2. Хроматографическую колонку заполняют слабым анионообменником типа "DEAE Sepharose Fast Flow" на высоту слоя 18 см. Колонку уравновешивают стартовым буфером с рН 9,4 ед. с линейной скоростью потока 70 см/ч. Затем в колонку через систему "суперпетля" загружают 180 куб. см вируссодержащего материала с последующей отмывкой несорбируемых примесей в течение 20 минут. Далее создают линейный градиент элюирующего буфера. В качестве элюирующего буфера используют стартовый буфер + 1,2 М КСl с изменением концентрации от 0 до 100%. Зоны вырезания и контроль активности определяют методом ИФА. Элюируют активные фракции антигена вируса клещевого энцефалита с изоэлектрическими точками 7,8 и 10,3 и объединяют их путем смешивания. По аналогии с примером 1 в очищенную субстанцию добавляют стабилизатор (человеческий альбумин) и адъювант (гидроокись алюминия). Полученная очищенная вакцина клещевого энцефалита в 1,3-1,5 раза активнее вакцины, получаемой известными способами. Неблагоприятных эффектов ее применения не выявлено. При необходимости объединенные фракции подвергают дополнительной очистке методом гель-фильтрации с использованием хроматографической колонки ХК 26/40, заполненной сорбентом типа Sephadex G-25 F. Данная концентрированная вакцина объемом 60 мл обладает повышенной в 3 раза активностью (по методу ИФА) по сравнению с вакциной, полученной по способу-прототипу. Получаемый лекарственный препарат, после введения необходимых добавок, является готовой формой инактивированной вакцины клещевого энцефалита.
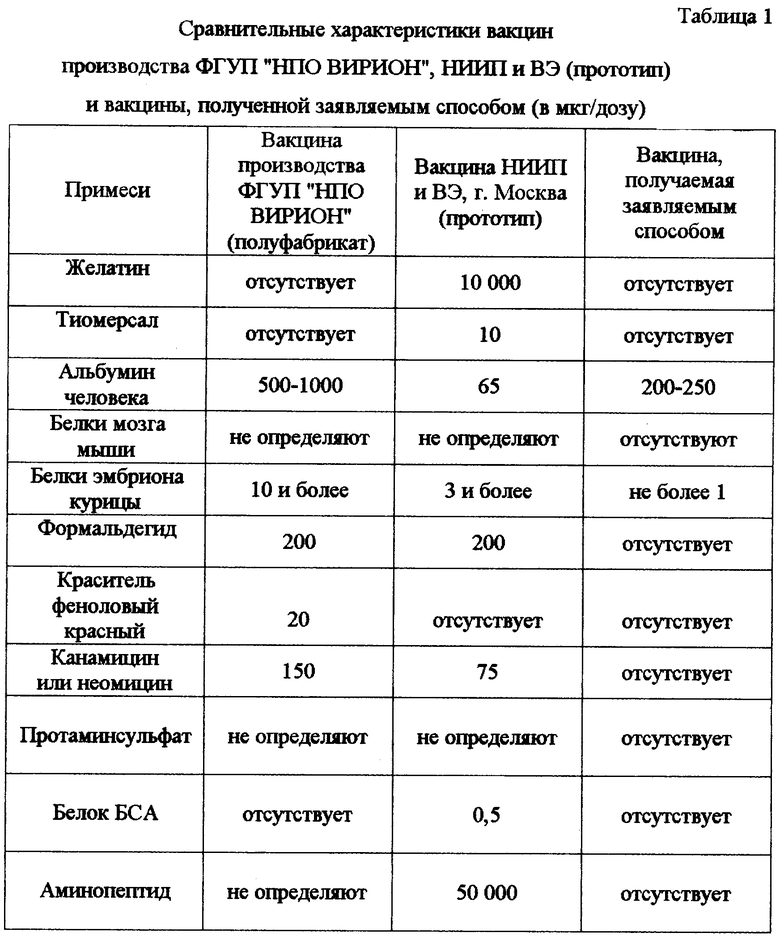
Количественные результаты, полученные при проверке эффективности заявленного способа, поясняются таблицами.
В таблице 1 приведены сравнительные характеристики по содержанию балластных и вредных примесей в вакцинах, получаемых по способу-прототипу и заявляемым способом. В таблице 2 приведены сравнительные характеристики этих вакцин по антигенной активности и иммуногенности. Данные таблиц свидетельствуют о том, что заявляемый способ обеспечивает высокую степень очистки от белковых и других низкомолекулярных примесей и повышенную иммуногенность получаемой вакцины. Он позволяет полностью избавиться от таких вредных примесей, как канамицин, формальдегид, феноловый красный, втрое снизить содержание куриного белка и освободиться от белков мозга мыши, не снижая при этом иммуногенную активность. Вакцина стабильна в процессе хранения и при транспортировке.
ЛИТЕРАТУРА
1. Авт. свид. СССР N 660389, С 12 N 7/04, С 12 К 5/00. Опубл. 28.02.1980, Б.И. №8.
2. Патент SU №1318149, C 12 N 7/04. Опубл. 15.06.1987, Б.И. №22.
3. Ляпустин В.Н. Автореферат диссертации на соискание ученой степени докт. биол. наук. Москва, 1993.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ДЛЯ ЭКСПРЕСС-ДИАГНОСТИКИ АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2003 |
|
RU2247991C1 |
| СПОСОБ ОЧИСТКИ И КОНЦЕНТРАЦИИ КОМПЛЕМЕНТСВЯЗЫВАЮЩЕГО АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1991 |
|
RU2016897C1 |
| Способ получения белкового антигена фасциол | 1983 |
|
SU1159579A1 |
| УСТРОЙСТВО ДЛЯ ОЧИСТКИ ВИРИОННЫХ СТРУКТУР ФЛАВИВИРУСОВ | 2007 |
|
RU2368660C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ТРЕХ ГИБРИДНЫХ БЕЛКОВ ОБОЛОЧКИ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ОПРЕДЕЛЯЮЩИХ ПРИНАДЛЕЖНОСТЬ К СИБИРСКОМУ (DBD2-D3S), ЕВРОПЕЙСКОМУ (DBD2-D3E) И ДАЛЬНЕВОСТОЧНОМУ (DBD2-D3D) ПОДТИПАМ ВИРУСА; РЕКОМБИНАНТНЫЕ ПЛАЗМИДЫ pDBD2-D3S, pDBD2-D3E И pDBD2-D3D; ШТАММЫ-ПРОДУЦЕНТЫ Escherichia coli M15 [pREP4]; ХИМЕРНЫЕ БЕЛКИ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2560588C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2001 |
|
RU2203089C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВИРИОННОГО АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2009 |
|
RU2402606C1 |
| КОМПЛЕКСНАЯ ТЕСТ-СИСТЕМА ИММУНОФЕРМЕНТНОГО АНАЛИЗА (ИФА) ДЛЯ ОПРЕДЕЛЕНИЯ УРОВНЯ АНТИТЕЛ К ВИРУСНЫМ РЕСПИРАТОРНЫМ ЗАБОЛЕВАНИЯМ КРУПНОГО РОГАТОГО СКОТА | 2008 |
|
RU2371726C1 |
| ЧЕТЫРЕХВАЛЕНТНАЯ ВЕКТОРНАЯ ВАКЦИНА И СПОСОБ ЕЕ ИСПОЛЬЗОВАНИЯ ДЛЯ ПРОФИЛАКТИКИ ЛИХОРАДКИ ДЕНГЕ | 2023 |
|
RU2812251C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРОМБИНОПОДОБНЫХ ФЕРМЕНТОВ ИЗ ЯДА ЗМЕИ | 2004 |
|
RU2271219C1 |

Изобретение относится к области медицинской вирусологии. Активные фракции антигена вируса клещевого энцефалита элюируют из полуфабриката при эффективном значении рН стартового и элюирующего буфера, преимущественно при рН>7,5 ед. В качестве элюирующего буфера может быть использован стартовый буфер с добавлением более 0,1 М галогенидов щелочных металлов, например KCl, и/или NaCl, и/или KBr. Зоны элюирования антигена определяют любым известным методом, преимущественно методом иммуноферментного анализа (ИФА), причем для элюирования целесообразно выбирать активные фракции антигена вируса клещевого энцефалита с изоэлектрическими точками со значениями 7,8 и 10,3. При необходимости элюированные фракции антигена объединяют и подвергают дополнительной очистке путем гель-фильтрации на сорбенте, способном поглощать низкомолекулярные примеси. В результате получают вакцину, сохраняющую эффективность при многократном разбавлении действующего начала. 4 з.п. ф-лы, 2 табл.
| СПОСОБ ПРИГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ КЛЕЩЕВОГО ИЛИ ЯПОНСКОГО ЭНЦЕФАЛИТА ИЗ ВИРУСНОЙ СУСПЕНЗИИ | 1996 |
|
RU2120804C1 |
| СПОСОБ ОЧИСТКИ И КОНЦЕНТРАЦИИ КОМПЛЕМЕНТСВЯЗЫВАЮЩЕГО АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1991 |
|
RU2016897C1 |
| Способ очистки суспензии вируса от клеточной ДНК | 1988 |
|
SU1532050A1 |
| СПОСОБ ПЕРЕРАБОТКИ ЖЕЛЕЗО-НИКЕЛЬ-КОБАЛЬТОВЫХСПЛАВОВ | 0 |
|
SU203909A1 |
| СОКОЛОВА Е.Д | |||
| и др | |||
| К вопросу об усовершенствовании инактивированной культуральной вакцины клещевого энцефалита посредством концентрирования вирусного антигена, Труды Томского медицинского института, 1989, т.35, с.32-39 | |||
| ЭЛЬБЕРТ Л.Б | |||
| и др | |||
| Концентрированная и очищенная вакцина против клещевого энцефалита, изготовленная методом ультрафильтрации и хроматографии, Вопросы вирусологии | |||
| - М.: Медицина, 1985, с.90-93. | |||
Авторы
Даты
2004-06-20—Публикация
2001-07-25—Подача