Изобретение относится к устройству для очистки вирусов и может быть использовано в микробиологической промышленности.
Обычно очистка вирусов осуществляется методами ультрацентрифугирования и гель-хроматографии. Основной недостаток этих методов заключается в трудности отделения примесей, сопоставимых по величинам молекулярных масс с вирионами. Способом, позволяющим избежать этого недостатка, является метод электрофореза, использующий различия макромолекул по их заряду. Одним из электрофоретических методов является изоэлектрофокусирование, сущность которого заключается в электрофорезе смеси белков в амфолинах. Разделение белков и белковых структур осуществляется благодаря тому, что белки при достижении своей изоэлектрической точки перестают двигаться в электрическом поле. Недостатком этого метода является то, что при достижении своей изоэлектрической точки белковые структуры частично денатурируют и теряют биологическую активность.
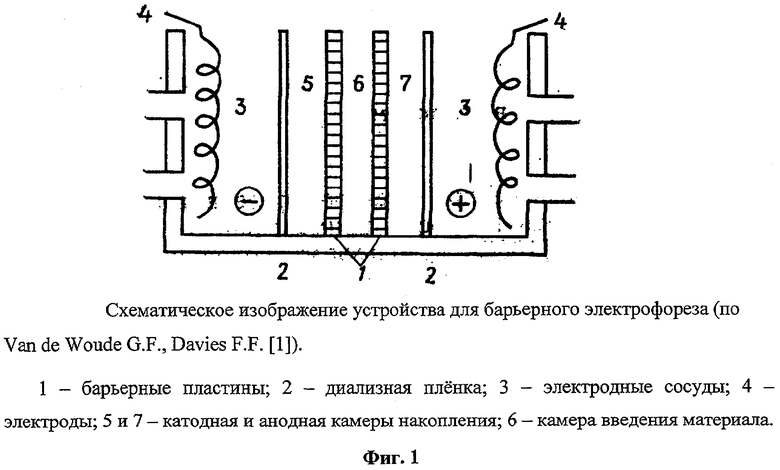
Метод барьерного электрофореза [1, 4] позволяет избежать этого благодаря подбору буферных систем и состава барьеров, что обеспечивает неподвижность очищаемого субстрата и перемещение других компонентов разделяемой смеси белков к аноду или катоду. Этот способ использовали для разделения бычьего сывороточного альбумина и бычьего сывороточного глобулина, для очистки гамма-глобулина человека из плазмы крови, для очистки рибонуклеазы Т1 от такадиастазы и для депротеинизации РНК. Однако этот метод не был адаптирован для очистки таких многокомпозитных, надмолекулярных структур, как вирусы. Для проведения барьерного электрофореза было предложено специальное устройство (см. фиг.1). Это устройство состоит из разделяющих камер объемом 5,0 мл, которые отделены друг от друга барьерами. Разделяющие камеры включают в себя катодную и анодную камеры накопления (5, 7), а также камеру введения материала (6). Барьерные пластины (1) толщиной 0,3 мм выполнены из плотных гелей (агаровых, силикагельных или полиакриламидных). Например, для барьеров применялся гель двух-трехпроцентного агара. Увеличение объема разделяемого материала, который вводился в камеру введения, достигалось за счет рециркуляции исходной композиции веществ.
Известен способ электрофореза для разделения вирусных популяций на субпопуляции. Эта электрофоретическая система применена для вирусов оспы и клещевого энцефалита (КЭ) [6, 7]. Этот метод не может быть применен для препаративной очистки флавивирусов, так как используемая установка не имеет разделительных барьеров и накопительных устройств.
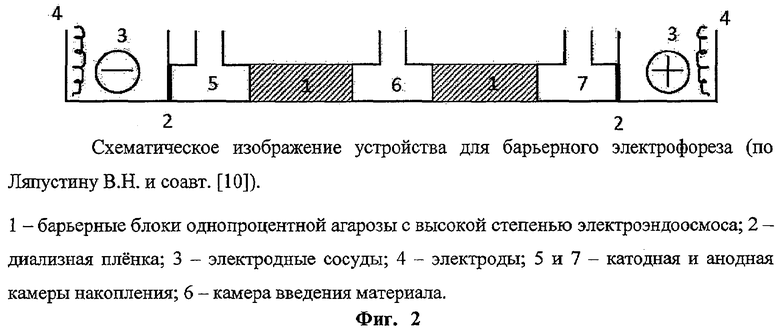
Обнаружено, что при иммуноэлектрофорезе антигенов вируса КЭ и вируса Западного Нила (ЗН) с использованием геля однопроцентной агарозы с высоким показателем электроэндоосмоса (-0,25±0,02 mr) основная часть вирионов флавивирусов в слабощелочной буферной системе Свендсена в отличие от других вирусных и клеточных белков и антигенов перемещается в ходе электрофореза к катоду [8, 9, 11]. Своеобразие движения нативных вирионов флавивирусов при иммуноэлектрофорезе послужило основанием для создания устройства для очистки и разделения флавивирусов. В частности, с помощью этого устройства, основанного на применении барьерного электрофореза, было проведено разделение вирионного и невирионного («растворимого») антигенов вируса КЭ [10]. Помимо разделения указанных антигенов устройство для барьерного электрофореза обеспечивало получение высокоочищенных препаратов вирионов даже из грубых клеточных суспензий. Разделение нативных антигенов вируса КЭ в электрофоретическом устройстве с последующей их инактивацией формалином позволило показать, что невирионный антиген, антигенность которого обеспечивается неструктурным белком NS1, обладает невысокими по сравнению с вирионами протективными свойствами [12].
Это устройство является наиболее близким аналогом предлагаемого изобретения, его составные части представлены на фиг.2. Довольно большая толщина барьеров однопроцентной агарозы - 30 мм, обеспечивала создание достаточного электроэндоосмотического тока жидкости, обуславливающего движение вирионов к катоду. Использование в качестве барьеров агарозы с высоким показателем электроэндоосмоса для барьерного электрофореза обеспечило отделение и очистку вирионов для иммунобиологических препаратов, получаемых из вируссодержащей культуральной жидкости и из клеточных суспензий.
С помощью такого устройства можно проводить субпопуляционный анализ штаммов вируса КЭ, имеющих разную нейровирулентность [5]. Недостатками этого устройства можно считать небольшой объем разделительных камер - 1,0 мл и существенную длительность электрофореза - 7-14 часов, которая обусловлена тем, что разделяемые белковые макромолекулы, чтобы попасть в камеры накопления, должны пройти через протяженный агарозный барьер.
Сущность предлагаемого изобретения заключается в разработке способа и устройства для очистки флавивирусов с помощью барьерного электрофореза, который позволяет получить высокоочищенные препараты вирионного антигена. Эта техническая задача решается с помощью предлагаемого устройства, в котором эндоосмотический ток жидкости, создаваемый агарозой с высокой степенью электроэндоосмоса, обеспечивается дополнительным агарозным блоком, вынесенным за систему барьеров, что позволяет уменьшить толщину барьеров, которые представлены либо тонким слоем агарозы, либо мембранными фильтрами типа Millipore. Использование агарозы со стандартным показателем электроэндоосмоса (-0,12±0,04 mr) также будет создавать эндоосмотический ток жидкости, но существенно меньший. Дополнительный блок расположен между анодной камерой и анодным электродным сосудом и заполнен гелем агарозы, например двухпроцентной, при этом толщина блока равна 65 мм. Предлагаемое устройство существенно снижает длительность электрофореза и предназначено для очистки вирионных структур флавивирусов, например вируса КЭ или вируса ЗН.
Такое устройство может быть выполнено в двух вариантах. Первый вариант состоит из блока трех отделенных друг от друга барьерами разделяющих камер: камеры введения материала, катодной и анодной камер накопления (см. фиг.3). В качестве барьеров использовали гель однопроцентной агарозы, при этом толщина катодного барьера составляла 5 мм, а анодного - 10 мм. Гель, содержащий около 1% агарозы, обеспечивает как проницаемость барьеров для вирусных структур, так и прочность агарозного барьера. В качестве барьеров также можно использовать мембранные фильтры Millipore. Эта модификация устройства применена в опыте, описанном в Примере 2.
Второй вариант устройства состоит лишь из двух разделяющих камер: камеры введения материала, объединенной с катодной камерой накопления, и анодной камеры. В обоих вариантах анодный и катодный электродные сосуды отделены диализной пленкой от блока разделяющих камер.
В первом варианте устройства, в котором катодная камера накопления отделена от камеры введения материала барьером, при электрофорезе основная часть вирионов остается в камере введения материала и отмечается движение значительной части вирионов к катоду и накопление их в катодной камере, а белковых примесей в анодную камеру.
Во втором варианте устройства, в котором катодная камера накопления объединена с камерой введения материала и вирусный материал вводят в объединенную камеру, при электрофорезе обе части вирионов остаются в этой камере и происходит только очистка вирионов от белковых примесей, которые перемещаются в анодную камеру накопления. Эта модификация устройства применена в эксперименте, описанном в Примере 3.
Для электрофоретического разделения использовали слабощелочные буферные растворы с высокой буферной емкостью: барбитал-трис-глициновый буфер Свендсена, рН=8,8, состоящий из смеси двух буферных растворов - барбиталового и трис-глицинового, трис-глициновый буфер [2] и трис-боратный буфер [15]. Электрофорез проводили при токе (I) 150 мА и напряжении (U) 40-50 В в течение 3-6 часов. Детекцию антигенной активности проводили с помощью методов ракетного иммуноэлектрофореза (РИЭФ) при использовании гипериммунного γ-глобулина из сывороток лошадей [8] и иммуноферментного анализа (ИФА) при использовании моноклональных антител (МКА) к поверхностному гликопротеиду Е и неструктурному белку NS1 [3, 14]. Концентрацию белка в пробах измеряли спектрофотометрически с помощью красителя Coomassie G.
Предлагаемое изобретение иллюстрируется следующими примерами.
Пример 1. Разделение нативных антигенных структур вируса КЭ с помощью устройства по первому варианту
В эксперименте использован буфер Свендсена. Для барьерного электрофореза применены пластины, состоящие из геля однопроцентной агарозы.
Вируссодержащая жидкость первичных культур клеток почек зеленых мартышек, полученная после заражения их вирусом КЭ штамм Софьин, в объеме 1 л была сконцентрирована до 10 мл с помощью ультрафильтрации на фильтрах Millipore с отсечкой белков, имеющих молекулярную массу выше 30 KD. Концентрат помещен в камеру введения электрофоретического устройства и проведен барьерный электрофорез при U=30 В и I=100 мА.
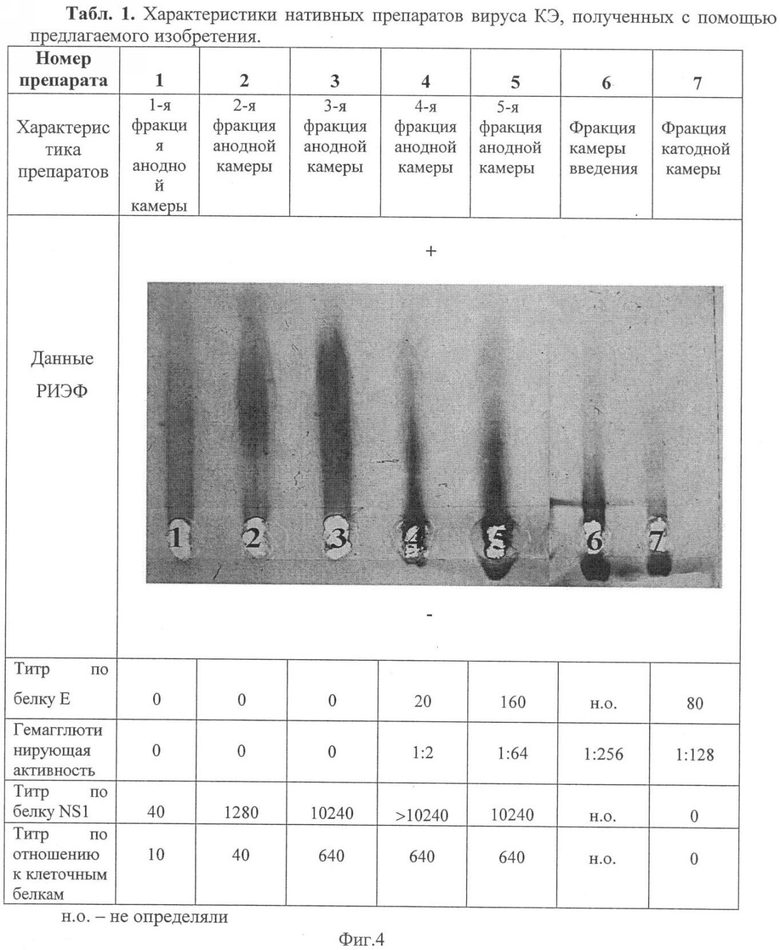
Фракции анодной камеры с 1 по 4 отбирали через каждые полчаса. После этого электрофорез проводили в течение 4 часов, разделенный вирусный материал отбирали из разделяющих камер и определяли активность полученных фракций. Выявление антигенной активности в полученных фракциях проводили методом РИЭФ и твердофазного одноступенчатого «сэндвич»-варианта ИФА на планшетах с использованием МКА 14D5 к белку Е и 4С4 к белку NS1 [3] и гипериммунной сыворотки кролика к белкам культуры клеток. С помощью РИЭФ в нативных препаратах невирионный антиген выявляется в виде ракетной полосы преципитации в анодной (верхней) части агарозного геля, а вирионный антиген - в виде ракетного преципитата в катодного (нижней) части геля. Из данных, приведенных в табл.1 (фиг.4), видно, что с помощью предлагаемого изобретения возможно получить образцы невирионного антигена, не содержащие примеси вирионов (препараты 1-3) и, наоборот, вирионных образцов без примеси невирионного антигена и клеточных белков (препарат 6 и 7).
Далее приведены эксперименты по изучению распределения белкового материала при электрофоретическом разделении концентратов инактивированного вируса КЭ. Концентраты получены с помощью ультрафильтрации из инактивированных формалином вируссодержащих культуральных жидкостей первичных культур клеток эмбрионов кур (обозначены как «первичные концентраты») [13].
Пример 2. Распределение антигенного материала первичного концентрата вируса КЭ, полученное с помощью устройства по первому варианту
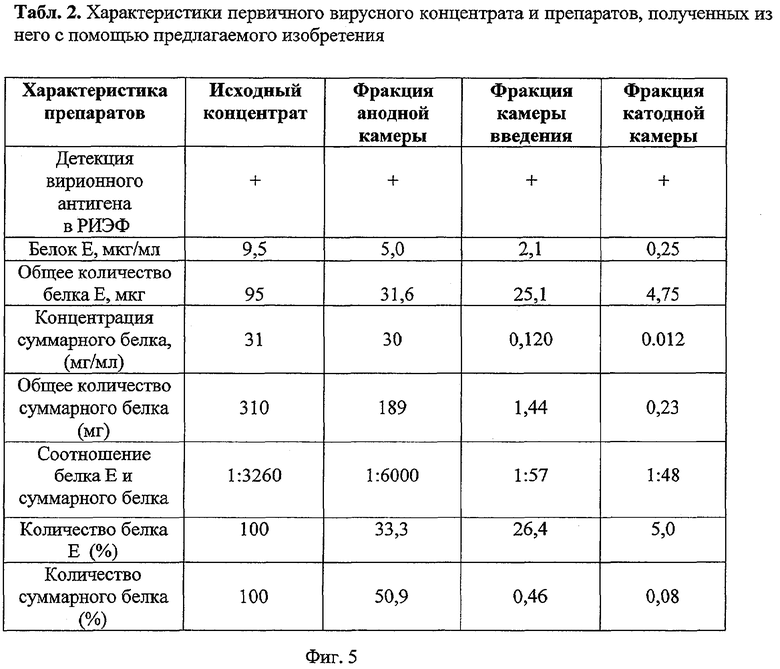
В эксперименте использован трис-глициновый буфер. Первичный вирусный концентрат также был приготовлен на этом буфере. Эксперимент выполнен с помощью устройства, созданного по первому варианту. В качестве барьеров применены миллипоровые фильтры диаметром пор 0,45 ммк. Полученные данные приведены в табл.2 (фиг.5).
В результате проведения барьерного электрофореза в катодной камере и камере введения материала были получены препараты вирионного антигена, отличающиеся по концентрации, но не по степени очистки (соотношение белка Е и суммарного белка составляло около 1:50). Эти препараты кардинально отличались по этому параметру от исходного концентрата и препарата, полученного в анодной камере накопления.
Пример 3. Распределение антигенного материала концентрата вируса КЭ, полученного из хроматографических фракций, при использовании второго варианта устройства
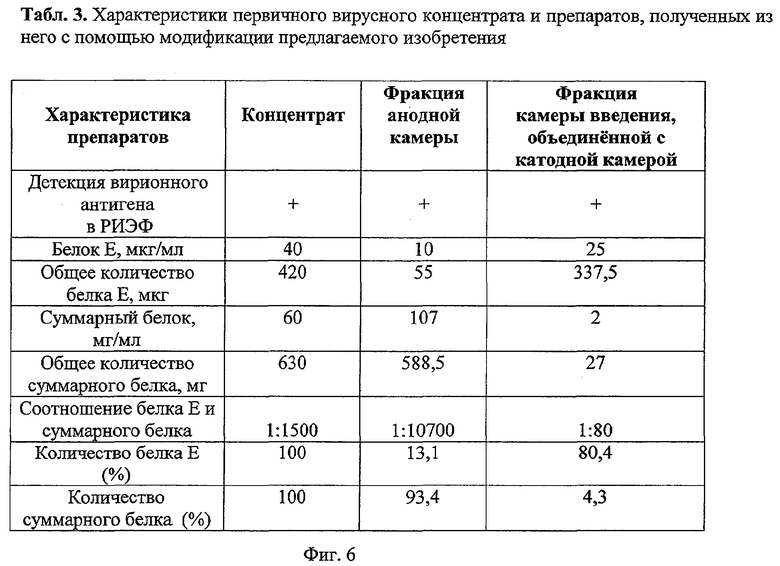
Сходство параметров препаратов вирионного антигена, получаемого в катодной камере накопления и камере введения материала, послужило основанием для внесения изменений в предлагаемое устройство. Модификация заключается в объединении катодной камеры накопления с камерой введения материала и исключении катодного барьера. Обнаружено, что если вирусный материал вводят в объединенную камеру, то в результате электрофореза обе части вирионов остаются в ней и происходит только очистка вирионов от белковых примесей, которые перемещаются в анодную камеру накопления. Для разделения использовали антигенный материал, приготовленный на трис-боратном буфере и имевший существенно более высокое содержание вирионного антигена, нежели в предыдущих примерах. В качестве барьера применен гель однопроцентной агарозы. Полученные данные приведены в табл.3 (фиг.6). В результате проведения электрофореза в модифицированном устройстве также был получен существенно очищенный препарат вирионного антигена - соотношение белка Е и суммарного белка составляло 1:80. Так же, как в примере 2, часть вирионного антигена в результате электрофореза перемещалась вместе с основным количеством примесных белков в анодную камеру.
Представленные данные свидетельствуют о том, что предлагаемое устройство для проведения барьерного электрофореза может быть использовано для очистки вирионов флавивирусов. С помощью предлагаемого изобретения можно получать высокоочищенные препараты вирионов флавивирусов, например вируса КЭ, в количествах, необходимых для создания диагностических препаратов. Этот метод позволяет получать и более чистые вакцинные препараты на основе вирионного антигена. Предлагаемый способ и устройство для барьерного электрофореза также можно использовать для очистки других флавивирусов с целью получения вакцин и диагностикумов.
ЛИТЕРАТУРА
1. Van de Woude G.F., Davies F.F. Barrier Electrophoresis: A New Electrophoretic Technique. Anal. Biochem., 1963, 6, 240-250.
2. Аксельсон Н. и соавт. Руководство по количественному иммуноэлектрофорезу. Методы и применение. М., «Мир», 1977.
3. Бахвалова В.Н., Караванов А.С., Матвеев Л.Э. и соавт. Исследование с помощью моноклональных антител антигенов Е и NS1 штаммов вируса клещевого энцефалита Западной Сибири. Вопр. вирусол., 2001, № 6, с.33-36.
4. Гааль Э., Медьеши Г., Верецкеи Л. Электрофорез в разделении биологических макромолекул. М., 1982.
5. Дживанян Т.И., Карганова Г.Г., Соболев С.Г. и соавт. Свойства частиц, формирующихся при воспроизведении острой инфекции in vitro вирусом КЭ, адаптированным к клещам Н.plumbeum. Вопр. вирусол., 1991, № 4, с.297-300.
6. Козлов Л.Б., Евтушенко А.Д. Применение электрофореза для фракционного разделения вируса осповакцины в жидкой среде. Вопр. вирусол., 1982, № 6, с.764-766.
7. Козлов Л.Б., Костылев С.Г., Евтушенко А.Д. Разделение вируса комплекса клещевого энцефалита с помощью электрофореза. Вопр. вирусол., 1983, № 5, с.571.
8. Ляпустин.В.Н., Жанков А.И., Дживанян Т.И. и соавт. Характеристики низкомолекулярного невирионного («растворимого») антигена вируса клещевого энцефалита. Вопр. вирусол., 1983, №2, с.200-207.
9. Ляпустин В.Н., Лашкевич В.А., Мустафина А.Н. и соавт. Зависимость синтеза вирионных структур вируса клещевого энцефалита от вида клеточных культур. Вопр. вирусол., 1987, № 6, с.701-709.
10. Ляпустин В.Н., Карганова Г.Г., Соболев С.Г. и соавт. Препаративное разделение структур вируса клещевого энцефалита с помощью электрофореза в жидкой фазе. Вопр. вирусол, 1988, № 1, с.98-102.
11. Ляпустин В.Н., Чунихин С.П., Решетников И.А. и соавт. Различия фенотипических свойств вируса лихорадки Западного Нила после репродукции в двух линиях культуры клеток комара Aedes albopictus Skuse, 1895. Мед. паразитол. и паразит. болезни, 1988, № 6, с.78-81.
12. Ляпустин В.Н., Пиванова Г.П., Караванов А.С. и соавт. Сопоставление протективных свойств препаратов вирионного и невирионного ("растворимого") антигенов вируса клещевого энцефалита. Вопр. вирусол., 1991, № 6, с.498-500.
13. Эльберт Л.Б., Красильников И.В., Дроздов С.Г. и соавт. Концентрированная и очищенная вакцина против клещевого энцефалита, приготовленная методом ультрафильтрации и хроматографии. Вопр. вирусол., 1985, № 1, с.90-93.
14. Тимофеев А.В., Эльберт Л.Б., Терлецкая Н.Н. и соавт. Применение прямого твердофазного иммуноферментного анализа для оценки иммунохимической активности вакцины против клещевого энцефалита. ЖМЭИ, 1987, № 9, с.89-93.
15. Фармакопейная статья ФС42-3874-99. Физико-химические, химические и иммунологические методы контроля медицинских и иммунобиологических препаратов, Фармакопейный государственный комитет, 1999, с.49.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВИРИОННОГО АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2009 |
|
RU2402606C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ КЛЕЩЕВОГО ЭНЦЕФАЛИТА НА ОСНОВЕ РАСТВОРИМОГО АНТИГЕНА | 1994 |
|
RU2084242C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ТРЕХ ГИБРИДНЫХ БЕЛКОВ ОБОЛОЧКИ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ОПРЕДЕЛЯЮЩИХ ПРИНАДЛЕЖНОСТЬ К СИБИРСКОМУ (DBD2-D3S), ЕВРОПЕЙСКОМУ (DBD2-D3E) И ДАЛЬНЕВОСТОЧНОМУ (DBD2-D3D) ПОДТИПАМ ВИРУСА; РЕКОМБИНАНТНЫЕ ПЛАЗМИДЫ pDBD2-D3S, pDBD2-D3E И pDBD2-D3D; ШТАММЫ-ПРОДУЦЕНТЫ Escherichia coli M15 [pREP4]; ХИМЕРНЫЕ БЕЛКИ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2560588C1 |
| СПОСОБ ПОЛУЧЕНИЯ И АТТЕСТАЦИИ СТАНДАРТНОГО ОБРАЗЦА АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2017 |
|
RU2667957C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК p7SHSHis ДЛЯ ПРОДУКЦИИ ДИМЕРНЫХ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА И ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ ДИМЕРНОЙ ФОРМЫ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2000 |
|
RU2190017C2 |
| Иммунобиологическое средство для профилактики заболеваний, вызванных вирусом клещевого энцефалита, на основе мРНК | 2024 |
|
RU2823754C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pSC13D6, СОДЕРЖАЩАЯ ГЕН ОДНОЦЕПОЧЕЧНОГО АНТИТЕЛА ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, И ШТАММ БАКТЕРИЙ Escherichia coli BL21(DE3)/pSC13D6 - ПРОДУЦЕНТ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, ОБЛАДАЮЩИХ ВИРУСНЕЙТРАЛИЗУЮЩИМИ СВОЙСТВАМИ | 2008 |
|
RU2378378C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PTLS, СОДЕРЖАЩАЯ ГЕН ОДНОЦЕПОЧЕЧНОГО АНТИТЕЛА ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI-ПРОДУЦЕНТ ОДНОЦЕПОЧЕЧНЫХ АНТИТЕЛ ПРОТИВ ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1998 |
|
RU2158309C2 |
| СПОСОБ ОЧИСТКИ И КОНЦЕНТРАЦИИ КОМПЛЕМЕНТСВЯЗЫВАЮЩЕГО АНТИГЕНА ВИРУСА КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 1991 |
|
RU2016897C1 |
| СПОСОБЫ УСКОРЕННОЙ ДИАГНОСТИКИ ГЕПАТИТА С, ОСНОВАННЫЕ НА ОБНАРУЖЕНИИ ГЕМАГГЛЮТИНИНОВ ВИРУСА ГЕПАТИТА С И АНТИТЕЛ К НИМ В РГА И РТГА В КРОВИ ЛЮДЕЙ | 2000 |
|
RU2194993C2 |
Изобретение относится к устройству для очистки вирусов и может быть использовано в микробиологической промышленности. Устройство включает последовательно размещенные катодный электродный сосуд, разделенные барьером катодную камеру накопления и анодную камеру накопления, анодный электродный сосуд. При этом катодный и анодный электродные сосуды отделены диализными пленками от катодной и анодной камер накопления соответственно. Между диализной пленкой, отделяющей анодную камеру накопления от анодного электродного сосуда, и анодным электродным сосудом введены последовательно расположенные буферная камера и блок геля агарозы с высокой степенью электроэндоосмоса. Изобретение позволяет снизить длительность электрофореза, получить высокоочищенные препараты вирионов флавивирусов. 4 з.п. ф-лы, 3 табл., 3 ил.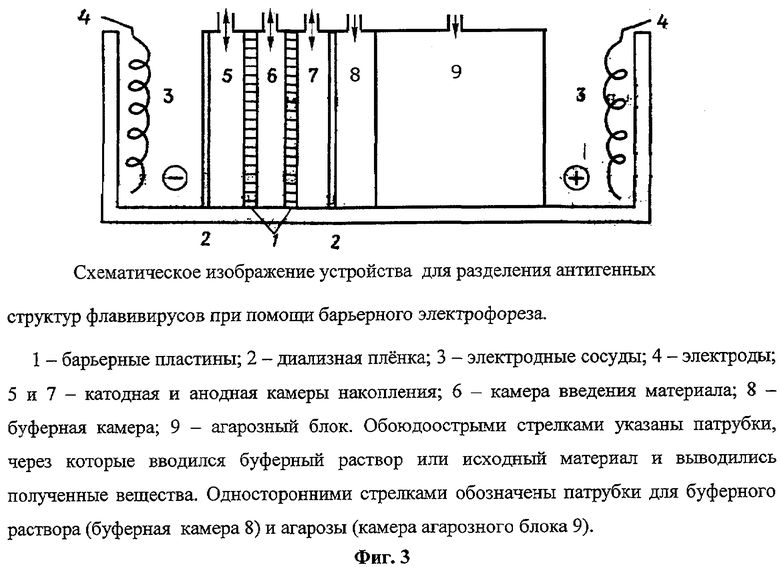
1. Устройство для очистки вирионных структур флавивирусов, включающее последовательно размещенные катодный электродный сосуд, разделенные барьером катодную камеру накопления и анодную камеру накопления, анодный электродный сосуд, катодный и анодный электродные сосуды отделены диализными пленками от катодной и анодной камер накопления соответственно, отличающееся тем, что между диализной пленкой, отделяющей анодную камеру накопления от анодного электродного сосуда, и анодным электродным сосудом введены последовательно размещенные буферная камера и блок геля агарозы с высокой степенью электроэндоосмоса.
2. Устройство по п.1, отличающееся тем, что между катодной камерой накопления и барьером, разделяющим катодную и анодную камеры накопления, размещена камера для введения материала, отделенная от катодной камеры накопления барьером в виде геля агарозы.
3. Устройство по п.1 или 2, отличающееся тем, что блок геля агарозы содержит двухпроцентную агарозу.
4. Устройство по п.1 или 2, отличающееся тем, что барьеры выполнены в виде геля однопроцентной агарозы.
5. Устройство по п.1 или 2, отличающееся тем, что барьеры выполнены в виде мембранных фильтров, например, типа Millipore.
| ЛЯПУСТИН В.Н | |||
| и др | |||
| Препаративное разделение антигенных структур вируса клещевого энцефалита с помощью электрофореза в жидкой среде | |||
| Вопросы вирусологии | |||
| Механическая топочная решетка с наклонными частью подвижными, частью неподвижными колосниковыми элементами | 1917 |
|
SU1988A1 |
| RU 2070935 C1, 27.12.1996 | |||
| СПОСОБ КОНЦЕНТРИРОВАНИЯ ВИРУСА | 1997 |
|
RU2130069C1 |
Авторы
Даты
2009-09-27—Публикация
2007-12-29—Подача