Изобретение относится к области основного органического синтеза, а именно к способу получения метилэтилкетона (МЭК, СН3СОС2Н5) каталитическим окислением н-бутенов кислородом, а также к катализаторам для его осуществления.
Вследствие исключительно высокой растворяющей способности метилэтилкетон-МЭК находит широкое промышленное применение [The Chemical Economics Handbook New York: SRI International (СЕН), 1996]. Он используется в производстве полиуретановых лаков, служащих для покрытия магнитных лент компьютеров, инструмента, аудио- и видеокассет, является лучшим депарафинизатором смазочных масел, обеспечивая их морозостойкость, является растворителем в производстве пенопластов, различных красок, эпоксидных и глифталевых смол, полихлорвинила, искусственной кожи, служит основой чернил для печатания.
МЭК используется в качестве сырья при получении метилизопропилкетона, 2,3-бутандиона; оксима метилэтилкетона, предотвращающего образование пленок при хранении красок. Используется для получения этилакриловой и изомерных метилкротоновых кислот, антиоксидантов резин, для пластификации производных нитроцеллюлозы, используемых в производстве бездымных порохов, находит применение как растворитель для пленочных покрытий таблеток и капсул лекарств, как реагент и экстрагент во многих фармацевтических производствах. Пероксид МЭК’а является инициатором полимеризации ненасыщенных полиэфиров в производстве армированных пластиков.
В промышленном масштабе МЭК получают несколькими способами. Один из них основан на жидкофазном свободнорадикальном окислении н-бутана по схеме (1), где МЭК является одним из целевых продуктов:
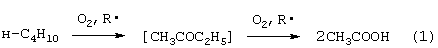
В этом способе выход МЭК не превышает 23%, одновременно получается и уксусная кислота. Достоинством этого способа является дешевизна исходного сырья, недостатком - обилие побочных продуктов, сильно осложняющих и удорожающих процесс выделения МЭК.
Основным промышленным способом синтеза МЭК является трехстадийная переработка бутиленовой фракции, являющейся побочным продуктом производства дивинила на заводах синтетического каучука. Способ отличается дешевизной сырья, он включает реакции (2)-(4):
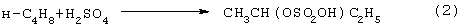
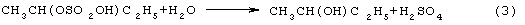
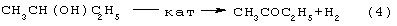
Из них реакции (2) и (3) - жидкофазные, а реакция (4) - гетерогенная каталитическая, а в некоторых вариантах - жидкофазная. Недостатками этого способа являются: обилие вредных необезвреживаемых отходов в виде загрязненной кислыми гудронами серной кислоты; высокая коррозионная активность среды в реакциях (2) и (3); высокая энергоемкость реакции (4); сложность процесса отделения МЭК от многочисленных примесей.
Разновидностью этого способа является процесс, в котором вместо H2SO4 используют уксусную кислота, а промежуточным продуктом является втор-бутилацетат:
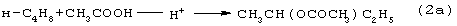
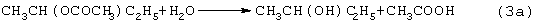
Катализатором стадий (2а) и (3а) служит сульфокатионит, который быстро забивается смолами и потому имеет малый срок службы. Использованный сульфокатионит также является вредным отходом производства, серьезно ухудшающим его экологию.
В последнее время были предложены и другие кислые катализаторы этих стадий, например гетерополикислоты [Cai Tianxi, Huang He, Lin Jinlong, He Min, Zhang Suofang, Li Luhui // Shiyou Huagong, 1988, V.17, N.9, P.565-567], однако они не обеспечили существенного улучшения способа. Во втop-бутилацетатном способе получения МЭК (2а)+(3а)+(4) отходов стало меньше, чем в сернокислотном. Недостатком его является неэкономичность, вызванная большими капиталовложениями и текущими затратами на единицу продукции из-за коррозионных свойств водной уксусной кислоты.
В последние годы предпринимались многократные попытки создания новых технологий получения МЭК из н-бутенов. Об этом свидетельствуют многочисленные патенты. Наибольший интерес из них представляют два новых способа: трехстадийный, включающий реакции (5)-(7) с промежуточным получением гидроперекиси втор-бутилбензола [Пат. США 5304684, 1994 фирмы Sumimoto Chem. Ltd.] и прямое окисление н-бутенов по реакции (8):
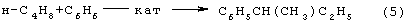
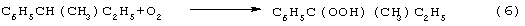

Трехстадийный способ основан на реакциях, подобных используемым в современном промышленном способе получения фенола и ацетона через гидроперекись кумола. Однако получение и разложение гидроперекиси втор-бутилбензола на стадиях (6) и (7) протекает с меньшей избирательностью, чем получение и разложение гидроперекиси кумола. В реакциях (6) и (7) наряду с МЭК и фенолом образуются карбоновые кислоты, их эфиры, альдегиды, непредельные кетоны, смолы. Побочные продукты удаляют щелочью, что существенно ухудшает экологию производства. Способ (5)-(7) мог бы стать перспективным для промышленности при условии существенного повышения избирательности на стадиях (6) и (7) получения и разложения гидроперекиси втор-бутилбензола.
В одностадийном способе получения МЭК гомогенная каталитическая реакция (8) аналогична реакции ваккеровского окисления этилена в ацетальдегид [Jira R., Freiesleben W. // in: Organometallic Reactions / Ed.: E.I.Becker, M.Tsutsui. Vol. 3 - New York et al.: Wiley Intersci., 1972, p.1-190]:
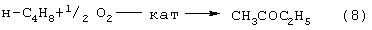
Реакцию (8) можно проводить в одном реакторе, подавая в него стехиометрическую смесь н-C4H8: O2=2: 1, которая прежде считалась невзрывоопасной [Справочник химика. 2-е изд. Дополнительный том. - Л.: Химия, 1968,с.434]. Однако для улучшения селективности и снижения степени риска реакцию следует проводить в две стадии: 1) взаимодействие н-бутилена с раствором промежуточного обратимо действующего окислителя Ох в присутствии соли палладия по уравнению (9); 2) регенерация Ох кислородом по уравнению (10):
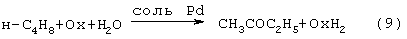

Первоначально в качестве Ох использовали хлорную медь CuCl2 [Jira R., Freiesleben W., см. выше], восстановленная форма которой - ион СuСl
В изобретениях [A.с. СССР 700973, B 01 J 23/44, 1994; A.с. СССР 822417, B 01 J 23/44, 1994] и более поздних [Пат. СССР 1669109, B 01 J 23/44, 1994] впервые было предложено использовать в качестве обратимого окислителя (Ох) Mo-V-фосфорные гетерополикислоты структуры Кеггина, имеющие общую формулу Н3+nPVnMo12-nO40, обозначенные нами через ГПК1. С их участием бутиленовая реакция описывалась уравнением (9а), а кислородная - уравнением (10а):
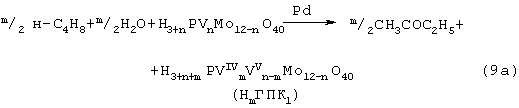
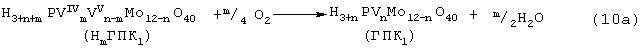
В этом способе (Ох=ГПК1) каталитическая система (PdII+ГПК1) не содержала Сl--ионов и потому обеспечивала полное отсутствие хлорорганических соединений в продуктах реакции. Избирательность системы достигала 95-98%, а активность в бутиленовой реакции (9a) в 100 раз превышала активность хлоридной системы (PdCl2+CuCl2). Каталитическая система (Pd+ГПК1) могла успешно использоваться как для окисления стехиометрической смеси н-C4H8: O2=2:1 в МЭК (одностадийный вариант), так и для проведения реакций (9a) и (10а) в разных реакторах (двухстадийный вариант). Последний вариант исключал контакт кислорода или воздуха с бутенами и с МЭК’ом и обеспечивал безопасность производства. Однако в последнем случае происходило глубокое восстановление молекул ГПК1. Это приводило к значительным изменениям химического состава и свойств как ионов Pd2+, так и самих молекул ГПК1. Этот вариант (нестационарного) катализа оказался связанным со снижением устойчивости каталитической системы (Pd+ГПK1).
Устойчивость катализатора в отношении ионов Pd2+ и молекул ГПК1 по-разному зависела от числа атомов ванадия в молекуле ГПК1 (n) и от отношения m:n (степени восстановления молекулы ГПК1). При малых значениях n (1≤ n≤ 3) и m≈ n неустойчивым оказывался палладий, который выделялся на поверхности восстановленного раствора в виде тонких металлических пленок, прилипавших к стенкам реактора. При большом числе атомов ванадия (4<n≤ 6) и m≈ n, кроме образования пленок палладия, наблюдалось выпадение из раствора также части ванадия в виде коричневого осадка V3О7·2Н2О. После окисления в воздушном реакторе восстановленной формы ГПК1 по реакции (10а) металлический палладий растворялся и возвращался в раствор, но ванадийсодержащий осадок при этом почти не растворялся. Полного же возвращения палладия в раствор в процессе получения МЭК не происходило, так как часть его осаждалась в различных частях пилотной установки. Поэтому катализатор (Pd+ГПК1) нельзя было признать вполне устойчивым ни в отношении палладия, ни в отношении ГПК1 с n≥ 4. Низкая стабильность такого катализатора оказалась его главным недостатком.
За последние 30 лет было предпринято много попыток стабилизировать палладий в катализаторе (Pd+ГПК1), однако все они по разным причинам оказались неприемлемыми для технологии. Простейший способ удержать Pd2+ в растворе введением малых концентраций Сl--ионов, соответствующих атомным отношениям Сl-:Pd=5-50, был предложен в патенте фирмы Catalytica Inc. (США) [Заявка WO 91/13852, 19.09.1991]. Однако даже при таких концентрациях хлор из раствора катализатора быстро переходил в продукты реакции с образованием хлорорганических соединений. Для поддержания стабильности палладия в катализатор приходилось непрерывно добавлять соляную кислоту и одновременно из продуктов реакции удалять и обезвреживать хлорорганические соединения. Поэтому "малохлоридный катализатор" (PdCl2+ГПК1) также не нашел промышленного применения.
Использование палладия в виде комплексов с пиридинкарбоновыми кислотами (α -пиколиновой или дипиколиновой) повышает его стабильность [А.с. СССР СССР 1584200, B 01 J 23/44, 1994; А.с. СССР 1669109, B 01 J 23/44, 1995]. Однако при этом в 10 и более раз снижается активность катализатора в реакции (9а) и падает его производительность. Это происходит потому, что комплекс Pd с производными пиридина оказывается слишком прочным и он чрезмерно стабилизирует палладий в высшей степени окисления (Pd2+). Поэтому такой способ оказался нетехнологичным.
В изобретении [Пат. Японии 07-149685, 1995] катализаторы (Pd+ГПК1) использовались в смешанных растворителях, содержащих менее 50% воды. В качестве таковых использовались диоксан, этанол, тетрагидрофуран, γ -бутиролактон или сульфолан. Реакцию (8) проводили одностадийно: растворенный α -бутен при 80° С и давлении О2 9 кг/см2 окислялся в МЭК. Устойчивость палладия обеспечивалась тем, что реакции (9а) и (10а) протекали одновременно (в одном реакторе). Однако конверсия α -бутена в МЭК была невелика: 21% за час в водном диоксане и 14% - в водном этаноле. В остальных растворителях она была еще меньше. Этот способ нетехнологичен и небезопасен. Идея использования неводных растворителей для реакции (8) оказалась неперспективной, поскольку эта реакция протекает через стадии (9а) и (10а), в которых вода является сокатализатором реакции (8), и понижение ее содержания резко снижает скорость реакции.
Эта же причина позволяет понять малую активность в реакции (8) гетерогенизированных катализаторов (Pd+ГПК1), нанесенных на твердый носитель [Stobbe-Kreemers A.W., van der Zon M., Makkee M., Scholten J.J.F. // J. Molec. Cat.,; Stobbe-Kreemers A.W., Makkee M., Scholten J.J.F. // Appl. Catal]. При применении таких катализаторов использовалась не жидкая вода, которая необходима, а водяной пар, который мог давать воду только конденсируясь в порах носителя. Поэтому стадия (9а), состоящая из этапов (9а’) и (9а’’), в гетерогенном варианте реакции (8) протекала очень медленно.
Прототипом предлагаемого способа и катализатора получения МЭК является способ [А.с. СССР 1584200, B 01 J 23/44, 1994], в котором в качестве катализатора используют водный раствор соли палладия, производного пиридина и кислой соли молибдованадофосфорной гетерополикислоты (ГПК1). Реакцию окисления проводят путем взаимодействия катализатора с н-бутиленом при температурах 50-70° С, а после отделения метилэтилкетона окисляют восстановленную форму катализатора кислородом или воздухом при температурах 130-160° С (двухстадийный вариант). В этом способе реакция (8) по-прежнему осуществляется в условиях нестационарного катализа. От глубины и скорости изменений химического состава, окислительных и других физико-химических свойств катализатора зависят его производительность и устойчивость на каждой стадии реакции (8). Оптимизация МЭК-технологии требует, чтобы такие изменения состава и свойств катализатора при протекании обеих стадий (9а) и (10а) были быстрыми, глубокими и обратимыми. Однако из-за выпадения осадков на стадии (9а) требование обратимости нарушается в отношении как палладия, так и молекул ГПК1 структуры Кеггина. Выпадение палладия в бутиленовом реакторе с неполным возвращением его в раствор в воздушном реакторе (нестабильность палладия) является недостатком каталитической системы (Pd+ГПК1). Еще более серьезным ее недостатком является нестабильность молекул ГПК1, обусловленная потерей ими части ванадия, выпадавшего в осадок на стадии (9а) и не возвратившегося в раствор на стадии (10а).
Изобретение решает задачу увеличения эффективности процесса за счет повышения стабильности компонентов катализатора (Pd+ГПК), что позволит значительно повысить производительность катализатора и его активность в обеих реакциях.
Задача решается катализатором получения метилэтилкетона окислением н-бутенов кислородом и/или кислородсодержащим газом, который состоит из водного раствора ГПК-z - молибдованадофосфорной гетерополикислоты (z - число атомов ванадия в молекуле ГПК-z), и/или смесь гетерополикислот, и/или их кислых солей, а также палладия с концентрацией 5· 10-4 - 1· 10-2 М, стабилизированного фталоцианиновым лигандом Рс при мольном отношении [Pd]:[Рс] = 0,5-2. Используют Mo-V-фосфорную ГПК-z состава: HaPxMOyVzOb, где 1≤ х≤ 3; 8≤ у≤ 20; 2≤ z≤ 12; 40≤ b≤ 99; а=2b-6у-5(х+z). Концентрация ванадия в водном растворе ГПК-z или ее соли составляет 0,4-2,2 грамм-атома на литр.
Задача решается также способом получения метилэтилкетона-МЭК путем гомогенного окисления н-бутенов кислородом и/или кислородсодержащим газом; катализатор содержит ГПК-z - молибдованадофосфорную гетерополикислоту состава: HaPxMoyVzOb, где 1≤ х≤ 3; 8≤ у≤ 20; 2≤ z≤ 12; 40≤ b≤ 99; a=2b-6у-5(x+z), и/или смесь кислот, и/или их кислые соли, а также Pd с концентрацией 5· 10-4 - 1· 10-2 М, стабилизированный фталоцианиновым лигандом Рс при мольном отношении [Pd]:[Рс]=0,5-2 при концентрации ванадия в водном растворе 0,4-2,2 грамм-атома на литр. Способ окисления н-бутенов в МЭК осуществляют непрерывно в двухстадийном режиме, в котором реакцию окисления н-бутенов ведут при температуре 15-90° С, а регенерацию катализатора путем взаимодействия его с кислородом или кислородсодержащим газом проводят при температуре 140-190° С при давлении кислорода 1-10 ата.
Предлагаемый способ синтеза МЭК, как и прототип, основан на использовании Mo-V-фосфорной ГПК в качестве обратимо действующего окислителя и палладия в качестве сокатализатора.
Основным отличием предлагаемого способа синтеза МЭК на катализаторе (Pd+ГПК) является то, что были использованы новые методы стабилизации компонентов катализатора (различные для палладия и ванадия). Они найдены нами в результате анализа причин нестабильности системы (Pd+ГПК1), а также на основе исследований кинетики и механизма реакций (9а) и (10а).
Для устранения недостатков известных катализаторов (Pd+ГПК1) и создания катализатора с высокой производительностью и устойчивостью ион палладия был стабилизирован комплексообразованием с фталоцианиновым лигандом Рс, а молекулы ГПК1 кеггиновской структуры заменены молекулами ГПК-z некеггиновского состава. В результате получен новый катализатор (Pd· Pc+ГПК-z).
Предлагаемые катализаторы на основе ГПК-z готовят способом, описанным в авторском свидетельстве [А.с. СССР 1782934, С 01 В 25/16, 1992]. Такие катализаторы имеют высокую гидролитическую устойчивость и не дают осадков при проведении стадий (9a1), (9a2) и (10а) реакции (8). Активность и производительность катализаторов в широких пределах можно регулировать четырьмя способами: а) выбором z; б) изменениями концентрации ГПК-z; в) вариациями концентраций комплекса Pd
Для контроля степени восстановления катализатора (или степени его окисленности) впервые использован метод измерения окислительного потенциала (Е) контактного раствора. Найденное значение Е (относительно нормального водородного электрода) сравнивается с полученной заранее кривой зависимости Е от m для используемого катализатора, где m - это степень восстановления ГПК (m=[V(IV)]/[ГПК]). По значению Е находят текущее значение m. В приведенных таблицах примеров имеется отдельная графа, где даны значения Е для окисленных растворов катализаторов. По ним можно судить о том, насколько хорошо регенерирован катализатор, так как от этого будет зависеть его производительность.
Отличием предлагаемого способа является создание в растворе высокой концентрации ванадия (до 2,2 грамм-атом на литр), которая приводит к повышению производительности катализатора с обеспечением его стабильности.
Следующим отличием этого способа является то, что регенерируют катализатор взаимодействием с кислородом и/или кислородсодержащим газом, а для повышения производительности способа регенерацию ведут при более высоких температурах (до 190° С) и РO2 до 10 ата.
Другим отличием является то, что бутиленовую реакцию проводят и при более низких, чем в способе-прототипе, температурах (от +15° С), поскольку катализатор (Pd· Pc+ГПК-z) обладает значительно большей активностью, чем катализатор способа-прототипа, где палладий стабилизирован дипиколиновой кислотой.
Сущность изобретения иллюстрируется примерами.
Пример 1. В реактор типа "каталитическая утка" на 120 мл, закрепленный на качалке, вливают 20 мл раствора катализатора, имеющего состав: [Н12Р3Мо17V9О87]=0,2 М, [Pd+2]=2· 10-3 М, мольное отношение [Pd]:[Рс]=4. Реактор термостатируют при 60° С, продувают 10-кратным объемом α -бутилена состава, %: α -C4H8 - 96,3, сумма цис- и тpaнс-β -C4H8 - 1,4, н-бутан - 2,2, тяжелые примеси - 0,1. Соединяют реактор с бюреткой, заполненной α -бутиленом, и при интенсивном встряхивании реактора проводят окисление C4H8 по реакции (9). За 40 мин раствор катализатора окисляет 188 мл α -бутилена (m=3,92е) с избирательностью 98,0%. После отпарки МЭК катализатор по реакции (10) окисляют в автоклаве с мешалкой при 190° С и Ро2=4 ата в течение 20 минут. Общее давление в автоклаве 16,4 ати за счет давления водяных паров (12,4 ати). С этим катализатором проводят 2-й цикл. Избирательность и активность катализатора не изменяются. Осадков в растворе нет.
Пример 2. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Mn2H13P3Mo18V8O90]=0.3 М, [Pd+2]=6· 10-3 М при мольном отношении [Pd]:[Рс]=2, за 23 мин окисляют 270 мл α -C4H8 (m=3,75е) с избирательностью 98,3%. После отпарки МЭК катализатор окисляют в автоклаве при условиях, аналогичных примеру 1. С этим катализатором проводят 2-й цикл. Избирательность и активность катализатора не изменяются. Осадков нет.
Пример 3. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Мn2Н6Р3Мо18V7O84]=0.3 М, [Pd+2]=6· 10-3 М при мольном отношении [Pd]:[Рс]=2, за 20 мин окисляют 244 мл α -C4H8 (m=3,39 е) с избирательностью 97,8%. После отпарки МЭК катализатор окисляют в автоклаве при условиях, аналогичных примеру 1. На втором цикле избирательность и активность катализатора не изменяются. Осадков нет.
Пример 4. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Н12Р2Мо12V6О62]=0.4 М, [Pd+2]=6· 10-3 М при мольном отношении [Pd]:[Рс]=2, за 17 мин окисляют 270 мл α -C4H8 (m=2,81 е) с избирательностью 98,3%.
Пример 5. Проводят по примеру 4, но отличается тем, что [Н12Р2Мо12V6O62]=0.2 М, за 20 мин окисляют 213 мл α -C4H8 (m=4,44 е) с избирательностью 97,9%.
Пример 6. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H17P3Mo18V8O90]=0.3 М, [Pd+2]=6· 10-3 М при мольном отношении [Pd]:[Рс]=2, за 22 мин окисляют 275 мл α -C4H8 (m=3,82 е) с избирательностью 98,2%.
Пример 7. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H10P3Mo19V7O87]=0.2 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 30 мин окисляют 180 мл α -C4H8 (m=3,75 е) с избирательностью 98,4%.
Пример 8. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H12P3Mo18V9O90]=0.2 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 29 мин окисляют 171 мл α -C4H8 (m=3,56 е) с избирательностью 98,0%. После отпарки МЭК катализатор окисляют в автоклаве при условиях, аналогичных примеру 1. На втором цикле избирательность и активность катализатора не изменяются.
Пример 9. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H15P3Mo19V8O92]=0.2 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Pc]=1, за 31 мин окисляют 177 мл α -C4H8 (m=3,67е) с избирательностью 98,0%.
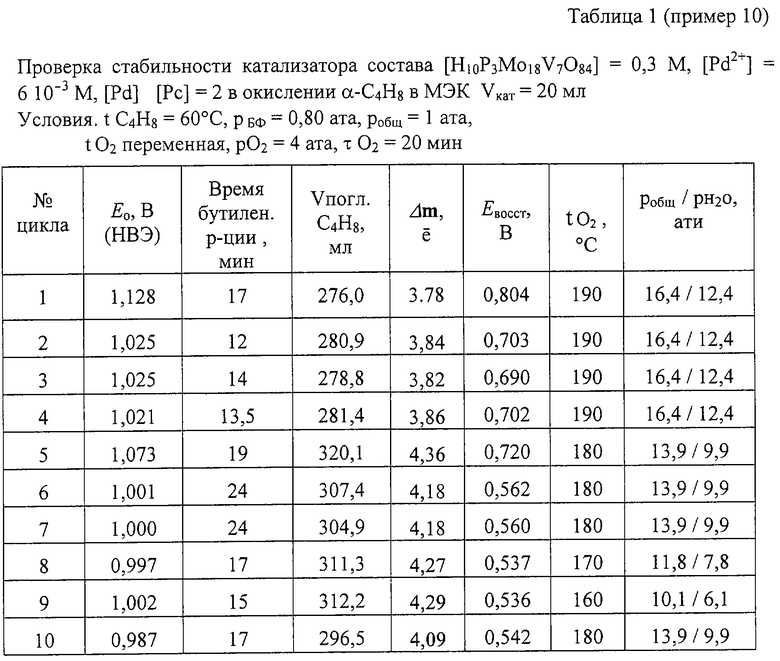
Пример 10. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H10P3Mo18V7O84]=0.3 М, [Pd+2]=6· 10-3 М при мольном отношении [Pd]:[Рс]=2, за 17 мин окисляют 276 мл α -C4H8 (m=3,78е) с избирательностью 97,5%. После отпарки МЭК катализатор окисляют по методике примера 1. С этим катализатором проводят 2-й цикл, на котором за 12 мин окисляют 281 мл α -C4H8. Всего с этим катализатором проводят 10 циклов, в процессе которых варьируют температуру регенерации катализатора от 160 до 190° С. Общее давление в автоклаве при этом меняют от 10,1 ати до 16,4 ати. Активность катализатора к 10 циклу практически не изменяется: за 19 мин на нем окисляют 278 мл α -C4H8 (3,83e). Данные приведены в таблице 1. Осадков в растворе нет.
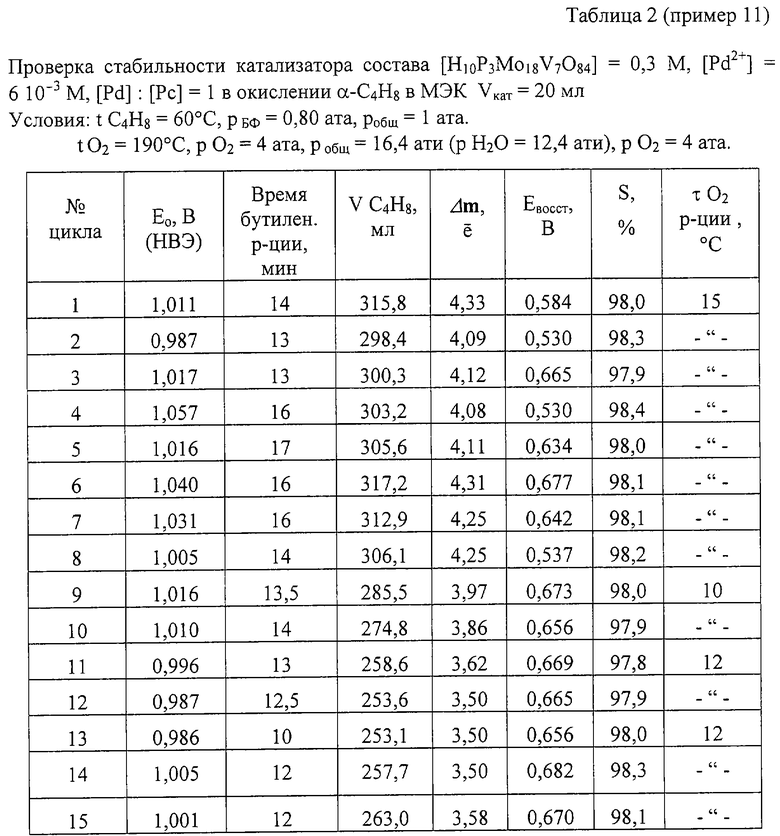
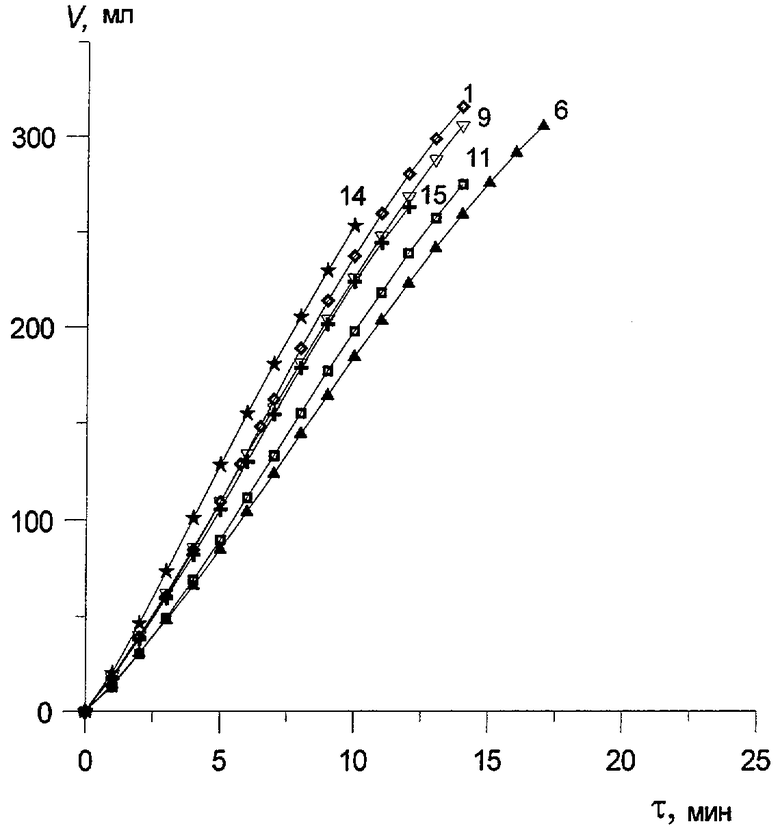
Пример 11. Проводят по примеру 10, но отличается тем, что мольное отношение [Pd]:[Рс]=1, за 14 мин окисляют 316 мл α -C4H8 (4,33e) с избирательностью 98,0%. После отпарки МЭК катализатор окисляют по методике примера 1 в течение 15 мин. Катализатор проработал 10 циклов, а затем после недельного стояния испытания были продолжены. Всего с этим катализатором проводят 15 циклов, в процессе которых постепенно снижают нагрузку на катализатор, а также время его регенерации до 10 мин (см. табл. 2). Катализатор работает с высокой стабильностью, избирательность его не изменяется, осадков нет. На чертеже приведены данные по активности катализатора в бутиленовой реакции в 15 циклах.
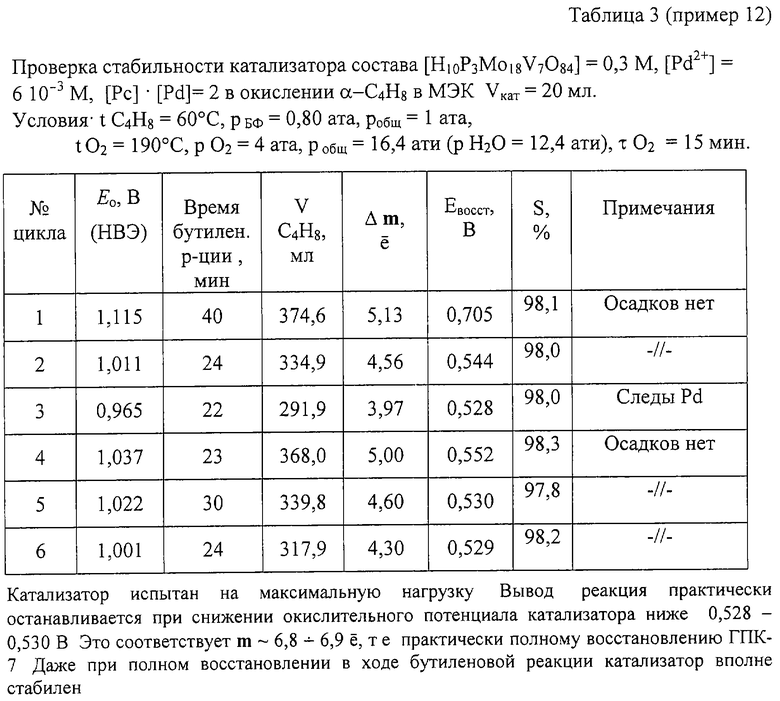
Пример 12. Проводят по примеру 10, но отличается тем, что мольное отношение [Рс]:[Pd]=2 (или [Pd]:[Рс] = 0,5), за 24 мин окисляют 335 мл α -C4H8 (4,56e) с избирательностью 98,1%. В этом примере катализатор испытан на максимальную нагрузку. После отпарки МЭК катализатор окисляют по методике примера 1 в течение 15 мин. Всего с этим катализатором проводят 6 циклов, в которых нагрузка была 4,0-5,0 е (см. табл. 3). Катализатор сохранил свою активность: он оказался стабилен даже при полном восстановлении в ходе бутиленовой реакции (6,8 е). Осадков нет.
Пример 13. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Н6РМо9V3O40]=0.5 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 30 мин окисляют 175 мл α -C4H8 (1,46е) с избирательностью 98,1%. После отпарки МЭК катализатор регенерируют по методике примера 1. С этим катализатором проводят всего 3 цикла. Его избирательность и активность постоянны.
Пример 14. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H5PMo10V2O40]=0.2 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 15 мин окисляют 113 мл α -C4H8 (2,35e) с избирательностью 98,0%. После отпарки МЭК катализатор регенерируют по методике примера 1.
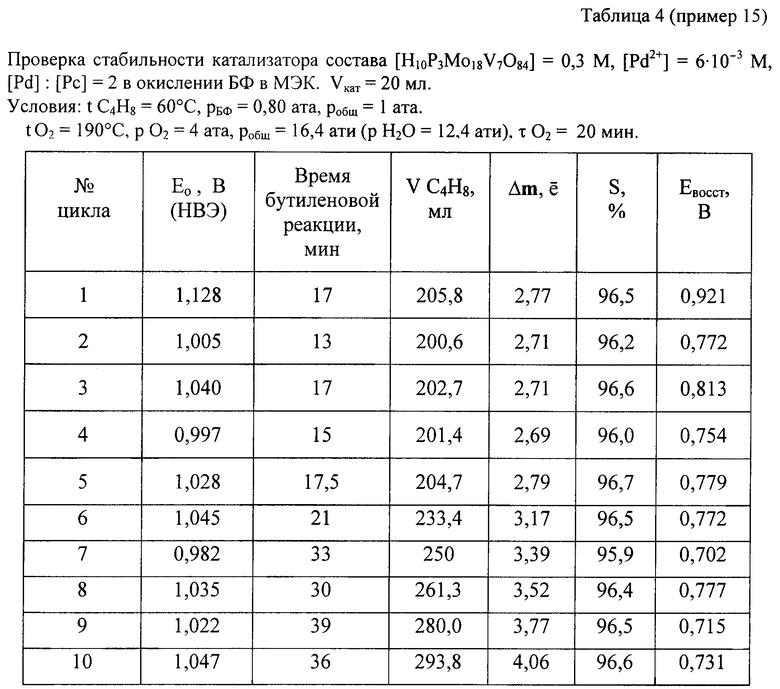
Пример 15. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H10P3Mo18V7O84]=0.3 М, [Pd+2]=6· 10-3 М при мольном отношении [Pd]:[Рс]=2, и тем, что на окисление подают промышленную бутиленовую фракцию (БФ) состава, %: бутен-1 - 37.5, цис-2-бутен - 34.9, транс-2-бутен - 25,9 (сумма н-бутенов равна 98,3), дивинил - 0,21, изо-бутилен - 0,1, ацетилены - 0,005, изо-бутан - 1,08, н-бутан - 0,3, за 17 мин окисляют 206 мл БФ (2,77е) с избирательностью 96,5%. После отпарки МЭК и регенерации катализатора по методике примера 1 с ним проводят 2-й цикл, на котором за 13 мин окисляют 201 мл БФ. Аналогично предыдущим проводят еще 3 цикла. Избирательность и активность катализатора не изменяются: на 5 цикле окисляют 205 мл БФ за 17,5 мин. На этом катализаторе далее проводят циклы 6-10, в которых постепенно поднимают нагрузку на катализатор (т.е. увеличивают его производительность). Катализатор работает стабильно, не изменяя своих показателей (см. табл. 4). На 10-м цикле на нем окисляют за 36 мин 294 мл БФ (m=4,06е). Осадков в растворе нет.
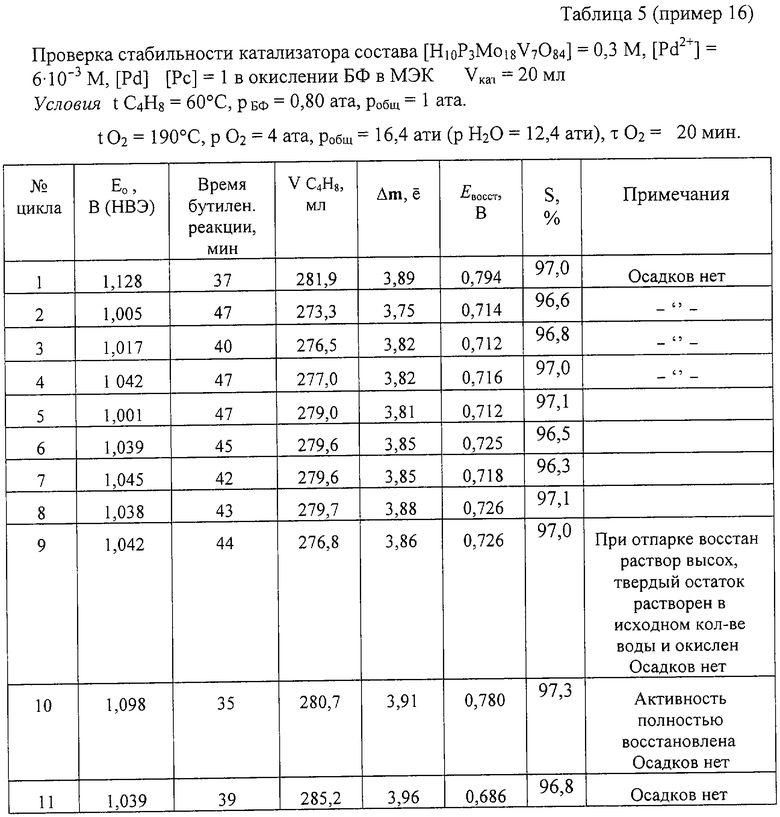
Пример 16. Проводят по примеру 15, но отличается тем, что мольное отношение [Pd]:[Рс] = 1, за 37 мин окисляют 282 мл БФ (m=3,89е) с избирательностью 97,0%. После отпарки МЭК катализатор окисляют по методике примера 1. С этим катализатором проводят еще 10 циклов (см табл. 5). Избирательность и активность его практически не изменяются. Так, на 11-м цикле раствор за 39 мин окисляет 286 мл БФ (m=3,96е). Осадков в растворе нет.
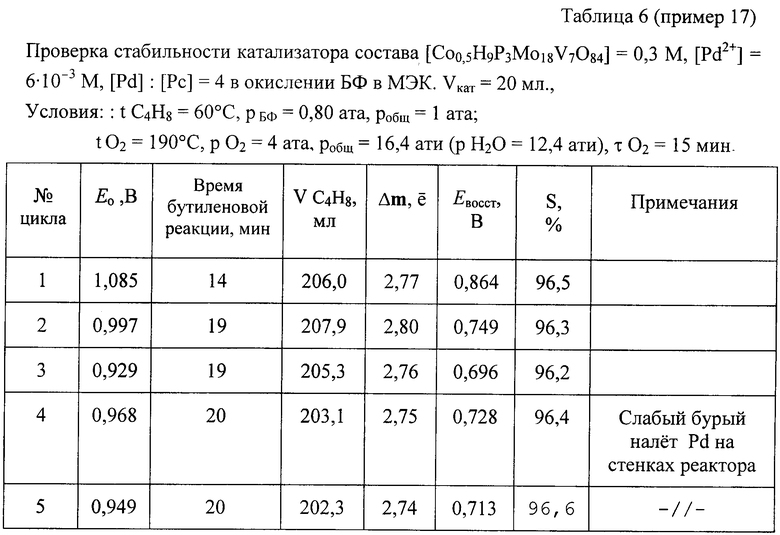
Пример 17. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют кислую соль [Cо0,5H9P3Mo18V7O84]=0.3 М, [Pd+2]=6· 10-3 M при мольном отношении [Pd]:[Рс]=4, а также тем, что окисляют БФ (см. пример 15), за 15 мин окисляют 206 мл БФ (m=2,77е) с избирательностью 96,5%. После отпарки МЭК катализатор окисляют по методике примера 1 в течение 15 мин. С этим катализатором проводят 2-й цикл, на котором за 19 мин окисляют 208 мл БФ. Аналогично предыдущим проводят еще 3 цикла. Активность катализатора стабилизируется на уровне активности 2-го цикла: на 5-м цикле за 19 мин на нем окисляют 207 мл БФ. Избирательность катализатора не изменяется (см. табл. 6). Как отмечено в примечании, на стенках реактора к концу испытаний появился незначительный темный налет, свидетельствующий о недостаточной стабилизации палладия при мольном отношении [Pd]:[Рс]=4. Как видно из примеров 15 и 16, это отношение должно быть меньше или равно 2.
Пример 18. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Mn2H13P3Mo16V12O94]=0.2 М, [Pd+2]=2· 10-3 М при мольном отношении [Pd]:[Рс]=4 и t=70° С, а также тем, что окисляют БФ (см. пример 15), за 55 мин окисляют 146 мл БФ (m=3,05е) с избирательностью 96,2%. После отпарки МЭК катализатор окисляют в автоклаве при 160° С и Ро2=4 ата в течение 20 мин. Общее давление в автоклаве 10,1 ати. С этим катализатором проводят 2-й цикл, на котором за 65 мин окисляют 183 мл БФ (3,78е). Катализатор регенерируют при 140° С и Ро2=4 ата. Общее давление в автоклаве 7,6 ати (давление водяных паров равно 3,6 ати). Аналогично проводят 3-й цикл, в котором за 59 мин окисляют 165,5 мл БФ (3,40е). Избирательность катализатора не изменяется.
Пример 19. Проводят по примеру 18, но отличается тем, что используют ГПК состава СuМnН3Р3Мо16V12O89, за 40 мин окисляют 188 мл БФ (m=3,95е) с избирательностью 96,8%. После отпарки МЭК катализатор окисляют в автоклаве при 160° С и Ро2=4 ата в течение 20 мин. Общее давление в автоклаве равно 10,1 ати (давление паров воды 6,1 ати). С этим катализатором проводят 2-й цикл, на котором за 41 мин окисляют 153 мл БФ (3,19е). Аналогично проводят 3-й цикл, в котором за 40 мин окисляют 152 мл БФ (3,18е). Избирательность катализатора практически не изменяется.
Пример 20. Проводят по примеру 18, но отличается тем, что используют ГПК состава СоМnН6Р2Мо18V7O84, за 46 мин окисляют 192 мл БФ (m=3,93е) с избирательностью 96,4%, После отпарки МЭК катализатор окисляют в автоклаве при 160° С и Ро2=4 ата в течение 20 мин. Общее давление в автоклаве 10,1 ати. С этим катализатором проводят 2-й цикл, на котором за 50 мин окисляют 148 мл БФ (3,08е). Аналогично проводят 3-й цикл, в котором за 45 мин окисляют 159 мл БФ (3,30е). Избирательность катализатора практически не изменяется.
Пример 21. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H10P3Mo18V7O84]=0.2 М, [Рd+2]=6· 10-3 М при мольном отношении [Pd]:[Рс]=1 и t=18° С, за 40 мин окисляют 64 мл α -C4H8 (m=1,33е) с избирательностью 98,5%.
Пример 22. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Н7Р3Мо16V12O89]=0.2 М, [Pd+2]=2· 10-3 М при мольном отношении [Pd]:[Рс]=4, за 40 мин окисляют 192 мл α -C4H8 (m=4,0е) с избирательностью 97,8%.
Пример 23. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Н7Р3Мо16V10O84]=0.2 М, [Pd+2]=2· 10-3 М при мольном отношении [Pd]:[Рс]=4, за 39 мин окисляют 185 мл α -C4H8 (m=3,85е) с избирательностью 98,0%.
Пример 24. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H12P3Mo17V9O87]=0.2 М, [Pd+2]=2· 10-3 М при мольном отношении [Pd]:[Рс]=4, за 37 мин окисляют 180 мл α -C4H8 (m=3,75е) с избирательностью 98.1%.
Пример 25. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [Н9Р3Мо19V12O99]=0.17 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 30 мин окисляют 166 л α -C4H8 (m=4,07е) с избирательностью 98,6%.
Пример 26. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H9P3Mo18V10O91]=0.2 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 32 мин окисляют 150 мл α -C4H8 (m=3,13е) с избирательностью 98,5%.
Пример 27. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H12P3Mo18V9O90]=0.25 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 30 мин окисляют 169 мл α -C4H8 (m=2,82е) с избирательностью 97,9%.
Пример 28. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H9P3Mo18V8O86]=0.25 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 30 мин окисляют 173 мл α -C4H8 (m=3,05е) с избирательностью 98,0%.
Пример 29. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H9P3Mo19V6O84]=0.25 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 32 мин окисляют 179 мл α -C4H8 (m=3,16е) с избирательностью 97,9%.
Пример 30. Проводят по примеру 1, но отличается тем, что в качестве катализатора используют [H10P3Mo20V5O85]=0.25 М, [Pd+2]=5· 10-4 М при мольном отношении [Pd]:[Рс]=1, за 30 мин окисляют 174 мл a-C4H8 (m=3,06е) с избирательностью 98,2%. После отпарки МЭК катализатор окисляют по методике примера 1. С этим катализатором проводят еще 2 цикла. Избирательность и активность его практически не изменяются. Так, на 3 цикле раствор за 29 мин окисляет 177 мл БФ (m=3,12е). Осадков в растворе нет.
Все катализаторы, описанные в примерах 1-30, готовят известным способом [А.с. СССР 1782934, С 01 В 25/16, 1992]. Вначале синтезируют раствор ГПК заданного состава и заданной концентрации исходя из стехиометрических количеств компонентов Н3РO4, МоО3 и V2O5. Затем в полученный раствор вводят навески PdCl2 и фталоцианина.
Пример синтеза 250 мл ГПК состава Н12Р3Мо17V9О87 (пример 1) с концентрацией 0,20 М.
Расчет количеств исходных компонентов ведут по уравнению
3Н3РO4+17МоО3+4,5V2O5+1,5H2O→ H12P3Mo17V9O87.
Используют 122,4 г МоО3 х.ч., 40,95 г V2O5 х.ч., 20,88 мл 7,183-молярного раствора Н3РO4 и 30%-ную Н2O2 ос.ч. Растворение реагентов проводят в четыре этапа:
1) 122,4 г МоО3+10,88 мл Н3РO4+1500 мл Н2O+2,0 мл Н2O2
2) 14,00 г V2O5+700 мл H2O+50 мл Н2O2+3,00 мл Н3РO4
3) 14,00 г V2O5+700 мл Н2О+50 мл Н2O2+3,00 мл Н3РO4
4) 12,95 г V2O5+700 мл Н2O+50 мл Н2O2+4,00 мл Н3РO4
Для растворения МоОз в коническую 3-литровую колбу загружают всю навеску МоО3, 1,5 л дистиллированной воды, 10,88 мл Н3РO4 и 2 мл 30%-ной H2O2 х.ч. Полученную смесь кипятят (она приобретает соломенно-желтую окраску) и постепенно упаривают до ~ 0,8 л. В кипящую смесь последовательно вводят растворы, полученные растворением V2O5 в воде в присутствии Н2O2 и Н3РO4. Каждую последующую порцию раствора V2О5+Н3РO4 вводят после упаривания смеси в колбе до ~ 1 л.
Для растворения 1-й навески V2O5 в 1-литровый стакан загружают 14 г V2О5, 0,7 л дистиллированной воды и 50 мл Н2О2. Полученную смесь перемешивают при 15-20° С (не выше) в течение 20-30 мин до получения темнокрасно-коричневого раствора. После растворения V2O5 к смеси при перемешивании добавляют 3 мл Н3РO4 и ожидают прекращения выделения О2, образующегося за счет разложения перекисных комплексов ванадия. Полученный темнокоричневый раствор переливают в колбу с кипящей суспензией МоО3+Н3РO4 и упаривают до ~ 1 л. Аналогично проводят растворение 2-й и 3-й навесок V2O5 и добавление полученного раствора к суспензии МоО3+V2O5+Н3РO4. Эту смесь затем кипятят и упаривают до 400 мл.
После охлаждения полученный раствор ГПК фильтруют через бумажный фильтр с красной полосой и фильтр промывают водой. Если осадок на фильтре превышает 2% от массы исходной V2O5 то его вместе с фильтром обрабатывают в стакане 15%-ной H2O2 (~ 50 мл), полученный раствор нагревают до полного разложения H2O2 и после охлаждения фильтруют через свежий бумажный фильтр. Этот фильтрат присоединяют к объединенному раствору ГПК с промывными водами и упаривают до 250 мл.
Катализаторы для опытов, содержащие ГПК, PdCl2 и фталоцианин, обычно готовят в количестве 20 мл. Например, для получения катализатора состава [H12P3Mo17V9O87]=0,20 М, [Pd2+]=2· 10-3 М с мольным соотношением [Рс]:[Pd2+]=1:4 в раствор 0,20 М ГПК вводят навески 0,0071 г PdCl2 и 0,0084 г фталоцианина. Раствор нагревают и кипятят 8-10 минут до полного растворения навесок. Затем раствор охлаждают и доводят его объем до 20 мл.
Как видно из приведенных примеров и таблиц, предлагаемое изобретение позволяет значительно увеличить стабильность работы катализатора и увеличить производительность процесса.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР И СПОСОБ ПОЛУЧЕНИЯ МЕТИЛЭТИЛКЕТОНА | 2003 |
|
RU2243818C1 |
| КАТАЛИЗАТОР И СПОСОБ ПОЛУЧЕНИЯ МЕТИЛЭТИЛКЕТОНА | 2004 |
|
RU2275960C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЕТОНОВ И КАТАЛИЗАТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2005 |
|
RU2294322C1 |
| КАТАЛИЗАТОР ДЛЯ ОКИСЛЕНИЯ Н-БУТИЛЕНА В МЕТИЛЭТИЛКЕТОН И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 1989 |
|
RU1669109C |
| СПОСОБ ОКИСЛИТЕЛЬНОЙ АКТИВАЦИИ БЕСХЛОРИДНОГО КАТАЛИЗАТОРА ДЛЯ ОКИСЛЕНИЯ Н-БУТИЛЕНА | 1987 |
|
SU1578908A1 |
| Способ получения карбонильных соединений | 1976 |
|
SU644774A1 |
| КАТАЛИЗАТОР ДЛЯ ОКИСЛЕНИЯ н-БУТИЛЕНА В МЕТИЛЭТИЛКЕТОН И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 1987 |
|
SU1584200A1 |
| Катализатор и способ получения высших 2-кетонов С5-С10 | 2022 |
|
RU2790246C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-МЕТИЛ-1,4 НАФТОХИНОНА И КАТАЛИЗАТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2000 |
|
RU2162837C1 |
| Гомогенный катализатор для окисления окиси углерода | 1981 |
|
SU1027880A1 |
Изобретение относится к области основного органического синтеза, а именно к способу получения метилэтилкетона каталитическим окислением н-бутенов кислородом, а также к катализаторам для его осуществления. Изобретение решает задачу увеличения эффективности процесса за счет повышения стабильности компонентов катализатора (Pd + ГПК), что позволит значительно повысить производительность катализатора и его активность в обеих реакциях. Задача решается способом получения метилэтилкетона окислением н-бутенов кислородом и/или кислородсодержащим газом с использованием каталитической системы, которая состоит из водного раствора ГПК-z - молибдованадофосфорной гетерополикислоты или смеси гетерополикислот и/или их солей, а также палладия с концентрацией 5·10-4-1·10-2 М, стабилизированного фталоцианиновым лигандом Рс при мольном отношении [Pd]:[Рс]=0,5-2. Используют Mo-V-фосфорную ГПК-z состава HaPxMoyVzOb, где 1≤х≤3; 8≤у≤20; 2≤z≤12; 40≤b≤99; а=2b-6у-5(х+z). Концентрация ванадия в водном растворе ГПК-z или ее соли составляет 0,4-2,2 грамм-атома на литр. Способ окисления н-бутенов в МЭК осуществляют в периодическом (двухстадийном) режиме, в котором реакцию окисления н-бутенов ведут в интервале температур 15-90°С, а регенерацию катализатора путем взаимодействия его с кислородом или кислородсодержащим газом проводят в интервале температур 140-190°С при давлении кислорода 1-10 ата. 2 н. и 5 з.п.ф-лы, 6 табл., 1 ил.
| КАТАЛИЗАТОР ДЛЯ ОКИСЛЕНИЯ н-БУТИЛЕНА В МЕТИЛЭТИЛКЕТОН И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 1987 |
|
SU1584200A1 |
| КАТАЛИЗАТОР ДЛЯ ОКИСЛЕНИЯ Н-БУТИЛЕНА В МЕТИЛЭТИЛКЕТОН И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 1989 |
|
RU1669109C |
| КАТАЛИЗАТОР ДЛЯ ЖИДКОФАЗНОГО ОКИСЛЕНИЯ ОЛЕФИНОВ В КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ | 1977 |
|
SU700973A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| US 5304684 A, 19.04.1994. | |||
Авторы
Даты
2004-06-20—Публикация
2003-03-31—Подача