Область изобретения
Настоящее изобретение относится, главным образом, к области питания и физиологической химии. Более конкретно, настоящее изобретение относится к новым способам биохимического определения антиоксидантной функции.
Описание предшествующего уровня техники
Клетки человека непрерывно подвергаются действию высоко химически активных и нестабильных молекул, названных свободными радикалами, которые вызывают окисленный стресс. Эти приносящие вред молекулы являются побочным продуктом нормальной жизнедеятельности и вырабатываются в результате метаболизма кислорода, то есть при клеточном дыхании, клетками иммунной системы (уничтожение чужеродного материала), а также в результате целого ряда ферментативных реакций, весьма важных в процессах обмена веществ. Источники свободных радикалов окружающей среды включают: сигаретный дым, ионизирующее излучение, загрязнение воздуха, химические соединения (карциногены, многие нефтехимические соединения, биоциды, красители, растворители, цитостатические лекарственные соединения и так далее), токсические тяжелые металлы, а также окисленные (прогорклые) жиры. К некоторым наиболее распространенным свободным радикалам относятся супероксид, гидроксид, синглетный кислород и пероксиды. Железо и медь определенных валентностей могут катализировать реакции образования свободных радикалов, хотя и короткоживущих, но которые ускоряют цепную реакцию образования радикалов, что влечет за собой изменение, повреждение биологических молекул.
Свободные радикалы токсичны для живых организмов, так как вызывают повреждение структуры всех биологических молекул. Молекулярное повреждение может приводить к изменению генетических кодов, нарушению целостности клеточной мембраны, неврологическим нарушениям, нарушению равновесия эндокринной системы, усилению аллергий, разрушению сосудистого эндотелия, а также к деградации и воспалению суставов.
Защита от вредного воздействия свободных радикалов была обнаружена среди широкого спектра молекул, названных антиоксидантами. Свободные радикалы и побочные продукты их реакций могут быть нейтрализованы и превращены в менее вредные продукты с помощью антиоксидантов. Антиоксидантами могут быть ферменты (такие как супероксиддисмутаза, каталаза, глутатион-пероксидаза), важные питательные вещества (такие как бета каротин, витамины С и Е, селен и цистеин) или широкий ряд разнообразных эндогенных соединений (таких как глутатион) или входящих в рацион питания соединений (таких как биофлаваноиды). Таким образом, организм человека имеет различные гасители свободных радикалов. Исследование человека показало, что недостаточное потребление питательных веществ, обладающих антиоксидантным действием связано с повышенным риском возникновения рака, сердечно-сосудистых заболеваний, артритов, катаракты и т.д. Также с повышенным потребление питательных веществ, обладающих антиоксидантным действием, связано снижение заболеваемости хроническими дегенеративными заболеваниями.
Обнадеживающие исследования показывают, что использование ан-тиоксидантных питательных добавок может оказывать положительное терапевтическое действие на человека. Лабораторное определение антиоксидантного статуса не вошло в обычную практику по целому ряду причин. Свободные радикалы крайне неустойчивы и, главным образом, не поддаются прямому измерению. Они могут быть определены через измерение продуктов, подвергшихся повреждающему действию свободных радикалов, таких как малондиальдегида (МДА), химически активных соединений тиобарбитуровой кислоты (АСТБК) или пероксидов липидов в сыворотке или моче. Эти тесты являются указателями окислительного стресса, однако отражают только повреждение определенных типов биомолекул (в большинстве случаев полиненасыщенных липидов и нуклеиновых кислот). Об уровнях антиоксидантных питательных веществ в сыворотке или клетках и активности антиоксидантных ферментов в клетке можно судить по недостаточности уровня специфических соединений, однако это не дает достаточной информации о взаимодействии и механизме действия антиоксидантов. Другие тесты для определения окислительного стресса пригодны в исследовательских целях, но неприемлемы для текущего практического использования в клинической лаборатории из-за их сложности и стоимости.
Недостаток предшествующего уровня техники заключается в отсутствии простых и эффективных способов биохимического определения антиоксидантной функции у человека. Настоящее изобретение осуществляет эту давнюю необходимость и потребность в данной области.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение обеспечивает клеточную культуральную среду, пригодную для биохимического определения антиоксидантной функции лимфоцитов человека, названная среда включает буферный бессывороточный раствор, содержащий следующие ингредиенты: карбогидрат, выбранный из группы, состоящей из глюкозы и соединения, биологически способного вырабатывать глюкозу в клетках; биологически пригодную форму пантотеновой кислоты, холин или биологически пригодную форму соединения, способного вырабатывать холин в клетках; неорганические ионы, состоящие из хлорида, фосфата, кальция, магния, калия, натрия и железа в биологически используемой форме, гидроксид кумола, деионизированную воду и митоген в количестве, эффективном для стимуляции исследуемых лимфоцитов; названный буферный бессывороточный раствор имеет рН, равную от приблизительно 6,8 до 7,6, заявляемая клеточная культуральная среда является эффективной для определения недостаточности, несоответствия и несбалансированности питания, а также для биохимического определения антиоксидантной функции лимфоцитов.
В другом аспекте настоящее изобретение обеспечивает способ биохимического определения антиоксидантной функции клеток человека, который включает следующие стадии: посев лимфоцитов конкретного индивидуума на клеточную культуральную среду настоящего изобретения, инкубацию лимфоцитов в клеточной культуральной среде и сравнение ответа лимфоцитов со средним ответом лимфоцитов в контрольной группе индивидуумов.
Еще в одном аспекте изобретение обеспечивает способ определения аномальных количественных потребностей в специфически требующихся питательных веществах у человека, который включает следующие стадии: посев лимфоцитов конкретного индивидуума на клеточную культуральную среду настоящего изобретения, названная культуральная среда содержит ограничивающие рост (рост лимфоцитов) концентрации определяемого питательного вещества, инкубацию лимфоцитов в клеточной культуральной среде и сравнение ответа лимфоцитов со средним ответом лимфоцитов контрольной группы индивидуумов.
В другом аспекте настоящее изобретение обеспечивает способ определения питательных факторов или биохимических посредников, которые нейтрализуют вредное действие питательных веществ, биохимических посредников или их продуктов, а также других компонентов крови, включая лекарства, у людей, чувствительных к таким вредным воздействиям, который включает следующие стадии: посев лимфоцитов на клеточную культуральную среду настоящего изобретения, содержащую по меньшей мере одно из питательных веществ, биохимических посредников или их продуктов, или других компонентов крови, включая лекарства, в концентрации, оказывающей отрицательное действие на ответ клеток; инкубацию лимфоцитов в клеточной культуральной среде и сравнение ответа с ответом в той же среде, дополненной источником тестируемого вещества, которое, как предполагается, нейтрализует отрицательное действие питательного вещества, биохимического посредника или его продуктов, или других компонентов крови, включая лекарства.
Другие дополнительные аспекты, особенности и преимущества настоящего изобретения станут понятными из следующего описания предпочтительных вариантов воплощения изобретения, приведенных с целью их раскрытия.
Для того, чтобы описание, в котором вышеизложенные особенности, преимущества и поставленные цели этого изобретения, а также те, которые будут изложены далее, стало понятным в деталях, более подробное описание изобретения, коротко сформулировано выше, может быть представлено в виде определенных вариантов его воплощения, которые иллюстрируются прилагаемым чертежом. Этот чертеж составляет часть подробного описания изобретения. Следует отметить, однако, что чертеж иллюстрирует предпочтительные варианты воплощения этого изобретения и поэтому не считается ограничивающими объем притязаний изобретения.
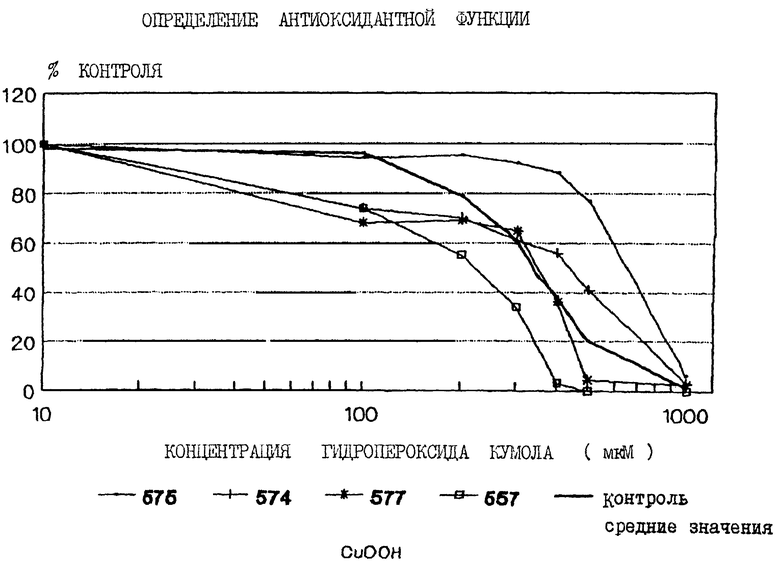
На чертеже показаны кривые ответа, зависимого от дозы гидропероксида кумола, полученные для ряда упомянутых исследуемых индивидуумов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к тестам крови, с помощью которых оценивают внутриклеточную недостаточность витаминов, а также общую антиоксидантную функцию, обеспечивающую новый биохимический анализ клеток человека. Такой анализ фактически отражает насколько хорошо питательные вещества и антиоксидантные системы функционируют в периферических лимфоцитах человека. Там, где определение содержания и сбалансированности витаминов (статуса) было ранее невозможно, способ настоящего изобретения позволяет определить их недостаточность прежде, чем это повлияет на возникновение клинических нарушений.
До разработки настоящего изобретения определение содержания витаминов было основано на клиническом наблюдении и измерении их статического уровня в сыворотке, моче или волосах вместе с некоторыми ферментами или белковыми маркерами. Такие тесты показывают кратковременные статические уровни и не оценивают многосложные метаболические пути, в которых эти соединения принимают участие в качестве ферментативных кофакторов. Поэтому другие способы в этой области дают результаты часто функционально неточные и поэтому клинически непригодные.
Вместо измерения статических уровней способ настоящего изобретения анализирует как на самом деле функционируют витамины, минералы, аминокислоты и антиоксидантные системы в лейкоцитах человека. В отличие от других подходов, даже претендующих на функциональность, в способе настоящего изобретения использовали метаболически активные периферические лимфоциты и измеряли синтез ДНК (рост клеток) для определения функциональной внутриклеточной недостаточности, при которой ограничен стимулированный митогеном ответ. Таким образом, способ настоящего изобретения обеспечивает результаты исследования, которые отражают общую метаболическую функцию вместо определения уровней в сыворотке или определения использования отдельных биохимических путей.
Лимфоциты обладают особыми преимуществами, так как они:
(1) являются ответственными за опосредованный клетками иммунитет и легко стимулируются к росту (митогенез);
(2) отражают средневременной долгосрочный статус питательных веществ (время жизни лимфоцита равно, приблизительно, шести месяцам);
(3) обладают метаболическими путями, общими с другими клетками, содержат ядра, в которых возможен быстрый синтез ДНК и рост клеток, и которые легко отбираются, путем стандартной венепункции.
Способ настоящего изобретения является только тестом крови, который определяет функциональные недостаточности внутриклеточно путем измерения синтеза ДНК (клеточного роста) лимфоцитов каждого больного с использованием химически определенной культуральной среды, не содержащей сыворотку или белок. Контрольная среда содержит минимальное количество каждого из важных питательных веществ, необходимых для поддержания оптимального роста лимфоцитов, или ответа, стимулированного митогеном. Функциональный статус 19 различных витаминов, минералов и аминокислот, вовлеченных в клеточный метаболизм, определяли непосредственно путем создания зависимости роста лимфоцитов от изменения содержания отдельных питательных веществ в среде и измерения, измененного в результате этого, синтеза ДНК.
Наиболее важно то, что способ настоящего изобретения обеспечивает определение общей антиоксидантной функции, с помощью которой оценивается общая способность клеток противостоять повреждению, вызываемому свободными радикалами и другим формам окислительного стресса. Из-за значительного числа клеточных антиоксидантов с широким спектром действия, избыточными количествами, восстанавливающими и перезаряжающими возможностями измерение суммарной функции является более точным и клинически эффективным путем для оценки общего антиоксидантного статуса. Способ настоящего изобретения обеспечивает более точный и клинически эффективный анализ содержания витаминов и минералов посредством использования живых, метаболически активных лимфоцитов каждого больного, по сравнению с любым из предшествующих лабораторных тестов в данной области.
При измерении роста лимфоцитов для оценки функциональной достаточности способ настоящего изобретения отражает очень широко индивидуальные потребности каждого больного. Поэтому наполнение может быть приспособлено к специфическим биохимическим потребностям каждого индивидуума, а не "среднего" больного, как определено так называемыми нормами.
По опубликованным данным, 70% американцев подвержены риску долгосрочной недостаточности витаминов и минералов. Эта недостаточность может неблагоприятно влиять на эффективное функционирование организма и его сопротивляемость заболеваниям. Научные данные показывают, что коррекция витаминной недостаточности повышает иммунокомпетентность и помогает в предупреждении или лечении хронических дегенеративных заболеваний. Исследования также показывают, что значительной внутриклеточной функциональной недостаточностью страдают около 40% больных, уже принимавших витамины. Более того, рекомендованные Нормы Питания (RDAs) не соответствует рекомендациям с учетом индивидуальных потребностей в витаминах и минералах.
Много людей может получить пользу от этого изобретения. Коррекция витаминной недостаточности необходима для здоровых людей с точки зрения сохранения здоровья. Определение исходного уровня у таких людей жизненно необходимо. Растущее количество медицинских исследований непрерывно отмечают большое количество заболеваний, связанных с недостаточностью витаминов.
Эти исследования показывают пользу оптимального содержания витаминов, минералов, аминокислот и антиоксидантов для предупреждения и лечения заболеваний - от предупреждения болезни сердца и различных форм рака, до стимулирования функций иммунной системы и замедления возрастных отклонений физиологических функций. Кроме того, на такие состояния, как алкоголизм, токсикомания, артриты, хроническая усталость, диабет, ВИЧ/СПИД и другие иммунные нарушения, дегенерация желтого пятна, недомогание и усталость, рассеянный склероз, дефекты нервной трубки, ожирение, остеопороз, осложнения при беременности может оказывать влияние, прямое или косвенное, недостаточность витаминов и минералов и их восполнение, как было показано, способствует приостановке или предупреждению этих хронических состояний.
Несмотря на то, что более предпочтительные варианты воплощения настоящего изобретения описаны подробно ниже, различные основные составляющие части исследования настоящего изобретения, а именно растворы, культуральная среда, соли и другие компоненты описаны в Патенте США №4499064.
Настоящее изобретение направлено на клеточную культуральную среду, пригодную для биохимического определения антиоксидантной функции лимфоцитов человека, причем названная среда включает буферный бессывороточный раствор, содержащий следующие ингредиенты: карбогидрат, выбранный из группы, состоящей из глюкозы и соединения, биологически способного вырабатывать глюкозу в клетках, биологически пригодную форму пантотеновой кислоты, холин или биологически пригодную форму соединения, способного вырабатывать холин в клетках, неорганические ионы, содержащие хлорид, фосфат, кальций, магний, калий, натрий и железо в биологически используемой форме, гидропероксид кумола, деионизированную воду и митоген в количестве, эффективном для стимуляции исследуемых лимфоцитов.
Названный буферный бессывороточный раствор имеет рН от приблизительно 6,8 до 7,6, названная клеточная культуральная среда является эффективной для определения недостаточности питательных веществ или их несоответствия и несбалансированности, а также для биохимического определения антиоксидантной функции лимфоцитов.
В одном варианте воплощения в клеточную культуральную среду добавляется питательная добавка, выбранная из группы, состоящей из биологически используемых форм аминокислот и витаминов, для определения недостаточности питательного вещества, его отсутствия в питательной добавке, или его наличия в ограничивающем или ингибирующем количестве. В этом случае витамины выбирали из группы, состоящей из биотина, фолиновой кислоты, или биологически пригодной формы фолиевой кислоты, никотинамида или никотиновой кислоты, рибофлавина, тиамина, витамина B6, витамина B12 или соединений, способных вырабатывать их в клетках, и где названные аминокислоты или соединения, способные вырабатывать аминокислоты, включают L-аргинин, L-цистеин, L-глутамин, глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-серин, L-треонин, L-триптофан, L-тирозин, L-валин, причем аминокислоты содержатся в группе, каждая в количестве, не превышающем ингибирующую концентрацию.
В большинстве случаев клеточная культуральная среда настоящего изобретения содержит концентрацию гидропероксида кумола, которая позволяет проведение точного биохимического определения антиоксидантной функции. Предпочтительно, чтобы концентрация гидропероксида кумола в клеточной культуральной среде составляла от приблизительно 50 мкМ до приблизительно 500 мкМ.
В другом варианте воплощения в клеточной культуральной среде настоящего изобретения добавляются одно или более стимулирующих питательных веществ, выбранных из группы, состоящей из пирувата, аденина и инозитола или соединений, способных вырабатывать их в клетках, в концентрациях, приближенно вызывающих максимальный ответ. Как правило, каждая аминокислота аминокислотной добавки присутствует приблизительно в минимальной концентрации, эффективной для вызова максимального ответа клеток, за исключением тестируемой аминокислоты. Кроме того, когда среда не содержит одну из аминокислот, серин или глицин или не содержит обе, в нее включают эффективную концентрацию для клеточного ответа витамина В6 или пригодной формы фолиевой кислоты, или их вместе. В другом варианте воплощения, когда среда не содержит одно из двух соединений, пантотеновую кислоту или холин, клеточная культура в названной среде эффективна для определения недостаточности питательных веществ и аномальных потребностей при добавлении или ограничивающих ответ клеток количеств пантотеновой кислоты или холина, не содержащихся в культуральной среде.
Настоящее изобретение также направлено на способ определения аномальных количественных потребностей в специфически требующихся питательных веществах у человека, который включает следующие стадии: посев лимфоцитов названного индивидуума на клеточную культуральную среду пункта 1. Названная культуральная среда содержит ограничивающие концентрации определяемого питательного вещества, инкубацию лимфоцитов в клеточной культуральной среде и сравнение ответа лимфоцитов со средним ответом лимфоцитов контрольной группы индивидуумов.
Настоящее изобретение также направлено на способ идентификации факторов питания или биохимических посредников, которые нейтрализуют вредное действие питательных веществ, биохимических посредников или их продуктов, а также других компонентов крови, включая лекарства, у людей, чувствительных к таким вредным воздействиям, который включает следующие стадии: посев лимфоцитов на клеточную культуральную среду пункта 1, содержащую по меньшей мере одно из питательных веществ, биохимических посредников или их продуктов, или других компонентов крови, включая лекарства, в концентрации, оказывающей отрицательное действие на ответ клеток; инкубацию лимфоцитов в клеточной среде; и сравнение ответа клеток с ответом в той же среде, дополненной источником тестируемого вещества, которое, как предполагается, нейтрализует отрицательное действие питательного вещества, биохимического посредника или другого компонента крови, включая лекарство.
Настоящее изобретение обеспечивает способ биохимического определения антиоксидантной функции клеток человека, который включает следующие стадии: посев лимфоцитов названного индивидуума на клеточную культуральную среду пункта 1, инкубацию лимфоцитов в клеточной культуральной среде, и сравнение ответа лимфоцитов со средним ответом лимфоцитов в контрольной группе индивидуумов.
Различные аспекты этих вариантов воплощения описаны подробно ниже.
Следующие примеры даны с целью иллюстрации различных вариантов воплощения этого изобретения и никоим образом не предназначены ограничивать данное изобретение.
ПРИМЕР 1
Взятие крови больного
Для способа настоящего изобретения необходимы два образца цельной крови, законсервированной смесью кислота-цитрат-декстроза, по 10 мл каждый. Не требуется спешки. Требуются только инструменты для забора крови. После этого можно приступать к проведению исследования настоящего изобретения, или кровь больного может быть переправлена в соответствующую лабораторию при комнатной температуре. Не требуется центрифугировать кровь. Исчерпывающие исследования обеспечивают глубокий научно-обоснованный анализ недостаточности у больных.
ПРИМЕР 2
Подготовка образца: выделение клеток
Все процедуры проводили с использованием стерильных способов в вытяжном шкафу под ламинарным потоком для обеспечения стерильности образца. Образцы крови каждого пациента обозначали номером по порядку, принятым в лаборатории способом. Этот порядковый номер использовали как номер образца в ходе всего процесса исследования, вместе с датой отбора крови и датой проведения определенной стадии анализа. Каждую опытную пробирку, центрифужную пробирку, планшет для микротитрования и распечатанные результаты исследования образца больного маркировали тем же номером (по порядку поступления) как исходный образец.
Образец, полученный от каждого пациента, состоял из двух пробирок типа вакутейнера, содержащих кислоту-цитрат-декстрозу (желтые крышки), которые содержали по 8 мл цельной крови каждая. После маркировки образца порядковым номером цельную кровь перемешивали переворачиванием 6 раз. Цельную кровь из двух пробирок объединяли в одноразовых центрифужных пробирках на 50 мл.
Аликвоту 500 мкл асептически отбирали из каждого образца и помещали в пробирки 12×17 мм. Эту аликвоту использовали для подсчета лейкоцитарной формулы цельной крови на Счетчике Клеток Coulter Cell Counter Модель Т450. Распечатанную в приборе лейкоцитарную формулу цельной крови маркировали номером исследуемого образца и прикрепляли к рабочему листу для данного больного.
Для каждого образца готовили две пробирки с градиентом Фикола путем добавления 5 мл Гистопак 1077 (Фикол/Диатризоат натрия, Sigma Chemicals, Сент Луис, Миссури) в 15 мл коническую центрифужную пробирку. Используя 10 мл пипетку и электрический пипетный дозатор, 8 мл цельной крови медленно наслаивали на слой градиента Фикола в каждой пробирке. Пробирки с градиентом Фикола закрывали крышками и центрифугировали при 2160 RPM в течение 20 минут.
После завершения центрифугирования пробирки с градиентом осторожно вынимали из центрифуги во избежание нарушения градиента. Пленку (слой, содержащий лимфоциты), образовавшуюся в середине слоя Фикола, переносили, используя 5 мл пипетку, в 15 мл одноразовую коническую центрифужную пробирку.
Слой, содержащий лимфициты, объединяли с раствором солевого фосфатного буфера, содержащего 0,72% глюкозы (ФБС-Г), и доводили до конечного объема 12 мл. Пробирку закрывали и переворачивали 6 раз для смешивания слоя, содержащего лимфоциты и ФБС-Г.
Пробирки, содержащие слой лимфоцитов и ФБС-Г, центрифугировали при 2160 RPM в течение 5 минут. После центрифугирования супернатант отбирали с осадка клеток и выбрасывали. Осадок клеток ресуспендировали в 12 мл ФБС-Г, переворачивали 6 раз для получения равномерного распределения клеточных элементов. Образец снова центрифугировали, как описано выше.
После второго центрифугирования супернатант отбирали и выбрасывали. Осадок ресуспендировали в 6,0 мл ФБС-Г. Клеточный осадок разрушали и перемешивали с ФБС-Г с помощью 5 мл пипетки и электрического пипетного дозатора. После получения гомогенной суспензии клеток аликвоту 200 мкл этой суспензии переносили в пробирку 12×75 мм. Эту аликвоту использовали для подсчета клеток в исходной клеточной суспензии (ИКС) с помощью Счетчика Клеток фирмы Coulter, модель Т540.
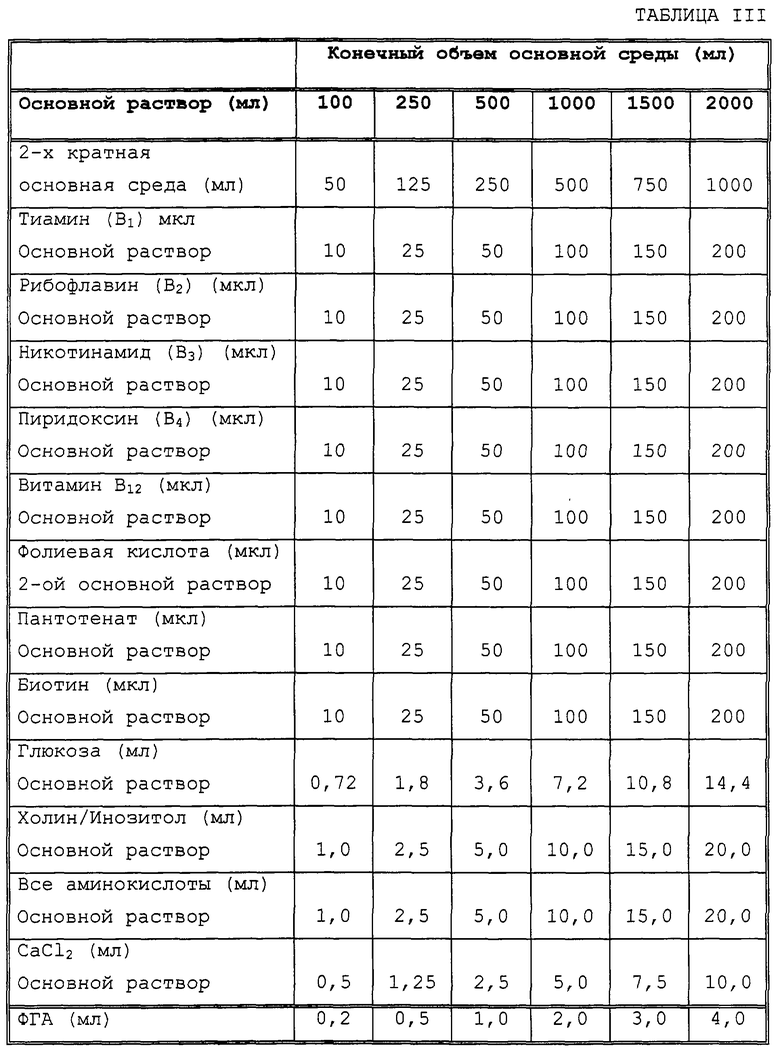
Распечатку результатов счета в этой аликвоте маркировали номером образца и присоединяли к рабочему листу. Если число лимфоцитов было между 3,9 и 1,2 тысяч клеток на кубический миллиметр (тыс./мм3), образец был готов для посева на планшет. Объем добавляемой клеточной суспензии указан в таблице III. Если число лимфоцитов было выше 3,9 тыс./мм3, то образец должен был быть разбавлен. Однако, если число лимфоцитов было ниже 1,2 тыс./мм3, то образец считался непригодным для исследования.
Дополнительное количество ФБС-Г, требующееся для правильного разведения образца, определяли, используя следующие расчеты:
C1V1=C2V2 С = концентрация лимфоцитов (тыс./мм3);
V = объем,
где С2=3,0 тыс./мм3, требуемая концентрация лимфоцитов конечной клеточной суспензии. Например, когда концентрация лимфоцитов в 6,0 мл исходной клеточной суспензии составляет 5,6 тыс./мм3 (Лц = 5,6 тыс./мм3)
C1V1=C2V2 (5,6) (6,0 мл)=(3,0) (X)
X=11,2 мл конечного объема
Соответствующий объем ФБС-Г добавляют к ресуспендированным клеткам до конечного объема 11,2 мл. В данном примере нужно добавить 5,2 мл к имеющимся 6,0 мл до конечного объема 11,2 мл. Требуемый объем ФБС-Г добавляли к (ИКС) для приготовления конечной клеточной суспензии (ККС). Концентрацию лимфоцитов (Лц) и объем ФБС-Г записывали в рабочую таблицу (Spectrox Test Worksheet).
После дополнительного разведения аликвоту 200 мкл разведенной клеточной суспензии переносили в новую пробирку 12×75 мм и проводили подсчет клеток, как описано выше. Распечатку результатов клеточного подсчета (Лц конечной клеточной суспензии) присоединяли к рабочему листу, а также записывали объем, используемый для посева.
ПРИМЕР 3
Посев на планшет
Конечную клеточную суспензию помещали в стерильный лоток. Планшет для микротитрования, содержащий среду, помещали в вытяжной шкаф с ламинарной циркуляцией. Используя 12-канальную автоматическую микропипетку, оснащенную стерильными 0-50 мкл защитными наконечниками, вносили определенное количество (в соответствии с таблицей I) конечной клеточной суспензии в каждую лунку ряда "Н" планшета.
Для посева на планшет использовали следующие объемы конечной клеточной суспензии, в зависимости от концентрации лимфоцитов (Лц тыс./мм3).

После добавления клеток к среде раствор гидропероксида кумола (CuOOH) добавляли к ряду "Н" следующим способом:
(1) В колонки 1, 2, 3 вносили 10 мкл 100 мкМ CuOOH;
(2) В колонки 4, 5, 6 вносили 10 мкл 200 мкМ CuOOH;
(3) В колонки 7, 8, 9 вносили 10 мкл 300 мкМ CuOOH;
(4) В колонки 10, 11, 12 вносили 10 мкл 400 мкМ CuOOH;
После добавления CuOOH в лунки микропланшета планшет закрывали крышкой, помещали в СО2 инкубатор и выдерживали при 37°С в течение 96 часов.
ПРИМЕР 4
Мечение
Все процедуры мечения проводили в радиоизотопной комнате. Рабочий раствор меченного тритием тимидина (H3-TdR) доставали из холодильника и согревали до 37°С в водяной бане. Через 96 часов планшеты для микротитрования доставали из СО2 инкубатора. Рабочий раствор H3-TdR помещали в стерильный лоток и с помощью 12-канальной автоматической микропипетки, оснащенной 0-50 мкл защитными наконечниками, вносили 10 мкл рабочего раствора H3-TdR в каждую лунку "Н" ряда микропланшета. Планшет вновь помещали в инкубатор при 37°С на 24 часа. Дату и инициалы лаборанта, проводившего мечение, заносили в рабочий журнал.
ПРИМЕР 5
Сбор клеток
Все процедуры сбора клеток проводили в Радиоизотопной Комнате. Один фильтр-подложку из стекловолокна (Packard Part №6005416) маркировали номером образца, используя карандаш №2. Включали вакуумный насос, и сушильный шкаф устанавливали на режим 100°С. Заполненную дистиллированной водой бутыль присоединяли к прибору для сбора клеток (Харвестеру). Планшеты для микротитрования вынимали из инкубатора через 24 часа после добавления Н3-TdR. Дату и инициалы лаборанта, проводившего сбор клеток, заносили в рабочий журнал.
Прибор для сбора клеток (фирмы Packarg Модель №С9619) находился в открытой позиции, О-Кольца выставлены, фильтр-подложку из стекловолокна помещали на поверхность сборника клеток, шероховатой стороной прикладывая к О-Кольцам. Прибор для сбора клеток закрывали и фильтр-подложку смачивали дистиллированной водой из промывной ванночки. Затем Прибор для сбора клеток переводили на вакуумный цикл (ВАК). С планшета для микротитрования удаляли крышку и помещали в Прибор для сбора клеток под наконечники зондов. Планшет медленно поднимали по направлению к зондам до тех пор, пока концы зондов не коснутся дна планшета. Одновременно с удалением среды дно лунок очищалось концами зондов в результате медленного кругового движения микропланшета. Очистку продолжали в течение 10 секунд. Одновременно с очисткой дна лунок планшета с помощью концов зонда включали режим промыва на 10 секунд. Жидкость удаляли из лунок и вышеописанные этапы повторяли. Планшет удаляли, ванночку для промыва заполняли метанолом, ванночку поднимали, метанол забирался и ванночку опускали.
Продолжали работать в режиме ВАК в течение 5 секунд, при этом Прибор для сбора клеток был открыт, фильтр-подложка плотно прилегала к верхней части. Через 5 секунд выключали ВАК и одновременно с этим удаляли фильтр-подложку с поверхности сборника клеток. Фильтр-подложку помещали шероховатой стороной вверх в сушильный шкаф на 10 минут. Фильтры-подложки вынимали из сушильного шкафа и охлаждали до комнатной температуры.
ПРИМЕР 6
Подсчет радиоактивности
Все процедуры подсчета радиоактивности проводили в Радиоизотопной комнате. Фильтр-подложку помещали в кассету для счета, шероховатой стороной вверх. Коллиматор (тонкая пластина из нержавеющей стали для фиксации фильтра-подложки) помещали сверху фильтра-подложки. Кассеты загружали в Счетчик радиоактивных бета-частиц, Packard Matrix 9600. Поток Q-газа (1,3% н-бутана в гелии) вводился в Матрикс 9600. Нажатием кнопки "СТАРТ" активизировали программу счета, в соответствии с которой производился подсчет общей радиоактивности в каждой лунке в течение 3 минут. Счет каждого образца сохраняли на жестком диске Matrix 9600. Кроме того, распечатывали печатные копии необработанных данных радиоактивного счета.
ПРИМЕР 7.
Преобразование данных
Данные с жесткого диска Матрикса 9600 переносили на 3,5 дискету. Необработанные данные преобразовывали в отчетную форму, используя программу Макро в Microsoft Exel. Эта программа Макро вычитает фон планшета из данных каждого измерения, выводит среднюю из трех параллельных значений и представляет эти данные, как процент от планшетного контроля, который приняли за 100%.
ПРИМЕР 8
Анализ данных (Нормализация)
Способ настоящего изобретения определяет общую антиоксидантную функцию. Используя лимфоциты, стимулированные к росту митогеном, антиоксидантную функцию выражали путем оценки ответа роста лимфоцитов в присутствии нескольких дозировок СuООН и без него. СuООН является фактором окислительного стресса, который использовали для определения антиоксидантной функции лимфоцитов каждого индивидуума. Первоначально рекомендованный диапазон был установлен. Однако, поскольку СuООН по своей природе является нестабильным соединением и имеет относительно короткий срок хранения, его активность со временем снижается. Поэтому периодически приходилось использовать соединение различной мощности, получаемой еще при его производстве. Каждая партия была приобретена в разное время относительно его срока хранения, и потребовалось в каждой партии ежедневно устанавливать соответствие со значениями первоначально рекомендованного диапазона. Использованные дозы СuООН (100 мкМ, 200 мкМ, 300 мкМ, 400 мкМ) были установлены первоначально с помощью большого числа СuООН в 1993/1994.
Такую нормализацию значений проводили ежедневно на каждой партии образцов. В каждом опыте проводили построение кривой дозозависимого ответа по четырем точкам, которые соответствовали четырем различным концентрациям СuООН, которые можно было выбирать из значений, ежедневно устанавливаемых для каждой партии и соответствующих первоначально рекомендованному диапазону, а также использовать новые значения для получения достоверных результатов. Нормализацию завершали путем нахождения среднего значения, медианы, диапазона и расхождения каждой дозы СuООН для каждого дня. Значение (значения), наиболее близкое к первоначально рекомендованному диапазону (которое дает 50% контроля роста), статистически сравнивали с помощью т-теста. Дозировка СuООН, наиболее близко соответствующая первоначально рекомендованному диапазону, была затем использована для вычисления результата теста. Также могут быть использованы промежуточные дозировки СuООН (такие как 200+300/2). Нормализация завершалась использованием расширенной программы Microsoft Exel.
ПРИМЕР 9
Обзор
Нормализацию проводили ежедневно для каждой партии из числа образцов, полученных от пациентов. Статистический анализ проводили для определения среднего значения, медианы, разброса и расхождения каждой СuООН дозировки с помощью описательно-статистической программы в Exel. Были выбраны значения дозировок, наиболее близкие к первоначально рекомендованному диапазону, и проведен т-тест с помощью Exel для того, чтобы определить отличалась или нет дозировка СuООН от первоначально рекомендованного диапазона. Дозировка, дающая дважды последовательно повторенные значения, наиболее близкая к 1,0 (и выше 0,5), была использована для подсчета конечных результатов. Результаты распечатывали и хранили в папке данных для данной партии.
ПРИМЕР 10
Оборудование, реактивы и растворы
Для проведения исследования настоящего изобретения было использовано следующее оборудование: вытяжной шкаф с ламинарной циркуляцией, центрифуга Beckman GS-6, счетчик клеток (Coulter, Модель Т540), 12-канальная автоматическая пипетка (5-500 мкл), электрический пипеточный дозатор (Drummond), стерильные пластиковые конические пробирки с крышками на 50 мл, полипропиленовые пробирки 12×75 мм, стерильные конические пластиковые центрифужные пробирки с крышками на 15 мл, автоматические пипетки (в диапазоне 0-20, 0-200, 0-100 мкл), стерильные стеклянные одноразовые пипетки на 5,0 мл, 10 мл, штативы для пробирок и антиаэрозольные наконечники для пипеток (0-50 мкл). В таблице 2 приведены различные соединения, используемые в способе настоящего изобретения, и их фирмы-поставщики.


ПРИМЕР 11
Растворы
Все растворы приготовлены с использованием деионизированной воды, которую обычно используют для тканевой культуры (ткд Н2O).
Для приготовления раствора фосфатного буфера солевого (ФБС), содержащего 0,72% глюкозы (ФБС-Г), ФБС готовили в соответствии с инструкциями, приложенными к упаковке, используя тдк Н2O. Добавляли необходимое количество 10% раствора глюкозы для получения конечной концентрации 0,72%. Раствор стерилизовали фильтрацией и хранили в холодильнике (при 2-8°С).
Приготовление концентрированной (2-кратной) основной среды: один (1) литр (2-кратной) основной среды содержит: (1) 23,80 г ГЭПЭС; (2) 14,02 г хлорида натрия; (3) 1,05 г фосфата калия двухосновного; (4) 0,241 г сульфата магния; (5) 1,0 мл (10 мкМ) аденина гидрохлорида; (6) 30,0 мл (100 мМ) пирувата натрия; (7) 0,5 мл 0,5% фенолового красного; (8) 5,0 мл смеси антибиотиков; (9) 8,0 мл 5N гидроксида натрия; (10) 20,0 мл Fe/ЭДТА (1,0 мМ FeSO4/0,4 мМ Na2ЭДTA). После того, как все ингредиенты были тщательно перемешаны, доводили рН до 7,6, используя 5N гидроксид натрия. Добавляли тдк H2O до конечного объема 1 литр. Раствор стерилизовали фильтрацией через фильтр с диаметром пор 0,2 мкМ и хранили в холодильнике при 4°С. При соблюдении этих условий стабильность сохранялась в течение 4 недель.
Основную среду, которую использовали для планшетного контроля, принятого за 100%, и нового способа настоящего изобретения готовили следующим образом.
Следует использовать стерильные приемы работы после фильтрации. Основную среду готовили в вытяжном шкафу с ламинарной циркуляцией. Все ингредиенты смешивали и доводили до конечного требуемого объема тдк Н2О. Раствор стерилизовали путем вакуумной фильтрации в стерильные бутылки. Добавляли требуемый объем основного раствора ФГА.
ПРИМЕР 12
Основной раствор гидропероксида кумола (СuООН)
Гидропероксид кумола (Sigma С 0524) имеет ограниченный срок хранения. Срок годности этого соединения равен трем месяцам от даты получения от фирмы Sigma. При отборе СuООН пипеткой из флакона необходимо учитывать повышенную вязкость СuООН. Надо быть уверенным в том, что забор жидкости в наконечник пипетки является полным. Это требует большего времени и внимания, чтобы быть уверенным в правильном наполнении наконечника пипетки. Также необходимо вытирать наконечник для удаления избытка СuООН с наружной стороны наконечника пипетки. Также необходимо равномерно размешать СuООН до полного растворения. После чего можно хранить раствор с требуемой стабильностью в холодильнике (при 2-8°С) в течение 3 месяцев.
Для приготовления первого основного раствора СuООН (1,0 М СuООН в ФБС-Г) 9,5 мкл гипероксида кумола (СuООН) смешивали с 990,5 мкл ФБС-Г.
Первый основной раствор СuООН можно хранить в холодильнике (при 2-8°С) с сохранением требуемой стабильности в течение 3 месяцев.
Второй основной раствор СuООН (100 мМ в ФБС-Г) необходимо готовить ежедневно перед началом выделения клеток. Он не может быть использован на следующий день. Для приготовления второго основного раствора СuООН, 200 мкл первого основного раствора СuООН смешивали с 1800 мкл ФБС-Г.
Четыре рабочих раствора гидропероксида кумола готовили ежедневно перед началом выделения клеток. Этот раствор добавляли в планшет для переноса (отдельный планшет) для отбора из него и добавления в опытные индивидуальные планшеты. Эти растворы нельзя использовать на следующий день. 4 рабочих раствора готовили следующим образом:
(1) 100 мкМ CuOOH: 110 мкл второго основного раствора СuООН смешивали с 4890 мкл ФБС-Г;
(2) 200 мкМ CuOOH: 220 мкл второго основного раствора CuOOH смешивали с 4780 мкл ФБС-Г;
(3) 300 мкМ CuOOH: 330 мкл второго основного раствора CuOOH смешивали с 4670 мкл ФБС-Г;
(4) 400 мкМ CuOOH: 440 мкл второго основного раствора CuOOH смешивали с 4560 мкл ФБС-Г.
ПРИМЕР 13
Основной раствор тимидина (ThY)
Основной раствор тимидина (ThY) (холодный): (1,33 мМ ThY, 0,322 г/л) готовили следующим образом: 0,161 г ThY (Sigma T9250) взвешивали и растворяли в ткд Н2О до конечного объема 500 мл. Этот раствор стерилизовали путем вакуумной фильтрации в стерильную бутылку с использованием асептических приемов работы. Этот раствор разливали на аликвоты в 50 мл центрифужные пробирки. В течение короткого времени раствор можно хранить в холодильнике (4°С) с сохранением стабильности в течение одного месяца. Для длительного хранения раствор можно замораживать (-70°), с сохранением стабильности в течение 6 месяцев. Рабочий раствор тимидина использовали для разведения радиоактивного тимидина (H3TdR), используемого для мечения клеток.
Для приготовления рабочего раствора тимидина (ThY+Н3-TdR) к 300 мл стерильной дегазированной тдк Н2O добавляли следующее: 1,15 мл 1,33 мМ раствора ThY (холодного), 1,7 мл H3-TdR (ICN Part №24066), со специфической активностью 300 мкКю/ммоль. Приготовленный раствор можно хранить в холодильнике (4°С) с сохранением требуемой стабильности в течение 1 недели.
Любые патенты или публикации, упомянутые в этом описании, свидетельствуют об уровне осведомленности тех специалистов в данной области, кому принадлежит это изобретение. Эти патенты и публикации упоминаются здесь в той же степени, как если бы каждая отдельная публикация, индивидуально указанная, была бы включена в виде ссылки.
Любой специалист в данной области легко оценит, что настоящее изобретение хорошо приспособлено для выполнения поставленных задач и получения результатов и упомянутых преимуществ, что также неотъемлемо. Имеющиеся примеры вместе со способами, методиками, обработками, молекулами и специфическими соединениями, описанными здесь, представляют собой предпочтительные варианты воплощения настоящего изобретения и являются иллюстрацией и не предназначены для ограничения объема притязаний изобретения. Изменения условий способа данного изобретения и другие применения, как это случается у специалиста, охватываются данным изобретением в объеме, определенном формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПРЕДЕЛЕНИЕ ВНУТРИКЛЕТОЧНЫХ КОНЦЕНТРАЦИЙ ЦИСТЕИНА И ГЛУТАТИОНА | 1997 |
|
RU2216020C2 |
| СПОСОБ СОЗДАНИЯ МОДЕЛИ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИМФОЦИТОВ | 2013 |
|
RU2541771C2 |
| СПОСОБ ДИАГНОСТИКИ АПОПТОЗА ЛИМФОЦИТОВ | 2013 |
|
RU2545900C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЗАЩИТЫ ЛИМФОЦИТОВ ОТ ПЕРЕОКИСЛЕНИЯ | 2013 |
|
RU2525183C1 |
| Бессывороточная питательная среда для культивирования клеток MDCK или Vero или вакцинных штаммов вирусов кори или гриппа | 2018 |
|
RU2703826C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОГО ПРЕПАРАТА НА ОСНОВЕ АКТИВИРОВАННЫХ ЛИМФОЦИТОВ ИЗ ЛЕЙКОЦИТАРНЫХ ФИЛЬТРОВ | 2024 |
|
RU2835686C2 |
| Штамм гибридных культивируемых клеток Homo sapiens/Mus musculus 1B9C7 - продуцент человеческих моноклональных антител, специфичных к протеолитическому домену ботулинического токсина типа A | 2021 |
|
RU2783897C1 |
| Штамм гибридных культивируемых клеток Homo sapiens/Mus musculus Hu-C6D7-RBD - продуцент человеческих моноклональных антител, специфичных к RBD домену S белка вируса SARS-CoV-2 | 2022 |
|
RU2788359C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ЗАЩИТЫ ЛИМФОЦИТОВ ОТ АПОПТОЗА | 2014 |
|
RU2568886C1 |
| Штамм гибридных культивируемых клеток H.sapiens/Mus musculus 8D4E9-Ba-LF-продуцент человеческих моноклональных антител против летального фактора возбудителя сибирской язвы | 2018 |
|
RU2699193C1 |
Изобретение относится к области биотехнологии и может быть использовано для биохимического определения антиоксидантной функции лимфоцитов. Бессывороточная среда для культивирования лимфоцитов в первом варианте включает глюкозу, пантотеновую кислоту, холин, неорганические ионы, гидропероксид кумола, митоген, буфер и деионизированную воду. Во второй вариант бессывороточной среды не включают пантотеновую кислоту и холин. Среды используют в способе определения аномальных количественных потребностей в питательных веществах, для идентификации питательных факторов или биохимических посредников, а также для биохимического определения антиоксидантной функции лимфоцитов. Изобретение позволяет повысить точность и клиническую эффективность оценки общего антиоксидантного статуса. 5 н. и 7 з.п. ф-лы, 1 ил., 3 табл.
| NORDBLOM et al | |||
| Двигатель внутреннего горения | 1921 |
|
SU450A1 |
| Arch | |||
| Biochem | |||
| Biophys | |||
| Планшайба для точной расточки лекал и выработок | 1922 |
|
SU1976A1 |
| JIANG et al | |||
| Ferrous ion Oxidation in the Presence of Xylenol Orange for Defection of Lipid Hydroperoxide in Low Density Lipoprotein | |||
| Analytical Biochemistry | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| US 4499064, 12.02.1985 | |||
| новые методы культуры животных тканей | |||
| М.: изд.МИГ, 1976, 255. | |||
Авторы
Даты
2004-07-27—Публикация
1997-06-18—Подача