акцией замещенной тиомочевины ф-лы HjN-C(S)-NR5R4l где Rj указано выше; R Р условии, что когда . имеет свободную перв, или втор, аминогруппу, то она защищена карбонилсо- держащей группой с соединением ф-лы R,-CHBr-C(0)-R2,, где R, и R указаны выше, или соответствующим ему соединением, где карбонил защищен в фор- не ацеталя при нагревании и рН 1-6 с последующим при необходимости удалением карбонилсодержащей группы и выделением целевого продукта в виде основания или аддитивной соли с кислотой. -Новые соединения при токсичности ЛД5о 60-450 мг/кг являются антагонистами холинэргических муска- риновых рецепторов типа М/ и некоторые из них имеют антагонистическую активность к действию возбудителей аминокислот в головном мозгу. 8табл,




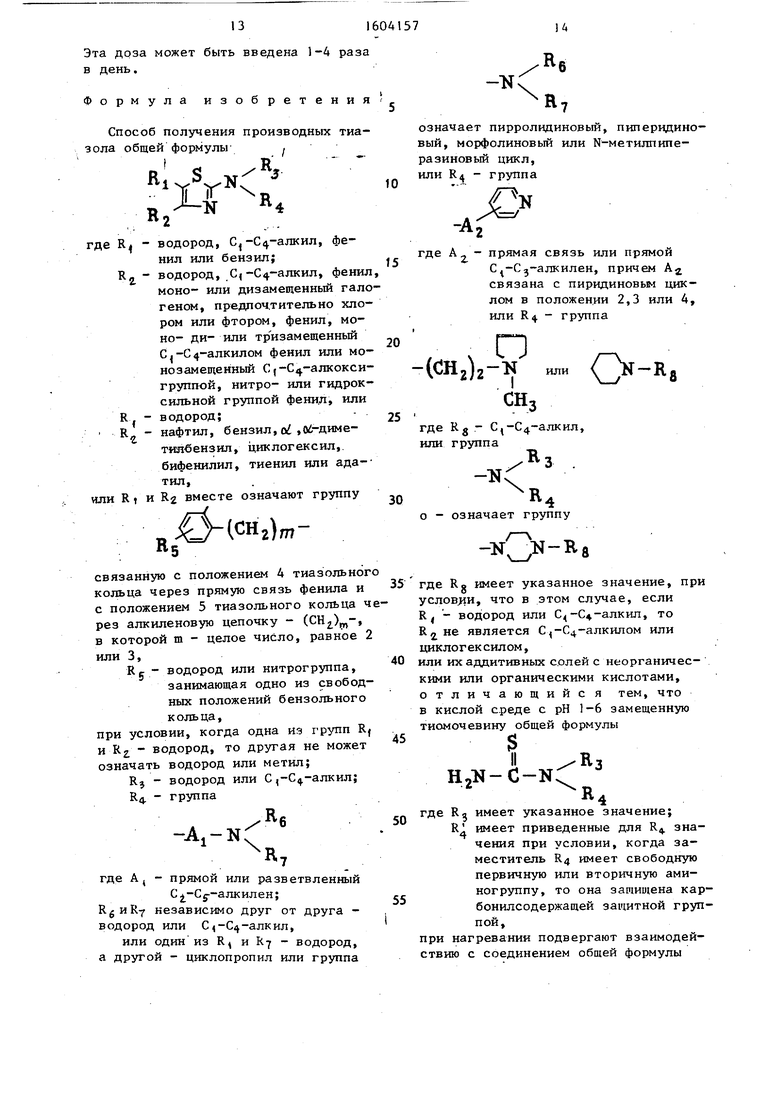





Изобретение касается гетероциклических соединений, в частности способа получения производных тиазола общей ф-лы S-CR1=CR2-N=C-NR3R4, где R1=H
C1-C4-алкил, фенил или бензил
R2-Н, С1-С4-алкил, фенил (он может быть моно- или дизамещен галогеном, лучше CL или F, моно-, или ди- или тризамещен C1-C4-алкилом, монозамещен C1-C4-алкокси, NO2 или OH), или R1-H и R2-нафтил, бензил, α, α-диметилбензил, циклогексил, бифенилил, тиенил или адамантил, или R1 и R2 вместе обозначают группу R5 @ -(CH2)M-, связанную с положением 4 тиазольного кольца через прямую связь фенила и с положением 5 тиазольного кольца через алкилен -(CH2)M-, где M=2 или 3 и R5-H или NO2 при условии, что, когда одна из R1 и R2-H, то другая ≠H или CH3
R3-H или C1-C4-алкил
R4=-A1-NR6R7, где A1=H- или изо-C2-C5-алкилен
R6 и R7 (независимо)-H или C1-C4-алкил, или один из R6 и R7=H, а другой - циклопропил, или NR6R7 означает пирролидиновый, пиперидиновый, морфолиновый или N-метилпиперазиновый цикл, или R4=-A2 @ N при A2-прямая связь или н-C1-C3-алкилен, причем A2 связана с пиридиновым циклом в положении 2, 3, или 4, или R4=-(CH2)2-CH-(CH2)3-N или @ N-R8 при R8-C1-C4-алкил
или NR3R4-N @ N-R8 при условии, что в этом случае, если R1-H или C1-C4-алкил, то R2≠C1-C4-алкилу или циклогексилу, R8 - указано выше, или их аддитивных солей с неорганическими или органическими кислотами, обладающих активностью в отношении холинэргической системы, что может быть использовано в медицине для лечения дегенеративных синдромов, связанных со старением. Цель - создание веществ с активностью, не характерной для данного класса. Синтез ведут реакцией замещенной тиомочевины ф-лы H2N-C(S)-NR3R4, где R3-указано выше
R4=R4 при условии, что когда R4 имеет свободную перв. или втор.аминогруппу, то она защищена карбонилсадержащей группой, с соединением ф-лы R1-CHBR-C(O)-R2, где R1 и R2 указаны выше, или с соответствующим ему соединением, где карбонил защищен в форме ацеталя при нагревании и рН=1-6 с последующим, при необходимости, удалением карбонилсодержащей группы и выделением целевого продукта в виде основания или аддитивной соли с кислотой. Новые соединения при токсичности ЛД50=60-450 мг/кг являются антагонистами холинэргических мускариновых рецепторов типа М1 и некоторые из них имеют антигонистическую активность к действию возбудителей аминокислот в головном мозгу. 8 табл.

Изобретение относится к способу получения новых химических соединений, а именно производных тиазола или их аддитивных солей с неорганиескими или органическими кислотами, оторые обладают активностью в отношении холинэргическ.ой системы и могут найти применение в медицине для лечения дегенеративных синдромов, связанных со старением.
Целью изобретения является полуение новых соединений ряда тиазола, обладающих новым видом биологического, действия для этого класса соединений.
Пример 1 . Получение 2-(2- -диэтиламиноэтил)амино -5-фенш1тиа- зола дигидрохлорида (соединение SR 44318А).
А) Получение К-бензоил- -(диэтил- аминоэтил)-тиомочевины.
К суспензии 51 г тиоцианата калия в 300 мл безводного ацетона при комнатной .температуре прикапывают раст- вор 70мл бензоилхлорида в 100мл безводного ацетона. По окончании добавления реакционную смесь кипятят с обратным холодильником в течение 5 мин. К полученному горячему раствору медленно добавляют при интенсивном перемешивании раствор 85 мл 2-ди- этиламиноэтиламина в 100 мл метилен- хлорида так, чтобы смесь поддерживать при кипении с обратным холодильником.. По окончании добавления в течение 1 ч при комнатной температуре перемешивают, затем растворители выпаривают и остаток обрабатьшают ледяной водой. Экстрагируют 2 раза 200 мл метиленхлорида и раствор су- щат над сульфатом магния. Растворитель выпаривают досуха и полученный
маслянистый продукт очищают путем хроматографии на колонке с диоксидом кремния, Элюируя смесью метиленхлорида с этилацетатом 80:20 (по объе- му) удаляют малополярные принеси.
Затем Элюируя смесью метиленхлорида с метанолом 95:5 (по объему), получают продукт. Вес 78 г; Т. пл. 54 - 56°С..
Б) Получение соединения SR 44 318 А.
В атмосфере азота в течение
30 мин кипятят с обратным холодильником 3,5 г полученного в А) соёдине7 ния в 18 мл 2,5 н раствора гидрок- сида натрия. После охлаждения добавляют концентрированную соляную кислоту вплоть до рН примерно 6 Добавляют раствор 2,48 г о -бромфенилаце- тальдегида в 25 мл 95 -ного этанола и кипятят с обратным холодильником
в течение 1 ч в атмосфере азота.
Вьшаривают под вакуумом и добавляют воднь1й 10%-ный раствор карбоната натрия. Экстрагируют 2 раза 4eти- ленхлоридом и раствор сушат над сульфатом магния. Растворитель выпаривают и остаток хроматографируют на колонке с диоксидом кремния, элюируя смесью метиленхпорида с метанолом 95:5 (по объему). Получают масло (1,46 г).
Это масло растворяют в безводном эфире и добавляют раствор газооб заз- ного. хлорводорода в безводном эфире и оставляют кристаллизоваться,Крис- таллы отсасывают,, промьшают безводным эфиром и высушивают под вакуумом. Т. пл, ,
П р им ер ы 2-108, А) Работая как в примере 1-А, но меняя используемые аминосоединения,
15
20
25
30
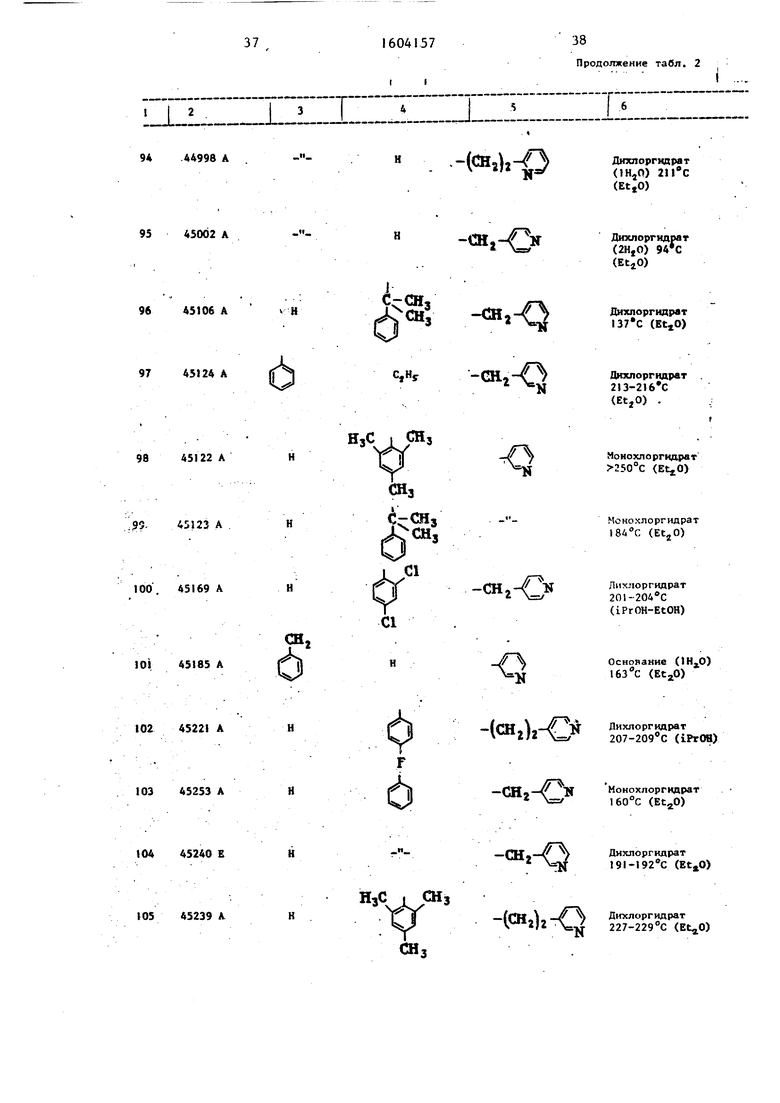
получают соответствующие замещенные тиомочевины, представленные в табл. 1 . Б) Работая как в примере , ис- пользуя тиомочевины из табл. 1 и ме- няя оксогалогенированное производ- ное, получают тиазолы, представленные в табл. 2, ..
Пример 109. Получение -аминопропил)-амино -5-метил-4-фенил тиазолдигидрохлорида (соединение
SR 44 514 А).
А) Получение N-Boc-3-аминопропи- онитрила (Вое - бензилоксикарбонил).
К раствору 25 г 3-аминопропионит- рил фумарата в 100 мл воды добавляют 56 мл триэтиламина, затем нагревают до 50°С. После этого добавляют при интенсивном перемешивании 46 г бис- -трет.-бутилового эфира () ди- карбоновой кислоты в виде раствора в 100 мл диоксана.
После вьтаривания растворителя обрабатывают дихлорметаном. Органический раствор промьшают водным 5%-ным
.раствором карбоната натрия, затем
сульфатным буфером с рН 2. Раствор сушат над сульфатом магния и раство- ритель выпаривают. Остаток (38,8 г) кристаллизуют.
Б) Получение К-Вос-З-аминопропиламина.
20 г вьшеполученного продукта растворяют в смеси 400 мл воды, 40 мл аммиака и 50 мл этанола. Добавляют35
никель Ренея и водород при обьгчных температуре и давлении.
После отфильтровьшания катализатора растворители выпаривают под вакуумом. Остаток обрабатьтают соленой40 водой и экстрагируют этилацетатом. Раствор сушат над сульфатом магния и растворитель выпаривают. Получают 12,6 г продукта.
В) Получение К-бензоил-К - (N-Boc- 45 -3-аминопропил)-тиомочевины.
К суспензии 70,6 г тиоцианата калия и 50 мл безводного ацетона при- капьшают раствор 6,38 мл бензоилхло- рида в 20 мл безводного ацетона, за- 50 тем в течение 5 мин кипятят с обратным холодильником.
К горячему раствору медленно при интенсивном перемешивании добавляют раствор 12,6 г N-Boc-3-аминопропил- 55 амина в 20 мл метиленхлорида.
По окончании добавления оставляют на 1 ч при перемешивании, затем растворители выпаривают и остаток обра.
15
20
25
30
35
40
батьшают 100 мл холодного безводного
эфира.
Выделяются кристаллы, которые от- сасьшают и промьшают холодным эфиром и высушивают с сушильном шкафу при 70°С. Вес 8,3 г; Т. пл. 104-105 С. Г) Получение соединения SR 44 514 А. В течение 15 мин кипятят с обратным холодильником 3,37 г вышеполученного продукта в 14 мл 2,5 н. раствора гидроксида натрия. После охлаждения добавляют концентрированную соляную кислоту д6 рН1. Добавляют 2,13 г 2-бромпропиофенона, растворенного в 20 мл этанола, кипятят с обратным холодильником в течение 1 ч в атмосфере азота. Смесь обрабатывают как указано в примере I-Б и получают масло. Путем добавления солянокислого эфира получают дихлоргидрат в виде раствора в метаноле. Т. пл. ЮО-ПО С.
Примеры 110и111.Из за- . меп1енной тиомочевины, полученной в примере 109, и работая как в примере 109-Г, но изменяя используе-мое бромпроизводное, получают 2-рЗ-ами- нопропил)аминоЗ-4-(4-фторфенил)-тиа- зол (SR 44886 А), вьщеленный в виде фумарата (0,5 ), Т. пл. 162- (пример ПО), и 2-(3-аминопропил) -аминоЗ-4-(2,4,6-триметилфенил)- тиазол (соединение SR 44949), выделенный в виде фумарата, Т. пл. 163- (пример 11).
Пример 112. Получение -метил-К-(3-пиридилметил)-амино -4(2, 4,6-триметилфенил -тиазол оксалат (соединение SR 45206 А).
Н;
СНз
/
снсн
R
R
А) Получение К-метил-К(3-пиридил- метил)-тиомочевины.
К суспензии 16,2 г тиоцианата натрия в 90 мл безводного ацетона, охлажденной до , при хорошем перемешивании прикапывают 24,6 мл пивалоилхлорида. Оставляют перемешиваться в течение 3 ч при , затем прика- пьшают 25 г 3-метиламинометилпириди- на так, чтобы температура поддерживалась 0-4 С. Оставляют температуру повьшаться до и перемешивают в течение 15 ч при этой температуре. Смесь выпаривают под вакуумом и остаток обрабатывают до 100 мл концентрированной соляной кислоты. Нагревают 1 ч при 95°С. После охлаждени экстрагируют 2 раза метиленхлоридом, затем водную фазу подщелачивают концентрированным раствором гидроксида натрия. Органические экстракты объединяют и сушат над сульфатом магния. Растворитель выпаривают и остаток кристаллизуют. Растирают кристаллы со 100 мл эфира и отсасьшают. После высушивания получают 26,7 г продукта;
Т. пл. 119-120 С.
Б) Получение соединения SR 45206 А
В течение 4 ч кипятят с обратным холодильником смесь 3,6 г вышеполученной тиомочевины, 6 г фенацил-2,4, 6-триметилбромида, 20 мл воды, 50 мл этанола и 2 мл концентрированной соляной кислоты.
После выпаривания под вакуумом остаток обрабатьюают 150 мл метилен- хлорида и экстрагируют 150 мл водного 1н. раствора соляной кислоты. Органическую фазу снова экстрагируют 3 раза с помощью 100 мл 1н. соляной кислоты и кислые экстракты объединяют. Подщелачивают раствором гид- рокеида натрия и экстрагируют 4 раза с помогщью 150 мл метиленхлорида. Органические экстракты объединяют, сушат над сульфатом магния и растворитель выпаривают. Маслянистый остаток хроматографируют на колонке с диоксидом кремния (100 г). Элюируя смесью метиленхлорида/с метанолом 97:3 по объему, получают 4,5 г маслянистого продукта.
Оксалат.
4,5 г вьшеполученного продукта растворяют в 30 мл ацетона и добавляют раствор 1,4 г щавелевой кислоты в 40 мл ацетона. Образуются кристаллы светло-желтого цвета, которые от- сасьшают, промьшают небольшим количеством ацетона и высушивают. Получают 4,3 г продукта. Т. пл. 160-161°С.
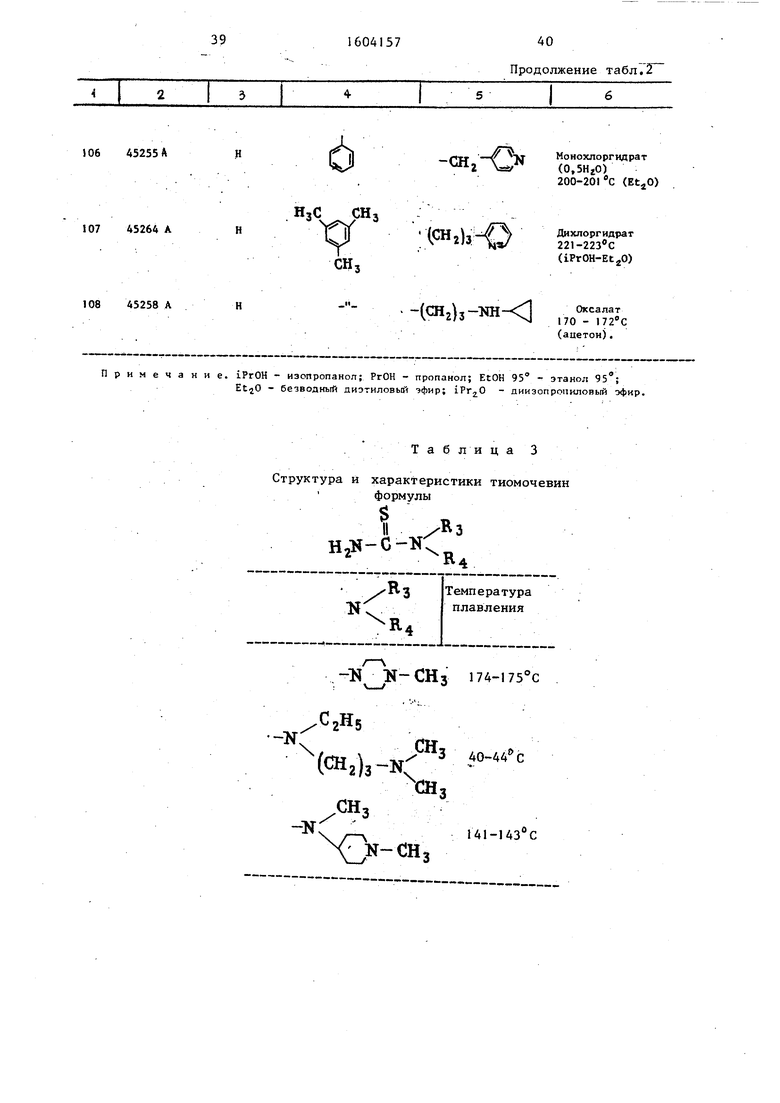
Примеры 113-117. Работая Как в примере 112-А), получают таким
0
5
0
5
0
5
40
45
50
5
же образом замещенные тиомочевины, объединенные Et табл. 3.
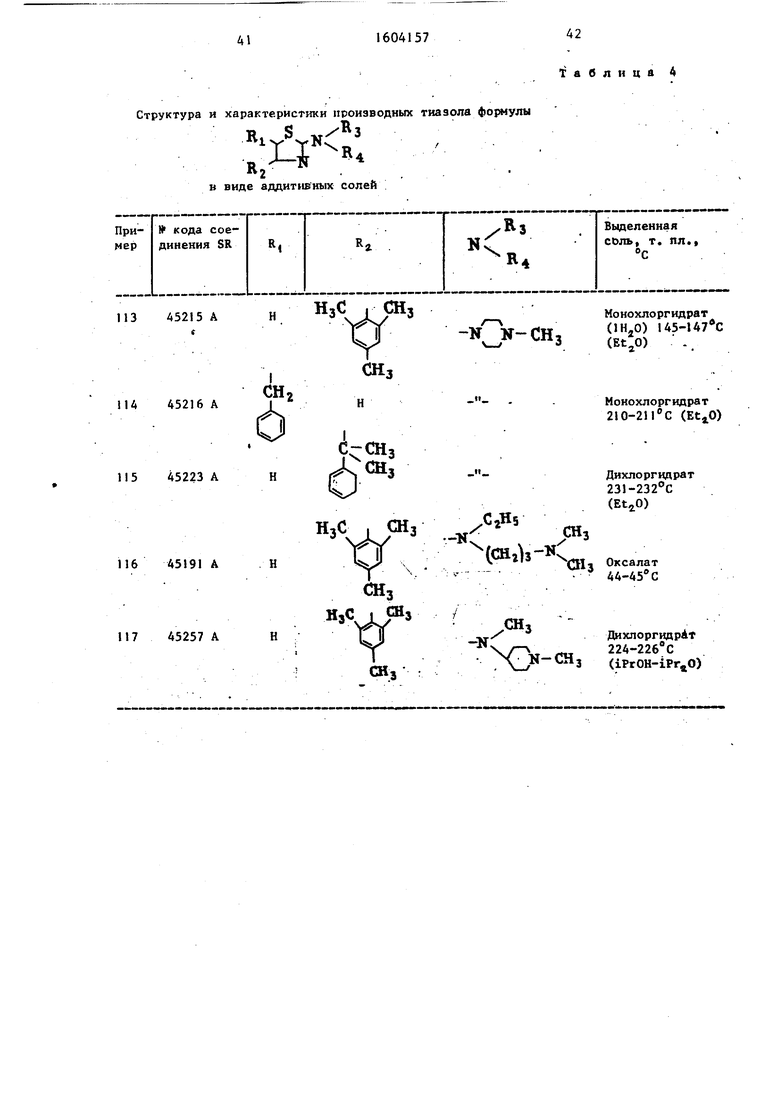
Б) Из этих различных тиомочевин, работая, как в примере 1 1 2-Б) , получают тиазолы, представленные в табл. 4.
Пример 118. Получение 2- -(2-морфолиноэтиламино)-4,5-дигид- ронафто(1,2-d)тиaзoлa дихлоргидрата (соединение SR 44 273 А).
В течение 15 мин в атмосфере азота кипятят с обратным холодильником 3,66 г М-бензоил-К -(морфолиноэтил)- тиомочевины в 17,5 мл 2,5 и раствора гидроксида натрия. После охлаждения добавляют концентрированную соляную кислоту до рН 7. Добавляют раствор 3 г 2-бром-1,2,3,4-тeтpaгид- poнaфтaлин-l-oнa в 20 Mji этанола ив течение 1 ч кипятят с обратньм холодильником. После выпаривания растворителя нейтрализуют добавлением бикарбоната натрия и экстрагируют 2 раза дихлорметаном. Органическую фазу сушат над сульфатом магния и хроматографируют на колонке с диоксидом кремния. Элюируют смесью ди- хлорметана с метанолом (95:5 по объему).После выпаривания растворителей маслянистый остаток обрабатьюают эфиром и хлоргидрат осаждают эфиром. 0т- сас.шают и перекристаллизуют из смеси изопропанола с этанолом 95. Т. пл. 255-257°С.
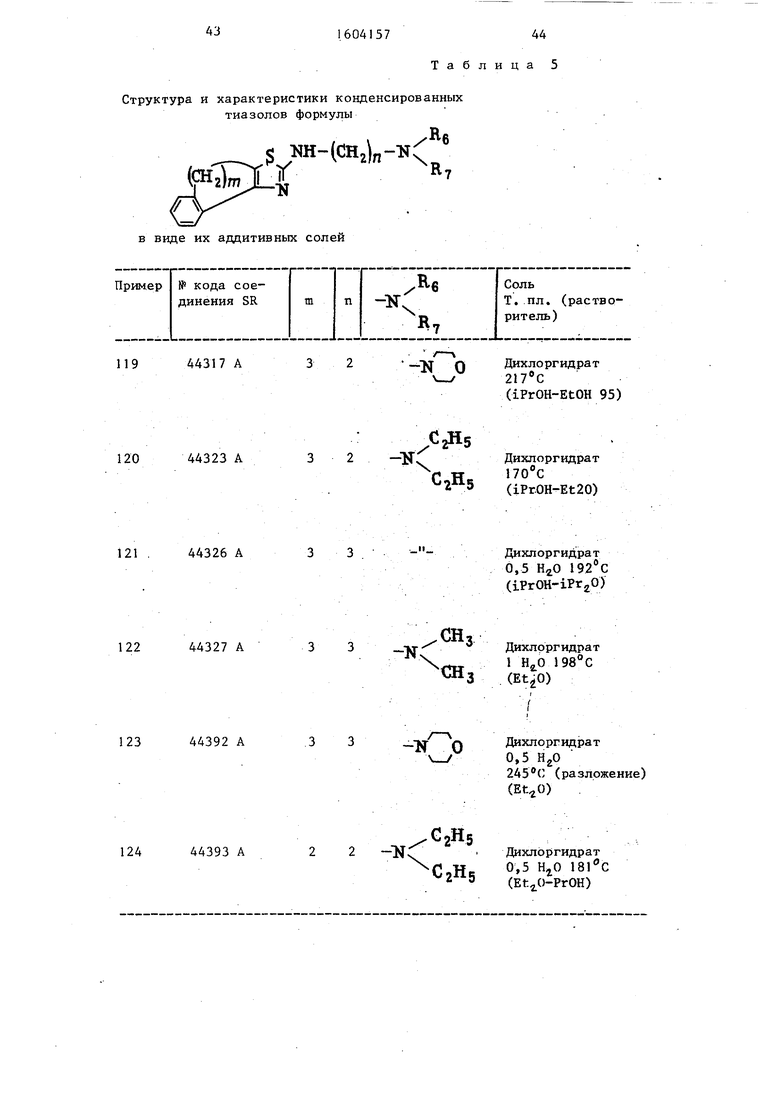
Примеры 119-124. Работая как в примере 118, но изменяя бром- производные и/или бензоилтиойочеви- ны, получают тиазолы, приведенные в . табл. 5.
Пример 125v Получение 2(2-диэтиламиноэтил.)-амино1-9-нитро- -5,6-дигидро-4Н-бенз:о (6,7)-циклогеп- та (1 ,2-d)тиaзoлa дихлоргидрата (соединение SR 44 411 А).
Работая как в примере 118, исходя из К-бензоилтК -(3-диэтиламинопро- пид)-тиомочевины, с одной стороны, и 2-бром-8-нитробензоциклогептан-1 -она, с другой стороны, получают ожидаемьй продукт в форме дихлоргидрата. Т. пл. 192-195 С (изопропанол - этанол 95).
Для продуктов, получаемых согласно предлагаемому способу, изучали их фармакологические свойства, в частности их сродство к холинэргичес- ким мускариновым рецепторам.
Изучение осуществляли биохимическими тестами ин витро, а также фармакологическими тестами, реализуемыми на животных.
Биохимическое изучение ин витро. У млекопитающих существуют два класса холинэргических мускариновых рецепторов: рецепторы H и Mj.
Рецепторы типа М сконцентрированы в некоторых зонах головного мозга, таких как гиппокамп, кора головного мозга, полосатое тело, так же как в симпатических ганглиях. Эти места связьгоания могут быть селективно маркированы содержащим тритий пирен- зепином (Hl-PZ) . Р ецепторы типа М2. преобладают.в сердце и в подвздошной кишке и могут быть маркированы содер- жащим тритий N-метилскополамином ( H-NMS). Для того, чтобы определить селективность продуктов по пред- лагаемому способу по отношению к местам М и М, исследовали их взаимодействие ин витро с фиксациями высо- кого сродства H-PZ к мембранам гиппокампа крысы и гладкой мьшщы подвздошной кишки морской свинки соответственно о Метрология.
А) Исследование сродства для холинэргического мускаринового рецептора типа М,.
Взаимодействие молекул с мускари- новыми рецепторами типа Mj изучали путем измере ния ин витро на гомоге- нате гиппокампа крысы сдвига, содержащего тритий пирензепина, с его специфических фиксированных положений. Аликвоты (10 мкл) 5%-ного гомогената гипокампа крысы (вес/объем) в буфере Ка,НР04 (50тМ, рН 7,40) инкубировали 2 ч при 4°С в присутствии H-PZ (76 Ci) ммоль; конечный 1 нМ) и при возрастающих концентрациях изучаемого продукта. Конечный объем 2 мл. Реакцию прекращали путем центрифугирования в течение 10 мин при 50 000 xg. После декантации и промьш- ки осадков фиксированную радиоактивность рассчйтьшали путем сцинТилл я- ции жидкости. Неспецифическую фиксацию определяли в присутствии 10(UM сульфата атропина. Ингибирующую концентрацию 50 (CIj(j) определяли графически.
Б) Исследование сродства для холинэргического мускаринового рецептора типа MI.
0
5
0
5
0
5
0
5
Взаимодействие,с мускариновыми рецепторами типа N2 изучали путем измерения ин витро на гомогенате гладкой мьш1цы подвздошной кишки морской свинки сдвига, содержащего тритий N-метилскополамина, его специфических фиксированных положений. Аликвоты (50 мкл) гомогената гладкой мьшщы подвздошной кишки морской свинки в концентрации 0,625% (вес/объем) в 20 мМ буфера HEPES: 2-(2-окси-4- -этил-1-пиперазинил)-этансуяьфокис- лоты, содержащей NaCl (100 тМ) и MgCl (10 шМ) (рН конечное 7,5), ишсубировали в течение 20 мин при 30°С в присутствии H-NMS (85 Ci) ммоль; 0,3 НМ конечный) и при возрастающих концентрациях исследуемого продукта. Конечный объем составляет 1 мл. Реакцию прекращали путем центрифугирования в течение 5 мин при 15 000 xg. Неспецифическую фиксацию определяли в присутствии 1 О тпМ сульфата атропина. Результаты:
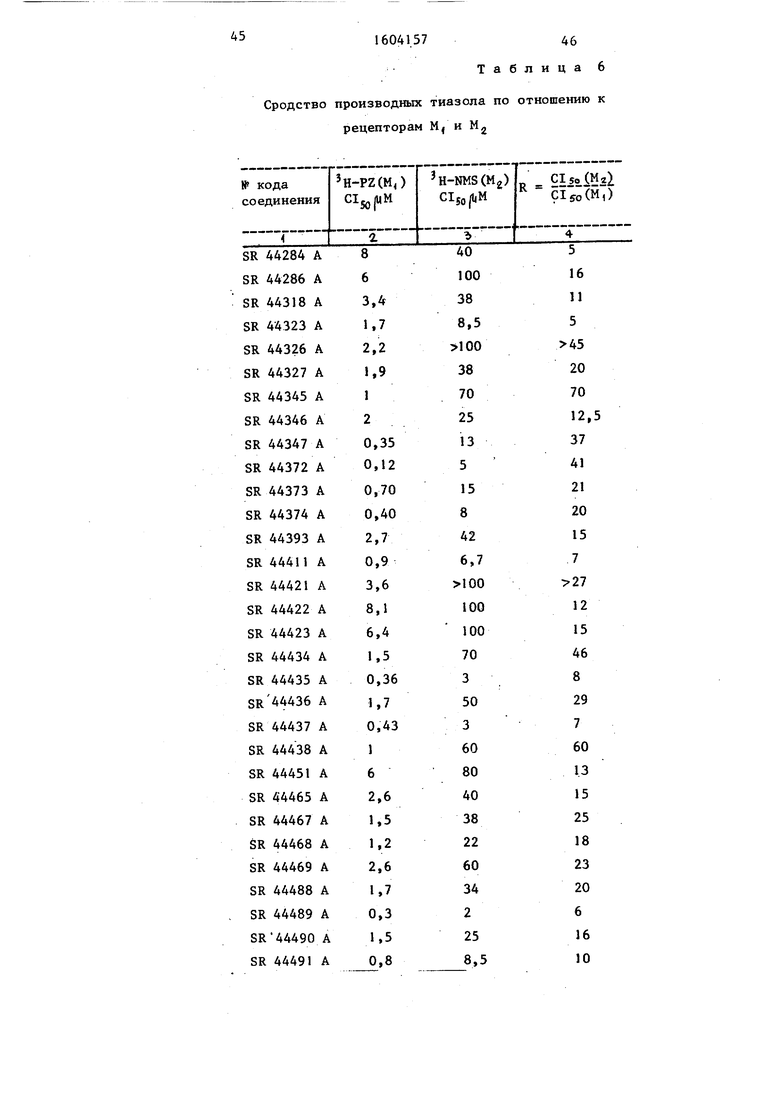
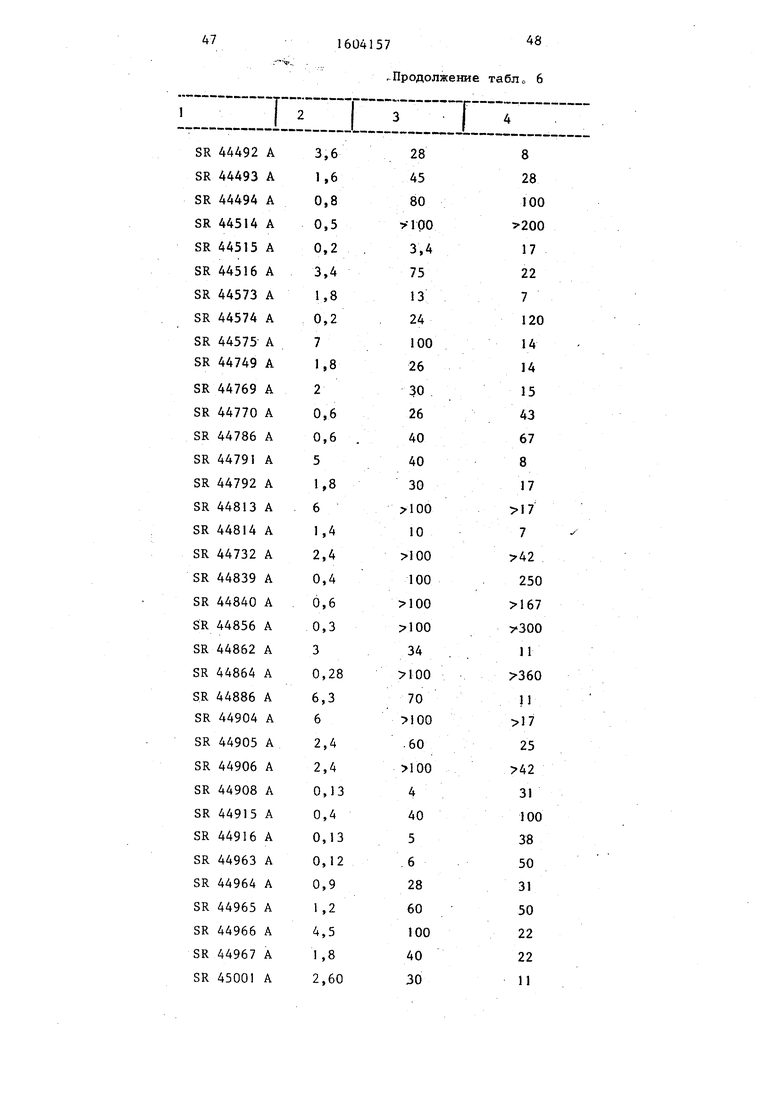
Табл. 6 показьшает сродство про- дуктов, полученных по предлагаемому способу, для рецепторов -М и М. Результаты выражены в ингибирующих концентрациях 50 (С1, либо в концентрации (мМ), которая приводит к сдвигу на 50% содержащего тритий лиганда, фиксированного на мембранных рецепторах. сдвига H-PZ представляет собой сродство для рецептора Mj ; Clgo сдвига H-NMS - сродство для рецептора М.
Кроме того, в следующей колонке табл. 6 указано соотношение R между Cljo ДЛЯ рецепторов М и М, которое выражает селективность продуктов по отношению к одному из типов рецепторов .
В качестве сравнения в табл. 6 указаны результаты, полученные с тремя стандартными продуктами.
Результаты показьшают, что соединения, полученные согласно предлагаемому способу, обладают сильным сродством для холинэргических мускариновых рецепторов с маркированной специфичностью для центральных рецепторов типа MI..
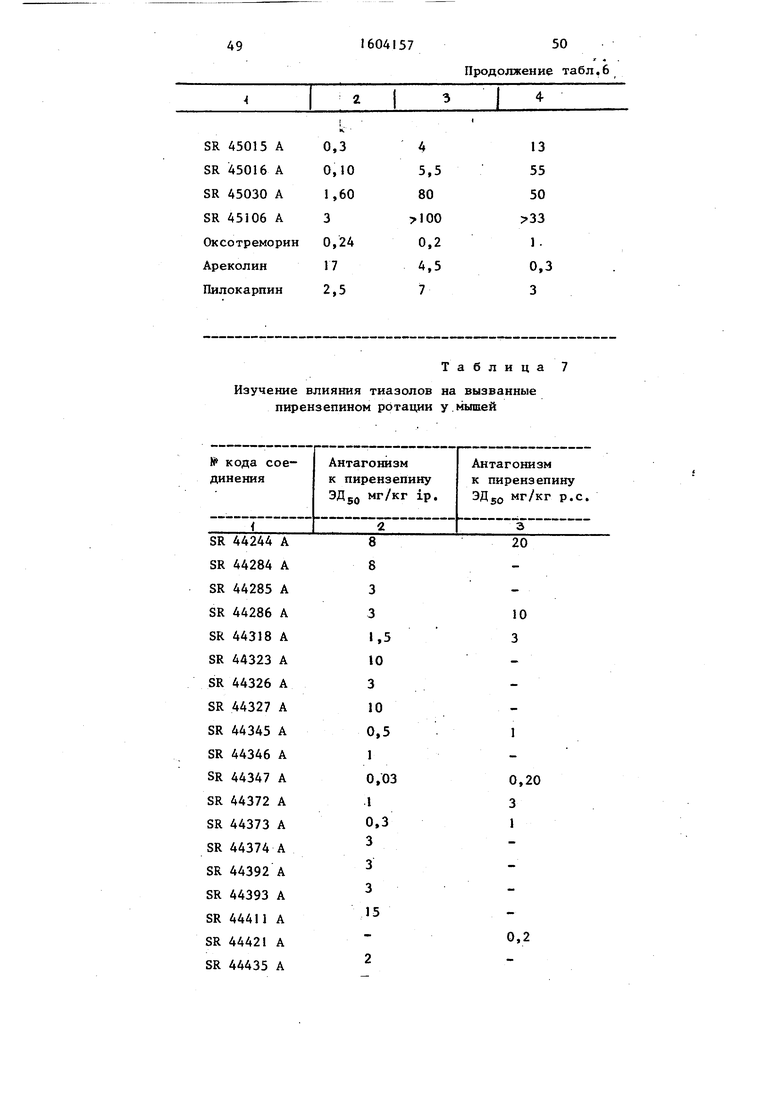
Фармакологическое изучение ин ви-во. Пирензепин (PZ) является специфи- ческим антагонистом холинэргических мускариновых центров М. Внутристриа та ль на я инъекция PZ мьппи приводит к вращательному поведению. Изучали антагонизм к этому поведению за счет продуктов, полученных согласно изоб- ретению.
Продукты проводили либо интрапе- ритонеально (i.p.), либо орально (P.O.) после растворения в дистиллированной воде или суспендирования в 5%-ном растворе гуммиарабика. Контролирование реализовали за счет введения чистого растворителя в тех же условиях.
Использовали самок мьшей (Swiss CD 1, Chearles River, Франция) весом 25-30 г.
Пирензепин растворяли в фосфатном буфере, рН раствора 6. .
Изучаемые продукты или их раство- рители вводили либо путем инъекции, либо интраперитонеально, либо орально с помощью пищеводного зонда, в объеме 0,4 мл на 20 г веса тела. Введение осуществляли либо за 15 мин (кнтраперитонеально), либо за 30 мин (перорально) до прямой инъекции пи рензепина в дозе 1 мкг в мкл растворителя в прямое полосатое тело мыши Число контралатеральных ротаций (в направлении, противоположном стороне инъекции) подсчитьшали в течение трех периодов по 2 мин после инъекции пирензепина: минуты 2-4, 8-10 и 13-15. Каждая обработка включала 3-4 дозы и 10 животных на дозу. Для каждой обработки рассчитьгоали общее число ротаций и процент антагонизма по отношению к контрольной партии.
Для каждого продукта графически определяли эффективную дозу 50 (ЭДд г доза, которая снижает на 50% число ротаций, вызванных пирензепи- ном.
Результаты представлены в табло 7«
Табл. 7 Показьшает для каждого испытуемого продукта эффективную дозу 50 (ЭД,.) в мг/кг у мыши для антаго U
.низма ротаций, вызываемых пиренэепи- ном, либо интраперитонеально, либо перорально.
В качестве сравнения полученные результаты соотносили с тремя стандартными продуктами. .
Пояснения к табл. 7„
Сильная индукция вторичных эффектов (дрожания, слюнотечение, лак
е
Q
5
0 5 О
o
5,
римация, дефекация, пилоэрекция, гипотермия, седатация) в дозах, близких к активным дозам в этих тестах.
Результаты табл. 7 показьшают, что соединения согласно изобретению обладают активностью, стимулирующе холинэргическую центральную передачу, и, следовательно, могут быть использованы в качестве агонистов мускариновых рецепторов.
Кроме того, некоторые из продуктов обнаруживают антагонистическзто активность к действию возбудителей аминокислот в головном мозге. Эту активность измеряли в тесте высвобождения ацетилхолина, вызванного Ы-метил-В-аспарагиновой кислотой (NMDA) на разрезах полосатого .тела крысы.
Острую токсичность определяли для различных продуктов согласно способа по изобретению. Продукты вводили интраперитонеально в возрас- тагацих дозах партиями по 10 самок мышей (Swiss CD 1, Charles River, Франция) весом по 20 г.
1) Гибель, вызьшаемая изз чаемьми продуктами, отмечали в течение 24ч сообразно введению продукта. Для каждого из продуктов определяли летальную дозу 50 (Щ, т.е. дозу, вызьшающую смерть 50% животных.
Полученные результаты объединены в табл. 8..
Продукты согласно способа по изобретению малотоксичны и не проявляют никакого признака токсичности в дозах, в которых они активны. Поэтому они могут быть использованы в качестве медикаментов для лечения дегенеративных синдромов, связанных со старением, и особенно расстройств памяти и старческих слабоумий.
В фармацевтические композиции для орального, подъязычного, чрескожного 1ЙЛИ ректального введения новые активные ингредиенты могут быть введены в смеси с фармацевтическими основами людям для лечения старческих слабоумий.
Для то.го, чтобы достичь желательного эффекта, доза действующего начала может изменяться от 20 до 500 мг в день.
Каждая доза может содержать 5-200 мг активного ингредиента в комбинации с фармацевтической основой.
Эта доза может быть введена 1-4 раза в день.
Формула изобретения
Способ получения производных тиа- зола общей формулы-
Г
N «2
Rде R - водород, С,-С4-алкил, фенил или бензил; водород. С,-С4-алкил, фенил, моно- или дизамещенный галогеном, предпочтительно хлором или фтором, фенил, моно- ди- или тр изамещенньй С,-С4-алкилом фенил или мо- нозамещеиный С j-С -алкокси- группой, нитро- или гидрок- сильной группой фенил или водород; нафтил, бензил, oi ,0 -Диметиябензил, циклогексил, бифенилил, тиенил или ада-- тил, ли R t и R2 вместе означают группу
Ь- R связанную с положением 4 тиазольног кольца через прямую связь фенила и с положением 5 тиазольного кольца чрез алкиленовую цепочку - (СН,,,-, в которой m - целое число, равное 2 или 3,
RC - водород или нитрогруппа,
занимающая одно из свободных положений бензольного к ОЛЬ ца,
при условии, когда одна из групп R, и R - водород, то другая не может означать водород или метил;
RI - водород или С -С -алкил; R4. - группа
/Re -А.-
где AJ - прямой или разветвленный
С -С -алкилен;
RgHR-7 независимо друг от друга - водород или С4-С4-алкил,
или один из R и Ry - водород, а другой - циклопропил или группа
.R
-N
6
означает пирролидиновый, пиперидино- вый, морфолиновый или N-метилпипе- разиновый цикл, или R4 группа
-А
«
где А 2 - прямая связь или прямой С -С -алкилен, причем А связана с пиридиновым циклом в положении 2,3 или 4, или R4 группа
-(CH2)2-lf
сн,
или
O-RI
где Rg - С,-С4-алкил, или группа
. -
4
о - означает группу
где Re имеет указанное значение, при услов 1И, что в этом случае, если R - водород или 0 -64-алкил, то является С,-С4-алкш1ом или циклогексилом,
или их аддитивных солей с неорганическими или органическими кислотами, отличающийся тем, что в кислой среде с рН 1-6 замещенную тиомочевину общей формулы
-N
R3 R
где Ra имеет указанное значение;
R имеет приведенные для R значения при условии, когда заместитель R4 имеет свободную первичную или вторичную аминогруппу, то она защио1ена кар- бонилсодержащей защитной группой,
при нагревании подвергают взаимодействию с соединением общей формулы
RI-CH-C-R.
I
7 Вг о
где R и RJ имеют указанные значения, де свободного основания или в виде или с соответствующим ему соедине- аддитивной соли с неорганическими нием в котором карбонильная группа или органическими кислотами..
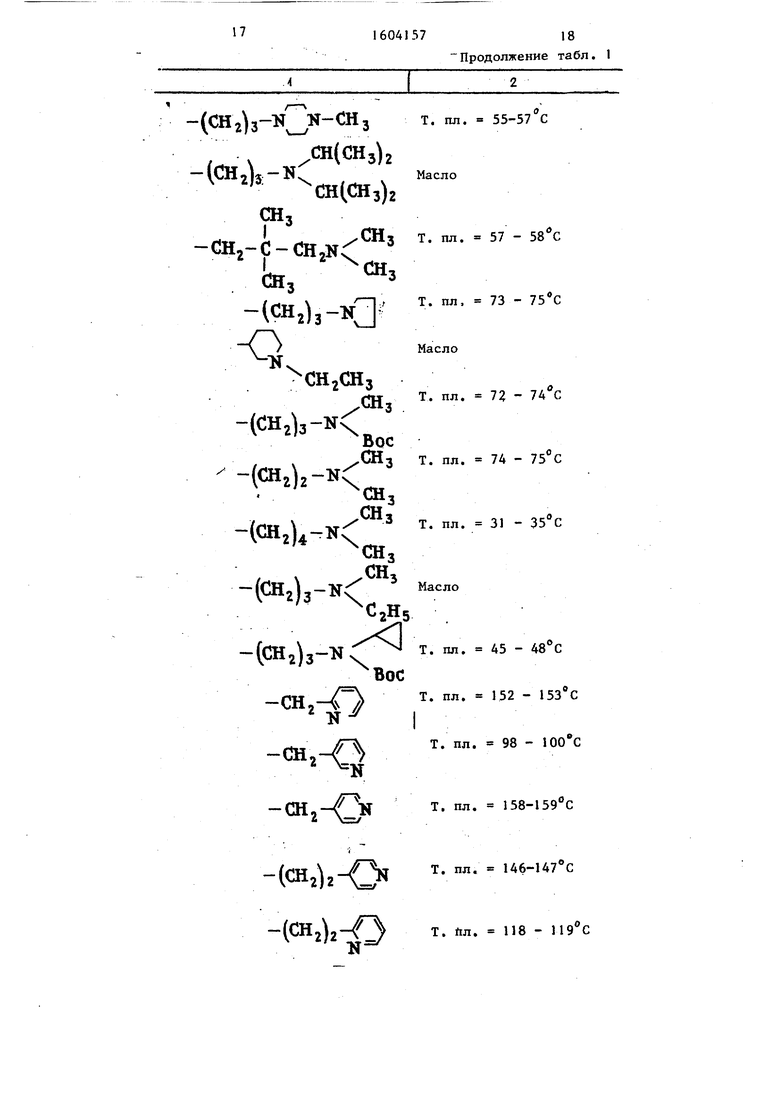
Т а б. л и ц а 1 Структурная характеристика исходных тиомочевин формулы
S V-CO-OT-d-NH-R
-(CH2)
(CHab-N
X
X
,с,н
2 5
,
-(СН2)
сн
{СН2)
(сн 2)2-0
l zlz-l Z
т. пл Т. пл Т. пд
(CH2)2-N
(СНг)
(СН2)зСН
(СН2)зСНз СН(СНз)2
СН(СНз)2
,
(,.
гНд -(CHa)z-I
СНз
защищена в форме ацеталя, с последующим в случае наличия удалением карбонйлсодержащей защитной группы и вьделением целевого продукта в нит. пл. 119 - 120 С
Масло, тонкослойная матография (ТСХ) Rf 0,51 С%С12. - МеОН 90/10 (по объему)
Т. пл. 67-69 с
т. пл. 98 - Т. пл. 70 - 71 °С Т. пд. 48-49 0
Т. пл. 93 -
Масло
Т. пл. 65 - 67 с
17
СН2)
.V /СН(СНз)2
lCH7l N Масло
сн(сн,)г
СНз
Т. пл
CHj-C-CH-N
/
2
СНз т. пл
СН:
-(СН2)з-К
-о
If
-{CH,)3-N
-(
-(CHj)-N
З т. пл. 74 - 75 С
СНз
т. пл. 31 -
СНз СНз
-(СНг)з-к
-(СН,)) -СН,
-fcT
N
- ОН . пл. 158-159°С
-(
(СН2 2-/ЛТ. йл. 118 - 119 С
.
160415718
Продолжение табл. 1
Т. пл. 55-57 С
СНз т. пл. 57 - 58 с
СН:
т. пл. 73 - 75 С
Масло
Т. пл. 72 -
Бос
З т. пл. 74 - 75 С
СНз СНз
Масло
пл. 45 - 48°С
Т. пл. 152 - 153 С
Т. пл. 98 - 100 С
Т. пл. 146-147 с
-(СНг)
N
(снОз
N
(сн,),-1Г)
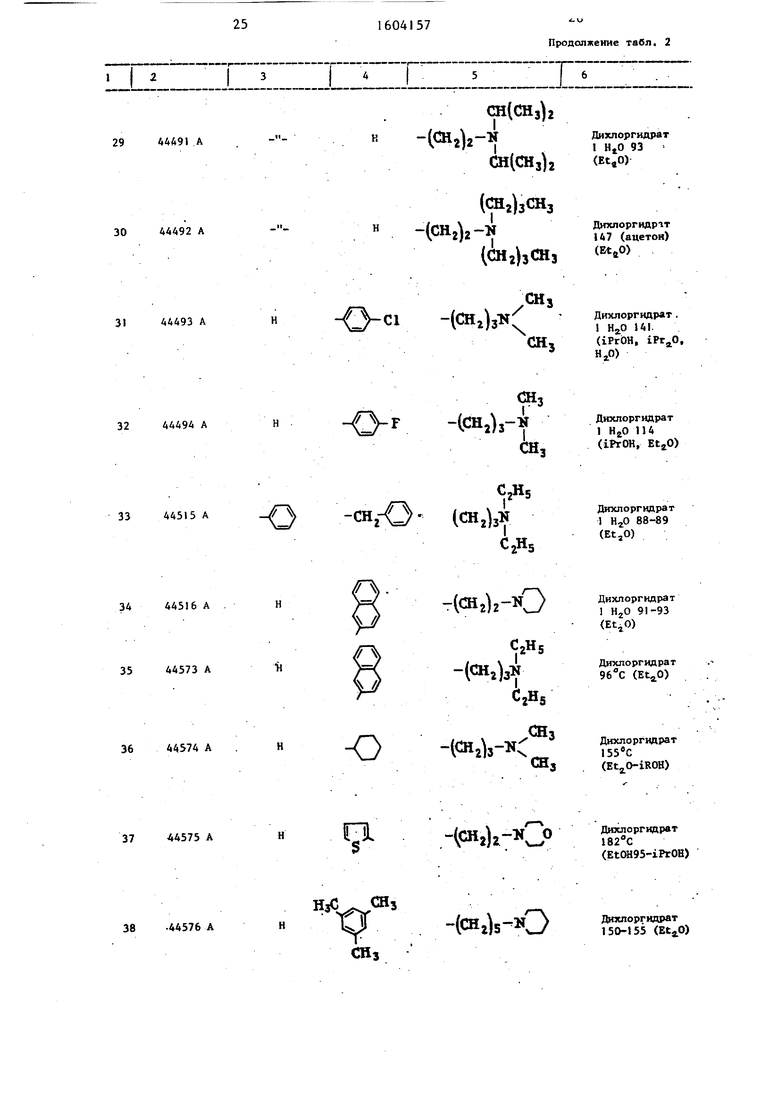
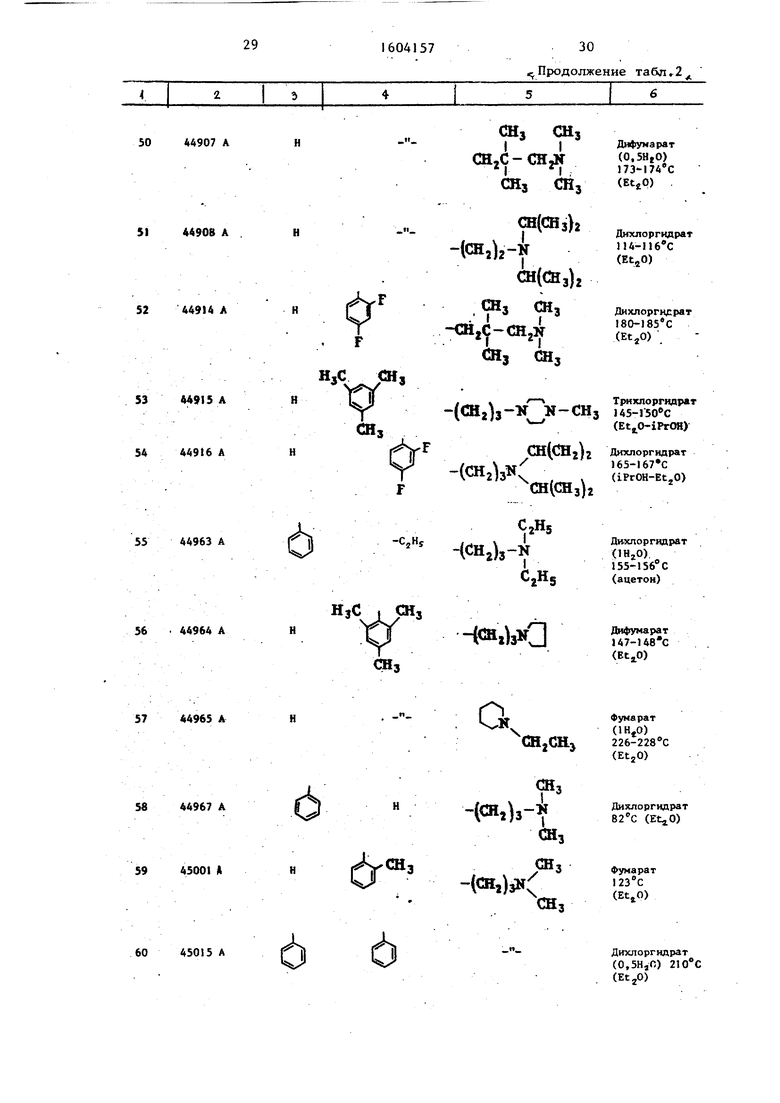
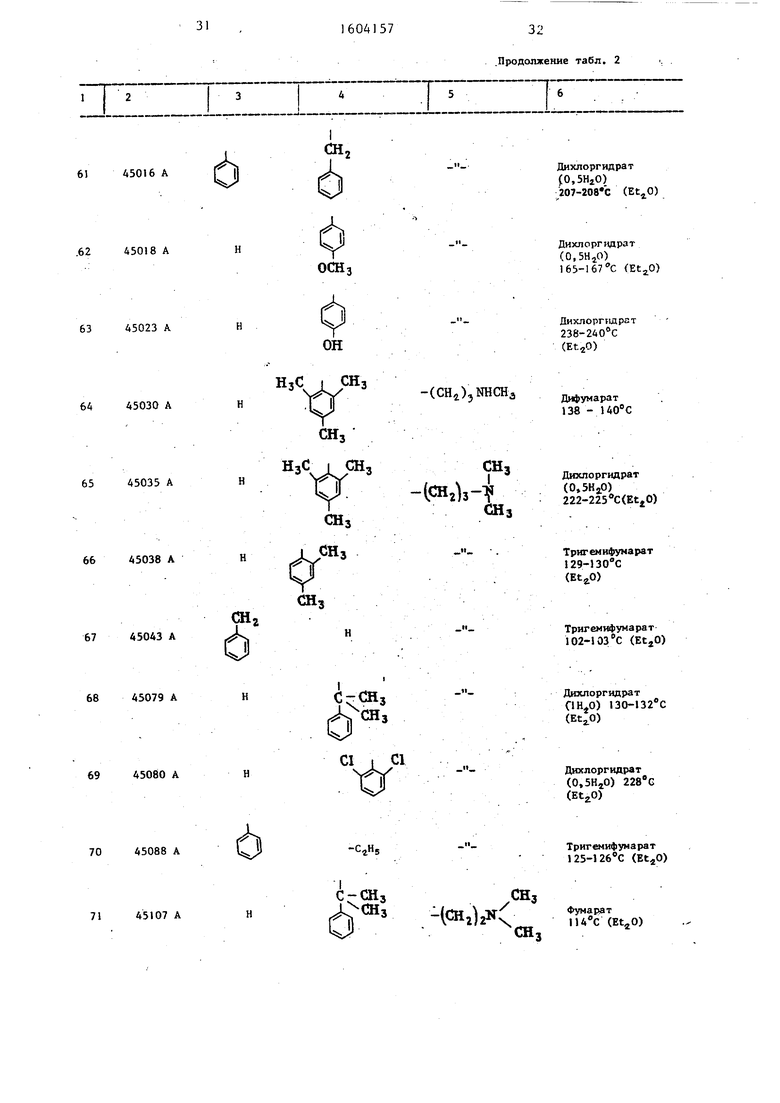
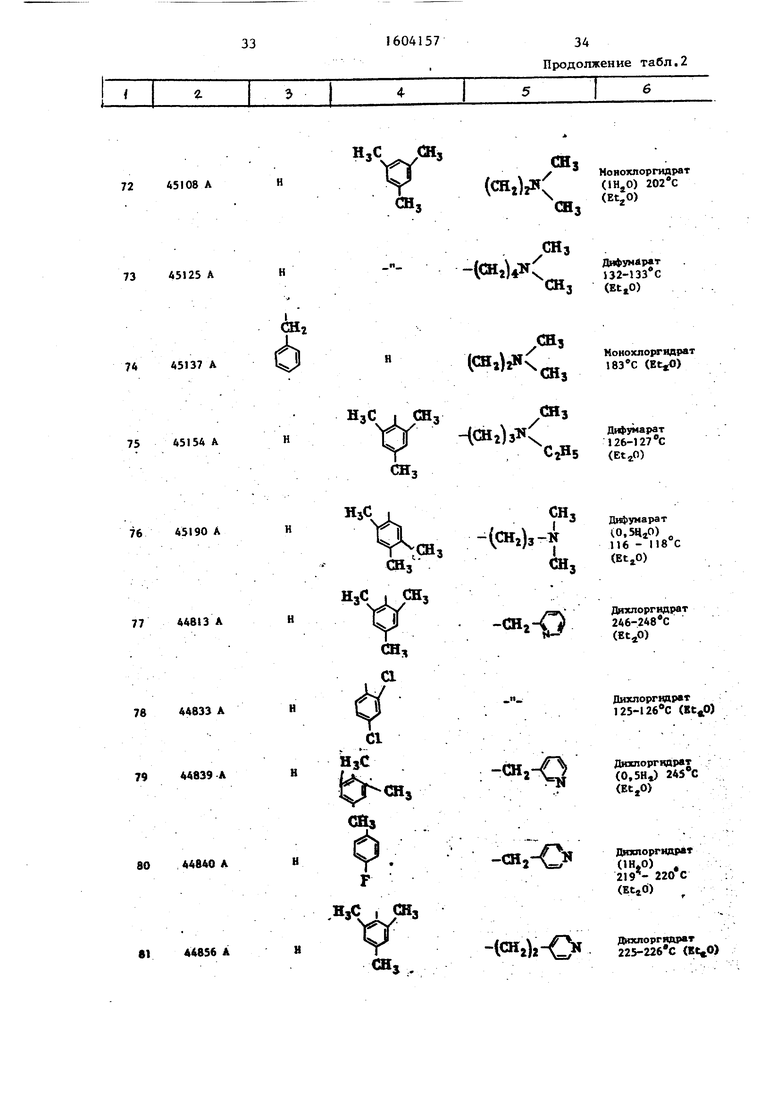
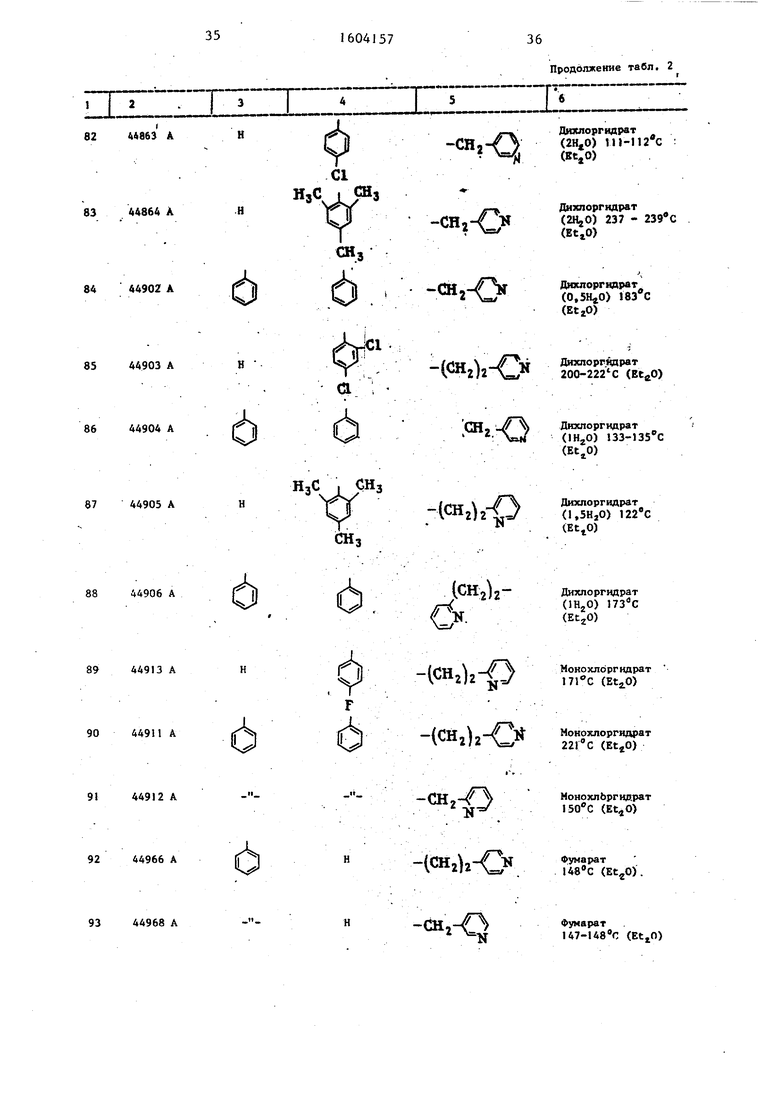
Таблица 2 Структура и характеристики .производных тиазола формулы/
.
или их аддитивных солей
44244 А
44234 А
44285 А
44286 А
44345 А
44346 А
сн.
844347 А
сн,
СНз
Продолжение табл.1
Т. пл. 142 -
Т; пл. 81 - 82 С
Т. пл. 118 -
/гЧ та ftДихлоргидрат
)2 v 220-221
(iPrOH-EtjO)
- (СН,-j-N ОДихлоргидрат
ZJJ j216-217
(iPrOH)
-(СН2)
Дихлоргидрат 264 - 265 (lPrOH-EtOH95)
-(CH2)4-N:
-(СН2)з-к:
.СгНд
CiHs .СНз
СНСукцинат
110-111
(iPrOH-iPrjO)
Дихлоргидрат
181-182
()
CjHs 1СНг)з
гЩ
®2)з
Дихлоргидрат
0,5 Н20; I43-444,
ацетон
Дихпоргидрат 199-200, к циклогек- сан EtjO
28 44490
- -
-( Дкхлоргипрат 2JZ / 250 (разложен
вне) (BtjO)
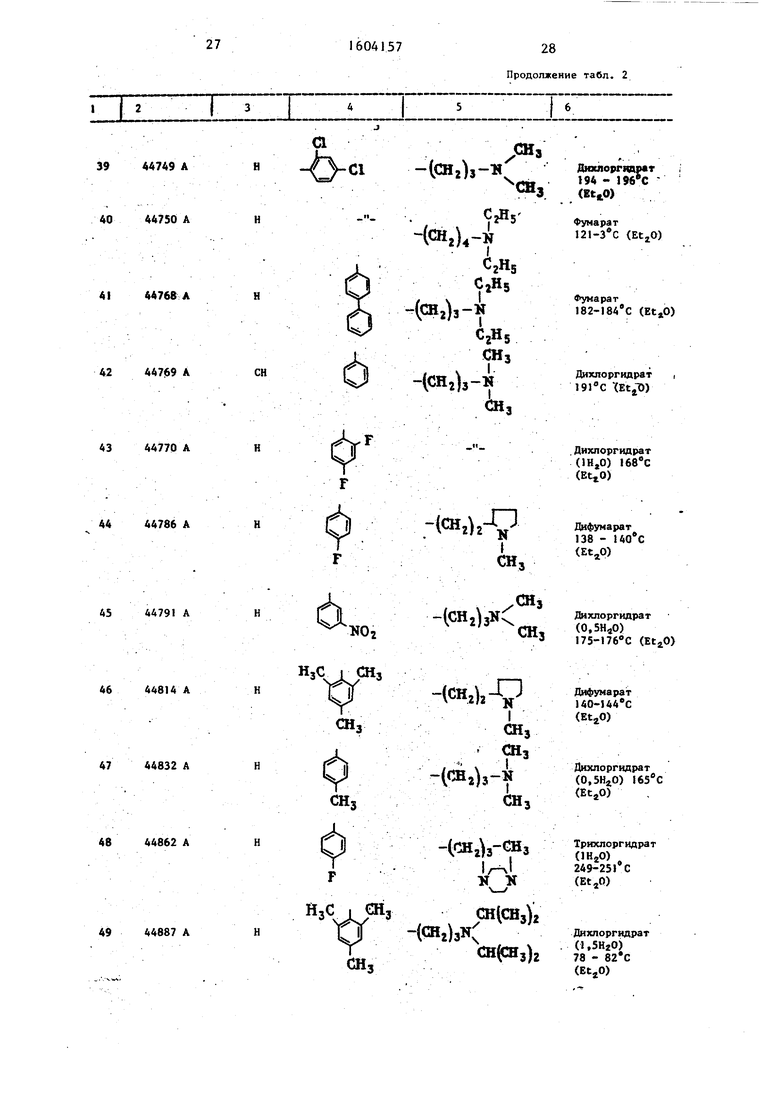
Продолжение табл. 2
29
1604157
30 « Продолжение табп , 2
.Продолжение табл. 2
,lU C (Et,0)
СНз
814A8S6 А
Продолжение табл.2
сн.
Чонг,)а-С
фослоргндрат 225-22б с ()
Продблжение табл. 2
39
1604157
106 45255 А
J07 45264 А
НзС СНз
сн.
108 45258 А
Примечание. iPrOH - изопропанол; РгОН - пропанол; EtOH 95° - этанол 95°;
- безводный диэтиловьо эфир; - диизопропилоиый эфир.
Табли
Структура и характеристики формулы
, хВз
HjN-C-
R4
.-I и-СНз 174-175 с
N
-С
(СН2)з-К
сн,
, 40-44 0
V
-к
Продолжение табл.2
Монохлоргндрат (0,5HzO)
200-201 с (EtjO)
Дихлоргидрат
221-223 С
(iPrOH-Et,,0)
-(CH,3-NH- C1Оксалат
V 170 - UZ C
(ацетон).
сн,
3
V
141-143°С
Структура и характеристики производных тиазола формулы
,, J-
в виде аддитивных солей
117 45257 АН
Таблица 4
-N
/
ДихлоргидрАт
224-22б с
(iPrOH-iPr O)
Структура и характеристики конденсированных тиазолов формулы
С Ш-(СН,)
и
в виде их аддитивных солей
119
44317 А
3 2
12044323 А
32-К
3 3
122
44327 А
3 3
12344392 А
3 3
124
44393 А
2 2 --N
Таблица 5
-N О
Дихлоргидрат 217°С (iPrOH-EtOH 95)
Дихлоргидрат
70°С
(iPr.OH-Et20)
Дихлоргидрат 0,5 192°С (iPrOH-iPrgO)
N
.
3- 3
Дихлррг идра т 1 198°С
()
(
f
O
Дихлоргидрат
0,5 HgO
245 С (разложение)
(ЕЦО)
СгНз
С
Дихлоргидрат 0,5 HjO (Etj O-PrOH)
45
Сродство производных тиазола по отношению к рецепторам М( и Mg
Таблицаб
49
Таблица 7
Изучение влияния тиазолов на вызванные пирензепином ротации у.ьшшей
SR 44244 А SR 44284 А SR 44285 А SR 44286 А SR 44318 А SR 44323 А SR 44326 А SR 44327 А SR 44345 А SR 44346 А SR 44347 А SR 44372 А SR 44373 А SR 44374 А SR 44392 А SR 44393 А SR 44411 А SR 44421 А SR 44435 А
160415750
X «
Продолжение табл.6
20
10 3
0,20
3 1
0,2
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ приготовления хлебного вина | 1925 |
|
SU424A1 |
| Шеститрубный элемент пароперегревателя в жаровых трубках | 1918 |
|
SU1977A1 |
| -Патент CDIA 4578451, кл | |||
| ПАРОПЕРЕГРЕВАТЕЛЬ ДЛЯ ЛОКОМОБИЛЬНЫХ КОТЛОВ | 1912 |
|
SU277A1 |
| Приспособление для установки двигателя в топках с получающими возвратно-поступательное перемещение колосниками | 1917 |
|
SU1985A1 |
| The Merck Index | |||
| An encyclopedia of Chemicals, Drugs and Biologicals | |||
| .Tenth Edition | |||
| Rahway, N | |||
| J., USA | |||
| Регистрационный ящик | 1918 |
|
SU983A1 |
| Способ обработки грубых шерстей на различных аппаратах для мериносовой шерсти | 1920 |
|
SU113A1 |
| Машковский М.Д | |||
| Лекарственные средства, М,: Медицина, 1986, т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| , | |||
Авторы
Даты
1990-10-30—Публикация
1988-03-11—Подача