Изобретение относится к микробиологии и может быть использовано для установления этиологической значимости выделенных штаммов микроорганизмов в развитии инфекционно-воспалительных процессов, оценки вирулентности микроорганизмов, диагностики дисбиозов.
Известны способы определения у микроорганизмов протеаз, разрушающих иммуноглобулины, основанные на использовании иммуноэлектрофореза [1], ауторадиографии [2], спектрофотометрического метода с использованием очищенных микробных протеаз [3].
Однако все эти методы трудоемкие, требуют использования специальной сложной аппаратуры для проведения электрофореза, учета уровня радиоактивности, реактивов, меченых изотопами, или технологически сложных приемов выделения бактериальных протеаз, разрушающих иммуноглобулины.
Наиболее близким к заявляемому способу по назначению и совокупности существенных признаков является способ определения антииммуноглобулиновой активности микроорганизмов [4], согласно которому исследуемую культуру выращивают на плотной питательной среде, стандартизируют взвесь на ФЭК-М до плотности, соответсвующей 0,5. Далее 0,1 мл взвеси вносят в пробирку с 0,1 мл сыворотки крови человека, содержащей известное количество IgM, IgG, IgA, определенное ранее методом радиальной иммунодиффузии (РИД) по Манчини [5], параллельно готовят контроль из физиологического раствора и сыворотки крови. Опыт и контроль инкубируют 30 мин, затем получают супернатант и определяют в нем методом радиальной иммунодиффузии остаточную концентрацию иммуноглобулинов. По разнице концентраций иммуноглобулина в контрольной и опытной пробах судят об антииммуноглобулиновой активности микроорганизмов.
Однако известный способ имеет ряд существенных недостатков. Чувствительность метода РИД, используемого для выявления антииммуноглобулиновой активности, недостаточно высокая и составляет 3 мг/мл [5]. Оценка зон преципитации предусматривает измерение диаметра зоны преципитации линейкой, что не позволяет избежать субъективных ошибок исследователя при измерении размера преципитата вокруг лунок в агаре с опытной и контрольной сыворотками. Известно, что в способе-прототипе в агар вносят моноспецифические антииммуноглобулиновые сыворотки, являющиеся гетерогенными по составу [6, 7]. С этим связано появление двойных колец преципитации вокруг лунок с опытными и контрольными пробами, что соответственно не позволяет точно оценить разницу в диаметре колец преципитации, образующихся вокруг опытной и контрольной лунок, и далее определить остаточную концентрацию иммуноглобулинов. К недостаткам метода следует отнести и использование цельной донорской сыворотки для инкубации с исследуемой культурой, так как сыворотка содержит самые разнообразные по строению и функции белки, которые могут влиять на антииммуноглобулиновую активность микроорганизмов.
Задачей заявляемого способа является повышение эффективности определения антииммуноглобулиновой активности микроорганизмов за счет увеличения чувствительности способа и повышения точности количественной оценки антииммуноглобулиновой активности.
Для решения указанной задачи в заявляемом способе определения антииммуноглобулиновой активности микроорганизмов исследуемую культуру микроорганизмов выращивают на плотной питательной среде, из выросшей агаровой культуры готовят микробную взвесь и смешивают с очищенным иммуноглобулином, параллельно готовят контроль из забуференного физиологического раствора и очищенного иммуноглобулина, опытную и контрольную пробы инкубируют не менее 18 ч, отделяют супернатант от бактериальных клеток центрифугированием, определяют концентрацию иммуноглобулина в опытной и контрольной пробах иммуноферментным анализом и затем рассчитывают антииммуноглобулиновую активность по формуле

где АИгА - антииммуноглобулиновая активность, %;
Ск - концентрация иммуноглобулина в контроле, мкг/мл;
Со - концентрация иммуноглобулина в опыте, мкг/мл.
Новыми признаками заявляемого способа являются:
- микробную взвесь инкубируют с очищенным иммуноглобулином;
- осуществляют инкубацию опытной и контрольной пробы не менее 18 ч;
- остаточную концентрацию иммуноглобулина в опытной и контрольной пробах определяют иммуноферментным анализом;
- рассчитывают антииммуноглобулиновую активность по формуле

где АИгА - антииммуноглобулиновая активность, %;
Ск - концентрация иммуноглобулина в контроле, мкг/мл;
Со - концентрация иммуноглобулина в опыте, мкг/мл.
Достигаемый при осуществлении изобретения технический результат состоит в том, что новый способ определения антииммуноглобулиновой активности микроорганизмов позволяет за счет увеличения чувствительности способа и повышения точности количественной оценки повысить эффективность определения антииммуноглобулиновой активности микроорганизмов.
Авторами экспериментально установлено, что определение способности микроорганизмов к инактивации иммуноглобулинов при инкубировании микробной взвеси с сывороткой крови человека, содержащей известное количество иммуноглобулинов, то есть в условиях контакта с другими белками сыворотки, менее достоверно по сравнению с тем, если инкубацию исследуемой микробной взвеси проводить с очищенным иммуноглобулином.
Учитывая, что исследуемые культуры микроорганизмов были выделены от больных людей, в проводимых авторами исследованиях использовались очищенные иммуноглобулины человека.
Проводился следующий эксперимент.
В опытной серии культуры E.coli, S.enteritidis выращивали на мясопептонном агаре при температуре 37°С в течение 24 ч, готовили их взвесь в концентрации 1 млрд/мл. Далее первую партию взвесей микроорганизмов в равных объемах смешивали с донорской сывороткой (пул сывороток крови от 15 здоровых доноров), а вторую партию взвеси исследуемых микроорганизмов смешивали с исходным раствором, содержащим 10 мг/мл очищенного IgG сыворотки крови человека (концентрация, соответствующая содержанию иммуноглобулина в сыворотке крови здорового человека) и предварительно разведенным в 1000 раз (с учетом требований по использованию калибровочных растворов из реагентов ИФА). Параллельно готовили контрольную пробу из забуференного физиологического раствора и очищенного иммуноглобулина в той же концентрации, что использовали в опытной пробе. Опытные пробы и контроль инкубировали в течение суток при температуре 37°С и центрифугировали при 8000 об/мин в течение 20 мин, получали бесклеточные супернатанты, в которых с помощью иммуноферментного анализа с использованием реагентов для определения концентрации иммуноглобулинов в сыворотке крови человека (ООО "Полигност") фотометром Multiskan (Labsystems, Финляндия) определяли концентрацию иммуноглобулина в опытных и контрольной пробах. По разнице концентраций иммуноглобулина в опыте и контроле определяли инактивацию иммуноглобулина и судили об антииммуноглобулиновой активности микроорганизмов.
Определили, что культура E.coli, инкубированная с сывороткой, инактивировала 0,09±0,02 мкг/мл IgG, содержащегося в донорской сыворотке, и 1,02±0,09 мкг/мл IgG при инкубации с очищенным человеческим IgG. Соответственно культура S.enteritidis инактивировала 0,04±0,007 мкг/мл IgG донорской сыворотки и 0,8±0,06 мкг/мл - очищенного человеческого IgG.
Это подтверждает то, что определение способности микроорганизмов к инактивации иммуноглобулинов при инкубации микробной взвеси с иммуноглобулинами в условиях контакта с другими белками донорской сыворотки менее достоверно по сравнению с тем, если инкубацию исследуемой микробной взвеси проводить с очищенным иммуноглобулином.
Предлагаемый способ позволяет определять антииммуноглобулиновую активность в отношении всех классов иммуноглобулинов. АИгА в отношении IgA обозначается как АИг(А)А, в отношении IgG - АИг(G)А; в отношении IgM - АИг(М)А; в отношении IgE - АИг(Е)А; в отношении IgD - AИг(D)A.
Учитывая, что наибольшее значение в инфекционной клинике имеют три основных класса иммуноглобулинов - IgA, IgM и IgG [8], авторы в экспериментальных исследованиях определяли антииммуноглобулиновую активность микроорганизмов в отношении данных классов иммуноглобулинов.
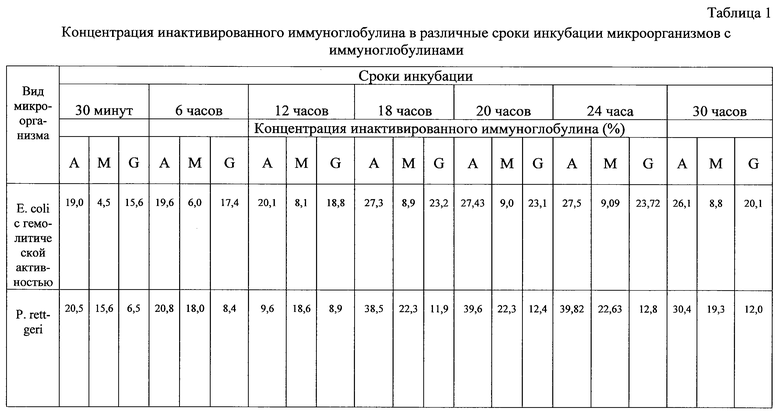
При разработке настоящего способа авторами были проведены исследования по выбору времени инкубации микробной взвеси и иммуноглобулина. Для этого взвесь суточных агаровых культур микроорганизмов в концентрации 1 млрд/мл инкубировали в равных объемах с препаратами очищенных IgM, IgG и IgA в течение 30 мин (этот временной диапазон используется в способе-прототипе), 6, 12, 18, 20, 24 и 30 ч при температуре 37°С. Проведенные авторами исследования показали (результаты приведены в таблице 1), что измерение остаточной концентрации иммуноглобулина в инкубационной смеси следует проводить не ранее чем через 18 ч от начала инкубации. Как видно из таблицы 1, измерение остаточной концентрации иммуноглобулина ранее 18 ч от начала совместного инкубирования бактерий с иммуноглобулином нецелесообразно, так как инактивация основных исследуемых классов иммуноглобулинов (IgA, IgM, IgG) в сроки ранее 18 ч выражена незначительно по сравнению со сроками, превышающими 18 ч от начала культивирования бактерий с иммуноглобулином.
В известном способе-прототипе [4] для выявления остаточной концентрации иммуноглобулина после взаимодействия последнего с микроорганизмом использован метод РИД, однако известно, что чувствительность метода РИД значительно уступает чувствительности ИФА (соответственно 3 мг/мл и 1 нг/мл) [5, 9].
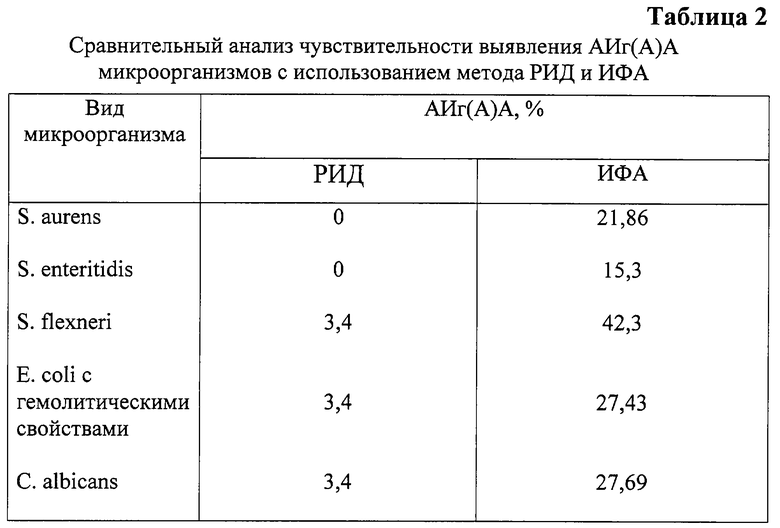
Авторами были проведены исследования для сравнения способности к инактивации IgA пяти культур микроорганизмов - S.enteritidis, S.aureus, S.flexneri, E.coli, C.albicans с использованием метода РИД и ИФА для определения остаточной концентрации иммуноглобулина и расчета АИг(А)А. Результаты исследований приведены в таблице 2.
Как видно из таблицы 2, при использовании ИФА способность к инактивации IgA (АИг(А)А) была выявлена у всех пяти штаммов, включая и те, у которых при использовании метода РИД эти свойства культур микроорганизмов не выявлялись. У штаммов S.flexneri, C.albicans, E.coli уровень АИг(А)А при использовании метода РИД для измерения остаточной концентрации составлял 3,4%, а при использовании ИФА - значительно превышал эти значения и колебался от 15,3 до 42,3%.
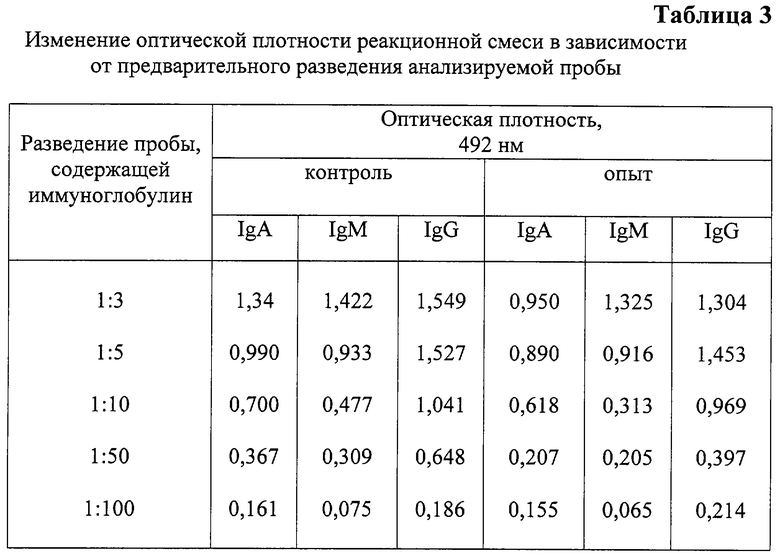
Известно, что результат взаимодействия антигена и антитела во многом определяется их эквивалентным соотношением [10, 11]. Учитывая, что в ИФА используется реакция взаимодействия антигена и антитела [9], авторами при разработке настоящего способа были проведены исследования по выбору наиболее оптимального разведения исследуемых проб, в которых проводилось иммуноферментным анализом определение остаточной концентрации иммуноглобулинов. Проведенные авторами исследования показали, что наиболее целесообразным является разведение исследуемых проб в соотношении 1:50 (табл.3). Как видно из таблицы 3, при разведении исследуемых проб в 1:3, 1:5, 1:10 не выявляется значительных различий в изменении оптической плотности в опыте по сравнению с контролем. Разведение 1:100 использовать нецелесообразно, так как оптическая плотность (ОП) как контрольных, так и опытных проб имеет значения ниже ОП отрицательного контроля, т.е меньше 0,2, что не допускается требованиями инструкции для определения концентрации IgG, IgM, IgA иммуноферментным анализом. Поэтому авторы предлагают использовать как наиболее оптимальное разведение исследуемых проб в соотношении 1:50, при котором выявляются существенные отличия ОП опытных и контрольных проб.
Способ осуществляется следующим образом.
1. Исследуемые культуры микроорганизмов выращивают на плотной питательной среде (для каждого вида микроорганизма используют соответствующий тип питательной среды) при 37°С в течение 24-36 ч.
2. Готовят микробную взвесь в физиологическом растворе в концентрации 1 млрд/мл.
3. На стерильном забуференном физиологическом растворе 0,15 М, рН 7,2, готовят раствор очищенного человеческого иммуноглобулина (Sigma, номера по каталогу для IgA - 1010, для IgG - 4506, для IgM - 8260), далее полученные растворы разводят в 1000 раз стерильным буфером в соответствии с требованиями инструкции по работе с реагентами ИФА. В лунки стерильного полистиролового планшета вносят по 50 мкл микробной взвеси и раствора иммуноглобулина.
4. Параллельно с опытной готовят контрольную пробу, содержащую вместо микробной взвеси 50 мкл забуференного физиологического раствора.
5. Пробы инкубируют не менее 18 ч при 37°С.
6. После инкубации пробы переносят в пластиковые пробирки и центрифугируют 8000 об/мин 20 мин при + 5°С.
7. Отбирают необходимое количество супернатанта в пробирки, содержащие такое количество буфера, чтобы пробы были разведены в соотношении 1:50.
8. Проводят определение остаточной концентрации иммуноглобулинов в опытной и контрольной пробах иммуноферментным анализом с использованием реагентов ООО "Полигност" (Санкт-Петербург) в соответствии с инструкцией использования данных реагентов. Измерение оптической плотности опытной и контрольной проб проводится на фотометре Multiskan (Labsystems, Финляндия при длине волны 492 нм), перерасчет концентрации иммуноглобулинов осуществляется путем построения калибровочных графиков. Найденные по графику значения концентрации Ig умножают на коэффициент разведения, т.е на 50, и получают концентрацию иммуноглобулина в мкг/мл.
9. Рассчитывают антииммуноглобулиновую активность по формуле

где АИгА - антииммуноглобулиновая активность, %;
Ск - концентрация иммуноглобулина в контроле, мкг/мл;
Со - концентрация иммуноглобулина в опыте, мкг/мл.
Антииммуноглобулиновая активность выражается в процентах (%) инактивации иммуноглобулина в опыте по сравнению с контролем.
Пример 1
У штамма Esherichia coli, обладающего гемолитической активностью, выделенного от больного дисбиозомом, была изучена способность инактивировать иммуноглобулины основных классов А, М, G. Для этого из суточной агаровой культуры была приготовлена микробная взвесь в физиологическом растворе в концентрации 1 млрд/мл, 50 мкл взвеси вносили в лунки стерильного полистиролового планшета, далее в каждую лунку вносили по 50 мкл раствора, содержащего 2,0 мг/мл - IgA; 2,0 мг/мл - IgM; 10,0 мг/мл - IgG, и предварительно разведенного в 1000 раз. В контрольную пробу вместо культуры микроорганизма внесли 50 мкл забуференного физиологического раствора 0,15 М, рН 7,2. После 24-часовой инкубации при +37°С содержимое каждой лунки переносили в пластиковые пробирки, супернатант отделяли от бактериальных клеток центрифугированием на холоде (+5°С) в течение 20 мин при 8000 об/мин. Затем из каждой пробы отбирался супернатант в пластиковые пробирки, содержащие буфер, прилагаемый к набору реагентов для ИФА (промывающий раствор), в соотношении 1:50 раз. Далее одну пробирку использовали для определения содержания IgM, вторую - для IgA и третью - для IgG. Концентрацию иммуноглобулина определяли иммуноферментным анализом в соответствии с инструкцией по применению реагентов для определения концентрации IgG, IgM, IgA. Регистрацию результатов проводили фотометрически на фотометре Multiskan Labsystems (Финляндия) при длине волны 492 нм. Были получены следующие значения ОП опытной пробы для IgA -0,206 и контрольной - 0,262. Соответственно для опытной пробы в лунках стрипов с иммобилизированными моноклональными антителами против иммуноглобулина М значения ОП составили 0,081, а в контрольной пробе -0,086. В лунках стрипов с иммобилизированными моноклональными антителами против IgG значения ОП пробы составили 0,339, а в контрольной пробе - соответственно 0,440. Концентрацию IgA, IgM, IgG в супернатантах опытной и контрольной проб рассчитывали по калибровочному графику с учетом значений оптической плотности проб. График строили на бланке, прилагаемом к набору реагентов ИФА: ось абсцисс - концентрация какого-либо иммуноглобулина в калибровочных пробах, ось ординат - соответствующее значение оптической плотности (ОП 492). Были получены следующие значения концентрации IgA в опытной пробе - 0,8 мкг/мл, а в контрольной пробе - 1,3 мкг/мл. Концентрация IgM в опытной пробе составила 0,45 мкг/мл, а в контрольной пробе - 0,55 мкг/мл. Концентрация IgG в опытной пробе составила 3,15 мкг/мл, а в контрольной пробе - 4,7 мкг/мл. АИг(А)А рассчитывали по формуле
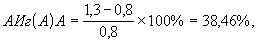
где АИг(А)А - антииммуноглобулиновая активность в отношении IgA, %;
1,3 - концентрация IgA в контроле, мкг/мл;
0,8 - концентрация IgA в опыте, мкг/мл.
Аналогичным способом были рассчитаны АИг(М)А и АИг(G)А исследуемого штамма E.coli:
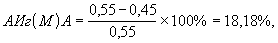
где АИг(М)А - антииммуноглобулиновая активность в отношении IgM, %;
0,55 - концентрация IgM в контроле, мкг/мл;
0,45 - концентрация IgM в опыте, мкг/мл.

где АИг(G)А - антииммуноглобулиновая активность в отношении IgG, %;
4,7 - концентрация IgG в контроле, мкг/мл;
3,15 - концентрация IgG в опыте, мкг/мл.
Таким образом, антииммуноглобулиновая активность штамма Esherichia coli в отношении IgA имеет значение 38,46%, в отношении IgM - 18,18%и в отношении IgG - 32,97%.
Пример 2
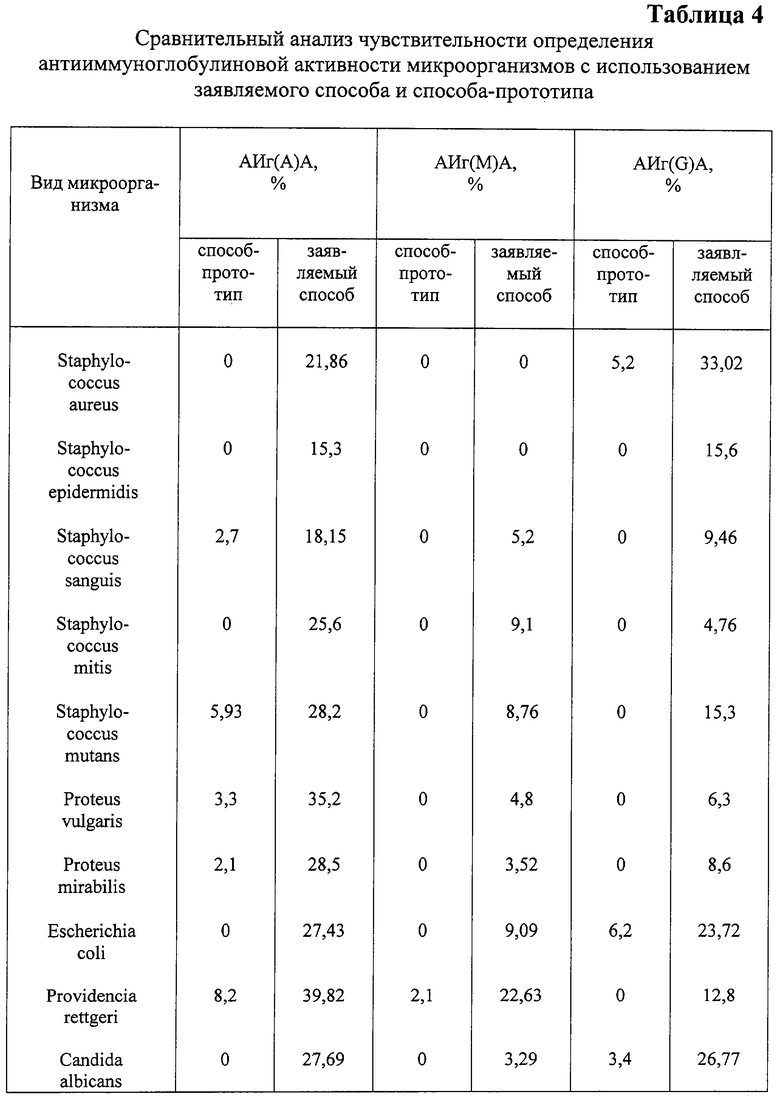
У 11 штаммов микроорганизмов, выделенных от больных с различной патологией, была определена АИг(G)А, АИг(М)А, АИг(А)А с использованием заявляемого способа и способа-прототипа.
Сравнительный анализ результатов представлен в табл.4. Как видно из таблицы 4, использование заявляемого способа позволило выявить АИг(А)А различного уровня в отношении сывороточного IgA у 100% исследуемых штаммов, а в способе-прототипе - только у 5%. АИг(М)А заявляемым способом выявлена у 8% исследуемых штаммов, а способом-прототипом - у 1%. Способность инактивировать IgG заявляемым способом выявлена у 100% исследуемых штаммов, а способом-прототипом - у 3%. Кроме того, в заявляемом способе диапазон выявляемой антииммуноглобулиновой активности составлял 9,46-39,82%, а способом-прототипом - 2,1-8,2%.
Таким образом, предлагаемый способ позволяет повысить эффективность определения антииммуноглобулиновой активности микроорганизмов за счет увеличения чувствительности способа и повышения точности количественной оценки антииммуноглобулиновой активности.
Источники информации
1. Lassiter M., Kindle J., Hobbs L., Gregory R. Estimation of immunoglobulin protease activity by quantitative rocket immunoelectrophoresis // J. Immunol. Methods. - 1989. - Vol. 123, №1. -P. 63-69.
2. Gilbert I., Plaut A., Detection of IgA Protease Activity among Multiple Bacterial Colonies // J. Immunol. Methods.- 1983. - Vol. 57, №1. - P. 247-251.
3. Bleeg H., Reinholdt J., Kilian M. Bacterial immunoglobulin a proteases monitored by continuous Spectrophotometry // Febs - Lett. -1985. -Vol. 188, №2. - P. 357-367.
4. Михайлова Е.А., Луда А.П., Бигеев М.И. Антииммуноглобулиновая активность бактерий и ее диагностическая ценность // Персистенция бактерий под редакцией О.В.Бухарина - Куйбышев, 1990 - С.107-111 (прототип).
5. Лабораторные методы исследования в клинике. Справочник под редакцией В.В. Меньшакова. - M., Медицина, 1987.- 365 с.
6. Обеспечение качества лабораторных исследований. Справочное пособие. Под редакцией В.В. Меньшакова.-М., 1999.- 318с.
7. Петров Р.В., Ковальчук Л.В., Соколова Е.В. Основные вопросы иммунологии. Учебно-методическое пособие. M., 1977,-134 с.
8. Клиническая иммунология. Под редакцией А.В. Караулова. -M., 1999. - 604с.
9. Егоров А.М., Осипов А.П., Дзантиев Б.Б., Гаврилова Е.М. Теория и практика иммуноферментного анализа- М.: Высшая школа, 1991. - 288с.
10. Медицинские лабораторные технологии. Справочник под редакцией А.И. Карпищенко. - Санкт-Петербург, 1999.- Том 2. - 653с.
11. Иммунологические методы. Под редакцией Г. Фримеля. - М., Медицина, 1987. -472 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИФФЕРЕНЦИАЦИИ КУЛЬТУР Candida albicans ВАГИНАЛЬНОГО БИОТОПА ЖЕНЩИН НА НОРМАЛЬНУЮ И ПАТОГЕННУЮ МИКРОФЛОРУ | 2015 |
|
RU2595370C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ С РАЗЛИЧНЫМ ТИПОМ АКТИВНЫХ ЦЕНТРОВ, СПОСОБНЫХ РАСЩЕПЛЯТЬ ИММУНОГЛОБУЛИНЫ КЛАССОВ IgA, IgM, IgG | 2010 |
|
RU2447446C2 |
| Способ диагностики туберкулеза | 2022 |
|
RU2794855C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛАКТОФЕРРИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2003 |
|
RU2245923C2 |
| Штамм hCoV-19/Russia/Omsk-202118-1707/2020 коронавируса SARS-CoV-2, иммуносорбент, содержащий цельновирионный очищенный антиген, полученный на основе указанного штамма и тест-система ИФА для выявления антител классов M, G и A к коронавирусу SARS-CoV-2 с использованием указанного иммуносорбента | 2021 |
|
RU2752862C1 |
| Способ диагностики риккетсиозов группы клещевой пятнистой лихорадки, иммуноферментная диагностическая тест-система для его осуществления | 2019 |
|
RU2726484C1 |
| СРЕДСТВО, СТИМУЛИРУЮЩЕЕ В ЭКСПЕРИМЕНТЕ СИНТЕЗ ИММУНОГЛОБУЛИНОВ | 1995 |
|
RU2108096C1 |
| СПОСОБ ДИАГНОСТИКИ ЛЕПРЫ | 2000 |
|
RU2171689C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 1E6 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К СПОРАМ Bacillus anthracis | 2010 |
|
RU2439148C1 |
| Способ определения резидентного стафилококкового бактерионосительства | 1990 |
|
SU1761809A1 |
Изобретение относится к микробиологии и может быть использовано для установления этиологической значимости выделенных штаммов микроорганизмов. Способ осуществляется путем выращивания исследуемой культуры микроорганизмов на плотной питательной среде, приготовления из выросшей агаровой культуры микробной взвеси и смешивания ее с очищенным иммуноглобулином. Параллельно готовят контроль из забуференного физиологического раствора и очищенного иммуноглобулина. Опытную и контрольную пробы инкубируют 18-24 ч, отделяют супернатант от бактериальных клеток центрифугированием, определяют концентрацию остаточного иммуноглобулина в опытной и контрольной пробах иммуноферментным анализом. Антииммуноглобулиновую активность рассчитывают по формуле 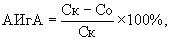 где АИгА - антииммуноглобулиновая активность, %; Ск - концентрация остаточного иммуноглобулина в контроле, мкг/мл; Со - концентрация остаточного иммуноглобулина в опыте, мкг/мл. Способ позволяет повысить эффективность определения антииммуноглобулиновой активности микроорганизмов за счет увеличения чувствительности способа и повышения точности количественной оценки антииммуноглобулиновой активности. 4 табл.
где АИгА - антииммуноглобулиновая активность, %; Ск - концентрация остаточного иммуноглобулина в контроле, мкг/мл; Со - концентрация остаточного иммуноглобулина в опыте, мкг/мл. Способ позволяет повысить эффективность определения антииммуноглобулиновой активности микроорганизмов за счет увеличения чувствительности способа и повышения точности количественной оценки антииммуноглобулиновой активности. 4 табл.
Способ определения антииммуноглобулиновой активности микроорганизмов, заключающийся в том, что исследуемую культуру микроорганизмов выращивают на питательной среде, выросшую культуру смешивают с иммуноглобулинсодержащим субстратом, параллельно готовят контроль, опытную пробу и контроль инкубируют, отделяют супернатант от микробных клеток центрифугированием, определяют антииммуноглобулиновую активность по разнице концентраций остаточного иммуноглобулина в опытной пробе и контроле, отличающийся тем, что исследуемую культуру микроорганизмов выращивают на плотной питательной среде, из выросшей агаровой культуры готовят микробную взвесь, смешивают с раствором очищенного иммуноглобулина, контроль готовят из забуференного физиологического раствора и раствора очищенного иммуноглобулина, опытную пробу и контроль инкубируют 18-24 ч, концентрацию остаточного иммуноглобулина в опытной пробе и контроле определяют иммуноферментным анализом.
| МИХАЙЛОВА Е.А | |||
| и др | |||
| Антииммуноглобулиновая активность бактерий и ее диагностическая ценность //Персистенция бактерий /Под редакцией С.В | |||
| БУХАРИНА | |||
| - Куйбышев, 1990, с.107-111 | |||
| Большая медицинская энциклопедия | |||
| Издание третье | |||
| - М.: Советская энциклопедия, т.18, с | |||
| Льномолотилка веялка | 1923 |
|
SU498A1 |
| Кладка стен из фасонного кирпича | 1922 |
|
SU542A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| СИНГЕР М., БЕРГ П | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Пер | |||
| с англ - М.: Мир, 1998, с | |||
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| Иммунологические методы исследования | |||
| Пер | |||
| с англ./ Под редакцией И | |||
| ЛЕФКОВИТСА | |||
| и др | |||
| - М.: Мир, 1988, с.27 | |||
| Лабораторные методы исследования в клинике | |||
| Справочник /Под редакцией В.В | |||
| МЕНЬШАКОВА | |||
| -М.: Медицина, 1987, 293с. | |||
Авторы
Даты
2004-09-20—Публикация
2002-09-24—Подача