Изобретение относится к биотехнологии и медицине, в частности к комбинации антигенов вируса гепатита В и дальнейшему использованию полученной композиции антигенов, такому как профилактика вирусного гепатита В и лечение хронического гепатита В путем изготовления новой вакцины против гепатита В.
Вирусный гепатит В является одним из наиболее опасных инфекционных заболеваний, которое может протекать как в острой форме, так и приводить к хронизации инфекции, что в свою очередь опасно развитием цирроза и рака печени.
Эпидемиологическая ситуация в мире в отношении вирусного гепатита В (ВГВ) улучшается с каждым годом. Причина - массовая иммунизация путем включения вакцины против гепатита B в календарь обязательных или усиленно рекомендуемых прививок. Это - широкоприменяемая в профилактическом здравоохранении рекомбинантная дрожжевая вакцина против гепатита В второго поколения (таблица 1).
Однако за очевидными успехами в виде убедительных данных о спаде заболеваемости вплоть до 10-ти кратного снижения смертности от тяжелых последствий ВГВ (цирроз и рак печени) дальновидный научный анализ показывает ее недостатки и даже возможные осложнения в будущем. Тем не менее существует реальная возможность решения проблемы.
Важным моментом в оценке ситуации является также то обстоятельство, что вакцинопрофилактика оставляет своим вниманием 350 миллионов хронических носителей вируса гепатита В, которые в разной форме от бессимптомной до агрессивной носят и распространяют вирус. Разработанные препараты для лечения хронического гепатита (комбинация интерферона и аналогов нуклеозидного обмена) не проявили достаточной эффективности, особенно в отношении отдаленных результатов, но при этом обладают известной токсичностью, а также приводят к возникновению резистентных форм вируса. Вакцина на основе всех белковых структурных компонентов вируса является перспективным способом для лечения этой патологии, поскольку содержит все эпитопы антигенов, индуцирующие полный спектр вирус-нейтрализующих антител, наряду с задействованием специфического клеточного иммунитета.
Биологическая сущность любой вакцины состоит в том, чтобы максимально близко воспроизвести модель природного процесса инфицирования человека, не допустив при этом развития инфекции. В результате формируется защитный иммунитет, но препарат должен быть безвредным и не нести потенциальную опасность в перспективе своего применения, даже если это весьма отдаленные побочные негативные осложнения. Вирус гепатита В относится к категории слабо изменчивых, но это лишь означает, что изменчивость требует большего времени для своего проявления. Если для вирусов HIV или гепатита С это составляет лишь период циркуляции в пределах одного организма-хозяина (несколько недель), в случае вируса гриппа - один год циркуляции в популяции, то для вируса гепатита В - это могут быть годы. Однако это не должно ослаблять внимание вирусологов, несмотря на кажущийся абсолютным успех в последнее 15 лет от массового применения вакцины гепатита В второго поколения. Совершенно очевидно, что чем больше структурное сходство вакцины с природным вирусом, тем более она эффективна. Включение в состав препарата всех компонентов вируса, сохранив их вирус-нейтрализующие эпитопы, за исключением частей, ответственных за воспроизведение вируса (кодирующие последовательности ДНК или РНК) - задача конструирования эффективной безвредной вакцины. Благодаря успехам техники рекомбинантных ДНК и накопленному опыту, это стало реально возможным.
Сущностью заявляемой группы изобретений является комбинированное использование всех элементов, несущих протективные эпитопы и относящихся к структурным белкам вируса гепатита В. Вакцина, созданная на основе антигенов, полученных предложенным способом, способна индуцировать широкий спектр противовирусных антител (анти-preS1, анти-preS2, анти-HBs и анти-НВс), относящихся к разным генотипам (серотипам, субтипам) вируса гепатита В, что характеризует вакцину как универсальную для применения в любых регионах мира. За счет использования эпитопов, специфичных для preS областей и HBcAg (cor-антигена), вакцина может иметь не только профилактическое действие широкого спектра, но и терапевтическое применение.
Включение в состав вакцинного препарата иммуногенных эпитопов preS-области и НВс антигена приводит к индуцированию anti-preS1, anti-preS2 и anti-HBc антител, что резко расширяет защитный спектр анти-вирусного гуморального иммунитета по сравнению с только anti-S антителами в случае вакцины 2-го поколения (таблица 1). Рекомбинантная вакцина нового 4-го поколения создана на основе научного анализа и прогноза в сочетании с высокой технологией, отработанной на предшественнике - вакцине гепатита В 2-го поколения. За счет использования всех элементов вакцины 3-го поколения (содержащей S и preS-области) и включения нового компонента НВс (cor), разработана вакцина 4-го поколения. При этом сочетание высокой технологии производства и его низкой себестоимости выводит ее в разряд перспективных разработок в области борьбы с гепатитом В плоть до искоренения этой инфекции.
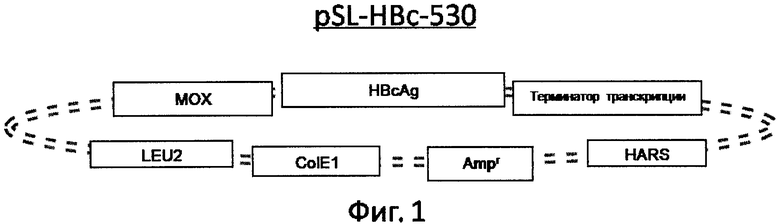
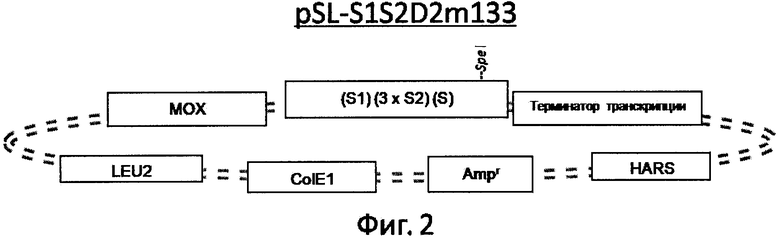
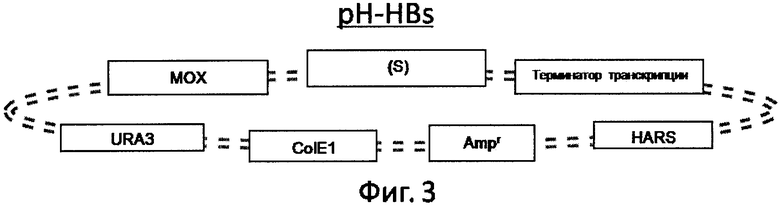
Предлагаемый способ получения вакцины против гепатита В 4-го поколения аналогов не имеет, и не обнаружено патентов, которые могли бы быть использованы в качестве прямого прототипа. Существуют лишь патенты на получение вакцин 1-го, 2-го и 3-его поколений. Причем они существенно отличаются между собой способами получения вирусных антигенов, используя кровь пациентов и рекомбинантные системы экспрессии: Е.coli, дрожжи или культивируемые клетки млекопитающих, например СНО (перевиваемые линии клеток китайского хомячка). Настоящее изобретение базируется на получении всех компонентов вакцины в высокоэффективной системе экспрессии, описанной в бразильском патенте С1 9705324-4 (2001), который является ближайшим аналогом к заявленной группе изобретений. В ближайшем аналоге раскрыт способ получения очищенного HBsAg для производства вакцины против гепатита В, включающий трансформацию клеток дрожжей Hansenula polymorpha плазмидой pH-HBs, культивирование клеток-продуцентов в среде, содержащей пептон, дрожжевой экстракт, с принудительной аэрацией, контролем биомассы, порционным добавлением в ферментер чистого метанола в количестве 0,5-1% (объем/объем) относительно объема ферментации, разрушение клеток экструзионным способом, очистку материала путем диафильтрации, преципитации при пониженном рН, ионообменной хроматографии на ДЕАЕ-целлюлозе, центрифугирования в градиенте плотности KBr, гель-фильтрации. В заявляемом способе для экспрессии всех антигенов заявляемой вакцины был использован тот же вектор, что и в ближайшем аналоге. На фиг.1-4 показаны схемы рекомбинантных плазмид для экспрессии искомых компонентов HBsAg, preS-HBsAg и HBcAg.
Отличительным свойством данной заявки является то, что дрожжи Hansenula polymorpha (Pichia angusta), трансформированные рекомбинантными экспрессирующими плазмидами, культивируются в особых, ранее не описанных условиях роста на метаноле - углеродном субстрате и одновременно индукторе дерепрессии промотора МОХ (метанолоксидазы), что приводит к максимальному синтезу целевого продукта и его накоплению в клетках дрожжей. Этапы выделения и очистки рекомбинантных антигенов, используемых для получения вакцины 4-го поколения, являются аналогичными этапам ближайшего аналога, однако имеются и отличия, приведенные в примерах. Получаемые по изобретению рекомбинантные антигены убедительно показали возможность индуцировать специфические антитела у белых мышей, что подтверждает их иммуногенность и возможность использования в качестве компонентов вакцины для человека.
Способ получения новой вакцины предусматривает следующие варианты:
- Синтез всех структурных белков вируса гепатита B в одной клетке дрожжей (за счет ко-экспрессии нескольких кодирующих последовательностей плазмид).
- Синтез отдельно взятых белков вируса гепатита B в разных клетках дрожжей, с последующим объединением культур, биомасс, полуочищенных или высокоочищенных антигенов, а также отдельно приготовленных вакцинных препаратов (формулированных с адъювантом и без) для сведения в одну дозу комбинированной вакцины.
Таким образом, заявляемая группа изобретений относится к генно-инженерному направлению получения вакцин против гепатита.
Гены вируса гепатита В клонируются и экспрессируются в прокариотических и эукариотических клетках. Однако уровни экспрессии, получаемые при использовании бактерий, бывают низкими, и при этом не происходит эффективной сборки антигена в иммуногенные частицы размером 22 нм, в силу чего данная система обычно не используется в качестве источника антигена для производства вакцин (Valensuela P. et al., Nature 1980, 280:815; Burrell C.J. et al., Nature 1979, 279:43).
Эукариотические клетки также используются для получения HBsAg (Michel M. L. et al., Biotechnology 1985, 3:561; Macnab G.M. et al., British Journal of Cancer 1976, 36:509), тем не менее производство вакцин на этой основе требует применения дорогостоящих и сложных методов, оборудования и питательных сред, что затрудняет организацию крупномасштабного производства. Кроме того, существуют опасения относительно надежности вакцин, полученных на основе клеточных линий млекопитающих, из-за возможного наличия ретровирусов. Поэтому данный подход также не всегда используется для широкого производства гепатитной вакцины.
Существующие коммерческие рекомбинантные вакцины против гепатита В основаны главным образом на HBsAg, полученном в генетически трансформированных дрожжах.
Антиген производится внутриклеточно, извлекается с помощью различных способов лизиса клеток и очищается при использовании разнообразных физико-химических методов, позволяющих добиться степени чистоты более 95% и получить продукт, антигенные свойства которого, как это было подтверждено на животных и человеке, соответствуют антигену из плазмы крови (Hauser P. et al. Posgraduate Medical Journal 1987, 63 suppl 2:83).
Описана эффективная система экспрессии, где в качестве клеток-хозяев используются клетки метилотрофных дрожжей Pichia pastoris. Система основана на применении промотора гена фермента алькогольоксидазы I (AOX1). Указанный фермент катализирует первую реакцию утилизации метанола дрожжами Pichia pastoris. Промотор AOX1 жестко регулируется и обеспечивает высокие уровни экспрессии фермента (до 30%), когда клетки выращивают в присутствии метанола, но не в присутствии глюкозы (Ellis S.B. et al. Molecular and Cellular Biology, 1985, 5:1111; Couderc R. et al. Agric Biol Chem. 1980, 44:2259).
Дрожжи Р. pastoris используются для экспрессии различных чужеродных белков, в том числе HBsAg (Cregg J.M. et al. Biotechnology 1987, 5:479). При этом ген, кодирующий HBsAg клонируется под контролем промотора алкогольоксидазы I (AOX1) в кассете экспрессии, которая интегрируется в хромосому мутантного штамма указанных дрожжей. Это обуславливает тот факт, что при активации системы в присутствии метанола от 2 до 3% полученных в растворенном виде белков приходится на HBsAg.
Другим достоинством данной системы по сравнению с S. cerevisiae является эффективная сборка антигена в частицы размером 22 нм, и в результате этого практически весь полученный антиген оказывается агрегированным в антигенные частицы в отличие от того, что происходит в системе S. serevisiae, где только часть мономеров размером 24 kd собирается в антигенные частицы (Valenzuela P. et al. Nature 1982, 298:397; Hitzeman R.A. et al. Nucleic Acids Research 1983, 11:2745; Miyanohara A. et al. Proceedings of the National Academy of Sciences USA 1983, 80:1).
Тем не менее для вакцинных препаратов, основанных на рекомбинантном HBsAg, которые в настоящее время имеются на рынке, в качестве источника антигена по-прежнему используют дрожжи S. cerevisiae.
С помощью заявленного нами способа, включающего соблюдение специфических условий ферментации и очистки, рекомбинантные антигены получают при культивировании дрожжей Hansenula polymorpha (Pichia angusta), при этом они отличаются высокой степенью агрегирования в частицы и большой однородностью, что придает им более высокие иммуногенные свойства. Данные эффекты и являются достигаемым техническим результатом.
Особенности процесса ферментации и состава примененной питательной среды позволяют эффективно создавать оптимальные физиологические условия, необходимые для роста микроорганизмов и для предпочтительной экспрессии клонируемого гена, а также добиваться высокой степени агрегирования получаемого продукта в частицы. Настоящее изобретение позволяет получать эффективную безвредную вакцину для широкого применения.
Примеры
Пример 1. Получение стабильных клонов штаммов-продуцентов
Для получения рекомбинантных штаммов Hansenula polymorpha - продуцентов HBsAg, HBcAg, HBs-preS и HBc-preS проводили генетическую трансформацию реципиентного штамма Hansenula polymorpha DL1 (Gellissen G (ed) (2002) Hansenula polymorpha - biology and applications), несущего мутацию LEU плазмидами: pSL-HBc-530 (фиг.1), pSL-S1S2D2m133 (фиг.2), pH-HBs (фиг.3) и pSL-HBc531-PreS1-3x-PreS2 (фиг.4). Для отбора клонов, в которых произошла успешная интеграция плазмиды в геном, осуществляли генетическую стабилизацию культур трансформированных клеток. Для этого проводили четыре пассажа колоний-трансформантов на минимальной агаризованой среде YNBD (Yeast Nitrogen Base (Difco, 239210) 0,7%, Д-Глюкоза 1,5%, агар-агар 1,5%). Колонии высевали методом штриха и инкубировали в течение 60 часов при температуре 30°С, правильно сформировавшиеся изолированные колонии отбирали на следующий пассаж. После проведения четырех пассажей, колонии пересевали на жидкую богатую среду Y1P1D2 (дрожжевой экстракт 1%, бакто-пептон 1%, Д-глюкоза 2%) и инкубировали при температуре 30°С в течение 60 часов при принудительной аэрации (в орбитальном шейкере со скоростью вращения 150-220 об/мин) в колбах Эрленмейера, наполненных средой на 1/12. По окончании инкубации, приготовляли серию разведений культуральной жидкости и высевали на чашки с агаризованой средой Y1P1D2 (с добавлением 1,5% агар-агара) и инкубировали в термостате в течение 60 часов при температуре 30°С. Отбирали 50 единичных колоний на агаризованую среду YNBD и 50 единичных колоний на агаризованую среду YNBD с добавлением лейцина (40 мг/л). Чашки инкубировали в термостате в течение 60 часов при температуре 30°С, после чего производили подсчет колоний и определяли эффективность интеграции фрагмента в хромосому по формуле
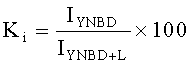 , где
, где
Ki - коэффициент интеграции
IYNBD - количество колоний, выросших на агаризованой среде YNBD
IYNBD+L - количество колоний, выросших на агаризованой среде YNBD с добавлением лейцина.
В случае, если коэффициент интеграции составлял менее 98%, процедуру генетической стабилизации повторяли еще раз.
В случае, если коэффициент интеграции составлял 98% и более, производили закладку культуры на долгосрочное хранение.
Для долгосрочного хранения клеток одну из колоний, выросших на чашке с агаризованой средой YNBD, высевали в жидкую среду YNBD и выращивали при принудительной аэрации в колбах, наполненных средой на 1/12, в течение 24 часов при температуре 30°С. К полученной культуральной жидкости добавляли 20% глицерина, после чего аликвоты (0.5 мл) замораживали при температуре -80°С (банк культуры).
Пример 2. Получение биомассы клеток штамма-продуцента
Первый пассаж культуры проводили, высевая в жидкую среду YNBD 2,5% (объем/объем) размороженной суспензии клеток из банка культуры, с последующей инкубацией в течение 36 часов при температуре 30°С и принудительной аэрации.
Полученную суспензию клеток использовали в качестве посевного материала для второго пассажа, высевая в свежую среду YP2D 20% суспензии (объем/объем) с последующей инкубацией в течение 36 часов при температуре 30°С и принудительной аэрации.
Для проведения третьего пассажа в свежую среду Y4P2G1 (4% дрожжевого экстракта, 2% пептона, 1% глицерина) высевали 12,5% (объем/объем) полученной на втором пассаже культуры и инкубировали при принудительной аэрации в течение 24 часов при температуре 30°С.
400 мл полученной культуры инокулировали в ферментер BioFlo 110 (New Brunswick Scientific), содержащий 3600 мл среды Y4P2M0,5 (4% дрожжевого экстракта, 2% бакто-пептона, 0,5% метанола) и проводили ферментацию при температуре 25°С без контроля рН, добавляя по 20 г метанола каждый раз, когда концентрация растворенного кислорода в среде поднималась от базового уровня (15%) и достигала не менее 40% от максимума (100%), что свидетельствовало о недостатке углеродного питания. Рост культуры контролировали, отбирая пробы культуральной жидкости и измеряя оптическую плотность при длине волны 600 нм и влажный вес биомассы (в г/л культуры). Влажный вес определяли, взвешивая осадок клеток, остающийся после центрифугирования культуральной жидкости в течение 10 мин на микроцентрифуге Beckman при 10000 g. Окончание ферментации определяли по отсутствию роста культуры в течение 12-24 часов.
Биомассу собирали при помощи центрифугирования на центрифуге Avanti-J25 (Beckman) на роторе JLA 9.1000 (7500 об/мин, 15 минут). Биомассу ресуспендировали в дистиллированной воде и центрифугировали в тех же условиях. Отмытую биомассу расфасовывали в контейнеры и хранили при температуре -80°С.
В результате получали с каждого литра среды 100-300 г биомассы клеток штаммов-продуцентов.
Пример 3. Выделение и очистка рекомбинантных антигенов из клеток штаммов-продуцентов
Биомассу клеток штаммов-продуцентов HBcAg, HbsAg, HBsAg-preS или HBc-preS, полученную в результате ферментации, разрушали экструзионным способом. Для этого биомассу размораживали в течение 12 часов при температуре 4°С, после чего ресуспендировали в буфере DBN (3М мочевина, 0,05 М Na2HPO4, 0,01 М ЭДТА, 0,5% Tween-20, pH 8.0) из расчета 400 мл буфера на каждые 100 г биомассы (1/4 масса/объем). Суспензию охлаждали до 6°С и разрушали с помощью гомогенизатора Gaulin APV 2000, контролируя температуру и не допуская ее повышения выше 40°С. Контроль эффективности разрушения осуществляли путем центрифугирования проб суспензии по 1 мл при 9000 g в течение 15 минут и измерения оптической плотности супернатанта при длине волны 280 нм (OD280) в стандартных кюветах 1 см. Разрушение проводили до достижения OD280 образца, разведенного в 100 раз, значения не менее 0,68 единиц.
Гомогенизат осветляли путем центрифугирования при 9000 g в течение 15 минут. Супернатант фильтровали через мембрану с размером пор 0,45 мкм (Millipore, диаметр фильтра 44,5 мм).
Отфильтрованный гомогенизат концентрировали при помощи системы Sartorius Slice 200 с установленной мембраной Millipore 300 кДа до 1/3 начального объема, после чего диализовали против 10 объемов фосфатного буфера РВ (10 ммоль Na2HPO4, pH 9.0), доводя конечную OD280 диализата до значения не менее 0,7 единиц при разведении в 100 раз.
Стандартизованный таким образом диализат очищали от посторонних белков путем преципитации с понижением pH. Для этого к раствору белка добавляли соляную кислоту, периодически отбирая пробы по 1 мл, центрифугируя их при 22000 rpm на центрифуге Microfuge 8 (Beckman) в течение 10 минут, с последующим измерением OD280 супернатанта, разведенного в 100 раз. Процесс продолжали до достижения OD280 0,15-0,19 единиц. По достижении требуемых параметров, раствор центрифугировали на центрифуге Avanti-J25 (Beckman) с ротором JA 14, 13500 об/мин в течение 40 минут. Супернатант отбирали и доводили pH при помощи гидроксида натрия до значения 9,4±0.2.
Полученный раствор белка фильтровали через мембрану Millipore с диаметром пор 0,45 нм, после чего наносили на хроматографическую колонку XK-16 (General Electric), заполненную сорбентом DEAE fast-flow (General Electric), предварительно сбалансированную в буфере РВ. Прохождение белка через колонку контролировали путем измерения OD280 на выходе из колонки. Полученный раствор белка подвергали дальнейшей очистке.
Для проведения следующего этапа очистки использовали два варианта осуществления, обеспечивающие необходимую степень чистоты. Первый вариант (А) включает проведение изопикнического центрифугирования раствора белка в градиенте плотности бромида калия. Второй вариант (Б) - очистку с применением метода гидрофобной хроматографии.
(А) Для проведения изопикнического центрифугирования в градиенте плотности раствор белка делили на три равные части, к которым добавляли сухой бромид калия до достижения плотности 1,05, 1,17 и 1,29 г/мл. Поликарбонатные пробирки Beckman (38×102 мм) заполняли на 1/3 раствором белка с плотностью 1,29 г/мл, после чего наслаивали такой же объем раствора белка с плотностью 1,17 г/мл, а затем - такой же объем раствора белка с плотностью 1,05 г/мл. Заполненные пробирки центрифугировали на ультрацентрифуге Beckman Optima L-90K с ротором Type 45 Ti при 32000 об/мин в течение 22 часов. Затем из пробирок отбирали фракции по 2 мл и определяли наличие в них антигена при помощи ИФА. Фракции с высокой концентрацией антигена объединяли и подвергали полученный раствор дальнейшей очистке с использованием гель-хроматографии. Аналогичный принцип использовали для проведения градиентного центрифугирования в зональном роторе Ti15.
(Б) Для проведения очистки методом гидрофобной хроматографии к раствору белка (в случаях HBcAg, HBsAg, HBs-preS) добавляли сухой сульфат аммония до конечной концентрации 0,5М или (в случае HBc-preS) сухой NaCl до концентрации 0,5М, после чего раствор инкубировали 1 час на ледяной бане, а затем пропускали через фильтр с диаметром пор 0,45 мкм (Millipore). Профильтрованный раствор белка наносили на колонку XK-26 (General Electric), наполненную носителем Phenil 650M (General Electric), уравновешенным буфером РВ с добавлением 0,5М сульфата аммония. После нанесения белка колонку промывали буфером РВ с добавлением 0,5М сульфата аммония, контролируя OD280 на выходе колонки. После того как OD280 снижалась до уровня фона, проводили десорбцию материала при помощи буфера РВ, собирая элюат до достижения фоновых значений OD280. Полученный элюат подвергали дальнейшей очистке с использованием гель-хроматографии.
Частично очищенные препараты антигенов, полученные методом изопикнического центрифугирования в градиенте плотности (А) или методом гидрофобной хроматографии (Б) подвергались окончательной очистке методом гель-хроматографии. Для этого частично очищенный раствор белка наносили на колонку XK-26 (General Electric), наполненную на высоту 30 см носителем HW-65 (General Electric) и уравновешенную РВ. Отбор фракций (объемом по 5 мл) на выходе колонки начинали при повышении OD280 и завершали при достижении OD280 фоновых значений. Каждую фракцию оценивали на наличие антигена (методом ИФА) и на чистоту (методом денатурирующего электрофореза в полиакриламидном геле и Высокоэффективной Жидкостной Хроматографии (ВЭЖХ)).
Фракции, имеющие наибольшую чистоту и активность антигена, объединяли для дальнейшей концентрации и хранения.
Белок концентрировали на системе Amicon 8400 (Millipore) до конечной концентрации белка 1-4 мг/мл, фильтровали через стерильную мембрану с размером пор 0,22 мкм (Acrodisc Tuffryn, Pall Life Sciences), добавляли стерильный глицерин до конечной концентрации 4% и разливали на аликвоты, которые хранили при -80°С.
Пример 4. Определение иммуногенности белков на мышах.
Для проведения исследований на животных антигены в стерильных условиях сорбировали на гидрооксиси алюминия. Для этого 100 мкл 3% суспензии Al(ОН)3 суспендировали в 2 мл вакцинного буфера (0,9% NaCl, 6,1 mM Na2HPO4, 3,9 mM NaH2PO4) и добавляли к суспензии очищенный белок до конечной концентрации 20 мкг/мл. Пробирки инкубировали на ротаторе со скоростью 5-10 об/мин при комнатной температуре в течение 12 часов, после чего использовали для приготовления вакцины в рабочих дозах от 0,04 до 0,5 мкг белка на животное. В качестве разбавителя использовали вакцинный буфер с добавлением 16,5 мл 3% суспензии гидрооксида алюминия на литр.
Вакцинные композиции готовили двумя способами.
А. Для приготовления вакцинной композиции смешивали предварительно сорбированные на гидроокись алюминия антигены.
Б. Для приготовления вакцинной композиции антигены вначале смешивали, а затем сорбировали на гидроокись алюминия.
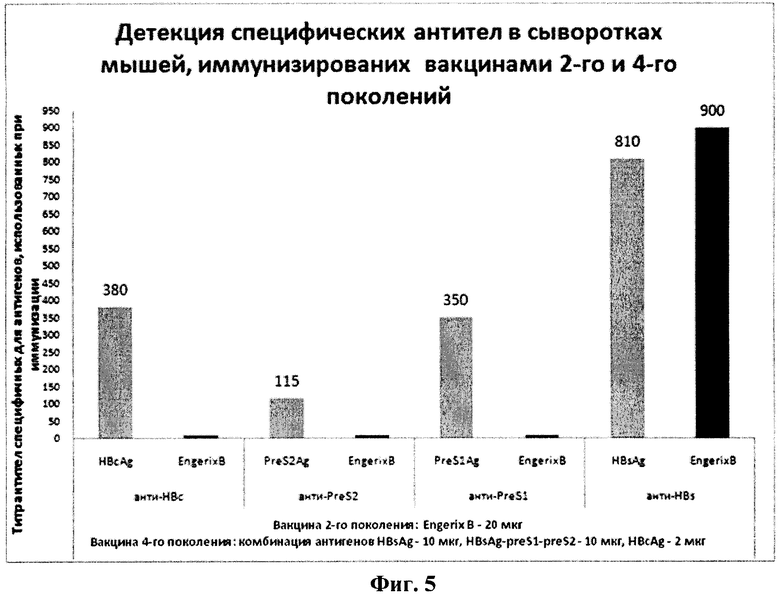
Полученные вакцинные композиции использовали для иммунизации мышей породы BALB-c путем внутрибрюшинной инъекции 0,5 мл вакцины. Через 28 дней производили забой животных и забор плазмы крови, в которой определяли наличие антител методом ИФА. Антитела к антигену HBsAg определяли с помощью автоматического анализатора Axsym system (Abbott), с использованием рекомбинантного антигена гепатита В (Ausab, Abbott). Антитела к антигену HBcAg определяли с помощью ИФА с использованием антигена Hepatitis В Virus core antigen protein (Abeam). Антитела к антигенам preS1 и preS2 определяли с использованием пептидов PL-887-PreS1-A (040602-07) и LBPreS2trimer (040121-05) (CDC Biotechnology core facility). На диаграмме представлены результаты определения специфических антител у мышей, иммунизированных вакциной, сочетающей антигены preS1, preS2, HBs и НВс (фиг.5).
Таким образом, заявленная полиэпитопная (несет эпитопы всех структурных антигенов) вакцина и способ ее получения в виде смеси очищенных антигенов вируса гепатита В, а также профиль применения для профилактики и лечения гепатита В являются новыми и очевидными на основании существующего уровня техники.
Описание рисунков и последовательностей.
Фиг.1 Схема плазмиды pSL-HBc-530.
Фиг.2 Схема плазмиды pSL-S1S2D2m133.
Фиг.3 Схема плазмиды pH-HBs.
Фиг.4 Схема плазмиды pSL-HBc531-PreS1-3x-PreS2.
Фиг.5 Результаты определения титра антител в сыворотке крови мышей, иммунизированных комбинированной вакциной.
Последовательность №1. Нуклеотидная последовательность клонированного гена HBcAg, кодирующая core-антиген гепатита В генотипа А.
Последовательность №2. Нуклеотидная последовательность, кодирующая гибридный белок, включающий области preS1 и preS2x3, дополненные комбинированным геном HBsAg субтипов adw4 (1-177 ак) и ayw (178-226 ак).
Последовательность №3. Нуклеотидная последовательность клонированного гена, кодирующего поверхностный антиген вируса гепатита В (HBsAg) субтипа ayw.
Последовательность №4. Нуклеотидная последовательность, кодирующая гибридный белок, включающий участки preS1 и preS2x3, дополненные геном HBcAg.



Изобретение относится к биотехнологии. Описан способ получения рекомбинантных очищенных структурных белков-антигенов для производства вакцины против гепатита В. Трансформируют клетки дрожжей Hansenula polymorpha рекомбинантными плазмидами, затем их культивируют в среде, содержащей пептон, дрожжевой экстракт, с принудительной аэрацией, контролем биомассы, порционным добавлением в ферментер чистого метанола в количестве 0,5-1% (объем/объем) относительно объема ферментации. Клетки разрушают экструзионным способом. Материал очищают путем диафильтрации, преципитации при пониженном рН, ионообменной хроматографии, градиентного центрифугирования, гель-фильтрации. При этом наряду с pH-HBs используют плазмиды: pSL-S1S2D2m133, pSL-HBc-530 или pSL-HBc531-PreS1-3x-PreS2. Существенным является комбинированное использование всех элементов, относящихся к структурным белкам вируса гепатита В. Изобретение позволяет получать вакцину, способную индуцировать широкий спектр противовирусных антител (анти-preS1, анти-pre82, анти-HBs и анти-НВс), относящихся к разным генотипам (серотипам, субтипам) вируса гепатита В, что позволяет применять вакцину в любых регионах мира. За счет использования компонентов, специфичных для preS областей и HBcAg (cor-антигена), вакцина может иметь и терапевтическое применение. 3 н.п. ф-лы, 5 ил., 1 табл., 4 пр.
1. Способ получения рекомбинантных очищенных структурных белков-антигенов для производства вакцины против гепатита В, включающий трансформацию клеток дрожжей Hansenula polymorpha рекомбинантными плазмидами, культивирование клеток-продуцентов в среде, содержащей пептон, дрожжевой экстракт, с принудительной аэрацией, контролем биомассы, порционным добавлением в ферментер чистого метанола в количестве 0,5-1% (объем/объем) относительно объема ферментации, разрушение клеток экструзионным способом, очистку материала путем диафильтрации, преципитации при пониженном рН, ионообменной хроматографии, градиентного центрифугирования, гель-фильтрации,
отличающийся тем, что наряду с pH-HBs используют плазмиды: pSL-S1S2D2m133, pSL-HBc-530 или pSL-HBc531-PreS1-3x-PreS2.
2. Применение антигенов, полученных способом по п.1 для получения вакцины для профилактики и лечения гепатита В, путем смешивания антигенов, полученных способом по п.1, в необходимой пропорции с последующей сорбцией на фармацевтически приемлемый адъювант.
3. Применение антигенов, полученных способом по п.1 для получения вакцины для профилактики и лечения гепатита В, путем сорбции антигенов, полученных способом по п.1, на фармацевтически приемлемый адъювант с последующим смешиванием сорбированных препаратов в необходимой пропорции.
| ВЕРЕМЕЙКО Т.А | |||
| и др | |||
| Гуморальный иммунный ответ мышей линии BALB/c, иммунизированных химерными белками HBcAg, несущими эпитопы поверхностного белка вируса гепатита В | |||
| Вопросы вирусологии, т.52, №1, январь-февраль 2007, с.40-45 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В (HBS AG), МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА СВ-HEPI, ПОВЕРХНОСТНЫЙ АНТИГЕН ВИРУСА ГЕПАТИТА В (HBS AG) И СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО КЛОНА 48/1/574, ПРОДУЦИРУЮЩЕГО МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА СВ-HEPI | 1992 |
|
RU2128707C1 |
Авторы
Даты
2012-12-20—Публикация
2011-08-23—Подача