Настоящее изобретение относится к новым модифицированным протеинам, способным образовывать устойчивые к понижающей регуляции С3-конвертазы, к последовательностям ДНК, кодирующим такие протеины, и к применению этих протеинов в качестве терапевтических агентов, в частности к их применению для уменьшения концентраций протеинов пути активации комплемента или для направления атаки комплемента (накопление С3b) в специфические сайты.
Система комплемента принимает участие в иммунном ответе у людей и других позвоночных и играет основную роль в эффекторных функциях, таких, как фагоцитоз, цитолиз и рекрутинг клеток, которые индуцируют местные воспалительные реакции [15]. Эти свойства являются желательными для элиминации внедряющихся в организм патогенов, таких, как бактерии, но нежелательными для запуска механизма воздействия на ткани хозяина (например, при пост-ишемическом реперфузионном повреждении [3]) или на чужеродный терапевтический материал (например, сверхострое отторжение ксенотрансплантатов [7]). Были предприняты попытки устранить эти нежелательные свойства путем применения производных регуляторных протеинов комплемента, нормальной функцией которых является подавление активации комплемента [10, 18].
Система комплемента включает протеины, которые находятся как на поверхности клеток (рецепторы и регуляторы), так и в жидкой фазе (плазма крови и другое внеклеточное окружение). Стадией, имеющей решающее значение для генерации ответов, является протеолитическое превращение С3 в фрагменты С3b и С3а. С3а представляет собой анафилатоксин, который, подобно С5а, привлекает тучные клетки к месту заражения, что приводит к местному выделению гистамина, расширению кровеносных сосудов и другим воспалительным реакциям. Образовавшийся С3b обладает способностью связываться с поверхностями, окружающими место его образования. Затем этот С3b фокусирует "атаку" цитолитических компонентов комплемента (С5-С9).
Связанный с поверхностью С3b и продукты его разложения функционируют в качестве лигандов для С3-рецепторов, опосредующих, например, фагоцитоз [15]. Существует два различных пути активации комплемента, оба из которых приводят к превращению С3 в С3b и к последующим реакциям. Классический путь обычно запускается комплексами антитела с антигеном, активирующих каскад, включающий протеины Clq, Clr, Cls, С2 и С4. Альтернативный путь зависит от петли активации, включающей сам С3, и он требует наличия факторов В и D.
Превращение С3 в С3b (или C3i) приводит к образованию продукта, который может соединяться с В-фактором с получением С3bВ (или C3iB). Для получения С3bВb эти комплексы действуют при участии D-фактора, который представляет собой С3-конвертазу, способную расщеплять большее количество С3 с образованием С3b, что приводит к увеличению образования С3bВb и к еще большему превращению С3. При определенных условиях комплекс С3bВb стабилизируется при связывании с пропердином (П), представляющим собой повышающий регулятор. Однако этот контур с положительной обратной связью обычно ограничен медленным "выключением процесса", вызванным регуляторными протеинами, в частности Н-фактором и I-фактором.
Фактор Н (и структурно близкие связанные с клеткой молекулы) (I) вытесняют В и Вb из С3b и (II) действуют в качестве кофактора I-фактора, который расщепляет С3b с образованем iC3b, тем самым предотвращая любую рекомбинацию с В-фактором, что позволяет получить большее количество С3-конвертаз. Этот путь запускается для усиленного продуцирования С3b в присутствии таких поверхностей, как стенки многих бактериальных клеток, которые связывают образующийся С3b и препятствуют его взаимодействию с факторами Н и I. Образовавшийся С3b также обладает способностью связываться с эндогенными клетками. Поверхности эндогенных клеток, обычно доступные для комплемента, дополнительно защищены связанными с мембраной регуляторами, такими, как МСР, DAF и CR1, которые действуют аналогично Н-фактору.
Известно несколько случаев, редко встречающихся в естественных условиях, когда нормальная регуляция в жидкой фазе не может происходить, а спонтанное превращение С3 в конечном итоге приводит к общей элиминации С3 из кровотока, а именно, (I) генетический дефицит фактора Н или I [13], (II) присутствие антител (нефритные факторы), которые связываются с С3bВb и препятствуют диссоциации [4], и (III) контакт с протеином яда кобры, называемым фактором яда кобры (CVF), который объединяется с В-фактором и образует фермент С3-конвертазу, который не содержит С3b и не подвержен воздействию факторов Н и I [14]. Эти данные иллюстрируют важность для нормальных физиологических реакций понижающей регуляции комплемента в отсутствие специфической активации.
Также известны случаи, когда специфическая активация происходит, но является нежелательной, в частности, когда она направлена против тканей хозяина (например, повреждение ткани при ишемии или хирургическом вмешательстве) или против чужеродного материала, специально введенного с терапевтическими целями (такого, как ксенотрансплантат, искусственный орган или диализная мембрана). Активация комплемента приводит к нежелательной атаке и дополнительному повреждению, поэтому в этих случаях представляется целесообразным блокировать или ингибировать активацию и ответ.
Существующие подходы по предотвращению опосредованного комплементом повреждения направлены на применение протеинов, обладающих понижающей регуляторной способностью (CR1, МСР, DAF и факторы Н и I) для ингибирования активации комплемента. Ингибиторы комплемента, такие, как I-фактор, Н-фактор и растворимые производные связанных с мембраной протеинов CR1, DAF, МСР, способны подавлять характерную для жидкой фазы петлю амплификации альтернативного пути. Поэтому были предприняты попытки использовать эти молекулы, в частности CR1 (который, вероятно, является наиболее активным), для снижения опосредованного комплементом повреждения в модельных физиологических ситуациях [10, 18].
Фактор Н представляет собой эндогенный фактор, который присутствует в плазме крови в высоких концентрациях (обычно 0,3-0,5 мг/мл [15]), и поэтому хотя повышенные концентрации ингибиторов могут снижать реакции в жидкой фазе, их активность является недостаточной, вследствие чего требуется вводить in vivo большие количества очищенных протеинов (например, более 5 мг растворимого CR1/кг веса тела). Кроме того, альтернативный путь активируется поверхностями, на которых действие Н-фактора уже затруднено. Хотя это не обязательно одновременно приводит к снижению активности других ингибиторов, можно предположить малую вероятность того, что эти факторы обладают полной или универсальной эффективностью.
Фактор яда кобры (CVF) обладает способностью продуцировать стабильную С3-конвертазу, которая в экспериментальных условиях in vivo может применяться для уменьшения уровня комплемента у животных in vivo и в других образцах (например, в плазме крови человека) in vitro. CVF обладает высокой активностью (например, 40 мкг/кг может нарушить активность комплемента мыши [16]). Однако имеются недостатки, которые делают его непригодным для терапевтического применения на людях.
Во-первых, его получают из яда кобры (что является труднодоступным и опасным источником), и, следовательно, он должен быть тщательно очищен от нейротоксинов яда. Также очевидны трудности в получении непосредственных источников яда. Эта проблема не может быть легко преодолена путем клонирования и экспрессии гена ex vivo, поскольку существуют посттрансляционные модификации, которые происходят в организме змей (специфический протеолитический процессинг), что может затруднить (или сделать невозможной) репродукцию in vitro. Кроме того, ферменты и условия разложения, необходимые для этого процессинга, в настоящее время неизвестны. Во-вторых, протеин является чужеродным по происхождению (для людей) и, следовательно, иммуногенным. Это исключает его повторное терапевтическое применение, что является необходимым для декомплементации пациента в течение многих недель (например, для того, чтобы дать прижиться ксенотрансплантату).
Хотя CVF обладает некоторыми структурными и функциональными гомологиями с человеческим С3 [17], он также обладает важными отличиями в обоих отношениях (например, отличается по строению цепи, месту биосинтеза, отсутствием чувствительности к регуляторам комплемента, по образованию стабильной С3-конвертазы). В настоящее время неизвестен эквивалент С3, который получен из иного источника, отличного от кобры, который может быть клонирован и секвенирован и который по общему строению и функции более сходен с С3 человека, чем CVF [8].
CVF представляет собой специфический для яда продукт из животного, чрезвычайно далекого в эволюционном плане от Homo sapiens. Поэтому не представляется целесообразным применять генетическое манипулирование для модификации этого протеина с целью его превращения в продукт, который может применяться и быть неиммуногенным для людей.
Авторами настоящего изобретения разработана альтернативная стратегия, в которой не используется физиологическая регуляция и которая вместо ингибирования активации комплемента приводит к суперактивации системы. Эта стратегия может применяться в двух случаях. Во-первых, она может использоваться in vivo для активации комплемента до тех пор, пока один или более компонентов не оказываются исчерпанными, что приводит к потере способности продуцировать локальные ответы на любое последующее вмешательство (такое, как ксенотрансплантат). Во-вторых, нерегулируемая суперактивация может быть преднамеренно локализована на конкретной мишени (например, вирусе или зараженной вирусом клетке) с целью повышения чувствительности этой мишени к разрушительным реакциям, которые опосредованы комплементом.
Понятие "регуляторы активации комплемента" в контексте настоящего описания включает все протеины, активность которых ингибирует усиление превращения С3, и подразумевается, что они не ограничены теми протеинами, гены которых локализованы в генетическом локусе RCA. Это понятие однако не включает "повышающие регуляторы", такие, как пропердин. Понятие "превращение С3" обозначает протеолитическое превращение С3 в С3b и С3а, если не указано иное, и понятие "С3-конвертаза" (или просто "конвертаза") обозначает фермент (обычно комплекс из двух или нескольких компонентов протеина, например, С3bВb, C3iBb, CVFBb или C4b2a), который катализирует эту реакцию.
Таким образом, первым предметом изобретения является протеин нативного пути активации комплемента, модифицированный таким образом, что протеин обладает способностью образовывать устойчивую к понижающей регуляции С3-конвертазу.
Понятие "нативный" обозначает встречающийся в естественных условиях, т.е. получаемый в природе. Таким образом, определение включает любой встречающийся в естественных условиях протеин пути активации комплемента, модифицированный, как указано выше. Подразумевается, что понятие не ограничено видоспецифичными протеинами. Другими словами, модифицированный человеческий протеин может применяться в качестве устойчивой к понижающей регуляции С3-конвертазы, например, в других видах млекопитающих. Обычно следует использовать модифицированные протеины пути активации комплемента этих же видов.
Модификация кодирующей последовательности ДНК С3, например, с использованием сайтнаправленного мутагенеза, может приводить к получению варианта С3, устойчивого к регуляторным протеинам комплемента, который еще сохраняет свои позитивные функциональные свойства (способность расщепляться С3-конвертазами с получением С3b) и особенности структурной целостности (правильное строение цепи и присутствие тиольной сложноэфирной связи). Настоящее изобретение, представленное в данном описании, относится к модифицированным генетическим путем формам нативных протеинов комплемента, например, к человеческому С3, С3b-фрагмент которого приобретает способность становиться устойчивым к физиологической регуляции комплемента. В результате такой устойчивости эти молекулы могут образовывать стабилизированные формы соответствующей С3-конвертазы, что приводит к усиленному превращению С3 в С3b и к последующему разложению продуктов в физиологических условиях (например, in vivo).
В предпочтительном варианте осуществления изобретение относится к модифицированному человеческому протеину С3, который обладает устойчивостью к расшеплению I-фактором.
Это может достигаться путем модификации остатков протеина в протеолитических сайтах.
Особенно предпочтительным вариантом является модифицированный человеческий протеин С3, который модифицирован путем замены либо Arg-1303, либо Arg-1320, либо их обоих на другую аминокислоту. Другая аминокислота может представлять собой тирозин, цистин, триптофан, глутамин, глутаминовую кислоту или глицин. Предпочтительна замена Arg-1303 глутаминовой кислотой или глицином (менее предпочтительна глутамином). Предпочтительна замена Arg-1320 глутамином.
Другие стратегии получения стабильных модифицированных протеинов по изобретению включают:
I) Пониженную чувствительность к ингибиторным действиям фактора Н и родственных протеинов (например, МСР, DAF, CR1). Например, в человеческом С3 остатки 767-776 и 1209-1271 вовлечены в связывание Н-фактора [21, 24] и замена одного или нескольких этих остатков или других остатков, также связанных с действием этих протеинов, может снизить связывание одного или нескольких из этих регуляторных протеинов.
II) Пониженную скорость диссоциации С3bВb. Могут быть интродуцированы мутации, которые будут усиливать взаимодействие между С3b и Вb. Результатом этого может быть как снижение спонтанной деструкции фермента, так и снижение эффективности Н-фактора (и родственных регуляторов) при вытеснении Вb из С3b.
Эти мутации необходимы для снижения скорости как спонтанной, так и опосредованной Н-фактором деструкции С3bВb. Даже при отсутствии Н-фактора время полужизни комплекса С3bВb в жидкой фазе при 37° С в присутствии пропердина составляет только примерно 10 мин [6].
III) Остатки 752-761 человеческого С3 участвуют в связывании В-фактора. Эта область представляет собой высококонсервативную область в С3 и в С4 обнаружена близкородственная к ней последовательность. Поскольку С4 связывает гомолог В-фактора С2, выраженное сходство этой области в С3 и С4, наряду с ее высокой консервативностью в С3, дополнительно подтверждает ее роль в С3 в качестве сайта связывания В-фактора. Таким образом, изменения в этой области могут влиять на аффинность к В и на стабильность С3bВb.
IV) Устойчивость к другим регуляторам активации комплемента, таким, как CR1, DAF и МСР, также является желательной. Механизм действия всех этих регуляторов аналогичен таковому Н-фактора, и поэтому дополнительный мутагенез не требуется. Аналогично этому некоторые патогенные организмы экспрессируют свои собственные ингибиторы активации комплемента, которые часто структурно и функционально гомологичны Н-фактору (например, секреторный пептид вируса осповакцины (Vaccinia)). Эти молекулы защищают внедряющийся вид от иммунных ответов, и поэтому может оказаться целесообразной атака на них с помощью направленного действия ферментов С3-конвертаз, устойчивых к указанной защите.
V) Мутации, усиливающие стабилизацию С3-конвертазы пропердином. Активность пропердина состоит в стабилизации комплекса С3bВb, в замедлении спонтанной и зависящей от Н-фактора диссоциации. Эта стабилизация неэффективна в жидкой фазе, но, вероятно, является более важной для усиления процесса, если он уже начат на соответствующей активирующей поверхности [5]. Возрастание этой активности (путем увеличения его аффинности) может нарушить баланс в жидкой фазе и тем самым усилить спонтанное превращение С3. Это должно быть особенно важным в сочетании с другими описанными выше модификациями.
VI) Мутации, которые препятствуют приобретению С3bВb С5-конвертазной активности. Истощение активного С3 в кровотоке обычно сопровождается нежелательным побочным эффектом, т.е. получением больших количеств анафилактических пептидов. Наиболее активным из них является С5а, который получается в результате расщепления С5 с помощью некоторых ферментов С3-конвертаз. Эта реакция, вероятно, зависит от аффинности конвертазы к другой молекуле С3b [11] и поэтому может подвергаться подавлению с помощью мутаций С3, которые устраняют это взаимодействие.
VII) Улучшенная активность С3-конвертазы. Активный сайт С3bВb фермента С3-конвертазы находится в Вb-области. Фукциями компонента С3b, вероятно, являются придание активной конформации Вb и/или связывание и ориентация субстрата, на который воздействует Вb. Механизм этого явления пока не известен, но в любом случае в данном случае существует возможность для усиления активности конвертазы посредством мутаций в С3.
VIII) Экспрессия в фунционально активной форме. Для С3 дикого типа необходимо превращение в С3b до того, как он может быть объединен в новый комплекс с С3-конвертазой. Для превращения в С3b (или в C3i) in vivo необходимо замедление действия модифицированного С3. Следовательно, желательно либо введение протеина в форме, способной немедленно формировать конвертазу, либо введение предварительно сформированных комплексов конвертазы. Поэтому представляется целесообразным получить функционально активный С3b-подобный реагент ex-vivo. Это может быть достигнуто in vitro (например, путем протеолиза).
IX) Модификации нативного протеина, которые служат для интродукции новых сайтов расщепления таким образом, что пептидные области, необходимые для связывания В-фактора, сохраняются, а области, необходимые исключительно для связывания Н-фактора, могут быть специально удалены. Например, могут быть интродуцированы такие сайты, что С3b-подобная форма модифицированного С3 может быть дополнительно расщеплена с получением формы, которая все еще связывает В-фактор, но обладает меньшей чувствительностью к инактивации факторами Н и I.
X) Модификации в других областях, которые могут влиять на взаимодействие С3b с В-фактором и/или с Н-фактором.
Изобретение основано на пересмотре традиционного подхода и основано на стимулировании превращения С3 для уменьшения С3, что приводит к выведению из строя системы. Дополнительной областью применения изобретения является возможность стимулировать превращение С3 в определенном месте нахождения и, следовательно, привлечь зависящие от комплемента эффекторные механизмы для атаки на специфическую мишень.
Таким образом, окончательным эффектом должно быть увеличение количества случаев превращения С3, когда модифицированный протеин вводят в физиологическую среду (например, в кровь), содержащую регуляторы активации комплемента. Затем эта активность может использоваться либо для уменьшения в этой среде нативного С3, либо для локализации превращения С3 на требуемой мишени.
Аналог С3, С3b-фрагмент которого устойчив к воздействиям I-фактора (например, производное, описанное в примере 1), должен связывать В-фактор, который затем должен быть расщеплен D-фактором и в конце концов диссоциирован до неактивной формы. В отсутствие инактивации I-фактором модифицированный С3b должен обладать способностью повторно связывать новые молекулы В-фактора и тем самым усиливать свою инактивацию. Следовательно, другим потенциальным применением модификаций, описанных в данном изобретении, может быть инактивация альтернативного пути с помощью исчерпывания активности В-фактора. Аналогичный подход может также применяться к модификации С4 для усиления расхода С2 и тем самым выведения из строя классического пути активации комплемента.
Изобретение включает любую другую протеазу, применяемую аналогично ферменту С3bВb, которая приводит к расщеплению С3 до С3b, несмотря на присутствие регуляторов активации комплемента.
Изобретение также включает последовательности ДНК, которые кодируют протеин по изобретению, а также конструкции ДНК, содержащие такие последовательности ДНК.
Понятие "последовательности ДНК" включает все другие нуклеотидные последовательности, которые благодаря вырожденности генетического кода, также кодируют данную аминокислотную последовательность, или которые практически гомологичны этой последовательности. Эти последовательности, таким образом, также подпадают под объем изобретения.
Нуклеотидные последовательности, которые являются "практически гомологичными", также подпадают под объем настоящего изобретения. "Практическая гомологичность" может рассматриваться либо на нуклеотидном уровне, либо на аминокислотном уровне. На нуклеотидном уровне последовательностями, имеющими значительную гомологию, могут считаться таковые, которые гибридизуются с нуклеотидными последовательностями по изобретению в строгих условиях (например, при температуре 35-65° С в растворе соли концентрации примерно 0,9М). На аминокислотном уровне последовательность протеина может считаться существенно гомологичной другой последовательности протеина, если значительное количество конститутивных аминокислот обладает гомологией. Могут быть гомологичными (в возрастающем порядке по предпочтительности) по крайней мере 55%, 60%, 70%, 80%, 90%, 95% или даже 99% аминокислот.
Как указано выше, протеины по изобретению могут применяться для достижения эффектов локализованной активации комплемента. Одним из путей, обеспечивающих это, является конъюгация протеина с фрагментом, который должен связываться с требуемой мишенью. Таким образом, вторым предметом изобретения является конъюгат, содержащий протеин по изобретению, сшитый со специфичным связывающим фрагментом, например со специфичным связывающим протеином. Примером такого протеина может быть антитело или его антигенсвязывающий фрагмент.
Протеины по изобретению предназначены для введения субъекту для достижения требуемого терапевтического эффекта. Поэтому изобретение также включает:
а) протеин по изобретению, предназначенный для применения в терапии;
б) применение протеина или конъюгата по изобретению для изготовления лекарственного средства, предназначенного для уменьшения уровней протеинов пути активации комплемента, и, в частности, применение для предупреждения отторжения чужеродного материала;
в) фармацевтическую композицию, содержащую один или несколько протеинов или конъюгатов по изобретению вместе с одним или с несколькими фармацевтически приемлемыми носителями и/или эксципиентами; и
г) способ уменьшения протеинов пути активации комплемента у млекопитающего, включающий введение млекопитающему протеина по изобретению, предпочтительно в форме фармацевтической композиции.
Фармацевтические композиции могут быть в виде стандарных дозируемых форм, содержащих предварительно определенное количество действующего вещества в дозе. Такая стандартная доза может содержать как минимум, например, 1 мг действующего вещества и предпочтительно 2-3 мг. Верхний предел, которого может достигать такая стандартная доза, будет зависеть от многих факторов, таких, как подлежащее лечению состояние, путь введения и возраст, вес и состояние пациента, а также от экономических факторов. Например, стандартная доза может содержать 10 мг или даже 100 мг действующего вещества.
Протеины по изобретнию могут применяться in vivo для выведения из строя системы комплемента. Это может оказаться целесообразным в следующих обстоятельствах:
(а) С целью предотвращения опосредованной комплементом деструкции или повреждения трансплантата, в частности ксенотрансплантата (материала, трансплантированного из других видов животных), и особенно дискордантного ксенотрансплантата (когда виды донора и реципиента являются дискордантными (несовпадающими)). У реципиента предварительно до операции должно быть проведено удаление комплемента, и он должен находиться в таком состоянии до тех пор, пока либо не произойдет аккомодация трансплантата, либо он будет заменен на более совместимый орган.
Первоначальное лечение должно быть проведено в течение нескольких дней до трансплантации. Дополнительное удаление комплемента может потребоваться во время кризиса отторжения. Лечение может проводиться с использованием антигистаминных препаратов для борьбы с общими воспалительными реакциями (например, с расширением кровеносных сосудов), вероятно, являющихся результатом производства С3а и/или С5а.
Удаление комплемента также может оказаться целесообразным при использовании искусственных органов или тканей (например, диализных мембран искусственной почки), что активирует систему комплемента. Как описано ранее, протеин может применяться либо в неактивированной форме, функционально подобной С3b-форме, либо в виде предварительно образованной активной С3-конвертазы (типа С3bВb). Эти формы могут вводиться с помощью любого пути, причем активная конвертаза должна встречаться с находящимся в кровотоке С3 (например, вводиться внутривенно, подкожно и т.д.).
Другим альтернативным способом может быть обработка ex vivo, например, путем трансфузии крови через матрикс, несущий активную конвертазу. Это может иметь преимущество, состоящее в том, что анафилактические пептиды (С3а и С5а) и другие низкомолекулярные медиаторы воспаления (наприимер, гистамин и оксид азота) могут быть удалены (например, путем диализа) до того, как кровь (или плазма) с удаленным комплементом будет возвращена пациенту.
(б) С целью предотвращения опосредованного комплементом повреждения, являющегося результатом крупного хирургического вмешательства. У пациента должен быть удален комплемент, как описано выше, предпочтительно до операции (но, если необходимо, после нее), и он должен находиться в таком состоянии до тех пор, пока не будет устранена опасность дополнительного внутреннего повреждения вследствие зависящей от комплемента иммунной атаки.
(в) С целью минимизации опосредованного комплементом повреждения, являющегося результатом нехирургического поражения. В этих случаях удаление комплемента должно быть осуществлено после первичного поражения, но композиции и методы введения, вероятно, в целом должны соответствовать описанным выше. Это может быть особенно целесообразным, когда восстановление включает реперпузию ишемической ткани путем циркуляции (например, ишемия миокарда, отморожения, ожоги и т.д.).
(г) С целью минимизации опосредованного комплементом повреждения, являющегося результатом взаимодействий антитело-антиген. Опосредованные комплементом защитные реакции являются особенно нежелательными при аутоиммунных заболеваниях, которые включают гломерулонефрит, гемолитическую анемию, перемежающуюся хромоту, диабет типа I, ревматоидный артрит и рассеянный склероз. Выведение из строя системы комплемента во время серьезных стадий заболевания может облегчить состояние, что может быть осуществлено, например, путем локального введения в сустав при ревматоидном артрите.
(д) С целью увеличения чувствительности специфической патогенной мишени к опосредованным комплементом иммунным механизмам. При этом подходе целью является не применение суперактивной С3-конвертазы для достижения общего уменьшения С3, а вместо этого для обеспечения превращения С3 в требуемой мишени конвертазу применяют локально. Мишень может представлять собой патогенный организм, такой, как бактерия, вирус или другой паразит, или вредоносную клетку-хозяина или ткань, такую, как клетка опухоли или инфицированная вирусом клетка. С3-конвертаза может быть локализована в мишени либо путем местного нанесения (например, возможна прямая инъекция в среду, которая задерживает ее распределение в общем кровотоке), либо путем объединения с направляющим фрагментом, например, антителом. Так, например, модифицированный протеин может быть сшит со специфическим иммуноглобулином либо с помощью химического перекрестного сшивания протеинов, либо путем объединения кодирующих последовательностей ДНК и экспрессии (и очистки) слитого протеина (например, в случае IgG, либо тяжелая, либо легкая цепь должна быть связана с С3 и совместно экспрессироваться с С3, или обе цепи могут быть объединены в одном полном слитом полипептиде), либо путем включения специфических кодирующих последовательностей (например, для доменов, подобных лейциновой "молнии") в ДНК обоих участвующих в слиянии партнеров (например, модифицированного
С3 и специфического антитела) таким образом, что экспрессируемые продукты при смешении вместе сами связываются между собой, образуя стабильные конъюгаты. Слитый протеин может затем вводиться локально или в общий кровоток.
Липосомы (несущие антитело на поверхности с модифицированным протеином, находящимся либо на поверхности или внутри липосомы) и/или вирионы (например, сконструированные для экспрессии протеинов на их поверхности) также могут применяться для совместной доставки антитела и модифицированного протеина. Эта стратегия может использоваться непосредственно, одна или в сочетании с другими системами обработки, на любой стадии заболевания. Может оказаться особенно целесообразно применять ее для элиминации любых раковых клеток, сохранившихся в кровотоке после удаления опухоли хирургическим путем. Конъюгаты антитела с модифицированным протеином также могут применяться ex vivo для элиминации патогенной ткани. Например, для уничтожения клеток лейкемии в экстрактах костного мозга и последующего возвращения оставшихся здоровых клеток пациенту.
В альтернативном варианте лимфоциты, которые не подходят к типам главного комплекса гистосовместимости (МНС) реципиента, могут быть удалены из костного мозга до трансплантации. Кроме того, модифицированный протеин может быть сшит с антигеном, и эта комбинация может применяться либо in vivo, либо ех vivo, для атаки на лимфоциты с ненужной реакционной способностью (например, против трансплантированной или собственной ткани).
Такая же методика может применяться для лечения других видов с использованием либо производного человеческого модифицированного протеина, либо подобного аналога, сконструированного специально для этих видов.
Предпочтительные характеристики каждого предмета изобретения являются также предпочтительными и для каждого другого предмета изобретения mutatis mutandis (при внесении соответствующих изменений).
Ниже изобретение поясняется на примерах, которые не направлены на ограничение объема изобретения, со ссылкой на прилагаемые чертежи.
На фиг.1 показана теоретически предсказанная последовательность протеина человеческого С3, закодированного в РС3 (использован стандартный однобуквенный код для аминокислот).
На фиг.2 показана последовательность кДНК в РС3 (использован стандартный однобуквенный код для дезоксинуклеотидов смысловой цепи, записано в направлении 5’-3’).
На фиг.3 показана визуализация модифицированных протеинов по изобретению.
На фиг.4 показано воздействие различных мутаций в человеческом С3, приводящих к замене Arg1303 или Arg1320, на опосредованное I-фактором расщепление в этих сайтах.
Примечание:
1) образцы, меченные биосинтетическим путем с помощью [35S],
2) реакции проведены при нормальной ионной силе,
3) иммуноосаждение с помощью анти-С3,
4) ДСН-ПААГ в восстанавливающих условиях,
5) авторадиогарфия.
На фиг.5 показана увеличенная устойчивость человеческого С3, имеющего мутацию Arg1303 → Gln1303, по отношению к инактивации факторами I и Н.
На фиг.6 показан анализ расщепления С3-конвертазой, имеющей мутации на остатках 752-754 и 758-760.
Представлена фотография вестерн-блоттинга, проведенного в 7,5%-ном полиакриламидном ДСН-ПААГ-геле (восстанавливающие условия), после электрофоретического переноса на нитроцеллюлозу, зондирования овечьим античеловеческим антителом к С3 и применения пероксидазы из хрена, сшитой с антиовечьим иммуноглобулином, и субстратов, усиливающих хемилюминесценцию "Enhanced ChemiLuminescence" (метод и реагенты для определения поставляются фирмой Amersham, Великобритания), запечатленная на рентгеновскую пленку. Реакции расщепления и определение проводили согласно примеру 4 при сопоставлении с результатами, приведенными на фиг.3.
Пояснение:
Дорожки 1-4: С3 дикого типа (экспрессирован в клетках COS).
Дорожки 5-8: Мутантный С3 (остатки 752-754 заменены на Gly-Ser-Gly и остатки 758-760 также заменены на Gly-Ser-Gly) (экспрессирован в клетках COS).
Дорожки 1,5: без добавления.
Дорожки 2, 6: + CVFBb.
Дорожки 3, 7: + факторы Н+I.
Дорожки 4, 8 + CVFBb + факторы H+I.
Полосы, обозначенные стрелками, соответствуют следующим:
А: альфа-цепь С3,
В: альфа’-цепь С3,
С: бета-цепь С3,
D: продукт расщепления альфа’-цепи С3 с молекулярной массой 68 кДа Е: тяжеля цепь IgG.
На фиг.7 показан анализ расщепления радиоактивномеченного В-фактора D-фактором в присутствии С3 дикого типа и мутантного С3 (С3i).
Приведена фотография авторадиографического исследования ДСН-ПААГ-геля. Все образцы содержали D-фактор и меченный с помощью 225I В-фактор и их инкубировали в течение 3 ч при 37° С.
Образцы в пронумерованных дорожках также включали:
1) только буфер,
2) разбавление 1/125 С3 дикого типа,
3) разбавление 1/25 С3 дикого типа,
4) разбавление 1/5 С3 дикого типа,
5) разбавление 1/25 мутантного С3 (остатки 1427 Gln, 1431 Asp и 1433 Gln),
6) разбавление 1/5 мутантного С3,
7) неразбавленный мутантный С3,
Полосы, обозначенные стрелками, соответствуют следующим:
А. Нерасщепленный меченный с помощью 125I В-фактор (93 кДа).
B. Расщепленный продукт 60 кДа ("Вb").
С: Расщепленный продукт 33 кДа ("Ва").
На фиг.8 показано исследование с помощью ДСН-ПААГ, иллюстрирующее образование конъюгата между C3i и IgG.
Результат получен при окрашивании с помощью кумасси (Coomassie) 4%-ного акриламидного ДСН-ПААГ-геля при разгонке в невосстанавливающих условиях.
Пронумерованные дорожки содержат следующие образцы:
1. PDP-IgG
2. C3i
3. PDP-IgG + реакционную смесь с C3i
Стрелками показаны:
А. Возможный конъюгат C3i-IgG (350 кДа)
В. C3i (200 кДа)
С. IgG (150 кДа)
На фиг.9 показано, что конъюгат направляет активность С3-конвертазы против овечьих эритроцитов.
На этом графике представлен % лизированных овечьих эритроцитов после сенсибилизации разбавлениями конъюгата C3i-IgG, PDP-IgG или C3i с последующей промывкой, получения С3-конвертаз с помощью пропердина и факторов В и D и окончательного проведения лизиса с помощью NGPS в CFD/ЭДТК, как описано в методах. Лизис вызывается только конъюгатом, и этот лизис зависит от дозы.
На фиг.10 и 11 показаны особенности расщепления мутанта С3 DV-1AM (см. примеры 12-14).
Применительно к фиг.10 супернатанты клеток COS, содержащие экспрессированный С3 дикого типа (А) и мутант С3 DV-1AM (В), обрабатывали с помощью 1) оставляли без обработки; 2) CVFBb; 3) 10 мкг/мл I-фактора и 50 мкг/мл Н-фактора; или 4) CVFBb плюс 10 мкг/мл I-фактора и 50 мкг/мл Н-фактора, подвергали иммуноосаждению, анализировали с помощью ДСН-ПААГ (в указанных дорожках) и переносили с помощью электроблоттинга на нитроцеллюлозу, как описано в примере 4. В этом случае блоттинг проводили, используя комбинацию крысиных моноклональных антител Clone-3 и Clone-9, которые реагируют с С3dg-областью С3 и ее фрагментированными продуктами (Lachmann PJ. и др., J. Immunol. 41:503 (1980)), а затем пероксидазу из хрена, сшитую с анти-крысиным иммуноглобулином (от фирмы Sigma), и выявляли, используя ECL-реагенты и инструкции, поставляемые фирмой Amersham.
Применительно к фиг.11 супернатанты клеток COS, содержащие экспрессированный мутант С3 DV-1B (А), С3 дикого типа (В) и мутант С3 DV-6 (С), обрабатывали с помощью 1) оставляли без обработки; 2) 10 мкг/мл I-фактора и 50 мкг/мл Н-фактора; 3)CVFBb; 4) CVFBb плюс 10 мкг/мл I-фактора и 2 мкг/мл Н-фактора; 5) CVFBb плюс 10 мкг/мл I-фактора и 10 мкг/мл Н-фактора; или 6) CVFBb плюс 10 мкг/мл I-фактора и 50 мкг/мл Н-фактора, подвергали иммуноосаждению, анализировали с помощью ДСН-ПААГ (в указанных дорожках), переносили с помощью электроблоттинга на нитроцеллюлозу и обнаруживали с помощью поликлональных овечьих антител к С3, как описано в примере 4.
На фиг.12 показан анализ продукта, родственного С3 и полученного в результате мутации "сдвига рамки считывания". Этот продукт обозначен как HDV-3X. Результаты, полученные для HDV-3X, сопоставляют с результатами, полученными для DV-3, который подобно HDV-3X включает мутации T1031G, E1032N, Q1033H, E1035N и K1036I, но в отличие от HDV-3X не модифицирован на С-конце.
Супернатанты клеток COS, содержащие экспрессированный мутант С3 DV-3 (А) и мутант С3 HDV-3X (В), обрабатывали с помощью 1) оставляли без обработки; 2) CVFBb + 10 мкг/мл I-фактора; 3) CVFBb + 10 мкг/мл I-фактора + 1 мкг/мл Н-фактора; 4) CVFBb + 10 мкг/мл I-фактора + 5 мкг/мл Н-фактора; 5) CVFBb + 10 мкг/мл I-фактора + 25 мкг/мл Н-фактора, подвергали иммуноосаждению, анализировали с помощью ДСН-ПААГ (в указанных дорожках) и переносили с помощью электроблоттинга на нитроцеллюлозу, как описано в примере 4. В этом случае блоттинг проводили, используя комбинацию крысиных моноклональных антител Clone-3 и Clone-9, которые реагируют с С3dg-областью С3 и ее фрагментированными продуктами (Lachmann P.J. и др., 1980, J. Immunol. 41: 503), а затем пероксидазу из хрена, сшитую с антикрысиным иммуноглобулином (от фирмы Sigma), и выявляли, используя ECL-реагенты и инструкции, поставляемые фирмой Amersham.
На фиг.13 показаны результаты эксперимента, в котором супернатанты клеток COS, содержащие экспрессированные мутанты С3 E1Q2 (A), E1Q2QG3 (В) и E1Q2E3 (С), обрабатывали (при 37° С, 2,5 ч) с помощью 1) CVFBb + 10 мкг/мл I-фактора; 2) CVFBb + 10 мкг/мл I-фактора + 50 мкг/мл Н-фактора; 3) CVFBb + 10 мкг/мл I-фактора + 25 мкг/мл sCRl, подвергали иммуноосаждению, анализировали с помощью ДСН-ПААГ (в указанных дорожках) и переносили с помощью электроблоттинга на нитроцеллюлозу, как описано в примере 4. В этом случае блоттинг проводили, используя комбинацию крысиных моноклональных антител Clone-3 и Clone-9, как описано в примере 12, а затем пероксидазу из хрена, сшитую с антикрысиным иммуноглобулином (от фирмы Sigma), и выявляли, используя ECL-реагенты и инструкции, поставляемые фирмой Amersham.
Полоса, соответствующая 86 кДа (обозначен стрелкой), представляет собой продукт расщепления, опосредованного I-фактором, в третьем сайте, если ранее не было расщепления в сайтах 1 или 2.
На фиг.14 показаны результаты эксперимента, в котором супернатанты клеток COS, содержащие экспрессированные мутанты С3 NC3 (A), FT-1 (В), FT-2 (С), FT-3 (D), FT-4 (Е) и FT-5 (F), обрабатывали (при 37° С, 2,75 ч) с помощью 1) оставляли без обработки; 2) CVFBb + 10 мкг/мл I-фактора + 50 мкг/мл Н-фактора, подвергали иммуноосаждению, анализировали с помощью ДСН-ПААГ (в указанных дорожках) и переносили с помощью электроблоттинга на нитроцеллюлозу, как описано в примере 4. В этом случае блоттинг проводили, используя комбинацию крысиных моноклональных антител Clone-3 и Clone-9, как описано в примере 12, а затем пероксидазу из хрена, сшитую с антикрысиным иммуноглобулином (от фирмы Sigma), и выявляли, используя ECL-реагенты и инструкции, поставляемые фирмой Amersham.
На фиг.15 показаны результаты эксперимента, в котором супернатанты клеток COS, содержащие экспрессированные мутанты С3 NC3 (A), FR-1 (В), FR-2 (С), FR-3 (D), FR-4 (Е) и FT-2 (F), обрабатывали (при 37° С, 2,5 ч) с помощью 1) оставляли без обработки; 2) CVFBb + 10 мкг/мл I-фактора + 50 мкг/мл Н-фактора, подвергали иммуноосаждению, анализировали с помощью ДСН-ПААГ (в указанных дорожках) и переносили с помощью электроблоттинга на нитроцеллюлозу, как описано в примере 4. В этом случае блоттинг проводили, используя комбинацию крысиных моноклональных антител Clone-3 и Clone-9, как описано в примере 12, а затем пероксидазу из хрена, сшитую с антикрысиным иммуноглобулином (от фирмы Sigma), и выявляли, используя ECL-реагенты и инструкции, поставляемые фирмой Amersham.
Для облегчения ссылок ниже приведена взаимосвязь между группами пунктов формулы изобретения, которые относятся к определенным протеинам, способным действовать в качестве устойчивых к понижающей регуляции С3-конвертаз, и примерами и таблицами настоящего описания:

Приведенные ниже стандартные методы и определения применимы для всех примеров.
Все компоненты комплемента обозначены в соответствии с таковыми человека, если не указано иное, с использованием стандартной терминологии для всех протеинов и фрагментов, которые являются их производными (например, в соответствии со ссылкой [15]). Кроме того, понятие "C3i" относится к любой молекулярной форме С3 без интактной тиольной сложноэфирной связи, но сохранившей полипептид С3а на альфа-цепи.
кДНК человеческого С3 и кодирующая последовательность пронумерованы в соответствии с фиг.2 с использованием нумерации, принятой в базе данных нуклеотидов EMBL (согласно ссылке [2]). Приведенная последовательность представляет собой конструкцию авторов (′ РС3’), в которой отсутствуют первые 11 нуклеотидов 5’-нетранслируемой области, приведенной в ссылке [2], и поэтому первое основание имеет номер 12. Предполагаемый инициирующий кодон представляет собой нуклеотиды с номерами 61-63, кодон для N-концевого остатка серина бета-цепи представлен нуклеотидами 127-129 и кодон для N-концевого остатка серина альфа-цепи представлен нуклеотидами 2074-2076.
Последовательность протеина пронумерована в соответствии с нумерацией последовательности-предшественника, как показано на фиг.1, в соответствии с трансляцией теоретически предсказанной последовательности ДНК, приведенной в приложении (предполагается, что аминокислоты 1-22 содержат сигнальную последовательность, которую удаляют в процессе биосинтеза, и предполагается, что аминокислоты 668-671 могут быть удалены при расщеплении предшественника на альфа- и бета-цепи).
Следующие сокращения имеют указанные ниже значения: CVF означает фактор яда кобры; ELISA означает твердофазный иммуноферментный анализ; Е. coli означает Escherichia coli; т.п.н. означает длину в тысячах пар нуклеотидов; HSV-1 означает вирус простого герпеса типа I; ЗФР означает забуференный фосфатом физиологический раствор, COS-1 означает линию клеток, происходящую из клеток почки обезьяны. Ниже приведены рестрикционные эндонуклеазы: AflII, DraI, DraIII, EcoRI, EcoRV, HindIII, NaeI, NheI, XbaI.
Стандартные методы
Стандартные методы молекулярной биологии, такие, как выделение плазмид, электрофорез в агарозном геле и лигирования ДНК, могут быть обнаружены в ссылке [21]. Двухцепочечную ДНК секвенировали с использованием набора "Sequenase version 2.0", поставляемого фирмой United States Biochemicals. Экспрессию С3 определяли с помощью анализа ELISA с использованием пластиковых планшетов, предварительно покрытых (сенсибилизированных) очищенным с помощью аффинной хроматографии поликлональным овечьим антителом к человеческому С3, к которому добавляли образцы супернатанта культуры. Связывание С3 определяли с помощью моноклонального антитела крысы к С3, конъюгированному с щелочной фосфатазой, и хромогенного субстрата, пара-нитрофенолфосфата. Образцы калибровали с помощью очищенного С3 плазмы человека.
Методы очистки протеинов комплемента и CVF и получения препаратов очищенных с помощью аффинной хроматографии антител к С3, применяемые при анализе, можно обнаружить в ссылке [28]. Эквивалентные реагенты также могут быть получены от фирмы Sigma chemical company LTD.
Кодирующая последовательность кДНК С3
Кодирующую последовательность кДНК С3 по изобретению конструировали из двух сегментов, выделенных из случайным образом примированной библиотеки кДНК печени человека в векторе pGEM4 (фирмы Promega). Пять олигодезоксинуклеотидов, соответствующих известным сегментам в кодирующей последовательности человеческого С3, радиоактивно метили с помощью полинуклеотидкиназы Т4 и [γ -32Р]АТФ и применяли для зондирования перенесенной на фильтры библиотеки из агарозных пластин. Выделяли два клона, содержащие вставки (инсерты) длиной приблизительно 4 т.п.н. Расщепление рестриктазами, гибридизация со специфичными олигонуклеотидными зондами и частичный анализ последовательности показали, что один из этих клонов (‘А13’) включал 5’-конец транскрипта длиной 5,1 т.п.н., а другой (‘В44’) располагался вплоть до 3’-конца.
Таким образом, эти вставки перекрывались на участке длиной приблизительно 3 т.п.н., включающем уникальный сайт рестрикции EcoRI. Неполную 5’-область А13 отщепляли с помощью EcoRI и NheI и замещали полным сегментом, выделенным из В44 с помощью расщепления EcoRI и XbaI. Оба фрагмента очищали с помощью гель-электрофореза на агарозе с низкой температурой плавления перед лигированием ДНК-лигазой Т4 с получением вектора (‘PGC3’), содержащего фрагмент ДНК, кодирующий полный протеин-предшественник С3, длиной 5,1 т.п.н..
Последовательности-линкеры 5’-конца кодирующей области С3 содержали два ATG, которые представляют собой ложные стартовые кодоны трансляции. Поэтому их удаляли с помощью гэп-плазмидного мутагенеза, как описано в методе примера 1, с использованием олигодезоксинуклеотида PL-ATC-3 (tagggagacc ggaagcttgc cctctccctc tgtccctctg t), что привело к делеции приблизительно 50 пар оснований ДНК линкера/адаптера, без изменения кодирующей последовательности С3. Этот мутантный вектор длиной 7,7 т.п.н., содержащий фрагмент последовательности кДНК С3 длиной 5,1 т.п.н. плюс последовательноть вектора PGEM4 длиной 2,6 т.п.н. (фирмы Promega), обозначен в настоящем описании как РС3.
Кодирующую область С3 плазмиды PGC3 секвенировали полностью и обнаружили только 4 отличия от ранее опубликованной последовательности кДНК человеческого С3 (аллель "S") [2]:
(I) замены C2481→ G и С2805→ Т не изменяют кодирование;
(II) замена Т1001→ С кодирует ранее описанную полиморфную форму HAV 4-1 (замена: лейцин 314→ пролин) [20]; и
(III) замена G2716→ A кодирует замену: валин 886 → изолейцин, что ранее не было описано для человеческого С3, хотя Il обнаружен в этом положении в С3 мыши и крысы.
Последовательность по изобретению включает стартовый и стоп-кодоны с полной сигнальной последовательностью и, следовательно, должна кодировать функционально активный С3.
С помощью анализа ELISA в супернатантах культур клеток COS-1 (зараженных с использованием липофектамина и экспрессирующего вектора pcDNA3 фирмы Invitrogen) экспрессируемый С3 дикого типа обнаружен в концентрации до 1,7 мкг/мл. Клетки, зараженные одним вектором pcDNA3, не продуцировали С3 в количестве, которое можно обнаружить. Кроме того, анализ экспрессируемого продукта с помощью реакций расщепления с последующей иммунопреципитацией, ПААГ-ДСН и иммуноблотинга показали, что:
(I) первичный продукт трансляции был правильно процессирован в зрелую двухцепочечную форму;
(II) этот продукт подобно нативному С3 мог быть расщеплен С3-конвертазой (CVFBb) с получением С3b; и
(III) экспрессируемый протеин, подобно нативному С3, не расщеплялся фактором Н плюс I, но становился расщепляемым после превращения в С3b с использованием фермента С3-конвертазы. Эти данные подтверждают, что исходная плазмида по изобретению может транслироваться в функционально активный С3.
Для получения данных об альтернативном пути конструирования и экспрессии кодирующей последовательности С3 смотри ссылку [25].
Пример 1: Получение С3, в котором остатки аргинина в обоих сайтах расщепления, распознаваемых I-фактором (положения на аминокислотной последовательности 1303 и 1320), заменены остатками глутамина с целью предотвращения расщепления фрагмента С3b I-фактором.
а) Мутагенез
В качестве мутагенов использовали олигодезоксинуклеотиды QRI1 (caactgcccagccaaagctccaagatcacc), QRI2 (gccagcctcctgcaatcagaagagaccaag) и AFL4149 (taataaattcgaccttaaggtcaccataaaac), а также соответствующие антисмысловые олигодезоксинуклеотиды QRI1n (ggtgatcttggagctttggctgggcagttg), QRI2n (cttggtctcttctgattgcaggaggctggc) и AFL4149n (gttttatggtgaccttaaggtcgaatttatta).
QRI1 и QRI1n определяют замену аргинина на глутамин в сайте расщепления, распознаваемом I-фактором, в положении 1303 аминокислотной последовательности предшественника С3 (путем замены G3968C3969 на АА в последовательности кДНК), а QRI2 и QRI2n приводят к такой же замене аминокислотного остатка в положении 1320 (путем замены нуклеотида G4019 на А) в сайте расщепления, распознаваемом I-фактором.
AFL4149 и AFL4149n интродуцируют сайт рестрикции AflII, в положении 4149 последовательности кДНК (путем замены С4149 на Т) без изменения кодируемой аминокислотной последовательности. Эти два праймера применяли в качестве маркеров, позволяющих установить на основе расщепления продукта ДНК с помощью AflII, что произошел успешный мутагенез.
Мутагенез проводили с помощью "гэп-плазмидного" метода. Серию плазмид PGC3 (‘UPGC3’), содержащих уридин вместо тимидина, получали в результате выращивания штамма Е. coli CJ236 в присутствии 0,25 мкг/мл уридина. Эту плазмиду расщепляли с помощью SmaI и продукт длиной 7,2 т.п.н. (‘USD1’) очищали на агарозном геле с целью удаления фрагмента длиной 0,5 т.п.н. из последовательности С3 (остатки 1463-1947). Второй компонент плазмиды с "брешью" (гэп-плазмиды) (‘DN2’) получали путем расщепления PGC3 с помощью DraIII плюс NaeI и двукратной очистки фрагмента длиной 5,1 т.п.н. электрофорезом на агарозном геле. 200 нг DN2 смешивали примерно с 500 нг US1 в 50 мкл воды, нагретой до 100° С, и медленно охлаждали до температуры ниже 50° С перед добавлением 20 мкл-25 мкл буфера 2ХТ7 (100 мМ трис/HCl/pH 7,4/14 мМ MgCl2, 100 мМ NaCl, 2 мМ дитиотреитол и по 1 мМ каждого из АТФ, дАТФ, дЦТФ, дТТФ и дГТФ) плюс 10 нмолей каждого из 5’-фосфорилированных мутагенных праймеров (в одной реакции использовали QRI1, QRI2 плюс AFL4149, в другой реакции использовали QRIln, QRI2n плюс AFL4149n). Смеси повторно нагревали до 70° С в течение 5 мин и медленно охлаждали (в течение 30-60 мин) до 20° С. Добавляли при 0° С 10 единиц ДНК-полимеразы Т7 плюс 80 единиц ДНК-лигазы Т4. Смесь (общий объем 50 мкл) инкубировали сначала при 0° С в течение 5 мин, затем при комнатной температуре в течение 5 мин и окончательно при 37° С в течение 3 ч. 1 мкл каждой смеси применяли для трансформации 100 мкл суперкомпетентного штамма Е. coli XL1 (фирмы Stratagene) согласно инструкциям производителя.
Устойчивые к ампициллину колонии подвергали скринингу по признаку расщепления AflII и позитивных (успешных) мутантов выращивали в 100 мл культур, из которых плазмиды выделяли и секвенировали (используя секвенирующий праймер С3ра-3876, cttcatggtgttccaagcct, соответствующий нуклеотидам 3876-3895 кДНК С3) для изучения свойств мутаций в сайтах расщепления, распознаваемых I-фактором.
Для получения информации о других протоколах мутагенеза с помощью "гэп-плазмидного" метода см. ссылки [26, 27].
б) Перенос мутантной ДНК в эукариотический экпрессирующий вектор
Фрагменты кодирующей последовательности С3 из мутантных плазмид вырезали путем двойного расщепления с помощью HindIII и NaeI. В оставшуюся плазмиду для вывода ее из строя также включали DraI. Кодирующую последовательность С3 очищали на агарозном геле и лигировали с вектором pcDNA3 (фирмы Invitrogen), который был линеаризирован с помощью ферментов HindIII и EcoRI и дефосфорилирован с помощью фосфорилазы кишечника теленка. Для трансформации суперкомпетентного штамма Е. coli XL1 использовали лигированные смеси, а затем его высевали на культуральные планшеты, содержащие ампициллин.
Отобранные случайным образом (три или четыре) устойчивые к ампициллину колонии выращивали в 2-3 мл культур и выделяли из них небольшие количества плазмидной ДНК. Плазмиды, несущие правильную вставку, выявляли путем расщепления плазмидной ДНК рестриктазами EcoRI, HindIII и AflII. Соответствующие колонии выращивали в 100 мл культур и плазмиды очищали стандартным методом. Эти мутанты первоначально были сконструированы из PGC3, и поэтому они сохраняли два кодона ATG на 5’-конце кодирующей области. Поэтому данную область (плюс 5’-конец длиной 3 т.п.н. кодирующей последовательности С3) отщепляли с помощью HindIII и EcoRI и замещали путем датирования с таким же фрагментом, вырезанным из РС3. Такие реконструированные векторы получали стандартным методом и применяли для трансфекции клеток COS.
в) Экспрессия С3 дикого типа и мутантного С3
Мутантные С3 и С3 дикого типа экспрессировали в течение непродолжительного периода времени в трансфектированных плазмидами клетках СО S-1 с использованием липофектамина® (фирмы GIBCO) согласно инструкциям производителя. Обычно 1-1,5× 105 клеток на лунку стандартного 6-луночного культурального планшета трансфектировали 2-4 мкг плазмид, используя 9 мкл реагента липофектамина. В супернатантах оценивали секрецию С3, и обычные выходы через 3-6 дней после трансфекции составляли 0,3-1,7 мкг на мл супернатанта.
Результаты
а) Получение мутантов
Были выделены следующие мутанты, которые обозначены в соответствии с включенными мутагенными олигодезоксинуклеотидными последовательностями:
(I) 3 мутанта, имеющих обе мутации QRI1 и QRI2 плюс AFL4149: С3М-26, С3М-58 и С3М-61;
(II) 1 мутант с обеими мутациями QRI1 и QRI2, но без AFL4149: С3М-8; и
(III) 1 мутант с мутациями QRI2 и AFL4149, но без QRI1: С3М-51 (который использован в примере 3).
б) Доказательство того, что функциональные воздействия являлись следствием мутаций, специфически интродуцированных в сайты расщепления, распознаваемые I-фактором
Секвенирование подтвердило отсутствие других модификаций на расстоянии 178-350 оснований вокруг мутантной области каждого мутанта. Последовательность одного из мутантов, полученных с помощью этой методики, С3М-51 (см. пример 3), была проанализирована на протяжении всей "бреши" (основания 2463-5067), примененной для мутагенеза, и не было обнаружено никаких других отклонений от последовательности дикого типа.
Более того, репрезентативное секвенирование полного фрагмента длиной 2922 оснований из всех мутантов не позволило выявить никакой отдельной точковой мутации, которая могла быть получена в результате ошибок, допущенных полимеразой. Все экспрессированные мутанты имели двухцепочечное строение и расщеплялились С3-конвертазами, характерными для нативного С3. В целом, маловероятно, чтобы примененные мутанты содержали какие-либо нежелательные замены, хотя они не были полностью повторно секвенированы.
Пример 2: Получение С3, в котором остаток аргинина в одном сайте расщепления, распознаваемом I-фактором (положение на аминокислотной последовательности 1303) заменен остатком глутамина
Работали аналогично методу, описанному в примере 1, за исключением того, что для мутагенеза использовали только мутагенные олигодезоксинуклеотиды AFL4149 плюс QRI1 или AFL4149n плюс QRI1n (т.е. без QRI2 и QRI2n).
Результаты
а) Полученные мутанты
Были выделены 2 мутанта, имеющих мутации QRI1 и AFL4149, но не имеющих мутации QRI2: C3M-I23, -27. Мутант C3M-I23 экспрессировали, как описано в примере 1.
Этот протеин расщеплялся CVFBb. С3b-подобный продукт оказался относительно (по сравнению с диким типом) устойчивым к расщеплению в положении 1303 факторами I и Н, но еще мог быть расщеплен в положении 1320. Следовательно, это производное С3b является частично устойчивым к I-фактору.
Пример 3: Получение С3, в котором остаток аргинина в одном сайте расщепления, распознаваемом I-фактором (положение на аминокислотной последовательности 1320), заменен остатком глутамина
Работали аналогично методу, описанному в примере 1, за исключением того, что для мутагенеза использовали только мутагенные олигодезоксинуклеотиды AFL4149 плюс QRI2 или AFL4149n плюс QRI2n (т.е. без QRI1 и QRI1n). Кроме того, методом, который использовали в примере 1, также получали одного мутанта, имеющего мутацию QRI2 и AFL4149, но не без QRI1.
Результаты
а) Полученные мутанты
Были выделены 3 мутанта, имеющих мутации QRI2 и APL4149, но не имеющих мутации QRI1: С3М-51, C3M-Q2, C3M-Q13. Мутант С3М-51 экспрессировали, как описано в примере 1. Этот протеин расщеплялся CVFBb. С3b- подобный продукт не мог быть легко расщеплен в положении 1320 факторами I и Н, но еще мог быть расщеплен в положении 1303. Следовательно, это производное С3b является частично устойчивым к I-фактору.
Пример 4: Анализ функциональных воздействий мутаций
Супернатанты (100-400 мкл) трансфектированных клеток COS инкубировали при 37° С в течение 2 ч, причем клетки COS трансфектировали pcDNA3, несущей такие вставки, как:
1) немутантная последовательность С3;
2) мутант C3M-I23 (кодирующий Arg1303 → Gln);
3) мутант С3М-26 (кодирующий Arg1303 → Gln, Arg1320 → Gln,); и
4) мутант С3М-51 (кодирующий Arg1320 → Gln).
200 мкл супернатантов культур, взятых через 3 дня после трансфекции, предварительно обрабатывали 2 мМ фенилметансульфонилфторидом (0° С, 15 мин) и затем инкубировали при 37° С в течение 2 ч в следующих условиях:
А) без добавления;
Б) с предварительно полученной С3-конвертазой, CVFBb (10 мкл из 200 мкл смеси, содержащей 6,6 мкг CVF, 100 мкг В-фактора и 1,4 мкг D-фактора в забуференном фосфатом физиологическом расторе (ЗФР), содержащем 10 мМ MgCl2, который предварительно инкубировали при 37° С в течение 15 мин);
В) с факторами Н (5 мкг) и I (1 мкг); и
Г) с CVFBb плюс факторы Н и I.
Полученный продукт затем подвергали иммунопреципитации, добавляя при комнатной температуре 0,6 мкг очищенного с помощью аффинной хроматографии овечьего иммуноглобулина к человеческому С3, и через 1 ч добавляя 20 мкл 5%-ной суспензии промытых, фиксированных с помощью формалина клеток группы С Streptococcus sp. (протеин G) (фирмы Sigma). После инкубации в течение 45 мин при комнатной температуре частицы однократно промывали в ЗФР, 5 мМ NаN3 и однократно в буфере, содержащем 20 мМ трис-НСl, 137 мМ NaCl, 0,1% (об./об.) Твин 20, рН 7,6, до элюирования 1% ДСН/2% 2-меркаптоэтанолом (90-100° С, 5 мин). Эти элюаты разделяли с помощью ДСН-ПААГ, подвергали электроблоттингу на нитроцеллюлозе и полосы, соответствующие С3, выявляли зондированием очищенным с помощью аффинной хроматографии овечьим иммуноглобулином к человеческому С3, а затем перексидазой из хрена, сшитой с ослиным антиовечьим иммуноглобулином (фирмы Sigma), и проводили определение с использованием субстратов, усиливающих хемилюминесценцию "Enhanced Chemiluminescence", поставляемых фирмой Amersham. Приведена фотография, полученная при 2 мин экспозиции пленки в рентгеновских лучах. Видимые, соответствующие С3 полосы, указаны выделенными стрелками, и индивидуальные образцы (1-4, А-D) представляют собой те, которые только что были описаны. (Выступающая полоса, соответствующая 50 кДа (между полосами, соответствующими 46 и 68 кДа), присутствующая во всех образцах, представляет собой тяжелую цепь IgG, который использовали при иммунопреципитации, и она выявляется с помощью перексидазы из хрена, сшитой с ослиным антиовечьим иммуноглобулином).
Результаты (см. фиг.3)
1. Все необработанные образцы (1-А, 2-А, 3-А, 4-А) содержат полосы правильной миграции для альфа- и бета-цепей С3, что свидетельствует о том, что все мутанты экспрессируются, и правильно пост-трансляцинно процессируются. Присутствие в этих образцах полос, соответствующих 43 или 46 кДа, свидетельствует о наличии некоторой Н-фактор+I-фактор-подобной активности в культуральной среде. Спонтанный гидролиз С3 в течение 3-дневного периода биосинтеза приводит к производству C3i, который расщепляется с помощью этой активности. В немутантном С3 это приводит к образованию полос, соответствующих 43 и 75 кДа (полоса 75 кДа не видна поскольку: (I) она скрыта бета-цепью, имеющей массу 75 кДа, и (II) антитело, применяемое для вестерн -блоттинга, обладает очень незначительной активностью по отношению к этой области альфа-цепи С3: - ее присутствие далее подтверждено путем повторного зондирования с крысиным моноклональным антителом, "Clone-3", специфическим в отношении этой области). Добавление факторов Н и I без CVFBb (1-С, 2-С, 3-С, 4-С) не расщепляло оставшуюся часть С3, что свидетельствует о том, что она представляет собой активный С3 (с интактной тиольной сложноэфирной связью).
2. Немутантный С3 (1) расщепляется CVFBb и продукт С3b дополнительно расщепляется эндогенными ферментами (1-В) или при добавлении факторов Н и I (1-D). Полоса, соответствующая 43 кДа, свидетельствует о расщеплении по Arg1320, а полоса, соответствующая 68 кДа (которая проявляется при более длительной экспозиции), свидетельствует о расщеплении по Arg1303.
3. Мутант C3M-I23 (Arg1303 → Gln) может расщепляться с помощью CVFBb, и этот продукт оказался относительно устойчивым к эндогенной активности, подобной активности факторов Н и I (2-В), причем определенный участок альфа’-цепи (С3b) проявляет устойчивость, но еще может расщепляться при добавлении избытка факторов Н и I (2-D). Наличие продукта с молекулярной массой 43 кДа свидетельствует о расщеплении по Arg1320 (слабая полоса, соответствующая 71 кДа, представляет собой другой фрагмент альфа’-цепи, который можно увидеть при более длительной экспозиции), но при этом отсутствовала полоса 68 кДа, что свидетельствует о том, что этот мутант обладает устойчивостью к расщеплению мутантного Gln1303.
4. Мутант С3М-26 (Arg1303 → Gln, Arg1320 →Gln) может расщепляться с помощью CVFBb, и С3b-подобный продукт (альфа’) оказался устойчивым к эндогенной активности, подобной активности факторов Н и I (3-B). Он оказался также очень устойчивым к дополнительным факторам Н и I (3-D) по сравнению с немутантным С3 (1) и другими мутантами (2 и 4). Обнаружено небольшое количество продукта 46 кДа, что свидетельствует о некотором расщеплении мутантного Gln1303 (сопутствующий фрагмент 68 кДа также становился видимым при более длительной экспозиции). Обнаружено очень незначительное количество или не обнаружено совсем продукта с молекулярной массой 43 кДа, соответствующего какому-либо расщеплению Gln1320.
Таким образом, мутация Arg - Gln в положении 1303 менее эффективна, чем мутация в положении 1320 в отношении предотвращения расщепления I-фактором. (Это медленное остаточное расщепление также может иметь место в мутанте C3M-I23 (Arg1303 → Gln), но промежуточный продукт 46 кДа, вероятно, быстро превращается в продукт 43 кДа в результате дальнейшего расщепления немутантного Arg1320).
5. Мутант С3М-51 (Arg1320 → Gln) может расщепляться с помощью CVFBb, и этот продукт расщеплялся эндогенной активностью, подобной активности факторов Н и I (4-B) и дополнительными факторами Н и I (4-D). Наличие продукта 46 кДа (и слабая полоса, соответствующая 68 кДа) свидетельствуют о расщеплении Arg1303. Однако отсутствие полосы 46 кДа свидетельствует о том, что не происходило расщепления мутантного Gln1320.
Пример 5: Сравнение различных аминокислотных замен в положении 1303
1. Введение
В предыдущих примерах описаны мутации Arg1303 и Arg1320, приводящие к получению остатка глутамина. Обе мутации придавали устойчивость к расщеплению I-фактором в этих положениях. Однако обнаружена небольшая, но выявляемая степень расщепления Gln1303. Поэтому был создан и оценен ряд других аминокислотных замен в этом положении. Расщепление происходит в порядке убывания эффективности, когда остаток в положении 1303 представляет собой: Arg>Туr>[Cys или Trp]>Gln>[Glu или Gly]. Эти результаты являются неожиданнными поскольку: (I) все известные встречающиеся в естественных условиях расщепления, опосредованные I-фактором человека, происходят на карбоксильном конце остатков аргинина, поэтому было сделано предположение, что фермент нуждается в аргинине; и (II) если идет расщепление по другим остаткам, то можно предположить, что они должны быть аналогичны Arg по электростатическим характеристикам, т.е. представлять собой щелочной остаток (Lys или His) (например, трипсин избирательно расщепляет карбоксильный конец Arg, Lys или His), поэтому нельзя предугадать возможность расщепления при замещении тирозином.
Следовательно, замена Arg1303 на глицин или глутаминовую кислоту является предпочтительной для создания производного С3, устойчивого к инактивации I-фактором.
2. Методы
2.1 Мутагенез: примененный мутагенный вырожденный праймер представял собой: caactgcccagc(gt) (ag) (cg)agctccaagatcacc (буквы в скобках обозначают смесь оснований в этом положении). Мутантов конструировали либо с помощью гэп-плазмидного метода (как описано ранее в примерах), либо с помощью "мегапраймерного метода" (V. Picard и др., Nucl. Asid Res. 22: 2587-91 (1994)), в котором обеспечивающий синтез против хода транскрипции праймер представлял собой caccaggaactgaatctagatgtgtccctc, а обеспечивающий синтез по ходу транскрипции праймер представлял собой gttttatggtgaccttaaggtcgaatttatta. Все мутации проводили на матрицах, в которых кодирующая С3 ДНК уже содержала мутации, при которых остаток аминокислоты в положении 1320 представлял собой глутамин, сайт рестрикции AflII был встроен в положение 4149 (как описано ранее в примерах), и что подтверждено с помощью секвенирования ДНК.
2.2 Экспрессия: мутантов экспрессировали в клетках COS с использованием вектора pcDNA3, как описано ранее в примерах, метили биосинтетическим путем с помощью [35S] метионина в бессывороточной среде.
2.3 Анализ: супернатанты обрабатывали CVFBb (полученной путем взаимодействия CVF с факторами В и D в буфере, содержащем магний) и факторами Н и I с последующей иммунопреципитацией с антителом к С3 и разделением электрофорезом в полиакриламидном геле с ДСН, который проводили в восстанавливающих условиях (как описано ранее в примерах). Гель фиксировали, обрабатывали реагентом "Amplify" фирмы Amersham, сушили и экспонировали на авторадиографическую пленку, получая результат, приведенный на чертеже.
3. Результаты
Расщепление, опосредованное I-фактором в положении 1303 (сайт 1), при отсутствии расщепления в положении 1320 (сайт 2) (где произошла замена на глутамин), приводит к получению полос, соответствующих 46 и 68 кДа. Видно, что расщепление происходит в следующем порядке: Arg(R)>Tyt(Y)>Cys(C) и Trp (W)>Gln(Q)>Gly(G) и Glu(E). Протеин дикого типа (аргинин в обоих положениях) расщепляется в обоих положениях с получением фрагментов с молекулярной массой 43 (которые слишком малы, чтобы проявляться в этом геле) и 68 кДа.
4. Чертеж
Результаты приведены на фиг.4. Остатки в сайте 1 (положение 1303) и в сайте 2 (положение 1320) указаны над соответствующими дорожками.
Пример 6: Демонстрация повышенной устойчивости к инактивации факторами I и Н в результате мутации Arg1303 → Gln
1. Введение
В приведенных ранее примерах показано, что замена Arg1303 или Arg1320 глутамином делает этот сайт устойчивым к расщепленипю I-фактором. Мутация обоих сайтов приводит к получению молекулы, устойчивой к расщеплению в обоих сайтах. В настоящем примере дополнительно продемонстрировано, что одна мутация Arg1303 → Gln (без модификации Arg1320) приводит к значительной устойчивости к функциональной инактивации факторами I и Н по сравнению с диким типом.
2. Метод
2.1 Экспрессия: Получение мутации Arg1303 →Gln описано в предыдущем примере. Этим мутантом трансфектировали СНО (обычная лабораторная линия клеток, происходящая из клеток яичника китайского хомячка) с помощью метода, основанного на использовании фосфата кальция, и стабильных трансфектантов отбирали по признаку устойчивости к G418 ("Geneticin", поставляемый фирмой Sigma). Собирали супернатанты клеточной культуры и экспрессированный С3 частично очищали с помощью осаждения сульфатом натрия (10-20% (мас./об.) фракция) и ионообменной хроматографии на Q-сефарозе и моно-Q-сефарозе (A.W. Dodds Methods Enzymol. 223:46 (1993)).
2.2 Анализ: Овечьи эритроциты покрывали (сенсибилизировали) моноклональным антителом SО16 (R.A.Harrison и P.J.Lachmann Handbook of Experimental Immunology, 4-е изд., глава 39 (1986)) и затем 4,4 мл 5% (об./об.) суспензии инкубировали приблизительно с 10 мкг С2, 24 мкг С4 и 1 мкг С1 (очищенные компоненты комплемента человека) в течение 10 мин при 37° С в CFD (R.A.Harrison и P.J.Lachmann, выше). Затем инкубировали 0,8 мл этой смеси в течение 105 мин с 0,25 мл смеси, содержащей полуочищенный С3 мутантного или дикого типа и ЭДТК до конечной концентрации 12,5 мМ. Затем клетки промывали CFD и использовали для включения в содержащий CFD желатин (0,1% мас./об.) (CFD-гель). Радиолигандное связывание с меченным с помощью [125I] клоном 4 моноклонального антитела к С3 использовали для подтверждения, что осаждаются соответствующие количества С3b дикого или мутантного типа.
Для анализа 40 мкл 5%-ной суспензии клеток разбавляли в 250 мкл CFD-геля и аликвоты объемом 50 мкл инкубировали с 50 мкл CFD-геля, содержащего разбавления каждого фактора I и Н до конечных концентраций 100, 10, 1 и 0 мкг/мл, при 37° С в течение 30 мин. Затем добавляли 0,9 мл CFD, клетки пеллетировали центрифугированием и промывали еще два раза, используя каждый раз по 1 мл CFD. Затем клетки ресуспендировали в 100 мкл CFD-геля, содержащего 100 мкг/мл В-фактора, 100 мкг/мл пропердина, 1 мкг/мл D-фактора и 0,3 мМ NiCl2. После инкубации в течение 10 мин при 37° С добавляли 0,9 мл CFD, содержащего 10 мМ ЭДТК и 2% (об./об.) нормальную сыворотку морской свинки. После дополнительной инкубации в течение 30 мин при 37° С неразрушенные в результате лизиса клетки пеллетировали центрифугированием и степень лизиса определяли, измеряя абсорбцию супернатанта при 412 нм. Абсорбцию, эквивалентную 100%-ному лизису, определяли из аликвотных количеств клеток, лизированных в воде, и отсюда рассчитывали процент лизиса.
Этот анализ позволяет оценить способность осажденных С3b образовывать функционально активную конвертазу С3bВbР. Превращение в iC3b предотвращает образование конвертазы и последующий лизис в сыворотке/ЭДТК.
3. Результаты
Результаты, приведенные на чертеже, свидетельствуют о том, что для устранения гемолитической активности мутанта Arg1303 → Gln необходимы более, чем 10-кратные количества I-фактора и Н-фактора, по сравнению с диким типом. Эта мутация, таким образом, дает преимущество при создании производного С3, С3b-продукт которого обладает устойчивстью к инактивации факторами Н и I. Этот эффект может быть следствием либо большей устойчивости к расщеплению в положении 1303 (когда Arg заменен на Gln), либо большей устойчивости к расщеплению в положении 1320, когда расщепление сначала происходит в положении 1303.
4. Чертеж
Результаты приведены на фиг.5. На оси Х отложена концентрация факторов Н и I. Q1 обозначает мутацию Arg1303 →Gln. Лизис (%) измеряют согласно тому, как описано в методах.
Заключение
Важными особенностями человеческого С3, присущими модифицированным вариантам, представленным в настоящем описании, являются следующие:
(I) Молекула содержит производное, функционально подобное С3b, которое может быть объединено с функционально активным человеческим В-фактором, и кроме того может расщепляться человеческим D-фактором с получением фермента, способного расщеплять человеческий С3.
(II) Аминокислотные последовательности производных имеют большую гомологию с С3 людей, чем с С3 любых других видов, для которых в настоящее время имеются данные о последовательности, или с любой другой известной в настоящее время последовательностью протеина. Структурные особенности С3, характерные для протеина дикого типа, но необязательные для модифицированных производных, включают следующие особенности:
(а) Кодирующая последовательность ДНК и последовательность транслированного протеина для варианта человеческого С3, который использовался в примерах изобретения, приведенных в настоящем описании, представлены на фиг.2 и 1 соответственно. Эта последовательность протеина отличается от опубликованной последовательности [2] по крайней мере двумя аминокислотами (детали приведены в примерах). Можно предположить, что с функций С3 совместимо существенно больше вариаций, даже если большинство из них не присутствует в популяции.
(б) Первичный продукт трансляции процессируется в результате протеолитического расщепления на две связанные дисульфидными мостиками цепи, альфа-цепь (остатки 672-1663) и бета-цепь (остатки 23-667), с удалением сигнальной последовательности (остатки 1-22).
(в) Зрелый протеин содержит тиольную сложноэфирную связь между остатками Cys1010 и Gln1013.
(г) С3-конвертаза расщепляет С3 с удалением С3а (остатки 672-748). После этой реакции происходит разрыв тиольной сложноэфирной связи.
(д) В присутствии Н-фактора I-фактор расщепляет С3b между остатками Argl303 и Ser 1304 и между Argl320 и Ser 1321.
Модификации, созданные на нативной молекуле С3
Замена Arg1303 на Gln
Эта модификация затрагивает один сайт расщепления С3b I-фактором. Ее действие направлено на снижение уровня расщепления I-фактором в этом положении. Замена на глутамин выбрана с целью устранения положительного заряда аргинина, что, вероятно, важно для серин-претеазной активности I-фактора, но при этом сохраняется характеристика гидрофильности и близкий размер цепи, что должно снизить до минимума любые нарушения третичной структуры протеина. Это предположение подтверждается данными о том, что мутация не мешала процессингу двухцепочечной структуры, образованию тиольной сложноэфирной связи или расщеплению С3 С3-конвертазой. Замена Arg на другую аминокислоту может дать подобный или даже более выраженный эффект, что показано в примере 5.
Также представляется возможным уменьшить это расщепление с помощью замены Ser1304 (другая сторона сайта расщепления) или других остатков, участвующих во взаимодействии фермент-субстрат.
Замена Arg1320 на Gln
Эта модификация затрагивает другой сайт расщепления С3b I-фактором. Ее действие направлено на значительное снижение уровня (фактически на устранение) расщепления I-фактором в этом положении. Замена на глутамин была сделана в соответствии с такими же критерями, как описано выше, и эта мутация также не мешала процессингу двухцепочечной структуры, образованию тиольной сложноэфирной связи или расщеплению С3 С3-конвертазой. И в этом случае замена на другую аминокислоту, а также замена Ser1321 или других остатков, участвующих во взаимодействии фермент-субстрат, может дать подобный эффект.
Комбинация двух мутаций, Arg1303 → Gln и Arg1320 →Gln, защищает С3b от инактивации и, следовательно, поддерживает его способность формировать часть активной С3bВb-конвертазы. Также могут применяться другие мутации (включая комбинации мутаций), устраняющие обе реакции расщепления (например, Arg1303 → Glu или Arg1303 → Gly могут использоваться в комбинации с Arg1320 → Gln).
Пример 7: Различные мутации, которые снижают взаимодействие C3b/C3i с Н-фактором
7.1 Введение
В других лабораториях получены данные, базирующиеся либо на действиях синтетических пептидов (Ganu V.S. и Muller-Eberhard H.J., 1985, Complement 2:27; Becherer J.D. и др., 1992, Biochemistry 31: 1787-1794), либо на ограниченном мутагенезе (Taniguchi-Sidle А. и Isenman D.E., 1994 J. Immunol. 153: 5285-5302), позволяющие предположить, что остатки 752-761 в первичной последовательности транскрипта С3 (см. фиг.1) могут участвовать во взаимодействии с Н-фактором. Однако в других опубликованных данных предполагается, что только остатки 767-776 участвуют во взаимодействии с Н-фактором, а остатки 752-761 важны для взаимодействия с В-фактором (Fishelson, 1991, Mol. Immunol. 28:545-552). Авторы изобретения предположили, что более интенсивный мутагенез этой области может уменьшить аффинность к Н-фактору и тем самым является желательным для цели создания производного С3, устойчивого к Н-фактору. Кроме того, было сделано предположение, что важными для мутации остатками могут являться выступающие кислотные остатки (аспарагиновой и глутаминовой кислот) и что может оказаться целесообразным заменить их на нейтральные остатки, которые способны опосредовать сильные взаимодействия с меньшей вероятностью. В этом примере описаны замена остатков 752-754 Asp-Glu-Asp на Gly-Ser-Gly в сочетании с заменой остатков 758-760 Glu-Glu-Asn на Gly-Ser-Gly. Продукт обладает пониженными характеристиками расщепления, что согласуются с уменьшением чувствительности к Н-фактору. Это является подтверждением того, что С3 может быть модифицирован с целью уменьшения свяывания Н-фактора и, следовательно, снижения чувствительности к факторам Н и I. Эти модификации являются желательными для получения С-конвертазы, стабильной в физиологических условиях.
7.2 Метод
Методы мутагенеза, экспрессии и анализа описаны ранее в примерах. Синтезированный мутагенный олигонуклеотид имел последовательность:
agtaacctgggttcgggcatcattgcaggatcgggcatcgtttcc.
7.3. Результаты
Результаты реакций расщепления приведены на фиг.6. Они показывают что:
1. Добавление CVFBb к С3 дикого типа приводит к элиминации альфа-цепи (дорожка 2), поскольку образовавшийся С3b чувствителен к низким концентрациям факторов I и Н в супернатанте культуры. C3i, образовавшийся в процессе экспрессии или последующей инкубации, аналогичным образом разлагался с получением iC3i. Добавление экзогенных факторов I и Н (дорожки 3 и 4) не вносит изменения относительно дорожек 1 и 2 соответственно, поскольку сама среда содержит достаточную активность фактора Н и I для осуществления полного расщепления.
2. В противоположность этому обработка мутанта С3 с помощью CVFBb (дорожка 6) не приводит к исчезновению альфа-цепи. Наблюдается образование некоторого количества альфа’, что соответствует С3b, но некоторая их часть или они все сохраняются, что свидетельствует о том, что устойчивость альфа-цепи не является только результатом отсутствия расщепления CVFBb. Оставшаяся нерасщепленной альфа-цепь на дорожке 2, следовательно, может представлять собой C3i, не расщепленный эндогенными активностями факторов Н и I, хотя также вероятно, что некоторая часть продукта представляет собой нативный С3, сохранившийся в случае, если мутант приобрел частичную устойчивость к CVFBb. Добавление высоких концентраций экзогенных факторов Н и I (дорожки 7 и 8) приводит к уменьшению альфа- и альфа’-цепей, что свидетельствует о том, что (I) мутант является не полностью устойчивым к этим факторам и (II) альфа-цепь, нерасщепленнная CVFBb (дорожка 2) скорее происходит из C3i (который расщепляется факторами Н и I, но не расщепляется CVFBb), а не из нативного С3 (который расщепляется CVFBb, а не факторами Н и I). То, что не вся альфа-цепь оказывается расщепленной, даже на дорожке 8, вероятно, является результатом устойчивости к факторам Н и I.
Таким образом, изменение остатков 752-754 и остатков 758-760 может приводить к получению молекулы С3, которая еще может расщепляться С3-конвертазами, но является частично устойчивой к действиям факторов Н и I. С учетом других опубликованных данных это представляется наиболее вероятным, потому что мутации модифицировали область, участвующую во взаимодействии с Н-фактором, что привело к снижению аффинности к Н-фактору.
Пример 8: Сайт С3, в котором может быть индуцирована мутация с целью модификации взаимодействия C3i с В-фактором
8.1 Введение
В предыдущих примерах показано, что мутации С3 могут изменять взаимодействия с факторами Н и I. Для выявления других сайтов в С3, которые могут взаимодействовать с В-фактором, проведено сравнение с известными последовательностями молекул С3 из различных видов, а также с доступными последовательностями С4 и других гомологичных протеинов. Выявлена область, соответствующая остаткам 1427-1433 человеческого С3, которая может участвовать в специфичных функциях С3 и С4. Они могут включать взаимодействие с В-фактором (или с его гомологом С2 в случае С4), но необязательно, поскольку другие возможные функции включают образование тиольной сложноэфирной связи, превращение в С3b (или в форму С4b), взаимодействие с субстратом С3 и/или С5 при конвертазной активности и взаимодействие с I-фактором и с его кофакторами. Таким образом, выбранные остатки заменяли на соответствующие остатки (основываясь на анализе первичной структуры последовательности), обнаруженные в другом гомологичном протеине, в данном случае в человеческом С5. Так, в положении 1427 заменяли остаток Arg на Gln, в положении 1431 заменяли остаток Lys на Asp и в положении 1433 заменяли остаток Glu на Gln. Обнаружено, что образовавшийся мутант чувствителен к расщеплению С3-конвертазой (CVFBb) и продукт С3b может расщепляться факторами Н и I. Однако этот мутант не поддерживает превращения В-фактора в Вb плюс Ва, что обусловлено связыванием В-фактора с C3i (или с С3b). Таким образом, получено подтверждение того, что изменение в этой области уменьшает взаимодействие с В-фактором. Хотя это является нежелательным для получения суперактивной С3-конвертазы, этот факт свидетельствует о том, что другие модификации указанной области С3 также могут изменять взаимодействие с В-фактором и некоторые из них, вероятно, могут увеличивать афинность. Как следствие, такие мутации также могут увеличивать стабильность и активность бимолекулярного фермента конвертазы С3bВb (или C3iBb).
8.2 Методы
Первичные структуры последовательностей, приведенные далее в таблице I (в конце текста), иллюстрируют, причину, по которой авторы изобретения считают, что эта область является перспективной для мутагенеза. Предполагается, что характер определенных остатков в этой области был выраженно консервативен в С3 и С4, но сильно отличался в других протеинах. Отобраны остатки в положениях 1427, 1431 и 1433, поскольку природа их заряда характерна для групп, которые могут участвовать во взаимодействиях протеин-протеин. Были осуществлены замены соответствующих остатков человеческого С5, поскольку они проявляли очень выраженные различия электростатических свойств, но внутри контекста некоторых других консервативных остатков, которые указывают на сходство их локального строения.
Методы мутагенеза, экспрессии и анализа реакций расщепления С3 соответствуют таковым, описанным в представленных ранее в примерах (примеры 1-4). Синтезированный мутагенный олигонуклеотид имел последовательность: tggtgttgaccaatacatctccgactatcagctggacaa.
Анализ превращения В-фактора
Экспрессированный продукт очищали от среды клеток COS аффинной хроматографией на колонке типа Clone-3-сефароза, как описано в примере 9. Этот метод приводит к значительному превращению формы C3i с разорванной тиолэфирной связью. С3 дикого типа выделяли с помощью такой же методики. Разбавления С3 дикого типа (1/5, 1/25 и 1/125) разгоняли с помощью электрофореза в ПААГ с ДСН (восстанавливающие условия) параллельно с мутантом С3, и окрашивание серебром показало, что мутант присутствовал в концентрации, эквивалентной таковой, соответствующей разбавлению дикого типа несколько ниже, чем 1/25, но существенно выше, чем 1/125. Такие же разбавления использовали при анализе превращения В-фактора. 5 мкл этих С3 инкубировали с 25 мкл CFD-G, содержащего 5 мкг/мл D-фактора и приблизительно 1,6 мкг/мл меченного с помощью 125I В-фактора (приблизительно 1000-2000 распадов в мин/мкл) в течение 3 ч при 37° С. Затем образцы анализировали с помощью ДСН-ПААГ (восстанавливающие условия) с последующей авторадиографией высушенного геля. Результаты приведены на фиг.7.
8.3 Результаты
Как видно на фиг.7, выраженное расщепление В-фактора происходит даже при разбавлении С3 дикого типа (C3i) 1/125. В противоположность этому никакого заметного расщепления не наблюдали в присутствии мутантного, даже неразбавленного С3, что должно соответствовать более высокой концентрации, чем разбавление 1/125 образца дикого типа.
Таким образом, этот мутант, вероятно, имеет уменьшенную способность расщеплять В-фактор, наиболее вероятно вследствие уменьшения его аффинности к связыванию В-фактора. Следовательно, в С3 имеется область, при индукции мутации в которой изменяется взаимодействие между C3i (или С3b) и В-фактором и, возможно, также изменение стабильности конвертазы (С3iВb или С3bВb).
Пример 9: Очистка экспрессированных мутантных молекул С3
9.1 Введение
В этом примере продемонстрировано, как мутантные молекулы С3 могут быть выделены из среды для экспрессии, такой, как культуральная среда, трансфектированных эукариотических клеток. С помощью простой аффинной очистки получают молекулы С3 достаточной чистоты для использования в тестах по определению функций и для конъюгации с антителом с помощью метода, описанного в примере 10. Хотя элюирование из антитела сопровождается гидролизом значительной части внутреннего тиоэфира, продукт С3i еще остается пригодным в качестве предшественника для получения активной С3-конвертазы, а также для получения конъюгатов С3i-антитело. Этот подход, вероятно, может рассматриваться как часть способа получения препарата, необходимого для использования in vivo.
9.2 Метод
Очистка аффинной хроматографией на колонке типа Clone-3-сефароза.
Clone-3 представляет собой крысиное моноклональное антитело, которое специфично по отношению к С3 и его производным, включая С3b и С3i (Lachmann P.J. и др., 1980, J. Immunol. 41: 503-515). Доступны также другие моноклональные антитела к С3, и они в ряде случаев успешно используются для выделения С3 из небольших количеств плазмы человека (Dodds A.W., 1993, Methods Enzymol. 223:46-61) и, следовательно, также могут применяться для выделения молекул, экспрессированных ех vivo. Фракцию IgG сшивали с сефарозой CL-4B, используя дицианбромид (методика описана у Harrison и Lachmann, 1986, Handbook of Experimental Immunology, 4-е изд., под ред. Weir, Herzenberg, Blackwell и Herzenberg; Blackwell, Oxford). Супернатанты культур либо непосредственно пропускали через колонку из этой смолы (повторная циркуляция), либо сначала концентрировали осаждением с помощью 25%-ного (мас./об.) Na2SO4 и повторно растворяли и подвергали диализу в противотоке ЗФР, 5 мМ NaN3. Затем колонку последовательно промывали (I) ЗФР, 5 мМ NaN3 и (II) ЗФР, содержащим 1 М NaCl. Связанный С3 элюируется 50 мМ натрий -боратным буфером, рН 10,5 и его немедленно нейтрализовали, собирая фракции объемом 0,9 мл в 0,1 мл 1 М трис/НСl-буфера, рН 7. Затем продукт подвергали диализу в противотоке ЗФР, 5 мМ NаN3.
Получение С3, несущего "His-Tag"
"His-Tag" (меченый гистидин) представляет собой нить остатков гиститида, проявляющую аффинность к колонкам, несущим ионы никеля. Этот метод применяли с целью выделения экспрессированного продукта. Предполагается, что этот метод может оказаться пригодным для выделения экспрессированных мутантных молекул С3, поэтому авторы изобретения применили инсерционный мутагенез для получения плазмиды, кодирующей С3, с хвостом, состоящим из 6 остатков гистидина на карбоксильном конце (С-конец, непосредственно прилегающий к остатку 1663). Такая локализация для "His-Tag" была выбрана с тем, чтобы уменьшить до минимума вмешательство в синтез, укладку, процессинг и образование дисульфидной связи полученного С3. Остаток 1661 представляет собой остаток цистеина, участвующий в образовании дисульфидной связи с предыдущим остатком последовательности (вероятно, Cys 1537; Dolmer К. и Sottrup-Jensen L., 1993, FEBS-Lett. 315:85-90) и, следовательно, представляется целесообразным сделать вставку за этим структурным элементом. Мутацию встраивали с помощью "гэп-плазамидного" метода, который применяли в примере 1, используя синтезированный мутагенный олигонуклеотид со следующей последовательностью: tgggtgccccaaccatcatcatcatcatcattgaccacaccccc.
Встраивание правильной последовательности подтверждали с помощью секвенирования ДНК. Последовательность ДНК после этого могла быть перенесена в экспрессирующий вектор. После трансфекции эукариотических клеток представляется возможным выделение экспрессированного С3 в результате аффинности к колонке, несущей ионы никеля, или с помощью любого другого матрикса, обладающего специфичной аффинностью по отношению к "His-Tag".
9.3 Результаты
Многочисленные мутанты С3 были очищены на колонке Clone-3-сефароза, включая мутантов, описанных в примерах 1 и 2 и экспрессированных в клетках СНО. Продукты сохраняли способность поддерживать расщепление В-фактора D-фактором. Этот же метод применяли для выделения мутанта, описанного в примере Б2, экспрессированного в клетках COS. Окрашенные серебром ДСН-ПААГ-гели, позволили выявить, что чистота выделенных продуктов не была 100%-ной, а часто была выше или равна 50%. Это связано с исходными материалами, обычно содержащими менее 10 мкг/мл С3 в 10% (об./об.) фетальной телячьей сыворотке плюс другие клеточные протеины. Кроме того, С3 не разлагались в процессе выделения и активность эндогенных факторов Н и I, вероятно, была устранена.
Очистка посредством "His-Tag" включает более мягкие условия элюирования из колонки, несущей ионы никеля. Например, была использована ЭДТК. Таким образом, применение этого метода для С3 должно обеспечить выделение без разрыва внутренней тиольной сложноэфирной связи.
Пример 10: Конъюгация C3i с антителом и применение для обеспечения активности С3-конвертазы в отношении конкретной клетки
10.1 Введение
Одним из предметов изобретения является тот факт, что стабильные С3-конвертазы, происходящие из мутантных молекул С3, должны вызывать усиленное превращение С3, которое, если оно локализовано в конкретном сайте-мишени, будет усиливать зависящую от комплемента атаку на эту мишень. Предпочтительным способом направления ответа является связывание мутантной молекулы С3 либо в виде производного C3i, либо в виде производного С3b, с антителом, специфическим по отношению к требуемой мишени. В этом примере продемонстрирована рабочая методика получения таких конъюгатов, которая применима для мутантных молекул C3i или С3b и может применяться для материала, очищенного из экспрессирующей системы на основе аффинности, даже, если в процессе очистки была разрушена тиольная сложноэфирная С3. Путем связывания C3i с антителом, которое специфично связывается с эритроцитами овцы, дополнительно показано, что может быть сформирован конъюгат, связывающий C3i с поверхностью эритроцита, такой, как конвертаза C3iBbP, который инициирует лизис этих клеток, когда другие компоненты комплемента поставляются в форме нормальной сыворотки морской свинки (в ЭДТК для предотвращения образования de-novo С3-конвертаз). Таким образом, конъюгация с антителом может применяться для направления молекулы C3i с целью инициации, зависящей от комплемента атаки на определенный тип клеток. В этом примере использован C3i дикого типа из плазмы человека, который формирует С3-конвертазу in vitro. In vivo C3i и С3b разрушаются факторами Н и I. Таким образом, мутант С3, сконструированный в соответствии с настоящим изобретением таким образом, чтобы он обладал устойчивостью к факторам Н и I и, следовательно, был способен образовывать стабильную С3-конвертазу, является предпочтительным с точки зрения физиологии.
10.2 Методы
(I) Получение и очистка конъюгата С3i-антитело
Примененное антитело представляло собой фракцию IgG, выделенную из поликлональной кроличьей антиовечьей эритроцитной сыворотки. 1,1 мг инкубировали с 75 нмолями SPDP в конъюгирующем буфере, рН 7,5 (20 мМ КН2РO4, 60 мМ Nа2НРO4, 0,12 М NaCl) в течение 2 ч при комнатной температуре. PDP-IgG очищали с помощью гель-фильтрации на колонке с суперозой б (фирмы Pharmacia) (в фосфатном буфере, рН 7,4, содержащем 0,5М NaCI). Восстановление образца дитиотреитолом использовали для того, чтобы установить, что 4 группы PDP сшиты с молекулой IgG. C3i получали обработкой очищенного С3 0,1 М метиламином, рН 7,2 (2 ч при 37° С). Избыток метиламина удаляли гель-фильтрацией с последующим диализом в противотоке конъюгирующего буфера. 18 нмолей C3i смешивали с 1,7 ммоля PDP-IgG в 1,26 мл конъюгирующего буфера и инкубировали в течение 1 дня при комнатной температуре, а затем 1,5 дня при 4° С. На фиг.8 показан окрашенный с помощью кумасси голубого (Coomassie Blue) ДСН-ПААГ-гель, соответствующий конъюгированной реакционной смеси, откуда видно появление видов фракций с молекулярной массой примерно 350 кДа, которые не присутствовали ни в PDP-IgG, ни в C3i. Эти виды частично очищали гель-фильтрацией на колонке с суперозой 6 в фосфатном буфере, рН 7,4, содержащем 0,5М NaCl, и затем подвергали диализу в противотоке ЗФР. Они элюировались до С3 в объеме, в котором фракции с молекулярной массой 300-400 кДа могут быть определены с использованием калибровки на основе стандартов молекулярных масс глобулярных молекул. Концентрации конъюгата, свободного антитела и несшитого С3 определяли из окрашенного с помощью кумасси (Coomassie) ДСН-ПААГ-геля (невосстанавливающие условия). Двумерный ДСН-ПААГ (первое направление невосстанавливающее, второе направление восстанавливающее) показал, что соотношение между IgG и C3i в конъюгате составляет 1:1.
(II) Демонстрация того, что конъюгат С3-антитело может применяться для обеспечения активности конвертазы в отношении конкретной клетки
20 мкл различных разбавлений конъюгата (0 (конъюгат отсутствует), 1/100, 1/50, 1/10) инкубировали с 100 мкл приблизительно 1% (об./об.) эритроцитами овцы (предварительно промытыми в CFD) в течение 1 ч при 37°С. Параллельно проводили инкубации с эквивалентными количествами PDP-IgG (без С3) и одного С3. Затем клетки четыре раза промывали в CFD и повторно суспендировали в 100 мкл CFD-G. 50 мкл этой смеси лизировали с помощью 150 мкл Н2О, а затем путем добавления 800 мкл CFD, содержащего 10 мМ ЭДТК и 2% (об./об.) NGPS. Другие 50 мкл сенсибилизированных конъюгатом клеток инкубировали в течение 15 мин при 37° С с 50 мкл CFD-G, содержащего 190 мкг/мл В-фактора, 2 мкг/мл D-фактора, 20 мкг/мл пропердина и 0,6 мМ NiCl2, а затем лизировали с помощью 900 мкл CFD, содержащего 10 мМ ЭДТК и 2% (об./об.) NGPS. После инкубации в течение 30 мин при 37°С клетки пеллетировали центрифугированием (2000× g в течение приблизительно 3 мин) и измеряли оптическую абсорбцию супернатанта при 412 нм. Принимая, что в обработанных водой образцах происходит 100% лизис, а чистый буфер свободен от клеток, подсчитывали % лизиса, как показано на фиг.9. Конъюгат вызывает зависящий от дозы лизис, в то время, как ни PDP-IgG, ни один C3i не приводят к какому-либо лизису, существенно превышающему таковой, проходящий в отсутствии любой такой обработки.
10.3 Обобщение результатов
Использованный метод позволил успешно осуществить сшивание C3i с IgG, что видно из следующего:
1. Образование полосы соответствующего размера (приблизительно 350 кДа) для конъюгата с соотношением C3:IgG 1:1 показано с помощью ДСН-ПААГ на фиг.8.
2. Двумерный ДСН-ПААГ (первое направление невосстанавливающее, второе направление восстанавливающее) показал, что эти виды содержали как IgG, так и C3i.
3. Характеристика элюирования этих видов с помощью гель-фильтрации и в этом случае соответствтует молекулярной массе примерно 350 кДа.
4. Конъюгат проявляет гемолитическую активность, которая не характерна ни для PDP-IgG, ни для C3i (фиг.9).
Анализ гемолитической активности (фиг.9) дополнительно показывает, что:
1) специфичное антитело к эритроцитам овцы локализовало C3i на мембране клетки-мишени (эритроцит овцы), защищая его от удаления при промывке (в противоположность к свободному C3i),
2) конъюгат сохраняет активность C3i в том плане, что еще способен образовывать С3-конвертазу при реакции с пропердином и факторами В и D,
3) эта конвертаза может инициировать зависящую от комплемента атаку на мишень, в этом случае путем активации лизисного пути (С5-9) для лизиса эритроцитов.
Дополнительные данные, полученные в других лабораториях, показали, что фактор яда кобры может быть связан с антителом, и что эти конъюгаты могут направлять активацию комплемента против конкретного типа клеток (Vogel, 1988, Targeted. Diagn. Ther. 1:191-224; Muller В. и Muller-Ruchholtz W., 1987, Leuk. Res. 11: 461-468; Parker C.J., White V.F. и Falk R.J., 1986, Complement 3:223-235; Petrella E.C. и др., 1987, J. Immunol. Methds 104: 159-172). Эти данные подтверждают утверждение, что С3, модифицированный таким образом, что он способен образовывать стабильную С3-конвертазу типа фактора яда кобры, может применяться для направления опосредованных комплементом ответов, что изложено в данном изобретении.
Пример 11: Демонстрация того, что мутантные молекулы С3 индуцируют превращение В-фактора в нормальной сыворотке человека
11.1 Введение
Основной целью изложенного в настоящем описании изобретения является разрушительное истощение активности комплемента в биологических жидкостях. В изобретении описаны способы получения молекул С3, устойчивых к понижающей регуляции факторами Н и I. В этом состоянии они будут связываться с В-фактором и генерировать активные С3-конвертазы. Активность этих конвертаз продемонстрирована в гемолитическом анализе, приведенном в примере 6. Такая конвертаза может, следовательно, разрушать С3. Если конвертаза является нестабильной, то она может диссоциироваться не приводя к существенному превращению С3. Однако это может позволить осуществлять связывание нового В-фактора и его превращение в Вb и Ва. Таким образом, мутантный С3 будет усиливать потребление В-фактора, приводя в конечном счете к выведению из строя альтернативного пути активации комплемента и к его неспособности усиливать стимуляцию классического пути. Если получена стабильная С3-конвертаза, превращение В-фактора должно понизиться, но потребление С3 должно возрасти. Таким образом, обе эти ситуации являются желательными. В этом примере показано, что мутантные молекулы С3, которые модифицированы с целью придания им устойчивости к I-фактору, но не имеющие никакой модификации, изменяющей стабильность конвертазы, обеспечивают ускоренное превращение В-фактора в сыворотке человека. В противоположность этому С3 дикого типа не вызывает заметного превращения, вероятно, вследствие того, что C3i дикого типа быстро разлагается факторами Н и I.
11.2 Метод
Полученные мутанты представляют собой следующие:
Q1R2 Arg1303 заменен на Gln (пример 2),
Q1Q2 Arg1303 заменен на Gln плюс Arg1320 заменен на Gln (пример 1),
E1Q2 Arg1303 заменен на Glu плюс Arg1320 заменен на Gln (пример 5).
Всех этих мутантов получали в клетках СНО и затем очищали осаждением с помощью Na2SO4, с последующей аффинной очисткой на Clone-3-сефарозе, как описано в примере БЗ. Аналогичным образом выделяли С3 дикого типа (R1R2). По данным, полученным с помощью ДСН-ПААГ при окрашивании серебром, концентрация Q1R2 составляла от 1/5 до 1/25 по сравнению с диким типом, концентрация Q1Q2 составляла примерно 1/5 от дикого типа, и концентарция E1Q2 составляла от 1/25 до 1/125 от дикого типа. Все препараты, вероятно, содержали в основном молекулы с разрушенной тиольной сложноэфирной связью (C3i).
10 мкл этих препаратов С3 инкубировали в течение 1 ч при 37° С с 10 мкл раствора 20% (об./об.) нормальной сыворотки человека в ЗФР, содержащем 1 мМ MgCl2 и приблизительно 300 нг меченного с помощью 125I В-фактора; приблизительно 2-300000 распадов в мин). Затем 5 мкл анализировали с помощью ДСН-ПААГ (восстанавливающие условия). Высушенный гель экспонировали на авторадиографическую пленку с целью выявления положений полос, соответствующих интактному В-фактору и продуктам его расщепления. Затем полосы вырезали и подсчитывали радиоактивность для того, чтобы точно определить степень расщепления. Значение, полученное при использовании одного буфера, вычитали в качестве фонового (что включает не только фоновое расщепление, но также и разложение продуктов и других загрязнителей, присутствующих в препарате радиолиганда).
11.3 Результаты
Полученные величины расщепления В-фактора, %:
1/25 дикого типа 1,49
1/5 дикого типа 2,74
Q1R2 6,19
Q1Q2 7,41
E1Q2 6,42
Следовательно, все мутанты, устойчивые к I-фактору, вызывают более высокие уровни расщепления В-фактора по сравнению с эквивалентными количествами С3 дикого типа (C3i). Повышенные дозы или более длительные инкубации могут привести к полному выведению из строя альтернативного пути активации комплемента.
Использованные в вышеприведенных примерах сокращения имеют следующие значения:
CFD обозначает разбавитель для связывания (фиксации) комплемента (определение по Harrison и Lachmann Handbook of Experimental Immunology, 4-e изд., под ред. Weir, Herzenberg, Blackwell и Herzenberg; Blackwell, Oxford);
CFD-G - CFD, содержащий 0,1% (маc./об.) желатина; ЗФР обозначает забуференный фосфатом физиологический раствор; NGPS обозначает нормальная сыворотка морской свинки, ДСН-ПААГ обозначает электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия; SPDP обозначает N-сукцинимидил-3-[2-пиридилдитио]пропионат.
Пример 12: Мутации в остатках 992-1000
1. Введение
В других лабораториях получены данные, базирующиеся на действиях синтетических пептидов (Ganu V.S. и Muller-Eberhard H.J., 1985, Complement 2:27; Becherer J.D. и др., 1992, Biochemistry 31: 1787-1794; Fishelson Z., 1991, Molecular Immunology 28: 545-552; Lambris J.D., Ganu V.S., Hirani S. и Muller-Eberhard HJ. 1988, J. Biol. Chem. 263: 12147-12150), позволяющие предположить, что различные остатки в человеческом С3b могут участвовать во взаимодействии с Н-фактором. Заявители применили другой подход сравнения последовательностей для теоретического предсказания остатков, участвующих в специфичных для С3 функциях. Был проведен сайтнаправленный мутагенез, который показал, что большинство из этих кандидатов влияет очень незначительно или не влияет вообще на функциональную чувствительность к Н-фактору. Однако несколько мутаций действительно уменьшали чувствительность к Н-фактору. Эти мутации были созданы в частях молекулы, для которых ранее не было выявлено участие во взаимосвязи с Н-фактором или в изменении его связывания. Поэтому изменение этих определенных остатков могло быть использовано для получения мутантных производных С3, которые частично или полностью устойчивы к ингибированию Н-фактором в физиологической среде и которые могут образовывать комплексные ферменты С3-конвертазы (С3bВb и т.д.), также устойчивые к инактивации Н-фактором.
Фактор Н по строению гомологичен другим ингибирующим комплемент протеинам, включая CR1, МСР и DAF. С точки зрения этой очевидной эволюционной взаимосвязи и взаимной конкуренции за связывание, вероятно, что структура взаимодействия с С3b сходна со структурой взаимодействия с Н-фактором (Fairies и др., 1990, Complement Inflamm. 7:30-41). Следовательно, описанные мутации, которые изменяют чувствительность к Н-фактору также, возможно, будут пригодны для изменения взаимодействий с этими другими протеинами, особенно для того, чтобы активность их комплементов не подвергалась понижающей регуляции. Они также могут найти применение для модификации взаимодействия с SCR-доменами В-фактора (и с гомологичными доменами в С2, участвующими в связывании с С4b). Мутации в соответствующих областях С4 и С5 также могут оказаться пригодными для модификации их взаимодействий с SCR-доменами Сlr и Cls (C4), С4b-связывающего протеина (С4b) и С6 и С7 (С5b).
2. Метод
2.1 Поиск остатков, участвующих в специфичных для С3 функциях.
Эти теоретические предсказания были сделаны на основе сравнительного анализа первичной структуры человеческого С3 и всех гомологичных протеинов, последовательности которых были доступны из опубликованных баз данных. Они включают функционально эквивалентные молекулы мыши, крысы, морской свинки, кролика, кобры, шпорцевой лягушки, цыпленка и радужной форели, человеческого и мышиного C4, человеческого и мышиного С5, С3-подобных протеинов речной миноги и миксины, фактора яда кобры (CVF) и человеческого альфа-2-макроглобулина и их гомологов. Затем был проведен поиск остатков, консервативных для различных С3, но отчетливо отличающихся гомологией (особенно у С5 и CVF), у которых отсутствуют предоставляющие интерес С3-специфические функции. Некоторые из этих остатков изменяли так, чтобы они кодировали остатки, соответствующие остаткам в С5 или CVF, экспрессировали в клетках COS и секретируемые продукты тестировали в отношении расщепления в присутствии CVFBb и факторов Н и I. Все методы соответствуют стандартным методам и методам, описанным в примере 1. Обобщенные результаты приведены в таблице II.

2.2 Конструирование и анализ мутанта DV-1AM
Этот мутант создавали таким же образом, что и другие мутанты, используя "мегапраймерный метод", описанный у V.Picard и др., 1994, Nuc. Acid. Res. 22:2587-2591. Мутагенный праймер имел последовательность ccagatgacaagtgctgccgtcagccagtcagggctgaagcacc, кодирующую мутации E992S, D993A, D996S, A997Q, E998S и R999G. Праймер, обеспечивающий синтез против хода транскрипции, имел последовательность tgtcatcgtgccgctaaaga (соответствующую дезоксинуклеотидам в положениях 2754-2773), а праймер, обеспечивающий синтез по ходу транскрипции, имел последовательность gttttatggtgaccttaaggtcgaatttatta (комплементарную дезоксинуклеотидам 4130-4165, с встроенным сайтом расщепления, распознаваемым ферментом рестриктазой AflII в положении 4149). Мутантный фрагмент ДНК лигировали с вектором, который содержал кодирующую последовательность С3 также со встроенным сайтом AflII в положении 4149, путем отщепления обоих фрагментов с помощью AflII и EcoRI (разрезы в положении 2997), очистки требуемых продуктов и их лигирования с использованием ДНК-лигазы Т4. Плазмидную ДНК выделяли из трансформированных бактериальных колоний и истинных мутантов выявляли с помощью секвенирования ДНК. При этом установлено, что последовательность ДНК содержала дополнительную мутацию, кодирующую L1000M. Полученным экспрессирующим вектором трансфектировали клетки COS и секретированный экспрессированный продукт анализировали в отношении расщепления, как описано ранее.
3. Свойства мутанта DV-1AM
Анализ экспрессированного продукта с мутациями DV-1AM приведен на фиг.10. Следует отметить, что:
(I) анализ методом вестерн-блоттинга проведен с использованием моноклональных антител к C3dg-области C3, с его помощью выявлены предшественник, альфа-, альфа’-цепь, фрагменты с молекулярной массой 77 и 68 кДа, но не выявлены бета-цепь, фрагменты с молекулярной массой 43 или 46 кДа,
(II) все полосы, соответствующие продукту DV-1AM (полосы В1-4) находятся несколько ниже эквивалентных полос С3 дикого типа (полосы А1-4); сдвиг в подвижности является результатом полученных мутаций,
(III) расщепление С3 дикого типа с помощью CVFBb приводит к получению небольшого количества альфа’-цепи из С3b, и значительно большего количества фрагмента с молекулярной массой 68 кДа, образующегося в результате расщепления С3b с получением iC3b за счет эндогенной активности факторов Н и I (полоса A3). Добавление экзогенных факторов Н и I завершает превращение С3b в iC3b (полоса А4). В отличие от этого расщепление продукта DV-1AM с помощью CVFBb приводит к получению большего количества альфа’-цепи и только небольшого количества фрагмента с молекулярной массой 68 кДа (полоса В3). Последующее добавление экзогенных факторов Н и I позволяет превратить С3b в iC3b (полоса В4). Таким образом, мутантный С3b обладает существенной большей устойчивостью по сравнению с диким типом к эндогенным факторам Н и I, хотя устойчивость не является полной, о чем свидетельствует чувствительность к расщеплению высокими концентрациями экзогенно добавленных факторов Н и I.
4. Заключение
Мутация DV-1AM создает устойчивость к зависящему от Н-фактора расщеплению I-фактором. Механизм этого явления остается неясным, хотя поскольку модифицированные остатки расположены далеко (с точки зрения первичной структуры) от сайтов расщепления I-фактором, вероятно, ухудшается взаимодействие с Н-фактором. В этом случае мутация также будет придавать устойчивость к другим ингибирующим активностям Н-фактора, таким, как: (I) конкуренция с В-фактором за связывание с С3b (или С3i и (II) ускоренная диссоциация С3bВb- и С3bВbР-конвертазами. Мутация DV-1AM представляет собой модификацию остатков, прямо или косвенно участвующих в поддержании аффинности к Н-фактору. Многочисленные различные мутации этих остатков должны, вероятно, оказывать такие же действия, как и мутации только некоторых остатков, полученные в результате модификации в соответствии с настоящим изобретением. Мутации в других остатках в этом сегменте первичной структуры, вероятно, тоже могут привести к аналогичному эффекту.
Пример 13: Мутации остатков в положениях 1001-1005
1. Введение
Как описано в предыдущем примере, остатки 1001, 1002 и 1005 также выявлены в качестве кандидатов, которые могут оказаться существенными для С3-специфических функций. Индукция мутаций подтвердила, что модификация этих остатков может использоваться для придания устойчивости к Н-фактору.
2. Метод
2.1 Конструирование и анализ мутанта DV-1B
Использовал такой же метод, как и описанный в предыдущем примере, за исключением того, что мутагенный праймер имел последовательность aacggctgaacatattaattcataccccctcgggc, кодирующую мутации K1001N, H1002I и V1005H. Анализ последовательности выделенной плазмидной ДНК подтвердил, что мутация была интродуцирована правильно. Не обнаружено никаких других мутаций.
3. Свойства мутанта DV-1B
Анализ экспрессированного продукта с мутациями DV-1B приведен на фиг.11. Следует отметить следующие моменты.
(I) Анализ методом вестерн-блоттинга проведен с использованием поликлонального антитела к С3, с его помощью ясно выявлены предшественник, альфа-, альфа’-цепь, бета-цепь, фрагменты с молекулярной массой 43 и 46 кДа, но только слабо видны фрагменты с молекулярной массой 77 или 68 кДа. Следует отметить, что альфа- и альфа’-цепи не перемещались (остались на старте) и не выявлялись со 100%-ной эффективностью, поэтому интенсивность этих полос ниже ожидаемой и неправильно отражает действительные присутствующие количества.
(II) Расщепление С3 дикого типа с помощью CVFBb приводит к получению небольшого количества альфа’-цепи из С3b, но большая его часть теряется вследствие расщепления С3b с получением iC3b за счет эндогенной активности факторов Н и I (полоса В3). Он проявляется в основном в виде фрагмента с молекулярной массой 43 кДа, хотя видны также небольшие количества промежуточного продукта с молекулярной массой 46 кДа. Добавление 2 мкг/мл экзогенного Н-фактора (полоса В4) с I-фактором приводит к значительному дополнительному расщеплению, а добавление 10-50 мкг/мл экзогенного Н-фактора (полосы В5, В6) завершает превращение С3b в полностью расщепленный iC3b (отсутствуют полосы, соответствующие альфа’-цепи или молекулярной массе 46 кДа). Расщепление продукта DV-1B с помощью CVFBb также приводит к получению небольшого количества альфа’-цепи (полоса A3; общее количество присутствующего С3 существенно меньше и полосы, соответствующие альфа- и альфа’-цепям очень слабые). Важно, что количество цепи с молекулярной массой 43 кДа, полученное в отсутствие экзогенных факторов Н и I ниже, чем у дикого типа, а проявляющееся количество промежуточного фрагмента с молекулярной массой 46 кДа относительно выше, что свидетельствует о менее эффективном расщеплении. Добавление экзогенных факторов Н и I (полосы А4-6) завершает превращение указанного С3b в iC3b, но видно, что количество продукта с молекулярной массой 43 кДа возрастает с повышением концентрации Н-фактора до 50 мкг/мл (полоса А6), когда полоса, соответствующая промежуточному продукту с молекулярной массой 46 кДа, еще заметна. Таким образом, мутантный С3b обладает большей устойчивостью по сравнению с диким типом к эндогенным и экзогенным факторам Н и I, хотя устойчивость не является полной, о чем свидетельствует чувствительность к расщеплению высокими концентрациями экзогенно добавленных факторов Н и I.
4. Заключение
Мутация DV-1B создает устойчивость к зависящему от Н-фактора расщеплению I-фактором. Механизм этого явления остается неясным, хотя, поскольку модифицированные остатки расположены далеко (с точки зрения первичной структуры) от сайтов расщепления I-фактором, а эффект зависел от дозы добавленного Н-фактора, возможно, что при этом ухудшается взаимодействие с Н-фактором. В этом случае мутация также будет придавать устойчивость к другим ингибирующим активностям Н-фактора, таким, как: (I) конкуренция с В-фактором за связывание с С3b (или C3i) и (II) ускоренная диссоциация С3bВb- и С3bВbР-конвертазами. Мутация DV-1B представляет собой модификацию остатков, прямо или косвенно участвующих в поддержании аффинности к Н-фактору. Многочисленные различные мутации остатков должны, вероятно, оказывать такие же действия, как и мутация только некоторых остатков, модифицированных в соответствии с настоящим изобретением. Мутации в других остатках в этом сегменте первичной структуры, вероятно, также могут привести к аналогичному эффекту.
Пример 14: Мутации остатков в положениях 1152-1155
1. Введение
Как описано в предыдущих примерах, остатки 1152, 1153 и 1555 также выявлены в качестве кандидатов, которые могут оказаться существенными для С3-специфических функций. Индукция мутаций подтвердила, что модификация этих остатков может использоваться для придания устойчивости к Н-фактору.
2. Метод
2.1 Конструирование и анализ мутанта DV-6
Использовали такой же метод, как и описанный в предыдущем примере, за исключением того, что мутагенный праймер имел последовательность atctcgctgcgcaaggctttcgatatttgcgag, кодирующую мутации Q1152R, Е1153К и K1155F. Анализ последовательности выделенной плазмидной ДНК подтвердил, что была интродуцирована правильная мутация. Не обнаружено никаких других мутаций.
3. Свойства мутанта DV-6
Анализ экспрессированного продукта с мутациями DV-6 приведен на фиг.11. Следует отметить следующие моменты.
(I) Как описано в предыдущем примере, анализ методом вестерн-блоттинга проведен с использованием поликлонального антитела к С3, с его помощью ясно выявлены предшественник, альфа-, альфа’-цепь, бета-цепь, фрагменты с молекулярной массой 43 и 46 кДа, но только слабо видны фрагменты с молекулярной массой 77 и 68 кДа. Следует отметить, что альфа- и альфа’-цепи не перемещались и не выявлялись со 100% эффективностью, т.е. интенсивность этих полос ниже ожидаемой и неточно отражает действительные присутствующие количества.
(II) Расщепление С3 дикого типа с помощью CVFBb приводит к получению небольшого количества альфа’-цепи С3b, но большая его часть теряется вследствие расщепления С3b с получением iС3b за счет эндогенной активности факторов Н и I (полоса В3). Он проявляется в основном в виде фрагмента с молекулярной массой 43 кДа, хотя видны также небольшие количества промежуточного продукта с молекулярной массой 46 кДа. Добавление 2 мкг/мл экзогенного Н-фактора (полоса В4) с I-фактором приводит к значительному дополнительному расщеплению, а добавление 10-50 мкг/мл экзогенного Н-фактора (полосы В5, В6) завершает превращение С3b в полностью расщепленный iC3b (не проявляются полосы, соответствующие альфа’-цепи или фрагменту с молекулярной массой 46 кДа). Расщепление продукта DV-6 с помощью CVFBb также приводит к получению небольшого количества альфа’-цепи (полоса С3). Важно, что количество цепи с молекулярной массой 43 кДа, полученное в отсутствие экзогенных факторов Н и I ниже, чем у дикого типа, а проявляющееся количество промежуточного фрагмента с молекулярной массой 46 кДа относительно выше, что свидетельствует о меньшей эффективности расщепления. Добавление экзогенных факторов Н и I (полосы С4-6) завершает превращение указанного С3b в iC3b. Однако, в то время, как при использованииС3 дикого типа промежуточный продукт с молекулярной массой 46 кДа элиминировался при концентрации Н-фактора 10 мкг/мл (полоса В5), что свидетельствует о полном расщеплении, изученные виды с мутацией, изменяющей чувствительность к Н-фактору, еще сохраняются при этой концентрации (полоса С5) и полное расщепление было обнаружено только при использовании концентрации Н-фактора 50 мкг/мл. Таким образом, мутантныйС3Ь обладает большей устойчивостью по сравнению с диким типом к эндогенным факторам Н и I, хотя устойчивость не является полной, о чем свидетельствует чувствительность к расщеплению высокими концентрациями экзогенно добавленных факторов Н и I.
4. Заключение
Мутация DV-6 создает устойчивость к зависящему от Н-фактора расщеплению I-фактором. Механизм этого явления остается неясным, хотя поскольку модифицированные остатки расположены далеко (с точки зрения первичной структуры) от сайтов расщепления I-фактором, а эффект зависел от дозы добавленного Н-фактора, возможно, что при этом ухудшается взаимодействие с Н-фактором. В этом случае мутация также будет придавать устойчивость к другим ингибирующим активностям Н-фактора, таким, как: (I) конкуренция с В-фактором за связывание с С3b (или С3i) и (II) ускоренная диссоциация С3bВb- и С3bВbР-конвертазами. Мутация DV-6 представляет собой модификацию остатков, прямо или косвенно участвующих в поддержании аффинности к Н-фактору. Многочисленные различные мутации этих остатков должны, вероятно, оказывать такие же действия, как и мутация только некоторых остатков, модифицированных в соответствии с настоящим изобретением. Мутации в других остатках в этом сегменте первичной структуры, вероятно, также может привести к аналогичному эффекту.
Пример 15: Модификация остатков 1546-1663
1. Введение
В отличие от предыдущих примеров (12-14) модификация остатков 1546-1663 не основывалась на сравнительном рассмотрении последовательностей С3 и родственных протеинов. Вместо этого описанная модификация была создана случайно в результате непреднамеренной делеции нуклеотидов, которая привела к мутации "сдвига рамки считывания" при трансляции С-концевых остатков. Образовавшийся продукт проявлял выраженную устойчивость к зависящему от Н-фактора расщеплению I-фактором. Таким образом, аналогичные, специально созданные модификации, вероятно, будут пригодны для придания устойчивости к регуляторным действиям Н-фактора и/или I-фактора.
2. Метод
Вектор, эквивалентный NC3, но несущий дополнительные мутации 3151g, 3152g, 3154а, 3156с, 3159с, 3163а, 3165t, 3167t, 3168t, которые транслируются в аминокислотные замены T1031G, E1032N, Q1033H, E1035N и K1036I, расщепляли с помощью рестриктаз Pvul (разрезы в последовательности вектора) и BsrGI (разрезы на нуклеотиде 4692) и выделяли полосу длиной 6,1 т.п.н. с помощью электрофореза в агарозном геле. Другой вектор, эквивалентный NC3, но несущий вставку catcatcatcatcatcat после нуклеотида 5049, кодирующую аминокислотную вставку НННННН на С-конце, аналогичным образом расщепляли с помощью Pvul и BsrGI и выделяли фрагмент длиной 4,4 т.п.н. Эти два фрагмента ДНК лигировали вместе и выделяли полную плазмиду. Секвенирование ДНК показало, что был потерян один нуклеотид (а4696 или а4697). Высказано предположение, что аминокислоты 1546-1663 не могут транслироваться в рамке считывания. Вместо этого будут считываться 48 остатков нормальной рамки до достижения стоп-кодона.
Продукт "HDV-3X" экспрессировали в клетках COS и тестировали согласно предыдущим примерам.
3. Свойства мутанта HDV-3X
Анализ экспрессированного продукта с модификациями HDV-3X приведен на фиг.12. Следует отметить следующие моменты.
(I) Анализ методом вестерн-блоттинга проведен с использованием моноклональных антител к С3dg-области С3, с его помощью выявлены предшественник, альфа-, альфа’-цепь, фрагменты с молекулярной массой 77 и 66 кДа, но не обнаружены бета-цепь, фрагменты с молекулярной массой 43 или 46 кДа.
(II) HDV-3X сравнили с мутантом DV-3, как с эквивалентным продуктом без дополнительной С-концевой модификации. HDV-3X имеет меньшую альфа-цепь, но нормального размера продукты с молекулярной массой 68 и 77 кДа, что согласуется с укорочением С-конца.
(III) Расщепление мутанта С3 DV-3 с помощью CVFBb в присутствии I-фактора приводит к получению небольшого количества альфа’-цепи из С3b, но большего количества фрагмента с молекулярной массой 68 кДа, образовавшегося в результате расщепления С3b с получением iC3b за счет эндогенного Н-фактора (полоса А2). Добавление экзогенного Н-фактора завершает превращение С3b в С3b (полосы A3-5). Превращение фактически полностью завершается при использовании только 1 мкг/мл Н-фактора (полоса A3). В противоположность этому расщепление продукта HDV-3X с помощью CVFBb приводит к получению большего количества альфа’-цепи и только незначительного количества фрагмента с молекулярной массой 68 кДа (полоса В2). Добавление экзогенного Н-фактора не оказывает влияния на превращение указанного С3b в iC3b (полосы В3-5). Только незначительное образование продуктов с молекулярной массой 68 и 77 кДа можно обнаружить при концентрации Н-фактора 25 мкг/мл (полоса А5). Таким образом, мутант С3b HDV-3X обладает большей устойчивостью по сравнению с диким типом к эндогенным факторам Н и I. Тот факт, что устойчивость частично преодолевается более высокими концентрациями Н-фактора, позволят предположить, что аффинность в отношении Н-фактора может быть в значительной степени пониженной.
4. Заключение
Модификация HDV-3X создает устойчивость к зависящему от Н-фактора расщеплению I-фактором. Механизм этого явления остается неясным, хотя, поскольку модифицированные остатки расположены далеко (с точки зрения первичной структуры) от сайтов расщепления I-фактором, а эффект зависел от дозы добавленного Н-фактора, возможно, что при этом ухудшается взаимодействие с Н-фактором. В этом случае мутация также будет придавать устойчивость к другим ингибирующим активностям Н-фактора, таким, как: (I) конкуренция с В-фактором за связывание с С3b (или С3i) и (II) ускоренная диссоциация С3bВb- и С3bВbР-конвертазами. Модификация HDV-3X влияет прямо или косвенно на остатки, участвующие в поддержании аффинности к Н-фактору. Многочисленные различные делеции или мутации этих остатков должны, вероятно, оказывать такие же действия, как и делеция или мутация только некоторых остатков, полученных в результате модификации в соответствии с настоящим изобретением. Вероятно они также могут привести к аналогичному эффекту.
Модификация HDV-3X не создана целенаправленно. Но методы, выбранные для создания ее и родственных модификаций, вероятно, должны представлять собой специфические методы сайтнаправленного мутагенеза, в том числе методы, описанные в предыдущих примерах.
Пример 16: Модификация остатков в положениях 954 и 955 с целью предотвращения опосредованного I-фактором расщепления в этом сайте
1. Введение
Описанное выше изменение остатков Р1 (1303 и 1320) обеспечило устойчивость к расщеплению I-фактором в первых двух сайтах (примеры 1-6). Не было известно, может ли предотвращение расщепления в этих двух сайтах также предотвращать расщепление в третьем сайте, ответственном за выделение С3с из C3dg. Это третье расщепление, которое в норме зависит от CR1 (связанный с мембраной рецептор, созданный в растворимой форме, sCR1) в качестве кофактора, является относительно медленным и ранее было обнаружено только на iC3b (или iC3i) (т.е. после расщепления в сайтах 1 и 2), и не обнаружено на С3i или С3b. Для исследования этого вопроса использовали мутант E1Q2 (описанный в примере 11), который обладает высокой устойчивостью к расщеплению в сайтах 1 и 2. Если бы этот мутант еще сохранял чувствительность к расщеплению в сайте 3, то это свидетельствовало бы о том, что целесообразно индуцировать мутации в этом сайте с целью предотвращения разложения молекулы в физиологических жидкостях. Однако в литературе имеются противоречивые данные о том, происходит ли расщепление исключительно на связи 954-955 (Davis A.E., Harrison R.A. и Lachmann P.J., 1984, J. Immunol. 132: 1960-1966), или расщепление также может происходить в других положениях, таких, как 959-960 (Harrison R.A. и др., 1996, Molecular Immunology 33, Доп.1, 59, реферат 235; Ekdahl K.N., Nilsson U.R. и Nilsson В., 1990, J. Immunol. 144: 4269-4274). Первоначально заменяли остаток аргинина на остаток глутаминовой кислоты в положении 954 (создавая мутацию E1Q2E3) поскольку: (I) из вышеуказанных публикаций ясно, что имеется остаток Р1 одного из сайтов расщепления и (II) из примера 5 ясно, что замена на глутаминовую кислоту в сайте 1 придала более высокую устойчивость к расщеплению, чем другие замены. Кроме того, С3 других видов млекопитающих (мышь, крыса, морская свинка, кролик) имеет глутамин и глицин вместо аргинина и глутаминовой кислоты в положениях 954 и 955, эквивалентных человеческому С3 (например, см. у Mavroidis M., Sunyer J.O. и Lambbris J.D., 1995 J. Immunol. 154: 2164-2174). Эти данные позволяют предположить, что этот сайт (954-955) не будет в достаточной мере расщепляться у других видов и что существует другой сайт, такой, как 959-960, который, вероятно, является более важным (Harrison R.A. и др., 1996, Molecular Immunology 33, Доп.1, 59, реферат 235). Таким образом, для человеческого С3 были сделаны эквивалентные мутации Arg954 → Gln и Glu955 →Gly с целью создания мутанта E1Q2QG3.
2. Метод
Для создания мутанта использовали такой же метод, как и описанный в предыдущих примерах, за исключением того, что мутагенный праймер для E1Q2E3 имел последовательность gaacgcctgggcgaagaaggagtgcag, кодирующую мутацию R954E, и мутагенный праймер для E1Q2QG3 имел последовательность aacgcctgggccaaggaggagtgcagaa, кодирующую мутации R954Q, E995G. Продукт лигировали в конструкцию, которая содержала мутации, кодирующие E1Q2 (Е1303, Q1320, как описано в примерах 5 и 11). Анализ последовательности выделенной плазмидной ДНК подтвердил, что была интродуцирована правильная мутация. Не было обнаружено других мутаций. Полученными экспрессирующими векторами трансфектировали клетки COS и секретированный экспрессированный продукт анализировали в отношении реакций расщепления, как описано ранее.
3. Опосредованные I-фактором расщепления мутантов E1Q2, E1Q2E3 и E1Q2QG3
Анализ экспрессированных продуктов приведен на фиг.13. Следует отметить следующие моменты.
(I) Анализ методом вестерн-блоттинга проведен с использованием моноклональных антител к C3dg-области C3, с его помощью выявлены предшественник, альфа-, альфа’-цепь, фрагменты с молекулярной массой 77 и 68 кДа, но не выявлены бета-цепь, фрагменты с молекулярной массой 43 или 46 кДа. Кроме того, мог быть обнаружен продукт расщепления сайта 3 с молекулярной массой 86 кДа без расщепления в сайтах 1 или 2.
(II) На чертеже видно, что продукт с молекулярной массой 86 кДа действительно образован путем опосредованного I-фактором расщепления E1Q2 в присутствии sCR1 (полоса A3), но не в случае, когда Н-фактор является кофактором (полоса А2).
(III) Продукт с молекулярной массой 86 кДа не образуется ни в мутанте E1Q2E3 (С), ни в мутанте E1Q2QG3 (В) даже в присутствии sCRl (C3 и В3).
4. Заключение
(I) Опосредованное I-фактором расщепление в сайте 3 может еще иметь место, когда расщепления в сайтах 1 и 2 заблокированы. Следовательно, дополнительное блокирование расщепления в сайте 3 целесообразно для предотвращения разложения в физиологической среде любого мутантного продукта, который в противном случае обладает устойчивостью к расщеплению только в сайтах 1 и 2.
(II) Расщепление в сайте 3 может быть блокировано с помощью замены остатка в положении 954 на Glu и с помощью замены остатков в положениях 954 и 955 на Gln и Gly. Таким образом, другие замены остатков в положении 954 и/или 955 также, вероятно, придают устойчивость к расщеплению в сайте 3.
(Ill) Указанные мутации не позволяли осуществлять расщепление в других предполагаемых положениях третьего сайта расщепления (таких, как 959-960), даже хотя эти сайты были не несли мутаций. Это может свидетельствовать о том, что либо только нуклеотиды в положениях 954-955 представляют собой важный сайт расщепления, либо что для других расщеплений требуется предварительное расщепление в положении 954-955, либо что индукция других мутаций в этих остатках препятствует расщеплению в других положениях с помощью иного механизма (такого, как конформационное искажение). В любом случае мутации в положении 954 и/или 955 представляют собой эффективное средство предотвращения разложения С3b- или С3i- подобных продуктов.
Пример 17: Модификации С-концевой области С3, ингибирующие расщепление I-фактором
1. Введение
В примере 15 представлено доказательство того, что мутация или делеция остатков в положениях 1546-1663 придает устойчивость к расщеплению I-фактором. В этом примере представлены дополнительные меньшие по масштабу мутанты, которые также обусловливают эту устойчивость, а также различные мутации, которые не обладают этим свойством.
2. Метод
Для создания мутанта использовали такой же метод, как и описанный в предыдущих примерах, за исключением того, что мутагенные праймеры, кодирующиеся указанные мутации, имели последовательности, приведенные в таблице III. Анализ последовательности выделенной плазмидной ДНК подтвердил, что была интродуцирована правильная мутация. Никаких других мутаций не выявлено. Полученными экспрессирующими векторами трансфектировали клетки COS и секретированный экспрессированный продукт анализировали в отношении реакций расщепления, как описано ранее.

3. Устойчивость различных мутантов к расщеплению I-фактором
Результаты опытов по расщеплению этих мутантов, проведенные с использованием факторов I и Н, приведены на фиг.14 и 15. Следует отметить, что анализ методом вестерн-блоттинга проведен с использованием моноклональных антител к C3dg-области С3, с его помощью выявлены предшественник, альфа-, альфа’-цепь, фрагменты с молекулярной массой 77 и 68 кДа, но не выявлены бета-цепь, фрагменты с молекулярной массой 43 или 46 кДа.
На фиг.14 видно, что С3 дикого типа (Nc3, А), продукты FT-3 (D), FT-4 (Е) и FT-5 (F) расщеплялись I-фактором, о чем свидетельствует появления полос, соответствующих молекулярной массе 77 кДа и/или 68 кДа и исчезновение альфа-цепи. В противоположность этому продукты FT-1 и FT-2 не расщеплялись.
На фиг.15 видно, что С3 дикого типа (NC3, А), продукты FR-1 (В), FR-2 (С), FR-3 (D) и FR-4 (Е) расщеплялись, несмотря на то, что в том случае продукт FT-2 (F) расщеплялся.
4. Заключение
(I) Даже небольшого усечения FT-2 достаточно для придания устойчивости к расщеплению I-фактором. Такая устойчивость, следовательно, может достигаться с помощью делеции некоторых или всех остатков в положениях 1636-1663. Это заключение подтверждается устойчивостью, которую проявляет FT-1, несущий делецию остатков в положениях 1636-1663 в дополнение к делеции/модификации остатков в положениях 1591-1635.
(II) Поскольку остатки в положениях 1636-1663 необходимы для опосредованного I-фактором расщепления, многие другие модификации этих остатков, вероятно, могут обусловливать устойчивость.
(III) Не все модификации этих остатков придают устойчивость. Неэффективные модификации включают таковые, обозначенные, как FT-5, FR-1, FR-2, FR-3 и FR-4, а также модификации, обозначенные, как FT-3 и FT-4, которые модифицируют остатки, отличные от остатков в положениях 1636-1663.
(IV) Эти данные позволяют предположить, что остатки внутри области 1636-1663, которые необходимы для расщепления, представляют собой остатки, которые не были модифицированы посредством FT-5, FR-1, FR-2, FR-3 или FR-4. Таким образом, некоторые из остатков в положениях 1649-1660 могут иметь решающее значение.
Библиография
1. Bergmann М. и Fruton J.S. (1941) Adv. EnzymoL, 1:63-98.
2. de Bruijn М.Н. и Fey G.H. (1985) Proc. Natl. Acad. Sci. U.S.A., 82:708-712.
3. Crawford М.Н. и др. (1988) Circulation., 78:1449-1458.
4. Daha M.R. и van Es L.A. (1982) Immunol., 43:33-38.
5. Farries T.C., Lachmann P.J. и Harrison R.A. (1988) Biochem. J., 252:47-54.
6. Farries T.C., Lachmann P.J. и Harrison R.A. (1988) Biochem. J., 253:667-675.
7. Forty J., Hasan R., Саrу N.. White D.J. и Wallwork J. (1992) Transplant. Proc., 24:488-489.
8. Fritzinger D.C. и др. (1992) J. Immunol., 149:3554-3562.
9. Harrison R.A. и Lachmann P.J. (1980) Mol. Immunol., 17:9-20.
10. Kalli K.R., Hsu Р. и Fearon D.T. (1994) Springer Semin. Immunopathol, 15:417-431.
11. Kinoshita Т., Takata Y., Kozono H., Takeda J., Hong K.S. и Inoue K. (1988) J. Immunol, 141:3895-3901.
12. McNeamey T.A., Odell С., Holers V.M., Spear P.O., Atkinson J.P. (1987) J. Exp. Med., 166:1525-1535.
13. Nicol P.A.E. и Lachmann P.J. (1973) Immunol, 24: 259-275.
14. Pangburn М.К. и Muller-Eberhard H.J. (1984) Springer Semin, Immunopathol, 7:163-192.
15. Rother К. и Till G.O. (ред.) (1988) "The complement System" (Springer-Verlag Berlin Heidelberg, Германия).
16. Van den Berg C.W., Aerts P.C. и Van Dijk H. (1991) J. Immunol. Methods, 136:287-294.
17. Vogel C.W., Smith C.A. и Muller-Eberhard H.J. (1984) J. Immunol., 133:3235-3241.
18. Weisman H.F. и др. (1990) Science, 249:146-151.
19. Wu R. (ред.) Methods EnzymoL, 217: главы 12-14 (Academic Press, San Diego, U.S.A.).
20. Botto M., Fong K.Y., So A.K., Koch С. и Walport M.J. (1990) J. Exp. Med., 172:1011-1017.
21. Sambrook J., Fritsch E.F. и Maniatis T. (1989) " Molecular Cloning. A Laboratory Manual", 2-е изд. (Cold Spring Harbor Laboratory Press).
22. Fishelson Z. (1991) Mol. Immunol., 28:545-552.
23. Taniguchi-Sidle А. и Isenman D.E. (1993) Mol. Immunol., 30:54.
24. Lambris J.D., Avila D., Becherer J.D. и Muller-Eberhard H.J. (1988) J. Biol. Chem., 263:12147-12150.
25. Taniguchi-Sidle А. и Isenman D.E. (1992) J. Biol. Chem., 267: 635-643. 26. Hofer В. и Kuhlein В. (1993) Methods EnzymoL, 217:173-189.
27. Morinaga Y. Franceschini Т., Inouye S. и Inouye M. (1984) Biotechnology, 2:636-639.
28. Harrison R.A. и Lachmann P.J. (1986) "Handbook of Experimental Immunology" (под ред. Weir, Herzenberg, Blackwell и Herzenberg; Blackwell, Oxford), 4-е изд.
29. Kotwal G. J. и Moss В., Nature (1988) 335 (6186):176-178.















| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЙ C3 БЕЛОК ЧЕЛОВЕКА, ФРАГМЕНТ ДНК, КОНЪЮГАТ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ УМЕНЬШЕНИЯ КОЛИЧЕСТВА БЕЛКА | 1995 |
|
RU2194713C2 |
| ГУМАНИЗИРОВАННОЕ АНТИТЕЛО К КОНФОРМАЦИОННОМУ ЭПИТОПУ С3 КОМПОНЕНТА КОМПЛЕМЕНТА ЧЕЛОВЕКА, ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), ЭКСПРЕССИОННЫЙ ВЕКТОР, СОДЕРЖАЩИЙ ПОСЛЕДОВАТЕЛЬНОСТЬ ДНК (ВАРИАНТЫ), И ШТАММ КЛЕТОК ЯИЧНИКОВ КИТАЙСКОГО ХОМЯЧКА CHO-humC34-ПРОДУЦЕНТ ДАННОГО ГУМАНИЗИРОВАННОГО АНТИТЕЛА | 2016 |
|
RU2630647C1 |
| АНТИТЕЛА ПРОТИВ C3b И СПОСОБЫ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ СВЯЗАННЫХ С КОМПЛЕМЕНТОМ НАРУШЕНИЙ | 2008 |
|
RU2473563C2 |
| ВАРИАНТЫ CRIG С СОЗРЕВШЕЙ АФФИННОСТЬЮ | 2009 |
|
RU2553517C2 |
| СПОСОБ ЛЕЧЕНИЯ ДИССЕМИНИРОВАННОГО ВНУТРИСОСУДИСТОГО СВЕРТЫВАНИЯ КРОВИ ПУТЕМ ИНГИБИРОВАНИЯ MASP-2 ЗАВИСИМОЙ АКТИВАЦИИ КОМПЛЕМЕНТА | 2010 |
|
RU2600876C2 |
| САЙТ-НАПРАВЛЕННАЯ МОДИФИКАЦИЯ FVIII | 2005 |
|
RU2423380C2 |
| КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ MASP-2-ЗАВИСИМОЙ АКТИВАЦИИ КОМПЛЕМЕНТА | 2012 |
|
RU2636038C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОГО ЖИВОТНОГО | 1990 |
|
RU2252533C2 |
| СПОСОБ ТРАНСПЛАНТАЦИИ ЖИВОТНОЙ КЛЕТКИ, ТКАНИ ИЛИ ОРГАНА РЕЦИПИЕНТУ И СРЕДСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1990 |
|
RU2195956C2 |
| МУТАГЕНЕЗ ДНК ЗА СЧЕТ НЕУПОРЯДОЧЕННОЙ ФРАГМЕНТАЦИИ И ВТОРИЧНОЙ СБОРКИ | 1995 |
|
RU2157851C2 |





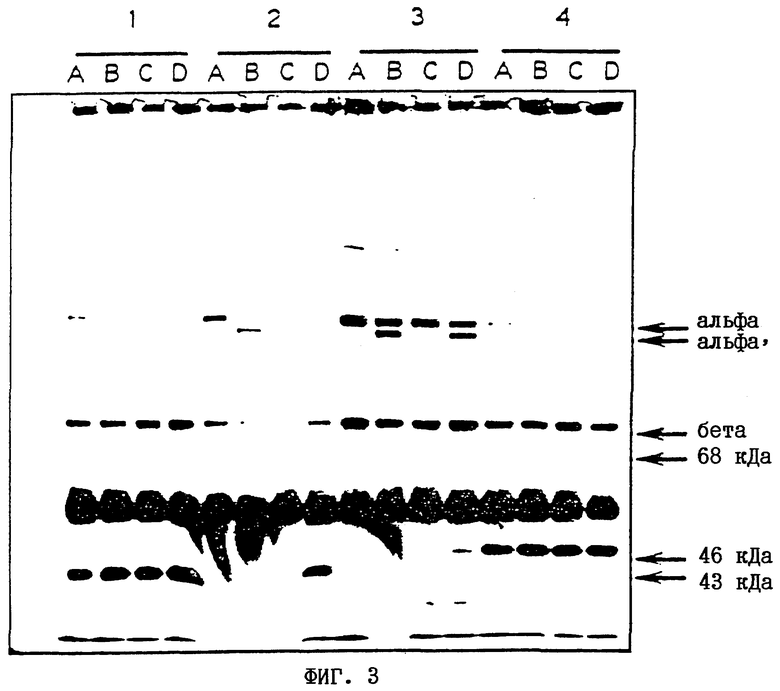

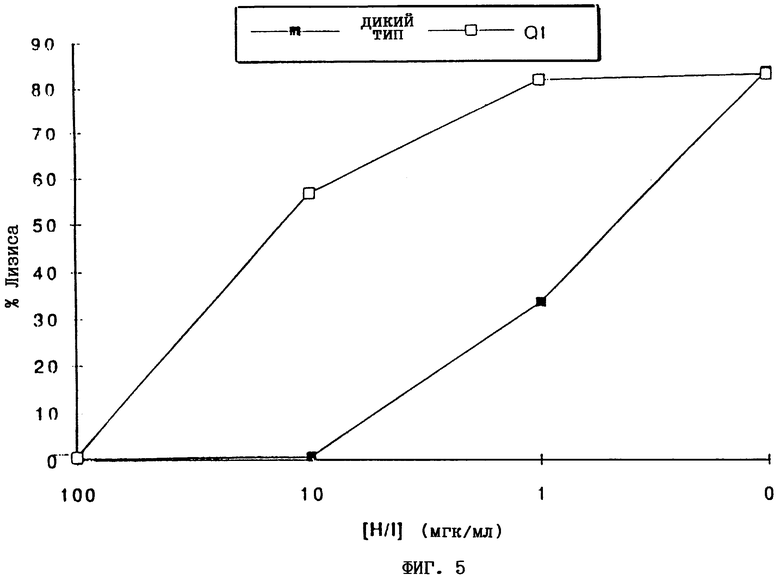


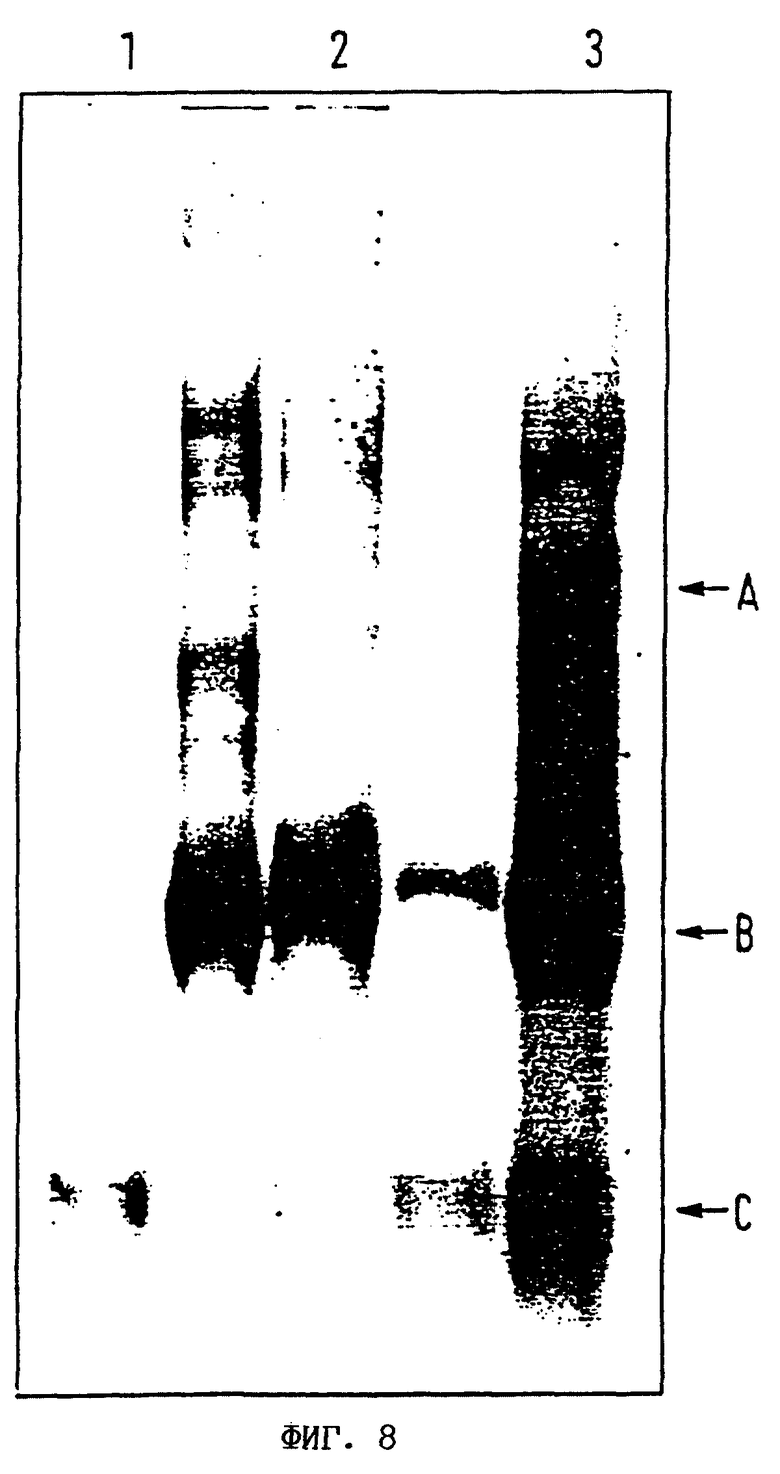
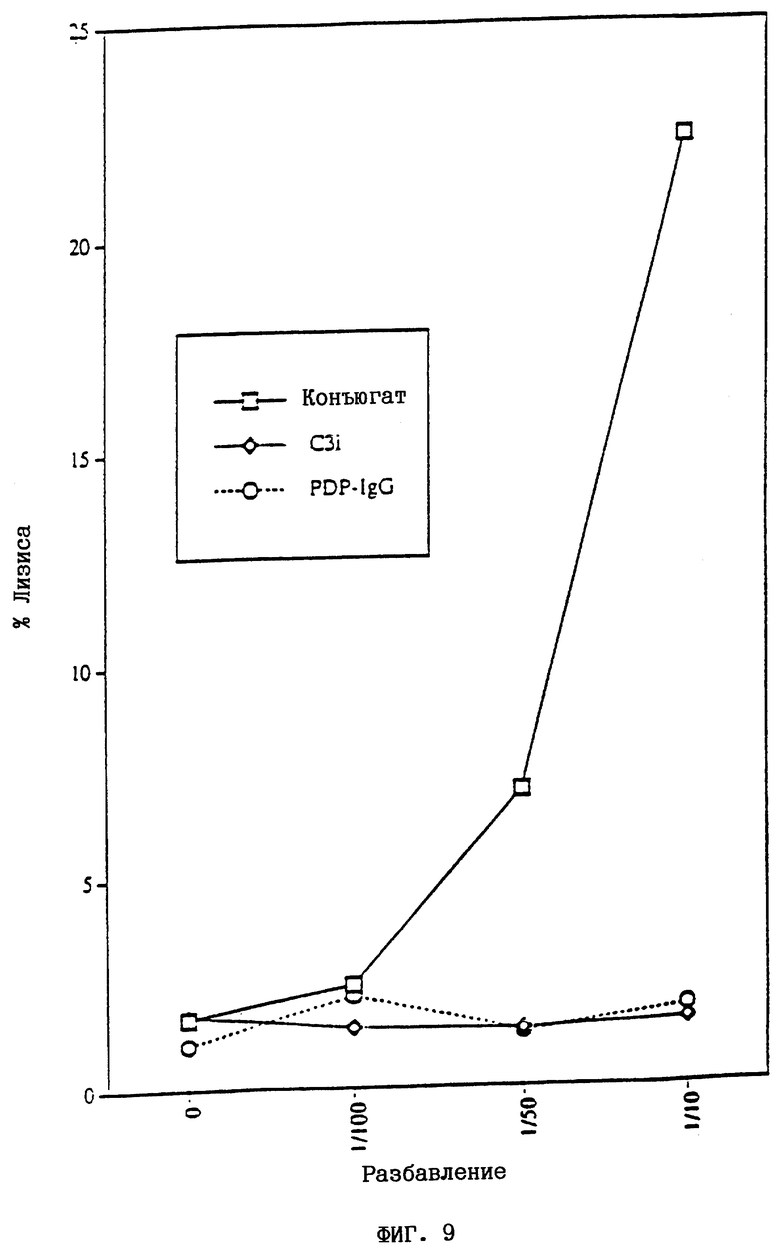
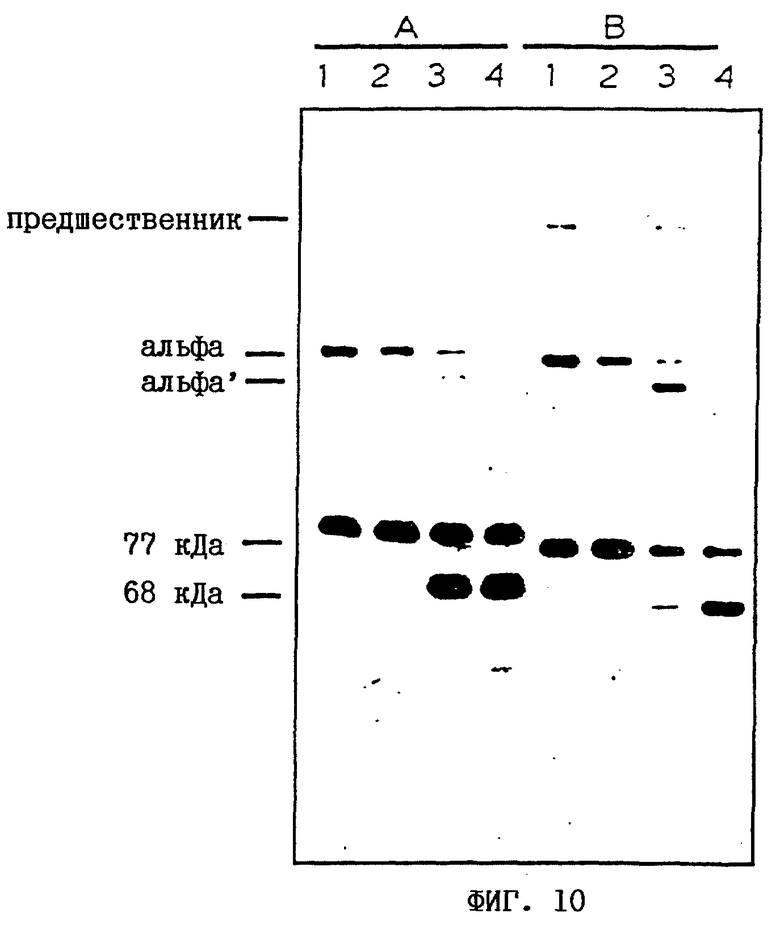





Изобретение относится к области биотехнологии и может быть использовано в медицине. В изобретении описаны нативные протеины пути активации комплемента, модифицированные таким образом, что протеин способен образовывать С3-конвертазу, устойчивую к понижающей регуляции. Предпочтительно модифицированный протеин представляет собой модифицированный человеческий протеин С3. Также описаны последовательности ДНК, кодирующие такие протеины, наряду с конструкциями ДНК. Описаны также конъюгаты, включающие такие протеины и специфично связывающий фрагмент, например, антитело, а также применение таких протеинов и/или конъюгатов в терапии. Изобретение можно применять для людей in vivo для активации комплемента, и получать препарат, который неиммуногенен для людей при его использовании. 7 н. и 28 з.п.ф-лы, 15 ил., 3 табл.
| US 4661347 А, 28.04.1987 | |||
| TANIGUCHI-SIDLE, A | |||
| et al | |||
| Journal of.Immunology, 1994, vol.153, p.5285-5302 | |||
| PANGBURN M.K., J.Immunol, 1989, 142(8), p.2759-2765. |
Авторы
Даты
2004-10-20—Публикация
1997-03-04—Подача