Область техники, к которой относится изобретение
Настоящее изобретение относится к термостабильным ДНК-полимеразам, обладающим повышенной эффективностью в отношении включения нуклеозидтрифосфатов, меченных красителями из класса флуоресцеина. В настоящем изобретении описаны способы выделения и получения таких модифицированных полимераз. Область применения ферментов по изобретению достаточно широка, в частности они находят применение в молекулярной биологии и прежде всего предпочтительны для секвенирования нуклеиновых кислот.
Предпосылки создания изобретения
Включение нуклеозидтрифосфатов (дНТФ), меченных флуоресцентными красителями, важно для многих случаев, когда используют синтез ДНК in vitro. Например, реакции секвенирования ДНК с использованием окрашенных терминаторов требуют включения флуоресцентных аналогов дидезоксинуклеотидов для терминации и мечения. Кроме того, при синтезе меченых продуктов in vitro может использоваться включение флуоресцентных нуклеотидов или аналогов нуклеотидов. Например, флуоресцентно меченную ДНК применяли в опытах по гибридизации с использованием упорядоченных микронаборов иммобилизованных зондов (Cronin и др., 1996, Human Mutation 7: 244).
Для обеспечения точности репликации ДНК ДНК-полимеразы обладают выраженной способностью к включению в растущую цепь естественных для них субстратов, которые в контексте настоящего описания называют обычными дезоксинуклеозидтрифосфатами (дНТФ), и способностью не включать необычные дНТФ, такие как дНТФ и аналоги дНТФ, меченные флуоресцентными красителями. В клетке эта способность приводит к уменьшению включения аномальных оснований, таких как дУТФ, в растущую цепь ДНК. Это свойство особенно ясно проявляется в опытах in vitro, когда присутствуют как обычные, так и необычные флуоресцентно меченные нуклеозидтрифосфаты, например в реакциях секвенирования ДНК с использованием варианта метода терминации дидезокси-цепи, основанного на применении окрашенных терминаторов (Lee и др., 1992, Nucl. Acids Res. 20: 2471, и эта публикация включена в настоящее описание в качестве ссылки).
Поступающие в продажу наборы для циклического секвенирования ДНК, предназначенные для методов, основанных на применении окрашенных терминаторов, содержат в качестве терминаторов цепи ддНТФ, меченные флуоресцентными красителями из класса родамина. Однако родаминовые красители биполярны по заряду, а нуклеозидтрифосфаты, меченные этими красителями, аномально мигрируют в электрофоретических гелях, которые применяются для разделения продуктов секвенирования с целью их обнаружения. Это свойство красителей из класса родамина требует внесения модификаций в стандартный протокол секвенирования, предусматривающий использование дезоксиинозинтрифосфата (дИТФ) и дополнительной стадии процессинга перед электрофорезом.
В отличие от этого отрицательно заряженные флуоресцентные красители, такие как красители из класса флуоресцеина, по сравнению с нейтральными или положительно заряженными флуоресцентными красителями способствуют 1) лучшему разделению меченых нуклеозидтрифосфатов и меченых продуктов удлинения праймера и 2) лучшей электрофоретической миграции меченых продуктов секвенирования. Таким образом, применение красителей из класса флуоресцеина устраняет необходимость в дополнительных стадиях процессинга, которые требуются в случае использования красителей из класса родамина. Однако доступные красители из класса флуоресцеина не являются идеальными для применения в форматах циклического секвенирования ДНК, имеющихся в продаже в настоящее время, поскольку при использовании этих форматов ддНТФ, меченные этими красителями, не включаются достаточно эффективно в продукты секвенирования. Таким образом, существует необходимость в разработке для целей продажи термостабильных ДНК-полимераз, которые могут эффективно включать как обычные, так и флуоресцентно меченные нуклеотиды. Настоящее изобретение направлено на решение этой задачи. Кроме того, неожиданным свойством мутантных ферментов по настоящему изобретению является более высокая скорость удлинения праймера по сравнению с соответствующим ферментом дикого типа. Другим неожиданным свойством является более высокая однородность включения различных нуклеотидов-терминаторов при автоматизированном анализе последовательности ДНК.
Краткое изложение сущности изобретения
Настоящее изобретение относится к зависимым от матрицы термостабильным ДНК-полимеразам, которые обладают пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с ранее описанными ферментами. Эти ферменты позволяют включать нуклеотиды, в том числе дезоксинуклеотиды (дНТФ) и аналоги оснований, такие как дидезоксинуклеотиды (ддНТФ), меченные красителями из класса флуоресцеина, более эффективно в сравнении с обычными термостабильными ферментами. В настоящем изобретении также описаны гены, кодирующие эти ферменты, а также рекомбинантные векторы экспрессии, предназначенные для получения больших количеств очищенных ферментов.
В соответствии с настоящим изобретением в термостабильных ДНК-полимеразах выявлена область, имеющая наиболее важное значение (критическая область), которая ответственна за способность полимеразы включать нуклеотиды, меченные красителями из класса флуоресцеина, сохраняя при этом способность правильно включать естественные нуклеотиды. С целью реализации преимуществ изобретения в гены термостабильной ДНК-полимеразы с помощью методов рекомбинантной ДНК, таких как сайтспецифический мутагенез, может быть интродуцирована эта имеющая наиболее важное значение область или "критический мотив".
Таким образом, одним из объектов изобретения являются рекомбинантные термостабильные ферменты - ДНК-полимеразы, которые отличаются тем, что эти ферменты содержат мутации, обеспечивающие получение критического мотива, и они обладают пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с соответствующим ферментом дикого типа.
В соответствии с этим аспектом в изобретении предлагаются рекомбинантные термостабильные ферменты - ДНК-полимеразы, которые отличаются тем, что а) в своей нативной форме указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1) (дана в однобуквенном коде), где Х обозначает любую аминокислоту; б) Х в положении 4 этой последовательности изменен по сравнению с указанной нативной последовательностью при условии, что Х не заменен на Е (глутамин); и в) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с нативной формой указанного фермента. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaXaaProXaaXaaGlu (SEQ ID NO:1), где "Хаа" в положениях 3, 4, 6, 9 и 10 этой последовательности обозначает остаток любой аминокислоты, а "Хаа" в положении 7 этой последовательности обозначает Val или Ilе.
В другом варианте рекомбинантные термостабильные ДНК-полимеразы отличаются тем, что а) нативная форма полимеразы включает аминокислотную последовательность LS(Q/G)XL(S/A)IPYEE (SEQ ID NO: 2), где Х обозначает любую аминокислоту; б) X в положении 4 указанной последовательности изменен по сравнению с указанной нативной последовательностью при условии, что Х не заменен на Е; и в) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с нативной формой указанного фермента. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaIleProTyrGluGlu (SEQ ID NO:2), где "Хаа" в положении 3 обозначает Gln или Gly, "Хаа" в положении 4 обозначает любую аминокислоту, а "Хаа" в положении 6 обозначает Ser или Аlа. В предпочтительном варианте аминокислотная последовательность представляет собой последовательность LSQXLAIPYEE (SEQ ID NO:3), где Х обозначает любую аминокислоту. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerGlnXaaLeuAlaIleProTyrGluGlu (SEQ ID NO:3), где "Хаа" в положении 4 обозначает любую аминокислоту. В более предпочтительном варианте "Хаа" в положении 4 обозначает Lys.
Еще в одном из вариантов осуществления изобретения рекомбинантные термостабильные ДНК-полимеразы отличаются тем, что а) нативная форма полимеразы включает аминокислотную последовательность LSVXLG(V/I)PVKE (SEQ ID NO:4); б) X в положении 4 этой последовательности изменен по сравнению с указанной нативной последовательностью при условии, что Х не заменен на Е; и в) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью по отношению к включению нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с нативной формой указанного фермента. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyXaaProValLysGlu (SEQ ID NO:4), где "Хаа" в положении 4 обозначает любую аминокислоту, а "Хаа" в положении 7 обозначает Val или Ilе. В предпочтительном варианте аминокислотная последовательность представляет собой последовательность LSVXLGVPVKE (SEQ ID NO:5), где Х в положении 4 обозначает любую аминокислоту. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyValProValLysGlu (SEQ ID NO:5), где "Хаа" в положении 4 обозначает любую аминокислоту. В более предпочтительном варианте "Хаа" в положении 4 обозначает Arg. Еще в одном из предпочтительных вариантов аминокислотная последовательность представляет собой последовательность LSVXLGIPVKE (SEQ ID NO:6), где Х в положении 4 обозначает любую аминокислоту. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyIleProValLysGlu (SEQ ID NO:6), где "Хаа" в положении 4 обозначает любую аминокислоту. В более предпочтительном варианте "Хаа" в положении 4 обозначает Arg.
В соответствии с другим объектом настоящего изобретения конкретная критическая область по настоящему изобретению может быть объединена с мотивами других областей гена полимеразы, для которых известно, что они позволяют получить термостабильные ДНК-полимеразы, обладающие пониженной дискриминирующей способностью в отношении включения необычных нуклеотидов, таких как рНТФ и дцНТФ. В качестве примера, приведенного в настоящем описании, была сконструирована рекомбинантная ДНК-полимераза Thermus aquaticus (Taq), содержащая две мутации. Первая мутация представляла собой замену Е (глутамина) на К (лизин) в остатке Х в положении 4 критического мотива по настоящему изобретению. Вторая мутация представляла собой мутацию, позволяющую более эффективно включать ддНТФ, известную как мутация F667Y. Эта мутация представляет собой замену фенилаланина на тирозин в положении 667 ДНК-полимеразы Taq (что описано в патенте США 5614365 и в заявке на патент США 8/448223, которые включены в настоящее описание в качестве ссылки). Было обнаружено, что в реакции секвенирования с использованием ддНТФ, меченных красителями из класса флуоресцеина, фермент с двойной мутацией Е681К F667Y позволяет получить четкую лестницу секвенирования. Таким образом, в этом варианте осуществления мотив, обусловливающий пониженную дискриминирующую способность по отношению к дидезоксинуклеотидам, объединяют с критическим мотивом по настоящему изобретению с целью получения фермента, обладающего повышенной эффективностью в отношении включения как меченых, так и немеченых ддНТФ.
Кроме того, неожиданно было обнаружено, что мутантный фермент Е681К F667Y обладает существенно увеличенной скоростью удлинения по сравнению с ферментом, имеющим одну мутацию F667Y. Таким образом, в соответствии с другим вариантом осуществления изобретения интродукция в термостабильную ДНК-полимеразу критического мотива, одного или в комбинации с другими мотивами, приводит к образованию ферментов, обладающих повышенной скоростью удлинения. Также неожиданно было обнаружено, что фермент с двойной мутацией приводит к получению более однородных по высоте пиков при дидезокси-секвенировании с окрашенным терминатором при использовании меченных родамином терминаторов. Таким образом, в соответствии с еще одним вариантом осуществления изобретения интродукция критического мотива в фермент термостабильную ДНК-полимеразу приводит к образованию ферментов, для которых характерны более однородные по высоте пики при секвенировании ДНК с помощью методов, основанных на использовании терминаторов, меченных красителями из класса родамина.
В соответствии с еще одним вариантом осуществления мутацию, которая позволяет более эффективно включать рНТФ, такую как мутацию, приводящую к замене глутаминовой кислоты на глицин в положении 615 ДНК-полимеразы Taq, или мутацию E615G (описанную в европейской заявке ЕР-А-823479, которая включена в настоящее описание в качестве ссылки) объединяют с критическим мотивом по настоящему изобретению с целью получения фермента, обладающего повышенной эффективностью в отношении включения рибонуклеотидов, меченных красителями из класса флуоресцеина.
Следующим объектом настоящего изобретения являются гены, кодирующие полимеразы по настоящему изобретению, в частности гены, кодирующие рекомбинантные термостабильные полимеразы, которые содержат критический мотив по настоящему изобретению. Также этот объект относится к генам, кодирующим комбинации из двух или большего количества мутаций, которые включают мутации, приводящие к получению критического мотива по настоящему изобретению.
Еще одним объектом изобретения являются усовершенствованные способы секвенирования ДНК, позволяющие применять более низкие концентрации ддНТФ, меченных красителями из класса флуоресцеина, снижая тем самым стоимость проводимых реакций. Улучшенные способы по изобретению также позволяют использовать более низкие соотношения ддНТФ, меченных красителями из класса флуоресцеина, и дНТФ. Благодаря применению этих способов достигается целый ряд преимуществ, в том числе более эффективная полимеризация, более низкие требуемые концентрации нуклеиновой кислоты - матрицы и снижение вероятности внесения ингибиторов в реакционную смесь. Эти преимущества также облегчают секвенирование длинных матриц. Изобретение также относится к улучшенным способам секвенирования, при которых реакционные смеси для секвенирования могут быть внесены непосредственно в секвенирующие гели для последующего электрофореза без промежуточной очистки.
Таким образом, в изобретении предлагаются усовершенствованные способы определения последовательности нуклеиновой кислоты-мишени с использованием рекомбинантного фермента, который имеет а) мутацию в положении 4, которая позволяет получить критический мотив по настоящему изобретению, и б) обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с соответствующим ферментом дикого типа. Настоящее изобретение также включает усовершенствованные способы секвенирования с использованием ферментов термостабильных ДНК-полимераз, происходящих из термофильных видов, причем эти ферменты содержат встречающиеся в естественных условиях вариации последовательности, которые приводят к получению критического мотива по настоящему изобретению. Эти нативные ферменты также могут обеспечивать пониженную дискриминирующую способность в отношении включения необычных нуклеотидов. Согласно этому варианту в изобретении предлагаются усовершенствованные способы секвенирования с использованием нативной термостабильной ДНК-полимеразы, которая а) имеет критический мотив по настоящему изобретению, в котором аминокислота в положении 4 не является Glu, и б) обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина.
Согласно настоящему изобретению предлагаются также усовершенствованные способы получения ДНК, меченной красителями из класса флуоресцеина. Ферменты по изобретению позволяют эффективно включать флуоресцентно меченные дНТФ при использовании метода полимеразной цепной реакции, приводя к получению амплифицированных продуктов, меченных в различных сайтах красителями из класса флуоресцеина. Таким образом, в этом варианте осуществления предлагаемый способ мечения ДНК включает а) получение реакционной смеси, содержащей дНТФ, меченные красителями из класса флуоресцеина, и фермент по изобретению, и б) проведение реакции амплификации нуклеиновой кислоты.
Дополнительными объектами изобретения являются ферменты по изобретению и гены, кодирующие эти ферменты, в виде наборов для секвенирования ДНК, которые содержат рекомбинантный фермент по изобретению и могут дополнительно включать отрицательно заряженное флуресцентное соединение-терминатор. Другие наборы для секвенирования ДНК включают а) отрицательно заряженное флуоресцентное соединение - терминатор и б) нативный фермент по изобретению.
Изобретение также относится к наборам для получения меченой ДНК, которые включают рекомбинантный фермент по изобретению. Другие наборы для получения меченой ДНК включают а) отрицательно заряженное флуоресцентное соединение - нуклеозидтрифосфат и б) нативный фермент по изобретению.
Краткое описание чертежей
На чертеже представлено схематическое изображение гена ДНК-полимеразы Taq. Сайты рестрикции обозначены в соответствии с примером I и с описанием способов получения дополнительных мутантов и векторов экспрессии, представленных в настоящем описании.
Подробное описание изобретения
Для облегчения понимания сущности изобретения ниже определен ряд понятий, используемых в описании.
Понятие "ген" относится к последовательности ДНК, которая включает контролирующие и кодирующие последовательности, необходимые для получения выделяемого, биологически активного полипептида или предшественника. Полипептид может кодироваться полноразмерной последовательностью гена или любой частью кодирующей последовательности, имеющей достаточную длину для того, чтобы сохранить ферментативную активность.
Понятие "нативный" относится к гену или к продукту гена, который выделяют из источника, встречающегося в естественных условиях. Это понятие также относится к рекомбинантной форме нативного протеина, полученной с использованием методов молекулярной биологии, которая имеет аминокислотную последовательность, идентичную последовательности нативной формы.
Понятие "мутант" относится к гену, нуклеотидная последовательность которого была модифицирована, или к продукту гена, аминокислотная последовательность которого была модифицирована, что приводит к получению продукта гена, который может обладать измененными функциональными свойствами по сравнению с нативным геном или геном дикого типа либо продуктом гена. Такие модификации включают точковые мутации, делеции и инсерции.
Понятие "клетка (и)-хозяин(ева)" относится как к одноклеточным прокариотическим или эукариотическим организмам, таким как бактерии, дрожжи и актиномицеты, так и к отдельным клеткам растений или животных высших отрядов, которые способны расти в культуре клеток.
Понятие "система экспрессии" относится к последовательностям ДНК, содержащим требуемую кодирующую последовательность и контролирующие последовательности в функционально связанном виде таким образом, что клетки-хозяева, трансформированные этими последовательностями, обладают способностью продуцировать кодируемые протеины. Для осуществления трансформации система экспрессии может быть включена в вектор, хотя пригодная ДНК также может быть включена в хромосому хозяина.
Понятие "олигонуклеотид" в контексте данного описания относится к молекуле, состоящей из двух или из нескольких, предпочтительно из более чем трех и обычно из более чем десяти дезоксирибонуклеотидов или рибонуклеотидов. Точный размер олигонуклеотида может зависеть от многих факторов, включающих основную функцию или применение олигонуклеотида.
Олигонуклеотиды могут быть получены любым пригодным методом, включая, например, клонирование и рестрикцию соответствующих последовательностей, а также методом прямого химического синтеза, таким как фосфотриэфирный метод, описанный у Narang и др., 1979, Meth. Enzymol. 68: 90-99; фосфодиэфирный метод, описанный у Brown и др., 1979, Meth. Enzymol. 68: 109-151; диэтилфосфорамидитный метод, описанный у Beaucage и др., 1981, Tetrahedron Lett. 22: 1859-1862; триэфирный метод, описанный у Matteucci и др., 1981, J. Am. Chem. Soc. 103: 3185-3191; или автоматизированными методами синтеза; или методом с использованием твердой подложки, описанным в патенте США 4458066, при этом каждая из этих публикаций включена в настоящее описание в качестве ссылки.
Понятие "праймер" в контексте данного описания относится к олигонуклеотиду, естественному или синтетическому, который обладает способностью действовать в качестве точки инициации синтеза в условиях, при которых инициируется удлинение праймера. Праймер предпочтительно представляет собой одноцепочечный олигодезоксирибонуклеотид. Пригодная длина праймера зависит от назначения праймера, но обычно составляет от 15 до 35 нуклеотидов. Короткие молекулы праймера обычно нуждаются в более низких температурах для образования достаточно стабильных гибридных комплексов с матрицей. Праймер не обязательно должен отражать точную последовательность матрицы, но для того, чтобы происходило удлинение праймера, он должен быть в достаточной степени комплементарным, чтобы гибридизоваться с матрицей.
При необходимости праймер может быть помечен путем включения метки, которая может быть обнаружена спектроскопическими, фотохимическими, биохимическими, иммунохимическими или химическими способами. Например, пригодные метки включают 32Р, флуоресцентные красители, электронно-плотные реагенты, ферменты (такие, которые обычно применяются в методах ELISA), биотин или гаптены и протеины, для которых имеются антисыворотки или моноклональные антитела.
Понятие "термостабильная полимераза" относится к стабильному при нагревании ферменту, который является устойчивым к нагреванию и сохраняет достаточную активность для того, чтобы влиять на последующие реакции удлинения праймера, и который не способен необратимо денатурироваться (инактивироваться) при воздействии повышенных температур в течение времени, необходимого для осуществления денатурации двухцепочечных нуклеиновых кислот. Условия нагревания, необходимые для денатурации нуклеиновой кислоты, хорошо известны в данной области, и их примеры приведены в патентах США 4683202 и 4683195, которые включены в настоящее описание в качестве ссылки. В контексте данного описания термостабильная полимераза пригодна для использования в реакции с температурными циклами, такой как полимеразная цепная реакция (ПЦР). Понятие "необратимая денатурация" в контексте настоящего описания относится к постоянной и полной потере ферментативной активности. Для термостабильной полимеразы под ферментативной активностью понимают способность соответствующим образом катализировать комбинации нуклеотидов для формирования продуктов удлинения праймера, которые комплементарны цепи матричной нуклеиновой кислоты.
Понятие "обычный" или "естественный", когда оно относится к основаниям нуклеиновой кислоты, нуклеозидтрифосфатам или нуклеотидам, относится к таковым, которые встречаются в естественных условиях в указанном полинуклеотиде (например, для ДНК это дАТФ, дГТФ, дЦТФ и дТТФ). Кроме того, в реакциях синтеза ДНК in vitro, таких как секвенирование, вместо дГТФ часто используются дИТФ и 7-деаза-дГТФ и вместо дАТФ может использоваться 7-деаза-дАТФ. Они все вместе могут быть названы дезоксирибонуклеозидтрифосфатами (дНТФ).
Понятие "необычный" или "модифицированный", когда оно относится к основанию нуклеиновой кислоты, нуклеозиду или нуклеотиду, включает модификацию, производные или аналоги обычных оснований, нуклеозидов или нуклеотидов, встречающихся в конкретном полинуклеотиде в естественных условиях. Дезоксирибонуклеотидная форма урацила (дУМФ) представляет собой необычное или модифицированное основание для ДНК, в то время как рибонуклеотидная форма урацила (УМФ) представляет собой обычное основание для РНК. В контексте настоящего описания необычные нуклеотиды включают соединения, применяемые в качестве терминаторов при секвенировании нуклеиновых кислот, но не ограничены ими. Соединения-терминаторы включают соединения, имеющие 2',3'-дидезокси-структуру, которые называют дидезоксинуклеозидтрифосфатами, но не ограничены ими. Дидезоксинуклеозидтрифосфаты ддАТФ, ддТТФ, ддЦТФ и ддГТФ все вместе называют ддНТФ. Другие необычные нуклеотиды включают фосфортиоаты дНТФ ([α-S]дНТФ), 5'-α-боран-дНТФ, α-метилфосфонаты дНТФ и рибонуклеозидтрифосфаты (рНТФ). Необычные основания могут быть мечены радиоактивными изотопами, такими как 32P, 33P или 35S, флуоресцентными метками, хемилюминесцентными метками, биолюминесцентными метками, гаптеновыми метками, такими как биотин, или ферментными метками, такими как стрептавидин или авидин. Флуоресцентные метки могут включать отрицательно заряженные красители, такие как красители из класса флуоресцеина, или нейтральные по заряду красители, такие как красители из класса родамина, положительно заряженные красители, такие как красители из класса цианина. Красители из класса флуоресцеина включают, например, FAM, HEX, TET, JOE, NAN и ZOE. Красители из класса родамина включают Texas Red, ROX, R110, R6G и TAMRA. FAM, HEX, TET, JOE, NAN, ZOE, ROX, R110, R6G и TAMRA поставляются на рынок фирмой Perkin-Elmer (Foster City, CA), a Texas Red поставляются фирмой Molecular Probes. Красители из класса цианина включают Су2, Су3, Су5 и Су7 и поставляются фирмой Amersham (Amersham Place, Little Chalfont, Buckinghamshire, Великобритания).
Понятие "реакция синтеза ДНК" относится к способам получения копий ДНК, включающим ПЦР, амплификацию замещения цепи, опосредуемую транскрипцией амплификацию, удлинение праймера и обратную транскрипцию, но не ограничено ими.
С целью дальнейшего облегчения понимания сущности изобретения в описании используются конкретные термостабильные ДНК-полимеразы и флуоресцентные красители, но эти ссылки не ограничивают объем изобретения.
Настоящее изобретение относится к новым и улучшенным композициям на основе термостабильных ДНК-полимераз. К ферментам по изобретению относятся рекомбинантные полимеразы, которые более эффективно включают нуклеозидтрифосфаты, меченные красителями из класса флуоресцеина, по сравнению с соответствующими ферментами дикого типа. Термостабильные ДНК-полимеразы по изобретению являются наиболее пригодными и целесообразными для применения в таких процессах, как секвенирование ДНК и синтез меченых продуктов in vitro, в сравнении с полимеразами, являющимися ближайшими аналогами. Улучшенные способы секвенирования ДНК по изобретению включают применение этих рекомбинантных полимераз, а также применение нативных ферментов, которые более эффективно включают нуклеозидтрифосфаты, меченные красителями из класса флуоресцеина, по сравнению с ранее описанными ферментами. Также описаны последовательности ДНК, кодирующие эти ферменты, и векторы, предназначенные для экспрессии протеинов.
Термостабильные ДНК-полимеразы по изобретению содержат внутри аминокислотной последовательности домена полимеразной активности фермента критическую область. Критическая область по настоящему изобретению внутри аминокислотной последовательности термостабильной ДНК-полимеразы приведена ниже с использованием общепринятого однобуквенного кода аминокислот (Lehninger, Biochemistry, New York, Worth Publishers Inc., 1970, стр. 67, и эта публикация включена в настоящее описание в качестве ссылки): SEQ ID NO:7: LSXXLX(V/I)PXXE, где X в положении 4 обозначает любую аминокислоту, кроме Е. В трехбуквенном коде аминокислот эта последовательность записывается в виде LeuSerXaaXaaLeuXaaXaaProXaaXaaGlu (SEQ ID NO:7), причем "Хаа" в положении 3, 6, 9 и 10 обозначает любую аминокислоту, "Хаа" в положении 4 этой последовательности обозначает любую аминокислоту, кроме остатка глутаминовой кислоты (Glu), а "Хаа" в положении 7 обозначает Val или Ile. Эта критическая область позволяет получить термостабильные ДНК-полимеразы, характеризующиеся способностью эффективно включать нуклеотиды, меченные красителями из класса флуоресцеина.
Например, в производном гена ДНК-полимеразы Thermus aquaticus (Taq), который уже содержит мутацию в положении 46, состоящую в замене глицина на аспарагиновую кислоту (мутация G46D), и мутацию F667Y, мутация, состоящая в замене G на А в первом положении кодона для глутаминовой кислоты на остатке 681 полноразмерной последовательности ДНК-полимеразы Taq (что соответствует положению 4 критического мотива) приводит к синтезу фермента, который имеет критический мотив. Этот фермент характеризуется 1) приблизительно 2-10-кратным увеличением эффективности включения нуклеотидов, меченных красителями из класса флуоресцеина, без ухудшения способности фермента участвовать в осуществлении ПЦР в присутствии обычных нуклеотидов и 2) 3-4,3-кратным увеличением скорости удлинения. В ДНК-полимеразе Taq эта конкретная мутация приводит к замене аминокислоты Е (глутаминовая кислота) на К (лизин).
Хотя эта конкретная аминокислотная замена приводит к созданию критического мотива и в значительной степени изменяет способность фермента включать необычные нуклеотиды, вероятно замена конкретно Е на К не имеет такого же решающего значения для изобретения, как и выявленное в настоящее время положение внутри критической области. Таким образом, в предпочтительном варианте осуществления изобретение относится к рекомбинантным ферментам термостабильным ДНК-полимеразам, которые отличаются тем, что а) в своей нативной форме эта полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту; б) Х в положении 4 указанной последовательности изменен по сравнению с указанной нативной последовательностью при условии, что Х в положении 4 не заменен на Е; и в) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с нативной формой указанного фермента. В более предпочтительном варианте X в положении 4 замещен аминокислотой, имеющей положительный заряд, такой как К, R или Н, или полярной аминокислотой, такой как Q или N. В наиболее предпочтительном варианте Х в положении 4 замещен на К.
В другом предпочтительном варианте изобретение отличается тем, что фермент а) обладает пониженной дискриминирующей способностью по отношению к включению нуклеотидов, меченных красителями из класса флуоресцеина и б) включает аминокислотную последовательность LS(Q/G)XL(S/A)IPYEE, где Х обозначает любую аминокислоту (SEQ ID NO:2). В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaIleProTyrGluGlu, причем "Хаа" в положении 3 обозначает Gln или Gly, "Хаа" в положении 4 обозначает любую аминокислоту, а "Хаа" в положении 6 обозначает Ser или Аlа.
В более предпочтительном варианте фермент, обладающий пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, включает аминокислотную последовательность LSQXLAIPYEE, где Х обозначает любую аминокислоту (SEQ ID NO:3). В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerGlnXaaLeuAlaIleProTyrGluGlu, причем "Хаа" в положении 4 обозначает любую аминокислоту. В более предпочтительном варианте "X" обозначает остаток К.
В еще одном предпочтительном варианте осуществления изобретения фермент, обладающий пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, включает аминокислотную последовательность LSVXLG(V/I)PVKE, где Х обозначает любую аминокислоту (SEQ ID NO:4). В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyXaaProValLysGlu, причем "Хаа" в положении 4 обозначает любую аминокислоту, а "Хаа" в положении 7 обозначает Val или Ilе.
В более предпочтительном варианте осуществления изобретения фермент, обладающий пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, включает аминокислотную последовательность LSVXLGVPVKE, где Х обозначает любую аминокислоту (SEQ ID NO:5). В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyValProValLysGlu, причем "Хаа" в положении 4 обозначает любую аминокислоту. В наиболее предпочтительном варианте Х обозначает остаток R.
В еще одном из наиболее предпочтительных вариантов осуществления фермент, обладающий пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, включает аминокислотную последовательность LSVXLGIPVKE, где Х обозначает любую аминокислоту (SEQ ID NO:6). В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyIleProValLysGlu, причем "Хаа" в положении 4 обозначает любую аминокислоту. В наиболее предпочтительном варианте Х обозначает остаток R.
Характеристика мутации Е681К, приведенной в настоящем описании, позволила определить область в гене ДНК-полимеразы, которая оказывает воздействие на способность полимеразы взаимодействовать с отрицательно заряженными флуоресцентными нуклеотидами. Этот сайт, периферический по отношению к спирали О, находится на конце спирали Оa и в начале спирали Ob полимеразы (Kim и др., 1995, Nature 376: 612). В соответствии с принципами молекулярного моделирования, хорошо известными в данной области, можно предположить, что замены в структуре спирали Оa-Ob, отличные от замены Е на К в положении 681, также могут вызвать изменения дискриминирующей способности в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина. Таким образом, мутации в других положениях критического мотива, отличные от мутации остатка Х в положении 4, также подпадают под объем настоящего изобретения. В этом варианте осуществления изобретение относится к рекомбинантной термостабильной ДНК-полимеразе, которая отличается тем, что а) в своей нативной форме эта полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту; б) рекомбинантная полимераза включает по крайней мере одну мутацию внутри аминокислотной последовательности при условии, что Х в положении 4 не заменен на Е; и в) фермент обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с соответствующим нативным ферментом.
Аналогично этому термостабильные ДНК-полимеразы, которые содержат критические мотивы, которые сходны, но не идентичны критическому мотиву, имеющему аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:7), где X в положении 4 обозначает любую аминокислоту, кроме Е, подпадают под объем настоящего изобретения. В частности, в одном из вариантов осуществления критический мотив имеет аминокислотную последовательность LXXXXXXXXXE (SEQ ID NO:8), где X в положении 4 обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuXaaXaaXaaXaaXaaXaaXaaXaaXaaGlu (SEQ ID NO:8), причем "Хаа" в положениях 2, 3, 5, 6, 7, 8, 9 и 10 обозначают любую аминокислоту, а "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu.
В другом варианте осуществления критический мотив имеет аминокислотную последовательность L(S/A)XX(L/I)XXXXXE (SEQ ID NO:9), где X в положении 4 обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuXaaXaaXaaXaaXaaXaaXaaXaaXaaGlu (SEQ ID NO:9), причем "Хаа" в положениях 3, 6, 7, 8, 9 и 10 обозначают любую аминокислоту, "Хаа" в положении 2 обозначает Ser или Аlа, "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu, а "Хаа" в положении 5 обозначает Leu или Ilе.
В еще одном варианте осуществления критический мотив имеет аминокислотную последовательность LSXXLXXXXXE (SEQ ID NO:10), где Х в положении 4 обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaXaaXaaXaaXaaGlu (SEQ ID NO:10), причем "Хаа" в положениях 3, 6, 7, 8, 9 и 10 обозначают любую аминокислоту, а "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu.
Способность ферментов по изобретению эффективно включать нуклеотиды, меченные красителями из класса флуоресцеина, оценивают с помощью опытов по включению ддНТФ. Одним из таких опытов является тест по конкурентному удлинению праймера в условиях лимитирующей матрицы. В этом опыте праймер DG48 (5'-GGGAAGGGCGATCGGTGCGGGCCTCTTCGC) (SEQ ID NO:11), связанный с матрицей M13mpl8 (Innis и др., 1988, Proc. Natl. Acad. Sci. USA, 85:9436), удлиняют в присутствии [α-33Р]дЦТФ и избытка фермента с различными концентрациями флуоресцентномеченного ддНТФ, Zowie-ддЦТФ. Поскольку включение остатка ддЦТФ прекращает реакцию удлинения, то чем более легко ДНК-полимераза включает ддЦТФ в удлиняемый праймер, тем меньшее количество [α-33Р]дЦТФ может быть включено. Таким образом, если эффективность включения флуоресцентномеченного ддЦТФ возрастает, то степень ингибирования синтеза ДНК увеличивается. Реакции также могут быть проведены с различными концентрациями немеченого ддЦТФ. Концентрации ддЦТФ и Zowie-ддЦТФ, необходимые для 50%-ного ингибирования, рассчитывали и сравнивали, получая относительную величину способности фермента включать флуоресцентномеченный нуклеотид. Более подробно опыт по включению ддНТФ описан в примере II.
Таким образом, в соответствии с этим вариантом осуществления изобретения характеристику снижения дискриминирующей способности в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, оценивают в опыте по включению флуоресцентного ддНТФ, который описан в примере II. В предпочтительном варианте осуществления концентрация ддНТФ, меченного флуоресцентным красителем, Zowie-ддЦТФ, необходимая для 50%-ного ингибирования синтеза ДНК, для мутантного фермента по изобретению оказалась по крайней мере в 3 раза ниже по сравнению с ферментом дикого типа. В более предпочтительном варианте осуществления концентрация оказалась ниже по крайней мере в 5 раз. В наиболее предпочтительном варианте осуществления концентрация оказалась ниже по крайней мере в 10 раз. В другом варианте осуществления характеристику снижения дискриминирующей способности оценивают путем измерения включения флуоресцентного дНТФ.
Еще один объект изобретения относится к последовательности гена термостабильной ДНК-полимеразы и к ферменту, происходящему из различных термофильных видов. В этом варианте осуществления последовательность гена полимеразы и фермент происходят из видов рода Thermus. В других вариантах осуществления последовательность гена и фермент происходят из термофильных видов, отличных от представителей рода Thermus. В настоящее время является доступной полная нуклеотидная и аминокислотная последовательность многочисленных термостабильных ДНК-полимераз. Последовательности полимеразы Taq каждого из следующих видов: Thermus thermophilus (Tth), Thermus species Z05, Thermus species spsl7, Thermotoga maritima (Tma) и Thermosipho africanus (Taf), были описаны в международной заявке PCT/US91/07035, публикация WO 92/06200 от 16 апреля 1992, которая включена в настоящее описание в качестве ссылки. Последовательности ДНК-полимеразы из Thermus flavus, Bacillus caldotenax и Bacillus stearothermophilus описаны у Akhmetzjanov и Vakhitov, 1992, Nucleic Acids Research 20(21): 5839; Uemori и др., 1993, J. Biochem. 113: 401-410, и известны под регистрационным номером BSU23149.ng из базы данных NG: New GenBank соответственно, причем эта публикация включена в настоящее описание в виде ссылки.
Последовательность термостабильной ДНК-полимеразы из Thermus caldophilus находится в EMBL/GenBank под регистрационным номером U62584. Последовательность термостабильной ДНК-полимеразы из Thermus filiformis может быть получена из АТСС, депозитный номер 42380, с помощью методов, описанных в патенте США 4889818, а также при использовании информации о последовательностях, представленной в таблице 1. Последовательность ДНК-полимеразы Thermotoga neapolitana находится в базе данных GenSeq Patent Data Base под регистрационным номером R98144 (а также описана в WO 97/09451).
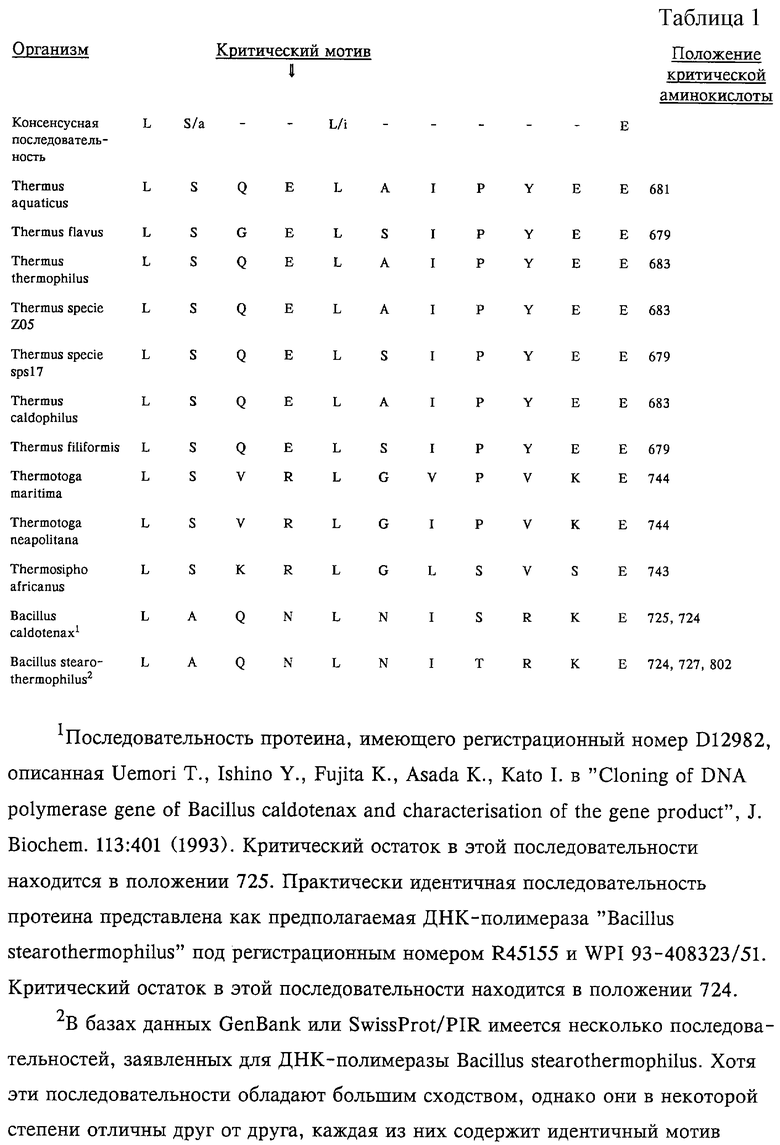

В таблице 1 последовательности протеина, включающие критический остаток в положении 724 критического мотива, описаны в опубликованном патенте Японии J 05304964A, в заявке ЕР 699760 и имеют регистрационный номер U33536. Другая, обладающая большим сходством, но имеющая некоторые отличия, последовательность протеина была опубликована в Gene, 163: 65-68 (1995), и она содержит критический остаток в положении 727 критического мотива. Еще одна, обладающая большим сходством, но имеющая некоторые отличия, последовательность протеина ДНК-полимеразы Bst, регистрационный номер U23149, содержит критический остаток в положении 802 критического мотива.
Поскольку ДНК-полимеразы каждого из термофильных видов являются уникальными, положение критической области в аминокислотной последовательности различно для каждого фермента. Программы, позволяющие определить первичную структуру аминокислотной и нуклеотидной последовательности, легко доступны и применительно к конкретной области, выявленной в настоящей заявке, помогают идентифицировать точную последовательность области по изобретению. Такие программы, позволяющие установить первичную структуру последовательностей, могут быть приобретены у Genetics Computer Group, 575 Science Drive, Madison, Wisconsin. Такими пригодными для конкретного мотива, определенного в данном описании, программами являются программы "GAP", "BESTFIT" и "PILEUP", способствующие выявлению локализации критического мотива. Положение критических областей термостабильной ДНК-полимеразы некоторых представленных в качестве примеров термофильных видов приведено в таблице 1.
Независимо от точного положения критического мотива LSXXLX(V/I)PXXE (SEQ ID NO:7), где X в положении 4 обозначает любую аминокислоту, кроме Е, внутри полимеразного домена термостабильной ДНК-полимеразы присутствие мотива помогает получать термостабильные ДНК-полимеразы, обладающие способностью эффективно включать нуклеотиды, меченные красителями из класса флуоресцеина. Таким образом, замена консервативной глутаминовой кислоты термостабильных ДНК-лолимераз Thermus flavus (Glu 679), Thermus thermophilus (Glu 683), Thermus species Z05 (Glu 683), Thermus species spsl7 (Glu 679), Thermus caldophilus (Glu 683), Thermus filiformis (Glu 679), приводящая к созданию критического мотива, оказывает усиливающее действие на способность полимеразы эффективно включать нуклеотиды, меченные красителями из класса флуоресцеина.
Кроме того, принимая во внимание высококонсервативную природу выявленного в настоящее время критического мотива, могут быть выявлены новые термостабильные ДНК-полимеразы на основе их гомологии, например, с ДНК-полимеразой Taq или с последовательностями других ДНК-полимераз, представленными в таблице 1 (см., например, патенты США 5618711 и 5624833, которые включены в настоящее описание в качестве ссылки). Такие полимеразы, в том случае, если их пептидная последовательность гомологична аминокислотной последовательности полимеразы Taq по крайней мере на 45% и наиболее предпочтительно более чем на 80%, что определяется методами, представленными в настоящем описании, подпадают под объем настоящего изобретения. Следовательно, изобретение относится к классу ферментов, которые также включают, например, термостабильную ДНК-полимеразу и соответствующий ген и векторы экспрессии из Thermus oshimai (Williams R.A. и др., 1996, Int. J. Syst. Bacteriol. 46(2): 403-408); Thermus silvanus и Thermus chliarophilus (Tenreiro S. и др., 1995, Int. J. Syst. Bacteriol. 45(4): 633-639); Thermus scotoductus (Tenreiro S. и др., 1995, Res. Microbiol. 146(4): 315-324); Thermus ruber ATCC 35948 (L.G. Loginova и др., 1984, Int. J. Syst. Bacteriol. 34: 498-499; и Thermus brockianus (Munster M.J., 1986, J. Gen. Microbiol. 132: 1677, при этом каждая из указанных публикаций включена в настоящее описание в качестве ссылки).
Для специалиста в данной области техники очевидно, что описанные выше термостабильные ДНК-полимеразы с повышенной эффективностью в отношении включения флуоресцентномеченных нуклеотидов наиболее легко могут быть сконструированы с помощью методов рекомбинантной ДНК, таких как сайтнаправленный мутагенез (см., например, у Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, 1989, 2-е изд., глава 15.51, "Oligonucleotide-mediated mutagenesis", причем эта публикация включена в настоящее описание в качестве ссылки). Этот метод в настоящее время является стандартным в данной области и может применяться для создания всех возможных вариантов изменений пар оснований в любом определенном сайте гена. Метод осуществляют с использованием синтетического олигонуклеотидного праймера, комплементарного одноцепочечной ДНК фага или плазмиды, в которых индуцируют мутации, за исключением ограниченного ошибочного спаривания, что представляет собой требуемую мутацию. В целом в качестве праймера для прямого синтеза цепи, комплементарной цепи фага или плазмиды, применяют синтетический олигонуклеотид и образовавшейся двухцепочечной ДНК трансформируют бактерию-хозяина, которая служит носителем фага или плазмиды. Образовавшаяся бактерия может быть проанализирована, например, методом секвенирования ДНК или путем гибридизации с зондом с целью выявить те бляшки или колонии, которые несут требуемую мутантную последовательность гена.
Вслед за изобретением ПЦР праймернаправленного мутагенеза (описан в патенте США 4683195, включенном в настоящее описание в качестве ссылки) и "перекрывающаяся ПЦР" (Higuchi, 1989 в PCR Technology, ред. Erlich, Stockton Press, New York, NY, стр. 61-70) стали общепринятыми методами внесения любой мутации в любое положение гена.
Мутантная ДНК может быть получена из плазмид, фазмид, фага или с помощью реакции амплификации обычными способами и лигирована с вектором экспрессии для последующего культивирования и выделения образовавшегося фермента. Для практической реализации изобретения пригодны многочисленные клонирующие и экспрессирующие векторы, включая системы млекопитающих и бактерий, и они описаны, например, у Sambrook и др., 1989, выше. Для удобства настоящее изобретение проиллюстрировано на примере с использованием промотора PL, происходящего из фага лямбда (Shimatake и др., 1981, Nature 292: 128). Применение этого промотора, в частности, описано в патентах США 4711845 и 5079352, которые включены в настоящее описание в качестве ссылки.
Плазмида pCS1 была депонирована в АТСС 28 августа 1997 г. и ей присвоен регистрационный номер 98521. Эта плазмида содержит ген, кодирующий термостабильную ДНК-полимеразу, причем этот ген изменен в кодоне в положении 681 таким образом, что в образовавшемся полипептиде глутаминовая кислота замещена на лизин, что дает возможность получить термостабильные ДНК-полимеразы, обладающие повышенной эффективностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина. В примере I проиллюстрировано применение фланкирующих сайтов рестрикции, пригодных для субклонирования мутации Е681К с целью создания других термостабильных ферментов ДНК-полимераз. В альтернативном варианте в связи с тем, что полная последовательность гена многочисленных термостабильных ДНК-полимераз является известной, специалисты в данной области техники, используя доступные депозиты АТСС и информацию о последовательностях, приведенную в настоящем описании, легко могут применить другие способы интродукции мутации Е681К, такие как рестрикционное расщепление и замещение фрагмента.
При необходимости получения одной из мутаций или нативных ферментов по настоящему изобретению или производного или гомолога этих ферментов создание фермента обычно включает трансформацию клетки-хозяина с помощью вектора экспрессии и культивирование трансформированной клетки-хозяина при условиях, в которых эта экспрессия будет происходить. Способы трансформации и культивирования трансформированных клеток-хозяев являются хорошо известными в данной области и описаны подробно, например, у Sambrook и др., 1989, см. выше.
Термостабильные ДНК-полимеразы по настоящему изобретению обычно выделяют из микроорганизмов, таких как штамм E.coli DG116 (который депонирован в АТСС 7 апреля 1987 г. под регистрационным номером 53606), которые были трансформированы вектором экспрессии, функционально связанным с геном, кодирующим ДНК-полимеразу дикого типа или модифицированную термостабильную ДНК-полимеразу. Методы очистки термостабильной ДНК-полимеразы описаны, например, в примере I и у Lawyer и др., 1993, PCR Methods and Applications 2: 275-287, и эта публикация включена в настоящее описание в качестве ссылки.
Термостабильные ферменты по изобретению могут применяться для любой цели, когда такая ферментативная активность является необходимой или целесообразной. Примеры применения включают секвенирование ДНК, мечение ДНК и мечение продуктов удлинения праймера. Настоящее изобретение позволяет в определенной степени улучшить секвенирование ДНК при использовании дидезоксинуклеотидного метода Сангера (Sanger и др., 1977, Proc. Natl. Acad. Sci. 74: 5463). Усовершенствования основного метода Сангера позволили создать новые векторы (Yanisch- Perron и др., 1985, Gene, 33:103-119) и аналоги оснований (Mills и др., 1979, Proc. Natl. Acad. Sci. 76: 2232-2235 и Barr и др., 1986, Biotechniques, 4: 428-432). В целом секвенирование ДНК требует зависимого от матрицы удлинения праймера в присутствии терминирующих рост цепи аналогов оснований, что приводит к распределению неполных фрагментов, которые затем разделяют по размеру. Основная процедура дидезокси-секвенирования включает (I) отжиг необязательно меченого олигонуклеотидного праймера с матрицей; (II) удлинение праймера с помощью ДНК-полимеразы в четырех различных реакционных смесях, каждая из которых содержит смесь немеченых дНТФ и ограниченное количество одного из необязательно меченых терминирующих рост цепи агентов, таких как ддНТФ; и (III) разделение четырех наборов продуктов реакций на денатурирующем полиакриламидном геле с высокой разрешающей способностью, содержащем мочевину. Продукты реакции в зависимости от примененной метки могут быть выявлены в геле с помощью авторадиографии или путем обнаружения флуоресценции, и изображение может быть проанализировано с целью сделать заключение о нуклеотидной последовательности. В этих методах используют ДНК-полимеразу, такую как фрагмент Кленова из штамма Е. coli Pol I или модифицированную ДНК-полимеразу фага Т7.
Доступность термоустойчивых полимераз, таких как ДНК-полимераза Taq, позволила улучшить методы секвенирования с использованием термостабильной ДНК-полимеразы (см. Innis и др., 1988, выше) и разработать их модификации, называемые "цикличным секвенированием" (Murray, 1989, Nucleic Acids Research, 17: 8889). В отличие от основного дидезоксисеквенирования цикличное секвенирование представляет собой линейную, асимметричную амплификацию последовательностей-мишеней, комплементарных последовательности матрицы, в присутствии терминаторов цепи. Один цикл приводит к получению семейства продуктов удлинения всех возможных длин. После отделения продукта реакции удлинения от матричной ДНК множественные циклы отжига праймера и удлинения праймера осуществляют в присутствии терминаторов, таких как ддНТФ. Для цикличного секвенирования требуется меньшее количество матричной ДНК, чем для обычного секвенирования на основе терминации цепи. Термостабильные ДНК-полимеразы имеют несколько преимуществ при цикличном секвенировании: они устойчивы к жестким температурам отжига, которые необходимы для специфической гибридизации праймера с нуклеиновыми кислотами-мишенями, а также устойчивы к большому количеству циклов высокотемпературной денатурации, которая присутствует в каждом цикле, т.е. к температуре 90-95°С. По этой причине ДНК-полимераза AmpliTaq®, ее производные и происходящие от нее ферменты были включены в наборы для цикличного секвенирования с использованием Taq, которые продаются различными компаниями, такими как фирма Perkin Elmer, Norwalk, СТ.
Известно два варианта метода секвенирования на основе терминации цепи - секвенирование с использованием окрашенного праймера и секвенирование с использованием окрашенного терминатора. При секвенировании с использованием окрашенного праймера ддНТФ-терминаторы являются немечеными, и для выявления продуктов удлинения используют меченый праймер (Smith и др., 1986, Nature 32: 674-679). При секвенировании ДНК с использованием окрашенного терминатора для включения дНТФ применяют ДНК-полимеразу и флуоресцентномеченные ддНТФ на конце ДНК-праймера (Lee и др., выше). Преимуществом этого способа является отсутствие необходимости синтезировать меченные красителем праймеры. Кроме того, реакции с использованием окрашенного терминатора являются более удобными, поскольку при этом все четыре реакции могут быть осуществлены в одной и той же пробирке.
Оба метода, как с использованием окрашенного праймера, так и использованием окрашенного терминатора, могут быть автоматизированы с помощью автоматических приборов для секвенирования, производимых фирмой Applied Biosystems, Foster City, CA (патент США 5171534, включенный в настоящее описание в качестве ссылки). При использовании прибора реакционную смесь по завершении реакции секвенирования подвергают фракционированию на денатурирующем полиакриламидном геле, которым снабжен прибор. Лазер, расположенный в нижней части прибора, обнаруживает флуоресцентные продукты, поскольку они в результате электрофореза разделены по размеру при прохождении через гель.
Для мечения терминаторов, которые применяются для секвенирования с окрашенным терминатором, обычно используют два типа флуоресцентных красителей: отрицательно заряженные и биполярные флуоресцентные красители. Отрицательно заряженные флуоресцентные красители включают красители из классов флуоресцеина и BODIPY. Красители из класса BODIPY (4,4-дифтор-4-бор-3а,4а-диаза-s-индацен) описаны в международной заявке WO 97/00967, включенной в настоящее описание в качестве ссылки. Биполярные флуоресцентные красители включают красители из класса родамина. В поступающих в продажу наборах для цикличного секвенирования используются терминаторы, меченные производными родамина. Однако меченные родамином терминаторы являются довольно дорогими, а продукт необходимо отделять от невключенного красителя-ддНТФ перед загрузкой в гель, поскольку они мигрируют в геле совместно с секвенируемыми продуктами. Вероятно, терминаторы, окрашенные красителем из класса родамина, стабилизируют структуры типа "шпильки" в областях, богатых GC, что приводит к аномальной миграции продуктов. Это требует использования дИТФ, который релаксирует вторичную структуру, но при этом также оказывает воздействие на эффективность включения терминатора.
В отличие от этого при использовании меченных флуоресцеином терминаторов не требуется стадии разделения до загрузки в гель, поскольку они несут более высокий чистый отрицательный заряд и мигрируют быстрее, чем секвенируемые продукты. Кроме того, меченные флуоресцеином секвенируемые продукты обладают лучшей электрофоретической подвижностью, чем секвенируемые продукты, меченные родамином. Хотя ДНК-полимераза Taq дикого типа не обладает способностью эффективно включать терминаторы, меченные красителями из класса флуоресцеина, в настоящее время необходимая эффективность может быть достигнута при использовании модифицированных ферментов, представленных в настоящем описании.
Таким образом, в настоящем изобретении предлагаются новые способы дидезокси-секвенирования с использованием ферментов, имеющих критический мотив, а также наборы для осуществления этого способа. В соответствии с этим вариантом осуществления способ секвенирования по изобретению включает:
а) создание рекомбинантной термостабильной ДНК-полимеразы, которая отличается тем, что
I) в своей нативной форме указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID N0:l), где X обозначает любую аминокислоту;
II) Х в положении 4 указанной последовательности изменен по сравнению с указанной нативной последовательностью при условии, что Х не заменен на Е; и
III) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с нативной формой указанного фермента; и
б) осуществление реакции секвенирования с использованием окрашенного терминатора.
В предпочтительном варианте осуществления вышеуказанного способа нативная форма фермента имеет аминокислотную последовательность LS(Q/G)XL(S/A)IPYEE (SEQ ID NO:2), где Х обозначает любую аминокислоту. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaIleProTyrGluGlu (SEQ ID NO:2), причем "Хаа" в положении 3 обозначает Gln или Gly, "Xaa" в положении 4 обозначает любую аминокислоту, а "Хаа" в положении 6 обозначает Ser или Аlа.
В более предпочтительном варианте осуществления вышеуказанного способа нативная форма фермента имеет аминокислотную последовательность LSQXLAIPYEE (SEQ ID NO:3), где X обозначает любую аминокислоту. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerGlnXaaLeuAlaIleProTyrGluGlu (SEQ ID NO:3), причем "Хаа" в положении 4 обозначает любую аминокислоту. В наиболее предпочтительном варианте "Хаа" в положении 4 обозначает Lys.
Как описано выше, для секвенирования ДНК с использованием термостабильных ДНК-полимераз требуется применение смеси необычных аналогов оснований, которые действуют в качестве терминаторов роста цепи, и обычных нуклеотидов в определенном соотношении концентраций, обеспечивающем получение популяции продуктов удлинения, представляющей фрагменты всех возможных длин вплоть до длины в несколько сотен оснований. Некоторые применяемые ранее для секвенирования термостабильные ДНК-полимеразы, такие как полимераза Taq дикого типа, отличаются тем, что они преимущественно включают обычные нуклеотиды в присутствии смеси обычных и необычных нуклеотидов. Однако некоторые описанные в настоящее время термостабильные ДНК-полимеразы позволяют уменьшить соотношение необычных аналогов оснований и обычных оснований в сто или в несколько сотен раз или даже в тысячу раз.
Одна из таких полимераз представляет собой Р667Y-мутантную ДНК-полимеразу Taq. Другая такая мутантная форма представляет собой ДНК-полимеразу Taq, имеющую мутацию F667Y и мутацию в положении 46, которая приводит к замене остатка глицина на остаток аспарагиновой кислоты (мутация G46D). Эта мутантная полимераза, известная как AmpliTaq, FS, производится фирмой Hoffmann-La Roche и поставляется на рынок фирмой Perkin Elmer. Другой такой полимеразой является ДНК-полимераза F730YTma30. Эта мутантная полимераза представляет собой комбинацию 1) нуклеотидов с 1 по 570 ДНК-полимеразы Taq, которые модифицированы таким образом, чтобы кодировать мутацию G46D и 2) нуклеотидов с 571 по 2679 ДНК-полимеразы Tma, которые модифицированы таким образом, чтобы кодировать замену аспарагиновой кислоты на аланин в положении 323, замену глутаминовой кислоты на аланин в положении 325 и замену фенилаланина на тирозин в положении 730 (заявка на патент США 60/052065 и европейская заявка 98112327.6, причем обе эти заявки включены в настоящее описание в качестве ссылки). Другой полимеразой, которая позволяет включать необычные аналоги оснований, является Р703Y-мутантная ДНК-полимераза из Thermotoga neapolitana (заявки WO 96/10640, WO 96/41014 и WO 97/09451, которые включены в настоящее описание в качестве ссылки). При использовании этих ферментов концентрация родамин - ддНТФ, соответствующая данной концентрации дНТФ, может быть снижена от приблизительно 50 до нескольких сотен раз по сравнению с концентрацией, которая необходима при использовании ранее доступных термостабильных ДНК-полимераз.
Мутацию Е681К по изобретению объединяли с помощью методов рекомбинантной ДНК с мутацией F667Y с целью получения ДНК-полимеразы Taq, несущей двойную мутацию, которая используется в реакциях секвенирования в примере IV. Фермент с двойной мутацией использовали в реакции секвенирования с окрашенным терминатором вместе с терминаторами, меченными красителем из класса флуоресцеина. Результаты, приведенные в примере IV, показывают, что фермент обладает способностью включать терминаторы, меченные красителем из класса флуоресцеина, при реакции секвенирования, что приводит к получению лестниц секвенирования, которые могут быть точно считаны при использовании автоматического прибора для секвенирования. Неожиданно было установлено, что комбинация мутаций Е681К и F667Y также приводит к получению термостабильной ДНК-полимеразы, способной в 3-4 раза увеличивать скорости удлинения по сравнению с ферментом, имеющим одну мутацию F667Y, что показано в опыте, описанном в примере III.
Таким образом, в соответствии с другим вариантом осуществления настоящего изобретения критический мотив, описанный в данном изобретении, может быть объединен с мотивами, обусловливающими пониженную дискриминирующую способность по отношению к ддНТФ, что позволяет получить полимеразы, обладающие повышенной эффективностью в отношении включения как меченых, так и немеченых ддНТФ. Эти полимеразы пригодны для использования в методах секвенирования ДНК. В этом варианте осуществления настоящего изобретения термостабильная ДНК-полимераза, имеющая критический мотив, указанный в настоящем описании, также содержит критический мотив, включающий мутацию F667Y, описанную в заявке на патент США 08/448223. В этом варианте осуществления изобретения термостабильная ДНК-полимераза отличается тем, что
I) в своей нативной форме указанная полимераза включает первую аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту;
II) Х в положении 4 указанной первой аминокислотной последовательности изменен по сравнению с указанной нативной последовательностью при условии, что Х в результате мутации не может быть заменен на Е;
III) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с нативной формой указанного фермента;
IV) указанная полимераза включает вторую аминокислотную последовательность MRRXXKXXNYXXXYG (SEQ ID NO:12), где Х обозначает любую аминокислоту;
V) указанная термостабильная ДНК-полимераза также обладает пониженной дискриминирующей способностью по отношению к включению необычных нуклеотидов по сравнению с нативной формой этого фермента. В трехбуквенном коде вторая аминокислотная последовательность может быть записана в виде MetArgArgXaaXaaLysXaaXaaAsnTyrXaaXaaXaaTyrGly (SEQ ID NO:12), где "Хаа" в положениях 4, 5, 7, 8, 11, 12 и 13 обозначает любую аминокислоту. В предпочтительном варианте осуществления "Хаа" в положении 4 в первой аминокислотной последовательности заменен на Lys. В более предпочтительном варианте фермент представляет собой ДНК-полимеразу Taq, и он включает мутации Е681К и F667Y. В настоящем изобретении также предлагаются способы секвенирования с использованием вышеуказанных полимераз.
В изобретении также предлагается усовершенствованный способ секвенирования, который осуществляют с использованием термостабильных ферментов ДНК-полимераз, имеющих критический мотив, который не получают с помощью мутации, а этот критический мотив существует в виде варианта естественного присхождения. В соответствии с этим вариантом ДНК-полимераза термофильных видов бактерий имеет критический мотив, в котором остаток в положении 4 не является Glu. Например, в термостабильной ДНК-полимеразе из Thermotoga neapolitana X в положении 4 в мотиве LSXXLX(V/I)PXXE (SEQ ID NO:7), где X обозначает любую аминокислоту, кроме Е, представляет собой остаток аргинина. Таким образом, изобретение относится к улучшенным способам секвенирования ДНК с использованием нативной термостабильной ДНК-полимеразы, которая включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:7), где Х может быть любой аминокислотой, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaXaaProXaaXaaGlu (SEQ ID NO:7), где "Хаа" в положениях 3, 6, 9 и 10 обозначает любую аминокислоту, "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu, а "Хаа" в положении 7 обозначает Val или Ilе. В этом варианте осуществления способ секвенирования по изобретению включает:
а) создание термостабильной ДНК-полимеразы, которая отличается тем, что
I) указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:7), где Х обозначает любую аминокислоту, кроме Е; и
II) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина;
б) создание окрашенного терминатора, меченного красителем из класса флуоресцеина; и
в) проведение реакции секвенирования с окрашенным терминатором.
В более предпочтительном варианте осуществления способ секвенирования по изобретению включает:
а) создание термостабильной ДНК-полимеразы, которая отличается тем, что
I) указанная полимераза включает первую аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:7), где X обозначает любую аминокислоту, кроме Е;
II) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина;
III) указанная полимераза включает вторую аминокислотную последовательность MRRXXKXXNYXXXYG (SEQ ID NO:12), где Х обозначает любую аминокислоту; и
IV) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения необычных нуклеотидов;
б) создание окрашенного терминатора, меченного красителем из класса флуоресцеина; и
в) проведение реакции секвенирования с окрашенным терминатором.
В другом предпочтительном варианте фермент включает аминокислотную последовательность LS(Q/G)XL(S/A)IPYEE (SEQ ID NO:13), где X в положении 4 обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaIleProTyrGluGlu (SEQ ID NO:13), причем "Хаа" в положении 3 обозначает Gln или Gly, "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu, а "Хаа" в положении 6 обозначает Ser или Аlа. В более предпочтительном варианте аминокислотная последовательность представляет собой LSQXLAIPYEE (SEQ ID NO:14), где Х обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerGlnXaaLeuAlaIleProTyrGluGlu (SEQ ID NO:14), причем "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu.
В еще одном предпочтительном варианте фермент имеет аминокислотную последовательность LSVXLG(V/I)PVKE (SEQ ID NO:15), где X обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyXaaProValLysGlu (SEQ ID NO:15), причем "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu, а "Хаа" в положении 7 обозначает Val или Ilе. В более предпочтительном варианте осуществления аминокислотная последовательность представляет собой LSVXLGVPVKE (SEQ ID NO:16), где Х обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyValProValLysGlu (SEQ ID NO:16), причем "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu. В наиболее предпочтительном варианте "Хаа" в положении 4 обозначает Arg. В другом более предпочтительном варианте аминокислотная последовательность представляет собой LSVXLGIPVKE (SEQ ID NO:17), где Х обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyIleProValLysGlu (SEQ ID NO:17), причем "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu. В наиболее предпочтительном варианте "Хаа" в положении 4 обозначает Arg.
В еще одном варианте осуществления изобретения способы секвенирования проводят с использованием нативного фермента, который имеет пониженный уровень дискриминирующей способности в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, причем этот уровень измеряют с использованием анализа по включению ддНТФ, который изложен в примере II. Определяют концентрацию ддЦТФ, необходимую для 50%-ного ингибирования синтеза ДНК, в сравнении с концентрацией Zowie-ддЦТФ, необходимой для 50%-ного ингибирования. Рассчитывают соотношение концентраций Zowie-ддЦТФ и концентрации ддЦТФ. В предпочтительном варианте осуществления соотношение равно 10 или менее. В более предпочтительном варианте осуществления соотношение равно 4 или менее. В наиболее предпочтительном варианте осуществления соотношение равно 1,2 или менее.
Хотя в представленных в настоящем описании примерах применяют дидезоксинуклеотиды, меченные красителями из класса флуоресцеина, использование других необычных нуклеотидов и флуоресцентных красителей также подпадает под объем настоящего изобретения. Другие необычные нуклеотиды включают флуоресцентномеченные дНТФ, которые могут использоваться для мечения продуктов синтеза ДНК, и флуоресцентномеченные рНТФ, которые могут использоваться для мечения продуктов удлинения праймера. Красители также включают другие отрицательно заряженные флуоресцентные красители, такие как BODIPY, которые структурно и химически близки к флуоресцеину. Другие красители также включают цианиновые красители. Меченные цианином дНТФ добавляли в стандартную реакционную смесь для ПЦР, включающую ДНК-полимеразу Taq, имеющую мутацию Е681К (и мутацию G46D). Неожиданно было установлено, что меченные цианином дНТФ включаются в продукты амплификации в более высокой концентрации, чем при использовании фермента дикого типа. Таким образом, в соответствии с этим вариантом в способе мечения ДНК по изобретению используют нативную или мутантную полимеразу по изобретению в комбинации с нуклеотидом, меченным либо отрицательно заряженным флуоресцентным красителем, либо цианиновым красителем. В этом варианте осуществления способ мечения по изобретению включает:
а) создание термостабильной ДНК-полимеразы, которая отличается тем, что
I) указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:7), где X в положении 4 может представлять собой любую аминокислоту, кроме Е; и
II) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения необычных нуклеотидов;
б) получение нуклеотида, меченного отрицательно заряженным флуоресцентным красителем; и
в) проведение реакции синтеза ДНК.
В другом варианте осуществления способ мечения ДНК по изобретению включает:
а) создание термостабильной ДНК-полимеразы, которая отличается тем, что
I) указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NО:7), где X в положении 4 может представлять собой любую аминокислоту, кроме Е;
II) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения необычных нуклеотидов;
б) получение нуклеотида, меченного цианиновым красителем; и
в) проведение реакции синтеза ДНК.
В соответствии с еще одним вариантом осуществления изобретения получена термостабильная ДНК-полимераза, в которой объединены мутация, позволяющая более эффективно включать рНТФ, такая как мутация в положении 615 ДНК-полимеразы Taq, приводящая к замене глутаминовой кислоты на глицин, и критический мотив по настоящему изобретению. Предполагается, что образовавшийся фермент должен обладать повышенной эффективностью в отношении включения рибонуклеотидов, меченных красителями из класса флуоресцеина. Таким образом, в этом варианте осуществления изобретение относится к рекомбинантной термостабильной ДНК-полимеразе, которая (1) в своей нативной форме включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту, и (2) Х в положении 4 изменен так, что Х в положении 4 не заменен на Е; и (3) также включает критическую область, представляющую собой аминокислотную последовательность SQIXLR(V/I) (SEQ ID NO:18), где "X" обозначает любую аминокислоту, кроме Е, и (4) обладает способностью эффективно включать рибонуклеотиды, меченные красителями из класса флуоресцеина. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде SerGlnIleXaaLeuArgXaa, где "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu, а "Хаа" в положении 7 обозначает Val или Ilе.
Домены мутантной полимеразы, такие как домены, содержащие мутации E615G и Е681К в случае полимеразы Taq, пригодны для использования в улучшенных способах получения продуктов удлинения праймера, меченных красителями из класса флуоресцеина. Например, в реакции удлинения праймера, такой как ПЦР, рНТФ, меченные красителями из класса флуоресцеина, замещают по крайней мере частично одним из четырех стандартных дНТФ и включают полимеразу, имеющую двойную мутацию, такую как Е681К E615G ДНК-полимеразу Taq. Мутантная полимераза синтезирует продукты удлинения праймера, которые имеют флуоресцентномеченные рибонуклеотидные остатки в различных положениях их последовательностей. Нагревание или обработка щелочью вызывает фрагментацию продуктов удлинения праймера на каждом рибонуклеотидном остатке, что приводит к получению популяции фрагментов с мечеными концами. Эта популяция однородно меченых фрагментов характеризует распределение флуоресцентной метки вдоль длины продукта удлинения праймера. Меченые фрагменты с такими характеристиками пригодны в методах определения нуклеиновых кислот, основанных на использовании силиконовой крошки, таких, как описанные у Cronin и др., см. выше. Таким образом, в этом варианте осуществления изобретение относится к способу мечения продуктов удлинения праймера, который включает (1) создание термостабильной ДНК-полимеразы, которая (а) в своей нативной форме включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту, (б) Х в положении 4 изменен так, что Х в положении 4 не заменен на Е, (в) также включает критическую область, представляющую собой аминокислотную последовательность SQIXLR(V/I) (SEQ ID NO:18), где X обозначает любую аминокислоту, кроме Е, и (д) обладает способностью эффективно включать рибонуклеотиды, меченные красителями из класса флуоресцеина и/или цианина, и (2) проведение реакции удлинения праймера.
В соответствии с еще одним объектом изобретения ферменты, имеющие критический мотив по настоящему изобретению, обладают повышенной скоростью удлинения по сравнению с ферментом дикого типа, что показано в примере IV для мутанта Е681К F667Y. В этом варианте осуществления фермент отличается тем, что (1) в своей нативной форме он включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту, (2) аминокислотная последовательность изменена в положении 4 так, что Х в положении 4 не заменен на Е; и (3) он обладает повышенной скоростью удлинения по сравнению с ферментом дикого типа. В предпочтительном варианте фермент отличается тем, что (1) в своей нативной форме он включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где Х обозначает любую аминокислоту, (2) аминокислотная последовательность изменена в положении 4 таким образом, что Х в положении 4 не заменен на Е; (3) он также включает аминокислотную последовательность MRRXXKXXNYXXXYG (SEQ ID NO:12), где X обозначает любую аминокислоту и (4) он обладает повышенной скоростью удлинения. В более предпочтительном варианте осуществления фермент характеризуется тем, что (1) в своей нативной форме он включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где Х обозначает любую аминокислоту, (2) аминокислотная последовательность изменена в положении 4 так, что Х в положении 4 заменен на К. В наболее предпочтительном варианте фермент представляет собой ДНК-полимеразу Taq и содержит мутацию Е681К и мутацию F667Y. В этом аспекте изобретение также относится к способам секвенирования и мечения ДНК с использованием полимераз, обладающих повышенной скоростью удлинения, а также к наборам для осуществления этих способов.
В предпочтительном способе секвенирования ДНК по изобретению в реакционную смесь включают термостабильную пирофосфатазу. Было установлено, что пирофосфатаза улучшает данные, получаемые при секвенировании с использованием мезофильных, а также мутантных термостабильных ДНК-полимераз, описанных в европейской заявке ЕР-А 763599 и в патенте США 5665551.
В приведенном в качестве примера варианте осуществления термостабильная ДНК-полимераза по изобретению также содержит мутацию в 5'-нуклеазном домене, что способствует существенному уменьшению этой нуклеазной активности. Модифицированные формы полимеразы Taq были описаны в международной заявке WO 92/06200, опубликованной 16 апреля 1992, и в патенте США 5466591. В одном из вариантов осуществления кодон, кодирующий остаток глицина в положении 46 аминокислотной последовательности, замещали кодоном для аспарагиновой кислоты (мутация G46D). Полученный фермент обладал повышенной эффективностью в реакциях цикличного секвенирования вследствие пониженной 5'-нуклеазной активности. У мутанта G46D по сравнению с ферментом дикого типа не изменились ни аминокислотная последовательность полимеразного домена, ни полимеразная активность.
В соответствии с вариантом осуществления, важным с коммерческой точки зрения, в изобретении предлагаются также наборы, предназначенные для практической реализации способов, усовершенствованных в соответствии с настоящим изобретением. Один из таких наборов для секвенирования ДНК включает
а) термостабильную ДНК-полимеразу, отличающуюся тем, что
I) указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:7), где X может быть любой аминокислотой, кроме Е;
II) эта полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина; и
б) окрашенный терминатор, меченный отрицательно заряженным флуоресцентным красителем, и дополнительно может включать другие реагенты для секвенирования ДНК, такие как дНТФ, термостабильную пирофосфатазу и соответствующие буферы. В еще одном варианте осуществления фермент, входящий в набор, имеет аминокислотную последовательность LSVXLG(V/I)PVKE (SEQ ID NO:15), где X обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyXaaProValLysGlu (SEQ ID N0:15), причем "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu, a "Хаа" в положении 7 обозначает Val или Не. В предпочтительном варианте осуществления аминокислотная последовательность представляет собой LSVXLGVPVKE (SEQ ID NO:16), где X обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyValProValLysGlu (SEQ ID NO:16), причем "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu. В более предпочтительном варианте осуществления "Хаа" в положении 4 обозначает Arg. В другом предпочтительном варианте осуществления аминокислотная последовательность представляет собой LSVXLGIPVKE (SEQ ID NO:17), где Х обозначает любую аминокислоту, кроме Е. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerValXaaLeuGlyIleProValLysGlu (SEQ ID NO:17), причем "Хаа" в положении 4 обозначает любую аминокислоту, кроме Glu. В более предпочтительном варианте осуществления "Хаа" в положении 4 обозначает Arg.
Другие наборы для секвенирования ДНК включают мутантную термостабильную ДНК-полимеразу, отличающуюся тем, что
а) в своей нативной форме указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту;
б) указанная аминокислотная последовательность изменена в положении 4 при условии, что Х в положении 4 не заменен на Е; и
в) указанная термостабильная ДНК-полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с нативной формой указанного фермента и дополнительно может включать реагенты для секвенирования ДНК, такие как соединения, являющиеся терминаторами цепи, дНТФ, термостабильную пирофосфатазу и соответствующие буферы. Если терминаторы являются мечеными, предпочтительными метками являются флуоресцентные красители, более предпочтительными метками являются отрицательно заряженные флуоресцентные красители или цианиновые красители и наиболее предпочтительными метками являются красители из класса флуоресцеина. В предпочтительном варианте осуществления фермент в наборе включает аминокислотную последовательность LS(Q/G)XL(S/A)IPYEE (SEQ ID NO:2), где X обозначает любую аминокислоту. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerXaaXaaLeuXaaIleProTyrGluGlu (SEQ ID NO:2), причем "Хаа" в положении 3 обозначает Gln или Gly, "Хаа" в положении 4 обозначает любую аминокислоту, а "Хаа" в положении 6 обозначает Ser или Аlа. В более предпочтительном варианте аминокислотная последовательность представляет собой последовательность LSQXLAIPYEE (SEQ ID NO:3), где Х обозначает любую аминокислоту. В трехбуквенном коде эта аминокислотная последовательность может быть записана в виде LeuSerGlnXaaLeuAlaIleProTyrGluGlu (SEQ ID NO:3), причем "Хаа" в положении 4 обозначает любую аминокислоту. В наиболее предпочтительном варианте "Хаа" в положении 4 обозначает Lys.
Наборы, предназначенные для мечения ДНК, включают термостабильную ДНК-полимеразу, отличающуюся тем, что а) в своей нативной форме указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту; б) Х в положении 4 указанной последовательности изменен по сравнению с указанной нативной формой при условии, что Х в положении 4 не заменен на Е; и в) фермент обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с соответствующим ферментом дикого типа, и дополнительно может включать дНТФ и соответствующие буферы. В предпочтительном варианте Х в положении 4 заменен на К. Другие наборы, предназначенные для мечения ДНК, включают а) нуклеотид или аналог нуклеотида, меченный отрицательно заряженным флуоресцентным соединением, и б) нативные термостабильные ДНК-полимеразы, имеющие следующий критический мотив: LSXXLX(V/I)PXXE (SEQ ID NO:7), где X в положении 4 может представлять собой любую аминокислоту, кроме Е; и указанная полимераза обладает пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных флуоресцеином, и дополнительно может включать дНТФ и соответствующие буферы. В предпочтительном варианте Х в положении 4 представляет собой К. В еще одном предпочтительном варианте Х в положении 4 представляет собой R.
Наборы, предназначенные для мечения продуктов удлинения праймера, включают термостабильную ДНК-полимеразу, отличающуюся тем, что а) в своей нативной форме указанная полимераза включает аминокислотную последовательность LSXXLX(V/I)PXXE (SEQ ID NO:1), где X обозначает любую аминокислоту; б) Х в положении 4 указанной последовательности изменен по сравнению с указанной нативной последовательностью при условии, что Х в положении 4 не заменен на Е; в) полимераза также включает вторую аминокислотную последовательность SQIXLR(V/I) (SEQ ID NO:18), где X обозначает любую аминокислоту, кроме Е; и г) фермент обладает пониженной дискриминирующей способностью в отношении включения рибонуклеотидов, меченных красителями из класса флуоресцеина, по сравнению с соответствующим ферментом дикого типа, и дополнительно может включать рибонуклеотид или аналог рибонуклеотида, меченный отрицательно заряженным флуоресцентным соединением или цианиновым соединением, дНТФ и соответствующие буферы. В предпочтительном варианте осуществления полимераза содержит мутацию Е681К и мутацию E615G.
Другие наборы, предназначенные для мечения продуктов удлинения праймера, включают а) рибонуклеотид или аналог рибонуклеотида, меченный отрицательно заряженным флуоресцентным соединением или цианиновым соединением, и б) нативную термостабильную ДНК-полимеразу, отличающуюся тем, что она (I) включает критический мотив, имеющий аминокислотную последовательность: LSXXLX(V/I)PXXE (SEQ ID NO:7), где X в положении 4 может представлять собой любую аминокислоту, кроме Е; (II) включает вторую аминокислотную последовательность SQIXLR(V/I), где X обозначает любую аминокислоту, кроме Е; и (III) обладает пониженной дискриминирующей способностью в отношении включения рибонуклеотидов, меченных флуоресцеином, и дополнительно может включать дНТФ и соответствующие буферы. В предпочтительном варианте в первой аминокислотной последовательности Х в положении 4 представляет собой К, а во второй аминокислотной последовательности Х обозначает G. В еще одном предпочтительном варианте в первой аминокислотной последовательности Х в положении 4 представляет собой R, а во второй аминокислотной последовательности Х обозначает G.
Ниже изобретение проиллюстрировано на примерах, которые не ограничивают объем изобретения, определяемый формулой изобретения.
Пример I
Экспрессия гена модифицированной полимеразы Taq, обладающей пониженной дискриминирующей способностью в отношении включения нуклеотидов, меченных красителями из класса флуоресцеина
С - концевая часть аминокислотной последовательности ДНК-полимеразы Taq содержит домен, включающий сайт полимеразной активности (Lawyer и др., 1993, PCR Methods and Applications 2: 275-287, Freemont и др., 1986, Proteins: Structure, Function and Genetics 1:66-73, причем все эти публикации включены в настоящее описание в качестве ссылки). Фрагмент ДНК, содержащий эту область, выделяли из полноразмерного гена Taq и мутации индуцировали с помощью ПЦР-амплификации в присутствии марганца (Leung и др., 1989, Technique 1(1): 11-15). Для этого примера все ферменты рестриктазы получали от фирмы New England Biolabs, Beverly, MA. Мутантные фрагменты расщепляли рестриктазами PstI и BglII и клонировали в плазмиде pLK102, экспрессирующей Taq, которую предварительно расщепляли PstI и BglII. Плазмида pLK102 является производной плазмиды pLK101, в которой PstI-BglII-фрагмент длиной 900 пар оснований замещен коротким PstI-BglII-линкером. Плазмида pLK101 представляет собой модифицированную форму плазмиды pSYX1578 (Lawyer и др., 1993, см. выше, и патент США 5079352), которая содержит делецию небольшого HincII/EcoRV-фрагмента, локализованного на 3'-конце области, кодирующей полимеразу.
Образовавшимися экспрессирующими плазмидами трансформировали штамм Е. coli N1624 (который может быть получен из Е. coli Genetic Stock Center в Йельском Университете, штамм номер CGSC № 5066) и полученных трансформантов подвергали скринингу на способность более эффективно включать [α-33P]Tet-дЦТФ по сравнению с ферментом дикого типа. Используя этот способ, мутанта CS1 выявляли по его способности более эффективно включать [α-33Р]Теt-дЦТФ. Для определения того, какая часть мутантного гена полимеразы Taq ответственна за измененный фенотип, экспрессирующую Taq мутантную плазмиду мутанта CS1 расщепляли с помощью HindIII-NheI и образовавшийся рестрикционный фрагмент субклонировали в плазмиде pLK101, несущей ген дикого типа, замещая немутантный HindIII-NheI-фрагмент. Субклоны, содержащие рестрикционный HindIII-NheI-фрагмент, придавали ферменту дикого типа измененный фенотип, свидетельствуя о том, что мутация находится внутри этого фрагмента. Последующий анализ субклонов показал, что мутация локализована в BamHI-NheI-фрагменте длиной 265 пар оснований.
Анализ последовательности ДНК NheI-BamHI-фрагмента длиной 265 пар оснований плазмиды pCS1 осуществляли с использованием набора для секвенирования TaqFS DyeDeoxy™ Terminator Cycle Sequencing Kit, поставляемый фирмой Applied Biosystems, Foster City, CA, и системы для секвенирования Applied Biosystems Model Prism 377 DNA Sequencing System.
Анализ последовательности выявил миссенс-мутацию в гене полимеразы Taq в аминокислоте в положении 681, которая привела к тому, что остаток глутаминовой кислоты (Е) был замещен остатком лизина (К). Нумерацию начинают с кодона, кодирующего первый остаток метионина зрелого протеина, как описано в патенте США 5079352, который включен в настоящее описание в качестве ссылки. Конкретно эта мутация Е681К состояла в замене GAG на AAG в последовательности кодона. Плазмида pCS1 была депонирована в АТСС 28 августа 1997 года и получила регистрационный номер 98521.
Плазмида pCS1 может содержать дополнительные мутации в кодирующей последовательности полимеразы Taq; однако в результате дополнительных экспериментов по субклонированию было установлено, что мутация Е681К является единственной мутацией, ответственной за увеличение эффективности включения нуклеозидтрифосфатов, меченных флуоресцеиновыми красителями. Эта точковая мутация локализована на BamHI-NheI-фрагменте ДНК длиной 265 пар оснований, показанном на фиг.1. Внутри фрагмента ДНК длиной 265 пар оснований мутация Е681К представляет собой единственное изменение по сравнению с последовательностью гена полимеразы Taq дикого типа.
Для дальнейшего анализа и количественной оценки эффективности в отношении включения аналогов нуклеотидов BamHI-NheI- фрагмент длиной 265 пар оснований плазмиды pCSl клонировали в векторе экспрессии Taq, pRDA3-2, который внутри полимеразного домена содержал последовательность дикого типа. Плазмида pRDA3-2, относящаяся к клону 3-2, в полной мере описана в международной заявке WO 92/06200, которая включена в настоящее описание в качестве ссылки. Второй клон, кодирующий как мутацию Е681К, так и мутацию F667Y, создавали путем праймернаправленного мутагенеза и последующего клонирования продукта ПЦР, содержащего обе мутации, в BamHI-NheI-сайтах плазмиды pRDA3-2.
Вектор экспрессии pRDA3-2 содержит полноразмерный ген ДНК-полимеразы Taq, функционально связанный с промотором РL фага лямбда. В векторе pRDA3-2 5'-нуклеазный домен гена ДНК-полимеразы Taq содержит точковую мутацию в кодоне, кодирующем глицин в положении 46, что снижает 5'-нуклеазную активность (мутация G46D). Однако последовательность гена внутри полимеразного домена вектора экспрессии pRDA3-2 идентична последовательности гена ДНК-полимеразы дикого типа. Плазмиды pRDA3-2, pCS1 и ПЦР-продукт Е681К F667Y расщепляли с помощью BamHI и NheI и фрагмент ДНК длиной 265 пар оснований из плазмиды pCS1 или ПЦР-продукта лидировали с вектором pRDA3-2 стандартными способами.
Образовавшимися плазмидами, pLK112 и pLK113 соответственно, трансформировали штамм Е. coli DG116 (АТСС № 53606). Эти плазмиды кодируют термостабильные ДНК-полимеразы, обозначенные в настоящем описании как G46D Е681К Taq и G46D Е681К F667Y Taq соответственно. Образовавшийся в результате экспрессии протеин термостабильной ДНК-полимеразы G46D Е681К F667Y Taq выделяли и очищали в соответствии с методом, описанным у Lawyer и др., 1993, см. выше.
Фермент G46D Е681К Taq очищали, используя аналогичный, но более мелкомасштабный способ, состоящий в следующем. Все стадии проводили при 4°С, если не указано иное. Клетки из 475 мл культуры ресуспендировли в 30 мл буфера (50 мМ трис-HCl, рН 7,5, 10 мМ ЭДТК, рН 8,0, 0,5 мМ Pefabloc©SC, 0,5 мкг/мл леупептина, 0,1 мМ Nα-пара-тозил-L-лизинхлорметилкетон, 1 мМ ДТТ). Клетки подвергали облучению ультразвуком при 50%-ном рабочем цикле, значении регулировочного параметра 5 в течение 1 мин и охлаждали на льду в течение 1 мин. Эту стадию повторяли еще два раза. Затем добавляли 1,5 мл 4,0 М сульфата аммония и смесь выдерживали в водяной бане при 75°С в течение 15 мин, после чего охлаждали на льду. Добавляли полиэтиленимин до концентрации 0,6% и смесь инкубировали на льду в течение 10 мин. Смесь центрифугировали при 16000xg в течение 30 мин. Супернатант загружали в фенил-сефарозную колонку объемом 1,8 мл (хроматографическая колонка типа Bio-rad Polyprep), уравновешенную раствором, включающим 50 мМ трис-HCl, рН 7,5, 10 мМ ЭДТК, рН 8,0, 1 мМ ДТТ, 0,2 М (NH4)2SO4. Колонку промывали 6 мл каждого из трех растворов: 1) 25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТК, 1 мМ ДТТ, 0,2 М (NH4)2SO4, 2) 25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТК, 1 мМ ДТТ и 3) 25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТК, 1 мМ ДТТ, 20%-ный этиленгликоль. Полимеразу элюировали с помощью 6 мл смеси, включающей 25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТК, 1мМ ДТТ, 20%-ный этиленгликоль, 2,5 М мочевину. После доведения концентрации КС1 с помощью 3 М КСl в препарате полимеразы до уровня 100 мМ смесь загружали в гепарин-сефарозную колонку (объем 1,8 мл, колонка типа Bio-rad Polyprep), уравновешенную раствором, включающим 25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТК, 1 мМ ДТТ, 100 мМ КСl. После промывки этим же буфером образец элюировали буфером, содержащим 25 мМ трис-HCl, рН 7,5, 1 мМ ЭДТК, 1 мМ ДТТ, 400 мМ КСl.
После очистки активность модифицированных ферментов определяли согласно методу оценки активности, описанному у Lawyer и др., 1989, J. Biol. Chem. 264: 6427-6437, причем эта публикация включена в настоящее описание в виде ссылки. Активность очищенных ферментов рассчитывали следующим образом: одна единица активности фермента соответствует 10 нмолям продукта, синтезированного в течение 30 мин. Активность ДНК-полимеразы прямо пропорциональна концентрации фермента до включения 80-100 пмолей дЦМФ (разбавление фермента составляет 0,024-0,03 единиц/мкл). Очищенные ферменты использовали для включения и в реакциях секвенирования, приведенных в примерах II-IV.
Пример II
Анализ сравнительной эффективности включения ддНТФ
Относительные способности ДНК-полимераз G46D F667Y Taq, G46D F667Y Е681К Taq и F730Y Tma30 включать ддЦТФ, меченные красителем из класса флуоресцеина, сравнивали с помощью конкурентного анализа удлинения праймера при использовании лимитирующей матрицы. ДНК-полимераза F730Y Tma30 описана в примере I заявки на патент США 60/052065, поданной 9 июля 1997 г., и в европейской заявке 98112327.6, причем оба эти документа включены в настоящее описание в качестве ссылки. Согласно этому конкурентному анализу, поскольку включение ддЦТФ прекращает реакцию удлинения, чем легче полимераза включает ддЦТФ в удлиненный праймер, тем меньше [α-33Р]дЦТФ может быть включено. Таким образом, когда эффективность включения ддЦТФ возрастает, возрастает и степень ингибирования синтеза ДНК. Эффективность включения ддЦТФ затем сравнивают с эффективностью включения флуоресцентномеченного ддЦТФ, получая относительную величину эффективности включения флуоресцентномеченных ддНТФ для данного фермента.
Анализ проводили в соответствии с описанным ранее методом (Lawyer и др., 1989, J. Biol. Chem. 264: 6427) со следующими модификациями. Смесь для анализа составляли таким образом, чтобы конечная концентрация ингредиентов была следующей: 50 мМ Bicine [N,N-бис(2-гидроксиэтил)глицин], рН 8,3, 25°С, 2,5 мМ MgCl2, 1 мМ β-меркаптоэтанол, 20 мкМ каждого из дАТФ, дГТФ и дТТФ (фирма Perkin Elmer), 20 мкМ дЦТФ (фирма Perkin Elmer) и [α-33Р]ДЦТФ (фирма New England Nuclear, Boston, MA). Матрицу M13mp18 (фирма Perkin Elmer) отжигали с праймером DG48 (SEQ ID NO:10) и количество, эквивалентное 0,085 пмолям ренатурированной (отожженной) матрицы, добавляли в смесь для анализа для каждой реакции. 35 мкл смеси для анализа с матричной ДНК добавляли в каждую из 38 пробирок Эппендорфа объемом 0,5 мл. Разбавления Zowie-ддЦТФ в 25 мМ буфере CAPSO, рН 9,6, готовили таким образом, чтобы когда в каждую из реакционных пробирок было добавлено по 10 мкл каждого из них, конечная концентрация Zowie-ддЦТФ составляла 3, 1, 0,5, 0,25, 0,125 или 0,0625 мкМ. Для полимеразы G46D F667Y Taq готовили по две пробирки для каждой из концентраций 3, 1, 0,5, 0,25, 0,125 мкМ Zowie-ддЦТФ. Для полимераз G46D F667Y Е681К Taq и F730Y Tma30 готовили по две пробирки для каждой из концентраций 1, 0,5, 0,25, 0,125 и 0,0625 мкМ Zowie-ддЦТФ. В остальные восемь реакционных пробирок добавляли 10 мкл 25 мМ буфера CAPSO, рН 9,6. Таким образом, каждая из 38 пробирок содержала 35 мкл смеси для анализа и 10 мкл либо 25 мМ буфера CAPSO, рН 9,6, либо одного из разбавлений Zowie-ддЦТФ.
Для каждого из ферментов, подлежащих тестированию, полимеризацию инициировали добавлением 5 мкл фермента в одну пробирку с каждым из разбавлений Zowie-ддЦТФ и в две пробирки, содеражащие только буфер CAPSO. Использовали следующие концентрации ферментов, предварительно определенные таким образом, чтобы в каждом анализе иметь избыточное количество фермента по сравнению с количеством субстрата: 2,5 единиц ДНК-полимеразы F667Y G46D Taq, полученной согласно примеру I; 1,25 единиц ДНК-полимеразы G46D F667Y Е681К Taq, полученной согласно примеру I; или 2 единицы ДНК-полимеразы F730Y Tma30. В качестве контроля для определения фонового уровня реакцию в оставшихся пробирках, представляющих собой отрицательный контроль, инициировали буфером для разбавления фермента, а не полимеразой. Все реакционные пробирки сразу же подвергали кратковременному встряхиванию и инкубировали в течение 10 мин при 75°С. Реакции прекращали, добавляя 10 мкл 60 мМ ЭДТК, и продукт хранили при 0°С.
В аналогичном эксперименте ддЦТФ разбавляли 25 мМ буфера CAPSO, рН 9,6, таким образом, чтобы когда в реакционные пробирки было добавлено по 10 мкл каждого из разбавлений, конечная концентрация составляла 0,5, 0,25, 0,125, 0,0625 или 0,0312 мкМ. По 10 мкл каждого разбавления вносили с помощью пипетки в каждую из трех пробирок Эппендорфа объемом 0,5 мл, содержащих 35 мкл смеси для анализа, как описано выше. Также подготавливали четыре пробирки, содержащие 35 мкл смеси для анализа плюс 10 мкл 25 мМ буфера CAPSO, рН 9,6. Таким образом, каждая из 19 пробирок содержала 35 мкл смеси для анализа и 10 мкл либо 25мМ буфера CAPSO, рН 9,6, либо одного из разбавлений ддЦТФ.
В одной пробирке, содержащей каждое из разбавлений ддЦТФ, и в одной пробирке, содержащей буфер CAPSO, полимеризацию инициировали добавлением по 2,5 ед. ДНК-полимеразы G46D F667Y Taq, 1,25 ед. ДНК-полимеразы G46D F667Y Е681К Taq или 2 ед. ДНК-полимеразы F730Y Tma30. В качестве отрицательного контроля реакцию в оставшейся пробирке, содержащей буфер CAPSO, инициировали буфером для разбавления фермента, а не буфером, содержащим полимеразу. Все реакционные смеси сразу же подвергали встряхиванию и инкубировали в течение 10 мин при 75°С. Реакции прекращали, добавляя 10 мкл 60 мМ ЭДТК и продукт хранили при 0°С.
Для каждой реакции аликвоты объемом 50 мкл из 60 мкл реакционной смеси разбавляли 1 мл 2 мМ ЭДТК и добавляли 50 мкг/мл фрагментированной ДНК спермы лосося в качестве носителя. ДНК осаждали с помощью трихлоруксусной кислоты (ТХУ), используя стандартные методы, и собирали на диски фильтра типа GF/C (фирма Whatman). Для каждого образца определяли количество включенного [α-33Р]дЦМФ и стандартизовали по отношению к образцам, содержащим буфер CAPSO без ддНТФ (0% ингибирования). Для каждого образца рассчитывали концентрацию ддЦТФ или Zowie-ддЦТФ, необходимую для 50%-ного ингибирования. Полученные данные приведены в таблице 2. Для конкретного фермента соотношение количества ддЦТФ, необходимого для 50%-ного ингибирования синтеза, и количества Zowie-ддЦТФ, необходимого для 50%-ного ингибирования синтеза, отражает относительную способность каждого фермента включать флуоресцентномеченный аналог. Эти данные показали, что ДНК-полимераза G46D F667Y Taq включает Zowie-ддЦТФ наименее эффективно из трех изученных ферментов (соотношение концентраций, необходимых для 50%-ного ингибирования, при использовании соответственно Zowie-ддЦТФ и ддЦТФ составляет 25). ДНК-полимераза F730Y Tma30 включает этот меченый аналог более эффективно, чем ДНК-полимераза G46D F667Y Taq (соотношение концентраций, необходимых для 50%-ного ингибирования, при использовании соответственно Zowie-ддЦТФ и ддЦТФ составляет 4), в то время как ДНК-полимераза G46D F667Y Е681К Taq включает меченый и немеченый ддЦТФ практически с одинаковой эффективностью (соотношение концентраций, необходимых для 50%-ного ингибирования, при использовании соответственно Zowie-ддЦТФ и ддЦТФ составляет 1, 2).
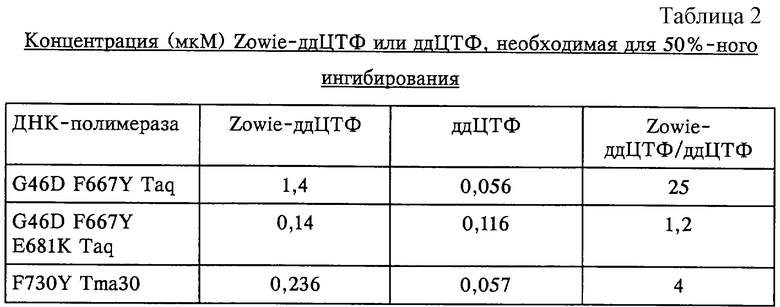
Пример III
Анализ скорости удлинения
Скорость удлинения при использовании полимераз G46D F667Y Taq и G46D F667Y Е681К Taq определяли с помощью анализа скорости удлинения. В этом эксперименте ферменты использовали для удлинения праймера, ренатурированного с М13, представляющего собой матрицу, в присутствии [α-33P]дЦМФ. Смеси, в которых проводили реакции удлинения, подвергали денатурации и продукты анализировали с помощью электрофореза в денатурирующем агарозном геле.
Анализ проводили согласно описанному ранее методу (Lawyer и др., 1989, J. Biol. Chem. 264: 6427) со следующими модификациями. Смесь для анализа составляли таким образом, чтобы конечная концентрация ингредиентов была следующей: 50 мМ Bicine, pH 8,3, 25°С, 2,5 мМ MgCl2, 1 мМ β-меркаптоэтанол, 200 мкМ каждого дАТФ, дГТФ и дТТФ (фирма Perkin Elmer), 100 мкМ дЦТФ (фирма Perkin Elmer), содержащий [α-33Р]дЦТФ (фирма New England Nuclear, Boston, MA). Матрицу M13mp18 (фирма Perkin Elmer) отжигали с праймером DG48 (SEQ ID NO:11) и количество, эквивалентное 0,085 пмолям ренатурированной матрицы, добавляли в смесь для анализа для каждой реакции. 45 мкл смеси для анализа с матричной ДНК добавляли в каждую из 14 пробирок Эппендорфа объемом 0,5 мл. Каждую пробирку предварительно инкубировали при 75°С в течение по крайней мере 30 с до начала реакции полимеризации.
В шести из четырнадцати анализируемых пробирок полимеризацию инициировали, добавляя по 5 мкл ДНК-полимеразы G46D F667Y Taq (2,5 ед.) или ДНК-полимеразы G46D F667Y Е681К Taq (1,25 ед.). Оба фермента получали согласно примеру I, а используемые концентрации были предварительно определены таким образом, чтобы в каждом анализе иметь избыточное количество фермента по сравнению с количеством субстрата. В качестве контроля для определения фонового уровня реакцию в оставшихся пробирках, представляющих собой отрицательный контроль, инициировали буфером для разбавления фермента, а не полимеразой. Все реакционные пробирки сразу же подвергали кратковременному встряхиванию и инкубировали при 75°С. Две из шести пробирок, содержащих ДНК-полимеразу G46D F667Y Taq, инкубировали в течение 3 мин, две в течение 6 мин и две в течение 10 мин. Аналогично этому две пробирки, реакцию в которых инициировали с помощью ДНК-полимеразы G46D F667Y Е681К Taq, инкубировали в течение 30 с, две в течение 1 мин и две в течение 2 мин. Контрольные пробирки инкубировали в течение 3 мин. Реакции прекращали, добавляя 10 мкл 60 мМ ЭДТК, и продукт хранили при 0°С.
Для каждой реакции аликвоты объемом 25 мкл из 60 мкл реакционной смеси разбавляли 1 мл 2 мМ ЭДТК и добавляли 50 мкг/мл фрагментированной ДНК спермы лосося в качестве носителя. ДНК осаждали с помощью ТХУ, используя стандартные методы, и собирали на диски фильтра типа GF/C (фирма Whatman). Для каждого образца определяли количество включенного [α-33P]дЦМФ.
Объединяли оставшиеся 35 мкл каждой смеси, взятой с дублированием, и образец объемом 70 мкл осаждали этанолом, сушили и ресуспендировали в 50 мМ NaOH, 1 мМ ЭДТК. Из этих образцов брали аликвоты таким образом, чтобы каждая из них содержала одинаковое количество радиоактивной метки [α-33Р]. Эти аликвоты загружали в 0,9%-ный щелочной агарозный гель, подвергали электрофорезу, сушили и авторадиографировали согласно ранее описанному методу (Maniatis и др., 1982, In Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY). В качестве стандарта молекулярной массы использовали ДНК бактериофага лямбда, расщепленную рестриказой HindIII (BRL) и меченную на 5'-конце с помощью 33P.
Длину продукта удлинения каждого образца (в парах оснований) определяли путем сравнения длины пробега каждого образца с длиной пробега ДНК фага лямбда стандартного размера. Количество пар оснований каждого продукта делили на время инкубирования (в секундах) каждой реакции удлинения, получая скорость удлинения, данные о которой приведены в таблице 3.
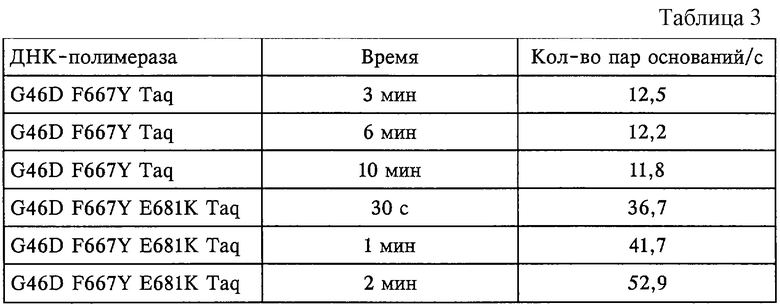
Эти результаты показывают, что наличие мутации Е681К в ферменте G46D F667Y Taq увеличивает скорость удлинения в 3-4,3 раза.
Пример IV
Цикличное секвенирование с использованием ДНК-полимеразы G46D F667Y Е681К Taq и меченных флуоресцеином ддНТФ
В этом примере продемонстрировано применение модифицированной полимеразы по изобретению для цикличного секвенирования с дидезокси-терминатором, меченным флуоресцеиновым красителем, с использованием концентрации ддНТФ 1 мкМ или ниже и соотношения ддНТФ:дНТФ по крайней мере 1:100. Дидезокси-терминаторы, меченные флуоресцеиновым красителем, представляют собой реагенты, входящие в наборы Applied Biosystems PRISM Sequenase® Terminator Sequencing Kits (фирма Perkin-Elmer, Norwalk, CT), которые оптимизировали с целью применения вместе с секвеназой ДНК-полимеразы и альфа-тио-дНТФ. Реакции цикличного секвенирования проводили в реакционной смеси объемом 20 мкл, содержащей 50 мМ трис-HCL (рН 8,8), 2,0 мМ MgCl2, дАТФ, дЦТФ и дТТФ с концентраций каждого 100 мкМ (фирма Perkin-Elmer, Norwalk, СТ), 500 мкМ дИТФ (Pharmacia Biotech, Piscataway, NJ), 0,2 мкг матричной одноцепочечной ДНК М13mp18 (фирма Perkin-Elmer), 0,15 мкМ праймер LacZ Forward Primer (фирма Perkin-Elmer), 5 единиц ДНК-полимеразы G46D F667Y Е681К Taq, 20 единиц термостабильной пирофосфатазы rTth (rTth Thermostable Pyrophosphatase) (европейская заявка ЕР-А-763599 и патент США 5665551), 0,05 мкМ окрашенный терминатор для секвеназы A (Sequenase A Dye Terminator), 0,80 мкМ окрашенный терминатор для секвеназы С (Sequenase С Dye Terminator), 0,08мкМ окрашенный терминатор для секвеназы G (Sequenase G Dye Terminator) и 1,0 мкМ окрашенный терминатор для секвеназы Т (Sequenase T Dye Terminator). Все четыре окрашенных терминатора для секвеназы получали от фирмы Perkin-Elmer. Реакционные смеси помещали в предварительно нагретую (75°С) термоячейку для проведения ПЦР типа Perkin-Elmer GeneAmp© PCR System 9600 и подвергали 25 циклам при 96°С в течение 10 с, 50°С в течение 5 с и 60°С в течение 4 мин. Меченные красителем фрагменты очищали с помощью колонок Centri-Sep™ (фирма Princeton Separations, Adelphia, NJ) согласно инструкциям производителя и сушили в вакуумной центрифуге. Дебрис ресуспендировали в 6 мкл смеси 5:1 (объем/объем) деионизированный формамид:50 мг/мл декстрана Blue (в 25 мМ ЭДТК, рН 8,0), выдерживали при 90°С в течение 3 мин и непосредственно загружали в предварительно подвергнутый электрофорезу гель, содержащий 4% полиакриламида/6 М мочевину, и подвергали электрофорезу и анализировали на секвенаторе типа Perkin-Elmer ABI PRISM' 377 DNA Sequencer согласно инструкциям производителя (ABI PRISM 377 DNA Sequencer User's Manual). Автоматизированное определение оснований с помощью программы анализа для секвенатора Perkin-Elmer ABI PRISM 377 DNA Sequencer позволило определить 450 оснований с точностью выше 98,5% (6 ошибок для оснований в положении от +10 до +460 в зависимости от праймера).
Перечень последовательностей приведен в конце описания.









| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННАЯ ТЕРМОСТАБИЛЬНАЯ ДНК-ПОЛИМЕРАЗА, СПОСОБ ЕЁ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 1997 |
|
RU2235773C2 |
| СПОСОБ ГОМОГЕННОЙ ДЕТЕКЦИИ ПО МЕНЬШЕЙ МЕРЕ ОДНОГО ПРОДУКТА ОДНОЦЕПОЧЕЧНОЙ АМПЛИФИКАЦИИ | 2005 |
|
RU2460804C2 |
| ПОЛИМЕРАЗЫ, КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2779599C1 |
| ФЕРМЕНТАТИВНЫЙ СИНТЕЗ L-НУКЛЕИНОВЫХ КИСЛОТ | 2013 |
|
RU2704833C2 |
| СЛИТЫЙ БЕЛОК ТИОРЕДОКСИНА И ДОМЕНА 4 ИНФЕСТИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ЭКСПРЕССИОННАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ СЛИТЫЙ БЕЛОК, И БАКТЕРИЯ РОДА Escherichia coli, ТРАНСФОРМИРОВАННАЯ ТАКОЙ ПЛАЗМИДНОЙ ДНК | 2012 |
|
RU2528251C2 |
| ВЫСОКОПРОИЗВОДИТЕЛЬНЫЙ АНАЛИЗ ТРАНСГЕННЫХ ГРАНИЦ | 2012 |
|
RU2603265C2 |
| Мутантные полимеразы вируса гепатита В | 2012 |
|
RU2625021C2 |
| ВАРИАНТЫ АЛЬФА-АМИЛАЗЫ | 2000 |
|
RU2231547C2 |
| МУТАНТНАЯ ЛЮЦИФЕРАЗА (ВАРИАНТЫ), ДНК, КОДИРУЮЩАЯ УКАЗАННУЮ ЛЮЦИФЕРАЗУ, И ВЕКТОР ДЛЯ ЭКСПРЕССИИ УКАЗАННОГО БЕЛКА | 1996 |
|
RU2210594C2 |
| ПОЛУЧЕННАЯ ИЗ МИКРООРГАНИЗМА ПРОТЕАЗА УСОВЕРШЕНСТВОВАННОГО ТИПА, ОБЕСПЕЧИВАЮЩАЯ СВЕРТЫВАНИЕ МОЛОКА | 2010 |
|
RU2495931C2 |
Изобретение относится к области генной инженерии и молекулярной биологии и может быть использовано при разработке и осуществлении многих методов анализа ДНК. Предложены модифицированные формы термостабильных ДНК-полимераз, получаемые путем замены остатка глутамата в 4-м положении 11-членного критического мотива, принадлежащего нативной форме фермента бактерий р. Thermus, другим аминокислотным остатком, введение которого имеет результатом понижение уровня дискриминирующей способности фермента по отношению к нуклеотидам, меченным красителем из класса флуоресцеина. Предпочтительной является замена глутамата в указанном положении лизином. Описаны ДНК-последовательности, кодирующие предлагаемые варианты термостабильной ДНК-полимеразы, векторы для экспрессии этих последовательностей в различных типах хозяйских клеток, способ получения рекомбинантных форм модифицированных ДНК-полимераз по изобретению и наборы для осуществления анализов с их использованием, которое существенно упрощает экспериментальную процедуру. 5 с. и 6 з.п. ф-лы, 1 ил., 3 табл.
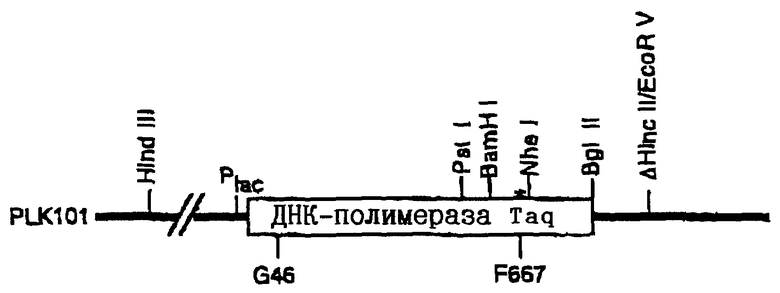
| TABOR S., RICHARDSON C.C | |||
| Proc | |||
| Natl | |||
| Acad | |||
| Sci | |||
| USA, v.92, р.6339-6343, 1995 | |||
| REEVE M.A, FULLER C.W | |||
| Nature, v.376, p.976, 977, 1995 | |||
| WO 9610640 А, 11.04.1996 | |||
| Тормозная система транспортного средства | 1977 |
|
SU727496A1 |
| WO 9641014 А, 19.12.1996. | |||
Авторы
Даты
2004-10-27—Публикация
1998-09-11—Подача