Область техники
Настоящее изобретение относится к очистке биологических веществ с применением магнитных частиц, связывающих материал, специфически образом выделяя его из смеси. Изобретение может быть использовано, например, для очистки нуклеиновых кислот ДНК и РНК.
Уровень техники
Магнитные частицы можно покрыть сепарирующим реагентом, специфическим образом реагирующим с заданным биологическим веществом. Связанное вещество вместе с частицами выделяется из смеси, а затем освобождается от частиц для дальнейшей обработки. В настоящее время на практике это осуществляется следующим образом: частицы выводят магнитом на стенку сосуда, содержащего смесь, а жидкость сливают или отсасывают из сосуда. После этого в сосуд может быть помещена новая жидкость. Для такой технологии разделения имеются также серийно выпускаемые ручные и автоматические устройства, например Spherotec, Inc., AutoMag Processor (США), Merck Magnetic Rack (Германия), планшетный сепаратор с ячейками (лунками) PerSeptive Biosystems 96, Multi-6 Separator, Solo-Sep Separator (США), Dynal Magnetic Particles Concentrators.
Традиционная техника очистки в случае ДНК включает в себя ультрацентрифугирование в хлориде цезия при наличии градиента концентрации. Однако для очистки нуклеиновых кислот применялась также и описанная выше технология с использованием магнитных частиц.
В международной патентной публикации WO 94/18565 (Labsystems Oy) предлагается способ и устройство для проведения специфических анализов связывания магнитными частицами, обеспечивающих сепарирование указанных частиц из смеси с помощью зонда, содержащего стержень, способный к перемещению в вертикальном канале и на нижнем конце снабженный магнитом. Зонд со стержнем, находящимся в нижнем положении, вводят в смесь, в результате чего частицы собираются на зонде. Затем зонд переносят в другой сосуд и стержень вытягивают в верхнее положение, освобождая частицы. Таким образом, каждую из стадий анализа можно провести в отдельном сосуде, не прибегая к переносу жидкостей. В последнем сосуде проводят измерения.
В международной патентной публикации WO 94/12959 (Labsystems Oy) предлагается инструмент для переноса магнитных частиц, содержащий удлиненный компонент с вогнутой сужающейся концевой частью. Кроме того, компонент содержит средства, создающие продольное магнитное поле для сбора частиц у указанной концевой части. Для освобождения частиц предусмотрена возможность выключения магнитного поля. Этот инструмент особенно пригоден для сбора частиц из большого объема и освобождения их в очень маленький объем.
Сущность изобретения
Согласно изобретению, разработан новый способ, представленный в п.1 формулы изобретения. Некоторые предпочтительные варианты осуществления изобретения определены другими пунктами формулы.
Согласно изобретению, подлежащий очистке материал помещают в первую среду, содержащую магнитные частицы. Они покрыты реагентом, обладающим по отношению к материалу связывающими свойствами. Протекает реакция связывания, после которой частицы выделяют из среды посредством магнитного зонда и переносят во вторую среду, в которой может иметь место требуемая далее реакция, необходимая для очистки. Для проведения дальнейших стадий способа очистки частицы можно перенести таким же образом через последующие среды. К моменту, когда частицы переносят в сосуды, содержащаяся в сосудах среда, необходимая для проведения реакция, должна быть готова к употреблению. Предпочтительно также, чтобы частицы освобождались от зонда во всех средах, начиная со второй.
Согласно изобретению, по меньшей мере одна из сред содержит агент, ослабляющий поверхностное натяжение. Это способствует полному сбору частиц.
Некоторые из таких агентов применялись в таких же целях для облегчения связывания выделяемого вещества, см., например, Wipat et al., Microbiology (1994), 140, 2067. В этих известных способах частицы не переносят из одного сосуда в другой, и они во время удаления среды из сосуда удерживаются на его стенке посредством находящегося снаружи магнита.
Изобретение может быть применено специально для очистки нуклеиновых кислот, таких как ssДНК, dsДНК и mРНК.
Перечень фигур чертежей
Прилагаемые чертежи являются составной частью описания.
На фиг.1 показан эффект воздействия детергента на стадиях сбора и освобождения частиц, способных к намагничиванию.
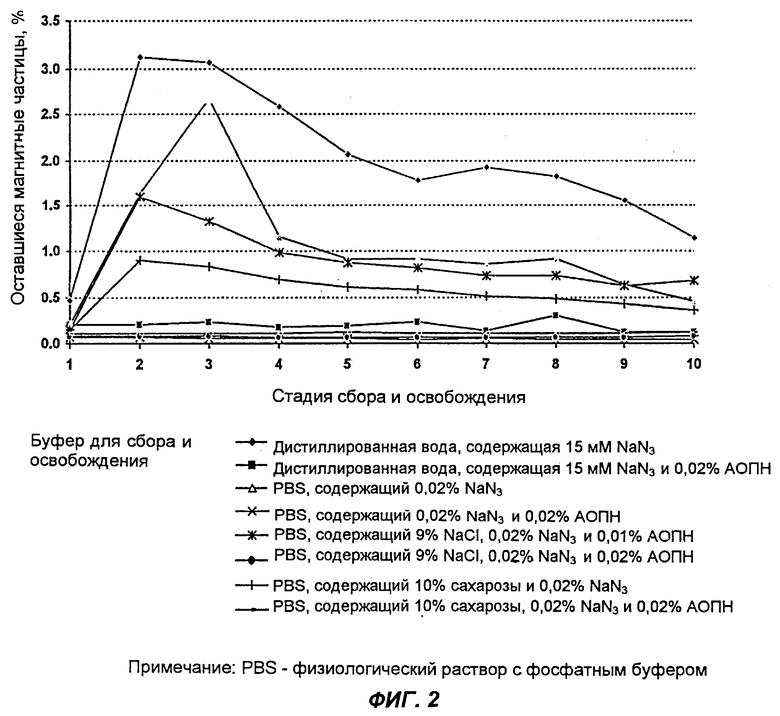
На фиг.2 показан эффект воздействия соли и сахарозы в буфере для сбора и освобождения.
На фиг.3 показан эффект воздействия протеина в буфере для сбора и освобождения.
На фиг.4 показан эффект воздействия детергента в случае применения магнитных частиц, полученных от различных поставщиков.
Сведения, подтверждающие возможность осуществления изобретения
Изобретение может быть применено, например, для очистки клеток, вирусов, субклеточных органелл, протеинов и в особенности материалов, содержащих нуклеиновые кислоты.
Магнитные частицы предпочтительно парамагнитны. Размер частиц составляет обычно величину менее 50 мкм, предпочтительно 0,1-10 мкм, наиболее предпочтительно 1-5 мкм. Концентрация частиц может равняться, например, 0,01-5 мг/мл, предпочтительно 0,05-3 мг/мл, наиболее предпочтительно 0,2-2 мг/мл.
Частицы покрывали или обрабатывали связывающим реагентом, например кремнием, пектином и/или другими реактивными функциональными группами, такими как олигонуклеотиды, антитела, антигены, стрептавидин или биотин.
Частицы переносят из одного сосуда в другой предпочтительно с применением зонда, содержащего стержень, способный к перемещению в вертикальном канале и на нижнем конце снабженный магнитом. Зонд со стержнем, находящимся в нижнем положении, вводят в смесь, в результате чего частицы собираются на зонде. Затем его переносят в другой сосуд и, когда стержень вытягивают в его верхнее положение, частицы освобождаются.
В способе могут быть применены различные типы соединений, ослабляющих поверхностное натяжение, в особенности это относится к водорастворимым соединениям. Примерами их являются:
А. Поверхностно-активные вещества (ПАВ), такие как
- Мыло различного типа
- Детергенты, включая анионные, катионные неионогенные и цвиттерионные соединения
Б. Спирты, такие как
- Полиэтиленовые и поливиниловые спирты, а также их протеиновые и другие производные
В. Протеины
Г. Соли и углеводы с высокими концентрациями, такие как
- NaCl
- Сахароза.
Могут применяться также и смеси указанных соединений.
В особенности пригодны ПАВ типа детергентов. К предпочтительным детергентам относятся сложные эфиры этоксилированного ангидросорбита. Сложные эфиры могут содержать, например, 4-20 этиленоксидных групп.
Концентрация ПАВ может составлять, например, 0,001-0,5% (вес/объем), предпочтительно 0,005-0,1% (вес/объем), наиболее предпочтительно 0,01-0,05% (вес/объем). Концентрация протеина может составлять, например, 0,1-10% (вес/объем), предпочтительно 0,25-5% (вес/объем), наиболее предпочтительно 0,5-2% (вес/объем). Концентрация соли может составлять, например, 0,1-10 М, предпочтительно 0,1-7 М.
Для очистки ДНК или mРНК, полученных из различных источников (например, ДНК из PCR (polymerace chain reaction, полимеразная реакция синтеза цепи) амплификации, ДНК из крови, костного мозга или культивированных клеток, mРНК из эукариотной общей РНК или из необработанных экстрактов тканей животных, клеток или растений) нуклеиновые кислоты иммобилизуют с применением магнитных частиц.
Связывание может осуществляться посредством взаимодействия стрептавидина и биотина, поэтому можно использовать частицы, покрытые стрептавидином, и биотинилированную ДНК. Кроме того, и сама ДНК может абсорбироваться на поверхности частиц. Связывание mРНК может осуществляться посредством препарата Oligo (dT)25, ковалентным образом присоединенного к поверхности частиц.
После иммобилизации нуклеиновые кислоты промывают несколько раз для удаления всех реакционных компонентов, образующихся в результате амплификации, или других загрязняющих веществ, в частности PCR ингибиторов.
Промывку можно проводить отсоединяющими и собирающими комплексами в промывающем буфере и путем переноса их в другую ячейку, содержащую свежий промывающий буфер.
В случае очистки ssДНК иммобилизованную двунитевую ДНК можно конвертировать в однонитевую форму путем инкубации с 0,1 М NaOH и применить магнитное разделение.
Для выделения mРНК ее можно отмыть от частиц с помощью буфера с низким содержанием соли.
Процесс очистки можно провести на установке, использующей магнитные частицы, в которой каждую среду приготавливают в отдельном сосуде. Агент, ослабляющий поверхностное натяжение, предпочтительно применять в каждой среде. Возможно применение пригодных планшетов одноразового действия, таких как микротитровальные планшеты, содержащих необходимые сосуды.
С помощью одного планшета можно совершить несколько параллельных процессов очистки.
Пример реагентов, применяемых для очистки ssДНК
1. Суспензия частиц, например, в физиологическом растворе с фосфатным, трифосфатным или боратным буфером, рН 7,4, содержащем 0,1% альбумина бычьей сыворотки (BSA), 15 мМ NaN3 и, например, 0,02% полиоксиэтилен(20)-сорбитанмонолаурата (Tween 20TM) в качестве отсоединяющего агента, снижающего поверхностное натяжение.
2. Связывающий и промывающий буфер (TEN): 10 мМ трис-HCl, 1 мМ ЭДТА (этилендиаминтетрауксусная кислота), 2 М NaCl, например, 0,02% Tween 20TM, 15 мМ NaN3, pH 7,5.
3. Переносящий буфер: 10 мМ трис-HCl, 1 мМ ЭДТА, например, 0,02% Tween 20TM, 15 мМ NаN3, рН7,5.
4. Плавящий раствор: 0,1 М NaOH, например, 0,02% Tween 20™.
5. Например, 0,02% Tween 20TM в дистиллированной воде, 15 мМ NaN3.
Пример реагентов, применяемых для прямой очистки mРНК
1. Суспензия частиц Олиго(dТ)25 в ФФБ (физиологический раствор с фосфатным буфером), рН 7,4, содержащим, например, 0,02% Tween 20TM и 15 мМ NaN3.
2. Лизисный/связывающий буфер: 100 мМ трис-HCl, рН 8,0, 500 мМ LiCl, 10 мМ ЭДТА, 1% LiDS (додецилсульфат лития), 5 мМ дитиотрейтола (ДТТ), 15 мМ NaN3, (например, 0,02% Tween 20™).
3. Промывающий буфер с додецилсульфатом лития (LiDS) или натрия (SDS): 10 мМ трис-HCl, рН 8,0, 0,15 М LiCl, 1 мМ ЭДТА, 0,1% LiDS, 15 мМ NaN3, (например, 0,02% Tween 20TM).
4. Промывающий буфер: 10 мМ трис-HCl, рН 8,0, 0,15 М LiCl, 1 мМ ЭДТА, например, 0,02% Tween 20TM, 15 мМ NaN3.
5. Элюирующий раствор: 2 мМ ЭДТА, рН 8,0, 15 мМ NaN3, например, 0,02% Tween.
6. Восстанавливающий раствор: 0,1 V NaOH, например, 0,02% Tween 20TM.
7. Сохраняющий буфер Олиго(dТ)25: 250 мМ трис-HCl, рН 8,0, 20 мМ ЭДТА, 0,1% Tween-20TM, 15мМ NаN3.
Пример реагентов, применяемых для очистки mРНК
1. Связывающий буфер: 20 мМ трис-HCl, рН 7,5, 1,0 М LiCl, 2 мМ ЭДТА, 15 мМ NaN3, например, 0,02% Tween-20TM.
2. Промывающий буфер: 10 мМ трис-HCl, рН 8,0, 0,15 мМ LiCl, 1 мМ ЭДТА, 15 мМ NaN3, например, 0,02% Tween 20TM.
3. Элюирующий раствор: 2 мМ ЭДТА, рН 8,0, 15 мМ NaN3, например, 0,02% Tween 20TM.
Пример реагентов, применяемых для выделения РНК
1. 4 М изотиоцианата гуанидиния, 25 мМ цитрата натрия рН 7,0, 0,5% N-лаурилсаркозина, 0,01 М β-меркаптоэтанола.
Пример реагентов, применяемых для прямой очистки ДНК
1. Суспензия частиц в лизисном буфере (например, 50 мМ трис-HCl, рН 7,2, 50 мМ ЭДТА, 3% SDS, 1% 2-меркаптоэтанола; 50 мМ KCl, 10-20 мМ трис-HCl, 2,5 мМ MgCl2, рН 8,3, 0,5% Tween-20TM, 100 мкг/мл протеиназы К; 100 мМ трис-HCl, рН 8,5, 5 мМ ЭДТА, 1% SDS, 500 мкг/мл протеиназы К), содержащем 15 мМ NaN3.
2. Промывающий буфер, содержащий 15 мМ NaN3 и, например, 0,02% Tween 20TM.
3. Ресуспендирующий буфер, содержащий 15 мМ NaN3 и, например, 0,02% Tween 20TM.
Пример очищающего процесса PCR продуктов при комнатной температуре на установке с магнитными частицами
Реагенты размещают в ячейки, последовательно расположенные на планшете.
Пример конфигурации расположения реагентов:
Ячейка 1. Образец (биотинилированная ДНК, PCR ампликоны).
Ячейка 2. Покрытые стрептавидином магнитные частицы в промывающем буфере.
Ячейки 3-5. Промывающий буфер.
Ячейка 6. NaOH.
Ячейка 7. Переносящий буфер.
Ячейка 8. Дистиллированная вода.
Пример стадий процесса:
Ячейка 2. Смешивание, промывание и сбор частиц, перемещение их в ячейку 3.
Ячейка 3. Промывание частиц, перемещение их в ячейку 4.
Ячейка 4. Промывание частиц, перемещение их в ячейку 1.
Ячейка 1. Десятиминутная инкубация образца, перемещение частиц в ячейку 4.
Ячейка 4. Промывание частиц, перемещение их в ячейку 5.
Ячейка 5. Промывание частиц, перемещение их в ячейку 6.
Ячейка 6. Пятиминутная инкубация в плавящем растворе, перемещение частиц в ячейку 4.
Ячейка 4. Промывание частиц, перемещение их в ячейку 5.
Ячейка 5. Промывание частиц, перемещение их в ячейку 7.
Ячейка 7. Прополаскивание частиц, перемещение их в ячейку 8.
Ячейка 8. Освобождение частиц.
Эффект воздействия агента, ослабляющего поверхностное натяжение (АОПН), на стадиях сбора и освобождения магнитных частиц
Покрытые стрептавидином магнитные частицы (размеры: Scigen стрептавидин 3 мкм, Scigen; SPHEROTM стрептавидин 4-4,5 мкм, Spherotec; Dynabeads M-280 стрептавидин 2,8 мкм, Dynal) пропитывали биотинилированной щелочной фосфатазой (Calbiochem, США) в течение 1 ч при 37°С. Пропитанные частицы сначала промыли с целью удаления несвязанной щелочной фосфатазы, а затем использовали для оценки эффекта воздействия АОПН на стадиях сбора и освобождения при работе установки с магнитными частицами. Инструмент, примененный в этих примерах, был настроен на интервал 20-200 мкл, а производительность устройства находилась в интервале 1-24 образца за цикл. В устройстве был использован стержневой магнит (цилиндрический NdFeB с аксиальным намагничиванием, длина 2 мм, диаметр 3 мм) в полипропиленовой трубке (наружный диаметр 4,5 мм).
Опуская подробности, можно резюмировать, что частицы последовательно подвергали освобождению и сбору, переводя их из одной ячейки в другую таким образом, чтобы весь процесс содержал 10 стадий. Количество частиц, оставшихся в ячейках после сбора, устанавливали путем количественного анализа с использованием щелочной фосфатазы. Образцы (10 мкл) из каждой ячейки перенесли на пустой микротитровальный планшет (ячейки с круглым дном, диаметр 6,5 мм).
В этом анализе в качестве стандарта применяли щелочную фосфатазу, пропитавшую частицы (0,016 мкг-1 мкг частиц/10 мкл разбавителя). В ячейки, содержащие 10 мкл образцов и стандартов, добавили 100 мкл pNPP-субстрата, разведенного в диэтаноламиновом (ДЭА) буфере (Labsystems). Субстрат инкубировали в течение 15 мин при 37°С с непрерывным взбалтыванием (900 об/мин) в виброустановке Labsystems iEMS Incubator/Shaker. Реакцию прекратили добавлением в каждую ячейку 100 мкл 1М NaOH и измерили поглощение у 405 нм на фотометре (Labsystems Multiskan).
Количество оставшихся частиц определили по линейному градуировочному графику и конечные результаты выразили в виде процентов от исходного количества частиц (0,2 мг/ячейка).
На фиг.1 показан эффект воздействия детергента (Tween 20TM) при различных концентрациях. В том случае, когда в собирающий и освобождающий буфер не добавляли агент, ослабляющий поверхностное натяжение, содержание остающихся частиц (Scigen стрептавидин) составило более 3%/ячейка. Когда концентрация детергента составляла ≥0,00125%, имел место эффективный сбор частиц.
На фиг.2 показан эффект воздействия соли и сахарозы, содержащихся в буфере для сбора и освобождения. При добавлении этих компонентов в буфер эффективность сбора частиц (Scigen стрептавидин) повышалась.
На фиг.3 показан эффект воздействия протеина (казеина), который в какой-то степени улучшал процесс на стадиях сбора частиц (SPHEROTM стрептавидин).
На фиг.4 показан эффект воздействия детергента в случае применения магнитных частиц, полученных от различных поставщиков.


Способы относятся к очистке биологических веществ с применением магнитных частиц. Предложены способ улучшения прилипания магнитных частиц из биологических жидкостей к магнитному зонду, способ их выделения из биологических жидкостей с помощью магнитного зонда и способ очистки биологических жидкостей, содержащих нуклеиновые кислоты – ДНК и РНК, при этом магнитные частицы обработаны реагентом, связывающим магнитные частицы с нуклеиновыми кислотами, а также используют реагент, ослабляющий поверхностное натяжение. Данные способы облегчают полный сбор частиц. 3 н. и 10 з.п. ф-лы, 4 ил.

| US 6040192 A, 21.03.2000.WO 9618731 A, 20.06.1996.WO 9831840 A1, 22.02.2000. |
Авторы
Даты
2004-10-27—Публикация
2000-01-18—Подача