Способ относится к медицине, к области молекулярно-биологических разработок биотералии лейкозов, а именно к разработкам методов специфичной биотерапии Ph+ лейкозов, возникающих в результате реципрокной транслокации хромосом t(9;22) в стволовой гемопоэтической клетке.
Образующаяся при этом Филадельфийская хромосома (Ph+ хромосома) является генетическим маркером ХМЛ, ОЛЛ и ряда других лейкозов; возникающий в составе Ph+ хромосомы онкоген BCR/ABL продуцирует онкобелки (тирозинкиназы р210, р190 и др.), которые являются этиологической причиной возникновения и прогрессии Ph+ лейкозов [1-4].
В настоящее время для терапии Рh+ лейкозов используется неспецифическая химиотерапия цитостатиками, интерферонотерания, трансплантация костного мозга (КМ). Эти методы тяжело переносятся больными и не обеспечивают полного выздоровления, за исключением трансплантации КМ, хотя последняя применима больным до 40 лет и при наличии совместимого костного мозга доноров [1].
Близким к предлагаемому методу является новый эффективный метод биотерапии ХМЛ и ОЛЛ препаратом STI-571 (“Гливек”), блокирующим функционирование тирозинкиназ (р210, р190 и др.) и индуцирующим программируемую гибель (апоптоз) Ph+ клеток.
Недостатками этого метода является повреждение еще 5 других важнейших клеточных тирозинкиназ, следствием чего является возникновение некоторых осложнений и лекарственной устойчивости к препарату у многих больных; кроме того, метод не учитывает закономерностей экспрессии онкобелков и поэтому для значительной доли больных он не эффективен [9-12].
Более специфичным подходом к биотерапии Рh+ лейкозов является заявляемый способ, основанный на применении антисенс технологии -действии антисмысловых (антисенс) олигонуклеотидов (АО) для ингибирования экспрессии онкогена BCR/ABL и его продуктов - онкобелков. Отметим, что антисенс технологии широко исследуются в поисках методов биотерапии вирусных, бактериальных и онкологических заболеваний [13, 14], в том числе и Рh+ лейкозов [5-8]. Показано, что антисенс олигонуклеотиды, узнающие последовательности мРНК онкогена BCR/ABL (AO-BCR/ABL) в районе слияния экзонов BCR и ABL, индуцируют торможение пролиферации и гибель Ph+ клеток в линиях, например BV 173. Однако на Ph+ клетках больных результаты были противоречивыми и касались в основном терминальной стадии ХМЛ - бластного криза. Антисенс олигонуклеотиды, специфичные к району b2а2 и b3а2 мРНК BCR/ABL, исследовались на животных и в элиминировании Ph+ клеток из КМ при ХМЛ для последующей трансплантации больному его же КМ, обработанного АО, на стадии бластного криза в сочетании с обычной химиотерапией, но без заметных успехов (двухмесячное увеличение продолжительности жизни больных) [5-8].
Заявляемый способ эффективной индукции апоптоза опухолевых Ph+ клеток костного мозга (КМ) и периферической крови (ПК) от больных Ph+ лейкозами использует обработку суспензионных культур Ph+ клеток антисенс олигонуклеотидами (АО) длиною в 15-26 нуклеотидных звеньев, специфичными к мРНК разных типов онкогена BCR/ABL (AO-BCR/ABL) в сочетании с АО к мРНК генов, блокирующих апоптоз Ph+ клеток и отличных от BCR/ABL.
1. Обработку Ph+ клеток проводят AO-BCR/ABL в сочетании с АО к мРНК других генов, блокирующих апоптоз, последовательно или одновременно в зависимости от характеристик экспрессии этих генов по данным обратной транскрипции и полимеразной цепной реакции (ОТ-ПЦР) или по данным гибели клеток в процессе обработки.
2. Используют Ph+ клетки КМ и ПК от больных, в которых экспрессируется неповрежденный ген супрессор р53 (wt-p53), что определяет максимальную индукцию гибели Ph+ клеток; в случаях с мутантным р53 наблюдается гибель части клеток.
3. Обработку суспензионных культур с АО проводят при длительной инкубации (по мере экспрессии мРНК мишеней) в среде, содержащей фетальную сыворотку теленка (ФТС) или другие ростовые факторы (смесь интерлейкина 3, колоний стимулирующих факторов: Г-КСФ и ГМ-КСФ, а также фактора роста стволовых клеток - CSF по 20-100 нг/мл) с кратковременным выдерживанием в начале обработки (от 30 до 120 мин) в среде без ФТС (или других ростовых факторов).
4. В качестве АО применяют олигонуклеотиды общей длиной в 15-26 нуклеотидов, узнающие различные последовательности мРНК генов, блокирущих алоптоз в Ph+ клетках: три типа BCR/ABL, BCL2, MDM2, cMYC и других, используя защищенные (фосфотиоаты, фосфотриэфиры и другие) и незащищенные (фосфодиэфиры) от клеточных нуклеаз олигонуклеотиды, с применением разного рода липосом или без них. При этом АО содержат последовательности сайтов инициации трансляции, слияния экзонов, сайты регуляции экспрессии генов, пролиферации или диференцировки клеток.
5. Для повышения специфичности апоптоза Ph+ клеток и снижения цитотоксического действия на Ph- клетки в качестве AO-BCR/ABL применяют олигонуклеотиды с минимальным числом нуклеотидов, комплементарных ABL фрагменту мРНК онкогена BCR/ABL (от 4 до 10) или комплементарные только фрагменту BCR мРНК онкогена (сайтам инициации трансляции или слияния экзонов). При этом для Ph+ клеток с мРНК BCR/ABL реализуется апоптоз, а для клеток с мРНК BCR - временное обратимое антисмысловое ингибирование экспрессии гена BCR.
Заявляемый способ эффективной индукции апоптоза в суспензионных культурах Ph+ клеток костного мозга и периферической крови при Ph+ лейкозах антисенс олигонуклеотидами к мРНК генов, блокирующих апоптоз, предназначают для очистки КМ и ПК от опухолевых Ph+ клеток (элиминации опухолевых клеток) с целью применения для аутологичной трансплантации костного мозга. Способ эффективной индукции апоптоза в суспензионных культурах также служит в качестве экспериментальной основы для разработки методов олигонуклеотидной генотерапии (биотерапии) ХМЛ и других Ph+ лейкозов. Этот подход к терапии лейкозов снизит токсичность по сравнению с применяемой химиотерапией на несколько порядков.
Предлагаемый способ индукции апоптоза в суспензионных культурах Ph+ клеток позволяет учитывать индивидуальные особенности протекания Ph+ лейкоза каждого больного и предсказывать его дальнейшее развитие на основании количественного анализа процессов, протекающих в суспензионных культурах под действием АО.
Описание метода.
Способ эффективной индукции гибели Ph+ клеток костного мозга (КМ) и периферической крови (ПК) от больных ХМЛ (мРНК BCR/ABL типа b3а2 и b2а2) и ОЛЛ (мРНК BCR/ABL типа е1а2) заключается в обработке суспензионных культур этих Ph+ клеток, выделенных из КМ и ПК любым методом (в градиенте плотности фикола, Лимфопрепа и др.), с последующей инкубацией с антисенс олигонуклеотидами (АО). Используются АО с длиной в 15-26 нуклеотидов, комплементарных к сайтам инициации трансляции мРНК онкогена BCR/ABL, к стыкам экзонов b2b3, b2a2, b3a2 или е1а2 и другим сайтам мРНК BCR/ABL онкогена в сочетании с АО к различным сайтам мРНК других генов, блокирующих апоптоз Ph+ клеток, в концентрации 0,03-50 мкМ АО одновременно, последовательно или раздельно в среде, содержащей 10-20%-ную фетальную сыворотку теленка (ФТС) или другие ростовые факторы в течение 3-7 суток, с кратковременным выдерживанием (от 30 до 120 мин) в среде без ФТС (или других ростовых факторов) в начале обработки АО при 37°С в 5%-ной атмосфере СО2 под контролем экспрессии генов и гибели клеток. При одновременной экспрессии BCR/ABL и р53 генов Ph+ клетки активно гибнут в течение 3 суток под действием АО. Если экспрессия BCR/ABL и др. генов наблюдается с лаг периодом, то необходима инкубация 5-7 суток и/или введение в среду других АО.
Метод эффективен для суспензионных культур КМ и ПК от больных ХМЛ и ОЛЛ при одновременной экспрессии в клетках BCR/ABL и р53 генов. Метод менее эффективен при ХМЛ в фазе бластного криза и в случае мутаций в 5-8 экзонах гена р53. Для Ph+ клеток с начальной экспрессией BCR/ABL и р53 генов применяют олигонуклеотиды с фосфодиэфирной межнуклеотидной связью (как наиболее дешевые); для длительной инкубации используются фосфотиоаты олигонуклеотидов или олигонуклеотиды с любой другой защитой межнуклеотидного фосфата. Для этого в инкубационную среду вводят АО-BCR/ABL и AO-BCL2 или АО к другим генам, блокирующим апоптоз, в соотношениях от 10:1 до 1:1 одновременно или последовательно (через 2-3 суток инкубации с первым АО). В композиции с AO-BCR/ABL также применяют попарно АО к мРНК MDM2, c-MYC или TdNT (в зависимости от экспрессии этих генов по данным ОТ-ПЦР в исходных Ph+ клетках или в процессе обработки).
Обработку проводят в среде А или среде В. Среда А - это среда α-МЕМ, содержащая 20% фетальной сыворотки теленка (ФСТ, Flow), 2 mM L-глютамина, 10-4 М 2-меркаптоэтанола, по 100 ед./мл пенициллина и стрептомицина, 25 mM HEPES-NaOH, pH 7,2-7,4. Среда В отличается от среды А отсутствием ФСТ.
Морфологию и состав клеток определяют в мазках окрашиванием с красителем Гимзой [15] или с помощью иммунофенотипирования с моноклональными антителами.
Экспрессию генов BCR/ABL, GAPDH, BCR, BCL2 и др. определяют методом ОТ-ПЦР по [16], применяя следующие олигонуклеотидные праймеры:
для гена BCR/ABL внешние праймеры -TGGATGAACTGGAGGCAG (1) и TCACAGGCGTGATGTAGTTG (2), внутренние праймеры GGAGCTGCAGATGCTGACCAAC (3) и GCTTCACACCATTCCCCATT (4);
для гена BCR внешние праймеры - 1 и CAGTTTGGCTCAGCTGTGTCCC (5), внутренние праймеры - 3 и CAGTGGCTGAGTGGACGATGAC (6); для гена р53 внешние праймеры - TGACACGCTTCCCTGGATTG (7) и GGAACAAGAAGTGGAGGATG (8), внутренние праймеры ACGTACTCCCCTGCCCTCAA (9) и GTCTTCCAGTGTGATGATGG (10);
для гена MDM2 внешние праймеры - ATGTGCAATACCAACATGTC (11) и TAGGGGAAATAAGTTAGCAC (12), внутренние праймеры - CAAGAACTCTCAGATGAAGATG (13) и TTGATGGCTGAGAATAGTCTTC (14);
для гена GAPDH праймеры GCTTGTCATCAATGGAAATC и CACGATACCAAAGTTGTCATG;
для гена BCL2 праймеры GCCTGCAGCTTTGTTTCATGGTACATC и TGTGGAACTGTACGGCCCCAGCATGCG.
АО для повышения включения в Ph+ клетки вводят либо после обработки с липосомами, катионными липидами, наночастицами, либо просто в среде А. Перед применением растворы АО в среде В стерилизуют фильтрованием через фильтры фирмы Corning диаметром 4 мм с порами 0,2 μк.
Суспензионные культуры получают из легкой фракции клеток костного мозга (КМ) и периферической крови (ПК) больных в хронической фазе ХМЛ до лечения (плотность 1,077 г/мл). KM отбирают из заднего гребешка подвздошной кости, у тех же больных отбирают венозную ПК. Клетки выделяют центрифугированием в течение 30 мин при 1500 об/мин, наслаивая КМ и ПК на Лимфопреп для выделения лимфоцитов (Flow lab.) с плотностью 1,077 г/мл. При этом получают фракцию клеток, обогащенную предшественниками и мононуклеарами, содержащую бласты, лимфоциты, моноциты и Ph+ гранулоциты, которые при ХМЛ остаются в основном незрелыми с низкой плотностью и не отделяются от мононуклеаров. Морфологию и состав клеток анализируют в мазках окрашиванием с красителем Гимзой [15]. Выделенные клетки трижды промывают буфером PBS, затем ресуспендируют в среде А. После выделения клетки инкубируют в среде А в 25 см2 пластиковом матрасе (Flow) в течение 2-4 суток. Затем неадгезированные клетки отмывают от сыворотки средой В и инкубируют с 0,03-15 мкМ АО при 37°С с 5% СО2 в воздухе в течение 0,5-2 часов в среде В, после чего добавляют ФСТ до 10-20% и инкубируют еще 4-7 суток. В отбираемых пробах анализируют число живых и погибших клеток по окрашиванию с трипановым синим после двухчасового выдерживания пробы в среде В или с пропидием иодидом флоуцитометрически. Также анализируют содержание фракции клеток, содержащих CD95 и р53 белок, тип фрагментации ДНК гель-электрофорезом и транскрипцию генов BCR/ABL, BCL2, р53, β-актина и GAPDH методом ОТ-ПЦР.
В качестве примера для индукции апоптоза приводятся следующие антисенс олигонуклеотиды, защищенные и не защищенные от клеточных нуклеаз:

После инкубации Ph+ клеток KM и ПК с АО содержание Ph+ клеток уменьшается на 40-90%. Клетки выдерживают 1-2 часа при 37°С после разбавления среды А средой В несколько раз, отделяют от погибших на сортере, суспендируют в среде А, 20% ФТС или в сыворотке крови IV группы человека и, добавив диметилсульфоксид до 10%, замораживают в жидком азоте.
Способность клеток к гемопоэзу анализируют, определяя их способность в полужидких средах к колониеобразованию, и по соотношению Ph+ и Ph-колоний, судят о степени элиминирования Ph+ клеток из КМ и ПК. Свойства полученных при обработке фракций клеток позволяют судить об их применимости для разработки и исследования олигонуклеотидной генотерапии, аутологичной трансплантации при Ph+ лейкозах и изучения механизма гемопоэза и механизмов прогрессии Ph+ лейкозов.
Примеры
Клетки КМ донора выделяли центрифугированием в течение 30 мин при 1500 об/мин, наслаивая на Лимфопреп для выделения лимфоцитов (Flow lab.) с плотностью 1,077 г/мл. Выделенные клетки легкой плотности трижды промывали буфером PBS, затем ресуспендировали в среде Б. После выделения клетки инкубировали в матрасах 3 суток (8×106/мл), затем отмывали и суспендировали в среде Б, переносили в 96-ти луночные платы (1,4×106/мл). АО добавляли к клеткам в среду без сыворотки, затем через 2 часа вносили ФСТ до 20% и продолжали инкубацию. К - контроль без АО, SN26-3,3 мкМ, 1.4.2 - 15 мкМ, 2.4.2 - 15 мкМ, 2.4.1 - 15 мкМ, ES2 - 12,2 мкМ, ES1 - 12,2 мкМ. На фиг.1 представлена динамика гибели клеток под действием АО, не отличающаяся от контрольной инкубации без АО.
1. Больная Ц-ва -№3, b3a2 мРНК BCR/ABL, ХМЛ. Клетки КМ после выделения и инкубации в матрасах (как описано выше) переносили в 96-ти луночные платы (1,1×106/мл). АО добавляли в среду без сыворотки, затем через 2 часа вносили ФСТ до 20% и продолжали инкубацию. К - контроль без АО; 2.4.1 -b2b3, as, 15 мкМ; trans1 (el, as), 13 мкМ; 1.4.1 -b3a2, as, 15 мкМ; SN26 -b2a2, as - 10 мкМ, 1.4.2 -b3a2, as, 15 мкМ; 2.4.2 -b2b3, as, 5 мкМ. Динамика гибели клеток под действием специфичных АО в 2-3 раза больше, чем в контроле без АО (фиг.2) и в 4-6 раз выше, чем КМ донора М (фиг.1).
2. Больная И-т, №34, b2a2 мРНК BCR/ABL, ХМЛ. Клетки ПК выделяли центрифугированием в течение 30 мин при 1500 об/мин, наслаивая на Лимфопреп для выделения лимфоцитов (Flow lab.) с плотностью 1,077 г/мл. Выделенные клетки легкой плотности трижды промывали буфером PBS, затем ресуспендировали в среде А и переносили в 24-ти луночные платы (0,8×106/мл). Через 2 суток добавляли АО. К - контроль без АО, MDM2, as, тио - 8,6 мкМ, SN26, as, тио - 6,6 мкМ, BCL2, as, тио - 8,6 мкМ, TNT, as, тио - 10,6 мкМ. Динамика гибели клеток представлена на фиг.3.
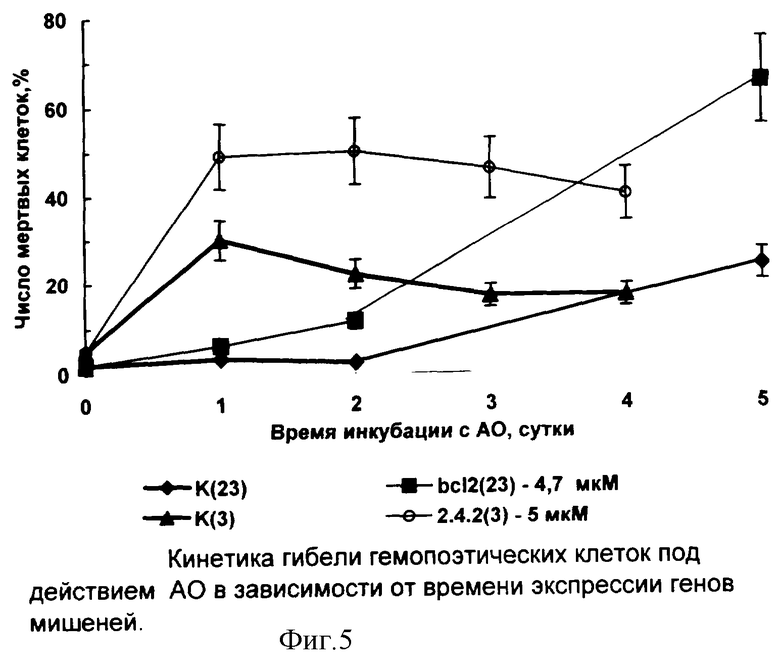
3. Больной К-в - №23, b3a2 мРНК BCR/ABL, ХМЛ. Клетки ПК после выделения и инкубации в матрасах (как описано выше) переносили в 96-и луночные платы (1,4×106/мл) в среде Б и добавляли АО BCL2, через 2 часа вносили ФСТ до 20% и продолжали инкубацию. Динамика гибели клеток представлена на фиг.4: К - контроль без АО; BCL2 - 4,7 мкМ. Динамика гибели клеток представлена на фиг.4.
4. Больная С-на - №40, е1а2 мРНК BCR/ABL, ОЛЛ. Клетки КМ после выделения на Лимфопрепе помещали в 24-ти луночные платы в концентрации 1,0×106/мл среды В, вносили АО Trans1, BCL2 и SN26, вce тио, в концентрации 15, 11 и 5 мкМ. Через 2 часа добавляли ФСТ до 10% и инкубировали при 37°С в атмосфере с 5% СO2. Через 7 суток гибель клеток достигает 80%. В интервале между 6 и 7 сутками инкубации в контроле без АО или в присутствии неактивных АО наблюдается активация деления клеток и увеличение фракции клеток в S фазе. Примененные АО это явление тормозят и при дальнейшей инкубации с новой порцией 5 мкМ АО Trans1, BCL2 и SN26 устраняют.
Гибель наблюдается в Рh+ клетках, экспрессирующих одновременно мРНК мишень для АО и мРНК для р53, сразу после обработки АО (пример 1) или после лаг-периода в 3-4 суток (примеры 3 и 4). Кинетические кривые гибели клеток в зависимости от времени экспрессии гена мишени для АО (фиг.5) демонстрируют результаты одновременной и последовательной обработки двумя АО. В отсутствие экспрессии р53 индукция гибели клеток не наблюдается (примерно у 30% больных).
После инкубации клетки суспендируют в свежей среде А, добавляют до 10% по объему диметилсульфоксид, замораживают в жидком азоте. Они могут использоваться в исследовании в качестве материала, обедненного опухолевыми клетками.
Во время инкубации и после клетки используют для анализа изменения морфологического состава и экспрессии генов GAPDH, BCR/ABL, BCL2, BCR и MDM2, c-MYC, BAX, р21, р53 и др., для исследования выживаемости клеток и их способности к колониеобразованию (как свидетельству способности к восстановлению кроветворения). Наблюдаемые закономерности развития процессов в суспензионных культурах КМ и ПК больных имеют предсказательное значение для оценки развития лейкоза у отдельного пациента.
Литература
1. Carella A.M, Frassoni. F., Melo J. et al. New insights in biology and current therapeutic options for patients with chronic myelogenous leukemia. //Haematologica, 1997, 82, p.478-495.
2. Era Т., Witte O.N. Regulated expression of P210 Bcr-Abl during embryonic stem cell differentiation stimulates multipotential progenitor expansion and myeloid cell fate. //Proc. Natl. Acad. Sci. USA, 2000, 97, p.1737-1742.
3. Melo J.V. The diversity of the ABL-BCR fusion proteins and their relationship to leukemia phenotype. // Blood, 1996, 88, p.2375-2384.
4. Melo J.V. The molecular biology of chronic myeloid leukemia. //Leukemia, 1996, 10, p.751-756.
5. Skorski Т., Neiborowska-Skorski M., Nicolaides N.C. et al. Supression of Philadelphia leukemia cell growth in mice by BCR/ABL antisense oligodeoxynucleotide. //Proc. Natl. Acad. Sci., 1994, 91, p.4504-4508.
6. Skorski Т., Neiborowska-Skorski M., Wlodarski P. et al. Antisense oligodeoxynucleotide combination therapy of primary chronic myelogenous leukemia blast crisis in SCID mice. //Blood, 1996, 88, р. 1005-1012.
7. de Fabritiis P., Amadori S., Petti M.C. et al. In vitro purging with BCR/ABL antisense oligodeoxynucleotides does not prevent haematologic reconstitution after autologous bone marrow transplantation. //Leukemia, 1995, 9, p.662-664.
8. de Fabritiis P., Petti M.C., Montefusco E. et al. BCR/ABL antisense oligodeoxynucleotides in vitro purging and autologous bone marrow transplantation for patients with chronic myelogenous leukemia in advanced phase.// Blood, 1998, 91, р.3156-3162.
9. Mauro M.J., Druker B.J. STI571: targeting BCR/ABL as therapy for CML. The Oncologist, 2001, 6, p.233-238.
10. Salttler M., Griffin J.D. Mechanisms of transformation by the BCR/ABL oncogene.// Int J. Hematol., 2001, 73, p.278-291.
11. Schindler Т., Bornmann W., Pellicena P. et al. Structural mechanism for STI-571 inhibition of abelson tyrosine kinase. // Science, 2000, 289, p.1938-1942.
12. Gorre M.E., Mohammed M., Ellwood К. et al. Clinical resistance to STI-571 cancer therapy by BCR/ABL gene mutation or amplification. // Science, 2001, 293, p.876-880.
13. E. Wickstrom, ed. Clinical trails of genetic therapy with antisense DNA and DNA vectors.//Press Marcel Decker Inc. N.Y. Basel, 1998.
14. С. Lichtenstein, W. Nellen, eds. Antisense technology, a practical approach // JRL press, 1997, Oxford, New-York, Tokio.
15. Sun Т., Li C., Yam L.T., eds. Atlas of cytochemistry.// Immunochemistry of hematological neoplasms, 1985, Chicago.
16. T. Horikoshi, K. Danenberg et.al. in: Methods in molecular biology, v.l5, PCR protocols.// Humana Press, 1993, Totowa, New Jersey, p.177-182.
17. Caltag Laboratory: Detection of intracellular antigens by flow cytometry; M. Jonuleit, C. Peschel et al.// British J. Hematol, 1998,100, p.295-303.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественного определения мутации G250E киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ | 2016 |
|
RU2620076C1 |
| СРЕДСТВО И СПОСОБ ИНДУКЦИИ АПОПТОЗА ОПУХОЛЕВЫХ КЛЕТОК | 2012 |
|
RU2488408C1 |
| Способ оценки влияния нитрозаминов на апоптоз у детей, проживающих в неблагоприятных условиях среды обитания | 2016 |
|
RU2626516C1 |
| Применение композиции наночастиц оксида меди и N-ацетилцистеина для индукции гибели клеток хронического миелоидного лейкоза | 2019 |
|
RU2721771C1 |
| Способ количественного определения мутаций F317L и F359V/C киназного домена BCR-ABL у больных хроническим миелоидным лейкозом, резистентных к терапии ингибиторами тирозинкиназ | 2019 |
|
RU2698461C1 |
| СПОСОБ ИНДУКЦИИ АПОПТОЗА КЛЕТОК ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ КОЛОРЕКТАЛЬНОГО РАКА И СРЕДСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2013 |
|
RU2551238C9 |
| АНТИТЕЛО, СЕЛЕКТИВНОЕ В ОТНОШЕНИИ РЕЦЕПТОРА ЛИГАНДА, ИНДУЦИРУЮЩЕГО АПОПТОЗ И СВЯЗАННОГО С ФАКТОРОМ НЕКРОЗА ОПУХОЛИ, И ЕГО ПРИМЕНЕНИЕ | 2002 |
|
RU2313537C2 |
| АНТИ-IL1RAP АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ЛЮДЕЙ | 2012 |
|
RU2597831C2 |
| СПОСОБ ОПТИМИЗАЦИИ ЛЕЧЕНИЯ ЛЕЙКОЗА, ПОЛОЖИТЕЛЬНОГО ПО ФИЛАДЕЛЬФИЙСКОЙ ХРОМОСОМЕ, ИНГИБИТОРАМИ Ab1-ТИРОЗИНКИНАЗЫ | 2007 |
|
RU2483732C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО МИЕЛОЛЕЙКОЗА | 2012 |
|
RU2481583C1 |



Изобретение относится к области молекулярной биологии, а именно к разработке методов специфичной биотерапии Ph+ лейкозов. Сущность способа заключается в обработке суспензионных культур Ph+ клеток антисмысловыми олигонуклеотидами, длиною 16-26 нуклеотидных звеньев, специфичными к мРНК онкогена BCR/ABL в сочетании с антисмысловыми олигонуклеотидами к мРНК других генов, блокирующих апоптоз Ph+ клеток, отличных от онкогена BCR/ABL. Техническим результатом является разработка экспериментальной основы для олигонуклеотидной генотерапии Ph+ лейкозов. 5 ил.

| US 5583034, 10.12.1996 | |||
| СИНТЕТИЧЕСКИЙ МУТАНТНЫЙ ГЕН RB (ВАРИАНТЫ), СИНТЕТИЧЕСКИЙ МУТАНТНЫЙ ГЕН P53, ПЛАЗМИДА (ВАРИАНТЫ), МУТАНТНЫЙ БЕЛОК (ВАРИАНТЫ), СПОСОБ ИНГИБИРОВАНИЯ КЛЕТОЧНОЙ ПРОЛИФЕРАЦИИ (ВАРИАНТЫ), СПОСОБ ИНДУЦИРОВАНИЯ АПОПТОЗА | 1995 |
|
RU2192431C2 |
| РОБИНСОН М.В | |||
| и др | |||
| Апотоз клеток иммунной системы | |||
| Успехи современной биологии, 1991, 111, №2, с.246-259. | |||
Авторы
Даты
2004-11-20—Публикация
2002-11-12—Подача