Область техники, к которой относится изобретение
Изобретение относится к области медицины, в частности к онкологии. Раскрытые в изобретении эмбриональный противоопухолевый модулятор, а также способ его получения могут быть использованы в медицинской промышленности для получения высокоэффективного средства для лечения предопухолевых состояний и профилактики злокачественных новообразований.
Уровень техники
По сравнению с патогенными стимуляторами антимикробного, вирусного и паразитарного происхождения иммуногенность опухолеассоцированных антигенов довольно слаба. Это основное препятствие для формирования онкотоксических Т-клеток, для чего необходима связь опухолевых антигенов с главным комплексом гистосовместимости I-II класса. С целью решения этого вопроса для лечения отдельных видов злокачественных новообразований и профилактики рецидивов получен ряд вакцин.
Известны вакцины против меланомы, которые представляют собой аллогенные опухолевые клетки и их лизаты, аутогенные опухолевые клетки, различные антигены (MAGE-1, MAGE-3, MART-1, gr 100 и др.). Эти вакцины повышают активность цитотоксических лимфоцитов по отношению к малигнизированным клеткам, активизируют пролиферацию Т-лимфоцитов, инфильтрацию опухоли CD8+.
Известны также вакцины, которые применяются при лечении рака молочной, предстательной желез, почек и толстой кишки. Причем используют вакцины различной степени очищенности с применением термического воздействия, облучения и т.д. Получение вакцин основано на приемах генной инженерии, рекомбинации ДНК, введении в опухолевые клетки гена интерлейкина-2, фактора некроза опухоли и т.д. Они используются, главным образом, с целью противорецидивной иммунотерапии и не являются профилактическим средством в смысле повышения противоопухолевой устойчивости людей. Очевидно, что они не представляют собой универсальное профилактическое средство и их применяют против одной конкретной нозологической формы рака. Указанные вакцины содержат опухолевые клетки, хотя и нейтрализованные.
В работе Tsang K.Y. (et.al., 1995) раскрывается способ, в котором описана иммуногенность опухолевого эмбрионального антигена (ОЭА) для людей. Он содержит ОЭА-ген рекомбинантного вируса и вызывает у людей особую Т-клеточную реакцию. Эта вакцина может использоваться только при лечении таких опухолей человека, которые вызывает этот антиген.
Временная фармакопейная статья (ВФС 013-52-98), утвержденная Агентством по лекарствам и медицинским технологиям Минздрава Республики Армения 29.05.1998 г., раскрывает эмбриональный противоопухолевый модулятор (ЭПОМ), который является первым в ряду полученных автором данного изобретения. Данный модулятор имеет целый ряд преимуществ. Однако временная фармакопейная статья не предполагает и не раскрывает эти преимущества. Предлагаемое изобретение представляет собой результат продолжительных и строго контролируемых исследований, приведших к неожиданному открытию источника антимутагенных, иммуномодулирующих свойств, антивирусных и других активностей, объясняющих не только выраженный превентивный противоопухолевый эффект, но и санирующее воздействие при ряде других патологических состояний.
Сущность изобретения
Таким образом, задачей настоящего изобретения является улучшение эффективности лечения ряда предопухолевых состояний и профилактики злокачественных новообразований. Эта задача решается путем повышения естественной противоопухолевой резистентности организма индивидуума.
Одним из аспектов указанной задачи является повышение специфической противоопухолевой устойчивости в группах высокого онкологического риска. В рамках этого аспекта предлагается вакцинопрофилактика эмбриональным противоопухолевым модулятором, который 1 раз в год вводят подкожно в эффективном количестве, предпочтительно в дозе от 0,02 до 0,04 мг/кг веса, наиболее предпочтительно в дозе 0,03 мг/кг.
По сравнению с известными способами и лекарственными средствами, предлагаемый способ и препарат предназначены для больных с предопухолевой патологией и лиц старше 35-40 лет, у которых повышен риск заболеть раком.
Особенностью предлагаемого способа является заполнение опросника (теста) и определение уровня предрасположенности к опухолевой патологии. Другая особенность состоит в том, что к группе высокого онкологического риска относят, в том числе, длительно курящих индивидуумов, лиц, имеющих семейную предрасположенность к раковым заболеваниям, а также тех пациентов, у которых количество фибриногена в крови в 1,5-2 раза превышает нормальный уровень.
Гиперфибриногенемия также считается фактором риска в связи с тем, что, как было установлено исследованиями автора данной заявки, при ее наличии раковые клетки покрываются "фибриновым щитом", имитируют банальный общепатологический процесс и тем самым ускользают из-под иммунного надзора.
Достичь решения поставленной задачи позволяет использование в предлагаемом способе нового эмбрионального противоопухолевого модулятора, который содержит широкий пул нормальных фетальных протеогликанов (см. далее в разделе “Качественный и количественный состав целевого продукта (ЭПОМ)”).
Предлагаемый в данном изобретении новый эмбриональный противоопухолевый модулятор Мкртчяна обладает превентивным противоопухолевым действием, антимутагенным и антикластогенным эффектом, интерфероногенным и иммуномодулирующим действием, а также антивирусной активностью.
Не претендуя на исчерпывающее и окончательное научное обоснование положительного влияния на организм предлагаемого модулятора, считается (на основании существующего знания в данной области), что в механизме реализации противоопухолевого действия ЭПОМа ключевую роль играет специфическая сенсибилизация эффекторных клеток иммунитета по отношению к онкофетальным антигенам, в силу чего усиливается киллинг малигнизированных клеток.
Основанием для такого вывода являются полученные автором данные реакции подавления прилипания лейкоцитов (РППЛ), реакции пассивной гемаглютинации (РПГА), реакции связывания комплемента (РСК) и реакции гиперчувствительности замедленного типа (РГЗТ). Направленная стимуляция противоопухолевой защиты сопровождается повышением выработки γ -интерферона, IL-6 (в селезенке семикратно по отношению к контролю) и пролактина - уровень последнего в центральном органе иммуногенеза - тимусе, в 6 раз превышал исходный фон. Ниже (в таблицах 1-3) приводятся некоторые из названных выше наблюдений.
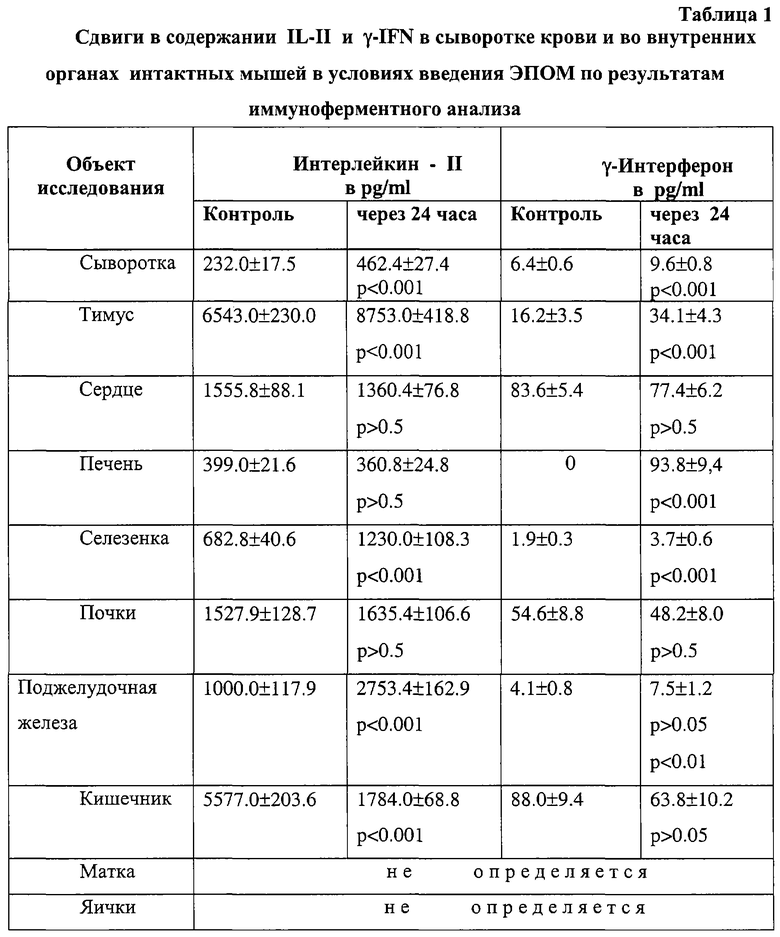
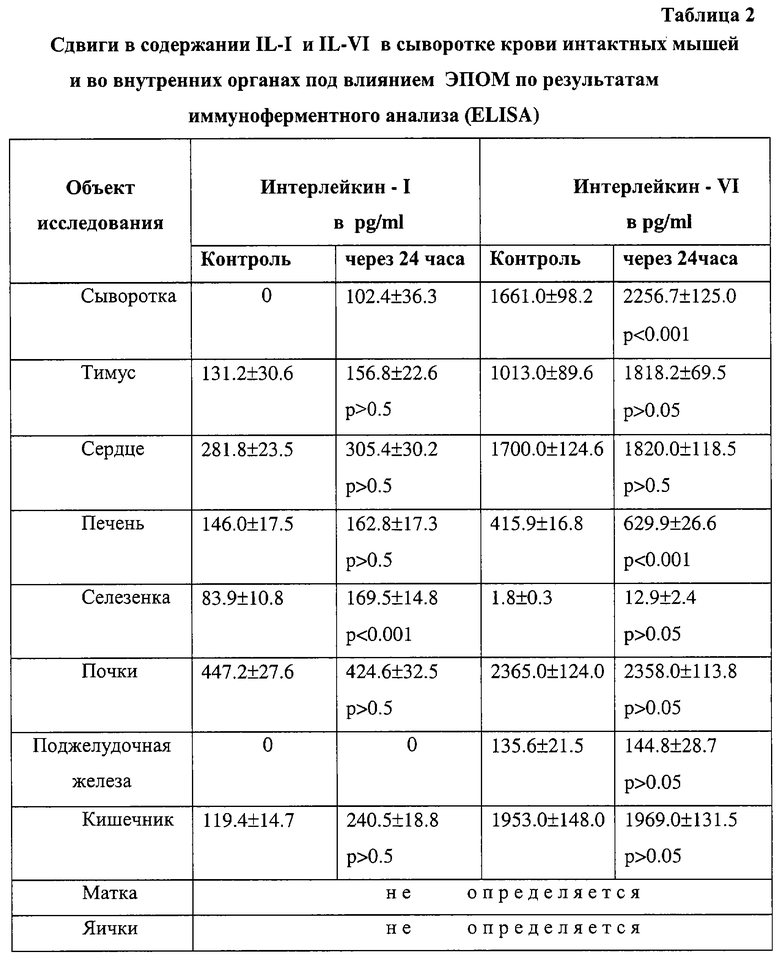
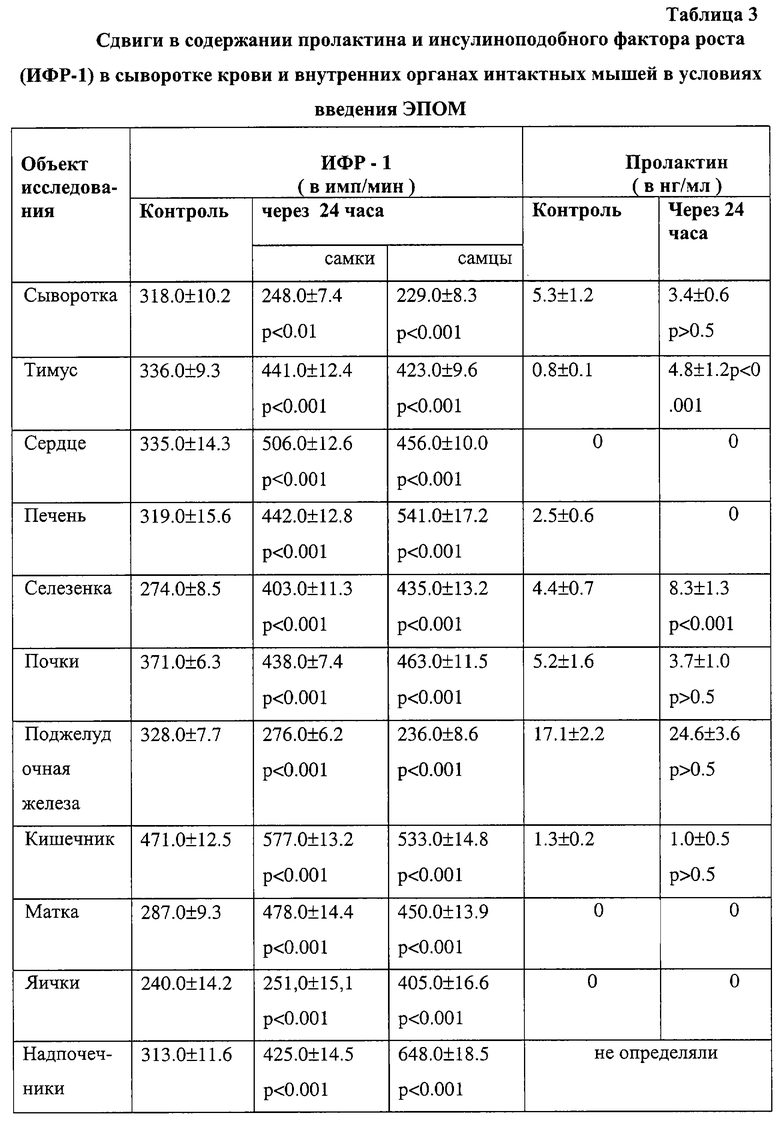
Позитивный иммуномодулирующий эффект выявлен также у вакцинированных ЭПОМ лиц, страдающих предопухолевой патологией, длительно курящих и имеющих семейную предрасположенность к раку.
По ряду параметров - предупредительное действие в отношении возникновения гистогенетически разных форм опухолей, использование малых доз в виде подкожных инъекций в область внутренней поверхности предплечья с определением степени выраженности местной реакции, а также проведение "прививок" в год раз - эмбриональный противоопухолевый модулятор уподобляется поливалентной противораковой вакцине. В ходе наблюдения над пациентами оказалось также, что ЭПОМ обладает общеукрепляющим и омолаживающим воздействием на организм.
Следующим аспектом изобретения является разработка способа получения эмбрионального противоопухолевого модулятора, обеспечивающего получение целевого продукта, обладающего свойствами и качествами, раскрытыми выше.
Особенностями способа согласно данному изобретению являются: экстракция эмбриональных протеогликанов в состоянии, максимально близком к нативному, получение широкого пула онкофетальных антигенов из нормальных эмбриональных тканей различного генеза, лиофилизация (см. далее в разд. “Способ получения ЭПОМ”).
Дополнительным аспектом изобретения является применение эмбрионального противоопухолевого модулятора согласно данному изобретению для производства препарата (в частности, противораковой вакцины) для лечения предопухолевых состояний и профилактики рака.
Далее изобретение поясняется неисчерпывающими примерами вариантов выполнения и чертежами, которые предназначены только для демонстрации осуществимости изобретения, но не для ограничения.
Краткое описание фигур
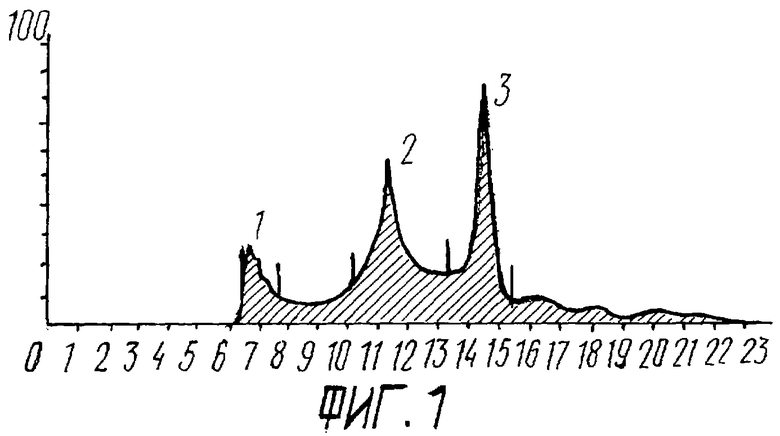
На фиг.1 представлены результаты гельфильтрационной компьютерной хроматографии, выполненной на приборе ПЭВ-2 (Фармация).
На фиг.2 представлены результаты жидкостной хроматографии под давлением (HPLC SP8000 PEV-2) (USA).
Подробное раскрытие изобретения
Способ получения ЭПОМа
Эмбриональные субстанции тщательно промываются в течение 4-5 часов в проточной воде и помещаются на 1,5 часа в 70° спирт (конечная концентрация). Затем ткань разрезается на кусочки, замораживается с помощью жидкого азота и гомогенизируется в специально приготовленном гомогенизаторе с большой ударной силой до порошкообразного состояния. Гомогенат разбавляется дистиллированной водой в соотношении 1:4, взбалтывается и суспензия на 20 минут помещается в шаровую мельницу, чаши и шары которой приготовлены из метаболитически инертных материалов. Предварительно последние охлаждаются до температуры 0° С. Число оборотов доводится до 400 в минуту. Контролем качества дезинтеграции эмбриональной ткани служит цитологическое исследование по выявлению рексированных клеточных ядер (более 80%), мельчайших цитоплазматических обрывов и фрагментов волокнистых структур. В плоской стеклянной посуде гомогенат подвергается ультрафиолетовому облучению в течение 25 минут, после чего центрифугируется в рефрижераторной центрифуге PC-6 в течение 15 минут при 6000 об/мин.
В прозрачный супернатант добавляется 96° винный спирт в количестве, достаточном для доведения концентрации спирта в растворе до 84° , что обеспечивает выпадение в осадок гликопротеидов. Последние отделяются центрифугированием при 16-20 тыс. об/мин (g - 58400) в течение 20 минут в зональной роторной ультрацентрифуге типа UP-65. Осадок растворяется из объемного соотношения 1:2 в дистиллированной воде, обрабатывается в шаровой мельнице в течение 10 минут и вновь центрифугируется при 20 тыс. об/мин (ускорение - 58400) в течение 15 минут в центрифуге UP-65. В надосадочной жидкости определяется белок (42-57%), устанавливается вязкость (в разных сериях 13-18) и после проведения через стерилизирующие мембранные фильтры (миллипоры - 0,8) супернатант подвергается лиофилизации.
Пристеночная заморозка производится в специальной стерильной вращающейся камере при температуре 25-30° С. Закалка проводится в течение 24 часов в низкотемпературном шкафу. Постепенное поднятие температуры в течение 28-30 часов с -40 до +37° С осуществляет полную сублимацию.
Качественный и количественный состав целевого продукта (ЭПОМ)
Препарат содержит пул белков - гликопротеидов, извлеченных методом спиртового осаждения. Согласно результатам аналитического электрофореза в 10% полиакриламидном геле по Девису препарат содержит 5 фракций белка. В лиофилизированных сериях препарата концентрация общего белка (при определении по Лоури с последующим спектрофотометрическим анализом) колеблется в разных сериях, приблизительно от 42 до 57 мас.%. Помимо белков в состав ЭПОМ входят около 1,5% свободных и около 8 - 10% связанных углеводов. Из ферментов присутствует аланинаминотрансфераза (АЛТ) - приблизительно 1,4 ед/л, аспартатаминотрансфераза (ACT) - приблизительно 71,9 ммоль/л, лактатдегидрогеназа (ЛДГ) - приблизительно 3,0 ед/л, щелочная фосфатаза (ЩФ) - приблизительно 24,7 ед/л, содержатся также микроэлементы: Mg - приблизительно 1,7 ммоль/л, К - приблизительно 0,96 ммоль/л, Са - приблизительно 0,65 ммоль/л, Р - приблизительно 0,52 ммоль/л, (по данным биохимического анализатора Хитачи - 911, Япония).
Иммуноферментный анализ на основе моноклональных антител выявил следующие раковые эмбриональные антигены (5 мг лиофилизированного ЭПОМ растворяли в 2 мл дистиллированной воды):
РЭА - около 1,4-1,7 нг/мл
АФП - около 95,0-99,0 нг/мл
ХГ - около 2,2-5,5 мМЕ/мл
ТВГ - около 45,0-50,0 нг/мл
Са-125 - около 13,5-14,3 Е/мл
Са-19,9 - около 79,8-102,2 Е/мл
Сокращения:
ХГ - хорионический гонадотропин
РЭА - раково-эмбриональный антиген
АФП - альфа-фетопротеин
ТВГ - трофобластический β 1-гликопротеин
Са-125 - карбогидратный антиген
Са-19,9 - карбогидратный антиген
Эмбриональные антигены (ЭАГ) в составе препарата родственны многочисленным опухолевым антигенам и дают с ними перекрестные иммунные реакции. Помимо ЭАГ, наличие которых обуславливает подлинность ЭПОМ, в каждой серии препарата имеются и другие белки, с которыми связаны ее интерфероногенные, антивирусные и антимутагенные свойства. Для выявления этих белков были применены следующие биохимические методы: гельфильтрационная компьютерная хроматография, электрофорез в полиакриламидном геле, высокочувствительная жидкостная хроматография под давлением.
Гельфильтрационная компьютерная хроматография - проводилась на аппарате фирмы “Фармация” (Франция), на колонках 5000 Р 7,5 мм × 30 см РВ, 005,5%. Получены три пика: наиболее значительный третий пик с мол. массой 150 КД и второй - с мол. массой 40 КД.
Электрофорез в полиакриламидном геле - обнаружено наличие в сериях препаратов 5 фракций белков с мол. массой 72, 67, 58, 50 и 40 кД. Фракция белков с мол. массой 72 кД имела электрофоретическую активность, характерную для альбумина и АФП, которые сходны по молекулярным массам и биологическим свойствам (АФП - эмбриональный альбумин).
Жидкостная хроматография под давлением. Структурный анализ пептидов, содержащихся в препарате, проведен на хроматографе Р-8000 фирмы Спектро-Физико (США). Длина волны 214 нм. Наиболее значительный и четкий пик 3-й с временем задержки 2679 м. Остальные пики менее четкие.
Электронный парамагнитный резонанс (ЭПР). Учитывая важную биологическую роль свободных радикалов, образцы различных серий препарата были подвергнуты исследованию методом ЭПР на аппарате фирмы “Вариан” с чувствительностью 1011-1012 спин. Записи спектра эталона (марганцевый эталон) и 7 изучаемых образцов препарата показали, что концентрация парамагнитных частиц во всех образцах ниже чувствительности прибора, что свидетельствует об отсутствии в ЭПОМе свободных радикалов.
Количественное определение белка. Активность определяется наличием в препарате белков. Определение пула белка осуществляли по методу Лоури с последующим определением интенсивности окрашивания на спектрофотометре (СФ-26 ЛОМО) при длине волны 750 нм.
Наличие РЭА выявляли с помощью иммуноферментного и радиоиммунного методов. ИФА проводили с помощью имеющихся тест-наборов фирмы Роше. Содержание трофобластического β 1-гликопротеина (ТБГ) определялось радиоиммунным методом отечественным набором.
Биологическая активность. Учитывая выраженную противоопухолевую активность препарата в эксперименте на перевиваемых опухолях (асцитная опухоль Эрлиха мышей, саркома 37 мышей, асцитная гепатома Зайделя, лимфосаркома Плисса и карциносаркома Уокера крыс) и при химическом канцерогенезе у крыс, индуцированном 7,12 - ДМБА и бензпиреном, за единицу активности препарата принимается такое его количество (однократная доза), которая обеспечивает 50% торможение роста опухоли. В качестве тест-системы используется лимфосаркома Плисса у крыс. В опытах использовались белые крысы самцы линии Vistar, прошедшие карантин не менее 10 дней, средний вес животных 145 г. Препарат вводили парэнтерально за неделю до введения суспензии опухолевых клеток.
Дополнительная характеристика целевого продукта
ЭПОМ представляет собой пористую, мягкую массу желтовато-белого цвета без запаха и вкуса.
При введении во флакон 2 мл изотонического 0,9% раствора NaCl ресуспензируется в течение около 15 минут без образования неразбивающихся хлопьев и комочков.
Инъекционный раствор представляет собой, предпочтительно, 0,02% непрозрачную гомогенную жидкость с желтоватым оттенком. Время полной деформации - около 15 минут.
Цветность раствора не превышает эталон цветности N 50 (ГФ XI, вып.1, стр.194).
рН раствора: 6,5-8,5 (определен потенциометрически РФ XI, 1, стр.113).
Остаточная влага. Определение проводили из 0,1 грамма препарата при 100° С, в течение 1 часа (ГФ XI, 1). Содержание влаги не более 9%.
Растворимость. Препарат трудно растворим в воде и 0,9% изотоническом растворе NaCl; практически не растворяется в 95% спирте и эфире (ГФ XI, 1).
Подлинность. 0,003 г сухого порошка растворяют в 10 мл воды (раствор А).
К 5 мл раствора А прибавляют 3-4 капли концентрированной азотной кислоты: сразу выпадает хлопьевидный осадок (белок).
К 5 мл раствора А прибавляют 0,1 мл 0,1% раствора нингидрина и нагревают до кипения. Появляется сине-фиолетовое окрашивание (аминокислотная часть).
Испытание на стерильность. Выдерживает требования, указанные в ГФ XI, вып.2, стр.187.
Механические включения. Определение механических включений проводят в соответствии с “Инструкцией по контролю на механические включения инъекционных растворов” (И 42-3-85), утвержденной МЗ СССР 10.10.85.
Испытания на токсичность. Препарат вводили животным в двух дозах, превышающих терапевтическую для человека в 200 раз (15 мг/кг) и 10 раз (0,7 мг/кг).
Методика иммуноферментного определения РЭА в различных сериях препарата
Принцип реакции: основой иммуноферментного анализа (ИФА) является иммунная реакция испытуемых проб с моноклональными мышиными AT к определяемому АГ и с моноклональными AT к этим AT, ковалентно связанными с пероксидазой хрена. В одноступенчатом твердофазном ИФА, искомый в пробах РЭА может реагировать со специфическими моноклональными AT, и одновременно с конъюгированными анти-РЭА AT, образуя сэндвич-комплекс. После окончания иммунной реакции и отмывания следует инкубация с раствором рабочего субстрата - тетраметилбензидином. Результаты развивающейся окраски определяют количество связанного анти-РЭА пероксидазного конъюгата. По интенсивности окраски, вызываемой энзиматической реакцией, устанавливается концентрация искомого АГ в испытуемых пробах.
Методика реакции. Для выявления различных РЭА лиофилизированные серии препарата растворяют в физиологическом растворе из расчета 1 мг/мл, хорошо размешивают и выдерживают, как и другие компоненты ИФА, в течение 1 часа при комнатной температуре.
Бусы с моноклональными AT помещают в дубликатные пробирки, куда прибавляют испытуемые пробы в объеме 50 мкл, стандарты определяемого РЭА, контроль - РЭА сыворотки человека, исключая одну пустую пробирку без бусинки - пустой реагент. Затем во все пробирки, кроме пустой, вносят по 250 мкл конъюгата против РЭА AT и инкубируют в термостате при 37° С, постоянно встряхивая в течение 15 минут. По окончании иммунной реакции буфер в пробирках промывают.
После окончания иммунной реакции готовят раствор рабочего субстрата по прилагаемой к набору инструкции. Рабочий раствор в объеме 250 мкл добавляют во все пробирки. После 15 минут инкубации при 37° С, при постоянном встряхивании и защите от яркого света, реакцию прекращают добавлением 1 мл 5% раствора серной кислоты и смешиванием без разбрызгивания. В пределах 1 часа после остановки энзиматической реакции измеряют адсорбцию испытуемых проб, стандартов РЭА и контроля сыворотки против пустой пробы, на спектрофотометре при 450 нм.
Уровень искомого РЭА определяют по стандартной кривой, построенной по величинам абсорбции, полученным для каждого из стандартов РЭА, с определенной концентрацией РЭА в МЕ/мл.
Неизвестные концентрации РЭА в испытуемых пробах определяют по стандартной кривой, используя величину средней абсорбции между контролем и каждой пробой.
Для выражения результатов реакции в нг/мл, полученные в ME, умножаются на 1,25.
Количественное определение белка. Около 0,1 г порошка препарата (точная навеска) помещают в мерную колбу вместимостью 200 мл и доводят объем изотоническим 0,9% раствором хлорида натрия до метки. Одновременно в колбы переносят по 1 мл полученного раствора и рабочего стандартного раствора (примечание 1), и воды (контрольный раствор), затем прибавляют по 1 мл 1,2% раствора едкого натра. Все смеси оставляют на 30 минут. Затем в эти три колбы прибавляют по 4 мл раствора В (примечание 3), перемешивают и оставляют на 10 минут, после чего добавляют 0,4 мл реактива Фолина (примечание 4), перемешивают и через 30 минут на спектрофотометре в кюветах толщиной слоя 1 см измеряют оптическую плотность испытуемого и стандартного растворов по отношению к контрольному раствору при длине волны 750 нм.
Содержание белка в % (X), вычисляют по формуле

где Cn - концентрация белка в рабочем стандартном растворе альбумина; Cl - концентрация испытуемого раствора; D1 - показатель оптической плотности испытуемого раствора; Dn - показатель оптической плотности стандартного раствора альбумина; b - остаточная влага.
Содержание белка в препарате в пересчете на сухое вещество предпочтительно составляет 42-57%.
Примечание:
1. Приготовление рабочего стандартного раствора альбумина
0,05 г бычьего альбумина, отвечающего требованиям (Aibumin bovine ciryst. Rcascarch grade. “SERVA”) растворяют в изотоническом 0,9% растворе NaCl в мерной колбе вместительностью 100 мл и доводят до метки тем же изотоническим раствором. 1 мл стандартного раствора содержит 0,0005 г альбумина.
2. Приготовление раствора А
К 2,5 мл 2,5% раствора виннокислого калия и натрия прибавляют 2,5 мл 2% раствора CuSО4×5H2О и 0,12 мл 1,2% раствора едкого натра (раствор А).
3. Приготовление раствора В
К 20 мл 2% раствора карбоната натрия прибавляют 0,4 мл раствора А (раствор В). Раствор В готовят непосредственно перед использованием.
4. Приготовление реактива Фолина
В круглодонную колбу на 300-500 мл помещают 20 г двуводного вольфрамовокислого натрия и растворяют в 140 мл дистиллированной воды. К раствору добавляют 10 мл 85% фосфорной кислоты и 20 мл концентрированной соляной кислоты. К колбе присоединяют обратный холодильник и смесь кипятят в течение 10 часов. Затем в колбу добавляют 30 г сернокислого лития (Li2SO4×Н2О), 10 мл дистиллированной воды и несколько капель брома. Смесь кипятят 15 минут для удаления избытка брома без холодильника под тягой. Раствор охлаждают, объем реактива доводят до 200 мл. Реактив может храниться длительное время. Перед употреблением нужное для работы количество реактива Фолина разбавляют дистиллированной водой в два раза.
Согласно требованиям, предъявляемым к новым лекарственным средствам, были изучены возможная острая и хроническая токсичность ЭПОМ на различных видах экспериментальных животных: мышах, крысах, кроликах, морских свинках и собаках.
Исследование на возможную острую токсичность ЭПОМ
Исследования проведены на 38 белых беспородных мышах, 35 сингенных мышах линии СВА, а также 38 белых беспородных и 35 крысах линии Вистар. Использованы гематологические и биохимические методы, проведены морфологические исследования внутренних органов, изучено состояние сердечно-сосудистой, нервной, выделительной систем, деятельности желудочно-кишечного тракта.
Животные были распределены по 5-7 в каждой группе. ЭПОМ вводился п/к и внутрибрюшинно. Исходная масса тела у белых мышей колебалась в пределах 19,0-24,4 г, крыс линии Вистар в среднем – 140 г.
Для определения ЛД50 мышам были введены максимально возможные дозы: для п/к введения - 2,5 мг белка в 0,5 мл раствора и для в/б введения - 2,5 мг белка в 0,5 мл раствора. Введение указанных максимальных доз не вызывало гибели животных в течение 2-недельного срока наблюдения.
Для выявления ЛД50 ЭПОМ у крыс также были использованы максимально возможные дозы: п/к - 5,0 мг ЭПОМ в 1,0 мл раствора и в/б - 5,0 мг ЭПОМ в 1,0 мл раствора. В течение всего срока наблюдения ни разу не отмечалась гибель крыс ни в опытной, ни в контрольной группах. Ежедневное наблюдение не выявило изменений в поведении животных по сравнению с контролем. Судорог и нарушений координации движений не наблюдалось, тонус скелетных мышц был в норме. Реакции на болевые, звуковые, тактильные и световые раздражители не отличались от таковых у контрольных животных. Волосяной покров тела оставался без изменений, диспептические явления отсутствовали, потребление корма и воды было нормальным. Масса тела подопытных животных определялась 2 раза в течение срока наблюдения. В конце опыта установлено увеличение массы тела как опытных, так и контрольных мышей в пределах от 2 до 5 г и у крыс - от 20 до 23 г. Общий и биохимический анализ крови в опытной и контрольной группах не выявил отклонений.
Исследование на возможную хроническую токсичность ЭПОМ
Исследование проводили на 180 беспородных крысах, разделенных на 2 группы. В опытной группе были по 80 самцов и самок, в контрольной - по 10 самцов и самок. Вес животных составил 120-140 г. Животным вводили ЭПОМ в течение трех дней, пути введения - п/к и в/б. Наблюдение над животными велись в течение 2 месяцев. Были использованы 3 дозы - 2,5; 5,0 и 10,0 мг на кг веса, которые вводились трехкратно. Суммарные дозы соответственно 7,5; 15; 30 мг/кг веса.
Ежедневные наблюдения за состоянием и поведением животных показало, что все животные переносят введение ЭПОМ хорошо, не отмечалось никаких изменений в их поведении по сравнению с контролем плацебо. Ни одна из использованных доз ЭПОМ не вызывала у крыс изменений волосяного покрова, нарушений со стороны ЖКТ и выделительной системы.
В соответствующей таблице приводится количество эритроцитов × 1012 и лейкоцитов × 108, а также морфологический состав крови - базофилы, эозинофилы, нейтрофилы, лимфоциты, моноциты - после введения, на 24-й день и в начале опыта. Заключение: гематологические показатели у крыс опытной и контрольной групп в означенные выше сроки наблюдений были сходны.
Сахар крови в контроле в конце срока наблюдения был 81 мг/%, а в опытной группе 82,3 мг/%, остаточный азот соответственно - 24,2 и 25,1 мг/%, общий белок - 6,3 и 6,1 мг/% соответственно.
Внутренние органы, а также головной мозг беспородных крыс, получивших трехкратно ЭПОМ п/к в суммарной дозе 30,0 мг, был подвергнут гистологическому исследованию с применением как обычных методов гистологического исследования, так и некоторых гистохимических методов. В кардиомиоцитах, гепатоцитах и эпителии проксимального отдела нефрона - слабо выраженная белковая дистрофия, а также умеренно выраженное застойное полнокровие легких, печени и почек.
Аналогичные данные выявлены при изучении возможной хронической токсичности у кроликов. У всех животных проводились электрокардиографические исследования: ZCC - 150-160 в минуту, PQ - 0,07 сек, QRS - 0,04 сек, QT - 0,14 сек. Зубцы Pi част.(-), РII,III(+) - 0,03-0,04; Pi<PII<PIII, r2 0,07 -0,25; R3>R2, R3 0,08 - 0,35, ТII - высокий, сегмент ST - на изолинии.
Дыхательный коэффициент - 0,83, частота дыхания в состоянии покоя 0,97 Гц (75 в минуту).
Проведено тщательное изучение возможной хронической токсичности эмбрионального противоопухолевого модулятора на собаках.
Эксперименты были проведены на 24 беспородных половозрелых собаках (12 самцов и 12 самок) с начальной массой тела 15,2-18,1 кг согласно "Правилам доклинической оценки безвредности фармакологических средств", Москва, 1998.
После трехнедельного карантина и акклиматизации собаки получили ЭПОМ в 1 терапевтической для человека дозе (0,03 мг/кг), 10-кратной терапевтической дозе и 25-кратной дозе (0,75 мг/кг).
Изучены следующие параметры: динамика массы тела, число сердечных сокращений в минуту, частота дыхания, ЭКГ, ректальная температура, картина периферической крови, биохимические показатели сыворотки крови (глюкоза, общий белок, креатин, мочевина, холестерин, активность ЩФ, ЛДГ, АЛТ, ACT), биохимические показатели мочи (белок, глюкоза, биллирубин, мочевина, электролиты). Исследования проводились 2 раза - до начала введения ЭПОМ (на 8-е и 15-е сутки после помещения собак в виварий), 3 раза в течение эксперимента (на 7-е, 15-е и 29-е сутки).
Данный раздел "Изучение фармакологической активности и безвредности ЭПОМ" занимает 114 страниц отчета и снабжен 43 таблицами. С тем, чтобы не загромождать текстуальную часть патента цифровыми данными, отметим лишь общий вывод - отсутствие токсичности ЭПОМ в эксперименте на собаках.
Исследование возможной кластогенности, мутагенности и гонадотоксичности ЭПОМ
Согласно требованиям Национального института по изучению рака США соединения, которые могут применяться для химиопрофилактики рака, не должны обладать токсичностью и мутагенностью и вместе с этим оказывать антимутагенный эффект (Boone C.W., Kellofl G.J. Development of surrogate endpoint biomarkers for clinical trials of cancer chemopreventive agents. - J.Cell Biochem., 1994, Suppl. 19, 10-22).
ЭПОМ был тестирован на 20 крысах и 80 мышах на наличие кластогенных свойств согласно требованиям ВОЗ. Даже высокие дозы ЭПОМ при многократном введении не индуцировали цитогенетический эффект в клетках костного мозга грызунов.
Изучение антимутагенной (антикластогенной) активности ЭПОМ проводилось на крысах, которым ЭПОМ вводился за 15 и 5 суток (общая доза 5 мг белка) до воздействия бенз(а)пирена (40 мг/кг) или 7,12 - диметилбенз(а)антрацена (10 мг/кг). Изучение клеток костного мозга крыс через 24 часа показало достоверное уменьшение количества мегакариоцитов с хромосомными аберрациями (в 1,5 раза в обоих случаях; р<0.001) по сравнению с контролем (только воздействие канцерогенов).
Определение длительности антимутагенного эффекта, вызываемого ЭПОМ, было проведено на мышах. ЭПОМ вводился животным по описанной выше схеме (общая доза 1 мг белка). В качестве мутагена использовали циклофосфан (30 мг/кг, внутрибрюшинно), который вводили мышам на 6, 7, 8, 11, 13, 16, 21 и 36 сутки после второго введения ЭПОМ. Показано, что ЭПОМ достоверно снижает кластогенный эффект, выявляемый по наличию микроядер в эритроцитах костного мозга с 6 по 11 сутки (на 29-50%).
Таким образом, ЭПОМ при отсутствии кластогенных свойств обладает выраженной антимутагенной активностью.
При изучении возможной гонадотоксичности ЭПОМ, методом доминантных летальных мутаций (ДЛМ), использовано 20 самцов нелинейных крыс массой 130-150 г. ЭПОМ вводился в дозе, соответствующей 200 человеческим дозам. К каждому самцу подсаживали по 3 самки. Метод ДЛМ основан на изучении эмбриональной смертности в потомстве самцов, подвергшихся действию какого-либо агента. Метод отражает чувствительность: I неделя - зрелых сперматозоидов; II неделя - поздних сперматид; III - неделя средних и ранних сперматид. Всего использовано в экспериментах 180 самок (140-160 г) - 90 в опыте и 90 в контроле. Оплодотворенных самок вскрывали на 19-20 день беременности и подсчитывали количество живых и мертвых эмбрионов, число желтых тел в яичниках, смертность до и после имплантации. Статистическую обработку полученных результатов проводили по методу Стьюдента - Фишера и критерию Х-квадрат.
На основании полученных данных следует прийти к выводу, что ЭПОМ в дозе 15 мг/кг (200 человеческих доз) не влияет на мужские половые клетки, т.е. не обладает гонадотоксичностью и не индуцирует ДЛС у крыс.
Испытания на аллергические свойства и пирогенность
Возможная аллергенность ЭПОМ изучалась на морских свинках весом 250-330 г. Их иммунизировали в/б 2,5 мг ЭПОМ в объеме 1 мл физраствора. В качестве контроля вводилась сыворотка крупного рогатого скота. Спустя 21 день животным вводили также в/б разрешающую дозу ЭПОМ, равную сенсибилизирующей (5,0 мг). Сыворотка крупного рогатого скота - 5.4 мг. Самцов было 10, самок - 8.
Введение разрешающей дозы ЭПОМ не вызвало гибели животных и симптомов анафилактического шока. Признаки слабой аллергизации выявлены лишь у 20% морских свинок. Они выражались в кратковременном почесывании мордочки, взъерошенности шерсти и единичных чиханиях.
Полученные данные позволяют оценить аллергизирующую реакцию на введение ЭПОМ как слабо положительную (“+”). В контрольной группе, получавшей сыворотку крупного рогатого скота, все животные погибли от анафилактического шока.
Для определения пирогенной реакции ЭПОМ были использованы кролики весом 1,5-2,0 кг. В течение 3-х суток до опыта проводились измерения температуры с помощью медицинского термометра.
Накануне опыта вечером у животных отобрали остатки корма и воды. Использованные шприцы и иглы, а также лекарственное вещество и растворитель (физраствор) были стерильны. ЭПОМ в количестве 5 мг растворяли в 2 мл стерильного не пирогенного физраствора. За 30 минут до введения раствора измеряли температуру тела животных. Раствор подогревали до 37° С и вводили в ушную вену кроликам в течение 2 минут. После введения раствора ЭПОМ, трижды с промежутками в 1 час, измеряли температуру тела животных.
После введения раствора ни у одного из трех кроликов ни в одном из трех измерений не наблюдалось повышения температуры более чем на 0,2° С. Следовательно, раствор ЭПОМ не обладает пирогенными свойствами.
Некоторые клинические наблюдения
При традиционной форме фетальной (клеточной) терапии больным вводят взятые из эмбриональных тканей животных или человека специально обработанные живые клетки. На определенной стадии эмбриогенеза эти клетки не иммуногенны, поскольку еще не "перешли" барьер видовой специфичности. Но несмотря на это клеточная эмбриональная терапия не может считаться абсолютно безвредной формой лечения различных заболеваний. В этом отношении заслуживают внимания изолированные гуморальные компоненты клеточной терапии и, прежде всего, протеогликаны как носители эмбриональных свойств. При такой постановке вопроса особую актуальность приобретает получение белкового экстракта в состоянии, максимально близком к нативному, и, естественно, использование таких приемов, которые полностью исключают контаминирование вирусных и иных патогенных агентов.
Более 5 лет мы наблюдаем пациентов из групп высокого онкологического риска, получавших эмбриональный противоопухолевый модулятор с целью предотвращения возможной неопластической патологии.
На месте подкожной инъекции (внутренняя поверхность предплечья вдали от контуров сосудов) в течение первых 2-х суток возникают гиперемия и инфильтрация, которые через 48 часов бесследно проходят. Размеры указанной местной реакции - в среднем 4,5× 6 см. Лишь в единичных случаях имело место повышение температуры тела в пределах субфебрильной (у 2 из 100 пациентов). Отсутствие местной реакции настораживает нас в плане предрасположенности к онкопатологии, а именно толерантности иммунной системы данного индивидуума к онкофетальным антигенам - онкомаркерам.
Почти все пациенты после иммунизации отмечают улучшение самочувствия, некоторый общеукрепляющий и омолаживающий эффект. Более того, имеется небольшое число наблюдений адъювантного терапевтического влияния ЭПОМ на течение сахарного диабета, гипертонической болезни и высокого коагуляционного потенциала крови при ишемической болезни сердца.
ЭПОМ зарекомендовал себя и как средство противорецидивной иммунотерапии, особенно в тех случаях, когда онкобольные после радикальной операции по тем или иным причинам отказываются от дальнейшего химиолучевого лечения. Это обстоятельство имеет чрезвычайно важное значение, поскольку в отличие от химиопрепаратов, ЭПОМ не вызывает иммуносупрессии, а наоборот, повышает как специфическую, так и неспецифическую противоопухолевую защиту.
В разных сериях индуцированного (7,12 - ДМБА и бенз/а/пирена) канцерогенеза и в опытах на моделях перевиваемых опухолей различного гистогенеза ЭПОМ полностью предотвращал возникновение злокачественных опухолей в 40-70%.
В группах лиц с высоким риском онкологического заболевания вакцинотерапия ЭПОМом не влияла на уровень СД4+ клеток, но проявила тенденцию к увеличению как относительных, так и абсолютных показателей СД4/СД8 клеток.
Динамика иммунологических показателей в группе онкологического риска, вакцинированной ЭПОМ, показана в таблице 4.

Отмечены достоверное повышение после вакцинации количества Т-клеток и тенденция к увеличению ЕКК. Вакцинация существенно не влияла на относительный и абсолютный показатели В-клеток. Онкофетальные антигены обладают иммуносупрессивным воздействием. Данные таблицы свидетельствуют о том, что полученный нами пул эмбриональных протеогликанов не оказал супрессивного воздействия на субпопуляции лимфоцитов.
Данные применения ЭПОМ и способа профилактики в условиях клиники
Способ осуществляется следующим образом. Формируют группу риска, при этом учитывают возраст индивидуума, профессию, предопухолевое заболевание, курение, семейную предрасположенность, гиперфибриногенемию, количество онкомаркеров в периферической крови; рассчитывают уровень опухолевого риска.
С учетом названных показателей проводят вакцинацию индивидуума ЭПОМом из расчета от 0,02 до 0,04 мг/кг веса, наиболее предпочтительно 0,03 мг/кг веса.
В процессе 17-летнего экспериментального изучения противоопухолевой активности и безвредности ЭПОМа на моделях индуцированного 7,12 - ДМБА и бенз(а)пиреном канцерогенеза, а также на гистогенетически различных перевиваемых опухолях (асцитная опухоль Эрлиха, саркома - 37, саркома - 180, асцитная гепатома Зайделя, карциносаркома Уокера, лимфосаркома Плисса), было продемонстрировано, что ЭПОМ в 40-70% случаев полностью предотвращает возникновение злокачественных новообразований.
У вакцинированных ЭПОМом лиц с высоким онкологическим риском в процессе многолетних наблюдений не выявлена онкологическая патология. Модулятор проявил лечебные свойства при предопухолевых состояниях женских гениталий и успешно использован в гинекологии. Он также показан для противорецидивной иммунотерапии. У наблюдаемых больных биологически активная доза не влияла на популяции Т-хелперов и Т-супрессоров. Даже в случае десятикратного превышения дозы наблюдался рост количества Т-супрессоров на фоне неизмененного количества Т-хелперов.
Пример 1
Пациент М., 55 лет. Долго курил, питание неправильное, по характеру работы - административный работник, гиподинамичен, имеет аденому предстательной железы (количество простатического антигена в крови - 7,8 нг/мл, фибриноген А - 540 мг/%, В - положит).
Подсчитан уровень онкологического риска, который соответствовал степени умеренного риска (23 единицы). Затем произведена вакцинация модулятором. Доза - 0,03 мг/кг. Кожная реакция положительная (3× 2 см, легкая инфильтрация, на 3-й день местная реакция прошла). Вакцинацию ЭПОМом проводили ежегодно в течение 5 лет. Образ жизни не изменился, гуморальные показатели иммунитета и онкомаркеры нормализовались, новообразований не обнаружено.
Пример 2
Пациент К., 44 года, медсестра, курила, питание неправильное, мать скончалась от рака яичников, анализ крови в норме. Выявлено предопухолевое состояние шейки матки: дисплазия эпителия I-II степени, лейкоплакия вульвы.
Подсчитан уровень онкологического риска, который соответствовал степени умеренного риска (21 единица), затем проводили ежегодные вакцинации модулятором (5 лет). Образ жизни не изменился. Объективно: эпителий шейки матки в нормальном состоянии, после проведенного лечения рецидивы не наблюдались; в иммунной системе выявлены положительные сдвиги. Новообразований не обнаружено.

Группа изобретений относится к области медицины, в частности к онкологии. Раскрытые в изобретении эмбриональный противоопухолевый модулятор Мкртчяна, а также способ его получения могут быть использованы в медицинской промышленности и медицинских исследованиях для промышленного получения высокоэффективного средства для лечения предопухолевых состояний и профилактики злокачественных новообразований. Для лечения предопухолевых состояний и предотвращения возникновения злокачественных новообразований больные с признаками предопухолевых состояний и лица с риском возникновения рака подвергаются вакцинации эмбриональным противоопухолевым модулятором (ЭПОМ), который содержит широкий спектр онкофетальных антигенов. Вакцинация модулятором производится подкожно, 1 раз в год в дозе от 0,02 до 0,04 мг/кг, предпочтительно, в дозе по 0,03 мг/кг веса тела. Технический результат: повышение стабильности модулятора и повышение при его применении противоопухолевой резистентности у лиц, относящихся к группам высокого онкологического риска. 3 н. и 1 з.п. ф-лы, 4 табл., 2 ил.
| Касса для продажи билетов пассажирам городского транспорта (троллейбуса, автобуса, трамвая) | 1959 |
|
SU135298A1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕЧЕБНОГО СРЕДСТВА, РЕГУЛИРУЮЩЕГО ДИФФЕРЕНЦИАЦИЮ КЛЕТКИ | 1997 |
|
RU2128513C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 1995 |
|
RU2105567C1 |
| МЕДИКАМЕНТОЗНАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ БОЛЬНЫХ СО ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ | 1996 |
|
RU2112547C1 |
| Аппарат для цинкования железных листов | 1924 |
|
SU1402A1 |
| WO 9525745 А1, 28.09.1995 | |||
| US 4882421 А, 21.11.1989 | |||
| ВЕРТОЛЕТНЫЙ ГАЗОТУРБИННЫЙ ДВИГАТЕЛЬ С УРОВНЕМ ШУМА, ПОНИЖАЕМЫМ С ПОМОЩЬЮ ШУМОГЛУШИТЕЛЬНОГО ОБОРУДОВАНИЯ ДЛЯ ЭЖЕКТОРА | 2007 |
|
RU2451193C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕЯ | 0 |
|
SU200090A1 |
Авторы
Даты
2004-11-27—Публикация
2002-01-30—Подача