Изобретение относится к фармацевтическим композициям, включающим стабильный нерастворимый в воде комплекс, состоящий из аморфного терапевтически активного соединения (например, лекарства), диспергированного в ионном полимере. Комплексы по настоящему изобретению позволяют существенно увеличить биологическую доступность слаборастворимых терапевтически активных соединений.
Биологическая доступность терапевтически активного соединения, как правило, зависит от (I) растворимости/скорости растворения соединения и от (II) коэффициента распределения/способности соединения проникать через желудочно-кишечную мембрану индивидуума. Основной причиной низкой биологической доступности терапевтически активных соединений является низкая растворимость/скорость растворения соединения. Низкая биологическая доступность часто также сопровождается нежелательно большими величинами вариабельности пациентов и непредсказуемыми соотношениями доза/терапевтические воздействия вследствие неравномерного поглощения терапевтически активного соединения (например, лекарства) организмом пациента.
Для улучшения биологической доступности слаборастворимых терапевтически активных соединений применяют различные методы. Эти методы обобщены ниже.
1. Уменьшение размера частиц. Слаборастворимые терапевтически активные вещества часто измельчают механически для уменьшения размера частиц соединения, увеличивая тем самым площадь поверхности (см. Lachman и др., The Theory and Practice of Industrial Pharmacy, глава 2, стр. 45 (1986)). Уменьшение размера частиц до микронного уровня может быть достигнуто с использованием струйной мельницы. Как правило, средний размер частиц, получаемых с использованием струйной мельницы, находится в диапазоне 1-10 мкм. Аналогично этому при мокром измельчении терапевтически активного соединения в присутствии защитных коллоидов или полимеров, как правило, получают частицы соединения размером в диапазоне приблизительно 300-800 нм. Согласно этой методике терапевтически активное соединение и полимер диспергируют в воде и измельчают с помощью измельчающей среды, такой как мелкие шарики (0,2-0,5 мм) (см. патент США 5494683). Однако уменьшение размера частиц может улучшить только скорость растворения терапевтически активного соединения, но не общее количество соединения в растворе в равновесном состоянии.
2. Твердая дисперсия
2.1. Метод сплавления. Согласно этой методике терапевтически активное соединение диспергируют в неионном полимере с получением твердой дисперсии. Как правило, неионный полимер (например, Pluronic® и полиэтиленгликоль) расплавляют при температуре выше его температуры плавления и в расплавленном полимере растворяют при перемешивании терапевтически активное соединение (см. патент США 5281420). Затем образовавшуюся расплавленную массу охлаждают до комнатной температуры. При таком процессе терапевтически активное соединение сплавляется с полимером и при охлаждении осаждается в аморфной форме. Аморфная форма соединения, как правило, имеет большую скорость растворения, чем исходная кристаллическая форма соединения. Таким образом, получение с помощью этого способа аморфной формы соединения улучшает биологическую доступность. Однако вследствие большей водорастворимости и низкой температуры плавления неионных полимеров аморфная форма терапевтически активного соединения не может сохранять свою стабильность и в конечном итоге превращается опять в кристаллическую форму после нахождения в условиях высокой влажности и при повышенных температурах, что часто имеет место при длительном хранении (см. Yoshioka и др., J.Pharm. Sci. 83: 1700-1705 (1994)). Поэтому эта методика непригодна для большинства дозируемых форм терапевтически активных соединений и, как очевидно, непригодна для терапевтически активных соединений, имеющих слабую растворимость.
2.2. Совместное осаждение. В другом известном способе, применяемом для улучшения биологической доступности слаборастворимого терапевтически активного соединения, соединение и неионный гидрофильный полимер, такой как поливинилпирролидон, растворяют в органическом растворителе. Растворитель удаляют выпариванием, при котором терапевтически активное соединение осаждается в матрицу из гидрофильного полимера (см. H.G. Britain, Physical Characterization of Pharmaceutical Solids, Drugs and Pharmaceutical Sciences, том 70 (Marcel Dekker, Inc., N.Y., 1995)). Вследствие гигроскопических свойств и водорастворимости полимера этот тип полимера не защищает аморфную форму терапевтически активного соединения от воздействия тепла и влажности. Поэтому терапевтически активное соединение в гидрофильной полимерной матрице не остается в аморфной форме и в конечном итоге в процессе хранения превращается в кристаллическую форму. Поэтому этот подход не обладает практической ценностью для улучшения биологической доступности слаборастворимых терапевтически активных соединений.
3. Система доставки самоэмульгирующегося лекарства (СДСЭЛ)
В этой системе терапевтически активное соединение растворяют в смеси пригодного масла и эмульгатора. Полученная жидкая композиция под воздействием жидкостей желудочно-кишечного тракта образует очень тонкую эмульсию или микроэмульсию. Благодаря большой площади поверхности масляных шариков биологическая доступность слаборастворимого терапевтически активного соединения, растворенного в этом масле, значительно повышается (см. P.P Constantinides, Pharm. Res. 12(11): 1561-1572 (1995)). Основное требование при применении такой системы состоит в том, что терапевтически активное соединение должно быть растворимо в масле, а будучи растворено в масле, оно должно оставаться в стабильной форме в растворе. Вследствие этого СДСЭЛ не является пригодной альтернативой для большинства терапевтически активных соединений, поскольку эти соединения обладают ограниченной растворимостью и неудовлетворительной стабильностью в растворах на основе масла.
Неожиданно было установлено, что если слаборастворимое терапевтически активное соединение (как правило, в кристаллической форме) диспергируют в виде молекул в водонерастворимом ионном полимере, имеющем молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50°С, физическая стабильность соединения (находящегося в этом случае в аморфной форме) сохраняется в течение длительных периодов времени даже при хранении в условиях высокой влажности и повышенной температуры. Вследствие большой молекулярной массы и высокой температуры стеклования ионного полимера, а также его относительной нерастворимости в воде, ионный полимер фиксирует терапевтически активное соединение в его аморфной форме, обеспечивая тем самым очень высокую стабильность соединения, превосходящую стабильность, достигаемую применяемыми в настоящее время способами. Кроме того, вследствие повышенной растворимости соединения, находящегося в комплексе соединение/полимер, биологическая доступность терапевтически активного соединения также значительно возрастает. Следовательно, этот способ пригоден прежде всего для улучшения биологической доступности слаборастворимых терапевтически активных соединений.
В настоящем изобретении предложена фармацевтическая композиция, включающая стабильный водонерастворимый комплекс, состоящий из макромолекулы носителя, которая представляет собой водонерастворимый ионный полимер, имеющий молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50°С, и аморфного терапевтически активного соединения, причем последнее включают или диспергируют в ионном полимере в стабильной аморфной форме, получая комплекс соединение/полимер. Другим объектом настоящего изобретения является водонерастворимый комплекс соединение/полимер.
Комплекс по изобретению получают путем микроосаждения терапевтически активного соединения в ионный носитель.
Комплекс соединение/полимер по изобретению может находиться в форме твердого продукта (например, пасты, гранул, порошка), которым заполняют капсулы или который прессуют в таблетки. Порошкообразная форма комплекса также может быть подвергнута пульверизации или тонкому измельчению, достаточному для образования стабильных жидких суспензий или полутвердых дисперсий. Комплекс по изобретению перед введением in vivo в случае парентерального применения может быть подвергнут стерилизации, например, с помощью гамма-облучения или облучения электронным пучком.
В настоящем изобретении предложен стабильный водонерастворимый комплекс, состоящий из водонерастворимого ионного полимерного носителя, имеющего молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50°С, и терапевтически активного соединения в стабильной аморфной форме. В настоящем изобретении также предложены способы приготовления таких комплексов и фармацевтических композиций, включающих такие комплексы. Преимуществом комплексов по изобретению является способность существенно увеличивать биологическую доступность относительно нерастворимых терапевтически активных соединений и способность осуществлять доставку таких соединений в течение длительных периодов времени (т.е. осуществлять непрерывное высвобождение таких соединений в кровоток).
В контексте настоящего описания следующие понятия имеют указанные ниже значения.
Понятие "комплекс соединение/полимер" или "водонерастворимый комплекс" относится к физически стабильному продукту, который образуется при совместном осаждении ("микроосаждении") терапевтически активного соединения и водонерастворимого ионного полимера согласно способам, приведенным в настоящем описании.
"Диспергированный" обозначает случайное распределение терапевтически активного соединения в ионном полимере.
"Скорость растворения" обозначает скорость, с которой конкретное соединение растворяется в физиологических жидкостях in vitro.
Понятие "ионный полимер" или "ионогенный полимер-носитель" включает как анионные (несущие отрицательный заряд), так и катионные (несущие положительный заряд) полимеры.
"Микроосаждение" обозначает любой способ, посредством которого соединение, в частности терапевтически активное соединение, диспергируют в полимере на молекулярном уровне.
"Диспергированный на молекулярном уровне" обозначает, что терапевтически активное(ые) соединение(я) присутствует(ют) в полимере в виде максимально мелких элементов, еще сохраняющих свойства самого соединения (см., например, M.G.Vachon и др., J.Microencapsulation 14(3): 281-301 (1997); М.А. и Vandelli и др., J.Microencapsulation 10(1): 55-65 (1993)).
Понятие "пациент" относится к человеку.
Понятие "слаборастворимое терапевтически активное соединение" относится к терапевтически активным соединениям (например, лекарствам), имеющим растворимость в воде, меньшую приблизительно 1 мг/мл, как правило, меньшую приблизительно 100 мкг/мл.
Одним из объектов настоящего изобретения являются фармацевтические композиции, включающие стабильный водонерастворимый комплекс, состоящий из макромолекулы носителя, которая представляет собой ионный полимер, и терапевтически активного соединения, стабильного в его аморфной форме. Применение такого комплекса соединение/полимер особенно предпочтительно, когда соединение плохо растворимо иным способом, что затрудняет достижение требуемой биологической доступности при оральном введении такого соединения.
Согласно настоящему изобретению, когда слаборастворимое кристаллическое терапевтически активное соединение и водонерастворимый ионный полимер, имеющий молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50°С, подвергают микроосаждению, соединение диспергируется на молекулярном уровне в аморфной форме в ионном полимере, приводя к образованию стабильного водонерастворимого комплекса. Микроосаждение можно проводить с использованием, например, любой из следующих технологий, каждая из которых подробнее описана ниже:
а) сушка распылением или лиофилизации,
б) осаждение, регулируемое с помощью растворителя,
в) осаждение, регулируемое с помощью значения рН,
г) экструзия горячего расплава,
д) технология на основе сверхкритической жидкости.
Если терапевтически активное соединение диспергируют таким образом в ионном полимере, то оно сохраняет свою аморфную структуру даже в течение длительного периода хранения, т.е. оно является "стабильным". Кроме того, ионный полимер защищает соединение от вредных факторов окружающей среды, таких как влажность и тепло, сохраняя тем самым увеличенную растворимость и обусловленную ей повышенную биологическую доступность.
Терапевтически активное соединение, находящееся в аморфной форме в составе комплекса по изобретению, имеет значительно увеличенную биологическую доступность по сравнению с соединением в его кристаллической форме и остается высокостабильным в течение длительного периода времени. Кроме того, вследствие контролируемой скорости растворения комплекса в жидкостях желудочно-кишечного тракта комплекс позволяет достичь характеристик непрерывного высвобождения терапевтически активного соединения, диспергированного в комплексе соединение/полимер.
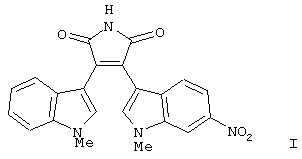
Настоящее изобретение применимо для любого терапевтически активного соединения, но оно наиболее пригодно для терапевтически активных соединений, растворимость в воде которых составляет менее приблизительно 1 мг/мл, и прежде всего для соединений, растворимость которых составляет менее 100 мкг/мл. Такие слаборастворимые терапевтически активные соединения включают, например, ретиноиды и ингибиторы протеазы. В частности, настоящее изобретение наиболее пригодно для следующих терапевтических соединений:
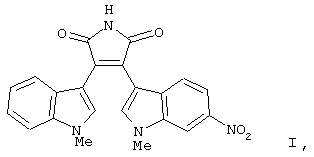
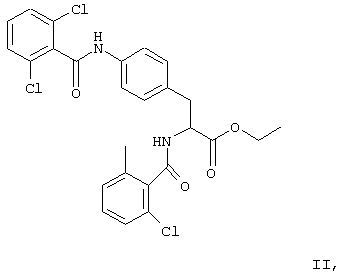

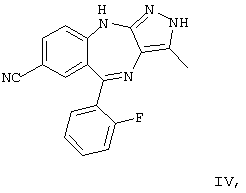
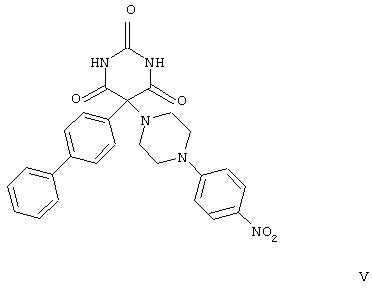
В своей кристаллической форме указанное выше соединение I имеет чрезвычайно низкие растворимость в воде (<10 мкг/мл) и биологическую доступность.
Настоящее изобретение также применимо для такого соединения, как толкапон (поставляемого в продажу фирмой Roche Laboratories Inc. под товарным знаком Tasmar®), такого соединения, как 1,3-цис-ретиноевая кислота (поставляемого в продажу фирмой Roche Laboratories Inc. под товарным знаком ACCUTANE®), такого соединения, как саквинавир (поставляемого в продажу фирмой Roche Laboratories Inc. под товарным знаком FORTOVASE™), а также следующих соединений:
Ионные полимеры, пригодные для применения согласно настоящему изобретению, представляют собой либо катионные, либо анионные полимеры, имеющие молекулярную массу больше приблизительной 80000 Да и температуру стеклования, равную или превышающую приблизительно 50°С, и относительно нерастворимые в воде, причем их растворимость предпочтительно зависит от значения рН. Примеры таких полимеров включают полиакрилаты (например, Eudragit®, фирма Rohm America), хитозан, Carbopol® (фирма BF Goodrich), фталат поливинилацетата, фталат ацетилцеллюлозы, полицианакрилаты, фталат гидроксипропилметилцеллюлозы, терефталат ацетилцеллюлозы, ацетилсукцинат гидроксипропилметилцеллюлозы, карбоксиметилцеллюлозу и гидроксипропилцеллюлозу с небольшим количеством замещений. Водонерастворимые комплексы по настоящему изобретению могут также включать смеси двух или нескольких вышеуказанных ионных полимеров (см., например, примеры 9 и 10).
Особенно предпочтительные анионные полимеры включают Eudragit® L100-55 (сополимер метакриловой кислоты и этилакрилата) и Eudragit® L100 или Eudragit® S100 (сополимеры метакриловой кислоты и метилметакрилата), причем все они производятся фирмой Rohm America. Eudragit® L100-55 растворим при значении рН выше 5,5 и практически нерастворим при значении рН ниже 5,5. Молекулярная масса Eudragit® L100-55 равна приблизительно 250000 Да, а температура стеклования равна 110°С. Eudragit® L100 растворим при значении рН выше 6 и практически нерастворим при значении рН ниже 6. Молекулярная масса Eudragit® L100 равна приблизительно 135000 Да, а температура стеклования равна приблизительно 150°С. Eudragit® S100 растворим при значении рН выше 7 и практически нерастворим при значении рН ниже 7. Молекулярная масса Eudragit® S100 равна приблизительно 135000 Да, а температура стеклования равна приблизительно 160°С.
Особенно предпочтительным катионным полимером является Eudragit® E (фирма Rohm America), который представляет собой сополимер диметиламино-этилметакрилата и нейтральных метакриловых эфиров. Этот полимер растворим при значении рН, не превышающем 4, и практически нерастворим при значении рН выше 4. Молекулярная масса Eudragit® E равна приблизительно 150000 Да, а температура стеклования равна приблизительно 50°С.
Фармацевтические композиции по настоящему изобретению, включающие водонерастворимые комплексы по изобретению, могут быть приготовлены известным в данной области способом, например, с помощью общепринятых методов смешения, измельчения, инкапсулирования, растворения, прессования, грануляции или лиофилизации. Кроме водонерастворимых комплексов эти фармацевтические композиции также могут включать терапевтически инертные неорганические или органические носители ("фармацевтически приемлемые носители"), отличные от ионного полимера, и/или эксципиенты. Фармацевтически приемлемые носители для таблеток, таблеток с покрытием, драже и желатиновых капсул с твердым покрытием включают лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли. Пригодные носители для желатиновых капсул с мягким покрытием включают растительные масла, воски, жиры и полутвердые или жидкие полиолы.
Фармацевтические композиции по изобретению также могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подсластители, красители, корригенты, соли для изменения осмотического давления, буферы, покрывные агенты или антиоксиданты. Эти композиции также могут содержать дополнительные терапевтически активные соединения или более одного комплекса терапевтически активное соединение/полимер.
Способы получения
В одном из вариантов осуществления настоящего изобретения водонерастворимые комплексы по изобретению получают с использованием одного из следующих способов.
а) Сушка распылением или диофилизация
Терапевтически активное соединение и ионный полимер растворяют в обычном растворителе, имеющем низкую температуру кипения, например, в этаноле, метаноле, ацетоне и т.д. С помощью сушки распылением или лиофилизации растворитель выпаривают, при этом терапевтически активное соединение остается микроосажденным в аморфной форме в ионной полимерной матрице. Эта методика не является предпочтительной для тех терапевтически активных соединений, которые не обладают соответствующей растворимостью (>5%) в предпочтительных растворителях.
б) Осаждение, контролируемое с помощью растворителя
Терапевтически активное соединение и ионный полимер растворяют в обычном растворителе, например в диметилацетамиде, диметилформамиде и т.д. Раствор терапевтически активное соединение/полимер добавляют к холодной (2-5°С) воде, значение рН которой доводят до соответствующей величины.
Требуемое значение рН зависит от используемого полимера и легко может быть определено специалистом в данной области. Это вызывает микроосаждение терапевтически активного соединения в полимерную матрицу. Микроосадок промывают несколько раз водной средой до тех пор, пока остаточное количество растворителя не станет меньше приемлемого для этого растворителя уровня. "Приемлемый уровень" для каждого растворителя определяют согласно руководствам Международной конференции по гармонизации (ICH).
в) Осаждение, контролируемое с помощью значения рН
В этом способе микроосаждение терапевтически активного соединения в ионный полимер контролируют резким изменением значения рН раствора. Терапевтически активное соединение и ионный полимер растворяют при высоком значении рН (например, рН ~9) и осаждают путем понижения значения рН раствора (например, до ~1) или наоборот. Этот способ особенно пригоден для терапевтически активных соединений, растворимость которых зависит от значения рН.
г) Метод экструзии горячего расплава
Микроосаждение терапевтически активного соединения в ионный полимер, обладающий характеристиками термопластичности, может быть достигнуто с помощью экструзии горячего расплава. Кристаллическое терапевтически активное соединение и ионный полимер смешивают в пригодном смесителе и непрерывно подают в экструдер с контролируемой температурой, что вызывает диспергирование на молекулярном уровне терапевтически активного соединения в расплавленном ионном полимере. Образовавшиеся экструдаты охлаждают до комнатной температуры и измельчают до тонкого порошка.
д) Технология на основе сверхкритической жидкости
Терапевтически активное соединение и ионный полимер растворяют в сверхкритической жидкости, такой как жидкий азот или жидкая двуокись углерода. Сверхкритическую жидкость затем удаляют выпариванием, при этом терапевтически активное соединение остается микроосажденным в полимерной матрице. В другом способе терапевтическое соединение и ионный полимер растворяют в пригодном растворителе. После этого микроосажденный порошок может быть получен путем впрыскивания раствора в сверхкритическую жидкость, которая действует в качестве антирастворителя.
В другом варианте осуществления изобретения фармацевтические композиции могут быть приготовлены согласно любой одной из предыдущих стадий с добавлением конечной стадии, во время которой комплексы по изобретению соединение/полимер приготавливают хорошо известными в данной области способами.
В предпочтительном варианте осуществления изобретения терапевтически активное соединение и ионный полимер растворяют в органическом растворителе. После этого соединение и ионный полимер осаждают в условиях относительной конкуренции, предпочтительно в водном растворе и предпочтительно при тех значениях рН, при которых независимо друг от друга нерастворимы ни соединение, ни полимер.
Органический растворитель, применяемый для растворения терапевтически активного соединения и ионного полимера, должен обеспечить хорошую растворимость как слабо растворимых соединений, так и используемых полимеров. Такими растворителями являются этиловый спирт, метиловый спирт, ацетон, диметилсульфоксид, диметилацетамид, диметилформамид, N-метилпирролидон, Transcutol® (моноэтиловый эфир диэтиленгликоля, фирма Gattefosse, Inc.), гликофурал, пропиленкарбонат, тетрагидрофуран, полиэтиленгликоли и пропиленгликоли.
Значение рН, выбранное для совместного осаждения терапевтически активного соединения и ионного полимера, зависит от растворимости каждого из конкретных полимеров и соединений, подлежащих осаждению. Специалист в данной области легко может определить предпочтительные значения рН для совместного осаждения каждой комбинации полимера и терапевтически активного соединения. В предпочтительном варианте осуществления, где анионный полимер выбирают из группы, включающей Eudragit® L100-55, Eudragit® L100 и Eudragit® S100, раствор осаждают при значении рН, меньшем приблизительно 4. В другом предпочтительном варианте осуществления, где применяют катионный полимер Eudragit® E100, раствор предпочтительно осаждают при значении рН, выше 4.
Количества терапевтически активного(ых) соединения (и) и полимера, необходимые для образования стабильного водонерастворимого комплекса по изобретению, могут значительно варьироваться в зависимости от конкретных используемых соединения и ионогенного(ных) полимера(ов), а также от конкретного(ных) растворителя(ей) и параметров осаждения. Например, соединение может присутствовать в комплексе в количестве приблизительно от 0,1 до приблизительно 80 мас.%. Аналогично этому полимер, как правило, присутствует в комплексе в количестве не менее приблизительно 20 мас.%. Предпочтительно соединение присутствует в комплексе в количестве приблизительно от 30 мас.% до приблизительно 70 мас.%, более предпочтительно приблизительно от 40 мас.% до приблизительно 60 мас.%. Наиболее предпочтительно соединение присутствует в комплексе в количестве приблизительно 50 мас.%. Для комплекса, содержащего соединение I, соединение присутствует в комплексе в количестве приблизительно 30-70 мас.%, наиболее предпочтительно приблизительно 50 мас.%.
Если комплекс соединение/полимер осадился в растворе, то образовавшийся комплекс можно выделять из раствора методами, известными специалистам в данной области, например фильтрацией, центрифугированием, промывкой и т.д. Затем выделенную массу можно высушить (на воздухе, в печи или под вакуумом), а полученный твердый продукт можно размалывать, пульверизовать или тонко измельчать до порошка способами, известными в данной области. Порошкообразная форма комплекса может быть затем диспергирована в носителе для приготовления фармацевтической композиции.
Фармацевтические композиции по изобретению могут быть введены пациенту любым путем, пригодным для достижения требуемого(ых) результата(ов) терапии. Предпочтительными путями введения являются парентеральное и оральное введение.
Фармацевтические композиции по изобретению включают терапевтически эффективное количество терапевтически активного соединения. Терапевтически эффективное количество обозначает количество, вводимое в таких дозах и в течение таких периодов времени, которые необходимы для достижения требуемого терапевтического результата. Кроме того, такое количество должно представлять собой количество, для которого общие полезные в терапевтическом отношении действия превалируют над токсичными или нежелательными побочными действиями. Терапевтически эффективное количество соединения часто варьируется в зависимости от состояния болезни, возраста и веса индивидуума, подлежащего лечению. Таким образом, дозировки, как правило, подбираются в соответствии с индивидуальными требованиями в каждом конкретном случае, и они известны специалистам в данной области.
Например, для вышеприведенного соединения I соответствующая суточная доза для введения взрослому человеку весом приблизительно 70 кг составляет приблизительно от 10 мг до приблизительно 10000 мг, предпочтительно приблизительно от 200 мг до приблизительно 1000 мг, хотя верхний предел может быть превышен при наличии к этому соответствующих показаний.
Суточная доза терапевтически активного соединения может быть введена в виде однократной дозы, в виде разделенных доз, или при парентеральном введении она может быть введена путем подкожной инъекции.
Ниже изобретение поясняется на примерах со ссылкой на прилагаемые чертежи, на которых показано:
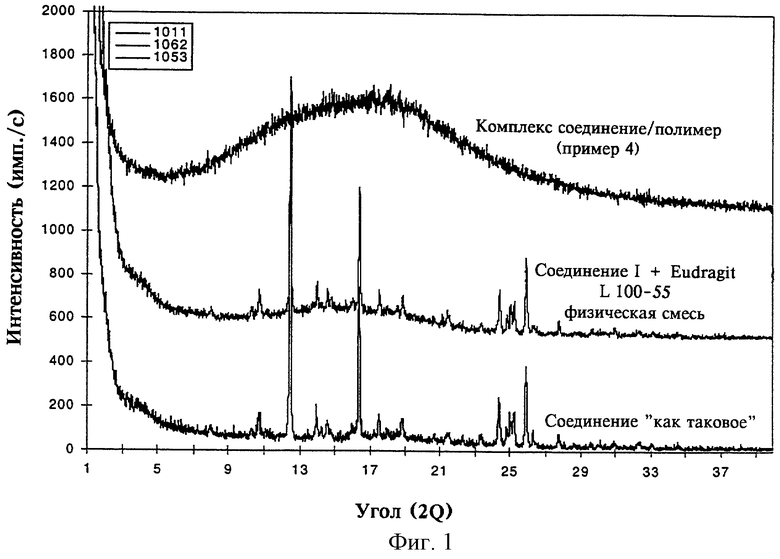
на фиг.1 - картина дифракции рентгеновских лучей на порошке, полученная для комплекса соединение/полимер из примера 4 в сравнении с таковыми, полученными для массы одного лекарства и физической смеси лекарства и полимера,
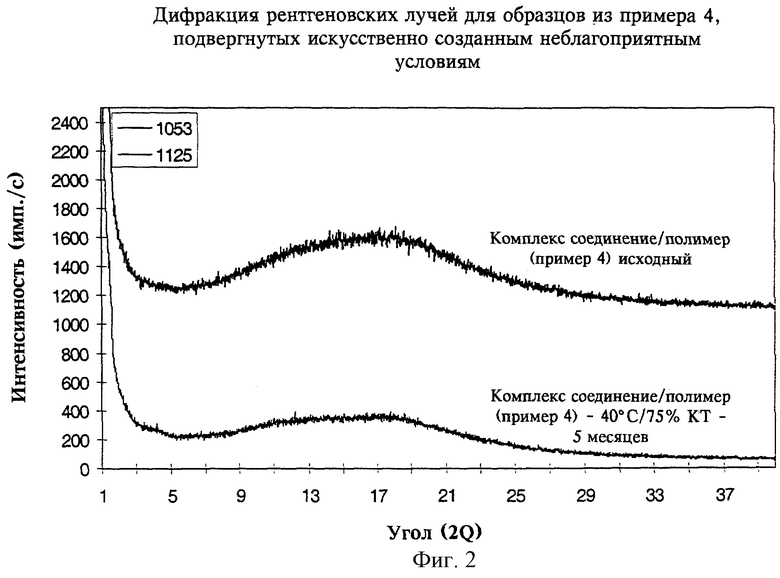
на фиг.2 - картина дифракции рентгеновских лучей на порошке, полученная для образцов комплекса соединение/полимер из примера 4, выдерживавшихся в искусственно созданных неблагоприятных условиях, в сравнении с таковой, полученной для не находившегося в таких условиях (исходного) комплекса соединение/полимер,
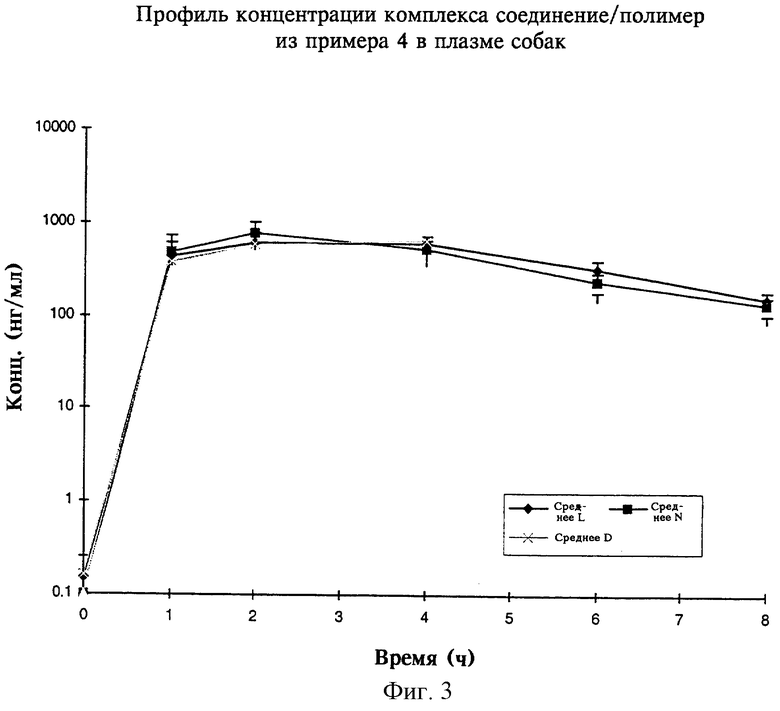
на фиг.3 - профиль концентрации комплекса соединение/полимер из примера 4 в плазме собак,
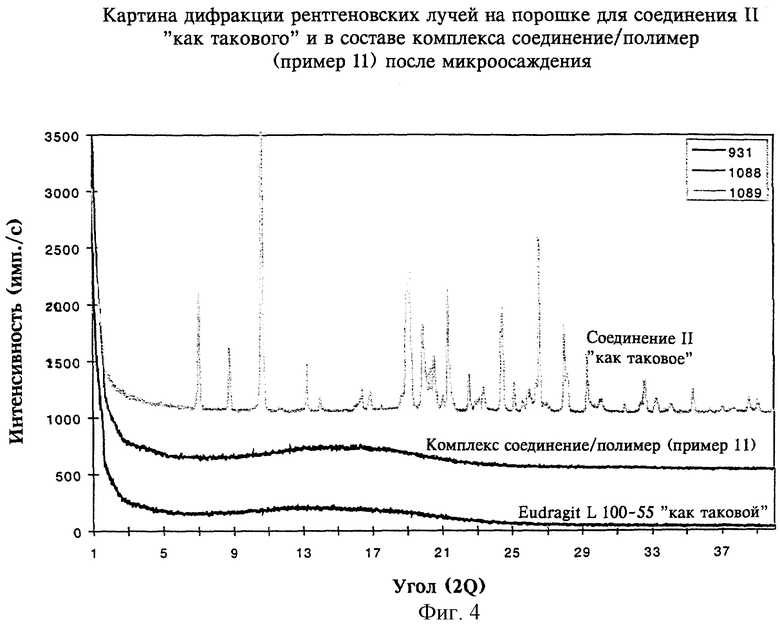
на фиг.4 - картины дифракции рентгеновских лучей на порошке, полученные для соединения II как такового и для комплекса соединение/полимер (пример 11) после микроосаждения согласно изобретению,
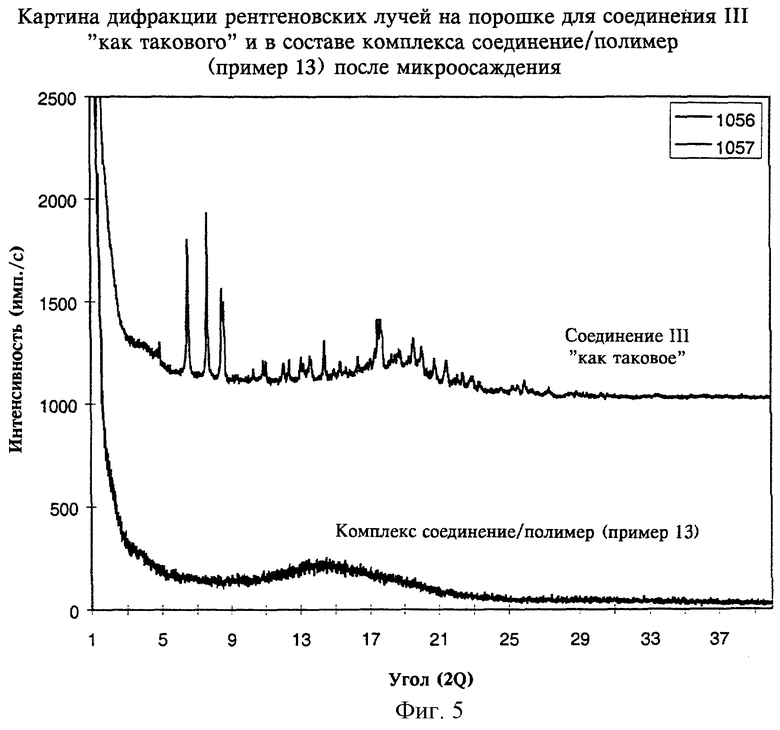
на фиг.5 - картины дифракции рентгеновских лучей на порошке, полученные для соединения III как такового и для комплекса соединение/полимер (пример 13) после микроосаждения согласно изобретению,
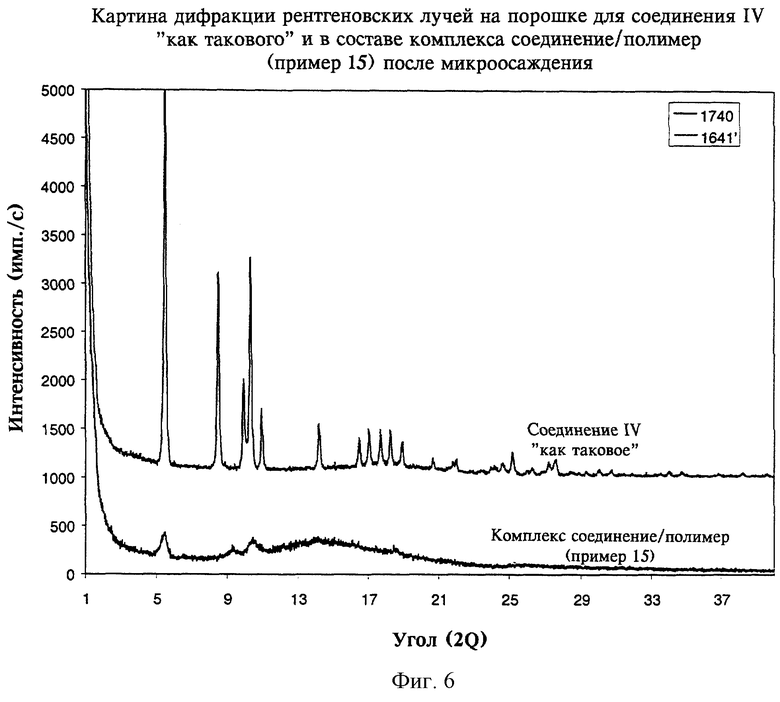
на фиг.6 - картины дифракции рентгеновских лучей на порошке, полученные для соединения IV как такового и для комплекса соединение/полимер (пример 15) после микроосаждения согласно изобретению, и
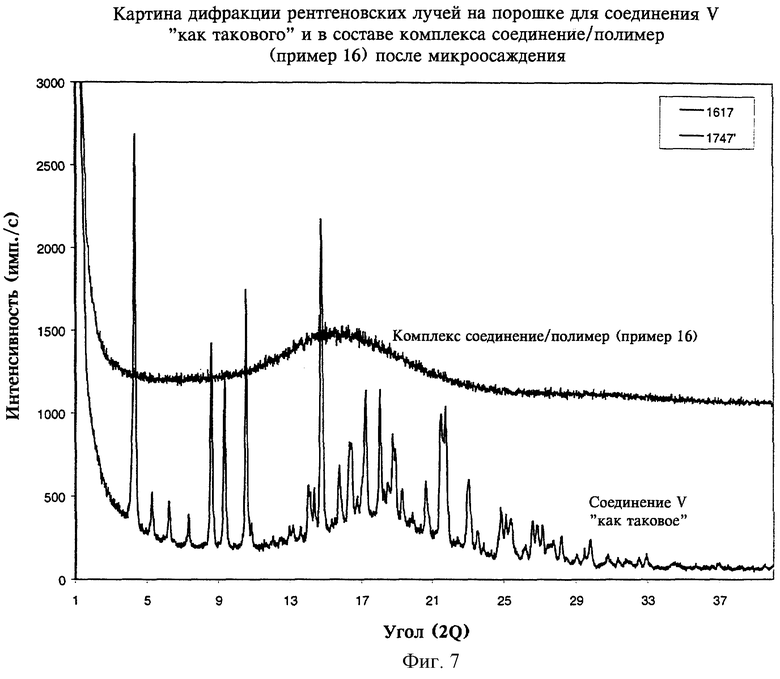
на фиг.7 - картины дифракции рентгеновских лучей на порошке, полученные для соединения V как такового и для комплекса соединение/полимер (пример 16) после микроосаждения согласно изобретению.
Примеры
Следующие примеры иллюстрируют способы приготовления водонерастворимых комплексов соединение/полимер(ы) по настоящему изобретению, а также фармацевтических композиций, содержащих указанные комплексы.
В приведенных в настоящем описании примерах тестируемыми терапевтически активными соединениями были соединения I, II, III, IV и V, структуры которых приведены выше. Эти соединения практически нерастворимы в жидкостях желудочно-кишечного тракта. До настоящего изобретения кристаллическая нерастворимая форма соединения I была единственной стабильной формой этого соединения, которую можно было получить.
Общие способы
Способ, пригодный для примера 1 (тонкоизмельченное соединение)
Соединение I тонко измельчали с использованием струйной мельницы, получая частицы со средним размером 10 мкм. Эта процедура не изменяла кристаллическую форму соединения.
Способ, пригодный для примера 2 (сверхтонкоизмельченное соединение)
10%-ную суспензию соединения I подвергали мокрому измельчению в водной среде, содержащей 5% Klucel EF® (гидроксипропилцеллюлоза, фирма Aqualon Corp.) в качестве защитного коллоида для предотвращения агрегации. Измельчение осуществляли периодически в мельнице типа Dynomill в течение 24 ч с использованием стеклянных шариков размером 0,25 мм в качестве измельчающей среды. Средний размер частиц образовавшейся суспензии составлял 700 нм, а анализ остатка, полученного после высушивания суспензии показал, что соединение присутствовало в кристаллической форме.
Способ, пригодный для примера 3 (дисперсия в Pluronic F 68)
С использованием метода горячего расплава получали 10%-ную дисперсию соединения I в Pluronic F 68 (полимер). Соединение смешивали с расплавленным Pluronic F 68 при 60°С и затем дисперсию нагревали до 180°С для растворения соединения I. Раствор охлаждали до комнатной температуры, получая твердую массу. Картина дифракции рентгеновских лучей ("ДРЛ") на порошке для расплавленной дисперсии была похожа на таковую для Pluronic F 68. Такая ДРЛ свидетельствует о том, что соединение I присутствовало в твердой дисперсии в аморфной форме. Твердую дисперсию, полученную этим способом, затем диспергировали в водной среде перед введением животным.
Способ, пригодный для примеров 4-12 и 15-16 (молекулярная дисперсия по изобретению)
Согласно способу по изобретению соединения I, II, IV или V и конкретный полимер, выбранный соответствующим образом в каждом случае (например, Eudragit® L100-55, Eudragit® L100 или Eudragit® S100), растворяли в диметилацетамиде. Затем образовавшийся раствор медленно добавляли к холодному (2-10°С) водному раствору с рН 2, что вызывало совместное осаждение соединения и полимера в виде нерастворимой матрицы, причем соединение было диспергировано в полимере на молекулярном уровне. В каждом случае осадок промывали несколько раз холодным (2-10°С) водным раствором с рН 2 до тех пор, пока остаточное количество диметилацетамида не оказывалось меньше 0,2%. Осадок сушили в течение 24 ч при 40°С в воздушной сушилке с принудительной циркуляцией до тех пор, пока уровень влажности не становился меньше 2%, и измельчали при низкой скорости в мельнице типа Fitz Mill® (фирма Fitzpatrick) с использованием передних ножей и сита размера 0 до получения частиц требуемого размера. Необходимо, чтобы средний размер 90% частиц находился в диапазоне 50-400 мкм.
Способ, пригодный для примеров 13-14 (соединение III)
Согласно описанным выше способам соединение III и конкретный полимер, выбранный соответствующим образом в каждом случае (например, Eudragit® L100-55, Eudragit® L100, фталат гидроксипропилметилцеллюлозы (HP-50) или Eudragit® S100), растворяли в этаноле. Образовавшийся раствор либо сушили в вакуумной печи при 40°С в течение 24 ч до тех пор, пока потеря веса при сушке не становилась меньше 2%, либо в альтернативном варианте раствор сушили распылением. В результате этого процесса соединение и полимер совместно осаждались в виде нерастворимого комплекса, в котором соединение было диспергировано в полимере на молекулярном уровне. Образовавшуюся высушенную пленку размалывали пестиком в ступе и просеивали через сито с размером ячеек 60 меш.
Результаты
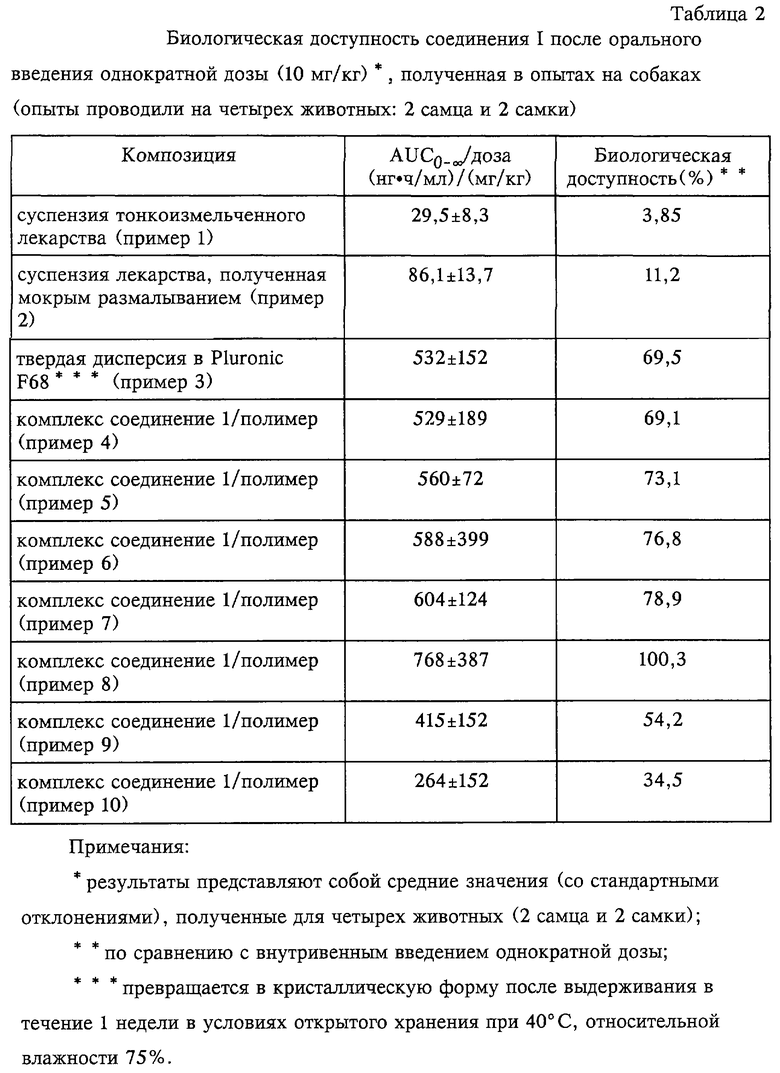
В приведенной ниже таблице 1 обобщены результаты для примеров 1-16. В таблице 1 для каждого примера указаны конкретные терапевтически активные соединения и, где это возможно, полученный комплекс соединение/полимер, способ приготовления комплекса соединение/полимер и физические характеристики образовавшихся продуктов.
Как показано на фиг.1 и в таблице 1, анализ картины дифракции рентгеновских лучей на порошке (ДРЛ) комплекса, полученного согласно примеру 4 (таблица 1), свидетельствует о том, что когда соединение I включают в ионный полимер согласно способу по настоящему изобретению, оно приобретает аморфную форму.
В таблице 1 и на фиг.4-7 также показано, что способы по настоящему изобретению пригодны для перевода соединений II, III, IV и V в аморфную форму.
Включение соединения I в ионный полимер защищало соединение от внешних воздействий окружающей среды, таких как влага и тепло. Этот результат продемонстрирован на фиг.2, где на основе дифракции рентгеновских лучей на порошке показано, что соединение I, включенное в полимер, сохраняло свою аморфную структуру даже при хранении в искусственно созданных неблагоприятных условиях. Способность комплекса сохранять соединение I в аморфной форме даже после хранения в искусственно созданных неблагоприятных условиях обусловлена большой молекулярной массой (>80000), высокой температурой стеклования (>50°С) и нерастворимостью в воде полимера(ов).
Кроме того, как показано ниже в таблице 2, полученная в опытах на собаках биологическая доступность соединения I в случае, когда оно согласно изобретению диспергировано на молекулярном уровне в ионном полимере, неожиданно оказалась выше, чем в случае, когда соединение вводили животным в обычных формах (например, после тонкого измельчения или мокрого размалывания). В таблице 2 также приведены результаты оценки биологической доступности, полученные при использовании твердой дисперсии соединения I, полученной методом горячего расплава с использованием Pluronic F68® (неионный водорастворимый полимер, состоящий из полиоксиэтиленовых и полиоксипропиленовых цепей, фирма BASF). Хотя биологическая доступность соединения, находящегося в такой твердой дисперсии была лучше, чем в случае, когда соединение было тонко измельчено или находилось в суспензии, полученной способом мокрого размалывания, физическая стабильность твердой дисперсии оказалась неудовлетворительной с точки зрения требований к фармацевтическому продукту, что является очевидным, т.к. соединение перешло назад в свою кристаллическую форму в течение одного месяца хранения в условиях окружающей среды. Вышеописанные результаты показывают непригодность использования для приготовления фармацевтического продукта способа получения твердой дисперсии в неионном водорастворимом полимере.
На фиг.3 показана зависимость концентрации в плазме от времени для различных партий комплекса соединение/полимер, приготовленных согласно примеру 4. Результаты этих тестов (обобщенные на фиг.3) свидетельствуют о воспроизводимости и взаимном соответствии данных, полученных для различных партий. Воспроизводимость и взаимное соответствие данных, полученных для различных партий, представляют собой важный аспект для любой композиции, предназначенной для введения больным людям.
На фиг.4-7 показано, что соединения II, III, IV и V также могут быть превращены в аморфную форму с использованием настоящего изобретения.
В целом данные, приведенные в таблицах 1 и 2 и на фиг.1, 2 и 4-7, где показаны картины дифракции рентгеновских лучей на порошке для комплексов соединение/полимер(ы), полученных согласно примерам 4-16, свидетельствуют о том, что диспергирование на молекулярном уровне слаборастворимого соединения в ионном(ых) полимере(ах) согласно настоящему изобретению переводит соединения в аморфную форму и сохраняет очень высокую стабильность аморфного соединения при длительном хранении.

| название | год | авторы | номер документа |
|---|---|---|---|
| СИСТЕМЫ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ВКЛЮЧАЮЩИЕ В СЕБЯ ТВЕРДЫЕ РАСТВОРЫ СЛАБООСНОВНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2007 |
|
RU2434630C2 |
| ЭЛЕКТРОПРЯДЕНЫЕ АМОРФНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2003 |
|
RU2331411C2 |
| СТАБИЛИЗИРОВАННАЯ АМОРФНАЯ ФОРМА АГОМЕЛАТИНА, СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ЕЕ СОДЕРЖАЩИЕ | 2013 |
|
RU2676476C9 |
| СТАБИЛИЗИРОВАННЫЕ АМОРФНЫЕ ФОРМЫ ИМАТИНИБА МЕЗИЛАТА | 2008 |
|
RU2489149C2 |
| Интраназальная система доставки лекарственных веществ в головной мозг | 2020 |
|
RU2755458C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДЫХ ДИСПЕРСИЙ ВЫСОКОКРИСТАЛЛИЧЕСКИХ ТЕРАПЕВТИЧЕСКИХ СОЕДИНЕНИЙ | 2007 |
|
RU2454220C2 |
| ТВЁРДЫЕ ДИСПЕРСИИ | 2016 |
|
RU2694832C2 |
| ТОЗИЛАТНАЯ СОЛЬ ТЕРАПЕВТИЧЕСКОГО СОЕДИНЕНИЯ И ЕЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2008 |
|
RU2430099C2 |
| СИСТЕМА ДЛЯ ПОВЫШЕНИЯ СТЕПЕНИ СОБЛЮДЕНИЯ ТЕРАПЕВТИЧЕСКОЙ СХЕМЫ С ПРОТИВОРАКОВЫМ СОЕДИНЕНИЕМ E7766 | 2020 |
|
RU2820595C2 |
| ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ДОСТАВКИ ЛЕКАРСТВЕННОГО СРЕДСТВА В ТОЛСТУЮ КИШКУ | 2007 |
|
RU2478372C2 |
Изобретение относится к фармацевтическим композициям, включающим стабильный нерастворимый в воде комплекс, состоящий из находящегося в стабильной аморфной форме терапевтически активного соединения, диспергированного на молекулярном уровне в водонерастворимом ионном полимере. Пригодные нерастворимые ионные полимеры имеют молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50оС. Соединения микроосаждают в аморфной форме в ионных полимерах. Предлагаемые комплексы значительно увеличивают биологическую доступность слаборастворимых терапевтически активных соединений. 11 н. и 30 з.п. ф-лы, 7 ил., 2 табл.
(а) растворения соединения формулы I
и водонерастворимого ионного полимера, имеющего молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50оС, в пригодном растворителе и (б) совместного осаждения соединения формулы I и ионогенного полимера в виде комплекса соединение/полимер.

в стабильной аморфной форме и водонерастворимого ионного полимера, имеющего молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50оС.
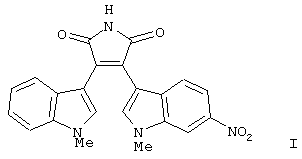
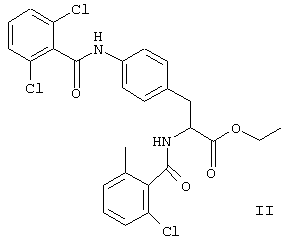
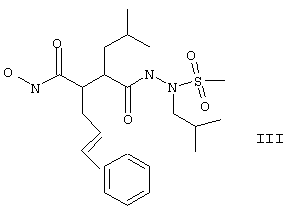
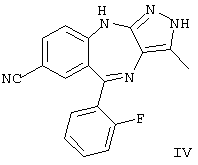
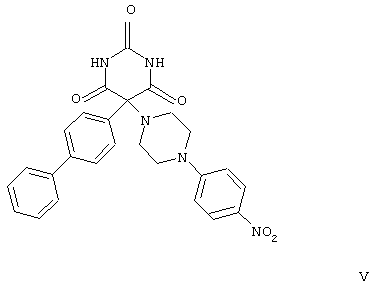
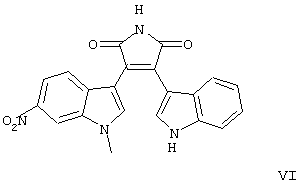
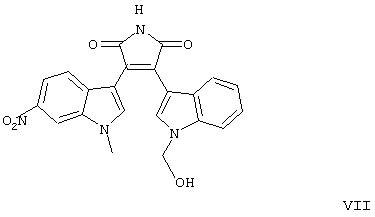
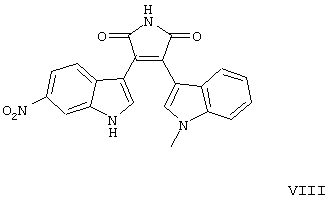
находящееся в стабильной аморфной форме, диспергированное на молекулярном уровне в водонерастворимом ионном полимере, имеющем молекулярную массу больше приблизительно 80000 Да и температуру стеклования, равную или превышающую приблизительно 50оС.
Приоритет по пунктам:
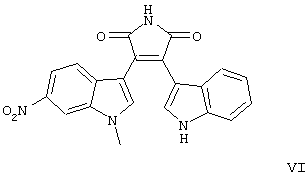
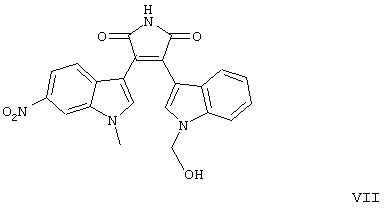
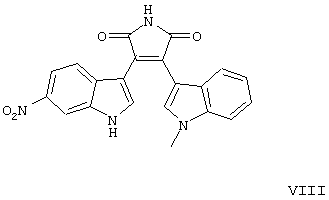
I-IV);
формул V-VIII).
| Способ получения твердой дисперсной композиции | 1987 |
|
SU1826977A3 |
| УСТРОЙСТВО для ИСПЫТАНИЯ КЛАВИШНЫХ ПЕРЕКЛЮЧАТЕЛЕЙ | 0 |
|
SU240773A1 |
| ТЕНЦОВА А.И | |||
| и др | |||
| Твердые дисперсные системы в фармации | |||
| Фармация, 1981, №2, с.65 | |||
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2159107C2 |
Авторы
Даты
2004-11-27—Публикация
1999-09-21—Подача