Настоящее изобретение относится к последовательности ДНК, кодирующей белок А. талианы, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, белок дельта-7 Ред, к способу их получения, к трансформированным дрожжевым штаммам и к видам их применения.
Дельта-5,7 стерин, дельта-7 редуктаза (Е.С.1.3.1.21) представляет собой микросомальный фермент, присутствие которого было обнаружено благодаря его действию в гомогенатах печени крысы (М.Е.Dempsey с соавторами. Methods Enzymol., 15, 501-514, 1969 г.), а также в препаратах растений Zea mays (М. Taton с соавторами, Biochem. Biophys. Res. Commun., 181, 465-473, 1991 г.). Указанная редуктаза зависима от НАДФН и обеспечивает in vitro восстановление 7-дигидрохолестерина в холестерин.
Стерины являются основными компонентами мембран у эукариотов, однако, в зависимости от вида, они имеют различную структуру. В клетках эукариотов, таких как дрожжи, основным стерином является эргостерин, который содержит двойную ненасыщенную связь в положении С-5 и С-7, разветвленную боковую цепь в положении С-24 и ненасыщенную связь в положении С-22, в то время как у млекопитающих холестерин отличается ненасыщенной связью в положении С-5 и насыщенной боковой цепью. Ситостерин, стигмастерин и кампестерин, которые представляют собой наиболее распространенные у растений стерины, обладают разветвленной, но насыщенной боковой цепью и так, же как и стерины позвоночных, не имеют ненасыщенной связи в положении С-7. Ферментом, вызывающим указанное различие структуры стеринового ядра, является дельта-5,7 стерин, дельта-7 редуктаза.
Дельта-5,7 стерин, дельта-7 редуктаза никогда не очищалась до состояния гомогенности, и в специальной литературе встречается лишь описание частичной очистки (указанные выше М.Е.Dempsey с соавторами, М.Taton с соавторами). При этом белок не рассматривался с точки зрения его физико-химических свойств. Никакой информации относительно последовательности белка не приводилось, так же как не встречается описаний каких бы то ни было антител к нему. Кроме того, очевидная нехватка 7-дегидрохолестеринредуктазы у человека была описана в связи с синдромом RSH/Смита-Лемли-Опитца (SLO) (J.М.Opitz с соавторами. Am. J. Med. Genet., 50, 326-338, 1994 г.).
Таким образом, клонирование кДНК, кодирующей дельта-5,7 стерин, дельта-7 редуктазу, которое может позволить идентифицировать соответствующую последовательность белка, а также характеризовать ген человека или выявить их врожденную недостаточность, не может производиться обычными методами, использующими, например, методы гибридизации и/или иммунологического обнаружения. Поэтому особенно важное значение имеет поиск новых методов скрининга, позволяющих выполнять клонирование, в частности, при отсутствии информации о белке.
Эргостерин, являющийся основным стерином грибковых мембран, включает пару двойных сопряженных связей в положении С-5,7, благодаря чему соединения из семейства полиенов, такие как нистатин, обладают антимикотичным действием (R.Bittman с соавторами, J.Biol. Chem., 260, 2884-2889, 1985 г.). Сильная зависимость действия нистатина на мембранную концентрацию ненасыщенных стеринов в положении С-5,7 позволила отобрать в S. cerevisiae мутантные штаммы относительно накопленных стеринов (S.W.Molzahn с соавторами, J. Gen. Microbiol., 72, 339-348, 1972 г.). Так, мутанты еrg2 и еrg3 накапливают стерины, не имеющие двойных сопряженных связей в положении С-5,7 вследствие недостаточности соответственно стерин дельта-8,7 изомеразы (W.Ashman с соавторами, Lippids, 26, 628, 1991 г.) и стерин дельта-5 дегидрогеназы (В.Arthinton с соавторами. Gene, 102, 39, 1991 г.). Подобные мутанты жизнеспособны, поскольку эргостерин, являющийся основным природным стерином дрожжей, может при некоторых условиях быть заменен различными стеринами-заменителями, включающими холестерин.
Преимущество повышения устойчивости к нистатину дрожжевых штаммов, обогащенных стеринами, не имеющими двойной ненасыщенной связи в положении С-5,7, было использовано изобретателями для клонирования кДНК, кодирующей гетерологичный белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, методом скрининга, использующим метаболическую интерференцию в S.Cerevisiae. Тем не менее, на успех подобного подхода, преимуществом которого является его независимость от знания последовательностей ДНК или белка, а также от обнаружения, основывающегося исключительно на ферментативной активности, рассчитывать нельзя из-за многочисленных трудностей технического характера, с которыми он связан.
Первое ограничение вызвано тем фактом, что действие нистатина не полностью изучено (L.W.Parks с соавторами, CRC Critical Reviews in Microbiology, 301-304, 1978 г.). Например, можно предвидеть слабую специфичность нистатинного отбора вследствие его косвенного характера, что приводит у дрожжей к выбору геномных спонтанных мутаций, таких как мутанты erg (указанный выше S.W.Molzahn с соавторами), или геномных мутаций, ведущих к устойчивости, не зависящей от метаболических путей стеринов. Так же и клетки, трансформированные банком, могут выражать гетерологичные гены, обеспечивающие устойчивость к нистатину, не зависящую от метаболического пути стеринов.
Другой пример ожидаемого ограничения относится к тому факту, что гетерологичный белок может иметь слабую активность в клетке, ведущую к отсутствию или ослаблению устойчивости к нистатину, например, по одной из нижеследующих причин: 1) слабая экспрессия гена, кодирующего дельта-5,7 стерин, дельта-7 редуктазу; 2) слабая активность или полное отсутствие активности белка вследствие плохой свернутости или вследствие ошибочной субклеточной адресации; 3) белок растения не признает стерины дрожжей в качестве субстратов или 4) стерины, которые могут быть субстратами, присутствуют в этерифицированном виде или скапливаются в пузырьках и не находятся в контакте с ферментом. Таким образом, можно предвидеть, что накопленные таким образом стерины не подвергаются воздействию дельта-5,7 стерин, дельта-7 редуктазы, которая, в случае эукариотов, считается локализованной в микросомах.
Настоящее изобретение относится к клонированию кДНК А. талианы, кодирующей белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, обозначаемый как дельта-7 Ред, по методу клонирования, выполняемого в дрожжах за счет метаболической интерференции, основывающейся на устойчивости к нистатину. Белок дельта-7 Ред обеспечивает восстановление стеринов, содержащих ненасыщенную связь в положении С-7, методом биологического восстановления, которое, кроме того, используется как удачное решение проблемы селективного восстановления в положении С-7 стеринов или стероидов, обладающих двойной ненасыщенной связью в положении С-5,7, что невозможно при использовании методов химического восстановления.
Настоящее изобретение относится также к трансформированным клеткам дрожжей, экспрессирующим дельта-7 Ред, которые удивительным образом накапливают продукты, насыщенные в положении С-7, и, возможно, насыщенные в положении С-22, которые, в отличие от эргостерина, являются субстратами фермента расщепления боковой цепи холестерина, то есть цитохром P450SCC.
Указанные неожиданные свойства позволяют использовать трансформированные дрожжи, являющиеся предметом настоящего изобретения, в способе получения стеринов или стероидов, представляющем промышленный и/или фармакологический интерес, в частности для получения прегненолона путем биологического окисления эндогенных стеринов дрожжей, восстановленных в положении С-7, с помощью цитохрома P450SCC (P450SCC) в присутствии адренодоксинредуктазы (ADR) и адренодоксина (ADX). Трансформированные дрожжи, являющиеся предметом настоящего изобретения, могут также использоваться в способе получения промежуточных стероидов пути метаболизации холестерина в гидрокортизон у млекопитающих и прочих позвоночных. Указанное использование обладает тем преимуществом, что оно позволяет получить гидрокортизон или его промежуточные продукты методом биологического окисления, не требующим использования в качестве исходного субстрата экзогенного стерина, такого как холестерин, что позволяет обойти проблему проникновения стерина в дрожжи, непроницаемость которых для экзогенных стеринов в условиях аэробиоза уже описывалась (R.Т.Lorentz с соавторами, J. Bacteriology, 981-985, 1986 г.).
Настоящее изобретение относится также к использованию нуклеотидных последовательностей, полученных с применением метода клонирования, являющегося предметом настоящего изобретения. Последовательность РНК или ДНК, кодирующая дельта-5,7 стерин, дельта-7 редуктазу, может использоваться при диагностике или лечении заболеваний, связанных с продуктом гена дельта-5,7 стерин, дельта-7 редуктазы. Например, считается, что нехватка дельта-5,7 стерин, дельта-7 редуктазы, которая преобразует 7-дегидрохолестерин в холестерин, приводит к синдрому RSH/SLO. Таким образом, последовательность ДНК человека может использоваться в качестве зонда при диагностике недостаточности дельта-5,7 стерин, дельта-7 редуктазы, а также в генной терапии для корректировки указанной недостаточности.
Таким образом, предметом настоящего изобретения является последовательность нуклеиновой кислоты, включающей последовательность, кодирующую белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, причем указанной нуклеиновой кислотой может быть ДНК или РНК и в первую очередь кДНК.
Дельта-5,7 стерин, дельта-7 редуктазная активность может быть обнаружена, например, с помощью ферментативного теста in vitro (в пробирке), описание которого приводится ниже, в экспериментальной части.
Предметом настоящего изобретения в первую очередь является последовательность кДНК, в которой кодирующая последовательность кодирует белок А. талианы, обладающий дельта-5,7 стерин, дельта-5,7 редуктазной активностью, и обладающая последовательностью нуклеотидов последовательности SEQ ID №1 (см. в конце текста), а также аллельные варианты данной последовательности.
Вышеприведенная последовательность кДНК, кодирующая белок, состоящий из 430 аминокислот, соответственно последовательности, представленной на фиг.3 (SEQ ID №2), является последовательностью кДНК, которую можно получить, например, путем клонирования в дрожжах, на основе банка экспрессии А. thaliana с использованием метода скрининга, основанного на появлении устойчивости дрожжей к нистатину, с соблюдением условий выполнения, подробное описание которых приводится ниже.
Знание вышеприведенной последовательности нуклеотидов SEQ ID №1 позволяет воспроизвести настоящее изобретение обычными методами, хорошо известными специалистам, например, путем выполнения химического синтеза или скрининга геномного банка или банка кДНК с помощью синтезированных олигонуклеотидных зондов с использованием методов гибридизации или амплификации методом PCR (polymerase chain reaction).
Предметом настоящего изобретения также является последовательность ДНК, кодирующая белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, и гибридизирующаяся с последовательностью нуклеотидов SEQ ID №1 в условиях средней или повышенной температуры гибридизации, или обладающая с данной последовательностью идентичностью на 60 или более процентов.
Последовательности, гибридизирующиеся поддающимся обнаружению образом в последовательности SEQ ID №1, гибридизируют в обычных условиях средней температуры гибридизации, например, при температуре +42°С, в течение 12 ч в 50%-ном растворе формамида, SSCX6, с последующей промывкой, или при менее высокой температуре гибридизации, например, при температуре +42°С, в течение 24 ч в 20%-ном растворе формамида, SSCX6 с последующей промывкой в общеизвестных обычных условиях (Т.Maniatis с соавторами, Molecular cloning. Cold Spring Harbor Laboratory Press, 1969 г.).
Процент идентичности последовательности нуклеотидов может быть определен с использованием, например, программы BLAST (basic local alignment search tool) (S.F.Altschul с соавторами, J. Mol. Biol., 215, 403-410, 1990 г.) на сервере NCBI.
Настоящее изобретение относится также к последовательности ДНК, кодирующей белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, амплифицированной методом PCR, с использованием в качестве затравок олигонуклеотидов, кодирующих консенсусную последовательность, обладающую аминокислотной последовательностью SEQ ID №3:
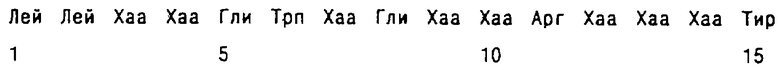
в которой Хаа в положении 7 представляет собой аминокислоту Трп, или Тир, а Хаа в положении 12 представляет собой Гис или Лиз.
Вышеуказанная последовательность SEQ ID №3 соответствует новой консенсусной последовательности, которая была определена в результате сопоставления аминокислотных последовательностей между новой последовательностью SEQ ID №2, выведенной из последовательности нуклеотидов SEQ ID №1, и известных последовательностей либо других стеринредуктаз, обладающих специфическим действием в положении, ином чем положение С-7, либо рецепторов для ламина В, как это подробно описано ниже, в экспериментальной части. На основе информации, полученной из аминокислотной последовательности SEQ ID №3, может быть определена и синтезирована затравка, состоящая не более чем из 45 нуклеотидов, которая в сочетании со второй затравкой олиго-dT (17 нуклеотидов) в качестве противоположной последовательности позволит, благодаря использованию готового набора PCR (например, набора Stratagene), амплифицировать ДНК, кодирующую белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью.
Настоящее изобретение относится также к белку A. thaliana, обладающему дельта-5,7 стерин, дельта-7 редуктазной активностью и аминокислотной последовательностью SEQ ID №2 (см. в конце текста), а также аллельные варианты и аналоги данной последовательности.
Под аллелями и аналогами понимают последовательности, модифицированные путем замещения, делеции или прибавления одной или нескольких аминокислот, при условии, что эти продукты сохранят ту же функцию. Модифицированные последовательности могут, например, быть получены с использованием метода направленного мутагенеза, хорошо известного специалистам.
Предметом настоящего изобретения в первую очередь является белок A. thaliana, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, и вышеуказанной аминокислотной последовательностью SEQ ID №2, обозначаемый как дельта-7 Ред.
Настоящее изобретение относится также к белку, обладающему дельта-5,7 стерин, дельта-7 редуктазной активностью, и аминокислотной последовательностью, идентичной с последовательностью SEQ ID №2 примерно на 60 и более процентов.
Процент идентичности может быть определен с использованием, например, указанной выше программы BLAST.
Настоящее изобретение относится также к белку, обладающему дельта-5,7 стерин, дельта-7 редуктазной активностью и перекрестной иммунореактивностью с белком A. thaliana вышеуказанного белка дельта-7 Ред.
Белок может быть обнаружен, например, путем иммуноосаждения с помощью антисыворотки, направленной против белка дельта-7 Ред, полученной общеизвестными методами.
Один из аспектов настоящего изобретения касается белка, обладающего дельта-5,7 стерин, дельта-7 редуктазной активностью, такого как полученный экспрессией в клетке-хозяине, содержащей определенную выше последовательность ДНК и, в первую очередь, белка A. thaliana, такого, как полученный экспрессией в клетке-хозяине, включающей последовательность ДНК, кодирующую вышеуказанную аминокислотную последовательность SEQ ID №2.
Когда белок, являющийся предметом настоящего изобретения, получают экспрессией в клетке-хозяине, это осуществляется с использованием методов генной инженерии и культур клеток, хорошо известных специалистам.
Экспрессия может осуществляться в прокариотических клетках-хозяевах, например в Е. coli, или в эукариотических клетках-хозяевах, например, в клетке млекопитающего, клетке насекомого или в дрожжах, включающих последовательность, кодирующую белок дельта-7 Ред, являющийся предметом настоящего изобретения, которой предшествует соответствующий промотор.
Полученный рекомбинантный белок может быть как гликолизированным, так и негликолизированным.
Настоящее изобретение относится, в частности, к белку, являющемуся предметом изобретения, такому, как полученный экспрессией в дрожжах.
Настоящее изобретение относится также к антителу, направленному против белка, обладающего определенной выше дельта-5,7 стерин, дельта-7 редуктазной активностью. Указанным антителом может быть поликлональное антитело или моноклональное антитело, полученное методами, хорошо известными специалистам.
Настоящее изобретение относится также к вектору экспрессии, содержащему определенную выше последовательность ДНК, а также клетке-хозяину, трансформированной указанным вектором.
Векторами экспрессии являются хорошо известные векторы, обеспечивающие экспрессию белка под контролем соответствующего промотора. В случае прокариотических клеток промотором может быть, например, промотор lac, промотор trp промотор tac; промотор β-лактамазы или промотор PL. В клетках млекопитающих промотором может быть промотор SV40 или промоторы аденовируса. Бакуловирусные векторы могут также использоваться для экспрессии в клетках насекомых. В случае дрожжевых клеток промотором может быть, например, промотор PGK, промотор ADH, промотор СУС1 или промотор GAL10/CYC1.
Клетками-хозяевами могут быть прокариотические клетки или эукариотические клетки. Прокариотическими клетками являются, например, Е. coll. Bacillus или Streptomyces. Эукариотические клетки-хозяева включают дрожжи и филаментные грибки, а также клетки высших организмов, например клетки млекопитающих или клетки насекомых. Клетками млекопитающих могут быть клетки СНО хомяка или клетки Cos обезьяны. Клетками насекомых являются, например, клетки SF9. Клетками дрожжей могут быть, например, Saccharomyces cerevisiae, Schizosaccharomyces pombe или Kluyveromyces lactis.
Предметом настоящего изобретения также является метод клонирования нуклеиновой кислоты, кодирующей белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, в микроорганизме, включающий метод скрининга, выбранный среди:
- устойчивости микроорганизма к нистатину или к аналогичному соединению, токсичность которого зависит от присутствия стеринов, содержащих ненасыщенную связь в положении С-7,
гибридизации нуклеиновой кислоты с последовательностью нуклеотидов указанной выше последовательности SEQ ID №1,
- идентификации нуклеиновой кислоты информационным путем среди последовательностей ДНК, изолированных произвольно,
- прямой экспрессии белка с последующим иммунологическим обнаружением с помощью антител, направленных против белка, обладающего указанной выше аминокислотной последовательностью SEQ ID №2.
Под микроорганизмом понимают дрожжи, такие как, например, S. cerevisiae, S. pombe или К. lactis.
Соединения, аналогичные нистатину, содержат, например, амфотерицин В или филипин.
Под гибридизацией понимают гибридизацию при средней или повышенной температуре гибридизации в обычных условиях, хорошо известных специалистам (указанный выше Т.Maniatis с соавторами).
Идентификация информационным путем может осуществляться, например, с использованием указанной выше программы BLAST.
Описание примера указанного выше метода клонирования, при котором метод скрининга использует устойчивость к нистатину в дрожжах, приводится ниже, в экспериментальной части.
Предметом настоящего изобретения также является последовательность нуклеиновой кислоты, ДНК или РНК, такой, как полученная указанным выше методом клонирования. Последовательность нуклеиновой кислоты может быть прокариотического или эукариотического происхождения, в зависимости от материала, на основе которого производилось клонирование, например, человеческого происхождения.
Предметом настоящего изобретения также является клетка-хозяин, трансформированная вектором, содержащим последовательность ДНК, полученной с использованием описанного выше метода клонирования. Клеткой-хозяином может быть прокариотическая клетка или эукариотическая клетка. Примеры клеток-хозяев и векторов приводились выше.
Предметом настоящего изобретения в первую очередь является клетка-хозяин, выбранная среди дрожжей или филаментного грибка, трансформированная вектором, содержащим последовательность ДНК, являющуюся предметом настоящего изобретения, определенную выше, или последовательность ДНК, такую, как полученная описанным выше методом клонирования.
Один из предметов настоящего изобретения относится также к способу получения белка, обладающего дельта-5,7 стерин, дельта-7 редуктазной активностью, в котором культивируют трансформированную клетку-хозяина, являющуюся предметом настоящего изобретения, и выделяют экспрессированный белок и, в первую очередь, к способу, в котором клеткой-хозяином являются трансформированные дрожжи, в которых кодирующая последовательность ДНК находится под контролем промотора дрожжей.
Один из предметов настоящего изобретения относится также к способу восстановления in vitro стерина, ненасыщенного в положении С-7, в котором инкубируют стерин, подлежащий восстановлению, с белком, полученным описанным выше способом, после чего полученный восстановленный стерин может быть выделен.
Один из предметов настоящего изобретения относится также к способу восстановления in vitro экзогенного стерина, ненасыщенного в положении С-7, в котором инкубируют стерин с трансформированной клеткой-хозяином, являющейся предметом настоящего изобретения, с возможностью выделения полученного восстановленного стерина. Клеткой-хозяином может быть прокариотическая клетка или эукариотическая клетка, в частности дрожжи или филаментный грибок.
Один из предметов настоящего изобретения относится также к способу восстановления in vivo эндогенного ненасыщенного в положении С-7 стерина, в котором культивируется трансформированный штамм-хозяин, являющийся предметом настоящего изобретения, выбранный среди дрожжей или филаментного грибка, с возможностью последующего выделения накопленного восстановленного стерина.
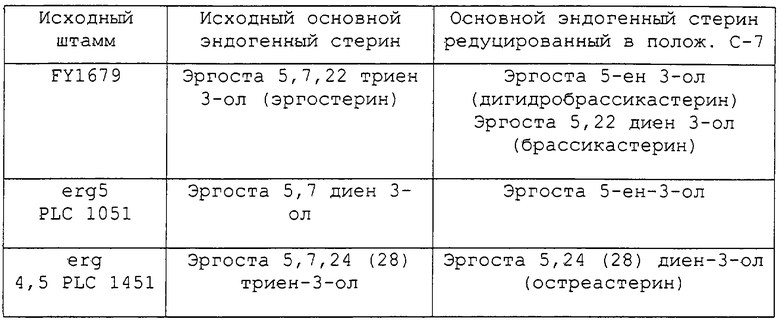
Настоящее изобретение относится, в первую очередь, к определенному выше способу восстановления in vitro или in vivo, в котором полученным восстановленным стерином является субстрат фермента расщепления боковой цепи холестерина (P450SCC), и, в первую очередь, относится к способу восстановления in vivo, в котором эндогенным стерином, подлежащим восстановлению, является эргоста 5,7 диен 3-ол, эргоста 5,7,24(28) триен 3-ол или эргоста 5,7,22 триен 3-ол или их смесь.
Предметом настоящего изобретения также является способ получения прегненолона, в котором культивируют трансформированные клетки-хозяева, являющиеся предметом настоящего изобретения, выбранные среди дрожжей или филаментного грибка, с возможностью последующего выделения накопленного восстановленного эндогенного стерина (накопленных восстановленных эндогенных стеринов) в положении С-7, после чего инкубируют восстановленные стерины в присутствии P450SCC и, возможно, в присутствии адренодоксинредуктазы (ADR) и адренодоксина (ADX), с возможностью последующего выделения полученного прегненолона.
Предметом настоящего изобретения в первую очередь является способ получения определенного выше прегненолона, в котором клеткой-хозяином являются дрожжи.
Настоящее изобретение относится также к способу получения прегненолона, в котором культивируют дрожжи, трансформированные одним или несколькими векторами, обеспечивающими коэкспрессию белка, обладающего дельта-5,7 стерин, дельта-7 редуктазной активностью, и P450SCC, и, возможно, ADR и ADX, с возможностью последующего выделения свободного или эстерифицированного прегненолона.
Настоящее изобретение относится, в частности, к описанному выше способу, в котором культивируют трансформированные дрожжи, коэкспрессирующие белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, P450SCC, ADR и ADX, и, главным образом, к вышеописанному способу, в котором белком, обладающим дельта-5,7 стерин, дельта-7 редуктазной активностью, является белок А. талианы, дельта-7 Ред, и, в первую очередь, к вышеописанному способу, в котором дрожжевым штаммом является штамм EC01/pCD63.
Примеры получения прегненолона в соответствии с настоящим изобретением приводятся ниже, в экспериментальной части.
Трансформированными дрожжами, используемыми для осуществления указанного выше способа получения прегненолона, могут быть, например, дрожжи, котрансформированные вектором экспрессии, являющимся предметом настоящего изобретения, содержащим последовательность ДНК, кодирующую белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, и вектором экспрессии цитохрома P450SCC и, возможно, ADX и ADR. Описание известных векторов экспрессии цитохрома P450SСС и/или ADX приводится, например, в патентной заявке ЕЭС ЕР 0340878, а также ниже, в экспериментальной части.
Используемыми трансформированными дрожжами могут также быть дрожжи, в которых последовательность ДНК, кодирующая белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, интегрирована в частный локус гена, например в локус ADE2, и в которых эргостерином является уже не основной стерин в условиях экспрессии дельта-7 редуктазы. Полученные “интегрированные” дрожжи могут быть затем трансформированы с помощью интегрирующих кассет экспрессии или векторов экспрессии, содержащих последовательность ДНК, кодирующую цитохром P450SCC и, возможно, ADX и ADR.
Пример конструирования дрожжевых штаммов, продуцирующих in vivo прегненолон или его сложный уксусноэтиловый эфир приводится ниже, в экспериментальной части.
Таким образом, предметом настоящего изобретения является также штамм трансформированных дрожжей, коэкспрессирующих белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью, P450SCC, ADR и АОХ, и накапливающий прегненолон, свободный или эстерифицированный, в частности указанный выше дрожжевой штамм, в котором белком, обладающим дельта-5,7 стерин, дельта-7 редуктазной активностью, является белок A. thaliana, дельта-7 Ред и, в первую очередь, дрожжевой штамм, обозначаемый как EC01/рСD63, детальное конструирование которых приводится ниже, в экспериментальной части.
Настоящее изобретение распространяется также на последовательность ДНК человека, такую как полученная по описанному выше способу клонирования, используемую в качестве зонда для диагностики врожденной нехватки дельта-5,7 стерин, дельта-7 редуктазы. Нехватка дельта-5,7 стерин, дельта-7 редуктазы включает, например, нехватку 7-дегидрохолестеринредуктазы, вызывающую ненормально низкое содержание холестерина в плазме.
Настоящее изобретение относится также к способу выявления нехватки дельта-5,7 стерин, дельта-7 редуктазы, включающему инкубацию пробы, содержащей геномную ДНК человека, с помощью зонда, указанного выше, в условиях стандартной гибридизации и выявление фиксации или отсутствия фиксации зонда на геномной ДНК, отсутствие фиксации или его восстановление, указывающее на врожденную нехватку дельта-5,7 стерин, дельта-7 редуктазы.
Способ согласно изобретению может позволить, например, выявление врожденной нехватки дельта-5,7 стерин, дельта-7 редуктазы, дородовой или у новорожденного, а также у пациентов, страдающих разнообразными заболеваниями, в частности, у пациентов с клиническим проявлением синдрома RSH/SLO.
Прилагаемые чертежи иллюстрируют некоторые аспекты настоящего изобретения:
На фиг. 1 представлен профиль общих стеринов, экстрагированных из клона F22, устойчивого к нистатину, полученному скринингом банка A. thaliana в дрожжах FY 1679. Анализ производился методом RP-HPLC при 205 нм или 285 нм (фиг. 1а) или методом CPG путем сравнения с нетрансформированными дрожжами FY1679 (фиг 1в).
На фиг. 2 представлена карта рестрикции фрагмента Not I плазмиды pF22 и стратегия определения последовательности оснований в ДНК.
На фиг. 3 представлена последовательность нуклеотидов кДНК дельта-7 Ред (SEQ ID №1) и соответствующая аминокислотная последовательность (SEQ ID №2).
Фиг. 4 иллюстрирует измерение in vitro активности дельта-5,7 стерин, дельта-7 редуктазы микросомной фракции FY1679, трансформированной индуцируемым вектором экспрессии “дельта-7/V8”. Анализ выполняется методом CPG и показывает трансформирование субстрата 7-дигидрохолестерина (Тr=16,528) в холестерин (TR=15,887) в присутствии эндогенных стеринов эргоста 5,22 диен 3-ол (TR=16,682); эргостерина (TR=17,249); эргоста 5-ен 3-ола (TR=17,664).
Фиг. 5 иллюстрирует получение прегненолона in vitro путем расщепления эргоста 5-ен 3-ола (фиг. 5а); эргоста 5,24 (28) диен 3-ола (5в) или эргоста 5,22 диен 3-ола (5С), очищенного на основе трансформированных дрожжей, экспрессирующим дельта-7 Ред, с последующей инкубацией в присутствии P450SCC, ADX и ADR. Анализ производится методом CPG сравнением с контрольным расщеплением холестерина (сплошная линия).
На фиг. 6 показано конструирование интегративной плазмиды рАDΔ7, позволяющей интегрировать кДHК, кодирующую дельта-7 Ред (стерин Д7 редуктаза), в локус ADE2.
Фиг. 7 представляет анализ методом CPG общих стеринов, экстрагированных омылением щелочью из штамма FY1679 и из интегрированного штамма ELR01, культивированного в присутствии галактозы.
На фиг. 8 схематически показано построение челночного вектора Е. coli-S. cerevisiae V13, содержащего специфический участок Sal I (Sa) в многоучастковом секторе клонирования.
На фиг. 9 представлены этапы построения интегративной плазмиды pCD62-1 и pCD62-2, позволяющие включить интегрирующую кассету экспрессии ADR в межгенную зону leu2 и sрl1Δ.
SCM1 и SCM2: множественные участки клонирования.
На фиг. 10 показана стратегия построения штамма CDR01.
На фиг. 11 показаны этапы построения плазмиды экспрессии рСО63, содержащей обе кассеты экспрессии: ADX и P450SCC.
На фиг. 12 представлен анализ методом CPG стеринов, экстрагированных из клеток (клеточный лизат) или из культуральной среды (среда), выделенных из штамма EC01/рСD63 после индукции галактозой в течение 9 ч (фиг. 12а) или 24 ч (фиг. 12б).
На фиг. 13 представлена структура плазмиды pTG 7457.
На фиг. 14 представлена структура плазмиды pTG 7453.
На фиг. 15 представлена структура плазмиды pTG 10014.
На фиг. 16 представлена структура плазмиды pTG 10004.
На фиг. 17 представлена структура плазмиды pTG 10031.
На фиг. 18 представлена структура плазмиды pTG 10033.
Приводимые далее примеры иллюстрируют настоящее изобретение, вместе с тем не ограничивая его.
ПРИМЕР 1: Клонирование кДНК, кодирующей дельта-5,7 стерин, дельта-7 редуктаэу (дельта-7 Ред) А. талианы
А - Скрининг банка экспрессии А. талианы в дрожжах
Исходный банк экспрессии кДНК представляет собой банк, описание которого дано М. Minet с соавторами (Plant J., 2, 417-422, 1992 г.), который был приготовлен на основе мРНК A. thaliana на этапе прорастания на стадии двух листиков, кДНК которого, ограниченные участком Not I, были включены в участок Bst XI кассеты экспрессии челночного вектора Е. coli/S. cerevisiae pFL61. Указанная кассета содержит последовательности промотора и терминатора гена фосфоглицераткиназы (ФГК). Точка начала репликации дрожжевой последовательности 2μ и маркер отбора URA3 обеспечивают репликацию вектора в дрожжах. Распространение вектора в Е. coli имеет в своей основе плазмиду pUC19.
Дрожжевой штамм FY 1679 (Мата), который представляет собой изогенный штамм штамма S288C и описание которого дано А. Thierry с соавторами (Yeast, 6, 521-534, 1990 г.), был трансформирован банком кДНК с применением метода, основанного на использовании литийацетата, описанного D. Gietz с соавторами (Nucleic Acids Res., 20, 1425, 1992 г.).
Клетки были нанесены на поверхность синтетической среды SGI, содержащей 7 г/л “дрожжевого азотистого основания” (Difco), 1 г/л бактоказаминокислот (Difco), 20 г/л глюкозы, 20 мг/л триптофана и лишенной урацила. Были получены 105 прототрофных трансформантов по урацилу, которые были сгруппированы и вновь нанесены на поверхность той же синтетической среды, лишенной урацила и содержащей 2 или 5 мкг/мл нистатина из расчета 5×104 клеток на чашку. Таким образом были перебраны 106 клеток для каждой концентрации нистатина. После 3 суток инкубации при температуре +28°С было получено примерно 100 клонов, которые выросли при концентрации нистатина в 2 мкг/мл и составили группы из 5 клонов, стериновый состав которых был подвергнут анализу высокопроизводительным методом обратнофазовой жидкостной хроматографии (обозначаемым в дальнейшем RP-HPLC), в то время как был получен лишь один устойчивый клон, называемый F22, при концентрации нистатина 5 мкг/мл.
Б - Анализ стеринов, накопленных в клоне F22
Общие стерины дрожжей получают с использованием метода омыления щелочью, описанного L. Parks с соавторами (Methods in Enzymol, 111, 333-346, 1985 г.), после чего выполняется анализ с использованием RP-HPLC и/или газовой хроматографии (обозначаемым CPG).
Полученный стериновый остаток растворяют в смеси этанол – тетрагидрофуран - вода (65:10:25 по объему), после чего анализируют методом колоночной хроматографии RP-HPLC на двуокиси кремния С 18 Applied Biosystems (100×2,1 мм), с расходом 1 мл/мин и при температуре +55°С с помощью линейного градиента метанола в воде (от 50% до 100% за 18 мин) и фотометрического анализа при 205 нм и 285 нм в сравнении со стандартными значениями для эргостерина, кампестерина и холестерина.
Стериновый состав также анализируют методом CPG на капиллярной колонке SE-30 Alltech (30 м × 0,32 мм) с использованием гелия в качестве газа-носителя при температуре +280°С и +310°С соответственно для инжектора и для детектора, с исходным повышением температуры с +110°С до +245°С при скорости 45°С/мин, а затем 3°С/мин для достижения температуры +280°С.
Анализ методом RP-HPLC (фиг. 1а) и анализ методом CPG (фиг. 1в) показывают профиль стеринов, накопленных в полученном выше клоне F22, отличающемся почти полным исчезновением эргостерина, основным стерином в нетрансформированном штамме FY 1679 и его заменой двумя основными стеринами в аналогичном количестве, которые не поглощают при 285 нм и, следовательно, уже не обладают двойной сопряженной ненасыщенной связью согласно анализу методом RP-HPLC.
На фиг. 1а кампестерин (Сигма) (24-К-эргоста 5-ен 3-ол) содержит примерно 35% дигидробрассикастерина (24-3-эргоста 5-ен 3-ол).
В - Клонирование кДНК дельта-7 Ред
Плазмиды, происходящие из клона F22, были амплифицированы в Е. coli в соответствии с методом, описанным J.N.Strathern с соавторами (Methods in Enzymol., 194, 319-329, 1991 г.), и расщеплены Not I. Были получены фрагмент примерно из 600 пар оснований (п.о.) и фрагмент из 1,6 тыс. п.о. Штамм FY1679 был трансформирован соответственно каждым из вышеуказанных фрагментов. Стериновый состав каждого клона трансформированных дрожжей был подвергнут анализу, как указано выше, и позволил выявить плазмиды, содержащие ген, ответственный за изменение стеринового профиля. Идентифицированная таким образом плазмида была названа pF22.
Г - Определение последовательности кДНК дельта-7 Ред
Вставка кДНК pF22 была субклонирована в сайте Not I вектора pUC9N, производного от pUC9 (Pharmacia), в котором участок Есо RI множественного участка клонирования заменен вставкой участка рестрикции Not I с одновременным сохранением фазы считывания гена LacZ. Затем была определена карта рестрикции (фиг. 2).
Фрагменты рестрикции, обладающие внешним участком Not I и внутренними участками EcoRI, PvuII или Hindi II соответственно, были подвергнуты субклонированию в плазмиде pBLuescript (Stratagene). Последовательность нуклеотидов была определена методом Сангера с ДНК-полимеразой Sequenase (набор Stratagene) на обеих нитях, с использованием прямых и обратных затравок pUC9, Т3 и Т7 pBLuescript или специфических затравок, выведенных из последовательности нуклеотидов кДНК.
Составление совокупности полученных последовательностей дает последовательность нуклеотидов кДНК дельта-7 Ред A. thaliana (SEQ ID №1), представленную на фиг. 3. Она включает 1496 нуклеотидов, заканчивающихся последовательностью полиаденилирования. Она представляет собой открытую рамку считывания, начинающуюся с исходного метионина с нуклеотида 76 и заканчивающуюся терминаторным кодоном с нуклеотидом 1366. В итоге возникает открытая фаза считывания из 1290 нуклеотидов, кодирующих белок из 430 аминокислот. Кодирующая область кДНК дельта-7 Ред кодирует белок дельта-7 Ред, выведенная аминокислотная последовательность которого (SEQ ID №2) представлена на фиг. 3. Последовательность белка содержит 430 аминокислот с расчетной молекулярной массой 49,286 кДа.
Образец штамма Е. coli DH5-1, содержащего кДНК дельта-7 Ред в векторе pUC9N (обозначение: кДНК дельта7ред/рUС9N), был подан 10 февраля 1995 г. в НККМ (Национальная коллекция культур и микроорганизмов при Институте Пастера) под номером 1-1535.
Д - Определение консенсусной последовательности SEQ ID №3
Путем информационного поиска в базах последовательностей (Genbank и EMBL) было выявлено, что последовательность белка дельта-7 Ред A. thaliana имеет некоторые сходства последовательности с другими стерин-редуктазами, в частности со стерин С-14 редуктазой и стерин С-24 (28) редуктазой S. cerevisiae, описание которых приводится соответственно у R.Т.Lorentz с соавторами (DNA Cell Biol., 11, 685-692, 1992 г.) и у W.Chen с соавторами (Yeast, 7, 305-308, 1991 г.), а также с продуктом гена sts 1+S. pombe, описание которого дают М. Shimanuki с соавторами (Mol. Biol. Cell, 3, 263-273, 1992 г.) и стерин С-14 редуктаза Neurospora crassa (№Х77955 в базе EMBL). Кроме того, белок дельта-7 Ред имеет сходство с 400 аминокислотами С-концевого участка рецептора ламина В цыпленка и с концевым участком соответствующего рецептора человека, описание которых приводится у Н.J.Worman с соавторами (J.Cell Biol., 1ll, 1535-1542, 1990 г.) и у Е.Schuler с соавторами (J.Biol. Chem., 269, 11312-11317, 1994 г.).
Были установлены ряды последовательностей, доказывающие идентичность между аминокислотной последовательностью SEQ ID №2, выведенной из полученной выше кДНК дельта-7 Ред, последовательностью трех дрожжевых стеринредуктаз и двух рецепторов ламина В, после чего была определена новая консенсусная последовательность, обладающая аминокислотной последовательностью (SEQ ID №3):

в которой Хаа в положении 1 представляет собой аминокислоту Трп или Тир, а Хаа в положении 12 представляет собой Гис или Лиз, для получения олигонуклеотидов, используемых в качестве затравок для амплификации методом PCR новых последовательностей геномной ДНК или кДНК, кодирующих белки, обладающие дельта-5,7 стерин, дельта-7 редуктазной активностью.
Е - Экспрессия белка дельта-7 Ред в дрожжах
а) Конструирование индуцируемого вектора экспрессии дельта-7/У8 в дрожжах
Делеция некодирующих зон кДНК р22 была осуществлена методом амплификации PCR с использованием следующих специфических олигонуклеотидов:
5' ЦГЦГГАТЦЦА ТГГЦГГАГАЦ ТГТАЦАТТЦ 3' (SEQ ID №4) и
5' ЦАГГТТАЦЦТ ЦААТАААТТЦ ЦГГААТГ 3' (SEQ ID №5),
которые были определены для ввода участка рестрикции BamH I непосредственно после исходного кодона и участка Kpn I непосредственно ниже стоп-кодона.
кДНК была амплифицирована, используя 1 нг плазмиды “кДНК дельта-7ред/рUC9N” в присутствии 2-х единиц Pfu ДНК-полимеразы и 0,2 мкМ каждой из вышеуказанных затравок с соблюдением следующих условий амплификации: +94°С, 10 с; +52°С, 50 с; +74°С, 90 с; 33 цикла с использованием набора PCR Stratagene.
Был получен фрагмент примерно из 1300 п.о., с последующим расщеплением ферментами рестрикции ВаmН I и Крn I и включением в участки ВаmН I и Крn I челночного вектора Е. Coli/S. cerevisiae pYeDP 1/8-2 (обозначение: V8), описание которого приводится у С.Cullin с соавторами (Gene, 65, 203-217, 1988 г.). V8 включает маркер селекции URA3 и содержит кассету экспрессии в дрожжах, содержащую промотор GAL10/CYC1 и терминаторную последовательность гена PGK. Полученный таким образом вектор, обозначаемый дельта-7/V8, позволяет выполнять индуцибельную экспрессию галактозой белка дельта-7 Ред.
б) Получение белка дельта-7 Ред
Дрожжевой штамм FY 1679 (Мата) был трансформирован с помощью полученной выше плазмиды дельта-7/V8 по методу, использующему литийацетат, описание которого приводится у D.Gietz с соавторами (процитированному выше).
Трансформированные дрожжи были культивированы при температуре +27°С в описанной выше селективной среде SGI, но в которой концентрация глюкозы составляет 5 г/л, до получения насыщенности клеточной плотности (DО600нм=12). Затем культура разбавляется добавлением объема полной среды YP (10 г/л дрожжевого экстракта (Difco) и 10 г/л бактопептона (Difco)), с последующим добавлением этанола (1/5% по объему) в качестве источника углерода. Когда рост позволил достичь клеточной концентрации не менее 7×107 клеток/мл, проявление дельта-7 Ред было индуцировано добавлением галактозы при концентрации 20 г/л.
Индуцирование было осуществлено в минимальной селективной среде SLI, соответствующей среде SGI, в которой глюкоза заменяется галактозой (20 г/л), вплоть до получения клеточной концентрации в 2×107 клеток/мл.
в) Ферментный тест In vitro дельта-5,7 стерин, дельта-7 редуктазной активности
Экспрессия белка дельта-7 Ред была выявлена с помощью ферментного теста, описанного М. Taton с соавторами (Biochem. Bioph. Res. Commun., 181, 465-473, 1991 г.), однако без системы регенерации НАДФН, с микросомными или цитозольными клеточными препаратами вышеуказанных индуцированных дрожжей.
Клеточные фракции были получены путем механического дробления индуцированных клеток и изоляции фракций методом ультрацентрифугирования, как описано у Р.Urban с соавторами (Eur. J.Biochem., 222, 843-850, 1994 г.). Клетки собирают и затем дважды промывают с использованием буфера. ТЕ-КСl (Трис-НСl 50 мМ, рН 7,4; ЭДТА 1 мМ, КСl 0,1 М) и суспендируют в буфере лизиса ТЕ-сорбит 0,6 М. Затем добавляются стеклянные шарики диаметром 0,45-0,5 мм (Braun) вплоть до достижения поверхности клеточной суспензии, с последующим взбалтыванием в течение 5 мин при температуре +4°С. Клеточный лизат на поверхности собирают, а стеклянные шарики трижды промывают с использованием лизисного буфера. Лизат и промывки объединяют и центрифугируют при 20000 g в течение 13 мин при температуре +4°С для удаления митохондриальных фракций. Собранную надосадочную жидкость центрифугируют в течение 1 ч при 100000 g при температуре +4°С. Осадок, содержащий микросомную фракцию и надосадочную жидкость, которая представляет собой цитозольную фракцию, собирают раздельно.
Полученную микросомную фракцию или цитозольную фракцию соответственно инкубируют в течение 90 мин при температуре +37°С в буфере Трис/НСl 100 мМ при рН 7,3, содержащем в качестве субстрата 7-дигидрохолестерин 150 мкМ, эмульгированный с помощью твина 80 (1,5 г/л) и в присутствии НАДФН 2 мМ. Стерины экстрагируют путем добавления 3-х объемов смеси метанола и дихлорметана (50:50 по объему), после чего выполняют анализ методом CPG, сравнивая со стандартными продуктами.
Образование холестерина (TR=15,887 мин) на основе 7-дегидрохолестерина (TR=16,528 мин) показано на фиг. 4 с микросомной фракцией (3,5 мг/мл по белку), полученной как указано выше, на основе дрожжей FY 1679, трансформированных вектором дельта-7/VS, индуцированных в течение 3 ч, и эндогенные стерины которых отличаются более продолжительным временем задерживания (TR=16,682 мин для эргоста 5-22 диен 3-ола; TR=17,249 мин для эргостерина и TR=17,664 мин для эргоста 5-ен 3-ола).
Приведенные результаты свидетельствуют о том, что белок дельта-7 Ред, с одной стороны, экспрессируется в трансформированных дрожжах и, с другой стороны, обладает дельта-5,7 стерин, дельта-7 редуктазной активностью.
ПРИМЕР 2: Восстановление in vivo эндогенных стеринов дрожжей, ненасыщенных в положении С-7.
Дрожжевые штаммы, основные стерины которых обладают двойной связью в положении С-5,7, были трансформированы вектором дельта-7/V8, полученным в Примере 1, а затем были культивированы и индуцированы, как указано в Примере 1. Эндогенные стерины, профиль которых анализируется методом CPG, были экстрагированы и очищены методом RP-HPLC, как описано в Примере 1, с использованием препаративной колонки С18 (100×4,6 мм), а затем идентифицированы ИК-, УФ-, СМ- и ЯМР-методами. Соответственно были использованы следующие три штамма:
- Штамм FY1679, описанный в Примере 1;
- Мутантный штамм егд5, обозначаемый PLC 1051, отличающийся нехваткой стерин С-22 дезатуразы, который был получен скрещиванием штамма FY1679 и оригинального штамма ро15, описание которого приводится у S.W.Morzahn с соавторами (J. Gen. Microbiol., 72, 339-348, 1972 г.) и который накапливает эргоста 5,7-диен 3-ол;
- Двойной мутантный штамм еrg4,5, обозначаемый PLC 1451, отличающийся нехваткой стерин С-22 дезатуразы (еrg5) и стерин С-24 (28) редуктазы (еrg4), был получен скрещиванием штамма FY1679 и штамма ро15, описание которого приводится у S.W.Morzahn с соавторами (указано выше), получившего спонтанную устойчивость к нистатину в результате систематического скрининга дрожжей с целью поиска стериновых мутантов, и который накапливает эргоста 5,7,24 (28) триен 3-ол. Полученный в результате гаплоидный штамм, содержащий двойную мутацию еrg4, еrg5, растет в присутствии галактозы и неспособного к брожению субстрата, и ауксотрофен к урацилу, триптофану и гистидину. Штаммы PLC 1051 и PLC 1451 были поданы в НККМ 10 февраля 1995 г. под номерами 1-1536 и 1-1537 соответственно.
Основные редуцированные стерины, соответственно идентифицированные на основе трех вышеуказанных трансформированных штаммов, приведены в нижеследующей таблице:
ПРИМЕР 3: Получение прегненолона in vitro путем расщепления эндогенных стеринов дрожжей, восстановленных в положении С-7
Прегненолон получают, прибегая к ферментному тесту расщепления боковой цепи холестерина in vivo, описание которого приводится у Wada с соавторами (Arch. Biochem. Biophys., 290, 376-380, 1991 г.), в котором 260 мкМ стерина, восстановленного в положении С-7, полученного в Примере 2, подвергают инкубации в 150 мкл фосфатного буфера 10 мМ, рН 7,4, Nad 100 мМ, твин 20 0,3% в присутствии 140 нМ адренодоксинредуктазы, 1,16 мкМ адренодоксина и 0,68 мкМ цитохрома P450SCC животного происхождения, полученного из надпочечных желез быка, как описано, например, у D.W.Seybert с соавторами (J. Biol. Chem., 254, 12088-12098, 1979 г.).
Реакция запускается путем добавления 150 мкМ НАДФН. После инкубации в течение 80 мин при температуре +37°С реакцию прекращают добавлением одного объема смеси метанола и дихлорметана (50:50 по объему). Стерины экстрагируют методом CPG, как указано в Примере 1.
На фиг. 5 показано соответственно, что эргоста 5-ен 3-ол (фиг. 5а), эргоста 5,24(28) диен 3-ол (фиг. 5в) или эргоста 5,22 диен 3-ол (фиг. 5с) является субстратом цитохрома P450SCC и ведет к получению продукта, обладающего временем задерживания (TR), идентичным с TR прегненолона, полученного в тех же условиях путем расщепления холестерина.
Полученные результаты свидетельствуют о том, что трансформированные дрожжи, экспрессирующие дельта-7 Ред, накапливают стерины, используемые непосредственно для получения прегненолона путем биологического окисления in vitro.
ПРИМЕР 4: Конструирование дрожжевых штаммов, производящих in vivo прегненолон или его сложный уксусноэтиловый эфир
А - Конструирование штамма ELR01, содержащего кассету экспрессии дельта-7 Ред A. thaliana, интегрированной в локус ADE2 гаплоидного штамма FY1679 матинг типа a(FY1679 Мата)
а) Конструирование интегративной плазмиды рАПдельта-7 (рАDΔ7)
Построение плазмиды pADΔ7 проводилось, как показано на фиг. 6. Фрагмент BglII (2244 п.о.), содержащий ген ADE2 S. cerevisiae, был выделен из плазмиды pASZ 11 (A.Stotz с соавторами. Gene, 95, 91, 1990 г.) и включен в вектор pBluescriptII KS+ (Stratagene) в сайт BamHI множественного участка клонирования.
Полученная плазмида, обозначаемая pBS-ADE2, была затем линеаризована в уникальном и дефосфорилированном сайте Stu I.
Фрагмент из примерно 2,44 тыс. пар оснований, содержащий промотор GAL10/CYCl, кодирующую фазу дельта-7 Ред (стерин Д7 редуктазы) и терминатор PGK (tPGK), был получен из плазмиды дельта-7/V8, полученной в Примере 1Е методом PCR, с использованием в качестве затравок нижеследующих олигонуклеотидов:
5' ГАТТАЦГЦЦА АГЦТТТТЦГА ААЦ 3' (SEQ ID №6) и
5' АГАТЦТТГАГ ААГАТГЦГГЦ ЦАГЦААААЦ 3' (SEQ ID №7)
которые были определены для конъюгации соответственно с концом 3' гена терминатора tPGK и концом гена URA3. При этом были использованы плазмида дельта-7/VS в качестве матрицы (80 нг), вышеперечисленные олигонуклеотиды (по 0,5 мкМ каждый), нативная Pfu ДНК-полимераза (1 единица в буфере, рекомендуемом фирмой Stratagene), при следующих условиях амплификации: 35 циклов; 1 мин при температуре +95°С; 5 с при +95°С; 30 с при +56°С; 4 мин 30 с при +70°С). Затем полученный фрагмент амплификации был клонирован с четким ограничением в вышеуказанной линеаризованной плазмиде pBS-ADE2 для получения плазмиды рАDΔ7, в которой фрагмент NotI-PstI из примерно 4720 п.о. содержит ген ADE2, не прерванный кассетой экспрессии дельта-7 Ред.
б) Хромосомная интеграция в дрожжевой штамм FY1679 Мата
Фрагмент NotI-PstI (4720 п.о.), выделенный из плазмиды рАDΔ7, расщепленной ферментами рестрикции NotI и PstI, был введен в дрожжи FY1679 Мата путем трансформации по методу, использующему литийацетат, описание которого приводится у D. Gietz с соавторами (процитированного выше).
Трансформанты, интегрировавшие указанный фрагмент путем гомологичной рекомбинации, были отобраны по их устойчивости к нистатину, причем это явление вызвано экспрессией дельта-7 Ред с превращением дрожжевых дельта-5,7 стеринов в дельта-5 стерины.
Трансформированные клетки были подвергнуты инкубации в течение 4 ч при температуре +28°С в полной среде YP, описание которой приведено в Примере 1Е, содержащей глюкозу (20 г/л) и дополнительно аденин (20 мг/л). Затем они были концентрированы и нанесены на минимальную SLI-агаровую среду (1 г/л бактоказаминокислот; 7 г/л “дрожжевого азотистого основания”; 20 г/л галактозы; 20 мг/л аденина; 20 г/л агара), а затем инкубированы в течение одной ночи при температуре +28°С для индукции экспрессии гена дельта-7 Ред. Отсутствие урациловой добавки позволяет ограничить рост клеток. Клоны были собраны, сгруппированы и нанесены на полную среду YP, содержащую галактозу (20 г/л) и дополнительно аденин (20 мг/л), и в присутствии возрастающих концентраций нистатина (0 мкг/мл, 1 мкг/мл, 2 мкг/мл, 5 мкг/мл, 20 мкг/мл соответственно). На четвертый день было получено примерно двадцать клонов, выросших при концентрации 5 мкг/мл нистатина. Двенадцать из указанных клонов были перенесены на емкости с минимальной WO-средой (7 г/л “дрожжевого азотистого основания” без аминокислот; 20 г/л глюкозы), обогащенной урацилом, лейцином, триптофаном, гистидином и аденином (по 20 мг/л каждого).
Ауксотрофность к аденину, вызванная нарушением гена ADE2, была впоследствии подтверждена отсутствием роста на вышеуказанной минимальной WO-среде, обогащенной урацилом, лейцином, триптофаном, гистидином, но лишенной аденина.
Присутствие кассеты экспрессии в геноме дрожжей было проверено путем амплификации методом PCR на основе геномной ДНК полученных клонов с использованием затравок, включающих указанные выше последовательности SEQ ID №6 и SEQ ID №7.
Функциональность интегрированного гена дельта-7 Ред была подтверждена выполнением анализа методом CPG содержания стеринов, накопленных в дрожжах и экстрагированных омылением щелочью в соответствии с методикой, описанной в Примере 1Б, с использованием 5-метровой капиллярной колонки SE-30 (Alltech).
Проведенный анализ выявил модифицированный профиль, содержащий насыщенные стерины в положении С-7 в тех случаях, когда клоны культивировались в присутствии галактозы. Полученный штамм, обозначаемый ELR01, накапливает эргоста 5 ен 3-ол и эргоста 5,22 диен 3-ол вместо эргоста 5, 7, 22 триен 3-ола (эргостерина), основного стерина исходного штамма FY1679, как было показано на фиг. 7.
Полученный таким образом штамм ERL01 экспрессирует ген дельта-7 Ред в тех случаях, когда он культивируется в присутствии галактозы, вследствие траскрипционного контроля промотором GAL10/CYC1. Хотя единица экспрессии дельта-7 Ред имеет то же транскрипционное направление, что и ген ADE2, никакой экспрессии дельта-7 Ред не выявляется при анализе содержания стеринов методом CPG, когда культивирование осуществляется в присутствии глюкозы вследствие репрессии промотора GAL10/ CYC1.
Б - Конструирование штамма CDR01, содержащего кассету экспрессии зрелой формы бычьей адренодоксинредуктазы (ADRm), интегрированной между локусами LEU2 и SPL1 гаплоидного штамма FY1679 матинг типа альфа (мат альфа)
а) Конструирование челночного вектора Е. coli - S. cerevisiae V13
Вектор V13 соответствует вектору V8 (С. Cullin с соавторами, процитированные ранее), включающему маркер отбора URA3 и кассету экспрессии в дрожжах, содержащую промотор GAL10/CYC1 (pG/C), в котором дополнительный участок Sal I (Sa) был введен во множественном участке клонирования, в соответствии со схемой построения, приведенной на фиг. 8.
Вектор V8 был расщеплен ферментами рестрикции Hind III и BamH I, а полученный фрагмент BamH I - Hind III (1722 п.о.), содержащий ген URA3 и промотор GAL10/CYC1 (обозначаемый далее “ура-гал”), был субклонирован между соответствующими участками вектора pUC18 (Pharmacia), расщепленного ферментами рестрикции Hind III и BamH I.
Фрагмент “ура-гал” был затем подвергнут амплификации методом PCR на основе 30 нг полученной плазмиды pUC18/“ура-гал”, денатурированной в течение 30 с при температуре +95°С при следующих условиях: 30 циклов; 5 с при температуре +86°С; 10 с при +95°С; 40 с при 38°С; 5 с при +55°С и 2 мин при +74°С, 2 единицы Taq ДНК-полимеразы (Boehrunger) в буфере изготовителя и 1 мкМ каждой из затравок, включающих нижеследующие последовательности нуклеотидов:
5' ГГГГАТЦЦГТ ГГТЦГАЦГТА АТТТАГТГТГ ТГТАТТТГТГ ТТГЦГ 3' (SEQ ID 8) и
5' ГТААААЦГАЦ ГГЦЦАГТ 3' (SEQ ID №9)
Затравка SEQ ID №8 включает один участок ВаmН I ГГАТЦЦ, идентичный участку фрагмента “ура-гал”, 3 последовательных нуклеотида на участке ВаmН I, не гибридизирующихся с матрицей, один участок Sal I ГТЦГАЦ и одну последовательность, гомологичную последовательности промотора GAL10/CYC1. Затравка SEQ ID №9 конъюгируется с предыдущей последовательностью участка Hind III множественного участка клонирования вектора pUC18. Фрагмент Hind III - BamH I из 1722 п.о., полученный после амплификации, был расщеплен Xho I м Barn HI, высвобождая фрагмент из 254 п.о., содержащий промотор GAL10/CyC1 (pG/C), который был затем субклонирован в векторе V8, расщепленной ферментами рестрикции BamH I и Xho I.
Полученный в результате вектор V13 содержит участки рестрикции, позволяющие легко субклонировать кДНК, кодирующие зрелую бычью адренодоксинредуктазу (ADRm), зрелый бычий адренодоксин (ADXm) и бычий цитохром P450SCC.
На основе вектора V13 были соответственно получены, как указано ниже, вектор V13-ADR, вектор V13-ADX и вектор V13-SCC10:
α) Конструирование вектора V13-ADR
Один фрагмент Sal I - Крn I из 1478 п.о., содержащий кДНК, кодирующую ADRm, был выделен из плазмиды pGBADR-2, описание которой приводится в Примере 25 патентной заявки ЕЭС ЕР 340878, и субклонирован в соответствующие участки вектора V13 для получения вектора V13-ADR.
β) Конструирование вектора V13-ADX
Фрагмент Sal BamH I из 390 п.о., содержащий кДНК, кодирующую ADXm, был выделен из плазмиды pGBADX-1, описание которой приводится в Примере 23 патентной заявки ЕЭС ЕР 340878, и субклонирован в соответствующие участки вектора VI3 для получения вектора V13-ADX.
γ) Конструирование вектора V13-SCC10
Фрагмент Sal I - EcoR I из 1554 п.о., содержащий кДНК, кодирующую P450SСС, был выделен из плазмиды pGBSCC-10, описание которой приводится в Примере 6 патентной заявки ЕЭС ЕР 340878, и субклонирован в соответствующие участки вектора VI 3 для получения вектора V13-SCC10.
в) Конструирование интегративных плазмид pCD62-1 и pCD62-2
Конструирование плазмид pCD62-1 и pCD62-2 выполнялось, как показано на фиг. 9.
α) Конструирование плазмиды pFL26CD
Участок Not I был введен в плазмиду pFL26 (N. Bonneaud с соавторами. Yeast, 7, 609-615, 1991 г.), в межгенную зону, разделяющую ген leu2 от конца 5' гена spl1 (обозначаемого sр11Δ) (С.Kolman с соавторами, J. Bacteriol., 175, 1433, 1993 г.), по нижеследующей методике.
Два фрагмента ДНК из 704 п.о. и 347 п.о., содержащие соответственно конец 5' гена ieu2 и конец 3' гена sрl1Δ, были синтезированы методом PCR с помощью затравок, обладающих нижеследующими последовательностями нуклеодидов:
5' ТТГААГГТЦ ААЦАТЦААТГ ГАТТТ 3' (SEQ ID №10) и
5' ГТГТГГЦГГЦ ЦГЦЦТЦЦТТГ ТЦААТАТТАА ТГТТАААГ 3' (SEQ ID №11)
для амплификации фрагмента из 704 п.о. и последовательностей нуклеотидов
5' ЦААГГАГГЦГ ГЦЦГЦЦАЦАЦ АААААГТАГ ГТГТ 3' (SEQ ID №12) и
5' ТЦТГЦТТЦЦЦ ТАГААЦЦТТЦ ТТАТГ 3' (SEQ ID №13)
для амплификации фрагмента из 347 п.о.
Затравки SEQ ID №11 и SEQ ID №12 включают последовательность ГГЦГГЦЦГ, соответствующую участку Not I, и в которой 3 основания не конъюгируются с матрицей. Затравка SEQ ID №10 конъюгируется с последовательностью, расположенной на 536 п.о. выше стоп-кодона leu2, а затравка SEQ ID №13 включает последовательность, расположенную на 194 п.о. выше стоп-кодона sрl1Δ.
Для начала фрагменты из 704 п.о. и 347 п.о. амплифицируют методом PCR с использованием в качестве матрицы плазмиды pFL26 и в качестве фермента - Pfu ДНК-полимеразу, в обычных условиях, рекомендуемых поставщиком (Stratagene).
Оба полученных амплифицированных фрагмента конъюгируются с 20 п.о. на уровне концов, генерированных затравкой SEQ ID №11 (фрагмент из 704 п.о.) и затравкой SEQ ID №12 (фрагмент из 347 п.о.) на основе конца 5'; указанные 20 п.о. соответствуют 20-ти первым нуклеотидам каждой из затравок соответственно.
Продукт, полученный в результате конъюгации фрагментов ДНК из 704 п.о. (1 нг) и из 347 п.о. (2 нг), был амплифицирован с использованием затравок SEQ ID №10 и SEQ ID №13 с соблюдением следующих условий: 30 циклов; 10 с при температуре +95°С, 5 с при +60°С, 1 мин при +45°С, 5 с при +65°С и 2 мин при +72°С, за которыми следует один цикл из 7 мин при температуре +72°С; 50 пмоль каждой затравки и 1 единица Pfu ДНК-полимеразы в 50 мкл реакционного буфера (Stratagene). В результате был получен амплифицированный фрагмент из 1031 п.о., включающий участок разрыва Not I. Затем указанный фрагмент был расщеплен ферментами Bst XI и Nsi I, а полученный фрагмент из 920 п.о., содержащий участок Not I, был включен на место исходного фрагмента Bst XI - Nsi I плазмиды pFL26 для получения плазмиды pFL26CD, карта которой представлена на фиг. 9а.
β) Конструирование плазмиды рСD60
 Получение плазмиды рDP10036
Получение плазмиды рDP10036
Фрагмент Sal I - BamH I из 390 п.о., содержащий кДНК, кодирующую зрелый бычий адренодоксин (ADXm), был выделен из плазмиды V13-ADX, а затем субклонирован на участках Sal I - Bgl II множественного участка клонирования плазмиды pTG10033, по бокам которой находятся индуцибельный промотор GAL10/CYC1 и терминатор terPGK. Плазмида pTG10033, карта которой представлена на фиг. 18 и которая соответствует вектору экспрессии pTG10031 (фиг. 17), содержащему промотор CYC1 и terPGK, в котором промотор CYC1 был заменен на промотор GAL10/CYC1, была получена в соответствии с методикой, описание которой приводится ниже.
Полученная таким образом плазмида, обозначаемая pDP10034, содержит кассету экспрессии ADX, то есть ген, кодирующий ADXm, под транскрипционным контролем GAL10/CYC1 и terPGK. В дальнейшем термин “кассета экспрессии” будет использоваться для всех генов, находящихся в транскрипционной зависимости от GAL10/CYC1 и terPGK.
Фрагмент Hind III из 3593 п.о., содержащий маркер отбора URA3 и кассету экспрессии ADR, был выделен из плазмиды V13-ADR, расщепленной ферментом рестрикции Hind III, а затем введен в соответствующий участок плазмиды pDP10034, расщепленной ферментом рестрикции Hind III. Полученная плазмида, обозначаемая pDP10036, содержит кассеты экспрессии ADX и ADR, отделенные одна от другой маркером URA3 (фиг. 9б).
 Получение плазмиды рСРD6О
Получение плазмиды рСРD6О
Фрагмент Afl III - Асc I из 2770 п.о., содержащий кассету ADR, был выделен путем частичного расщепления плазмиды pDP10036 ферментами рестрикции Afl III и Асc I, с четким ограничением за счет обработки фрагментом Кленова ДНК-полимеразы I, и субклонирован после лигирования с четким ограничением на участке Sma I плазмиды pBlue-Script KS+ (Stratagene). В полученной плазмиде, обозначаемой pCD60, кассета экспрессии ADR ограничена с двух сторон участками Not I, один из которых располагается на 209 п.о. выше участка лигирования Afl III/Sma I и происходит из субклонированного фрагмента, а другой происходит из множественного участка клонирования (SCM1) плазмиды pBlue-Script KS+ (фиг. 9б).
γ) Конструирование плазмид pCD62-1 и pCD62-2
Фрагмент Not I из 2558 п.о., выделенный из плазмиды pCD60, расщепленной ферментом рестрикции Not I, был затем субклонирован в уникальный участок Not I плазмиды pFL26CD. В зависимости от направления встраивания фрагмента были получены две плазмиды, обозначаемые pCD62-1 и pCD62-2 (фиг. 9в).
В плазмиде pCD62-l кассета экспрессии ADR ориентирована в траскрипционном направлении гена leu2, в то время как указанное ориентирование в случае плазмиды pCD62-2 имеет обратное направление.
Для последующих конструирований была выбрана плазмида pCD62-1.
в) Хромосомная интеграция в дрожжевой штамм FY1679 (Матальфа)
Плазмида pCD62-1 включает зоны, гомологичные хромосомному локусу штамма FY1679. Указанные зоны соответствуют фрагментам Вg1 II - Сlа I из 1060 п.о. (A), EcoR I - Not I из 707 п.о. (В) и Not I - Вg1 II из 602 п.о. (С) соответственно, как показано на фиг. 10.
Зона, соответствующая фрагменту С1а I - EcoR I из 486 п.о. плазмиды pCD62-l, была подвергнута делеции в штамме FY1679, что связано с ауксотрофией указанного штамма по отношению к лейцину (штамм LEU2-) (R.S.Sikorski с соавторами. Genetics, 122, 19, 1989 г.).
Плазмида pCD62-l была линеаризована расщеплением ферментом рестрикции Хbа I, участок разрыва которым располагается вне гомологичных зон, после чего она была введена путем трансформации в штамм FY1679 (Матальфа) с помощью метода, использующего литийацетат (D. Gietz с соавторами, процитированные выше).
Способность репарировать клеточную ДНК с помощью дрожжей (“gap repair”) и отбор рекомбинантов, обладающих фенотипом LEU2+, позволили отобрать на первом этапе два типа рекомбинантов: первый тип получен в результате гомологичных рекомбинаций на уровне фрагментов А и В, а второй тип был получен в результате гомологичных рекомбинаций на уровне фрагментов А и С. Только последний тип рекомбинации обеспечил интеграцию кассеты экспрессии ADR в дополнение к восстановлению фенотипа LEU2+.
С целью отбора указанного второго типа клона был выполнен скрининг методом PCR с использованием вышеуказанной затравки SEQ ID №10 и затравки, содержащей следующую последовательность нуклеотидов:
5' ТАЦАТТАГГТ ЦЦТТТГТАГЦ 3' (SEQ ID №14)
с тем, чтобы одновременно подтвердить и присутствие, и правильность локализации кассеты экспрессии ADR в геноме штамма FY1679 (Матальфа).
В указанном скрининге затравка SEQ ID №14 конъюгируется исключительно с последовательностью, кодирующей ADRm, а затравка SEQ ID №10 конъюгируется с хромосомной последовательностью (фиг. 10).
Реакция амплификации была произведена с использованием в качестве матрицы геномной ДНК (20 нг), выделенной из штамма FY1679 (Матальфа) (С. Hoffman с соавторами, Gene, 57, 267, 1987 г.), одной единицы Taq ДНК-полимеразы (Boehrunger), 50 пмоль каждой из затравок и 30 циклов методом PCR (10 с при температуре +95°С, 1 мин при +55°С, 3 мин при +72°С), в обычных условиях, рекомендуемых поставщиком.
Амплификация привела к выделению фрагмента из 2,9 тыс. п.о., в случае интегрирования кассеты экспрессии. В противном случае не было выявлено никакого продукта амплификации.
Отобранный таким образом штамм FY1679 (Матальфа), содержащий интегрированную кассету экспрессии ADR, был обозначен CDR01.
Экспрессия ADR указанным штаммом была выявлена на основе цитозольных клеточных фракций, полученных в соответствии с протоколом, описание которого приводится в Примере 1Е, путем иммунообнаружения белка, узнаваемого антителами анти-ADR.
Функциональность ADR, экспрессируемой штаммом CDR01, была подтверждена в результате проведения ферментного теста расщепления боковой цепи холестерина in vitro, описание которого приводится в Примере 3, в котором очищенная ADR (0,28 пмоль) была заменена на цитозольную клеточную фракцию штамма CDR01 с содержанием 100 мкг общих белков. При этом наблюдалась биоконверсия холестерина в прегненолон порядка 25%, что сравнимо с уровнем конверсии, полученной с очищенной ADR.
В - Конструирование диплоидного штамма ЕС01, коэкспрессирующего дельта-7 Ред А. талианы и ADRm
Диплоидный штамм ЕС01 был получен скрещиванием гаплоидных штаммов CDR01 и ELR01, полученных, как указано выше, в соответствии с протоколом, описание которого приводится у G. Sprague с соавторами (Methods in Enzymology, 194, 77, 1991 г.).
Первый отбор в описанной выше минимальной селективной среде, обогащенной урацилом, триптофаном и гистидином (по 20 мг/л каждого), но лишенной лейцина, позволил изолировать диплоидные клоны LEU2+ (прототрофный признак, свидетельствующий о присутствии кассеты экспрессии ADR). Затем указанные клоны подверглись тестированию на устойчивость к нистатину при 5 мкг/мл (признак устойчивости, свидетельствующий о присутствии кассеты экспрессии дельта-7 Ред) на твердой синтетической SLI-агаровой среде, описание которой приводилось выше.
Таким образом, среди клонов, устойчивых к нистатину, был произвольно выделен штамм, обозначаемый ЕС01.
Г - Конструирование штамма EC01/pCD63, продуцирующего прегненолон и прегненолон 3-ацетат
а) Конструирование плазмиды экспрессии pCD63
Конструирование плазмиды pCD63 проводилось, как показано на фиг. 11.
Фрагмент Not I из 4961 п.о., содержащий кассету экспрессии ADX, маркер отбора URA3 и кассету экспрессии ADR, был выделен из плазмиды pDP10036, полученной, как указано выше, и расщеплен ферментом рестрикции Not I, а затем клонирован на участке Not I множественного участка клонирования плазмиды pFL45L (N. Bonneaud с соавторами. Yeast, 7, 609, 1991). Полученный таким образом вектор, обозначаемый pDP10037, представлен на фиг. 11.
С одной стороны, плазмида pDP10037 была линеаризована расщеплением ферментом TthlllI, участок расщепления которым располагается в гене, кодирующем ADRm.
С другой стороны, фрагмент Pvu II - EcoRV из 3476 п.о., содержащий кассету экспрессии P450SCC и конец 5' маркера URA3, был очищен на основе плазмиды V13-SCC10, полученной ранее и расщепленной ферментами рестрикции Pvu II и EcoRV.
Обе линейные, соответственно полученные ДНК обладают гомологичными зонами, которые соответствуют, с одной стороны, концу 5' гена URA3 и промотору GAL10/CYC1 и, с другой стороны, терминатору terPGK, как показано на фиг. 11а.
Эти два фрагмента были затем введены в дрожжевой штамм FY1679 (Мата) путем котрансформации методом, использующим литийацетат (D.Gietz с соавторами, процитированные ранее).
Нижеследующая селекция прототрофных рекомбинантов для урацила и триптофана (URA3+ TRP1+) позволила выделить клоны, в которых двухнитевый разрыв, генерированный поглощением ферментом рестрикции Tth111I, был репарирован вследствие встраивания кассеты экспрессии P450SCC путем гомологичной рекомбинации.
Селекция рекомбинантов (UРА3+, TRP1+) была осуществлена на минимальной селективной среде WO, обогащенной лейцином, гистидином и аденином (по 20 мг/л каждого), но лишенной урацила и триптофана. На основе 50 объединенных клонов общая ДНК была экстрагирована методом, описание которого приводится у С.Hoffman с соавторами (Gene, 57, 267, 1987 г.), а затем введена электропорацией в штамм Е. coli XL1-Blue (Stratagene). Клоны, трансформированные плазмидой, генерированной “gар repair”, были селекционированы на богатой среде LB (триптон 1%, экстрагированный из дрожжей 0,5%, NaCl 1%), содержащей 50 мг/л ампициллина. На основе одного из селекционированных клонов по методу, описание которого приводится у J. Sambrook с соавторами (Molecular Cloning, Cold Spring Harbor Laboratory Press, 1989 г.) была экстрагирована плазмида, обозначаемая pCD63. Полученная плазмида рСD63 содержит кассеты экспрессии ADX и P450SCC, отделенные одна от другой маркером селекции URA3, как показано на рисунке 11б.
б) Трансформация штамма ЕС01 плазмидой pCD63
Плазмида pCD63 была введена в полученный выше штамм ЕС01 путем трансформации методом, использующим литийацетат (D.Gietz с соавторами, процитированные ранее). Затем трансформированные дрожжи были культивированы на минимальной среде WO, описанной выше и лишенной урацила, триптофана, аденина и лейцина, но с добавлением гистидина (из расчета 20 мг/л).
Таким образом был выделен штамм, обозначаемый EC01/pCD63. Образец штамма с обозначением EC01/pCD63 был подан 10 февраля 1995 г. в CNCM под номером 1-1538.
в) Получение in vivo прегненолона и прегненолон 3-ацетата
Штамм EC01/pCD63 был культивирован при температуре +28°С аэробиозом (130 об/мин) в 3-литровой эрленмейеровой колбе до достижения фазы стационарного роста (D0600 = от 12 до 13) в селективной среде SGI, описание которой приводится в Примере 1А, и в которой концентрация глюкозы составляет 5 г/л. Затем культуру разбавляют добавлением одного объема описанной выше полной среды YP и последующим добавлением этанола (0,5% по объему) в качестве источника углерода. По достижении новой фазы стационарного роста (D0600 = от 12 до 13) в культуру добавляют галактозу (20 г/л) в виде концентрированного раствора (500 г/л), с тем чтобы индуцировать одновременно экспрессию генов, кодирующих ADXm, ADRm, P450SCC и дельта-7 Ред, которые находятся соответственно под контролем промотора GAL10/CYC1.
Коэкспрессия четырех генов была выявлена путем анализа стеринов, накопившихся соответственно в клетках и в надосадочной жидкости культуры, в соответствии со следующей методикой.
По истечении 9 ч и 24 ч индукции были взяты пробы культуры по 50 мл. Для отделения клеток от культуральной среды каждая проба была подвергнута центрифугированию (4000 g, 10 мин, +4°С).
С одной стороны, клетки лизируют путем механического дробления в присутствии стеклянных шариков по методу, указанному в Примере 1Е. На основе полученного таким образом лизата межклеточные стерины затем экстрагируются путем добавления одного объема гексана.
С другой стороны, стерины, присутствующие в культуральной среде, экстрагируются непосредственно путем добавления одного объема гексана.
Содержание экстрагированных стеринов анализируют методом CPG, как указано в Примере 1, в сравнении со стандартными продуктами.
Результаты, полученные после 9 часов или после 24 часов индукции, представлены соответственно на фиг. 12а и 12б.
Фиг. 12а с результатами, полученными после 9 часов индукции, показывает:
- присутствие в клеточном лизате основного соединения, обладающего тем же временем задерживания, что и у стандартного прегненолонацетата (TR=11,8 мин), в то время как во времени задерживания прегненолона наблюдается лишь очень низкое пиковое значение (TR=9,9 мин). Незначительные количества редуцированных дрожжевых эндогенных стеринов в положении С-7 (эргоста 5-ен 3-ол и эргоста 5,22 диен 3-ол), идентифицированы соответственно при TR=18 мин и TR=17 мин. Омыление клеточного лизата перед анализом приводит к присутствию основного соединения, комигрирующего с прегненолоном. Это дает возможность подтвердить, что накопленное соединение, TR которого равен 11,8 мин, соответствует прегненолонацетату;
- значимое отсутствие в культуральной среде прегненолона или его ацетата.
Фиг. 12б с результатами, полученными после 24 часов индукции, показывает:
- присутствие в клеточном лизате незначительных количеств прегненолона (TR=10,2 мин) и прегненолонацетата (TR=12 мин), а также редуцированных дрожжевых эндогенных стеринов (TR=17 мин и TR=18 мин). Холестерин (TR=16,2 мин) является внутренним стандартом, добавленным перед экстрагированием;
- присутствие в культуральной среде в основном прегненолонацетата и незначительного количества прегненолона.
Опыты, проведенные параллельно со штаммом ЕС01, трансформированным контрольной плазмидой, такой как указанная ранее pFL45L, не показали никакого пикового значения, соответствующего прегненолону, свободному или в виде ацетата.
Выполненная таким образом идентификация стеринов показывает, что дрожжевой штамм EC01/pCD63 накопил прегненолон и прегненолонацетат, при полном отсутствии какого бы то ни было источника экзогенных стеринов, после индукции в присутствии галактозы со значительной продукцией после 9-часовой индукции.
Указанные результаты показывают, с одной стороны, эффективную мобилизацию редуцированных эндогенных стеринов в положении С-1 штамма ЕС01 и, с другой стороны, эффективность связывания реакции разреза боковой цепи эндогенных стеринов.
Приготовление Примера 4: Конструирование плазмиды pTG10033
1. Производная pUC19, обладающая новым множественным участком алонирования:
Вектор клонирования М13mр19 (С. Yanish-Peron с соавторами, Gene, 33, 103, 1985 г.) был подвергнут мутагенезу с использованием следующего олигонуклеотида:
5' ГЦГЦТЦАГЦГ ГЦЦГЦТТТЦЦ АГТЦГ 3' SEQ ID №15
для введения участка Not I в последовательность усеченного гена lac I и для получения плазмиды M13TG724.
Затем в участок EcoR I плазмиды M13TG724 был введен полилинкер, содержащий участки EcoR I, SnaB I и Not I, с использованием следующих олигонуклеотидов:
5' ААТТГЦГГЦЦ ГЦГТАЦГТАТГ 3' SEQ ID №16 и
5' ААТТЦАТАЦГ ТАЦГЦГГЦЦГЦ 3' SEQ ID №17
для получения плазмиды M13TG7244, в которой наблюдалась модификация вставки во время стадии амплификации. Вставка плазмиды M13TG7244 обладает следующей последовательностью нуклеотидов:
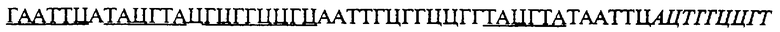
в которой участки EcoR I, SnaB I и Not I подчеркнуты, а участок lacZ плазмиды pUC19 выделен курсивом.
После расщепления плазмиды M13TG7244 ферментами рестрикции EcoR I и Sst I был введен полилинкер, содержащий участки Mlu I и Avr II, с использованием следующих олигонуклеотидов:
5' ЦААЦГЦГТЦЦ ТАГГ 3' SEQ ID №18 и
5' ААТТЦЦТАГТ АЦГЦГТТГАГ ЦТ 3' SEQ ID №19
После расщепления ферментом Pvu II полученный фрагмент Pvu II был субклонирован в pUC19 (С. Yanish-Perron с соавторами, процитированные выше) для получения плазмиды pTG7457 (фиг. 13).
2. Субклонирование терминатора PGK
pUC19 была расщеплена ферментами рестрикции ВаmН I и EcoR I и был введен новый полилинкер ВаmН I Sst I с использованием следующих олигонуклеотидов:
5' ГАТЦЦГЦАГА ТАТЦАТЦТАГ АТЦЦЦГГГАГАТ 3' SEQ ID №20,
5' АГАГЦТЦААГ АТЦТАЦЦЦГГ ГАТЦТАГАТГ АТАТЦТГЦГ 3' SEQ ID №21,
5' ЦТТГАГЦТЦТ АЦГЦАГЦТГГ ТЦГАЦАЦЦТАГГАГ 3' SEQ ID №22 и
5' ААТТЦТЦЦТА ГГТГТЦГАЦЦ АГЦТГЦГТ 3' SEQ ID №23
Таким образом, была получена плазмида pTG7453 (фиг. 14), которая затем была расщеплена ферментами рестрикции ВаmН I и Sst I. Участки полилинкера между ВаmН I и Sst I были введены в производную полученной выше плазмиды pTG7457 и расщепленной ферментами рестрикции ВаmН I и Sst I. Новая полученная плазмида содержит участки Pvu II, Hind III, BamH I, EcoR I, Xba I, Sma I, Bgl II, Sst I (=Sac I), Mlu I, Avr II, EcoR I, SnaB I, Not I, SnaB I, Pvu I.
Указанная новая плазмида была расщеплена ферментами рестрикции Bgl II и Hind III, а фрагмент Bgl II - Hind III, содержащий промотор PGK (R. A. Hitzeman с соавторами. Nucleic Acids Res., 10, 7791, 1982 г.; G. Loison с соавторами. Yeast, 5, 497, 1989 г.) был введен в нее для получения плазмиды PTG10014 (фиг. 15).
3. Субклонирование промоторов
а) Промотор CYC1
Участки полилинкера между BamH I и Sst I плазмиды pTG7453 были введены в производную плазмиды pTG745, как указано выше. Новая полученная плазмида была расщеплена ферментом рестрикции SnaB I, а затем для получения плазмиды pTG7503 был введен фрагмент Rsa I-Dra I из 456 п.о. плазмиды pEMBL8 (L. Dente с соавторами. Nucleic Acid Res., 11, 1645, 1983 г.), содержащий точку начала репликации фага fl.
Фрагмент BamH I Hind III из 0,78 тыс. пар оснований плазмиды pGBSCC-9, полученный в Примере 6 патентной заявки ЕЭС ЕР 0340378, содержащий промотор CYC1 S. cerevisiae, полилинкер и лактазный терминатор К. lactis, был субклонирован в плазмиде pTG7503, расщепленной ферментами рестрикции Hind III и BamH I для получения плазмиды pTG10004 (фиг. 16).
Затем участки Xho I и Mlu I промотора CYC1 были удалены методом направленного мутагенеза двухцепочечной ДНК плазмиды pTG10004 с использованием следующих олигонуклеотидов:
5' ГЦГГАТЦТГЦ ТЦГААГАТТГ ЦЦТГЦГЦТТ ГГГЦТТГАТЦ 3' SEQ ID 24
Полученная таким образом плазмида pTG10005 была затем расщеплена ферментами рестрикции Sal I и Xho I после чего был введен участок Mlu I, с использованием следующих олигонуклеотидов:
5' ТЦГАЦГГАЦГ ЦГТГГ 3' SEQ ID №25 и
5' ТЦГАЦЦАЦГЦ ГТЦЦ 3' SEQ ID №26
для получения плазмиды pTG10006.
б) Промотор GAL10/CYC1
Плазмида pYeDPl/8-2 (С.Cullin с соавторами. Gene, 203, 1988 г.) была раскрыта с помощью фермента рестрикции Xho I. Созданные связующие концы были свернуты с помощью фрагмента Кленова ДНК-полимеразы, а затем плазмида была вновь лигирована. Полученная таким образом плазмида pTG10010, в которой промотор GAL10/CYC1 уже не содержал участка Xho I, используется в качестве матрицы для амплификации методом PCR.
4. Конструирование вектора экспрессии рТG10031
Оставшаяся часть кодирующей последовательности lacZ была удалена в плазмиде pTG7503 с помощью направленного метода мутагенеза с использованием следующих олигонуклеотидов:
5' ТГГЦЦГТЦГТ ТТТАЦТЦЦТГ ЦГЦЦТГАТГЦГГТАТ 3' SEQ ID №27
для получения плазмиды рТG7549.
Промотор lacZ, присутствующий в плазмиде pTG7549, был затем подвергнут делеции с использованием следующих олигонуклеотидов:
5' ГГЦЦГЦАААА ЦЦААА 3' SEQ ID №28 и
5'АГЦТТТТГГТ ТТТГЦ 3' SEQ ID №29
которые затем вводятся в плазмиду, предварительно расщепленную ферментами рестрикции Not I и Hind III, и восстанавливают оба участка для получения плазмиды pTG7553.
Один фрагмент ВаmН I Mlu I, содержащий промотор CYC1, был получен на основе плазмиды pTG10006, расщепленной ферментами рестрикции ВаmН I и Mlu I, а один фрагмент Mlu I Hind III, содержащий промотор PGK, был изолирован из плазмиды pTG10015, расщепленной ферментами рестрикции Mlu I и Hind III. На указанных двух фрагментах было выполнено лигирование, а полученный продукт лигирования был введен в плазмиду pTG7553, предварительно расщепленную ферментами рестрикции Mlu I и Hind III.
Следующий олигонуклеотид:
5' ГАТЦТАТЦГА ТГЦГГЦЦГЦГ 3' SEQ ID №30,
гибридизированный со следующим олигонуклеотидом:
5' ЦГЦГЦГЦГГЦ ЦГЦАТЦГАТА 3' SEQ ID №31,
образующий линкер BamH I Mlu I, содержащий участки Cla I и Not I, был добавлен и подвергнут лигированию для получения вектора экспрессии pTG10031 (фиг. 17).
Фрагмент, амплифицированный методом PCR, полученный выше из плазмиды pYeDP1/8-2, был расщеплен ферментами рестрикции Cla I. и Sal I, а затем был введен в плазмиду pTG10031, предварительно расщепленную теми же ферментами рестрикции для получения плазмиды рТG10033 (фиг. 18).
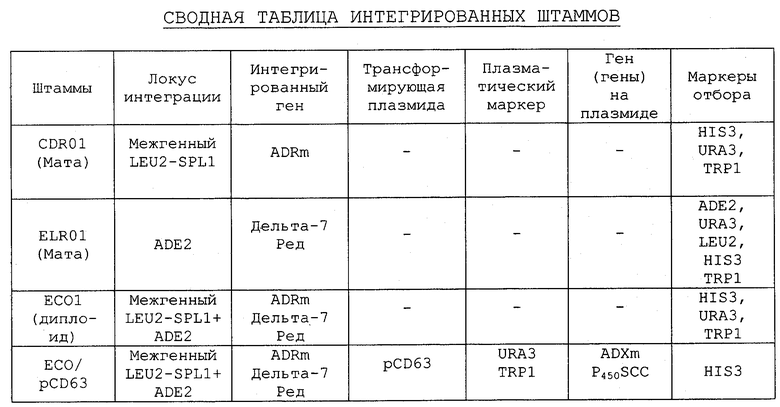





















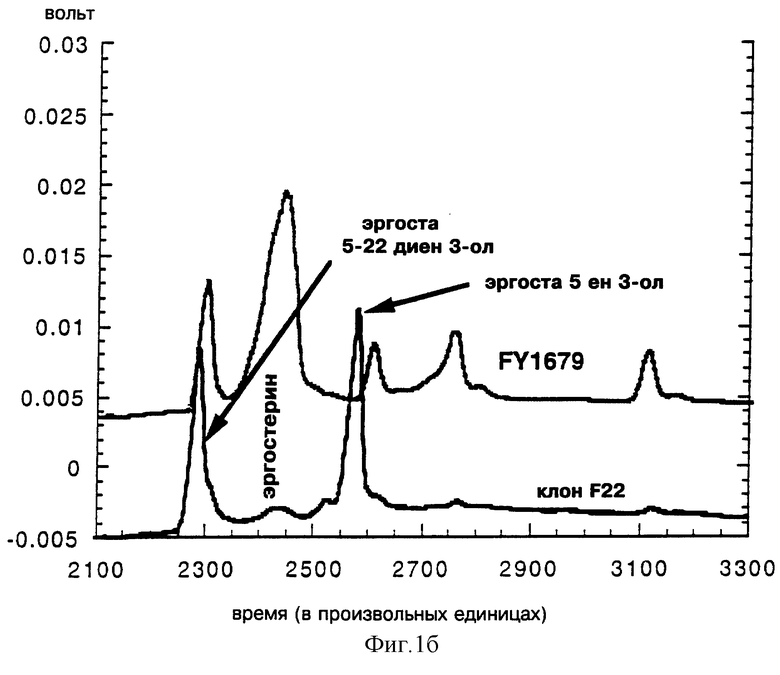
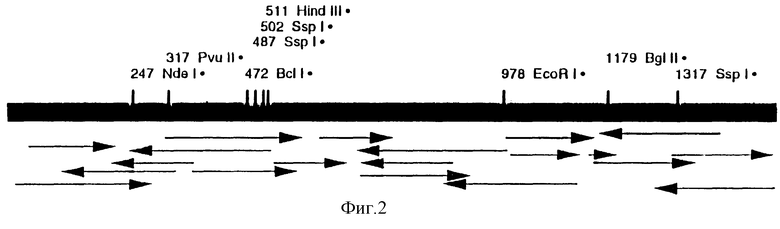
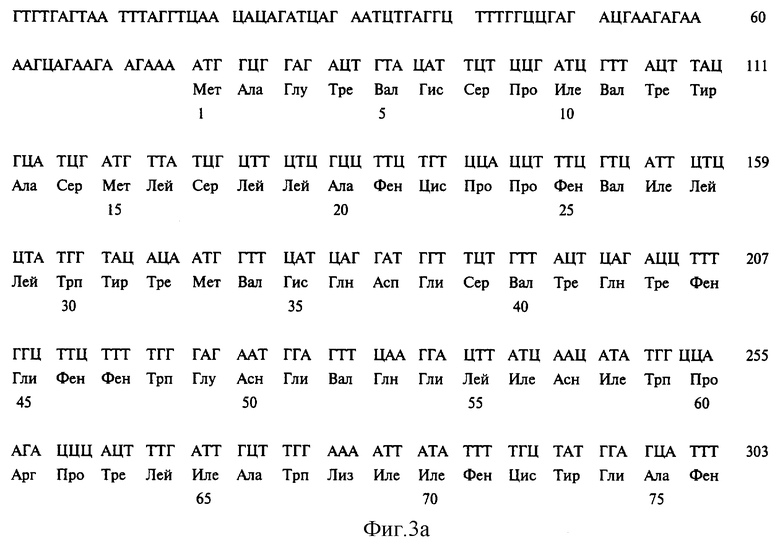





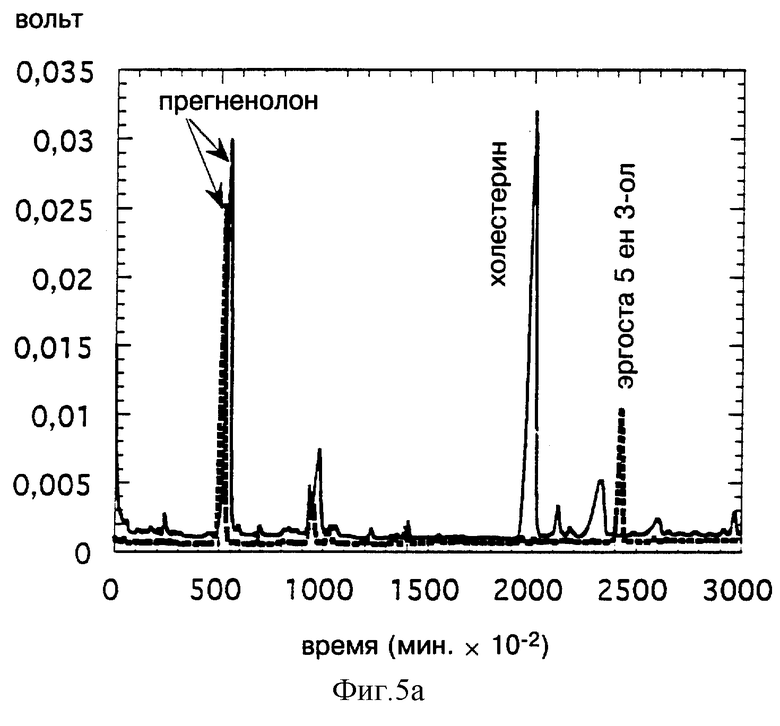
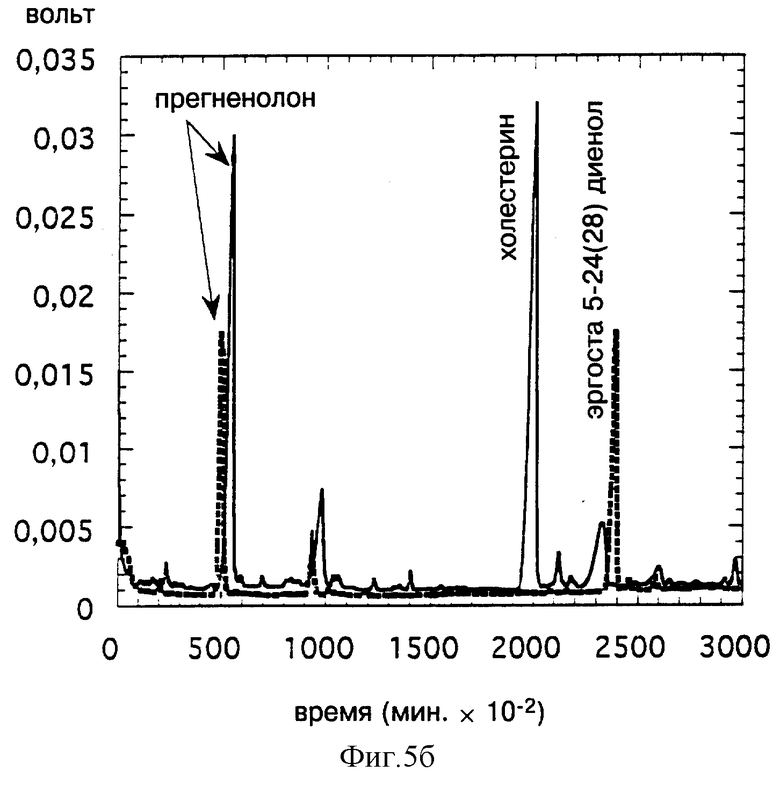
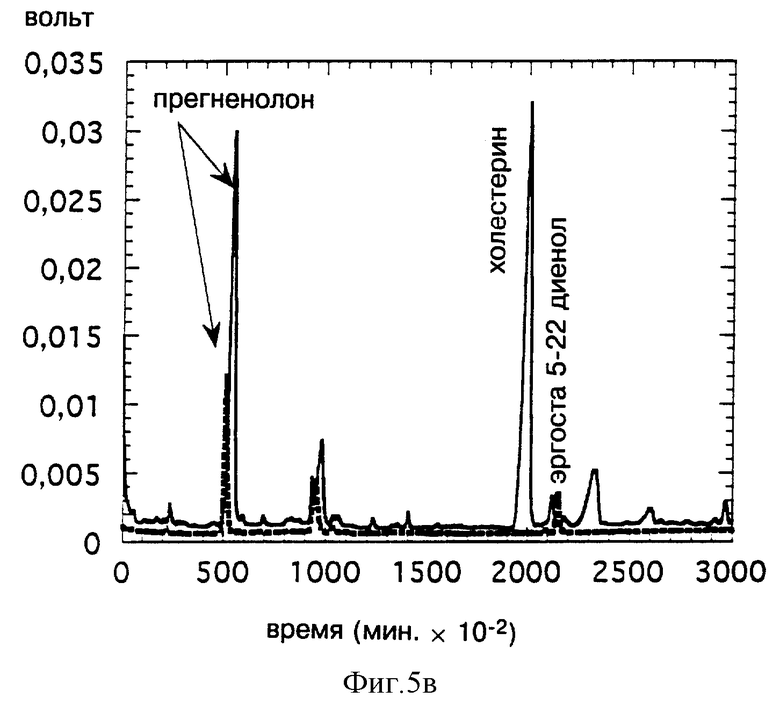
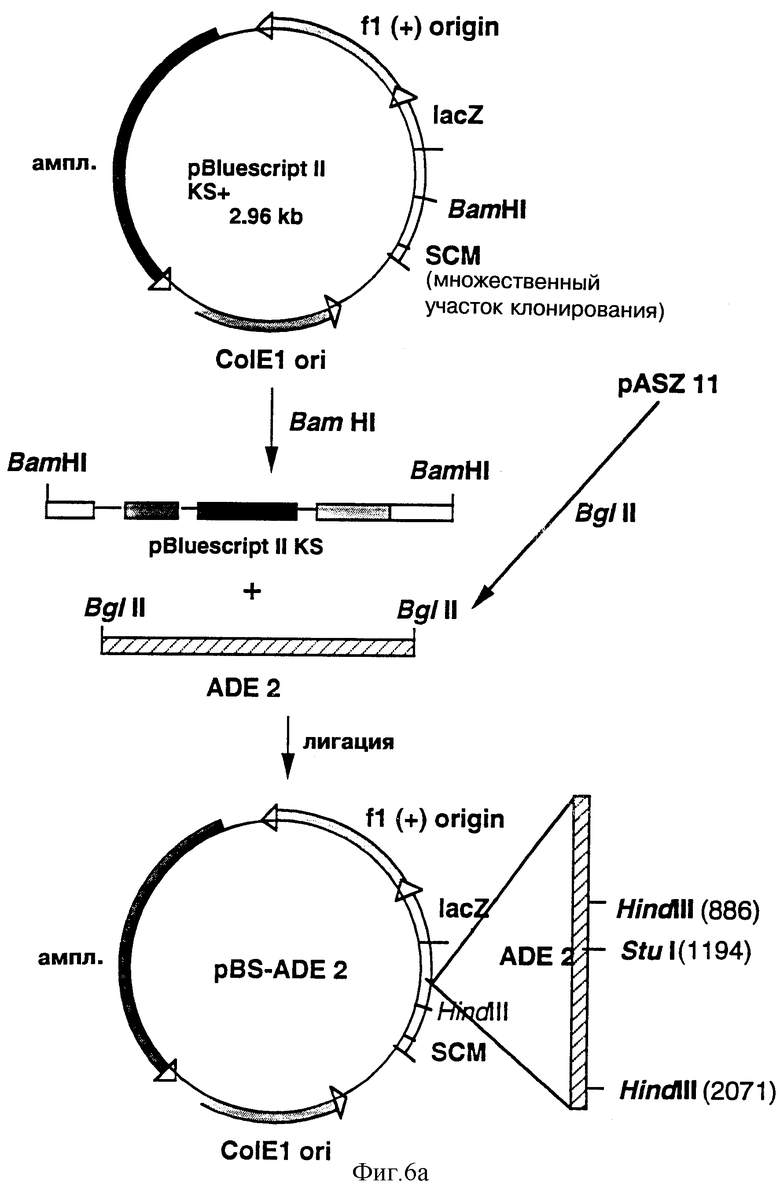
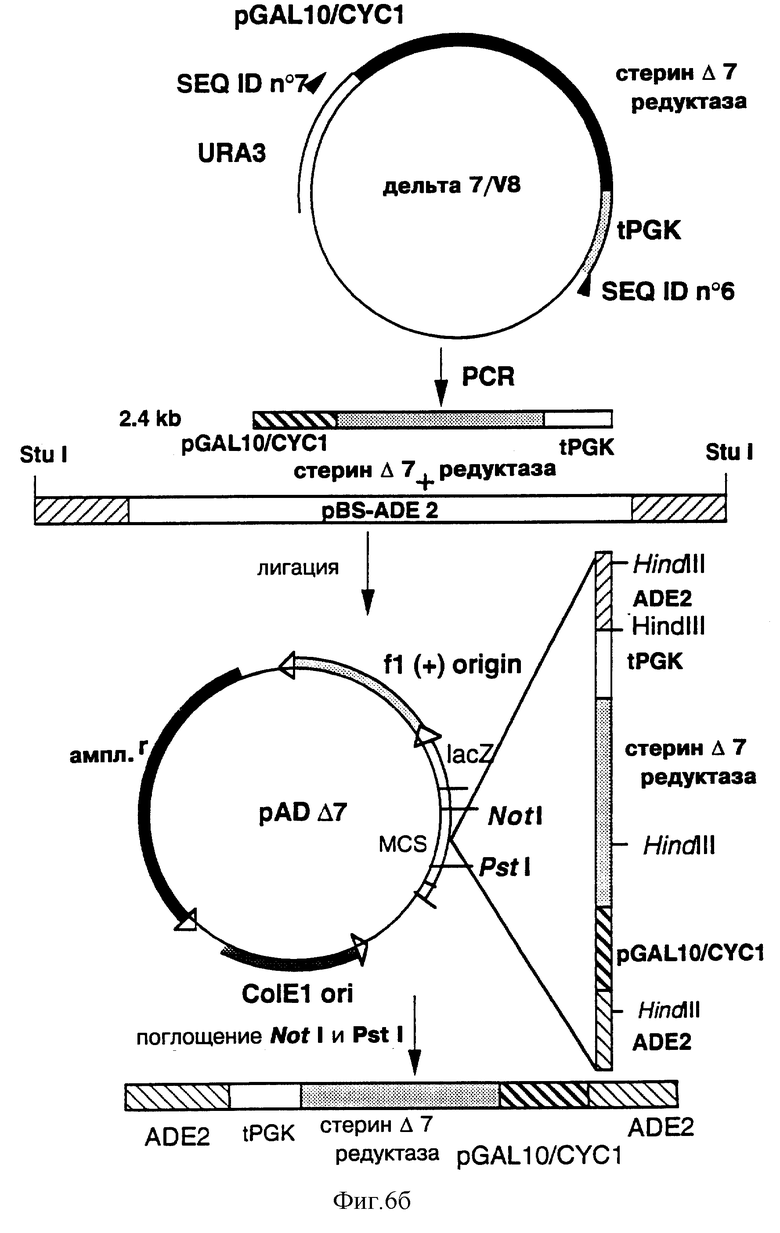
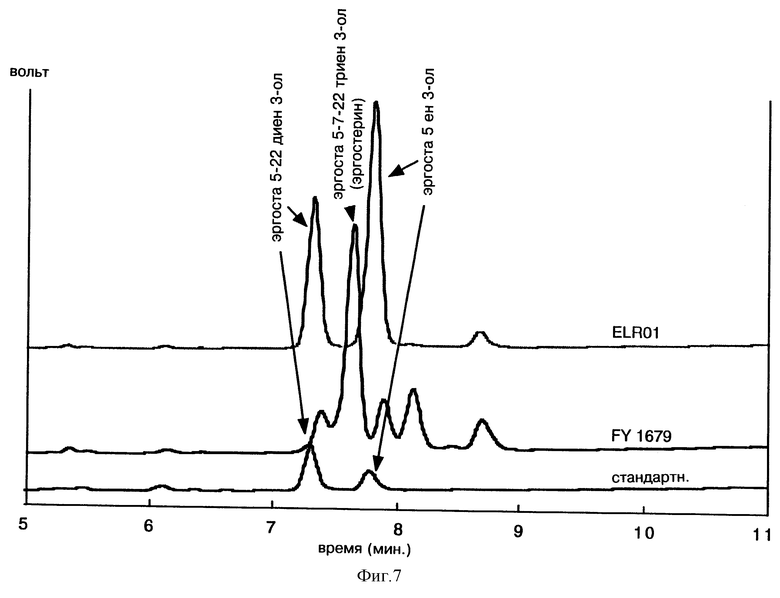
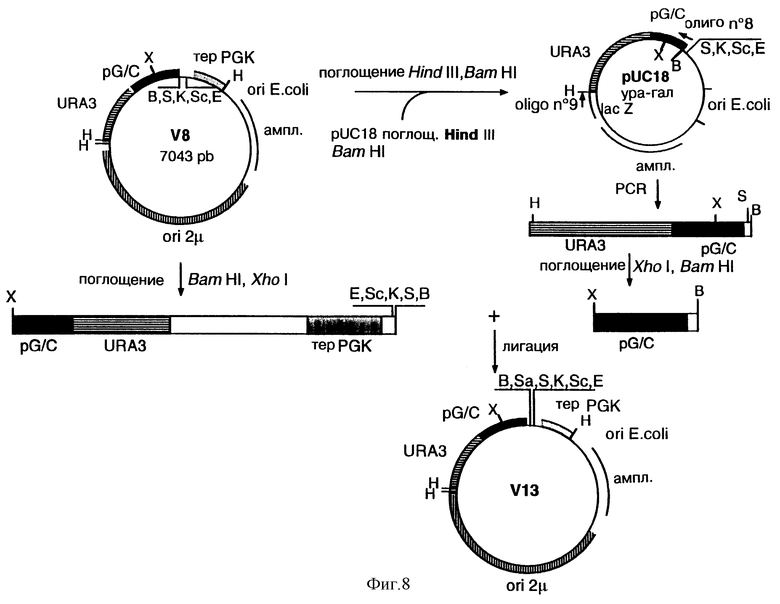
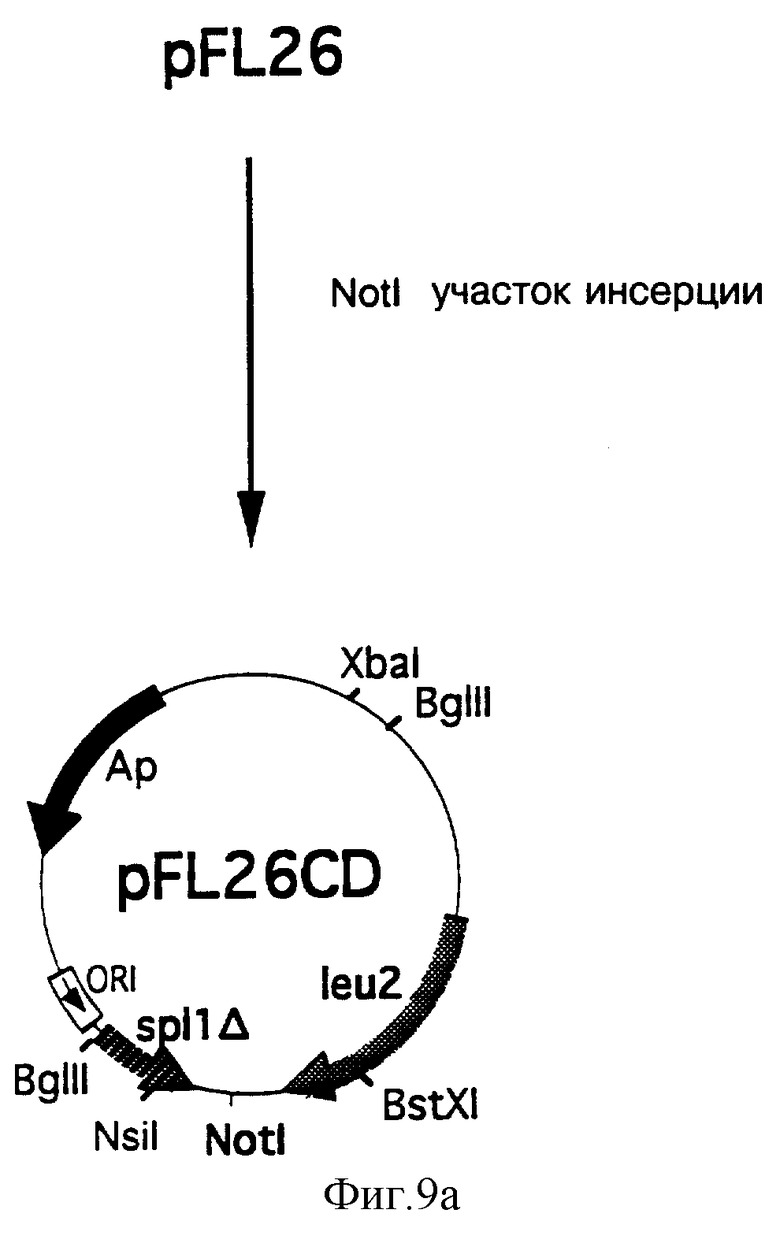
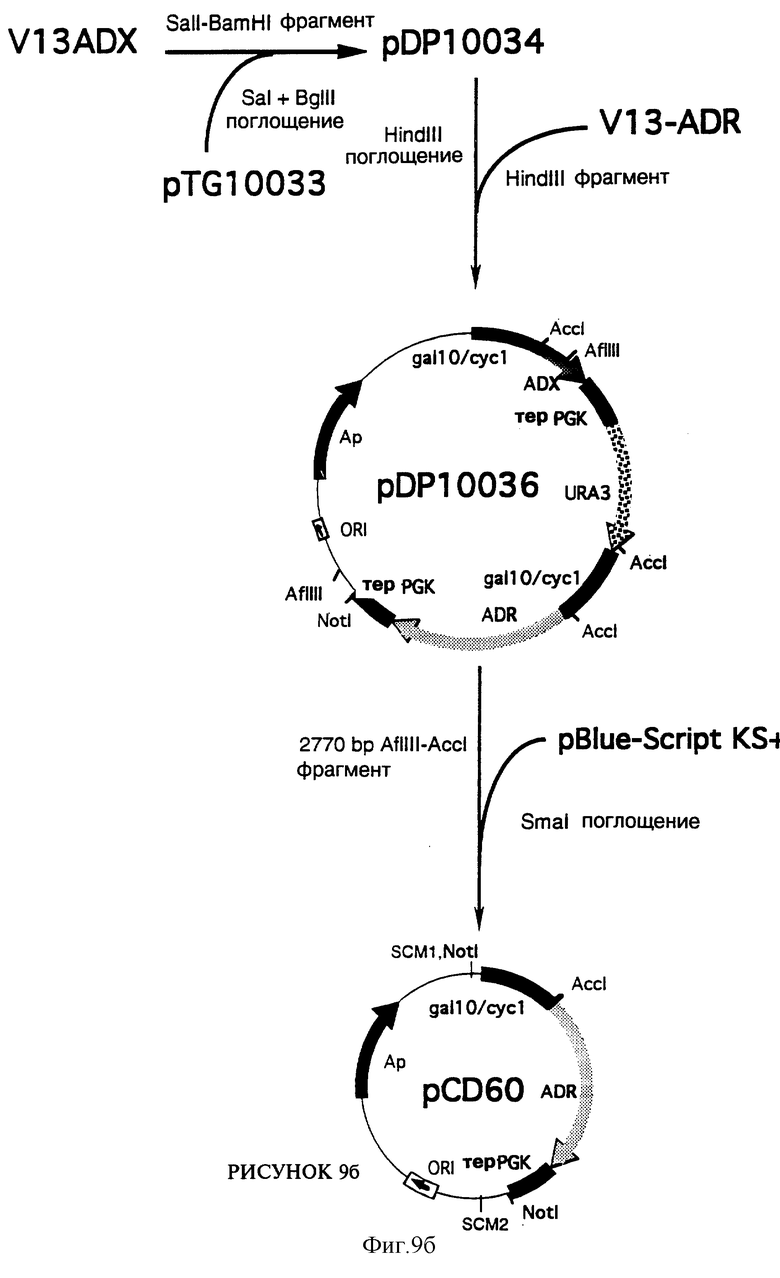
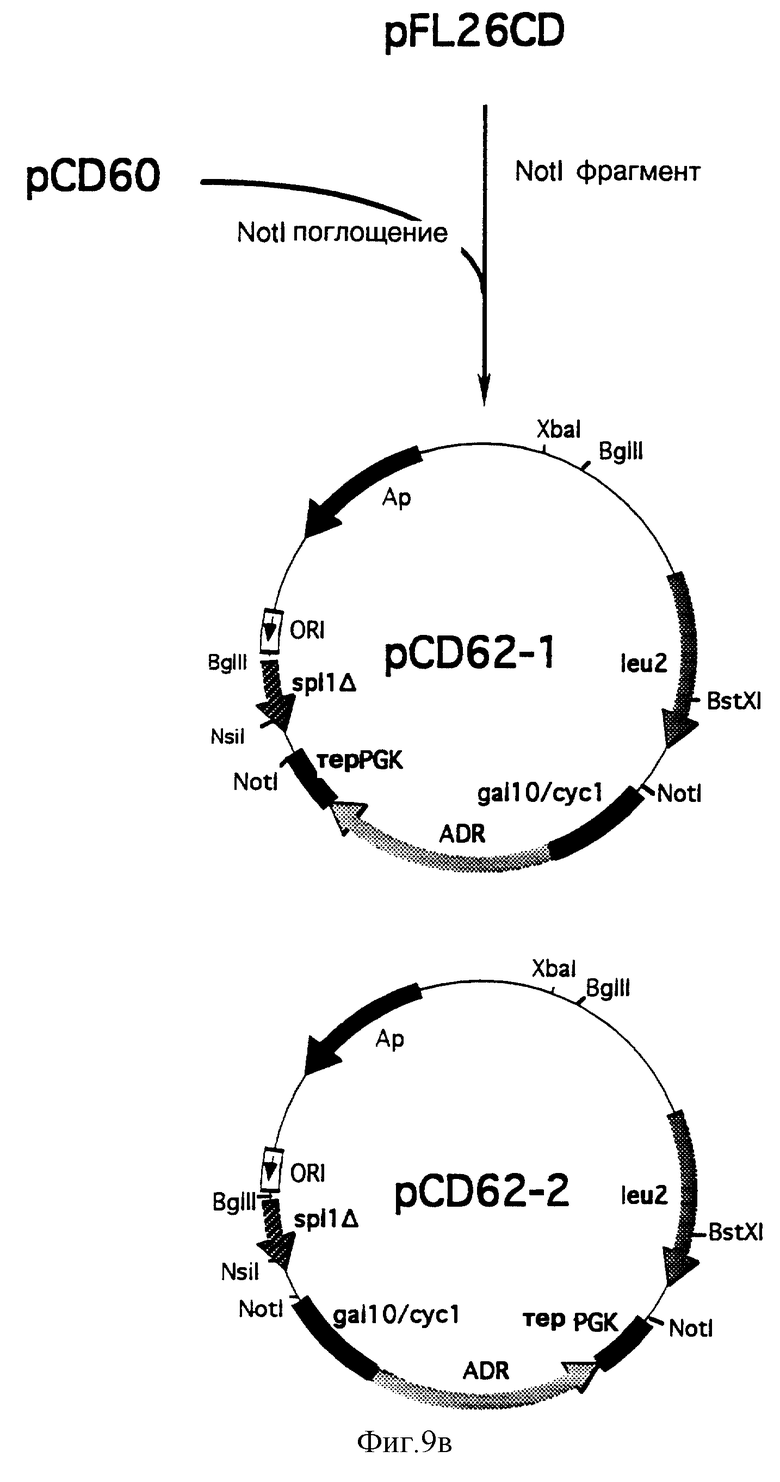
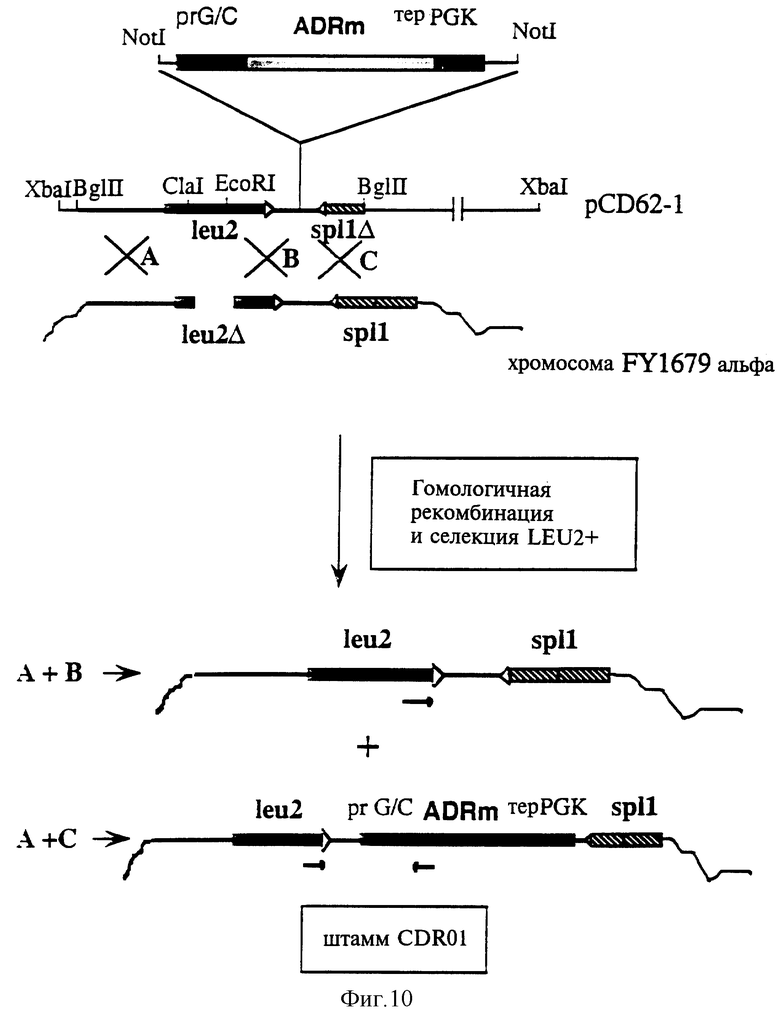
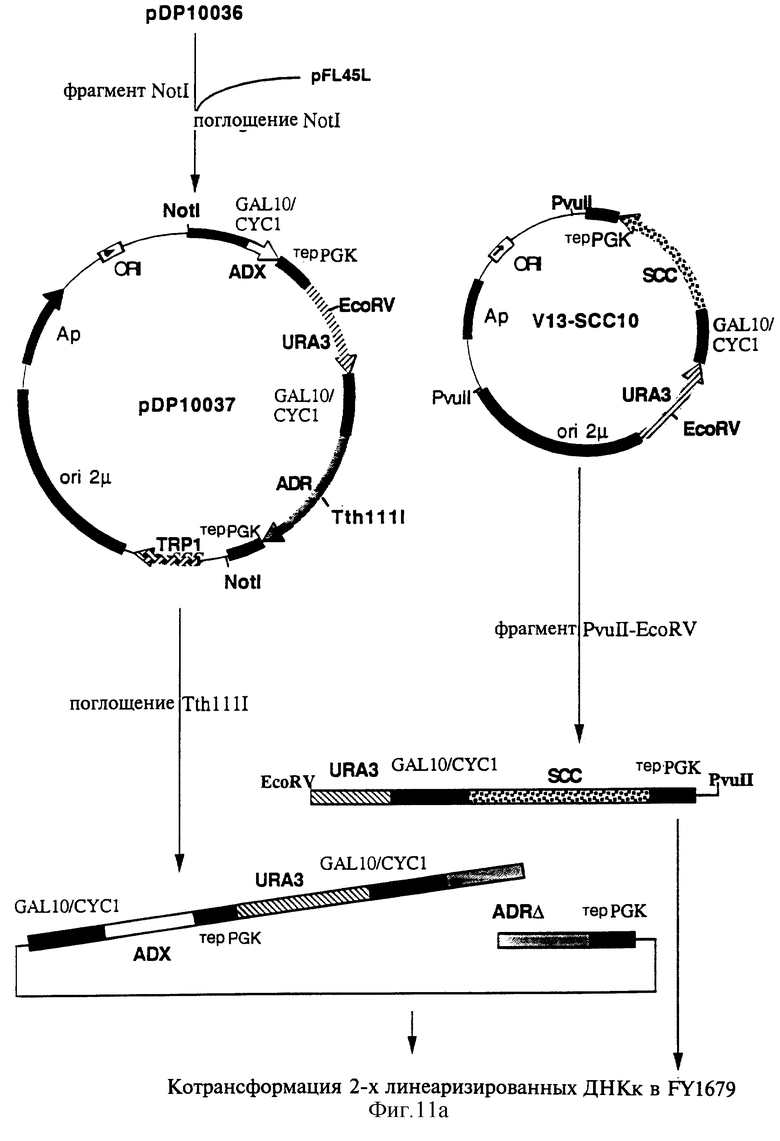
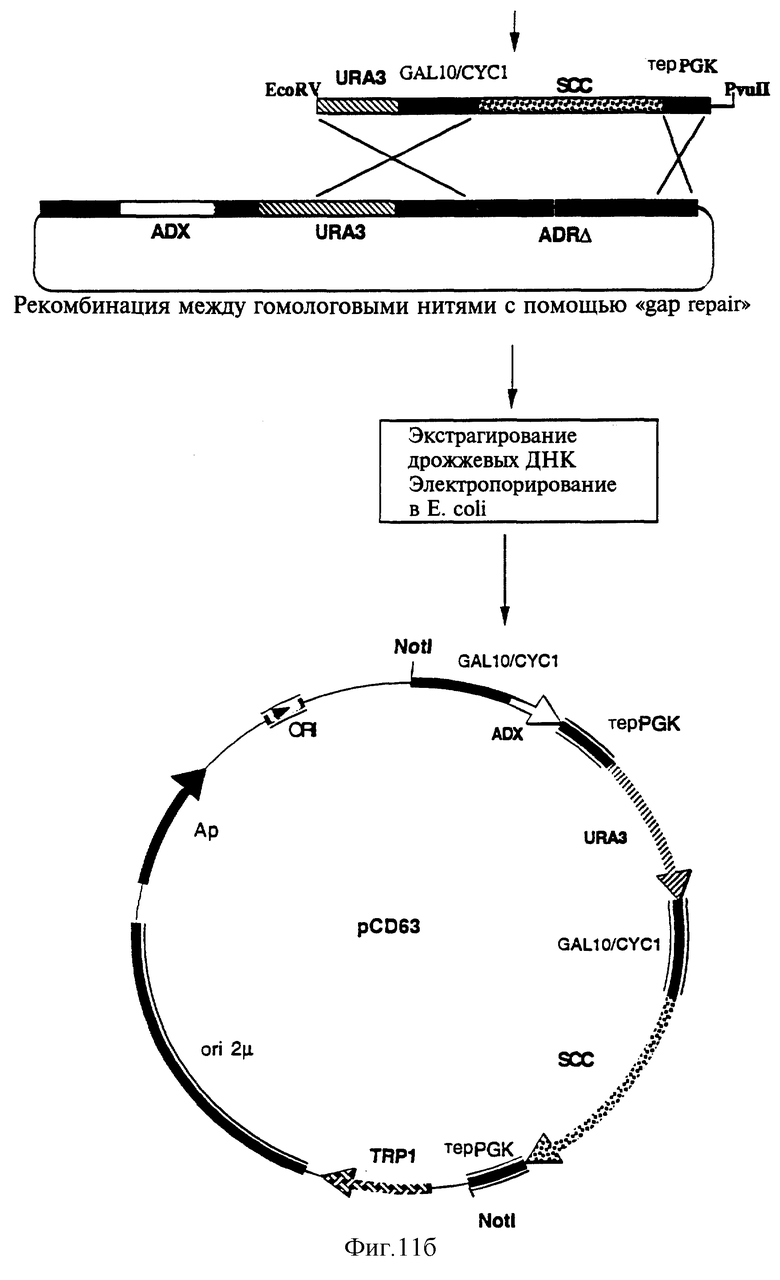
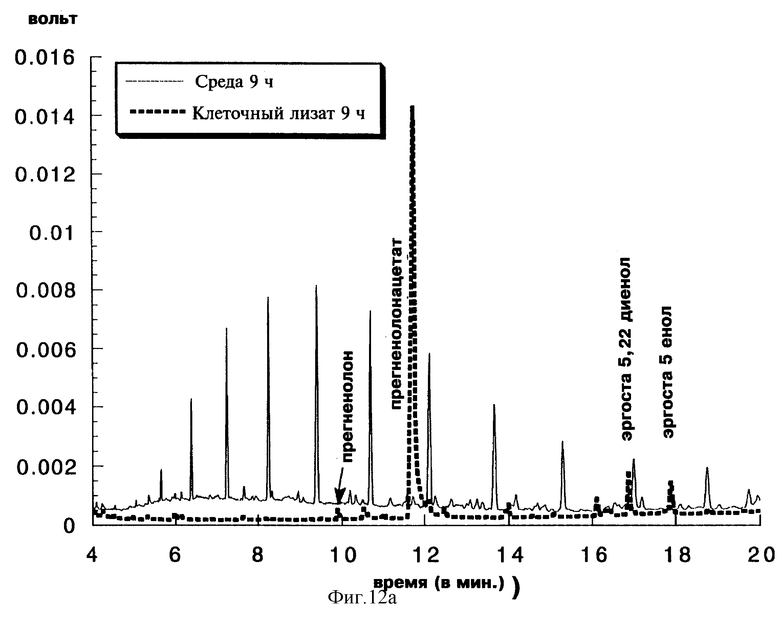
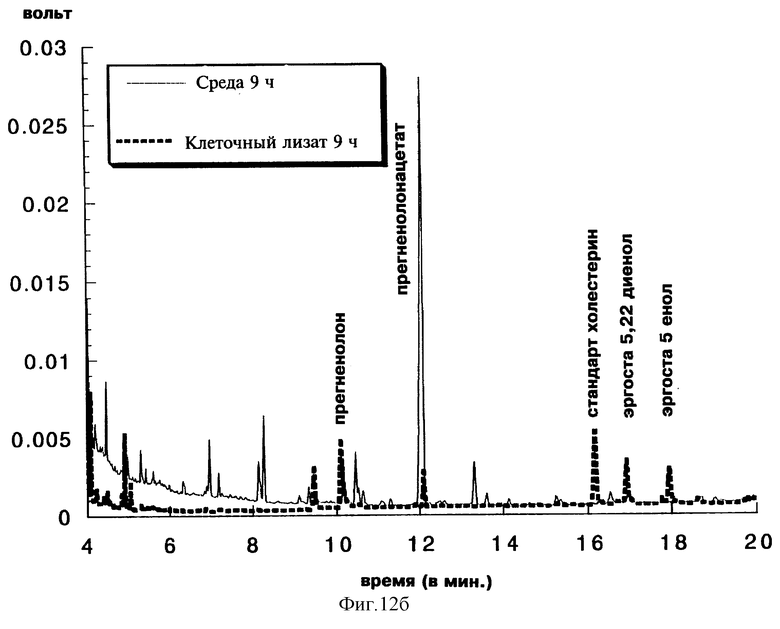


Изобретение относится к генной инженерии. Клонирование нуклеотидной последовательности в дрожжах позволяет получить белок, обладающий дельта-5,7 стерин, дельта-7 редуктазной активностью. Восстановление стерина в положении С-7 может быть использовано для получения прегненолона и гидрокортизона, а использование соответствующего гибридизационного зонда - для выявления недостаточности в организме человека дельта-5,7 стерин, дельта-7 редуктазы, например его врожденной недостаточности, а также у пациентов, страдающих разнообразными заболеваниями, например с клиническим проявлением синдрома RSH/SLO. 21 н. и 10 з.п. ф-лы, 30 ил., 2 табл.
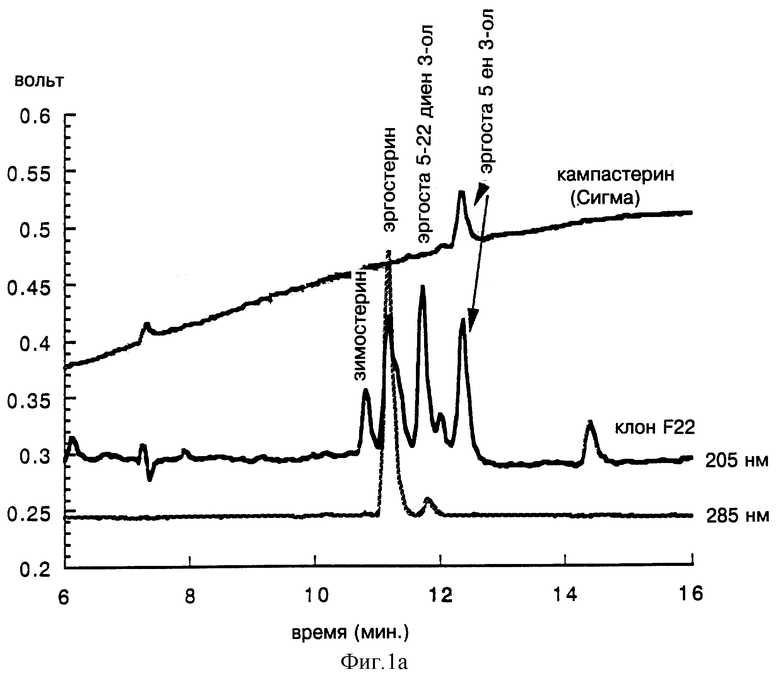
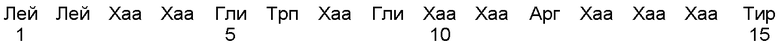
в которой Хаа в положении 7 представляет собой аминокислоту Трп или Тир, а Хаа в положении 12 представляет собой Гис или Лиз.
| US 5137822 А, 11.08.1992 | |||
| US 5366968 А, 22.11.1994 | |||
| СПОСОБ ПРИГОТОВЛЕНИЯ БИОКОМПОСТА ИЗ ОРГАНИЧЕСКИХ ОТХОДОВ И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2013 |
|
RU2554986C2 |
| Способ получения @ 4- @ или @ прегненолона | 1982 |
|
SU1090716A1 |
| СПОСОБ ПОЛУЧЕНИЯ 3 β - ГИДРОКСИПРЕГН-5-ЕН-20-ОНА | 1989 |
|
RU2026865C1 |
Авторы
Даты
2004-12-20—Публикация
1996-02-14—Подача