Настоящая заявка основана на приоритетной заявке на патент США №09/177,391, поданной 23 октября 1998 г., которая в свою очередь имеет приоритет по предварительным заявкам США №60/078,925 от 20 марта 1998 г. и №60/089,938 от 19 июня 1998 г.
Правительство США имеет оплаченную лицензию на данное изобретение и право в ограниченных условиях потребовать от патентообладателя предоставить лицензию на разумных условиях другим лицам, как это оговорено условиями контракта №R01-HD-03402 с National Institutes of Health, Public Health Service.
Настоящее изобретение относится к сушке вымораживанием сперматозоидов, оплодотворению ооцитов сперматозоидами, восстановленными после сушки вымораживанием, и развитию из них живого потомства
Успешное криосохранение спермы с использованием криопротекторов и возможность долгое время хранить замороженную сперму произвели разительный переворот как в разведении животных, так и в репродуктивной медицине человека. Было обнаружено, что криосохраненные смерматозоиды, размороженные после заморозки, часто восстанавливают свою подвижность и оплодотворяют почти так же эффективно, как и свежие сперматозоиды.
Для криосохранения сперматозоидов скота и человека обычно используют долгосрочное хранение сперматозоидов в жидком азоте (-196°С). Однако обычное сохранение спермы, в течение долгого времени стоит очень дорого, поскольку требует постоянного запаса жидкого азота. Более того, в некоторых районах земного шара затруднительно и/или дорого хранить сперматозоиды в жидком азоте; например, в развивающихся странах, где непросто достать жидкий азот (или даже сухой лед). Транспортировка сперматозоидов, замороженных обычным способом, также проблематична, так как она требует транспортировки больших емкостей для жидкого азота или использования специальных судовых контейнеров, содержащих жидкий азот или сухой лед. Поэтому было осуществлено множество попыток сохранения сперматозоидов без необходимости их хранения в жидком азоте.
Например, если способные к оплодотворению сперматозоиды можно было бы хранить в сублимированном (замороженно-обезвоженном) состоянии при обычных температурах или в простых холодильниках, снижение эксплуатационных и транспортных затрат могло бы быть огромным.
Считается, что первая зафиксированная попытка сублимирования (т.е. замораживания и обезвоживания) сперматозоидов была проделана в 1949 году, когда 1 миллилитр (мл) семени петуха смешали с равным объемом раствора Рингера, содержащего 20-30% глицерола, нанесли тонким слоем на дистилляционную колбу и “сублимировали”, удалив 90% воды. Когда препарат регидратировали через 2 ч после нагревания до комнатной температуры, было отмечено, что до 50% сперматозоидов сохранили подвижность. Однако до сих пор не была определена способность регидратированных сперматозоидов к оплодотворению.
Последующие попытки получения живого потомства с использованием сублимированных сперматозоидов не приносили успеха. Сообщалось, например, что после искусственного осеменения коровы сперматозоидами быка, которые были восстановлены сразу же после сублимации и показали 50-ти процентную подвижность спермиев, родился живой теленок. Также сообщалось, что было получено двенадцать выводков нормальных крольчат после осеменения с использованием сублимированных сперматозоидов. Однако, ни один из этих результатов не мог быть повторен авторами, либо дублирован и подтвержден другими специалистами, работающими в данной области.
Из изучения свойств и фертильности нормальных и восстановленных сперматозоидов известно, что сперматозоидам не нужно быть “живыми” в обычном понимании этого слова (т.е. иметь неповрежденные плазменные мембраны) для того, чтобы поддерживать нормальное эмбриональное развитие. Например, при использовании методики инъекции спермия внутрь цитоплазмы (ИСВЦ) отбирают подвижные сперматозоиды человека. Их иммобилизируют (“убивают”) непосредственно перед инъекцией в ооцит путем энергичного удаления хвостовых частей, что приводит к нарушению плазменной мембраны. Было отмечено, что иммобилизация спермиев значительно увеличивает уровень успешности ИСВЦ оплодотворении. Также есть сообщение о том, что когда сперматозоиды мыши суспензировали в среде без какого-либо криопротектора, а затем мгновенно замораживали в жидком азоте, 100% сперматозоидов были “мертвыми”, как это определили с использованием маркировки живых/мертвых клеток, однако после микроинъекции головок размороженных сперматозоидов в ооциты происходило нормальное эмбриональное развитие. Также есть сообщение о рождении двух нормальных телят после микроинъекции в ооциты сперматозоидов, погибших при размораживании после сушки сублимацией в отсутствие каких-либо криопротекторов.
Хотя известно, что высушенные вымораживанием головки сперматозоидов хомяка и человека, инъецированные в ооциты хомяка, могут образовывать внешне нормальные пронуклеусы, никогда ранее не определяли, могут ли такие головки сперматозоидов поддерживать нормальное эмбриональное развитие. Более того, было показано, что сублимирование сперматозоидов до влажности менее 30%, 7% и 0,5% приводит соответственно к потере подвижности, нарушению акросом и вытеканию энзимов. Были получены доказательства того, что клеточные белки в сперматозоидах изменяются при дегидратации ниже влажности в 6%.
Ввиду перечисленного выше существует необходимость в надежном и воспроизводимом способе сублимации (сушки вымораживанием) сперматозоидов, при котором сублимированные спермии сохраняют свою способность к оплодотворению во время долгого хранения при комнатной температуре или в обычных холодильниках, либо при более низких температурах. Кроме того, необходим способ инъекции спермиев, при котором используют регидратированные после сублимации спермии для оплодотворения реципиентных ооцитов с получением в результате нормального живого потомства.
Согласно изобретению предложен способ сушки вымораживанием сперматозоидов для получения по меньшей мере одного восстановленного сперматозоида, чья головка (ядро) обладает способностью оплодотворять ооцит для получения живого потомства. Способ изобретения включает стадии: (а) сбор живых сперматозоидов; (б) суспензирование сперматозоидов в суспензирующей среде; (в) замораживание суспензии сперматозоидов и (г) обезвоживание суспензии сперматозоидов до уровня влажности менее 1%, предпочтительнее менее 0,01%, еще лучше менее 0,001% и в особенности менее 0,00001%. Способ далее может включать стадию регидратации суспензии высушенных вымораживанием сперматозоидов, когда по меньшей мере одна головка регидратированного сперматозоида сохраняет свою генетическую целостность и способность к оплодотворению ооцита для получения живого потомства. Как будет рассмотрено ниже, способ может в дальнейшем включать стадию хранения высушенных вымораживанием сперматозоидов до регидратации.
Для получения живого потомства, по меньшей мере головка (ядро) регидратированного сперматозоида вводится в изолированный ооцит для образования оплодотворенного ооцита. Головку сперматозоида вводят в ооцит микроинъекцией, предпочтительно, пьезоэлектрической микроинъекцией. Предпочтительно, введение ядра происходит в течение одного часа после регидратации. Оплодотворенному ооциту затем предоставляют возможность развиться в эмбрион и имплантируют в матку суррогатной матери, где он развивается в живого потомка.
У некоторых видов (например, у большинства наземных млекопитающих, включая людей) нормальное эмбриональное развитие оплодотворенного ооцита требует также введения отцовских центросом, связанных с ядром спермия. Когда головка и хвостовая часть разделены, центросомы обычно остаются прикрепленными либо к заднему концу головки спермия, либо к переднему концу хвостовой части спермия. Так, в одной реализации изобретения связанная со спермием центросома другого сперматозоида может быть введена одновременно с головкой спермия или может быть введена путем одновременного, либо последующего введения хвостовой части спермия В качестве альтернативы введение ядра спермия и центросомы может сопровождаться введением целого регидратированного сперматозоида в ооцит.
Было обнаружено, что сперматозоиды, подвергнутые сушке вымораживанием по способу изобретения могут храниться, по меньшей мере, три месяца или, что более предпочтительно, по меньшей мере, в течение года при температурах, колеблющихся в пределах от обычных (т.е. комнатная температура) до температур, существующих в холодильниках (т.е. около 4°С) без потери их генетической целостности или способности к оплодотворению. Так, высушенные вымораживанием сперматозоиды могут сохранять свои "способности" во время перевозки их практически в любую точку земного шара при обычных или существующих в холодильниках температурах и также могут выносить кратковременное хранение при обычных температурах или температурах, существующих в холодильниках, в местах, где жидкий азот или сухой лед не являются легко доступными. Предпочтительно, долгосрочное (т.е. неопределенно долгое) хранение высушенных вымораживанием спермиев происходит при температурах меньше 4°С (например, - 20°С или ниже).
Способ изобретения может быть использован для сушки вымораживанием сперматозоидов как беспозвоночных, так и позвоночных животных, включая, но, не ограничиваясь беспозвоночными, такими как морской еж, лобстер, оболочник, моллюски и тому подобное и позвоночные, такие как рыбы, амфибии, рептилии, птицы и все млекопитающие.
В материалах данного патента содержится по меньшей мере один рисунок, выполненный в цвете. Копии данного патента с цветным рисунком могут быть предоставлены Ведомством по Патентам и Товарным Знакам в ответ на запрос и после оплаты необходимых пошлин.
Фиг.1 является фотографией вакуумированных ампул, содержащих высушенные вымораживанием сперматозоиды. Белый порошок на дне каждой ампулы - это среда CZB, содержащая сперматозоиды.
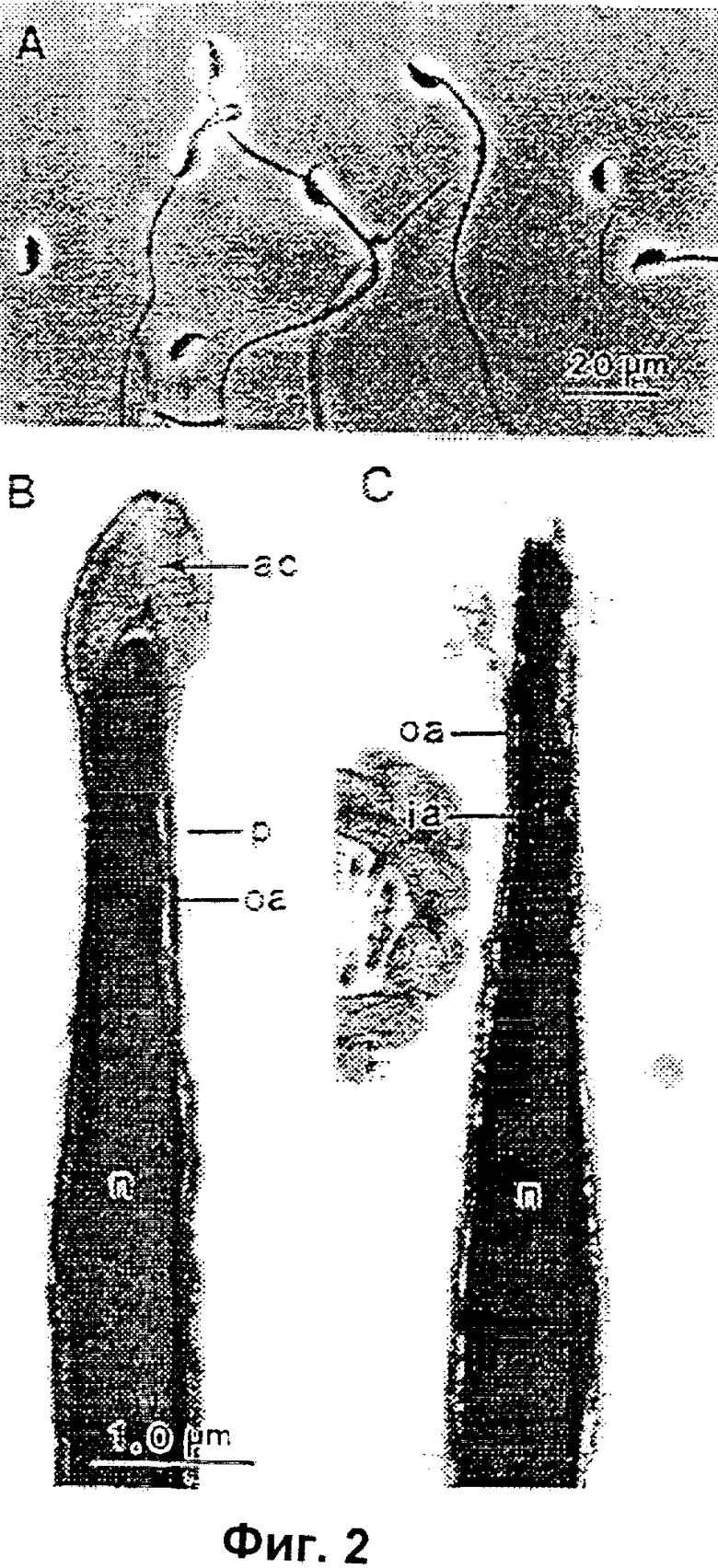
Фиг.2А является микрофотографией высушенных вымораживанием сперматозоидов мыши сразу после регидратации. Доля головок спермиев без хвостовых частей или со сломанными хвостовыми частями колеблется в зависимости от того, как аккуратно или грубо обращались с высушенными образцами во время хранения.
Фиг.2В является электронной микрофотографией, показывающей продольное сечение через передний конец головки нормального спермия, который не был заморожен.
Фиг.2С является электронной микрофотографией, на которой показаны продольное и горизонтальное сечения через переднюю часть головки высушенного вымораживанием сперматозоида после регидратации. Плазменная мембрана (п) и содержимое акросомы (ак) потеряно, (вам) - внутренняя акросомальная мембрана, (нам) - наружная акросомальная мембрана, (н) - нуклеус.
Фиг.3 является фотографией трех молодых (черных) мышей, родившихся у CD-1 (альбинос) суррогатной матери. Эти детеныши развились из ооцитов B6D2F1, инъецированных сперматозоидами B6D2F1, которые хранились при комнатной температуре в течение одного месяца после сушки вымораживанием.
Во время обычного оплодотворения у млекопитающих оплодотворяющий сперматозоид поднимается по женскому половому тракту, проникает через оболочки ооцита и затем сливается с ооцитом. Слияние спермия с ооцитом вызывает активирование ооцита. Активированный ооцит продолжает отложенный мейоз, и хромосомы ооцита трансформируются в женский пронуклеус. Тем временем ядро спермия внутри ооцита деконденсируется для трансформации в мужской пронуклеус. Полностью развитые мужской и женский пронуклеусы сливаются, и хромосомы из этих пронуклеусов объединяются. Образовавшаяся зигота развивается в живого потомка.
Настоящее изобретение предлагает способ сублимации (т.е. сушки вымораживанием) сперматозоидов, которые после регидратации способны оплодотворять изолированные ооциты для получения живого потомства. Высушенные вымораживанием сперматозоиды, полученные по способу изобретения, сохраняют свой генетический и репродуктивный потенциал даже тогда, когда после регидратации они неподвижны и в обычном смысле “мертвы”. Когда целый спермий или изолированные головки спермиев (т.е. головки, содержащие все компоненты, включая ядро) или лишенные мембран спермии или головки спермиев (т.е. сохранившие ядро и перинуклеарный материал, но не имеющие плазменной мембраны) согласно изобретению инъецируются непосредственно в ооциты, происходит нормальное оплодотворение и эмбриональное развитие, которое может привести к получению живого потомства. Предпочтительнее головка спермия (ядро) вводится напрямую в цитоплазму ооцита. Введение головки спермия проводится микроинъекцией, предпочтительно пьезоэлектрической микроинъекцией. Как будет рассмотрено ниже, эмбриональное развитие оплодотворенного ооцита некоторых видов может требовать одновременной или следующей сразу после этого инъекции центросомы спермия.
Если центросома не подвергается процессу сушки вымораживанием, для введения в ооцит можно отбирать центросомы из незамороженных сперматозоидов.
Далее более детально представлены отдельные стадии и подстадии способа изобретения для подготовки способных к оплодотворению высушенных вымораживанием спермиев и их использование в процедуре оплодотворения, проводимой in vitro.
Подготовка сперматозоидов
Для того чтобы обеспечить как можно большему числу высушенных вымораживанием спермиев сохранение их генетической целостности в процессе сушки вымораживанием, в способе изобретения предпочтительно использовать физиологически зрелые сперматозоиды. В зрелых сперматозоидах ДНК связана с основными белками, которые называются протаминами. У млекопитающих протамины многократно прошиты дисульфидными связями. Это стабилизирует ядра спермиев и делает их очень устойчивыми к физическому и химическому разрушению. Прошивка ядерных протаминов происходит в основном во время движения сперматозоидов через эпидидимис. Таким образом, сперматозоиды млекопитающих в эпидидимисе и эякуляте (семени) в основном физиологически более зрелые, чем внутри яичек, и предпочтительнее для способа изобретения, по крайней мере, в случае млекопитающих.
Зрелые сперматозоиды беспозвоночных и позвоночных собирают способами, хорошо известными специалистам. Например, зрелые сперматозоиды грызунов, таких как мышь, золотой (Сирийский) хомяк, морская свинка, кролик и тому подобное, могут быть собраны из хвостовых эпидидимисов; тогда как у других видов, таких как люди, свиньи, лошади, быки, козлы, петухи и тому подобное, зрелые сперматозоиды можно выделить из свежего эякулированного семени плодовитых самцов. Сперматозоиды рыб (например, мечехвоста, Xiphophorus helleri) и беспозвоночных, таких как морские ежи (Tripneustes gratilla) можно отбирать из яичек зрелых самцов.
В качестве примера ниже описан способ получения сперматозоидов из каудального эпидидимиса. Каудальный эпидидимис берут у половозрелого самца мыши (приблизительно через 8 недель после рождения или старше). Кровь и жировую ткань убирают с поверхности хвостового эпидидимиса. Затем его сдавливают для высвобождения плотной массы сперматозоидов. Каплю (около 2 мкл) массы спермы помещают на дно полипропиленовой пробирки для центрифугирования с объемом 1,5 мл и сверху помещают 0,5 мл теплой физиологической среды (например, среды CZB, физраствора с фосфатным буфером, или изотонического физраствора). По истечении 10-20 мин при 37°С подвижные сперматозоиды могут быть отобраны из надосадочной жидкости.
Далее следует пример получения сперматозоидов из семени. Свеже эякулированной человеческой сперме позволяют перейти в жидкое состояние в течение 30 мин при комнатной температуре (около 25°С). Затем семя разбавляют примерно 10 мл физиологического раствора и фильтруют через два слоя фильтровальной бумаги для удаления примесей. Фильтрат затем можно отцентрифугировать при 400×g в течение 10 минут, а осажденные сперматозоиды повторно суспензировать в физиологическом растворе до желаемой концентрации для процесса сушки вымораживанием.
Далее следует пример способа получения сперматозоидов из мужских половых желез. Удаленные железы помещают в эритроцит-лизирующий буфер (т.е. 155 мМ NH4Cl, 10 мМ KHCO4, 2 мМ ЭДТК, рН 7.2-7.4), измельчают острыми ножницами и фильтруют через два слоя фильтровальной бумаги для удаления примесей. Затем фильтрат центрифугируют (например, 700×g, 5 минут) и осадок повторно суспензируют в физиологическом растворе до желаемой концентрации в процессе подготовки к процессу сушки вымораживанием.
Вне зависимости от использованного способа подготовки сперматозоидов более 50% восстановленных сперматозоидов должны быть подвижными.
Восстановленные таким образом сперматозоиды суспензируют в физиологической среде, описанной ниже, для подготовки к процессу сушки вымораживанием. Альтернативно до начала сушки вымораживанием сперматозоиды могут быть подвергнуты дальнейшей обработке для получения лишенных мембран головок сперматозоидов
Приготовление лишенных мембран головок сперматозоидов
Лишенные мембран головки сперматозоидов являются экстрагированными детергентом головками, которые лишены всех мембран, включая плазменную мембрану и внутреннюю и наружную акросомальные мембраны, но сохранившие ядерный и перинуклеарный материал. Например, головки сперматозоидов могут быть лишены мембран обработкой Тритоном Х-100 с или без ДСН (додецил сульфат натрия). Тритон Х-100 является хорошо известным неионным поверхностно-активным веществом, который широко используется для удаления мембранных компонентов в условиях без денатурации. ДСН является анионным детергентом, используемым для растворения различных белков, включая белки мембран. Было показано, что у мыши головки спермиев, лишенные мембран Тритоном Х-100, способны активировать ооциты, что приводит к нормальному эмбриональному развитию.
Далее приводится типичный способ удаления мембран головок спермиев, Кратные суспензии спермиев, подготовленные, как описано выше, подвергают действию звука. Например, сперматозоиды, отобранные из каудального эпидидимиса, половых желез или спермы, как описано выше, можно суспензировать в 5 мл БМ буфера (75 мМ NaCl, 24 мМ ЭДТК и 50 мМ Трис-HCl, рН 7.2) и подвергнуть действию звука в течение 30 секунд на 70%-80% мощности прибора Biosonic sonicator фирмы (Bronwill Scientific, Rochester, NY). Более 95% сперматозоидов обезглавливается при такой обработке. Для удаления мембран головок сперматозоидов суспензию спермиев после звукового воздействия центрифугируют в течение 5 мин при 700 g, и осадок промывают БМ буфером, а затем при комнатной температуре обрабатывают 1% Тритоном Х-100 в среде НИМ (среда НИМ состоит из 123 мМ КСl, 2.6 мМ NaCl, 7.8 мМ NaH2PO4, 1.4 мМ KH2PO4, 3 мМ Na2ЭДTK, с рН 7.2) Затем головки тщательно промывают средой НИМ и повторно суспензируют в процессе подготовки к процессу сушки вымораживанием.
Суспензионная среда для сперматозоидов
В процессе подготовки к сушке вымораживанием сперматозоиды (или лишенные мембран головки сперматозоидов) суспензируют в физиологическом растворе, который достаточен для поддержания в нормальных условиях целостности, по меньшей мере, ядер сперматозоидов. Раствор должен быть сбалансированным солевым раствором, имеющим, по меньшей мере, подходящее осмотическое давление и рН. Не существует единой среды, которая могла бы поддерживать выживание сперматозоидов всех видов животных. Например, подходящим раствором для сперматозоидов морского ежа является морская вода, имеющая осмотическое давление около 1,000 милли-осмолей и значение рН примерно 8.2. Морская вода, однако, мгновенно убьет сперматозоиды млекопитающих. Сперматозоиды млекопитающих требуют раствора с осмотическим давлением около 300 милли-осмолей и рН 7.0-7.6. Такой раствор, однако, убьет сперматозоиды морского ежа.
С учетом вышесказанного среда для суспензирования сперматозоидов должна быть выбрана согласно интересующему виду, принимая во внимание критерии, хорошо известные специалистам. Такой выбор можно сделать без проведения экспериментов. Поскольку для успешного оплодотворения ооцитов инъекцией сперматозоиды не обязательно должны быть с целыми мембранами (они могут быть “мертвыми”), не существует жестких требований к криопротекторам, таким как глицерол или тому подобное, в среде для суспензии.
Упаковка
Суспензию спермиев можно поместить во множество различных контейнеров, включая, но не ограничиваясь стеклянными ампулами, пластиковыми криотрубочками (криопузырьками) с завинчивающимися крышками, либо суспензию можно поместить в пластиковые соломинки, которые после процесса сушки вымораживанием могут быть запечатаны порошковым герметиком, запаяны или закрыты нейлоновыми пробками. Объем суспензии сперматозоидов в каждой емкости не важен. Обычно объем примерно в 50-100 мкл помещают в 2 мл ампулу.
Сушка вымораживанием спермы.
Суспензию сперматозодов можно заморозить быстро или медленно хорошо известными способами. Например, суспензию можно заморозить в парах жидкого азота или в воздухе механического (электрического) холодильника способами, хорошо известными специалистам. Охлаждение и замораживание может проводиться в ручном статическом или стадийном режиме, либо в электронной автоматизированной и программируемой системе, подающей жидкий азот. Можно использовать различные скорости замораживания (например, 1°С-25°С/мин). Например, стадию замораживания можно проводить со скоростью до -196°С в течение 10 минут.
Для успешного замораживания суспензии в соломинках, ампулах или криотрубочках на пару можно использовать различные варианты. Металлический контейнер (канистра) с сигароподобными трубочками или другие держатели с соломинками, или держатели, или стойки с ампулами, или криотрубочками могут быть помещены прямо в пары жидкого азота с использованием жидкоазотного холодильника.
Высушивание замороженной суспензии спермиев в вакууме может быть осуществлено с помощью множества различных систем, известных специалистам. Например, известен аппарат модели VirTis 10-020 фирмы (VirTis Co., Gardiner, NY). Суспензию высушивают до уровня влажности менее 1%. Однако, предпочтительнее, чтобы уровень влажности был менее 0,01%, еще лучше менее 0,001% и особенно хорошо - менее 0,00001%. Контейнер с высушенными вымораживанием сперматозоидами предпочтительно упаковывают под вакуумом или в присутствии инертного газа, такого как азот или аргон.
Хранение
Контейнеры с высушенными вымораживанием сперматозоидами предпочтительнее хранить в темноте или завернутыми в алюминиевую фольгу или другим подобным образом. В случае долгосрочного хранения предпочтительно хранить контейнеры при температуре -20° или ниже. Предполагается, что аналогично высушенным вымораживанием бактериям, грибам и тому подобному, высушенные вымораживанием ядра спермиев при данных условиях хранения полностью сохранят свою генетическую целостность. Однако, некоторое время, превышающее три месяца, контейнеры можно хранить и при обычных температурах (т.е. комнатной температуре) или температурах обычных холодильников (около 4°С) без ухудшения способности высушенных вымораживанием ядер спермиев оплодотворять ооциты. Следовательно, высушенные вымораживанием спермии можно перевозить без необходимости создания особых условий или использования громоздких контейнеров.
Регидратация сублимированной спермы
Препараты высушенных вымораживанием спермиев предпочтительнее регидратировать чистой водой, объем которой равен начальному объему суспензии спермиев до высушивания вымораживанием. После регидратации для разбавления можно использовать любой физиологический солевой раствор, такой как 0,9% физраствор или среда CZB (см. ниже). Объем разбавителя не нормируется.
Концентрация сперматозоидов в окончательной регидратированной среде должна быть достаточной для обеспечения восстановления отдельных спермиев или отдельных головок спермиев с целью инъекции спермиев в ооциты, как это будет описано ниже.
Оказалось, что количество случаев активации ооцитов и нормального оплодотворения, следующих за инъекцией головки спермия, снижается с увеличением времени после регидратации спермиев. Допустимый промежуток времени между регидратацией и инъекцией у разных видов можно варьировать; однако, в качестве примера, для сперматозоидов мыши этот промежуток предпочтительно равен одному часу или еще меньше.
Микроскопическое исследование спематозоидов, регидратированных после сушки сублимацией
Высушенные вымораживанием сперматозоиды неподвижны. Жизнеспособность сперматозоидов может быть определена с использованием любого метода окрашивания, который позволяет различить сперматозоиды, которые в обычном смысле являются живыми и мертвыми. Подходящий тест-прибор на жизнеспособность, который легко можно купить для использования в изобретении это Live/dead FertiLight, фирмы Molecular Probes, Eugene, Oregon, который позволяет отличать клетки с ненарушенными плазменными мембранами (живые) от клеток с поврежденными плазменными мембранами (мертвые) по характеру флюоресценции под УФ микроскопом после окрашивания йодидом пропидиума/SYBR 14. Ядра “живых” сперматозоидов с ненарушенной плазменной мембраной флуоресцируют зеленым, тогда как таковые “мертвых” сперматозоидов флуоресцируют ярко оранжево-красным. Ожидается, что все исследованные сперматозоиды будут “мертвыми” в обычном смысле.
Фиг.2А является микрофотографией типичного высушенного вымораживанием сперматозоида мыши сразу после регидратации. Головки и хвостовые части некоторых сперматозоидов разделены. Доля сперматозоидов со сломанными хвостовыми частями или без хвостовых частей может варьировать в зависимости от того, как осторожно или грубо обращались с образцами во время хранения. Сперматозоиды с хвостовыми частями или без них использовались в процедуре инъекции, описанной ниже.
Различия между свежим (не высушенным вымораживанием) сперматозоидом и высушенным вымораживанием и регидратированным по способу изобретения сперматозоидом показаны на фиг.2В и 2С соответственно. Каждая из этих фигур представляет широтное поперечное сечение через переднюю часть головки спермия. Хотя высушенный вымораживанием регидратированный спермий сохранил ядро (я), часть наружной акросомальной мембраны (нам) и часть внутренней акросомальной мембраны (вам), как плазменная мембрана (пм), так и содержимое акросомы (а) отсутствуют.
Ооциты-реципиенты
Ооциты-реципиенты можно получить, например, вызывая у животного овуляцию или сверховуляцию действием инъекций гонадотропных гормонов (например, последовательным назначением лошадиного и человеческого хориональных гонадотропинов) и отбирая хирургическим путем яйцеклетки из яйцевода вскоре после ожидаемого времени овуляции (например, спустя 13-15 часов после инъекции человеческого хорионального гонадотропина мыши). В качестве альтернативы ооциты можно отбирать из яичников и культивировать в среде до их созревания, как это известно специалистам. Примером предпочтительной среды для культивации является видоизмененная среда Игла (ВСИ), усиленная альбумином сыворотки быка (АСБ), описанная у Downs, S.M. and A.M. Mastropolo, Develop. Biol. 162: 154-168, 1994 для ооцитов мыши.
Компоненты спермы, необходимые для успешного оплодотворения in vitro
Известно, что у мыши нормального оплодотворения можно достичь, инъецируя изолированные головки спермиев в ооциты и что плазма и акросомальные мембраны и все компоненты хвоста не существенны для нормального эмбрионального развития. Мышь и, возможно, наиболее обычные лабораторные грызуны являются “исключениями” в том, что им для нормального оплодотворения не требуется центросома спермия, и во время обычного оплодотворения центросома спермия в шейке сперматозоида после оплодотворения обречена на дегенерацию внутри ооцита.
В противоположность этому, у большинства наземных млекопитающих, включая скот и человека, центросома спермия играет центральную роль в образовании микротрубочек, которые необходимы для объединения мужского и женского пронуклеусов, также как и для последующего дробления во время эмбрионального развития. Таким образом, у этих видов введение как ядра спермия (головки), так и центросомы в ооцит оказалось необходимым для получения нормального потомства. В настоящее время неизвестно, у всех ли видов центросомы спермиев могут выдержать сушку вымораживанием. Если нет, то для гарантии нормального эмбрионального развития центросома незамороженного спермия должна быть инъецирована в ооцит совместно с высушенной вымораживанием головкой спермия. Введение большего числа центросом, однако, приведет к ненормальному развитию пронуклеусов и ненормальному эмбриональному развитию.
Когда головка и хвостовая часть разделены, центросома обычно остается прикрепленной либо к заднему концу головки спермия, либо к переднему концу хвостовой части спермия. Поэтому центросома спермия может быть введена в ооцит одновременно с головкой спермия, или может быть введена путем одновременного или последующего введения хвостовой части спермия. В качестве альтернативы введение ядра спермия и центросомы может сопровождаться введением целого регидратированного сперматозоида в ооцит.
Введение ядра сперматозоида в ооцит-реципиент
В цитоплазму ооцита реципиента можно ввести целый сперматозоид, но для тех видов, у которых сперматозоиды крупные, предпочтительно прямо в цитоплазму техникой микроинъекции вводится изолированная головка (ядро) спермия. В предпочтительном методе микроинъекции регидратированной головки спермия или регидратированных лишенных мембран головок спермиев в ооцит-реципиент используется пьезоэлектрическая микропипетка.
Подходящий пьезоэлектрически управляемый прибор продается под названием Piezo Micromanipulator/Piezo Impact Drive Unit фирмой Prime Tech Ltd. (Tsukuba, Ibaraki-ken, Japan). В приборе используется пьезоэлектрический эффект для очень быстрого контролируемого продвижения держателя (инъекционной) пипетки на очень небольшое расстояние (приблизительно 0.5 микрометров). Интенсивность и продолжительность каждого импульса можно варьировать и регулировать с помощью пульта управления.
Для инъекции в ооцит отдельный сперматозоид засасывается хвостовой частью вперед в инъекционную пипетку с коротким плоским кончиком, внутренний диаметр которого около 5 микрометров, помещенную в пьезоэлектрически управляемый прибор в соответствии с инструкциями изготовителя. Головка спермия отделяется от хвостовой части приложением одного или нескольких пьезоимпульсов в районе шейки. Затем головку засасывают внутрь пипетки.
Во время инъекции головки (ядра) спермия ооцит удерживают подходящей удерживающей пипеткой. Кончик инъекционной пипетки, содержащий выбранную головку спермия, приводят в тесный контакт с зоной пеллюцида ооцита и для продвижения пипетки прикладывают несколько пьезоимпульсов (используя пульт управления, устанавливают интенсивность по шкале 1-5, скорость 4-6), одновременно создавая небольшое отрицательное давление внутри. Когда кончик пипетки проходит зону пеллюцида, получившуюся пробочку зоны выталкивают в перивителлиновое пространство, и головка спермия проталкивается вперед до тех пор, пока она не окажется вблизи кончика пипетки. Кончик пипетки затем прикладывают к плазменной мембране и продвигают вперед (по направлению к противоположной стороне ооцита), и удерживающая пипетка почти достигает противоположной стороны кортекса ооцита. Теперь плазменная мембрана глубоко вогнута вокруг кончика инъекционной иглы. При приложении одного или двух пьезоимпульсов (интенсивностью 1-2, скоростью 1), оолемма на кончике пипетки прорывается, на что указывает четко видное быстрое расслабление оолеммы. Головка спермия затем выталкивается в ооплазму с минимальным количеством (около 6 пиколитров) сопровождающей среды. Затем пипетку осторожно вынимают, оставляя вновь введенную головку внутри цитоплазмы ооцита. Эту операцию проводят быстро, обычно на группе из 10-15 ооцитов, которые все это время содержатся в условиях культуры.
Альтернативно микроинъекционным вариантам для инъекции головок спермиев можно использовать обычные инъекционные пипетки. Пример подходящего микроинъекционого способа с использованием обычной пипетки для инъекции головки спермия в ооцит хомяка описан у Yanagida, К., Yanagimachi, R., Perreault, S.D. and R.G. Kleinfeld, Biology of reproduction 44, 440-447 (1991), описание которого, относящееся к таковому способу, включено в ссылки.
Микроинъекция головки спермия/лишенной мембраны головки спермия имеет несколько преимуществ. Во-первых, перенос головки спермия микроинъекцией применим для широкого спектра типов сперматозоидов вне зависимости от размера, морфологии и тому подобного. Во-вторых, микроинъекция позволяет совместно с инъекцией головки спермия (с головкой донорского спермия) осуществлять контролируемую инъекцию дополнительных агентов в ооцит. Ниже это показано на примерах. В-третьих, в реализации изобретения, где внесение головки спермия проводится пьезоэлектрической микроинъекцией, возможна быстрая и эффективная обработка проб, таким образом, снижается травмирование спермия и ооцитов, подвергнувшихся манипуляциям. Ооциты некоторых видов (например, мыши) не поддаются микроинъекции с использованием обычных игл, тогда как пьезоэлектрическая микроинъекция дает высокий уровень успешности.
Активация оплодотворенных ооцитов
Известно, что ооцит мыши может быть активирован инъекцией единственного неповрежденного сперматозоида мыши или его изолированной головки. Изолированная хвостовая часть спермия не может активировать ооцит. Активный, происходящий от спермия ооцит - активирующий фактор(ы) обычно появляется во время превращения шарообразной сперматиды в сперматозоид. Действие этих факторов не является строго видоспецифичным, поскольку ооциты мыши активируются инъекцией сперматозоидов других видов, таких как хомяк, кролик, свинья, человек и даже рыба. Есть сообщение, что один такой активирующий фактор является белком, размером 33 кило-дальтона и размещающимся в районе экваториального сегмента акросомы. Этот белок, называемый осциллин, легко экстрагируется из зрелых сперматозоидов (хомяка) простым замораживанием и размораживанием. Помимо осциллина зрелый сперматозоид, очевидно, несет другой активирующий фактор, который непросто экстрагировать, но можно получить последовательной обработкой сперматозоида Тритоном Х-100 и SDS. Однако неизвестно, являются ли легко экстрагируемый осциллин и замороженные/размороженные, устойчивые к экстракции факторы биологически и химически идентичными.
Известно, что головки спермиев, обработанные звуком в присутствии Тритона Х-100, теряют все составные части, кроме ядра и перинуклеарных материалов. Однако после микрохирургического введения в ооциты такие обработанные Тритоном Х-100 головки спермиев (имеющие ядро и перинуклеарный материал, но без плазматических мембран) могут активировать ооциты так же эффективно, как и неповрежденные сперматозоиды.
Как описано на примерах ниже, по меньшей мере, происходящие от спермия ооцит-активирующие молекулы мыши должны быть устойчивы к сушке вымораживанием, поскольку большинство ооцитов, которые выжили после инъекции высушенных вымораживанием головок спермиев, были нормально активированными и оплодотворенными.
Если у других видов инъекция головки спермия не вызывает активации ооцита, активация может осуществляться партеногенетическими средствами, такими как электроактивация, инъекция одного или нескольких ооцит-активирующих веществ или переносом ооцитов в среду, содержащую одно или больше ооцит-активирующих веществ. Реагенты, способные давать активирующий стимул (или комбинацию активирующих стимулов), включают, но не ограничиваются: активирующим фактором цитоплазмы спермия и определенными фармакологическими соединениями (например, Са2+ и другими модуляторами сигнальной трансдукции), которые могут быть введены микроинъекцией после или одновременно с инъекцией головки спермия. Некоторые активирующие стимулы применяют вслед за переносом оплодотворенных ооцитов в среду, содержащую один из членов подгрупп активирующих соединений, включая стимуляторы высвобождения Са2+ (например кофеин, Са2+, ионофоры, такие как А 23187 и иономицин, и этанол), модуляторы фосфопротеиновых сигналов (например, 2-аминопурин, стауроспурин и сфингозин), ингибиторы синтеза протеинов (например, А 23187, циклогексамид), 6-диметиламинопурин или комбинации перечисленных (например, 6-диметиламинопурина и иономицина). В одном способе реализации изобретения активация ооцитов мыши достигалась культивированием в течение 1-6 часов в свободной от Са2+ CZB среде, содержащей 2-10 мМ Sr2+.
Развитие эмбриона с получением жизнеспособного плода и потомства
Вслед за образованием пронуклеуса эмбрион можно культивировать in vitro до достижения им стадии 2-8 клеток или стадии морула/бластоцист, на которой эмбрион можно перенести в яйцевод или матку суррогатной матери.
Одновременное введение с головками спермы биологически значимых веществ
В одном примере реализации изобретения микроинъекция головки спермия в ооцит позволяет вводить до, во время, или после инъекции головки спермия в ооцит один или нескольких агентов, оказывающих влияние на выход развившихся эмбрионов Например, рибонуклеиновая кислота (РНК) или дезоксирибонуклеиновая кислота (ДНК), могут быть введены в ооцит микроинъекцией до или вслед за инъекцией головки спермия. Например, инъекция рекомбинантной ДНК, несущей необходимые cis-активные сигналы, может привести к транскрипции последовательностей, присутствующих на рекомбинантной ДНК резидентными или инъецированными совместно с ней факторами транскрипции и последующей экспрессии закодированных белков с антагонистическим действием на факторы, ингибирующие развитие, либо с позитивным действием на эмбриональное развитие. Более того, транскрипт может обладать антисенсорной активностью против мРНК, кодирующих протеины, ингибирующие развитие. Альтернативно, антисенсорную регуляцию можно получить инъекциями нуклеиновых кислот (или их производных), которые способны влиять на ингибиторное действие путем прямого взаимодействия с их мишенями - нуклеиновыми кислотами, без предварительной транскрипции внутри ооцита.
Рекомбинантная ДНК (линейная или другая), введенная по способу изобретения, может нести функциональный репликон, содержащий один или более экспрессируемых функциональных генов под контролем промоутера, проявляющего все, от узкого до широкого, профили экспрессии развития. Например, промоутер может вызывать мгновенную, но краткую экспрессию тогда, когда промоутер активен только в ранней зиготе. Интродуцированная ДНК может либо теряться в какой-то момент во время эмбрионального развития, либо интегрироваться в одном или нескольких геномных локусах, чтобы стабильно реплицироваться во время жизни получившегося трансгенного индивидуума. В одном примере реализации одновременно с микроинъекцией в ооцит может быть введена ДНК, строящая закодированные, предположительно “направленные против старения” протеины, такие как теломераза или суперокисная дисмутаза. Альтернативно, такие белки могут быть инъецированы напрямую.
ПРИМЕРЫ
Нижеследующие примеры иллюстрируют способ изобретения и развитие живого потомка из ооцита, инъецированного восстановленным после сушки вымораживанием сперматозоидом. В частности, пример иллюстрирует развитие нормальных мышей из ооцитов мыши, инъецированных головками (ядрами) восстановленных после сушки вымораживанием сперматозоидов мыши, которые хранили либо при комнатной температуре (около 25°С), либо в холодильнике (около 4°С). Средой для суспензирования спермиев до сушки вымораживанием были среды CZB или ДМЕМ, описанные ниже.
Примеры, приведенные здесь, следует рассматривать только в качестве примеров ооцитов и сперматозоидов отдельных видов животных, сред для суспензирования спермиев, схем замораживания, условий хранения, сред для регидратации и тому подобного, что может быть использовано в процессе изобретения, но не следует ограничиваться ими, поскольку другие примеры способов реализации изобретения могут быть без труда определены специалистами.
Среда и реагенты
Все неорганические и органические соединения были приобретены у Sigma Chemicals Co. (St. Louis), если это не оговорено особо.
Собранные ооциты до инъекции спермиев хранили в среде CZB (Chatot, et al., 1989. J. Reprod. Pert. 86, 679-688). Среда CZB содержит 81.6 мМ NaCl, 4.8 мМ КСl, 1.7 мМ СаCl2, 1.2 мМ MgSO4, 1.8 мМ KH2PO4, 25.1 мМ NaHCO3, 0.1 мМ лактата натрия, 0.3 мМ пирувата натрия, 7 ед./мл пенициллина G, 5 ед./мл сульфата стрептомицина, и 4 мг/мл альбумина сыворотки быка. Среда для сбора ооцитов из яйцеводов, последующей обработки и микроманипуляций была модифицированной средой CZB, содержащей 20 мМ Hepes, уменьшенное количество NаНСО3 (5 мМ), и альбумина сыворотки быка (АСБ) - 3 мг/мл. Эта среда здесь упоминается как Hepes-CZB. Для целей микроинъекции предпочтительно заменить АСБ в Hepes-CZB на 1 мг/мл поливинилового спирта (ПВС, растворенного в холодной воде, средняя молекулярная масса 10×103), потому что ПВС сохраняет стенки инъекционной пипетки менее липкими в течение большего времени, чем АСБ, что лучше при неоднократном использовании одной и той же пипетки для многократных переносов головок спермиев в ооциты.
Были использованы две различные среды для суспензирования сперматозоидов перед сушкой вымораживанием: (1) среда CZB без этилендиаминтетрауксусной кислоты (ЭДГК), содержащая 4 мг/мл АБС; и (2) модифицированная Dulbecco среда Eagle (ДМИС), усиленная 10% (об./проц.) сывороткой бычьего плода (Hyclone, Logan, UT).
Для того чтобы определить, какая среда будет “наилучшей” для суспензирования сперматозоидов, были проведены предварительные эксперименты; с этой целью было проведено первичное суспензирование свежих сперматозоидов в среде CZB, за чем последовало центрифугирование и повторное суспензирование в одной из сред, описанных ниже, и затем сразу же следовала сушка вымораживанием спермиев. Тестируемые среды для суспензирования спермиев включали (а) дистиллированную воду, (6) 34% сахарозы в дистиллированной воде, (в) 180 мг/мл рафинозы плюс 5 мг/мл АСБ, (г) 0.9% NaCl с 5 мг/мл АСБ, (д) 0.9% NaCl с 1 мг/мл глюкозы плюс 5 мг/мл АСБ и (е) свободную от лактата и кальция CZB. Только последняя среда (е) оказалась столь же хорошей, как и обычная CZB по способности сохранять ядро спермия, способным к развитию во время сушки вымораживанием (данные не приводятся).
Животные
Животных, которые были использованы в этих примерах, содержали в соответствии с указаниями лабораторной службы животных Гавайского университета и указаниями, подготовленными Комитетом по содержанию и использованию лабораторных животных Института лабораторных ресурсов Национального Исследовательского совета (DHEW, публикация №{NIH} 80-23, пересмотренная в 1985). Схема обращения с животными и работа с ними были пересмотрены и одобрены Комитетом по содержанию и использованию животных Гавайского университета.
ПРИМЕР 1
Подготовка сперматозоидов
Было подготовлено четыре различных препарата для того, чтобы проиллюстрировать влияние среды для суспензирования сперматозоидов, температуры хранения и времени хранения на способность ядер, высушенных вымораживанием спермиев, участвовать в развитии живого потомства после инъекции в ооцит, как это описано ниже и проиллюстрировано таблицей 1. Для каждого препарата были использованы по два каудальных эпидидимиса половозрелого B6D2F1 самца мыши. Одновременно со сдавливанием каждого эпидидимиса пальцами, его дистальную часть протыкали острым пинцетом. Плотную массу сперматозоидов, выделившуюся из эпидидимиса переносили в 1,5 мл полипропиленовую трубку, содержащую 1 мл одной или двух описанных выше исследуемых сред, CZB или ДМИС. После инкубации в течение 30 минут при 37,5°С, верхние 0.3-0.5 мл среды удаляли из трубки. Более 90% сперматозоидов в этой взвеси (приблизительно 3-10×106 на мл) были активно подвижными.
ПРИМЕР 2
Сушка вымораживанием сперматозоидов
Аликвотное количество (100 мкл) суспензии спермиев помещали в 2 мл ампулу (Wheaton Scientific, Millville, NJ, каталог №651506), которую опускали прямо в жидкий азот. Десять минут спустя ампулы помещали в предварительно охлажденные (-50°С) холодильные колбы, соединенные с установкой для сушки сублимацией (вымораживанием) (Модель 10-020, VirTis Co., Gardner, NY). Давление на входе было приблизительно равно 1 миллиТорр. Колбы отсоединяли от системы примерно через 12 ч, когда она наполнялась аргоном, поданным через камеру для осушки газа (Fisher Scientific, Pittsburg, PA номер по каталогу 09-204). Каждую ампулу подсоединяли к вакуумному насосу и, после того, как больше 99% газа было откачано, запаивали. Ампулы индивидуально заворачивали в алюминиевую фольгу и хранили в темноте при комнатной температуре (около 25°С) или при 4°С.
Ампулы с высушенными вымораживанием сперматозоидами, подготовленными, как описано выше, показаны на фиг.1. Белый порошок на дне каждой ампулы представляет собой сухую среду CZB, содержащую сперматозоиды.
ПРИМЕР 3
Регидратация высушенных вымораживанием спермиев
Ампулы, содержащие высушенные вымораживанием сперматозоиды, подготовленные описанным выше способом, вскрывали и добавляли в ампулу по 100 мкл дистиллированной воды для получения восстановленной суспензии спермиев. Затем 5 мкл суспензии тщательно смешивали с 50 мкл Hepes-CZB, содержащей 12% (мас./об.) поливинилпирролидона (средняя молекулярная масса 360,000). Регидратированные спермии просматривали под микроскопом и для дальнейших манипуляций отбирали только те, которые имели неповрежденные головки и хвостовые части.
ПРИМЕР 4
Перевозка высушенных вымораживанием сперматозоидов
Был проведен эксперимент для того, чтобы убедиться, могут ли подготовленные в соответствии с настоящим изобретением высушенные вымораживанием сперматозоиды быть перевезены за границу, сохранив при этом способность оплодотворять ооциты после регидратации. В этом эксперименте несколько ампул высушенных вымораживанием эпидидимисных сперматозоидов перевозили вручную во время трехнедельного путешествия в Японию, начавшегося в Гонолулу, Гавайи. До высушивания вымораживанием сперматозоиды были суспензированы в среде CZB. Никаких специальных мер предосторожности для сохранения сперматозоидов не соблюдали кроме того, что ампулы во время всего путешествия были завернуты в алюминиевую фольгу, и их держали в картонных коробках. Окружающая температура менялась от 5°С до 30°С. Через неделю после возвращения в Гонолулу сперматозоиды регидратировали и использовали по способу изобретения.
ПРИМЕР 5
Подготовка ооцита
У половозрелых самок B6D2F1 (C57BL/6×DBA/2) вызывали сверховуляцию путем инъецирования каждой мыши 7,5 международных единиц (ME) гонадотропина сыворотки беременной кобылы, потом через 48 ч следовала инъекция 7,5 ME человеческого хорионального гонадотропина (чГТ). Через четырнадцать часов после инъекции чГТ из яйцеводов отбирали комплексы кумулюс-ооцит и для отделения клеток кумулюса обрабатывали тестикулярой гиалорунидазой быка (300 USP ед./мл; ICN Biochemicals, Costa Mesa, CA) в среде Hepes-CZB в течение 3 мин.
До инъекции ядром спермия ооциты промывали и хранили в среде CZB до 4 ч в атмосфере, содержащей 5% СО2 в воздухе.
ПРИМЕР 6
Микроинъекция ядер спермиев в ооциты
Для инъекции головок спермиев в подготовленные ооциты подготовили камеру для микроинъекции с использованием крышечки (10 мм глубиной) для пластиковой чашки (100 мм×15 мм; Falcon Plastics, Oxnard, CA, номер по каталогу 1001). Ряд, состоящий из двух круглых капель и одной продолговатой капли, помещали вдоль центральной линии чашки. Первая капля (2 мкл; 2 мм диаметром) - для промывки пипетки (Hepes-CZB, содержащая 12% (мас./об.) ПВС, средней молекулярной массы 360,000 дальтон). Вторая капля (2 мкл; 2 мм диаметром) представляла собой суспензию регидратированных высушенных вымораживанием сперматозоидов в CZB или ДМЭМ, подготовленных, как описано выше. Третья, продолговатая капля (6 мкл; 2 мм шириной и 6 мм длиной) представляла собой среду Hepes-CZB для ооцитов. Каждая из этих капель была покрыта минеральным маслом (Squibb and sons). Чашку располагали на столике инверсионного микроскопа с интерферентной контрастной оптикой.
Микроинъекцию ядер спермиев в ооциты проводили описанным ранее способом пьезоэлектрической микроинъекции с использованием пьезомикроманипулятора модели MB-U от Prime Tech Ltd. (Tsukuba, Ibaraki-ken, Japan). В приборе используется пьезоэлектрический эффект для однократного продвижения держателя пипетки на очень маленькое расстояние (например, 0.5 мкм) на очень большой скорости, Интенсивность и скорость импульсов регулировали с помощью пульта управления.
Для инъекции в ооцит, подготовленный как описано выше, в инъекционную пипетку (внутренний диаметр кончика около 5 мкм), которая была прикреплена к прибору, управляющему пьезоэлектрической пипеткой, отбирали отдельный сперматозоид хвостовой частью вперед. Головку и хвостовую часть спермия разделяли приложением одного или нескольких пьезоимпульсов в районе шейки. Интенсивность и скорость (частоту) импульсов регулировали пультом PMAS-CT01 (на пульте установлены шкалы: интенсивность 2, скорость 1). Затем головки засасывали глубоко в пипетку и небольшой объем (около 0.5 мкл) ртути помещали у проксимального конца инъекционной пипетки.
Тем временем зрелый неоплодотворенный ооцит помещали на столик микроскопа в среду Hepes-CZB. Ооцит фиксировали удерживающей пипеткой, и кончик инъекционной пипетки приводили в тесный контакт с зоной пеллюцида в положении на 3 ч. Подавали несколько пьезоимпульсов (интенсивностью 1-2, скоростью 1-2) для продвижения пипетки с одновременным созданием легкого отрицательного давления внутри Когда кончик инъекционной пипетки проходил зону пеллюцида, цилиндрический кусочек зоны пеллюцида в пипетке выталкивался в перивителлиновое пространство. После того как головку сперматозоида проталкивали вперед, пока она не окажется вблизи кончика пипетки, пипетку механически продвигали вперед до тех пор, пока ее кончик почти не доходил до противоположной стороны кортекса ооцита. Оолемму протыкали приложением 1 или 2 пьезоимпульсов (интенсивностью 1-2, скоростью 1) и головку сперматозоида выталкивали в ооплазму с минимальным количеством (около 6 пкл) сопровождающей среды для суспензии спермиев. После удаления максимально возможного количества среды, пипетку осторожно вынимали, оставляя головку сперматозоида внутри ооплазмы. Все инъекции проводили в среде Hepes-CZB при комнатной температуре (23-27°С) в течение одного часа после регидратации. В каждый ооцит инъецировали одну головку спермия. Приблизительно 5-20 ооцитов микроинъецировали в течение 10-15 минут.
ПРИМЕР 7
Осмотр ооцитов и пересадка эмбрионов
Инъецированные головками сперматозоидов ооциты инкубировали в среде Hepes-CZB при 37°С при 5% содержании СО2 в воздухе и осматривали под инверсионным микроскопом через 5-6 часов. Сперматозоиды, которые имели два четких пронуклеуса и второе полярное тельце, считали нормально оплодотворенными и культивировали в среде Hepes-CZB в течение 4 суток. Сперматозоиды, которые достигли стадии морулы или бластоциста, переносили в рога (трубы) маток реципиентных самок CD-1 (альбиносы), которые были спарены с вазектомированными CD-1 самцами за три дня до этого для синхронизации стадий эмбрионального развития с развитием эндометрии матки. В среднем восемь морул/бластоцистов перемещали в каждый рог (трубу). Самкам предоставляли возможность выносить и вырастить их суррогатных потомков (с черными, коричневыми или серыми шкурками). Несколько половозрелых самцов и самок из потомства были отобраны случайным образом и скрещены, для того чтобы проверить их плодовитость.
РЕЗУЛЬТАТЫ
Микроскопическое исследование регидратированных высушенных вымораживанием сперматозоидов
Микроскопическое исследование регидратированных сперматозоидов показало, что 100% спермиев были неподвижными. Жизнеспособность спермиев определяли с использованием набора для определения жизнеспособности клеток, который легко можно купить (Leave/dead FertiLight, Molecular Probes, Eugene, Oregon) и который выявляет клетки с целой плазменной мембраной (живые) и с поврежденной плазменной мембраной (мертвые) в соответствии с характером флюоресценции под УФ микроскопом. Ядра “живых” сперматозоидов с целыми плазменными мембранами флюоресцируют зеленым, тогда как ядра “мертвых” флюоресцируют ярким красно-оранжевым. После сушки вымораживанием и дегидратации, было исследовано более 10000 сперматозоидов от четырех самцов. Все исследованные сперматозоиды были “мертвыми”, как это было определено с помощью данного теста.
Как проиллюстрировано в таблице 1, 1236 из 1353 ооцитов (91.4%) пережили инъекционную микрохирургию и из выживших 1157 (93,6%) были активированы ядром спермия и нормально оплодотворены, вне зависимости от первоначальной среды для суспензирования (CZB или ДМЭМ), температуры хранения (25°С или 4°), и времени хранения (1 день, 2 недели, 1 месяц или 3 месяца).
Максимальное время хранения ампул в этих примерах было 3 месяца при 4°С. В трех экспериментах, 57 ооцитов от трех самок были инъецированы сперматозоидами, хранившимися 3 месяца, 95% инъецированных ооцитов пережили микрохирургию, и все они были нормально оплодотворены. 91% оплодотворенных яиц развился до стадии морула/бластоцист in vitro. Четырнадцать (30%) из 46 эмбрионов, перенесенных трем суррогатным матерям, развились в нормальные взрослые организмы.
Большинство (90%-93%) оплодотворенных яиц, которые были инъецированы головками спермиев, суспензированных в среде CZB, высушенных замораживанием, хранившихся от 1 дня до 2 недель при 25°С или 4°С и регидратированных, развились до стадии морула/бластоцист in vitro и 25-34 (20%-29%) из них развились до нормального потомства после переноса в суррогатных матерей. Хотя меньший процент (76%) оплодотворенных яиц, которые были инъецированы суспензированными в среде CZB высушенными вымораживанием спермиями, хранившимися до регидратации в течение 1 месяца при 25°С, развились до стадии морула/бластоцист, 16 (18%) из них развились до нормальных потомства после переноса в суррогатных матерей. Девять (28%) из 32 перенесенных эмбрионов, происходящих из оплодотворенных яиц, которые были инъецированы спермиями, суспензированными в среде CZB, высушенными вымораживанием и хранившимися при 4°С в течение 3 месяцев, развились в нормальное потомство. В общем, при использовании суспензированных в среде CZB высушенных вымораживанием спермиев, всего было получено 143 живых потомка после переноса 562 эмбрионов, развившихся из 664 ооцитов, которые пережили микрохирургию и оплодотворились нормально при среднем уровне успешности 18,7%.
Как проиллюстрировано на фиг.1b, все потомство росло нормально. Соотношение полов у них было 1:1. Две полностью выросшие самки и два самца из каждой из 12 экспериментальных групп были случайным образом выбраны и спарены. Все доказали свою плодовитость и произвели выводки обычных размеров (от 8 до 12).
Из сперматозоидов, которые были отправлены в Японию и обратно и восстановлены после их возвращения в Гонолулу, 29 выбранных случайным образом сперматозоидов были индивидуально инъецированы в ооциты. Девятнадцать (83%) развились до стадии морула/бластоцист in vitro. Три (16%) из них достигли полного развития после переноса в суррогатную мать. Все три (2 самки и 1 самец) выросли в плодовитых взрослых.
С точки зрения последующих примеров было продемонстрировано, что сперматозоиды мыши могут сохранять свою генетическую целостность после сушки вымораживанием. Нет причин верить в то, что сперматозоиды других видов, включая беспозвоночных и позвоночных, будут вести себя по-иному.
Хотя описанное выше изобретение касается предпочтительных форм реализации, следует понимать, что изобретение не ограничивается вышеописанными формами. Напротив, предполагается, что настоящее изобретение охватывает все модификации и альтернативные варианты, подпадающие под дух и область данного изобретения.
Развитие ооцитов мыши, инъецированных высушенными вымораживанием сперматозоидами
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРАНСГЕНЕЗ У МЛЕКОПИТАЮЩИХ ПУТЕМ ИНТРАЦИТОПЛАЗМАТИЧЕСКОЙ ИНЪЕКЦИИ СПЕРМЫ | 1999 |
|
RU2267270C2 |
| ПРИМЕНЕНИЕ ЦИКЛИЧЕСКОГО ТРИПЕПТИДА ДЛЯ УЛУЧШЕНИЯ КЛЕТОЧНОГО ЭНЕРГЕТИЧЕСКОГО МЕТАБОЛИЗМА | 2016 |
|
RU2737116C2 |
| ПАРТЕНОГЕНЕТИЧЕСКАЯ АКТИВАЦИЯ ЧЕЛОВЕЧЕСКИХ ООЦИТОВ ДЛЯ ПОЛУЧЕНИЯ ЧЕЛОВЕЧЕСКИХ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2006 |
|
RU2469085C2 |
| СПОСОБ ВВЕДЕНИЯ ЧУЖЕРОДНОЙ ДНК В СПЕРМАТОЗОИДЫ | 1994 |
|
RU2081914C1 |
| ТРАНСГЕННЫЕ КОПЫТНЫЕ ЖИВОТНЫЕ, ИМЕЮЩИЕ ПОНИЖЕННУЮ АКТИВНОСТЬ ПРИОННОГО БЕЛКА, И ИХ ПРИМЕНЕНИЯ | 2003 |
|
RU2384059C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛОНИРОВАННОГО ПРЕДСТАВИТЕЛЯ СЕМЕЙСТВА ПСОВЫХ | 2006 |
|
RU2391817C2 |
| СПОСОБ ДИФФЕРЕНЦИРОВКИ ЖИВЫХ СПЕРМАТОЗОИДОВ С ПОМОЩЬЮ ДИАГНОСТИЧЕСКОЙ КУЛЬТУРАЛЬНОЙ СРЕДЫ ПРИ АБСОЛЮТНОЙ АСТЕНОЗООСПЕРМИИ В РАМКАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ | 2015 |
|
RU2603084C2 |
| СПОСОБ ИСПОЛЬЗОВАНИЯ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ ФОЛЛИКУЛЯРНОЙ ЖИДКОСТИ ДЛЯ УВЕЛИЧЕНИЯ ПОДВИЖНОСТИ СПЕРМАТОЗОИДОВ ЧЕЛОВЕКА В ПРОГРАММАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ | 2022 |
|
RU2801339C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ КРОЛИКОВ, ПРОДУЦИРУЮЩИХ БЕЛКИ В МОЛОЧНУЮ ЖЕЛЕЗУ | 2007 |
|
RU2402211C2 |
| НЕОРГАНИЧЕСКИЙ ПИРОФОСФАТ И ЕГО ПРИМЕНЕНИЕ | 2012 |
|
RU2626932C2 |

Изобретение относится к области искусственного осеменения животных. Продукт для искусственного оплодотворения содержит обработанные сушкой вымораживанием до уровня влажности менее 1% сперматозоид с нарушенной мембраной или головку сперматозоида, ядро которых сохранило генетическую целостность, достаточную для оплодотворения. Причем после регидратации и микроинъекции в изолированный ооцит указанные головки сперматозоида оплодотворяют изолированный ооцит. При этом сохраненная генетическая целостность достаточна для оплодотворения с получением живого потомства. Способы получения продукта для искусственного оплодотворения и оплодотворения ооцитов включают сбор живых зрелых сперматозоидов, суспензирование сперматозоидов в физиологической среде для суспензирования, замораживание суспензии сперматозоидов для получения замороженных сперматозоидов, высушивание замороженных сперматозоидов или головок сперматозоидов под вакуумом до уровня влажности менее 1%, регидратацию сперматозоидов или головок сперматозоидов с нарушенной мембраной и отбор тех из них, которые имеют сохранившее генетическую целостность ядро. Отобранные сперматозоиды или головки сперматозоидов используют для оплодотворения изолированного ооцита с получением живого потомства. Способ и продукт позволяют получить живое потомство, 5 н. и 34 з.п. ф-лы, 3 ил., 1 таб.

| KATAYOSE H | |||
| et al | |||
| jhe ability of dehydrated hamster and human sperm nuclei to develop into pronuclei | |||
| BIOL | |||
| REPROD | |||
| Пуговица для прикрепления ее к материи без пришивки | 1921 |
|
SU1992A1 |
| СОЛСБЕРИ Г.У | |||
| и др | |||
| Теория и практика искусственного осеменения коров в США | |||
| - М.: Колос, 1966, с.261-264, 317-318, 322-323, 334. | |||
Авторы
Даты
2005-01-20—Публикация
1999-03-18—Подача