Изобретение относится к медицине и биологии и может быть использовано для дифференциальной диагностики представителей семейства Chlamydiaceae.
Известен способ дифференциальной диагностики возбудителей хламидиозов на основе полимеразной цепной реакции (ПЦР), включающий: выделение ДНК возбудителя, амплификацию мишени с использованием специфических праймеров и анализ полиморфизма длины ПЦР-рестрикционных фрагментов (ПЦР-ПДРФ) с помощью электрофореза. В одном из существующих на данный момент методов дифференциальной диагностики хламидиозов, основанных на ПЦР-ПДРФ, дифференциация видов хламидий осуществляется с использованием анализа полиморфизма длины рестрикционных фрагментов гена omp1 (H. Yoshida, Y. Kishi, et.al. Differentiation of Chlamydia Species by Combined Use of Polymerase Chain Reaction and Restriction Endonuclease Analysis. 1998. Microbiol. Immunol., 42(5), 411-414).
Из известных на данный момент чаще всего применяются методы диагностики и дифференциации видов семейства Chlamydiaceae на основе ПЦР-ПДРФ.
Основные недостатки этого способа:
1. Трудоемкий.
2. Требует значительных затрат времени и реактивов.
3. Требует специализированных навыков персонала.
Сущность предлагаемого способа состоит в том, что осуществляют выделение ДНК возбудителя, амплификацию мишени с использованием семейственно-специфических праймеров к 5’-концевому фрагменту гена omp1 и электрофорез ПЦР-продуктов в агарозном геле, содержащем сиквенс-специфический ДНК-лиганд - бисбензимид-ПЭГ (Б-ПЭГ), с последующей идентификацией ПЦР-продуктов посредством сравнения скорости их миграции в геле с электрофоретической подвижностью контролей, при этом электрофоретическая подвижность амплификационных фрагментов omp1 возрастает для рода Chlamydia в следующем порядке: 1 – C.trachomatis (серовары D-K), 2 - C.trachomatis (серовар L2), 3 - C.muridarum и Chlamydia suis движутся с равной скоростью, а для рода Chlamydophila: 1 - C.pecorum, 2 - C.pneumoniae, 3 - C.felis, 4 - C.psittaci и C.abortus движутся с равной скоростью.
Выбранный ПЦР-фрагмент обладает высокой внутривидовой консервативностью, но в то же время значительной межвидовой вариабельностью, что делает возможным определение видовой принадлежности неизвестных хламидийных штаммов.
Электрофорез в присутствии Б-ПЭГ является методом разделения ПЦР-фрагментов, отличающихся по нуклеотидной последовательности, а именно по числу сайтов связывания с бисбензимидом.
Бисбензимид обладает специфической аффинностью к участкам ДНК из 4 последовательно расположенных А/Т-оснований, а ковалентно-связанный с ним полиэтиленгликоль снижает подвижность в геле ДНК, содержащей тетра-А/Т сайты. Таким образом, фрагменты ДНК с одинаковой молекулярной массой, но различным числом и структурой тетра-А/Т сайтов могут быть разделены в агарозном геле, содержащем Б-ПЕГ (С.Wawer, H.Ruggeberg, G.Meyer, G.Muyzer. 1995. A simple and rapid electrophoresis method to detect sequence variation in PCR-amplified DNA fragments. Nucleic Acid Res. 11, 4928-4929).
Отличия в первичной структуре амплификационных фрагментов разных видов Chlamydiaceae позволяют дифференцировать их посредством электрофоретического разделения в присутствии Б-ПЭГ параллельно с контрольными образцами.
Способ осуществляется следующим образом.
Выделение ДНК из клинического материала (моча, кровь, урогенитальные и респираторные мазки, образцы тканей) осуществляют с помощью набора “ДНК-сорб-В-30” (ЦНИИ Эпидемиологии МЗ РФ) в соответствии с рекомендациями производителя. Затем проводят ПЦР-амплификацию.
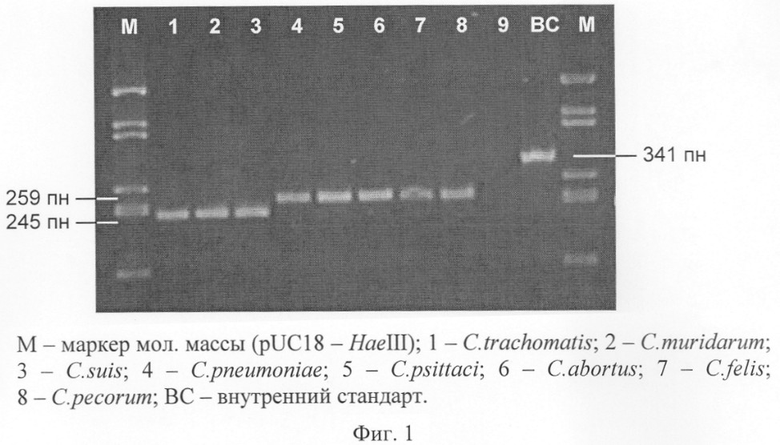
Для амплификации 245-259-пн фрагмента гена omp1 различных видов Chlamydiaceae используются семейственно-специфические праймеры СМ1: 5’-CAG-GAC-ATC-TTG-TCT-GGC-TT-3’ и СМ2: 5’-CAA-GGA-TCG-CAA-GGA-TCT-CC-3’, предложенные Yoshida и др. (1998). ПЦР смесь объемом 25 мкл содержит: 0,5 мкМ каждого праймера, 0,2 мМ каждого дезоксинуклеозидтрифосфата, 1,5 единицы Taq-полимеразы, 10 мМ Трис-НСl (рН 9,0), 50 мМ КС1, 1,5 мМ MgCl2, 0,1% бычьего сывороточного альбумина и 5 мкл исследуемого образца. Для контроля ингибирования ПЦР в реакционную смесь также вносят 600 копий внутреннего стандарта (ВС), который представляет собой гетерологичный фрагмент ДНК фага λ (341 пн), фланкированный участками связывания хламидийных праймеров СМ1 и СМ2 и клонированный в плазмидный вектор pCR2.1.
ПЦР проводят в ДНК-амплификаторе РТС-200 DNA Engine (MJ Research, США) согласно следующему протоколу: 94°С - 2 мин 50 сек, затем 35 циклов: 94°С - 10 сек, 61°С - 10 сек, 72°С - 15 сек, завершающий этап элонгации продлевается до 3 мин. Затем проводят электрофорез.
Стандартный электрофорез проводится для оценки результата амплификации и предварительной дифференциации видов хламидий на уровне родов (фиг.1). Родовую дифференциацию амплификационных фрагментов omp1 осуществляют на основании оценки их молекулярной массы: 245-249 пн для рода Chlamydia и 258-259 пн для рода Chlamydophila.
ПЦР-продукты исследуемых образцов разделяют в 3,5% агарозном геле параллельно с амплификационными фрагментами omp1 контрольных штаммов Chlamydia trachomatis L2 (245 пн) и Chlamydophila pneumoniae K7 (258 пн) в течение 60 мин при напряженности электрического поля 8,5 В/см.
Электрофоретическая подвижность контрольных фрагментов ДНК служит ориентиром для идентификации неизвестных хламидийных изолятов на уровне родов. Электрофоретический анализ продуктов ПЦР в присутствии Б-ПЭГ.
Перед заливкой геля в охлажденную до 50°С 3,5% агарозу добавляют Б-ПЭГ (Н.А.-Yellow, Hanse Analytic GmbH, Германия) в концентрации 1 ед. (1 мкл) лиганда на 1 мл агарозы и хорошо перемешивают.
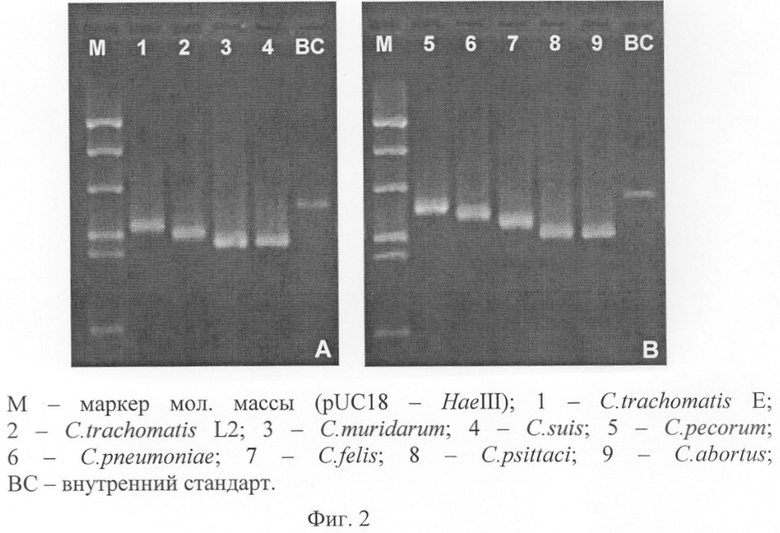
ПЦР-продукты исследуемых образцов разделяют параллельно с амплификационными фрагментами omp1 контрольных штаммов: С. trachomatis L2, Chlamydia muridarum MoPn, Chlamydophila pecorum LW613, C.pneumoniae K7, Chlamydophila felis FEPN, Chlamydophila psittaci 6BC, в течение 100 мин при напряженности электрического поля 8,5 В/см.
Идентификацию ПЦР-продуктов различных видов хламидий осуществляют посредством сравнения скорости их миграции в геле с электрофоретической подвижностью контролей (фиг.2). Скорость движения амплификационных фрагментов omp1 возрастает для рода Chlamydia в следующем порядке: 1 - C.trachomatis (серовары D-К), 1 - С.trachomatis (серовар L2), 3 - C.muridarum и Chlamydia suis движутся с равной скоростью, а для рода Chlamydophila: 1 - C.pecorum, 2 - C.pneumoniae, 3 - C.felis, 4 - C.psittaci и Chlamydophila abortus движутся с равной скоростью.
Пример 1. Пациент В., 2 мес., поступил в детское отделение с температурой тела 38°C и хрипами в области легких. Пациенту был поставлен предварительный диагноз - пневмония. У матери пациента в предродовом периоде была выявлена инфекция C.trachomatis. У пациента был взят мазок с задней стенки глотки. ПЦР с семейственно-специфическими праймерами СМ1 и СМ2 к omp1 подтвердили наличие хламидийной инфекции. На основании подвижности амплификационного фрагмента omp1 сделан вывод о его принадлежности к С.trachomatis.
Пример 2. С целью определения видовой принадлежности и паспортизации в лабораторию предоставлены частично очищенные элементарные тельца хламидийных изолятов "Ростиново-70" и "250", выделенные из плаценты овцы и паренхиматозных органов абортированного плода коровы соответственно. Результат ПЦР с семейственно-специфическими праймерами СМ1 и СМ2 и разделения ПЦР-продуктов в геле, содержащем Б-ПЭГ, показал наличие в исследуемом материале ДНК С.abortus. Идентификация подтверждена результатами прямого секвенирования ПЦР-продуктов.
В модельных экспериментах по оценке аналитической чувствительности метода с использованием разведении хламидийной ДНК показано, что нижний предел обнаружения любого из видов Chlamydiaceae в присутствии избыточного количества ДНК человека (200 нг) и 600 копий ДНК ВС составляет от 2 до 10 геном-эквивалентов на реакцию, при этом неспецифическая амплификация отсутствует.
Для оценки клинической чувствительности и специфичности проведен параллельный анализ 219 урогенитальных образцов с помощью предложенного метода и коммерческой ПЦР-тест-системы "Амплисенс Chlamydia trachomatis" (ЦНИИ Эпидемиологии МЗ РФ) с праймерами к криптической плазмиде. Четыре образца не могли быть проанализированы с помощью предложенного метода в связи с наличием в них компонентов, ингибирующих ПЦР. Для оставшихся 215 образцов результаты тестирования с применением обоих вышеуказанных методов совпали: ДНК C.trachomatis выявлена в 41 образце, 174 - оказались отрицательными.
Предлагаемый способ дифференциальной диагностики видов семейства Chlamydiaceae с помощью электрофореза ПЦР-продуктов в геле с бис-бензимидом-ПЭГ обеспечивает следующие преимущества:
1. Позволяет дифференцировать все виды сем. Chlamydiaceae, за исключением C.muridarum и C.suis, а также C.psittaci и C.abortus между собой, которые, однако, вызывают заболевания у разных животных.
2. Не требует сложного и дорогостоящего оборудования и реактивов, а также особых навыков персонала.
3. Позволяет снизить риск контаминации продуктами ПЦР и получения ложноположительных результатов за счет сокращения числа процедур, связанных с анализом ПЦР-продуктов.
4. Благодаря высокой чувствительности и специфичности может использоваться не только для анализа культивированных штаммов, но и для прямой диагностики в образцах клинического материала, полученного от человека и животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА CHLAMYDIACEAE | 2003 |
|
RU2245369C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ CHLAMYDIA SPP., CHLAMYDOPHILA PNEUMONIAE И ВОЗБУДИТЕЛЕЙ ЗООНОЗНЫХ ХЛАМИДИОЗОВ | 2003 |
|
RU2241042C1 |
| ОЛИГОНУКЛЕОТИДЫ И СПОСОБ ОПРЕДЕЛЕНИЯ ДНК БАКТЕРИЙ, ОТНОСЯЩИХСЯ К СЕМЕЙСТВУ Chlamydiaceae | 2011 |
|
RU2486255C1 |
| СПОСОБ МОЛЕКУЛЯРНОГО ТИПИРОВАНИЯ CHLAMYDIA TRACHOMATIS | 2008 |
|
RU2378364C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ МАНИФЕСТНОЙ ИЛИ СТЕРТОЙ ФОРМЫ ХЛАМИДИЙНОЙ ИНФЕКЦИИ ЧЕЛОВЕКА ИЛИ ОБЕЗЬЯН И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2385945C1 |
| СПОСОБ ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ (ВАРИАНТЫ) | 2001 |
|
RU2205876C1 |
| СПОСОБ ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ ЧЕЛОВЕКА ИЛИ ОБЕЗЬЯН И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2385946C1 |
| НАБОР РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК CHLAMYDIA TRACHOMATIS И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2621863C2 |
| СПОСОБ ГЕНОТИПИРОВАНИЯ CHLAMYDIA TRACHOMATIS | 2010 |
|
RU2443782C1 |
| СПОСОБ МОЛЕКУЛЯРНОЙ ДИАГНОСТИКИ ГЕНЕТИЧЕСКОГО РИСКА РАЗВИТИЯ ОСЛОЖНЕНИЙ УРОГЕНИТАЛЬНОЙ ХЛАМИДИЙНОЙ ИНФЕКЦИИ, ПРИВОДЯЩИХ К НАРУШЕНИЮ РЕПРОДУКТИВНОЙ ФУНКЦИИ, У ЧЕЛОВЕКА | 2012 |
|
RU2535724C2 |
Изобретение относится к области медицины и биологии. Предложен новый способ дифференциальной диагностики представителей семейства Chlamydiaceae. Способ предусматривает выделение ДНК возбудителя, амплификацию мишени с использованием праймеров СМ1 и СМ2, специфичных к 5`-концевому фрагменту гена omp1, и электрофоретическое разделение ПЦР-продуктов. Электрофорез проводят в агарозном геле с добавлением сиквенс-специфического ДНК-лиганда-бисбензимида-ПЭГ. Видовую принадлежность ПЦР-продуктов определяют путем сравнения скорости миграции ПЦР-продуктов в геле с электрофоретической подвижностью контроля. Предложенный способ позволяет дифференцировать все виды семейства Chlamydiaceae, прост и быстр, а также может быть использован для прямой диагностики образцов клинических материалов. Изобретение может быть использовано в медицине и вирусологии для дифференциальной диагностики представителей семейства Chlamydiaceae. 2 ил.
Способ дифференциальной диагностики представителей семейства Chlamydiaceae, включающий выделение ДНК возбудителя, амплификацию мишени с использованием семейственно-специфических праймеров СМ1 (5`-CAG-GAC-ATC-TTG-TCT-GGC-TT-3`) и СМ 2 (5`-CAA-GGA-TCG-CAA-GGA-TCT-CC-3`) к 5`-концевому фрагменту гена omp 1 и электрофоретическое разделение ПЦР-продуктов, отличающийся тем, что электрофорез проводят в агарозном геле с добавлением 1 ед./мл сиквенс-специфического ДНК-лиганда-бисбензимида-ПЭГ и видовую принадлежность ПЦР-продуктов определяют путем сравнения скорости их миграции в геле с электрофоретической подвижностью контроля, при этом скорость движения амплификационных фрагментов omp 1 возрастает для рода Chlamydia в следующем порядке: 1 - С-trachomatis (серовары Д-К), 2 - С-trachomatis (серовар L2), 3 - С.muridarum и C. suis движутся с равной скоростью, а для рода Chlamydophila: 1 - C. pecorum, 2 - C. pneumoniae, 3 - C. felis, 4 - C. psittaci и С. abortus движутся с равной скоростью.
| YOSHIDA H | |||
| et al, “Differentiation of Chlamydia species by combined use of polymerase chain reaction and restriction endonuclease analysis”, Microbiol Immunol | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| WAWER C | |||
| et al., “A simple and rapid electrophoresis method to detect sequence variation in PCR-amplified DNA fragments”, Nucleic Acids Res | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Шихта для плавки углеродистого ферромарганца | 1984 |
|
SU1211324A1 |
| US 6261769, 17.07.2001 | |||
| СПОСОБ ОБНАРУЖЕНИЯ ИНФИЦИРОВАННЫХ CHLAMYDIA PSITTACI СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 1997 |
|
RU2135516C1 |
Авторы
Даты
2005-01-27—Публикация
2003-05-05—Подача