Настоящее изобретение относится к области молекулярной биологии. В частности, оно относится к способам и реагентам, предназначенным для обнаружения микроорганизмов, относящихся к семейству Chlamydiaceae. Областью применения изобретения является медицина, медицинская микробиология, ветеринария, биология, молекулярная биология.
Хламидии являются облигатными внутриклеточными паразитами, вызывающими широкий спектр заболеваний у человека, животных и птиц. По современной классификации к филуму Chlamydiae относят 8 семейств, однако наиболее известными и актуальными в медицинском и ветеринарном значении являются микроорганизмы из семейства Chlamydiaceae, в котором насчитывают 9 видов, разделенных на два рода - Chlamydia и Chlamydophila. К роду Chlamydia относятся C.trachomatis, C.muridarum, C.suis. К роду Chlamydophila относятся С.pneumonia, C.abortus, C.caviae, C.felis, C.psittaci, C.pecorum. Хламидиозы отличаются большим полиморфизмом клинических проявлений и отсутствием специфических симптомов. У человека хламидии являются возбудителями трахомы, венерической лимфогрануломы, заболеваний урогенитального и респираторного тракта, конъюнктивитов, зоо- и орнитоантропонозных заболеваний. С некоторой долей вероятности с этими бактериями связывают развитие сердечно-сосудистых патологий, атеросклероза, болезни Альцгеймера, некоторых форм артритов и бронхиальной астмы. У животных хламидии могут вызывать респираторные заболевания и абортивные реакции у крупного и мелкого рогатого скота, конъюнктивиты и риниты у домашних животных, широкий спектр заболеваний у копытных животных, в том числе свиней, системные заболевания у попугаев, домашней птицы, и др. Однако истинная роль хламидии в патогенезе многих заболеваний остается невыясненной, в том числе по причине отсутствия простых и надежных средств детекции, идентификации и дифференциации хламидии, учитывающих современный уровень знаний об их биологическом разнообразии.
Диагностика хламидийных инфекций представляет собой сложную задачу ввиду как крайне широкого спектра клинических проявлений, так и недостатков традиционно использующихся диагностических методов. Наиболее мощным подходом для диагностики бактериальных и вирусных инфекций вообще, и хламидийных в частности, является метод полимеразной цепной реакции (ПЦР), в основе которого лежит многократное копирование с помощью фермента ДНК-полимеразы определенного фрагмента ДНК или РНК, являющегося маркерным для данного вида возбудителя инфекционного заболевания. В настоящее время ПЦР является наиболее чувствительным способом индикации микроорганизмов, способным потенциально обнаруживать единичные частицы возбудителей инфекционных заболеваний. Преимуществами данного типа диагностики также являются прямое определение собственно возбудителя, а не белков или других продуктов его жизнедеятельности, высокая специфичность, высокая скорость получения результата, а также возможность диагностики хронических и латентных инфекций, что особенно важно в случае хламидии. Существует несколько разновидностей ПЦР, описанных, например, в работах: PCR Protocols: A guide to methods and applications, 1990 (ред. M.A.Innis и др.), Academic Press, San Diego, CA; PCR Strategies, 1995 (ред. М.A.Innis и др.), Academic Press, San Diego, CA; PCR Protocols. Series: Methods in Molecular Biology, 2003, Vol.226 (ред., J.M.S.Bartlett, D.Stirling), Humana Press. В более ранних вариантах ПЦР для детекции продуктов амплификации использовали гель-электрофорез, что усложняет анализ. Современные модификации метода используют флуоресцентные метки и детекцию флуоресцентного сигнала непосредственно в процессе прохождения реакции, за что метод часто называют ПЦР в реальном времени («real-time PCR»). Другое название метода - количественная ПЦР («quantitative PCR, qPCR»),- отражает возможности метода проводить количественную оценку детектируемого объекта.
Известен способ обнаружения бактерий, принадлежащих семейству Chlamydiaceae (с флуоресцентной детекцией продуктов амплификации), в котором в качестве мишени использовали ген 23 S рРНК и так называемые FRET-зонды (DeGraves et al. 2003). Авторы способа не учитывали 9-ти видовую классификацию хламидий, вошедшую в обиход в начале 20-го столетия (Everett et al. 1999), и декларировали детекцию только трех видов С.psittaci, С.corum и С.pneumonia.
Еще один способ описан в работе (Robertson et al. 2009). В этом способе в качестве мишени использовали ген 16S рРНК, а генерация флуоресцентного сигнала происходила в результате использования интеркалирующего красителя SYTO 9 green. Недостатком методов с интеркалирующими красителями является их более низкая специфичность, так как краситель будет взаимодействовать и с неспецифическими ампликонами, давая рост флуоресцентного сигнала.
Наиболее близким настоящему изобретению является способ, описанный в работе (Wooters et al. 2009). В качестве мишени использовали ген 16S рРНК и Taqman-зонд. Размер ампликона составлял 208 п.о., что для данного метода не является оптимальным, т.к. амплифицируется значительная часть мишени, которая не связывается с зондом и является излишней.
Технической задачей изобретения является выявление ДНК любого из 9-ти видов бактерий, относящихся к семейству Chlamydiaceae, в исследуемом материале с высокой степенью специфичности и с детекцией результатов реакции в режиме реального времени с помощью семейство-специфичного зонда.
Указанный технический результат достигается тем, что в способе определения ДНК микроорганизмов, относящихся к семейству Chlamydiaceae, используется полимеразная цепная реакция с использованием двух праймеров и одного зонда, отличающихся тем, что в качестве праймеров используют олигонуклеотиды формулы Seq1 и Seq2, а в качестве зонда - олигонуклеотид формулы Seq3.
Для подбора праймеров и зонда был проведен компьютерный анализ нуклеотидных последовательностей гена 16S рРНК, определены консервативные всех видов семейства Chlamydiaceae участки, в пределах которых могут быть подобраны фланкирующие праймеры и зонд. В результате были подобраны олигонуклеотиды следуюшет состава
Seq1 5′-AAGAAGGGGATCTTAGGACCTTTCGGTT-3′
Seq2 5′-GCAGTGTCTCAGTCCCAGTGTTGGC-3′
Seq3 5′-TGACGTCTAGGCGGATTGAGAGATTG-3′
Рассчитанная длина продукта ПЦР для праймеров Seq1 и Seq2 составляет приблизительно 150 п.н.
Техническим результатом заявляемого изобретения является сочетание нуклеотидных последовательностей двух праймеров и флуоресцентного зонда, которые могут быть использованы для ПЦР в реальном времени для определения ДНК микроорганизмов, относящихся к семейству Chlamydiaceae.
Сущность изобретения поясняется на следующих примерах.
Пример 1. Амплификация участка гена 16S рРНК трех видов хламидий: C.trachomatis, C.pneumoniae, C.psittaci.
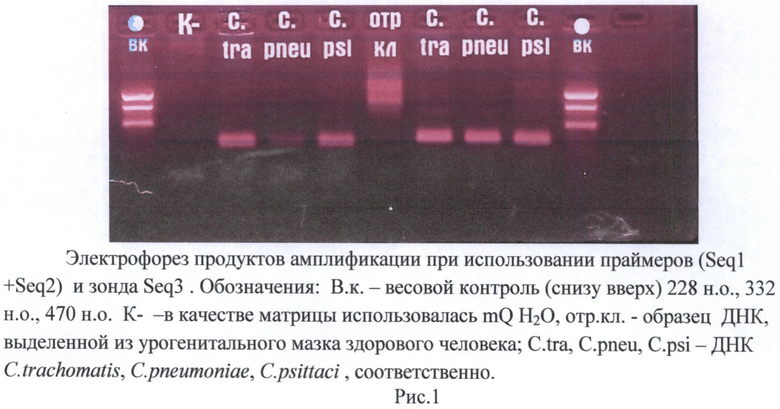
Работоспособность праймеров исследовали в ПЦР с электрофоретическим анализом продуктов реакции.
Полимеразную цепную реакцию проводили на амплификаторе ДТ-96, производитель "ДНК-технология", г.Москва. В качестве матрицы использовали образцы ДНК C.trachomatis, C.pneumoniae, C.psittaci, полученные как описано в работе (Demkin, Zimin 2005). В качестве отрицательных образцов использовали mQ H2O и ДНК, выделенную из урогенитальных мазков здоровых людей.
Реакцию проводили в следующем режиме: 1 цикл стадии предварительной денатурации 2 минуты при 95°С и 40 циклов, включающих в себя 10 секунд при 95°С и 30 секунд при 55°С стадии отжига. Анализ продуктов амплификации проводили путем электрофореза в 2% агарозном геле с бромистым этидием. Результаты эксперимента, представленные на рисунке 1, показывают, что только в пробах, содержащих ДНК хламидий, образуются ампликоны расчетного размера.
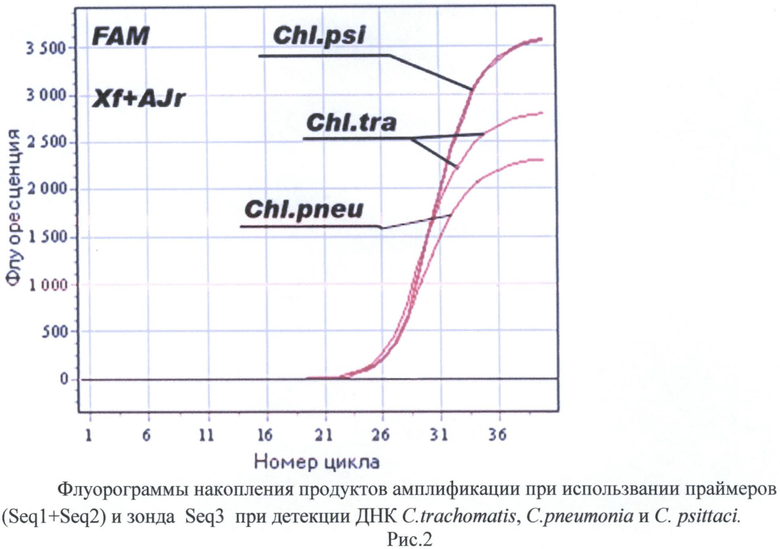
Пример 2. Определение ДНК C.trachomatis, C.pneumoniae, C.psittaci с флуоресцентной детекцией.
Пример демонстрирует работоспособность зонда Seq3 в режиме детекции флуоресцентного сигнала. Зонд на 5′-конце содержал флуоресцентный краситель FAM, а на 3′-конце - флуоресцентный гаситель BHQ2.
Инкубационная смесь была как в примере 1 за тем исключением, что дополнительно был добавлен зонд в концентрации 0,17 мкМ. Набор исследованных образцов и режим амплификации - тот же, что и в примере 1, с тем лишь отличием, что проводили детекцию флуоресцентного сигнала по каналу FAM на этапе отжига праймеров при 55°С. На рис.2 представлены результаты эксперимента. Разгорание флуоресцентного сигнала наблюдается только в пробах, содержащих ДНК хламидий. Разгорание флуоресцентного сигнала в образцах, где в качестве матрицы была использована mQ H2O, и в образце ДНК, выделенной из урогенитального мазка здорового человека, не выявлено.
Полученные результаты говорят о том, что подобранные олигонуклеотиды обеспечивают специфическое определение ДНК хламидий. Целевые последовательности тех видов семейства Chlamydiaceae, тестирование которых не проводилось в описанных экспериментах, полностью комплементарны разработанным праймерам и зонду, что обеспечивает универсальность работы праймеров и зондов при определении ДНК любого из видов семейства Chlamydiaceae.
СПИСОК ЛИТЕРАТУРЫ
PCR Strategies, 1995 (ред. М.A.Innis и др.), Academic Press, San Diego, CA;
PCR Protocols. Series: Methods in Molecular Biology, 2003, Vol.226 (ред., J.M.S.Bartlett, D.Stirling), Humana Press.
DeGraves FJ, Gao D, Hehnen HR, Schlapp T, Kaltenboeck В Quantitative detection of Chlamydia psittaci and С pecorum by high-sensitivity real-time PCR reveals high prevalence of vaginal infection in cattle. J Clin Microbiol 2003 Vol.41(4): 1726-1729
Robertson T, Bibby S, O′Rourke D, Belfiore T, Lambie H, Noormohammadi AH.
Characterization of Chlamydiaceae species using PCR and high resolution melt curve analysis of the 16S rRNA gene. J Appl Microbiol. 2009 Vol.107(6):2017-2028.
Wooters MA, Kaufhold RM, Field JA, Indrawati L, Heinrichs JH, Smith JG. A real-time quantitative polymerase chain reaction assay for the detection of Chlamydia in the mouse genital
tract model. Diagn Microbiol Infect Dis. 2009 Vol.63(2):140-147.
Demkin, V.V., Zimin A.L. A new amplification target for PCR-RFLP detection and identification of Chlamydiaceae species. Arch Microbiol. 2005 Vol.183(3): 169-175.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА CHLAMYDIACEAE | 2003 |
|
RU2245369C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ CHLAMYDIA SPP., CHLAMYDOPHILA PNEUMONIAE И ВОЗБУДИТЕЛЕЙ ЗООНОЗНЫХ ХЛАМИДИОЗОВ | 2003 |
|
RU2241042C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА CHLAMYDIACEAE | 2003 |
|
RU2245370C1 |
| СПОСОБ ДИАГНОСТИКИ ХЛАМИДИЙНОЙ ИНФЕКЦИИ (ВАРИАНТЫ) | 2001 |
|
RU2205876C1 |
| СПОСОБ ТАРГЕТНОЙ АМПЛИФИКАЦИИ ГЕНОМОВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ ОРГАНОВ РЕПРОДУКЦИИ ЧЕЛОВЕКА С ЦЕЛЬЮ ОДНОВРЕМЕННОЙ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЕЙ С НАБОРОМ ПРАЙМЕРОВ | 2015 |
|
RU2625006C1 |
| Тест-система для выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2701332C1 |
| Способ выявления ДНК микроорганизмов класса Mollicutes в крови и других биоматериалах методом ПЦР-РВ | 2023 |
|
RU2831277C1 |
| Способ выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2700381C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ ВИРУСА ХЛОРОТИЧЕСКОЙ ПЯТНИСТОСТИ ЛИСТЬЕВ ЯБЛОНИ МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ | 2024 |
|
RU2835209C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ ВОЗБУДИТЕЛЯ ЧЁРНОГО РАКА ЯБЛОНИ SPHAEROPSIS MALORUM МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ | 2024 |
|
RU2840150C1 |
Изобретение относится к области молекулярной биологии. Предложен способ обнаружения ДНК микроорганизмов, относящихся к семейству Chlamydiaceae, методом ПЦР с использованием праймеров и зонда, комплементарных консервативному участку гена 16S рРНК. Изобретение может быть использовано в медицине, ветеринарии, микробиологии, биологии для обнаружения микроорганизмов, относящихся к семейству Chlamydiaceae. 1 з.п. ф-лы, 2 ил., 2 пр.
1. Способ определения бактерий семейства Chlamydiaceae, включающий амплификацию бактериальной нуклеиновой кислоты в исследуемом материале путем проведения полимеразной цепной реакции с использованием олигонуклеотидных праймеров с последовательностями, не менее чем на 75% гомологичными последовательностям SEQ ID NO:1 и SEQ ID NO:2, и зонда с последовательностью, не менее чем на 75% гомологичной последовательности SEQ ID NO:3, содержащего на 5′ и/или 3′ концах метки.
2. Способ по п.1, где в качестве меток зонда могут выступать радиоизотопы, ферменты, флуоресцентные красители, люминесцентные красители, вещества, поглощающие флуоресценцию, биотин.
| Газоочиститель к судовым газогенераторам | 1936 |
|
SU51635A1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ CHLAMYDIA SPP., CHLAMYDOPHILA PNEUMONIAE И ВОЗБУДИТЕЛЕЙ ЗООНОЗНЫХ ХЛАМИДИОЗОВ | 2003 |
|
RU2241042C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ПРЕДСТАВИТЕЛЕЙ СЕМЕЙСТВА CHLAMYDIACEAE | 2003 |
|
RU2245370C1 |
Авторы
Даты
2013-06-27—Публикация
2011-10-13—Подача