Изобретение относится к ферментативно гидролизованным пшеничным отрубям с глюкоамилазной, протеолитической и ксиланазной активностями, а также к способу их получения путем твердофазного сбраживания пшеничных отрубей с помощью Aspergillus niger.
Известно получение этилового спирта из кукурузного крахмала путем ферментного расщепления, включающего этап разжижения крахмала с помощью альфа-амилазы с целью гидролиза крахмала с образованием декстринов, далее - этап осахаривания с помощью глюкоамилазы (называемой иначе амилоглюкозидазой) для гидролиза декстринов с образованием глюкозы и, наконец, этап сбраживания последней до получения этилового спирта.
Использование ферментов альфа-амилазы и глюкоамилазы дает, как правило, удовлетворительные результаты в тех случаях, когда в качестве исходного материала берут относительно чистое крахмальное молоко, получаемое мокрым размолом кукурузы, однако если требуется заменить кукурузный крахмал крахмалом пшеницы или пшеничной мукой, применение лишь указанных двух ферментов не дает приемлемых результатов вследствие присутствия гемицеллюлоз, которые способствуют увеличению вязкости осахаренных мучных сусел настолько, что выполнение процесса становится затруднительным. Для устранения этих трудностей приходится использовать на этапе осахаривания специальные вспомогательные ферменты. Кроме того, в процессе осахаривания желательно также использовать протеазы с целью гидролиза содержащихся в муке белков, что позволит обогатить сусло азотом перед последующим этапом спиртового брожения. Благодаря этому удается уменьшить традиционное обеспечение азотистым питанием, которое необходимо для роста дрожжей.
Хотя все вышеперечисленные ферменты имеются по отдельности на рынке в очищенном виде, их недостатком является относительная дороговизна, ведущая к увеличению затрат на получение этилового спирта из пшеницы. Кроме того, приходится составлять рецептуру составов на основе отдельных ферментов, что усложняет процесс.
Таким образом, назрела потребность в недорогом полиферментном препарате, в котором сочетались бы глюкоамилазная, протеолитическая и гемицеллюлазная активности, с тем чтобы можно было получать этиловый спирт из пшеничной муки с малыми затратами.
Целью изобретения и является удовлетворение этой потребности.
Настоящее изобретение относится к ферментативно гидролизованным пшеничным отрубям, имеющим глюкоамилазную, протеолитическую и ксиланазную активности, характеризующимся тем, что они сброжены с помощью штамма Aspergillus niger, причем указанные глюкоамилазная, протеолитическая и ксиланазная активности имеют следующие минимальные значения:
- глюкоамилазная - по меньшей мере, 100 Г ед. на грамм сухого вещества,
- протеолитическая - по меньшей мере, 100 П ед. на грамм сухого вещества,
- ксиланазная - по меньшей мере, 100 К ед. на грамм сухого вещества,
при условии, что глюкоамилазная активность должна составлять, по меньшей мере, 750 Г ед. на грамм сухого вещества и/или ксиланазная активность должна составлять, по меньшей мере, 300 К ед. на грамм сухого вещества.
Предпочтительнее, чтобы глюкоамилазная активность составляла, по меньшей мере, 1500 Г ед. на грамм сухого вещества и/или ксиланазная активность составляла, по меньшей мере, 400 К ед. на грамм сухого вещества.
Целесообразно также, чтобы протеолитическая активность составляла, по меньшей мере, 400 П ед. на грамм сухого вещества.
Предметом изобретения является также способ получения ферментативно гидролизованных пшеничных отрубей, характеризующийся тем, что он включает этапы, состоящие в том, что (а) берут пшеничные отруби; (б) увлажняют указанные отруби и после этого подвергают их тепловой обработке с целью их пастеризации или стерилизации; (в) инокулируют полученные пшеничные отруби штаммом Aspergillus niger; (г) когда отруби имеют вид слоя толщиной, по меньшей мере, 10 см, производят их твердофазное сбраживание в реакторе с аэрацией и периодическим перемешиванием в течение от 1 до 3 суток при температуре 28-38° С, предпочтительно 32-36° С, причем начальное содержание влаги в указанных отрубях устанавливают на 50-60 вес.%, поддерживая его практически неизменным в течение времени брожения, в условиях аэрации, обеспечивающих предотвращение накопления углекислого газа, оказывающего вредное воздействие на брожение в реакторе и обусловленного брожением повышения температуры сверх рекомендованных пределов, до тех пор, пока не будут достигнуты следующие минимальные значения ферментативной активности продукта брожения:
- глюкоамилазная - по меньшей мере, 100 Г ед. на грамм сухого вещества,
- протеолитическая - по меньшей мере, 100 П ед. на грамм сухого вещества,
- ксиланазная - по меньшей мере, 100 К ед. на грамм сухого вещества,
при условии, что глюкоамилазная активность должна составлять, по меньшей мере, 750 Г ед. на грамм сухого вещества и/или ксиланазная активность должна составлять, по меньшей мере, 300 К ед. на грамм сухого вещества.
Предпочтительнее, чтобы глюкоамилазная активность составляла, по меньшей мере, 1500 Г ед. на грамм сухого вещества и/или ксиланазная активность составляла, по меньшей мере, 400 К ед. на грамм сухого вещества.
Целесообразно также, чтобы протеолитическая активность составляла, по меньшей мере, 400 П ед. на грамм сухого вещества.
Целесообразно выбирать штамм Aspergillus niger из группы, включающей штамм NRLL 3112, штамм АТСС 76061 и штаммы, получаемые из указанных штаммов путем селекции или мутации при необходимости достижения высокой глюкоамилазной активности. Особенно предпочтителен штамм АТСС 76061.
При необходимости достижения высокой глюкоамилазной активности используемые в качестве исходного материала пшеничные отруби не должны быть обескрахмаленными. Если не считать этого ограничения, можно применить отруби любого типа, однако предпочтительнее все же, чтобы в них содержалась значительная доля (не менее 40 вес.%) частиц размером менее 1 мм.
Ниже в качестве примеров, не имеющих ограничительного характера, приводятся характеристики двух пригодных для этих целей отрубей.
Пшеничные отруби подлежат увлажнению и тепловой обработке с целью их пастеризации или стерилизации. Предпочтительнее не проводить тепловую обработку перед увлажнением, поскольку при таком порядке следования операций были отмечены неудовлетворительные результаты сбраживания. Тепловая обработка может заключаться, например, в нагреве в автоклаве. Очень хорошие результаты дала автоклавная обработка в течение 20 мин при температуре 120-121° С, однако вполне приемлемы и менее жесткие режимы (пастеризация в сушильной камере при температуре 105° С в течение 15 мин). Можно также выполнять тепловую обработку отрубей посредством инжекции в них водяного пара, что позволит осуществить одновременно увлажнение отрубей.
Целесообразно поддерживать значение рН в процессе увлажнения в пределах от 4 до 5,5 с целью усилить пастеризационное действие тепловой обработки и облегчить инициацию процесса необходимого брожения.
Кроме стерилизующего действия, тепловая обработка способствует желатинизации содержащегося в пшеничных отрубях крахмала, а следовательно, и доступности этого субстрата для гриба Aspergillus niger, что обеспечивает возможность более эффективного брожения.
Существенное значение имеет увлажнение отрубей, так как влагосодержание оказывает влияние на характеристики брожения. Вначале исходное влагосодержание отрубей регулируют на значение 50-60%, предпочтительнее 50-55%, от общей массы отрубей и воды и поддерживают его в процессе брожения практически неизменным в этом диапазоне, например, путем периодического подвода воды с целью компенсировать убыль воды из среды. Говоря "поддерживают практически неизменным", мы имеем в виду, что вполне приемлемо, чтобы влажность принимала значения, незначительно отклоняющиеся (на ±5% единиц) от диапазона 50-60% в течение относительно кратковременного периода между двумя следующими друг за другом регулировками влажности или по окончании брожения. В любом случае, целесообразно, чтобы уровень влажности не падал ниже 45%. Влажность культуральной питательной среды демонстрирует тенденцию к снижению в процессе выращивания из-за испарения вследствие повышения температуры, вызванного ростом грибов, учитывая, что эта среда является плохим проводником тепла. Значительную роль играет также качество используемой воды. Можно использовать качественную проточную воду или дистиллированную воду.
Инокуляцию пшеничных отрубей можно производить любым подходящим инокулятом. Специалистам в данной области известны многочисленные способы приготовления необходимого инокулята из предварительно выбранного штамма. Целесообразно, чтобы количество инокулята составляло, по меньшей мере, 1× 107 спор/грамм исходного сухого вещества.
Сбраживание можно осуществлять в любом подходящем реакторе. Примеры используемых для этих целей реакторов приведены в статье А. Дюрана с соавторами, опубликованной в Agro-Food-Industry Hi-Tech (май-июнь 1997 г., с.39-42).
Сбраживание можно осуществлять в течение времени от 1 до 3 суток, предпочтительнее от 30 до 60 часов. При длительности процесса менее 1 суток брожение оказывается слишком неполным. По прошествии 3 суток брожение оказывается завершенным или почти завершенным, так что его дальнейшее продолжение неэкономично. Температуру среды поддерживают, как правило, в пределах от 28 до 38° С, предпочтительнее от 32 до 36° С, что соответствует оптимальному диапазону активности, наблюдаемому у штаммов Aspergillus niger, выбранных для целей изобретения. Целесообразно для этого поддерживать температуру воздуха в первые часы брожения в диапазоне 34-38° С с целью стимулирования прорастания спор, а затем понижать ее до 28-32° С в оставшееся время брожения с целью регулирования температуры среды.
Значение рН сбраживаемой среды обычно не регулируют. Если его исходное значение близко к 6,0-6,4, то в процессе выращивания оно снижается до 3,8-4,2, а по его завершении возрастает. Эти изменения коррелируют, как правило, с фазой споруляции гриба. Изменение рН дает наглядное представление о состоянии культуры.
Необходимо предусмотреть в ферментере аэрацию, предпочтительно непрерывную, с целью обеспечить подвод необходимого для брожения кислорода, а также предотвратить излишнее накопление углекислого газа, вырабатываемого при брожении. Кроме того, аэрация способствует регулированию температуры и влажности культуральной среды. Целесообразно предусмотреть достаточное насыщение воздуха водой, с тем чтобы ограничить тенденцию к обезвоживанию среды. Дать какую-либо количественную информацию относительно интенсивности аэрации довольно затруднительно, так как здесь играют роль многие переменные - такие, в частности, как размеры и конфигурация реактора, количество загруженных отрубей и пр. Тем не менее, путем несложных типовых опытов специалист сможет легко определить необходимый в каждом конкретном случае расход.
Загрузку отрубей в реактор следует периодически пополнять в процессе брожения с помощью специальных перемешивающих механизмов типа рычагов, лопастей или шпателей, либо шнеков во избежание формирования непроницаемых масс и с тем, чтобы аэрация затронула всю массу отрубей максимально равномерно. Следует, однако, избегать слишком интенсивного перемешивания, поскольку это может причинить ущерб грибу.
Заявляемый согласно изобретению продукт является твердым продуктом, пригодным, в частности, для получения этилового спирта из пшеницы. Его можно добавлять непосредственно к разжиженному крахмалу (декстринам), получаемому на этапе разжижения, с целью выполнения осахаривания. При таком его применении наиболее существенным фактором является глюкоамилазная активность. Поэтому целесообразно использовать продукт согласно изобретению, который имел бы глюкоамилазную активность, например, не менее 750 Г ед., предпочтительнее не менее 1500 Г ед. на грамм сухого вещества.
Другое возможное применение заявленного продукта относится к получению корма на пшеничной основе для моногастральных животных (с однокамерным желудком), таких как домашняя птица и свиньи. В этом случае наиболее важным фактором становится ксиланазная активность. Поэтому здесь целесообразно использовать продукт, который имел бы ксиланазную активность, например, не менее 400 К ед. на грамм сухого вещества.
При необходимости предлагаемый продукт может быть подвергнут высушиванию или замораживанию для целей хранения.
Сушку следует производить при умеренной температуре, с тем чтобы не вызвать отрицательных последствий для ферментативной активности. Так, например, хорошие результаты дала сушка в сушильной камере при температуре 40° С. Замораживание можно осуществлять для влажных продуктов при низкой температуре, например, -20° С.
В ходе процессов, иллюстрируемых в приводимых ниже примерах, различные ферментативные активности измеряли с использованием следующих методов.
а) Глюкоамилазная активность
При воздействии препарата глюкоамилазы (ГА) на крахмальный раствор происходит выделение редуцирующих сахаров. При нагреве до 100° С в присутствии 3,5-динитросалициловой кислоты (ДНС) эти композиции принимают коричневую окраску, определяемую по спектрофотометру (Kontron Instruments, Милан, Италия) при 540 нм.
Реакционная среда содержит:
- 1%-ного крахмального раствора 500 мкл;
- нитратного буфера 450 мкл;
- раствора фермента 50 мкл.
Реакция протекает в течение 30 мин при температуре 60° С (для препаратов глюкоамилазы A. orizae - 55° С). Каждые 5 мин производят отбор проб, смешивают их с ДНС и помещают в ледяную баню. После этого их нагревают в течение 5 мин при температуре 100° С, быстро охлаждают и, наконец, производят их количественный анализ на 540 нм.
Указанные условия количественного анализа были определены после изучения влияния температуры и рН на активность препаратов ГА. В качестве субстрата для этого ферментативного гидролиза использовали растворимый крахмал фирмы Merck (Дармштадт, ФРГ). ДНС приготавливают в соответствии с процедурой, предложенной Р.Bernfeld, Methods in enzymology, 1, 149-159 (1955):
- предварительно растворить:
- 10 г 3,5-динитросалициловой кислоты
- 200 мл 2-молярного гидроксида натрия
- 200 мл дистиллированной воды
- далее добавить:
- 300 г тартрата натрия и калия
- довести объем до 1 л с помощью дистиллированной воды после полного растворения.
После приготовления этого реагента его следует хранить с защитой от действия света. Калибровочные кривые построены с использованием глюкозы в качестве эталонного продукта для количественного анализа глюкоамилазной активности и контроля реакций разжижения-осахаривания и с использованием ксилозы для измерения ксиланазной активности.
Одна единица глюкоамилазной активности (Г ед.) соответствует количеству фермента, необходимому для расщепления одного микромоля субстрата в минуту, где в качестве эталона используется глюкоза. Глюкоамилазную активность, вычисляемую по приведенной ниже формуле, соотносят с количеством исходного сухого вещества (ИСВ):
А=(Р/Vэнз)*(Vферм/Мферм)
- А - ГА активность, выраженная в Г ед.· г ИСВ-1 (мкмоль· мин-1·г ИСВ-1),
- Р - скорость выделения эквивалентов глюкозы в мкмоль· мин-1,
- Vэнз - объем ферментного раствора, определяемый в мл,
- Vферм - суммарный объем дистиллированной воды, используемый для экстрагирования ферментного раствора, в мл,
- Мферм, выражаемая в г ИСВ, - исходная масса сухого продукта, из которого экстрагирован ферментный раствор.
б) Протеазная активность
Этот количественный анализ был разработан для азоказеина по методике Бейнона, описанной в работе "Способы очистки протеинов - Практический подход" под ред. Э.Л.В. Хэрриса и С. Энгела, IRL-Press, Oxford University Press, 1-66 (1989). Расщепление этого субстрата протеазами приводит к выделению азогрупп, поглощающих в УВ-диапазоне 340 нм. По изменению абсорбционной способности в процессе кинетики гидролиза этого протеина можно судить об интенсивности реакции.
Реакционная среда содержит:
- 1%-ного раствора азоказеина с рН 5,0 1000 мкл
- раствора фермента 200 мкл
Азоказеин (Sigma, Сент-Луис, США) растворяют в ацетатном буфере 0,1 М с рН 5,0. Количественный анализ протеазных активностей проводили именно при этом рН, поскольку при меньших значениях азоказеин нерастворим в указанном ацетатном буфере. Ферментативную реакцию осуществляют при температуре 60° С. В течение 20 мин каждые 5 мин производят отбор проб и смешивают их с 5%-ной трихлоруксусной кислотой (ТХУ) для прекращения реакции.
Одна единица протеазной активности (П ед.) соответствует количеству ферментов, необходимому для увеличения единицы А340нм на 0,01 в минуту, обусловленного выделением азогрупп в указанных выше условиях. Эту активность, вычисляемую по приведенной ниже формуле, соотносят с исходным сухим веществом (П ед.· г-1 ИСВ) или с глюкоамилазной активностью (П ед.· г ед.-1):
А=(Р/Vэнз)· (Vферм/Мферм)
- А - протеазная активность, выраженная в П ед.· г ИСВ-1,
- Р - скорость выделения азогрупп, выраженная в виде увеличения единицы А340нммин-1 на 0,01,
- Vэнз - объем ферментного раствора, определяемый в мл,
- Vферм - суммарный объем дистиллированной воды, используемый для экстрагирования ферментного раствора, в мл,
- Мферм, выражаемая в г ИСВ, - исходная масса сухого продукта, из которого экстрагирован ферментный раствор.
в) Ксиланазная активность
Для выявления этой ферментативной активности осуществляли реакцию препаратов ГА с раствором растворимого ксилана и измеряли выделяемое количество редуцирующих сахаров по методу ДНС.
Реакционная среда включает:
- 1%-ного раствора ксилана с рН 4,5 900 мкл
- ферментного раствора 100 мкл
Раствор лиственничного ксилана (камеди) (Sigma, 1%) приготавливают в цитратном буфере с рН 4,5 и ведут реакцию при температуре 60° С. В течение 20 мин каждые 5 мин отбирают пробы, смешивают их с ДНС и помещают в ледяную баню. Затем производят их количественный анализ в соответствии с процедурой, аналогичной той, которая была описана применительно к измерению ГА-активности с использованием ксилозы в качестве эталона.
Одна единица ксиланазной активности (К ед.) соответствует количеству ферментов, необходимому для выделения одного микромоля редуцирующих сахаров в минуту. Эту активность соотносят с исходным сухим веществом (К ед.· г-1 ИСВ) или с глюкоамилазной активностью (К ед.· Г ед-1). Для расчета этой активности используют ту же формулу, что и для расчета ГА-активностей, где:
- А - ксиланазная активность, выраженная в К ед.· г ИСВ-1 (мкмоль· мин-1·г ИСВ-1),
- Р - скорость выделения эквивалентов ксилозы в мкмоль· мин-1,
- остальные члены формулы остаются неизменными.
ПРИМЕР 1 - Отбор штаммов Asperyllus
Проводили сравнительное исследование способности семи разных имеющихся на рынке штаммов Aspergillus к производству глюкоамилазы в процессе твердофазного сбраживания пшеничных отрубей.
Опыты проводили на 50 г сбраживаемой среды в колбе Эрленмейера. Среда состояла из 21,5 г пшеничных отрубей, 27,5 г воды и 1 г крахмала пшеницы. Исходное значение рН среды составляло 6,0-6,5. Среду стерилизовали в автоклаве в течение 20 мин при температуре 120° С.
Каждую среду засевали испытуемым штаммом в количестве 2× 107 спор на грамм исходного сухого вещества. Возраст спор был равен 3 суткам. Обеспечивали возможность брожения в течение 40-50 часов, при этом колбы Эрленмейера помещали в термостат с температурой 35° С. По окончании брожения сброженную среду перемешивали со 150 мл дистиллированной воды с целью перевода полученных ферментов в раствор, после чего смесь подвергали фильтрации для извлечения ферментного раствора. Раствор центрифугировали с целью удаления остаточных спор и частиц, затем расфасовывали раствор во флаконы по 100 мл, которые хранили при температуре -20° С до определения глюкоамилазной активности.
Испытуемые штаммы и полученные результаты сведены в нижеследующую Таблицу 1.
Можно заметить, что штаммы A.niger NRLL 3112, A.niger ATCC 76061 и А.oryzae ATCC 22788 демонстрируют наивысшую активность в смысле производства глюкоамилазы.
Однако следует принимать во внимание и другое важное свойство - стабильность получаемой глюкоамилазы. Поэтому были проведены испытания на теплоустойчивость путем тепловой обработки ферментных растворов при температуре 55 и 60° С в течение 30 мин. с измерением по прошествии этого времени глюкоамилазной активности. Эти операции подобны рабочим режимам, используемым при осахаривании крахмала. Было обнаружено, что наиболее устойчивые
глюкоамилазы получены от штаммов A.niger ATCC 76061 и A.niger NRLL 3112 (100%-ная остаточная активность по прошествии 30 мин при температуре 55° С и примерно 50%-ная остаточная активность по прошествии 30 мин при температуре 60° С), тогда как штаммы A.oryzae ATCC 22788 и ATCC 42149 дают глюкоамилазы с нулевой остаточной активностью по прошествии 30 мин при температуре 60° С и 46%-ной остаточной активностью по прошествии 30 мин при температуре 55° С. Поэтому были отобраны именно штаммы А.niger ATCC 76061 и NRLL 3112. Кроме того, оказалось, что штамм А.niger NRLL 3112 генетически довольно неустойчив (потеря активности после нескольких репродуктивных циклов), так что наиболее предпочтительным следует признать все же штамм А.niger ATCC 76061. По этой причине он и был отобран для последующих примеров.
ПРИМЕР 2 - Получение глюкоамилаз в нестерильных экспериментальных чанах по 50 л, поставляемых INRA: важное значение предварительной обработки пшеничных отрубей
Опыты проводили с использованием нестерильного ферментера емкостью 50 л, аналогичного описанному в цитировавшейся выше статье А.Дюрана с соавторами (фиг.1), и пшеничных отрубей марки ВСЕ, поставляемых спиртовым заводом Brie Champagne Ethanol в Провенсе, Франция. Для получения 5 кг культуральной среды с 55%-ным влагосодержанием использовали два следующих метода приготовления отрубей:
- сухие отруби: отруби стерилизуют в автоклаве в течение 1 ч при температуре 105° С, после чего смешивают с водой (опыт F4C3);
- мокрые отруби: отруби увлажняют в месильной машине до 45% и автоклавируют в течение 20 мин при температуре 121° С (опыт F4C4).
В обоих случаях производят инокуляцию количеством, равным 2× 107 спор· г-1 СВ (сухого вещества), и регулируют влагосодержание сред на значение порядка 55%. Затем их сбраживают на 10-сантиметровом слое в аэрируемых чанах. В ходе этих операций выращивания среду подвергают прерывистому рассеканию шпателем для снижения ее температуры. В процессе брожения атмосферу непрерывно обновляют кондиционированным воздухом, температура, влажность и расход которого приведены в таблицах.
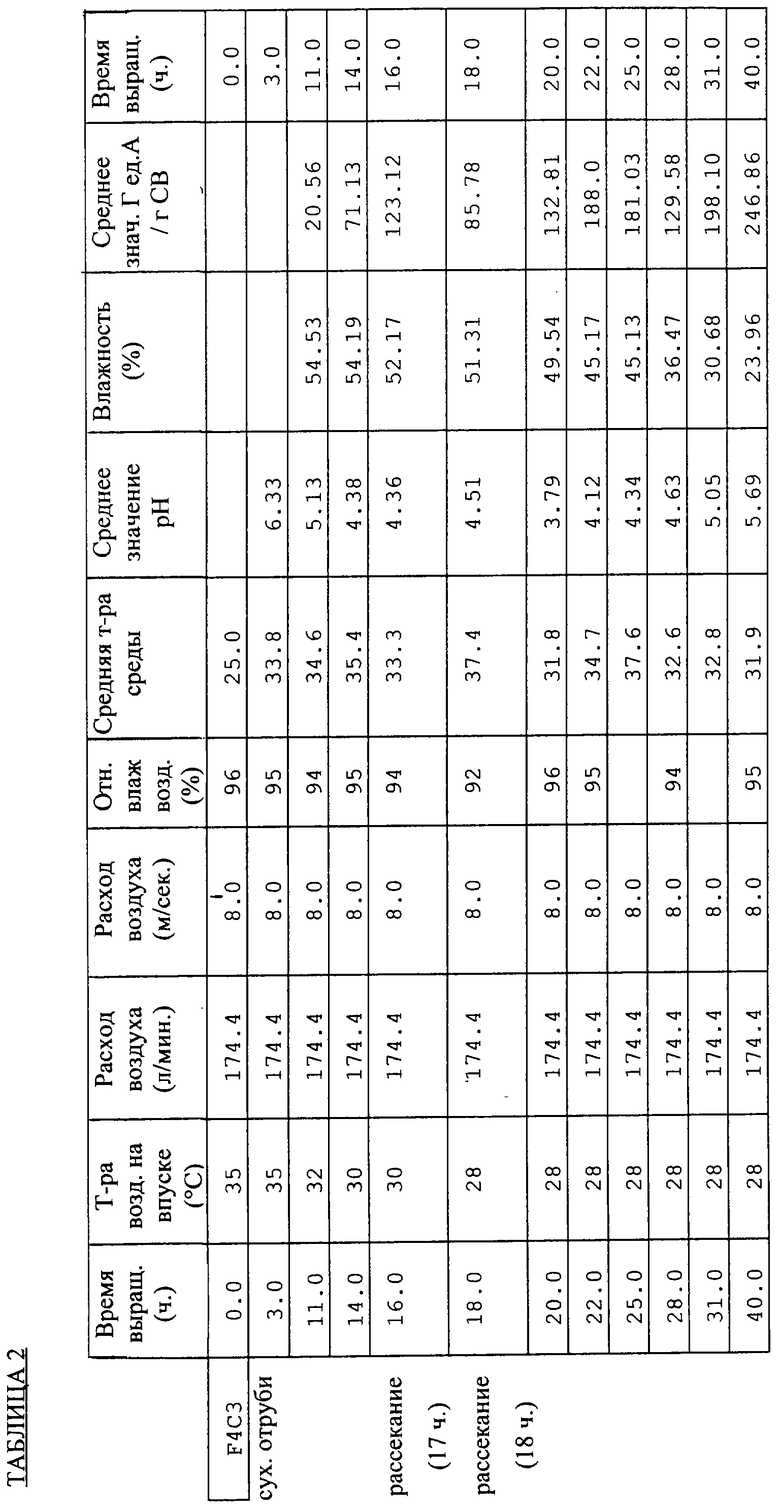
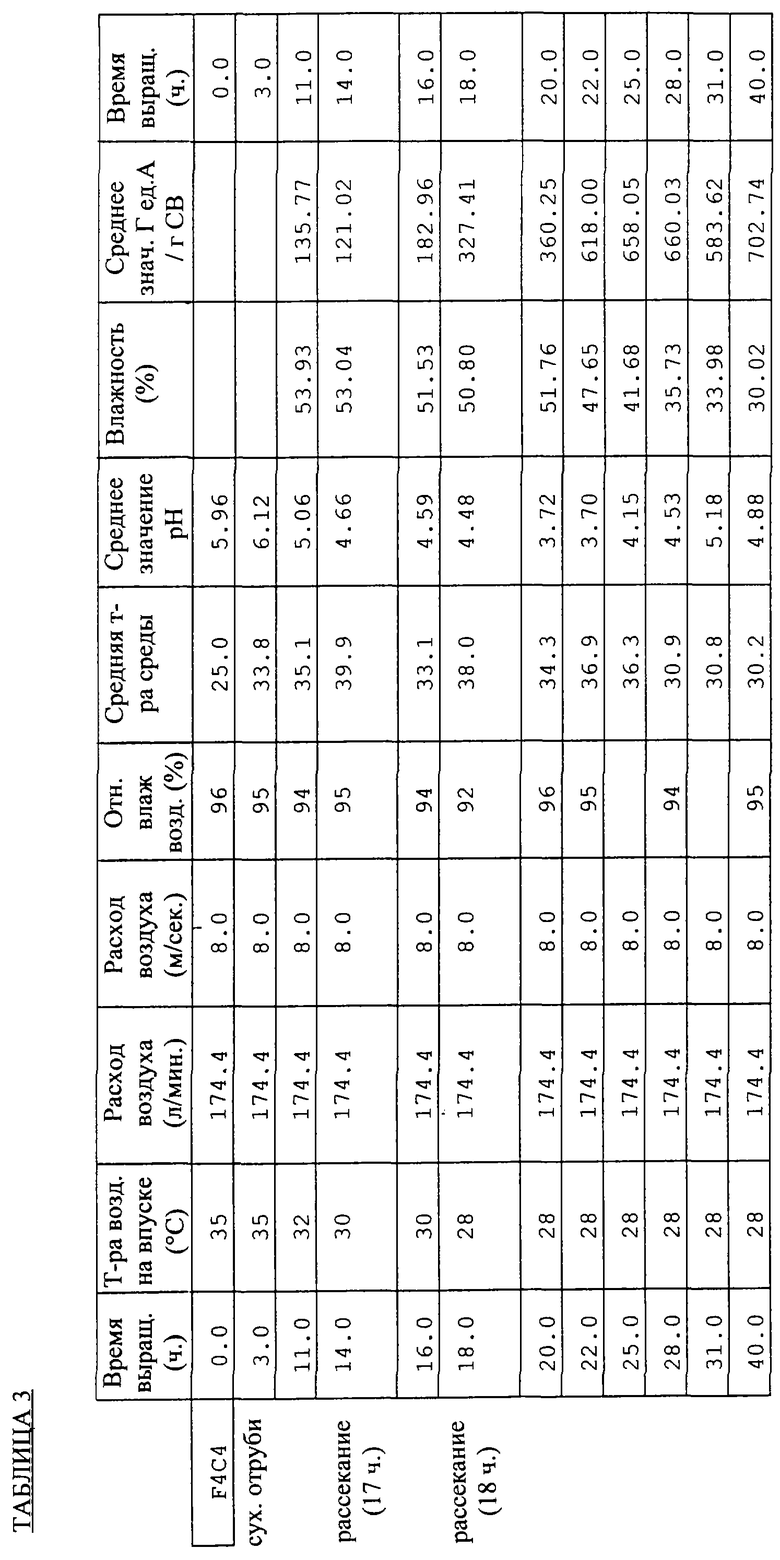
Результаты сведены в Таблицы 2 (для опыта F4C3) и 3 (для опыта F4C4).
Полученные данные позволяют сделать ряд следующих выводов.
- Для обеспечения эффективного производства глюкоамилаз необходимо перед тепловой обработкой пшеничных отрубей выполнить их увлажнение. Помимо обеззараживания, тепловая обработка пшеничных отрубей способствует, вероятно, желатинизации крахмала.
- Значение рН представляется хорошим количественным показателем динамики роста и производства грибных ГА, не позволяя при этом, однако, выполнить оценку получаемых количеств ГА.
- Умеренное перемешивание (рассекание) среды не оказывает сколько-нибудь вредного воздействия на производство ферментов.
- Изменение влагосодержания в процессе рассмотренных циклов брожения указывает на существенное высыхание культуральной среды, которое может нанести ущерб росту грибов.
ПРИМЕР 3 - Получение глюкоамилаз в экспериментальном ферментере, поставляемом фирмой FUJIWARA: важное значение поддержания влажности среды в процессе брожения
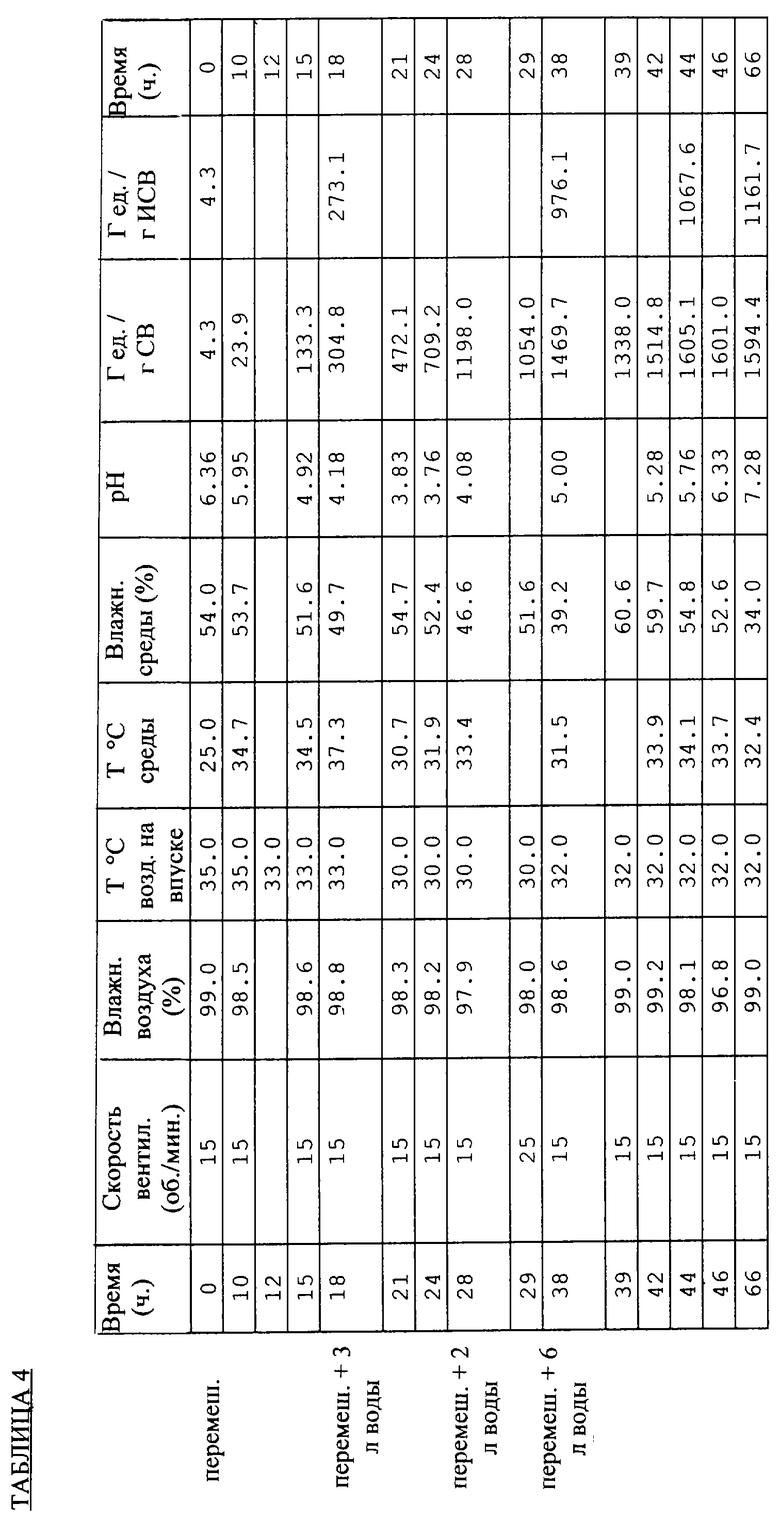
Этот опыт проводили с использованием ферментера, выпускаемого фирмой FUJIWARA, Окаяма, Япония, и пшеничных отрубей марки ВСЕ. Его отличие от ферментера, описанного в Примере 2, состоит, в частности, в диаметре чана, который равен 0,66 м, в отличие от 0,35 м для чанов INRA. В этом ферментере необходимо использовать 20 кг среды с 55%-ным содержанием воды, приготавливаемой по "методу мокрых отрубей", описанному в Примере 2, что дает возможность выращивания на слое толщиной 12 см. Перемешивание обеспечивается тремя непрерывно вращающимися вертикальными шнеками, которые встряхивают среду во вращающемся чане (5-10 мин/об.). В процессе брожения, как и в случае с чанами INRA в Примере 2, газовая атмосфера непрерывно замещается кондиционированным воздухом, температура, влажность и расход которого приведены в Таблице 4.
В ходе этого опыта, которому присвоен индекс FII, исследовали возможности регулирования влагосодержания. Здесь прибегали к точечным измерениям влажности культуры с помощью инфракрасного прибора, а также массы среды для определения необходимого количества воды, добавляемой с целью поддержания влагосодержания среды на уровне более 50%.
Результаты этого опыта FII сведены в Таблицу 4. Полученные данные требуют следующих комментариев.
- Из опыта FII с очевидностью следует, что благодаря поддержанию влагосодержания на уровне от 50 до 55% стимулируется производство ферментов с выделением 1600 Г ед./г СВ по прошествии 44 ч брожения, что более чем вдвое превышает активность, достигаемую в ходе опыта F4C2 в Примере 2, где подобное регулирование не предусмотрено.
- Стабилизация производства ферментов после 44 ч брожения, совпадающая с появлением грибных спор, указывает на то, что нет необходимости в продолжении выращивания по окончании этой фазы.
- Удовлетворительное регулирование температуры среды на уровне около 35° С может быть достигнуто надлежащим сочетанием кондиционирования воздуха с перемешиванием среды.
- Культура беспрепятственно выдерживает прерывистое перемешивание, осуществляемое соответствующими средствами, предусмотренными в ферментере фирмы FUJIWARA.
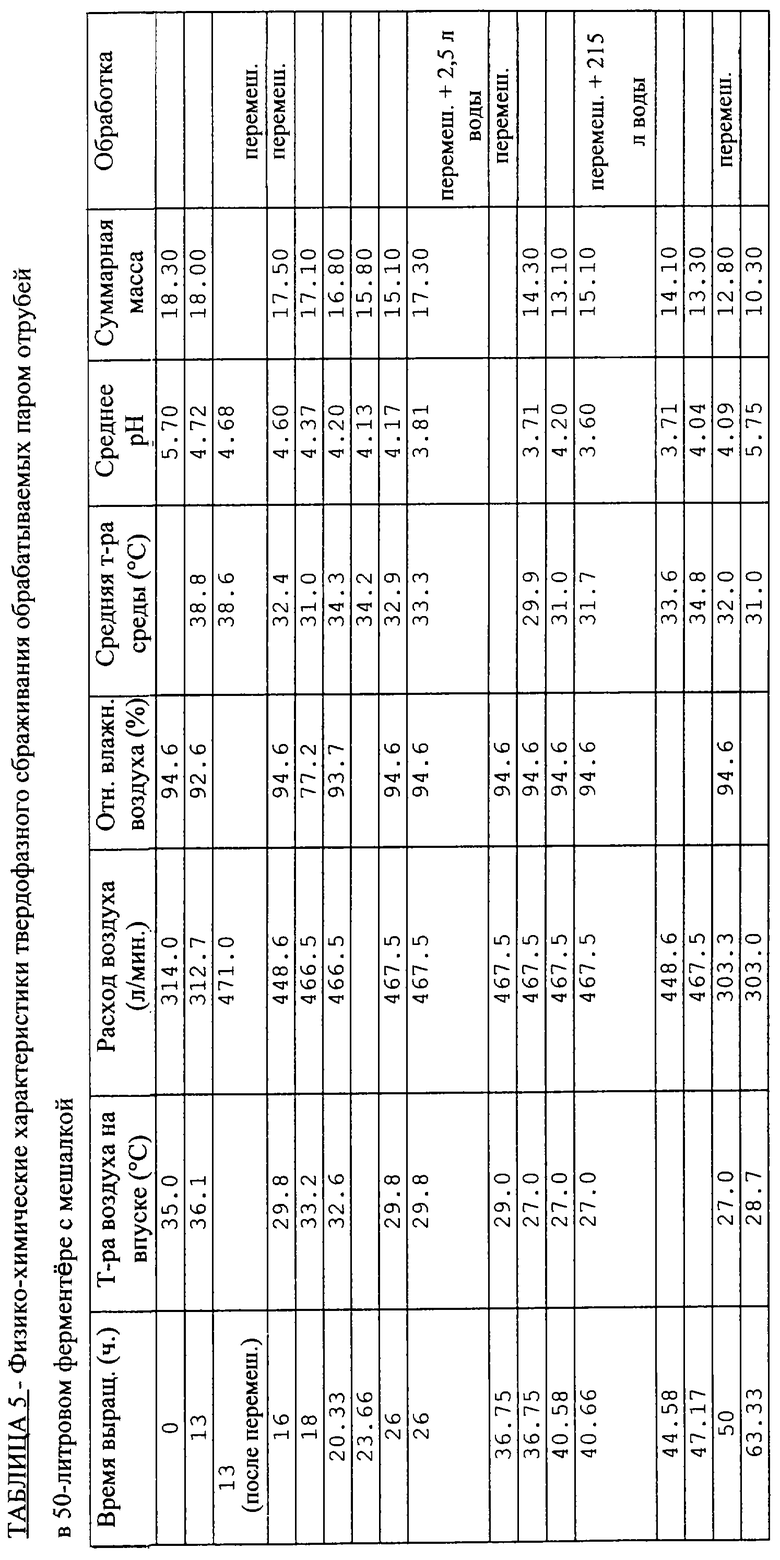
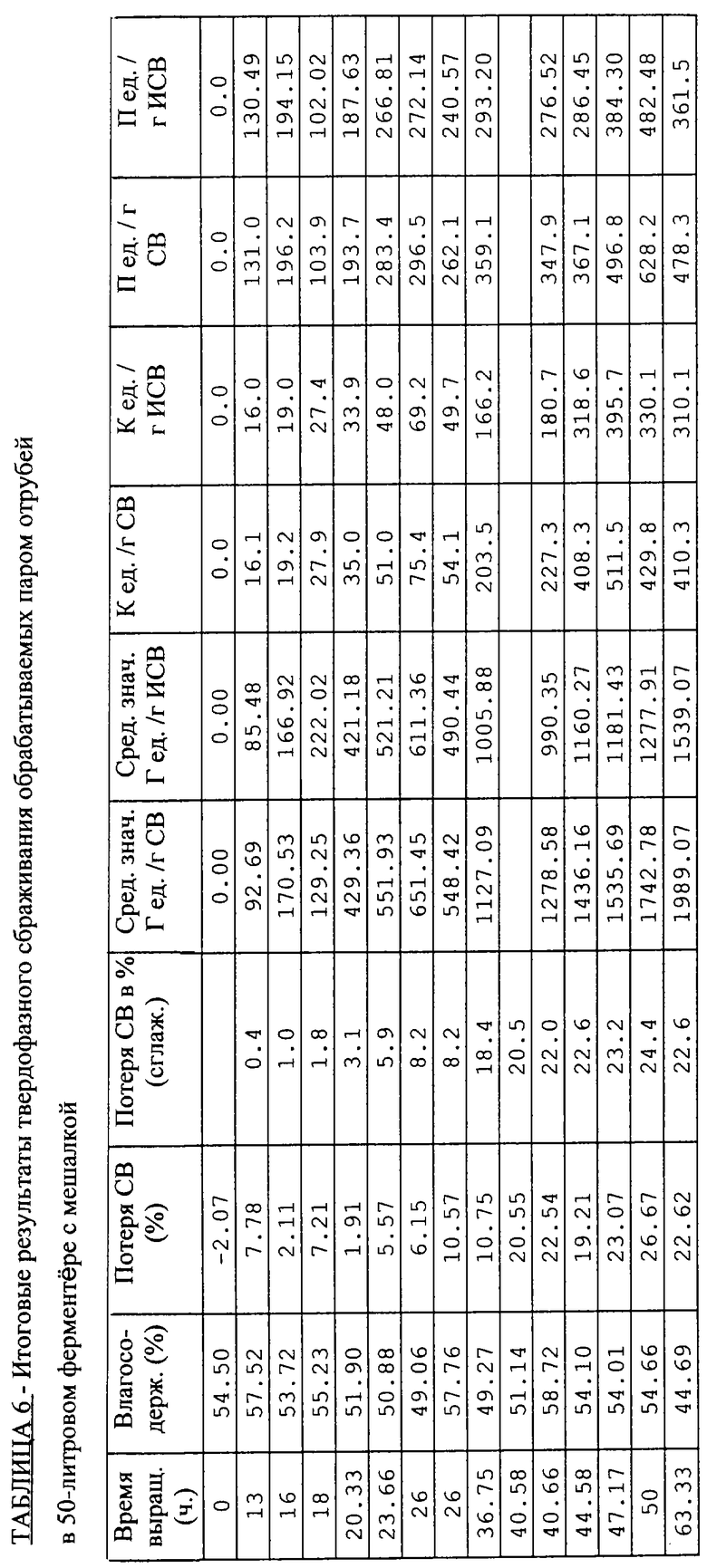
ПРИМЕР 4 - Получение глюкоамилаз в экспериментальном ферментере INRA емкостью 50 л с мешалкой: целесообразность предварительной паровой обработки отрубей и выращивания в "стерильных условиях"
Этот экспериментальный ферментер аналогичен описанному в документе WO-А-9418306 и показанному на фиг.4 в цитировавшейся выше статье А. Дюрана с соавторами. Благодаря этой установке становится возможной паровая обработка отрубей непосредственно в ферментере, каковой способ приготовления в промышленном масштабе является предпочтительным. Кроме того, культуру приготавливают, засевают и выращивают в стерильных условиях, за исключением отборов проб, что придает этому опыту полустерильный характер, в отличие от двух предыдущих примеров.
А) Условия проведения эксперимента
В ферментер загружают 9 кг отрубей ВСЕ, предварительно увлажненных водой в количестве 1,5 л, и затем стерилизуют непосредственно на месте в течение 20 минут при температуре 121° С с периодическим перемешиванием в течение 5 секунд через каждые 5 минут. Благодаря такой обработке удается добиться влагосодержания 46%, которое впоследствии, на этапе инокуляции, доводят до 55%.
Отруби инокулируют препаратом типа koji:
180 г отрубей ВСЕ (с исходной влажностью 55%), сбраживаемых в течение 4 суток при температуре 35° С, смешивают с 3 литрами стерилизованной воды для получения суспензии спор, составляющей инокулят.
Исходные условия сбраживания таковы:
18,3 кг культуры с 55%-ной влажностью и исходным рН 5,7;
высота слоя 40 см;
скорость аэрации 314 л· мин-1;
температура поступающего воздуха 35° С;
относительная влажность поступающего воздуха 95%.
Б) Контроль за брожением
Кроме определения рН, температуры среды, процентного содержания сухого вещества и производства ГА, осуществляют непрерывную регистрацию изменения массы культуры в 50-литровом ферментере с мешалкой, а в нестерильном реакторе производят взвешивание культуры по прошествии 21 ч и 42 ч брожения.
Подобные измерения массы имеют двоякую выгоду.
Поддержание влажности в процессе выращивания посредством оценки процентного содержания сухого вещества (СВ)
В процессе брожения уменьшению массы культуры способствуют два фактора, а именно:
- высыхание среды, которое компенсируется благодаря подводу воды;
- потеря сухого вещества, которая связана с ростом гриба.
Эта потеря сухого вещества довольно существенна: за 40 ч выращивания теряется 20% СВ, или 0,5% СВ в час, если допустить в порядке приближения, что потери являются линейными.
Исходя из этого, если известна масса культуры (M(t)) в определенный момент времени, то можно вывести из нее теоретическое процентное содержание СВ в момент t по следующей формуле:
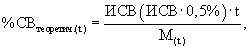
где ИСВ – количество исходного сухого вещества.
В случае, когда вычисленный таким образом % СВ превышает 50%, добавляют стерилизованную воду для его снижения до 45%.
Результаты на грамм исходного СВ
Изменения массы и измеренного процентного содержания СВ позволяют рассчитать потерю реального сухого вещества (Lсв, выражаемую в %) в процессе выращивания. Таким образом, количество ГА, которое до сих пор выражали в Г ед.· г-1 СВ, можно выразить в Г ед. · г-1 исходного СВ с помощью следующей формулы:
(Г ед.· г-1 ИСВ)=(Г ед.· г-1 СВ)· (100-Lсв)/100
В) Результаты
В Таблицы 5 и 6 сведены рабочие условия и результаты, полученные в реакторе с мешалкой для подвергнутых паровой обработке отрубей.
Несмотря на аэрацию культуры влагонасыщенным воздухом, она обезвоживается настолько, что пришлось, как видно из Таблицы 5, дважды регулировать ее влагосодержание, когда оно падало до уровня менее 50%.
Удалось поддерживать температуру среды на среднем уровне 35° С путем уменьшения количества подводимого воздуха, но главным образом - с помощью прерывистого перемешивания.
В этих условиях культивирования рост гриба, ход которого контролировали путем измерения рН, поддерживается в течение 60 ч и позволяет достичь производства 1436 Г ед.· г-1 СВ за время 44 ч и 1990 Г ед.· г-1 СВ за 63 ч. Если привести количество получаемой ГА к исходному СВ, оно составит, соответственно, 1160 и 1540 Г ед.· г-1 ИСВ. Для сравнения укажем, что в рамках Примера 3 за 44 ч выращивания было получено 1605 Г ед. · г-1 СВ, что эквивалентно 1067 Г ед. · г-1 ИСВ. Можно отметить определенную выгоду, так как из приведенных данных видно, что хотя в обоих опытах производительность одинакова, однако условия эксперимента по Примеру 4 дают возможность продлить производство ферментов даже при высоте слоя в 40 см.
Таким образом, обработка отрубей паром с последующим сбраживанием в 50-литровом реакторе INRA с мешалкой обеспечивает продление выращивания гриба производства ферментов.
Если привести количество получаемой ГА к исходному СВ, оно составит 1540 Г ед. · г-1ИСВ.
Для тех же проб было проведено количественное определение ксиланазной и протеазной активностей. Полученные результаты оказались вполне удовлетворительными, при этом максимальные значения после 50 ч брожения составили в среднем:
350 К ед.· г-1 ИСВ для ксиланаз;
400 П ед.· г-1 ИСВ для протеаз.
Благодаря непрерывной регистрации массы удалось вычислить потерю сухого вещества в процессе выращивания. Она составила порядка 23% по прошествии 60 ч выращивания (с точностью до 2% с учетом погрешности взвешивания).
ПРИМЕР 5 - Использование сброженных отрубей, полученных в опыте по Примеру 4, для гидролиза пшеничной муки
Был проведен ряд опытов по осахариванию отрубями, полученными в Примере 4, пшеничной муки, предварительно подвергнутой традиционному ферментному разжижению. В качестве контрольного образца использовали глюкоамилазный препарат AMG 300L®, выпускаемый фирмой NOVO. Объектом этих опытов была обычная пшеничная мука типа 45. Рабочие режимы сведены в Таблицу 7 применительно к количеству сусла 750 г.
В ходе этого гидролиза пшеничной муки каждый раз производили отбор трех проб среды. Результаты по концентрациям редуцирующих сахаров (PC) в различные моменты осахаривания, приведенные в Таблице 8, представляют собой средние значения для указанных трех отборов. Эти количественные определения, для которых была применена методика ДНС, выполнялись на надосадочной жидкости центрифугированных проб. Измеряли также конечную вязкость осахаренных продуктов.
(г/л)
Кроме того, наблюдалось увеличение содержания растворимого азота в сусле после осахаривания, что объясняется протеолитическим действием сброженных отрубей.
Эти результаты свидетельствуют о том, что получаемые в опытах по Примеру 4 сброженные отруби способны гидролизовать пшеничную муку столь же эффективно, как и стандартный препарат ГА, независимо от методики их хранения.
Гидролиз муки сброженными отрубями приводит также к существенному уменьшению вязкости по сравнению с традиционным ферментным препаратом.
ПРИМЕР 6
На этом примере иллюстрируется возможность получения значительных количеств ксиланаз и небольшого количества глюкоамилаз с помощью штамма Aspergillus niger.
Рассматриваемый опыт проводили на экспериментальном ферментере фирмы Fujiwara с использованием отрубей ВСЕ и штамма А. niger ATCC 201202, известного своей способностью к производству ксиланаз. Работа экспериментального ферментера описана в Примере 3. В данном случае брали 20 кг среды с 55%-ной влажностью, приготовленной в соответствии с изложенным в Примере 2. Как и в Примере 3, влажность среды поддерживали в процессе брожения на уровне более 50% и регулировали температуру среды в пределах около 35° С.
По прошествии 37 часов брожения в указанных условиях штамм A. niger ATCC 201202 произвел сброженные отруби, содержащие 727 К ед.· г СВ и 162 Г ед.· г СВ.
ПРИМЕР 7 - Целесообразность включения сброженных отрубей согласно изобретению в птичий корм на пшеничной основе, предназначенный для бройлеров
Известно, что содержащиеся в пшеничной муке гемицеллюлазы частично растворимы в воде и повышают вязкость содержимого кишечника, вследствие чего ослабляются выделение и поглощение питательных веществ.
Было установлено, что добавление гемицеллюлаз ведет к расщеплению гемицеллюлоз, в результате чего становится возможным уменьшение вязкости содержимого кишечника и улучшение зоотехнических характеристик моногастрических животных, каковыми являются бройлеры, питающиеся кормами, единственным злаком в составе которых является пшеница.
Был проведен опыт на 1200 бройлерах Росса с целью демонстрации выгоды от использования сброженных отрубей с гемицеллюлазной (ксиланазной) активностью в сравнении с бесферментным кормом и кормом, содержащим стандартный источник ксиланазы - продукт Avizyme®. Корма с ферментом или без такового приготавливали таким образом, чтобы прокормить 4 группы по 300 цыплят. Детальный состав этого корма приведен в Таблице 9. В первые 21 день выкармливания бройлерам давали корм для роста (КР), который затем заменяли "доводочным" кормом (ДК) на последующие 18 дней.
В корм 1 ферменты не добавляли. В корма 2 и 3 включали соответственно по 3 и 5 кг сброженных отрубей на тонну корма. В корм 4 включали 0,6 кг Avizyme® на тонну корма.
Результаты этого опыта по прошествии 39 суток выкармливания сведены в Таблицу 10.
б. Avizyme® поставляется финской фирмой Finfeed;
в. отношение веса потребленного корма к привесу
г. процентное снижение веса потребленного корма относительно веса потребленного корма 1 (без фермента).
Благодаря включению сброженных отрубей в птичий корм (3 или 5 кг/тонну) удалось значительно снизить коэффициент трансформации корма. В условиях эксперимента использование дозы сброженных отрубей более 3 кг/тонну не дает, по-видимому, сколько-нибудь существенной практической выгоды. Отмеченное улучшение сравнимо с получаемым при использовании имеющегося на рынке продукта Avizyme® (0,6 кг/тонну). Тем не менее, применение сброженных отрубей обладает тем преимуществом, что оно требует меньших затрат, чем при работе с ферментативным продуктом, имеющимся в продаже.
Разумеется, описанные выше варианты осуществления изобретения приведены лишь в качестве примеров, так что возможны их разнообразные модификации, в частности путем замены на технические эквиваленты, если не выходить при этом за пределы объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ ДОБАВКА ДЛЯ СРЕДЫ СПИРТОВОГО БРОЖЕНИЯ | 2007 |
|
RU2495926C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА ASPERGILLUS AWAMORI - ПРОДУЦЕНТ КОМПЛЕКСА ФЕРМЕНТОВ ГЛЮКОАМИЛАЗЫ И КСИЛАНАЗЫ | 2011 |
|
RU2457246C1 |
| СПОСОБ ПРЕОБРАЗОВАНИЯ ГРАНУЛИРОВАННОГО КРАХМАЛА В ЭТАНОЛ | 2007 |
|
RU2460798C2 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА ASPERGILLUS AWAMORI - ПРОДУЦЕНТ ГЛЮКОАМИЛАЗЫ | 2000 |
|
RU2196821C2 |
| Способ получения биомодифицированного белкового продукта из тритикалевых отрубей | 2016 |
|
RU2662981C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ПРОДУЦЕНТ КОМПЛЕКСА ФИТАЗЫ А И ЭНДО-1,4-β-ГЛЮКАНАЗЫ II И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ДОБАВКИ В КОРМАХ | 2022 |
|
RU2810538C2 |
| ШТАММ ГРИБА PENICILLIUM VERRUCULOSUM ПРОДУЦЕНТ КОМПЛЕКСА ФИТАЗЫ А И ЭНДО-1,4-β-КСИЛАНАЗЫ Е И ФЕРМЕНТНЫЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ДОБАВКИ В КОРМАХ | 2023 |
|
RU2819918C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ЗЕРНОВОГО СЫРЬЯ НА СПИРТ И КОРМОВОЙ ПРОДУКТ | 2009 |
|
RU2396007C1 |
| ШТАММ МИЦЕЛИАЛЬНОГО ГРИБА ASPERGILLUS AWAMORI - ПРОДУЦЕНТ ГЛЮКОАМИЛАЗЫ | 2002 |
|
RU2245364C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО КОДЖИ | 2006 |
|
RU2409659C2 |
Изобретение относится к биотехнологии, может быть использовано для производства этилового спирта или корма моногастральных животных. Полиферментный продукт с глюкоамилазной, протеолитической и ксиланазной активностями получен ферментацией пшеничных отрубей, с помощью микроорганизма Aspergillus niger, причем указанные глюкоамилазная, протеолитическая и ксиланазная активности имеют следующие минимальные значения: глюкоамилазная активность - по меньшей мере, 100 Г ед. на грамм сухого вещества; протеолитическая активность - по меньшей мере, 100 П ед. на грамм сухого вещества; ксиланазная активность - по меньшей мере, 100 К ед. на грамм сухого вещества, при условии, что глюкоамилазная активность должна составлять, по меньшей мере, 750 ед. Г на грамм сухого вещества и/или ксиланазная активность должна составлять, по меньшей мере, 300 ед. К на грамм сухого вещества. Изобретение обеспечивает повышение растворимого азота в сусле после осахаривания, уменьшение вязкости продукта, эффективность их использования. 2 н. и 12 з.п. ф-лы, 10 табл.
| В.Л.ЯРОВЕНКО и др | |||
| Производство ферментных препаратов из грибов и бактерий | |||
| - М.: Пищевая промышленность, 1970, с.100-106 | |||
| LABELLE et al | |||
| Comparative study of wheat flour saccharification and ethanol production with two glucoamylase preparation | |||
| INDUSTRIAL CROPS AND PRODUCTS | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА И ФЕРМЕНТНЫЙ ПРЕПАРАТ | 1994 |
|
RU2057179C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ МИКРООРГАНИЗМОВ | 1996 |
|
RU2112806C1 |
Авторы
Даты
2005-02-20—Публикация
2000-01-25—Подача