Область техники
Настоящее раскрытие было создано с поддержкой Министерства науки, ИКТ (информационно-коммуникационные технологии) и перспективного планирования Республики Корея согласно проекту №2016M3A9D3021340, который был проведен в исследовательском проекте, названном "Research on Multifunctional Fusion T Cell Therapy Using Chimeric Antigen Receptor and В Cells" в исследовательской программе, названной "Biomedical Technology Development Project (Next-Generation Bio) Immunity Mechanism Control Technology Development", осуществляемой Фондом промышленно-академической кооперации Сеульского национального университета под управлением Национального фонда исследований Кореи, с 01 мая 2016 г. до 31 января 2021 г.
В данной заявке испрашивается приоритет и преимущество корейской патентной заявки №10-2018-0125538, поданной в Корейское ведомство по интеллектуальной собственности 19 октября 2018 г, раскрытие которой включается в данный документ посредством ссылки.
Настоящее раскрытие относится к антителу против L1CAM или его антигенсвязывающему фрагменту, которое специфично связывается с антигеном L1CAM, химерному рецептору антигена, содержащему его, и к их применениям.
Предшествующий уровень техники
Рак яичника представляет собой самую смертельную гинекологическую злокачественную опухоль и главную причину смертей, связанных с гинекологическими опухолями. Несмотря на то, что были сделаны значительные успехи в комбинированных терапиях на основе хирургического подхода и цитотоксической терапии, у большинства пациентов с продвинутыми стадиями во время постановки диагноза в конечном счете наблюдается рецидив. Следовательно, срочно требуются новые способы лечения против рака яичника. Поскольку постепенно выявляются факты о том, что рак яичника может появляться из-за иммунологических причин, и рак яичника может распознаваться и атаковаться иммунной системой, активно исследуются разные способы лечения на основе иммунотерапии. Большое число пептидных вакцин, вакцин на основе дендритных клеток и адоптивных клеточных терапий фактически находятся на стадии клинических испытаний.
В частности, недавно было доказано то, что адоптивные терапии против гематологического рака посредством Т-клеток, экспрессирующих химерный рецептор антигена (CAR), имеют терапевтический потенциал, и они были выведены на рынок. Кроме того, недавно опубликованные результаты исследования свидетельствуют о том, что CAR-T могут демонстрировать аналогичные влияния даже на солидные раковые заболевания. CAR уникален в том, что он придает цитотоксические эффекторные функции Т-клеткам способом, не ограниченным HLA (человеческий лейкоцитарный антиген), и CAR является очень важным в связи с тем, что прогрессирование рака яичника коррелирует с понижающей регуляцией HLA. На самом деле, предпринимались попытки лечения рака яичника с использованием CAR-T, специфичных к мезотелину, MUC16 и рецепторам фолата, которые известны в качестве факторов, связанных с раком яичника, но их лечебные эффекты пока еще не являются достаточными.
Известно, что молекула клеточной адгезии L1 (L1-CAM, L1CAM) высоко экспрессируется при разных карциномах, включающих рак яичника, и такая высокая экспрессия L1CAM ассоциирована с отрицательными результатами клинического лечения. Согласно предыдущим исследованиям в результате обработки клеток рака яичника человека (линия клеток SKOV3) непосредственно моноклональными антителами, специфично связывающимися с L1CAM in vitro, и обработки моделей человеческих ксенотрансплантатов, которым были трансплантированы данные клетки, рост опухолевых клеток ингибировался. Авторы настоящего изобретения получили настоящее раскрытие на основе релевантности L1CAM для разных карцином, терапевтических потенциалов при раке яичника и тому подобного.
Документ предшествующего уровня техники
Непатентные документы
Нао Hong. L1 Cell Adhesion Molecule-Specific Chimeric Antigen Receptor-Redirected Human T Cells Exhibit Specific and Efficient Antitumor Activity against Human Ovarian Cancer in Mice. (2016). PLoS ONE 11(1): e0146885
Подробное описание изобретения
Техническая проблема
Авторы настоящего изобретения провели интенсивные попытки исследований для разработки антитела и его антигенсвязывающего фрагмента, которое связывается с L1CAM, и включающего его химерного рецептора антигена. В результате, авторы настоящего изобретения установили, что разработанные антитела против L1CAM очень специфично связываются с человеческими и мышиными молекулами антигена L1CAM, и химерные рецепторы антигена и CAR-Т, которые включают их, демонстрируют высокую противораковую активность в отношении линий клеток рака яичника SKOV3, линий клеток нейробластомы SH-SY5Y и линий клеток рака яичника HeLa, и, таким образом, реализовали настоящее раскрытие.
Следовательно, одним аспектом настоящего раскрытия является предложение антитела против L1CAM или его антигенсвязывающего фрагмента, которое специфично связывается с антигеном L1CAM.
Другим аспектом настоящего раскрытия является предложение химерного рецептора антигена, включающего антитело против L1CAM или его антигенсвязывающий фрагмент, и эффекторной клетки, экспрессирующей данный химерный рецептор антигена.
Еще одним другим аспектом настоящего раскрытия является предложение фармацевтической композиции, включающей антитело против L1CAM или его антигенсвязывающий фрагмент, или эффекторную клетку, экспрессирующую данный химерный рецептор антигена.
Еще одним другим аспектом настоящего раскрытия является предложение способа лечения заболевания, ассоциированного с высокой экспрессией L1CAM, у субъекта, нуждающегося в этом, включающего введение данному субъекту эффекторной клетки, экспрессирующей данный химерный рецептор антигена.
Техническое решение
В данном документе антитело согласно одному аспекту настоящего раскрытия представляет собой антитело, специфично связывающееся с L1CAM, и модифицированное антитело, подвергнутое созреванию аффинности.
Антитело против L1CAM или его антигенсвязывающий фрагмент по настоящему раскрытию имеет специфичную способность к связыванию с антигеном L1CAM, подобную традиционным антителам против L1CAM.
Термин "антитело» в том виде, в котором он используется в данном документе, относится к антителу, специфичному к антигену L1CAM, и он охватывает не только форму полного антитела, но также и антигенсвязывающие фрагменты молекулы антитела.
Полное антитело имеет структуру из двух полноразмерных легких цепей и двух полноразмерных тяжелых цепей, где каждая легкая цепь связывается с тяжелой цепью через дисульфидные связи. Термин «тяжелая цепь» относится к большей из двух типов полипептидных цепей, присутствующих в молекулах антител в их встречающихся в природе конформациях, и которая обычно определяет класс, к которому принадлежит антитело. Термин «тяжелая цепь» относится и к полноразмерной тяжелой цепи, и к ее фрагменту, который включает домен VH, который представляет собой вариабельную область тяжелой цепи антитела, содержащую аминокислотную последовательность, имеющую достаточную последовательность вариабельной области для придания специфичности к антигену, и домены СН1, СН2 и СН3, которые представляют собой три константные области тяжелой цепи. Константная область тяжелой цепи имеет типы гамма (γ), мю (μ), альфа (α), дельта (δ) и эпсилон (ε), и подклассы гамма1 (γ1), гамма2 (γ2), гамма3 (γ3), гамма4 (γ4), альфа1 (α1) и альфа2 (α2).
Термин «легкая цепь» относится к меньшей из двух типов полипептидных цепей, присутствующих в молекулах антител в их встречающихся в природе конформациях. Термин «легкая цепь» относится и к полноразмерной легкой цепи, и к ее фрагменту, который включает домен VL, который представляет собой вариабельную область легкой цепи антитела, содержащую аминокислотную последовательность, имеющую достаточную последовательность вариабельной области для придания специфичности к антигену, и домен CL, который представляет собой константную область легкой цепи. Константные области легкой цепи имеют типы каппа и лямбда (Cellular and Molecular Immunology, Wonsiewicz, M.J., Ed., Chapter 45, pp. 41-50, W.B. Saunders Co. Philadelphia, PA (1991) и Nisonoff, A., Introduction to Molecular Immunology, 2nd Ed., Chapter 4, pp.45-65, sinauer Associates, Inc., Sunderland, MA (1984)).
Термин «антиген» или «Ag» относится к молекуле, которая запускает иммунный ответ. Данный иммунный ответ может включать либо продукцию антител, либо активацию специфичных иммунологически компетентных клеток, либо и то, и другое.
Термин «область, определяющая комплементарность (CDR)» в том виде, в котором он используется в данном документе, относится к аминокислотной последовательности гипервариабельной области тяжелой или легкой цепи иммуноглобулина (Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987)). Каждая из тяжелой цепи (CDRH1, CDRH2 и CDRH3) и легкой цепи (CDRL1, CDRL2 и CDRL3) включает три CDR. CDR предоставляют главные контактные остатки в связывании антитела с антигеном или эпитопом.
Термин «антигенсвязывающий фрагмент» в том виде, в котором он используется в данном документе, относится к фрагменту, который сохраняет антигенсвязывающую функцию, и включает Fab, F(ab'), F(ab')2, Fv и тому подобные. Среди фрагментов антитела антигенсвязывающий фрагмент (Fab) относится к структуре, которая имеет вариабельные области тяжелой и легкой цепей, константную область легкой цепи и первую константную область тяжелой цепи (CH1), и имеет один антигенсвязывающий сайт. Fab' отличается от Fab тем, что первый имеет шарнирную область, включающую один или более чем один остаток цистеина на С-конце домена СН1 тяжелой цепи. Антитело F(ab')2 создается дисульфидной связью, образующейся между остатками цистеина в шарнирных областях фрагментов Fab'. Fv представляет собой минимальный фрагмент антитела, имеющий только вариабельную область тяжелой цепи и вариабельную область легкой цепи, и рекомбинантная технология для продуцирования фрагмента Fv раскрывается в данной области. Двухцепочечный Fv представляет собой фрагмент, в котором вариабельная область тяжелой цепи и вариабельная область легкой цепи связываются посредством нековалентной связи, а одноцепочечный вариабельный фрагмент (scFv) представляет собой фрагмент, в котором вариабельная область тяжелой цепи и вариабельная область легкой цепи обычно связываются посредством ковалентной связи через пептидный линкер или непосредственно связываются на С-конце, образуя димероподобную структуру, подобную двухцепочечному Fv. Данные фрагменты антитела могут быть получены с использованием протеолитических ферментов (например, фрагменты Fab могут быть получены посредством рестрикции-расщепления полного антитела папаином, и фрагмент F(ab')2 может быть получен посредством рестрикции-расщепления полного антитела пепсином) или могут быть изготовлены посредством методик генной инженерии.
Антитело по настоящему раскрытию включает моноклональные антитела, мультиспецифичные антитела, человеческие антитела, гуманизированные антитела, химерные антитела, одноцепочечные Fv (scFv), одноцепочечные антитела, фрагменты Fab, фрагменты F(ab'), связанные дисульфидом Fv (sdFv), антиидиотипические антитела (анти-Id), эпитопсвязывающие фрагменты вышеупомянутых антител и тому подобные, но не ограничиваются ими.
Термин «каркас» или «FR» в том виде, в котором он используется в данном документе, относится к остатку вариабельного домена, отличному от остатка вариабельной области (HVR). FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Следовательно, последовательности HVR и FR типично демонстрируются в VH (или VL/Vk) в следующем порядке:
(a) FRH1 (каркасная область 1 тяжелой цепи) - CDRH1 (определяющая комплементарность область 1 тяжелой цепи) - FRH2-CDRH2-FRH3-CDRH3-FRH4; и
(b) FRL1 (каркасная область 1 легкой цепи) - CDRL1 (определяющая комплементарность область 1 легкой цепи) - FRL2-CDRL2-FRL3-CDRL3-FRL4.
Термин «специфично связываться» или тому подобные в том виде, в котором они используются в данном документе, означают, что антитело или его антигенсвязывающий фрагмент, или другие конструкции, такие как scFv, образуют комплекс с антигеном, который является относительно стабильным при физиологических условиях. Специфичное связывание может отличаться по меньшей мере равновесной константой диссоциации примерно 1×10-6 М или меньше (например, KD, меньшее, чем данное значение, указывает более прочное связывание). Способы определения того, связываются ли специфично друг с другом две молекулы, хорошо известны в данной области, и их примеры включают равновесный диализ, поверхностный плазмонный резонанс и тому подобные.
Термин «аффинность» в том виде, в котором он используется в данном документе, относится к общей силе нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитело) и его партнером связывания (например, антиген). Если не определяется иначе, термин «аффинность связывания» относится к собственной аффинности связывания, которая отражает взаимодействие 1:1 между членами пары связывания (например, антитело и антиген). Аффинность между молекулой Y и ее партнером Y может быть типично представленной константой диссоциации (Kd). Данную аффинность можно измерять обычными способами, известными в данной области, включающими способы, описанные в настоящем раскрытии.
«Человеческое антитело» в том виде, в котором данный термин используется в данном документе, обладает аминокислотной последовательностью, которая соответствует антителу, продуцируемому человеком или человеческой клеткой, или аминокислотной последовательностью антитела, происходящего из источника, не являющегося человеческим, в котором используются репертуары человеческого антитела или других последовательностей, кодирующих человеческое антитело. Такое определение человеческого антитела исключает гуманизированное антитело, содержащее антигенсвязывающие остатки, не являющиеся человеческими.
Термин «химерное антитело» в том виде, в котором он используется в данном документе, относится к антителу, в котором часть тяжелой цепи и/или легкой цепи происходит из конкретного источника или вида, тогда как остальная часть тяжелой цепи и/или легкой цепи происходит из другого источника или вида.
Термин «гуманизированное антитело» в том виде, в котором он используется в данном документе, относится к химерному иммуноглобулину, который содержит минимальную последовательность, происходящую из иммуноглобулина, не являющегося человеческим, антител, не являющихся человеческими (например, мыши), цепь иммуноглобулина или ее фрагмент (например, Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антитела). В большинстве случаев гуманизированные антитела представляют собой человеческие иммуноглобулины (антитела-реципиенты), в которых остатки из определяющей комплементарность области (CDR) реципента заменяются остатками из CDR вида, не являющегося человеком (антитело-донор), такого как мышь, крыса или кролик, имеющего желательную специфичность, аффинность и активность. В некотрых случаях остатки каркасной области Fv (FR) человеческого иммуноглобулина заменяются соответствующими остатками, не являющимися человеческими. Кроме того, гуманизированные антитела могут включать остатки, которые не находятся ни в антителе-реципиенте, ни в импортированных последовательностях CDR или каркаса. Данные модификации делаются для дальнейшего улучшения и оптимизации эффективности антитела. В общем, гуманизированное антитело будет включать все из по меньшей мере одного и типично двух вариабельных доменов, в которых все или по существу все из областей CDR соответствуют областям CDR иммуноглобулина, не являющегося человеческим, и все или по существу все из областей FR имеют последовательности областей FR последовательности человеческого иммуноглобулина. Гуманизированное антитело включает по меньшей мере часть константной области иммуноглобулина (область Fc), типично константной области (область Fc) человеческого иммуноглобулина.
Антитело против L1CAM или его антигенсвязывающий фрагмент по настоящему раскрытию может включать варианты аминокислотной последовательности в пределах интервала, способного специфично распознавать L1CAM, как понятно специалисту в данной области. Например, для того, чтобы улучшать аффинность связывания и/или другие биологические свойства антитела, могут быть сделаны модификации аминокислотной последовательности данного антитела. Такие модификации включают, например, делеции, вставки и/или замены остатков аминокислотной последовательности антитела.
Такие вариации аминокислот делают на основе относительного сходства заместителей боковой цепи аминокислоты, как, например, по гидрофобности, гидрофильности, заряду и размеру. Согласно анализу размеров, форм и типов заместителей боковых цепей аминокислот можно видеть то, что все из аргинина, лизина и гистидина представляют собой положительно заряженные остатки; аланин, глицин и серии имеют аналогичные размеры; и фенилаланин, триптофан и тирозин имеют аналогичные формы. Таким образом, на основе данных соображений можно сказать то, что аргинин, лизин и гистидин; аланин, глицин и серии; фенилаланин, триптофан и тирозин представляют собой биологически функциональные эквиваленты.
При введении вариаций можно рассматривать индекс гидропатичности аминокислот. Каждой аминокислоте был приписан индекс гидропатичности на основе ее гидрофобности и характеристик заряда: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин/цистин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серии (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутамат (-3,5); глутамин (-3,5); аспартат (-3,5); аспарагин (-3,5); лизин (-3,9) и аргинин (-4,5).
Индексы гидрофобных аминокислот являются очень важными в придании биологических функций взаимодействия белков. В данной области известно, что определенные аминокислоты могут быть заменены другими аминокислотами, имеющими аналогичный индекс гидропатичности, и все еще приводить к аналогичной биологической активности. В случаях, где вводится вариация по отношению к индексам гидрофобности, делается замена между аминокислотами, имеющими разницу в индексе гидрофобности в пределах предпочтительно плюс/минус 2, более предпочтительно плюс/минус 1 и еще более предпочтительно плюс/минус 0,5.
Тем временем, также хорошо известно, что замены между аминокислотами, имеющими аналогичные значения гидрофильности, приводят к белкам с эквивалентной биологической активностью. Как раскрыто в патенте США №4554101, каждому аминокислотному остатку были приписаны следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспартат (+3,0 плюс/минус 1); глутамат (+3,0 плюс/минус 1); серии (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5 плюс/минус 1); аланин (-0,5); гистидин (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5); триптофан (-3,4).
В случаях, где вводятся вариации относительно значений гидрофильности, могут быть сделаны замены между аминокислотами, которые демонстрируют различие значения гидрофильности предпочтительно в пределах плюс/минус 2, более предпочтительно в пределах плюс/минус 1 и даже более предпочтительно в пределах плюс/минус 0,5.
В данной области известны замены аминокислот в белках, которые не изменяют полностью активность молекулы (Н. Neurath, R. L. Hill, The Proteins, Academic Press, New York, 1979). Самые обычные встречающиеся замены представляют собой замены между аминокислотными остатками Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu nAsp/Gly.
Согласно одному аспекту настоящего раскрытия предложено антитело против L1CAM или его антигенсвязывающий фрагмент, включающее вариабельную область тяжелой цепи (VH), включающую i), ii) и iii) ниже, и вариабельную область легкой цепи (VL), включающую iv), v) и vi) ниже:
i) определяющая комплементарность область 1 тяжелой цепи (CDRH1), содержащая следующую аминокислотную последовательность:
X1YAMX5
в которой, независимо друг от друга,
Х1 представляет собой D, S или N; и
Х5 представляет собой N, Н или S,
ii) определяющая комплементарность область 2 тяжелой цепи (CDRH2), содержащая SEQ ID NO: 12, SEQ ID NO: 13 или следующую аминокислотную последовательность:
AISSX5GX7X8X9YYADSVKG
в которой, независимо друг от друга,
Х5 представляет собой S или Т;
Х7 представляет собой S или G;
Х8 представляет собой S или Т; и
Х9 представляет собой I, Т или К,
iii) определяющая комплементарность область 3 тяжелой цепи (CDRH3), содержащая любую аминокислотную последовательность, выбранную из SEQ ID NO: 15- SEQ ID NO: 23,
iv) определяющая комплементарность область 1 легкой цепи (CDRL1), содержащая следующую аминокислотную последовательность:
RASQSIX7X8X9LN
в которой, независимо друг от друга,
Х7 представляет собой S или G;
Х8 представляет собой R, N или S; и
Х9 представляет собой D или Y,
v) определяющая комплементарность область 2 легкой цепи (CDRL2), содержащая следующую аминокислотную последовательность:
AX2SX4LQS
в которой, независимо друг от друга,
Х2 представляет собой А или Т; и
Х4 представляет собой S, N, R или Т и
vi) определяющая комплементарность область 3 легкой цепи (CDRL3), содержащая следующую аминокислотную последовательность:
QQSX4SX6PX8T
в которой, независимо друг от друга,
Х4 представляет собой Y или Е;
Х6 представляет собой Т, F или Y; и
Х8 представляет собой Y, W, L или F.
Приведенные в данном документе символы, такие как «Xn» и «Xm» используются для указания аминокислот в положениях n и m в общих формулах, определенных выше. В данном отношении каждый из n и m представляет собой целое число, которое указывает положение аминокислоты в пределах последовательности при подсчете от N-конца указанной последовательности. Например, Х1, и Х5 указывают аминокислоту в положении 1 и 5, соответственно, от N-конца данной последовательности.
В одном воплощении настоящего раскрытия Xn или Xm независимо выбраны из группы возможных остатков, которые могут представлять собой Xn или Xm в общих формулах. Специалисту в данной области будет понятно, что Xn может быть выбран из любой из перечисленных групп возможных остатков, и что данный выбор не зависит от выбора аминокислот в Xm, где n отличается от m. Следовательно, любой из перечисленных возможных остатков в положении Xn в общих формулах может быть независимо объединен с любым из перечисленных возможных остатков в любом другом вариабельном положении (положение Xm).
Как подробно описано в примерах ниже, CDRH1, CDRH2, CDRL1, CDRL2 и CDRL3 антитела против L1CAM, его модифицированного антитела или его антигенсвязывающих фрагментов, которые специфично связываются с L1CAM, согласно настоящему раскрытию выражаются i), ii), iv), v) и vi), соответственно, и данные общие формулы были созданы на основе результатов статистического анализа многочисленных случайным образом модифицированных антител. Антитело против L1CAM и его антигенсвязывающий фрагмент, и его модифицированные антитела, которые специфично связываются с L1CAM, были отобраны посредством подтверждения взаимодействий с L1CAM посредством повторных анализов для отбора.
В одном воплощении настоящего раскрытия в CDRH1, независимо друг от друга, X1 представляет собой D или S; и Х5 представляет собой N, Н или S.
В одном примере настоящего раскрытия аминокислотная последовательность CDRH1, представленная данной общей формулой, соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 1-7.
Согласно конкретному примеру настоящего раскрытия аминокислотная последовательность CDRH1, представленная данной общей формулой, соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 1-3 и 7, и они соответствуют CDRH1 четырех типов антител, наконец отобранных в настоящем раскрытии.
В другом воплощении настоящего раскрытия, независимо друг от друга,
Х5 представляет собой Т или S в CDRH2;
Х7 представляет собой S или G в CDRH2;
Х8 представляет собой S или Т в CDRH2; и
Х9 представляет собой I или Т в CDRH2.
В одном примере настоящего раскрытия аминокислотная последовательность CDRH2, представленная данной общей формулой, соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 8-14.
Согласно конкретному примеру настоящего раскрытия аминокислотная последовательность CDRH2, представленная данной общей формулой, соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 8-10, и они соответствуют CDRH2 четырех типов антител, наконец отобранных в настоящем раскрытии.
Согласно конкретному воплощению настоящего раскрытия аминокислотная последовательность CDRH3 соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 15-17 и 22, и они соответствуют CDRH3 четырех типов антител, наконец отобранных в настоящем раскрытии.
В одном воплощении настоящего раскрытия аминокислотная последовательность CDRL1 соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 32-36.
Согласно конкретному воплощению настоящего раскрытия аминокислотная последовательность CDRL1 соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 32-34 и 36, и они соответствуют CDRL1 четырех типов антител, наконец отобранных в настоящем раскрытии.
В другом воплощении настоящего раскрытия, независимо друг от друга, в CDRH1 Х2 представляет собой А или Т; и X4 представляет собой S или N.
В одном примере настоящего раскрытия аминокислотная последовательность CDRL2, представленная данной общей формулой, соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 37-42.
Согласно конкретному примеру настоящего раскрытия аминокислотная последовательность CDRL2, представленная данной общей формулой, соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 37, 38 и 42, и они соответствуют CDRL2 четырех типов антител, наконец отобранных в настоящем раскрытии.
В еще одном другом воплощении настоящего раскрытия, независимо друг от друга,
X4 представляет собой Y в CDRL3;
Х6 представляет собой Т или F в CDRL3; и
Х8 представляет собой Y или W в CDRL3.
В одном примере настоящего раскрытия аминокислотная последовательность CDRL3, представленная данной общей формулой, соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 43-47.
Согласно конкретному примеру настоящего раскрытия аминокислотная последовательность CDRL3, представленная данной общей формулой, соответствует аминокислотной последовательности SEQ ID NO: 43 и 44, и они соответствуют CDRL3 четырех типов антител, наконец отобранных в настоящем раскрытии.
Согласно еще одному другому воплощению настоящего раскрытия в антителе против L1CAM или его антигенсвязывающем фрагменте по настоящему раскрытию VH включает каркасную область 1 тяжелой цепи (FRH1), содержащую любую аминокислотную последовательность, выбранную из SEQ ID NO: 24-26.
Согласно конкретному воплощению настоящего раскрытия VH включает каркасную область 1 тяжелой цепи (FRH1), содержащую аминокислотную последовательность SEQ ID NO: 24.
Кроме того, VH включает каркасную область 2 тяжелой цепи (FRH2), содержащую аминокислотную последовательность SEQ ID NO: 27.
Кроме того, VH включает каркасную область 3 тяжелой цепи (FRH3), содержащую аминокислотную последовательность SEQ ID NO: 28 или 29.
Кроме того, VH включает каркасную область 4 тяжелой цепи (FRH4), содержащую аминокислотную последовательность SEQ ID NO: 30.
В другом воплощении настоящего раскрытия VH содержит аминокислотную последовательность vii), приведенную ниже:
vii)
EVQLVESGGGLXaQPGGSLRLSCAASGFTFS[CDRH1]WVRQAPGKGLEVWS[CDRH2]RFTISRDNSKNTLYLQXbNSLRAEDTAVYYCAK[CDRH3]WGQGTLVTVSS,
в которой, независимо друг от друга,
[CDRH1], [CDRH2] и [CDRH3] указывают определенные выше аминокислотные последовательности CDRH1, CDRH2 и CDRH3 соответственно:
Ха представляет собой V, L или А; и
Xb представляет собой М или I.
В конкретном воплощении настоящего раскрытия в последовательности vii) Ха представляет собой V, и Xb представляет собой М.
Согласно типичному воплощению настоящего раскрытия аминокислотная последовательность VH соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 52-55.
Согласно конкретному воплощению настоящего раскрытия VL включает каркасную область 1 легкой цепи (FRL1), содержащую аминокислотную последовательность SEQ ID NO: 48.
Кроме того, VL включает каркасную область 2 легкой цепи (FRL2), содержащую аминокислотную последовательность SEQ ID NO: 49.
Кроме того, VL включает каркасную область 3 легкой цепи (FRL3), содержащую аминокислотную последовательность SEQ ID NO: 50.
Кроме того, VL включает каркасную область 4 легкой цепи (FRL4), содержащую аминокислотную последовательность SEQ ID NO: 51.
В другом воплощении настоящего раскрытия VL содержит аминокислотную последовательность viii), приведенную ниже:
viii)
DIQMTQSPSSLSASVGDRVTITC[CDRL1]WYQQKPGKAPKLL1Y[CDRL2]GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC[CDRL3]FGQGTKVEIK,
в которой, независимо друг от друга, [CDRL1], [CDRL2] и [CDRL3] указывают определенные выше аминокислотные последовательности CDRL1, CDRL2 и CDRL3 соответственно.
Согласно примеру настоящего раскрытия аминокислотная последовательность VL соответствует любой аминокислотной последовательности, выбранной из SEQ ID NO: 56-59.
Антитело против L1CAM или его антигенсвязывающий фрагмент по настоящему раскрытию включает антитело против L1CAM или его антигенсвязывающий фрагмент, который содержит минорную модификацию по сравнению вышеописанной аминокислотной последовательностью, то есть, изменение, которое едва влияет на третичную структуру и функции данного антитела. В некоторых воплощениях модифицированное антитело против L1CAM или его антигенсвязывающий фрагмент может иметь сходство последовательности по меньшей мере 90%, 93%, 95% или 98%, даже если оно не является идентичным вышеописанной последовательности.
В настоящем раскрытии вариабельная область тяжелой цепи и вариабельная область легкой цепи, содержащаяся в данном антителе или его антигенсвязывающем фрагменте, может быть связана через линкер, содержащий аминокислотную последовательность, представленную общей формулой (GnSm)p или (SmGn)p.
В каждом случае, независимо друг от друга,
n представляет собой целое число от 1 до 7;
m представляет собой целое число от 0 до 7;
сумма n и m представляет собой целое число 8 или меньше;
и
р представляет собой целое число от 1 до 7.
Согласно конкретному воплощению настоящего раскрытия в линкере n равен от 1 до 5, и m равен от 0 до 5. В более конкретном воплощении n равен 4, и m равен 1. В еще одном более конкретном воплощении данный линкер представляет собой (G4S)3 или (S4G)3.
В другом воплощении линкер представляет собой VDGS, и в еще одном другом воплощении данный линкер представляет собой ASGS.
Вариабельная область легкой цепи и вариабельная область тяжелой цепи антитела или его антигенсвязывающего фрагмента согласно настоящему раскрытию могут существовать, например, в следующих ориентациях:
вариабельная область легкой цепи - линкер - вариабельная область тяжелой цепи или
вариабельная область тяжелой цепи - линкер - вариабельная область легкой цепи.
Согласно самому конкретному воплощению настоящего раскрытия антитело против L1CAM или его антигенсвязывающий фрагмент по настоящему раскрытию содержит аминокислотную последовательность, выбранную из SEQ ID NO: 64-67, но не ограничивается ей.
Согласно другому аспекту настоящего раскрытия предложен слитый белок, включающий антитело против L1CAM или его антигенсвязывающий фрагмент.
В настоящем раскрытии данный слитый белок получают для продуктивности, эффективности очистки, улучшенной биологической активности, повышенной стабильности слитого белка, улучшенного сворачивания и/или связывания с функциональной группировкой с дополнительной функциональностью антитела против L1CAM или его антигенсвязывающего фрагмента по настоящему раскрытию. Данный слитый белок может быть образован в виде двух или более чем двух полипептидных цепей, соединенных ковалентной связью, посредством его экспрессии в виде рекомбинантного белка или может задействоваться в виде конъюгата, в котором две или более чем две полипептидные цепи соединяются посредством химического конъюгирования.
Согласно еще одному другому аспекту настоящего раскрытия предложен полипептид химерного рецептора антигена, включающий:
(a) домен связывания L1CAM;
(b) трансмембранный домен (ТМ);
(c) костимулирующий домен; и
(d) внутриклеточный домен сигнализации (ICD).
Термин «химерный рецептор антигена (CAR)» в том виде, в котором он используется в данном документе, относится к искусственно сконструированному гибридному белку (слитому белку) или полипептиду, содержащему домен, связывающий мишень (например, одноцепочечный вариабельный фрагмент (scFv)), связанный с доменом сигнализации эффекторной клетки или доменом активации эффекторной клетки (например, домен сигнализации Т-клетки или домен активации Т-клетки). В общем, химерные рецепторы антигенов имеют способность перенаправлять специфичность и реактивость Т-клеток в отношении выбранной мишени способом, не ограниченным МНС (главный комплекс гистосовместимости), используя антигенсвязывающие свойства моноклональных антител. Неограниченное МНС распознавание антигена дает Т-клеткам, экспрессирующим CAR, способность распознавать антиген независимо от процессинга антигена, таким образом, обходя главный механизм ускользания опухоли. Кроме того, при экспрессии в Т-клетках CAR преимущественно не димеризуется с альфа и бета цепями эндогенного Т-клеточного рецептора (TCR).
Химерный рецептор антигена по настоящему раскрытию включает вышеописанное антитело против L1CAM или его антигенсвязывающий фрагмент в виде внеклеточного антигенсвязывающего домена. Следовательно, химерный рецептор антигена по настоящему раскрытию экспрессируется в виде химерного рецептора антигена против L1CAM (CAR против L1CAM), CAR против L1CAM или тому подобного.
Термины, такие как «L1-CAR», «L1CAM-CAR» и «L1-H8-CAR», используемые в примере по настоящему раскрытию, представляют собой аббревиатуры химерного рецептора антигена против L1CAM, изобретенного авторами настоящего изобретения, и они относятся к химерному рецептору антигена, включающему внеклеточный антигенсвязывающий домен, который специфично связывается с вышеупомянутым L1CAM.
Согласно одному воплощению настоящего раскрытия химерный рецептор антигена по настоящему раскрытию содержит домен, связывающий L1CAM, включающий антитело против L1CAM или его антигенсвязывающий фрагмент, описанный в настоящем раскрытии, и, таким образом, распознает антиген L1CAM и экспрессируется на поверхности клетки.
Химерный рецептор антигена по настоящему раскрытию экспрессируется на поверхности клетки и, таким образом, содержит трансмембранный домен. Данный трансмембранный домен может представлять собой трансмембранный домен, выбранный из группы, состоящей из альфа, бета или дзета цепи рецептора Т-клетки, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154 или комбинации всех или некоторых их последовательностей, но не ограничивается ими.
Согласно конкретному воплощению настоящего раскрытия трансмембранный домен представляет собой трансмембранный домен CD8 или CD28, и, наиболее конкретно, трансмембранный домен CD28, кодируемый нуклеотидной последовательностью SEQ ID NO: 78, или трансмембранный домен CD8 альфа, кодируемый нуклеотидной последовательностью SEQ ID NO: 119.
Костимулирующий домен химерного рецептора антигена по настоящему раскрытию представляет собой функциональный домен сигнализации, полученный из белка, выбранного из группы, состоящей из лигандов, специфично связывающихся с молекулами МНС класса I, белков-рецепторов TNF (фактор некроза опухолей), иммуноглобулиноподобных белков, рецепторов цитокинов, интегринов, сигнализирующих лимфоцитарных активирующих молекул (SLAM), активированных рецепторов NK-клеток (клетка-природный киллер), аттенюаторов В- и Т-лимфоцитов (BTLA), рецепторов TolI-подобных лигандов, ОХ40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1ВВ (CD137), В7-Н3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, L1GHT, HVEM (L1GHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (тактильный), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и CD83, но не ограничивающейся ими.
Согласно конкретному воплощению настоящего раскрытия костимулирующий домен может представлять собой функциональный домен сигнализации, полученный из белка, выбранного из группы, состоящей из CD28, ОХ40, 4-1 ВВ (CD137) и ICOS (CD278), более конкретно - функциональный домен сигнализации CD28, кодируемый нуклеотидной последовательностью SEQ ID NO: 79, функциональный домен сигнализации ОХ40, кодируемый нуклеотидной последовательностью SEQ ID NO: 80, функциональный домен сигнализации 4-1 ВВ, кодируемый нуклеотидной последовательностью SEQ ID NO: 101 или SEQ ID NO: 120, функциональный домен сигнализации ICOS, кодируемый нуклеотидной последовательностью SEQ ID NO: 102, или комбинации всех или некоторых его последовательностей.
Согласно другому воплощению настоящего раскрытия внутриклеточный домен сигнализации представляет собой функциональный домен сигнализации 4-1 ВВ, CD28, ОХ40 или CD3 дзета, или их комбинацию. Наиболее конкретно, внутриклеточный домен сигнализации представляет собой функциональный домен сигнализации CD3 дзета.
Согласно одному примеру настоящего раскрытия внутриклеточный домен сигнализации представляет собой функциональный домен сигнализации CD3 дзета, кодируемый нуклеотидной последовательностью SEQ ID NO: 81, функциональный домен сигнализации CD3 дзета-iso2М, кодируемый нуклеотидной последовательностью SEQ ID NO: 121, или функциональный домен сигнализации CD3 дзета-iso2, кодируемый нуклеотидной последовательностью SEQ ID NO: 126, но не ограничивается ими.
Согласно одному воплощению настоящего раскрытия химерный рецептор антигена возможно дополнительно включает лидерную последовательность (LS). Данная лидерная последовательность располагается на аминоконце (N-конец) рекомбинантного полипептида, составляющего химерный рецептор антигена. Данная лидерная последовательность возможно отщепляется от антигенсвязывающего домена во время внутриклеточного процессинга и локализации химерного рецептора антигена в клеточной мембране.
В конкретном воплощении настоящего раскрытия лидерная последовательность может представлять собой лидерную последовательность hCD8 альфа, лидерную последовательность альфа-цепи рецептора hGM-CSF (человеческий гранулоцитарно-макрофагальный колониестимулирующий фактор) или лидерную последовательность антитела 3E8.
В более конкретном воплощении настоящего раскрытия данная лидерная последовательность представляет собой лидерную последовательность, включающую, аминокислотные последовательности, кодируемые нуклеотидными последовательностями SEQ ID NO: 128-130.
Домен связывания L1CAM химерного рецептора антигена по настоящему раскрытию связывается с трансмембранным доменом посредством шарнирного домена (или спейсера).
Согласно другому воплощению настоящего раскрытия шарнирный домен представляет собой шарнир, происходящий из IgG1, IgG2, IgG4 или IgD, шарнир, происходящий из CD8 или CD28, внеклеточный домен (ECD), происходящий из CD28, или их комбинацию.
Согласно одному примеру настоящего раскрытия, шарнирный домен представляет собой шарнир IgD, кодируемый нуклеотидной последовательностью SEQ ID NO: 77, шарнир IgG1, кодируемый нуклеотидной последовательностью SEQ ID NO: 85, шарнир СН3 IgG1, кодируемый нуклеотидной последовательностью SEQ ID NO: 86, шарнир hCD8 альфа, кодируемый нуклеотидной последовательностью SEQ ID NO: 118, шарнир, кодируемый нуклеотидной последовательностью SEQ ID NO: 124, внеклеточный домен hCD28, кодируемый нуклеотидной последовательностью SEQ ID NO: 125, или комбинацию всех или некоторых из данных последовательностей.
Согласно одному аспекту настоящего раскрытия предложена молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую вышеописанное антитело против L1CAM или его антигенсвязывающий фрагмент.
Согласно другому аспекту настоящего раскрытия предложена молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую слитый белок, включающий вышеописанное антитело против L1CAM или его антигенсвязывающий фрагмент.
Согласно еще одному другому аспекту настоящего раскрытия предложена молекула нуклеиновой кислоты, содержащая нуклеотидную последовательность, кодирующую вышеописанный полипептид химерного рецептора антигена.
Термин «нуклеиновая кислота» в том виде, в котором он используется в данном документе, охватывает молекулы ДНК (гДНК (геномная ДНК) и кДНК (комплементарная ДНК) и РНК, а нуклеотиды, которые являются основными строительными блоками данной молекулы нуклеиновой кислоты, включают не только природные нуклеотиды, но также и аналоги, имеющие модифицированные группировки сахара или основания (Scheit, Nucleotide Analogs, John Wiley, New York (1980) и Uhlman and Peyman, Chemical Reviews, 90:543-584(1990)).
В одном воплощении настоящего раскрытия нуклеотидная последовательность, кодирующая полипептид химерного рецептора антигена по настоящему раскрытию, является достаточной для того, чтобы быть нуклеотидной последовательностью, кодирующей аминокислотную последовательность, составляющую молекулу химерного рецептора антигена, и специалисту в данной области было бы очевидно, что такая нуклеотидная последовательность не ограничивается любой конкретной нуклеотидной последовательностью.
Причиной является то, что даже если данная нуклеотидная последовательность подвергается мутации, экспрессия мутировавшей нуклеотидной последовательности в белок может не вызывать изменения последовательности данного белка. Это называется вырожденностью кодонов. Следовательно, данная нуклеотидная последовательность включает нуклеотидные последовательности, содержащие функционально эквивалентные кодоны, кодоны, кодирующие ту же самую аминокислоту (например, число кодонов для аргинина или серина составляет шесть из-за вырожденности кодонов), или кодоны, кодирующие биологически эквивалентные аминокислоты.
Согласно конкретному воплощению настоящего раскрытия молекула нуклеиновой кислоты, кодирующая полипептид домена связывания L1CAM химерного рецептора антигена, содержит любую нуклеотидную последовательность, выбранную из SEQ ID NO: 60-63.
Рассматривая вышеописанную вариацию, имеющую биологически эквивалентную активность, молекула нуклеиновой кислоты, кодирующая полипептид химерного рецептора антигена по настоящему раскрытию, также истолковывается как включающая последовательности, имеющие существенную идентичность с последовательностями, описанными в перечнях последовательностей. Существенная идентичность означает, что при выравнивании последовательности по настоящему раскрытию и другой последовательности для максимального соответствия друг другу, и анализе выровненных последовательностей с использованием алгоритма, который обычно используется в данной области, данные последовательности имеют по меньшей мере 61%-ную гомологию, более предпочтительно по меньшей мере 70%-ную гомологию, еще более предпочтительно по меньшей мере 80%-ную гомологию и наиболее предпочтительно по меньшей мере 90%-ную гомологию. Способы выравнивания для сравнения последовательностей известны в данной области. Разные способы и алгоритмы для выравнивания раскрываются в Smith and Waterman, Adv. Appl. Math. 2:482(1981); Needleman and Wunsch, J. Mol. Bio. 48:443(1970); Pearson and Lipman, Methods in Mol. Biol. 24: 307-31(1988); Higgins and Sharp, Gene 73:237-44(1988); Higgins and Sharp, CABIOS 5:151-3(1989); Corpet et al., Nuc. Acids Res. 16:10881-90(1988); Huang etal., Сотр. Appl. BioSci. 8:155-65(1992) и Pearson et al., Meth. Mol. Biol. 24:307-31(1994). Основной поисковый инструмент местного выравнивания NCBI (BLAST) (Altschul et al., J. Mol. Biol. 215:403-10(1990)), доступный от NCBI (Национальный центр США биотехнологической информации), или тому подобное в Интернете можно использовать в связи с программами анализа последовательностей, такими как BLASTP, BLASTN, BLASTX, TBLASTN и TBLASTX. Доступ к BLAST можно получить через веб-страницу BLAST на веб-сайте NCBI. Способ сравнения гомологии последовательности с использованием такой программы доступен на странице помощи BLAST веб-сайта NCBI.
Согласно еще одному другому аспекту настоящего раскрытия предложен рекомбинантный вектор, включающий молекулу нуклеиновой кислоты, кодирующую антитело против L1CAM или его антигенсвязывающий фрагмент, или полипептид химерного рецептора антигена.
Термин «вектор» в том виде, в котором он используется в данном документе, охватывает вектор доставки и экспрессионный вектор.
Термин «вектор доставки» в том виде, в котором он используется в данном документе, относится к композиции вещества, которое содержит выделенную нуклеиновую кислоту и может использоваться для доставки выделенной нуклеиновой кислоты в клетку. Вектор доставки включает линейный полинуклеотид, полинуклеотид, связанный с ионным или амфифильным соединением, плазмиду и вирус, но не ограничивается ими. Более конкретно вектор доставки включает самореплицируемую плазмиду или вирус. Данный термин также истолковывается так, что он включает неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновых кислот в клетки, такие как, например, полилизиновые соединения, липосомы и т.д. Примеры вирусного вектора доставки включают аденовирусный вектор, вектор на основе аденосателлитного вируса, ретровирусный вектор и лентивирусный вектор, но не ограничиваются ими.
В одном воплощении настоящего раскрытия данный вектор представляет собой лентивирусный вектор. В конкретном воплощении настоящего раскрытия данный вектор дополнительно включает промотор. Данный промотор может представлять собой, например, промотор EF-1, но не ограничивается им.
В другом воплощении настоящего раскрытия данный вектор представляет собой ретровирусный вектор. Ретровирусы предоставляют удобную платформу для системы доставки генов. Ген, выбранный для доставки генов, может быть вставлен в ретровирусный вектор и может быть упакован в пределах ретровирусной частицы. Затем рекомбинантный ретровирус может быть доставлен в целевую клетку-хозяина in vivo или in vitro. В данной области известны многие ретровирусные векторы, и в конкретном воплощении настоящего раскрытия ретровирусный вектор может представлять собой ретровирусный вектор рМТ, который представляет собой ретровирусный вектор на основе MLV, но не ограничивается им.
Термин «экспрессионный вектор» относится к вектору, включающему рекомбинантный нуклеотид, включающий последовательность контроля экспрессии, связанную функциональным образом с нуклеотидной последовательностью, подлежащей экспрессии, для того, чтобы экспрессировать целевой ген в клетке-хозяине. Данный экспрессионный вектор содержит достаточный для экспрессии цис-действующий элемент, и могут быть предоставлены другие элементы экспрессии клеткой-хозяином или системой экспрессии in vitro. Примеры экспрессионного вектора включают плазмидный вектор, включающий рекомбинантный полинуклеотид; космидный вектор и вирусный вектор, такой как бактериофаговый вектор, аденовирусный вектор, лентивирусный вектор, ретровирусный вектор и вектор на основе аденосателлитного вируса. Согласно конкретному воплощению настоящего раскрытия молекула нуклеиновой кислоты, кодирующая переключающую молекулу, связывается функциональным образом с промотором вектора по настоящему раскрытию. Термин «связанный функциональным образом» в том виде, в котором он используется в данном документе, относится к функциональной связи между последовательностью контроля экспрессии нуклеиновой кислоты (например, промотор, сигнальная последовательность или набор сайтов связывания фактора регуляции транскрипции) и другой последовательностью нуклеиновой кислоты, посредством чего данная контрольная последовательность контролирует транскрипцию и/или трансляцию последовательности другой нуклеиновой кислоты.
Система рекомбинантного вектора по настоящему раскрытию может быть сконструирована разными способами, известными в данной области, и конкретный способ раскрывается в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press (2001), которая включается в данный документ посредством ссылки.
Вектор по настоящему раскрытию может быть сконструирован в виде вектора для клонирования генов, вектора для экспрессии генов или вектора для доставки генов. Кроме того, вектор по настоящему раскрытию может быть сконструирован посредством применения прокариотической или эукариотической клетки в качестве хозяина.
Например, в случаях, где вектор по настоящему раскрытию представляет собой экспрессионный вектор, и эукариотическая клетка используется в качестве клетки-хозяина, можно использовать промотор, полученный из генома клетки млекопитающего (например, промотор металлотионеина, промотор бета-актина, промотор человеческого гемоглобина и промотор человеческого мышечного креатина), или промотор, полученный из вирусов млекопитающих (например, поздний промотор аденовируса, промотор 7,5 К вируса осповакцины, промотор SV40, промотор цитомегаловируса, промотор tk HSV (человеческий синтициальный вирус), промотор мышиного вируса молочной железы (MMTV), промотор LTR ВИЧ (вирус иммунодефицита человека), промотор вируса Молони, вируса Эпштейна-Барр (EBV) и вируса саркомы Рауса (RSV)), а полиаденилированную последовательность обычно можно использовать в качестве последовательности терминации транскрипции.
Вектор по настоящему раскрытию может быть слит с другими последовательностями для облегчения очистки полипептида или белка, экспрессируемого от них. Примеры слитой последовательности включают глутатион-S-трансферазу (Pharmacia, США), мальтозосвязывающие белки (NEB, США), FLAG (IBI, США), 6× His (гексагистидин; Quiagen, США) и тому подобные. Экспрессионный вектор по настоящему раскрытию может включать антитело или его антигенсвязывающий фрагмент по настоящему раскрытию и маркерный ген и/или репортерный ген, который можно использовать в качестве селектируемого маркера для оценки экспрессии включающего его полипептида CAR. Ген селектируемого маркера включает ген устойчивости к антибиотику, который обычно используется в данной области, и его примерами являются гены устойчивости против ампициллина, гентамицина, карбенициллина, хлорамфеникола, стрептомицина, канамицина, генетицина, неомицина и тетрациклина. Примеры гена-репортера включают гены люциферазы, бета-галактозидазы, хлорамфениколацетилтрансферазы или зеленого флуоресцентного белка.
Способы введения рекомбинантного вектора по настоящему раскрытию в клетку и осуществления его экспрессии хорошо известны в связанной с этим области. Данный вектор может быть легко введен в клетку-хозяина, например, клетку млекопитающего, бактериальную клетку, дрожжевую клетку или клетку насекомого согласно способам, известным в данной области. Например, данный вектор может доставляться в клетку-хозяина физическими, химическими или биологическими способами. Физические способы включают совместное осаждение с фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и тому подобные. Химические способы включают коллоидные дисперсионные системы, такие как макромолекулярный комплекс, нанокапсулу, микросферу и шарик, и системы на основе липидов, включающие эмульсию типа «масло в воде», мицеллу, смешанную мицеллу и липосому. Биологические способы включают применение ДНК- или РНК-вектора, такого как лентивирусный вектор или ретровирусный вектор, как описано выше.
Согласно еще одному другому аспекту настоящего раскрытия предложена эффекторная клетка, экспрессирующая полипептид химерного рецептора антигена (CAR).
В одном воплощении настоящего раскрытия эффекторная клетка выбрана из группы, состоящей из дендритных клеток, дендритных клеток-киллеров, тучных клеток, клеток-природных киллеров, В-лимфоцитов, Т-лимфоцитов, макрофагов и их клеток-предшественников, но не ограничивается ими. Т-лимфоциты выбраны из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хэлперных Т-лимфоцитов.
В настоящем раскрытии эффекторная клетка включает группу аутологических клеток или аллогенных клеток. То есть, эффекторная клетка включает группу аутологических клеток или аллогенных клеток, экспрессирующих настоящий полипептид CAR против L1CAM.
Термин «аутологический» в том виде, в котором он используется в данном документе, относится к любому материалу, который происходит из индивида и подлежит повторному введению тому же самому индивиду. Термин «аллогенный» в том виде, в котором он используется в данном документе, относится к любому материалу, происходящему от другого животного того же самого вида, что и индивид, которому вводится данный материал.
Согласно одному воплощению настоящего раскрытия эффекторная клетка включает группу клеток, трансфицированных или трансдуцированных вектором, содержащим молекулу нуклеиновой кислоты, кодирующую полипептид CAR против L1CAM. Трансфекция или трансдукция могут достигаться разными способами, известными в данной области, без ограничения.
Соответственно, согласно конкретному воплощению настоящего раскрытия молекула нуклеиновой кислоты, кодирующая CAR против L1CAM, доставляется в эффекторную клетку, например, Т-лимфоцит или клетку-природный киллер и транскрибируется в мРНК. Полипептид CAR против L1CAM транслируется от данной мРНК и экспрессируется на поверхности данной эффекторной клетки.
Как подтверждается в примерах настоящего раскрытия, эффекторная клетка, экспрессирующая CAR против L1CAM по настоящему раскрытию, эффективно умерщвляет SKOV3 (линия клеток рака яичника), SH-SY5Y (линия клеток нейробластомы) и НеLa (линия клеток шейки матки), которые представляют собой линии раковых клеток, экспрессирующие L1CAM на поверхности. Следовательно, эффекторная клетка, экспрессирующая CAR против L1CAM по настоящему раскрытию, может преимущественно использоваться в качестве активного ингредиента композиций для лечения разных раковых заболеваний.
Согласно другому аспекту настоящего раскрытия предложена фармацевтическая композиция для лечения или диагностики рака или воспалительного заболевания, причем данная фармацевтическая композиция включает вышеупомянутое антитело против L1CAM или его антигенсвязывающий фрагмент.
Согласно еще одному другому аспекту настоящего раскрытия предложена фармацевтическая композиция для лечения или диагностики рака или воспалительного заболевания, причем данная фармацевтическая композиция включает вышеупомянутую эффекторную клетку, экспрессирующую полипептид химерного рецептора антигена.
Данная фармацевтическая композиция представляет собой фармацевтическую композицию для иммунотерапии, включающую антитело против L1CAM или его антигенсвязывающий фрагмент, или эффекторную клетку, экспрессирующую полипептид химерного рецептора антигена.
Здесь термин «иммунотерапия» относится к лечению рака, при котором иммунная система помогает устранять рак. Иммунотерапия классифицируется на активную иммунотерапию и пассивную иммунотерапию. Активная иммунотерапия включает i) терапию противораковой вакциной, активирующую иммунную систему, посредством инъецирования раковых клеток или веществ, продуцируемых раковыми клетками, в человеческий организм, и ii) иммуномодулирующую терапию, активирующую специфичные лейкоциты посредством введения иммуномодулирующих средств, таких как цитокины (интерфероны, интерлейкины и т.д.) и факторы роста. Пассивная иммунотерапия включает терапию антителами и терапию иммунными клетками, связывающимися со специфическими раковыми клетками. В частности, терапия иммунными клетками включает терапию вакциной с дендритными клетками, терапию Т-клетками с химерным рецептором антигена (CAR-T), терапию клетками-природными киллерами (NK), терапию цитотоксическими Т-лимфоцитами (CTL), адоптивный перенос клеток и тому подобное, но не ограничивается ими. В настоящем раскрытии иммунотерапия, главным образом, относится к вышеупомянутой терапии иммунными клетками.
Фармацевтическая композиция по настоящему раскрытию включает эффекторные клетки, экспрессирующие антитело или его антигенсвязывающий фрагмент, которые связываются с антигеном L1CAM клетки-мишени, или включающий их химерный рецептор антигена, и, таким образом, она является эффективной в постановке диагноза или лечении заболевания, ассоциированного с высокой экспрессией L1CAM. Примерами заболевания, ассоциированного с высокой экспрессией L1CAM, являются раки воспалительное заболевание.
В особенности, раком, ассоциированным с высокой экспрессией L1CAM, является солидный рак, и данный солидный рак выбран из группы, состоящей из рака желудка, рака молочной железы, рака поджелудочной железы, рака шейки матки, карциномы эндометрия, желудочно-кишечной стромальной опухоли, рака яичника, меланомы, рака желчного пузыря, печеночно-клеточной карциномы, холангиокарциномы, аденокарциномы протоков поджелудочной железы, рака пищевода, карциномы клеток почки, рака прямой кишки, рака толстой кишки, рака предстательной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака щитовидной железы, глиомы, глиобластомы, нейробластомы и астроцитомы.
Воспалительное заболевание, ассоциированное с высокой экспрессией L1CAM, представляет собой воспалительное заболевание кишечника, но не ограничивается им.
Фармацевтическая композиция по настоящему раскрытию может включать вышеупомянутые эффекторные клетки, экспрессирующие CAR, например, целый ряд эффекторных клеток, экспрессирующих CAR, в комбинации с одним или более чем одним фармацевтически или физиологически приемлемым носителем, разбавителем или эксципиентом. Данная фармацевтическая композиция может включать буфер, такой как нейтральный буферизованный физиологический раствор или фосфатно-солевой буферный раствор; углевод, такой как глюкоза, манноза, сахароза или декстран, маннит; белок; полипептид или аминокислоту, такую как глицин; антиоксидант; хелатор, такой как EDTA (этилендиаминтетрауксусная кислота) или глутатион; адъювант (например, гидроксид алюминия) и консервант. В одном воплощении настоящего раскрытия фармацевтическую композицию готовят для внутривенного введения.
Фармацевтическая композиция по настоящему раскрытию может вводиться перорально или парентерально и может достигать мишени посредством, например, внутривенного введения, подкожного введения, внутрикожного введения, внутримышечного введения, внутрибрюшинного введения, внутриопухолевой инъекции, внутримозгового введения, внутричерепного введения, внутрилегочного введения и ректального введения, но не ограничиваясь ими.
Фармацевтическая композиция, включающая эффекторную клетку по настоящему раскрытию, вводится пациенту посредством внутрикожной или подкожной инъекции. В одном воплощении фармацевтическая композиция по настоящему раскрытию вводится посредством внутривенной инъекции. В другом воплощении фармацевтическая композиция по настоящему раскрытию вводится непосредственно в опухоль, лимфатические узлы или инфицированные участки.
Нуждающийся субъект по настоящему раскрытию может получать стандартное лечение с использованием высокодозной химиотерапии после пересадки стволовых клеток периферической крови. В одном воплощении настоящего раскрытия нуждающийся субъект по настоящему раскрытию может получать размноженные Т-клетки с CAR по настоящему раскрытию посредством введения, после или одновременно с пересадкой стволовых клеток периферической крови. В другом воплощении размноженные клетки вводятся до или после хирургии.
Подходящая доза для «иммунологически эффективного количества», «противоопухолевого эффективного количества», «подавляющего опухоль эффективного количества» или «терапевтического количества» фармацевтической композиции по настоящему раскрытию определяется такими факторами, как способ приготовления, способ введения, возраст пациента, масса тела и пол, патологическое состояние, питание, время введения, путь введения, скорость выведения и восприимчивость, и практикующий врач обычной квалификации может легко определять и прописывать дозу, которая является эффективной для желательного лечения или предупреждения, и подходящая доза будет определяться клиническими испытаниями. Термин «лечение» в том виде, в котором он используется в данном документе, относится к ослаблению, подавлению, уменьшению интенсивности или устранению болезненного состояния. Термин «противоопухолевый» в том виде, в котором он используется в данном документе, охватывает уменьшение объема опухоли, уменьшение числа опухолевых клеток, уменьшение числа метастазов, увеличение ожидаемой продолжительности жизни, уменьшение пролиферации опухолевых клеток, уменьшение выживания опухолевых клеток или уменьшения интенсивности разных физиологических симптомов, ассоциированных с раковым состоянием.
В общем, можно утверждать, что фармацевтическая композиция, включающая Т-клетки, описанная в данном документе, может вводиться в дозировке от 104 до 109 клеток/кг массы тела, в некоторых случаях от 105 до 106 клеток/кг массы тела (включая все целочисленные значения в пределах данных интервалов). Композицию Т-клеток также можно вводить в данных дозах много раз. Данные клетки могут вводиться посредством применения методик инфузии, которые обычно известны в иммунотерапии (см., например, [Rosenberg et al., New Eng. J. of Med. 319:1676, 1988]).
Фармацевтическая композиция по настоящему раскрытию также может использоваться в комбинации с другими фармацевтически активными лекарственными средствами и терапиями, помимо вышеописанного активного ингредиента. Термин «комбинация» может выражаться в виде одновременного или совместного введения. Эффекторная клетка, экспрессирующая CAR, описанная в данном документе, и по меньшей мере одно дополнительное терапевтическое средство могут вводиться одновременно в той же самой композиции или в отдельных композициях, или последовательно. Для последовательного введения описанная в данном документе клетка, экспрессирующая CAR, может вводиться первой, а дополнительное средство может вводиться вторым, или порядок введения может быть обращен.
Примеры терапевтического средства, которое можно использовать в комбинации с фармацевтической композицией по настоящему раскрытию, включают: одно или более чем одно химиотерапевтическое средство, известное в данной области (например, аспарагиназа, бусульфан, карбоплатин, цисплатин, даунорубицин, доксорубицин, фторурацил, гемцитабин, гидроксимочевина, метотрексат, паклитаксел, ритуксимаб, винбластин, винкристин и т.д.); одну или более чем одну таргетную терапию (например, бевацизумаб, олапариб и т.д.); PD-1/PD-L1-специфичные ингибиторы иммунологической контрольной точки (например, опдиво, кейтруда и т.д.), но не ограничиваются ими.
Согласно еще одному другому аспекту настоящего раскрытия предложен способ лечения рака или воспалительного заболевания у субъекта, нуждающегося в этом, включающий введение данному субъекту эффекторной клетки, экспрессирующей химерный рецептор антигена.
Раковые и воспалительные заболевания, которые являются целевыми заболеваниями способа лечения по настоящему раскрытию, являются такими же, что и заболевания, определенные по отношению к целевым заболеваниям лечения фармацевтической композицией.
В одном воплощении настоящего раскрытия субъектом является млекопитающее или человек.
Поскольку в способе лечения рака или воспалительного заболевания по настоящему раскрытию обычно используется вышеописанная эффекторная клетка, экспрессирующая химерный рецептор антигена в качестве активного ингредиента, описание перекрывающегося содержания между ними опускается для того, чтобы избежать избыточной сложности настоящего описания изобретения.
Полезные эффекты
Согласно настоящему раскрытию предложено антитело против L1CAM или его антигенсвязывающий фрагмент, которое специфично связывается с антигеном L1CAM, включающий его химерный рецептор антигена и их применения. Антитело против L1CAM или его антигенсвязывающий фрагмент по настоящему раскрытию имеет превосходную специфичность и аффинность по отношению к L1CAM и, таким образом, может использоваться в лечении и постановке диагноза разных типов раковых заболеваний и воспалительных заболеваний, ассоциированных с высокой экспрессией L1CAM. В частности, при экспрессии химерного рецептора антигена, включающего антитело против L1CAM, по настоящему раскрытию в эффекторных клетках, например, Т-лимфоцитах, такую экспрессию можно преимущественно использовать в качестве иммунотерапевтического способа против разных типов раковых заболеваний и воспалительных заболеваний, ассоциированных с L1CAM.
Краткое описание графических материалов
На ФИГ. 1 схематически показана методика пэннинга библиотеки фагового дисплея.
На ФИГ. 2 показаны графики, иллюстрирующие степень обогащения фагов в отношении антигена mL1CAM согласно циклу пэннинга фага (верх: титр фага на выходе, низ: элюционное отношение титра).
На ФИГ. 3А-3С показаны результаты проведения EL1SA (твердофазный иммуноферментный анализ) на моноклональный фаг для отбора клонов фага, специфично связывающихся с антигеном mL1CAM, для каждого цикла пэннинга фага.
На ФИГ. 4 показана частота отбора девяти типов клонов scFv, отобранных в настоящем раскрытии.
На ФИГ. 5 показаны результаты проведения EL1SA на моноклональный клон фага в отношении hL1CAM на девяти типах уникальных клонов scFv против mL1CAM, перекрестно реагирующих с мышиным L1CAM, которые были отобраны в настоящем раскрытии, для того, чтобы раскрыть антитела, перекрестно реагирующие с человеческим L1CAM и мышиным L1CAM.
На ФИГ. 6 показан анализ SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) очищенных клонов scFv против mL1CAM.
На ФИГ. 7А-7С показана аффинность к антигенам mL1CAM и hL1CAM у четырех типов антител scFv против mL1CAM по настоящему раскрытию согласно результатам EL1SA в растворе на ФИГ. 5.
На ФИГ. 7D и 7Е показана аффинность к антигенам mL1CAM и hL1CAM у четырех типов антител scFv против L1CAM по настоящему раскрытию согласно результатам октетной системы.
На ФИГ. 8 показана карта вектора плазмиды pMT-CART, используемой для изготовления конструкции CAR, содержащей scFv против L1CAM, отобранное в настоящем раскрытии.
ФИГ. 9 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить конструкцию CAR, содержащую scFv против L1CAM по настоящему раскрытию.
На ФИГ. 10А-10 В показаны структуры CAR-конструкций, содержащих scFv против L1CAM (L1-CAR-001, L1-CAR-002, L1-CAR-003 и L1-CAR-004), сконструированных в примере по настоящему раскрытию.
На ФИГ. 11А и 11 В показаны ретровирусные векторы, в которые вводили четыре типа CAR-конструкций, содержащих scFv против L1CAM (L1-CAR-001, L1-CAR-002, L1-CAR-003 и L1-CAR-004) по настоящему раскрытию.
На ФИГ. 12 показаны показатели экспрессии L1CAM в клетках SKOV3 и клетках 293Т.
На ФИГ. 13А и 13 В показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM по настоящему раскрытию, на клетках SKOV3 (высокая экспрессия L1CAM, ФИГ. 13А) и клетках 293Т (низкая экспрессия L1CAM, ФИГ. 13 В).
На ФИГ. 14 показана противораковая активность in vivo Т-клеток, экспрессирующих CAR против L1CAM (CAR против L1) по настоящему раскрытию.
На ФИГ. 15 показана карта вектора плазмиды pMT-CAR-002, используемой для изготовления конструкции CAR, содержащей scFv против L1CAM, отобранной в настоящем раскрытии.
ФИГ. 16 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовлять CAR-конструкцию, содержащую scFv против L1CAM по настоящему раскрытию.
На ФИГ. 17 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-002), сконструированный в примере по настоящему раскрытию.
На ФИГ. 18 показана карта вектора плазмиды pMT-CART-003, используемой для изготовления CAR-конструкции, содержащей scFv против L1CAM, отобранной в настоящем раскрытии.
ФИГ. 19 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM по настоящему раскрытию.
На ФИГ. 20 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-003), сконструированной в примере по настоящему раскрытию.
ФИГ. 21 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM по настоящему раскрытию.
На ФИГ. 22 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-004), сконструированной в примере по настоящему раскрытию.
На ФИГ. 23A-23D показаны ретровирусные векторы, в которые вводили четыре типа CAR-конструкций, содержащих scFv против L1CAM (L1-H8-CAR-001, L1-H8-CAR-002, L1-H8-CAR-003 и L1-H8-CAR-004) по настоящему раскрытию.
На ФИГ. 24A-24G показаны показатели экспрессии L1CAM в клетках SKOV3, клетках HeLa, клетках SH-SY5Y и клетках 293Т.
На ФИГ. 25 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках SKOV3 (высокая экспрессия L1CAM).
На ФИГ. 26 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках 293Т (низкая экспрессия L1CAM).
На ФИГ. 27А и 27 В показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках SH-SY5Y (высокая экспрессия L1CAM).
На ФИГ. 28А и 28 В показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках HeLa (высокая экспрессия L1CAM).
На ФИГ. 29 показана противораковая активность in vivo Т-клеток, экспрессирующих CAR против L1CAM (CAR против L1), по настоящему раскрытию.
На ФИГ. 30 показана карта вектора плазмиды pMT-CART-004, используемой для изготовления CAR-конструкции, содержащей отобранный scFv против L1CAM.
ФИГ. 31 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM.
На ФИГ. 32 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-001-28BB), сконструированной в примере по настоящему раскрытию.
На ФИГ. 33 показана карта вектора плазмиды pBHA-ICOS TM+ICD, используемой для изготовления CAR-конструкции, содержащей отобранный scFv против L1CAM.
ФИГ. 34 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM.
На ФИГ. 35 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-001-28ICOS), сконструированной в примере по настоящему раскрытию.
ФИГ. 36 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM.
На ФИГ. 37 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-001-28), сконструированной в примере по настоящему раскрытию.
ФИГ. 38 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM.
На ФИГ. 39 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-001-OX), сконструированной в примере по настоящему раскрытию.
ФИГ. 40 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM.
На ФИГ. 41 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-001-BB), сконструированной в примере по настоящему раскрытию.
ФИГ. 42 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM.
На ФИГ. 43 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-001-ICOS), сконструированной в примере по настоящему раскрытию.
На ФИГ. 44A-44F показаны ретровирусные векторы, в которых ввели шесть типов CAR-конструкций, содержащих scFv против L1CAM (L1-H8-CAR-001-28BB, L1-H8-CAR-001-28ICOS, L1-H8-CAR-001-28, L1-H8-CAR-001-OX, L1-H8-CAR-001-BB, и L1-H8-CAR-001-ICOS) по настоящему раскрытию.
На ФИГ. 45A-45I показаны показатели экспрессии L1CAM в клетках SKOV3, клетках SH-SY5Y, клетках HeLa и клетках 293Т.
На ФИГ. 46 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках SKOV3 (высокая экспрессия L1CAM).
На ФИГ. 47 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках 293Т (низкая экспрессия L1CAM).
На ФИГ. 48А-48С показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках SH-SY5Y (высокая экспрессия L1CAM).
На ФИГ. 49А-49С показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках HeLa (высокая экспрессия L1CAM).
На ФИГ. 50 показана противораковая активность in vivo Т-клеток, экспрессирующих CAR против L1CAM (CAR против L1), по настоящему раскрытию.
На ФИГ. 51 показана карта вектора плазмиды pBHA-3E8LS-H8Rev, используемой для изготовления CAR-конструкции, содержащей scFv против L1CAM, отобранной в настоящем раскрытии.
ФИГ. 52 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM по настоящему раскрытию.
На ФИГ. 53 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-005), сконструированной в примере по настоящему раскрытию.
На ФИГ. 54 показана карта вектора плазмиды pMT-CART-005, используемой для изготовления CAR-конструкции, содержащей scFv против L1CAM, отобранной в настоящем раскрытии.
ФИГ. 55 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM по настоящему раскрытию.
На ФИГ. 56 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-006), сконструированной в примере по настоящему раскрытию.
На ФИГ. 57 показана карта вектора плазмиды pMT-CART-006, используемой для изготовления CAR-конструкции, содержащей scFv против L1CAM, отобранной в настоящем раскрытии.
ФИГ. 58 представляет собой схематическую диаграмму, показывающую ряд процедур ПЦР-амплификации для того, чтобы изготовить CAR-конструкцию, содержащую scFv против L1CAM по настоящему раскрытию.
На ФИГ. 59 показана структура CAR-конструкции, содержащей scFv против L1CAM (L1-H8-CAR-007), сконструированной в примере по настоящему раскрытию.
На ФИГ. 60А-60С показаны ретровирусные векторы, в которые были введены три типа CAR-конструкций, содержащих scFv против L1CAM (L1-H8-CAR-005, L1-H8-CAR-006 и L1-H8-CAR-007) по настоящему раскрытию.
На ФИГ. 61A-61F показаны показатели экспрессии L1CAM в клетках SKOV3, клетках SH-SY5Y, клетках HeLa и клетках 293Т.
На ФИГ. 62 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках SKOV3 (высокая экспрессия L1CAM).
На ФИГ. 63 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках SH-SY5Y (высокая экспрессия L1CAM).
На ФИГ. 64 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM, по настоящему раскрытию на клетках HeLa (высокая экспрессия L1CAM).
На ФИГ. 65 показана противораковая активность Т-клеток, экспрессирующих CAR против L1CAM по настоящему раскрытию на клетках 293Т (низкая экспрессия L1CAM).
Способ осуществления данного изобретения
Далее настоящее раскрытие будет описано более подробно со ссылкой на примеры. Данные примеры приводятся только с целью более подробного иллюстрирования настоящего раскрытия и, следовательно, согласно цели настоящего раскрытия, специалисту в данной области было бы очевидным то, что данные примеры не истолковываются для ограничения объема настоящего раскрытия.
Примеры
Во всем настоящем описании изобретения «%», используемый для выражения концентрации конкретного вещества, если конкретно не утверждается иное, относится к % (масс./масс.) для твердое вещество/твердое вещество, % (масс./об.) для твердое вещество/жидкость и % (об./об.) для жидкость/жидкость.
Пример 1: отбор антител scFv против антигена L1CAM
1.1. Пэннинг библиотеки фагового дисплея человеческих синтетических антител scFv
Для отбора антител scFv против mL1CAM, связывающихся с мышиным антигеном L1CAM (mL1CAM), проводили вплоть до 4 циклов пэннинга фага в отношении белка антигена mL1CAM посредством применения библиотеки фагового дисплея человеческих синтетических scFv (KscFv-1, KBIO HEALTH) (ФИГ. 1). Белок антигена mL1CAM (R&D system, кат. №5674-NC) добавляли в иммунопробирки, инкубировали при 4°С в течение ночи и затем блокировали посредством инкубации с фосфатно-солевым буферным раствором, содержащим 5% обезжиренного молока (MPBS, от англ. milk phosphate buffered saline), при комнатной температуре в течение 1 часа. MPBS добавляли к KscFv-1, с последующей инкубацией при комнатной температуре в течение 1 часа, получая, посредством этого, блокированных фагов. Данных блокированных фагов добавляли в иммунопробирки, покрытые белком антигена mL1CAM, с последующей инкубацией при 37°С в течение 90 минут. После промывки фагов PBS, содержащим 0,05% Твин 20, добавляли к сбору (элюату) фагов, прикрепившихся к иммунопробиркам, 100 мМ триметиламин. Собранных фагов нейтрализовали добавлением 1 М Tris-HCI, и затем добавляли Е, coli TG1 (Lucigen, кат. №60502-2), культивируемую в средней логарифмической фазе (ОП600 (оптическая плотность при 600 нм) 0,5-1,0), с последующей инкубацией при 37°С в течение 1 часа. После инкубации осадки клеток собирали и инокулировали на планшетах со средой ТВ, содержащей ампициллин и 2% глюкозы. Культивируемые колонии собирали и затем хранили при -80°С после добавления 50% глицерина. Поскольку белок антигена mL1CAM (R&D system, кат. №5674-NC) был слит с доменом Fc, на стадии пэннинга также проводили контрольный пэннинг Fc для обеднения Fc, и обогащение фагов отслеживали посредством отношения титра элюции посредством сравнения соответствующих значений титра на выходе в каждом цикле. Отношение титра элюции представляет собой значение, полученное делением значения титра фага на выходе (антиген mL1CAM) на значения титра контрольного Fc на выходе (нет антигена mL1CAM). Как показано на ФИГ. 2, mL1CAM-Fc демонстрировал большое различие в титре на выходе от Fc контроля со 2-го цикла пэннинга фага. Обогащение инициировалось со 2-го цикла пэннинга фага, и для антигена mL1CAM mL1CAM-Fc демонстрировало различие примерно в 23,9 раз по сравнению с контролем во втором цикле пэннинга фага, различие в 66,1 раз в третьем цикле пэннинга фага и различие в 141,4 раз в четвертом цикле пэннинга фага.
1.2 Скрининг фага посредством EL1SA
Для отбора среди фагов, полученных пэннингом фагов, клонов, специфично прилипающих к белку антигена mL1CAM, проводили EL1SA на моноклональные фаги на 95 клонах, полученных во 2-ом, 3-ем и 4-ом циклах пэннинга.
В частности, белок антигена mL1CAM добавляли в 96-луночные планшеты, инкубировали при 4°С в течение ночи и затем блокировали 2% MPBS при 37°С в течение 2 часов. Поскольку белок антигена mL1CAM был слит с доменом Fc, в 96-луночные планшеты также добавляли Fc в качестве Fc контроля, инкубировали при 4°С в течение ночи и блокировали 2% MPBS при 37°С в течение 2 часов. Затем в данные 96-луночные планшеты добавляли фаги (вплоть до 1011 КОЕ (колониеобразующая единица). После инкубации при комнатной температуре в течение 90 минут разводили в PBS антитело против М13, конъюгированное с HRP (пероксидаза хрена) (Sino Biological, кат. №11973-ММ05), до 1:5000 и добавляли в 96-луночные планшеты. После инкубации при комнатной температуре в течение 1 часа последовательно добавляли субстрат ТМВ (тетраметилбензидин) (Sigma, кат. №Т0440) и 2 н. H2SO4 (Merck, кат. №100731), и измеряли поглощение (ОП) при 450 нм. В результате, при установлении порога отсечения поглощения (А450 нм) по меньшей мере 0,4 для антигена mL1CAM для отбора, один клон во 2-ом цикле, всего 26 клонов в 3-ем цикле и всего 9 клонов в 4-ом цикле специфично связывались (позитивные) с антигеном mL1CAM в EL1SA (ФИГ. 3).
1.3 Секвенирование уникальных клонов scFv в отношении антигена mL1CAM по настоящему раскрытию
36 типов клонов scFv в отношении антигена mL1CAM, которые продемонстрировали положительный ответ в EL1SA на моноклональный фаг, секвенировали, и данные последовательности группировали выравниванием посредством нумерации по Kabat, и в результате всего получали 9 типов уникальных клонов scFv против mL1CAM (Таблицы 1 и 2). Рассматривая частоту отбора клонов scFv, полученных для антигена mL1CAM, клоны 3-го цикла (mL1CAM-3R-H8, mL1CAM-3R-E1 и mL1CAM-3R-C9) были отобраны как главные клоны, насчитывающие 33%, 26% and 16%, соответственно, и остальные клоны были отобраны как минорные клоны, насчитывающие в интервале 3-10% (ФИГ. 4).
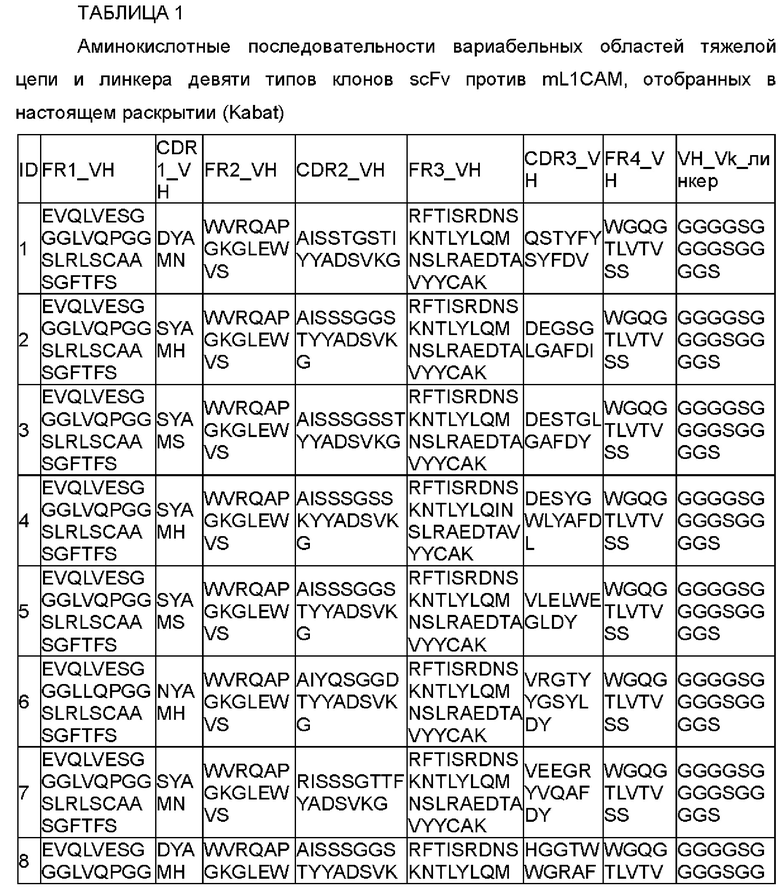
ID клонов, выделенные жирный шрифтом, означают ID клонов, представляющих соответствующие группы.
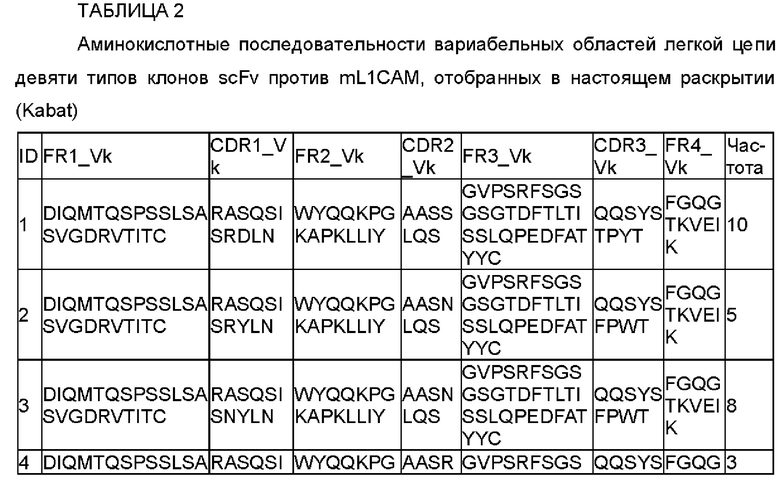
ID клонов, выделенные жирный шрифтом, означают ID клонов, представляющих соответствующие группы.
1.4. Открытие антител scFv, перекрестно реагирующих с человеческим L1CAM (hL1CAM) и мышиным L1CAM (mL1CAM)
Для открытия антител, перекрестно реагирующих с человеческим L1CAM (hL1CAM, R&D system, кат. №777-NC) и мышиным L1CAM, осуществляли EL1SA на моноклональный фаг всего на 9 типах уникальных клонов scFv против mL1CAM в отношении антигена hL1CAM. В результате, при установке порога отсечения поглощения (А450 нм) для антигена hL1CAM по меньшей мере 0,4 для отбора всего четыре клона (mL1CAM-3R-H8, mL1CAM-3R-C9, mL1CAM-3R-E1 и mL1CAM-3R-E9) перекрестно реагировали с антигеном hL1CAM (ФИГ. 5 и Таблицы 3 и 4).
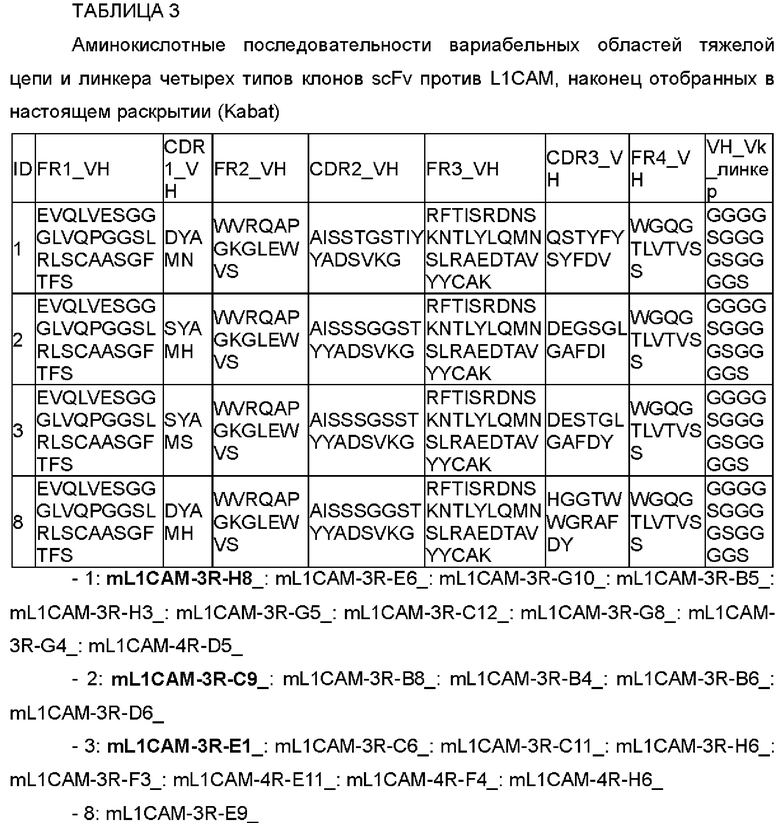
ID клонов, выделенные жирный шрифтом, означают ID клонов, представляющих соответствующие группы.
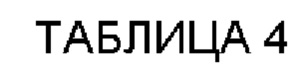
ID клонов, выделенные жирный шрифтом, означают ID клонов, представляющих соответствующие группы.
1.5. Экспрессия в Е. coli и очистка четырех типов уникальных клонов scFv, перекрестно реагирующих с человеческим L1CAM и мышиным L1CAM.
Всего четыре типа уникальных клонов scFv против mL1CAM, полученных посредством оценки перекрестной реактивности и ELISA на моноклональный фаг, клонировали в экспрессионные векторы Е. coli (pKFAB, KBIO HEALTH), индуцированные к экспрессии посредством 0,5 мкМ IPTG (изопропилтиогалактозид) в 200 мл среды ТВ, и инкубировали при 30°С в течение ночи. Растворимые белки получали посредством экстракции периплазматического белка и затем очищали посредством аффинной хроматографии с использованием колонки с меткой strep II. Экспрессию каждого очищенного клона подтверждали посредством анализа SDS-PAGE (электрофорез в полиакриламидном геле с додецилсульфатом натрия) (ФИГ. 6).
1.6. Анализ аффинности
Аффинность связывания каждого клона с белком L1CAM сравнивали и анализировали посредством EL1SA в растворе с использованием белков антител scFv против L1CAM (4 типа), которые были отобраны и очищены.
В частности, в 96-луночные планшеты добавляли белок антигена mL1CAM или белок антигена hL1CAM, инкубировали при 4°С в течение ночи и затем блокировали 2% MPBS при комнатной температуре в течение 1 часа. Затем добавляли очищенный белок антитела scFv против L1CAM. После инкубации при комнатной температуре в течение 90 минут антитело против StrepMAB, конъюгированное с HRP (IBA, кат. №2-1509-001), разводили в 2% MPBS до 1:5000 и добавляли. После инкубации при комнатной температуре в течение 1 часа последовательно добавляли субстрат ТМВ (Sigma, кат. №Т0440) и 2 н. H2SO4 (Merck, кат. №100731), и измеряли поглощение (ОП) при 450 нм. В результате каждый клон связывался с антигеном mL1CAM с аффинностью, варьирующей от 5 нМ (mL1CAM-3R-C9) до 50 нМ (mL1CAM-3R-E1). В результате сравнения и проведения анализа аффинности в отношении белка hL1CAM каждый клон связывался с антигеном hL1CAM с аффинностью, варьирующей от 2 нМ (mL1CAM-3R-H8) до 20,87 мкМ (mL1CAM-3R-E9) (ФИГ. 7А-7С). При синтетическом сравнении аффинности связывания четырех типов перекрестно реагирующих клонов для каждого L1CAM, аффинность связывания повышалась в порядке Н8 больше Е1 больше С9 больше Е9.
Клон 3R-H8, демонстрирующий наивысшую аффинность связывания среди четырех типов scFv против L1CAM, подвергали процедуре превращения, посредством этого сохраняя полное антитело IgG1. Посредством системы Octet (Forte Bio, № модели QK384) с использованием очищенного полного антитела IgG1 анализировали аффинность антиген-антитело в отношении белка антигена hL1CAM (Sino biological, кат. №10140-Н08Н) или белка mL1CAM (R&D, кат.№5674-NC). Результат подтвердил то, что соответствующее антитело имело аффинность связывания 4.14Е-09 KD (М) с белком антигена hL1CAM и аффинность связывания 2,05Е-08 KD (М) с антигеном mL1CAM (ФИГ. 7D-7E).
Пример 2: изготовление Т-клеток, экспрессирующих ген CAR против L1CAM, и подтверждение их активности
2.1. Получение гена CAR против L1CAM
2.1.1. Получение гена антитела scFv против mL1CAM
Нуклеотидные последовательности клонов scFv против L1CAM получали посредством секвенирования с использованием промотора Lac-прямых праймеров от фагмид, содержащих клоны scFv против L1CAM, отобранные в настоящем раскрытии (Таблица 5). Прямые и обратные праймеры получали на основе проанализированных нуклеотидных последовательностей, и ПЦР-продукты получали амплификацией фагмид в качестве матриц посредством способа ПЦР. Полученные ПЦР-продукты антител scFv против L1CAM амплифицировали в качестве матриц посредством ПЦР с использованием праймера SEQ ID NO: 68 (Таблица 6) и праймера SEQ ID NO: 69 (Таблица 6). Праймер, связывающийся с 5' сайтом вариабельной тяжелой цепи (VH) антитела scFv против L1CAM, имеет 12-нуклеотидную последовательность лидерной последовательности (LS) антитела 3Е8, которое представляет собой мышиный моноклонольный IgG, и праймер, связывающийся с 3' сайтом вариабельной легкой цепи (VL) антитела scFv против L1CAM, имеет 12-нуклеотидную последовательность шарнира IgD. Следовательно, ПЦР-продукт, амплифицированный данными праймерами, имеет нуклеотидную последовательность шарнира 3Е8 LS-scFV-IgD. Амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.



2.1.2. Получение гена лидерной последовательности антитела 3Е8
Плазмиду pMT-CAR, содержащую лидерную последовательность антитела 3E8 (ФИГ. 8), амплифицировали в качестве матрицы посредством ПЦР с использованием праймера SEQ ID NO: 70 (Таблица 6) и праймера SEQ ID NO: 71 (Таблица 6) перед применением. Праймер, связывающийся с 5' сайтом лидерной последовательности (LS) 3E8 имеет нуклеотидную последовательность рестрикционного фермента Mlu I, и праймер, связывающийся с 3' сайтом лидерной последовательности (LS) 3E8, имеет 12-нуклеотидную последовательность вариабельной области тяжелой цепи антитела scFv против L1CAM. Следовательно, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-3E8 LS-scFv. Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
2.1.3. Получение гена шарнирной области человеческого IgD, трансмембранного домена, внутриклеточного домена сигнализации, костимулирующего домена и CD3ζ.
Для изготовления CAR-конструкций по настоящему раскрытию ген шарнирной области человеческого IgD, трансмембранного домена (ТМ) CD28, внутриклеточного домена сигнализации (ICD), костимулирующего домена ОХ40 и CD3ζ получали следующими способами.
Во-первых, плазмиду pMT-CAR (ФИГ. 8) амплифицировали в качестве матрицы посредством ПЦР с использованием праймера SEQ ID NO: 72 (Таблица 6) и праймера SEQ ID NO: 73 (Таблица 6). Праймер, связывающийся с 5' сайтом шарнирной области человеческого IgD, включает 12-нуклеотидную последовательность вариабельной области легкой цепи антитела scFv против L1CAM, и праймер, связывающийся с 3' сайтом CD3ζ, включает нуклеотидную последовательность рестрикционного фермента Xhol. Следовательно, ПЦР-продукт, амплифицированный данными праймерами, имеет нуклеотидную последовательность scFv-шарнир IgD-TM CD28-ICD-OX40-CD3ζ-Xho I (Таблица 7). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.


2.1.4. Получение векторов pGemT-L1CAM-CAR
Mlu I-LS 3E8-scFv, который представляет собой ПЦР-продукт, амплифицированный в 2.1.2, и LS 3E8-scFv-шарнир IgD, который представляет собой ПЦР-продукт, амплифицированный в 2.1.1, амплифицировали в качестве матриц посредством ПЦР с перекрывающимися праймерами (ПП-ПЦР), используя праймер SEQ ID NO: 70 (Таблица 6) и праймер SEQ ID NO: 69 (Таблица 6).
Образующиеся амплифицированные Mlu I-LS 3E8-scFv-шарнир IgD и scFv-шарнир IgD-TM CD28-ICD-OX40-CD3ζ-Xho I, который представляет собой ПЦР-продукт, амплифицированный в 2.1.3, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймера SEQ ID NO: 70 (Таблица 6) и праймера SEQ ID NO: 73 (Таблица 6) (ФИГ. 9). Образующийся амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv-шарнир IgD-TM CD28-ICD-OX40-CD3ζ-Xho I. Данный амплифицированный ПЦР-продукт лигировали в вектор pGemT EASY (Promega, WI, США), имеющий множественные последовательности Т на обоих концах линейной ДНК, с получением конструкций CAR: pGemT-L1-CAR-001, pGemT-L1-CAR-002, pGemT-L1-CAR-003 и pGemT-L1-CAR-004. Подтверждали, что полученные конструкции CAR являются такими же, что и исходная последовательность, посредством секвенирования (ФИГ. 10А и 10 В). Для секвенирования использовали пару праймеров SEQ ID NO: 74 и 75 (Таблица 6).
2.1.5. Получение ретровирусных векторов pMIN-L1-CAR
Четыре типа векторов pGemT-L1-CAR обрабатывали рестрикционными ферментами Mlu I и Xho I с получением фрагментов ДНК. Полученные фрагменты ДНК лигировали с ретровирусными векторами рМТ (патент США №US7049143), ранее обработанными рестрикционными ферментами Mlu I и Xho I, с конструированием четырех типов ретровирусных векторов pMT-L1-CAR (ФИГ. 11). Ретровирусные векторы pMT-L1-CAR, сконструированные таким образом, включают последовательности, кодирующие антитело против L1-CAR под контролем промотора MLV LTR.
2.2. Получение Т-клеток, экспрессирующих ген CAR против L1
2.2.1. Получение ретровирусов, экспрессирующих ген CAR против L1 (ретро в и русы с CAR против L1)
Ретровирусы для доставки гена CAR против L1 получали с использованием трансформации плазмидной ДНК (Soneoka Yet al., 1995). Использовали систему трансформации TransIT 293 (Mirus Bio LLC, WI, США) и действовали согласно протоколу изготовителя. На предыдущие сутки ретровирусные векторы pMT-L1-CAR (pMT-L1-CAR-001, pMT-L1-CAR-002, pMT-L1-CAR-003 и pMT-L1-CAR-004), сконструированные в 2.1 выше, экспрессионный вектор gag-pol и экспрессионный вектор RD114 env трансформировали в линии клеток 293Т, которые высевали в количестве 1×106 на 60 мм чашки, и затем данные клетки культивировали в течение примерно 48 часов. По завершении культивирования все культуры клеток отбирали и затем фильтровали через 0,45 мкм фильтр. Четыре типа ретровирусов с CAR против L1, полученных таким образом, измеряли на титр посредством ПЦР в реальном времени с использованием набора для измерения титра ретровирусов (TaKaRa, ЯПОНИЯ) и затем хранили замороженными при -80°С до применения.
2.2.2 Получение Т-клеток, экспрессирующих ген CAR против L1
Одноядерные клетки получали из крови реципиента с использованием SepMate™-50 (STEMCELL) и FicolI-Paque PLUS (GE healthcare, Швеция). Одноядерные клетки распределяли в количестве 1×107 в 100 мм чашки, в то время как в качестве культуральной среды использовали среду AIMV (Invitrogen), содержащую 5% человеческой сыворотки, и затем добавляли антитело против CD3 (ОКТЗ, eBioscience) в количестве 50 нг на мл, посредством этого активируя Т-клетки. Для роста Т-клеток добавляли в культуральную среду человеческий IL-2 (интерлейкин-2) (R&D) в концентрации 300 U на мл и осуществляли культивирование. После 48-часовой инкубации активированные Т-клетки отбирали и использовали для доставки четырех типов ретровирусов с CAR против L1.
Ретронектин (TaKaRa, Япония), полученный в концентрации 10 мкг/мл, добавляли в 6-луночные планшеты в объеме 2 мл на лунку, и затем покрывали им планшеты посредством инкубации при комнатной температуре в течение 2 часов. После инкубации остаточный ретронектин удаляли и затем добавляли фосфатно-солевой буферный раствор (PBS), содержащий 2,5% бычьего сывороточного альбумина (BSA), в объеме 2 мл на лунку и блокировали посредством инкубации при комнатной температуре в течение 30 минут. После инкубации раствор, используемый для блокирования, удаляли, и клетки промывали добавлением HBSS, содержащего 2,5% 1 М HEPES, в объеме 3 мл на лунку. Ретровирусы с CAR против L1 разводили до 3×1010 копий на лунку с использованием сред AIMV, содержащих 5% человеческой сыворотки, и добавляли 4 мл разведения, с последующим центрифугированием при условиях 2000 g и 32°С в течение 2 часов, посредством этого иммобилизуя ретровирусы на ретронектине. Такое же количество среды, использованной для разведения ретровируса, добавляли в лунки, подлежащие применению в качестве контроля. После инкубации остаточные ретровирусы удаляли, и активированные Т-клетки добавляли в количестве 2×106 на лунку, с последующей инкубацией при 1000 g в течение 15 минут, доставляя, посредством этого, ретровирусы с CAR против L1 в Т-клетки. Для увеличения эффективности доставки, процедуру доставки повторяли еще один раз на следующие сутки, и, таким образом, всего осуществляли доставку 2 раза. Через 24 часа после доставки все Т-клетки собирали и субкультивировали в Т-образных флаконах в концентрации 5×105 клеток на мл со средой AIMV, содержащей 300 U/мл 5% человеческой сыворотки и человеческого IL-2. Данные клетки субкультивировали в концентрации 5×105 клеток на мл каждые 3-4 суток и поддерживали таким образом, чтобы не превышать концентрацию 2×106 на мл.
Исследовали то, экспрессировался ли CAR против L1 в активированных Т-клетках (Т-клетки, экспрессирующие CAR против L1), доставляющих ретровирусы с CAR против L1. В сутки 8 и 20 инкубации получали 1×106 клеток и инкубировали с биотинилированным белком L (Genescript, кат. №М00097) при 4°С в течение 45 минут. После инкубации клетки инкубировали со стрептавидином, конъюгированным с фикоэритрином (BD, кат. №554061) при 4°С в течение 30 мин, и показатель экспрессии CAR против L1 проверяли посредством проточной цитометрии. Данные результаты подтвердили то, что хотя и имеется различие в зависимости от донора, показатель экспрессии CAR против L1 составлял примерно от 19,9% до 67,2% в сутки 8 инкубации и примерно от 34,5% до 94,9% в сутки 20 инкубации (Таблица 8).
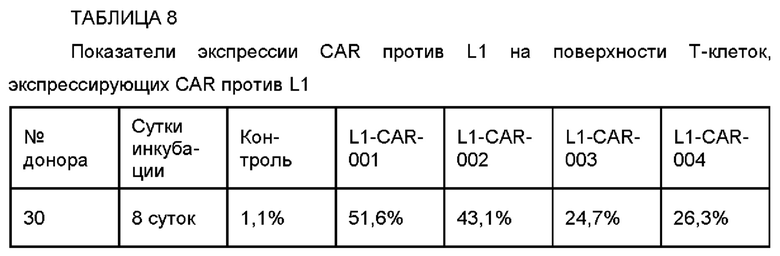

2.3. Подтверждение противораковой активности Т-клеток, экспрессирующих ген CAR против L1
2.3.1. Подтверждение показателей экспрессии L1CAM в клетках-мишенях
Известно, что линия клеток аденокарциномы яичника человека SKOV3 высоко экспрессирует L1CAM, который является антигеном в настоящем раскрытии, и, таким образом, представляет собой подходящую линию клеток для исследования противораковой активности Т-клеток, экспрессирующих CAR против L1CAM по настоящему раскрытию. Для проверки этого линию клеток SKOV3 получали в концентрации 5×105 клеток в 100 мкл PBS, и добавляли 0,25 мкг антитела против hCD171-PE (клон 5G3) (eBioscience, кат. №12-1719-42) с последующей инкубацией при 4°С в течение 30 минут. После инкубации клетки дважды промывали PBS, и показатель экспрессии L1CAM проверяли посредством проточной цитометрии. Результаты подтверждали, что показатель экспрессии L1CAM составлял примерно 74% в раковых клетках SKOV3. Тем временем, в результате исследования экспрессии L1CAM в линии клеток человеческой эмбриональной почки 293Т посредством того же самого способа был подтвержден показатель экспрессии примерно 3% (ФИГ. 12).
2.3.2. Подтверждение противораковой активности Т-клеток, экспрессирующих L1CAM, на клетках-мишенях
Для исследования противораковой активности Т-клеток, экспрессирующих CAR против L1CAM (CAR против L1) (эффекторные клетки, Е) по настоящему раскрытию на клетках-мишенях (Т), использовали способ анализа клеток в реальном времени xCELLigence (RTCA). Согласно способу RTCA xCELLigence поток электронов численно отображается как значение индекса при включении электропроводящего раствора (например, культуральной среды) на планшет, покрытый биосенсором на основе золотого микроэлектрода, и ток электронов нарушается, приводя к измененным значениям индекса при прилипании клеток-мишеней к планшету. При добавлении Т-клеток, экспрессирущих CAR (CAR-T), прилипающие клетки-мишени отделяются от планшета из-за цитотоксичности Т-клеток, и противораковую активность (цитотоксичность) можно проверять посредством анализа изменения в значении индекса. Клетки-мишени получали в количестве 1×104 клеток в 50 мкл культуральной среды и добавляли на планшет для анализа. Через 21 час Т-клетки, экспрессирующие CAR против L1, готовили в количестве 1×104, 5×104 и 1×105 (отношение Е:Т равно 1, 5 и 10) в 50 мкл среды AIMV, содержащей человеческую сыворотку и человеческий IL-2, и добавляли в лунки, содержащие клетки-мишени, для проверки значения клеточного индекса в реальном времени в течение 50 часов. Кроме того, готовили лунки, содержащие только клетки-мишени, и противораковую активность Т-клеток, экспрессирующих CAR против L1, рассчитывали следующим образом.
Уравнение
Цитотоксичность (%)={(значение индекса лунки клетки-мишени) - (значение индекса инкубационной лунки клетки-мишени и Т-клетки)}/(значение индекса лунки клетки-мишени) × 100
Результаты подтвердили, что среди четырех типов Т-клеток, экспрессирующих CAR против L1 по настоящему раскрытию, L1-CAR-004 демонстрировал большую цитотоксичность в клетках SKOV3, чем Т-клетки, не экспрессирующие CAR (контроль). Хотя и имеется различие в зависимости от донора, L1-CAR-001 демонстрировали цитотоксичность в клетках SKOV3 по сравнению с контролем (ФИГ. 13А). Все четыре типа демонстрировали меньшую цитотоксичность, чем контроль в клетках 293Т, демонстрируя низкий показатель экспрессии L1CMA (ФИГ. 13 В). Следовательно, Т-клетки, экспрессирующие CAR против L1 по настоящему раскрытию, демонстрировали противораковую активность в раковых клетках-мишенях, высоко экспрессирующих антигены L1CAM, и, таким образом, могут преимущественно использоваться в качестве клеточного терапевтического средства для противоракового применения.
Пример 3: подтверждение Т-клеток, экспрессирующих ген CAR против L1CAM, in vivo
Для исследования противораковой активности in vivo Т-клеток, экспрессирующих ген CAR против L1CAM, использовали животные модели с индукцией рака. Раковые клетки SKOV3 (мишень, Т), смешанные с матригелем в соотношении 1:1, подкожно (п.к.) вводили в количестве 3×106 в правый бок мышей NOD/SCID (7-недельные, самки), не имеющих Т-клеток, В-клеток и клеток-природных киллеров (NK-клетки), для индукции посредством этого рака. L1-CAR-002 и L1-CAR-004, которые подтверждены как два типа Т-клеток, экспрессирующих CAR против L1CAM, имеющих эффективность in vitro, и контрольные Т-клетки вводили один раз в сутки, всего 3 раза каждой мыши NOD/SCID через 3 суток после введения раковых клеток. Т-клетки вводили через хвостовую вену (внутривенно, в.в.) в количестве 2×107 на дозу, и размер раковой опухоли измеряли вплоть до суток 25. Результаты подтвердили, что оба типа Т-клеток, экспрессирующих CAR против L1CAM, ингибировали скорость роста рака по сравнению с группой введения контрольных Т-клеток (ФИГ. 14). Посредством того факта, что L1-CAR-004 значительно ингибировали скорость роста рака по сравнению с L1-CAR-002, было подтверждено то, что эффективность L1-CAR-004 in vivo была лучше.
Пример 4: изготовление Т-клеток, экспрессирующих гены CAR против L1CAM с разными структурами спейсерного домена, и подтверждение их активности
4.1. Получение генов L1-H8-CAR с разными структурами спейсерного домена
4.1.1. Отбор антитела scFv против mL1CAM
Посредством анализа противораковой активности, проведенного в Примере 3, подтвердили, что ингибирующий скорость роста рака эффект L1-CAR-004 был наилучшим. Получали нуклеотидные последовательности полинуклеотидов, кодирующих вариабельные области тяжелой цепи и легкой цепи L1CAM-специфичного антитела L1-CAR-004 (ФИГ. 10В), и использовали для получения следующего гена. Далее pMT-L1-CAR-004 экспрессировали в виде pMT-L1-H8-CAR-001.
4.1.2. Получение гена L1-H8-CAR-002
4.1.2.1. Получение гена лидерной последовательности (LS) антитела 3E8 и антитела scFv против mL1CAM
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 9) и SEQ ID NO: 69 (Таблица 9). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нукпеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом scFv L1-H8, имеет 12-нуклеотидную последовательность hIgD, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD (Таблица 10). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.



4.1.2.2. Получение гена шарнира, СН3, ТМ, ICD, костимулирующего домена и CDζ
Плазмиду pMT-CAR-002 (ФИГ. 15), содержащую шарнир человеческого IgD и шарнир IgG1, СН3, ТМ CD28 и ICD, костимулирующий домен ОХ40 и CD3ζ-изо1 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 72 (Таблица 9) и SEQ ID NO: 73 (Таблица 9) перед применением. Праймер, связывающийся с 5' концом шарнира hIgD, имеет 12-нукпеотидную последовательность вариабельной области легкой цепи (VL) антитела scFv L1-H8, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность scFv L1-Н8-шарнир IgD-шарнир IgG1-CH3-TM CD28-ICD CD28-OX40-CD3ζ-iso1-Xho I (Таблица 10). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
4.1.2.3. Получение гена LS 3E8, scFv L1-H8, шарнира, СН3, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир IgD и scFv L1-H8-шарнир IgD-шарнир IgG1-CH3-TM CD28-ICD CD28-OX40-CDζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством способа ПЦР с перекрывающимися праймерами (ПП-ПЦР) с использованием праймеров SEQ ID NO: 70 (Таблица 9) и SEQ ID NO: 73 (Таблица 9) (ФИГ. 16). Данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-3E8-scFv L1-H8-шарнир IgD-шарнир IgG1-CH3-TM CD28-ICD CD28-OX40-CD3ζ-iso1-Xho I и имеет структуру L1-H8-CAR-002 (ФИГ. 17).
4.1.3. Получение гена L1-H8-CAR-003
4.1.3.1. Получение гена лидерной последовательности (LS) антитела 3E8 и антитела scFv против mL1CAM
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 9) и SEQ ID NO: 69 (Таблица 9). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом scFv L1-H8, имеет 12-нуклеотидную последовательность шарнира hIgD, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD (Таблица 10). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
4.1.3.2. Получение гена шарнира, СН3, ТМ, ICD, костимулирующего домена и CD3ζ
Плазмиду pMT-CAR-003 (ФИГ. 18), содержащую шарнир человеческого IgD и шарнир IgG1, ТМ и ICD CD28, костимулирующий домен ОХ40 и CD3ζ-iso1 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 72 (Таблица 9) и SEQ ID NO: 73 (Таблица 9) перед применением. Праймер, связывающийся с 5' концом шарнира hIgG, имеет 12-нуклеотидную последовательность вариабельной области легкой цепи (VL) антитела scFv L1-H8, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность scFv L1-Н8-шарнир IgD-шарнир IgG1-TM CD28-ICD CD28-OX40-CD3ζ-iso1-Xho I (Таблица 10). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
4.1.3.3. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир IgD и scFv L1-H8-шарнир IgD-шарнир IgG1-TM CH28-ICD CD28-OX40-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 9) и SEQ ID NO: 73 (Таблица 9) (ФИГ. 19). Данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-3E8-scFv L1-H8-шарнир IgD-шарнир IgG1-TM CH28-ICD CD28-OX40-CD3ζ-iso1-Xho I и имеет структуру L1-H8-CAR-003 (ФИГ. 20).
4.1.4. Получение гена L1-H8-CAR-004
4.1.4.1. Получение гена лидерной последовательности (LS) антитела 3E8 и антитела scFv против mL1CAM
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 9) и SEQ ID NO: 83 (Таблица 9). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом scFv L1-H8, имеет 12-нуклеотидную последовательность шарнира hIgG1, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-148-шарнир hIgG1 (Таблица 10). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
4.1.4.2. Получение гена шарнира, СН3, ТМ, ICD, костимулирующего домена и CD3ζ
Плазмиду pMT-CAR-002 (ФИГ. 15), содержащую шарнир IgG1, СН3, ТМ и ICD CD28, костимулирующий домен ОХ40 и CD3ζ-iso1 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 84 (Таблица 9) и SEQ ID NO: 73 (Таблица 9). Праймер, связывающийся с 5' концом шарнира hIgG1, имеет 12-нуклеотидную последовательность вариабельной области легкой цепи (VL) антитела scFv L1-H8, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность scFv L1-H8-шарнир IgG1-TM CD28-ICD CD28-OX40-CD3ζ-iso1-Xho I (Таблица 10). Данный амплифицированный ПЦР-продукт использовали в следующем процесса ПЦР-амплификации.
4.1.4.3. Получение гена LS 3E8, scFv L1-H8, шарнира, СН3, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир IgG1 и scFv L1-H8-шарнир IgG1-TM CH28-ICD CD28-OX40-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 9) и SEQ ID NO: 73 (Таблица 9) (ФИГ. 21). Данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-3E8-scFv L1-Н8-шарнир IgG1-TM CH28-ICD CD28-OX40-CD3ζ-iso1-Xho I и имеет структуру L1-H8-CAR-004 (ФИГ. 22).
4.1.5. Получение ретровирусных векторов pMT-L1-H8-CAR
Три типа амплифицированных ПЦР-продуктов обрабатывали рестрикционными ферментами Mlu I и Xho I с получением фрагментов ДНК. Полученные фрагменты ДНК лигировали в ретровирусные векторы рМТ (патент США №US 6451595), ранее обработанные рестрикционными ферментами Mlu I и Xho I, с получением трех типов ретровирусных векторов pMT-L1-H8-CAR (ФИГ. 23). Ретровирусные векторы pMT-L1-H8-CAR, полученные таким образом, включают последовательность, кодирующую CAR против L1 под контролем промотора MLV LTR.
4.2. Получение ретровирусов, экспрессирующих гены L1-H8-CAR с разными структурами спейсерного домена (ретровирусы с L1-H8-CAR)
Ретровирусы для доставки гена L1-H8-CAR получали с использованием трансформации плазмидной ДНК (Soneoka Yet al., 1995). Использовали систему трансформации TransIT 293 (Mirus Bio LLC, WI, США) и действовали согласно протоколу изготовителя. На предыдущие сутки четыре типа ретровирусных векторов pMT-L1-H8-CAR, экспрессионный вектор gag-pol и экспрессионный вектор RD114 env трансформировали в линии клеток 293Т, которые высевали в количестве 1×106 на 60 мм чашки, и затем данные клетки культивировали в течение примерно 48 часов. По завершении культивирования все культуры клеток отбирали и затем фильтровали через 0,45 мкм фильтр. Четыре типа ретровирусов с L1-H8-CAR, полученных таким образом, измеряли на титр посредством ПЦР в реальном времени с использованием набора для измерения титра ретровирусов (TaKaRa, ЯПОНИЯ) и затем хранили замороженными при -80°С до применения.
4.3. Получение Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами спейсерного домена
Одноядерные клетки получали из крови реципиента с использованием SepMate™-50 (STEMCELL) и FicolI-Paque PLUS (GE healthcare, Швеция). Одноядерные клетки распределяли в количестве 1×107 в 100 мм чашки, в то время как в качестве культуральной среды использовали среду AIMV (Invitrogen), содержащую 5% человеческой сыворотки, и затем добавляли антитело против CD3 (ОКТЗ, eBioscience) в количестве 50 нг на мл, посредством этого активируя Т-клетки. Для роста Т-клеток добавляли в культуральную среду человеческий IL-2 (R&D) в концентрации 300 U на мл и осуществляли культивирование. После 48-часовой инкубации активированные Т-клетки отбирали и использовали для доставки четырех типов ретровирусов с CAR против L1-H8.
Ретронектин (TaKaRa, Япония), полученный в концентрации 10 мкг/мл, добавляли в 6-луночные планшеты в объеме 2 мл на лунку, и затем покрывали им планшеты посредством инкубации при комнатной температуре в течение 2 часов. После инкубации ретронектин удаляли и затем добавляли фосфатно-солевой буферный раствор (PBS), содержащий 2,5% человеческого альбумина, в объеме 2 мл на лунку и блокировали посредством инкубации при комнатной температуре в течение 30 минут. После инкубации раствор, использованный для блокирования, удаляли, и осуществляли промывку добавлением HBSS, содержащего 2,5% 1 М HEPES в объеме 3 мл на лунку. Ретровирусы с L1-H8-CAR разводили до 3×1010 копий на лунку с использованием среды AIMV, содержащей 5% человеческой сыворотки, и добавляли 4 мл разведения, с последующим центрифугированием при условиях 2000 g и 32°С в течение 2 часов, посредством этого иммобилизуя ретровирусы на ретронектине. Такое же количество среды, использованной для разведения ретровируса, добавляли в лунки, подлежащие применению в качестве контроля. После культивирования ретровирусы удаляли, и активированные Т-клетки добавляли в количестве 2×106 на лунку, с последующей инкубацией при 1000 g в течение 15 минут, доставляя, посредством этого, ретровирусы с L1-H8-CAR в Т-клетки. Для увеличения эффективности доставки, процедуру доставки повторяли еще один раз на следующие сутки, и, таким образом, всего осуществляли доставку 2 раза. Через 24 часа после доставки все Т-клетки собирали и субкультивировали в Т-образных флаконах в концентрации 5×105 клеток на мл со средой AIMV, содержащей 300 U/мл 5% человеческой сыворотки и человеческого IL-2. Данные клетки субкультивировали в концентрации 5×105 на мл каждые 3-4 суток и поддерживали таким образом, чтобы не превышать 2×106 на мл.
Исследовали то, экспрессировался ли L1-H8-CAR в активированных Т-клетках (Т-клетки, экспрессирующие L1-H8-CAR), доставляющих ретровирусы с L1-H8-CAR. В первую и вторую недели культуры получали 1×106 клеток и инкубировали с белком L, конъюгированным с FITC (флуоресцеина изотиоцианат) (ACROBiosystems, кат. №RPL-PF141) при 4°С в течение 30 минут, и показатель экспрессии L1-H8-CAR проверяли посредством проточной цитометрии. Данные результаты подтвердили то, что хотя и имеется различие в зависимости от донора, показатель экспрессии L1-H8-CAR составлял примерно от 16,4% до 52,4% в сутки 8 инкубации и примерно от 29,6% до 69,2% в сутки 15 или сутки 18 инкубации (Таблица 11).
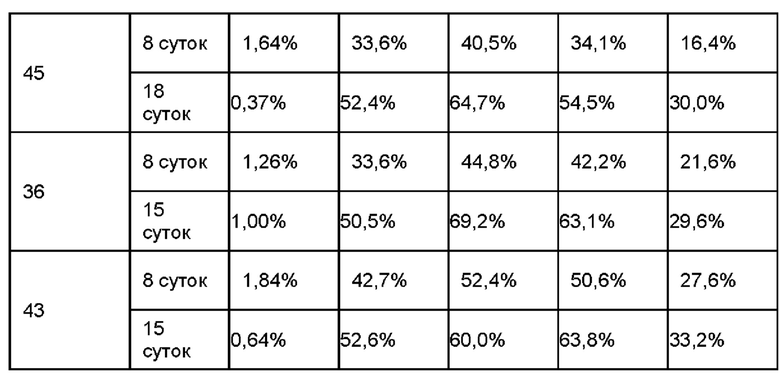
4.4. Подтверждение противораковой активности Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами спейсерного домена (in vitro)
4.4.1. Подтверждение показателей экспрессии L1CAM в клетках-мишенях
Известно, что линия клеток аденокарциномы яичника человека SKOV3
высоко экспрессирует L1CAM, и, таким образом, представляет собой подходящую линию клеток для исследования противораковой активности Т-клеток, экспрессирующих CAR против L1CAM. Для проверки этого линию клеток SKOV3 получали в концентрации 5×105 клеток в 100 мкл PBS, и добавляли 0,25 мкг антитела против hCD171-PE (клон 5G3) (eBioscience, кат. №12-1719-42) с последующей инкубацией при 4°С в течение 30 минут. После инкубации клетки дважды промывали PBS, и затем экспрессию L1CAM исследовали посредством проточной цитометрии. Результаты подтверждали, что показатель экспрессии L1CAM составлял примерно от 93,4 до 99,2% в раковых клетках SKOV3 (ФИГ. 24А-24С). В результате исследования экспрессии L1CAM в линии клеток рака шейки матки человека HeLa, линии клеток человеческой нейробластомы SH-SY5Y и линии клеток человеческой эмбриональной почки 293Т показатель экспрессии составлял примерно 99,9% в HeLa (ФИГ. 24F), примерно 89,6% в SH-SY5Y (ФИГ. 24А) и примерно от 0,57 до 0,61% в 293Т (ФИГ. 24D и 24Е).
4.4.2. Подтверждение противораковой активности Т-клеток, экспрессирующих L1CAM, на клетках-мишенях (in vitro)
4.4.2.1. Подтверждение противораковой активности с использованием анализа xCelligence
Для исследования противораковой активности Т-клеток, экспрессирующих CAR против L1CAM (L1-H8-CAR) (эффекторные клетки, Е), на клетках-мишенях (Т), использовали анализ клеток в реальном времени (RTCA) xCELLigence. Согласно способу RTCA xCELLigence поток электронов численно отображается как значение индекса при включении электропроводящего раствора (например, культуральной среды) на планшет, покрытый биосенсором на основе золотого микроэлектрода, и ток электронов нарушается, приводя к измененным значениям индекса при прилипании клеток-мишеней к планшету. При добавлении Т-клеток, экспрессирущих CAR, прилипающие клетки-мишени отделяются от планшета из-за цитотоксичности Т-клеток, и противораковую активность (цитотоксичность) можно проверять посредством анализа изменения в значении индекса. Клетки-мишени получали в концентрации 1×104 клеток в 50 мкл культуральной среды и добавляли на планшет для анализа. Примерно через 21 час Т-клетки, экспрессирующие CAR против L1-H8, готовили в количестве 1×104, 5×104 и 1×105 (отношение Е:Т равно 1, 5 и 10) в 50 мкл среды AIMV, содержащей человеческую сыворотку и человеческий IL-2, и добавляли в лунки, содержащие клетки-мишени, для проверки значения клеточного индекса в реальном времени в течение 30 часов. Кроме того, готовили лунки, содержащие только клетки-мишени, и противораковую активность Т-клеток, экспрессирующих CAR против L1-H8, рассчитывали следующим образом.
Уравнение
Цитотоксичность (%)={(значение индекса лунки клетки-мишени) - ((значение индекса инкубационной лунки клетки-мишени и Т-клетки)}/(значение индекса лунки клетки-мишени) ×100
В результате четыре типа Т-клеток, экспрессирующих L1-H8-CAR-001, -002, -003 и -004 демонстрировали высокую цитотоксичность на клетках SKOV3 по сравнению с Т-клетками, не экспрессирующими 1-H8-CAR (контроль) (ФИГ. 25).
Цитотоксичность на клетках 293Т проверяли таким же способом. Клетки-мишени в количестве 2,5×104 добавляли в 50 мкл культуральной среды, и примерно через 21 час Т-клетки, экспрессирующие L1-H8-CAR, готовили в количестве 2,5×104, 1,25×105 и 2,5×105 (отношение Е:Т равно 1, 5 и 10) в 50 мкл среды AIMV, содержащей человеческую сыворотку и человеческий IL-2, и добавляли в лунки, содержащие клетки-мишени, для проверки значения клеточного индекса в реальном времени в течение 30 часов. Кроме того, готовили лунки, содержащие только клетки-мишени, и противораковую активность Т-клеток, экспрессирующих L1-H8-CAR, рассчитывали таким же способом, что и в приведенных выше анализах. В результате все четыре типа продемонстрировали аналогичную цитотоксичность с контролем в клетках 293Т, демонстрирующих низкий показатель экспрессии L1CMA (ФИГ. 26).
4.4.2.2. Подтверждение противораковой активности с использованием красителя CellTox™ Green
Для исследования противораковой активности Т-клеток, экспрессирующих CAR против L1CAM (L1-H8-CAR) (эффекторные клетки, Е) на клетках-мишенях (Т) использовали краситель CellTox™ Green. Краситель CellTox™ Green представляет собой краситель, который присоединяется к ДНК, высвобожденной из мертвых клеток, демонстрируя флуоресценцию, и используется для исследования противораковой активности (цитотоксичности). Клетки-мишени готовили в количестве 1×104 в 50 мкл культуральной среды, добавляли 0,2 мкл красителя CellTox™ Green, и данную смесь добавляли в 96-луночные черные планшеты. Т-клетки, экспрессирующие L1-H8-CAR, готовили в количестве 5×103, 1×104, 5×104 и 1×105 (отношение Е:Т равно 0,5, 1, 5 и 10) в 50 мкл среды AIMV, содержащей человеческую сыворотку и человеческий IL-2, и добавляли в лунки, содержащие клетки-мишени, с последующей инкубацией в инкубаторе с CO2 при 37°С в течение 24 часов. Группу с добавлением только Т-клеток, экспрессирующих L1-H8-CAR, готовили в лунках, содержащих культуральную среду красителя CellTox™ Green и клетки-мишени, и исключали значение реакции красителя, появляющееся посредством присоединения к ДНК, высвобожденной из мертвых Т-клеток, экспрессирующих L1-H8-CAR, во время инкубации. Лунки, содержащие только клетки-мишени, готовили для корректировки низкого контрольного значения (спонтанное высвобождение ДНК), а лизисный раствор добавляли в лунку, содержащую только клетки-мишени, для корректировки высокого контрольного значения (максимальное высвобождение ДНК). Цитотоксичность на клетках-мишенях рассчитывали посредством следующего способа.
Уравнение 2
Цитотоксичность (%)={(значение реакции клеток-мишеней и эффекторных клеток) - (значение реакции эффекторных клеток)} - (Низкий контроль) / (Высокий контроль - Низкий контроль) ×100
В результате четыре типа Т-клеток, экспрессирующих L1-H8-CAR-001, -002, -003 и -004, демонстрировали высокую цитотоксичность на клетках SH-SY5Y по сравнению с Т-клетками, не экспресирующими 1-H8-CAR (контроль) (ФИГ. 27А и 27 В).
Цитотоксичность на клетках HeLa проверяли таким же способом анализа. Клетки-мишени готовили в количестве 3,5×103 в 50 мкл культуральной среды, добавляли 0,2 мкл красителя CellTox™ Green, и данную смесь добавляли в 96-луночные черные планшеты. Т-клетки, экспрессирующие L1-H8-CAR, готовили в количестве 1,75×103, 3,5×103, 1,75×104 и 3,5×104 (отношение Е:Т равно 0,5, 1, 5 и 10) в 50 мкл среды AIMV, содержащей человеческую сыворотку и человеческий IL-2, и добавляли в лунки, содержащие клетки-мишени, с последующей инкубацией в инкубаторе с CO2 при 37°С в течение 24 часов. Цитотоксичность на клетках-мишенях корректировали и рассчитывали посредством такого же способа. В результате четыре типа Т-клеток, экспрессирующих L1-H8-CAR-001, -002, -003 и -004, демонстрировали высокую цитотоксичность на клетках HeLa по сравнению с Т-клетками, не экспрессирующими 1-H8-CAR (контроль) (ФИГ. 28А и 28 В).
4.5. Подтверждение противораковой активности Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами спейсерного домена (in vitro)
Для исследования противораковой активности in vivo Т-клеток, экспрессирующих ген CAR против L1CAM (L1 CAM-CAR), использовали животные модели с индукцией рака. Раковые клетки SKOV3 (мишень, Т), смешанные с матригелем в соотношении 1:1, подкожно (п.к.) вводили в количестве 3×106 в правый бок мышей NOD/SCID (7-недельные, самки), не имеющих Т-клеток, В-клеток и клеток-природных киллеров (NK-клетки), для индукции посредством этого рака. Четыре типа Т-клеток, экспрессирующих L1-H8-CAR, подтвердили наличие эффективности in vitro, и контрольные Т-клетки вводили каждой мыши NOD/SCID через 3 суток и 5 суток после введения раковых клеток один раз в сутки, всего 2 раза. Т-клетки вводили через хвостовую вену (внутривенно, в.в.) в количестве 2×107 на дозу, и размер раковой опухоли измеряли вплоть до суток 25. Результаты подтвердили то, что оба типа Т-клеток, экспрессирующих CAR против L1CAM, ингибировали скорость роста рака по сравнению с группой введения контрольных Т-клеток. В особенности подтвердили то, что наилучшим был ингибирующий эффект L1-H8-CAR-003 на рост раковой опухоли (ФИГ. 29).
Пример 5: изготовление Т-клеток, экспрессирующих CAR против L1CAM с разными структурами костимулирующего домена, и подтверждение их активности
5.1. Получение генов L1CMA-CAR с разными структурами костимулирующего домена
5.1.1. Получение гена L1-H8-CAR-001-28BB
5.1.1.1. Получение гена лидерной последовательности (LS) антитела 3E8, scFv L1-H8, шарнира, ТМ и ICD
pMT-L1-H8-CAR-001 в качестве матрицы амплифицировали посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 87 (Таблица 12). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом ICD CD28, имеет 12-нуклеотидную последовательность 4-1 ВВ, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-4-1BB (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.




5.1.1.2. Получение гена костимулирующего домена и CD3ζ
Плазмиду pMT-CAR-004 (ФИГ. 30), содержащую костимулирующий домен 4-1ВВ и CD3ζ-iso1, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 88 (Таблица 12) и SEQ ID NO: 73 (Таблица 12). Праймер, связывающийся с 5' концом 4-1 ВВ, имеет 12-нуклеотидную последовательность ICD CD28, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ICD-4-1 BB-CD3ζ-iso1-Xho I (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.1.3. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-Н8-шарнир hIgD-TM CD28-ICD CD28-4-1ВВ и ICD CD28-4-1 BB-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 73 (Таблица 12) (ФИГ. 31). Данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-4-1BB-CD3ζ-iso1-Xho I и имеет структуру L1-H8-CAR-001-28BB (ФИГ. 32).
5.1.2. Получение гена L1-H8-CAR-001-28ICOS
5.1.2.1. Получение гена лидерной последовательности (LS) антитела 3E8, scFv L1-H8, шарнира, ТМ и ICD
pMT-L1-H8-CAR-001 в качестве матрицы амплифицировали посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 89 (Таблица 12). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом ICD CD28, имеет 12-нуклеотидную последовательность ICOS, и, таким образом, данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-ICD ICOS (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.2.2. Получение гена костимулирующего домена ICOS
Синтезировали структуры ТМ и ICD гена костимулирующего домена ICOS. pBHA-ICOS TM+ICD (ФИГ. 33), обеспеченную посредством синтеза гена, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 90 (Таблица 12) и SEQ ID NO: 91 (Таблица 12). Праймер, связывающийся с 5' концом ICD ICOS, имеет 12-нуклеотидную последовательность ICD CD28, и праймер, связывающийся с 3' концом ICD ICOS, имеет нуклеотидную последовательность CD3ζ-iso1, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ICD CD28-ICD ICOS-CD3ζ-iso1 (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.2.3. Получение гена CD3ζ
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 92 (Таблица 12) и SEQ ID NO: 73 (Таблица 12). Праймер, связывающийся с 5' концом CD3ζ-iso1, имеет 12-нуклеотидную последовательность ICD ICOS, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ICD ICOS-CD3ζ-iso1-Xho I (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.2.4. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, ICD и костимулирующего домена
Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-ICD ICOS и ICD CD28-ICD ICOS-CD3ζ-iso1, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 91 (Таблица 12) (ФИГ. 34). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-ICD ICOS-CD3ζ-iso1 (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.2.5. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-ICD ICOS-CD3ζ-isol и ICD ICOS-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 73 (Таблица 12) (ФИГ. 34). Данный амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-ICD ICOS-CD3ζ-iso1-Xho I и имеет структуру L1-H8-CAR-001-28ICOS (ФИГ. 35).
5.1.3. Получение гена L1-H8-CAR-001-28
5.1.3.1. Получение гена лидерной последовательности (LS) антитела 3E8, scFv L1-H8, шарнира, ТМ и ICD
pMT-L1-H8-CAR-001 в качестве матрицы амплифицировали посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 93 (Таблица 12). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом ICD CD28, имеет 12-нуклеотидную последовательность CD3ζ-iso1, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-CD3ζ-iso1 (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.3.2. Получение гена CD3ζ
pMT-L1-H8-CAR-001 в качестве матрицы амплифицировали посредством ПЦР с использованием праймеров SEQ ID NO: 94 (Таблица 12) и SEQ ID NO: 73 (Таблица 12). Праймер, связывающийся с 5' концом CD3ζ-iso1, имеет 12-нуклеотидную последовательность ICD CD28, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ICD ICD28-CD3ζ-iso1-Xho I (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.3.3. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-CD3ζ-iso1 и ICD CD28-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 73 (Таблица 12) (ФИГ. 36). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD CD28-CD3ζ-iso1-Xho I и структуру L1-H8-CAR-001-28 (ФИГ. 37).
5.1.4. Получение гена L1-H8-CAR-001-OX
5.1.4.1. Получение гена лидерной последовательности (LS) антитела 3E8, scFv L1-H8, шарнира и ТМ
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 95 (Таблица 12). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом ТМ CD28, имеет 12-нуклеотидную последовательность ОХ40, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-OX40 (Таблица 13). Данный амплифицированный продукт использовали в следующем процессе ПЦР-амплификации.
5.1.4.2. Получение гена костимулирующего домена и CD3ζ
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 96 (Таблица 12) и SEQ ID NO: 73 (Таблица 12). Праймер, связывающийся с 5' концом ОХ40, имеет 12-нуклеотидную последовательность ТМ CD28, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ТМ CD28-OX40-CD3ζ-iso1-Xho I (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.4.3. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-OX40 и ТМ CD28-OX40-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 73 (Таблица 12) (ФИГ. 38). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-OX40-CD3ζ-iso1-Xho I и структуру L1-H8-САР-001-ОХ(ФИГ. 39).
5.1.5. Получение гена L1-H8-CAR-001-BB
5.1.5.1. Получение гена лидерной последовательности (LS) антитела 3E8, scFv L1-H8, шарнира и ТМ
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 97 (Таблица 12). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом ТМ CD28, имеет 12-нуклеотидную последовательность 4-1 ВВ, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-4-1BB (Таблица 13). Данный амплифицированный продукт использовали в следующем процессе ПЦР-амплификации.
5.1.5.2. Получение гена костимулирующего домена и CD3ζ
pMT-L1-H8-CAR-004 (ФИГ. 30) амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 98 (Таблица 12) и SEQ ID NO: 73 (Таблица 12). Праймер, связывающийся с 5' концом 4-1 ВВ, имеет 12-нуклеотидную последовательность ТМ CD28, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ТМ CD28-4-1BB-CD3ζ-iso1-Xho I (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.5.3. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-4-1BB и ТМ CD28-4-1BB-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали, в качестве матриц, посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 73 (Таблица 12) (ФИГ. 40). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-4-1 BB-CD3ζ-iso1-Xho I и структуру L1-H8-CAR-001-BB (ФИГ. 41).
5.1.6. Получение гена L1-H8-CAR-001-ICOS
5.1.6.1. Получение гена лидерной последовательности (LS) антитела 3E8, scFv L1-H8, шарнира и ТМ
pMT-L1-H8-CAR-001 в качестве матрицы амплифицировали посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 99 (Таблица 12). Праймер, связывающийся с 5' концом лидерной последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом ТМ CD28, имеет 13-нуклеотидную последовательность ICD ICOS, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD ICOS (Таблица 13). Данный амплифицированный продукт использовали в следующем процессе ПЦР-амплификации.
5.1.6.2. Получение гена костимулирующего домена ICOS
pBHA-ICOS TM+ICD (ФИГ. 33) амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 100 (Таблица 12) и SEQ ID NO: 91 (Таблица 12). Праймер, связывающийся с 5' концом ICD ICOS, имеет 12-нуклеотидную последовательность ТМ CD28, и праймер, связывающийся с 3' концом ICD ICOS, имеет нуклеотидную последовательность CD3ζ-iso1, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ТМ CD28-ICD ICOS-CD3ζ-iso1 (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.6.3. Получение гена CD3ζ
pMT-L1-H8-CAR-001 амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 92 (Таблица 12) и SEQ ID NO: 73 (Таблица 12). Праймер, связывающийся с 5' концом CD3ζ-iso1, имеет 12-нуклеотидную последовательность ICD ICOS, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность ICD ICOS-CD3ζ-iso1-Xho I (Таблица 13). Данный амплифицированный продукт использовали в следующем процессе ПЦР-амплификации.
5.1.6.4. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ и костимулирующего домена
Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD ICOS и ТМ CD28-ICD ICOS-CD3ζ-iso1, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 91 (Таблица 12) (ФИГ. 42). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD ICOS-CD3ζ-iso1 (Таблица 13). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
5.1.6.5. Получение гена LS 3E8, scFv L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD ICOS-CD3ζ-iso1 и ICD ICOS-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 12) и SEQ ID NO: 73 (Таблица 12) (ФИГ. 42). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv L1-H8-шарнир hIgD-TM CD28-ICD ICOS-CD3ζ-iso1-Xho I и структуру L1-H8-CAR-001-ICOS (ФИГ. 43).
5.1.7. Получение ретровирусных векторов pMT-L1-H8-CAR
Шесть типов амплифицированных ПЦР-продуктов обрабатывали рестрикционными ферментами Mlu I и Xho I с получением фрагментов ДНК. Полученные фрагменты ДНК лигировали в ретровирусные векторы рМТ (патент США №US 6451595), ранее обработанные рестрикционными ферментами Mlu I и Xho I, с получением шести типов ретровирусных векторов pMT-L1-H8-CAR (ФИГ. 44). Ретровирусные векторы pMT-L1-H8-CAR, полученные таким образом, включают последовательности, кодирующие L1-H8-CAR под контролем промотора MLV LTR.
5.2. Получение ретровирусов, экспрессирующих гены L1-H8-CAR с разными структурами костимулирующего домена
Семь типов ретровирусов, экспрессирующих L1-H8-CAR-001 и L1-H8-CAR-001-28ВВ, -28ICOS, -28, -ОХ, -ВВ и -ICOS, получали таким же способом, как и в Примере 4.2.
5.3. Получение Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами костимулирующего домена
Семь типов L1-H8-CAR-T получали таким же способом, как и в Примере 4.3. Данные результаты подтвердили, что хотя и имеется различие в зависимости от донора, показатель экспрессии L1-H8-CAR составлял примерно от 7,7% до 88,4% в сутки 7 или сутки 8 инкубации, примерно от 9,0% до 82,4% в сутки 11 инкубации и примерно от 6,7% до 89,8% в сутки 15 или сутки 17 инкубации (Таблица 14).
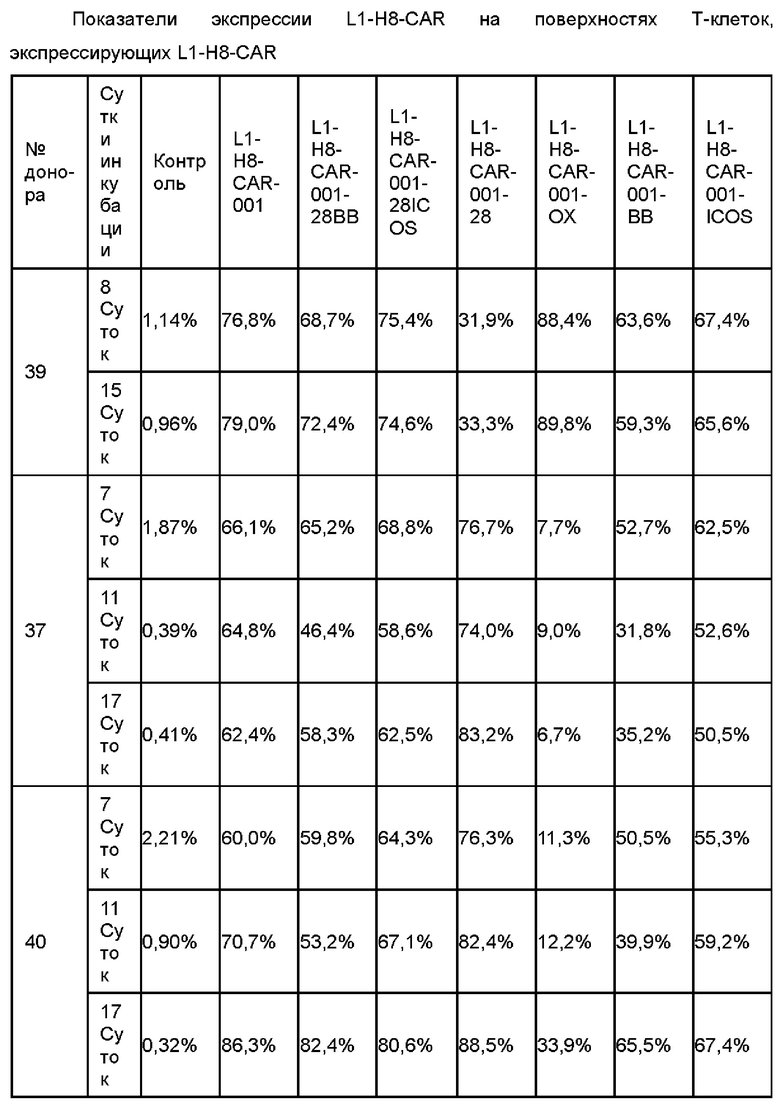
5.4. Подтверждение противораковой активности Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами спейсерного домена (in vitro)
5.4.1. Подтверждение показателей экспрессии L1CAM в клетках-мишенях
Показатель экспрессии L1CAM в клетках-мишенях исследовали таким же способом, как и в Примере 4.4.1. Результаты подтверждали, что показатель экспрессии L1CAM составлял примерно от 80,4 до 98,5% в раковых клетках SKOV3 (ФИГ. 45А-45С). В результате исследования экспрессии L1CAM в линии клеток рака шейки матки человека HeLa, линии клеток человеческой нейробластомы SH-SY5Y и линии клеток человеческой эмбриональной почки 293Т посредством того же самого способа показатель экспрессии составлял примерно от 99,6% до 99,9% в HeLa (ФИГ. 45F и 45G), примерно от 52,1 до 98,1% в SH-SY5Y (ФИГ. 45Н и 45I) и примерно от 0,023 до 4,72% в 293Т (ФИГ. 45D и 45Е).
5.4.2. Подтверждение противораковой активности Т-клеток, экспрессирующих L1CAM, на клетках-мишенях (in vitro)
5.4.2.1. Подтверждение противораковой активности с использованием анализа xCelligence
Активность семи типов L1-H8-CAR на SKOV3 исследовали таким же способом, что и в Примере 4.4.2.1. В результате семь типов Т-клеток, экспрессирующих L1-H8-CAR-001 и L1-H8-CAR-001-28BB, -28ICOS, -28, -ОХ, -ВВ и -ICOS демонстрировали высокую цитотоксичность на клетках SKOV3 по сравнению сТ-клетками, не экспрессирующими L1-H8-CAR (контроль) (ФИГ. 46).
Цитотоксичность на клетках 293Т исследовали таким же способом, что и в Примере 4.4.2.1. В результате все семь типов продемонстрировали аналогичную цитотоксичность с контролем в клетках 293Т, демонстрирующих низкий показатель экспрессии L1CMA (ФИГ. 47).
5.4.2.2. Подтверждение противораковой активности с использованием красителя CellTox™ Green
Цитотоксичность на клетках SH-SY5Y исследовали таким же способом, что и в Примере 4.4.2.2. В результате семь типов Т-клеток, экспрессирующих L1-H8-CAR-001 и L1-H8-CAR-001-28BB, -28ICOS, -28, -ОХ, -ВВ и -ICOS, демонстрировали высокую цитотоксичность на клетках SH-SY5Y по сравнению с Т-клетками, не экспресирующими L1-H8-CAR (контроль) (ФИГ. 48А-48С).
Цитотоксичность на клетках HeLa исследовали таким же способом, что и в Примере 4.4.2.2. В результате семь типов Т-клеток, экспрессирующих L1-H8-CAR-001 и L1-H8-CAR-001-28BB, -28ICOS, -28, -ОХ, -ВВ и -ICOS, демонстрировали высокую цитотоксичность на клетках HeLa по сравнению с Т-клетками, не экспрессирующими L1-H8-CAR (контроль) (ФИГ. 49А-49С).
5.5. Подтверждение противораковой активности Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами спейсерного домена (in vivo)
Для исследования противораковой активности in vivo Т-клеток, экспрессирующих ген CAR против L1CAM (L1-H8-CAR), использовали животные модели с индукцией рака. Раковые клетки SKOV3 (мишень, Т), смешанные с матригелем в соотношении 1:1, подкожно (п.к.) вводили в количестве 3×106 в правый бок мышей NOD/SCID (7-недельные, самки), не имеющих Т-клеток, В-клеток и клеток-природных киллеров (NK-клетки), для индукции посредством этого рака. Семь типов Т-клеток, экспрессирующих L1-H8-CAR, для которых было подтверждено наличие эффективности in vitro, и контрольные Т-клетки вводили один раз в сутки, всего 2 раза каждой мыши NOD/SCID через 3 суток и 5 суток после введения раковых клеток. Т-клетки вводили через хвостовую вену (внутривенно, в.в.) в количестве 2×107 на дозу, и размер раковой опухоли измеряли вплоть до суток 25. Результаты подтвердили то, что все семь типов Т-клеток, экспрессирующих CAR против L1CAM, ингибировали скорость роста рака по сравнению с группой введения контрольных Т-клеток. В особенности, было подтверждено то, что эффект ингибирования роста рака L1-H8-CAR-001-28ICOS был наилучшим (ФИГ. 50).
Пример 6: изготовление Т-клеток, экспрессирующих CAR против L1CAM с разными структурами, и подтверждение их активности
6.1. Получение генов L1CMA-CAR с разными структурами
6.1.1. Получение гена L1-H8-CAR-005
6.1.1.1. Получение лидерной последовательности (LS) антитела 3E8 и гена scFv-обратный L1-H8
Синтезировали структуру LS 3E8, вариабельной области легкой цепи (VL) антитела scFv L1-H8, линкера и вариабельной области тяжелой цепи (VH) антитела scFv L1-H8. pBHA-3E8-H8Rev (ФИГ. 51), полученную посредством синтеза гена, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 15) и SEQ ID NO: 103 (Таблица 15). Праймер, связывающийся с 5' концом лидерой последовательности (LS) 3E8, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) 3E8, и праймер, связывающийся с 3' концом scFv-обратный L1-H8, имеет 12-нукпеотидную последовательность шарнира hIgD, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS 3E8-scFv-Rev L1-Н8-шарнир IgD (Таблица 16). Данный амплифицированный продукт использовали в следующем процессе ПЦР-амплификации.


6.1.1.2. Получение гена шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Плазмиду pMT-L1-H8-CAR-003 (ФИГ. 23), содержащую шарнир человеческого IgD и шарнир IgG1, ТМ CD28 и ICD, костимулирующий домен ОХ40 и CD3ζ-iso1, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 104 (Таблица 15) и SEQ ID NO: 73 (Таблица 15) перед применением. Праймер, связывающийся с 5' концом шарнира hIgD, имеет 12-нуклеотидную последовательность вариабельной области тяжелой цепи (VH) антитела scFv L1-H8, и праймер, связывающийся с 3' концом CD3ζ-iso1, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность scFv-Rev L1-Н8-шарнир IgD-шарнир IgG1-TM CD28-ICD CD28-OX40-CD3ζ-iso1-Xho I (Таблица 16). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
6.1.1.3. Получение гена LS 3E8, scFv-Rev L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS 3E8-scFv-Rev L1-H8-шарнир IgD и scFv-Rev L1-H8-шарнир IgD-шарнир IgG1-TM CD28-ICD CD28-OX40-CD3ζ-iso1-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 70 (Таблица 15) и SEQ ID NO: 73 (Таблица 15) (ФИГ. 52). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-3E8-scFv-Rev L1-H8-шарнир IgD-шарнир IgG1-TM CD28-ICD CD28-OX40-CD3ζ-iso1-Xho I и имеет структуру L1-H8-CAR-005 (ФИГ. 53).
6.1.2. Получение гена L1-H8-CAR-006
6.1.2.1. Получение гена лидерной последовательности (LS) CD8 альфа Плазмиду pMT-CAR-005 (ФИГ. 54), содержащую LS CD8 альфа, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 105 (Таблица 15) и SEQ ID NO: 106 (Таблица 15). Праймер, связывающийся с 5' концом лидерной последовательности (LS) CD8 альфа, имеет нуклеотидную последовательность рестрикционного фермента Mlu I и 18-нуклеотидную последовательность лидерной последовательности (LS) CD8 альфа, и праймер, связывающийся с 3' концом лидерной последовательности (LS) CD8 альфа, имеет 12-нуклеотидную последовательность вариабельной области тяжелой цепи (VH) антитела scFv L1-H8, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS hCD8α-scFv L1-H8 (Таблица 17). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.


6.1.2.2. Получение гена scFvL1-H8
Плазмиду pMT-L1-H8-CAR-001 (ФИГ. 23), содержащую scFv L1-H8, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 107 (Таблица 15) и SEQ ID NO: 108 (Таблица 15) перед применением. Праймер, связывающийся с 5' концом scFv L1-H8, имеет 12-нуклеотидную последовательность LS CD8 альфа, и праймер, связывающийся с 3' концом scFv L1-H8, имеет 12-нуклеотидную последовательность шарнира hCD8 альфа, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность LS hCD8α-scFv L1-Н8-шарнир hCD8α (Таблица 17). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
6.1.2.3. Получение гена шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Плазмиду pMT-CAR-005 (ФИГ. 54), содержащую шарнир человеческого CD8 альфа, ТМ, костимулирующий домен 4-1ВВ и CD3ζ-iso2M, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 109 (Таблица 15) и SEQ ID NO: 110 (Таблица 5) перед применением. Праймер, связывающийся с 5' концом шарнира hCD8α, имеет 12-нуклеотидную последовательность вариабельной области легкой цепи (VL) антитела scFv L1-H8, и праймер, связывающийся с 3' концом CD3ζ-iso2, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность scFv L1-Н8-шарнир hCD8α-TM hCD8α-4-1BB-CD3ζ-iso2M-Xho I (Таблица 17). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
6.1.2.4. Получение гена LS CD8α и scFv L1-H8
Mlu I-LS hCD8α-scFv L1-H8 и LS hCD8α-scFv L1-H8-шарнир hCD8α, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 105 (Таблица 15) и SEQ ID NO: 108 (Таблица 15) (ФИГ. 55). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS hCD8α-scFv L1-H8-шарнир CD28. Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
6.1.2.5. Получение гена LS CD8α , scFv L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Mlu I-LS hCD8α-scFv L1-H8-шарнир hCD8α и scFv L1-H8-шарнир hCD8α-TM hCD8α-4-1BB-CD3ζ-iso2M-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 105 (Таблица 15) и SEQ ID NO: 110 (Таблица 15) (ФИГ. 55). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-LS hCD8α-scFv L1-H8-шарнир hCD8α-TM hCD8α-4-1BB-CD3ζ-iso2M-Xho I и имеет структуру L1-H8-CAR-006 (ФИГ. 56).
6.1.3. Получение гена L1-H8-CAR-007
6.1.3.1. Получение гена сигнальной последовательности альфа-цепи рецептора hGM-CSF
Плазмиду pMT-CAR-006 (ФИГ. 57), содержащую сигнальную последовательность рец. α hGM-CSF, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 111 (Таблица 15) и SEQ ID NO: 112 (Таблица 5). Праймер, связывающийся с 5' концом рец. α hGM-CSF, имеет нуклеотидную последовательность рестрикционного фермента Mlu I, и праймер, связывающийся с 3' концом рец. α hGM-CSF, имеет 12-нуклеотидную последовательность вариабельной области тяжелой цепи (VH) scFv L1-H8, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-рец. α hGM-CSF-scFv L1-H8 (Таблица 18). Данный амплифицированный продукт использовали в следующем процессе ПЦР-амплификации.

6.1.3.2. Получение гена scFv L1-H8
Плазмиду pMT-L1-H8-CAR-001 (ФИГ. 23), содержащую scFv L1-H8, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 113 (Таблица 15) и SEQ ID NO: 114 (Таблица 15) перед применением. Праймер, связывающийся с 5' концом scFv L1-H8, имеет 12-нуклеотидную последовательность LS рец. α hGM-CSF, и праймер, связывающийся с 3' концом scFv L1-H8, имеет 9-нуклеотидную последовательность шарнира и 3-нуклеотидную последовательность pECD hCD28, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность LS рец. α hGM-CSF-scFv L1-Н8-шарнир-рЕСО hCD28 (Таблица 18). Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
6.1.3.3. Получение гена шарнира, ТМ, ICD, костимулирующего домена и CD3ζ
Плазмиду pMT-CAR-006 (ФИГ. 57), содержащую шарнир, pECD hCD28, ТМ, ICD и hCD3ζ-iso2, амплифицировали в качестве матрицы посредством ПЦР с использованием праймеров SEQ ID NO: 115 (Таблица 13) и SEQ ID NO: 116 (Таблица 13). Праймер, связывающийся с 5' концом шарнира, имеет 12-нуклеотидную последовательность вариабельной области легкой цепи (VL) scFv L1-H8, и праймер, связывающийся с 3' концом CD3ζ-iso2, имеет нуклеотидную последовательность рестрикционного фермента Xho I, и, таким образом, амплифицированный ПЦР-продукт имеет нуклеотидную последовательность scFv L1-Н8-шарнир-рЕСО hCD28-TM hCD28-ICD hCD28-CD3ζ-iso2-Xho I (Таблица 16). Данный амплифицированный продукт использовали в следующем процессе ПЦР-амплификации.
6.1.3.4. Получение гена сигнальной последовательности альфа-цепи рецептора hGM-CSF и scFv L1-H8
Mlu I-рец. α hGM-CSF-scFv L1-H8 и LS рец. α hGM-CSF-scFv L1-Н8-шарнир-pECD hCD28, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 111 (Таблица 15) и SEQ ID NO: 114 (Таблица 15) (ФИГ. 58). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-рец. α hGM-CSF-scFv L1-Н8-шарнир-рЕСО hCD28. Данный амплифицированный ПЦР-продукт использовали в следующем процессе ПЦР-амплификации.
6.1.3.5. Получение гена сигнальной последовательности альфа-цепи рецептора hGM-CSF, scFv L1-H8, шарнира, ТМ, ICD, костимулирующего домена и CD3C
Mlu I-рец. α hGM-CSF-scFv L1-Н8-шарнир-рЕСО hCD28 и scFv L1-H8-шарнир-pECD hCD28-TM hCD28-ICD hCD28-CD3ζ-iso2-Xho I, которые представляли собой амплифицированные ПЦР-продукты, амплифицировали в качестве матриц посредством ПП-ПЦР с использованием праймеров SEQ ID NO: 111 (Таблица 15) и SEQ ID NO: 116 (Таблица 15) (ФИГ. 58). Амплифицированный ПЦР-продукт имеет нуклеотидную последовательность Mlu I-рец. α hGM-CSF-scFv L1-Н8-шарнир-рЕСО hCD28-TM hCD28-ICD hCD28-CD3ζ-iso2-Xho I и структуру L1-H8-CAR-007 (ФИГ. 59).
6.1.4. Получение ретровирусных векторов pMT-L1-H8-CAR
Три типа амплифицированных ПЦР-продуктов обрабатывали рестрикционными ферментами Mlu I и Xho I с получением фрагментов ДНК. Полученные фрагменты ДНК лигировали в ретровирусные векторы рМТ (патент США №US 6451595), ранее обработанные рестрикционными ферментами Mlu I и Xho I, с получением трех типов ретровирусных векторов pMT-L1-H8-CAR (ФИГ. 60). Ретровирусные векторы pMT-L1-H8-CAR, полученные таким образом, включают последовательность, кодирующую L1-H8-CAR под контролем промотора MLV LTR.
6.2. Получение ретровирусов, экспрессирующих гены L1-H8-CAR с разными структурами (ретровирусы с L1-H8-CAR)
Четыре типа ретровирусов, экспрессирующих гены L1-H8-CAR-003, -005, -006 и -007, получали таким же способом, как и в Примере 4.2.
6.3. Получение Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами
Четыре типа L1-H8-CAR-T получали таким же способом, как и в Примере 4.3. Данные результаты подтвердили, что хотя и имеется различие в зависимости от донора, показатель экспрессии L1-H8-CAR составлял примерно от 22,1% до 74,1% в сутки 8 инкубации, примерно от 27,1% до 77,1% в сутки 11 инкубации, примерно от 24,6% до 76,6% в сутки 14 инкубации и примерно от 29,8% до 81,9% в сутки 16 инкубации (Таблица 19).
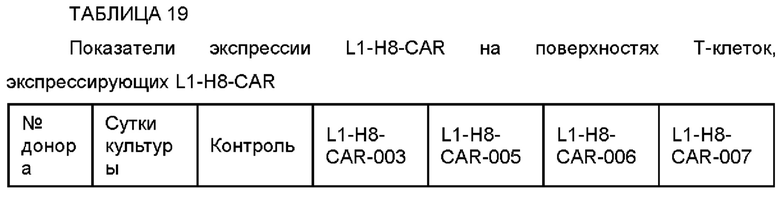
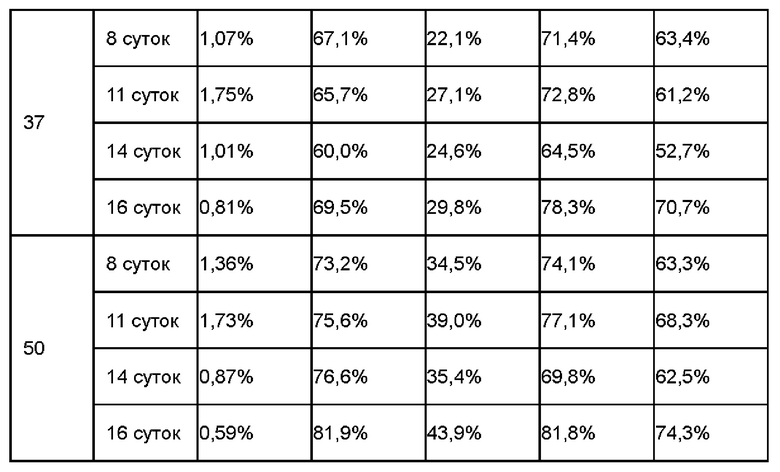
6.4. Подтверждение противораковой активности Т-клеток, экспрессирующих гены L1-H8-CAR с разными структурами (in vitro)
6.4.1. Подтверждение показателей экспрессии L1CAM в клетках-мишенях
Показатель экспрессии L1CAM в клетках-мишенях исследовали таким же способом, как и в Примере 4.4.1. Результаты подтверждали, что показатель экспрессии L1CAM составлял примерно от 67,1% до 87,0% в раковых клетках SKOV3. В результате исследования экспрессии L1CAM в линии клеток рака шейки матки человека HeLa, линии клеток человеческой нейробластомы SH-SY5Y и линии клеток человеческой эмбриональной почки 293Т показатель экспрессии составлял примерно 98,4% в HeLa, примерно от 65,0 до 70,9% в SH-SY5Y и примерно 0,082% в 293Т (ФИГ. 61A-61F).
6.4.2. Подтверждение противораковой активности Т-клеток, экспрессирующих L1CAM, на клетках-мишенях (in vitro)
6.4.2.1. Подтверждение противораковой активности с использованием анализа xCelligence
Способность четырех типов L1-H8-CAR на SKOV3 исследовали таким же способом, как и в Примере 4.4.2.1. В результате четыре типа Т-клеток, экспрессирующих L1-H8-CAR-003 и L1-H8-CAR-005, -006 и -007 демонстрировали высокую цитотоксичность на клетках SKOV3 по сравнению с Т-клетками, не экспрессирующими L1-H8-CAR (контроль) (ФИГ. 62).
Цитотоксичность на клетках SH-SY5Y исследовали таким же способом, как и в Примере 4.4.2.1. Клетки-мишени добавляли в 50 мкл культуральной среды в количестве 1,0×105, и примерно через 21 час Т-клетки, экспрессирующие L1-H8-CAR, готовили в количестве 5,0×104, 1,0×105 и 5,0×105 (отношение Е:Т равно 0,5, 1, и 5) в 50 мкл среды AIMV, содержащей человеческую сыворотку и человеческий IL-2, и добавляли в лунки, содержащие клетки-мишени, с проверкой значения клеточного индекса в реальном времени в течение 30 часов. Кроме того, готовили лунки, содержащие только клетки-мишени, и противораковую активность Т-клеток, экспрессирующих L1-H8-CAR, рассчитывали таким же способом, что и в приведенных выше анализах. В результате четыре типа Т-клеток, экспрессирующих L1-H8-CAR-003 и L1-H8-CAR-005, -006 и -007, демонстрировали высокую цитотоксичность на клетках SH-SY5Y по сравнению с Т-клетками, не экспрессирующими L1-H8-CAR (контроль) (ФИГ. 63).
6.4.2.2. Подтверждение противораковой активности с использованием красителя CellTox™ Green
Активность четырех типов L1-H8-CAR на клетках HeLa исследовали таким же способом, что и в Примере 4.4.2.2. В результате четыре типа Т-клеток, экспрессирующих L1-H8-CAR-003 и L1-H8-CAR-005, -006 и -007, демонстрировали высокую цитотоксичность на клетках HeLa по сравнению с Т-клетками, не экспресирующими L1-H8-CAR (контроль) (ФИГ. 64).
Цитотоксичность на раковых клетках 293Т исследовали таким же способом, как и в Примере 4.4.2.2. Клетки-мишени готовили в количестве 1,0×104 в 50 мкл культуральной среды, добавляли 0,2 мкл красителя CellTox™ Green, и данную смесь добавляли в 96-луночные черные планшеты. Т-клетки, экспрессирующие L1-H8-CAR, готовили в количестве 5,0×103, 1,0×104, 5,0×104 и 1,0×105 (отношение Е:Т равно 0,5, 1, 5 и 10) в 50 мкл среды AIMV, содержащей человеческую сыворотку и человеческий IL-2, и добавляли в лунки, содержащие клетки-мишени, с последующей инкубацией в инкубаторе с CO2 при 37°С в течение 24 часов. Цитотоксичность на клетках-мишенях корректировали и рассчитывали посредством такого же способа.
В результате все четыре типа демонстрировали аналогичную или меньшую цитотоксичность, чем цитотоксичность контроля в клетках 293Т, демонстрирующих низкий показатель экспрессии L1CMA (ФИГ. 65).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> CARTEXELL INC.
<120> АНТИТЕЛО ПРОТИВ МОЛЕКУЛЫ КЛЕТОЧНОЙ АДГЕЗИИ L1 ИЛИ ЕГО
АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И СОДЕРЖАЩИЙ ЕГО ХИМЕРНЫЙ РЕЦЕПТОР АНТИГЕНА
<130> PP190039
<150> KR 10-2018-0125538
<151> 2018-10-19
<160> 130
<170> KoPatentIn 3.0
<210> 1
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> Определяющая комплементарность область 1 тяжелой цепи (CDRH1)
mL1CAM-3R-H8
<400> 1
Asp Tyr Ala Met Asn
1 5
<210> 2
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 mL1CAM-3R-C9
<400> 2
Ser Tyr Ala Met His
1 5
<210> 3
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 mL1CAM-3R-E1, mL1CAM-3R-F1 и mL1CAM-2R-F8
<400> 3
Ser Tyr Ala Met Ser
1 5
<210> 4
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 mL1CAM-3R-F6
<400> 4
Ser Tyr Ala Met His
1 5
<210> 5
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 mL1CAM-3R-G6
<400> 5
Asn Tyr Ala Met His
1 5
<210> 6
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 mL1CAM-3R-A2
<400> 6
Ser Tyr Ala Met Asn
1 5
<210> 7
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH1 mL1CAM-3R-E9
<400> 7
Asp Tyr Ala Met His
1 5
<210> 8
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 mL1CAM-3R-H8
<400> 8
Ala Ile Ser Ser Thr Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 9
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 mL1CAM-3R-C9, mL1CAM-3R-F1 и mL1CAM-3R-E9
<400> 9
Ala Ile Ser Ser Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 10
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 mL1CAM-3R-E1
<400> 10
Ala Ile Ser Ser Ser Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 11
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 mL1CAM-3R-F6
<400> 11
Ala Ile Ser Ser Ser Gly Ser Ser Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 12
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 mL1CAM-3R-G6
<400> 12
Ala Ile Tyr Gln Ser Gly Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 13
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 mL1CAM-3R-A2
<400> 13
Arg Ile Ser Ser Ser Gly Thr Thr Phe Tyr Ala Asp Ser Val Lys Gly
1 5 10 15
<210> 14
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH2 mL1CAM-2R-F8
<400> 14
Ala Ile Ser Ser Ser Gly Gly Thr Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 15
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-H8
<400> 15
Gln Ser Thr Tyr Phe Tyr Ser Tyr Phe Asp Val
1 5 10
<210> 16
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-C9
<400> 16
Asp Glu Gly Ser Gly Leu Gly Ala Phe Asp Ile
1 5 10
<210> 17
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-E1
<400> 17
Asp Glu Ser Thr Gly Leu Gly Ala Phe Asp Tyr
1 5 10
<210> 18
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-F6
<400> 18
Asp Glu Ser Tyr Gly Trp Leu Tyr Ala Phe Asp Leu
1 5 10
<210> 19
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-F1
<400> 19
Val Leu Glu Leu Trp Glu Gly Leu Asp Tyr
1 5 10
<210> 20
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-G6
<400> 20
Val Arg Gly Thr Tyr Tyr Gly Ser Tyr Leu Asp Tyr
1 5 10
<210> 21
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-A2
<400> 21
Val Glu Glu Gly Arg Tyr Val Gln Ala Phe Asp Tyr
1 5 10
<210> 22
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-3R-E9
<400> 22
His Gly Gly Thr Trp Trp Gly Arg Ala Phe Asp Tyr
1 5 10
<210> 23
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRH3 mL1CAM-2R-F8
<400> 23
His Gly Ser Tyr Ala Phe Val Phe Asp Tyr
1 5 10
<210> 24
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> Каркасная область 1 тяжелой цепи (FRH1) mL1CAM-3R-H8,
mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F6,
mL1CAM-3R-F1, mL1CAM-3R-A2 и mL1CAM-3R-E9
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 25
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRH1 mL1CAM-3R-G6
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Leu Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 26
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRH1 mL1CAM-2R-F8
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Ala Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser
20 25 30
<210> 27
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRH2 mL1CAM-3R-H8, mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F6,
mL1CAM-3R-F1, mL1CAM-3R-G6, mL1CAM-3R-A2, mL1CAM-3R-E9 и
mL1CAM-2R-F8
<400> 27
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
1 5 10
<210> 28
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRH3 mL1CAM-3R-H8, mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F1,
mL1CAM-3R-G6, mL1CAM-3R-A2, mL1CAM-3R-E9 и mL1CAM-2R-F8
<400> 28
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
20 25 30
<210> 29
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRH3 mL1CAM-3R-F6
<400> 29
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Ile Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys
20 25 30
<210> 30
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRH4 mL1CAM-3R-H8, mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F6,
mL1CAM-3R-F1, mL1CAM-3R-G6, mL1CAM-3R-A2, mL1CAM-3R-E9 и
mL1CAM-2R-F8
<400> 30
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 31
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> Линкер (G4S1)3
<400> 31
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 32
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Определяющая комплементарность область 1 легкой цепи (CDRL1)
mL1CAM-3R-H8
<400> 32
Arg Ala Ser Gln Ser Ile Ser Arg Asp Leu Asn
1 5 10
<210> 33
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL1 mL1CAM-3R-C9 и mL1CAM-3R-G6
<400> 33
Arg Ala Ser Gln Ser Ile Ser Arg Tyr Leu Asn
1 5 10
<210> 34
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL1 mL1CAM-3R-E1, mL1CAM-3R-F6, mL1CAM-3R-A2 и
mL1CAM-2R-F8
<400> 34
Arg Ala Ser Gln Ser Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 35
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL1 mL1CAM-3R-F1
<400> 35
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 36
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL1 mL1CAM-3R-E9
<400> 36
Arg Ala Ser Gln Ser Ile Gly Ser Tyr Leu Asn
1 5 10
<210> 37
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 mL1CAM-3R-H8 и mL1CAM-2R-F8
<400> 37
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 38
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 mL1CAM-3R-C9 и mL1CAM-3R-E1
<400> 38
Ala Ala Ser Asn Leu Gln Ser
1 5
<210> 39
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 mL1CAM-3R-F6 и mL1CAM-3R-F1
<400> 39
Ala Ala Ser Arg Leu Gln Ser
1 5
<210> 40
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 mL1CAM-3R-G6
<400> 40
Ala Ala Ser Thr Leu Gln Ser
1 5
<210> 41
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 mL1CAM-3R-A2
<400> 41
Ala Thr Ser Arg Leu Gln Ser
1 5
<210> 42
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL2 mL1CAM-3R-E9
<400> 42
Ala Thr Ser Ser Leu Gln Ser
1 5
<210> 43
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3 mL1CAM-3R-H8 и mL1CAM-3R-E9
<400> 43
Gln Gln Ser Tyr Ser Thr Pro Tyr Thr
1 5
<210> 44
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3 mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-A2 и
mL1CAM-2R-F8
<400> 44
Gln Gln Ser Tyr Ser Phe Pro Trp Thr
1 5
<210> 45
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3 mL1CAM-3R-F6
<400> 45
Gln Gln Ser Tyr Ser Phe Pro Leu Thr
1 5
<210> 46
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3 mL1CAM-3R-F1
<400> 46
Gln Gln Ser Glu Ser Phe Pro Tyr Thr
1 5
<210> 47
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> CDRL3 mL1CAM-3R-G6
<400> 47
Gln Gln Ser Tyr Ser Tyr Pro Phe Thr
1 5
<210> 48
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<223> Каркасная область 1 легкой цепи (FRL1) mL1CAM-3R-H8,
mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F6,
mL1CAM-3R-F1, mL1CAM-3R-G6, mL1CAM-3R-A2, mL1CAM-3R-E9 и
mL1CAM-2R-F8
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 49
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRL2 mL1CAM-3R-H8, mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F6,
mL1CAM-3R-F1, mL1CAM-3R-G6, mL1CAM-3R-A2, mL1CAM-3R-E9 и
mL1CAM-2R-F8
<400> 49
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 50
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRL3 mL1CAM-3R-H8, mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F6,
mL1CAM-3R-F1, mL1CAM-3R-G6, mL1CAM-3R-A2, mL1CAM-3R-E9 и
mL1CAM-2R-F8
<400> 50
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 51
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> FRL4 mL1CAM-3R-H8, mL1CAM-3R-C9, mL1CAM-3R-E1, mL1CAM-3R-F6,
mL1CAM-3R-F1, mL1CAM-3R-G6, mL1CAM-3R-A2, mL1CAM-3R-E9 и
mL1CAM-2R-F8
<400> 51
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 52
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи (VH) mL1CAM-3R-H8
<400> 52
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Thr Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Ser Thr Tyr Phe Tyr Ser Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 53
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи mL1CAM-3R-C9
<400> 53
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Glu Gly Ser Gly Leu Gly Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 54
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи mL1CAM-3R-E1
<400> 54
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Ser Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Glu Ser Thr Gly Leu Gly Ala Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 55
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область тяжелой цепи mL1CAM-3R-E9
<400> 55
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys His Gly Gly Thr Trp Trp Gly Arg Ala Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 56
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи (VL) mL1CAM-3R-H8
<400> 56
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Arg Asp
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 57
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи mL1CAM-3R-C9
<400> 57
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 58
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи mL1CAM-3R-E1
<400> 58
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Asn Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 59
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<223> Вариабельная область легкой цепи mL1CAM-3R-E9
<400> 59
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Thr Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 60
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность одноцепочечного вариабельного
фрагмента (scFv) mL1CAM-3R-H8
<400> 60
gaagtacagt tggtcgaaag tggcggtggc ctcgtgcaac cgggtggttc actgcgtctg 60
agctgcgccg cctcgggttt tactttctct gattatgcaa tgaattgggt tcgtcaggcg 120
ccgggcaagg gtctcgaatg ggtttcagca atctcttcta ctggttctac tatctactat 180
gccgattcag tgaagggtcg ctttaccatt tcccgtgaca actctaagaa tactctgtat 240
ctgcagatga actcgctgcg tgccgaagac acggccgtct attattgcgc caaacagtct 300
acttactttt actcttactt tgatgtttgg ggtcagggca ctttagtgac cgtctcatcg 360
ggtggaggcg gttcaggcgg aggtggatcc ggcggtggcg gatcggacat tcaaatgacg 420
cagagtccct cctcactgag tgctagcgtg ggcgatcgtg tgacaattac ttgtcgcgct 480
agccagtcta tctctcgtga tctgaactgg tatcagcaga aaccgggcaa ggcgccaaaa 540
ttgctgattt acgcagcatc ctctctgcag tctggtgtac cgtcccgttt ctctggcagc 600
ggttctggta cggattttac cctgaccatc tcaagcctcc agcctgaaga ttttgccacc 660
tattattgtc agcaatctta ctctactccg tacacgttcg ggcagggaac taaagtggaa 720
attaaa 726
<210> 61
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность scFv mL1CAM-3R-C9
<400> 61
gaagtacagt tggtcgaaag tggcggtggc ctcgtgcaac cgggtggttc actgcgtctg 60
agctgcgccg cctcgggttt tactttctct tcttatgcaa tgcactgggt tcgtcaggcg 120
ccgggcaagg gtctcgaatg ggtttcagca atctcttctt ctggtggttc tacttactat 180
gccgattcag tgaagggtcg ctttaccatt tcccgtgaca actctaagaa tactctgtat 240
ctgcagatga actcgctgcg tgccgaagac acggccgtct attattgcgc caaagatgaa 300
ggttctggtc tgggtgcatt tgatatctgg ggtcagggca ctttagtgac cgtctcatcg 360
ggtggaggcg gttcaggcgg aggtggatcc ggcggtggcg gatcggacat tcaaatgacg 420
cagagtccct cctcactgag tgctagcgtg ggcgatcgtg tgacaattac ttgtcgcgct 480
agccagtcta tctctcgtta cctgaactgg tatcagcaga aaccgggcaa ggcgccaaaa 540
ttgctgattt acgcagcatc caatctgcag tctggtgtac cgtcccgttt ctctggcagc 600
ggttctggta cggattttac cctgaccatc tcaagcctcc agcctgaaga ttttgccacc 660
tattattgtc agcaatctta ctcttttccg tggacgttcg ggcagggaac taaagtggaa 720
attaaa 726
<210> 62
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность scFv mL1CAM-3R-E1
<400> 62
gaagtacagt tggtcgaaag tggcggtggc ctcgtgcaac cgggtggttc actgcgtctg 60
agctgcgccg cctcgggttt tactttctct tcttatgcaa tgtcttgggt tcgtcaggcg 120
ccgggcaagg gtctcgaatg ggtttcagca atctcttctt ctggttcttc tacttactat 180
gccgattcag tgaagggtcg ctttaccatt tcccgtgaca actctaagaa tactctgtat 240
ctgcagatga actcgctgcg tgccgaagac acggccgtct attattgcgc caaagatgaa 300
tctactggtc tgggtgcatt tgattactgg ggtcagggca ctttagtgac cgtctcatcg 360
ggtggaggcg gttcaggcgg aggtggatcc ggcggtggcg gatcggacat tcaaatgacg 420
cagagtccct cctcactgag tgctagcgtg ggcgatcgtg tgacaattac ttgtcgcgct 480
agccagtcta tctctaatta cctgaactgg tatcagcaga aaccgggcaa ggcgccaaaa 540
ttgctgattt acgcagcatc caatctgcag tctggtgtac cgtcccgttt ctctggcagc 600
ggttctggta cggattttac cctgaccatc tcaagcctcc agcctgaaga ttttgccacc 660
tattattgtc agcaatctta ctcttttccg tggacgttcg ggcagggaac taaagtggaa 720
attaaa 726
<210> 63
<211> 729
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность scFv mL1CAM-3R-E9
<400> 63
gaagtacagt tggtcgaaag tggcggtggc ctcgtgcaac cgggtggttc actgcgtctg 60
agctgcgccg cctcgggttt tactttctct gattatgcaa tgcactgggt tcgtcaggcg 120
ccgggcaagg gtctcgaatg ggtttcagca atctcttctt ctggtggttc tacttactat 180
gccgattcag tgaagggtcg ctttaccatt tcccgtgaca actctaagaa tactctgtat 240
ctgcagatga actcgctgcg tgccgaagac acggccgtct attattgcgc caaacatggt 300
ggtacttggt ggggtcgtgc attcgattac tggggtcagg gcactttagt gaccgtctca 360
tcgggtggag gcggttcagg cggaggtgga tccggcggtg gcggatcgga cattcaaatg 420
acgcagagtc cctcctcact gagtgctagc gtgggcgatc gtgtgacaat tacttgtcgc 480
gctagccagt ctatcggttc ttacctgaac tggtatcagc agaaaccggg caaggcgcca 540
aaattgctga tttacgcaac ttcctctctg cagtctggtg taccgtcccg tttctctggc 600
agcggttctg gtacggattt taccctgacc atctcaagcc tccagcctga agattttgcc 660
acctattatt gtcagcaatc ttactctact ccgtacacgt tcgggcaggg aactaaagtg 720
gaaattaaa 729
<210> 64
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность scFv mL1CAM-3R-H8
<400> 64
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Thr Gly Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gln Ser Thr Tyr Phe Tyr Ser Tyr Phe Asp Val Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser
130 135 140
Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Gln Ser Ile Ser Arg Asp Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln Ser Tyr Ser Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 65
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность scFv mL1CAM-3R-C9
<400> 65
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Glu Gly Ser Gly Leu Gly Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser
130 135 140
Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Gln Ser Ile Ser Arg Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln Ser Tyr Ser Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 66
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность scFv mL1CAM-3R-E1
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Ser Gly Ser Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Glu Ser Thr Gly Leu Gly Ala Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser
130 135 140
Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Gln Ser Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln Ser Tyr Ser Phe Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 67
<211> 243
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность scFv mL1CAM-3R-E9
<400> 67
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ser Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys His Gly Gly Thr Trp Trp Gly Arg Ala Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
130 135 140
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg
145 150 155 160
Ala Ser Gln Ser Ile Gly Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Thr Ser Ser Leu Gln Ser
180 185 190
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
195 200 205
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
210 215 220
Gln Gln Ser Tyr Ser Thr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val
225 230 235 240
Glu Ile Lys
<210> 68
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для лидерной последовательности (LS) VH 3E8 плюс ScFv(F) L1
<400> 68
ggtgtccact ccgaagtaca gttggtc 27
<210> 69
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ScFv L1 плюс шарнирная область(R) hIgD
<400> 69
acctggccag cgtttaattt ccacttt 27
<210> 70
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для Mlu 1 плюс VH(F) 3E8
<400> 70
acgcgtatgg aatggagctg ggtc 24
<210> 71
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для VH 3E8 плюс ScFv(R) L1
<400> 71
caactgtact tcggagtgga cacctgt 27
<210> 72
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ScFv L1 плюс шарнирная область(F) hIgD
<400> 72
gtggaaatta aacgctggcc aggttct 27
<210> 73
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для XhoI плюс CD3дзета(R)
<400> 73
ccgctcgagt tagcgagggg gcagggc 27
<210> 74
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для T7(F)
<400> 74
tatacgactc actataggg 19
<210> 75
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для SP6(R)
<400> 75
atttaggtga cactatag 18
<210> 76
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Mlu I-стартовый кодон-LS 3E8
<400> 76
acgcgtatgg aatggagctg ggtctttctc ttcttcctgt cagtaactac aggtgtccac 60
tcc 63
<210> 77
<211> 192
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Шарнирная область IgD
<400> 77
cgctggccag gttctccaaa ggcacaggcc tcctccgtgc ccactgcaca accccaagca 60
gagggcagcc tcgccaaggc aaccacagcc ccagccacca cccgtaacac aggtagagga 120
ggagaagaga agaagaagga gaaggagaaa gaggaacaag aagagagaga gacaaagaca 180
ccaggttgtc cg 192
<210> 78
<211> 81
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Транс мембранный (TM) домен CD28
<400> 78
ttttgggtgc tggtggtggt tggtggagtc ctggcttgct atagcttgct agtaacagtg 60
gcctttatta ttttctgggt g 81
<210> 79
<211> 123
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Внутриклеточный домен (ICD) CD28
<400> 79
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 80
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<223> OX40
<400> 80
gccctgtacc tgctccggag ggaccagagg ctgccccccg atgcccacaa gccccctggg 60
ggaggcagtt tccggacccc catccaagag gagcaggccg acgcccactc caccctggcc 120
aagatc 126
<210> 81
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD3дзета
<400> 81
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgcag agaaggaaga accctcagga aggcctgtac 180
aatgaactgc agaaagataa gatggcggag gcctacagtg agattgggat gaaaggcgag 240
cgccggaggg gcaaggggca cgatggcctt taccagggtc tcagtacagc caccaaggac 300
acctacgacg cccttcacat gcaggccctg ccccctcgc 339
<210> 82
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD3дзета-стоп кодон-Xho I
<400> 82
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgcag agaaggaaga accctcagga aggcctgtac 180
aatgaactgc agaaagataa gatggcggag gcctacagtg agattgggat gaaaggcgag 240
cgccggaggg gcaaggggca cgatggcctt taccagggtc tcagtacagc caccaaggac 300
acctacgacg cccttcacat gcaggccctg ccccctcgct aactcgag 348
<210> 83
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для scFv L1-H8 плюс шарнирная область(R) IgG1
<400> 83
agatttgggc tctttaattt ccacttt 27
<210> 84
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для scFv L1-H8 плюс шарнирная область(F) IgG1
<400> 84
gtggaaatta aagagcccaa atcttgt 27
<210> 85
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Шарнирная область IgG1
<400> 85
gagcccaaat cttgtgacaa aactcacaca tgcccaccgt gccca 45
<210> 86
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CH3 IgG1
<400> 86
gggcagcccc gagaaccaca ggtgtacacc ctgcccccat cccgggatga gctgaccaag 60
aaccaggtca gcctgacctg cctggtcaaa ggcttctatc ccagcgacat cgccgtggag 120
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 180
gacggctcct tcttcctcta cagcaagctc accgtggaca agagcaggtg gcagcagggg 240
aacgtcttct catgctccgt gatgcatgag gctctgcaca accactacac gcagaagagc 300
ctctccctgt ctccgggtaa a 321
<210> 87
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD CD28 плюс 41BB(R)
<400> 87
tctgccccgt ttggagcgat aggctgc 27
<210> 88
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD CD28 плюс 41BB(F)
<400> 88
gcctatcgct ccaaacgggg cagaaag 27
<210> 89
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD CD28 плюс ICD (R) ICOS
<400> 89
ggatgaatac ttggagcgat aggctgc 27
<210> 90
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD CD28 плюс ICD (F) ICOS
<400> 90
gcctatcgct ccaagtattc atccagt 27
<210> 91
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD ICOS плюс CD3дзета(R)
<400> 91
gaacttcact ctggtcacat ctgtgag 27
<210> 92
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD ICOS плюс CD3дзета(F)
<400> 92
acagatgtga ccagagtgaa gttcagc 27
<210> 93
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD CD28 плюс CD3дзета(R)
<400> 93
gaacttcact ctggagcgat aggctgc 27
<210> 94
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ICD CD28 плюс CD3дзета(F)
<400> 94
gcctatcgct ccagagtgaa gttcagc 27
<210> 95
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для TM CD28 плюс OX40(R)
<400> 95
caggtacagg gccacccaga aaataat 27
<210> 96
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для TM CD28 плюс OX40(F)
<400> 96
attttctggg tggccctgta cctgctc 27
<210> 97
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для TM CD28 плюс 41BB(R)
<400> 97
tctgccccgt ttcacccaga aaataat 27
<210> 98
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для TM CD28 плюс 41BB(F)
<400> 98
attttctggg tgaaacgggg cagaaag 27
<210> 99
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для TM CD28 плюс ICD(R) ICOS
<400> 99
tggatgaata cttcacccag aaaataata 29
<210> 100
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для TM CD28 плюс ICD(F) ICOS
<400> 100
attttctggg tgaagtattc atccagt 27
<210> 101
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4-1BB
<400> 101
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 102
<211> 93
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ICOS
<400> 102
aagtattcat ccagtgtgca cgaccctaac ggtgaataca tgttcatgag agcagtgaac 60
acagccaaaa aatctagact cacagatgtg acc 93
<210> 103
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для тяжелой цепи L1-H8 плюс шарнирная область(R) IgD
<400> 103
acctggccag cgcgatgaga cggtcac 27
<210> 104
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для тяжелой цепи L1-H8 плюс шарнирная область(F) IgD
<400> 104
accgtctcat cgcgctggcc aggttct 27
<210> 105
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для AS плюс MluI плюс 2173-CD8a_LS(F)
<400> 105
cgacgcgtat ggccctccct gtcaccg 27
<210> 106
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для 2173-CD8a_LS плюс ScFv(R) C9
<400> 106
caactgtact tcgggccgag cggcgtg 27
<210> 107
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для 2173-CD8a_LS плюс ScFv(F) C9
<400> 107
gccgctcggc ccgaagtaca gttggtc 27
<210> 108
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ScFv C9 плюс шарнирная область(R) hCD8a
<400> 108
tggggtagtg gttttaattt ccacttt 27
<210> 109
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для ScFv C9 плюс шарнирная область(F) hCD8a
<400> 109
gtggaaatta aaaccactac cccagca 27
<210> 110
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для AS плюс Xho1 плюс 2173-CD3дзета(R)
<400> 110
ccgctcgagt taccgaggcg gcagggc 27
<210> 111
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для AS плюс MluI плюс GMCSF rec.a LS(F)
<400> 111
cgacgcgtat gcttctcctg gtgacaa 27
<210> 112
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для GMCSF rec.a LS плюс scFv(R) L1-H8
<400> 112
caactgtact tctgggatca ggaggaa 27
<210> 113
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для GMCSF rec.a LS плюс scFv(F) L1-H8
<400> 113
ctcctgatcc cagaagtaca gttggtc 27
<210> 114
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для scFv L1-H8 плюс шарнирная область плюс hCD28(R)
<400> 114
aattgcggcc gctttaattt ccacttt 27
<210> 115
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для scFv L1-H8 плюс шарнирная область плюс hCD28(F)
<400> 115
gtggaaatta aagcggccgc aattgaa 27
<210> 116
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер для AS плюс Xho1 плюс CD3-дзета (R)
<400> 116
ccgctcgagt tagcgagggg gcagg 25
<210> 117
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Mlu I-стартовый кодон-LS hCD8a
<400> 117
acgcgtatgg ccctccctgt caccgccctg ctgcttccgc tggctcttct gctccacgcc 60
gctcggccc 69
<210> 118
<211> 135
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Шарнирная область hCD8a
<400> 118
accactaccc cagcaccgag gccacccacc ccggctccta ccatcgcctc ccagcctctg 60
tccctgcgtc cggaggcatg tagacccgca gctggtgggg ccgtgcatac ccggggtctt 120
gacttcgcct gcgat 135
<210> 119
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TM hCD8a
<400> 119
atctacattt gggcccctct ggctggtact tgcggggtcc tgctgctttc actcgtgatc 60
actctttact gt 72
<210> 120
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<223> 4-1BB
<400> 120
aagcgcggtc ggaagaagct gctgtacatc tttaagcaac ccttcatgag gcctgtgcag 60
actactcaag aggaggacgg ctgttcatgc cggttcccag aggaggagga aggcggctgc 120
gaactg 126
<210> 121
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD3дзета-iso2M
<400> 121
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc 60
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga 120
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac 180
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc 240
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc 300
tatgacgctc ttcacatgca ggccctgccg cctcgg 336
<210> 122
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD3дзета-iso2M-стоп кодон-Xho I
<400> 122
cgcgtgaaat tcagccgcag cgcagatgct ccagcctaca agcaggggca gaaccagctc 60
tacaacgaac tcaatcttgg tcggagagag gagtacgacg tgctggacaa gcggagagga 120
cgggacccag aaatgggcgg gaagccgcgc agaaagaatc cccaagaggg cctgtacaac 180
gagctccaaa aggataagat ggcagaagcc tatagcgaga ttggtatgaa aggggaacgc 240
agaagaggca aaggccacga cggactgtac cagggactca gcaccgccac caaggacacc 300
tatgacgctc ttcacatgca ggccctgccg cctcggtaac tcgag 345
<210> 123
<211> 72
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Mlu I-стартовый кодон-hGM-CSF rec.a LS
<400> 123
acgcgtatgc ttctcctggt gacaagcctt ctgctctgtg agttaccaca cccagcattc 60
ctcctgatcc ca 72
<210> 124
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<223> шарнирная область
<400> 124
gcggccgca 9
<210> 125
<211> 117
<212> ДНК
<213> Искусственная последовательность
<220>
<223> hCD28 pECD
<400> 125
attgaagtta tgtatcctcc tccttaccta gacaatgaga agagcaatgg aaccattatc 60
catgtgaaag ggaaacacct ttgtccaagt cccctatttc ccggaccttc taagccc 117
<210> 126
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD3дзета-iso2
<400> 126
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgctaa 339
<210> 127
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CD3дзета-iso2-стоп кодон-Xho I
<400> 127
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgctaat aactcgag 348
<210> 128
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Лидерная последовательность 3E8
<400> 128
gagctgggtc tttctcttct tcctgtcagt aactacaggt gtccactcc 49
<210> 129
<211> 60
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Лидерная последовательность альфа hCD8
<400> 129
gccctccctg tcaccgccct gctgcttccg ctggctcttc tgctccacgc cgctcggccc 60
60
<210> 130
<211> 63
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Лидерная последовательность альфа-цепи рецептора hGM-CSF
<400> 130
cttctcctgg tgacaagcct tctgctctgt gagttaccac acccagcatt cctcctgatc 60
cca 63
<---
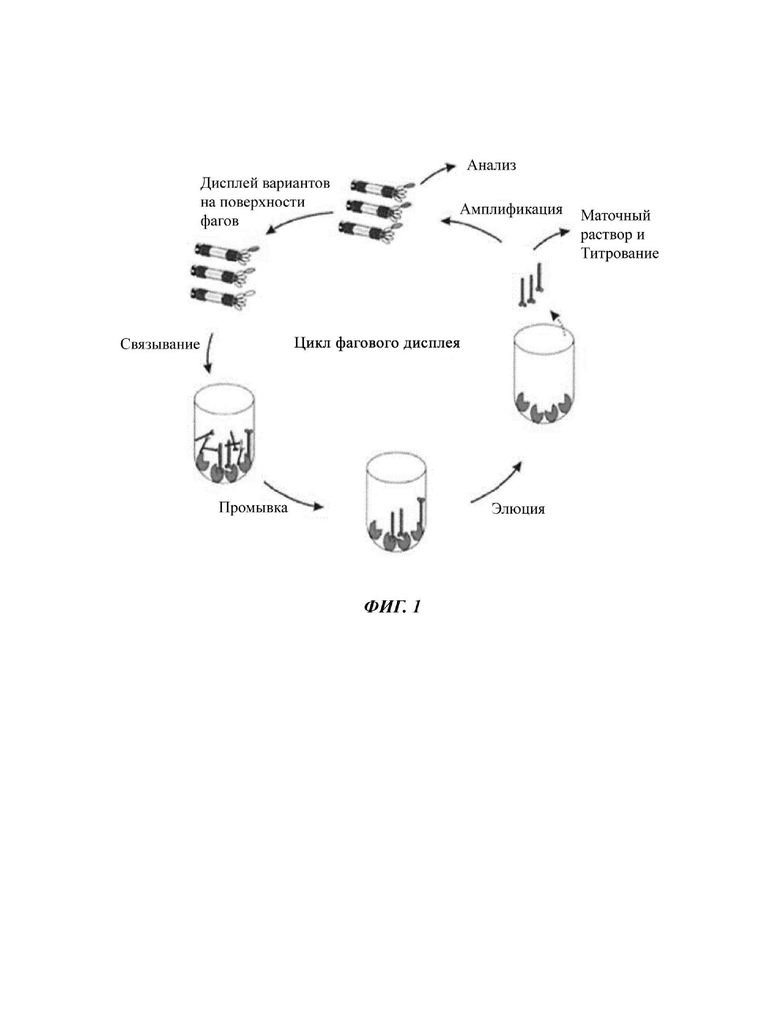




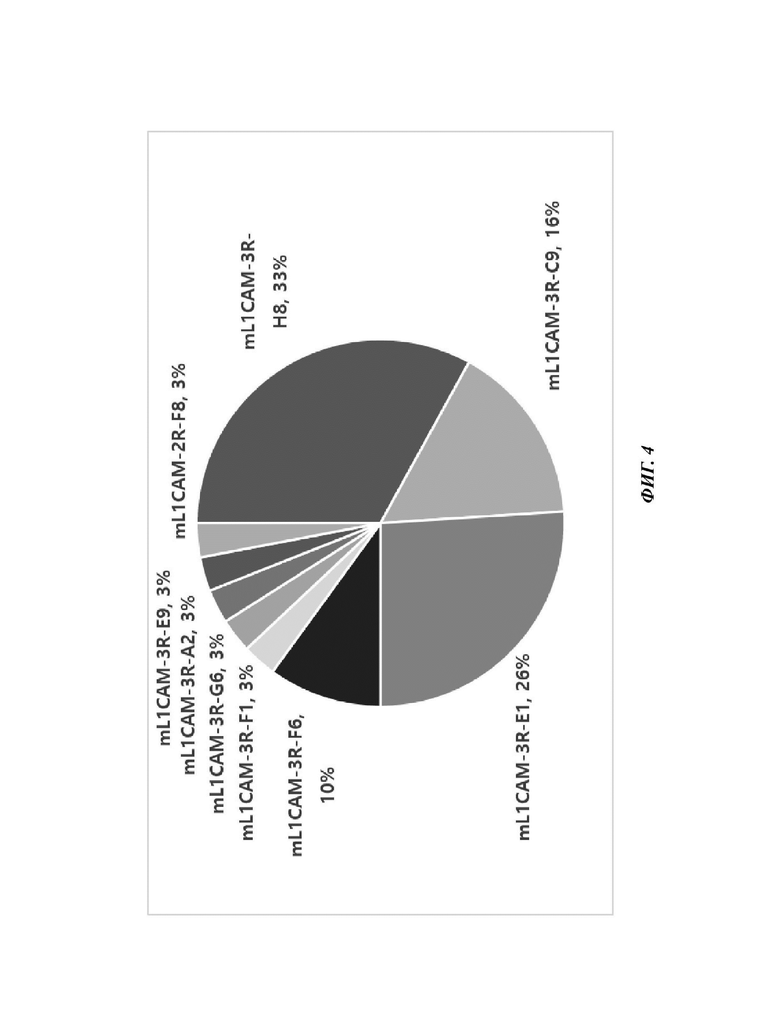
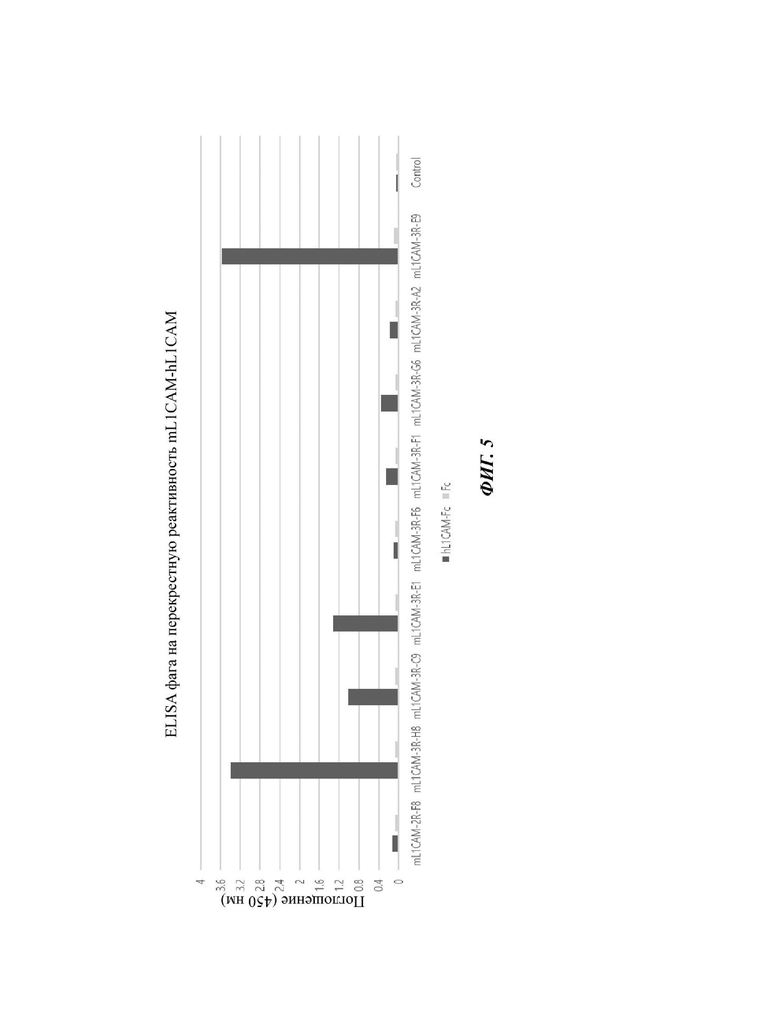

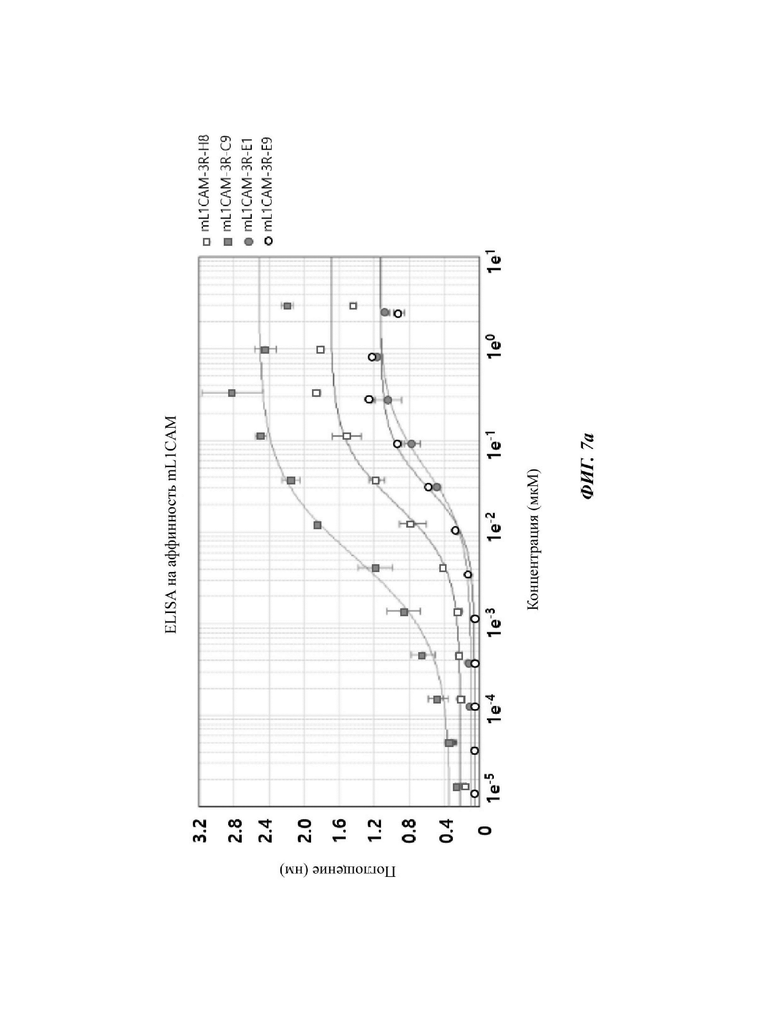

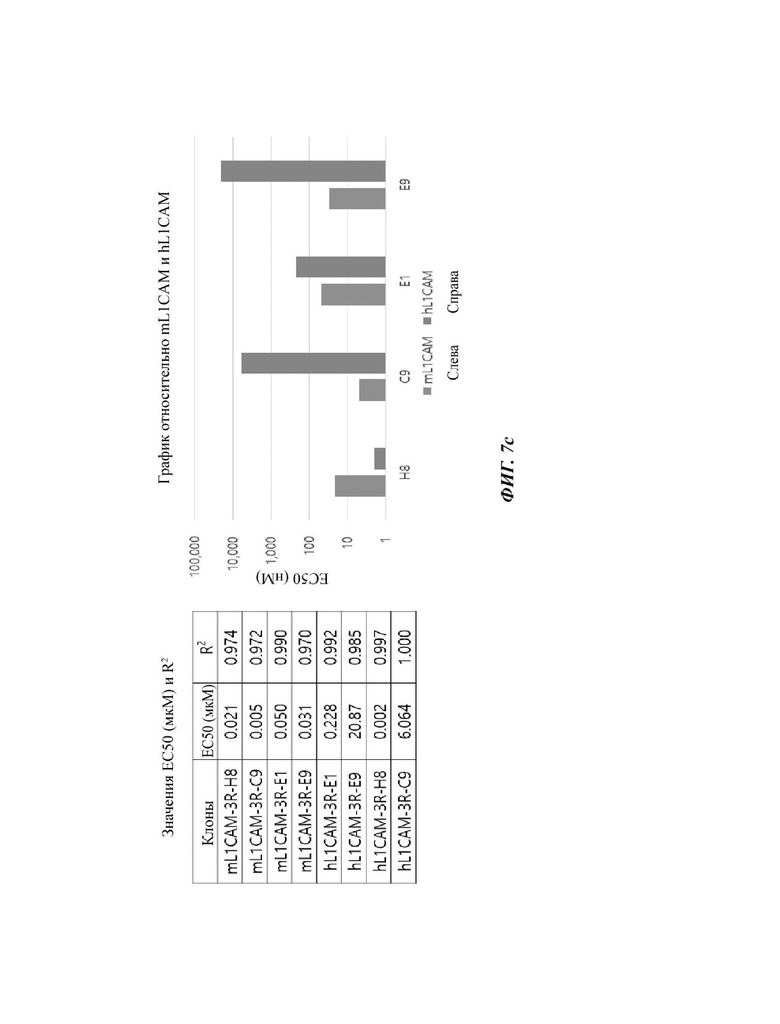

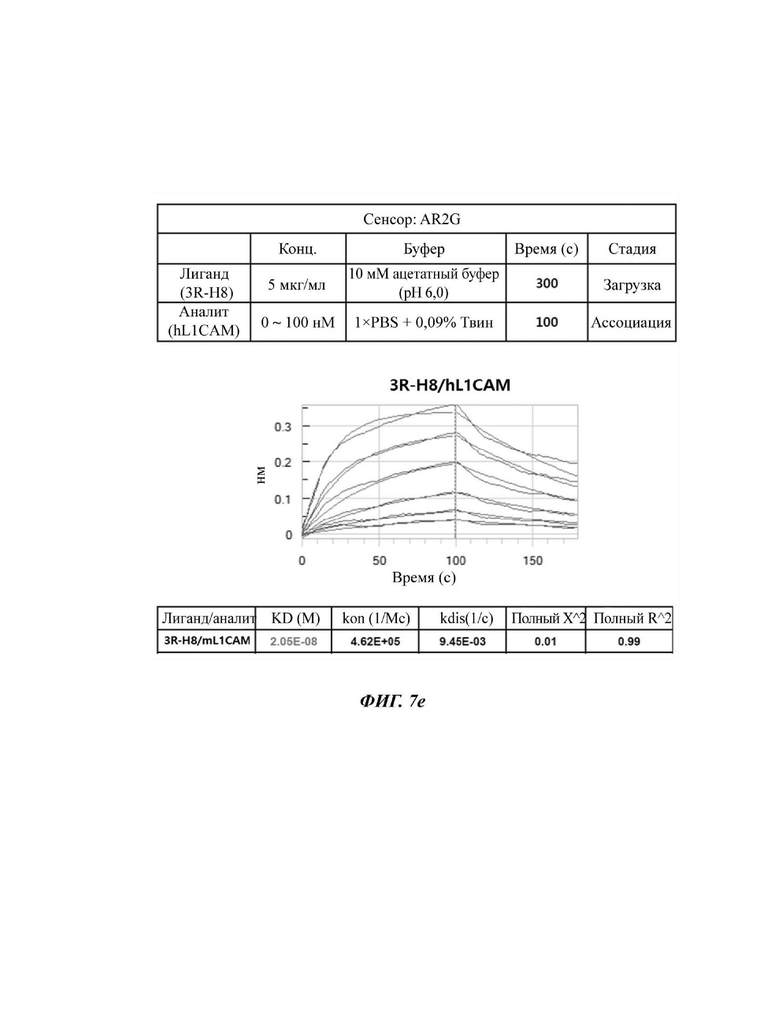
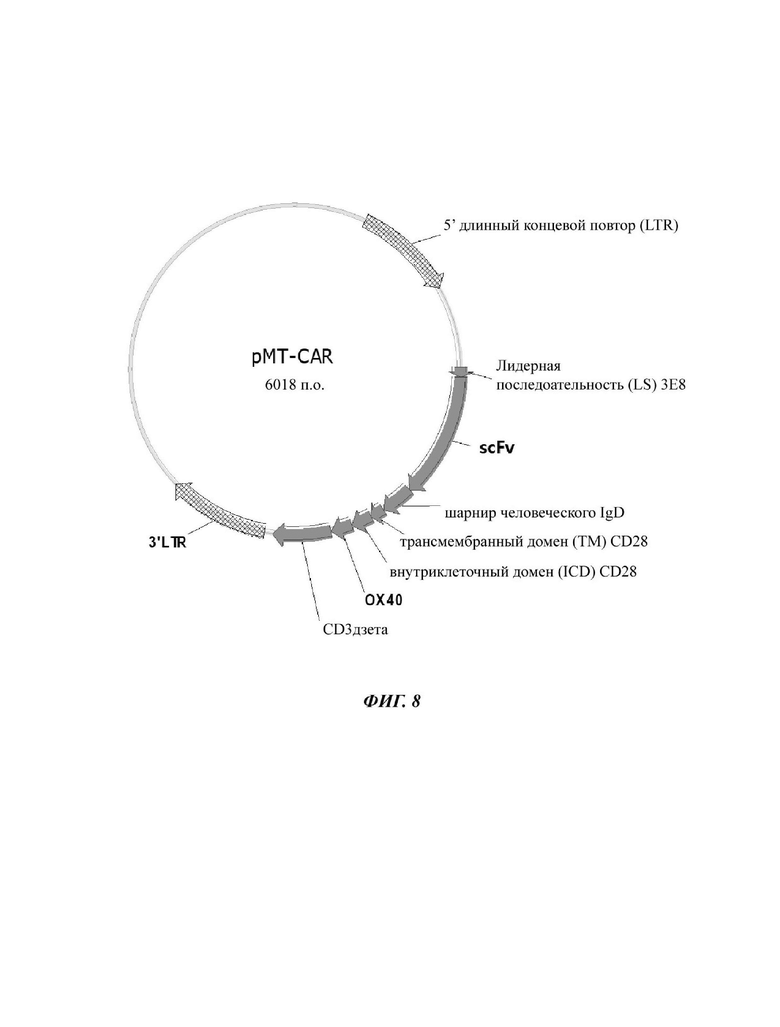
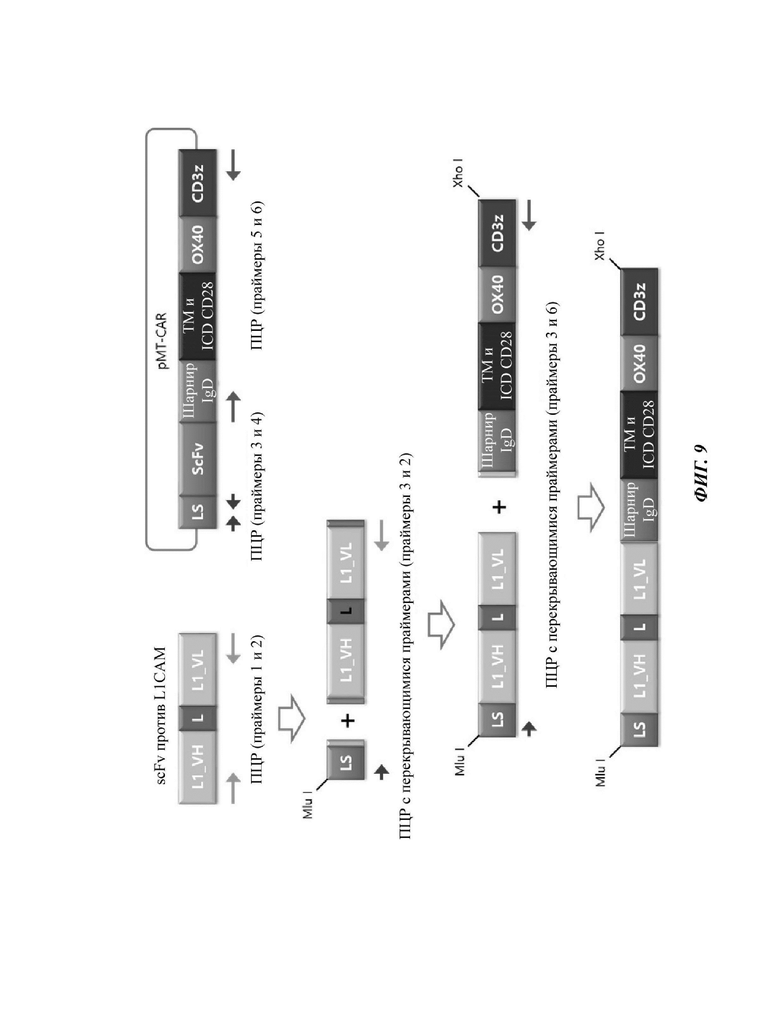
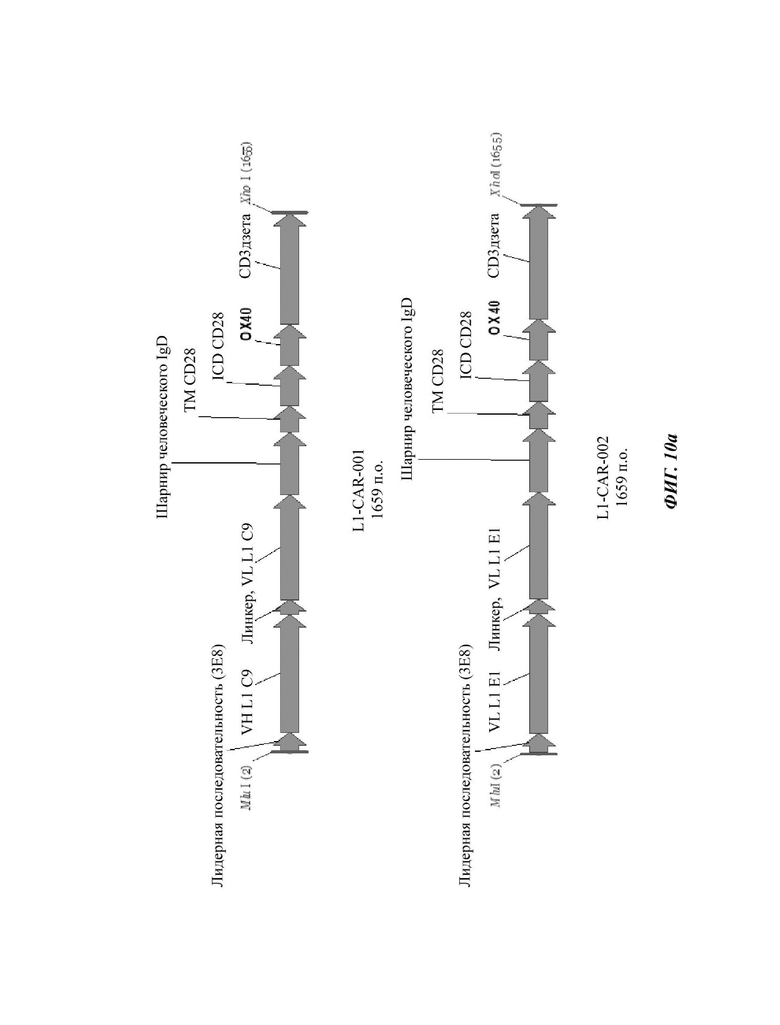
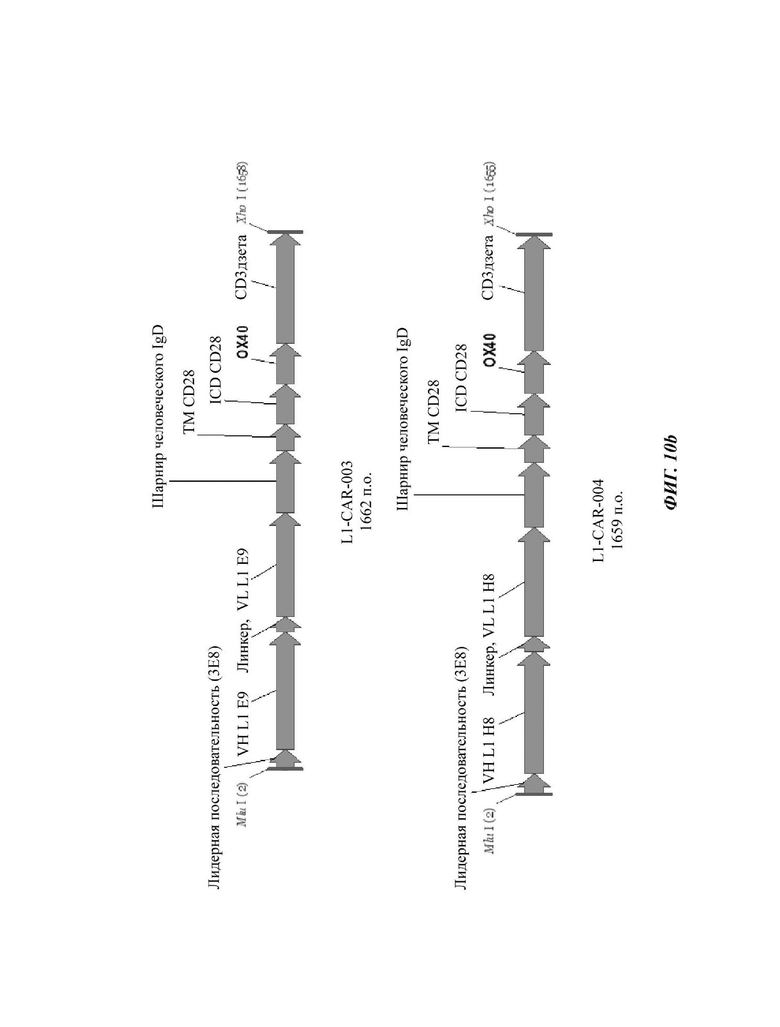

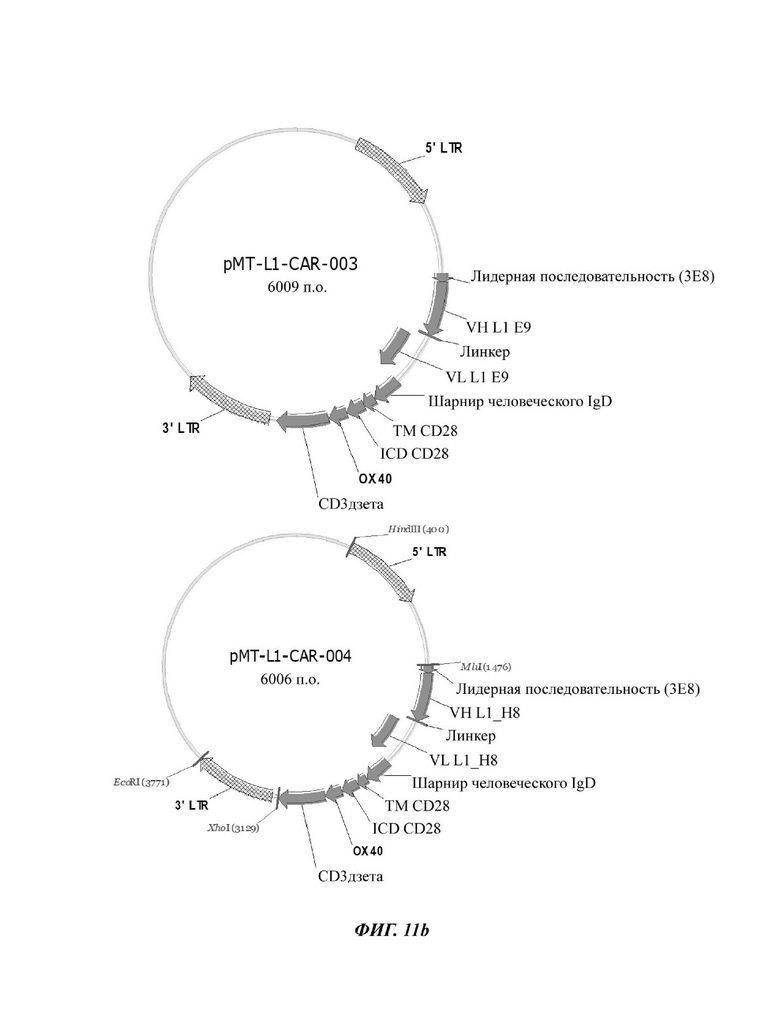

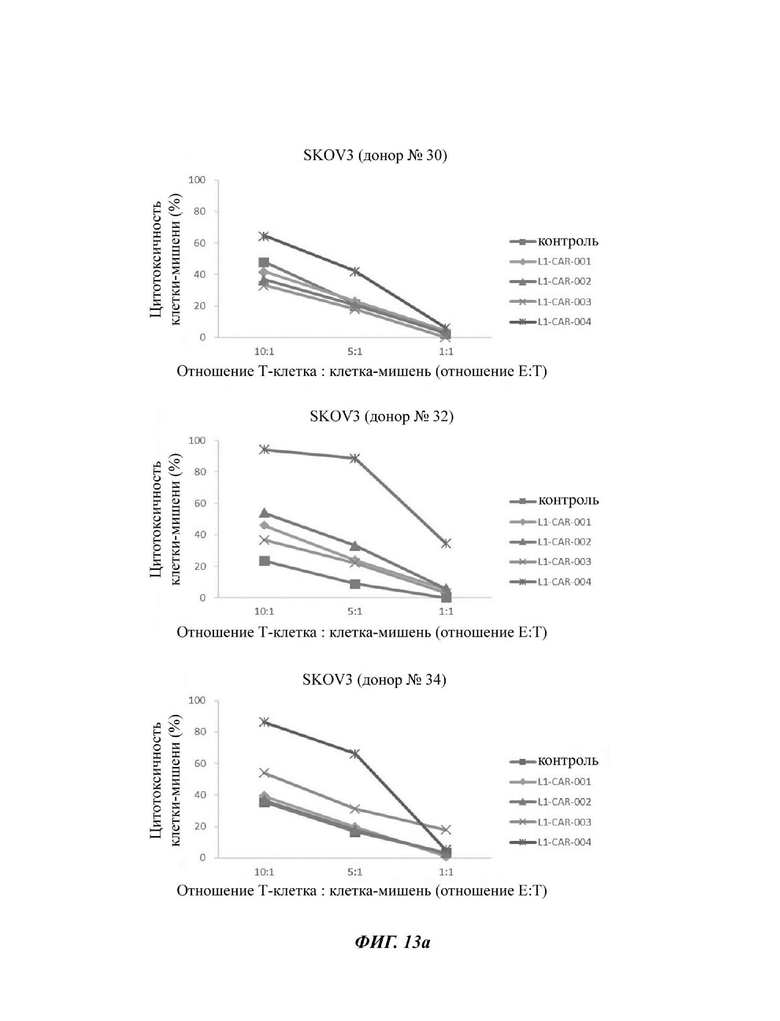
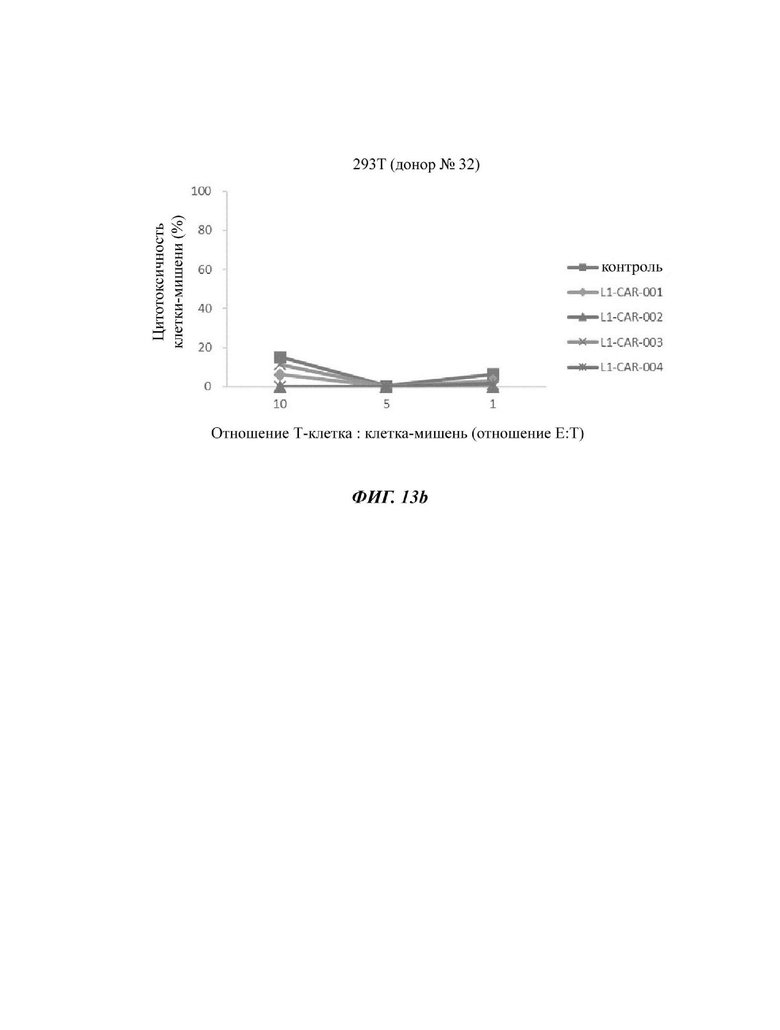

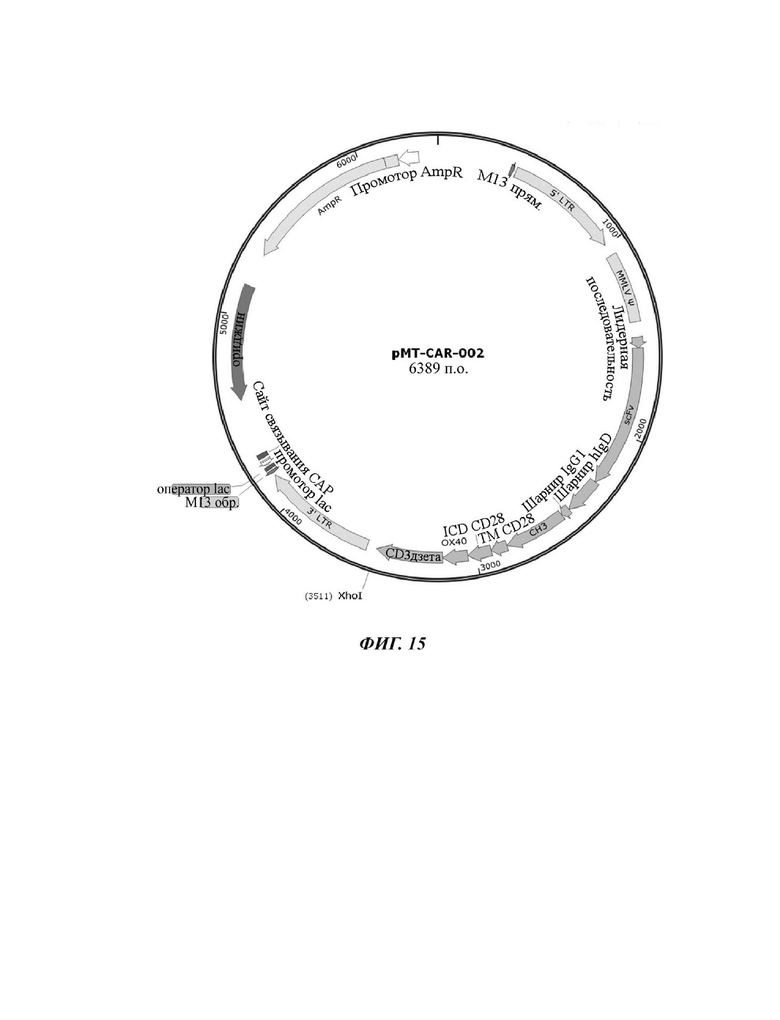

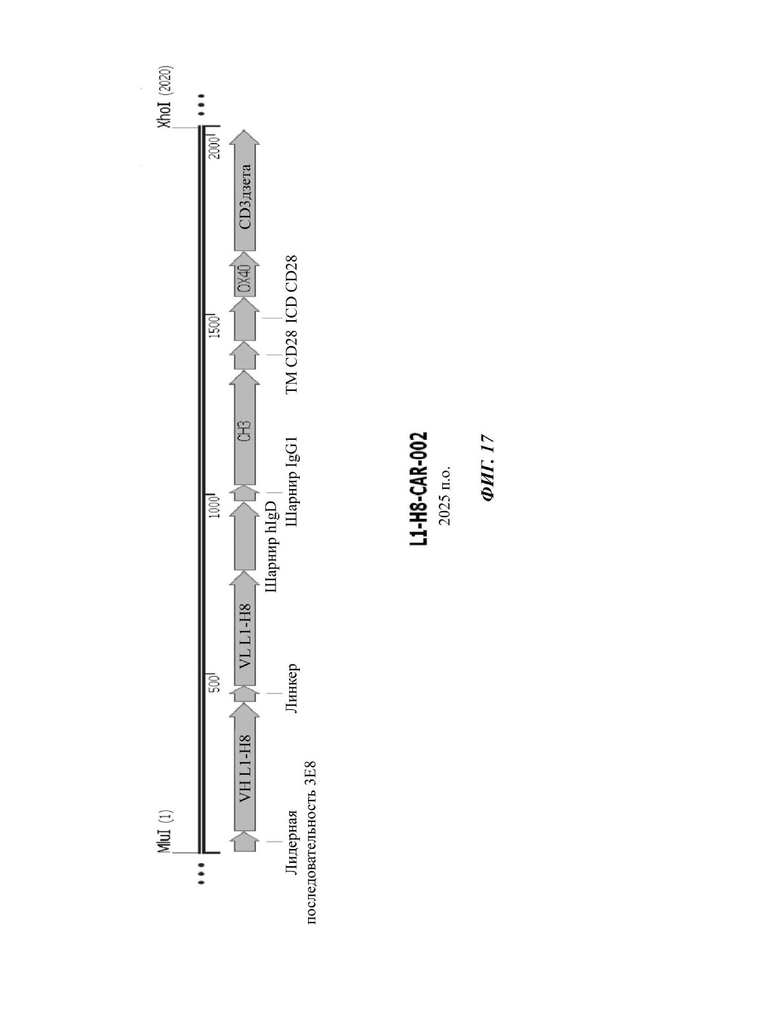
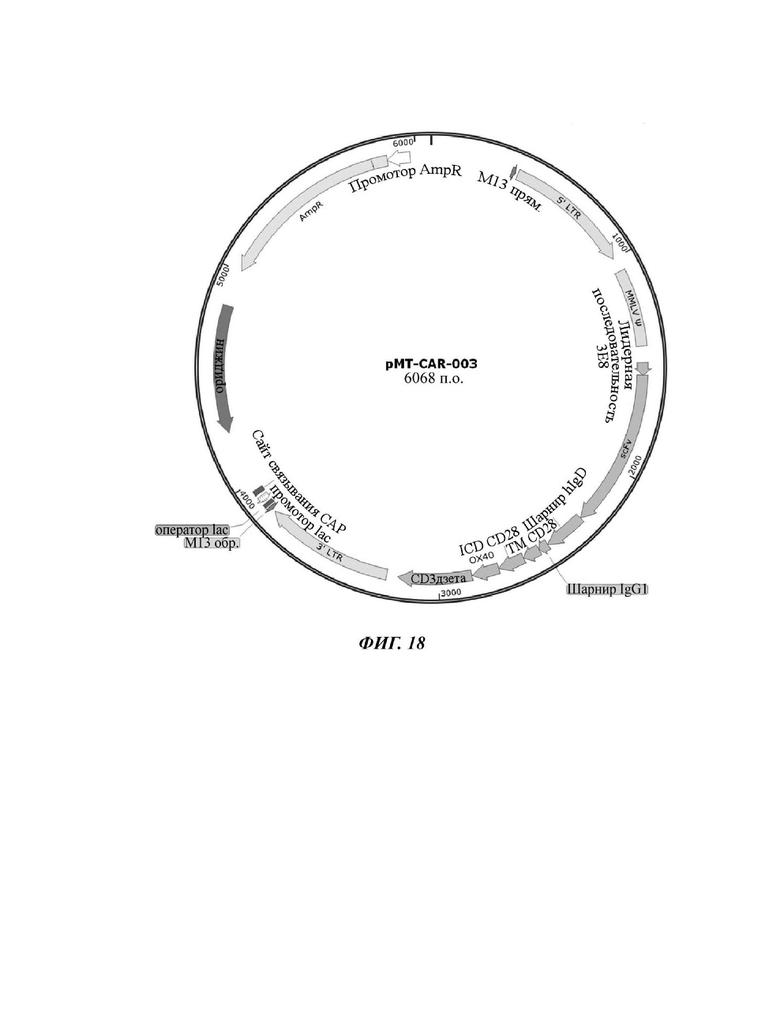
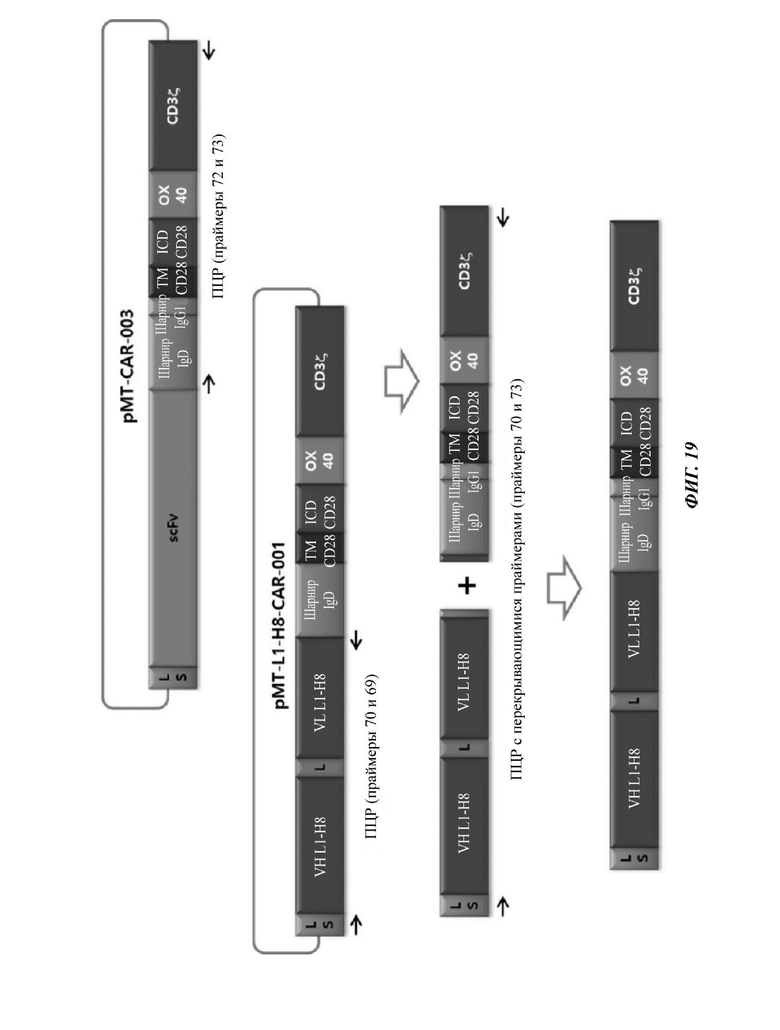
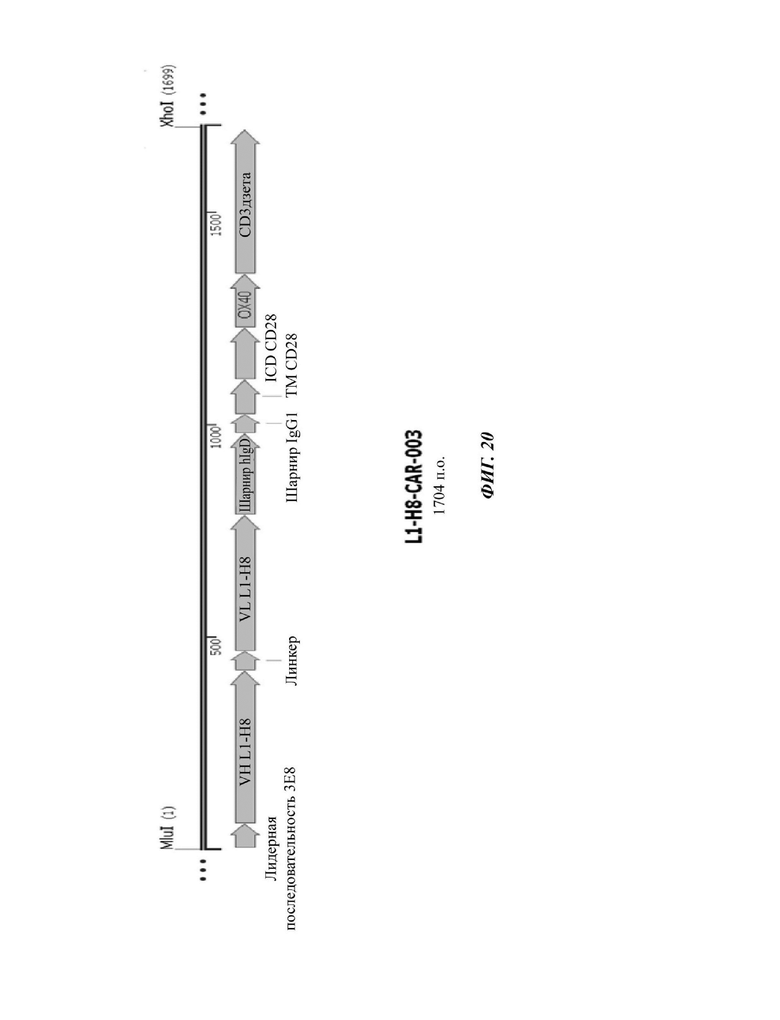
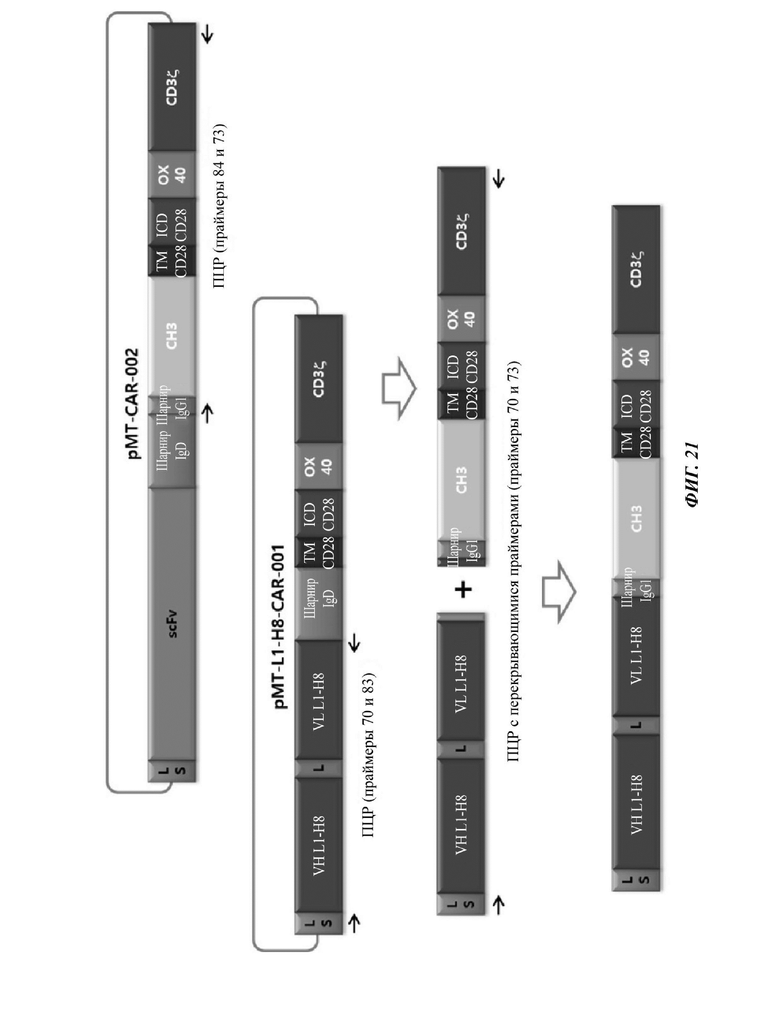

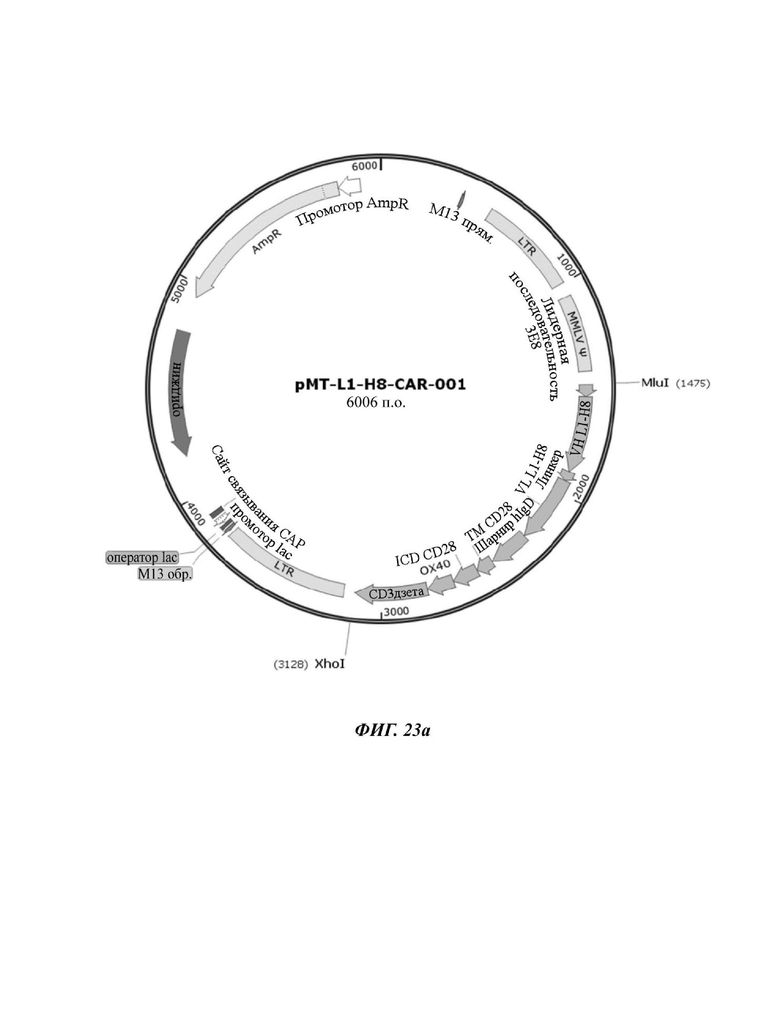
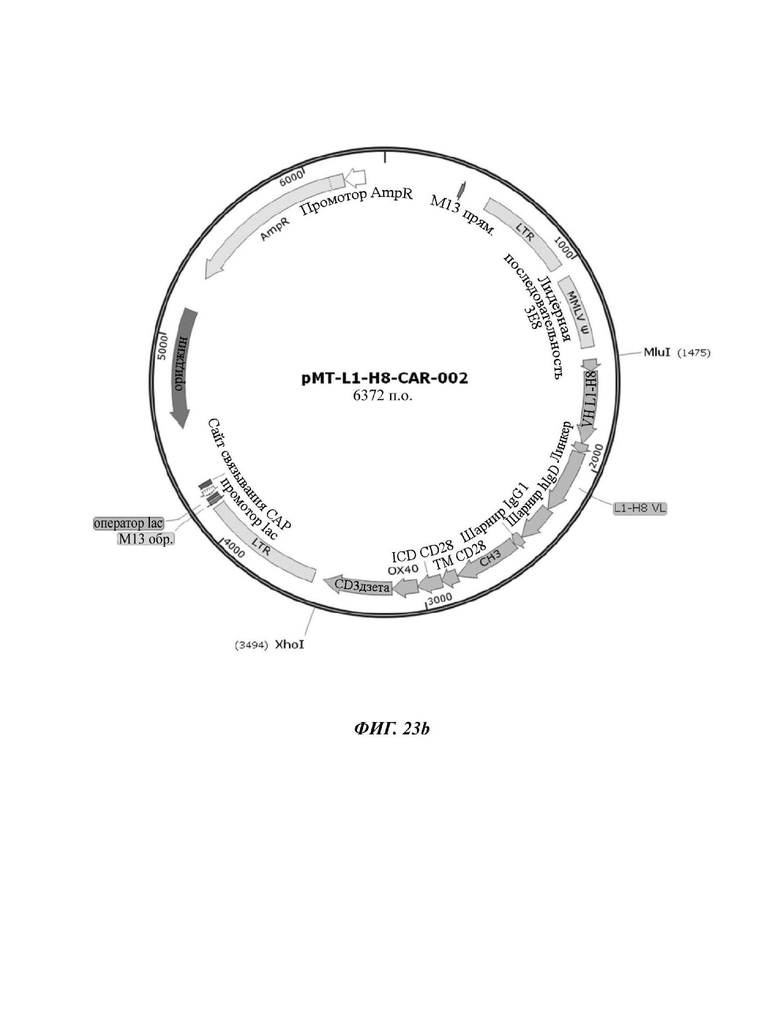
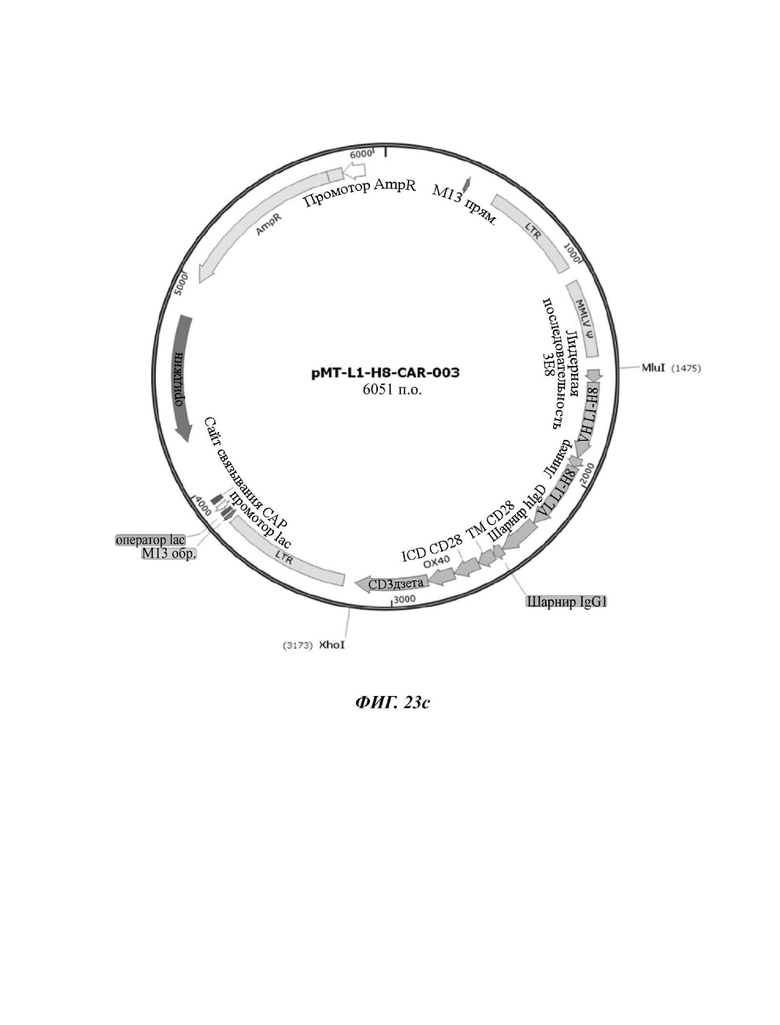

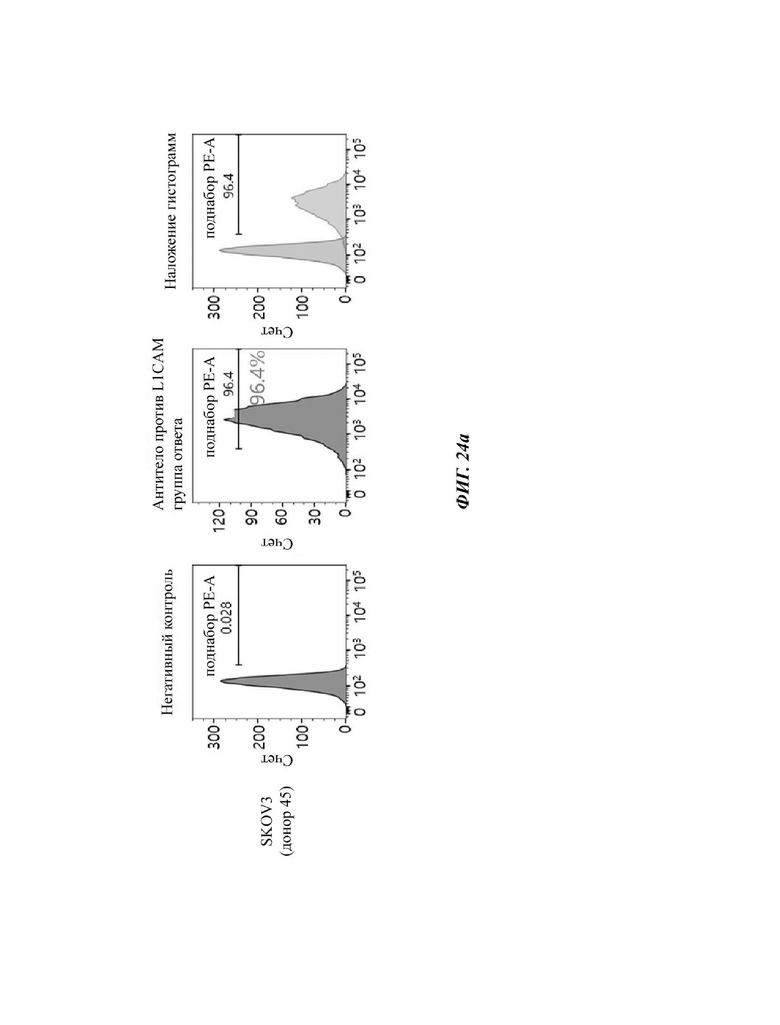

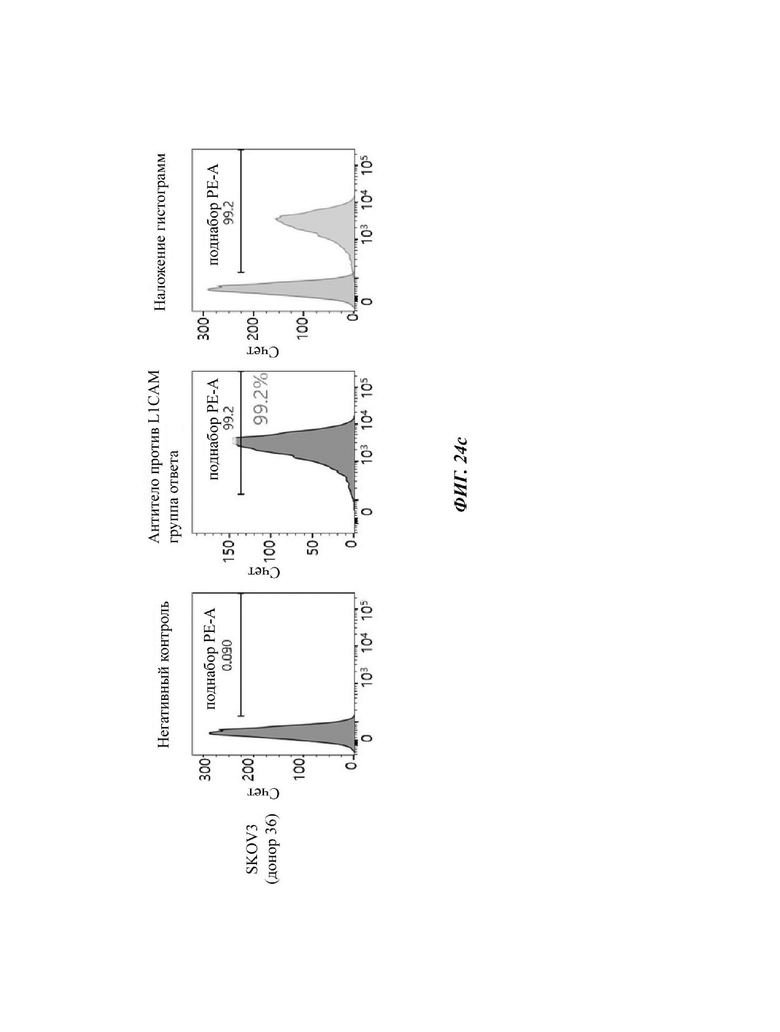
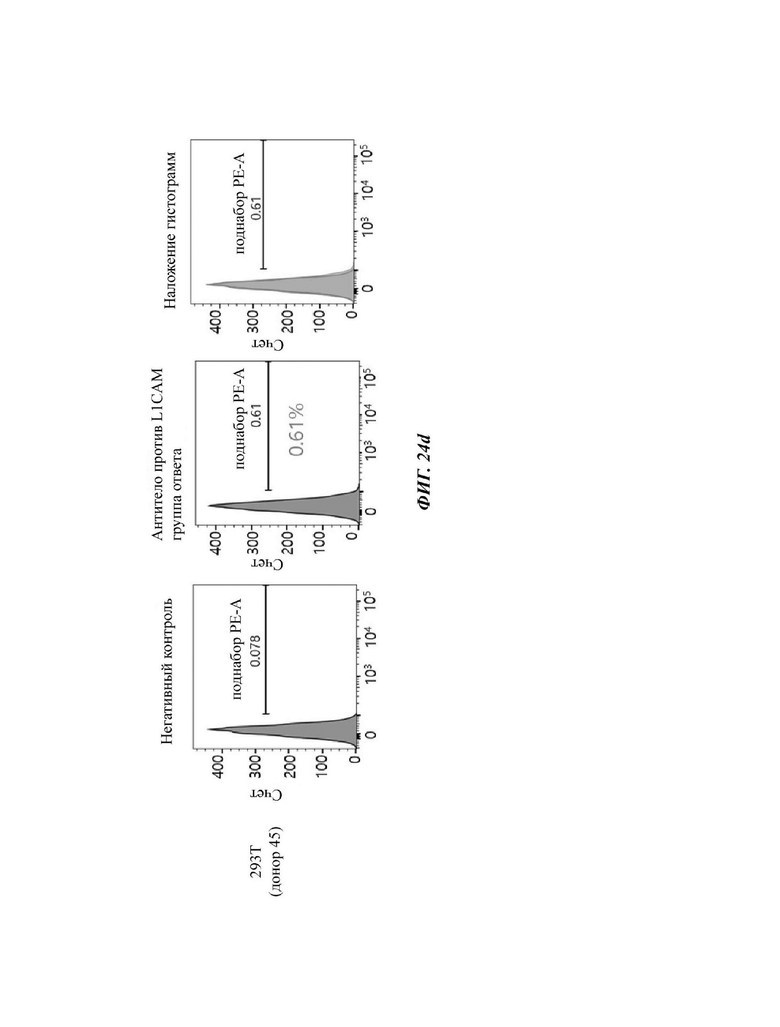
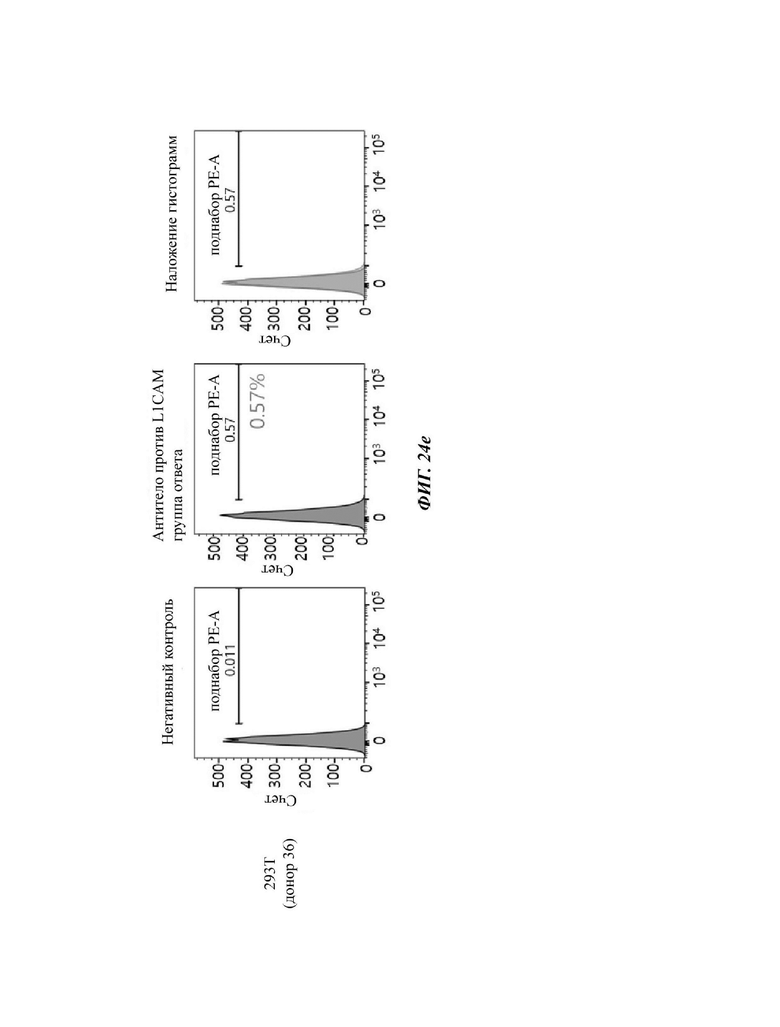
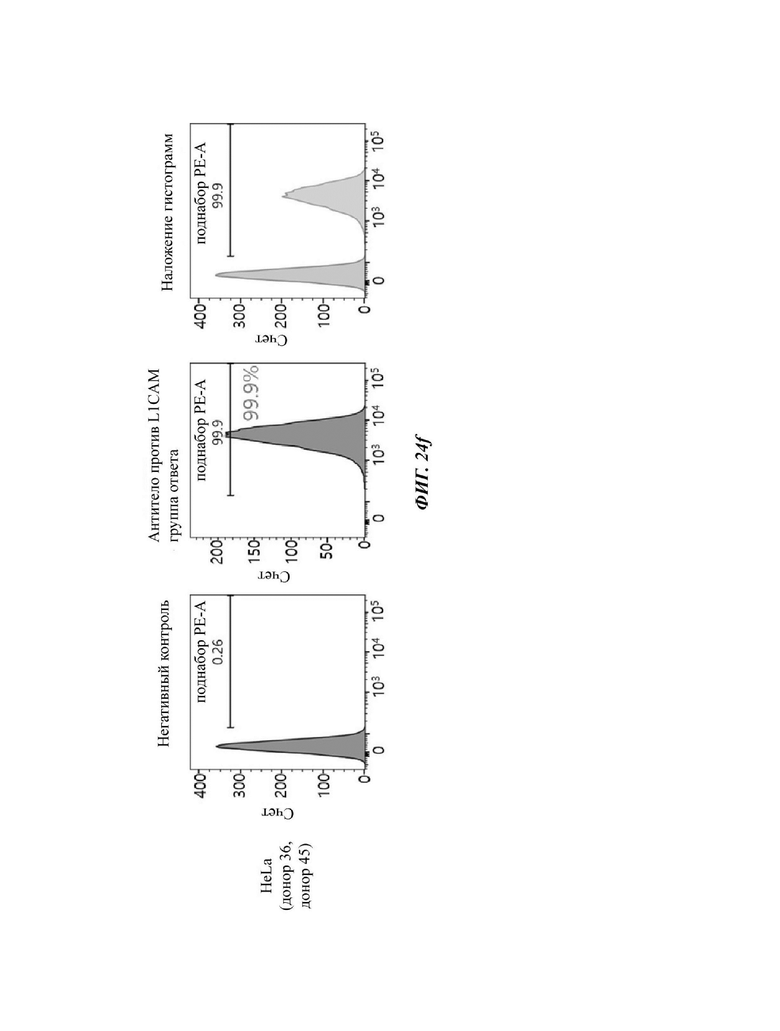

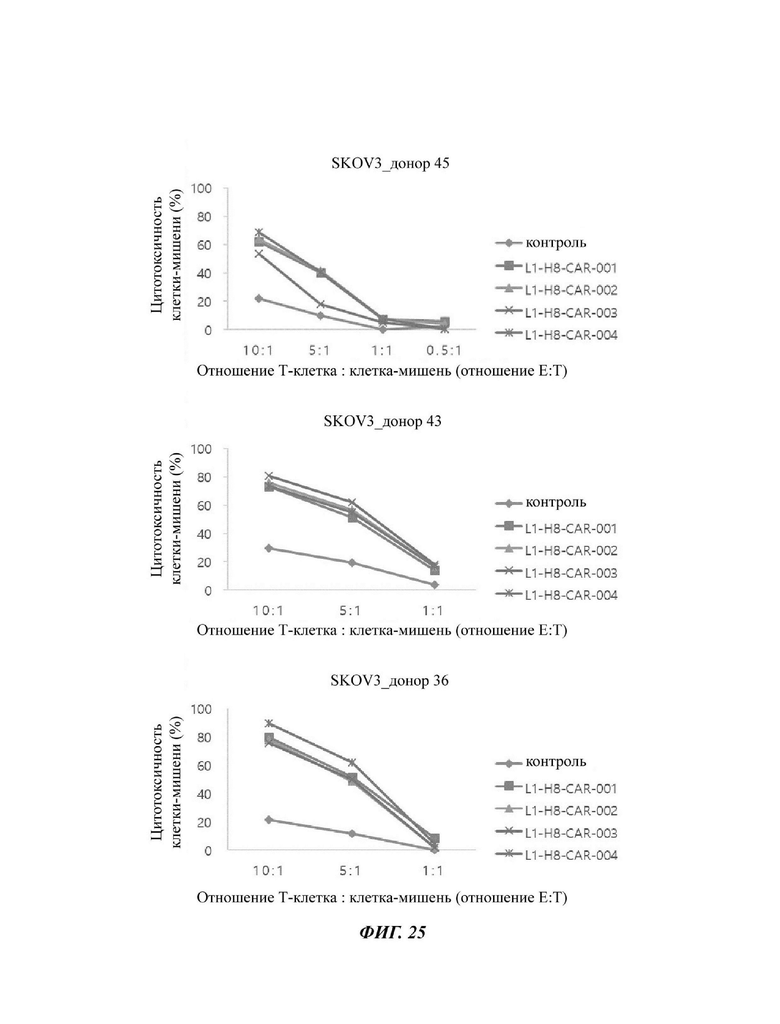
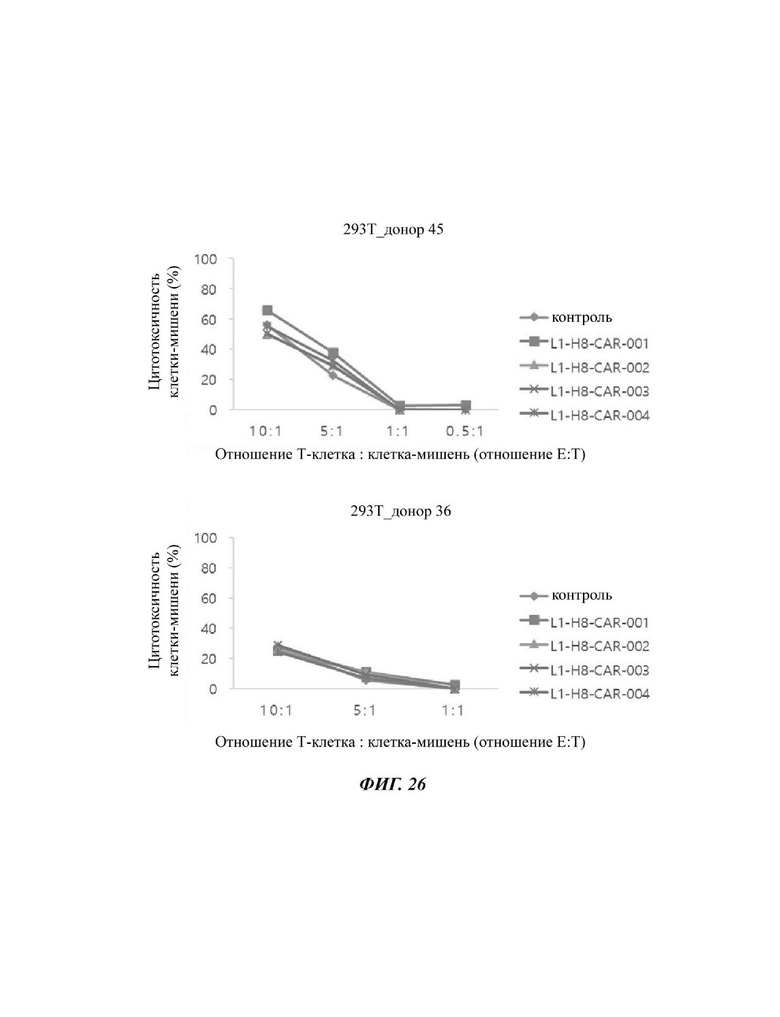
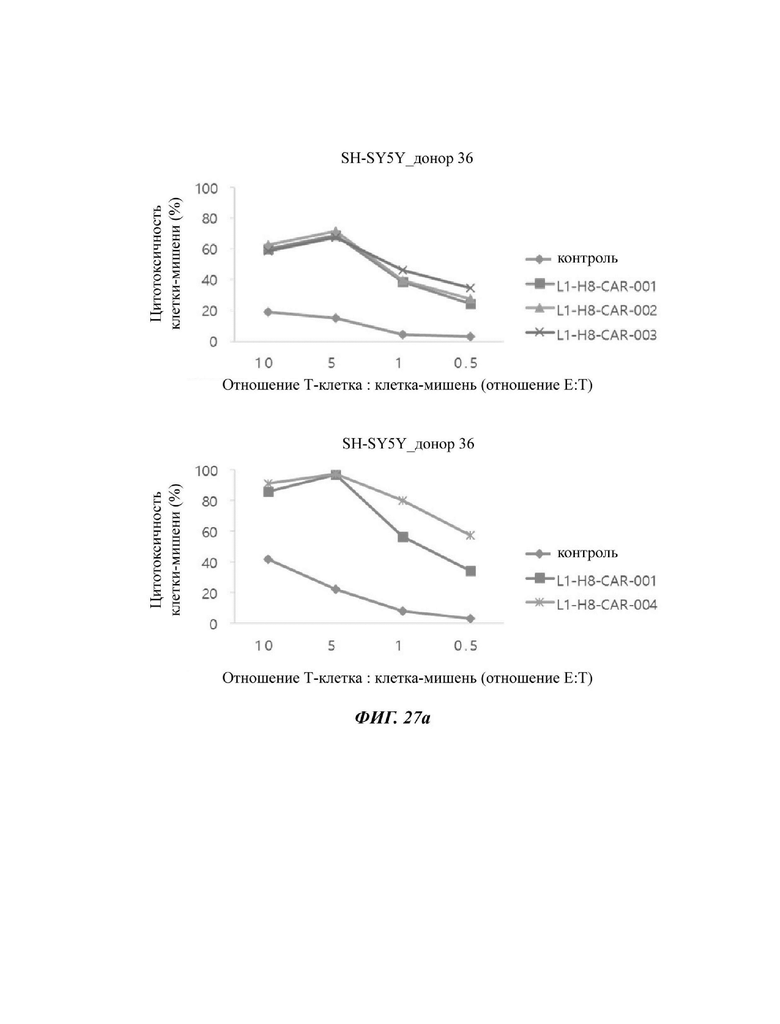
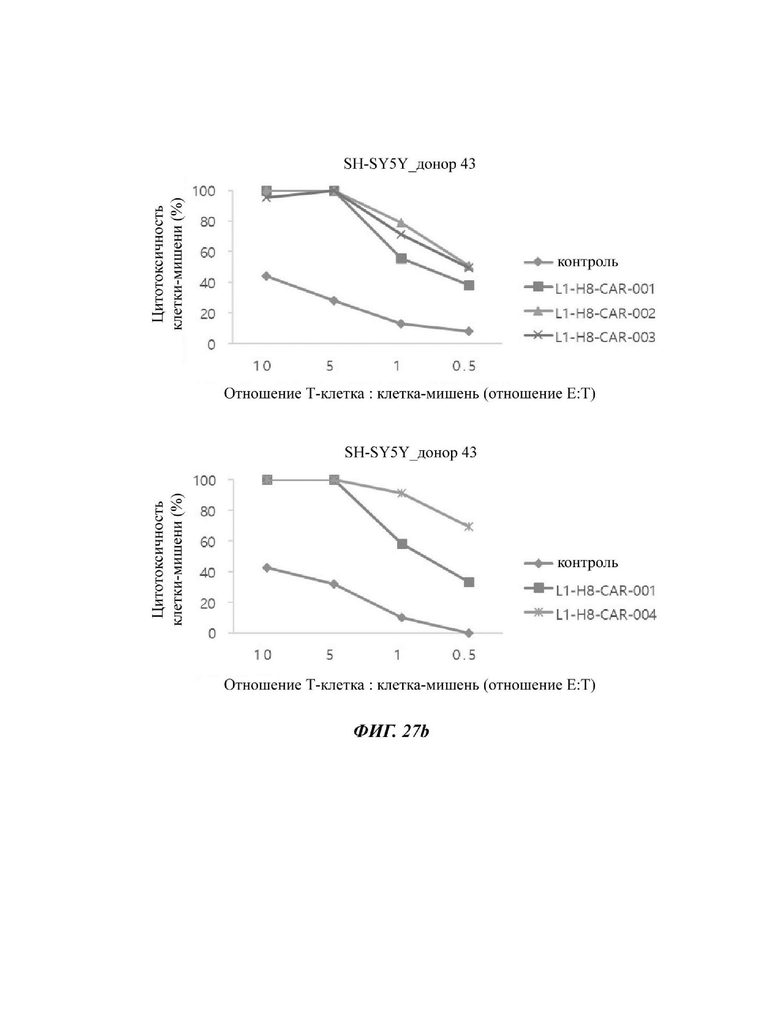
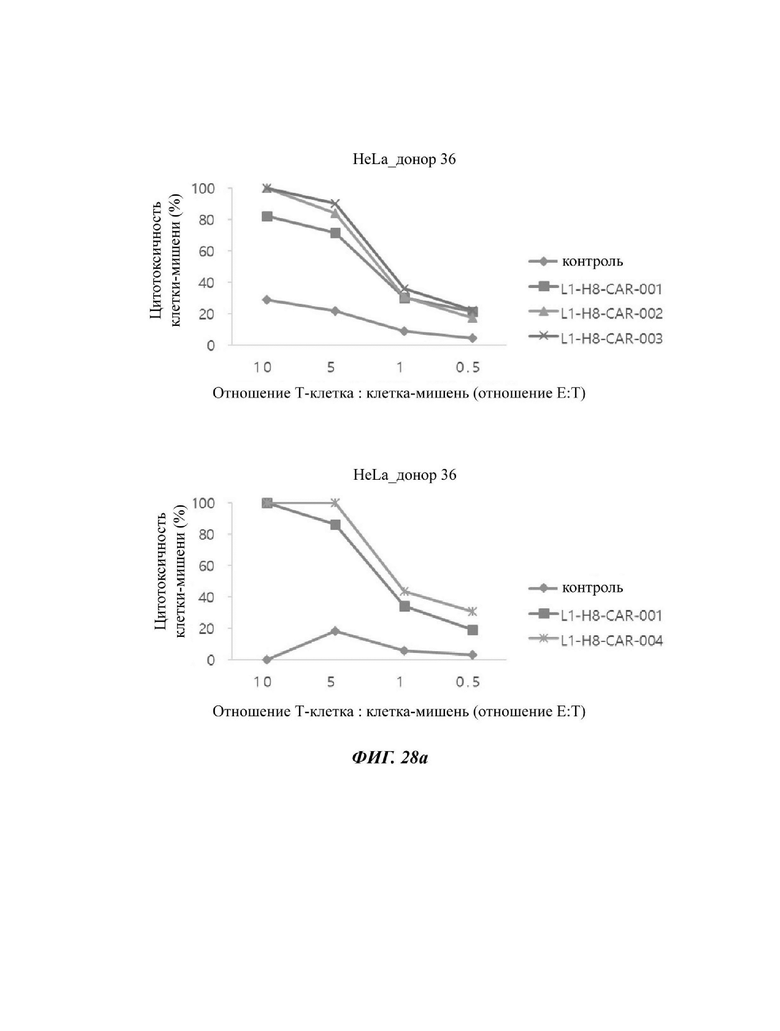
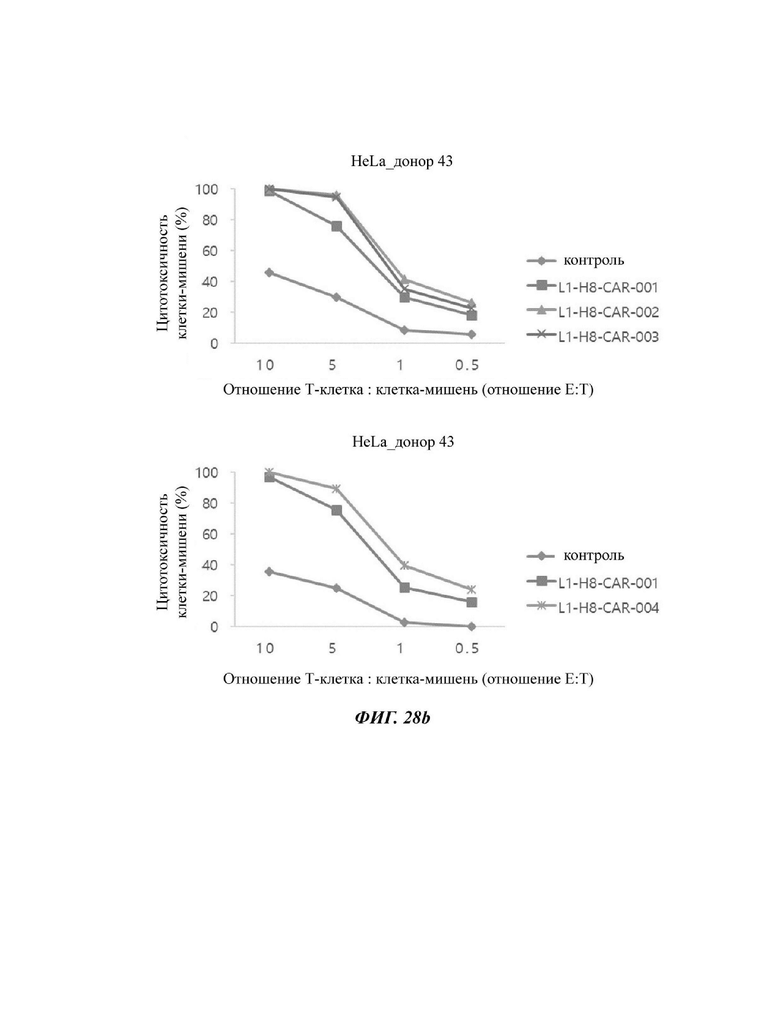
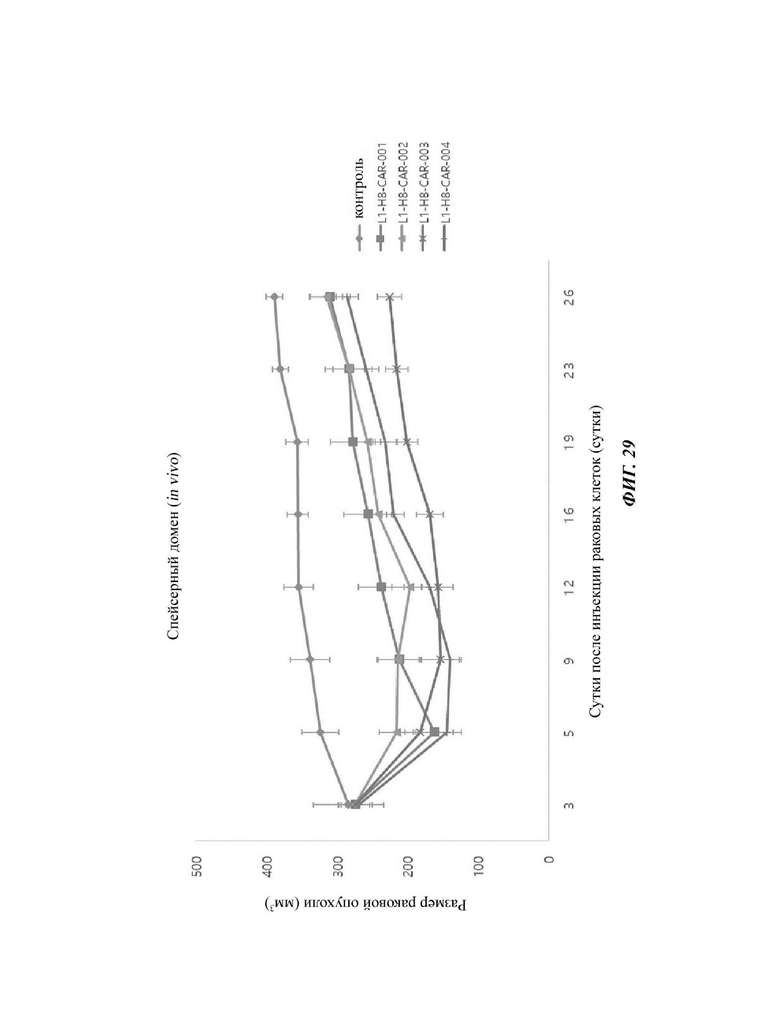

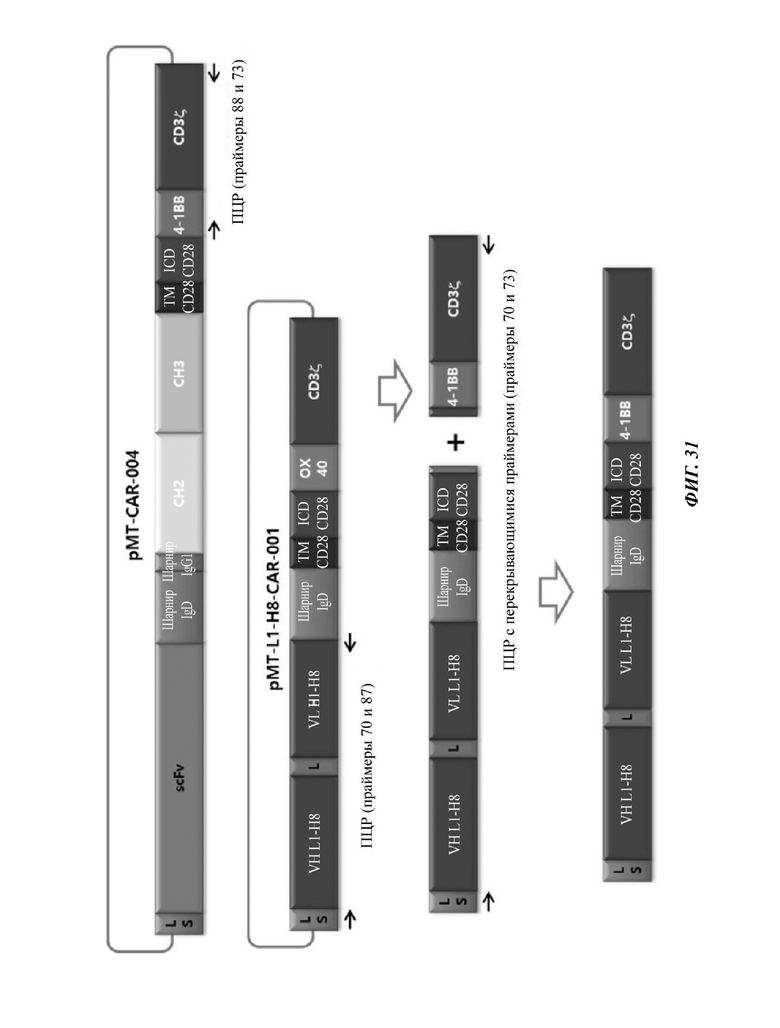
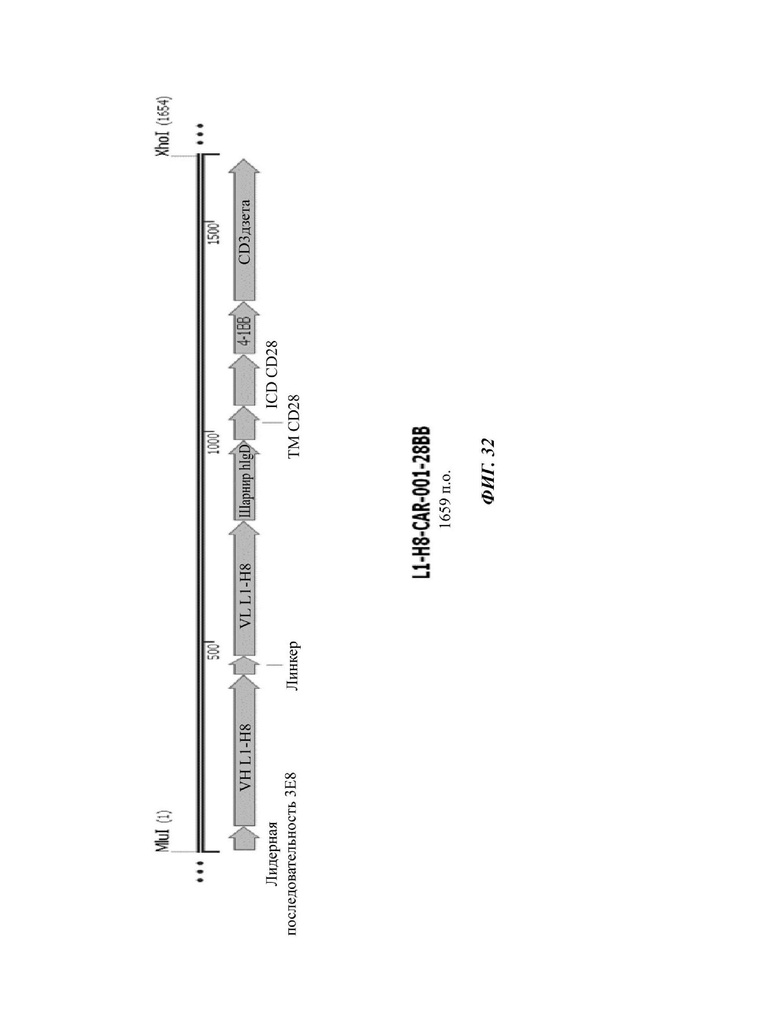
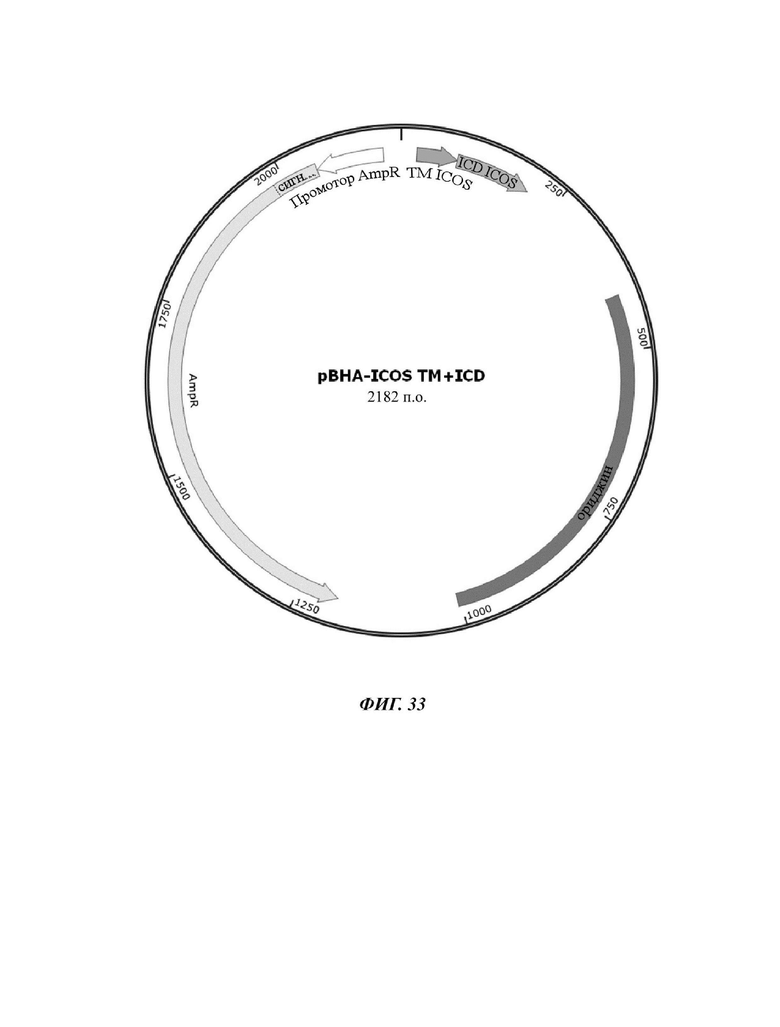
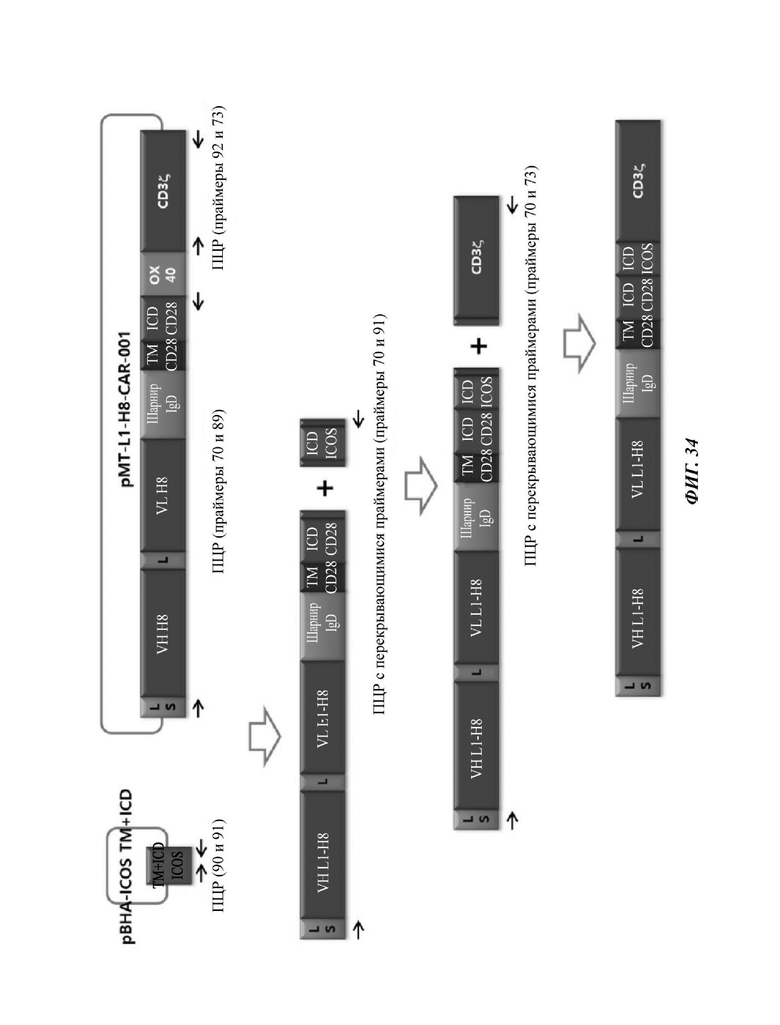

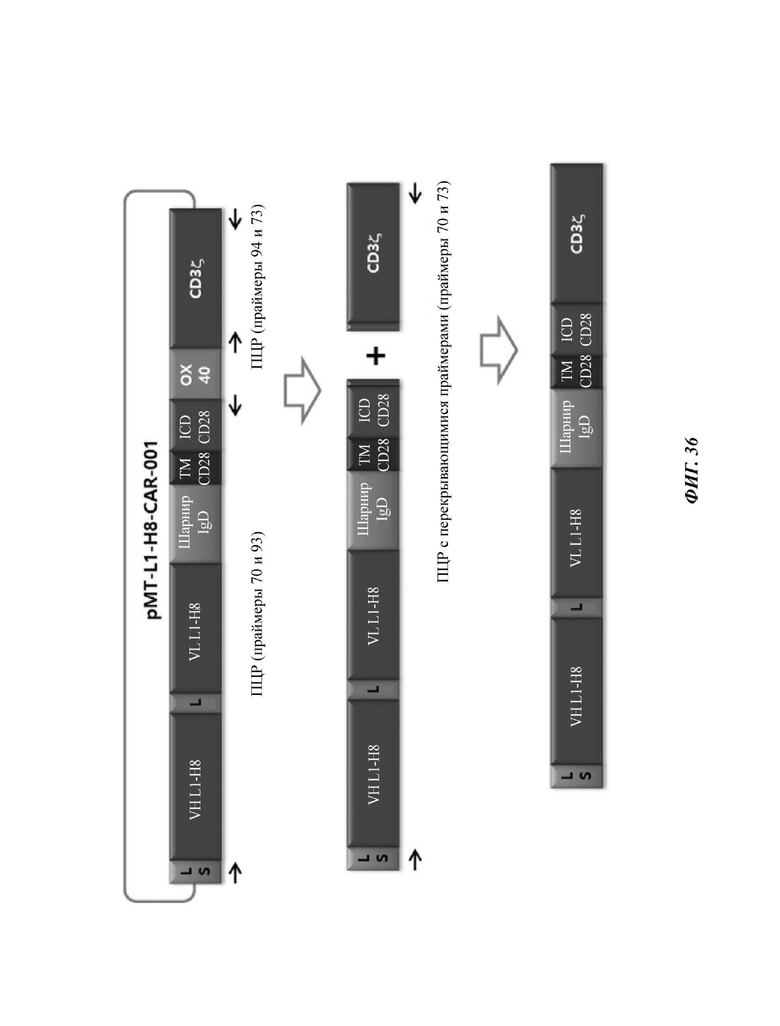
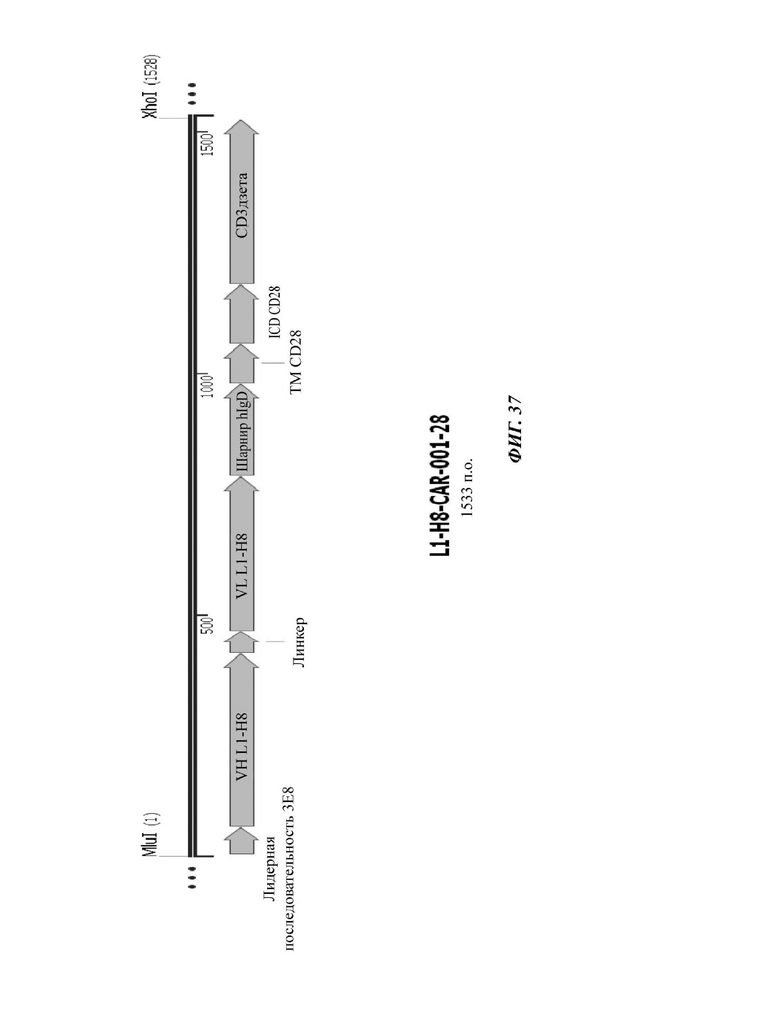

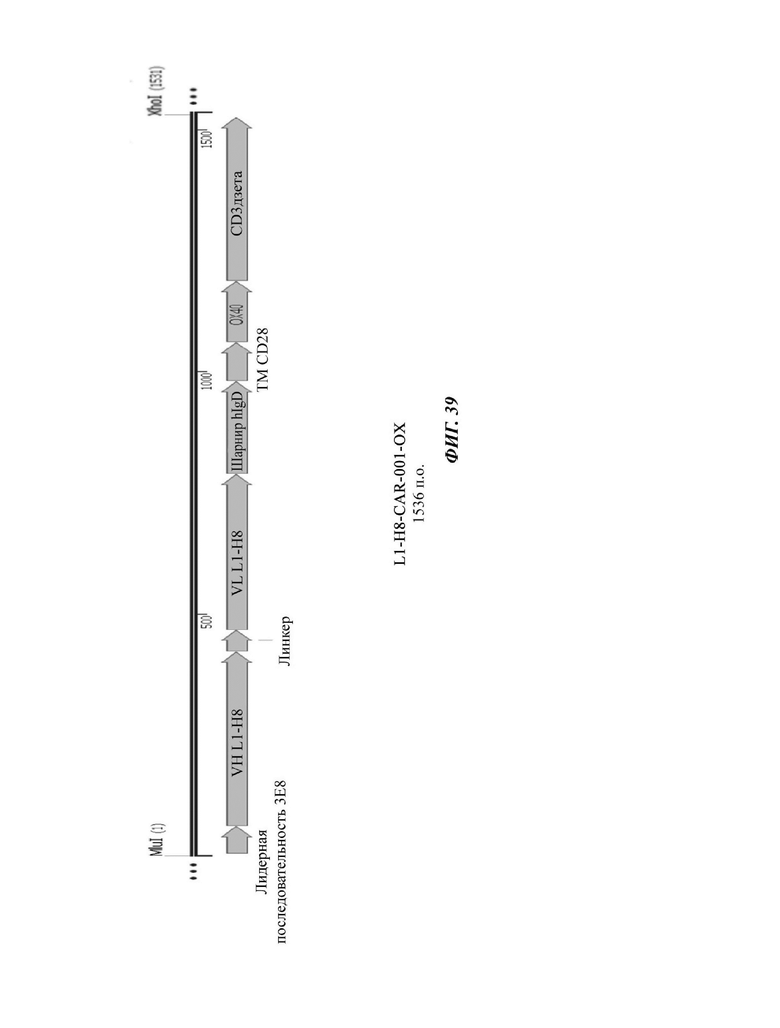
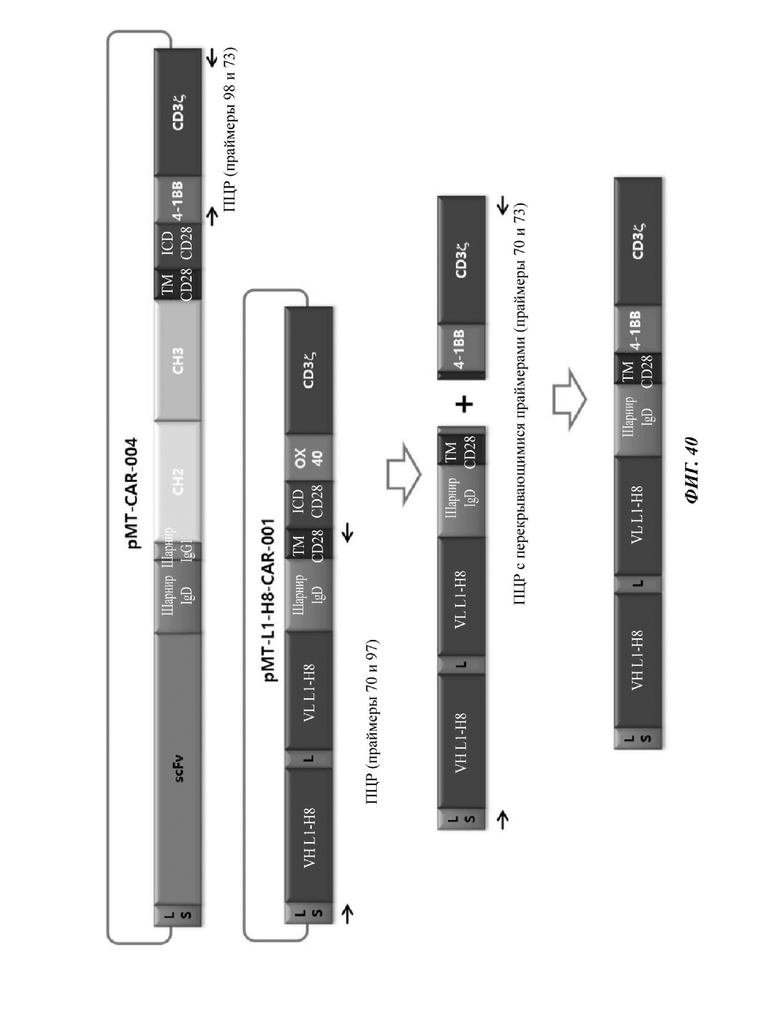
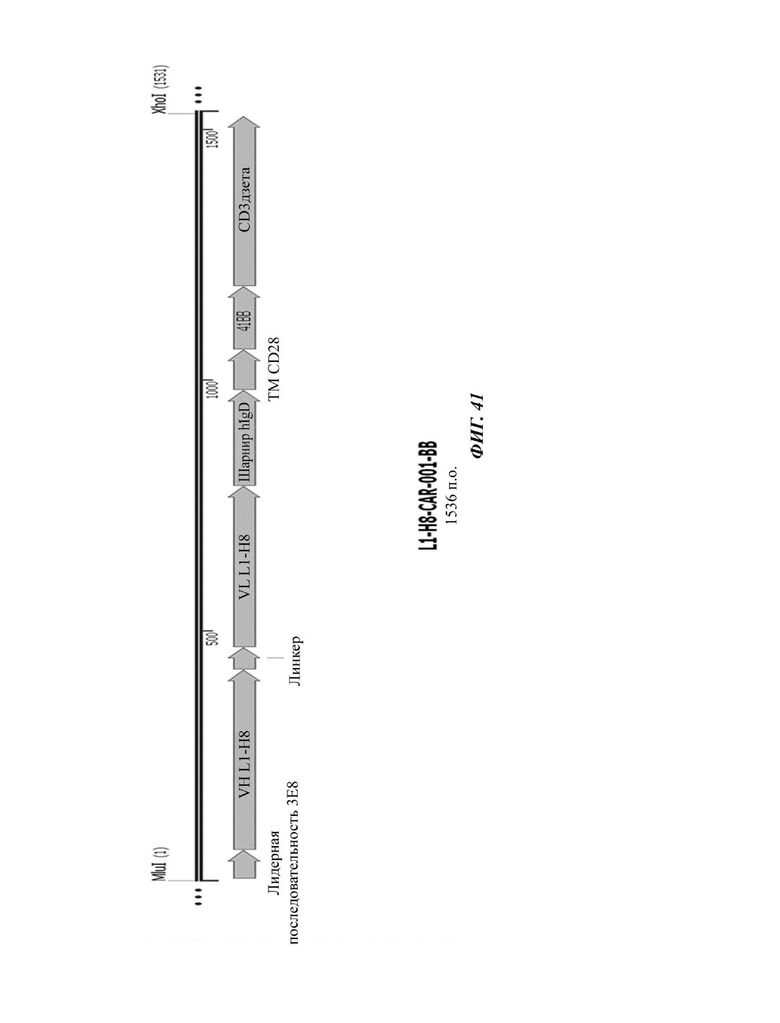
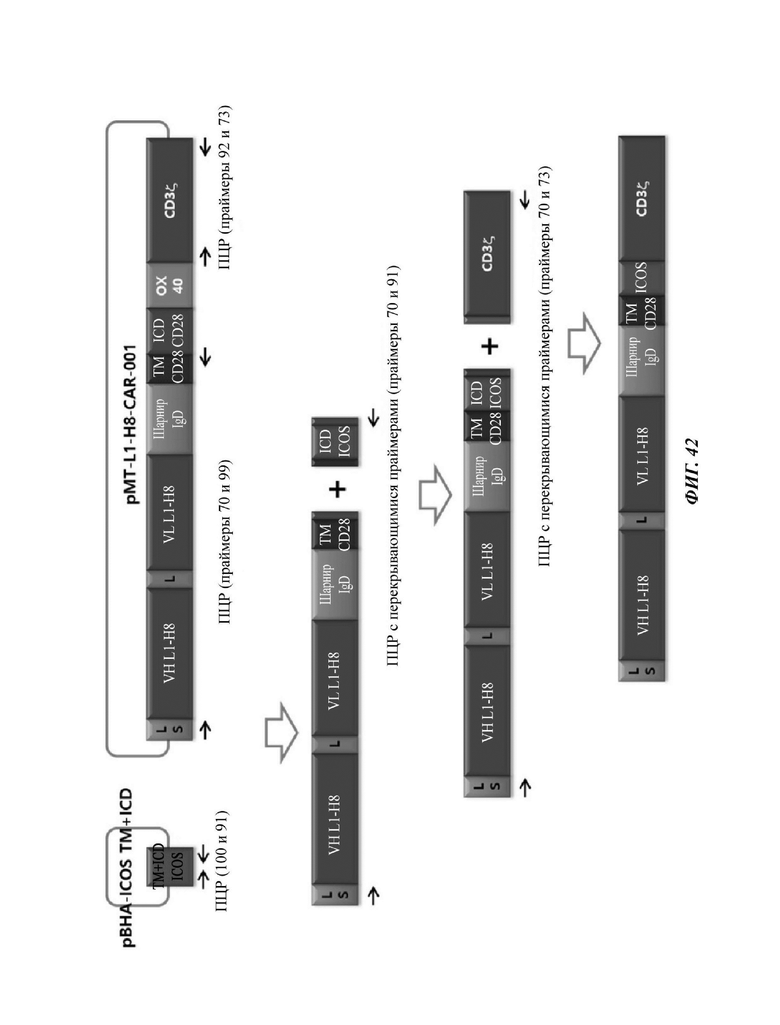

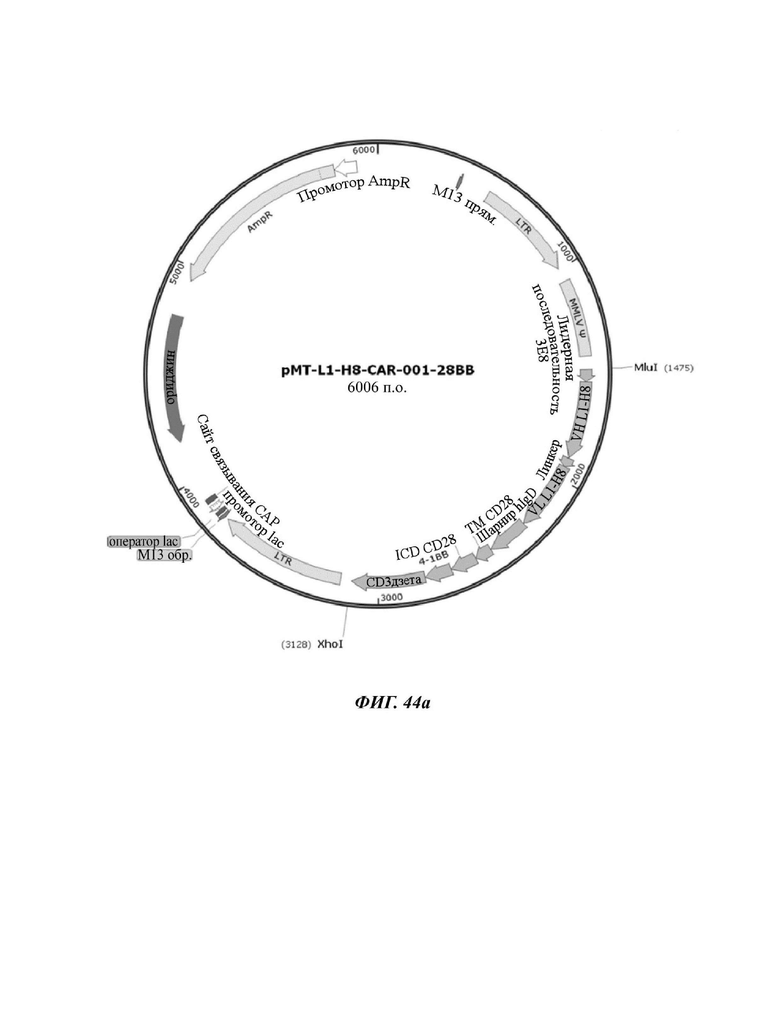
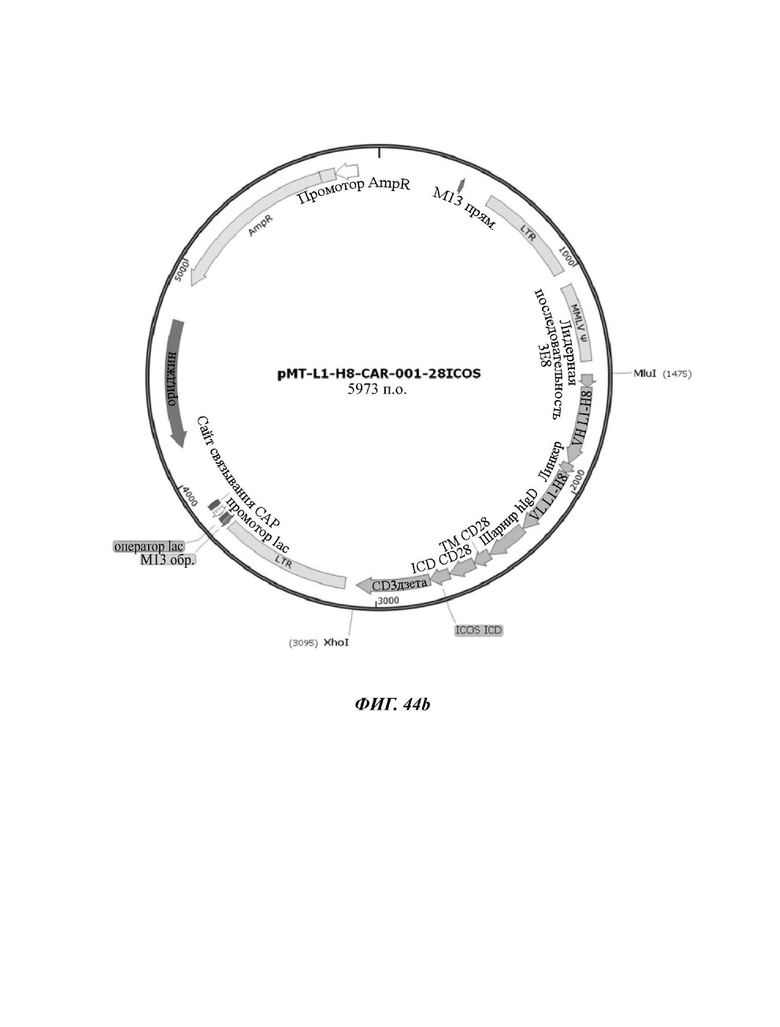
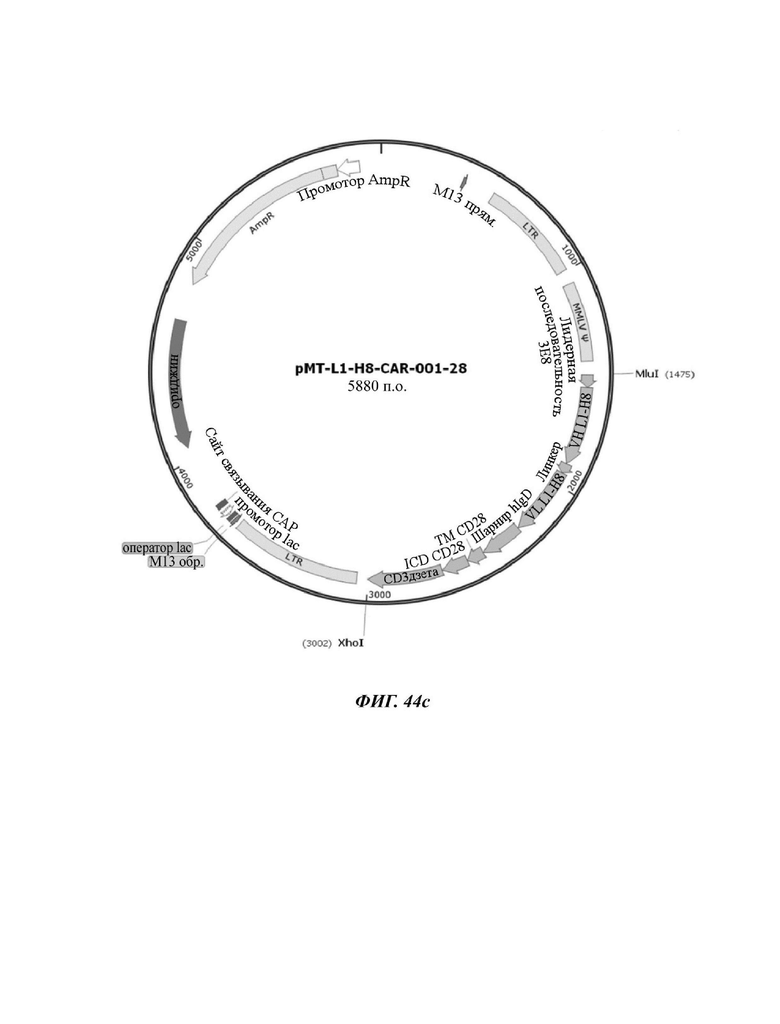
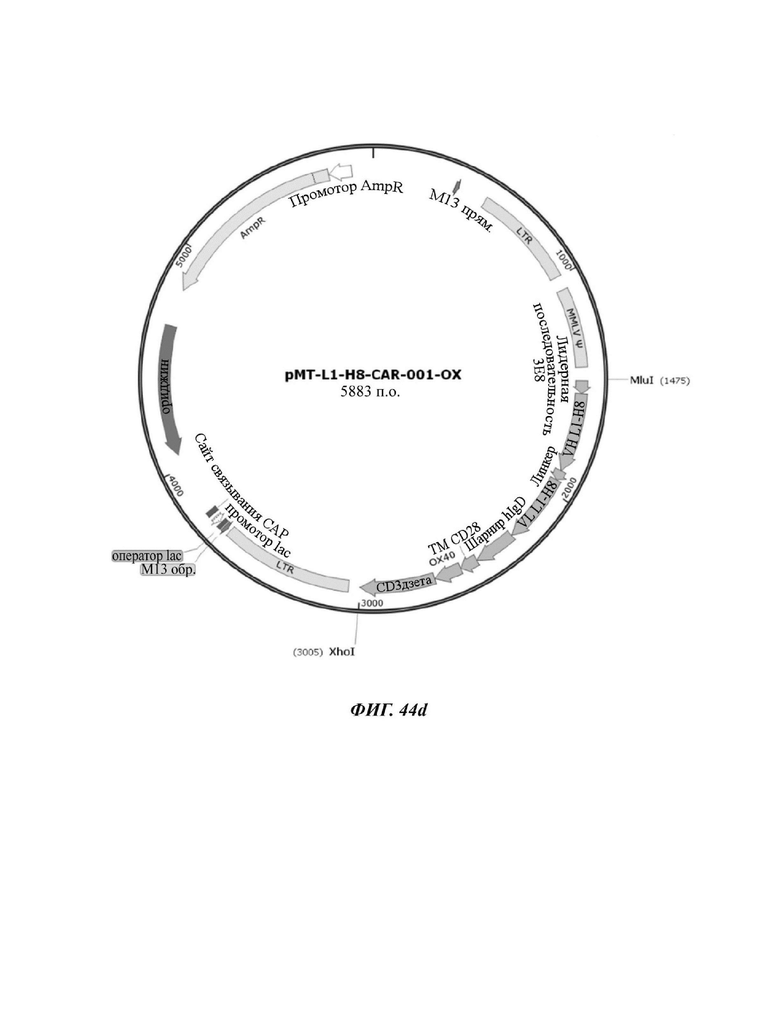
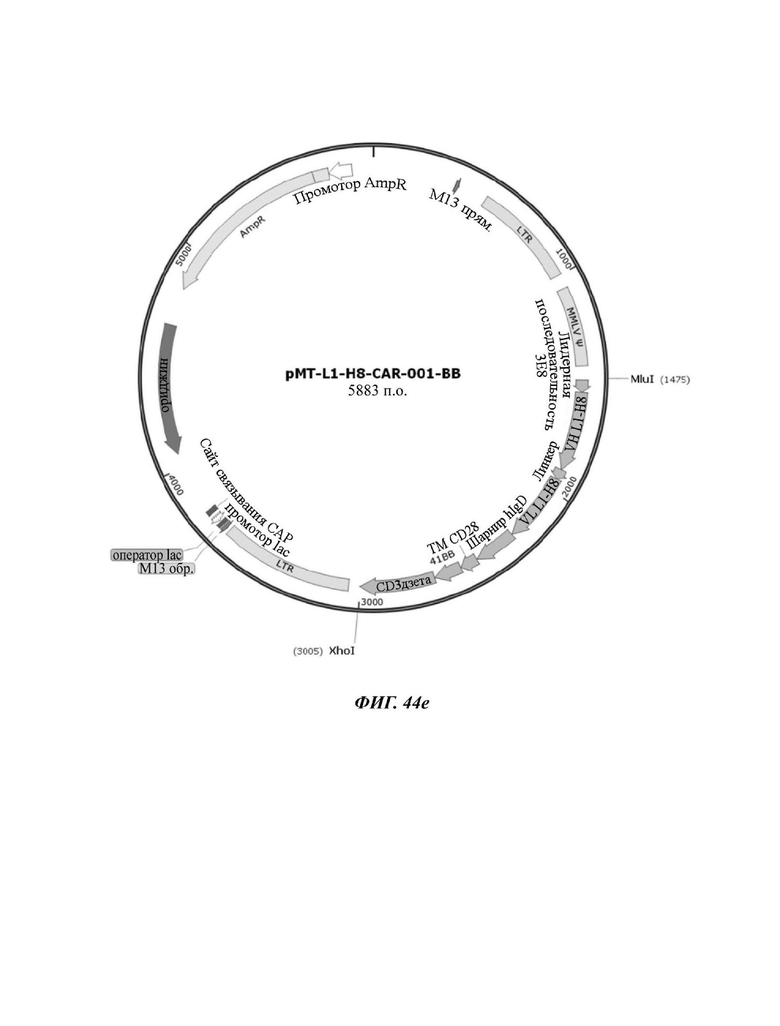
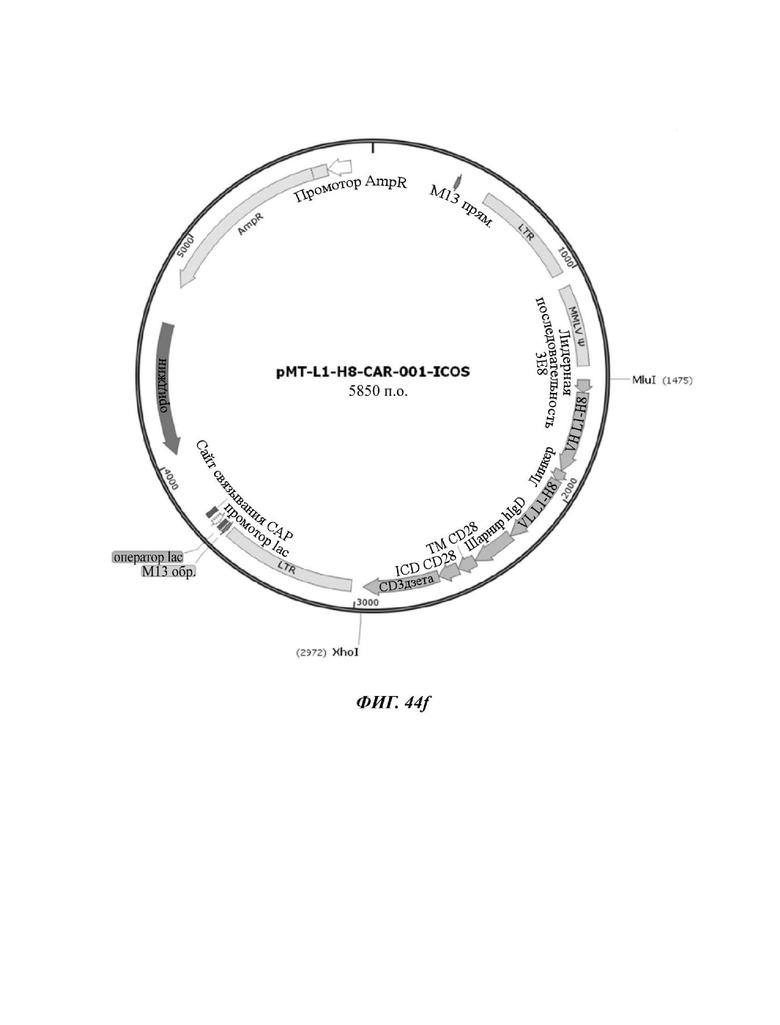
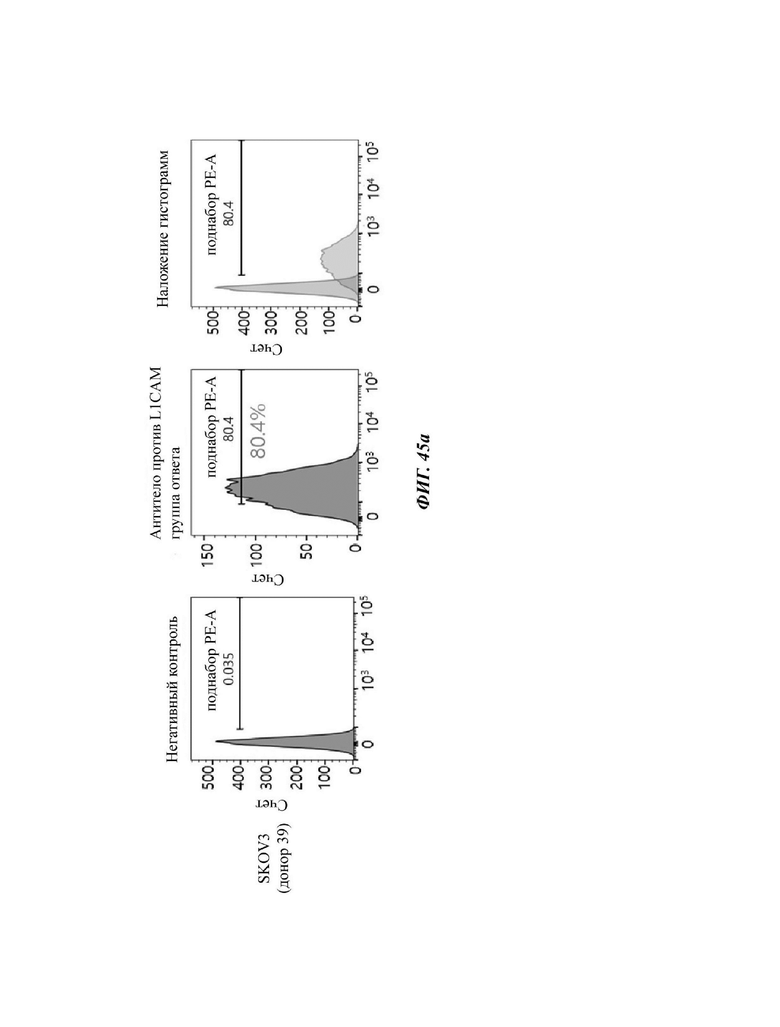
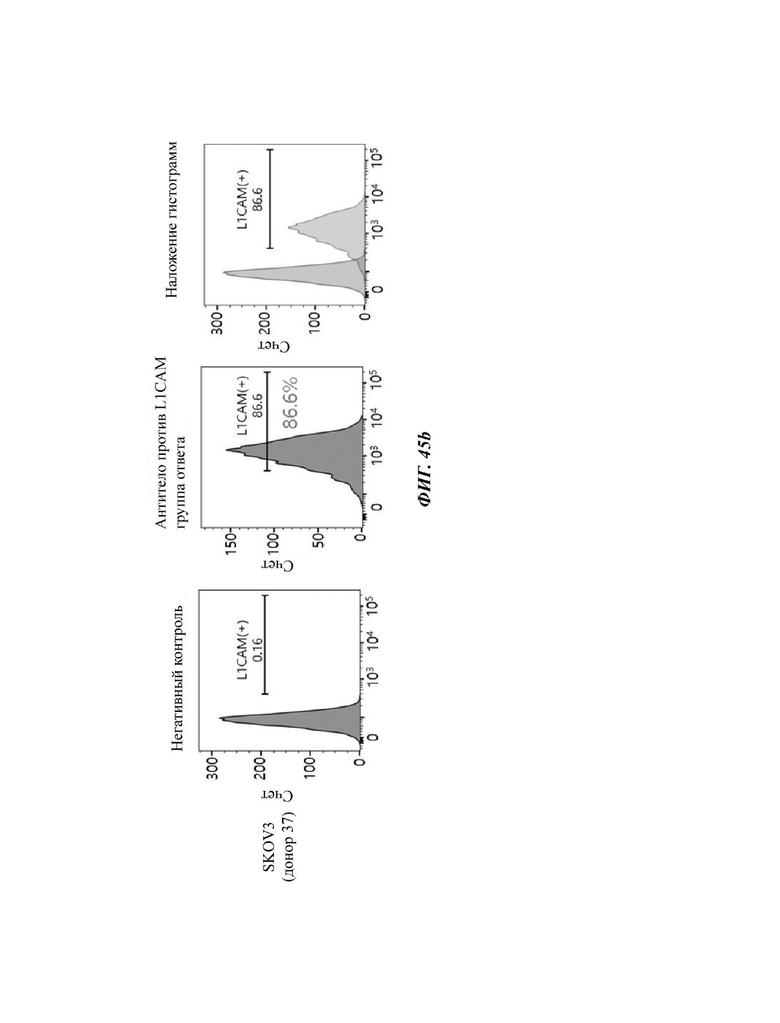
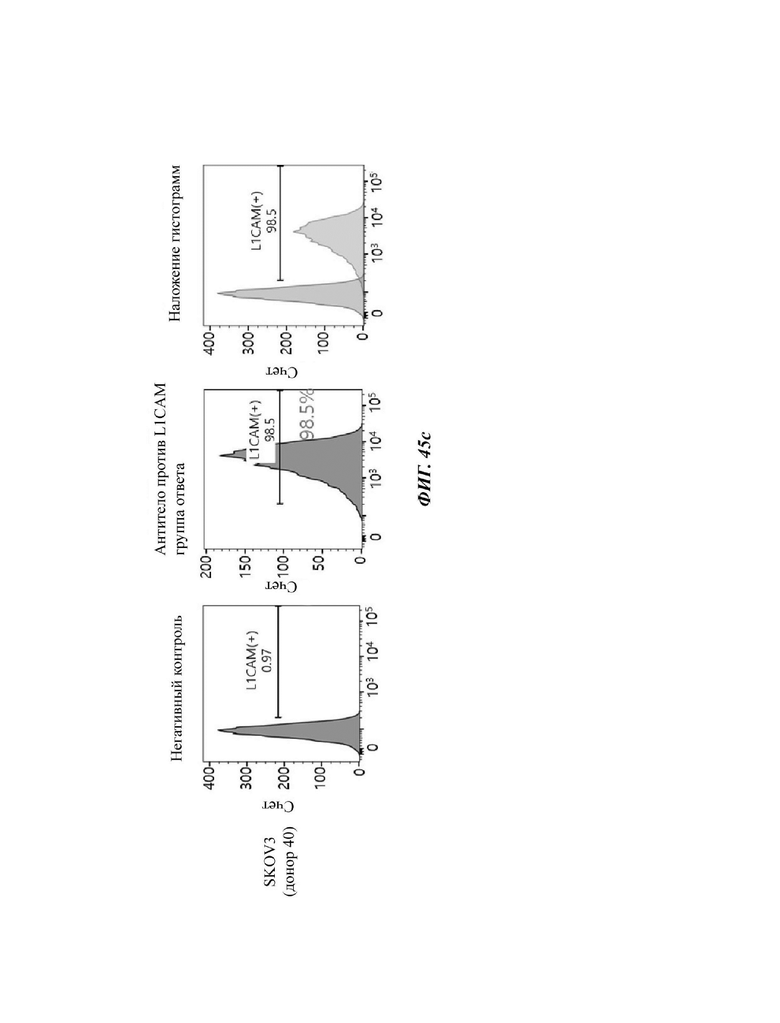
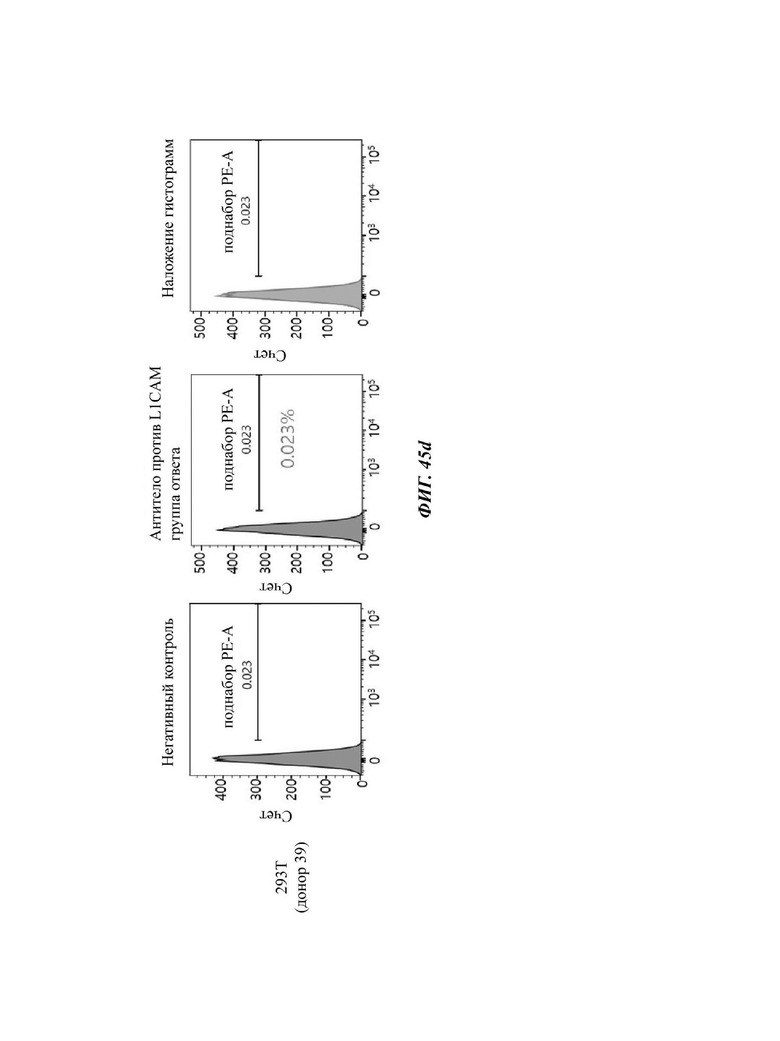


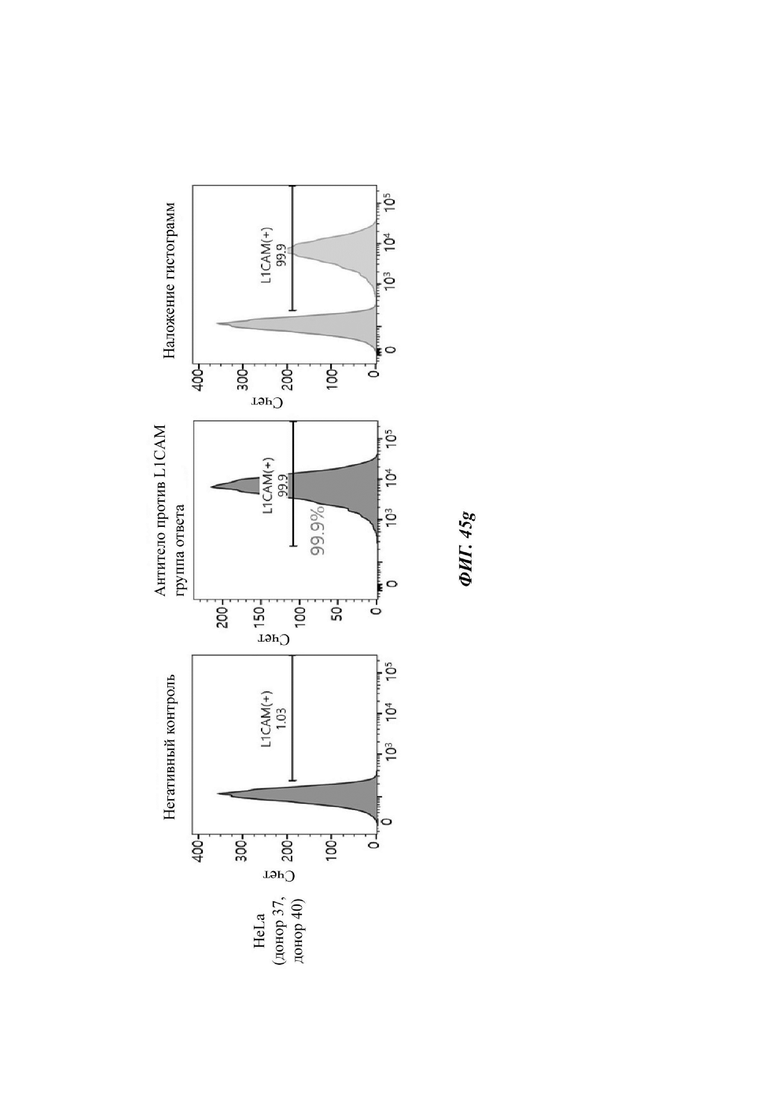
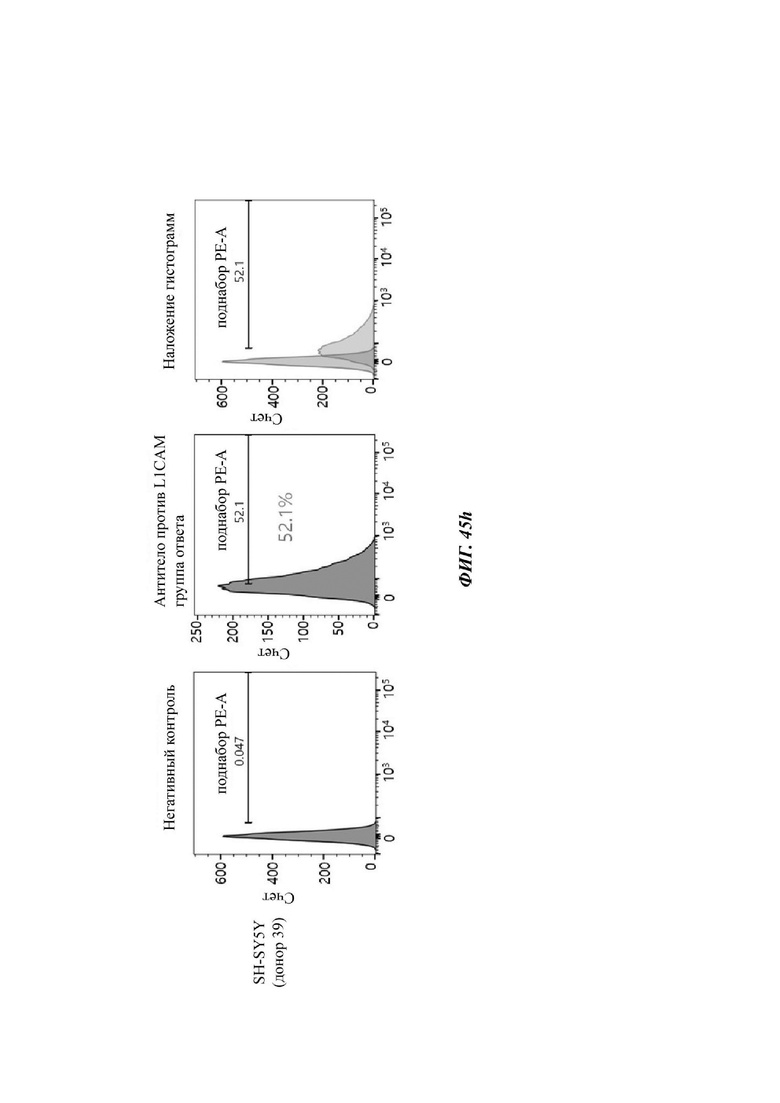
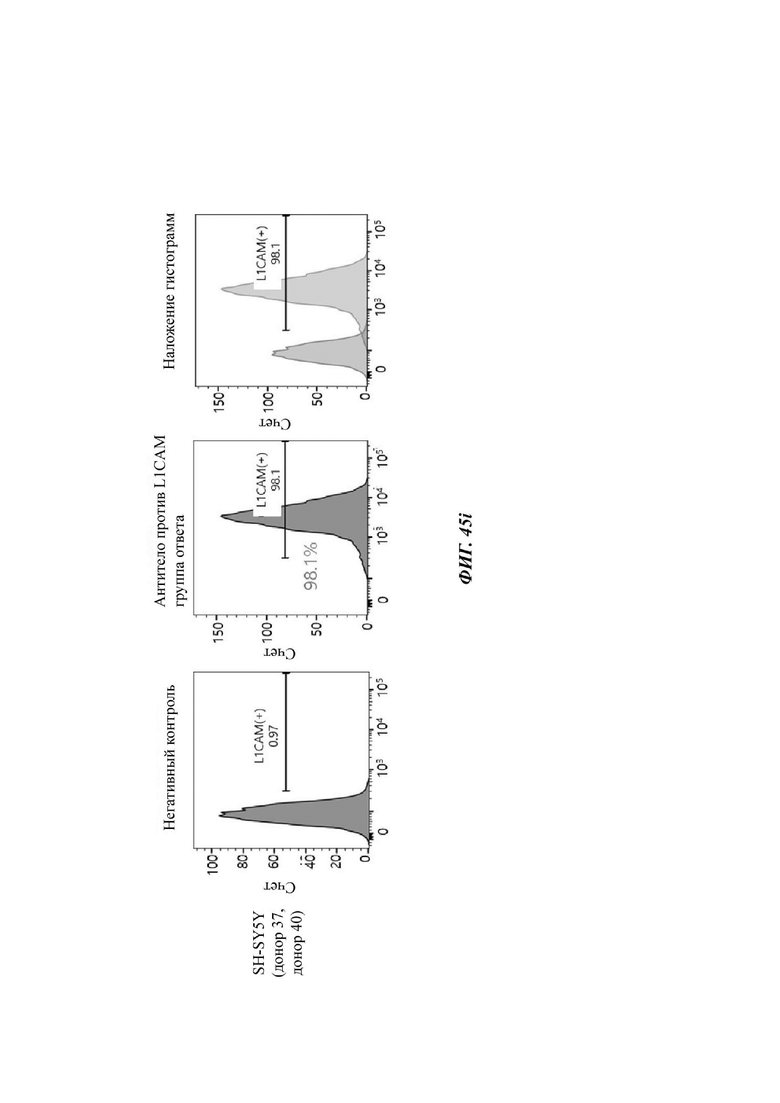

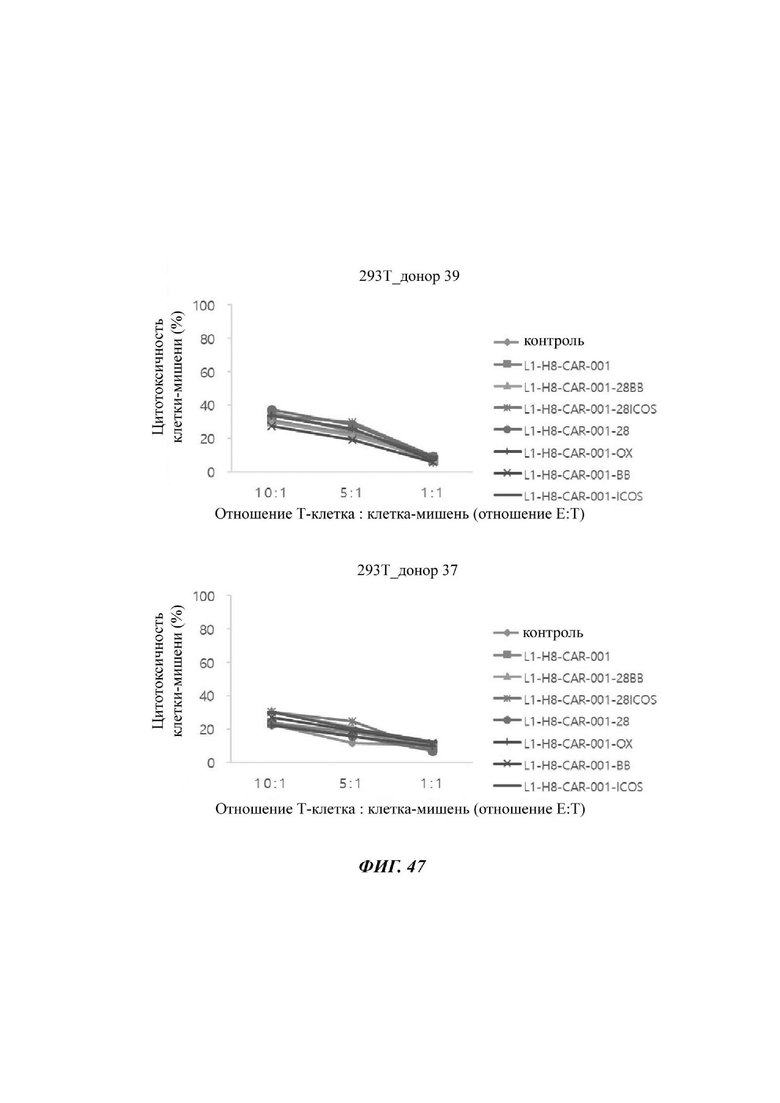
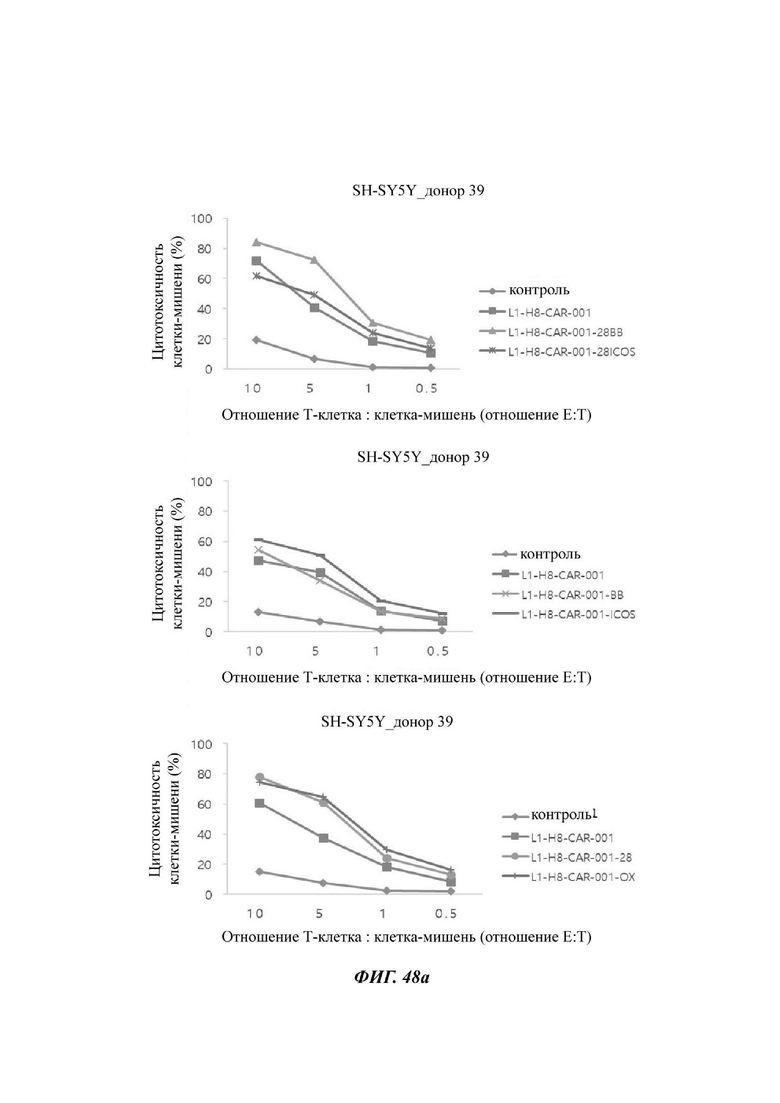
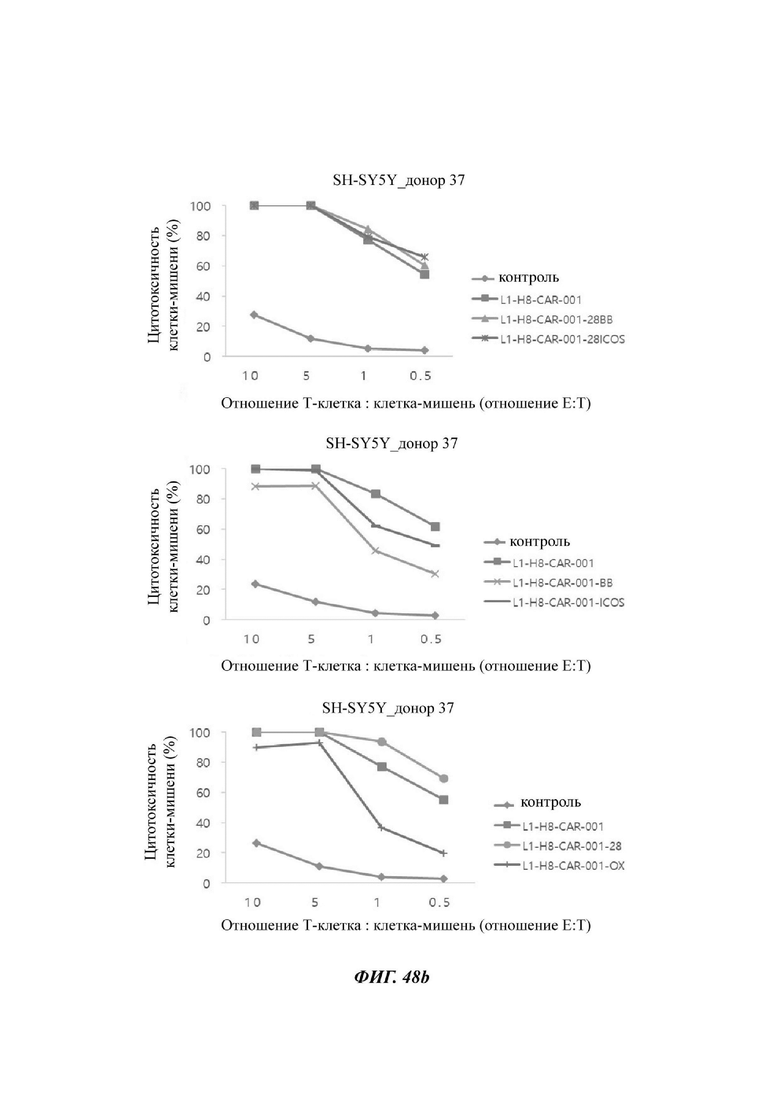

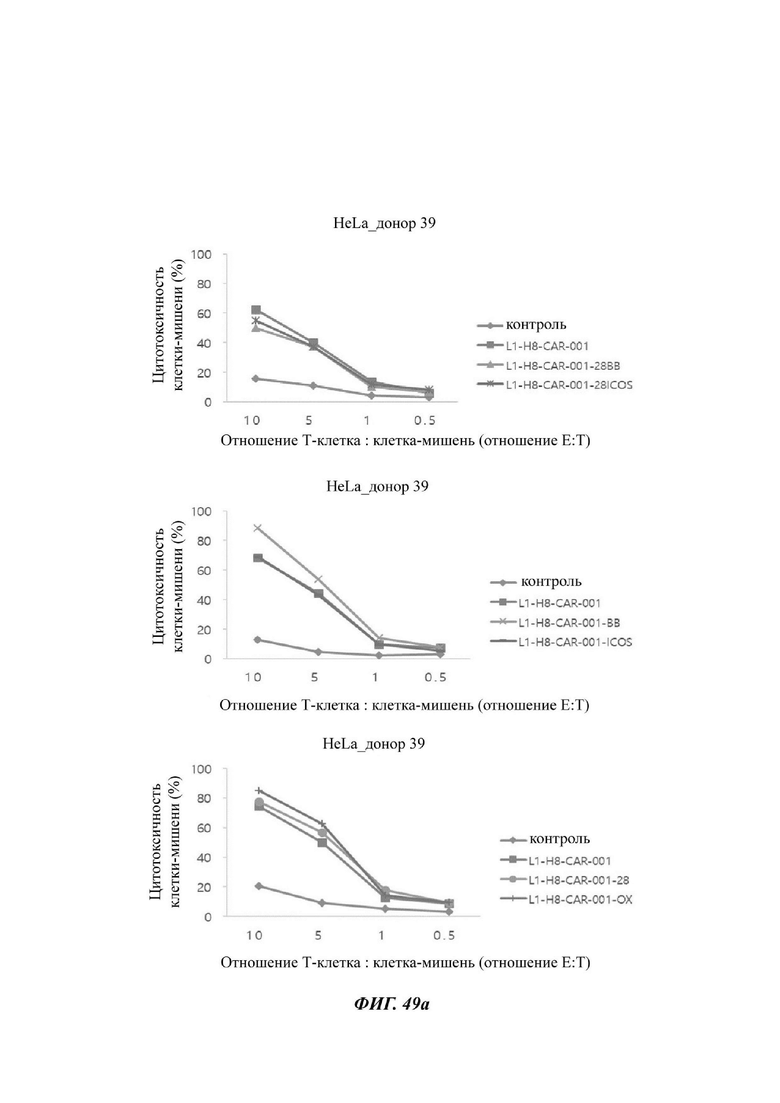
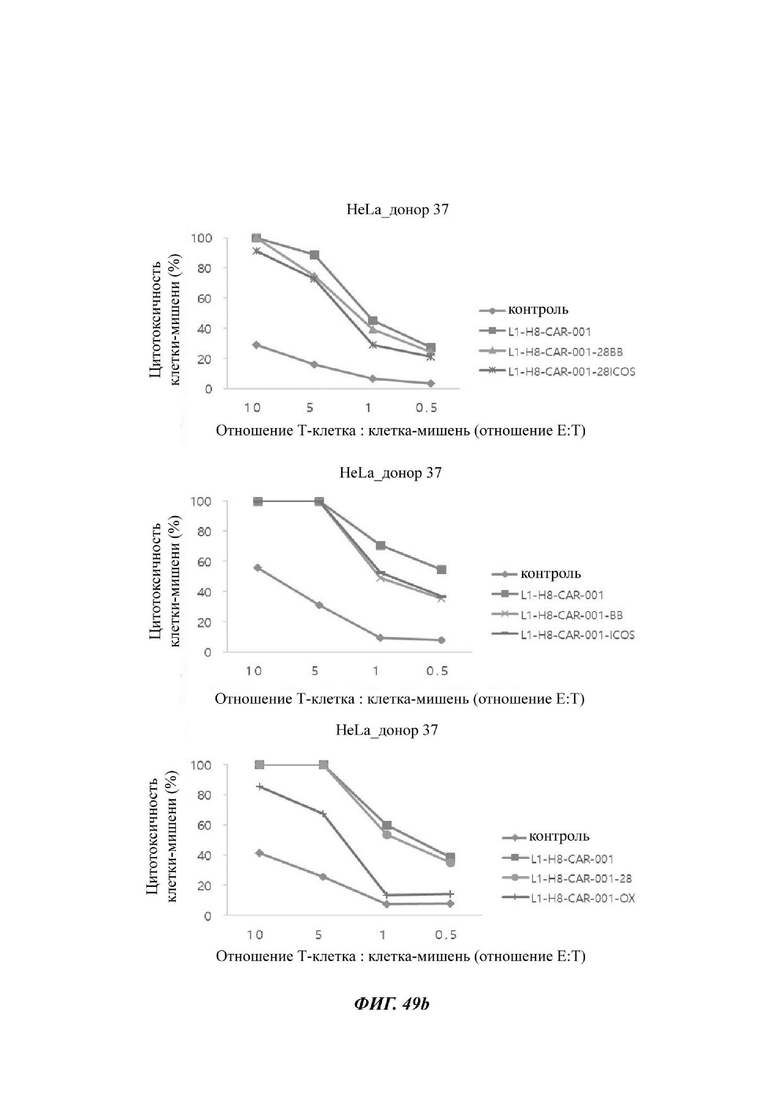
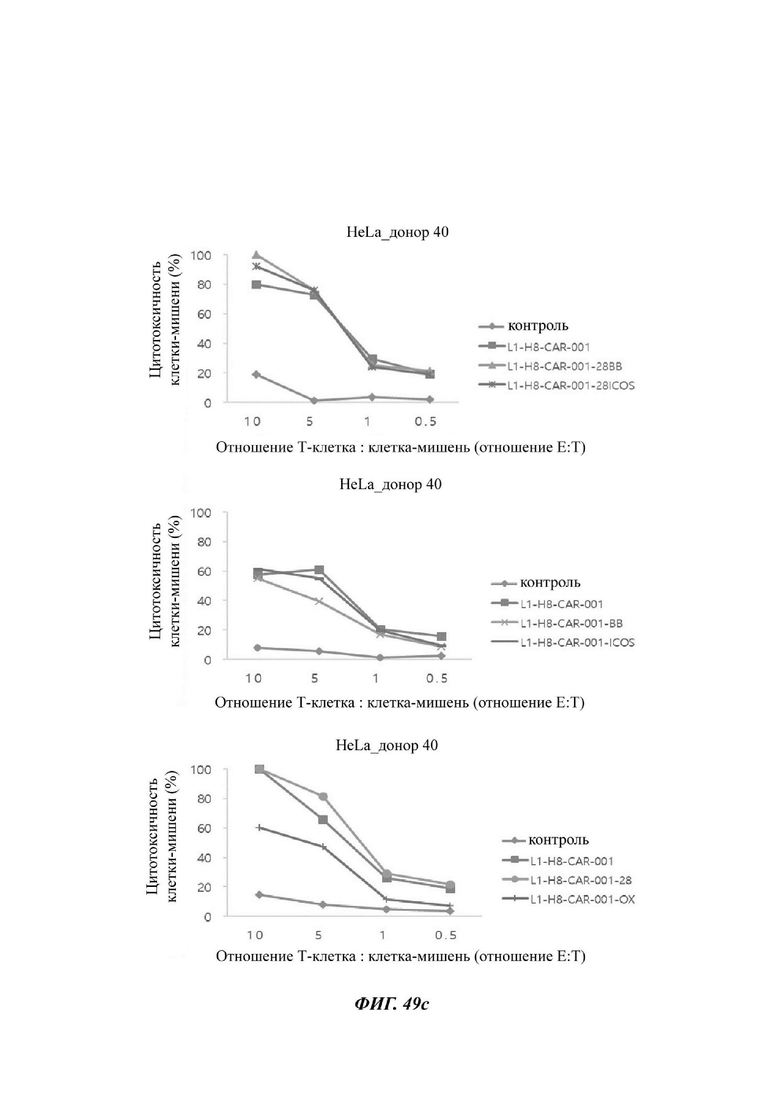
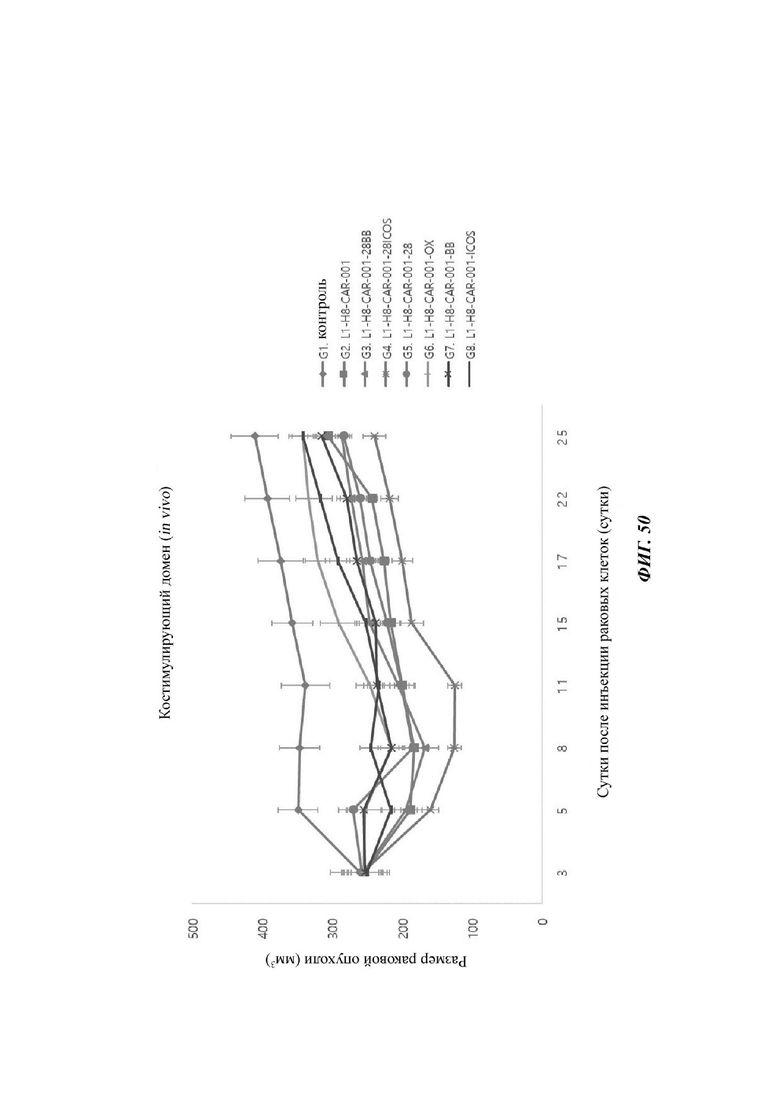
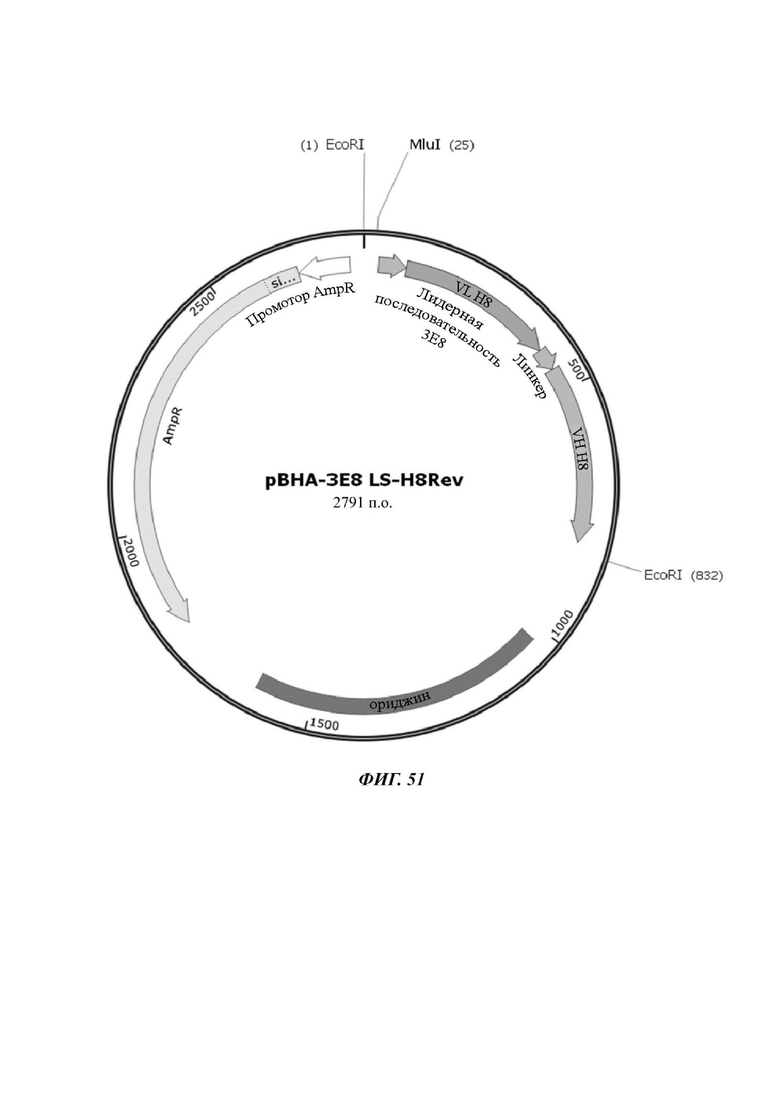


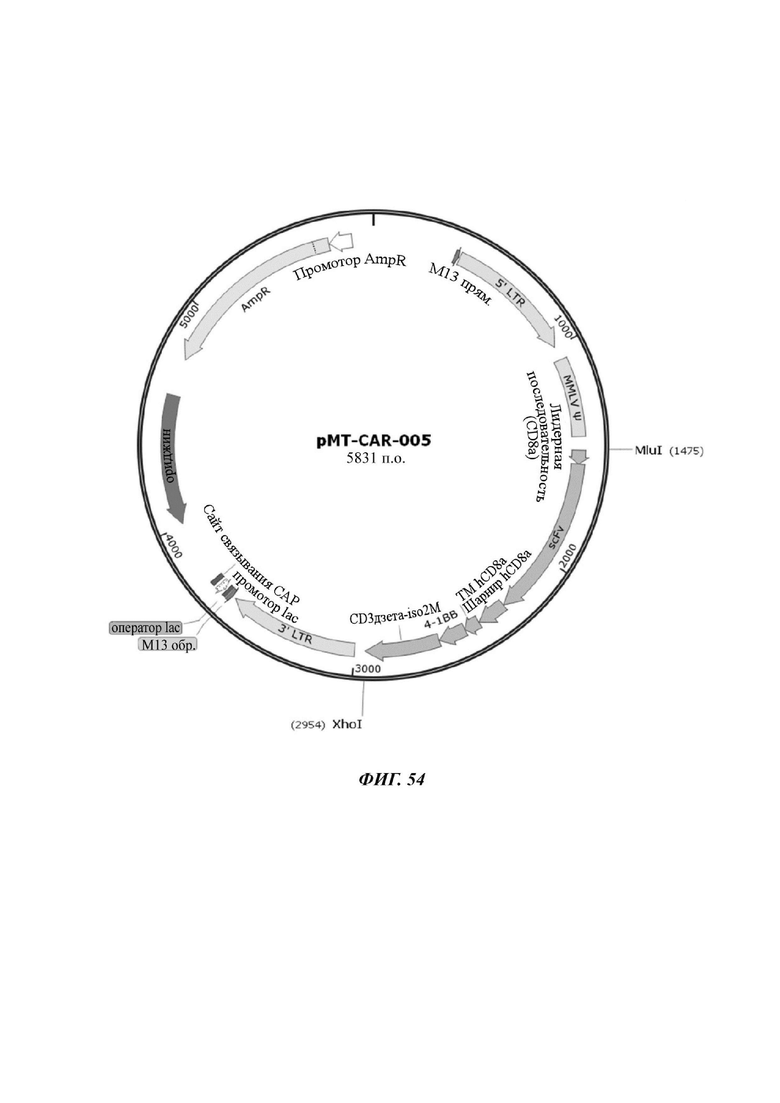
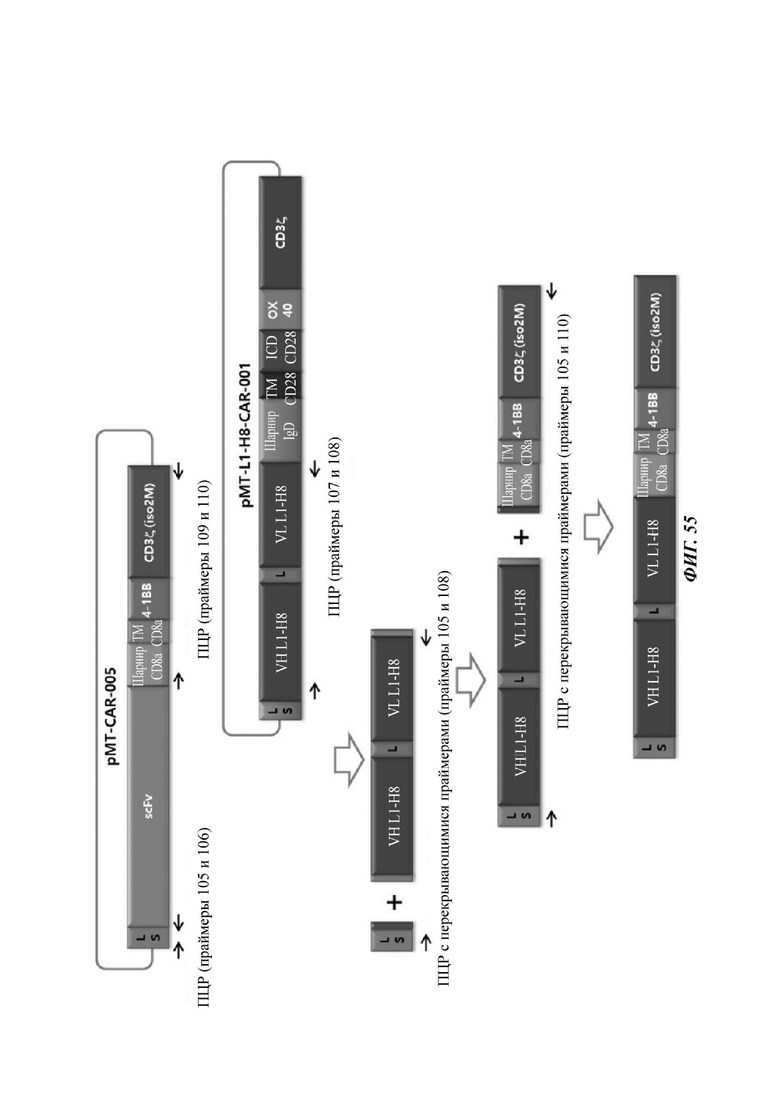
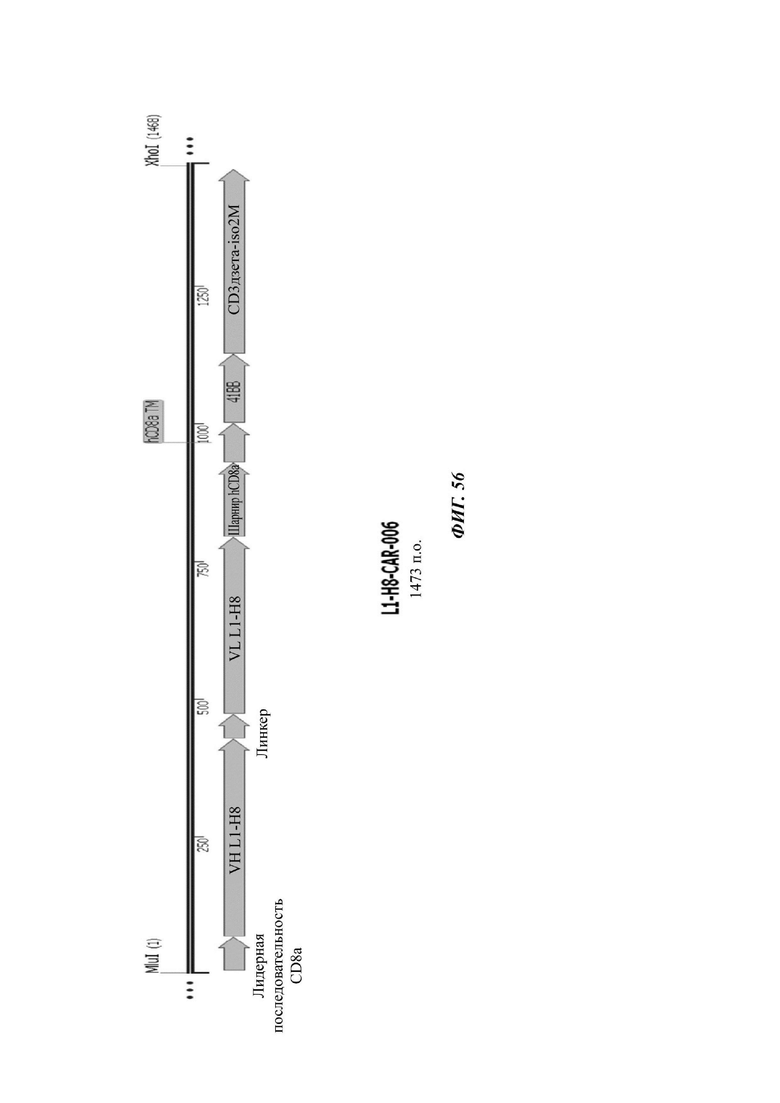
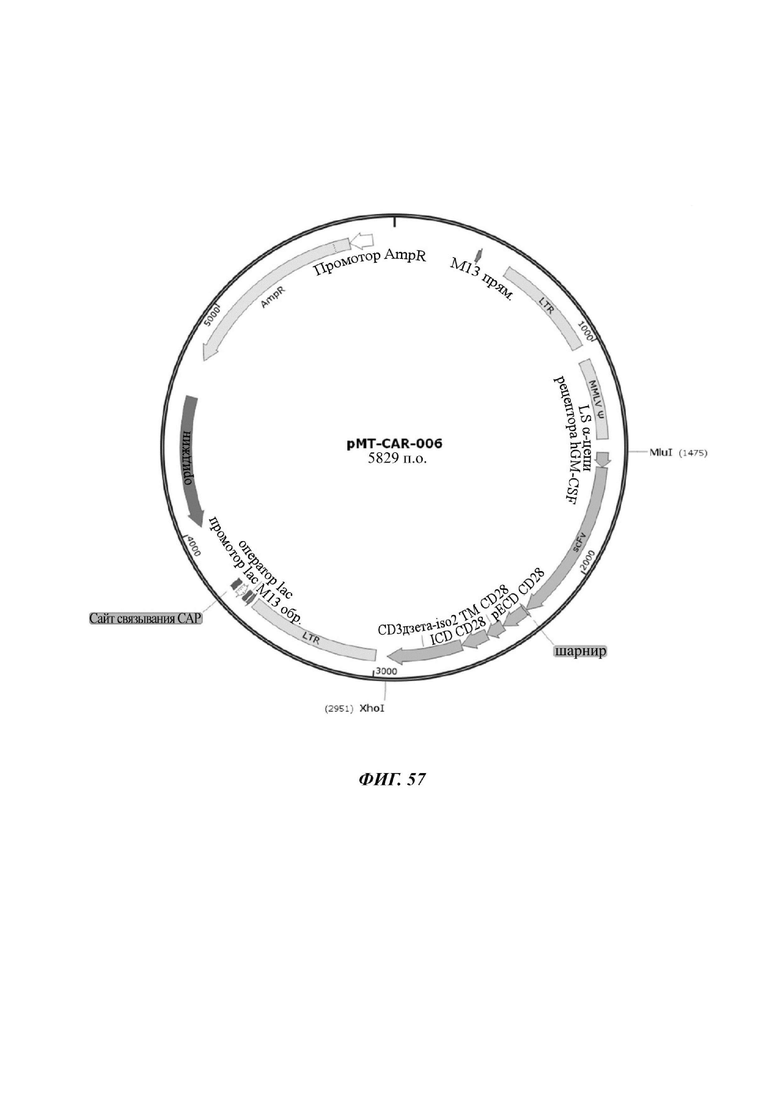

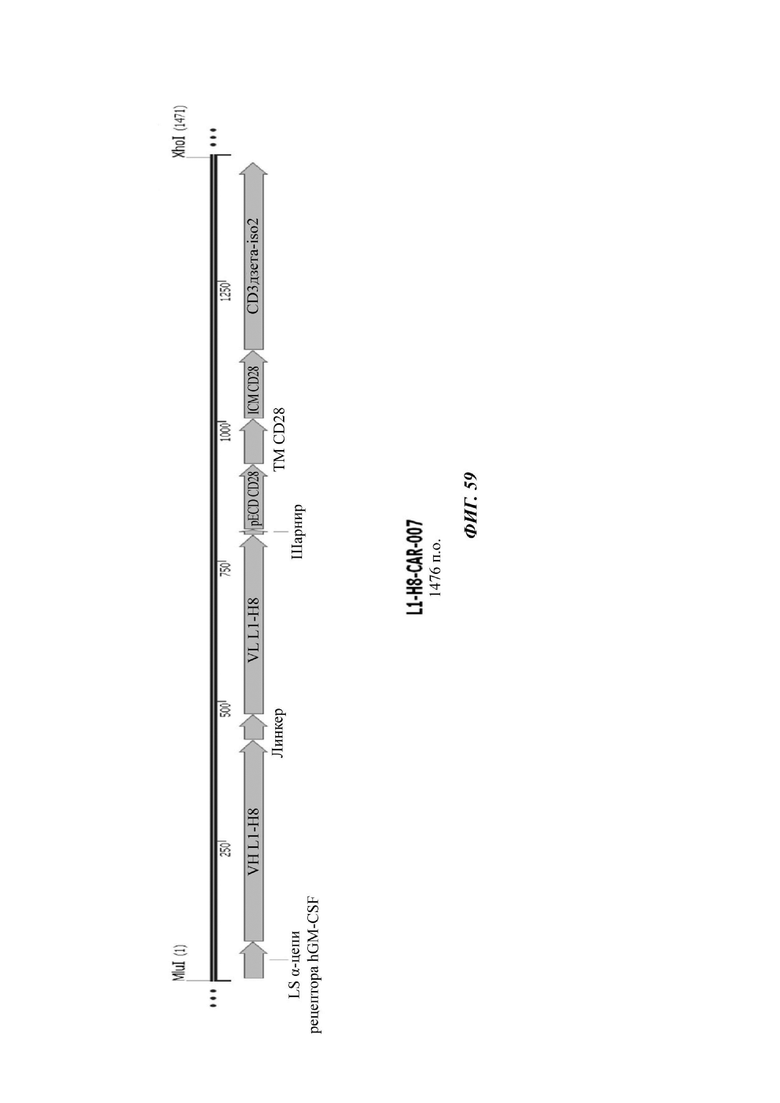
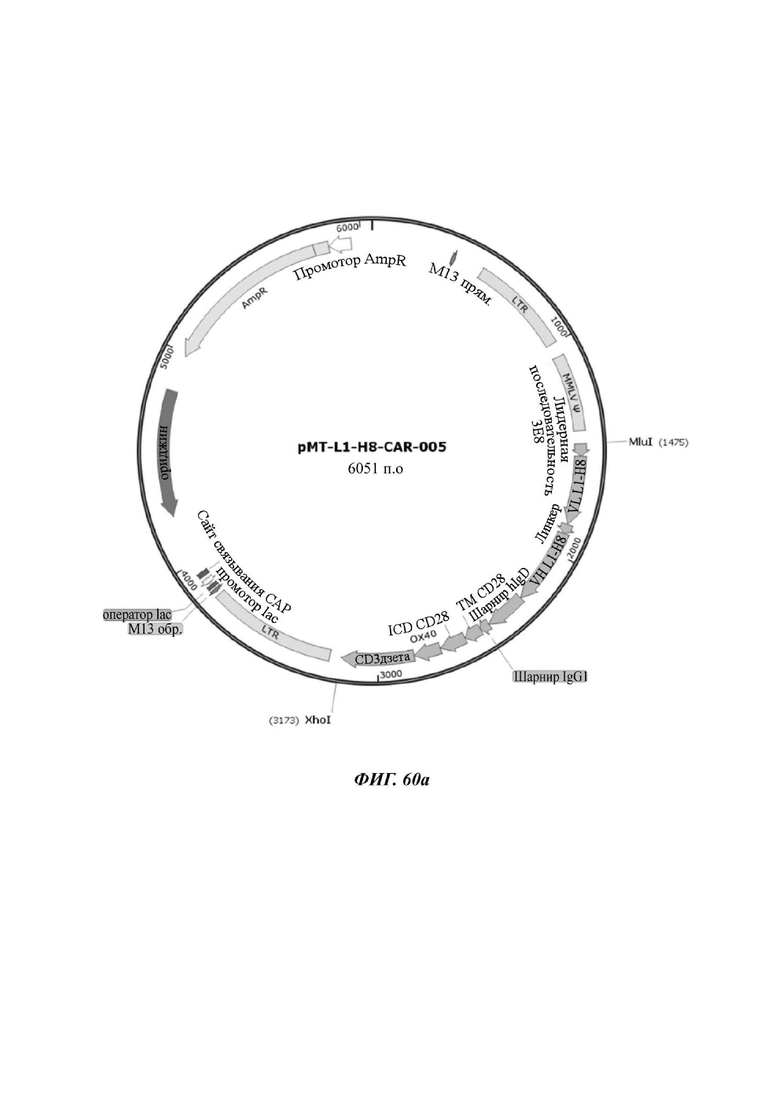
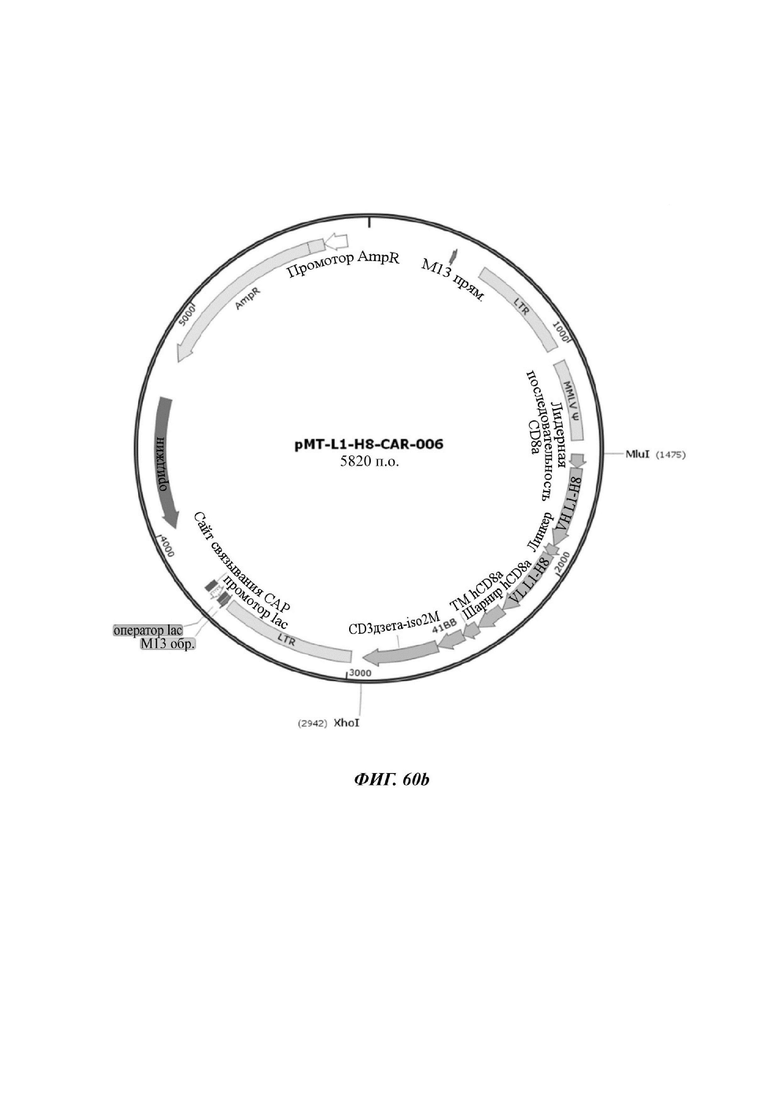
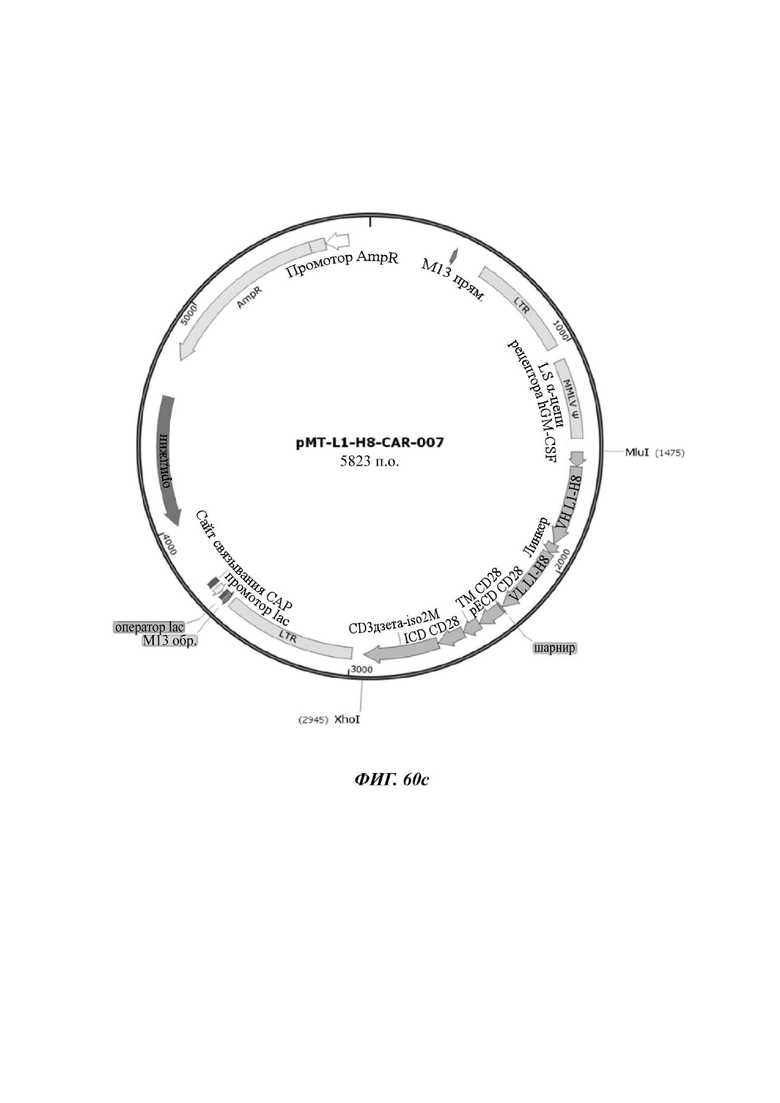
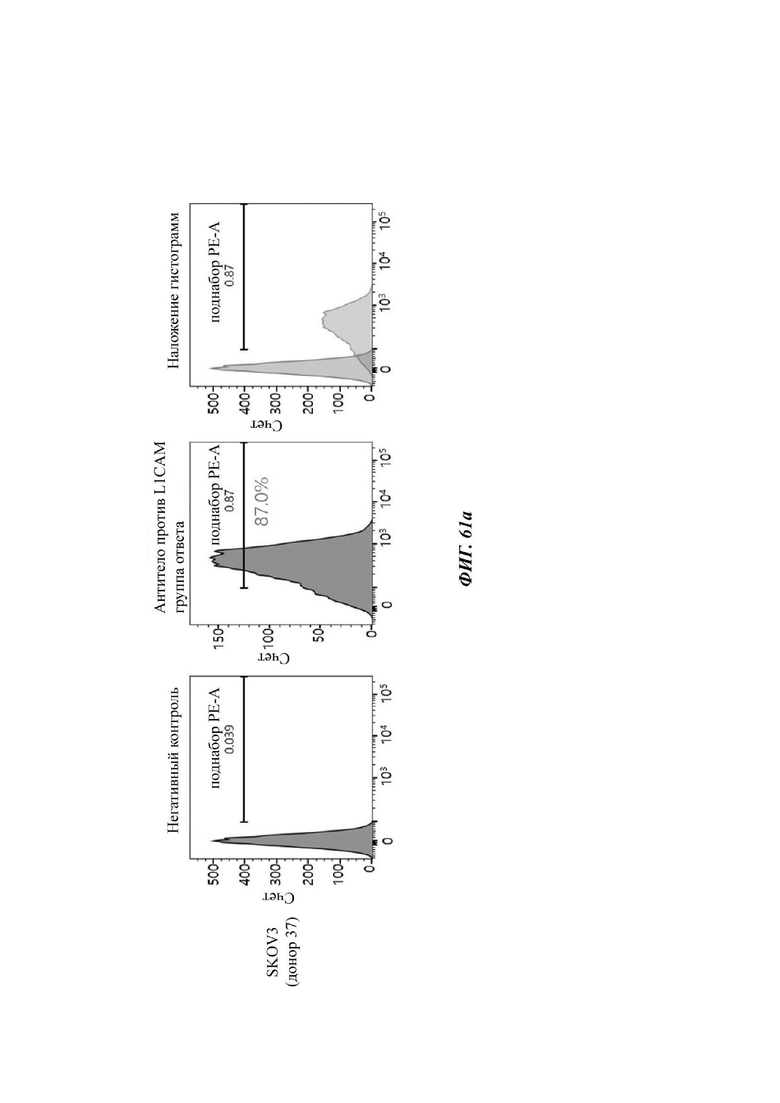
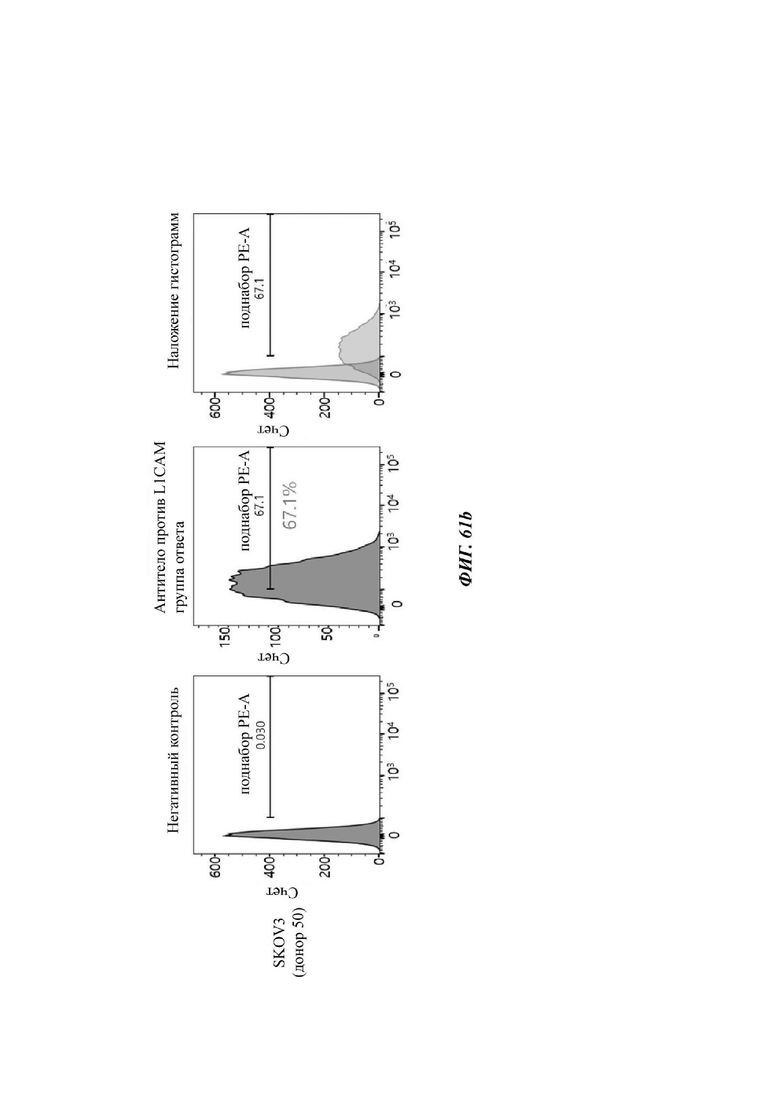
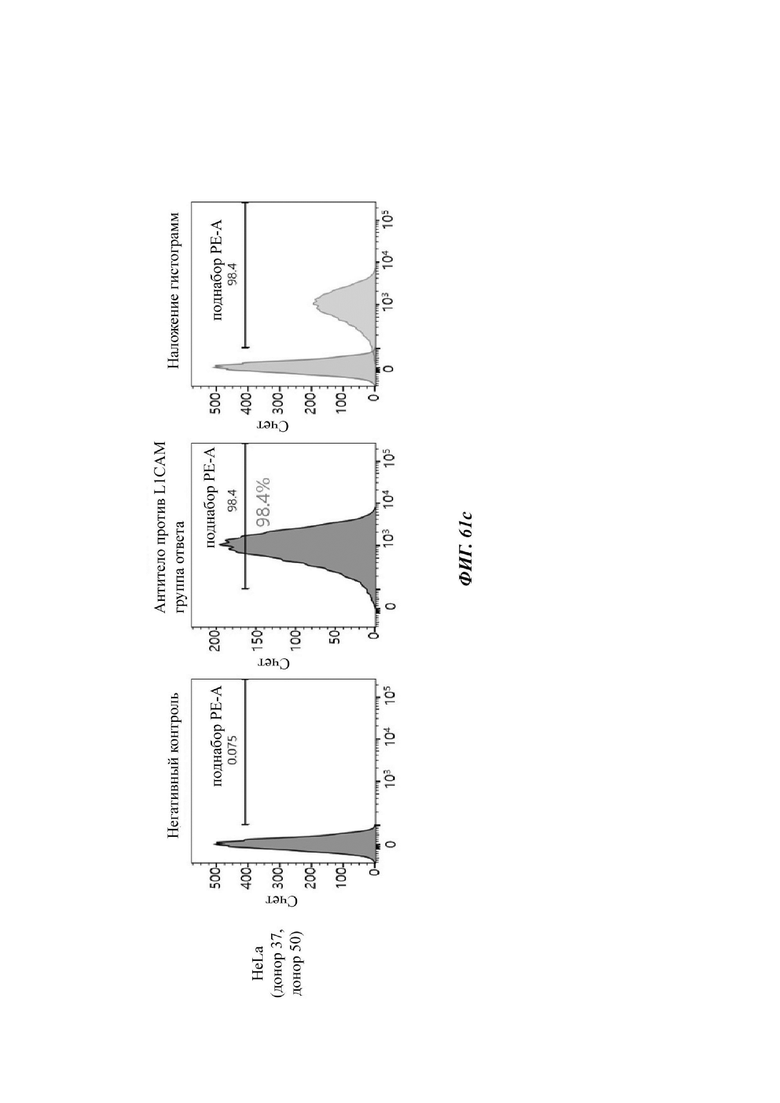
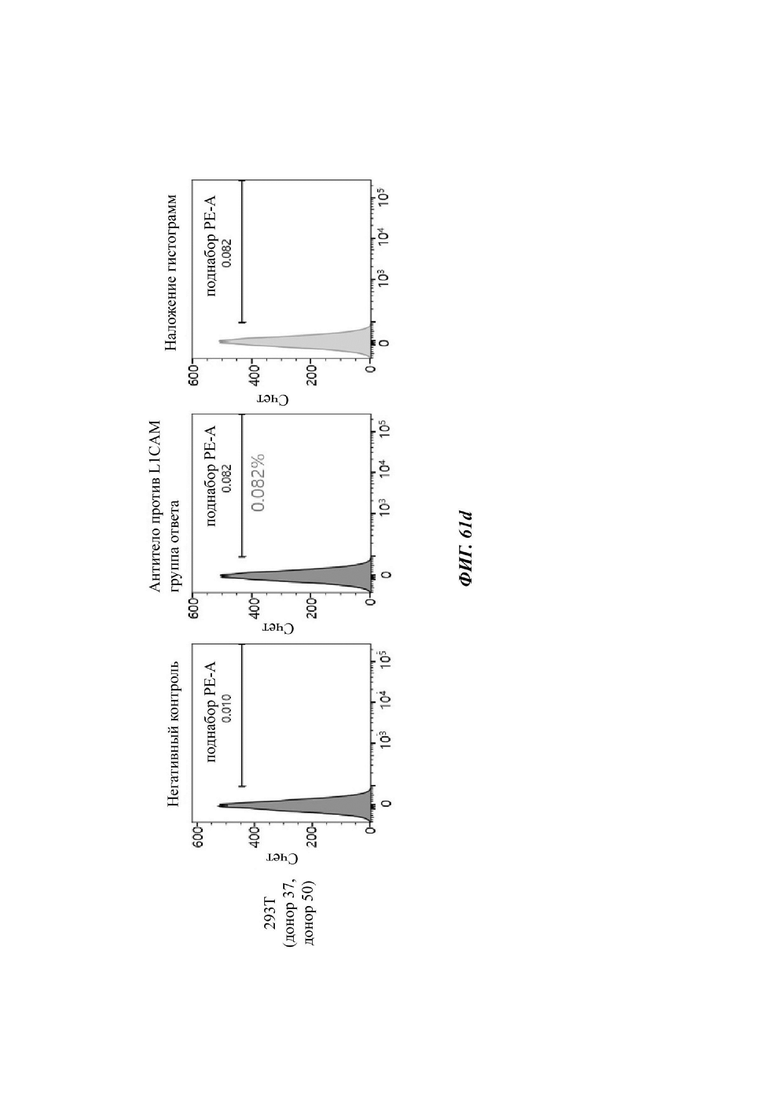

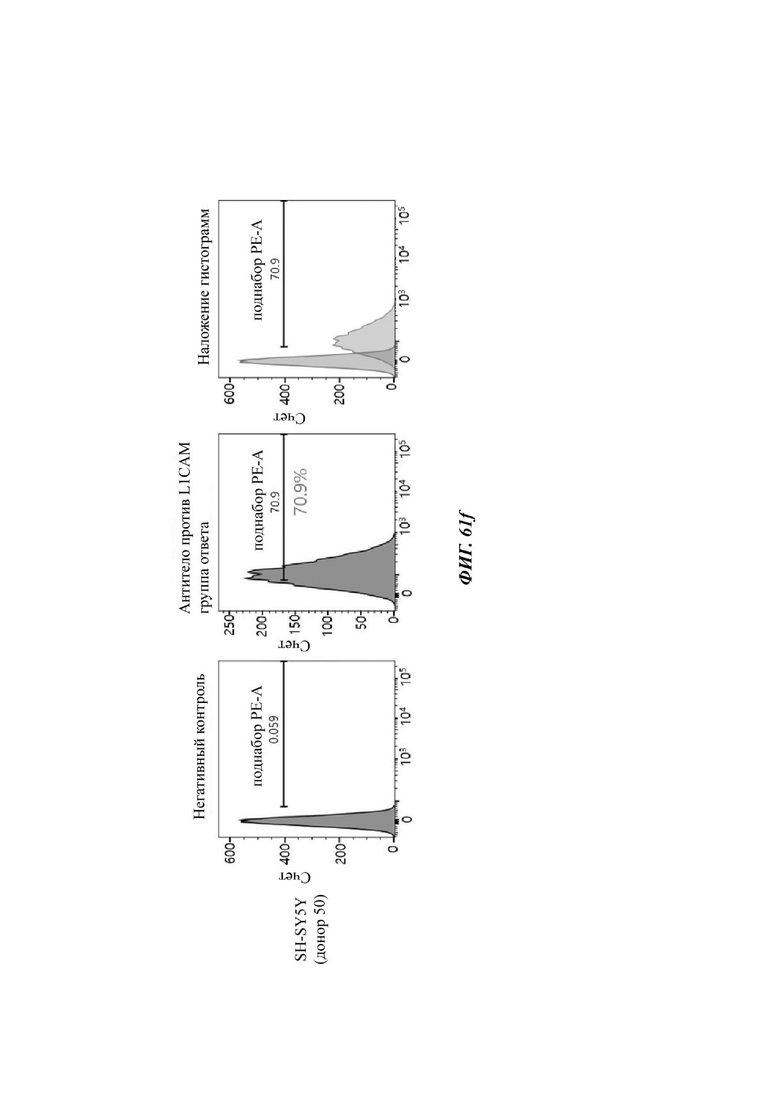

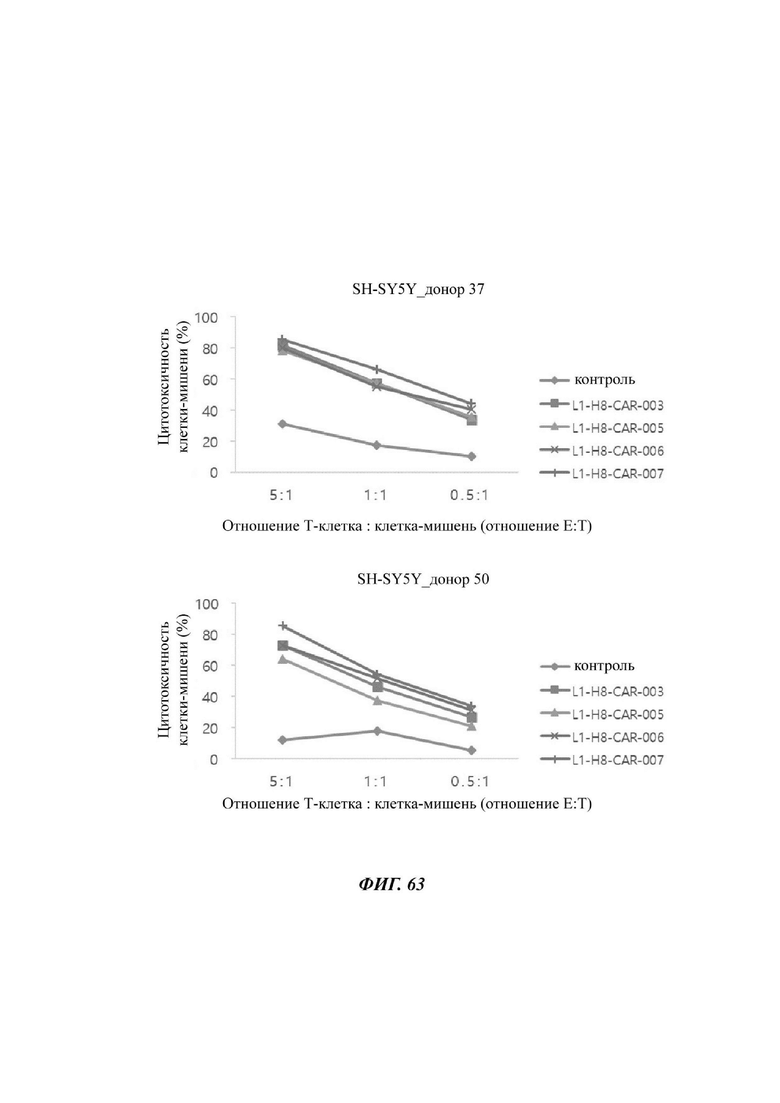

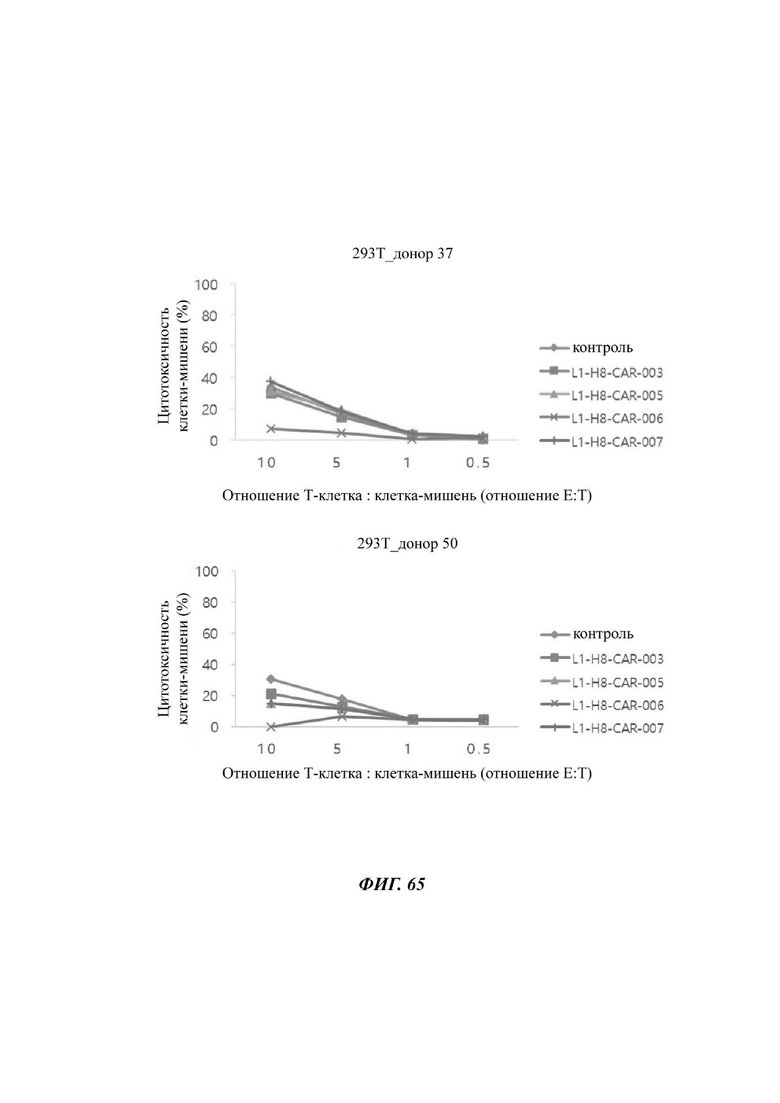
Изобретение относится к области биотехнологии, в частности к антителу против L1CAM или его антигенсвязывающему фрагменту. Также изобретение относится к содержащему указанное антитело химерному рецептору антигена, кодирующей его нуклеиновой кислоте, вектору экспрессии и эффекторной клетке, экспрессирующей полипептид химерного рецептора антигена. Эффекторная клетка представляет собой Т-лимфоцит. Кроме того, предложено применение антител и эффекторных клеток, экспрессирующих химерный рецептор антигена, для лечения или профилактики рака и воспалительных заболеваний. Антитело против L1CAM или антигенсвязывающий фрагмент по настоящему изобретению является превосходным по специфичности и аффинности к L1CAM и, таким образом, может использоваться в лечении и диагностике раковых заболеваний, связанных с высокой экспрессией L1CAM, и заболеваний, связанных с воспалительными расстройствами. 9 н. и 20 з.п. ф-лы, 109 ил., 19 табл., 6 пр.
1. Антитело против L1CAM или его антигенсвязывающий фрагмент, содержащее вариабельную область тяжелой цепи (VH), содержащую CDRH1 (определяющую комплементарность область 1 тяжелой цепи), CDRH2 и CDRH3, указанные ниже, и вариабельную область легкой цепи (VL), содержащую CDRL1, CDRL2 и CDRL3, указанные ниже:
i) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 1, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 8, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 15; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 32, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 37, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 43;
ii) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 2, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 9, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 16; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 33, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 38, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 44;
iii) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 3, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 10, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 17; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 34, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 38, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 44;
iv) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 4, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 11, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 18; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 34, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 39, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 45;
v) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 3, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 9, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 19; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 35, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 39, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 46;
vi) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 5, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 12, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 20; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 33, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 40, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 47;
vii) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 6, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 13, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 21; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 34, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 41, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 44;
viii) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 7, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 9, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 22; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 36, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 42, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 43; или
ix) CDRH1, состоящая из аминокислотной последовательности SEQ ID NO: 3, CDRH2, состоящая из аминокислотной последовательности SEQ ID NO: 14, и CDRH3, состоящая из аминокислотной последовательности SEQ ID NO: 23; и CDRL1, состоящая из аминокислотной последовательности SEQ ID NO: 34, CDRL2, состоящая из аминокислотной последовательности SEQ ID NO: 37, и CDRL3, состоящая из аминокислотной последовательности SEQ ID NO: 44.
2. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, которое содержит VH и VL, указанные ниже:
i) VH, состоящая из аминокислотной последовательности SEQ ID NO: 52, и VL, состоящая из аминокислотной последовательности SEQ ID NO: 56;
ii) VH, состоящая из аминокислотной последовательности SEQ ID NO: 53, и VL, состоящая из аминокислотной последовательности SEQ ID NO: 57;
iii) VH, состоящая из аминокислотной последовательности SEQ ID NO: 54, и VL, состоящая из аминокислотной последовательности SEQ ID NO: 58;
iv) VH, состоящая из аминокислотной последовательности SEQ ID NO: 55, и VL, состоящая из аминокислотной последовательности SEQ ID NO: 59.
3. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VH содержит каркасную область 1 тяжелой цепи (FRH1), содержащую любую аминокислотную последовательность, выбранную из SEQ ID NO: 24-26.
4. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VH содержит каркасную область 2 тяжелой цепи (FRH2), содержащую аминокислотную последовательность SEQ ID NO: 27.
5. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VH содержит каркасную область 3 тяжелой цепи (FRH3), содержащую аминокислотную последовательность SEQ ID NO: 28 или 29.
6. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VH содержит каркасную область 4 тяжелой цепи (FRH4), содержащую аминокислотную последовательность SEQ ID NO: 30.
7. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VL содержит каркасную область 1 легкой цепи (FRL1), содержащую аминокислотную последовательность SEQ ID NO: 48.
8. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VL содержит каркасную область 2 легкой цепи (FRL2), содержащую аминокислотную последовательность SEQ ID NO: 49.
9. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VL содержит каркасную область 3 легкой цепи (FRL3), содержащую аминокислотную последовательность SEQ ID NO: 50.
10. Антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1, в котором VL содержит каркасную область 4 легкой цепи (FRL4), содержащую аминокислотную последовательность SEQ ID NO: 51.
11. Полипептид химерного рецептора антигена для специфичного связывания с L1CAM, содержащий:
(а) домен, связывающий L1CAM;
(b) трансмембранный домен (ТМ);
(с) костимулирующий домен; и
(d) внутриклеточный домен сигнализации (ICD),
где домен, связывающий L1CAM, содержит антитело против L1CAM или его антигенсвязывающий фрагмент по любому из пп. 1-10.
12. Полипептид химерного рецептора антигена по п. 11, в котором трансмембранный домен включает трансмембранный домен белка, выбранного из группы, состоящей из альфа, бета или дзета цепи рецептора Т-клетки, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154.
13. Полипептид химерного рецептора антигена по п. 11, в котором костимулирующий домен представляет собой функциональный домен сигнализации, полученный из белка, выбранного из группы, состоящей из лигандов, специфично связывающихся с молекулами МНС класса I, белков-рецепторов TNF (фактор некроза опухолей), иммуноглобулиноподобных белков, рецепторов цитокинов, интегринов, сигнализирующих лимфоцитарных активирующих молекул (SLAM), активированных рецепторов NK-клеток (клетка-природный киллер), аттенюаторов В- и Т-лимфоцитов (BTLA), рецепторов Toll-подобных лигандов, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4,IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (тактильный), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и CD83.
14. Полипептид химерного рецептора антигена по п. 11, в котором внутриклеточный домен сигнализации включает функциональный домен сигнализации 4-1ВВ, CD28, OX40 или CD3 дзета или их комбинацию.
15. Молекула нуклеиновой кислоты, кодирующая полипептид химерного рецептора антигена по любому из пп. 11-14.
16. Молекула нуклеиновой кислоты по п. 15, где данная молекула нуклеиновой кислоты содержит любую нуклеотидную последовательность, выбранную из SEQ ID NO: 60-63.
17. Рекомбинантный экспрессионный вектор, содержащий молекулу нуклеиновой кислоты по п. 16.
18. Эффекторная клетка, экспрессирующая полипептид химерного рецептора антигена по любому из пп. 11-14, где эффекторная клетка представляет собой Т-лимфоцит.
19. Эффекторная клетка по п. 18, где Т-лимфоцит выбран из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хэлперных Т-лимфоцитов.
20. Фармацевтическая композиция для лечения рака или воспалительного заболевания, содержащая антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1.
21. Фармацевтическая композиция для диагностики рака или воспалительного заболевания, содержащая антитело против L1CAM или его антигенсвязывающий фрагмент по п. 1.
22. Фармацевтическая композиция для лечения рака или воспалительного заболевания, содержащая эффекторную клетку, экспрессирующую полипептид химерного рецептора антигена по п. 11.
23. Фармацевтическая композиция по любому из пп. 20-22, где рак представляет собой солидный рак.
24. Фармацевтическая композиция по п. 23, где солидный рак выбран из группы, состоящей из рака желудка, рака молочной железы, рака поджелудочной железы, рака шейки матки, карциномы эндометрия, желудочно-кишечной стромальной опухоли, рака яичника, меланомы, рака желчного пузыря, печеночно-клеточной карциномы, холангиокарциномы, аденокарциномы протоков поджелудочной железы, рака пищевода, карциномы клеток почки, рака прямой кишки, рака толстой кишки, рака предстательной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака щитовидной железы, глиомы, глиобластомы, нейробластомы и астроцитомы.
25. Фармацевтическая композиция по любому из пп. 20-22, где воспалительное заболевание представляет собой воспалительное заболевание кишечника.
26. Способ лечения рака или воспалительного заболевания у субъекта, нуждающегося в этом, включающий введение данному субъекту эффекторной клетки, экспрессирующей химерный рецептор антигена по п. 11.
27. Способ по п. 26, в котором рак представляет собой солидный рак.
28. Способ по п. 27, в котором солидный рак выбран из группы, состоящей из рака желудка, рака молочной железы, рака поджелудочной железы, рака шейки матки, карциномы эндометрия, желудочно-кишечной стромальной опухоли, рака яичника, меланомы, рака желчного пузыря, печеночно-клеточной карциномы, холангиокарциномы, аденокарциномы протоков поджелудочной железы, рака пищевода, карциномы клеток почки, рака прямой кишки, рака толстой кишки, рака предстательной железы, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака щитовидной железы, глиомы, глиобластомы, нейробластомы и астроцитомы.
29. Способ по п. 26, в котором воспалительное заболевание представляет собой воспалительное заболевание кишечника.
| WO 2014077648 A1, 22.05.2014 | |||
| KR 20100064985 A, 15.06.2010 | |||
| US 8138313 B2, 20.03.2012 | |||
| ARLT M.J.E | |||
| et al., Efficient inhibition of intra-peritoneal tumor growth and dissemination of human ovarian carcinoma cells in nude mice by anti-L1-cell adhesion molecule monoclonal antibody treatment, CANCER RESEARCH, 2006, vol.66, no.2, pp.936-943 |
Авторы
Даты
2023-02-02—Публикация
2019-10-21—Подача