Область изобретения
Изобретение касается нового способа получения {2-[4-(α-фенил-п-хлорбензил)-пиперазин-1-ил]этокси}уксусной кислоты, имеющей следующую формулу:
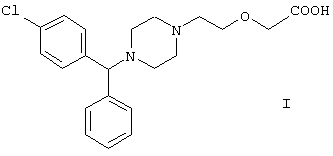
{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусная кислота известна под международным непатентованным названием цетиризин и широко используется как ингредиент противоаллергических фармацевтических композиций.
Изобретение также касается новых {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}-ацетамидов, имеющих следующую формулу:
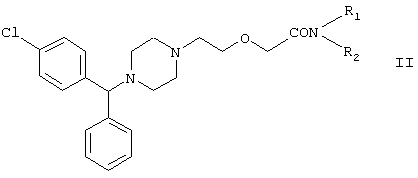
где
R1 и R2 независимо представляют собой С1-4алкил, который может быть замещен фенилом, С2-4алкенил или циклогексил, или
R1 и R2 образуют вместе с соседним атомом азота морфолиновую группу,
и их кислотных аддитивных солей, которые являются полезными промежуточными соединениями при синтезе цетиризина.
Предпосылки изобретения
Известно несколько способов получения цетиризина формулы I. Согласно Европейской патентной заявке №58146 (Chem. Abstr., 98, 34599r), эфир или амид формулы
где Y представляет собой группу формулы -OR1 или аминогруппу, где R1 означает алкил, гидролизуют для получения соединения формулы I.
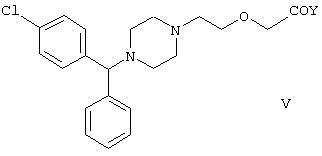
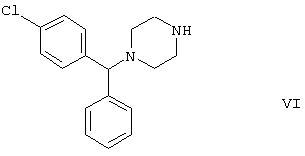
Используя в качестве исходного вещества метиловый эфир формулы V, при гидролизе с гидроксидом калия получают калиевую соль цетиризина с выходом 59%. Из калиевой соли образуется соответствующая кислота с выходом 81%, а выход ожидаемого дигидрохлорида цетиризина составляет 80%. Таким образом, общий выход при получении по известному способу составляет 38,2%. Существенным недостатком известного способа является то, что получение эфиров формулы V, которые используются в качестве исходных соединений, сопряжено с большими трудностями и с маленьким выходом. Так, 1-[(4-хлорфенил)фенилметил]пиперазин формулы VI
реагирует с метил-2-хлорэтоксиацетатом формулы VII
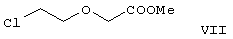
с образованием метилового эфира формулы V с выходом до 10,6% после хроматографии.
В уже упоминавшейся Европейской патентной заявке говорится о том, что цетиризин можно получать также из ацетамидов формулы V, где Y представляет собой аминогруппу, путем гидролиза. Однако гидролиз ацетамида формулы V не подтверждается ни примерами, ни данными выхода. Согласно более позднему сообщению (Synthesis, 1995. 766), ацетамид формулы V гидролизуют в соляной кислоте при 50°С для получения цетиризина с выходом 71%.
Для получения ацетамида формулы V известны еще три способа. Например, 1-[(4-хлорфенил)фенилметил]пиперазин формулы VI реагирует с 2-хлорэтоксиацетамидом формулы:
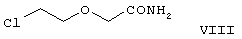
в присутствии связывающего кислоту агента с образованием ацетамида формулы V с выходом 47%. Согласно второму способу {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}-этанол формулы
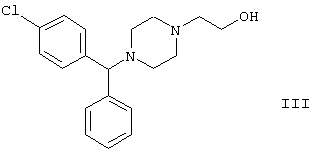
реагирует с гидридом натрия, давая натриевую соль, а соль реагирует с хлорацетамидом формулы

где Х обозначает атом хлора, R1 и R2 обозначают атом водорода. Однако выход этой реакции всего 11%. Согласно третьему методу ацетамид формулы V может быть получен также из соответствующего метилового эфира формулы V, где Y обозначает метоксигруппу, путем реакции с аммиаком с выходом 54%. Из-за низкого выхода (27,8%) реакции получения метилового эфира общий выход составляет 15,0%. Следовательно, последний упомянутый способ синтеза цетиризина также неэкономичен.
Способ, описанный в патенте UK No. 2225320 (Chem. Abstr., 113. 191395s), направлен на устранение недостатков упомянутых выше известных способов путем получения цетиризина из {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}этанола формулы III, который превращается в калиевую соль, реагируя с трет-бутилатом калия. Калиевую соль подвергают реакции с хлорацетатом натрия для получения дигидрохлорида цетиризина с выходом 48,8%. Кроме того, получают 5,1% побочного продукта реакции. Описан также улучшенный способ получения {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}этанола формулы III, согласно которому 1-[(4-хлорфенил)фенилметил]пиперазин формулы VI подвергают реакции с хлоргидрином этилена с выходом 90,4%; общий выход производного пиперазина формулы VI в процессе синтеза составляет всего лишь 48,7%.
Последний из известных способов имеет еще один недостаток. Реакцию производного этанола формулы III с хлорацетатом натрия можно осуществить с относительно приемлемым выходом, если добавлять реагенты в раствор производного этанола формулы III несколькими порциями. Добавление реагентов нужно программировать на основе постоянного мониторинга состава реакционной смеси. Эта технология очень неудобна, особенно в промышленном масштабе.
Последний из известных способов пытаются улучшить с помощью способа, описанного в патенте PL No. 163415 (Chem. Abstr., 123. 55923s), согласно которому реакцию проводят в системе, состоящей из двух фаз, в присутствии нейтрального органического растворителя и водного раствора гидроксида натрия, получая дигидрохлорид цетиризина с выходом 60%. Хотя этот способ менее сложен, чем способ, опубликованный в патенте UK No.2225320, общий выход составляет всего 54%, как рассчитано для производного этанола формулы III, которое может быть получено более подходящим способом.
Другой способ получения цетиризина известен из патента UK No. 2225321 (Chem. Abstr., 113, 191396t), согласно которому 1-[(4-хлорфенил)фенилметил]пиперазин формулы VI подвергают реакции с хлорэтоксиацетонитрилом, получая производное нитрила, имеющее следующую формулу:
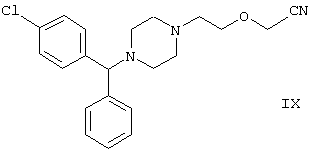
которое гидролизуют в кислой или щелочной среде до цетиризина. При таком способе дигидрохлорид цетиризина получают из производного нитрила формулы IX с общим выходом 60,5% в случае кислотного гидролиза и 65,5% в случае щелочного гидролиза.
Однако реакция 1-[(4-хлорфенил)фенилметил]пиперазина формулы VI с хлорэтоксиацетонитрилом дает производное нитрила с выходом 86,4%, уменьшая общий выход в процессе синтеза до 52,2% и 56,6%, соответственно.
Следует принимать во внимание также, что согласно литературе (E.J. Salmi, R. Leimu and H. Kallio, Suomen Kemistilehti, 17B, 17-19 (1944)), хлорэтоксиацетонитрил может быть получен из хлоргидрина этилена в две стадии с использованием очень ядовитого цианида меди (I) с общим выходом 58%.
Наконец, простой способ получения возможен благодаря способу, известному из опубликованной Европейской патентной заявки No. 801064, согласно которой цетиризин получают из 1-[(4-хлорфенил)фенилметил]пиперазина формулы VI путем реакции с 2-хлорэтоксиуксусной кислотой в нейтральном растворителе в присутствии связывающего кислоту агента. В данной публикации приводится только один Пример, который не содержит ни данных выхода, ни качественных данных о продукте. К тому же, большим недостатком этого способа является недоступность 2-хлорэтоксиуксусной кислоты в промышленных масштабах.
Целью данного изобретения является создание экономичного способа получения цетиризина, который удовлетворял бы самым строгим требованиям, предъявляемым к качеству вещества.
Краткое описание изобретения
Было обнаружено, что описанная выше цель достигается благодаря созданию способа получения {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты формулы I или ее фармацевтически приемлемой кислотной аддитивной соли или соли металла посредством гидролиза соответствующего ацетамида в щелочной или кислой среде и при необходимости превращения полученного продукта в кислотную аддитивную соль или соль металла и/или высвобождения основания из кислотной аддитивной соли или соли металла, причем соединение формулы II или его кислотная аддитивная соль используется в качестве ацетамида, и при необходимости гидролиз проводят в присутствии межфазного катализатора.
Изобретение включает {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамиды формулы II, которые являются новыми соединениями.
Описание предпочтительных воплощений
В способе изобретения исходным соединением является ацетамид формулы II или его кислотная аддитивная соль, образующаяся с органической или неорганической кислотой, и исходное соединение подвергают щелочному или кислотному гидролизу способом, известным per se, и при необходимости в присутствии межфазного катализатора.
При желании полученный продукт превращают в фармацевтически приемлемую кислотную аддитивную соль или соль металла, и/или основание высвобождают из кислотной аддитивной соли способом, известным per se.
Гидролиз {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамидов формулы II происходит удивительно быстро и полностью, без образования побочных продуктов, за 1-8 часов, в зависимости от природы R1 и R2. Цетиризин или его дигидрохлорид могут быть легко выделены из реакционной смеси в очень чистом виде, который удовлетворяет чрезвычайно жестким требованиям Европейской фармакопеи (3, 1997, 1084) по ВЭЖХ.
Эксперта может удивить то, что гидролиз {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]-этокси}ацетамидов формулы II протекает так быстро, так как из литературы известно, что диалкилацетамиды представляют собой стабильные соединения, гидролиз которых протекает медленно и требует жестких условий реакции. Например, N, N, N', N'-тетраэтил-5,5-диметил-3,7-диоксанондиамид гидролизовали в 3н. водном растворе гидроксида натрия при кипячении в течение 5 дней для получения соответствующей дикарбоновой кислоты с выходом 91,5% [J. Chem. Soc. Perkin Trans. I., 1981, 741-745, Chem. Abstr., 95, 42286q (1981)]. Однако после кипячения в течение 5 дней только 39,8% соответствующего N, N, N', N'-тетраметилового производного превращалось в соответствующую дикарбоновою кислоту, которую выделяли в виде метилового эфира. Кроме того, когда, например, трео-10,11-дигидрокси-N,N-диметилнонадеканамид подвергали кипячению в этаноле с 2н. водным раствором гидроксида натрия в течение 1 часа, распада, в результате которого получается соответствующая карбоновая кислота, не наблюдалось. [J. Chem. Soc., 1961, 351-356, Chem. Abstr., 55, 12276q (1961)]. Это является причиной того, что амиды карбоновых кислот обычно гидролизуют до карбоновых кислот в концентрированной щелочной или лучше концентрированной кислотной среде в присутствии нитритов [Houben-Weyl: Methoden der Organischen Chemie, Vol. 8, 432; A. R. Katritzky et al., Comprehensive Organic Functional Group Transformations, Vol. 5, 34-36 (1995)].
В качестве ацетамида формулы II предпочтительней использовать N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид.
Согласно предпочтительному способу изобретения гидролиз {2-[4-(α-фенил-п-хлор-бензил)пиперазин-1-ил]этокси}ацетамидов формулы II осуществляют в водном растворе гидроксида щелочного металла, предпочтительней гидроксида натрия или калия, где концентрация щелочи в растворе составляет 2-25 мас.%, предпочтительней 6-16 мас.%, более предпочтительней около 12 мас.%, обычно при 40-110°С, предпочтительней при 70-110°С, более предпочтительней при точке кипения раствора. После щелочного гидролиза продукт выделяют следующим образом: реакционную смесь разбавляют водой, подкисляют соляной кислотой до рН=3,8-4,0, цетиризиновое основание растворяют в органическом растворителе, который не смешивается с водой, предпочтительней в дихлорметане, органический раствор упаривают досуха при пониженном давлении, и оставшийся похожий на мед осадок растворяют в 5-36%, предпочтительней в 10-20%, более предпочтительней в 16% соляной кислоте. Потом к раствору прибавляют смешивающийся с водой органический растворитель, предпочтительней ацетон, метилэтилкетон или тетрагидрофуран, для кристаллизации дигидрохлорида, или раствор соляной кислоты концентрируют при пониженном давлении до содержания воды 20-25 мас.%, и к концентрированному раствору прибавляют упомянутый выше смешивающийся с водой органический растворитель, и похожий на мед дигидрохлорид цетиризина перекристаллизовывают.
После гидролиза и доведения рН до 3,8-4,0 возможна экстракция раствора цетиризинового основания в дихлорметане предпочтительней с помощью 5-30% соляной кислоты, водный раствор концентрируют при пониженном давлении для уменьшения содержания воды до 20-25 мас.%, и затем следуют процедуре, описанной выше для получения дигидрохлорида цетиризина.
Похожий на мед осадок, полученный после упаривания раствора цетиризинового основания в дихлорметане, может быть растворен в смешивающемся с водой органическом растворителе, предпочтительней в ацетоне, метилэтилкетоне или тетрагидрофуране, и полученный таким образом раствор цетиризинового основания в органическом растворителе затем обрабатывают соляной кислотой. Кислый раствор подвергают любой из вышеописанных процедур для получения дигидрохлорида цетиризина.
Согласно еще одному предпочтительному способу изобретения гидролиз ацетамида формулы II осуществляют в водном растворе неорганической кислоты, предпочтительней соляной или серной кислоты, при 40-110°С, предпочтительней при 70-110°С, более предпочтительней при точке кипения раствора. Обычно используют 2-25 мас.%, предпочтительней 10-20 мас.%, более предпочтительней 15 мас.% раствор неорганической кислоты. Для отделения продукта полученный кислотный гидролизат разбавляют водой, доводят рН до значения 3,8-4,0 путем добавления водного раствора гидроксида натрия, и затем следуют процедуре, описанной для щелочного гидролиза.
И щелочной, и кислотный гидролиз можно проводить в присутствии межфазного катализатора и при необходимости также сорастворителя. В качестве межфазного катализатора может быть использован галид тетраалкиламмония, предпочтительней хлорид тетрабутиламмония, хлорид триэтилбензиламмония или хлорид триоктиметиламмония (Aliquat 336) или краун-эфир, предпочтительней 15-краун-5 или 18-краун-6. Сорастворителем может быть смешивающийся с водой органический растворитель, как, например, этанол, бутанол, этиленгликоль или диоксан.
Если в способе изобретения в качестве исходного соединения используется кислотная аддитивная соль ацетамида формулы II, полученная с органической кислотой, эта органическая кислота кристаллизуется из реакционной смеси после осаждения продукта кислотой. В этом случае выпавшую органическую кислоту можно отделить путем фильтрации перед экстракцией продукта дихлорметаном, для того чтобы добиться более легкого разделения фаз. Однако с реакционной смесью можно работать и без отделения органической кислоты.
Таким образом, способ изобретения экономичен, может быть легко выполнен и дает цетиризин или его кислотную аддитивную соль в очень чистом виде.
Второй аспект данного изобретения касается новых промежуточных соединений формулы II, где R1 и R2 определены выше, и их кислотных аддитивных солей, образуемых при взаимодействии с органическими и неорганическими кислотами. Изобретение включает изомеры {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамидов формулы II и их смеси.
В формуле II, при определении R1 и R2, С1-4алкил, который может быть замещен фенилом, может иметь прямую или разветвленную цепь, например метил, этил, изопропил, трет-бутил или бензил и так далее. С2-4алкенил может быть, например, аллилом или металлилом.
Предпочтительным соединением формулы II является (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид.
{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид формулы II получают при взаимодействии соли щелочного металла {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}-этанола формулы III с 2-галогенацетамидом формулы IV, где R1 и R2 такие, как определены для формулы II, Х обозначает атом галогена, предпочтительней хлора, в органическом апротонном растворителе, и при необходимости путем превращения полученного основания формулы II в кислотную аддитивную соль или путем высвобождения основания из его кислотной аддитивной соли.
Реакцию проводят при температуре не выше 120°С, предпочтительней при 60-90°С.
Соль щелочного металла {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}этанола формулы III получают в нейтральном апротонном растворителе, используя гидрид, амид или алкоголят щелочного металла, предпочтительней гидрид натрия, амид натрия или метилат натрия. Нейтральный апротонный растворитель представляет собой органический апротонный растворитель, нейтральный с точки зрения реакции, предпочтительней бензол, толуол, ксилол или N,N-диметилформамид.
Новые {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамиды формулы II выделяются из реакционной смеси способом, известным per se. Согласно предпочтительному способу соединение формулы II подвергают разделению между водой и несмешивающимся с водой органическим растворителем, фазы разделяют и органическую фазу, содержащую соединение формулы II, упаривают.
Согласно особенно предпочтительному способу разделения, во время описанного выше разделения соединения формулы II между водой и несмешивающимся с водой органическим растворителем, примеси удаляют из органического раствора путем доведения рН раствора до 6,2-6,7, предпочтительней до 6,4, с помощью водного раствора неорганической или органической кислоты, предпочтительней соляной кислоты, во время выполнения экстракции и разделения фаз. Затем к органическому раствору добавляют еще одну порцию воды, доводят рН приблизительно до 4 добавлением водного раствора кислоты, таким образом превращая продукт в его кислотную аддитивную соль, которая разлагается в водной фазе. После разделения фаз основание высвобождают щелочью, предпочтительней водным раствором гидроксида натрия, и снова экстрагируют несмешивающимся с водой органическим растворителем, предпочтительней дихлорметаном. После упаривания раствора остаток растворяют в более низком алканоле, предпочтительней изопропаноле, и полученный раствор обрабатывают алканолом, содержащим хлористый водород, предпочтительней изопропанолом, содержащим хлористый водород, для получения дигидрохлорида, который осаждают в кристаллической форме добавлением растворителя, который не растворяет продукт, предпочтительней ди(низший алкил)кетона, более предпочтительней ацетона.
Согласно другому предпочтительному способу выделения дигидрохлорида ацетамида формулы II после упаривания раствора основания в органическом растворителе осадок растворяют в холодной соляной кислоте, упаривают воду при пониженном давлении и к осадку добавляют ди(низший алкил)кетон, более предпочтительней ацетон для кристаллизации дигидрохлорида.
Таким образом, ацетамид формулы II получают в очень чистом виде, что более предпочтительно для получения чистого цетиризина.
{2-(4-(α-Фенил-п-хлорбензил)пиперазин-1-ил)этанол формулы III, использующийся в качестве исходного соединения для получения ацетамида формулы II, давно известен из литературы [Н. Morren et al., Belg. Chem. Industrie, XIX, 1176-1185 (1954), Chem. Abstr., 53, 2240e (1959)]. Для получения очень чистого цетиризина особенно предпочтительней использовать {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}этанола дигидрохлорида моногидрат [т.пл. -196-205°С (при разложении), содержание воды (согласно Karl Fisher): 4,6%].
2-Галогенацетамиды формулы IV также известны из литературы [W. E.Weaver and W. M. Whaley, J. Amer. Chem. Soc., 69, 516 (1947); J. Kasprzyk et al., J. Heterocycl. Chem. 30, 119 (1993)] и могут быть легко получены способами, описанными в указанных выше ссылках.
Изобретение далее поясняется следующими Примерами.
Получение {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамидов формулы II
Пример 1
(RS)-N,N-Диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорид
К раствору 99,3 г (0,3 моль) (RS)-{2-[4-(α-фенил-п-хлорбензил]пиперазин-1-ил]}этанола в 500 мл толуола добавляют 25,8 г (0,33 моль) 50% суспензии амида натрия в толуоле при 25°С в потоке азота. Реакционную смесь помещают в масляную баню, нагретую до 105°С, и выдерживают 3 часа. Во время реакции внутренняя температура реакционной смеси остается 80-85°С. Затем реакционную смесь охлаждают до 40°С, прибавляют к ней по капле 40,1 г (0,33 моль) N,N-диметил-2-хлорацетамида и перемешивают при 50°С еще 2 часа. К реакционной смеси добавляют 120 г толченого льда и доводят рН до 6,4 добавлением 8 мл концентрированной соляной кислоты. Фазы разделяют, к толуольной фазе добавляют 150 мл воды и рН смеси доводят до 4 добавлением приблизительно 21 мл концентрированной соляной кислоты. Водную фазу отделяют, прибавляют к ней 300 мл дихлорметана и доводят рН до 7-8 добавлением приблизительно 28 мл (0,28 моль) 40% водного раствора гидроксида натрия. Органическую фазу отделяют, экстрагируют с помощью 40 мл насыщенного водного раствора хлорида натрия, высушивают над безводным сульфатом магния, фильтруют и упаривают при пониженном давлении. Похожий на мед осадок (124 г, 99%) растворяют в 50 мл изопропанола и к полученному раствору по каплям при перемешивании прибавляют 90 мл изопропанола, содержащего 25 мас.% хлористого водорода, при комнатной температуре. К реакционной смеси при энергичном перемешивании добавляют 1000 мл ацетона и смесь перемешивают еще час. Выпавшие кристаллы отфильтровывают, промывают 3 раза по 50 мл ацетона, затем 100 мл диизопропилового эфира.
Таким образом получают 120 г (81,1%) (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)-пиперазин-1-ил]этокси}ацетамида дигидрохлорида, т.пл. 182-190°С.
Спектральные данные основания:
ИК(КВr);ν С=O 1658 см-1
ПМР (CDCl3): δ м.д. 2,41 (уш.с, 4Н, пиперазин-3,5-NСН2), 2,53 (т. J=5,8 Гц, 4Н, пиперазин-2,6-NCH2), 2,62 (т, J=7,0 Гц, 2Н, этокси-NСН2), 2,92 и 2,98 (двойной с, 2×3H, NCH3), 3,63 (т, J=7,0 Гц, 2Н этокси-ОСН2), 4,14 (с, 2Н, СОСН2), 4,20 (с, 1Н, СН), 7,15-7,37 (м, 9Н, АrН).
Пример 2
(RS)-N,N-Диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорид
Выполняют процедуру, описанную в Примере 1, с той разницей, что похожий на мед осадок основания растворяют в 100 мл 20% соляной кислоты, полученный раствор концентрируют при 10-20°С при пониженном давлении для уменьшения содержания воды приблизительно до 5%, осадок растворяют в 100 мл изопропанола, к полученному раствору прибавляют 1000 мл ацетона и затем снова выполняют процедуру, описанную в Примере 1.Таким образом получают 110 г (76,4%) названного соединения, т.пл.: 184-189°С.
Пример 3
(RS)-N,N-Диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорид
Выполняют процедуру, описанную в Примере 1, с той разницей, что похожий на мед осадок растворяют в 30 мл метанола и к полученному раствору прибавляют 80 мл метанола, содержащего 27% хлористого водорода, затем отделяют дигидрохлорид, как описано в Примере 1. Таким образом получают 108,9 г (75,6%) названного соединения, т.пл.: 185-190°С.
Пример 4
(RS)-N,N-Диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорид
126,8 г (0,3 моль) (RS)-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}этанола дигидрохлорида моногидрата растворяют в 300 мл воды и к полученному раствору прибавляют 100 г толченого льда. К полученному раствору прибавляют 200 мл толуола и доводят рН до 8 добавлением приблизительно 60 мл 40 мас.% водного раствора гидроксида натрия. Фазы разделяют, водную фазу экстрагируют 50 мл толуола. Объединенные растворы толуола промывают 50 мл насыщенного водного раствора хлорида натрия, высушивают над безводным сульфатом магния, фильтруют, затем выполняют процедуру, описанную в Примере 1.
Таким образом получают 129,2 г (88,1%) названного соединения, т.пл.: 185-190°С.
Чистота: больше 99,6%, как определено ВЭЖХ.
Пример 5
(RS)-N,N-Диметил-{2-[4-(-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида фумарат
Выполняют процедуру, описанную в Примере 1, с той разницей, что реакцию проводят с 0,025 моль, похожее на мед основание (10,3 г, 98%) растворяют в 10 мл изопропанола, к полученному раствору прибавляют 2,9 г (0,024 моль) фумаровой кислоты и смесь нагревают до растворения. К теплому раствору добавляют 40 мл этилацетата для последующей кристаллизации продукта. После охлаждения кристаллы отфильтровывают и промывают этилацетатом. Таким образом получают 11,2 г (84,0%) названного соединения, т.пл.: 138-141°С.
Пример 6
(RS)-N,N-Диэтил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид
Выполняют процедуру, описанную в Примере 1, с той разницей, что реакцию проводят с 0,025 моль, и вместо N,N-диметил-2-хлорацетамида используют 4,11 г (0,0275 моль) N,N-диэтил-2-хлорацетамида. В процессе обработки реакционной смеси похожее на мед основание (9,98 г, 89,9%) не превращают в дигидрохлорид, а очищают посредством хроматографии на колонке с силикагелем, которую подвергают элюции хлороформом, содержащим 1-10% метанола, при постоянном увеличении полярности смеси.
Таким образом получают 9,16 г (82,5%) названного соединения в виде бледно-желтого, похожего на мед продукта. Rf=0,45 (пластина Kieselgel Merck, хлороформ-метанол=9:1).
ИК(КВr);ν С=O 1646см-1
ПМР (CDCl3): δ м.д. 1,10 и 1,15 (двойной т, J=7,0 Гц, 2×3Н, СН3), 2,42 (уш.с, 4Н, пиперазин-3,5-NСН2), 2,54 (уш.с, 4Н, пиперазин-2,6-NСН2), 3,30 и 3,33 (двойной м, 2×2Н, ЭТИЛ-NСН2), 3,65 (т, J=5,9 Гц, 2Н, этокси-ОСН2), 4,14 (с, 2Н, COCH2), 4,20 (с, 1Н, СН), 7,17-7,37 (м, 9Н, АrН).
Пример 7
(RS)-N,N-Диаллил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид
Выполняют процедуру, описанную в Примере 1, с той разницей, что вместо N,N-диэтил-2-хлорацетамида используют 4,77 г (0,0275 моль) N,N-диаллил-2-хлорацетамида. Похожее на мед основание (10,5 г, 89%), полученное после обработки реакционной смеси, очищают посредством хроматографии на колонке с силикагелем, используя в качестве элюента смесь хлороформа и 2% метанола.
Таким образом получают 9,45 г (80,1%) названного соединения в виде бледно-желтого, похожего на мед продукта. Rf=0,5 (пластина Kieselgel Merck, хлороформ-метанол=9:1).
ИК(КВr);ν С=O 1657см-1
ПМР (CDCl3): δ 2,42 (уш.с, 4Н, пиперазин-3,5-NСH2), 2,53 (уш.с, 4Н, пиперазин-2,6-NСН2), 2,62 (т, J=5,8 Гц, 2Н, этокси-NCН2), 3,65(т, J=5,8 Гц, 2Н, этокси-ОСН2) 3,86 (т, J=5,8 Гц, 2Н, NCH2), 3,96 (т, J=5,8 Гц, 2Н, NCH2), 4,15 (с, 2Н, СОСН2), 4,20 (с, 1Н, СН), 5,16 (м, 4Н, ССН2), 5,72 (м, 2Н, СН), 7,17-7,38 (м, 9Н, АrН).
Пример 8
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетилморфолид
Выполняют процедуру, описанную в Примере 1, с той разницей, что реакцию проводят с 0,05 моль, и вместо N,N-диметил-2-хлорацетамида используют 8,9 г (0,05 моль) хлорацетилморфолида. Похожее на мед основание (10,4 г, 45,4%), полученное после обработки реакционной смеси, очищают посредством хроматографии на колонке с силикагелем, используя в качестве элюента смесь этилацетата и 10% метанола.
Таким образом получают 8,3 г (36,2%) названного соединения в виде маслянистого продукта. Rf=0,35 (пластина Kieselgel Merck, хлороформ-метанол=9:1).
ИК(КВr);ν С=O 1655см-1
ПМР (CDCl3): δ 2,41 (уш.с, 4Н, пиперазин-3,5-NCH2), 2,53 (уш.с, 4Н, пиперазин-2,6-NСН2), 2,61 (т, J=5,6 Гц, 2Н, этокси-NСН2), 3,50 (м, 4Н морфолино-NCH2), 3,57 (м, 4Н, морфолино-ОСH2), 3,62 (т, J=5,6 Гц, 2Н, этокси-ОСН2), 4,13 (с, 2Н, СОСН2), 4,20 (с, 1Н, СН), 7,16-7,36 (м, 9Н, АrН).
MC(Cl):(M+1)+=458
Пример 9
(RS)-N,N-Дициклогексил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид.
Выполняют процедуру, описанную в Примере 1, с той разницей, что реакцию проводят с 0,02 моль, и вместо N,N-диметил-2-хлорацетамида используют 5,2 г (0,02 моль) N,N-дихлоргексил-2-хлорацетамида. Таким образом получают 9,8 г (88,9%) названного соединения в виде похожего на мед продукта. Чистота: больше 99%, как определено ВЭЖХ.
ИК(КВr);ν С=O 1656 см-1
ПМР (CDCI3): δ 1,23 (м, 4Н, циклогексил-4-CH2), 1,46-1,78 (м, 16Н, циклогексил-2,3,5,6-CH2), 2,45 (уш.с, 4Н, пиперазин-3,5-NСН2), 2,59 (уш.с, 4Н, пиперазин-2,6-NСН2), 2,67 (м, 2Н, этокси-NСН2), 3,48(м, 2Н, циклогексил-СН), 3,67 (м, 2Н, этокси-ОСН2), 4,08 (с, 2Н, COCH2), 4,21 (с, 1Н, СН), 7,17-7,36 (м, 9Н, АrН).
Пример 10
(RS)-N,N-Дициклогексил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дималеинат
1,1 г похожего на мед основания, полученного по способу, описанному в Примере 9, растворяют в 3 мл изопропанола, к полученному раствору при комнатной температуре прибавляют раствор 0,23 г малеиновой кислоты в 2 мл изопропанола и реакционную смесь перемешивают при комнатной температуре в течение 14 часов. Выпавшие кристаллы отфильтровывают и промывают некоторым количеством изопропанола.
Таким образом получают 9,8 г (88,9%) названного соединения. Чистота: 99,6%, как определено ВЭЖХ.
Пример 11
(RS)-N,N-Дибензил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид
Выполняют процедуру, описанную в Примере 1, с той разницей, что реакцию проводят с 0,05 моль, и вместо N,N-диметил-2-хлорацетамида используют 13,7 г (0,05 моль) N,N-дибензил-2-хлорацетамида. Похожее на мед основание (9,98 г, 89,9%), полученное после обработки реакционной смеси, очищают посредством хроматографии на колонке с силикагелем, которую подвергают элюции смесью этилацетата и н-гексана при постоянном увеличении полярности смеси. Таким образом получают 17,0 г (57%) названного соединения в виде похожего на мед продукта. Rf=0,7 (пластина Kieselgel Merck, этилацетат-метанол=1:1).
ИК(КВr);ν С=O 1654 см-1
ПМР (СDСl3): δ 2,35 (уш.с, 4Н, пиперазин-3,5-NСН2), 2,49 (уш.с, 4Н, пиперазин-2,6-NСН2), 2,59 (т, J=5,5 Гц, 2Н, этокси-NCH2). 3,68 (т, J=5,5 Гц, 2Н, этокси-ОСН2), 4,16 (с, 1Н, СН), 4,25 (с, 2Н, СОСH2), 4,43 (с, 2Н, PhCH2), 4,55 (с, 2Н, PhCH2), 7,16-7,36 (м, 9Н, АrН).
Пример 12
(RS)-N,N-Диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорид
К раствору 99,3 г (0,3 моль) (RS)-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]}этанола в 500 мл толуола прибавляют 17,8 г (0,33 моль) метилата натрия при 25°С при интенсивном перемешивании в потоке азота. Реакционную смесь нагревают до кипения и упаривают 200 мл растворителя, затем прибавляют 500 мл абсолютного толуола с той же скоростью, с какой происходит упаривание, поддерживая таким образом объем реакционной смеси от 250 до 350 мл. После прекращения добавления толуола в дистилляте не обнаруживается метанол. Реакционную смесь прекращают нагревать, добавляют 200 мл абсолютного толуола, температуру смеси доводят до 40°С и прибавляют по капле 40,1 г (0,33 моль) N,N-диметил-2-хлорацетамида, и реакционную смесь перемешивают при 50°С в течение 2 часов. Реакционную смесь обрабатывают, как описано в Примере 1.
Таким образом получают 120 г (81,8%) (RS)-N,N-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорида с чистотой, идентичной чистоте продукта из Примера 1.
Получение {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты формулы I
Пример 13
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
К раствору 97,8 г (0,2 моль) (RS)-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}-ацетамида дигидрохлорида в 340 мл воды при перемешивании прибавляют раствор 80 г (2,0 моль) гидроксида натрия в 200 мл воды и суспензию кипятят в течение 2,5 часов, продувая через нее азот. Реакционную смесь охлаждают до 40°С, разбавляют 500 мл воды, подкисляют до рН 3,8 добавлением 120 мл концентрированной соляной кислоты и экстрагируют сначала с помощью 400 мл дихлорметана, затем 200 мл дихлорметана. Объединенные органические фазы упаривают при пониженном давлении, осадок растворяют в 50 мл воды, подкисляют добавлением 24 мл концентрированной соляной кислоты и упаривают досуха при пониженном давлении. Густой маслянистый осадок растворяют в 50 мл ацетона, к полученному раствору затем добавляют 550 мл ацетона и смесь перемешивают в течение 1 часа. Выпавший кристаллический продукт отфильтровывают, промывают ацетоном, затем диэтиловым эфиром и высушивают при пониженном давлении.
Таким образом получают 74,3 г (80,5%) чистого названного соединения, т.пл.: 226-228°С.
Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997, 1084.
Пример 14
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что вместо (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорида используют 83, 2 г (0,2 моль) (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамидного основания. Таким образом получают 75,0 г (81,3%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997, 1084.
Пример 15
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что вместо (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида дигидрохлорида используют 106,4 г (0,2 моль) (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида фумарат, и после подведения рН реакционной смеси до 3,8 выпавшую фумаровую кислоту отфильтровывают для облегчения экстракции с помощью дихлорметана. Таким образом получают 71,8 г (77,8%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 16
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 14, с той разницей, что вместо (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида используют 104,4 г (0,2 моль) (RS)-N,N-диэтил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}-ацетамида, в качестве сорастворителя используют 100 мл диоксана, и во время щелочного гидролиза реакционную смесь кипятят 4 часа. Таким образом получают 69,1 г (74,9%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997, 1084.
Пример 17
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 14, с той разницей, что вместо (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида используют 110,0 г (0,2 моль) (RS)-N,N-диаллил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}-ацетамида, в качестве сорастворителя используют 100 мл диоксана, и во время щелочного гидролиза смесь кипятят в течение 10 часов. Таким образом получают 64,0 г (69,3%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084
Пример 18
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 14, с той разницей, что вместо (RS)-N,N-диметил-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамида используют 107,7 г (0,2 моль) (RS)-N,N-{2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетил-морфолида, и гидролиз проводят в течение 5 часов при кипячении. Таким образом получают 72,4 г (78,4%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 19
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что после гидролиза реакционную смесь разбавляют 3500 мл воды, экстрагируют 600 мл этилацетата и 200 мл диизопропилового эфира, остатки органических растворителей удаляют из водного раствора при пониженном давлении и продолжают выполнять процедуру из Примера 13. Таким образом получают 68,1 г (73,8%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 20
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что после гидролиза реакционную смесь разбавляют 3500 мл воды, охлаждают до 0°С, выпавшую кристаллическую натриевую соль цетиризина осаждают в течение 1 часа, фильтруют, затем растворяют в 1000 мл воды, доводят рН до 3,8 добавлением соляной кислоты, затем продолжают выполнять процедуру из Примера 13. Таким образом получают 65,7 г (71,2%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 21
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что гидролиз проводят в присутствии 170 мл (2,0 моль) концентрированной соляной кислоты, и к концу гидролиза рН реакционной смеси доводят до нужного уровня 3,8 с помощью приблизительно 270 мл 40% водного раствора гидроксида натрия. Таким образом получают 70,6 г (76,5%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 22
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что гидролиз проводят в присутствии 170 мл (0,9 моль) 50% серной кислоты, и к концу гидролиза рН реакционной смеси доводят до нужного уровня 3,8 с помощью приблизительно 260 мл 40% водного раствора гидроксида натрия. Таким образом получают 67,3 г (72,9%) названного соединения, т.пл.: 225-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 23
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что к реакционной смеси кроме водного раствора гидроксида натрия прибавляют 2 г Aliquat 336 (хлорид триоктиметиламмония). Таким образом получают 74,9 г (81,2%) названного соединения, т.пл.: 226-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 24
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что к реакционной смеси кроме водного раствора гидроксида натрия прибавляют 1 г 15-краун-5 (1,4,7,10,13-пентаоксациклопентадекан). Таким образом получают 76,1 г (82,5%) названного соединения, т.пл.: 226-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Пример 25
(RS)-{2-[4-(α-Фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты дигидрохлорид
Выполняют процедуру, описанную в Примере 13, с той разницей, что гидролиз проводят в присутствии 280 мл 40% водного раствора гидроксида калия. Таким образом получают 75,0 г (81,3%) названного соединения, т.пл.: 226-228°С. Чистота продукта соответствует требованиям Европейской Фармакопеи, 3, 1997,1084.
Настоящее изобретение относится к способу получения {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}уксусной кислоты (цетиризина) формулы I

заключающемуся в том, что соединение формулы II
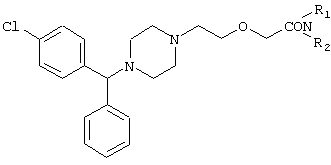
где R1 и R2 независимо представляют собой C1-4алкил, который может быть замещен фенилом, C2-4алкенил или циклогексил, или R1 и R2 образуют вместе с соседним атомом азота морфолиновую группу, гидролизуют, при необходимости в присутствии межфазного катализатора. Цетиризин используется как ингредиент противоаллергических фармацевтических композиций. Описан также способ получения промежуточных продуктов формулы II. 4 с. и 1 з.п. ф-лы.

или ее фармацевтически приемлемой кислотной аддитивной соли или соли металла путем гидролиза соответствующего ацетамида в щелочной или кислой среде и, при необходимости, превращения полученного продукта в кислотную аддитивную соль или соль металла и/или высвобождения основания из кислотной аддитивной соли или соли металла, отличающийся тем, что {2-[4-(α-фенил-п-хлорбензил)пиперазин-1-ил]этокси}ацетамид формулы
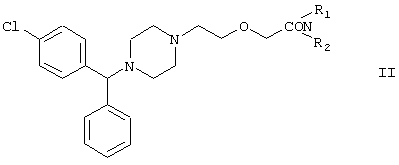
где R1 и R2 независимо представляют собой C1-4алкил, который может быть замещен фенилом, C2-4алкенил или циклогексил, или R1 и R2 образуют вместе с соседним атомом азота морфолиновую группу, или его кислотную аддитивную соль используют в качестве ацетамида, и, при необходимости, проводят гидролиз в присутствии межфазного катализатора.
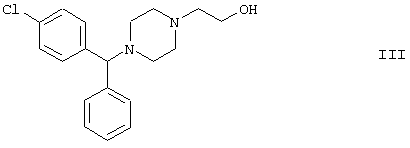
подвергают реакции с 2-галогенацетамидом формулы
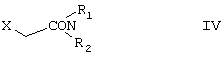
где R1 и R2 определены выше, Х обозначает атом галогена, предпочтительней атом хлора, и, при необходимости, полученное основание формулы II превращают в кислотную аддитивную соль с неорганической или органической кислотой, или основание высвобождают из его кислотной аддитивной соли.
| 2- @ 4-(Дифенилметил)-1-пиперазинил @ -уксусные кислоты или их амиды,или их нетоксичные фармацевтически приемлемые соли,проявляющие спазмолитическую и антигистаминную активность | 1982 |
|
SU1310397A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2005-03-27—Публикация
2000-11-29—Подача