Область, к которой относится изобретение
Настоящее изобретение относится к новым гетероциклическим соединениям и к их фармацевтически приемлемым солям.
Соединения настоящего изобретения обладают действием, снижающим уровень триглицеридов в крови, действием, снижающим уровень холестерина липопротеинов низкой плотности (называемого далее «ЛНП-Х»), а также действием, снижающим уровень глюкозы в крови, действием, снижающим уровень инсулина в крови, или действием, повышающим уровень холестерина липопротеинов высокой плотности (называемого далее «ЛВП-Х»), и действием, уменьшающим атерогенный индекс, который представляет собой отношение не-ЛНП-Х к ЛВП-Х и который вычисляют по формуле: (общий холестерин - ЛВП-Х)/ (ЛВП-Х). Следовательно, соединения настоящего изобретения могут быть использованы для предупреждения и лечения коронарной болезни сердца, инфаркта головного мозга, гиперлипидемии, артериосклероза или сахарного диабета.
Предпосылки создания изобретения
Синдром резистентности к инсулину, осложненный нарушением углеводного и/или липидного метаболизма и гипертензией, привлекает особое внимание специалистов как фактор очень высокого риска возникновения ишемической болезни сердца. Синдром резистентности к инсулину обнаруживается у большинства пациентов, страдающих ожирением и инсулин-независимым сахарным диабетом (ИНСД). Известно, что нарушение метаболизма липидов приводит к увеличению уровня триглицеридов в крови, которое обусловлено, главным образом, повышением уровней хиломикрона, липопротеинов очень низкой плотности и остаточных липопротеинов, которые являются их промежуточными метаболитами, а также снижением уровней ЛВП-Х (Diabetes, 37, 1595-1607 (1988); Arch. Intern. Med., 149, 1514-1520 (1989); Diabetes Care, 14, 173-194 (1991)).
Хотя часто указывалось, что уровень триглицерида является, вероятно, важным фактором риска заболеваний артериосклерозом, однако, явного соответствия между ними не было установлено. На основании недавно полученных результатов артериографии (Circulation, 90, 2230-2235 (1994)) сообщалось, что указанный уровень триглицеридов является независимым фактором риска возникновения ишемической болезни сердца.
Хорошо известно, что уровень ЛВП-Х обратно пропорционален заболеваемости ишемической болезнью сердца, как было выявлено из результатов серии эпидемиологических исследований (Circulation, 79, 8-15 (1989)). Предполагается, что ЛВП участвует в обратном транспорте холестерина в печень из внепеченочных тканей, и в экспериментах на животных, используемых в качестве моделей, было продемонстрировано, что он обладает действием, направленным против артериосклероза (J. Clin. Invest., 85, 1234-1241 (1990); Nature, 353, 265-267 (1991)).
В результате широкомасштабных испытаний по коррекции уровня холестерина было подтверждено, что уровень общего холестерина в крови, а в частности, уровень ЛНП-Х, положительно коррелирует с заболеваемостью ишемической болезнью сердца, и эта заболеваемость может быть снижена путем уменьшения указанного уровня (Lipid Research Clinics Program: JAMA, 251, 351 (1984); Lipid Research Clinics Program: JAMA, 251, 365 (1984)).
В соответствии с этим, соединения, которые способствуют уменьшению уровня триглицеридов и ЛНП-Х в крови, а также увеличению уровня ЛВП-Х или снижению атерогенного индекса, могут быть использованы в качестве лекарственного средства для лечения артериосклероза, особенно для предупреждения или лечения ишемической болезни сердца. Кроме того, ожидается, что соединения, которые повышают резистентность к инсулину, способствуют снижению уровня глюкозы в крови и уровня инсулина в крови и улучшению патологических состояний при таких осложнениях, как сахарный диабет, гиперинсулинемия, гипертензия и ожирение, которые могут быть факторами риска возникновения артериосклеротических заболеваний, и поэтому обладают эффективной превентивной или терапевтической активностью, направленной против артериосклероза.
В настоящее время известно, что 2-арил-5-алкилоксазольные производные или 2-арил-5-алкилтиазольные производные общей формулы (А), которые имеют некоторое сходство с соединениями настоящего изобретения, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
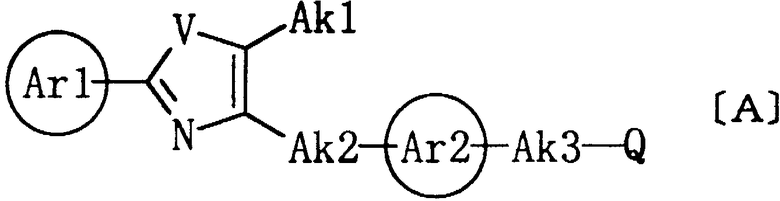
где кольцо Ar1 представляет арил; V представляет кислород или серу; Ak1 представляет водород, алкил или галогеналкил; Ak2 представляет алкилен; Ak3 представляет алкилен, алкенилен или алкинилен, необязательно замещенные алкокси, алкоксикарбонилом, ацилтио, ациламино или арилом; Q представляет карбокси, 2,4-оксазолиндион-5-ил, 2,4-тиазолиндион-5-ил или 1,2,4-оксадиазолидин-3,5-дион-2-ил; а кольцо Ar2 представляет группу формулы [B1] или [B2].
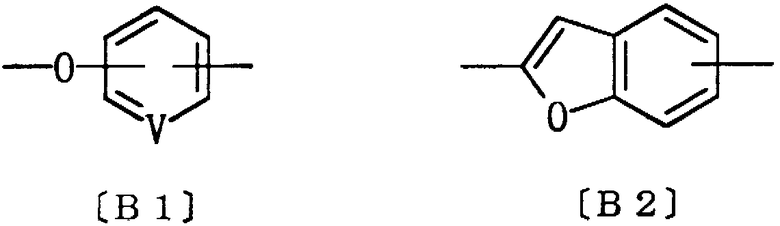
Так, например, в USP 5532256, WO96/05186, JP H7-188227, A, JP S61-85372, A и USP 5401761, сообщалось, что соединения общей формулы (А), а именно 2,4-тиазолидиндионовые производные, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
В JP H9-124623, A, WO95/18125, JP H7-165735, A, USP 5468762 и JP Н8-92228, A указывалось, что соединения общей формулы (А), а именно 2,4-оксазолидиндионовые производные, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
В USP 5510360 и USP 5480896 указывалось, что соединения общей формулы (А), а именно 1,2,4-оксадиазолидин-3,5-дионовые производные, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
В WO99/462325, WO98/00137, WO97/31907, WO96/38415, JP H9-323982, A, JP H8-325264, A, JP Н5-507920, А, USP 5510360 и USP 5480896 указывалось, что соединения общей формулы (А), а именно производные карбоновых кислот, обладают действием, снижающим уровень липидов в крови, или действием, снижающим уровень глюкозы в крови.
Соединения общей формулы (А) отличаются тем, что они имеют:
(1) 2-арил-5-алкилоксазольное кольцо или 2-арил-5-алкилтиазольное кольцо на одном конце;
(2) карбокси, 2,4-оксазолиндион-5-ил, 2,4-тиазолиндион-5-ил или 1,2,4-оксадиазолидин-3,5-дион-2-ил на другом конце; и
(3) ароматическое кольцо, такое как бензол, представленное кольцом Ar2 в данной молекуле.
Кроме того, В ЕР-А-220573 показано, что окзазольные производные общей формулы (В) обладают противоартритной активностью.
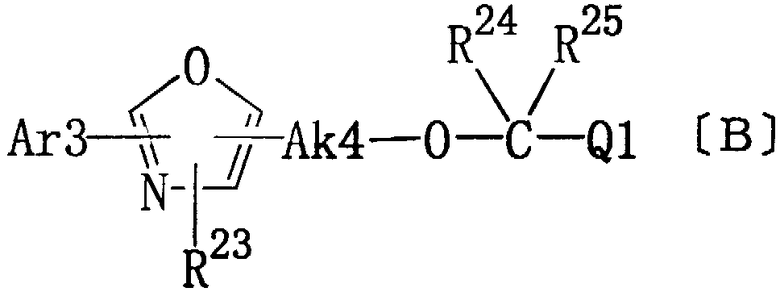
где Ar3 представляет замещенный фенил или тиенил; R23 представляет водород или алкил; Ak4 представляет алкилен, имеющий 1-2 атома углерода; каждый из R24 и R25 представляет алкил; Q1 представляет карбокси, алкоксикарбонил, карбамоил, N-алкилкарбамоил или N,N-диалкилкарбамоил.
Описание изобретения
Одной из целей настоящего изобретения является получение эффективного профилактического или терапевтического средства против гиперлипидемии, артериосклероза, сахарного диабета, гипертензии, ожирения и т.п., которое обладает действием, снижающим уровень триглицеридов в крови; действием, снижающим уровень ЛНП-Х в крови, а также действием, снижающим уровень глюкозы в крови или уровень инсулина в крови, либо действием, повышающим уровень ЛВП-Х в крови, или действием, снижающим атерогенный индекс.
Для достижения этой цели авторами настоящего изобретения были проведены интенсивные исследования, и было обнаружено, что гетероциклические соединения формулы [1], представленной ниже, удовлетворяют поставленной цели и способствуют осуществлению настоящего изобретения.
Таким образом, настоящее изобретение относится к гетероциклическому соединению приведенной ниже формулы [1] или к его фармацевтически приемлемым солям и к фармацевтической композиции, содержащей это соединение в качестве активного ингредиента.
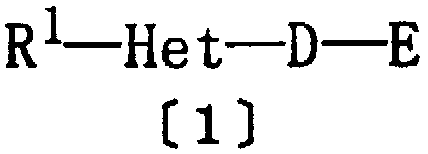
где R1 представляет арил, ароматическую гетероциклическую группу или циклоалкил, где указанная арильная или ароматическая гетероциклическая группа необязательно замещены одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена и нитро;
Het представляет двухвалентную ароматическую гетероциклическую группу, где указанная ароматическая гетероциклическая группа необязательно замещена алкилом или тригалогеналкилом;
D представляет алкилен, алкенилен, алкинилен или группу формулы [2]:
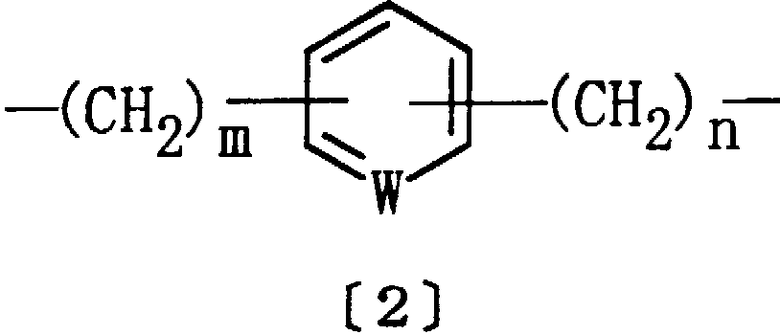
где W представляет СН или азот, m равно целому числу 1-10, а n равно целому числу 0-9, при условии, что m + n равно целому числу 1-10; и
Е представляет группу формулы [3] или [4]:
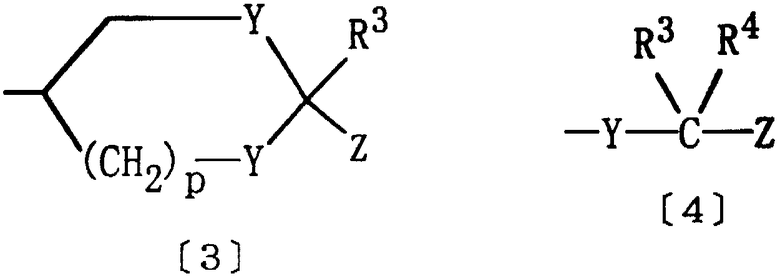
где Y представляет кислород или серу; R3 и R4 являются одинаковыми или различными, и каждый из них представляет водород или алкил; р равно целому числу 0-2; Z представляет карбокси, алкоксикарбонил, гидроксиметил, карбамоил, N-гидроксикарбамоил, N-алкилкарбамоил, N,N-диалкилкарбамоил, циано, 1Н-5-тетразолил, 1-алкил-5-тетразолил или 2-алкил-5-тетразолил, при условии, что если D представляет группу формулы [2], то Е не является группой формулы [4].
Из гетероциклических соединений формулы [1] соединения, в которых Het представляет группу формулы [5z]:
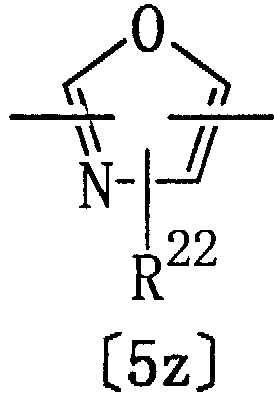
где R22 представляет водород, алкил или тригалогеналкил, D представляет алкилен, имеющий 1-2 атома углерода, Е представляет группу формулы [4], а Y представляет кислород, являются известными соединениями. Однако авторами настоящего изобретения было впервые обнаружено, что соединения формулы [1] обладают действием, снижающим уровень триглицеридов в крови; действием, снижающим уровень ЛНП-Х в крови, а также действием, снижающим уровень глюкозы в крови, уровень инсулина в крови, либо действием, повышающим уровень ЛВП-Х в крови, или действием, снижающим атерогенный индекс.
Гетероциклические соединения [1], отличающиеся от соединений формулы [1], где Het представляет группу формулы [5z]; D представляет алкилен, имеющий 1-2 атома углерода, R22 представляет водород, алкил или тригалогеналкил, Е представляет группу формулы [4], а Y представляет кислород, являются новыми соединениями, которые до сих пор не были описаны ни в одной работе.
Из соединений [1] настоящего изобретения предпочтительными являются соединения, где D представляет алкилен, алкенилен или алкинилен, имеющие 3-10 атомов углерода. Другими предпочтительными соединениями являются соединения, где Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]:
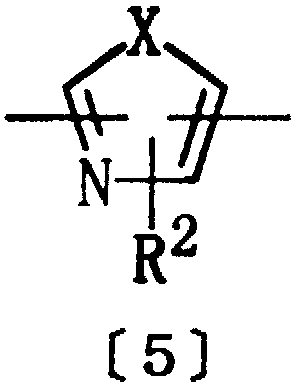
где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, а R2 представляет водород, алкил или тригалогеналкил.
Из соединений [1] настоящего изобретения более предпочтительными являются соединения, где Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]; Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R2 представляет водород, алкил или тригалогеналкил, а D представляет алкилен, алкенилен или алкинилен, имеющие 3-10 атомов углерода.
Из соединений [1] настоящего изобретения еще более предпочтительными являются соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена, тригалогеналкила и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а]:
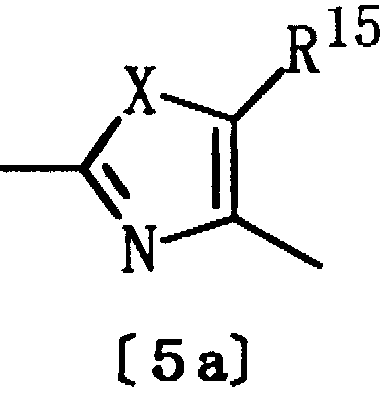
где Х определен выше, R15 представляет алкил или тригалогеналкил, а D представляет алкилен или алкенилен, имеющие 3-7 атомов углерода.
Из соединений [1] настоящего изобретения еще более предпочтительными являются, во-первых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена, тригалогеналкила и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R15 представляет алкил или тригалогеналкил, D представляет алкилен или алкенилен, имеющие 3-5 атомов углерода, Е представляет группу формулы [3], р равно 1, Y представляет кислород, R3 представляет водород или алкил, а Z представляет карбокси или алкоксикарбонил; и во-вторых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R15 представляет алкил или тригалогеналкил, D представляет алкилен, алкенилен или алкинилен, имеющие 5-7 атомов углерода, Е представляет группу формулы [4], Y представляет кислород, R3 и R4 являются одинаковыми или различными, и каждый из них представляет водород или алкил, а Z представляет карбокси или алкоксикарбонил.
Из соединений [1] настоящего изобретения особенно предпочтительными являются, во-первых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, R15 представляет алкил, D представляет алкилен, имеющий 3-5 атомов углерода, Е представляет группу формулы [3], р равно 1, Y представляет кислород, R3 представляет алкил, а Z представляет карбокси; и во-вторых, соединения, где R1 представляет фенил, необязательно замещенный одной или двумя группами, выбранными из алкила, галогена и алкокси; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5а], Х представляет кислород, R15 представляет алкил, D представляет алкилен, алкенилен или алкинилен, имеющие 5-7 атомов углерода, Е представляет группу формулы [4], Y представляет кислород, R3 и R4 являются одинаковыми, и каждый из них представляет водород или алкил, а Z представляет карбокси.
Конкретными примерами предпочтительных соединений [1] настоящего изобретения являются нижеследующие гетероциклические соединения (1)-(14) или их фармацевтически приемлемые соли:
(1) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси]пропионовая кислота,
(2) цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(3) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионовая кислота,
(4) 2-изобутил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(5) 2-этил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(6) 2-метил-цис-5-{4-[5-метил-2-(4-трифторметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(7) 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-(Е)-3-бутенил]-1,3-диоксан-r-2-карбоновая кислота,
(8) цис-5-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоновая кислота,
(9) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропанол,
(10) 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионовая кислота,
(11) 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(12) 2-метил-цис-5-{4-[5-метил-2-(3-фтор-4-метилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(13) 2-метил-цис-5-{4-[5-метил-2-(м-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота и
(14) 2-метил-цис-5-{4-[5-метил-2-(3,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота.
Используемый в описании настоящего изобретения термин «алкил» означает алкильную группу с прямой или разветвленной цепью, имеющую 1-7 атомов углерода, например, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, н-гексил, изогексил, н-гептил и изогептил. Предпочтительными являются алкильные группы с прямой цепью, имеющие 1-3 атомов углерода, например, метил, этил, н-пропил.
Примерами алкильной части групп «галогеналкил», «тригалогеналкил», «алкокси», «алкоксикарбонил», «N-алкилкарбамоил», «N,N-диалкилкарбамоил», «1-алкил-5-тетразолил» и «2-алкил-5-тетразолил» являются алкильные группы, определенные выше.
Термин «циклоалкил» означает циклоалкильную группу, имеющую 4-8 атомов углерода, например, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Предпочтительными являются циклоалкильные группы, имеющие 5-7 атомов углерода.
Термин «алкилен» означает алкиленовую группу с прямой или разветвленной цепью, имеющую 1-10 атомов углерода, например, метилен, этилен, 1-метилэтилен, 2-метилэтилен, триметилен, тетраметилен, пентаметилен, гексаметилен, гептаметилен, октаметилен, нонаметилен и декаметилен. Предпочтительными являются алкиленовые группы, имеющие 3-10 атомов углерода, а более предпочтительными являются алкиленовые группы, имеющие 3-7 атомов углерода.
Термин «алкенилен» означает алкениленовую группу с прямой или разветвленной цепью, имеющую 2-10 атомов углерода, например, этенилен, 1-пропенилен, 2-пропенилен, 1-бутенилен, 2-бутенилен, 3-бутенилен, 1-пентенилен, 2-пентенилен, 3-пентенилен, 4-пентенилен, 4-метил-3-пентенилен, 1-гексенилен, 2-гексенилен, 3-гексенилен, 4-гексенилен, 5-гексенилен, 1-гептенилен, 2-гептенилен, 3-гептенилен, 4-гептенилен, 5-гептенилен, 6-гептенилен, 1-октенилен, 2-октенилен, 3-октенилен, 4-октенилен, 5-октенилен, 6-октенилен, 7-октенилен, 1-ноненилен, 2-ноненилен, 3-ноненилен, 4-ноненилен, 5-ноненилен, 6-ноненилен, 7-ноненилен, 8-ноненилен, 1-деценилен, 2-деценилен, 3-деценилен, 4-деценилен, 5-деценилен, 6-деценилен, 7-деценилен, 8-деценилен и 9-деценилен. Предпочтительными являются алкениленовые группы, имеющие 3-10 атомов углерода, а более предпочтительными являются алкениленовые группы, имеющие 3-7 атомов углерода.
Термин «алкинилен» означает алкиниленовую группу с прямой или разветвленной цепью, имеющую 2-10 атомов углерода, например, этинилен, 1-пропинилен, 2-пропинилен, 1-бутинилен, 2-бутинилен, 3-бутинилен, 1-пентинилен, 2-пентинилен, 3-пентинилен, 4-пентинилен, 2-метил-3-пентинилен, 1-гексинилен, 2-гексинилен, 3-гексинилен, 4-гексинилен, 5-гексинилен, 1-гептинилен, 2-гептинилен, 3-гептинилен, 4-гептинилен, 5-гептинилен, 6-гептинилен, 1-октинилен, 2-октинилен, 3-октинилен, 4-октинилен, 5-октинилен, 6-октинилен, 7-октинилен, 1-нонинилен, 2-нонинилен, 3-нонинилен, 4-нонинилен, 5-нонинилен, 6-нонинилен, 7-нонинилен, 8-нонинилен, 1-децинилен, 2-децинилен, 3-децинилен, 4-децинилен, 5-децинилен, 6-децинилен, 7-децинилен, 8-децинилен и 9-децинилен. Предпочтительными являются алкиниленовые группы, имеющие 3-10 атомов углерода, а более предпочтительными являются алкиниленовые группы, имеющие 3-7 атомов углерода.
Термин «арил» означает арильную группу, имеющую 6-10 атомов углерода, например, фенил, 1-нафтил и 2-нафтил, при этом, предпочтительным является фенил.
Термин «ароматическое гетероциклическое кольцо» означает 5-6-членное ароматическое кольцо, содержащее 1-4 гетероатома, выбранных из азота, кислорода и серы, или указанное ароматическое кольцо, конденсированное с бензольным кольцом. Примерами являются 1-пирролил, 2-пирролил, 3-пирролил, 3-индолил, 2-фурил, 3-фурил, 3-бензофуранил, 2-тиенил, 3-тиенил, 3-бензотиенил, 2-оксазолил, 2-тиазолил, 2-бензотиазолил, 2-имидазолил, 4-имидазолил, 2-бензимидазолил, 1Н-1,2,4-триазол-1-ил, 1Н-тетразол-5-ил, 2-пиридин, 3-пиридил, 4-пиридил, пиридин-1-оксид-2-ил, пиридин-1-оксид-3-ил, пиридин-1-оксид-4-ил, 2-пиримидинил, 4-пиримидинил, 2-пиразинил, 1,3,5-триазин-2-ил.
Термин «двухвалентное ароматическое гетероциклическое кольцо» означает 5-6-членное ароматическое кольцо, содержащее 1-4 гетероатома, выбранных из азота, кислорода и серы, или указанное ароматическое кольцо, конденсированное с бензольным кольцом. Примерами являются пирролилен, индолилен, фуранилен, бензофуранилен, тиенилен, бензотиенилен, оксазолилен, тиазолилен, бензотиазолилен, имидазолилен, бензимидазолилен, 1Н-1,2,4-триазолилен, пиридинилен, пиримидинилен, пиразинилен и 1,3,5-триазинилен.
Примерами «галогена» являются фтор, хлор, бром и иод.
Примерами галогеновой части «галогеналкила» и «тригалогеналкила» является галоген, определенный выше.
Конкретными примерами «тригалогеналкила» являются трифторметил, трихлорметил, 2,2,2-трифторэтил и 2,2,2-трихлорэтил.
Соединения [1] настоящего изобретения могут быть получены способами, проиллюстрированными ниже или в рабочих примерах.
Способ А
Соединение [1а] настоящего изобретения, где Е представляет группу формулы [3], а Z представляет алкоксикарбонил, может быть получено взаимодействием соединения [11] и соединения [22].
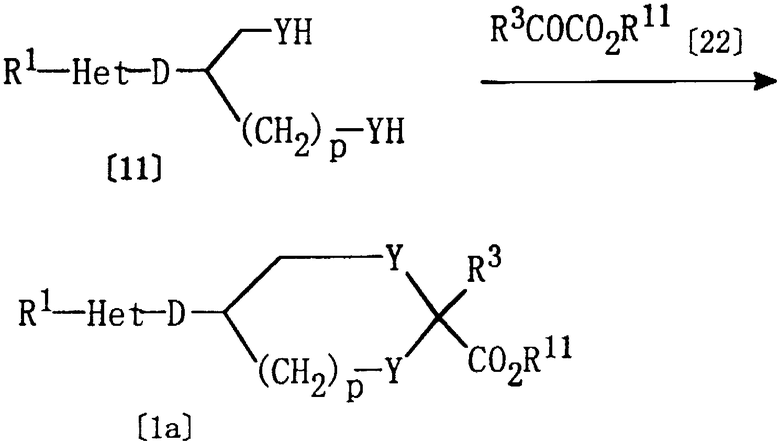
где R1, Het, D, Y, р и R3 являются такими, как они определены выше, а R11 представляет алкил.
Обычно, данная реакция может быть проведена в подходящем растворителе (например, в полярном растворителе, таком как ацетонитрил или N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в сложноэфирном растворителе, таком как метилацетат или этилацетат, в углеводородном растворителе, таком как бензол, толуол или н-гексан, или в их смеси) в присутствии кислоты Льюиса (например, эфиратного комплекса трифторида бора) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [11] и соединения [22] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [22] предпочтительно используется в количестве 1-5 моль на один моль соединения [11].
Способ В
Соединение [1b] настоящего изобретения, где Е представляет группу формулы [4], а Z представляет карбокси, может быть получено по реакции соединения [12] и соединения [13] с последующей обработкой кислотой.
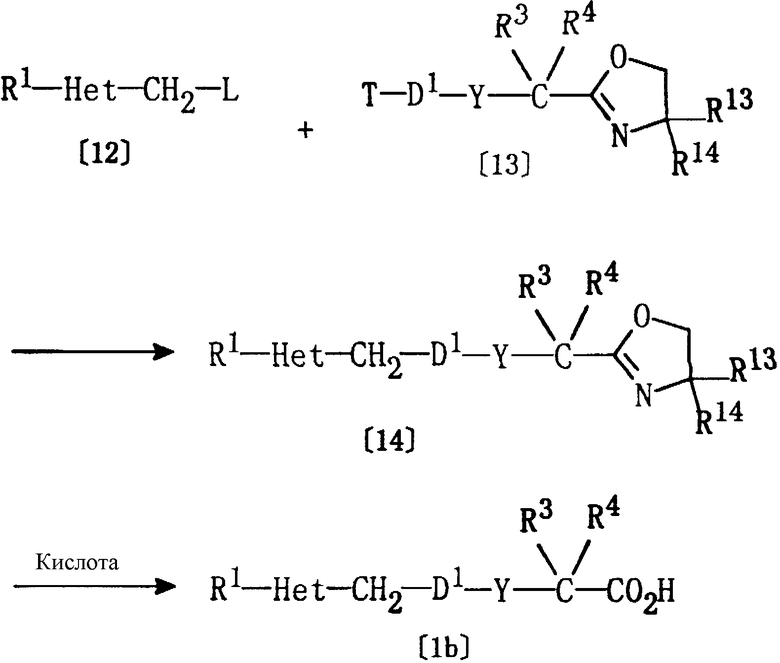
где R1, Het, Y, R3 и R4 являются такими, как они определены выше, L представляет уходящую группу, такую как галоген, метансульфонилокси или толуолсульфонилокси, Т представляет галоген, R13 и R14 являются одинаковыми или различными, и каждый из них представляет алкил, D1 представляет алкилен, алкенилен или алкинилен, имеющий на один атом углерода меньше, чем D (D имеет значения, определенные выше).
Соединение [14] может быть получено, в основном, обработкой соединения [13] металлическим реагентом, таким как бутиллитий или магний, и последующим проведением реакции с соединением [12] в присутствии иодида меди или бромида меди при температуре от -80 до 150°С в апротонном растворителе (например, в полярном растворителе, таком как ацетонитрил или N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в сложноэфирном растворителе, таком как метилацетат или этилацетат, в углеводородном растворителе, таком как бензол, толуол или н-гексан, или в их смеси). Хотя время реакции может варьироваться в зависимости от вида соединения [12], соединения [13] и металлического реагента или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Металлический реагент и соединение [12] предпочтительно используются в количестве 1-1,2 моль на один моль соединения [13].
Соединение [1b] может быть, в основном, получено обработкой соединения [14] кислотой (например, хлористоводородной кислотой) в спиртовом растворителе (например, в метаноле или этаноле) при температуре от -80 до 80°С в течение периода времени от 5 минут до 24 часов.
Способ С
Соединение [1с], где D представляет алкенилен, который присоединен к Het в части с ненасыщенной связью, может быть получено по реакции Виттига с использованием соединения [15] и соединения [16].
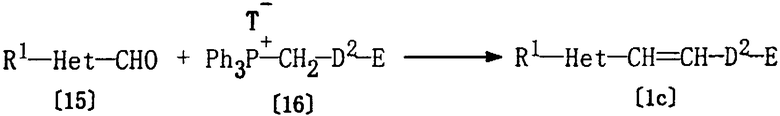
где R1, Het, Е и Т являются такими, как они определены выше, Ph представляет фенил, D2 представляет алкенилен, имеющий на два атома углерода меньше, чем D (D имеет значения, определенные выше), или группу формулы [2].
Указанная реакция, обычно, может быть осуществлена в том же растворителе, который был использован в описанном выше способе А, в присутствии основания (например, гидроксида натрия) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [15] и соединения [16] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [16] предпочтительно используется в количестве 1-1,2 моль на один моль соединения [15].
Способ D
Соединение [1d] настоящего изобретения, где Het представляет группу формулы [5а]:

где Х и R15 являются такими, как они определены выше, Е представляет группу формулы [3] или [4], а Z представляет алкоксикарбонил, может быть также получено по реакции соединения [17] с оксихлоридом фосфора, тионилхлоридом, пентоксидом фосфора, метильным реагентом Дэви (2,4-бис(метилтио)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом), реактивом Лавессона (2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом), аммиаком или алкиламином. При использовании оксихлорида фосфора, тионилхлорида или пентоксида фосфора могут быть получены оксазольные производные; при использовании метильного реагента Дэви или реагента Лавессона могут быть получены тиазольные производные; а при использовании аммиака или алкиламина могут быть получены имидазольные производные.

где R1, D и R15 являются такими, как они определены выше, а Е представляет группу формулы [31] или [41]:
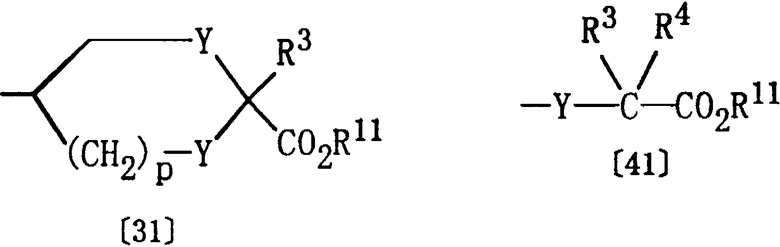
где R3, R4, R11, Y и р являются такими, как они определены выше.
Обычно данная реакция может быть проведена в подходящем растворителе (например, в углеводородном растворителе, таком как бензол, толуол или ксилол, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в полярном растворителе, таком как N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в уксусной кислоте или в их смеси) при температуре от -10 до 200°С. Хотя время реакции зависит от вида реагента (например, оксихлорида фосфора, реагента Лавессона, алкиламина), вида соединения [17] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Оксихлорид фосфора, тионилхлорид, пентоксид фосфора, метильный реагент Дэви, реагент Лавессона, аммиак или алкиламин предпочтительно используются в количестве 1-10 моль на один моль соединения [17].
Способ Е
Соединение [1е] настоящего изобретения, где Het представляет указанную выше группу формулы [5а], Е представляет группу формулы [4], а Z представляет алкоксикарбонил, может быть получено по реакции соединения [18] и соединения [19].
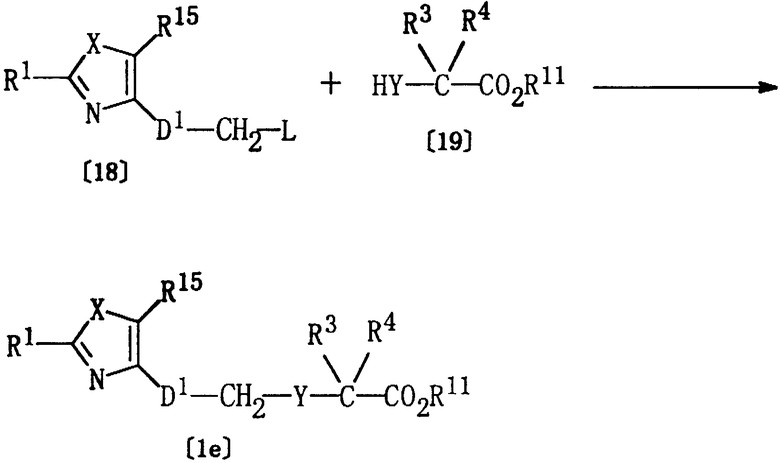
где R1, R3, R4, R11, R15, Х, Y, L и D1 являются такими, как они определены выше.
Указанная реакция может быть осуществлена, обычно, в таком же растворителе, который был использован в описанном выше способе А, в присутствии основания (например, гидрида натрия или карбоната натрия) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [18] и соединения [19] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [19] предпочтительно используется в количестве 1-1,2 моль на один моль соединения [18].
Способ F
Соединение [1d] настоящего изобретения, где Het представляет указанную выше группу формулы [5а], может быть получено по реакции соединения [20] и соединения [21].
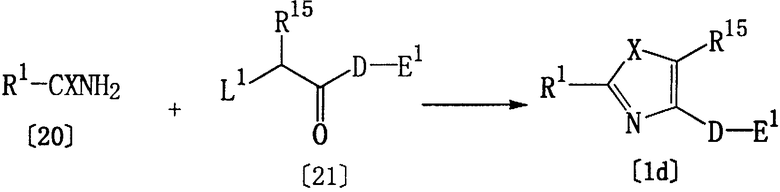
где R1, R15, D, Е1 и Х являются такими, как они определены выше, а L1 представляет хлор или бром.
Указанная реакция может быть осуществлена, обычно, в отсутствие растворителя или в растворителе, который был использован в описанном выше способе А, в присутствии основания (например, гидрида натрия или карбоната натрия) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [20] и соединения [21] или от температуры реакции, однако, обычно, подходящее время реакции составляет от 30 минут до 24 часов. Соединение [21] предпочтительно используется в количестве 1-1,2 моль на один моль соединения [20].
Способ G
Соединение формулы [1h] настоящего изобретения, где Z представляет карбокси, может быть получено гидролизом соединения формулы [1g] настоящего изобретения, где Z представляет алкоксикарбонил.
Соединение [1g] настоящего изобретения может быть получено конденсацией соединения [1h] настоящего изобретения со спиртом [73] или взаимодействием с алкилирующим агентом.
Кроме того, соединение [1i] настоящего изобретения, где Z представляет карбамоил, N-гидроксикарбамоил, N-алкилкарбамоил или N,N-диалкилкарбамоил, может быть получено взаимодействием соединения [1h] настоящего изобретения с соединением [82], то есть, аммиаком, гидроксиламином, алкиламином или диалкиламином.
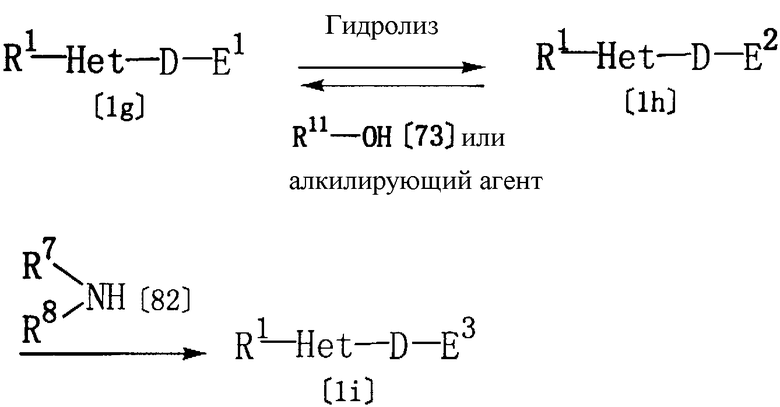
где R1, R11, Het, D и Е1 определены выше; R7 представляет водород, а R8 представляет водород, гидрокси или алкил, либо R7 представляет алкил, и R8 представляет алкил; Е2 представляет группу формулы [32] или [42]; Е3 представляет группу формулы [33] или [43]:
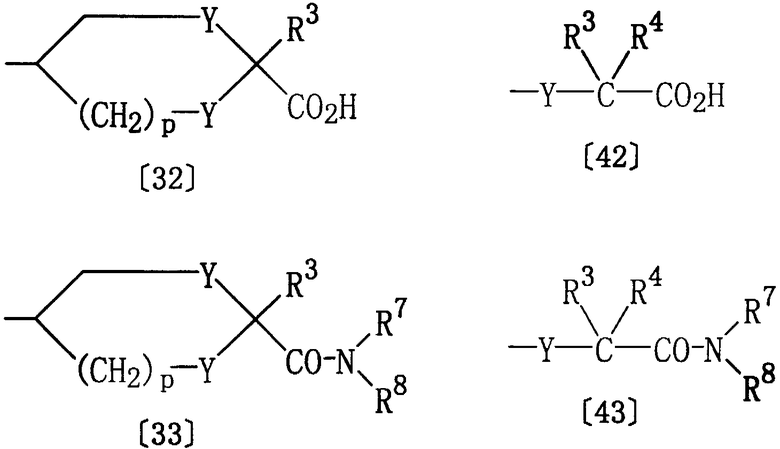
где R3, R4, R7, R8, Y и р определены выше.
Гидролиз соединения [1g] может быть, обычно, проведен в смешанном спиртовом растворителе, таком как метанол, этанол, изопропанол или трет-бутиловый спирт и вода, в присутствии кислоты (например, хлористоводородной кислоты, серной кислоты или п-толуолсульфоновой кислоты) или основания (например, гидроксида натрия или гидроксида калия) при температуре от -20 до 150°С. Хотя время реакции варьируется в зависимости от вида соединения [1g] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Кислота или основание предпочтительно используются в количестве 1-20 моль на один моль соединения [1g].
Конденсация соединения [1h] и спирта [73] может быть, обычно, проведена с использованием спирта в качестве растворителя в присутствии кислоты (например, хлористоводородной кислоты, серной кислоты или п-толуолсульфоновой кислоты) при температуре от -20 до 150°С. Хотя время реакции варьируется в зависимости от вида соединения [1h], вида спирта или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Кислота или основание предпочтительно используется в количестве 0,1-1,2 моль на 1 моль соединения [1h].
Указанная реакция конденсации может быть также осуществлена в таком же растворителе, который был использован в описанном выше способе А, в присутствии конденсирующего агента (например, N,N'-дициклогексилкарбодиимида или 1,1'-карбонилдиимидазола) при температуре от -20 до 150°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1h], вида спирта или конденсирующего агента, или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Конденсирующий агент, предпочтительно, используется в количестве 1-1,2 моль на 1 моль соединения [1h].
Реакция между соединением [1h] и алкилирующим агентом (например, триметилсилилдиазометаном/метанолом, метилиодидом) может быть осуществлена в таком же растворителе, который был использован в описанном выше способе А, при (-20)-(150)°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1h], вида алкилирующего агента или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Алкилирующий агент, предпочтительно, используется в количестве 1-2 моль на 1 моль соединения [1h].
Реакция между соединением [1h] и соединением [82] может быть осуществлена способом, аналогичным способу проведения указанной реакции конденсации соединения [1h] и спирта [73]. Кроме того, соединение [1i] настоящего изобретения может быть получено по реакции реакционноспособного производного соединения [1h] и соединения [82], проводимой известным способом. Примерами реакционноспособных производных являются реагенты, в основном, используемые в реакции амидирования, такие как галогенангидриды (хлорангидрид или бромангидрид), смешанный ангидрид кислоты, активированный амид и т.п.
Так, например, если в качестве реакционноспособного производного используется галогенангидрид, то реакция может быть проведена в апротонном растворителе (например, в полярном растворителе, таком как ацетонитрил или N,N-диметилформамид (ДМФ), в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в углеводородном растворителе, таком как бензол, толуол или н-гексан, или в их смеси) в присутствии основания (например, карбоната калия, карбоната натрия, гидрокарбоната натрия, гидрокарбоната калия, пиридина, 4-диметиламинопиридина, триэтиламина, гидроксида натрия) при температуре от -20 до 100°С. Хотя время реакции варьируется в зависимости от вида галогенангидрида и соединения [82] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Соединение [82] предпочтительно используется в количестве 1-1,2 моль на один моль галогенангидрида.
Способ Н
Соединение [1k] настоящего изобретения, где D представляет алкенилен, который присоединен к Het в части с ненасыщенной связью, может быть также получено дегидрированием соединения [1j] настоящего изобретения, где D представляет алкилен.
Кроме того, соединение [1k] настоящего изобретения может быть также получено гидрированием соединения [1m] настоящего изобретения, где D представляет алкинилен, который присоединен к Het в части с ненасыщенной связью.
Соединение [1j] настоящего изобретения может быть также получено гидрированием соединения [1k] настоящего изобретения.
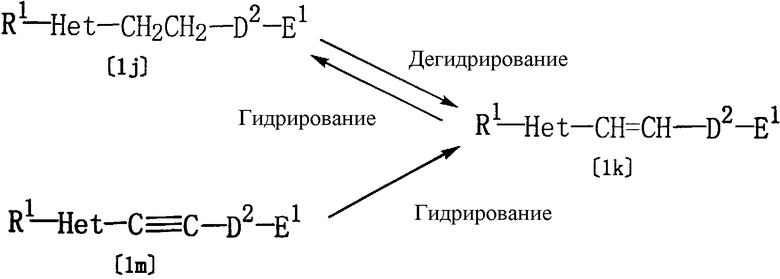
где R1, Het, D2 и Е1 определены выше.
Дегидрирование соединения [1j] может быть проведено по реакции указанного соединения с N-бромсукцинимидом (NBS) или с N-хлорсукцинимидом (NCS) в таком же растворителе, который был использован в описанном выше способе А, при температуре от -20 до 150°С, с последующей реакцией с основанием (например, гидроксидом натрия или гидроксидом калия) в спиртовом растворителе, таком как метанол или этанол. Хотя время реакции может варьироваться в зависимости от вида соединения [1j] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. NBS, NCS или основание, предпочтительно, используются в количестве 1-1,2 моль на 1 моль соединения [1j].
Гидрирование соединения [1m] может быть проведено в спиртовом растворителе (например, в метаноле или этаноле) в присутствии палладиевого катализатора (например, палладия на карбонате кальция или палладия на угле) при (-20)-(150)°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1m], от палладиевого катализатора или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Палладиевый катализатор, предпочтительно, используется в количестве 0,05-0,5 моль на 1 моль соединения [1m].
Гидрирование соединения [1k] может быть проведено в спиртовом растворителе (например, в метаноле или этаноле) в присутствии палладиевого катализатора (например, палладия на угле) при (-20)-(150)°С. Хотя время реакции может варьироваться в зависимости от вида соединения [1k], от палладиевого катализатора или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Палладиевый катализатор, предпочтительно, используется в количестве 0,05-0,2 моль на 1 моль соединения [1k].
Способ I
Соединение [1n] настоящего изобретения, где Z представляет гидроксиметил, может быть получено восстановлением соединения [1g] настоящего изобретения, где Z представляет алкоксикарбонил.
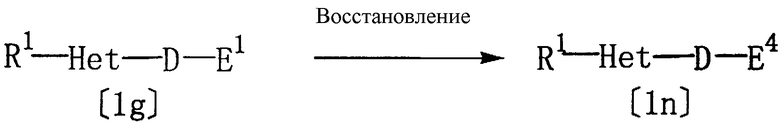
где R1, Het, D и Е1 определены выше, а Е4 представляет группу следующих формул [34] или [44]:
где R3, R4, Y и р определены выше.
Данная реакция может быть осуществлена в присутствии восстановителя (например, алюмогидрида лития, боргидрида натрия или диизобутилалюмогидрида лития) в соответствующем растворителе (например, в эфирном растворителе, таком как тетрагидрофуран (ТГФ) или диэтиловый эфир, в полярном растворителе, таком как N,N-диметилформамид (ДМФ) или диметилсульфоксид, в спиртовом растворителе, таком как метанол, этанол или изопропанол, или в их смеси) при (-20)-(100)°С. Хотя время реакции варьируется в зависимости от вида соединения [1g] или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Восстановитель, предпочтительно, используется в количестве 0,5-2 моль на один моль соединения [1g].
Способ J
Соединение [1q], где Е представляет группу формулы [3] или [4], а Z представляет циано, может быть получено из соединения [1р] настоящего изобретения, где Z представляет карбамоил или N-гидроксикарбамоил.

где R1, Het и D определены выше, а Е5 представляет группу следующих формул [35] или [45], а Е6 представляет группу следующих формул [36] или [46]:
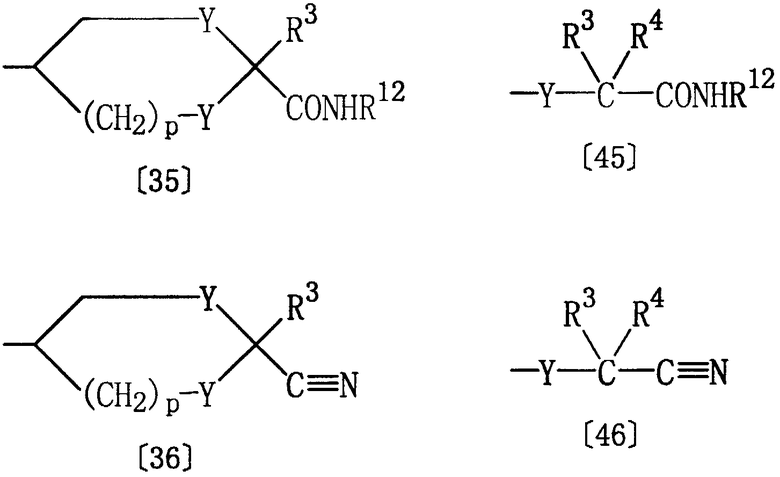
где R3, R4, Y и р определены выше, а R12 представляет водород или гидрокси.
Если используется исходное соединение, где Z представляет карбамоил, то есть, R12 представляет водород, то оно может быть, обычно, обработано дегидратирующим агентом (например, пентоксидом фосфора, тионилхлоридом, трифторуксусным ангидридом или N,N'-дициклогексилкарбодиимидом) в отсутствие растворителя или в растворителе, аналогичном растворителю, используемому в описанном выше способе А. Хотя время реакции варьируется в зависимости от вида соединения [1р], вида дегидратирующего агента или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 24 часов. Дегидратирующий агент, предпочтительно, используется в количестве 1-5 моль на 1 моль соединения [1р].
Если используется исходное соединение, где Z представляет N-гидроксикарбамоил, то есть, R12 представляет гидрокси, то данная реакция может быть осуществлена по методике, описанной A. Liguori et al., Synthesis, 168 (1987).
Способ К
Соединение [1r] настоящего изобретения, где Е представляет группу формулы [3] или [4], а Z представляет 1Н-5-тетразолил, может быть получено по реакции соединения [1q] настоящего изобретения, где Z представляет циано, с азидом.

где R1, Het, D и Е6 определены выше, а Е7 представляет группу формулы [37] или [47]:
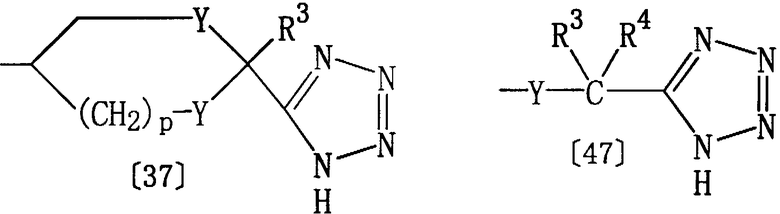
где R3, R4, Y и р определены выше.
Данная реакция может быть, обычно, проведена в подходящем растворителе (например, в спиртовом растворителе, таком как метанол, этанол или метоксиэтанол, в углеводородном растворителе, таком как бензол или толуол, в галогенированном углеводородном растворителе, таком как хлороформ или дихлорметан, в полярном растворителе, таком как N,N-диметилформамид (ДМФ) или диметилсульфоксид, в эфирном растворителе, таком как тетрагидрофуран (ТГФ), или в их смеси) в присутствии азида (например, азида натрия, триметилсиланазида или азида трибутилолова) при 0-200°С. Данная реакция может быть проведена в присутствии добавки, такой как хлорид лития или хлорид аммония. Хотя время реакции зависит от вида соединения [1q], вида азида или температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 100 часов.
Способ L
Соединение [1s] настоящего изобретения, где Е представляет группу формулы [3] или [4], а Z представляет 1-алкил-5-тетразолил или 2-алкил-5-тетразолил, может быть получено по реакции соединения [1r] настоящего изобретения, где Z представляет 1Н-5-тетразолил, с алкилирующим агентом.
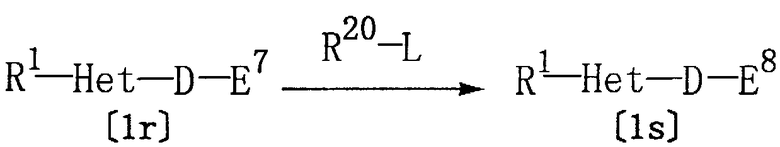
где R1, Het, D, Е7 и L определены выше, R20 представляет алкил, а Е8 представляет группу формулы [38] или [48]:
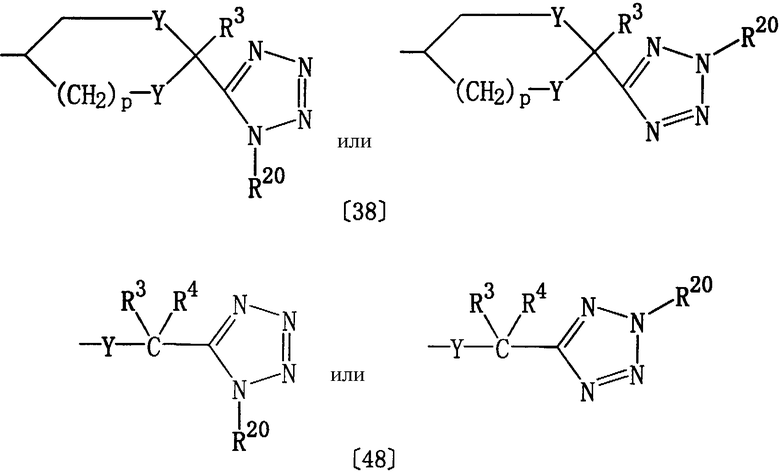
где R3, R4, Y, р и R20 определены выше.
Данная реакция может быть проведена, например, в таком же растворителе, который был использован в описанном выше способе А, в присутствии алкилирующего агента (например, алкилгалогенида, алкилмезилата или алкилтозилата) и основания при 0-150°С. Примерами используемого основания являются органический амин (например, пиридин или триэтиламин), гидрид металла (например, гидрид натрия), неорганическое основание (например, карбонат калия, гидрокарбонат натрия или гидроксид натрия). Хотя время реакции может варьироваться в зависимости от вида исходного соединения или от температуры реакции, однако, в основном, подходящее время реакции должно составлять от 30 минут до 100 часов. Галогенирующий агент и основание, предпочтительно, используются в количестве 1-10 моль, а предпочтительно, 1-5 моль на 1 моль соединения [1r].
Соединения настоящего изобретения могут существовать в виде таутомеров. Настоящее изобретение относится к соответствующим таутомерам, которые входят в его объем.
Соединения настоящего изобретения могут существовать в виде геометрических изомеров, что обусловлено присутствием двойной связи. Настоящее изобретение относится к соответствующим геометрическим изомерам и их смесям.
Соединения настоящего изобретения могут существовать в виде стереоизомеров, что обусловлено присутствием асимметрического атома углерода. Настоящее изобретение относится к соответствующим стереоизомерам и их смесям.
Такой стереоизомер может быть получен из смеси с помощью колоночной хроматографии на силикагеле.
Кроме того, указанный стереоизомер может быть получен из смеси с помощью жидкостной хроматографии на колонке для разделения оптически активного вещества (например, CHIRALCEL(OD, CHIRALCEL(OF, DAICEL, Ltd.).
Если соединение настоящего изобретения имеет карбоксигруппу, то оно может быть превращено в фармацевтически приемлемую соль известным способом. Примерами фармацевтически приемлемой соли являются соль щелочного металла (например, соль натрия, соль калия и т.п.), соль щелочноземельного металла (например, соль кальция, соль магния и т.п.), соль аммония, соль, образованная органическим амином (например, триэтиламином, лизином, аргинином и т.п.), и т.п.
Так, например, соль щелочного металла настоящего изобретения может быть получена добавлением одного эквивалента гидроксида натрия или гидроксида калия к соединению настоящего изобретения, предпочтительно, в спиртовом растворителе.
Соль щелочноземельного металла настоящего изобретения может быть получена растворением соли щелочного металла, полученной описанным выше способом, в воде, метаноле, этаноле или в смешанном растворителе, и добавлением одного эквивалента хлорида кальция или т.п.
Если соединение настоящего изобретения является основным, то оно может быть превращено в фармацевтически приемлемую соль известным способом. Примерами такой соли являются соль, образованная неорганической кислотой, такой как хлористоводородная кислота, серная кислота, азотная кислота, фосфорная кислота или т.п.; или соль, образованная органической кислотой, такой как фумаровая кислота, малеиновая кислота, метансульфоновая кислота, п-толуолсульфоновая кислота или т.п.Так, например, гидрохлорид соединения настоящего изобретения может быть получен добавлением одного эквивалента хлористоводородной кислоты к соединению настоящего изобретения, предпочтительно, в спиртовом растворителе.
Соединение настоящего изобретения или его соль могут быть выделены и очищены из реакционной смеси описанной выше реакции любым стандартным способом, например, таким как экстракция, концентрирование, нейтрализация, фильтрация, перекристаллизация, колоночная хроматография, тонкослойная хроматография и т.п.
Соединения, используемые в качестве исходных веществ для получения соединения настоящего изобретения, являются известными соединениями, либо они могут быть получены, например, способами, проиллюстрированными ниже, или способами, описанными в ссылочных примерах.
Получение соединений [11а] и [11b]
Из соединений формулы [11], используемых в качестве исходных веществ в способе А, соединения, где D представляет СН2-D1, а Y представляет кислород (соединение [11а]) или серу (соединение [11b]), могут быть получены в соответствии со следующими методиками.
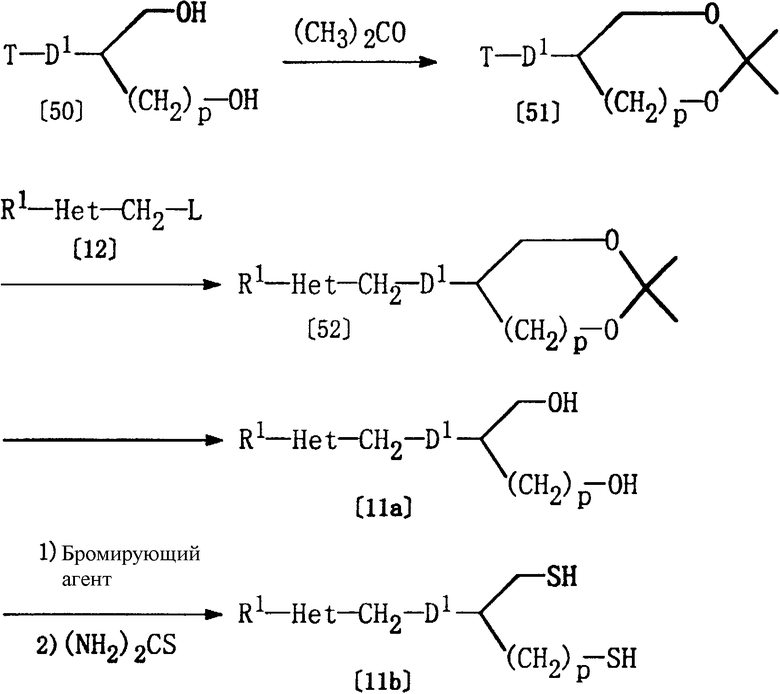
где R1, Het, D1, р, Т и L определены выше.
Соединение [51] может быть получено дегидратационной конденсацией соединения [50] и ацетона в соответствующем растворителе (например, в бензоле) в присутствии кислотного катализатора (например, п-толуолсульфоновой кислоты).
Соединение [52] может быть получено добавлением три-н-бутилфосфина и иодида меди к соединению [51] в соответствующем растворителе (например, в безводном тетрагидрофуране) и осуществлением реакции с соединением [12] при температуре -60°С или ниже. Вместо три-н-бутилфосфина и иодида меди может быть использован магний.
Соединение [11а] может быть получено обработкой соединения [52] в соответствующем растворителе (например, в этаноле или в метаноле) в кислой среде (например, в присутствии п-толуолсульфоната пиридиния) при 0-100°С.
Соединение [11b] может быть получено превращением соединения [11а] в бромид по реакции с бромирующим агентом (например, с трифенилфосфином/тетрабромметаном или трибромидом фосфора) в соответствующем растворителе (например, в тетрагидрофуране, бензоле), а затем реакцией с тиомочевиной при температуре от -20 до 100°С.
Получение соединения [50а]
Из соединений формулы [50], используемых в качестве исходных веществ для получения соединения [11а], описанного выше, соединение [50а], где р равно 1, может быть получено в соответствии со следующими методиками.
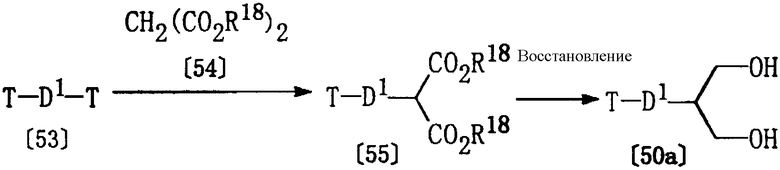
где D1 и Т определены выше, а R18 представляет алкил.
Соединение [55] может быть получено по реакции соединения [53] и диэфира малоновой кислоты [54] в соответствующем растворителе (например, в безводном тетрагидрофуране) в присутствии основного катализатора (например, гидрида натрия) при температуре от -50 до 100°С.
Соединение [50а] может быть получено реакцией соединения [55] по методике, описанной выше в Способе I.
Получение соединения [50b]
Из соединений формулы [50], используемых в качестве исходных веществ для получения соединения [11а], описанного выше, соединения [50b], где р равно 0, могут быть получены в соответствии со следующими методиками.
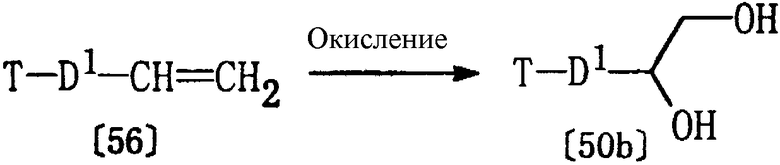
где D1 и Т определены выше.
Соединение [50b] может быть получено по реакции соединения [56] с окислителем (например, тетроксидом осмия) в соответствующем растворителе (например, в диэтиловом эфире) при температуре от -20 до 50°С.
Получение соединения [50с]
Из соединений формулы [50], используемых в качестве исходных веществ для получения соединения [11а], описанного выше, соединения [50с], где р равно 2, могут быть получены в соответствии со следующими методиками.
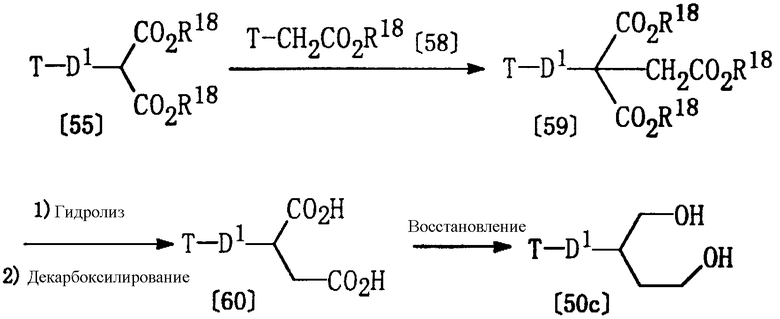
где D1, Т и R18 определены выше.
Соединение [59] может быть получено по реакции соединения [55] и соединения [58] в соответствующем растворителе (например, в тетрагидрофуране или этаноле) в присутствии основания (например, алкоксида натрия, такого как этоксид натрия или гидрид натрия) при температуре от -20°С до комнатной температуры.
Соединение [60] может быть получено гидролизом соединения [59] по методике, описанной выше в Способе G, с последующим проведением реакции декарбоксилирования нагреванием при 50-150°С в отсутствие растворителя или в соответствующем растворителе (например, в ксилоле, толуоле, этилацетате или в их смеси).
Соединение [50с] может быть получено восстановлением соединения [60] по методике, описанной выше в Способе I.
Соединение [50с] может быть также получено этерификацией соединения [60] стандартным способом, с последующим восстановлением, как описано выше.
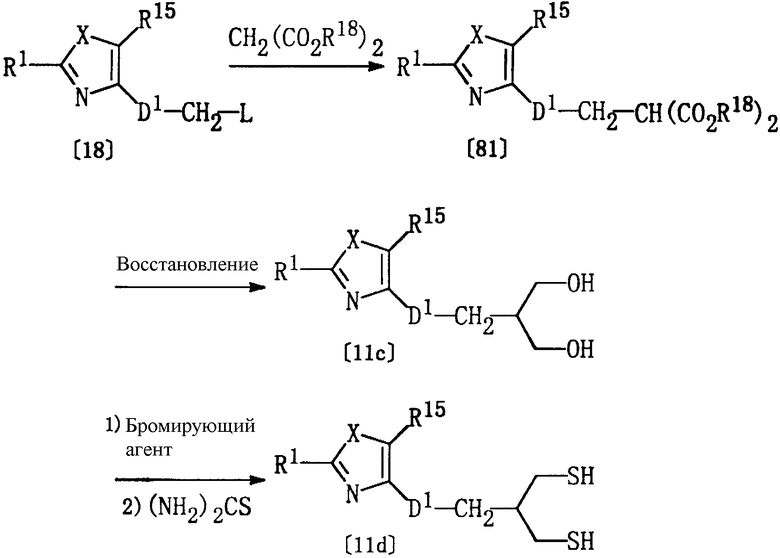
Получение соединений [11с] и [11d]
Из соединений формулы [11], используемых в качестве исходных веществ в способе А, соединения, где Het представляет группу формулы [5а], D представляет D1-СН2, р равно 1, а Y представляет кислород (соединение [11с]) или серу (соединение [11d]), могут быть получены в соответствии со следующими методиками.
где R1, R15, R18, D1, Х и L определены выше.
Соединение [81] может быть получено по реакции соединения [18] и диалкилмалоновой кислоты [54] в соответствующем растворителе (например, в тетрагидрофуране или этаноле) в присутствии основания (например, алкоксида натрия, такого как этоксид натрия или гидрид натрия) при температуре в пределах от -20°С до комнатной температуры.
Соединение [11с] может быть получено реакцией соединения [81] по методике, описанной выше в Способе I.
Соединение [11d] может быть получено реакцией соединения [11c] по методике, аналогичной получению соединения [11b] из соединения [11а].
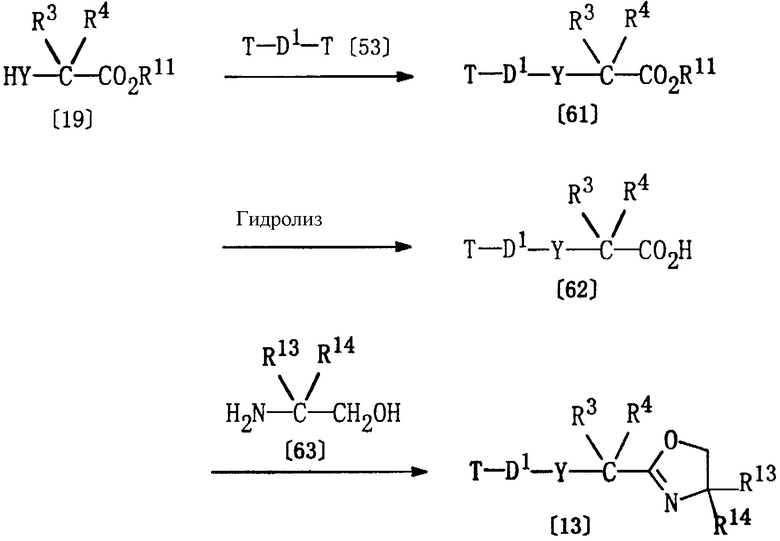
Получение соединения [13]
Соединение формулы [13], используемое в качестве исходного вещества в способе В, может быть получено в соответствии со следующими методиками.
где R3, R4, R11, R13, R14, D1, Y и Т определены выше.
Соединение [61] может быть получено по реакции соединения [19] и соединения [53], как описано в Способе Е.
Соединение [62] может быть получено обработкой соединения [61] по методике гидролиза, описанного выше в Способе G.
Соединение [13] может быть получено по реакции соединения [62] и соединения [63] в соответствующем растворителе (например, в толуоле) при 90-150°С.
Получение соединения [16]
Соединение [16], используемое в качестве исходного вещества в способе С, может быть получено в соответствии со следующими методиками.
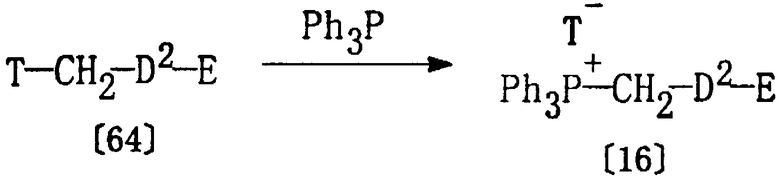
где Е, D2, Т и Ph определены выше.
Соединение [16] может быть получено по реакции соединения [64] и трифенилфосфина в растворителе, аналогичном растворителю, описанному выше в Способе А, при температуре от -20 до 150°С.
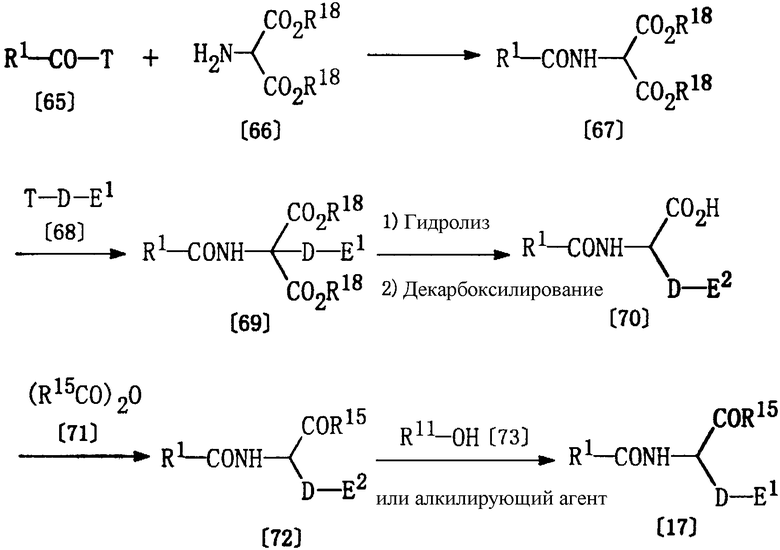
Получение соединения [17]
Соединение формулы [17], используемое в качестве исходного соединения в способе D, может быть получено в соответствии со следующими методиками.
где R1, R11, R15, R18, Е1, Е2, D и Т определены выше.
Соединение [67] может быть получено по реакции соединения [65] и соединения [66] в растворителе, аналогичном растворителю, описанному выше в Способе А, в присутствии основания (например, триэтиламина или диметиланилина) при температуре от -20 до 150°С.
Соединение [69] может быть получено из соединений [67] и [68] по методике, описанной выше для получения соединения [59].
Соединение [70] может быть получено из соединения [69] по методике, описанной выше для получения соединения [60].
Соединение [72] может быть получено по реакции соединения [70] и соединения [71] в соответствующем растворителе (например, в пиридине) при 50-110°С, а затем, после добавления воды, при 30-100°С.
Соединение [17] может быть получено реакцией соединения [72], проводимой как описано выше в Способе G, где соединение [1g] получают из соединения [1h].
Получение соединения [68а]
Из соединений формулы [68], используемых в качестве исходных веществ для получения соединения [17], соединение [68а], где Е1 представляет группу формулы [31], может быть получено в соответствии со следующими методиками.
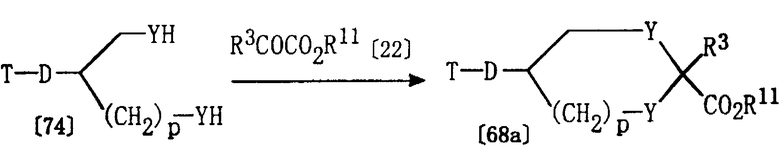
где D, Т, Y, р, R3 и R11 определены выше.
Соединение [68а] может быть получено по реакции соединения [22] и соединения [74], которое может быть получено по методике получения соединения [50], описанной выше в Способе А.
Получение соединения [68b]
Из соединений формулы [68], используемых в качестве исходных веществ для получения соединения [17], соединения [68b], где Е1 представляет группу формулы [41], могут быть получены в соответствии со следующими методиками.
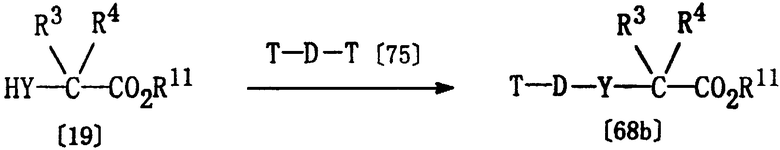
где D, Т, Y, R3, R4 и R11 определены выше.
Соединение [68b] может быть получено реакцией соединения [19] и соединения [75], по методике получения соединения [61], описанной выше.
Получение соединения [18]
Соединение формулы [18], используемое в качестве исходного вещества в способе Е, может быть получено в соответствии со следующими методиками.
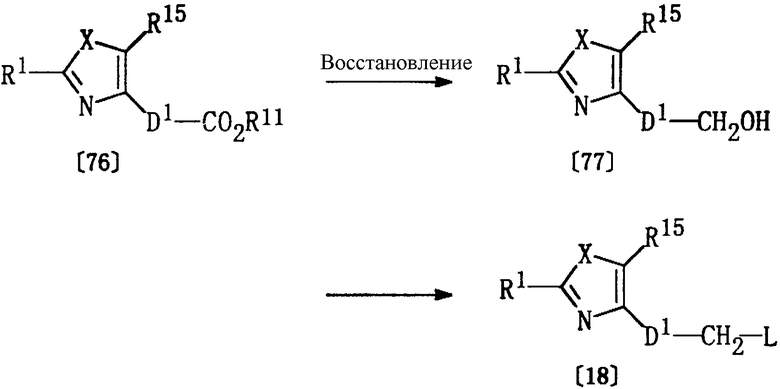
где R1, R11, R15, Х, D1 и L определены выше.
Соединение [77] может быть получено из соединения [76], полученного как описано выше в Способе D, по методике, описанной выше в Способе I.
Соединение [18] может быть получено по реакции соединения [77] и бромирующего агента (например, трифенилфосфина/тетрабромметана) или сульфонилгалогенида (например, п-толуолсульфонилхлорида) в растворителе, аналогичном растворителю, описанному выше в Способе А, при температуре от -20 до 150°С.
Получение соединения [21]
Соединение формулы [21], используемое в качестве исходного вещества в способе F, может быть получено в соответствии со следующими методиками.
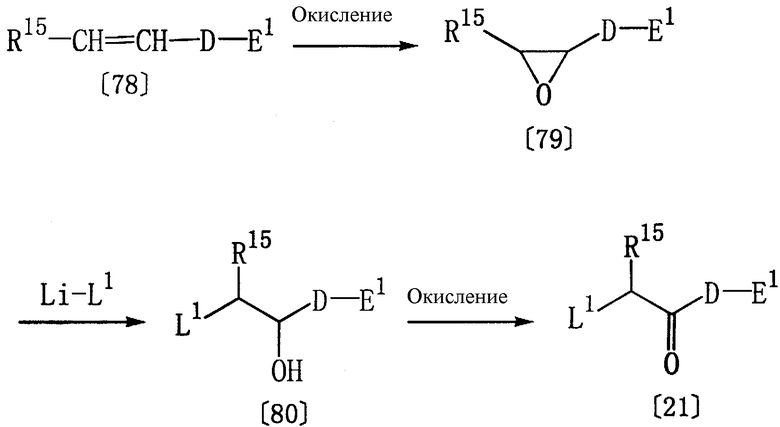
где R15, D, Е1 и L1 определены выше.
Соединение [79] может быть получено по реакции соединения [78] с окислителем (например, м-хлорпербензойной кислотой) в соответствующем растворителе (например, в дихлорметане) при температуре в пределах от -10°С до комнатной температуры.
Соединение [80] может быть получено по реакции соединения [79] с хлоридом лития или бромидом лития в соответствующем растворителе (например, в безводном тетрагидрофуране) при комнатной температуре.
Соединение [21] может быть получено по реакции соединения [80] с реагентом Джонсона (например, с концентрированной серной кислотой и оксидом хрома(VI)) при комнатной температуре.
Соединение настоящего изобретения обладает действием, снижающим уровень триглицеридов в крови, и действием, снижающим уровень ЛНП-Х в крови, и поэтому оно может быть использовано для предупреждения и лечения таких заболеваний, как гиперлипидемия, вызываемая повышенным уровнем триглицеридов или уровнем общего холестерина в крови.
Соединения настоящего изобретения обнаруживали различные эффекты на КК-Ау-мышиной модели инсулин-независимого диабета (ИНСД), который приводил к развитию гипертриглицеридемии, гипергликемии и гиперинсулинемии, например, такие эффекты, как снижение уровня триглицеридов в крови, снижение уровней холестерина липопротеинов очень низкой плотности (далее называемого «ЛОНП-Х»), снижение уровня ЛНП-Х, а также снижение уровня глюкозы в крови, снижение уровня инсулина в крови или повышение уровня ЛВП-Х, либо снижение атерогенного индекса, и поэтому, предполагается, что, по сравнению с известными соединениями, соединения настоящего изобретения могут служить превосходным профилактическим или терапевтическим средством против артериосклероза. Кроме того, соединения настоящего изобретения, в своей эффективной дозе, имеют низкую токсичность.
В соответствии с этим, соединения и фармацевтические композиции настоящего изобретения могут быть использованы не только для предупреждения и лечения артериосклероза, вызываемого геперлипидемией, но они могут быть также использованы для предупреждения и лечения, например, инфаркта миокарда, коронарной болезни сердца, включая реокклюзию после чрескожной внутрипросветной коронарной ангиопластики (ЧВКА), стенокардии и ишемической болезни сердца, вызванных коронарной болезнью сердца, инфаркта головного мозга, включая инфаркт кортикальной ветви и инфаркт прободающей ветви, тромбоза и артериосклероза, вызванных и тем и другим, и т.п.
Кроме того, соединения и фармацевтические композиции настоящего изобретения могут быть использованы для предупреждения и лечения ожирения, гипертензии, сахарного диабета и особенно инсулин-независимого диабета.
Если соединение настоящего изобретения используют в качестве лекарственного средства, то оно может быть введено млекопитающему, включая человека, в чистом виде, либо в виде фармацевтической композиции, содержащей данное соединение в фармацевтически приемлемом нетоксичном и инертном носителе в концентрации, например, от 0,1% до 99,5%, а предпочтительно, от 0,5% до 90%.
Примерами используемого носителя являются твердые, полутвердые или жидкие разбавители, наполнители и другие вспомогательные технологические добавки, и, по крайней мере, один из них может быть использован. Фармацевтическую композицию, предпочтительно, вводят в виде единичной дозированной лекарственной формы. Фармацевтическая композиция настоящего изобретения может быть введена внутривенно, перорально, в ткань, местно (например, чрескожно) или ректально. Очевидно, что необходимо использовать единичную дозированную лекарственную форму, подходящую для каждого конкретного способа введения. Особенно предпочтительным является пероральное введение.
Доза фармацевтической композиции для предупреждения и лечения артериосклероза должна быть, предпочтительно, скорректирована в зависимости от состояния пациента, то есть, его возраста, массы тела, способа введения, природы и тяжести заболевания, но, в основном, суточная доза соединения настоящего изобретения, используемая в качестве активного ингредиента для введения взрослому индивидууму, может составлять 0,1-100 мг/человек, а предпочтительно, 0,5-20 мг/человек. Доза, превышающая указанный интервал, не является критической, причем, в некоторых случаях, может оказаться достаточной доза ниже указанного интервала, а в других случаях может оказаться необходимой доза, превышающая указанный интервал. Суточная доза может быть введена в виде 2-3 частей общей дозы.
При использовании фармацевтической композиции для предупреждения и лечения сахарного диабета или других заболеваний доза соединения настоящего изобретения может быть скорректирована, как описано выше.
Наилучший вариант осуществления настоящего изобретения
Для более подробной иллюстрации настоящего изобретения приводятся следующие примеры, включая ссылочные примеры, рабочие примеры, примеры испытаний и примеры получения фармацевтических препаратов, которые не ограничивают объем изобретения.
Ссылочный пример 1
Диэтил (4-хлорбутил)малонат
К 458 мл безводного тетрагидрофурана (ТГФ) добавляют 13,4 г 60% гидрида натрия, а затем по каплям, при перемешивании и при охлаждении льдом, добавляют 160,6 г диэтилмалоната. После добавления перемешивание продолжают в течение 15 минут и добавляют 57,3 г 1-бром-4-хлорбутана. Смесь перемешивают в течение 50 часов при комнатной температуре. Реакционную смесь выливают в ледяную воду, нейтрализуют разбавленной хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают перегонке при пониженном давлении и получают 26,8 г целевого соединения в виде бесцветного масла.
Т.кип.127-130°С (5 мм рт.ст.)
В соответствии с методикой, описанной в ссылочном примере 1, получают следующие соединения:
диэтил (3-хлорпропил)малонат и
диэтил (5-хлорпентил)малонат.
Ссылочный пример 2
Диэтил (5-гексенил)малонат
К 120 мл безводного тетрагидрофурана (ТГФ) добавляют 4,9 г 60% гидрида натрия, а затем по каплям, при перемешивании и при охлаждении льдом, добавляют 29,5 г диэтилмалоната. После добавления перемешивание продолжают в течение 15 минут, добавляют 10 г 6-бром-1-гексена и смесь кипятят с обратным холодильником в течение 21 часа. Реакционный раствор охлаждают, выливают в ледяную воду, нейтрализуют разбавленной хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=20:1)) и получают 14,5 г целевого соединения в виде желтоватого масла.
1Н-ЯМР (CDCl3)δ: 1,23-1,47 (10Н, м), 1,84-2,11 (4Н, м), 3,28-3,37 (1Н, м), 4,14-4,25 (4Н, м), 4,91-5,05 (2Н, м), 5,69-5,90 (1Н, м).
Ссылочный пример 3
6-Хлор-2-гидроксиметил-1-гексанол
К 214 мл безводного эфира добавляют 8 г алюмогидрида лития, а затем по каплям, при перемешивании и при охлаждении льдом, добавляют 26,7 г диэтил (4-хлорбутил)малоната/53 мл безводного эфира. После перемешивания в течение 1 часа при комнатной температуре смесь охлаждают ледяной водой и постепенно добавляют 173 мл тетрагидрофурана/14,7 мл воды. Затем добавляют 14,7 мл 1N раствора гидроксида натрия и 35 мл воды, перемешивают в течение 15 минут и фильтруют для удаления нерастворимых веществ. Фильтрат концентрируют с получением 18,2 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,22-1,38 (2Н, м), 1,42-1,58 (2Н, м), 1,68-1,88 (3Н, м), 2,36-2,44 (2Н, м), 3,55 (2Н, т), 3,61-3,72 (2Н, м), 3,77-3,88 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 3, получают следующие соединения:
5-хлор-2-гидроксиметил-1-пентанол;
7-хлор-2-гидроксиметил-1-гептанол и
2-гидроксиметил-7-октен-1-ол.
Ссылочный пример 4
Метил цис-5-(4-хлорбутил)-2-метил-1,3-диоксан-r-2-карбоксилат
К 270 мл ацетонитрила добавляют 18 г 6-хлор-2-гидроксиметил-1-гексанола и 44 г метилпирувата. К раствору смеси при перемешивании при комнатной температуре добавляют 65,2 г эфирата трифторида бора (примерно 47%) и смесь перемешивают 14 часов. Реакционную смесь выливают в раствор гидрокарбоната натрия в ледяной воде и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, н-гексан:этилацетат=10:1)) и получают 14,8 г целевого соединения в виде желтоватого масла.
1Н-ЯМР (CDCl3)δ: 0,99-1,11 (2Н, м), 1,37-1,55 (5Н, м), 1,68-1,82 (2Н, м), 1,95-2,09 (1Н, м), 3,41 (2Н, т), 3,48-3,60 (2Н, м), 3,83 (3Н, с), 3,92-4,00 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 4, получают следующие соединения:
метил цис-5-(3-хлорпропил)-2-метил-1,3-диоксан-r-2-карбоксилат и
метил цис-5-(5-хлорпентил)-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 5
Диэтил [4-(тетрагидро-2Н-пиран-2-илокси)-(Z)-2-бутенил]малонат
2-[4-Хлор-(Z)-2-бутенилокси]тетрагидро-2Н-пиран (100 г) растворяют в 2000 мл безводного тетрагидрофурана/600 мл безводного N,N-диметилформамида. К раствору добавляют 100 г диэтилмалоната, а затем, при перемешивании и при охлаждении льдом, добавляют 25 г 60% гидрида натрия и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, н-гексан:этилацетат=9:1)) и получают 65,5 г целевого соединения в виде масла.
1Н-ЯМР (CDCl3)δ: 1,27 (6Н, т), 1,50-1,90 (6Н, м), 2,67 (2Н, т), 3,39 (1Н, т), 3,45-3,60 (1Н, м), 3,80-3,95 (1Н, м), 4,05-4,35 (6Н, м), 4,61 (1Н, дд), 5,45-5,75 (2Н, м).
Ссылочный пример 6
2-Гидроксиметил-6-(тетрагидро-2Н-пиран-2-илокси)-(Z)-4-гексен-1-ол
Диэтил [4-(тетрагидро-2Н-пиран-2-илокси)-(Z)-2-бутенил]малонат (65,5 г) растворяют в 650 мл безводного тетрагидрофурана и добавляют 15,1 г боргидрида натрия. Затем по каплям постепенно добавляют 110 г метанола/275 мл тетрагидрофурана, перемешивая при кипячении с обратным холодильником. После этого добавляют 13,18 г хлорида лития и 11 г боргидрида натрия и смесь кипятят с обратным холодильником в течение 1,5 часов. Реакционный раствор охлаждают и выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, хлороформ)) с получением 22,8 г целевого соединения в виде масла.
1Н-ЯМР (CDCl3)δ: 1,40-1,90 (7Н, м), 2,20 (2Н, шир.), 2,26 (2Н, ддд), 3,46-3,90 (6Н, м), 4,10-4,30 (2Н, м), 4,68 (1Н, дд), 5,50-5,80 (2Н, м).
Ссылочный пример 7
Метил цис-5-[4-гидрокси-(Z)-2-бутенил]-2-метил-1,3-диоксан-r-2-карбоксилат
Эфират трифторида бора (примерно 47%, 26,8 г) по каплям, при охлаждении льдом, добавляют к раствору 21,79 г 2-гидроксиметил-6-(тетрагидро-2Н-пиран-2-илокси)-(Z)-4-гексен-1-ола, 430 мл ацетонитрила и 38,57 г метилпирувата и смесь перемешивают в течение 15 часов при комнатной температуре. Реакционный раствор выливают в раствор гидрокарбоната натрия в ледяной воде и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=7:1)) и получают 5,36 г целевого соединения в виде масла.
1Н-ЯМР (CDCl3)δ: 1,51 (3Н, с), 1,85 (2Н, дд), 1,95-2,20 (1Н, м), 3,43 (2Н, дд), 3,84 (3Н, с), 3,95 (2Н, дд), 4,14 (2Н, дд), 5,44 (1Н, ддд), 5,70 (1Н, ддд).
Ссылочный пример 8
Метил цис-5-[4-хлор-(Z)-2-бутенил]-2-метил-1,3-диоксан-r-2-карбоксилат
Метил цис-5-[4-гидрокси-(Z)-2-бутенил]-2-метил-1,3-диоксан-r-2-карбоксилат (538 мг) растворяют в 12 мл N,N-диметилформамида и добавляют 1,13 г 2,4,6-триметилпиридина и 396 мг хлорида лития. Затем, по каплям и при охлаждении льдом, добавляют 1,07 г метансульфонилхлорида и смесь перемешивают в течение 9 часов при комнатной температуре. Реакционный раствор выливают в ледяную воду, добавляют 0,5N хлористоводородную кислоту и раствор экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) и получают 561 мг целевого соединения в виде масла.
1Н-ЯМР (CDCl3)δ: 1,52 (3Н, с), 1,89 (2Н, дд), 2,00-2,20 (1Н, м), 3,45 (2Н, дд), 3,85 (3Н, с), 3,95 (2Н, дд), 4,00 (2Н, дд), 5,53 (1Н, ддд), 5,72 (1Н, ддд).
Ссылочный пример 9
Метил цис-5-[4-иод-(E)-2-бутенил]-2-метил-1,3-диоксан-r-2-карбоксилат
Метил цис-5-[4-хлор-(Z)-2-бутенил]-2-метил-1,3-диоксан-r-2-карбоксилат (300 мг) растворяют в 5 мл ацетона и добавляют иодид натрия. Смесь кипятят с обратным холодильником в течение 2 часов. Реакционный раствор охлаждают, добавляют ледяную воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 353 мг целевого соединения в виде масла.
1Н-ЯМР (CDCl3)δ: 1,51 (3Н, с), 1,79 (2Н, дд), 2,00-2,20 (1Н, м), 3,41 (2Н, дд), 3,81 (2Н, дд), 3,84 (3Н, т), 3,93 (2Н, дд), 5,48-5,93 (2Н, м).
Ссылочный пример 10
Метил цис-5-(4-иодбутил)-2-метил-1,3-диоксан-r-2-карбоксилат
Метил цис-5-(4-хлорбутил)-2-метил-1,3-диоксан-r-2-карбоксилат (14,8 г) растворяют в 148 мл ацетона и добавляют 44,2 г иодида натрия. Смесь перемешивают в течение 22,5 часов при 40°С. Реакционный раствор концентрируют, к остатку добавляют воду и раствор экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 19,9 г целевого соединения в виде масла.
1Н-ЯМР (CDCl3)δ: 0,99-1,10 (2Н, м), 1,30-1,45 (2Н, м), 1,51 (3Н, с), 1,72-1,86 (2Н, м), 1,97-2,08 (1Н, м), 3,16 (2Н, т), 3,40 (2Н, т), 3,83 (3Н, с), 3,92-4,00 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 10, получают следующие соединения:
метил цис-5-(3-иодпропил)-2-метил-1,3-диоксан-r-2-карбоксилат и
метил цис-5-(5-иодпентил)-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 11
6-Бром-1-(тетрагидро-2H-пиран-2-илокси)-2-гексин
В токе аргона 13,46 г 3-(тетрагидро-2Н-пиран-2-илокси)-1-пропина растворяют в 135 мл безводного тетрагидрофурана, а затем по каплям в течение 20 минут, перемешивая при температуре реакционной смеси -10°С, добавляют 60 мл раствора 1,6N н-бутиллития в гексане. Смесь перемешают в течение 1 часа при той же температуре. После перемешивания в течение еще 1 часа при комнатной температуре температуру реакционной смеси доводят до -3°С и к смеси добавляют 16,7 мл триамида гексаметилфосфорной кислоты (НМРА). Затем при температуре реакционной массы -10°С порциями добавляют 58,14 г 1,3-дибромпропана и смесь перемешивают в течение 12 часов при комнатной температуре. Реакционный раствор выливают в ледяную воду, экстрагируют эфиром, промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают перегонке при пониженном давлении с получением 12,0 г целевого соединения в виде бесцветного масла.
Т.кип.121-126°С (5 мм рт.ст.).
Ссылочный пример 12
Метил 2-(6-бромгексилокси)-2-метилпропионат
К 120 мл безводного N,N-диметилформамида добавляют 4,0 г 60% гидрида натрия. К смеси при перемешивании и при охлаждении льдом по каплям добавляют 11,81 г метил 2-гидроксиизобутирата и смесь перемешивают 10 минут. После этого добавляют 122 г 1,6-дибромгексана и смесь перемешивают в течение 15 часов при комнатной температуре. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=20:1)) и получают 6,25 г целевого соединения в виде желтоватого масла.
1Н-ЯМР (CDCl3)δ: 1,42-1,65 (12Н, м), 1,80-1,94 (2Н, м), 3,32-3,45 (4Н, м), 3,73 (3Н, с).
В соответствии с методикой, описанной в ссылочном примере 12, получают следующие соединения:
метил 2-(5-бромпентилокси)-2-метилпропионат,
метил 2-(7-бромгептилокси)-2-метилпропионат,
метил 2-(8-бромоктилокси)-2-метилпропионат,
этил 2-метил-2-[6-(тетрагидро-2Н-пиран-2-илокси)-4-гексинилокси]пропионат,
этил 2-(6-бромгексилокси)-2-метилпропионат и
метил 2-[6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси]-2-метилпропионат.
Ссылочный пример 13
Этил 2-(6-гидрокси-4-гексинилокси)-2-метилпропионат
Этил 2-метил-2-[6-(тетрагидро-2Н-пиран-2-илокси)-4-гексинилокси]пропионат (3,72 г) растворяют в 37 мл этанола, добавляют 15,372 мг Amberlyst, и смесь перемешивают 1 час при 55-60°С. После охлаждения смесь фильтруют и фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1-3:1)) и получают 1,98 г целевого соединения в виде светло-желтого масла.
1Н-ЯМР (CDCl3)δ: 1,29 (3Н, т), 1,42 (6Н, с), 1,70-1,83 (2Н, м), 2,30-2,39 (2Н, м), 3,44-3,50 (2Н, м), 4,14-4,26 (4Н, м).
Ссылочный пример 14
Метил 2-метил-2-(8-ноненилокси)пропионат
К 500 мл безводного N,N-диметилформамида добавляют 17 г 60% гидрида натрия, а затем при перемешивании и при охлаждении льдом по каплям добавляют 48 г метил 2-гидроксиизобутирата и смесь перемешивают 10 минут. После этого добавляют 100 г 9-бром-1-нонена (чистота 63,4%) и смесь перемешивают в течение 15 часов при комнатной температуре. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток подвергают перегонке при пониженном давлении с получением 29,9 г целевого соединения в виде желтоватого масла.
Т.кип.124-127°С (8 мм рт.ст.).
В соответствии с методикой, описанной в ссылочном примере 14, получают следующие соединения:
метил 2-(6-гептенилокси)-2-метилпропионат,
метил 2-метил-2-(7-октенилокси)пропионат и
метил 2-(9-деценилокси)-2-метилпропионат.
Ссылочный пример 15
Метил 2-(8,9-эпоксинонилокси)-2-метилпропионат
Метил 2-метил-2-(8-ноненилокси)пропионат (40 г) растворяют в 320 мл метиленхлорида, а затем, при перемешивании и охлаждении льдом, добавляют 40,8 г 70% 3-хлорпербензойной кислоты и смесь перемешивают в течение 15 часов при комнатной температуре. Реакционный раствор фильтруют для удаления нерастворимых веществ и фильтрат концентрируют. Остаток растворяют в н-гексане и 4 раза промывают водным 10% раствором карбоната калия, затем промывают водой, сушат над безводным сульфатом магния и концентрируют с получением 43,2 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,25-1,70 (18Н, м), 2,44-2,48 (1Н, м), 2,72-2,77 (1Н, м), 2,85-2,97 (1Н, м), 3,34 (2Н, т), 3,73 (3Н, с).
В соответствии с методикой, описанной в ссылочном примере 15, получают следующие соединения:
метил 2-(6,7-эпоксигептилокси)-2-метилпропионат,
метил 2-(7,8-эпоксиоктилокси)-2-метилпропионат,
метил 2-(9,10-эпоксидецилокси)-2-метилпропионат и
метил цис-5-(5,6-эпоксигексил)-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 16
Метил 2-(9-хлор-8-гидроксинонилокси)-2-метилпропионат
Метил 2-(8,9-эпоксинонилокси)-2-метилпропионат (26 г) растворяют в 260 мл безводного тетрагидрофурана, а затем добавляют 6,8 г хлорида лития и 7 г уксусной кислоты и смесь перемешивают в течение 22 часов при комнатной температуре. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 31,7 г целевого соединения в виде масла.
В соответствии с методикой, описанной в ссылочном примере 16, получают следующие соединения:
метил 2-(7-хлор-6-гидроксигептилокси)-2-метилпропионат,
метил 2-(8-хлор-7-гидроксиоктилокси)-2-метилпропионат,
метил 2-(10-хлор-9-гидроксидецилокси)-2-метилпропионат и
метил цис-5-(6-хлор-5-гидроксигексил)-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 17
Метил 2-(9-хлор-8-оксононилокси)-2-метилпропионат
Метил 2-(9-хлор-8-гидроксинонилокси)-2-метилпропионат (31 г) растворяют в 465 мл ацетона при перемешивании и при охлаждении льдом по каплям добавляют 46 мл реагента Джонса, полученного добавлением 10,2 мл концентрированной серной кислоты и 12 г оксида хрома (VI) к 45 мл воды. После 3-часового перемешивания при комнатной температуре избыточное количество реагента Джонса разлагают добавлением изопропилового спирта. Реакционную смесь выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=7,5:1)) и получают 18,16 г целевого соединения в виде масла.
1Н-ЯМР (CDCl3)δ: 1,24-1,40 (6Н, м), 1,41 (6Н, с), 1,45-1,75 (4Н, м), 2,58 (2Н, т), 3,34 (2Н, т), 3,73 (3Н, с), 4,07 (2Н, с).
В соответствии с методикой, описанной в ссылочном примере 17, получают следующие соединения:
метил 2-(7-хлор-6-оксогептилокси)-2-метилпропионат,
метил 2-(8-хлор-7-оксооктилокси)-2-метилпропионат,
метил 2-(10-хлор-9-оксодецилокси)-2-метилпропионат и
метил цис-5-(6-хлор-5-оксогексил)-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 18
Диэтил п-толуоиламиномалонат
Гидрохлорид диэтиламиномалоната (20,5 г) суспендируют в 180 мл метиленхлорида и добавляют 29,4 г триэтиламина, охлаждая ледяной водой. После перемешивания в течение 30 минут по каплям добавляют 15 г п-толуоилхлорида и смесь перемешивают в течение 24 часов при комнатной температуре. Реакционный раствор промывают водой, разбавленной хлористоводородной кислотой и водой, сушат над безводным сульфатом магния и концентрируют. К остатку добавляют изопропиловый эфир и полученные кристаллы отфильтровывают и сушат с получением 25,9 г целевого соединения в виде белых кристаллов.
Т.пл. 101-102°С.
В соответствии с методикой, описанной в ссылочном примере 18, получают следующие соединения:
диэтилбензоиламиномалонат,
диэтил (4-хлорбензоил)аминомалонат,
диэтил (4-фторбензоиламино)малонат,
диэтил (4-трифторметилбензоил)аминомалонат,
диэтил (4-трет-бутилбензоил)аминомалонат и
диэтил (4-этилбензоил)аминомалонат.
Ссылочный пример 19
Этил цис-5-[5,5-бис(этоксикарбонил)-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат
К 27 мл безводного этанола добавляют 6,6 г 20% раствора этоксида натрия в этаноле и 5,4 г диэтил-п-толуоиламиномалоната и перемешивают в течение 30 минут при комнатной температуре. Затем по каплям добавляют раствор 6,3 г метил цис-5-(4-иодбутил)-2-метил-1,3-диоксан-r-2-карбоксилата/5,4 мл безводного этанола и перемешивают в течение 15 часов при 50-60°С. Реакционный раствор выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=5:1)) и получают 4,34 г целевого соединения в виде желтоватых кристаллов. Т.пл.=60-63°С.
В соответствии с методикой, описанной в ссылочном примере 19, получают следующие соединения:
этил цис-5-(4-бензоиламино-4,4-бис(этоксикарбонил)бутил)-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-(5-бензоиламино-5,5-бис(этоксикарбонил)пентил)-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-(6-бензоиламино-6,6-бис(этоксикарбонил)гексил)-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-[5,5-бис(этоксикарбонил)-5-(4-фторбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-[5,5-бис(этоксикарбонил)-5-(4-трифторметилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-[5-(4-трет-бутилбензоиламино)-5,5-бис(этоксикарбонил)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-[5-бензоиламино-5,5-бис(этоксикарбонил)-(Е)-2-пентенил]-2-метил-1,3-диоксан-r-2-карбоксилат,
5-(5-бензоиламино-5,5-бис(этоксикарбонил)пентил)-2,2-диметил-1,3-диоксан,
этил цис-5-[5,5-бис(этоксикарбонил)-5-(4-хлорбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-[6,6-бис(этоксикарбонил)-6-(п-толуоиламино)гексил]-2-метил-1,3-диоксан-r-2-карбоксилат,
этил цис-5-[5,5-бис(этоксикарбонил)-5-(3-фтор-4-метилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат и
этил цис-5-[5,5-бис(этоксикарбонил)-5-(4-этилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 20
Этил 2-(7-бензоиламино-7,7-бис(этоксикарбонил)гептилокси)-2-метилпропионат
К 5 мл безводного этанола добавляют 675 мг 20% раствора этоксида натрия в этаноле и 698 мг диэтилбензоиламиномалоната и перемешивают в течение 30 минут при комнатной температуре. Затем по каплям добавляют раствор 914 мг метил 6-бромгексилокси-2-метилпропионата/4 мл безводного этанола и перемешивают в течение 15 часов при 50-60°С. Реакционный раствор выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=5:1)) и получают 642 мг целевого соединения в виде желтоватого масла.
1Н-ЯМР (CDCl3)δ: 1,10-1,37 (15Н, м), 1,38 (6Н, с), 1,42-1,60 (2Н, м), 2,41-2,49 (2Н, м), 3,30 (2Н, т), 4,11-4,33 (6Н, м), 7,40-7,60 (4Н, м), 7,81-7,86 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 20, получают следующие соединения:
этил 2-метил-2-[7-(п-толуоиламино)-7,7-бис(этоксикарбонил)гептилокси]пропионат,
этил 2-[7-бензоиламино-7,7-бис(этоксикарбонил)-4-гептинилокси]-2-метилпропионат,
этил 2-[7-(4-хлорбензоиламино)-7,7-бис(этоксикарбонил)гептилокси]-2-метилпропионат,
этил 2-[7,7-бис(этоксикарбонил)-7-(4-фторбензоиламино)гептилокси]-2-метилпропионат,
этил 2-[7-(4-трет-бутилбензоиламино)-7,7-бис(этоксикарбонил)гептилокси]-2-метилпропионат,
этил 2-[6-бензоиламино-6,6-бис(этоксикарбонил)гексилокси]-2-метилпропионат,
этил 2-[8-бензоиламино-8,8-бис(этоксикарбонил)октилокси]-2-метилпропионат,
этил 5-бензоиламино-5,5-бис(этоксикарбонил)пентаноат,
этил 6-бензоиламино-6,6-бис(этоксикарбонил)гексаноат,
этил 5,5-бис(этоксикарбонил)-5-(п-толуоиламино)пентаноат и
5-(бензоиламино)-1-бром-5,5-бис(этоксикарбонил)-(Е)-2-пентен.
Ссылочный пример 21
цис-5-[5-Карбокси-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота
Этил цис-5-[5,5-бис(этоксикарбонил)-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат (4,2 г) растворяют в 33,6 мл этанола и добавляют раствор 2,0 г гидроксида натрия/8,4 мл воды. Смесь кипятят с обратным холодильником в течение 5 часов. Реакционный раствор концентрируют. К остатку добавляют воду и смесь подкисляют хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 3,23 г желтоватого масла. Полученное масло перемешивают в течение 30 минут при 130°С с получением 3,1 г целевого соединения в виде белых кристаллов. Т.пл. 152-156°С.
В соответствии с методикой, описанной в ссылочном примере 21, получают следующие соединения:
цис-5-(4-бензоиламино-4-карбоксибутил)-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-(5-бензоиламино-5-карбоксипентил)-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-(6-бензоиламино-6-карбоксигексил)-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-карбокси-5-(4-фторбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-карбокси-5-(4-трифторметилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-(4-трет-бутилбензоиламино)-5-карбоксипентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-бензоиламино-5-карбокси-(Е)-2-пентенил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
5-(5-бензоиламино-5-карбоксипентил)-2,2-диметил-1,3-диоксан,
2-(7-бензоиламино-7-карбоксигептилокси)-2-метилпропионовая кислота,
2-[7-карбокси-7-(п-толуоиламино)гептилокси]-2-метилпропионовая кислота,
2-[7-бензоиламино-7-карбокси-4-гептинилокси]-2-метилпропионовая кислота,
2-[7-карбокси-7-(4-хлорбензоиламино)гептилокси]-2-метилпропионовая кислота,
2-[7-карбокси-7-(4-фторбензоиламино)гептилокси]-2-метилпропионовая кислота,
2-[7-(4-трет-бутилбензоиламино)-7-карбоксигептилокси]-2-метилпропионовая кислота,
2-[8-бензоиламино-8-карбоксиоктилокси]-2-метилпропионовая кислота,
2-(6-бензоиламино-6-карбоксигексилокси)-2-метилпропионовая кислота,
5-бензоиламино-5-карбоксипентановая кислота,
6-бензоиламино-6-карбоксигексановая кислота,
цис-5-[5-карбокси-5-(4-хлорбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[6-карбокси-6-(п-толуоиламино)гексил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
5-карбокси-5-(п-толуоиламино)пентановая кислота,
цис-5-[5-карбокси-5-(3-фтор-4-метилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота и
цис-5-[5-карбокси-5-(4-этилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота.
Ссылочный пример 22
цис-5-[5-Ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота
цис-5-[5-карбокси-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновую кислоту (3,1 г) растворяют в 15,5 мл пиридина, добавляют 10,2 мл уксусного ангидрида и перемешивают в течение 1 часа при 90°С. Затем по каплям добавляют 10,2 мл воды и смесь перемешивают в течение 30 минут при 90°С. Реакционный раствор охлаждают, выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь хлороформ:метанол=100:1)) с получением 2,2 г целевого соединения в виде желтоватого масла.
1Н-ЯМР (CDCl3)δ: 0,99-1,10 (2Н, м), 1,15-1,45 (4Н, м), 1,54 (3Н, с), 1,50-1,82 (1Н, м), 1,84-2,15 (2Н, м), 2,27 (3Н, с), 2,40 (3Н, с), 3,47 (2Н, дд), 3,89-4,04 (2Н, м), 4,82-4,92 (1Н, м), 7,01 (1Н, д), 7,22-7,27 (2Н, м), 7,68-7,74 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 22, получают следующие соединения:
цис-5-(4-ацетил-4-бензоиламинобутил)-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-(5-ацетил-5-бензоиламинопентил)-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-(6-ацетил-6-бензоиламинобутил)-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-ацетил-5-(4-фторбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-ацетил-5-(4-трифторметилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-ацетил-5-(4-трет-бутилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-ацетил-5-бензоиламино-(Е)-2-пентенил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
5-(5-ацетил-5-бензоиламинопентил)-2,2-диметил-1,3-диоксан,
2-(7-ацетил-7-бензоиламиногептилокси)-2-метилпропионовая кислота,
2-[7-ацетил-7-(п-толуоиламино)гептилокси]-2-метилпропионовая кислота,
2-(7-ацетил-7-бензоиламино-4-гептинилокси)-2-метилпропионовая кислота,
2-[7-ацетил-7-(4-хлорбензоиламино)гептилокси]-2-метилпропионовая кислота,
2-[7-ацетил-7-(4-фторбензоиламино)гептилокси]-2-метилпропионовая кислота,
2-[7-ацетил-7-(4-трет-бутилбензоиламино)гептилокси]-2-метилпропионовая кислота,
2-(8-ацетил-8-бензоиламинооктилокси)-2-метилпропионовая кислота,
2-(6-ацетил-6-бензоиламиногексилокси)-2-метилпропионовая кислота,
5-ацетил-5-бензоиламинопентановая кислота,
6-ацетил-6-бензоиламиногексановая кислота,
цис-5-[5-ацетил-5-(4-хлорбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[6-ацетил-6-(п-толуоиламино)гексил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
5-ацетил-5-(п-толуоиламино)пентановая кислота,
цис-5-[5-ацетил-5-(3-фтор-4-метилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота,
цис-5-[5-ацетил-5-(4-этилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновая кислота и
7-ацетил-7-(бензоиламино)-(Е)-4-гептеновая кислота.
Ссылочный пример 23
Метил цис-5-[5-ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат
цис-5-[5-Ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновую кислоту (2,1 г) растворяют в 44 мл бензола и 4,2 мл метанола, а затем при перемешивании и при охлаждении льдом по каплям добавляют 4,2 мл 2,0М раствора триметилсилилдиазометана/гексана. Смесь перемешивают в течение 1 часа и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=2,5:1)) с получением 0,85 г целевого соединения в виде желтоватого масла.
1 Н-ЯМР (CDCl3)δ: 0,90-1,08 (2Н, м), 1,10-1,40 (4Н, м), 1,50 (3Н, с), 1,55-1,80 (1Н, м), 1,85-2,16 (2Н, м), 2,27 (3Н, с), 2,40 (3Н, с), 3,36 (2Н, дд), 3,82 (3Н, с), 3,92 (2Н, дд), 4,80-4,89 (1Н, м), 6,89 (1Н, д), 7,25 (2Н, д), 7,70 (2Н, д).
В соответствии с методикой, описанной в ссылочном примере 23, получают следующие соединения:
метил цис-5-(4-ацетил-4-бензоиламинобутил)-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-(5-ацетил-5-бензоиламинопентил)-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-(6-ацетил-6-бензоиламиногексил)-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(4-фторбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(4-трифторметилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(4-трет-бутилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат и
метил цис-5-[5-ацетил-5-бензоиламино-(Е)-2-пентенил]-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 24
Метил цис-5-[5-ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат
цис-5-[5-Ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоновую кислоту (20 г) растворяют в 140 мл ацетонитрила и добавляют 14,5 мл метилиодида и 14,1 г карбоната калия. Смесь кипятят с обратным холодильником в течение 3 часов. Реакционный раствор охлаждают, выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=2:1)) с получением 10,3 г целевого соединения в виде желтоватого масла.
В соответствии с методикой, описанной в ссылочном примере 24, получают следующие соединения:
метил цис-5-(5-ацетил-5-бензоиламинопентил)-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(4-хлорбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[6-ацетил-6-(п-толуоиламино)гексил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(3-фтор-4-метилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат и
метил цис-5-[5-ацетил-5-(4-этилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 25
Метил 6-ацетил-6-бензоиламиногексаноат
6-Ацетил-6-бензоиламиногексановую кислоту (4,35 г) растворяют в 100 мл метанола и добавляют 0,5 мл концентрированной серной кислоты. Смесь кипятят с обратным холодильником в течение 2,5 часов. Реакционный раствор охлаждают, выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют, в результате чего получают 4,4 г целевого соединения в виде желтоватых кристаллов. Т.пл. 59-60°С.
В соответствии с методикой, описанной в ссылочном примере 25, получают следующие соединения:
метил 2-(7-ацетил-7-бензоиламиногептилокси)-2-метилпропионат,
метил 2-[7-ацетил-7-(п-толуоиламино)гептилокси]-2-метилпропионат,
метил 2-(7-ацетил-7-бензоиламино-4-гептинилокси)-2-метилпропионат,
метил 2-[7-ацетил-7-(4-хлорбензоиламино)гептилокси]-2-метилпропионат,
метил 2-[7-ацетил-7-(4-фторбензоиламино)гептилокси]-2-метилпропионат,
метил 2-[7-ацетил-7-(4-трет-бутилбензоиламино)гептилокси]-2-метилпропионат,
метил 2-(8-ацетил-8-бензоиламинооктилокси)-2-метилпропионат,
метил 2-(6-ацетил-6-бензоиламиногексилокси)-2-метилпропионат,
метил 5-ацетил-5-бензоиламинопентаноат,
метил 5-ацетил-5-(п-толуоиламино)пентаноат и
метил 7-ацетил-7-(бензоиламино)-(Е)-4-гептеноат.
Ссылочный пример 26
Диэтил (3-бромбензил)малонат
Гидрид натрия (60%, 1,6 г) суспендируют в 20 мл безводного тетрагидрофурана/15 мл безводного N,N-диметилформамида и при охлаждении льдом по каплям добавляют 7,6 мл диэтилмалоната. Смесь перемешивают в течение 15 минут. Затем добавляют раствор 5 г 3-бромбензилбромида/10 мл безводного тетрагидрофурана и перемешивают в течение 1 часа при охлаждении льдом. К реакционному раствору добавляют ледяную воду и раствор экстрагируют эфиром, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=10:1)) с получением 5,41 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,22 (6Н, т), 3,81 (2Н, д), 3,61 (1Н, т), 4,17 (4Н, кв), 7,10-7,20 (2Н, м), 7,29-7,40 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 26, получают следующее соединение:
диэтил (4-бромбензил)малонат.
Ссылочный пример 27
Диэтил (4-бромфенил)малонат
В токе аргона 10,85 г диэтилкарбоната растворяют в 60 мл бензола, добавляют 2,75 г 60% гидрида натрия и кипятят с обратным холодильником. К раствору в течение 1 часа по каплям добавляют раствор 5,58 г этил 4-бромфенилацетата/20 мл бензола и смесь кипятят с обратным холодильником в течение 1 часа. После охлаждения к реакционному раствору медленно по каплям добавляют ледяную воду. Органический слой отделяют, промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=10:1)) с получением 6,45 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,26 (6Н, т), 4,21 (4Н, кв), 4,56 (1Н, с), 7,29 (2Н, д), 7,50 (2Н, д).
В соответствии с методикой, описанной в ссылочном примере 27, получают следующее соединение:
диэтил (3-бромфенил)малонат.
Ссылочный пример 28
2-(3-Бромбензил)-1,3-пропандиол
К 94 мл охлажденного льдом раствора 1,0М гидрида диизобутилалюминия в толуоле по каплям добавляют 5,41 г диэтил (3-бромбензил)малоната при 15°С или менее в токе аргона. Смесь перемешивают 30 минут при охлаждении льдом, нагревают до комнатной температуры и перемешивают в течение 2 часов. Реакционный раствор охлаждают льдом и медленно по каплям добавляют 21 мл метанола, а затем по каплям добавляют 41 мл 2N хлористоводородной кислоты. Смесь перемешивают в течение 20 минут при комнатной температуре. Реакционный раствор фильтруют для удаления нерастворимых веществ, экстрагируют этилацетатом, промывают насыщенным гидрокарбонатом натрия, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь хлороформ:метанол=10:1)) с получением 1,96 г целевого соединения в виде белых кристаллов. Т.пл. 61-63°С.
В соответствии с методикой, описанной в ссылочном примере 28, получают следующие соединения:
2-(4-бромбензил)-1,3-пропандиол,
2-(4-бромфенил)-1,3-пропандиол и
2-(3-бромфенил)-1,3-пропандиол.
Ссылочный пример 29
5-(3-Бромбензил)-2,2-диметил-1,3-диоксан
2-(3-Бромбензил)-1,3-пропандиол (1,85 г) растворяют в смеси 8 мл ацетона/18 мл бензола и добавляют 70 мг моногидрата п-толуолсульфоновой кислоты. Раствор подвергают азеотропной дегидратации с использованием насадки Дина-Старка в течение 1 часа. После добавления насыщенного раствора гидрокарбоната натрия смесь экстрагируют этилацетатом, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=4:1)) с получением 1,47 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,43 (6Н, д), 1,90-2,10 (1Н, м), 2,60 (2Н, д), 3,61 (2Н, дд), 3,86 (2Н, дд), 7,05-7,20 (2Н, м), 7,30-7,40 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 29, получают следующие соединения:
5-(4-бромбензил)-2,2-диметил-1,3-диоксан,
5-(4-бромфенил)-2,2-диметил-1,3-диоксан и
5-(3-бромфенил)-2,2-диметил-1,3-диоксан.
Ссылочный пример 30
2,2-Диметил-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксан
В токе аргона 1,45 г 5-(3-бромбензил)-2,2-диметил-1,3-диоксана растворяют в 7 мл безводного тетрагидрофурана и охлаждают на бане сухим льдом и ацетоном. К смеси добавляют 0,9 мл N,N,N',N'-тетраметилэтилендиамина, а затем по каплям добавляют н-бутиллитий (1,6 М раствор в гексане) при -60°С или менее. После перемешивания в течение 10 минут добавляют суспензию 1,03 г три-н-бутилфосфина и 0,97 г иодида меди/7 мл безводного тетрагидрофурана и смесь перемешивают в течение 10 минут. Затем по каплям добавляют раствор 1,52 г 4-иодметил-5-метил-2-фенилоксазола/7 мл безводного тетрагидрофурана при температуре -60°С или менее, после чего смесь перемешивают в течение 15 минут в тех же условиях. Баню удаляют и смесь перемешивают в течение 1,5 часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония. Смесь разбавляют водой, экстрагируют эфиром, фильтруют для удаления нерастворимых веществ, промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=4:1)) с получением 0,34 г целевого соединения в виде белых кристаллов. Т.пл. 85-87°С.
В соответствии с методикой, описанной в ссылочном примере 30, получают следующие соединения:
2,2-диметил-5-{4-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксан,
2,2-диметил-5-{4-[(5-метил-2-фенилоксазол-4-ил)метил]фенил}-1,3-диоксан и
2,2-диметил-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]фенил}-1,3-диоксан.
Ссылочный пример 31
5-(5-Метил-2-фенилоксазол-4-ил)-1-пентанол
К 17 мл безводного эфира добавляют 550 мг алюмогидрида лития и по каплям добавляют 3,3 г метил 5-(5-метил-2-фенилоксазол-4-ил)-1-пентаноата/10 мл безводного эфира. После перемешивания в течение 1 часа при комнатной температуре смесь охлаждают ледяной водой и постепенно по каплям добавляют 12 мл тетрагидрофурана/0,7 мл воды. Затем добавляют 0,7 мл 1N гидроксида натрия и 2,5 мл воды и смесь перемешивают в течение 15 минут. Смесь фильтруют для удаления нерастворимых веществ и фильтрат концентрируют с получением 2,9 г целевого соединения в виде желтоватых кристаллов. Т.пл. 40-42°С.
В соответствии с методикой, описанной в ссылочном примере 31, получают следующие соединения:
4-(5-метил-2-фенилоксазол-4-ил)-1-бутанол,
4-[5-метил-2-(п-толил)оксазол-4-ил]-1-бутанол,
4-[2-(п-толил)-5-трифторметилоксазол-4-ил]-1-бутанол,
6-[5-метил-2-(п-толил)оксазол-4-ил]-1-гексанол и
6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексен-1-ол.
Ссылочный пример 32
4-(5-Бромпентил)-5-метил-2-фенилоксазол
4-(5-Метил-2-фенилоксазол-4-ил)-1-пентанол (2,9 г) растворяют в 62 мл безводного эфира и добавляют 8,4 г тетрабромметана. К смеси постепенно добавляют 6,6 г трифенилфосфина при охлаждении льдом. Затем смесь перемешивают в течение 2,5 часа при комнатной температуре, фильтруют для удаления нерастворимых веществ и фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=10:1)) с получением 2,61 г целевого соединения в виде желтоватого масла.
В соответствии с методикой, описанной в ссылочном примере 31, получают следующие соединения:
4-(4-бромбутил)-5-метил-2-фенилоксазол,
этил 2-(6-бром-4-гексинилокси)-2-метилпропионат,
4-(4-бромбутил)-5-метил-2-(п-толуол)оксазол,
4-(4-бромбутил)-2-(п-толил)-5-трифторметилоксазол,
4-(6-бромгексил)-5-метил-2-(п-толил)оксазол и
4-[6-бром-(Е)-2-гексенил]-5-метил-2-фенилоксазол.
Ссылочный пример 33
Диэтил [5-(5-метил-2-фенилоксазол-4-ил)пентил]малонат
К 35 мл безводного тетрагидрофурана по каплям, при перемешивании и охлаждении льдом, добавляют 650 мг 60% гидрида натрия и 3,9 мл диэтилмалоната. После перемешивания в течение 10 минут добавляют 4-(4-бромпентил)-5-метил-2-фенилоксазол (2,5 г). Смесь перемешивают в течение 10 минут при комнатной температуре, а затем кипятят с обратным холодильником в течение 12 часов. Реакционный раствор выливают в ледяную воду, нейтрализуют разбавленной хлористоводородной кислотой, а затем экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=10:1)) и получают 2,75 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,26 (6Н, т), 1,32-1,43 (4Н, м), 1,55-1,75 (2Н, м), 1,82-2,00 (2Н, м), 2,31 (3Н, с), 2,47 (2Н, т), 3,31 (1Н, т), 4,19 (4Н, кв), 7,37-7,47 (3Н, м), 7,95-8,00 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 33, получают следующие соединения:
диэтил [4-(5-метил-2-фенилоксазол-4-ил)бутил]малонат,
диэтил {4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}малонат,
диэтил {4-[2-(п-толил)-5-трифторметилоксазол-4-ил]бутил}малонат и
диэтил [5-(бензоиламино)-5,5-бис(этоксикарбонил)-(Е)-2-пентенил]малонат.
Ссылочный пример 34
4-[6,6-Бис(гидроксиметил)гексил]-5-метил-2-фенилоксазол
К 15 мл безводного эфира по каплям добавляют 637 мг алюмогидрида лития и 2,6 г диэтил [5-(5-метил-2-фенилоксазол-4-ил)бутил]малоната/10 мл безводного эфира. После перемешивания в течение 2 часов при комнатной температуре смесь охлаждают ледяной водой и по каплям постепенно добавляют 14 мл тетрагидрофурана/0,8 мл воды. Затем к смеси добавляют 0,8 мл водного раствора 1N гидроксида натрия и 2,3 мл воды, перемешивают в течение 15 минут и фильтруют для удаления нерастворимых веществ. Фильтрат концентрируют и получают 2,0 г целевого соединения в виде белых кристаллов. Т.пл.=71-74°С.
В соответствии с методикой, описанной в ссылочном примере 34, получают следующие соединения:
4-[5,5-бис(гидроксиметил)пентил]-5-метил-2-фенилоксазол,
4-[5,5-бис(гидроксиметил)пентил]-5-метил-2-(п-толил)оксазол,
4-[5,5-бис(гидроксиметил)пентил]-2-(п-толил)-5-трифторметилоксазол и
4-[5,5-бис(гидроксиметил)пентил]-5-этил-2-(п-толил)оксазол.
Ссылочный пример 35
4-{3-[2,2-Бис(гидроксиметил)этил]бензил}-5-метил-2-фенилоксазол
Раствор смеси 320 мг 2,2-диметил-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксана, 21 мл этанола и 21 мг п-толуолсульфоната пиридиния (PPTS) перемешивают в течение 2 часов при 55-60°С. Реакционный раствор концентрируют и остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, хлороформ)) и получают 305 мг целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,90-2,15 (1Н, м), 2,29 (3Н, с), 2,35 (2Н, шир.), 2,60 (2Н, д), 3,64 (2Н, дд), 3,78 (2Н, дд), 3,85 (2Н, с), 6,90-7,50 (7Н, м), 7,85-8,05 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 35, получают следующие соединения:
4-{4-[2,2-бис(гидроксиметил)этил]бензил}-5-метил-2-фенилоксазол,
4-{4-[1,1-бис(гидроксиметил)метил]бензил}-5-метил-2-фенилоксазол,
4-{3-[1,1-бис(гидроксиметил)метил]бензил}-5-метил-2-фенилоксазол и
4-[5,5-бис(гидроксиметил)пентил]-5-метил-2-фенилоксазол.
Ссылочный пример 36
Метил 5-(5-метил-2-фенилоксазол-4-ил)пентаноат
Метил 6-ацетил-6-бензоиламиногексаноат (4,35 г) растворяют в 87 мл толуола и добавляют 2,9 мл оксихлорида фосфора и кипятят с обратным холодильником в течение 50 минут. Реакционный раствор охлаждают, выливают в ледяную воду, нейтрализуют водным раствором гидрокарбоната натрия, экстрагируют этилацетатом и промывают насыщенным раствором соли. Полученный раствор сушат над безводным сульфатом магния и концентрируют, в результате чего получают 3,40 г целевого соединения в виде желтоватого масла.
В соответствии с методикой, описанной в ссылочном примере 36, получают следующие соединения:
метил 4-(5-метил-2-фенилоксазол-4-ил)бутаноат,
метил 4-[5-метил-2-(п-толил)оксазол-4-ил]бутаноат,
этил 6-[5-метил-2-(п-толил)оксазол-4-ил]гексаноат и
метил 6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексеноат.
Ссылочный пример 37
1-Бром-3-[2,2-бис(этоксикарбонил)-2-(п-толуоиламино)этил]бензол
К 100 мл безводного этанола добавляют 21,45 г раствора 20% этоксида натрия в этаноле и 17,61 г диэтил-п-толуоиламиномалоната и перемешивают при комнатной температуре в течение 30 минут в атмосфере аргона. После добавления по каплям 15,00 г 3-бромбензилбромида реакционный раствор перемешивают в течение 8 часов при 55°С, а затем концентрируют. К остатку добавляют воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и получают 29,82 г целевого соединения в виде желтого масла.
1Н-ЯМР (CDCl3)δ: 1,31 (6Н, т), 2,41 (3Н, с), 3,74 (2Н, с), 4,30 (4Н, кв), 6,90-7,40 (7Н, м), 7,60-7,70 (2Н, м).
Ссылочный пример 38
1-Бром-3-[2-карбокси-2-(п-толуоиламино)этил]бензол
1-Бром-3-[2,2-бис(этоксикарбонил)-2-(п-толуоиламино)этил]бензол (28,93 г) растворяют в 200 мл этанола и добавляют раствор 9,6 г гидроксида натрия/60 мл воды, а затем кипятят с обратным холодильником в течение 3 часов. Реакционный раствор концентрируют. К остатку добавляют воду и промывают диэтиловым эфиром. Водный слой подкисляют хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют с получением 24,19 г целевого соединения в виде бесцветного масла. Полученное масло растворяют в 150 мл этилацетата и после добавления 150 мл ксилола перемешивают в течение 15 часов при 130°С. Растворитель отгоняют при пониженном давлении и полученные кристаллы промывают диэтиловым эфиром с получением 17,22 г целевого соединения в виде бесцветных кристаллов. Т.пл. 196-197°С.
Ссылочный пример 39
1-[2-Ацетил-2-(п-толуоиламино)этил]-3-бромбензол
1-Бром-3-[2-карбокси-2-(п-толуоиламино)этил]бензол (16,84 г) растворяют в 85 мл пиридина, добавляют 55 мл уксусного ангидрида и перемешивают в течение 3 часов в атмосфере аргона при 90-95°С. Затем постепенно по каплям добавляют воду (55 мл) так, чтобы максимальная температура не превышала 100°С, и смесь перемешивают в течение 20 минут при 60-70°С. Реакционный раствор охлаждают, выливают в ледяную воду и экстрагируют этилацетатом. Полученный раствор последовательно промывают 10% хлористоводородной кислотой, водой и насыщенным водным раствором гидрокарбоната натрия, а затем сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении. Полученные кристаллы промывают изопропиловым эфиром с получением 13,31 г целевого соединения в виде коричневатых кристаллов. Т.пл. 106-107°С.
Ссылочный пример 40
1-Бром-3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензол
1-[2-Ацетил-2-(п-толуоиламино)этил]-3-бромбензол (13,26 г) растворяют в 260 мл толуола, добавляют 6,8 мл оксихлорида фосфора и кипятят с обратным холодильником в течение 3 часов. Реакционный раствор охлаждают, выливают в ледяную воду и экстрагируют этилацетатом. Полученный раствор последовательно промывают насыщенным водным раствором гидрокарбоната натрия, а затем сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=4:1)) с получением 10,86 г целевого соединения в виде желтоватых кристаллов. Т.пл. 74-75°С.
Ссылочный пример 41
3-{[5-Метил-2-(п-толил)оксазол-4-ил]метил}бензальдегид
N,N-Диметилформамид (30 мл) добавляют к 9,48 г 1-бром-3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензола, 2,83 г формиата натрия и 0,97 г дихлорида бис(трифенилфосфин)палладия (II) и смесь перемешивают в течение 9 часов при 110°С, барботируя монооксид углерода. К реакционному раствору добавляют воду, экстрагируют этилацетатом, фильтруют для удаления нерастворимых веществ, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=4:1)) с получением 3,58 г целевого соединения в виде бесцветных кристаллов. Т.пл. 98-99°С.
Ссылочный пример 42
3-{[5-Метил-2-(п-толил)оксазол-4-ил]метил}бензиловый спирт
3-{[5-Метил-2-(п-толил)оксазол-4-ил]метил}бензальдегид (3,54 г) суспендируют в 35 мл метанола, а затем при перемешивании и при охлаждении льдом добавляют 230 мг боргидрида натрия и перемешивают в течение 1,5 часов при комнатной температуре. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении с получением 3,54 г целевого соединения в виде бесцветных кристаллов. Т.пл. 97-99°С.
Ссылочный пример 43
3-{[5-Метил-2-(п-толил)оксазол-4-ил]метил}бензилбромид
3-{[5-Метил-2-(п-толил)оксазол-4-ил]метил}бензиловый спирт (3,52 г) суспендируют в 60 мл дихлорметана. После добавления 3,77 г трифенилфосфина и 5,17 г тетрабромметана смесь перемешивают в течение 30 минут при комнатной температуре. Реакционный раствор концентрируют и остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=4:1)) с получением 3,96 г целевого соединения в виде бесцветных кристаллов. Т.пл. 101-102°С.
Ссылочный пример 44
Диэтил 3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензилмалонат
К 15 мл безводного тетрагидрофурана и 7 мл безводного N,N-диметилформамида добавляют 0,88 мг 60% гидрида натрия. К смеси, при перемешивании и охлаждении льдом, по каплям добавляют 4,40 г диэтилмалоната. После перемешивания в течение 15 минут добавляют раствор 3,93 г 3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензилбромида/5 мл безводного тетрагидрофурана и перемешивают в течение 1 часа при охлаждении льдом. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=5:1)) и получают 3,95 г целевого соединения в виде бесцветных кристаллов.
1Н-ЯМР (CDCl3)δ: 1,17 (6Н, т), 2,25 (3Н, с), 2,38 (3Н, с), 3,18 (2Н, д), 3,62 (1Н, т), 4,07 (2Н, с), 4,12 (4Н, кв), 7,00-7,30 (6Н, м), 7,80-7,90 (2Н, м).
Ссылочный пример 45
2-[3-{[5-Метил-2-(п-толил)оксазол-4-ил]метил}бензил]-1,3-пропандиол
К 30 мл безводного тетрагидрофурана добавляют 854 мг алюмогидрида лития, а затем, при перемешивании и охлаждении льдом, по каплям добавляют 3,94 г диэтил [3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензилмалоната/10 мл безводного тетрагидрофурана. Смесь перемешивают в течение 1,5 часов при комнатной температуре и охлаждают ледяной водой. К смеси последовательно по каплям добавляют 0,85 мл воды, 0,85 мл 15% раствора гидроксида натрия и 2,5 мл воды и перемешивают 15 минут. Смесь фильтруют для удаления нерастворимых веществ и фильтрат концентрируют. Остаток растворяют в этилацетате и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь хлороформ:метанол=20:1)) и получают 2,32 г целевого соединения в виде бесцветных кристаллов. Т.пл. 114-115°С.
Ссылочный пример 46
Диэтил (3-фтор-4-метилбензоил)аминомалонат
К раствору 10,1 г 3-фтор-4-метилбензойной кислоты и 15,2 г гидрохлорида диэтиламиномалоната в 200 мл N,N-диметилформамида последовательно добавляют 9,7 г 1-гидроксибензотриазола, 23 мл триэтиламина и 13,8 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и перемешивают в течение 1 часа при комнатной температуре. После добавления воды к реакционному раствору смесь экстрагируют этилацетатом. Экстракт последовательно промывают водой, 10% хлористоводородной кислотой, водой и насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток кристаллизуют путем добавления изопропилового эфира с получением 15,1 г целевого соединения в виде бесцветных кристаллов. Т.пл. 102-103°С.
Ссылочный пример 47
1-(п-Толуолсульфонилокси)-3-[2-(п-толил)-5-трифторметилоксазол-4-ил]пропан
3-[2-(п-Толил)-5-трифторметилоксазол-4-ил]-1-пропанол (6,40 г), синтезированный по методике, описанной Kawase et al. (Chem. Pharm. Bull., 46, 749-756 (1998)), растворяют в 35 мл дихлорметана. К раствору последовательно добавляют 293 мг 4-(диметиламино)пиридина, 4,7 мл триэтиламина и 5,13 г п-толуолсульфонилхлорида и перемешивают в течение 3 часов при комнатной температуре. К реакционному раствору добавляют этилацетат и последовательно промывают водой, 10% хлористоводородной кислотой и насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении с получением 10,08 г целевого соединения в виде светло-коричневых кристаллов. Т.пл. 57-58°С.
Ссылочный пример 48
4-[2-(п-Толил)-5-трифторметилоксазол-4-ил]бутаннитрил
К 40 мл диметилсульфоксида добавляют 10,08 г 1-(п-толуолсульфонилокси)-3-[2-(п-толил)-5-трифторметилоксазол-4-ил]пропана и 1,16 г цианида натрия и смесь перемешивают в течение 2 часов при 90°С. К реакционному раствору добавляют воду и смесь экстрагируют диэтиловым эфиром, промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и получают 6,35 г целевого соединения в виде светло-коричневых кристаллов. Т.пл. 41-42,5°С.
Ссылочный пример 49
Метил 4-[2-(п-толил)-5-трифторметилоксазол-4-ил]бутаноат
4-[2-(п-Толил)-5-трифторметилоксазол-4-ил]бутаннитрил (5,28 г) растворяют в 40 мл метанола и перемешивают в течение 10 минут при охлаждении льдом и при барботировании газообразного хлористого водорода. После прекращения барботирования смесь нагревают до комнатной температуры и перемешивают 30 минут. К реакционному раствору добавляют 5 мл воды и смесь перемешивают в течение 30 минут, а затем выдерживают в течение ночи при комнатной температуре. После добавления воды реакционный раствор экстрагируют этилацетатом. Экстракт промывают насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=3:1)) с получением 5,63 г целевого соединения в виде бесцветных кристаллов.
Т.пл. 44,5-45°С.
Ссылочный пример 50
Метил 4-(фторметил)бензоат
Безводный ацетонитрил (150 мл) добавляют к 25,00 г метил (4-бромметил)бензоата, 19,02 г фторида калия и 9,51 г фторида кальция и смесь кипятят с обратным холодильником в течение 3 дней. Реакционный раствор концентрируют. После добавления 200 мл ацетонитрила нерастворившиеся вещества отфильтровывают и фильтрат снова концентрируют. Остаток очищают колоночной хроматографией на силикагеле (YMC·GEL(SIL-60-230/70, смесь н-гексан:этилацетат=10:1-4:1), а затем перегоняют при пониженном давлении с получением 14,45 г целевого соединения в виде бесцветного масла. Т.кип.118,5-119°С/18 мм рт.ст.
1Н-ЯМР (CDCl3)δ: 3,93 (3Н, с), 5,44 (2Н, д), 7,40-7,46 (2Н, м), 8,03-8,09 (2Н, м).
Ссылочный пример 51
4-(Фторметил)бензойная кислота
В 200 мл метанола растворяют 8,68 г метил 4-(фторметил)бензоата и при перемешивании и охлаждении льдом по каплям добавляют 77 мл водного раствора 1N гидроксида натрия. Затем смесь перемешивают в течение 3,5 часов при комнатной температуре. После подкисления смеси 1N хлористоводородной кислотой осажденные кристаллы отфильтровывают и фильтрат концентрируют. Осажденные кристаллы объединяют с остатком, полученным от концентрирования фильтрата, и добавляют воду. Смесь экстрагируют этилацетатом и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении с получением 7,47 г целевого соединения в виде бесцветных кристаллов. Т.пл. 192-194°С.
Ссылочный пример 52
4-(Фторметил)бензоилхлорид
4-(Фторметил)бензойную кислоту (6,20 г) растворяют в 30 мл бензола, добавляют 0,3 мл N,N-диметилформамида, а затем по каплям добавляют 4,4 мл тионилхлорида. Смесь перемешивают в течение 1 часа при 40°С, а затем кипятят с обратным холодильником в течение еще 1 часа. Растворитель отгоняют при пониженном давлении с получением 6,70 г целевого соединения в виде светло-желтого масла.
Ссылочный пример 53
Этил 6-хлор-2-этоксикарбонил-2-(п-толуоиламино)гексаноат
Натрий (6,42 г) растворяют в 390 мл этанола при комнатной температуре. К раствору добавляют 78,0 г диэтил-п-толуоиламиномалоната и при кипячении с обратным холодильником по каплям добавляют 47,9 г 1-бром-4-хлорбутана. Смесь кипятят с обратным холодильником в течение 20 часов. Реакционный раствор концентрируют. К остатку добавляют воду и смесь промывают этилацетатом. После последовательной промывки 10% хлористоводородной кислотой и водой раствор сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) с получением 55,7 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,26 (6Н, т), 1,26-1,42 (2Н, м), 1,72-1,86 (2Н, м), 2,41 (3Н, с), 2,44-2,52 (2Н, м), 3,51 (2Н, т), 4,28 (4Н, кв), 7,24-7,28 (2Н, м), 7,48 (1Н, с), 7,71-7,75 (2Н, м).
Ссылочный пример 54
6-Хлор-2-(п-толуоиламино)гексановая кислота
Этил 6-хлор-2-этоксикарбонил-2-(п-толуоиламино)гексаноат (103,2 г) растворяют в 412 мл этанола, добавляют раствор 24,5 г гидроксида натрия/98 мл воды и кипятят с обратным холодильником в течение 16 часов. Реакционный раствор концентрируют. К остатку добавляют этилацетат. Смесь подкисляют хлористоводородной кислотой и экстрагируют этилацетатом. Экстракт промывают водой, сушат над безводным сульфатом магния и концентрируют с получением 80,0 г бесцветной смолы. К полученной смоле добавляют 75 мл уксусной кислоты и кипятят с обратным холодильником в течение 10 часов. После перемешивания и охлаждения смеси осажденные кристаллы промывают этилацетатом и перекристаллизовывают из уксусной кислоты с получением 26,0 г целевого соединения в виде бесцветных кристаллов. Т.пл. 177-181°С.
Ссылочный пример 55
8-Хлор-4-(п-толуоиламино)-3-октанон
6-Хлор-2-(п-толуоиламино)гексановую кислоту (10,0 г) растворяют в 15 мл безводного пиридина, добавляют 15 мл пропионового ангидрида и перемешивают 2,5 часа при 90°С. К смеси медленно добавляют 15 мл воды так, чтобы максимальная температура не превышала 85°С, и перемешивают в течение 20 минут при 80°С. Реакционный раствор охлаждают, выливают в ледяную воду и экстрагируют диэтиловым эфиром. Экстракт последовательно промывают 10% хлористоводородной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=8:1-4:1)) с получением 6,0 г целевого соединения в виде бесцветных кристаллов. Т.пл. 85-86°С.
Ссылочный пример 56
4-(4-Хлорбутил)-5-этил-2-(п-толил)оксазол
В 150 мл толуола растворяют 6,5 г 8-хлор-4-(п-толуоиламино)-3-октанона, добавляют 4,1 мл оксихлорида фосфора и кипятят с обратным холодильником в течение 1,5 часов. Реакционный раствор охлаждают, выливают в ледяную воду и экстрагируют этилацетатом. Экстракт последовательно промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=8:1)) с получением 5,5 г целевого соединения в виде желтоватых кристаллов.
1Н-ЯМР (CDCl3)δ: 1,27 (3Н, т), 1,78-1,87 (4Н, м), 2,38 (3Н, с), 2,52 (2Н, т), 2,67 (2Н, кв), 3,57 (2Н, т), 7,23 (2Н, д), 7,84-7,89 (2Н, м).
Ссылочный пример 57
Диэтил 4-[5-этил-2-(п-толил)оксазол-4-ил]бутилмалонат
К 32,8 мл раствора 21% этоксида натрия в этаноле добавляют, при кипячении с обратным холодильником, 16,7 мл диэтилмалоната. Затем по каплям добавляют 5,0 г 4-(4-хлорбутил)-5-этил-2-(п-толил)оксазола/5 мл этанола и смесь кипятят с обратным холодильником в течение 7 часов в атмосфере аргона. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=10:1)) и получают 2,65 г целевого соединения в виде желтого масла.
1Н-ЯМР (CDCl3)δ: 1,25 (6Н, т), 1,29 (3Н, т), 1,35-1,46 (2Н, м), 1,65-1,73 (2Н, м), 1,88-1,99 (2Н, м), 2,39 (3Н, с), 2,48 (2Н, т), 2,66 (2Н, кв), 3,32 (1Н, т), 4,13-4,26 (4Н, м), 7,22 (2Н, д), 7,87 (2Н, д).
Ссылочный пример 58
В соответствии с методикой, описанной в приведенном ниже примере 6, получают следующие соединения:
2,2-диметил-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан,
метил 4-(5-метил-2-фенилоксазол-4-ил)бутират и
метил 3-(5-метил-2-фенилоксазол-4-ил)пропионат.
Ссылочный пример 59
1-(о-Толуоиламино)-2-пропанол
К 100 мл раствора 5,83 г 1-амино-2-пропанола в толуоле добавляют 18,0 мл триэтиламина, а затем, при перемешивании и охлаждении льдом, по каплям медленно добавляют 10 мл раствора 10,00 г о-толуоилхлорида в толуоле. После перемешивания в течение 30 минут ледяную баню удаляют и смесь перемешивают еще 1 час при комнатной температуре. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают 10% хлористоводородной кислотой, ледяной водой и насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток кристаллизуют с добавлением диэтилового эфира с получением 7,25 г целевого соединения в виде бесцветных кристаллов. Т.пл. 78-81°С.
В соответствии с методикой, описанной в ссылочном примере 59, получают следующие соединения:
1-(4-фторметилбензоиламино)-2-пропанол,
1-(м-толуоиламино)-2-пропанол и
1-(циклогексилкарбониламино)-2-пропанол.
Ссылочный пример 60
1-(о-Толуоиламино)-2-пропанон
Хлорхромиат пиридиния (15,91 г) добавляют, перемешивая, к 143 мл суспензии 7,13 г 1-(о-толуоиламино)-2-пропанола и 15,91 г целита в дихлорметане. Смесь перемешивают в течение 4 часов при комнатной температуре. Реакционный раствор очищают колоночной хроматографией на силикагеле (Wakogel (C-200, хлороформ)), и растворитель отгоняют при пониженном давлении. Элюат снова очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=1:2)) с получением 5,73 г целевого соединения в виде бесцветных кристаллов. Т.пл. 65-66°С.
В соответствии с методикой, описанной в ссылочном примере 60, получают следующие соединения:
1-(2,4-диметилбензоиламино)-2-пропанон,
1-(4-фторметилбензоиламино)-2-пропанон,
1-(м-толуоиламино)-2-пропанон,
1-(3,4-диметилбензоиламино)-2-пропанон,
1-(4-метоксибензоиламино)-2-пропанон и
1-(циклогексилкарбониламино)-2-пропанон.
Ссылочный пример 61
Метил цис-5-[5-ацетил-5-(о-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат
В атмосфере аргона 40 мл суспензии 1,18 г 60% гидрида натрия в N,N-диметилформамиде охлаждают до -25°С на бане с сухим льдом и ацетоном, а затем по каплям медленно добавляют 15 мл раствора 5,65 г 1-(о-толуоиламино)-2-пропанона в N,N-диметилформамиде. После перемешивания в течение 1 часа по каплям медленно добавляют 5 мл раствора 10,09 г метил цис-5-(4-иодбутил)-2-метил-1,3-диоксан-r-2-карбоксилата в N,N-диметилформамиде и смесь перемешивают в течение еще 1 часа. К реакционному раствору добавляют 1 мл 1N хлористоводородной кислоты, а затем воду и смесь экстрагируют диэтиловым эфиром. Экстракт промывают водным раствором 0,5% водного гидроксида натрия, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=1:1)), с получением 6,38 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,01-1,08 (2Н, м), 1,22-1,39 (4Н, м), 1,51 (3Н, с), 1,62-1,71 (2Н, м), 1,97-2,09 (1Н, м), 2,28 (3Н, с), 2,44 (3Н, с), 3,39 (2Н, т), 3,83 (3Н, с), 3,94 (2Н, дд), 4,84 (1Н, кв), 6,49 (1Н, д), 7,22-7,42 (4Н, м).
В соответствии с методикой, описанной в ссылочном примере 61, получают следующие соединения:
метил цис-5-[5-ацетил-5-(2,4-диметилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(4-фторметилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(м-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(3,4-диметилбензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(4-метоксибензоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-[5-ацетил-5-(2-теноиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат и
метил цис-5-[5-ацетил-5-(циклогексилкарбониламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат.
Ссылочный пример 62
1-(3,4-Диметилбензоиламино)-2-пропанол
К 30 мл раствора 5,00 г 3,4-диметилбензойной кислоты и 2,75 г 1-амино-2-пропанола в N,N-диметилформамиде последовательно добавляют 4,95 г 1-гидроксибензотриазола, 6,96 мл триэтиламина и 7,02 г гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и смесь перемешивают 15 минут при комнатной температуре. После добавления воды реакционный раствор экстрагируют этилацетатом, последовательно промывают 10% хлористоводородной кислотой, ледяной водой и насыщенным водным раствором гидрокарбоната натрия и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и получают 6,28 г целевого соединения в виде бесцветных кристаллов. Т.пл. 77-78°С.
В соответствии с методикой, описанной в ссылочном примере 62, получают следующие соединения:
1-(2,4-диметилбензоиламино)-2-пропанол и
1-(4-метоксибензоиламино)-2-пропанол.
Ссылочный пример 63
Метил 2-(2-теноиламино)ацетат
К 250 мл суспензии 12,56 г гидрохлорида метил-2-аминоацетата в дихлорметане добавляют 20,24 г триэтиламина и перемешивают при комнатной температуре в течение 30 минут. После охлаждения льдом по каплям медленно добавляют 20 мл раствора 14,66 г 2-теноилхлорида в дихлорметане. Ледяную баню удаляют и смесь перемешивают в течение 14 часов при комнатной температуре. Осажденные кристаллы отфильтровывают и промывают дихлорметаном. Растворитель отгоняют из фильтрата при пониженном давлении. К остатку для осаждения добавляют трет-бутилметиловый эфир. Оба продукта объединяют и получают 17,20 г целевого соединения в виде коричневатых кристаллов.
1Н-ЯМР (CDCl3)δ: 3,80 (3Н, с), 4,23 (2Н, д), 6,62 (1Н, шир.), 7,09 (1Н, дд), 7,50 (1Н, дд), 7,57 (1Н, дд).
Ссылочный пример 64
2-(2-Теноиламино)ацетат натрия
К 200 мл раствора 16,70 г метил 2-(2-теноиламино)ацетата в метаноле добавляют 20 мл водного раствора 4,02 г гидроксида натрия и кипятят с обратным холодильником в течение 30 минут. Растворитель отгоняют при пониженном давлении. Остаток кристаллизуют добавлением изопропанола с получением 18,03 г целевого соединения в виде светло-желтых кристаллов.
Ссылочный пример 65
1-(2-Теноиламино)-2-пропанон
К 44,0 мл суспензии 16,70 г 2-(2-теноиламино)ацетата натрия в β-пиколине добавляют 42,7 мл уксусного ангидрида и перемешивают в течение 3 часов при комнатной температуре. После охлаждения льдом последовательно и медленно по каплям добавляют 26,3 мл этанола, 129,7 мл воды и 45,2 мл концентрированной хлористоводородной кислоты, а затем смесь перемешивают в течение 15 минут при той же температуре. После удаления ледяной бани смесь перемешивают еще 15 минут при комнатной температуре. Затем добавляют воду (250 мл) и осажденные кристаллы отделяют и промывают водой. К кристаллам добавляют 37,0 мл воды и смесь кипятят с обратным холодильником в течение 1 часа. После добавления 14,0 г хлорида натрия смесь кипятят с обратным холодильником еще 1 час. Реакционный раствор экстрагируют этилацетатом и сушат над безводным сульфатом магния. После добавления активированного угля (Kyoryoku-sirasagi(MOIWY433) смесь перемешивают в течение 30 минут при комнатной температуре. Растворитель отгоняют при пониженном давлении. Остаток кристаллизуют добавлением трет-бутилметилового эфира с получением 7,15 г целевого соединения в виде светло-коричневых кристаллов.
1Н-ЯМР (CDCl3)δ: 2,27 (3Н, с), 4,34 (2Н, д), 6,80 (1Н, шир.), 7,09 (1Н, дд), 7,50 (1Н, дд), 7,57 (1Н, дд).
Ссылочный пример 66
4-[5,5-Бис(бромметил)пентил]-5-метил-2-(п-толил)оксазол
К 15 мл раствора 2,25 г 4-[5,5-бис(гидроксиметил)пентил]-5-метил-2-(п-толил)оксазола в N,N-диметилформамиде последовательно добавляют 3,92 мл γ-колидина, 2,57 г бромида лития и 2,3 мл метансульфонилхлорида и перемешивают при нагревании в течение 2,5 часов при 80°С. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) с получением 1,45 г целевого соединения в виде коричневого масла.
1Н-ЯМР (CDCl3)δ: 1,30-1,55 (2Н, м), 1,60-1,85 (4Н, м), 1,95-2,15 (1Н, м), 2,31 (3Н, с), 2,38 (3Н, с), 2,49 (2Н, т), 2,82-3,05 (4Н, м), 7,38-7,45 (2Н, м), 7,94-8,01 (2Н, м).
Ссылочный пример 67
4-[5,5-Бис(ацетилтиометил)пентил]-5-метил-2-(п-толил)оксазол
К 4 мл раствора 923 мг 4-[5,5-бис(бромметил)пентил]-5-метил-2-(п-толил)оксазола в полиэтиленгликоле 200 добавляют 1,18 г тиолацетата калия и перемешивают в течение 1,5 часов при нагревании при 80°С. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) с получением 830 мг целевого соединения в виде коричневого масла.
1Н-ЯМР (CDCl3)δ: 1,35-1,50 (4Н, м), 1,55-1,70 (2Н, м), 1,75-1,95 (1Н, м), 2,32 (3Н, с), 2,33 (6Н, с), 2,38 (3Н, с), 2,47 (2Н, т), 2,82-3,05 (4Н, м), 7,20-7,25 (2Н, м), 7,84-7,89 (2Н, м).
В соответствии с методикой, описанной в ссылочном примере 67, получают следующее соединение:
5-метил-4-(6-ацетилтиогексил)-2-(п-толил)оксазол.
Ссылочный пример 68
4-[5,5-Бис(меркаптометил)пентил]-5-метил-2-(п-толил)оксазол
К 8 мл раствора 830 мг 4-[5,5-бис(ацетилтиометил)пентил]-5-метил-2-(п-толил)оксазола в метаноле добавляют 8 мг водного 1N раствора гидроксида натрия и кипятят с обратным холодильником в течение 1 часа. Реакционный раствор подкисляют 1N хлористоводородной кислотой, экстрагируют дихлорметаном и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и получают 675 мг целевого соединения в виде светло-желтого масла.
1Н-ЯМР (CDCl3)δ: 1,25-1,95 (9Н, м), 2,31 (3Н, с), 2,38 (3Н, с), 2,48 (2Н, т), 2,55-2,85 (4Н, м), 7,16-7,24 (2Н, м), 7,81-7,89 (2Н, дд).
Ссылочный пример 69
Этил 6-иодгексаноат
К 112 мл раствора 13,38 г этил 6-бромгексаноата в ацетоне добавляют 26,97 г иодида натрия и смесь кипятят с обратным холодильником в течение 18 часов. Реакционный раствор охлаждают, фильтруют для удаления нерастворимых веществ и промывают ацетоном. Фильтрат концентрируют и после добавления воды экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 16,21 г целевого соединения в виде красно-желтого масла.
1Н-ЯМР (CDCl3)δ: 1,26 (3Н, т), 1,39-1,51 (2Н, м), 1,58-1,73 (2Н, м), 1,78-1,92 (2Н, м), 2,31 (2Н, т), 3,19 (2Н, т), 4,13 (2Н, кв).
Ссылочный пример 70
Этил 7-ацетил-7-(п-толуоиламино)гептаноат
Суспензию (100 мл) 60% гидрида натрия (2,64 г) в N,N-диметилформамиде охлаждают до -18°С на бане со льдом и хлоридом натрия и по каплям медленно добавляют 31 мл раствора 12,62 г 1-(п-толуоиламино)-2-пропанона в N,N-диметилформамиде. После перемешивания в течение 1 часа по каплям медленно добавляют 31 мл раствора 16,21 г этил 6-иодгексаноата в N,N-диметилформамиде. Ледяную баню удаляют и смесь перемешивают в течение 18 часов при комнатной температуре. После добавления ледяной воды реакционный раствор экстрагируют этилацетатом, последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=3:1)) с получением 13,13 г целевого соединения в виде желтого масла.
1Н-ЯМР (CDCl3)δ: 1,20-1,45 (4Н, м), 1,24 (3Н, т), 1,54-1,77 (3Н, м), 2,01-2,08 (1Н, м), 2,23-2,31 (2Н, т), 2,40 (3Н, с), 2,78 (3Н, с), 4,11 (2Н, кв), 4,18-4,90 (1Н, м), 6,90 (1Н, д), 7,25 (2Н, д), 7,71 (2Н, д).
Ссылочный пример 71
Этил 2-(6-иодгексилокси)-2-метилпропионат
К 76 мл раствора 12,16 г этил 2-(6-бромгексилокси)-2-метилпропионата в ацетоне добавляют 18,52 г иодида натрия и смесь кипятят с обратным холодильником в течение 18 часов. Реакционный раствор охлаждают, фильтруют для удаления нерастворимых веществ и промывают ацетоном. Фильтрат концентрируют и после добавления воды экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют с получением 14,46 г целевого соединения в виде красно-желтого масла.
1Н-ЯМР (CDCl3)δ: 1,29 (3Н, т), 1,37-1,40 (4Н, м), 1,41 (6Н, с), 1,55-1,62 (2Н, м), 1,80-1,87 (2Н, м), 3,19 (2Н, т), 3,56 (2Н, т), 4,12 (2Н, кв).
Ссылочный пример 72
Этил 2-[7-ацетил-7-(п-толуоиламино)гептилокси]-2-метилпропионат
Суспензию (70 мл) 1,81 г 60% гидрида натрия в N,N-диметилформамиде охлаждают до -18°С на бане со льдом и хлоридом натрия и по каплям медленно добавляют 21 мл раствора 8,67 г 1-(п-толуоиламино)-2-пропанона в N,N-диметилформамиде. После перемешивания в течение 1 часа по каплям медленно добавляют 21 мл раствора 14,10 г этил 2-(6-иодгексилокси)-2-метилпропионата в N,N-диметилформамиде. Баню удаляют и смесь перемешивают еще 18 часов при комнатной температуре. После добавления ледяной воды реакционный раствор экстрагируют этилацетатом, последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=3:1)) с получением 12,20 г целевого соединения в виде желтых кристаллов.
1Н-ЯМР (CDCl3)δ: 1,23-1,41 (6Н, м), 1,27 (3Н, т), 1,39 (6Н, с), 1,51-1,57 (2Н, м), 1,71-1,74 (1Н, м), 2,01-2,08 (1Н, м), 2,27 (3Н, с), 2,40 (3Н, с), 3,32 (2Н, т), 4,17 (2Н, кв), 4,80-4,90 (1Н, м), 6,89 (1Н, д), 7,25 (2Н, д), 7,71 (2Н, д).
Ссылочный пример 73
7-(Бензоиламино)-7-карбокси-(E)-4-гептеновая кислота
К 170 мл раствора 8,50 г диэтил [5-(бензоиламино)-5,5-бис(этоксикарбонил)-(Е)-2-пентенил]малоната в этаноле добавляют 34 мл водного раствора гидроксида натрия (5,53 г) и кипятят с обратным холодильником в течение 20 часов. Реакционный раствор концентрируют и, после добавления воды, остаток промывают диэтиловым эфиром. Водный слой подкисляют хлористоводородной кислотой, экстрагируют этилацетатом, сушат над безводным сульфатом магния и концентрируют с получением 6,58 г светло-желтого масла. Полученное масло растворяют в 90 мл этилацетата. К раствору добавляют 90 мл ксилола и перемешивают в течение 15 часов при 130°С. Растворитель отгоняют при пониженном давлении и полученные кристаллы промывают изопропиловым эфиром, что дает 4,52 г целевого соединения в виде бесцветных кристаллов. Т.пл. 138°С.
Пример 1
Метил 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат
4-[5,5-Бис(гидроксиметил)пентил]-5-метил-2-фенилоксазол (36 г) растворяют в 432 мл ацетонитрила и добавляют 25,4 г метилпирувата. К смеси, перемешивая при комнатной температуре, добавляют 35,3 г эфирата трифторида бора (около 47%) и кипятят с обратным холодильником в течение 2 часов. Реакционный раствор охлаждают, выливают в охлажденный льдом водный раствор гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, н-гексан:этилацетат=7,5:1)) и элюированные ранее фракции концентрируют с получением 16,5 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,00-1,12 (2Н, м), 1,22-1,40 (2Н, м), 1,55-1,70 (5Н, м), 1,90-2,20 (1Н, м), 2,30 (3Н, с), 2,45 (2Н, т), 3,39 (2Н, т), 3,82 (3Н, с), 3,95 (2Н, дд), 7,37-7,47 (3Н, м), 7,92-8,03 (2Н, м).
Пример 2
Метил 2-метил-транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат
Последние фракции примера 1 собирают и концентрируют с получением 11 г остатка, который снова очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=7,5:1)) с получением 0,83 г целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,33-1,44 (3Н, м), 1,51 (3Н, с), 1,63-1,78 (4Н, м), 2,33 (3Н, с), 2,51 (2Н, т), 3,75-3,81 (2Н, м), 3,83 (3Н, с), 3,91-3,99 (2Н, м), 7,38-7,45 (3Н, м), 7,96-8,01 (2Н, м).
В соответствии с методикой, описанной в примерах 1 и 2, получают следующие соединения:
метил цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил 2-этил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил 2-изобутил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил 2,5-диметил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил 2,5-диметил-транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил 5-этил-2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил 5-этил-2-метил-транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-[3-(5-метил-2-фенилоксазол-4-ил)пропил]-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-транс-5-[3-(5-метил-2-фенилоксазол-4-ил)пропил]-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[(5-метил-2-фенилоксазол-4-ил)метил]фенил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]фенил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[2-(п-толил)-5-трифторметилоксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-этил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат и
этил 2-этил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат.
Пример 3
Метил 2-метил-цис-5-[4-(2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат
В 5 мл ацетонитрила растворяют 1,25 г 4-[5,5-бис(гидроксиметил)пентил]-2-фенилоксазола и добавляют 927 мг метилпирувата. К этой смеси, перемешивая при комнатной температуре, добавляют 1,3 г эфирата трифторида бора (примерно 47%) и кипятят с обратным холодильником в течение 3 часов при комнатной температуре. Реакционный раствор охлаждают, выливают в охлажденный льдом водный раствор гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, н-гексан:изопропиловый эфир=1:1)) и элюированные ранее фракции концентрируют с получением 450 мг целевого соединения в виде белых кристаллов. Т.пл. 71-74°С.
1Н-ЯМР (CDCl3)δ: 1,01-1,12 (2Н, м), 1,27-1,43 (2Н, м), 1,51 (3Н, с), 1,59-1,74 (2Н, м), 1,90-2,20 (1Н, м), 2,56 (2Н, т), 3,39 (2Н, т), 3,83 (3Н, с), 3,96 (2Н, дд), 7,41-7,47 (4Н, м), 7,99-8,05 (2Н, м).
Пример 4
Метил 2-метил-транс-5-[4-(2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат
Последние фракции примера 3 собирают и концентрируют. Остаток снова очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:изопропиловый эфир=1:1)) и получают 110 мг целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,25-1,48 (2Н, м), 1,51 (3Н, с), 1,63-1,80 (5Н, м), 2,62 (2Н, т), 3,76-3,86 (5Н, м), 3,92-4,00 (2Н, м), 7,41-7,47 (4Н, м), 8,00-8,05 (2Н, м).
Пример 5
Метил 2-метил-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксан-2-карбоксилат
К 5 мл ацетонитрила добавляют 297 мг 4-{3-[2,2-бис(гидроксиметил)этил]бензил}-5-метил-2-фенилоксазола и 369 мг метилпирувата. К этой смеси, перемешивая при комнатной температуре, добавляют 544 мг эфирата трифторида бора (примерно 47%) и смесь перемешивают в течение 14 часов при комнатной температуре. Реакционный раствор охлаждают, выливают в охлажденный льдом водный раствор гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, н-гексан:этилацетат=3:1)) с получением 185 мг смеси (цис:транс=2,5:1, на основании суммарного значения ЯМР) в виде бесцветного масла.
Пример 6
Метил 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат
Метил цис-5-[5-ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилат (0,85 г) растворяют в 17 мл толуола. После добавления 644 мг оксихлорида фосфора смесь кипятят с обратным холодильником в течение 2,5 часов. Реакционный раствор охлаждают, выливают в ледяную воду, нейтрализуют водным раствором гидрокарбоната натрия, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, хлороформ:метанол=100:1)) с получением 0,42 г целевого соединения в виде белых кристаллов. Т.пл. 92-94°С.
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 68,07; Н, 7,43; N, 3,65.
В соответствии с методикой, описанной в примере 6, получают следующие соединения:
метил 2-метил-цис-5-[3-(5-метил-2-фенилоксазол-4-ил]пропил]-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил]бутил]-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-[5-(5-метил-2-фенилоксазол-4-ил]пентил]-1,3-диоксан-r-2-карбоксилат,
метил цис-5-{4-[2-(4-фторфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоксилат,
метил цис-5-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(4-трифторметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-(Е)-2-бутенил]-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропионат,
метил 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионат,
метил 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионат,
метил 2-{6-[2-(4-хлорфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионат,
метил 2-{6-[2-(4-фторфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионат,
метил 2-{6-[2-(4-трет-бутилфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионат,
метил 2-метил-2-[7-(5-метил-2-фенилоксазол-4-ил)гептилокси]пропионат,
метил 2-метил-2-[5-(5-метил-2-фенилоксазол-4-ил)пентилокси]пропионат,
метил 2-[6-(5-этил-2-фенилоксазол-4-ил)гексилокси]-2-метилпропионат,
метил 2-метил-2-{6-[5-метил-2-(4-пиридил)оксазол-4-ил]гексилокси}пропионат,
метил 2-метил-2-{6-[5-метил-2-(3-пиридил)оксазол-4-ил]гексилокси}пропионат,
метил 2-метил-цис-5-{4-[5-метил-2-(4-хлорфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{5-[5-метил-2-(п-толил)оксазол-4-ил]пентил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(3-фтор-4-метилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(4-этилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(2,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[2-(4-фторметилфенил)-5-метилоксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(м-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(о-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(3,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(4-метоксифенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[5-метил-2-(2-тиенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат,
метил 2-метил-цис-5-{4-[2-циклогексил-5-метилоксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат и
этил 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионат.
Пример 7
Метил 2-метил-2-[6-(2-фенилоксазол-4-ил)гексилокси]пропионат
Смесь 956 мг бензамида и 1,1 г метил 2-(8-хлор-7-оксооктилокси)-2-метилпропионата перемешивают в течение 2 часов при 120°С. Реакционный раствор охлаждают, растворяют в этилацетате, промывают, добавляя гидрокарбонат натрия, промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) с получением 658 мг целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,36-1,50 (10Н, м), 1,55-1,80 (4Н, м), 2,54-2,63 (2Н, м), 3,35 (2Н, т), 3,73 (3Н, с), 7,41-7,47 (4Н, м), 7,99-8,05 (2Н, м).
В соответствии с методикой, описанной в примере 7, получают следующие соединения:
метил 2-метил-2-[7-(2-фенилоксазол-4-ил)гептилокси]пропионат,
метил 2-{7-[2-(4-хлорфенил)оксазол-4-ил]гептилокси}-2-метилпропионат,
метил 2-{7-[2-(4-фторфенил)оксазол-4-ил]гептилокси}-2-метилпропионат,
метил 2-{6-[2-(4-фторфенил)оксазол-4-ил]гексилокси}-2-метилпропионат и
метил 2-метил-2-[8-(2-фенилоксазол-4-ил)октилокси]пропионат.
Пример 8
Метил 2-метил-2-[7-(2-фенилтиазол-4-ил)гептилокси]пропионат
Смесь 783 мг тиобензамида и 1,0 г метил 2-(9-хлор-8-оксононилокси)-2-метилпропионата перемешивают в течение 2 часов при 120°С. Реакционный раствор охлаждают и растворяют в этилацетате, промывают, добавляя гидрокарбонат натрия, промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) с получением 963 мг целевого соединения в виде бледно-желтого масла.
1Н-ЯМР (CDCl3)δ: 1,36-1,39 (6Н, м), 1,42 (6Н, с), 1,54-1,61 (2Н, м), 1,72-1,80 (2Н, м), 2,78-2,86 (2Н, м), 3,31-3,38 (2Н, м), 3,73 (3Н, с), 6,87 (1Н, с), 7,39-7,46 (3Н, м), 7,91-7,96 (2Н, м).
В соответствии с методикой, описанной в примере 8, получают следующее соединение:
метил 2-метил-2-[8-(2-фенилтиазол-4-ил)октилокси]пропионат.
Пример 9
2-Метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Метил 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоксилат (15,76 г) растворяют в 215 мл метанола, добавляют раствор 2,53 г гидроксида натрия/28 мл воды, смесь кипятят с обратным холодильником в течение 4 часов. Реакционный раствор охлаждают, выливают в ледяную воду, подкисляют разбавленной хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток растворяют при нагревании в смеси толуол/н-гексан и оставляют для охлаждения. Осадок отфильтровывают и получают 13,52 г целевого соединения.
1Н-ЯМР (CDCl3)δ: 1,00-1,15 (2Н, м), 1,25-1,45 (2Н, м), 1,50-1,70 (5Н, м), 1,90-2,20 (1Н, м), 2,32 (3Н, с), 2,52 (2Н, т), 3,49 (2Н, дд), 3,99 (2Н, дд), 7,40-7,50 (3Н, м), 7,90-8,05 (2Н, м), 9,70 (1Н, шир.).
Элементный анализ для С20Н25NO5:
вычислено (%): С, 66,84; Н, 7,01; N, 3,90
найдено (%): С, 66,76; Н, 7,09; N, 3,82.
Пример 10
2-Метил-цис-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксан-r-2-карбоновая кислота
Метил 2-метил-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксан-r-2-карбоксилат (смесь цис:транс=3:1) (185 мг) растворяют в 5 мл метанола, добавляют раствор 0,5 мл 2N гидроксида натрия и кипятят с обратным холодильником в течение 1 часа. Реакционный раствор охлаждают, выливают в ледяную воду, подкисляют разбавленной хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. К остатку добавляют эфир. Осажденные кристаллы отфильтровывают, перекристаллизовывают из ацетонитрила и сушат с получением 109 мг целевого соединения в виде белых кристаллов. Т.пл. 147-149°С.
Элементный анализ для С24Н25NO5:
вычислено (%): С, 70,75; Н, 6,18; N, 3,44
найдено (%): С, 70,85; Н, 6,26; N, 3,33.
Пример 11
2-Метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Метил 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат (250 мг) растворяют в 2,5 мл метанола, добавляют раствор 51 мг гидроксида натрия/0,6 мл воды и смесь кипятят с обратным холодильником в течение 4 часов. Реакционный раствор охлаждают, выливают в ледяную воду, подкисляют разбавленной хлористоводородной кислотой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. К остатку добавляют эфир. Осадок отфильтровывают, растворяют при нагревании в ацетонитриле и оставляют для охлаждения. Осадок отфильтровывают и сушат, в результате чего получают 196 мг целевого соединения.
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 67,57; Н, 7,25; N, 3,76.
Соединения примеров 12-52 получают в соответствии с методикой, описанной в примере 11.
Пример 12
2-Метил-транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 135-140°С.
1Н-ЯМР (CDCl3)δ: 1,38-1,50 (3Н, м), 1,56 (3Н, с), 1,60-1,80 (4Н, м), 2,33 (3Н, с), 2,54 (2Н, т), 3,79 (2Н, дд), 4,03 (2Н, дд), 7,20 (1Н, шир.), 7,40-7,50 (3Н, м), 7,90-8,10 (2Н, м).
Элементный анализ для С20Н25NO5:
вычислено (%): С, 66,84; Н, 7,01; N, 3,90
найдено (%): С, 67,35; Н, 7,00; N, 3,77.
Пример 13
2-Метил-цис-5-[5-(5-метил-2-фенилоксазол-4-ил)пентил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 135-137°С.
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 67,44; Н, 7,34; N, 3,77.
Пример 14
2-Метил-цис-5-[4-(2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С19Н23NO5:
вычислено (%): С, 66,07; Н, 6,71; N, 4,06
найдено (%): С, 66,09; Н, 6,75; N, 4,03.
Пример 15
Цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 119-121°С.
Элементный анализ для С19Н23NO5:
вычислено (%): С, 66,07; Н, 6,71; N, 4,06
найдено (%): С, 66,02; Н, 6,87; N, 4,18.
Пример 16
Транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 103-105°С.
Элементный анализ для С19Н23NO5:
вычислено (%): С, 66,07; Н, 6,71; N, 4,06
найдено (%): С, 66,07; Н, 6,99; N, 4,04.
Пример 17
2-Метил-транс-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 120-122°С.
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 67,61; Н, 7,35; N, 3,74.
Пример 18
Цис-5-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С24Н33NO5:
вычислено (%): С, 69,37; Н, 8,00; N, 3,37
найдено (%): С, 69,26; Н, 7,96; N, 3,43.
Пример 19
Цис-5-{4-[2-(4-фторфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 138-139,5°С.
Элементный анализ для С20Н24FNO5:
вычислено (%): С, 63,65; Н, 6,41; N, 3,71
найдено (%): С, 63,62; Н, 6,58; N, 3,69.
Пример 20
2-Метил-цис-5-{4-[5-метил-2-(4-трифторметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С21Н24F3NO5:
вычислено (%): С, 59,01; Н, 5,66; N, 3,28
найдено (%): С, 59,14; Н, 5,83; N, 3,29.
Пример 21
2-Этил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 67,05; Н, 7,24; N, 3,60.
Пример 22
2-Изобутил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 126-130°С.
Элементный анализ для С23Н31NO5:
вычислено (%): С, 68,80; Н, 7,78; N, 3,49
найдено (%): С, 68,72; Н, 7,88; N, 3,45.
Пример 23
2,5-Диметил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 147-150°С.
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 68,17; Н, 7,76; N, 3,46.
Пример 24
2,5-Диметил-транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 142-144°С.
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 67,35; Н, 7,37; N, 3,44.
Пример 25
5-Этил-2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 155-158°С.
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 68,18; Н, 7,59; N, 3,49.
Пример 26
5-Этил-2-метил-транс-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 126-130°С.
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 67,77; Н, 7,57; N, 3,47.
Пример 27
2-Метил-цис-5-[3-(5-метил-2-фенилоксазол-4-ил)пропил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 131-134°С.
Элементный анализ для С19Н23NO5:
вычислено (%): С, 66,07; Н, 6,71; N, 4,06
найдено (%): С, 65,59; Н, 6,69; N, 3,92.
Пример 28
2-Метил-транс-5-[3-(5-метил-2-фенилоксазол-4-ил)пропил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 164-166°С.
Элементный анализ для С19Н23NO5:
вычислено (%): С, 66,07; Н, 6,71; N, 4,06
найдено (%): С, 65,64; Н, 6,70; N, 3,91.
Пример 29
2-Метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-(E)-2-бутенил]-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 148-150°С.
Элементный анализ для С20Н23NO5:
вычислено (%): С, 67,21; Н, 6,49; N, 3,92
найдено (%): С, 67,26; Н, 6,36; N, 3,82.
Пример 30
2-Метил-5-{4-[(5-метил-2-фенилоксазол-4-ил)метил]бензил}-1,3-диоксан-2-карбоновая кислота
Была получена смесь (цис:транс=4:1, на основании интегрального значения ЯМР)
Элементный анализ для С24Н25NO5:
вычислено (%): С, 70,75; Н, 6,18; N, 3,44
найдено (%): С, 70,69; Н, 6,23; N, 3,45.
Пример 31
2-Метил-цис-5-{4-[(5-метил-2-фенилоксазол-4-ил)метил]фенил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 215-216°С.
Элементный анализ для С23Н23NO5:
вычислено (%): С, 70,21; Н, 5,89; N, 3,56
найдено (%): С, 70,02; Н, 5,88; N, 3,35.
Пример 32
2-Метил-цис-5-{3-[(5-метил-2-фенилоксазол-4-ил)метил]фенил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 122-124°С.
Элементный анализ для С23Н23NO5:
вычислено (%): С, 70,21; Н, 5,89; N, 3,56
найдено (%): С, 70,05; Н, 6,08; N, 3,51.
Пример 33
2-Метил-цис-5-{4-[5-метил-2-(3-пиридил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 126-129°С.
Элементный анализ для С19Н24N2O5:
вычислено (%): С, 63,32; Н, 6,71; N, 7,77
найдено (%): С, 63,16; Н, 6,73; N, 7,57.
Пример 34
2-Метил-2-[5-(5-метил-2-фенилоксазол-4-ил)пентилокси]пропионовая кислота
Т.пл. 66-68°С.
Элементный анализ для С19Н25NO4·H2O
вычислено (%): С, 65,31; Н, 7,79; N, 4,01
найдено (%): С, 65,20; Н, 7,84; N, 4,03.
Пример 35
2-Метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропионовая кислота
Элементный анализ для С20Н27NO4
вычислено (%): С, 69,54; Н, 7,88; N, 4,05
найдено (%): С, 69,12; Н, 7,86; N, 4,11.
Пример 36
2-Метил-2-[7-(5-метил-2-фенилоксазол-4-ил)гептилокси]пропионовая кислота
Т.пл. 70-71°С.
Элементный анализ для С21Н29NO4
вычислено (%): С, 70,17; Н, 8,13; N, 3,90
найдено (%): С, 70,03; Н, 8,15; N, 3,90.
Пример 37
2-Метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил)гексилокси]пропионовая кислота
Элементный анализ для С21Н29NO4
вычислено (%): С, 70,17; Н, 8,13; N, 3,90
найдено (%): С, 70,07; Н, 8,07; N, 3,92.
Пример 38
2-Метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионовая кислота
Элементный анализ для С20Н23NO4
вычислено (%): С, 70,36; Н, 6,79; N, 4,10
найдено (%): С, 70,24; Н, 6,51; N, 3,90.
Пример 39
2-{6-[2-(4-Хлорфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионовая кислота
Элементный анализ для С20Н26ClNO4
вычислено (%): С, 63,24; Н, 6,90; N, 3,69
найдено (%): С, 63,17; Н, 6,82; N, 3,82.
Пример 40
2-{6-[2-(4-Фторфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионовая кислота
Т.пл. 64-67°С.
Элементный анализ для С20Н26FNO4
вычислено (%): С, 66,10; Н, 7,21; N, 3,85
найдено (%): С, 66,18; Н, 7,30; N, 4,06.
Пример 41
2-{6-[2-(4-трет-Бутилфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионовая кислота
Т.пл. 89-91°С.
Элементный анализ для С24Н35NO4
вычислено (%): С, 71,79; Н, 8,79; N, 3,49
найдено (%): С, 71,79; Н, 8,81; N, 3,52.
Пример 42
2-[6-(5-Этил-2-фенилоксазол-4-ил)гексилокси]-2-метилпропионовая кислота
Т.пл. 88,5-89°С.
Элементный анализ для С21Н29NO4
вычислено (%): С, 70,17; Н, 8,13; N, 3,90
найдено (%): С, 70,36; Н, 8,07; N, 3,90.
Пример 43
2-Метил-2-[6-(2-фенилоксазол-4-ил)гексилокси]пропионовая кислота
Т.пл. 75-77°С.
Элементный анализ для С19Н25NO4
вычислено (%): С, 68,86; Н, 7,60; N, 4,23
найдено (%): С, 68,89; Н, 7,62; N, 4,27.
Пример 44
2-Метил-2-[7-(2-фенилоксазол-4-ил)гептилокси]пропионовая кислота
Т.пл. 72-75°С.
Элементный анализ для С20Н27NO4
вычислено (%): С, 69,54; Н, 7,88; N, 4,05
найдено (%): С, 69,67; Н, 7,89; N, 4,06.
Пример 45
2-Метил-2-[8-(2-фенилоксазол-4-ил)октилокси]пропионовая кислота
Т.пл. 59-61°С.
Элементный анализ для С21Н29NO4
вычислено (%): С, 70,17; Н, 8,13; N, 3,90
найдено (%): С, 70,02; Н, 8,30; N, 3,91.
Пример 46
2-{7-[2-(4-Хлорфенил)оксазол-4-ил]гептилокси}-2-метилпропионовая кислота
Т.пл. 91-93°С.
Элементный анализ для С20Н26ClNO4
вычислено (%): С, 63,24; Н, 6,90; N, 3,69
найдено (%): С, 63,39; Н, 6,98; N, 3,72.
Пример 47
2-{7-[2-(4-Фторфенил)оксазол-4-ил]гептилокси}-2-метилпропионовая кислота
Т.пл. 67-74°С.
Элементный анализ для С20Н26FNO4
вычислено (%): С, 66,10; Н, 7,21; N, 3,85
найдено (%): С, 65,90; Н, 7,06; N, 3,84.
Пример 48
2-{6-[2-(4-Фторфенил)оксазол-4-ил]гексилокси}-2-метилпропионовая кислота
Т.пл. 80-83°С.
Элементный анализ для С19Н24FNO4
вычислено (%): С, 65,31; Н, 6,92; N, 4,01
найдено (%): С, 65,15; Н, 6,77; N, 3,91.
Пример 49
2-Метил-2-[7-(2-фенилтиазол-4-ил)гептилокси]пропионовая кислота
Т.пл. 71-72°С.
Элементный анализ для С20Н27NO3S
вычислено (%): С, 66,45; Н, 7,53; N, 3,87
найдено (%): С, 66,46; Н, 7,57; N, 3,98.
Пример 50
2-Метил-2-[8-(2-фенилтиазол-4-ил)октилокси]пропионовая кислота
Т.пл. 64-70°С.
Элементный анализ для С21Н29NO3S·H2O
вычислено (%): С, 64,09; Н, 7,94; N, 3,56
найдено (%): С, 64,67; Н, 7,89; N, 3,83.
Пример 51
2-Метил-2-{6-[5-метил-2-(4-пиридил)оксазол-4-ил]гексилокси}пропионовая кислота
Т.пл. 91-93°С.
Элементный анализ для С19Н26N2O4
вычислено (%): С, 65,88; Н, 7,56; N, 8,09
найдено (%): С, 65,79; Н, 7,52; N, 8,03.
Пример 52
2-Метил-2-{6-[5-метил-2-(3-пиридил)оксазол-4-ил]гексилокси}пропионовая кислота
1Н-ЯМР (CDCl3)δ: 1,25-1,50 (10Н, м), 1,55-1,75 (4Н, м), 2,34 (3Н, с), 2,50 (2Н, т), 3,45 (2Н, т), 7,35-7,42 (1Н, м), 8,26-8,30 (1Н, м), 8,62-8,66 (1Н, м), 9,21-9,22 (1Н, м).
Пример 53
2-Метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-(E)-3-бутенил]-1,3-диоксан-r-2-карбоновая кислота
Метил 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-3-бутенил]-1,3-диоксан-r-2-карбоксилат (7,5 г) растворяют в 30 мл N,N-диметилформамида и, при перемешивании и охлаждении льдом, по каплям медленно добавляют раствор 3,57 г N-бромсукцинимида (NBS)/20 мл N,N-диметилформамида. После перемешивания в течение 30 минут реакционный раствор выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=7:1)) с получением 215 мг масла. Полученное масло растворяют в 3 мл метанола. К раствору добавляют 70 мг гидроксида натрия и 0,8 мл воды и смесь кипятят с обратным холодильником в течение 2,5 часов и концентрируют. После добавления льда остаток подкисляют 1N хлористоводородной кислотой, экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, этилацетат)) с получением 30 мг целевого соединения.
1Н-ЯМР (CDCl3)δ: 1,22 (2Н, ддд), 1,65 (3Н, с), 2,00-2,30 (3Н, м), 2,38 (3Н, с), 3,51 (2Н, дд), 4,02 (2Н, дд), 4,20 (1Н, шир.), 6,15-6.40 (2Н, м), 7,40-7,60 (3Н, м), 7,90-8.20 (2Н, м).
Пример 54
2-Метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-(E)-4-гексенилокси]пропионат калия
К 20 мл раствора 920 мг метил 2-[6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси]-2-метилпропионата в метаноле добавляют 20 мл водного раствора 206 мг гидроксида натрия и смесь кипятят с обратным холодильником в течение 20 часов. Реакционный раствор концентрируют. После добавления ледяной воды остаток подкисляют 10% хлористоводородной кислотой. Смесь экстрагируют этилацетатом, промывают водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, хлороформ)) с получением 670 мг 2-[6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси]-2-метилпропионовой кислоты в виде бесцветного масла. Часть (100 мг) полученного масла превращают в калиевую соль с использованием гидроксида калия. После добавления изопропилового эфира осадок отфильтровывают и получают 88 мг целевого соединения.
Элементный анализ для С20Н24NO4К·1/2 H2O:
вычислено (%): С, 61,51; Н, 6,45; N, 3,59
найдено (%): С, 61,56; Н, 6,24; N, 3,53.
Пример 55
2-Метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропанол
К 214 мл безводного эфира добавляют 1,35 г алюмогидрида лития и, при перемешивании и охлаждении льдом, по каплям медленно добавляют раствор 10,7 г метил 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропионата/40 мл безводного эфира и смесь перемешивают в течение 1 часа. К этой смеси по каплям медленно добавляют 43 мл тетрагидрофурана/1,7 мл воды, а затем 6,3 мл воды и 1,7 мл 1N гидроксида натрия, после чего смесь перемешивают в течение 15 минут и фильтруют для удаления нерастворимых веществ. Фильтрат концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=3:1)) с получением 8,44 г целевого соединения.
Элементный анализ для С20Н29NO3·1/2 H2O:
вычислено (%): С, 70,55; Н, 8,88; N, 4,11
найдено (%): С, 70,95; Н, 8,67; N, 4,21.
Соединения примеров 56-58 получают в соответствии с методикой, описанной в примере 55.
Пример 56
2-{6-[2-(4-трет-Бутилфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропанол
1Н-ЯМР (CDCl3)δ: 1,14 (6Н, с), 1,34-1,43 (11Н, м), 1,45-1,75 (6Н, м), 1,95-2,10 (1Н, м), 2,31 (3Н, с), 2,47 (2Н, т), 3,30-3,41 (4Н, м), 7,41-7,45 (2Н, м), 7,88-7,92 (2Н, м).
Элементный анализ для С24Н37NO3·H2O:
вычислено (%): С, 71,07; Н, 9,69; N, 3,45
найдено (%): С, 70,89; Н, 9,32; N, 2,20.
Пример 57
2-Метил-2-{6-[5-метил-2-(3-пиридил)оксазол-4-ил]гексилокси}пропанол
1Н-ЯМР (CDCl3)δ: 1,15 (6Н, с), 1,34-1,40 (4Н, м), 1,45-1,85 (4Н, м), 1,95-2,10 (1Н, м), 2,34 (3Н, с), 2,45 (2Н, т), 3,31-3,40 (4Н, м), 7,27-7,36 (1Н, м), 8,22-8,28 (1Н, м), 8,61-8,64 (1Н, м), 9,20-9,21 (1Н, м).
Элементный анализ для С19Н28N2O3·H2O:
вычислено (%): С, 65,12; Н, 8,63; N, 7,99
найдено (%): С, 65,24; Н, 8,40; N, 7,73.
Пример 58
r-2-Гидроксиметил-2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан
Т.пл. 58-59°С.
Элементный анализ для С21Н29NO4:
вычислено (%): С, 70,17; Н, 8,13; N, 3,90
найдено (%): С, 69,97; Н, 8,05; N, 3,88.
Пример 59
2-Метил-2-{6-[5-метил-2-(4-пиридил)оксазол-4-ил]гексилокси}пропанолметансульфонатная соль
Метил 2-метил-2-{6-[5-метил-2-(4-пиридил)оксазол-4-ил]гексилокси}пропионат (210 мг) растворяют в 20 мл безводного эфира, добавляют 44 мг алюмогидрида лития и смесь перемешивают в течение 30 минут при охлаждении льдом. Затем по каплям добавляют 5 мл тетрагидрофурана/0,33 мл воды, перемешивают в течение 15 минут, фильтруют для удаления нерастворимых веществ и фильтрат концентрируют. Остаток растворяют в эфире. К раствору добавляют 59 мг метансульфоновой кислоты/1 мл эфира и отфильтровывают осажденные кристаллы, которые промывают эфиром и сушат с получением 195 мг целевого соединения в виде светло-желтых кристаллов. Т.пл. 128-130°С.
Элементный анализ для С19Н28N2O3·СН4O3S·H2O:
вычислено (%): С, 53,79; Н, 7,67; N, 6,27
найдено (%): С, 53,87; Н, 7,28; N, 6,17.
Пример 60
2-Метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбогидроксамовая кислота
2-Метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновую кислоту (350 мг) растворяют в 7,5 мл тетрагидрофурана и добавляют 174 мг 1,1'-карбонилдиимидазола и смесь перемешивают в течение 24 часов при комнатной температуре. Реакционный раствор концентрируют и добавляют 3 мл метанола для растворения остатка, а затем по каплям добавляют раствор 190 мг хлорида гидроксиламмония/6 мл метанола и 336 мг триэтиламина, после чего смесь перемешивают в течение 4 часов при комнатной температуре. Реакционный раствор выливают в ледяную воду, экстрагируют этилацетатом, промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь хлороформ:метанол=100:1)) с получением 53,8 мг целевого соединения в виде белых кристаллов. Т.пл. 115-116°С.
Элементный анализ для С20Н26N2O5·1/4 H2O:
вычислено (%): С, 63,39; Н, 7,05; N, 7,39
найдено (%): С, 63,35; Н, 6,85; N, 7,37.
Соединения примеров 61-77 получают в соответствии с методикой, описанной в примере 11.
Пример 61
2-Метил-цис-5-{4-[5-метил-2-(4-хлорфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 145-146°С
Элементный анализ для С20Н24ClNO5:
вычислено (%): С, 60,99; Н, 6,14; N, 3,56
найдено (%): С, 60,75; Н, 6,25; N, 3,36.
Пример 62
2-Метил-цис-5-{5-[5-метил-2-(п-толил)оксазол-4-ил]пентил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 118-119°С
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 68,20; Н, 7,53; N, 3,60.
Пример 63
2-Этил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 123-126°С
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 69,22; Н, 7,53; N, 3,21.
Пример 64
2-Метил-цис-5-{4-[5-метил-2-(3-фтор-4-метилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С21Н26FNO5:
вычислено (%): С, 64,44; Н, 6,69; N, 3,58
найдено (%): С, 64,49; Н, 6,68; N, 3,90.
Пример 65
2-Метил-цис-5-{4-[5-метил-2-(4-этилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 147°С
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 67,99; Н, 7,50; N, 3,76.
Пример 66
2-Метил-цис-5-{4-[2-(п-толил)-5-трифторметилоксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 130-131°С
Элементный анализ для С21Н24F3NO5:
вычислено (%): С, 59,01; Н, 5,66; N, 3,28
найдено (%): С, 59,11; Н, 5,67; N, 3,16.
Пример 67
2-Метил-цис-5-{4-[5-метил-2-(2,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 130-131°С
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 68,25; Н, 7,53; N, 3,65.
Пример 68
2-Метил-цис-5-{4-[2-(4-фторметилфенил)-5-метилоксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 144-145°С
Элементный анализ для С21Н26FNO5:
вычислено (%): С, 64,44; Н, 6,69; N, 3,58
найдено (%): С, 64,35; Н, 6,69; N, 3,52.
Пример 69
2-Метил-цис-5-{4-[5-этил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 160-161°С
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 68,15; Н, 7,52; N, 3,56.
Пример 70
2-Метил-цис-5-{4-[5-метил-2-(п-толил)тиазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С21Н27NO4S:
вычислено (%): С, 64,76; Н, 6,99; N, 3,60
найдено (%): С, 64,68; Н, 6,97; N, 3,64.
Пример 71
2-Метил-цис-5-{4-[5-метил-2-(м-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 67,57; Н, 7,22; N, 3,80.
Пример 72
2-Метил-цис-5-{4-[5-метил-2-(о-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 121-122°С
Элементный анализ для С21Н27NO5:
вычислено (%): С, 67,54; Н, 7,29; N, 3,75
найдено (%): С, 67,47; Н, 7,29; N, 3,71.
Пример 73
2-Метил-цис-5-{4-[5-метил-2-(3,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С22Н29NO5:
вычислено (%): С, 68,20; Н, 7,54; N, 3,61
найдено (%): С, 68,31; Н, 7,53; N, 3,65.
Пример 74
2-Метил-цис-5-{4-[5-метил-2-(4-метоксифенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С21Н27NO6:
вычислено (%): С, 64,77; Н, 6,99; N, 3,60
найдено (%): С, 64,80; Н, 7,13; N, 3,57.
Пример 75
2-Метил-цис-5-{4-[5-метил-2-(2-тиенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Элементный анализ для С18Н23NO5S:
вычислено (%): С, 59,16; Н, 6,34; N, 3,83
найдено (%): С, 59,45; Н, 6,32; N, 3,76.
Пример 76
2-Метил-цис-5-{4-[2-циклогексил-5-метилоксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 118-121°С
Элементный анализ для С20Н31NO5:
вычислено (%): С, 65,73; Н, 8,55; N, 3,83
найдено (%): С, 65,75; Н, 8,57; N, 3,80.
Пример 77
2-Метил-цис-5-{4-[1,5-диметил-2-(п-толил)имидазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота
Т.пл. 192-194°С (с разложением).
Элементный анализ для С22Н30N2O4·1H2O
вычислено (%): С, 65,32; Н, 7,97; N, 6,93
найдено (%): С, 65,36; Н, 7,58; N, 6,75.
Пример 78
Метил 2-метил-цис-5-[3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензил]-1,3-диоксан-r-2-карбоксилат
2-[3-{[5-Метил-2-(п-толил)оксазол-4-ил]метил}бензил]-1,3-пропандиол (2,29 г) растворяют в 38 мл ацетонитрила и добавляют 2,65 г метилпирувата. К этой смеси, перемешивая при комнатной температуре, добавляют 3,69 г эфирата трифторида бора (примерно 47%) и перемешивают в течение 18 часов при комнатной температуре. Реакционный раствор выливают в водный раствор гидрокарбоната натрия и экстрагируют этилацетатом. Органический слой промывают водой, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=4:1)) и ранее элюированные фракции концентрируют с получением 752 мг целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,49 (3Н, с), 2,20-2,35 (3Н, м), 2,25 (3Н, с), 2,38 (3Н, с), 3,48 (2Н, т), 3,80-3,95 (4Н, м), 3,83 (3Н, с), 6,92-7,24 (6Н, м), 7,80-7,90 (2Н, м).
Пример 79
Метил 2-метил-транс-5-[3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензил]-1,3-диоксан-r-2-карбоксилат
Последние фракции соединения примера 78 собирают и концентрируют с получением 294 мг целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,57 (3Н, с), 2,20-2,35 (1Н, м), 2,25 (3Н, с), 2,38 (3Н, с), 2,98 (2Н, д), 3,70-3,88 (4Н, м), 3,82 (3Н, с), 3,93 (2Н, дд), 7,00-7,30 (6Н, м), 7,87 (2Н, д).
Пример 80
2-Метил-цис-5-[3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензил]-1,3-диоксан-r-2-карбоновая кислота
В 20 мл метанола растворяют 968 мг метил 2-метил-цис-5-[3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензил]-1,3-диоксан-r-2-карбоксилата. После добавления 3,3 мл водного 1N раствора гидроксида натрия смесь кипятят с обратным холодильником в течение 1,5 часов. Реакционный раствор концентрируют. После добавления воды остаток промывают диэтиловым эфиром. Водный слой подкисляют 1N хлористоводородной кислотой, экстрагируют диэтиловым эфиром, сушат над безводным сульфатом магния и концентрируют. Остаток кристаллизуют добавлением диэтилового эфира и промывают изопропиловым эфиром с получением 733 мг целевого соединения в виде бесцветных кристаллов.
Т.пл. 151-152°С.
Элементный анализ для С25Н27NO5:
вычислено (%): С, 71,24; Н, 6,46; N, 3,32
найдено (%): С, 71,50; Н, 6,42; N, 3,48.
Пример 81
2-Метил-транс-5-[3-{[5-метил-2-(п-толил)оксазол-4-ил]метил}бензил]-1,3-диоксан-r-2-карбоновая кислота
Целевое соединение получают в соответствии с методикой, описанной в примере 80.
Элементный анализ для С25Н27NO5:
вычислено (%): С, 71,24; Н, 6,46; N, 3,32
найдено (%): С, 70,18; Н, 6,34; N, 3,31.
Пример 82
2-Метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-дитиан-r-2-карбоновая кислота
К 2 мл раствора 124 мг метил 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-дитиан-r-2-карбоксилата в метаноле добавляют 1 мл водного раствора 1N гидроксида натрия и смесь кипятят с обратным холодильником в течение 1,5 часов. Реакционный раствор концентрируют. После добавления воды остаток промывают диэтиловым эфиром. Водный слой подкисляют 1N хлористоводородной кислотой, экстрагируют этилацетатом, сушат над безводным сульфатом магния и концентрируют. Остаток кристаллизуют добавлением изопропилового эфира и промывают н-гексаном с получением 88 мг целевого соединения в виде бесцветных кристаллов. Т.пл. 157-159°С.
Элементный анализ для С21Н27NO3S2:
вычислено (%): С, 62,19; Н, 6,71; N, 3,45
найдено (%): С, 61,93; Н, 6,70; N, 3,40.
Пример 83
2-Метил-транс-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-дитиан-r-2-карбоновая кислота
Целевое соединение получают в соответствии с методикой, описанной в примере 82.
Т.пл. 162-164°С.
Элементный анализ для С21Н27NO3S2:
вычислено (%): С, 62,19; Н, 6,71; N, 3,45
найдено (%): С, 61,75; Н, 6,66; N, 3,42.
Пример 84
2-Метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилтио}пропионовая кислота
В атмосфере аргона 24 мг растертого гидроксида натрия добавляют к 2 мл раствора 100 мг 4-(6-ацетилтиогексил)-5-метил-2-(п-толил)оксазола в ацетоне и перемешивают в течение 2 часов при комнатной температуре. К полученному раствору добавляют 20 мкл воды с последующим добавлением 113 мг 1,1,1-трихлор-2-метил-2-пропанол·0,5 гидрида (хлорэтона), а затем тремя порциями через интервалы в 30 минут добавляют 96,5 мг растертого гидроксида натрия. Смесь перемешивают еще 18 часов при комнатной температуре. Реакционный раствор концентрируют. После добавления воды остаток экстрагируют диэтиловым эфиром. Органические слои объединяют, промывают водой и промывки подкисляют 1N хлористоводородной кислотой и экстрагируют этилацетатом. Органические слои объединяют, последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь хлороформ:метанол=100:1)) и полученные кристаллы промывают н-гексаном с получением 28,0 мг целевого соединения в виде светло-желтых кристаллов.
Т.пл. 111°С.
Элементный анализ для С21Н29NO3S2:
вычислено (%): С, 67,17; Н, 7,78; N, 3,73
найдено (%): С, 67,33; Н, 7,85; N, 3,67.
Пример 85
2-Метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионнитрил
Трибромид фосфора (6,77 г) добавляют к 94 мл раствора 4,90 г 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионгидроксамовой кислоты в бензоле и кипятят с обратным холодильником в течение 4 часов. Реакционный раствор охлаждают и выливают в ледяную воду. После добавления водного раствора насыщенного гидрокарбоната натрия смесь экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) с получением 3,32 г целевого соединения в виде бесцветных кристаллов. Т.пл. 36°С.
Элементный анализ для С21Н28N2O2·1/5 H2O:
вычислено (%): С, 73,31; Н, 8,32; N, 8,14
найдено (%): С, 73,21; Н, 8,27; N, 7,88.
Пример 86
5-[1-Метил-1-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}этил]тетразол
Азид натрия (4,12 г) и 2,97 г хлорида аммония добавляют к 27 мл раствора 2,70 г 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионнитрила в N,N-диметилформамиде и смесь перемешивают в течение 1,5 часов при 120°С. К реакционному раствору добавляют ледяную воду, экстрагируют этилацетатом, последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь хлороформ:метанол=100:1-50:1)) и перекристаллизовывают из изопропилового эфира с получением 1,69 г целевого соединения в виде бесцветных кристаллов. Т.пл. 87°С.
Элементный анализ для С21Н29N5O2:
вычислено (%): С, 65,77; Н, 7,62; N, 18,26
найдено (%): С, 65,67; Н, 7,65; N, 17,97.
Пример 87
2-Метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксамид
В атмосфере аргона 45 мл раствора 3,00 г 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновой кислоты в тетрагидрофуране охлаждают льдом и добавляют 1,12 мл триэтиламина, а затем по каплям добавляют 5 мл раствора 959 мг этилхлорформиата в тетрагидрофуране. После перемешивания в течение 45 минут по каплям добавляют 45 мл смеси аммиака и насыщенного тетрагидрофурана, а затем перемешивают еще 1 час. К реакционному раствору добавляют воду, экстрагируют этилацетатом, последовательно промывают насыщенным гидрокарбонатом натрия и водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и полученные кристаллы промывают диэтиловым эфиром с получением 2,81 г целевого соединения в виде бесцветных кристаллов. Т.пл. 146-147°С.
Элементный анализ для С21Н28N2O4:
вычислено (%): С, 67,72; Н, 7,58; N, 7,52
найдено (%): С, 67,26; Н, 7,54; N, 7,39.
Пример 88
2-Метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбонитрил
В атмосфере аргона 2,04 мл триэтиламина по каплям добавляют к 34 мл раствора 2,27 г 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксиамида в тетрагидрофуране. После перемешивания в течение 10 минут, при охлаждении льдом, по каплям медленно добавляют 5 мл раствора 1,53 г трифторуксусного ангидрида в тетрагидрофуране и перемешивают еще 1 час. К реакционному раствору добавляют воду, экстрагируют диэтиловым эфиром, последовательно промывают насыщенным гидрокарбонатом натрия и водой и сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=4:1)) с получением 2,07 г целевого соединения в виде бесцветных кристаллов. Т.пл. 79-80°С.
Элементный анализ для С21Н26N2O3:
вычислено (%): С, 71,16; Н, 7,39; N, 7,90
найдено (%): С, 71,01; Н, 7,42; N, 7,90.
Пример 89
Метил 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-дитиан-r-2-карбоксилат
К 20 мл раствора 635 мг 4-[5,5-бис(меркаптометил)пентил]-5-метил-2-(п-толил)оксазола в ацетонитриле добавляют 0,344 мл метилпирувата и 0,48 мл эфирата трифторида бора (примерно 47%) и кипятят с обратным холодильником в течение 2 часов. Реакционный раствор охлаждают, выливают в ледяную воду и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=9:1)) и элюированные ранее фракции концентрируют с получением 124 мг целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,25-1,55 (4Н, м), 1,69 (3Н, с), 1,70-1,90 (3Н, м), 2,31 (3Н, с), 2,38 (3Н, с), 2,40-2,60 (4Н, м), 3,54 (2Н, м), 3,77 (3Н, с), 7,22 (2Н, с), 7,86 (2Н, с).
Пример 90
Метил 2-метил-транс-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-дитиан-r-2-карбоксилат
Последние фракции соединения примера 89 собирают и концентрируют с получением 124 мг целевого соединения в виде бесцветного масла.
1Н-ЯМР (CDCl3)δ: 1,30-1,50 (4Н, м), 1,55-1,90 (7Н, м), 2,31 (3Н, с), 2,38 (3Н, с), 2,47 (2Н, т), 2,58 (2Н, дд), 3,07 (2Н, дд), 3,11 (2Н, с), 7,23 (2Н, д), 7,87 (2Н, д).
Пример 91
2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионгидроксамовая кислота
К 20 мл раствора 4,84 г этил 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионата в метаноле добавляют 3,47 г гидроксиламмонийхлорида, а затем, при перемешивании и охлаждении льдом, медленно по каплям добавляют 12,5 мл раствора 5М гидроксида калия в метаноле. Ледяную баню удаляют и смесь перемешивают в течение 36 часов при комнатной температуре. Реакционный раствор концентрируют. Остаток подкисляют 50% водным раствором уксусной кислоты, добавляют воду и экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и концентрируют. После добавления толуола остаток концентрируют и снова концентрируют после добавления этанола, в результате чего получают 4,90 г целевого соединения в виде светло-желтого масла.
1Н-ЯМР (CDCl3)δ: 1,36-1,41 (4Н, м), 1,38 (6Н, с), 1,53-1,70 (4Н, м), 2,31 (3Н, с), 2,38 (3Н, с), 2,48 (2Н, т), 3,37 (2Н, т), 7,23 (2Н, д), 7,87 (2Н, д).
Пример 92
Метил 2-метил-цис-5-{4-[1,5-диметил-2-(п-толил)имидазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат
К 20 мл раствора 0,80 г метил цис-5-[5-ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилата в ксилоле добавляют 1,5 мл раствора 2М метиламина в тетрагидрофуране и 0,84 мл уксусной кислоты. Смесь подвергают азеотропной дегидратации в течение 2 часов с использованием насадки Дина-Старка. Реакционный раствор охлаждают, выливают в водный гидрокарбонат натрия, экстрагируют этилацетатом, сушат над безводным сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь хлороформ:метанол=100:1)) с получением 634 мг целевого соединения в виде светло-желтого масла.
1Н-ЯМР (CDCl3)δ: 0,97-1,10 (2Н, м), 1,20-1,40 (2Н, м), 1,50 (3Н, с), 1,54-1,70 (2Н, м), 1,90-2,15 (1Н, м), 2,18 (3Н, с), 2,38 (3Н, с), 2,51 (2Н, т), 3,38 (2Н, т), 3,53 (3Н, с), 3,83 (3Н, с), 3,95 (2Н, дд), 7,23 (2Н, дд), 7,45 (2Н, дд).
Пример 93
Метил 2-метил-цис-5-{4-[5-метил-2-(п-толил)тиазол-4-ил]бутил}-1,3-диоксан-r-2-карбоксилат
В 10 мл тетрагидрофурана растворяют 1,01 г метил цис-5-[5-ацетил-5-(п-толуоиламино)пентил]-2-метил-1,3-диоксан-r-2-карбоксилата. После добавления 1,42 г 2,4-бис(метилтио)-1,3-дитиа-2,4-дифосфофетан-2,4-дисульфида (метильный реагент Дэви) смесь перемешивают 3 часа при 50-55°С, а затем еще 3 часа при 70-75°С. К реакционному раствору добавляют этилацетат, последовательно промывают 10% хлористоводородной кислотой, водой и 10% гидроксидом натрия, сушат над сульфатом магния и концентрируют. Остаток очищают колоночной хроматографией на силикагеле (Wakogel (C-200, смесь н-гексан:этилацетат=5:1)) с получением 384 мг целевого соединения в виде светло-желтого масла.
1Н-ЯМР (CDCl3)δ: 1,00-1,15 (2Н, м), 1,23-1,40 (2Н, м), 1,51 (3Н, с), 1,60-1,77 (2Н, м), 1,92-2,14 (1Н, м), 2,37 (6Н, с), 2,66 (2Н, т), 3,39 (2Н, т), 3,83 (3Н, с), 3,95 (2Н, дд), 7,20 (2Н, д), 7,75 (2Н, д).
Экспериментальный пример 1
Действие на углеводный и липидный метаболизм у КК-Ау-мыши
Эксперимент проводили с использованием соединений, описанных в Примерах, в качестве тестируемых соединений, и троглитазона (5-[4-(6-гидрокси-2,5,7,8-тетраметилхроман-2-илметокси)бензил]-2,4-тиазолидиндиона) в качестве контрольного соединения.
Каждое тестируемое соединение при определенной дозе в течение 4 дней перорально вводили КК-Ау-мышам (10-недельным самцам), используемым в качестве модели ИНСД. На следующий день после последнего введения у мышей, не подвергаемых голоданию, из кровеносных сосудов кончика хвоста брали кровь для получения гепаринизированной плазмы. Затем, при анестезии пентобарбиталом, брали кровь из большой брюшной вены для получения сыворотки. Уровень глюкозы (УГ), уровень триглицеридов (УТ) и уровень инсулина (УИ) в плазме определяли с использованием теста на глюкозу, CII-теста Wako (Wako Pure Chemical Industries, Ltd), CLINTECH TG-S (IATORON LABORATORIES, INC.) или теста на триглицерид, Е-теста WAKO (Wako Pure Chemical Industries, Ltd), и набора для измерения уровня инсулина у крыс (Morinaga Biochemistry Research Institute) или Т-теста для определения уровня мышиного инсулина REBIS (Mouse Insulin ELISA (TMB) KIT, Shibayagi Co., Ltd), соответственно. Кроме того, сумма уровней ОЛНП-Х и уровней ЛНП-Х в сыворотке (обозначаемая далее «(О)ЛНП-Х»), уровень общего холестерина (ОХ) и уровень ЛВП-Х измеряли с использованием системы высокоэффективной жидкостной хроматографии для измерения холестерина липопротеина (TOSON CORPORATION). Поскольку уровни ОЛНП-Х и ЛНП-Х не могут быть измерены отдельно, то измеряют уровень (О)ЛНП-Х. Атерогенный индекс (АИ) вычисляли по следующей формуле:
АИ=[(уровень ОХ)-(уровень ЛВП-Х)]/(уровень ЛВП-Х)
Результаты представлены в таблице 1.
Действие на углеводный и липидный метаболизм у КК-Ау-мыши
Соединения настоящего изобретения обладают превосходным действием, снижающим уровень триглицеридов в крови, и действием, снижающим уровень (О)ЛНП-Х. Кроме того, соединения настоящего изобретения обладают действием, снижающим уровень глюкозы в крови, действием, снижающим уровень инсулина в крови, или действием, повышающим уровень ЛВП-Х, или действием, снижающим атерогенный индекс.Очевидно, что соединения настоящего изобретения могут быть использованы в качестве профилактического или терапевтического средства для лечения артериосклероза и т.п.
Пример получения фармацевтической композиции 1
Таблетка (для перорального введения)
Состав одной таблетки (200 мг)
Смесь, содержащая ингредиенты в указанном выше соотношении, спрессовывают и получают таблетки для перорального введения.
Пример получения фармацевтической композиции 2
Таблетка (для перорального введения)
Состав одной таблетки (120 мг)
Смесь, содержащая ингредиенты в указанном выше соотношении, спрессовывают и получают таблетки для перорального введения.
Пример получения фармацевтической композиции 3
Таблетка (для перорального введения)
Состав одной таблетки (180 мг)
Смесь, содержащая ингредиенты в указанном выше соотношении, спрессовывают и получают таблетки для перорального введения.
Промышленная применимость
Соединения настоящего изобретения обладают превосходным действием, снижающим уровень триглицеридов в крови; действием, снижающим уровень (О)ЛНП-Х в крови, а также действием, снижающим уровень глюкозы в крови, действием, снижающим уровень инсулина в крови, либо действием, повышающим уровень ЛВП-Х в крови, или действием, снижающим атерогенный индекс, и поэтому они могут быть использованы для предупреждения или лечения коронарной болезни сердца, церебрального инфаркта, гиперлипидемии, артериосклероза, сахарного диабета, гипертензии, ожирения и т.п.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ И ИХ МЕДИЦИНСКОЕ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2287529C2 |
| Способ получения разветвленных олигоарилсиланов на основе фенилоксазолов | 2016 |
|
RU2620088C1 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИЗОХИНОЛИНА И ИХ СОЛИ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2000 |
|
RU2256661C2 |
| ПРОИЗВОДНЫЕ 1,3-ДИОКСАНАЛКЕНОВОЙ КИСЛОТЫ | 1989 |
|
RU2045526C1 |
| ПРОИЗВОДНЫЕ ДИГИДРОПТЕРИДИНОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2010 |
|
RU2559881C2 |
| N, N', N'-ТРИЗАМЕЩЕННЫЕ ИЗОСЕЛЕНОМОЧЕВИНЫ | 2010 |
|
RU2434852C1 |
| ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2809631C2 |
| 1,3-ДИИОКСАНОНОВЫЕ ПРОИЗВОДНЫЕ АЛКЕНОВОЙ КИСЛОТЫ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМАЯ СОЛЬ | 1989 |
|
RU2040525C1 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛА АМИДНОГО ТИПА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ | 2001 |
|
RU2232761C2 |
| ПРОИЗВОДНЫЕ 1-ФЕНИЛ 2-ПИРИДИНИЛАЛКИЛОВЫХ СПИРТОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2012 |
|
RU2617401C2 |
Настоящее изобретение относится к профилактическому или терапевтическому средству против гиперлипидемии, содержащему в качестве активного ингредиента гетероциклическое соединение формулы [1] или его фармацевтически приемлемую соль:
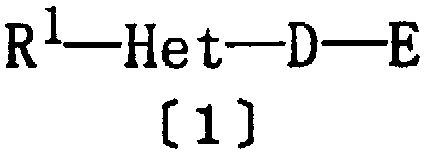
где: R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена; Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]:
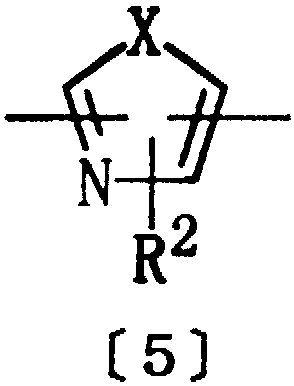
где Х представляет кислород, серу или NR6; R6 представляет водород или алкил; R2 представляет водород, алкил или тригалогеналкил; D представляет алкилен, алкенилен; и Е представляет группу формулы [3] или [4]:
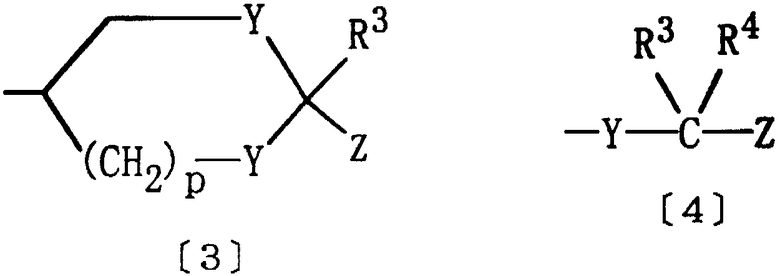
где Y представляет кислород или серу; R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил; р равно 1; Z представляет карбокси, алкоксикарбонил, циано или 1Н-5-тетразолил, а также к новым соединениям, принадлежащим к группе перечисленных выше гетероциклических соединений формулы [1], которые обладают действием, снижающим уровень триглицеридов в крови; действием, снижающим уровень холестерина липопротеинов низкой плотности (ЛНП-Х) в крови; действием, снижающим уровень глюкозы в крови, и действием, снижающим уровень инсулина в крови, либо действием, повышающим уровень ЛВП-Х в крови, или действием, снижающим атерогенный индекс, и поэтому они могут быть использованы для предупреждения или лечения гиперлипидемии, артериосклероза, ишемической болезни сердца, инфаркта головного мозга, реокклюзии после чрескожной внутрипросветной коронарной ангиопластики (ЧВКА), сахарного диабета и ожирения. 10 н. и 19 з. п. ф-лы, 1 табл.
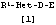
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]
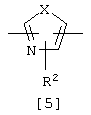
где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]
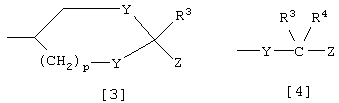
где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.

где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, а R2 представляет водород, алкил или тригалогеналкил.

где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R2 представляет водород, алкил или тригалогеналкил, a D представляет алкилен, алкенилен.
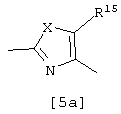
где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R15 представляет алкил или тригалогеналкил, и D представляет алкилен или алкенилен, имеющие 3-7 атомов углерода.
(1) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси]пропионовая кислота,
(2) цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(3) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионовая кислота,
(4) 2-изобутил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(5) 2-этил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(6) 2-метил-цис-5-{4-[5-метил-2-(4-трифторметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(7) 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-(Е)-3-бутенил]-1,3-диоксан-r-2-карбоновая кислота,
(8) цис-5-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоновая кислота,
(9) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропанол,
(10) 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионовая кислота,
(11) 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(12) 2-метил-цис-5-{4-[5-метил-2-(3-фтор-4-метилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(13) 2-метил-цис-5-{4-[5-метил-2-(м-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота и
(14) 2-метил-цис-5-{4-[5-метил-2-(3,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота.
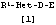
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.
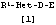
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.
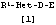
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.
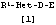
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где X представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.
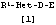
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.
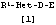
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.
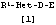
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемая соль, при условии, что исключается соединение формулы [1], где D представляет алкилен, имеющий 1-6 атома углерода, и Е представляет группу формулы [4], где Y представляет кислород.

где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, а R2 представляет водород, алкил или тригалогеналкил; или его фармацевтически приемлемая соль.

где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, R2 представляет водород, алкил или тригалогеналкил, D представляет алкилен, алкенилен, имеющие 3-10 атомов углерода; или его фармацевтически приемлемая соль.
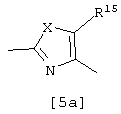
где Х представляет кислород, серу или NR6, R6 представляет водород или алкил, D представляет алкилен или алкенилен, имеющие 3-7 атомов углерода;
R15 представляет алкил или тригалогеналкил; или его фармацевтически приемлемая соль.
(1) цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(2) 2-изобутил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(3) 2-этил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)бутил]-1,3-диоксан-r-2-карбоновая кислота,
(4) 2-метил-цис-5-{4-[5-метил-2-(4-трифторметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(5) 2-метил-цис-5-[4-(5-метил-2-фенилоксазол-4-ил)-(Е)-3-бутенил]-1,3-диоксан-r-2-карбоновая кислота,
(6) цис-5-{4-[2-(4-трет-бутилфенил)-5-метилоксазол-4-ил]бутил}-2-метил-1,3-диоксан-r-2-карбоновая кислота,
(7) 2-метил-цис-5-{4-[5-метил-2-(п-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(8) 2-метил-цис-5-{4-[5-метил-2-(3-фтор-4-метилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота,
(9) 2-метил-цис-5-{4-[5-метил-2-(м-толил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота и
(10) 2-метил-цис-5-{4-[5-метил-2-(3,4-диметилфенил)оксазол-4-ил]бутил}-1,3-диоксан-r-2-карбоновая кислота или их фармацевтически приемлемая соль.
(1) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропионовая кислота,
(2) метил 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропионат,
(3) 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионовая кислота,
(4) метил 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил]гексилокси}пропионат,
(5) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионовая кислота,
(6) метил 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионат,
(7) 2-{6-[2-(4-хлорфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионовая кислота,
(8) метил 2-{6-[2-(4-хлорфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионат,
(9) 2-метил-2-{6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси}пропионовая кислота,
(10) метил 2-{6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси}-2-метилпропионат и
(11) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропанол или их фармацевтически приемлемая соль.
(1) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропионовая кислота,
(2) 2-метил-2-{6-[5-метил-2-(п-толил)оксазол-4-ил] гексилокси}пропионовая кислота,
(3) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)-4-гексинилокси]пропионовая кислота,
(4) 2-{6-[2-(4-хлорфенил)-5-метилоксазол-4-ил]гексилокси}-2-метилпропионовая кислота,
(5) 2-метил-2-{6-(5-метил-2-фенилоксазол-4-ил)-(Е)-4-гексенилокси}пропионовая кислота и
(6) 2-метил-2-[6-(5-метил-2-фенилоксазол-4-ил)гексилокси]пропанол или их фармацевтически приемлемая соль.
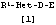
где R1 представляет арил, необязательно замещенный одинаковыми или различными одной-тремя группами, выбранными из алкила, галогеналкила, тригалогеналкила, алкокси, галогена;
Het представляет двухвалентную ароматическую гетероциклическую группу формулы [5]

где Х представляет кислород, серу или NR6;
R6 представляет водород или алкил;
R2 представляет водород, алкил, тригалогеналкил;
D представляет алкилен, алкенилен;
Е представляет группу формулы [3] или [4]

где Y представляет кислород или серу;
R3 и R4 являются одинаковыми или различными, и каждый представляет водород или алкил;
р равно 1;
Z представляет карбокси, алкоксикарбонил, циано, 1H-5-тетразолил;
или его фармацевтически приемлемую соль.
| EP 0 220 573 A1, 06.05.1987.WO 99/31056 A1, 24.06.1999.RU 2 079 497 C1, 20.05.1997. |
Авторы
Даты
2005-08-27—Публикация
2001-05-25—Подача