ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым пиразиновым соединениям, направленно воздействующим на аденозиновые рецепторы (особенно на А1 и А2, в частности, на А2а). Настоящее изобретение также относится к фармацевтическим композициям, содержащим одно или более соединений в качестве активного ингредиента, и применению этих соединений в лечении заболеваний, ассоциированных с аденозиновыми рецепторами (AR), например рака, такого как немелкоклеточный рак легкого (NSCLC), почечноклеточная карцинома (RCC), рак предстательной железы и рак молочной железы.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Аденозин является природным нуклеозидом, который вызывает разнообразные физиологические ответы в результате взаимодействия с семейством аденозиновых рецепторов. У людей различают четыре подтипа аденозиновых рецепторов (А1, А2а, A2b и A3) на основании их биохимических и фармакологических свойств, таких как характеристики связывания с лигандом, гликозилирование и функции.
Воспалительная реакция помогает выводить вредные агенты из организма, но воспаление также является неспецифической реакцией, которая может нанести вред здоровой ткани. Существует широкий спектр патогенных факторов, которые могут инициировать воспалительную реакцию, включая инфекцию, аллергены, аутоиммунные стимулы, иммунный ответ на трансплантированную ткань, вредные химические реагенты и токсины, ишемию/реперфузию, гипоксию, механическую и тепловую травму, а также рост опухолей.
Имеются сообщения о том, что аденозиновые рецепторы играют не избыточную роль в отрицательной регуляции воспаления in vivo, действуя как физиологический «СТОП» (механизм терминации), который может ограничивать иммунный ответ и тем самым защищать нормальные ткани от чрезмерного повреждения под действием иммунной системы во время патогенеза различных заболеваний. Показано, что аденозиновые рецепторы, такие как А2а, A2b и A3, подавляют иммунный ответ во время воспаления и защищают ткани от повреждения под действием иммунной системы. Ингибирование передачи сигнала с участием аденозинового рецептора можно использовать для усиления и пролонгации иммунного ответа. Аденозин подавляет длительное воспаление, действуя через аденозиновый рецептор А2а (Ohta et al., Nature, 2001, 414: 916-920). Аденозиновый рецептор A2b участвует в регуляции клеточного роста (см. Adenosine A2b Receptors as Therapeutic Targets, Drug Dev. Res., 45: 198; Feoktistov et al., Trends Pharmacol. Sci., 19: 148-153).
Ввиду этого, соединения, которые направленно воздействуют на аденозиновые рецепторы, необходимы в качестве фармакологических средств и представляют значительный интерес в качестве лекарственных средства для лечения заболеваний, ассоциированных с аденозиновыми рецепторами, таких как рак (например, NSCLC, RCC, рак предстательной железы или рак молочной железы), болезнь Паркинсона, эпилепсия, церебральная ишемия и инсульт, депрессия, когнитивная недостаточность, инфекция вирусом иммунодефицита человека (ВИЧ), вызванный дефицитом аденозиндезаминазы тяжелый комбинированный иммунодефицит (ADA-SCID), острая сердечная недостаточность (AHF) и хроническая сердечная недостаточность, хроническая обструктивная болезнь легких (COPD) или астма.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Согласно одному из аспектов настоящего изобретения предложены соединение, представленное формулой (I):

или его фармацевтически приемлемая соль, где X, кольцо А, кольцо В, W, V, Y, Rb R2, тип являются такими, как определено в данном описании.
Согласно одному из аспектов настоящего изобретения предложены соединение, представленное формулой (Ia):
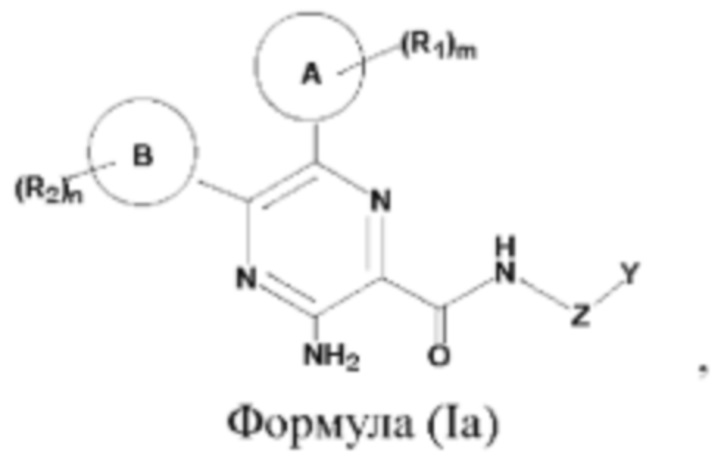
или его фармацевтически приемлемая соль, где кольцо А, кольцо В, Z, Y, R1, R2, тип являются такими, как определено в данном описании.
Согласно одному из аспектов настоящего изобретения предложены соединение, представленное формулой (Ia-i):
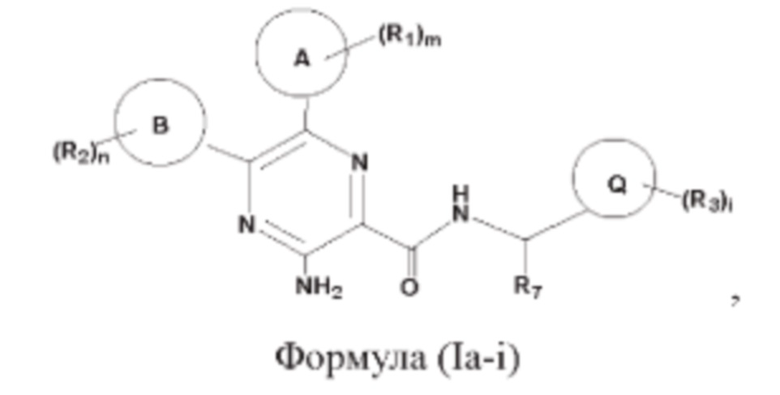
или его фармацевтически приемлемая соль, где кольцо А, кольцо В, кольцо Q, R1, R2, R3, R7, m, n и i являются такими, как определено в данном описании.
Согласно одному из аспектов настоящего изобретения предложены соединение, представленное формулой (Ia-ii):
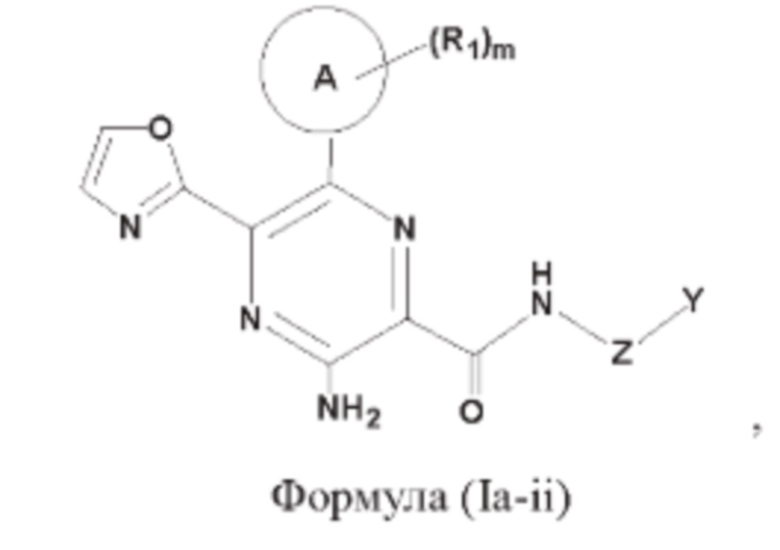
или его фармацевтически приемлемая соль, где кольцо A, Z, Y, R1 и m являются такими, как определено в данном описании.
Согласно одному из аспектов настоящего изобретения предложены соединение, представленное формулой (Ib):
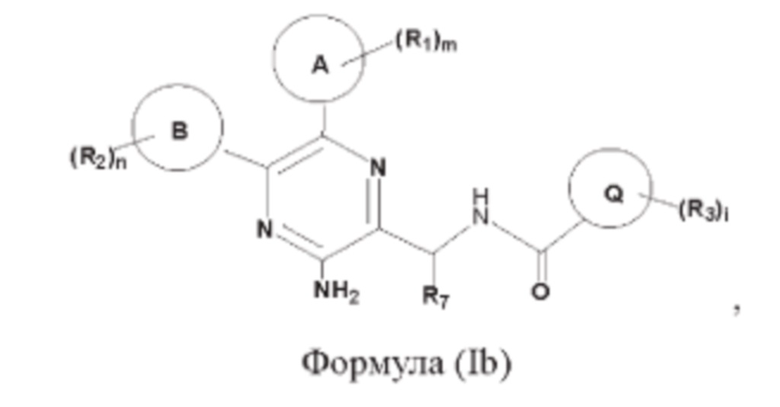
или его фармацевтически приемлемая соль, где кольцо А, кольцо В, кольцо Q, R1, R2, R3, R7, m, n и i являются такими, как определено в данном описании.
Согласно другому аспекту настоящее изобретение также относится к фармацевтическим композициям, содержащим одно или более чем одно соединение либо его фармацевтически приемлемую соль в качестве активного ингредиента, и применению таких соединений или их фармацевтически приемлемой соли в лечении ассоциированных с аденозиновыми рецепторами (AR) заболеваний, например рака, такого как NSCLC, RCC, рак предстательной железы или рак молочной железы.
ПОДРОБНОЕ ОПИСАНИЕ
Согласно одному из аспектов настоящего изобретения предложены соединения формулы (I):

или их фармацевтически приемлемая соль,
где
X выбран из амино, галогена, гидроксила, циано, С1-12алкоксила, N-(C1-12алкил)амино, N,N-(C1-12алкил)2амино, С1-12алканоиламино;
кольцо А представляет собой 3-12-членный насыщенный или ненасыщенный моно- или полициклический гетероциклил;
кольцо В выбрано из 3-12-членного насыщенного или ненасыщенного карбоциклила либо 3-12-членного насыщенного или ненасыщенного моно- или полициклического гетероциклила;
W представляет собой -С1-12алкилен- или -С(О)-, который может быть замещен однократно или независимо многократно гидроксилом, С1-12алкилом, С1-12алкоксилом или группой С1-12алкил-ОН;
V представляет собой -NH-, -КИ-С1-12алкилен-, -NH-C(O)- или N-присоединенный пирролидинил, который может быть замещен однократно или независимо многократно гидроксилом, С1-12алкилом, С1-12алкоксилом, группами N-(C1-12алкил)амино, N,N-(С1-12алкил)2амино или С1-12алкил-ОН;
Y представляет собой водород, галоген, гидроксил, циано, амино, карбамоил, мочевину, карбонил, карбамат, сульфонил, С1-12алкил, С1-12алкоксил, С1-12алканоил, С1-12алкил-ОН, С1-12алкил-циано, С1-12алогеналкил, С1-12алогеналкоксил, N-(C1-12алкил)амино, N,N-(C1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, С1-12алкилсульфонил, С1-12алканоиламино, 3-12-членный насыщенный или ненасыщенный карбоциклил либо 3-12-членный насыщенный или ненасыщенный гетероциклил, который возможно может быть замещен однократно или независимо многократно группой R3;
каждый R1 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(C1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, C1-12алканоиламино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R1 возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(C1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, С1-12алканоиламино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщеного или ненасыщенного гетероциклила, при этом каждый R2 возможно может быть дополнительно замещен однократно или независимо многократно группой R5;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, сульфонила, фосфата, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(C3-12циклоалкил)амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-12алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6,
при этом каждый R4, R5 или R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфинила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(C1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, С1-12алканоиламино, С1-12алкилсульфонил и С1-12галогеналкоксил;
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3 или 4.
В некоторых воплощениях X выбран из амино, N-(С1-12алкил)амино, N,N-(C1-12алкил)2амино или С1-12алканоиламино.
В некоторых воплощениях X представляет собой амино.
В некоторых воплощениях кольцо А представляет собой 3-12-членный насыщенный или ненасыщенный моно- или полициклический гетероциклил, имеющий 1, 2 или 3 гетероатома, выбранных из N, О или S.
В некоторых воплощениях кольцо А представляет собой 6-10-членный ненасыщенный моно- или полициклический гетероциклил.
В некоторых воплощениях кольцо А выбрано из
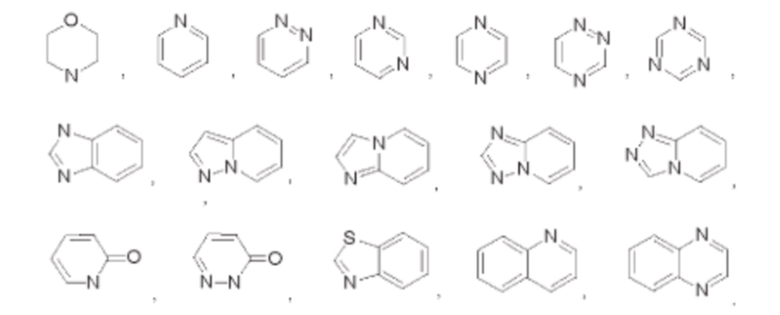
В некоторых воплощениях кольцо А выбрано из
В некоторых воплощениях каждый R1 независимо выбран из гидроксила, фтора, хлора, брома, амино, карбамоила, мочевины, карбамата, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метокси, этокси, трифторметокси, трифторэтокси, метиламино, диметиламино или этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила, оксетанила или 1,1-диоксотиетанила, который возможно может быть дополнительно замещен однократно или независимо многократно группой R4, при этом каждая R4 независимо выбрана из галогена, гидроксила, циано, амино, С1-12алкила, C1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила.
В некоторых воплощениях каждый R1 независимо выбран из амино, хлора, метила, дифторметила, трифторметила, аминометила, этила, гидроксиэтила, изопропила, гидроксипропила, метоксиэтила, 2-гидроксил-н-пропила, циклопропила и оксетанила.
В некоторых воплощениях m равно 0.
В некоторых воплощениях m равно 1.
В некоторых воплощениях m равно 2.
В некоторых воплощениях m равно 3.
В некоторых воплощениях m равно 4.
В некоторых воплощениях m равно 0, 1 или 2.
В некоторых воплощениях кольцо В представляет собой 3-12-членный насыщенный или ненасыщенный моно- либо полициклический гетероциклил, имеющий 1, 2 или 3 гетероатома, выбранных из N, О или S. В некоторых воплощениях кольцо В выбрано из:
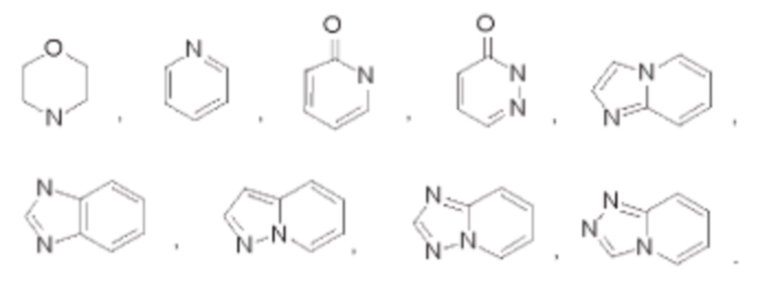
В некоторых воплощениях кольцо В выбрано из:
В некоторых воплощениях каждый R2 независимо выбран из галогена, гидроксила, амино, С1-12алкила или С1-12галогеналкила, при этом каждый R2 возможно может быть дополнительно замещен однократно или независимо многократно группой R5, выбранной из галогена, гидроксила, циано, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила.
В некоторых воплощениях каждый R2 независимо выбран из циано, фтора, хлора, брома, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, этоксила, метоксила, дифторметокси, трифторметокси, метиламино, диметиламино, этиламино, изопропаниламино, гидроксиметила или гидроксиэтила.
В некоторых воплощениях каждый R2 представляет собой независимо фтор или метил.
В некоторых воплощениях n равно 0.
В некоторых воплощениях n равно 1.
В некоторых воплощениях n равно 2.
В некоторых воплощениях n равно 3.
В некоторых воплощениях n равно 4.
В некоторых воплощениях n равно 0, 1 или 2.
В некоторых воплощениях W представляет собой метилен или -С(О)-.
В некоторых воплощениях, когда W представляет собой метилен, V представляет собой -NH-C(O)-; когда W представляет собой -С(О)-, V представляет собой -NH-, -NH-С1-12алкилен- или N-присоединенный пирролидинил, который может быть замещен однократно или независимо многократно гидроксилом, С1-12алкилом, С1-12алкоксилом или группой С1-12алкил-ОН.
В некоторых воплощениях Y представляет собой водород, гидроксил, амино, циано, карбонил, карбамоил, С1-12алкил, С1-12алкил-ОН, С1-12алкоксил, сульфонил, (С1-12алкил)сульфонил, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(C1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, 3-12-членный насыщенный или ненасыщенный карбоциклил либо 3-12-членный насыщенный или ненасыщенный гетероциклил, который возможно может быть замещен однократно или независимо многократно группой R3.
В некоторых воплощениях Y представляет собой 3-12-членный насыщенный или ненасыщенный карбоциклил либо 3-12-членный насыщенный или ненасыщенный гетероциклил, выбранный из:
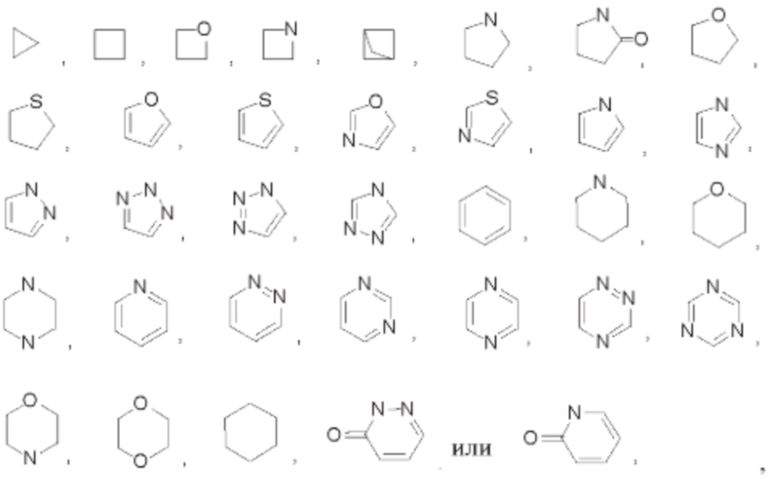
который возможно может быть замещен однократно или независимо многократно группой R3.
В некоторых воплощениях Y выбран из:
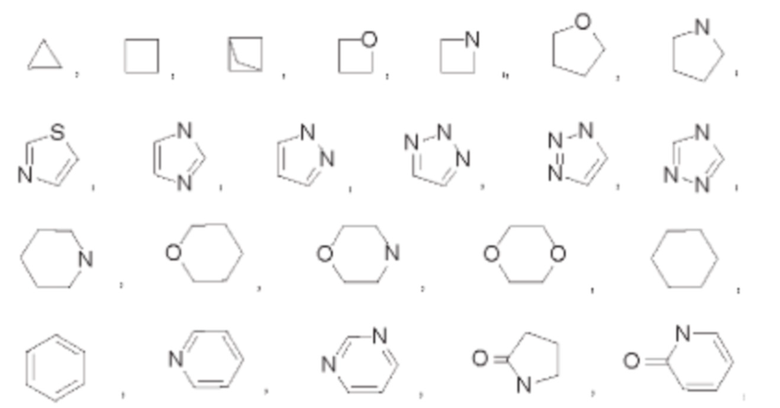
который возможно может быть замещен однократно или независимо многократно группой R3.
В некоторых воплощениях Y представляет собой водород, галоген, гидроксил, циано, амино, карбамоил, мочевину, карбамат, сульфонил, С1-12алкил, С1-12алкоксил, С1-12алканоил, С1-12алкил-ОН, С1-12алкил-циано, С1-12галогеналкил, С1-12галогеналкоксил, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алкилсульфонил, который возможно может быть замещен однократно или независимо многократно группой R3.
В некоторых воплощениях каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, сульфонила, фосфата, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, М-(С1-12алкил)амино, N,N-(C1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, C1-12алканоиламино, Н-(С1-12алкил-ОН)амино, С1-12галогеналкоксил, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6. В некоторых воплощениях каждый R3 независимо выбран из
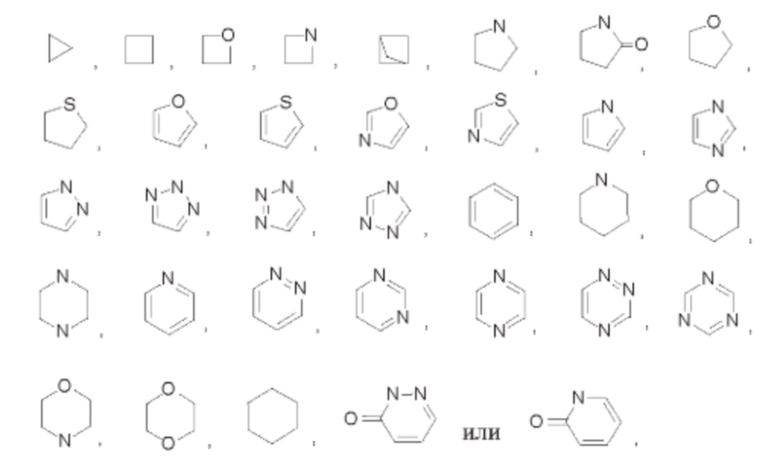
который возможно может быть дополнительно замещен однократно или независимо многократно группой R6.
В некоторых воплощениях каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(C1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)гкарбамоил, С1-12алканоиламино, С1-12алкилсульфонил, С1-12галогеналкоксил или С1-12алкил-замещенный циклоалкил.
В некоторых воплощениях каждый R3 независимо выбран из: гидроксила, амино, циано, карбамоила, сульфонила, фосфорила, фосфинила, фтора, хлора, брома, метила, этила, н-пропила, изопропила, метоксила, этоксила, этиламино, гидроксиэтила, гидроксиметила, гидроксиэтоксила, сульфонилметила, аминометила, циклопропила, циклопропилкарбонила, циклобутиламино, циклопропила, циклобутанила, циклогексила, пиранила, фуранила, фенила, пиридинила, пиразинила, пиперазинила, морфолинила, азетидинила, пирролидинила, пиперидинила, 1,4-оксанила, бицикл о [1.1.1]пентанила, 1,6-диазаспиро[3.3]гептанила, 2,6-диазаспиро[3.3]гептанила, 2,6-диазаспиро[3.4]октанила, 3,6-диазабицикло[3.1.1]гептанила, 2,5-диазабицикло[2.2.1]гептанила и 3,8-диазабицикло[3.2.1]октанила, которые возможно могут быть дополнительно замещены однократно или независимо многократно фтором, гидроксилом, метоксилом, этоксилом, амино, метиламино, диметиламино, сульфонилом, метилсульфонилом, карбамоилом, N-метилкарбамоилом, N,N-диметилкарбамоилом, гидроксиметилом, гидроксиэтилом, циклопропилом, циклопропанкарбонилом.
В некоторых воплощениях каждый R3 независимо выбран из: гидроксила, циано, фтора, хлора, брома, метила, фторметила, дифторметила, трифторметила, метоксила, дифторметоксила, трифторметоксила, амино, метиламино, диметиламино, гидроксиэтокси, метиламиноэтоксила, диметиламиноэтоксила, гидроксиэтиламино, аминокарбонилметоксила, 2-гидроксил-этила, метоксиметила, метилсульфонила, метил сульфонил метил а, N-метилкарбамоила, N,N-диметилкарбамоила, диметиламинометила, гидроксиметила, диметилфосфорила, метиламинокарбонила, метиламинокарбонилметила, диметиламинокарбонила, диметиламинокарбонилметила, 2-метоксил-этила, гидроксилэтоксила, метиламиноэтоксила, циклопропила, циклопропилкарбонила, 3-(диметиламино)циклобутиламино, фенила, пиридин-2-ила, азетидин-1-ила, пирролидин-1-ила, N-морфолинила, 3-(диметиламино)азетидин-1-ила, 4-метил пиперазин-1-ила, 1,6-диазаспиро[3.3]гептан-6-ила, 3-метил-1,6-диазаспиро[3.3]гептан-6-ила, 3,8-диазабицикло[3.2.1]октан-8-ила, 8-метил-3,8-диазабицикло [3.2.1]октан-8-ила, 3,8-диазабицикло [3.2.1]октан-3-ила, 8-метил-3,8-диазабицикло[3.2.1]октан-3-ила, 3,6-диазабицикло[3.1.1]гептан-6-ила, 3-метил-3,6-диазабицикло[3.1.1]гептан-6-ила, 2,6-диазаспиро[3.4]октан-2-ила, 6-метил-2,6-диазаспиро[3.4]октан-2-ила, пиперидинила, пиперазин-1-ила, 1-метилпиперидин-4-ила, 3-(диметиламино)пирролидина, 3-(диметиламинометил)азетидин-1-ила, 2,5-диазабицикло[2.2.1]гептан-2-ила, 5-метил-2,5-диазабицикло[2.2.1]гептан-2-ила, 2,6-диазаспиро[3.3]гептан-2-ила или 3,4-диметилпиперазин-1-ила.
В некоторых воплощениях Y представляет собой водород, гидроксил, амино, циано, карбонил, карбамоил, метил, этил, пропил, изопропил, гидроксиметил, гидроксиэтил, гидроксипропил, метоксил, этоксил, сульфонил, метиламино, диметиламино, метилкарбамоил, диметилкарбамоил, 3-12-членный насыщенный или ненасыщенный карбоциклил либо 3-12-членный насыщенный или ненасыщенный гетероциклил, который возможно может быть замещен однократно или независимо многократно группой R3, при этом каждая R3 независимо выбрана из гидроксила, метила, фтора, циано, диметиламино, диметилкарбамоила, гидроксиэтила. гидроксиметила, метоксила, трифторметила, трифторметоксила, метилсульфонила, диметиламино, метоксиметила, метилкарбамоила, фенила, пиридинила, циклопропила.
В некоторых воплощениях Y представляет собой водород, гидроксил, циано, карбамоил, метил, метоксил, метоксиметил, 1-метокси-этил, 2-метокси-этил, трифторметоксил, трифторметоксиметил, трифторметоксиэтил, 1-гидроксил-этил, 2-гидроксил-этил, метоксиметил, метоксиэтил, метиламино, диметиламино, метил сульфонил, метилсульфонилметил, метилсульфонилэтил, метилкарбамоил, диметилкарбамоил, диметиламинометил или пиперидин-1-ил-карбонил.
Согласно другому аспекту настоящего изобретения предложены соединения формулы (Ia):
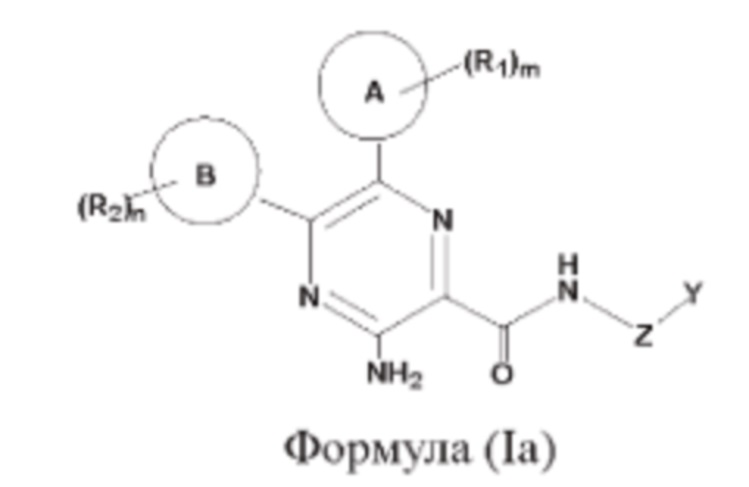
или их фармацевтически приемлемая соль, где
кольцо А представляет собой 6-10-членный насыщенный или ненасыщенный моно- либо полициклический гетероциклил, имеющий 1, 2 или 3 гетероатома, выбранных из N, О или S;
кольцо В представляет собой 5-6-членный насыщенный или ненасыщенный карбоциклил либо 5-6-членный насыщенный или ненасыщенный гетероциклил;
Z представляет собой -С1-12алкилен- или связь;
Y представляет собой водород, амино, карбамоил, карбонил, сульфонил, С1-12алкил, С1-12алкоксил, С1-12алкил-ОН, С1-12алкил-циано, С1-12галогеналкил, С1-12галогеналкоксил, N-(C1-12амино)2амино, N,N-(С1-12алкил)2амино, N-(C1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, С1-12алкилсульфонил, С1-12алканоиламино, 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил, который возможно может быть замещен однократно или независимо многократно группой R3;
каждый R1 независимо выбран из гидроксила, фтора, хлора, брома, амино, карбамоила, мочевины, карбамата, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метокси, этокси, трифторметокси, трифторэтокси, метиламино, диметиламино или этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила, оксетанила или 1,1-диоксотиетанила, который возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 представляет собой независимо галоген, гидроксил, амино, С1-12алкил или С1-12галогеналкил, при этом каждый R2 возможно может быть дополнительно замещен однократно или независимо многократно группой R5;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, сульфонила, фосфата, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(C1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-12алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклиал либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R5 независимо выбран из галогена, гидроксила, циано, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино, С1-12алкилсульфонил, С1-12галогеналкоксил или С1-12алкил-замещенный циклоалкил;
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3 или 4.
В некоторых воплощениях Z представляет собой связь, Y представляет собой циклобутил, монозамещенный С1-12алкоксилом, возможно метоксилом.
В некоторых воплощениях Z представляет собой этилен, Y представляет собой метоксил.
Согласно другому аспекту настоящего изобретения предложены соединения формулы (Ia-i):
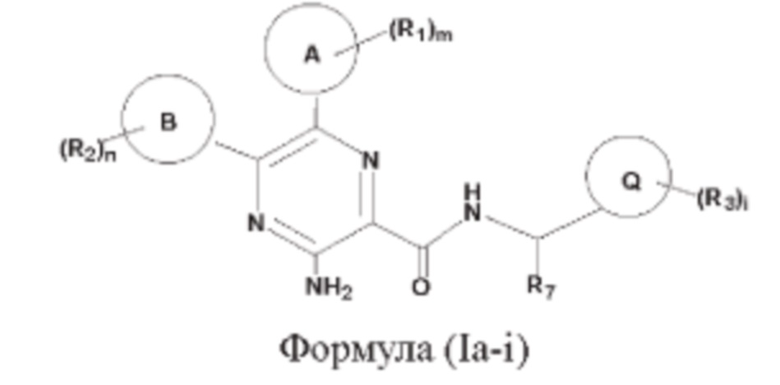
или их фармацевтически приемлемая соль, где
кольцо А представляет собой 6-10-членный насыщенный или ненасыщенный моно- или полициклический гетероциклил, имеющий 1, 2 или 3 гетероатома, выбранных из N, О или S;
кольцо В представляет собой 5-6-членный насыщенный или ненасыщенный карбоциклил либо 5-6-членный насыщенный или ненасыщенный гетероциклил;
кольцо Q представляет собой 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил;
каждый R1 независимо выбран из гидроксила, фтора, хлора, брома, амино, карбамоила, мочевины, карбамата, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метокси, этокси, трифторметокси, трифторэтокси, метиламино, диметиламино или этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила. оксетанила или 1,1-диоксотиетанила, который возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 представляет собой независимо галоген, гидроксил, амино, С1-12алкил или С1-12галогеналкил, при этом каждый R2 возможно может быть дополнительно замещен однократно или независимо многократно группой R5;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, сульфонила, фосфата, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(C1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(C1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (C1-12алкил)фосфинил, (C1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(C1-12алкил)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R5 независимо выбран из галогена, гидроксила, циано, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино, С1-12алкилсульфонил, С1-12галогеналкоксил или С1-12алкил-замещенный циклоалкил;
R7 представляет собой водород, С1-12алкил, С1-12алкоксил или С1-12алкил-ОН;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3 или 4; и
i равно 0, 1, 2, 3 или 4.
В некоторых воплощениях R7 представляет собой водород, метил или этил.
В некоторых воплощениях кольцо Q выбрано из:
В некоторых воплощениях i равно 0.
В некоторых воплощениях i равно 1.
В некоторых воплощениях i равно 2.
В некоторых воплощениях i равно 3.
В некоторых воплощениях i равно 4.
В некоторых воплощениях i равно 0, 1, 2 или 3.
Согласно еще одному аспекту настоящего изобретения предложены соединения формулы (Ia-ii):
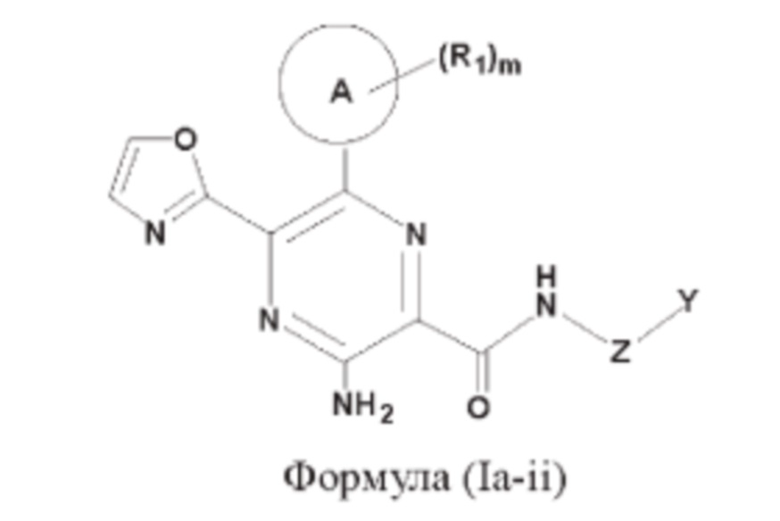
или их фармацевтически приемлемая соль, где
кольцо А представляет собой 6-10-членный насыщенный или ненасыщенный моно- либо полициклический гетероциклил, имеющий 1, 2 или 3 гетероатома, выбранных из N, О или S;
Z представляет собой -С1-12алкилен- или связь;
Y представляет собой водород, С1-12алкил, С1-12алкоксил, С1-12алкил-ОН, 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил, который возможно может быть замещен однократно или независимо многократно группой R3;
каждый R1 независимо выбран из гидроксила, фтора, хлора, брома, амино, карбамоила, мочевины, карбамата, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метокси, этокси, трифторметокси, трифторэтокси, метиламино, диметиламино или этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила, оксетанила или 1,1-диоксотиетанила, который возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, сульфонила, фосфата, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(C1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-2алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино, С1-12алкилсульфонил, С1-12галогеналкоксил или С1-12алкил-замещенный циклоалкил; и
m равно 0, 1, 2, 3 или 4.
В некоторых воплощениях кольцо А представляет собой пиридонил или азаиндолизинил.
В некоторых воплощениях m равно 1, и R1 представляет собой С1-12алкил, возможно С1-12алкил, возможно метил.
В некоторых воплощениях Z представляет собой связь, Y представляет собой циклобутил, монозамещенный метоксилом.
В некоторых воплощениях Z представляет собой этилен, Y представляет собой метоксил.
В некоторых воплощениях Z представляет собой метилен, Y представляет собой фенил, пирролидил или тетрагидрофурил, каждый из которых возможно может быть замещен однократно или независимо многократно группой R3.
В некоторых воплощениях R3 представляет собой галоген или С1-12алкил.
В некоторых воплощениях R3 представляет собой фтор или метил.
Согласно другому аспекту настоящего изобретения предложены соединения формулы (Ib):
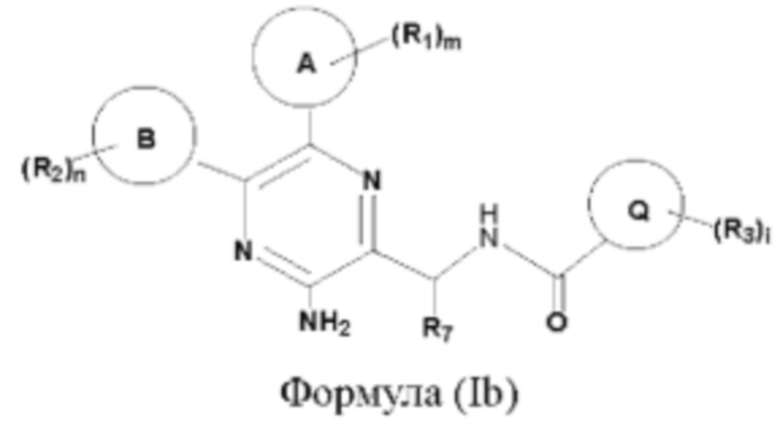
или их фармацевтически приемлемая соль,
где
кольцо А представляет собой 6-10-членный насыщенный или ненасыщенный моно- либо полициклический гетероциклил, имеющий 1, 2 или 3 гетероатома, выбранных из N, О или S;
кольцо В представляет собой 5-6-членный насыщенный или ненасыщенный карбоциклил либо 5-6-членный насыщенный или ненасыщенный гетероциклил;
кольцо Q представляет собой 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил;
R7 представляет собой водород, С1-12алкил, С1-12алкоксил или С1-12алкил-ОН;
каждый R1 независимо выбран из гидроксила, фтора, хлора, брома, амино, карбамоила, мочевины, карбамата, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метокси, этокси, трифторметокси, трифторэтокси, метиламино, диметиламино или этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила, оксетанила или 1,1-диоксотиетанила, который возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 представляет собой независимо галоген, гидроксил, амино, С1-12алкил или С1-12галогеналкил, при этом каждый R2 возможно может быть дополнительно замещен однократно или независимо многократно группой R5;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, мочевины, карбамата, сульфонила, фосфата, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(C3-12циклоалкил)амино, N-(C1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (C1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(C1-12алкилОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R5 независимо выбран из галогена, гидроксила, циано, С1-12алкила, С1-12галогеналкила, С1-12алкокси или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, мочевины, карбамата, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино, С1-12алкилсульфонил, С1-12галогеналкоксил или С1-12алкил-замещенный циклоалкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3 или 4; и
i равно 0, 1, 2, 3 или 4.
В некоторых воплощениях кольцо А выбрано из
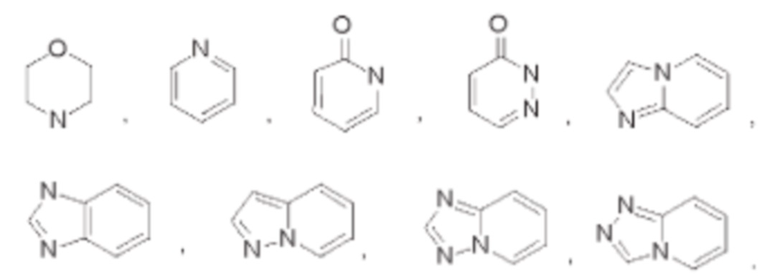
В некоторых воплощениях каждый R1 независимо выбран из фтора, хлора, амино, метила, этила, изопропила, фторметила, дифторметила, трифторметила, гидроксиэтил, гидроксипропила, метоксиэтила, 2-гидроксипропила, циклопропила или оксетанила.
В некоторых воплощениях m равно 0, 1 или 2. В некоторых воплощениях кольцо В выбрано из:
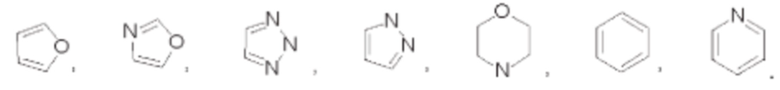
В некоторых воплощениях R2 представляет собой метил или фтор.
В некоторых воплощениях n равно 0 или 1.
В некоторых воплощениях кольцо Q выбрано из:
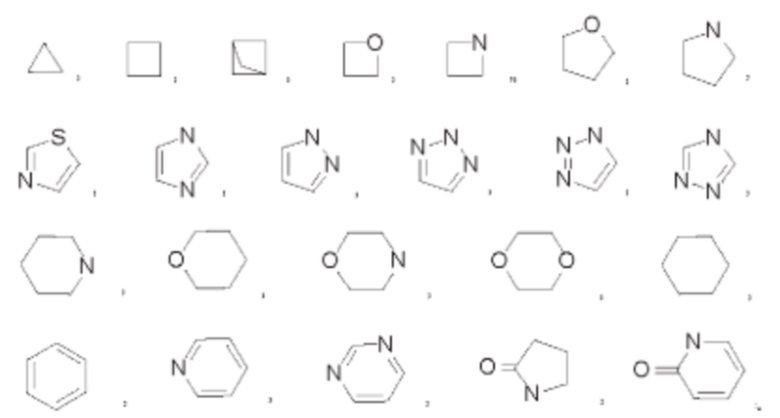
В некоторых воплощениях каждый R3 независимо выбран из фтора, хлора, брома, циано, метила, этила, фторметила, дифторметила, трифторметила, метоксила, этоксила, дифторметоксила, трифторметоксила, трифторэтоксила, гидроксиметила, гидроксиэтила, гидроксиэтилоксила, метоксиэтилоксила, амино, метиламино, диметиламино, этиламино, изопропиламино, гидроксиэтиламино, метиламиноэтилокеила, диметиламиноэтилоксила, диметилфосфинил-метила, карбамоила, карбамоилметоксила, азетидинила, пирролидила, морфолинила, пиразинила, диметиламино азетидинила, 1-метил-пиразин-4-ила, 3-метил-3,8-диаза-бицикло[3.2.1]октан-8-ила, 3-метил-3,6-диаза-бицикло[3.1.1]гептанила, 8-метил-3,8-диаза-бицикло[3.2.1]октан-3-ила, 6-метил-2,6-диаза-спиро[3.4]октан-2-ила или 5-метил-2,5-диаза-спиро[3.3]-гептан-2-ила.
В некоторых воплощениях i равно 0, 1, 2 или 3.
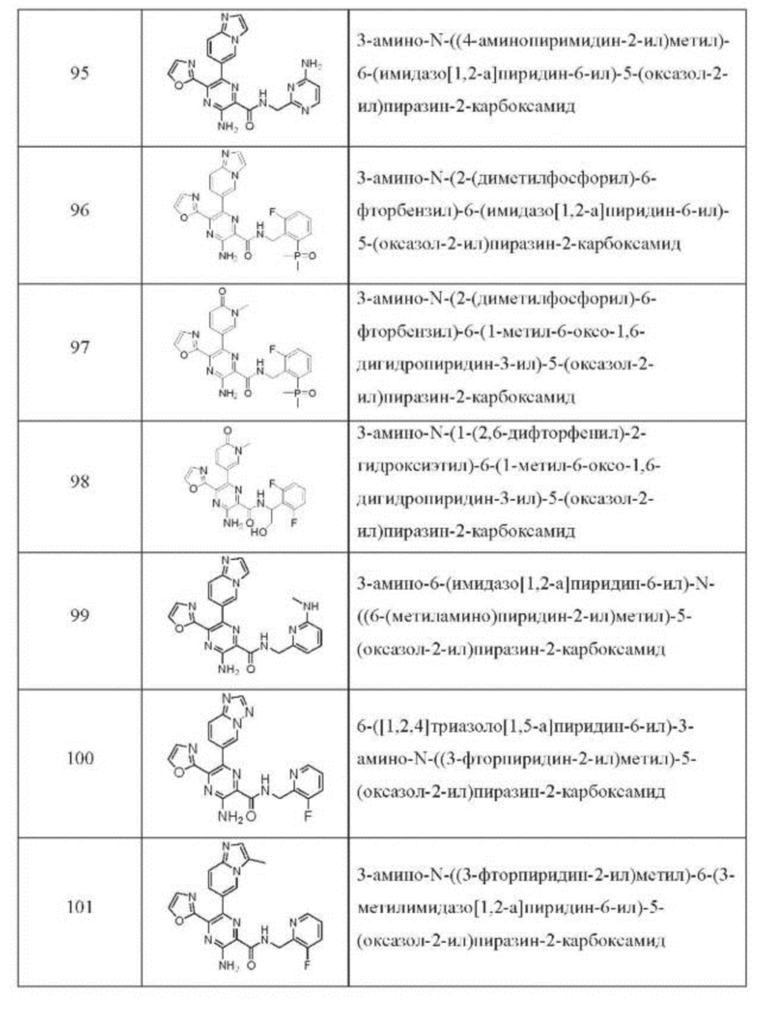
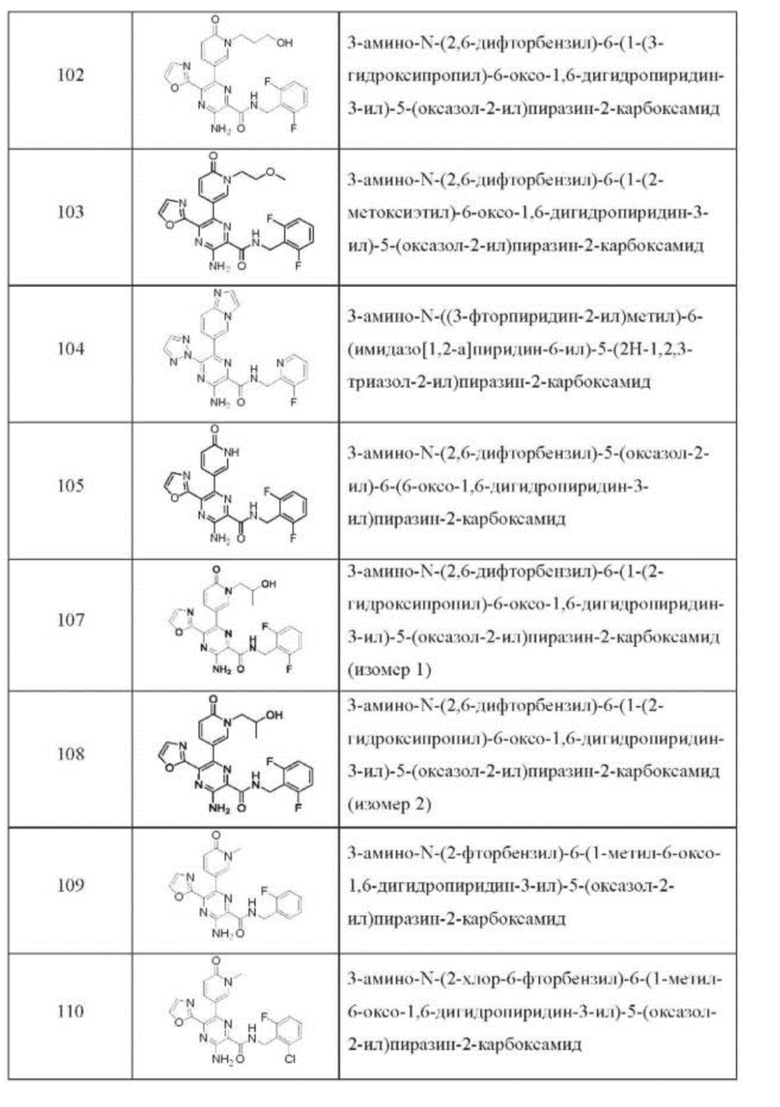
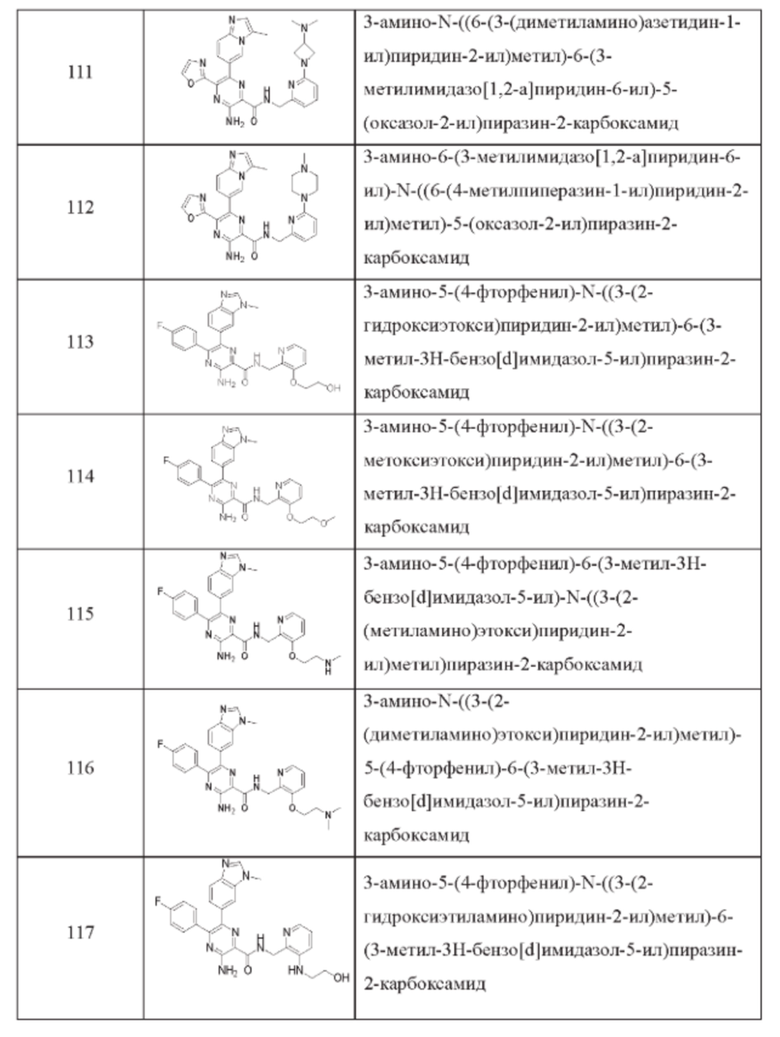
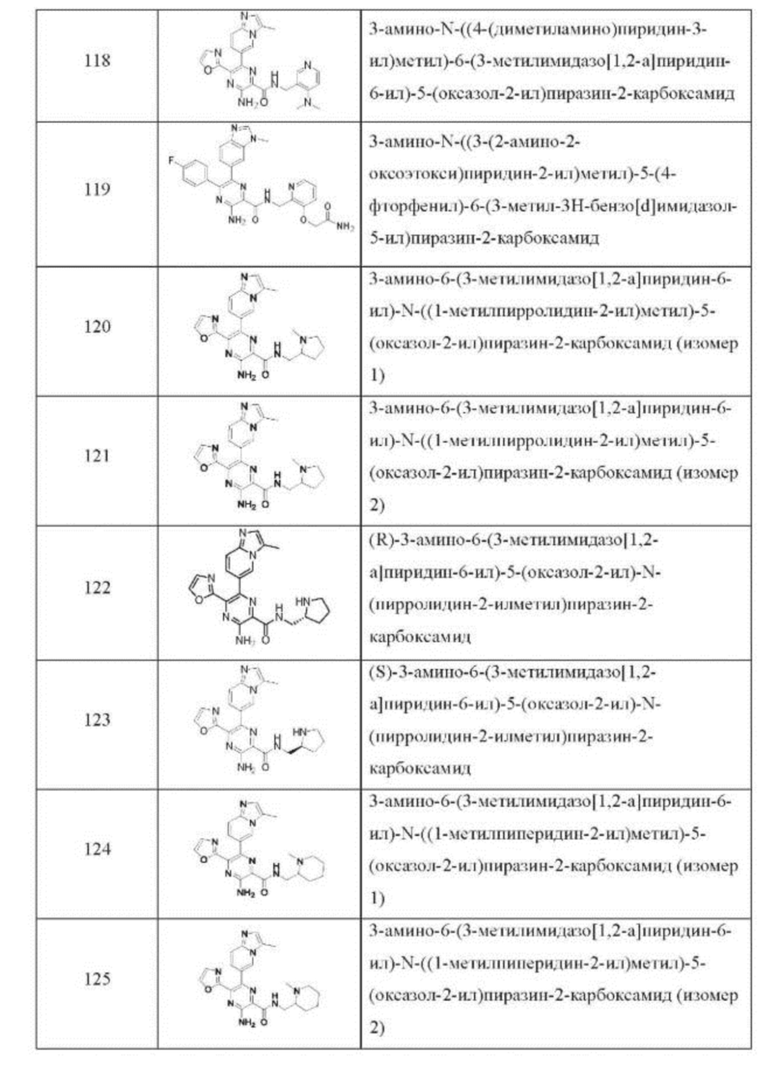
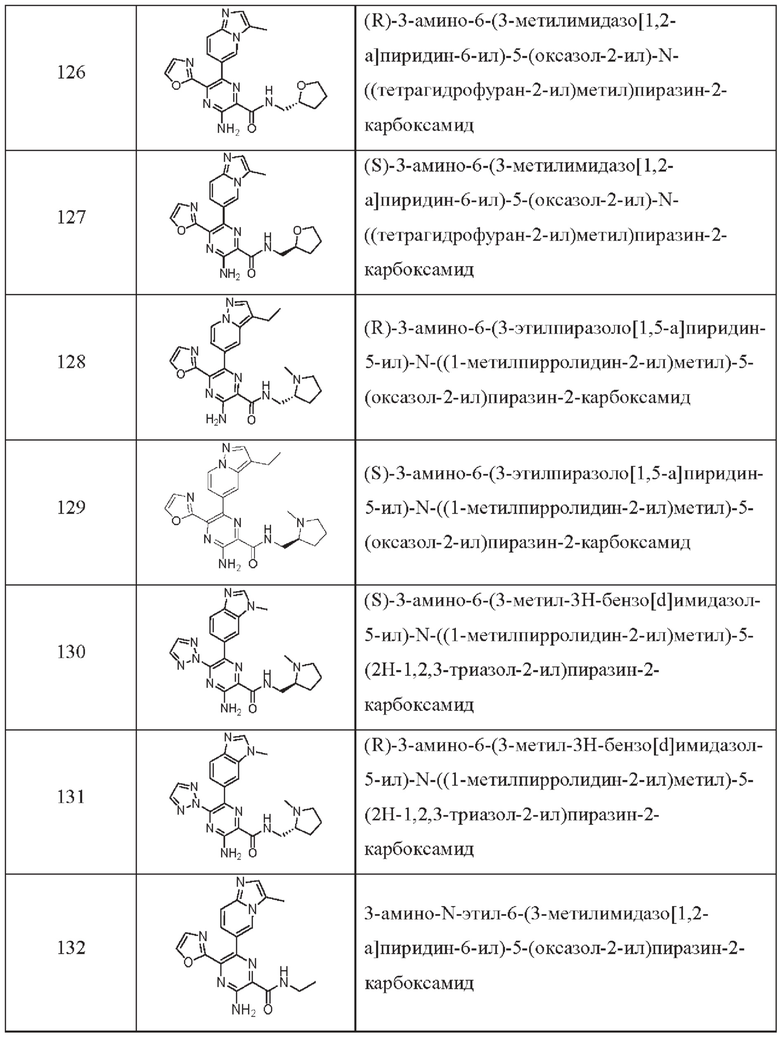
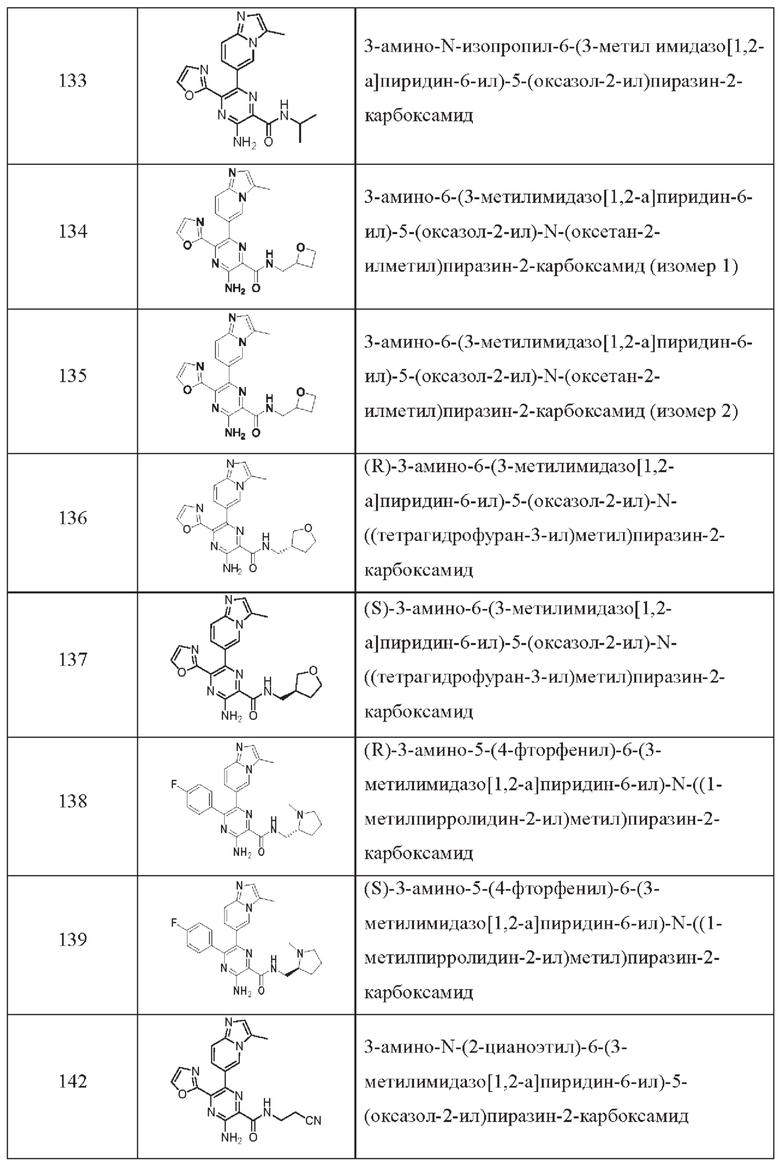
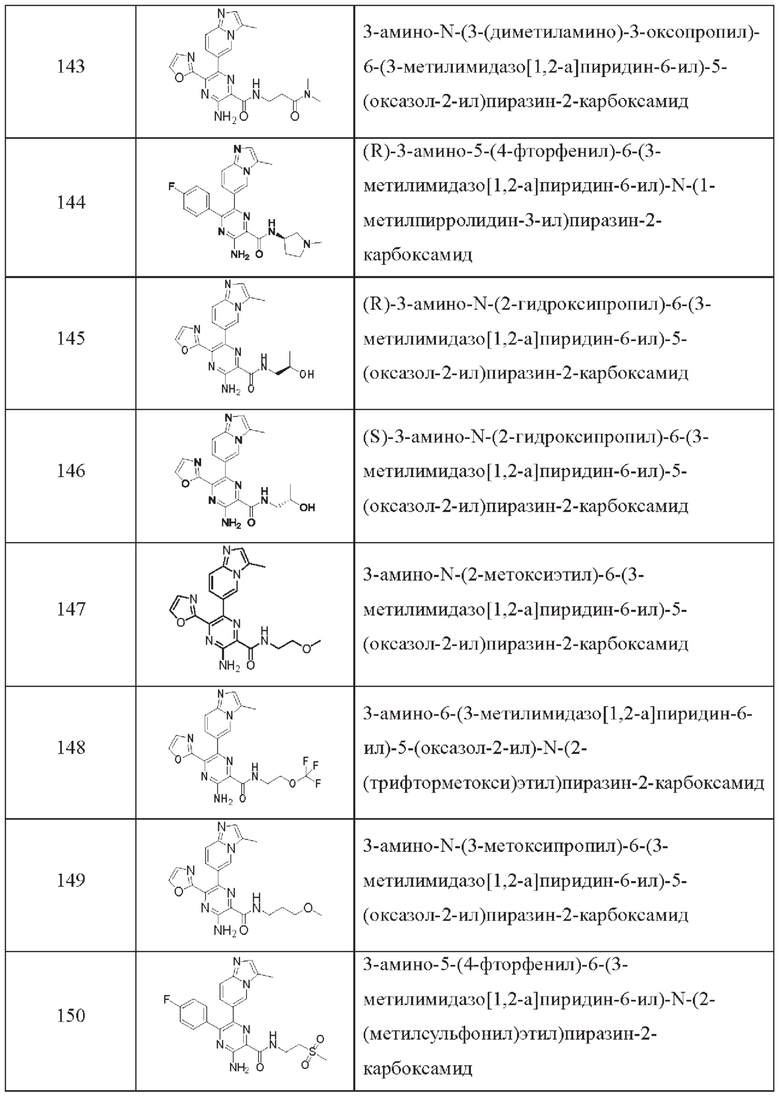
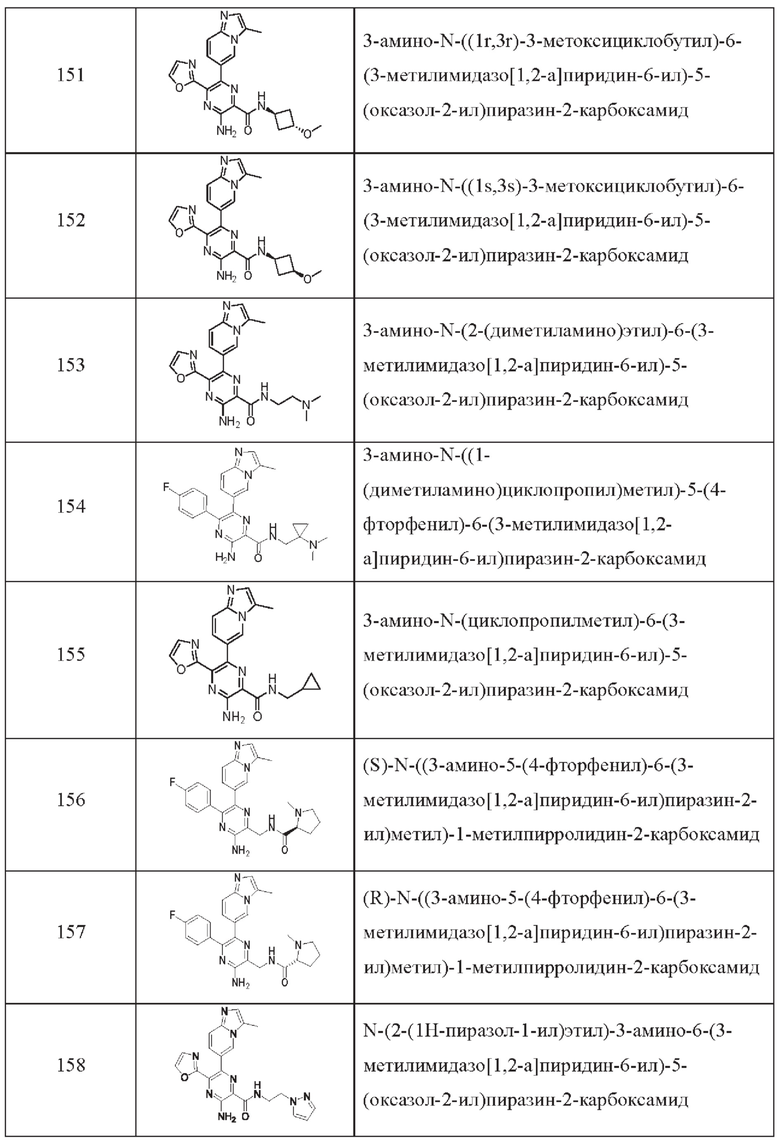
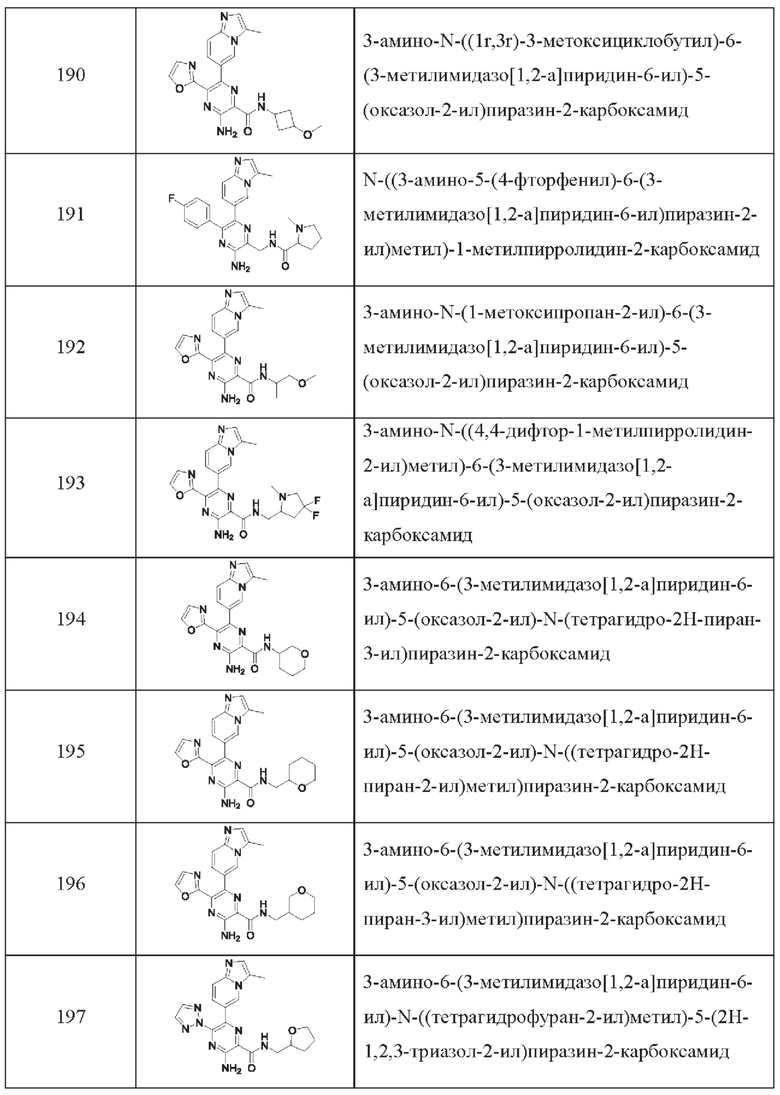
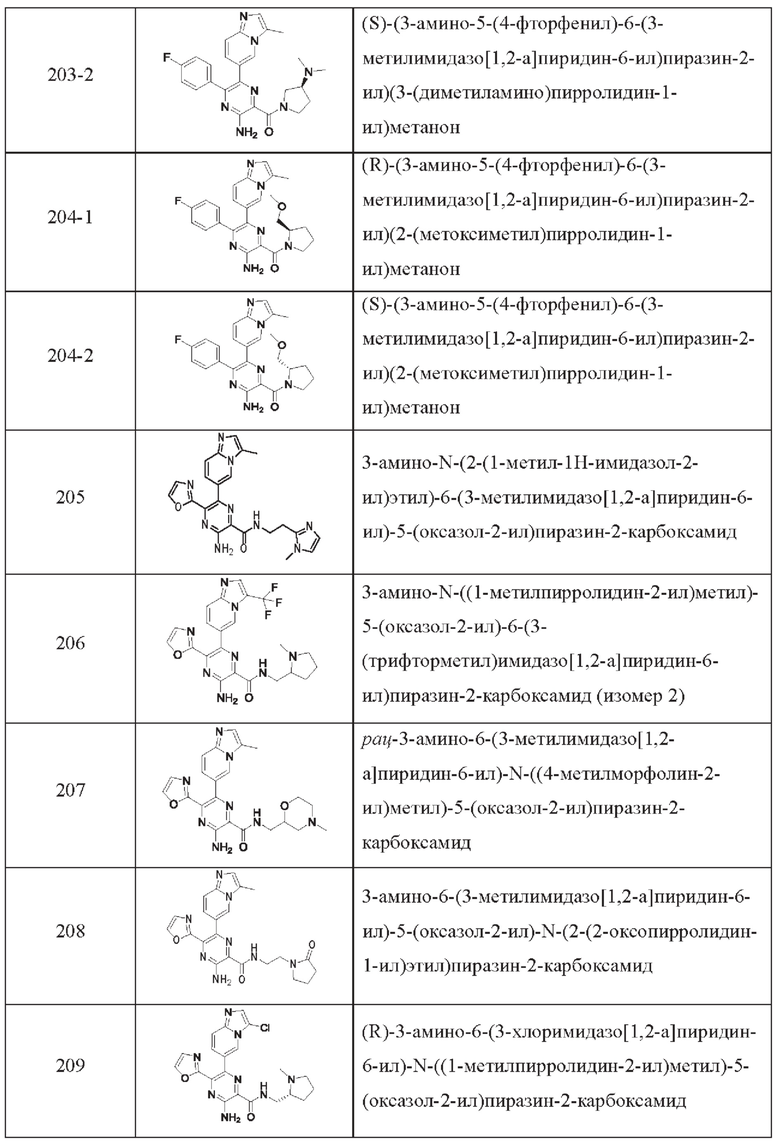
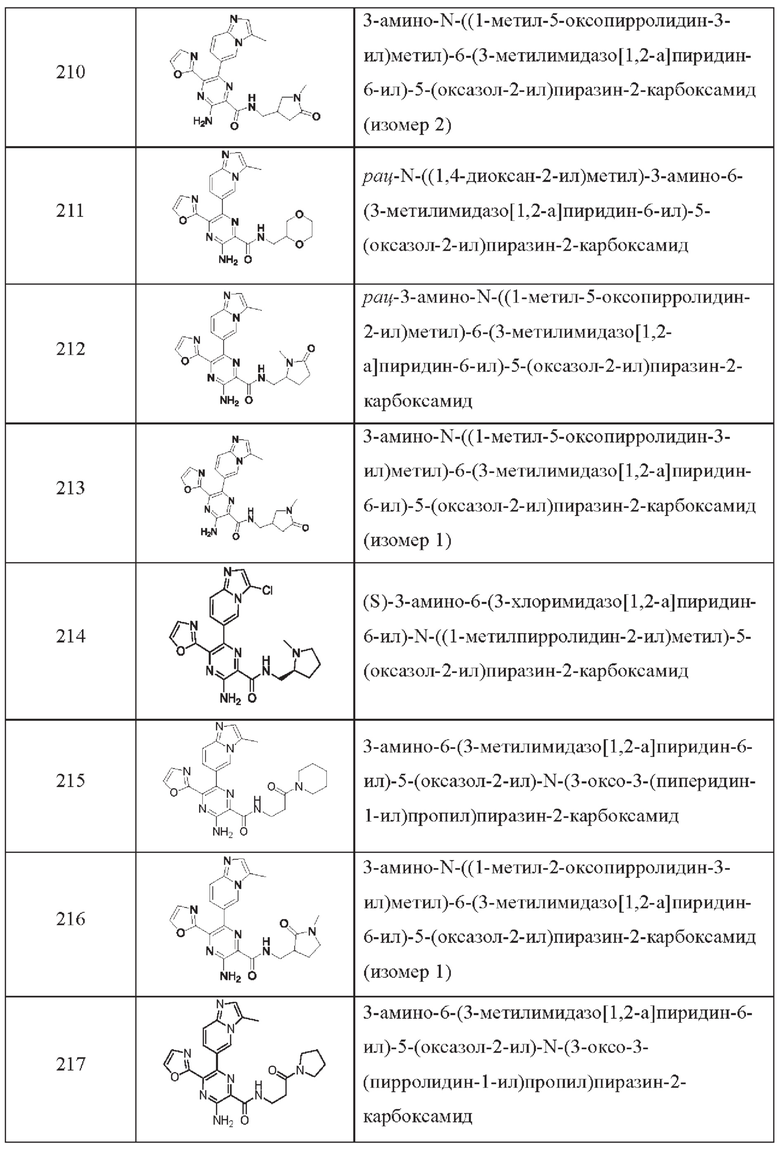
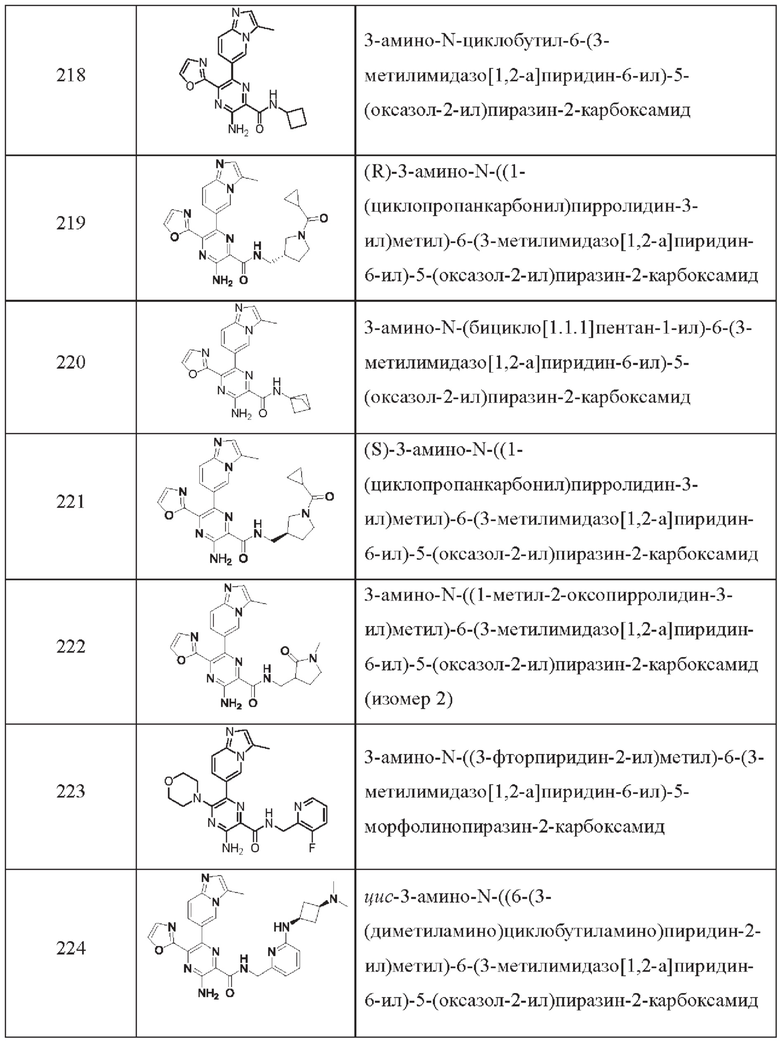
Согласно одному из аспектов настоящего изобретения предложено соединение формулы (I), выбранное из типичных соединений 1-306, приведенных ниже в Таблице 1.
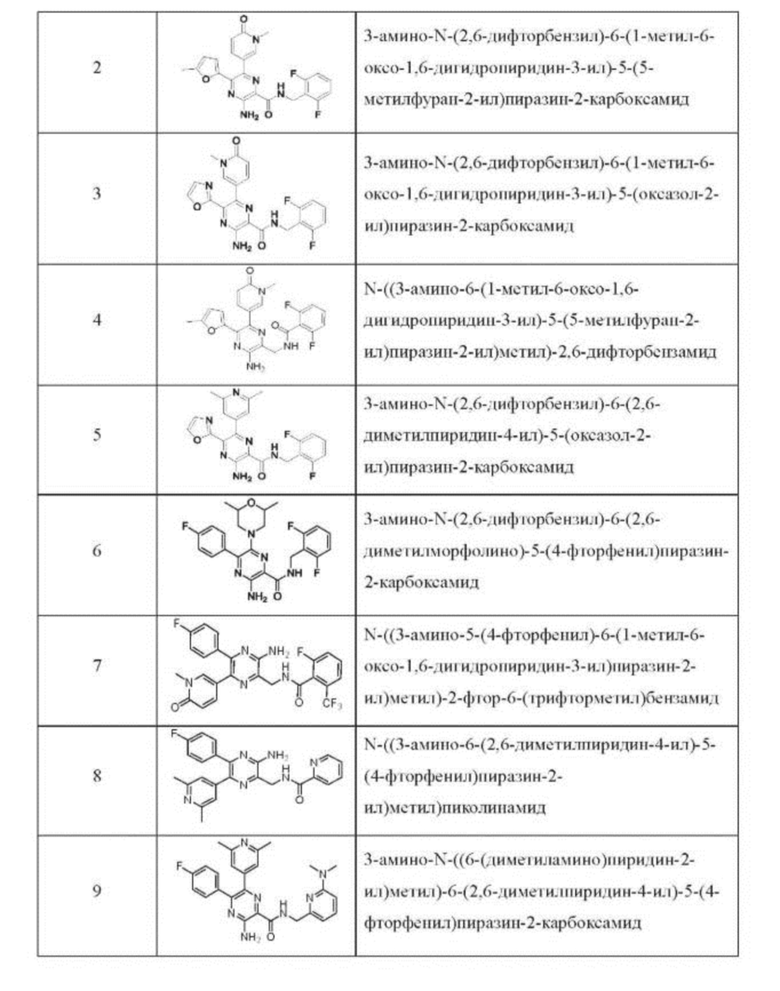
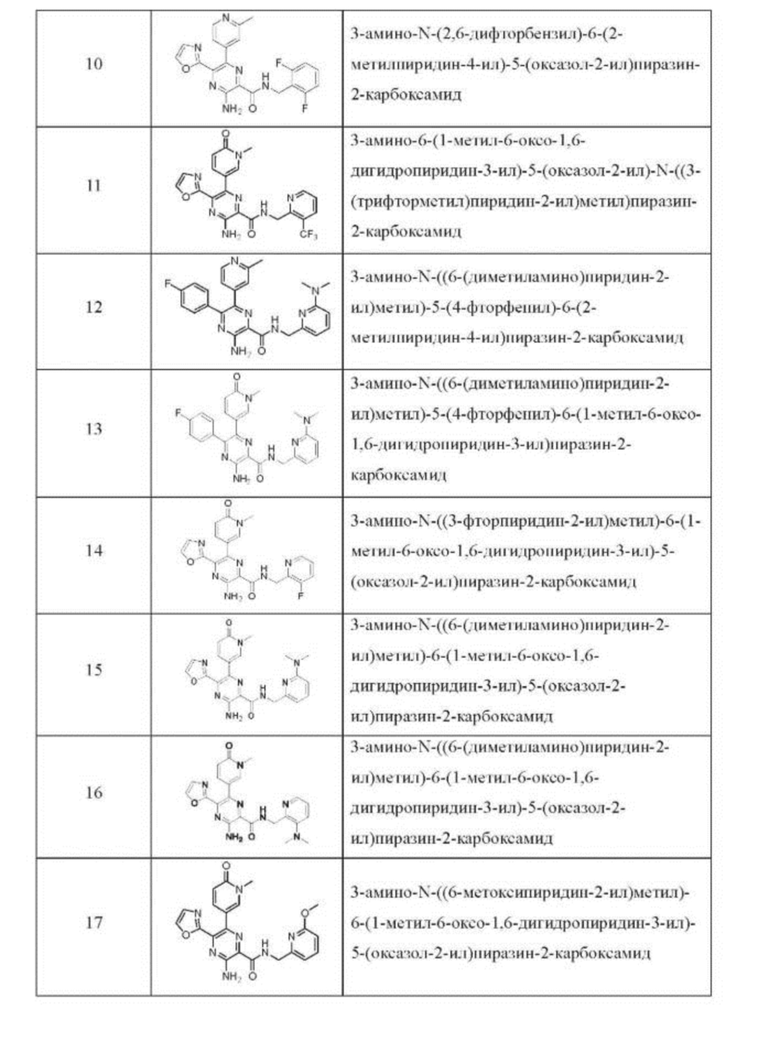
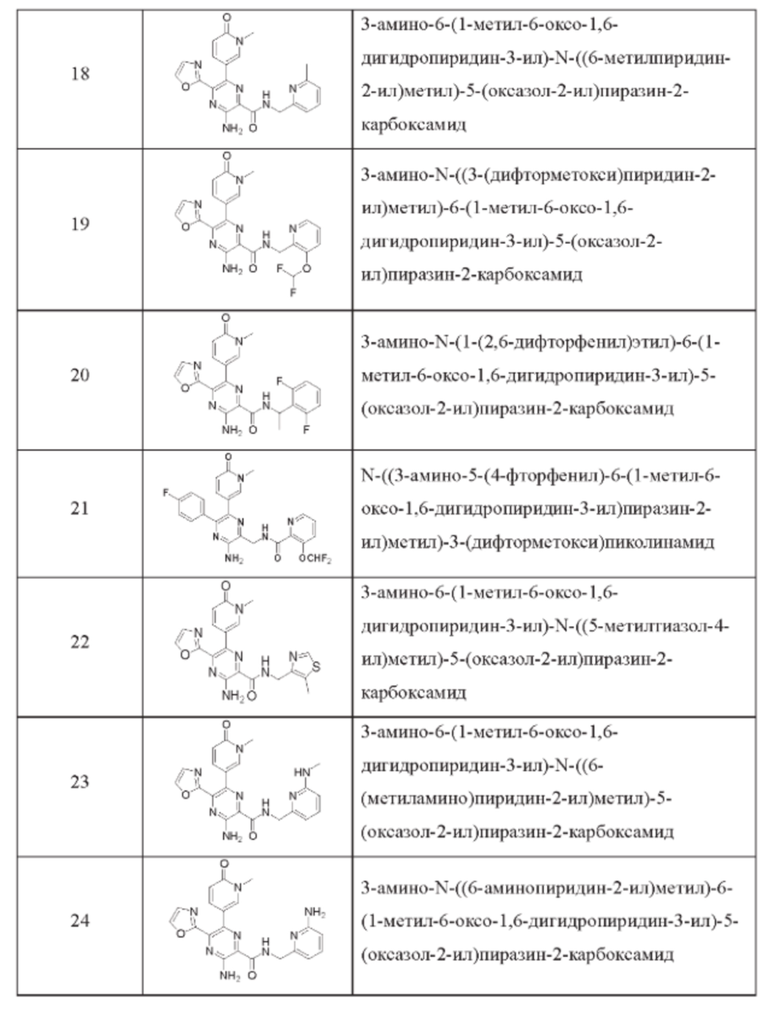
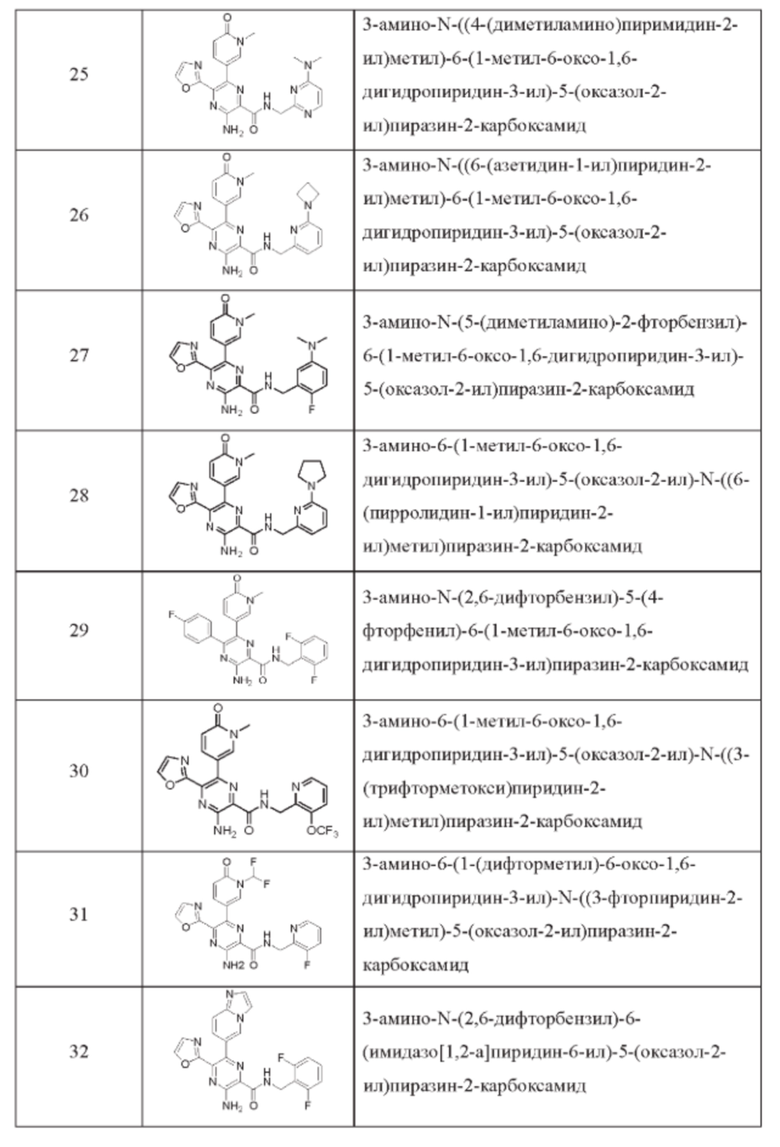
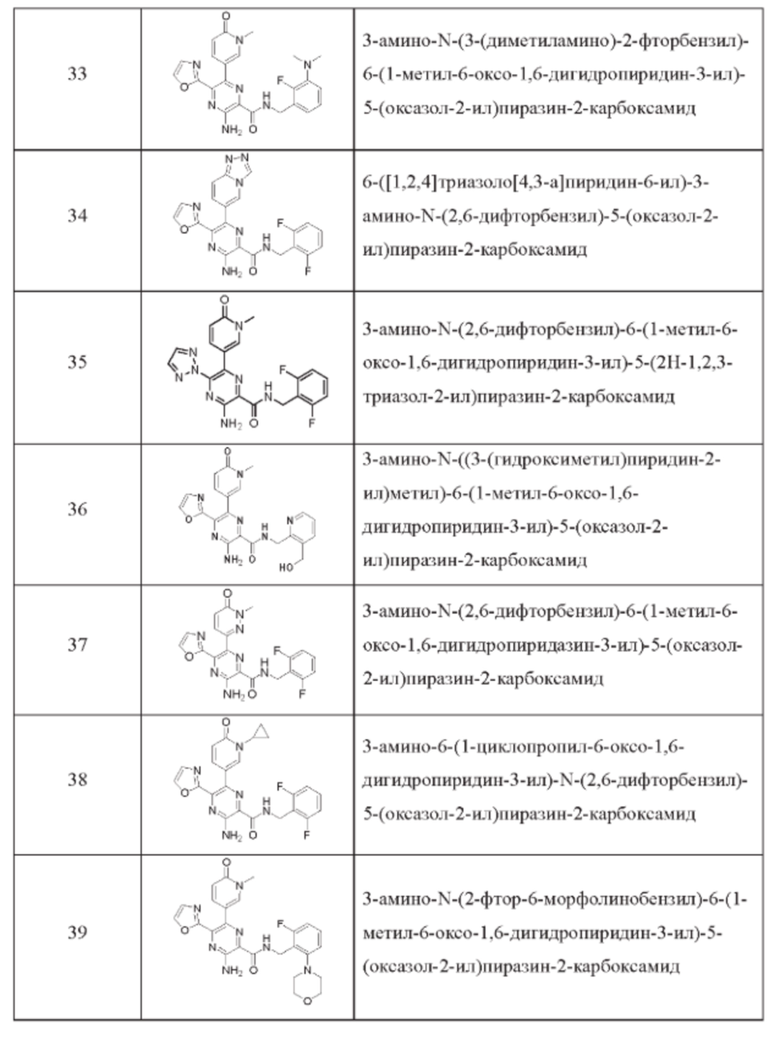
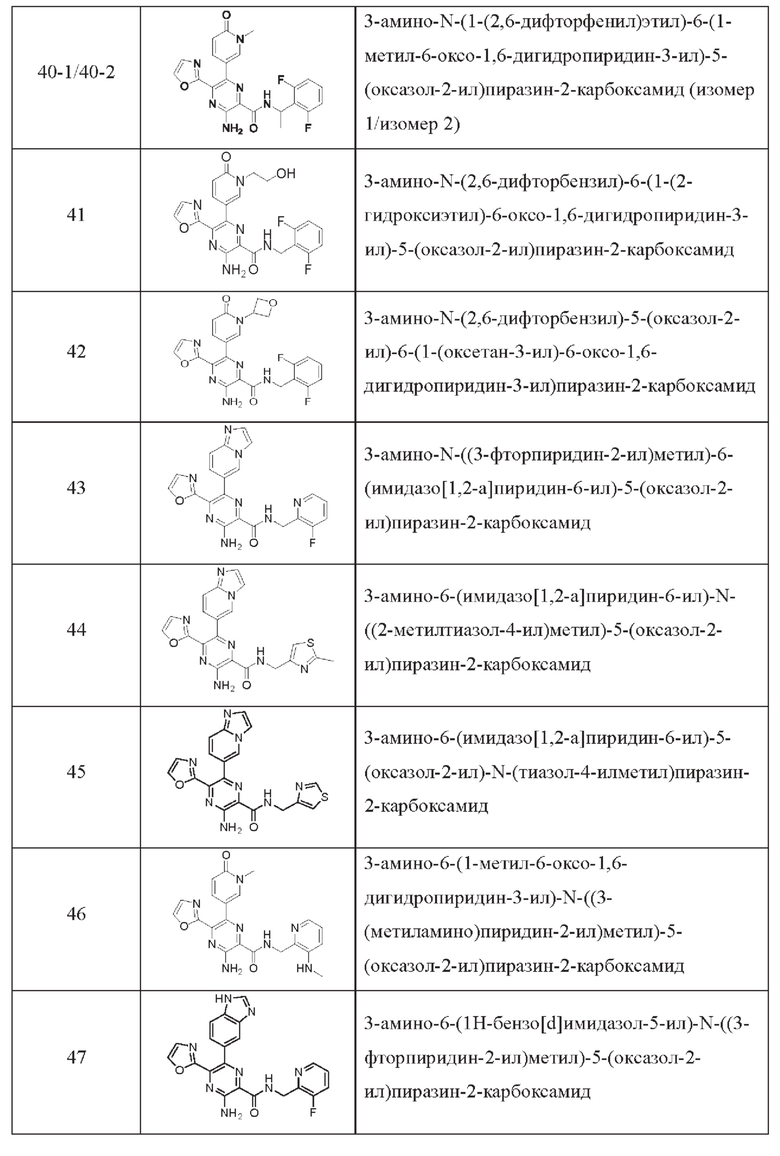
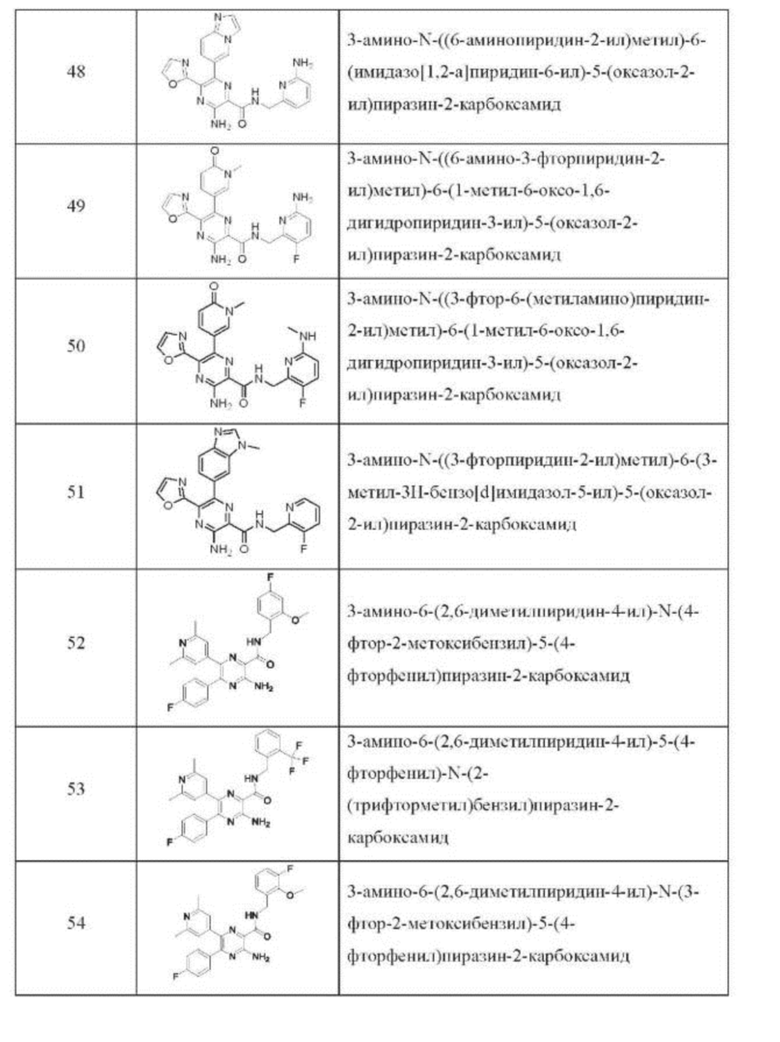
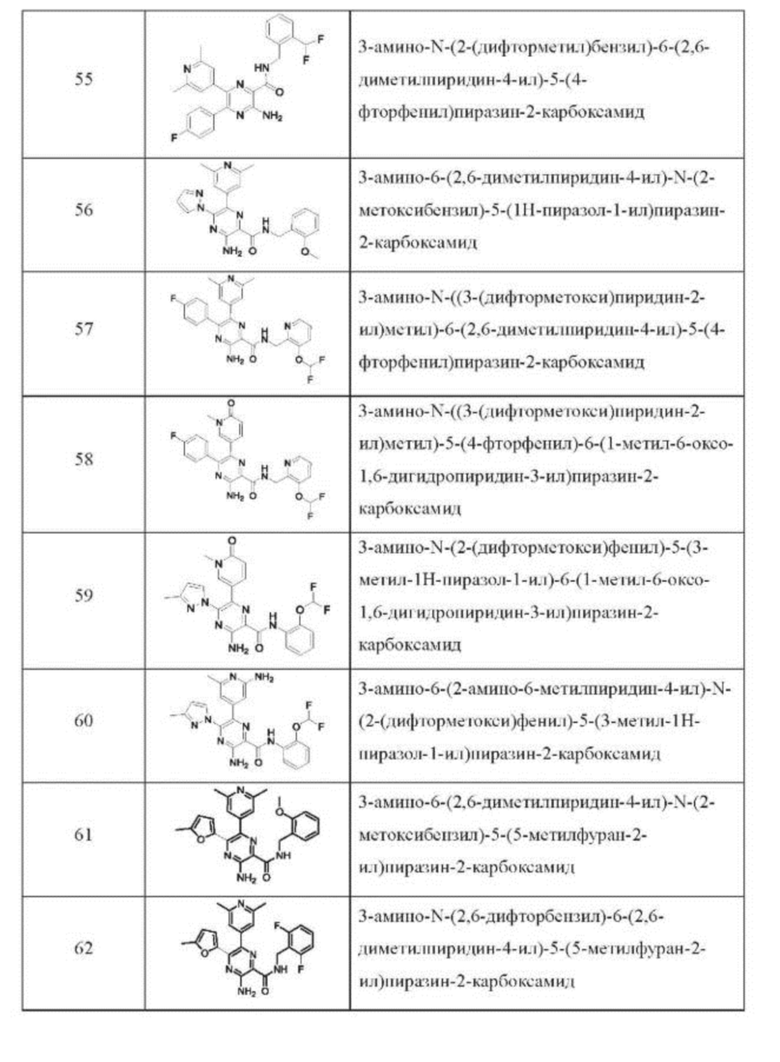
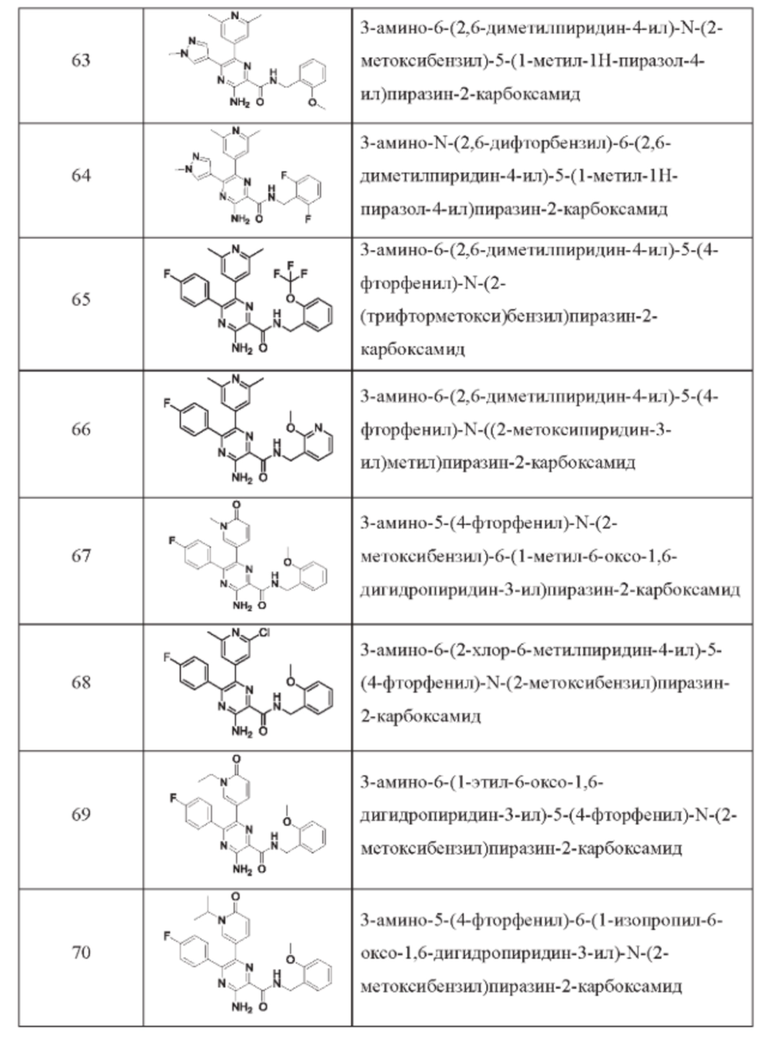
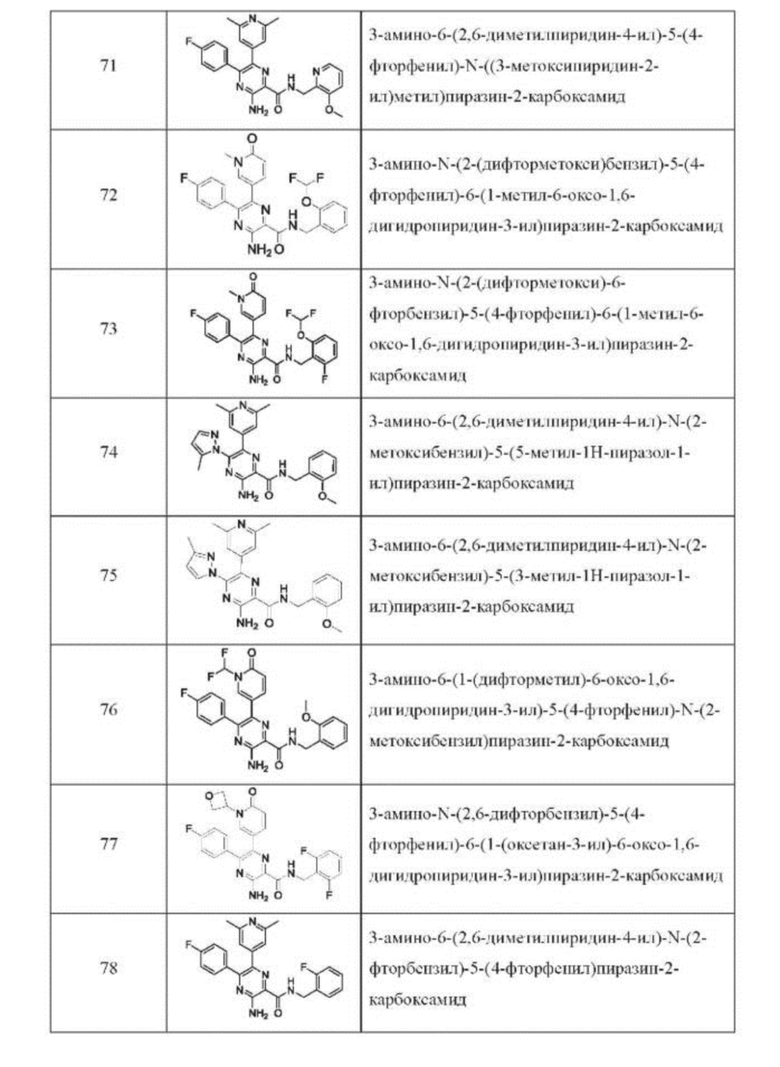
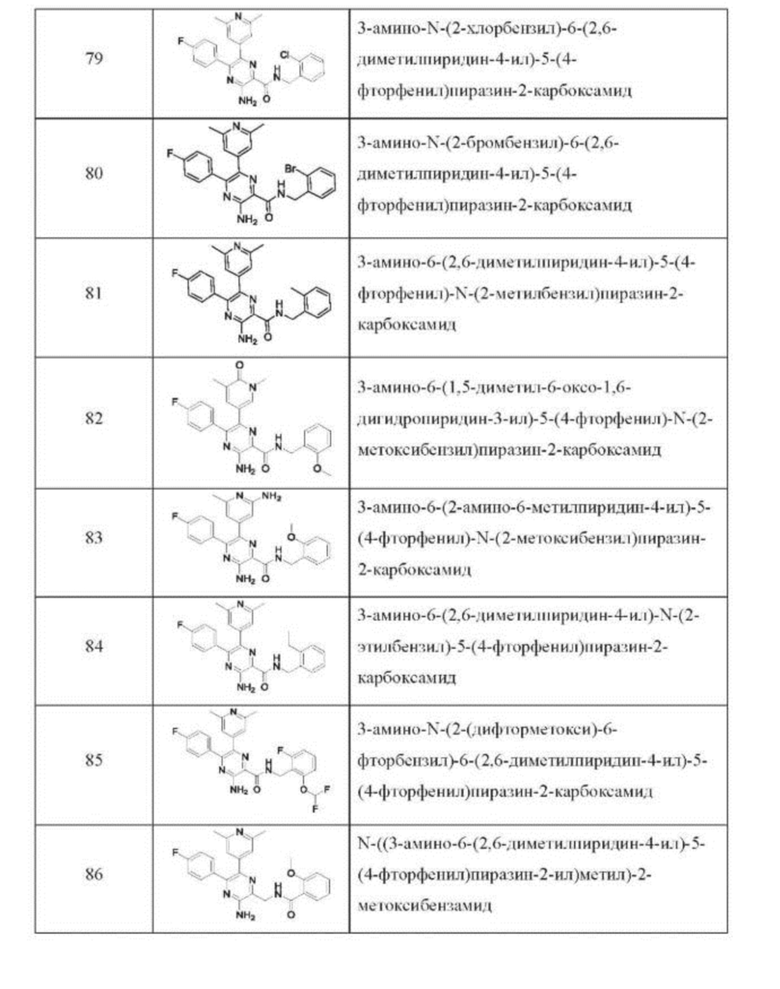
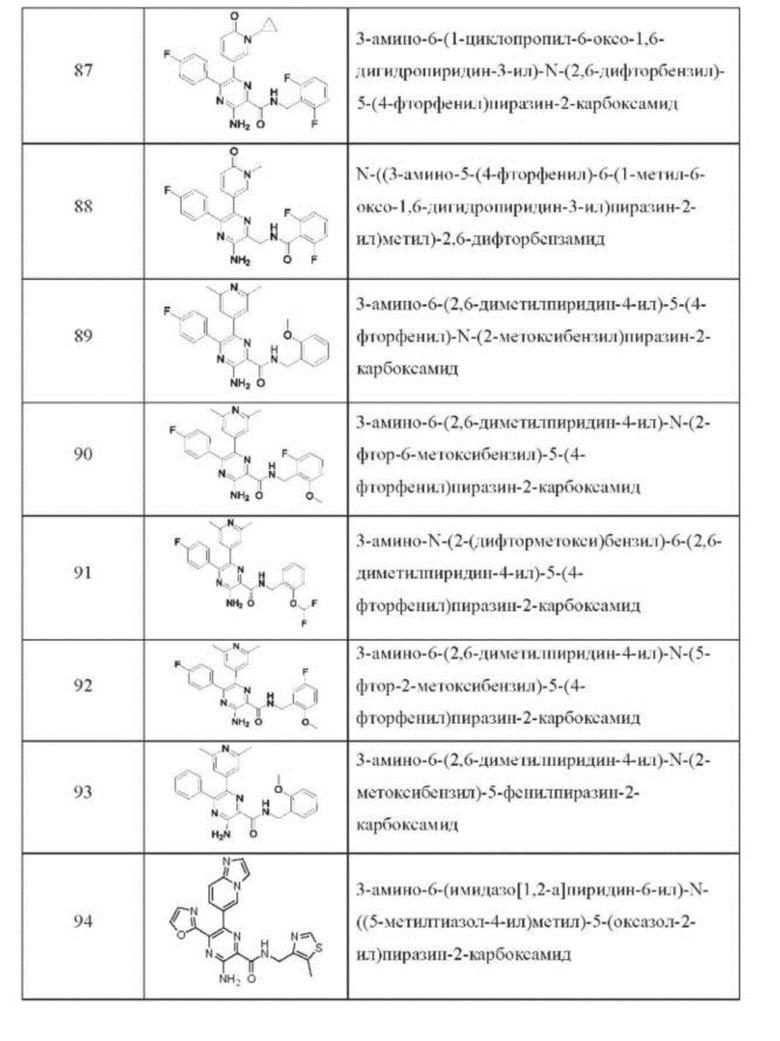





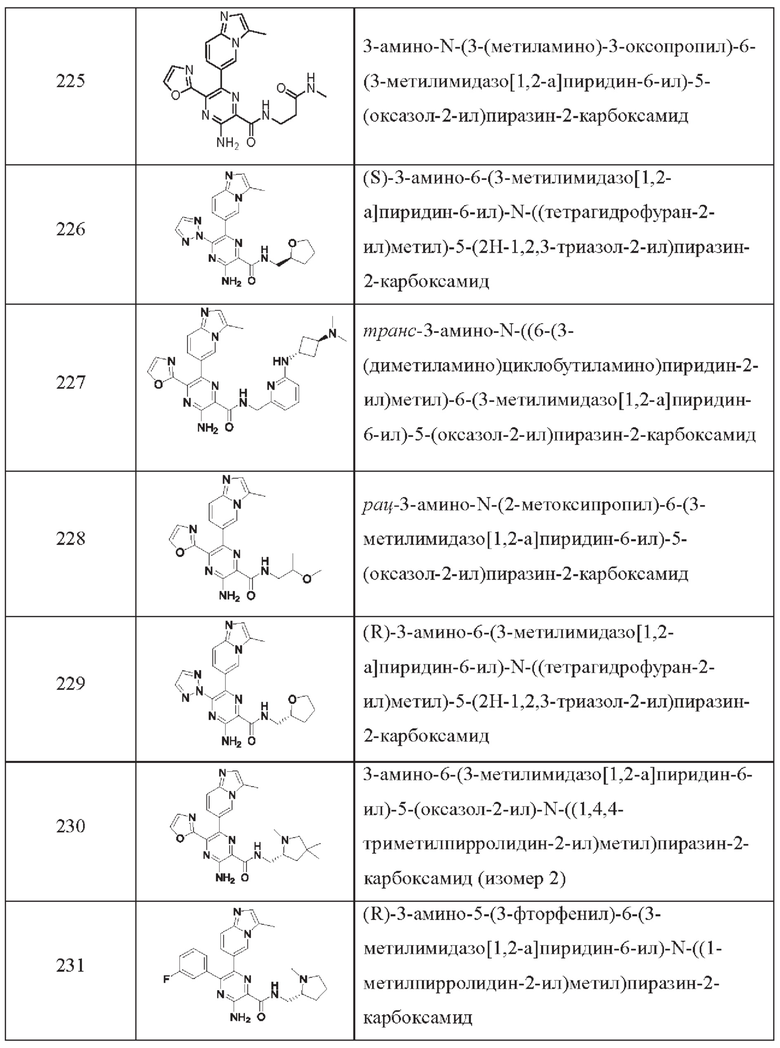

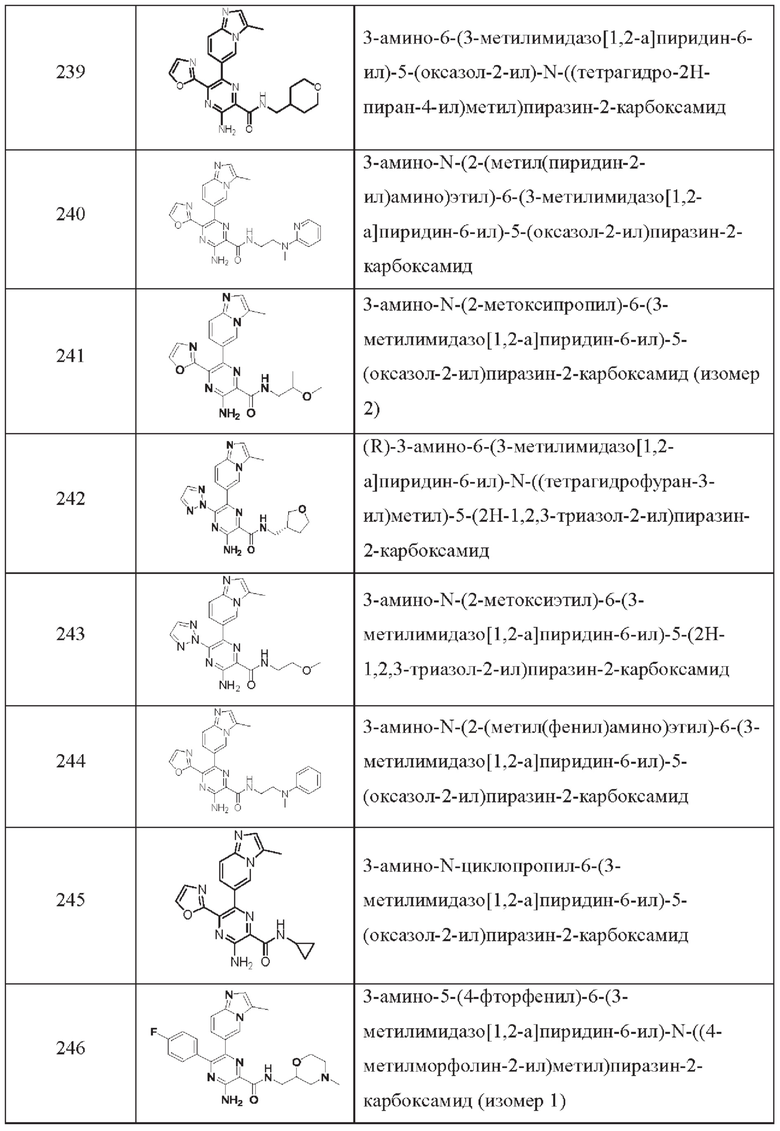
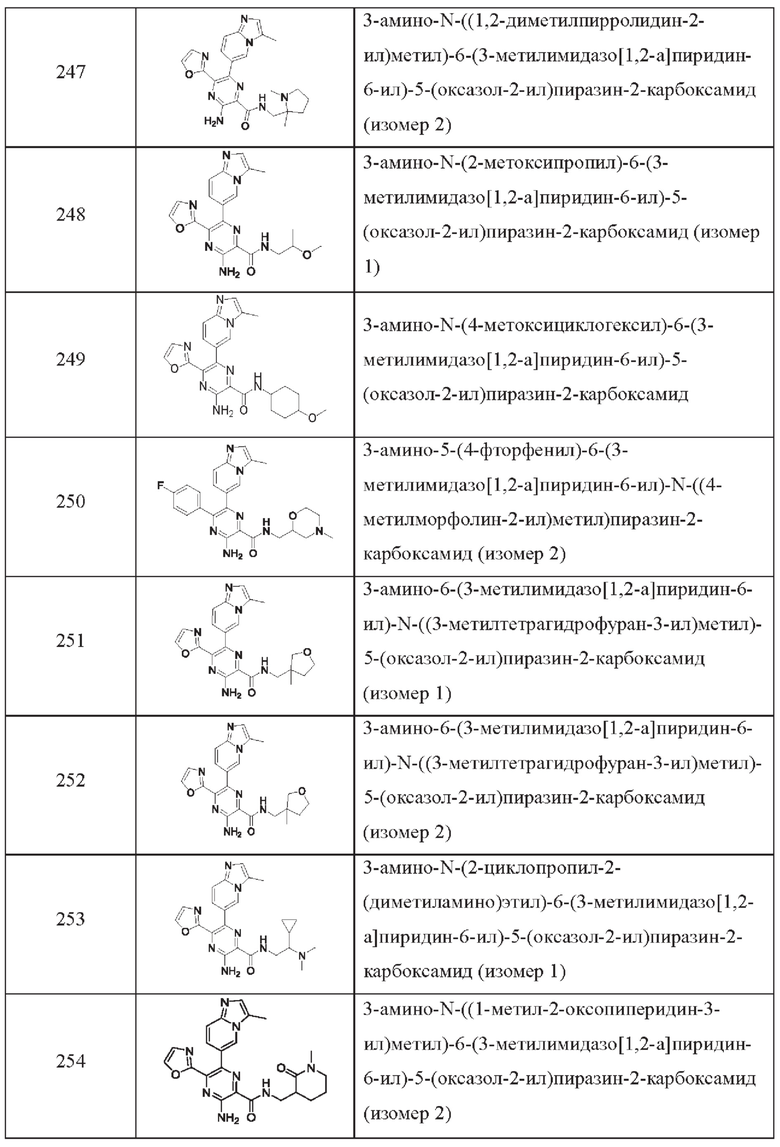
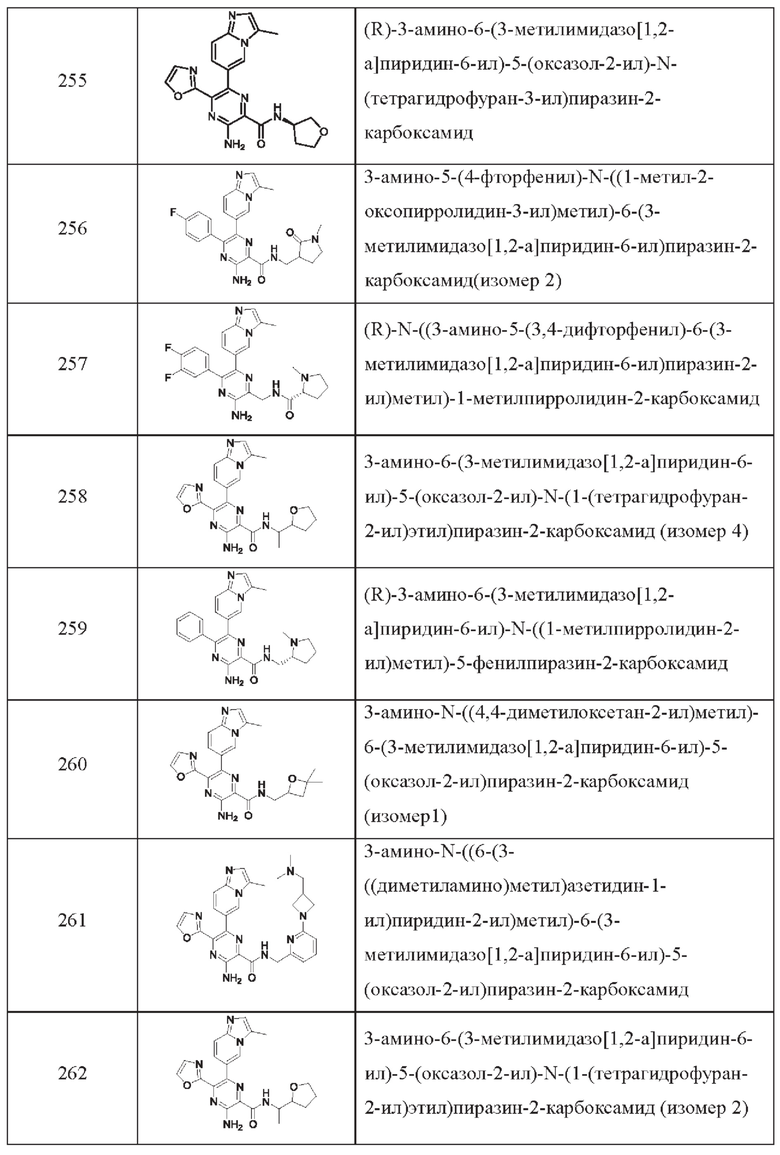
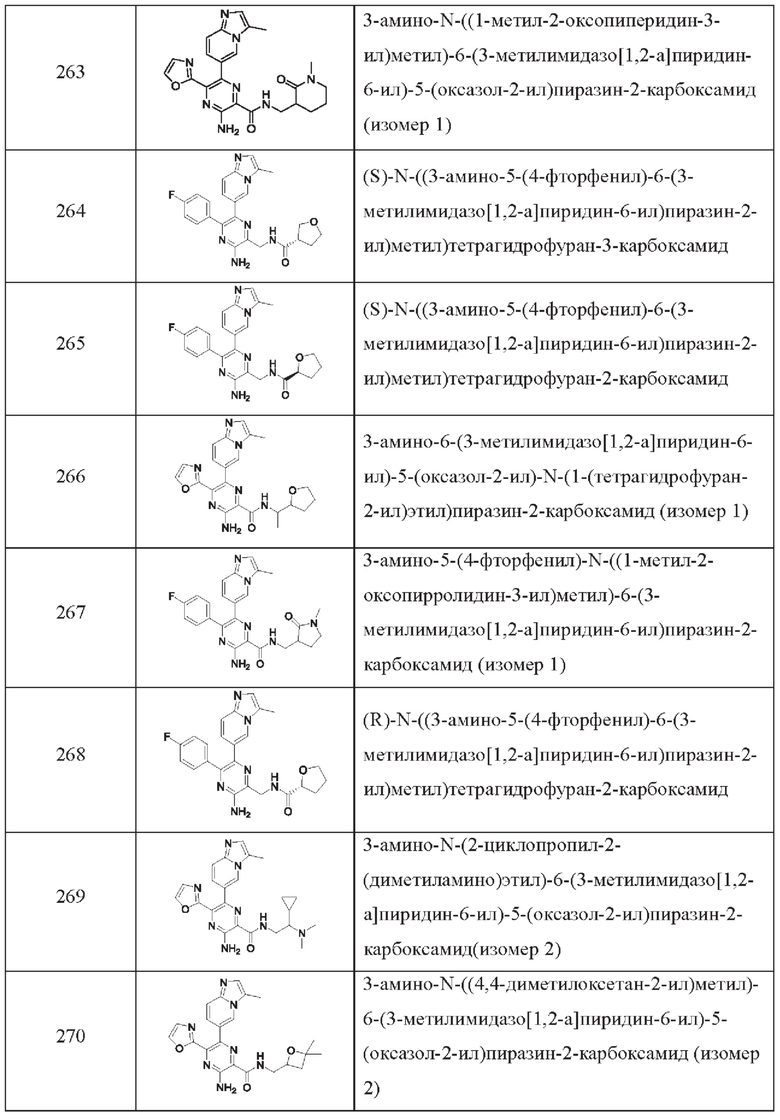

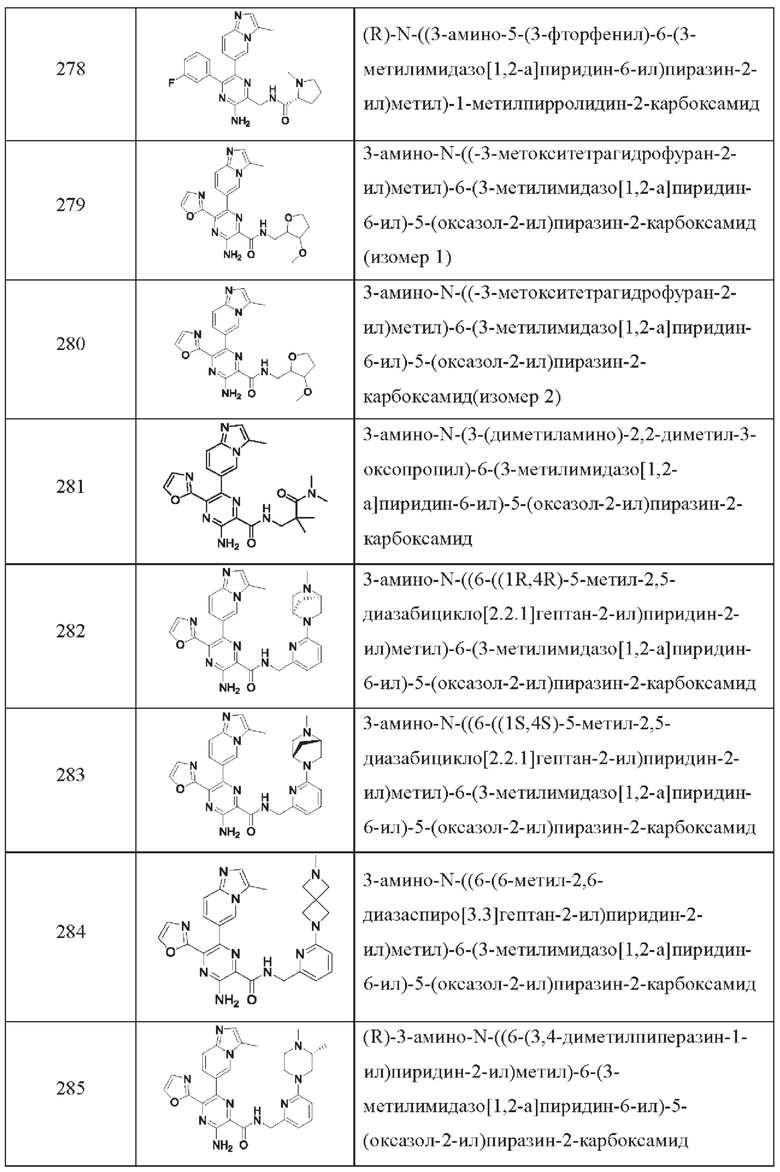

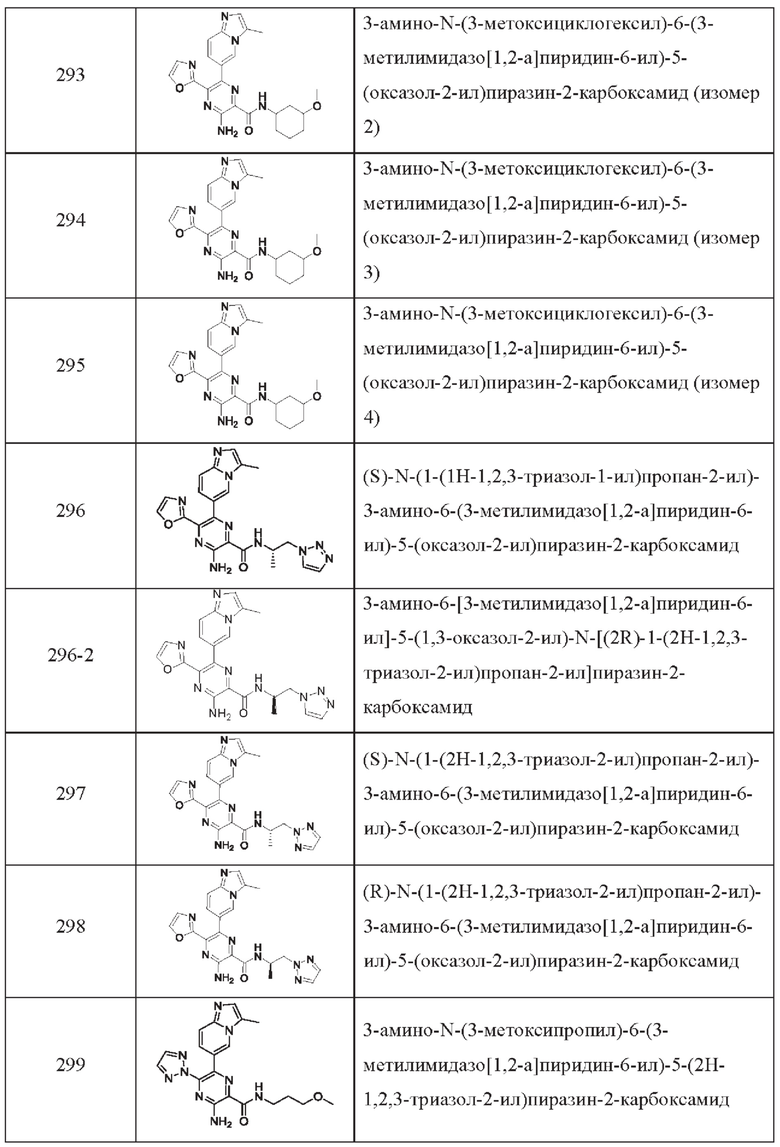
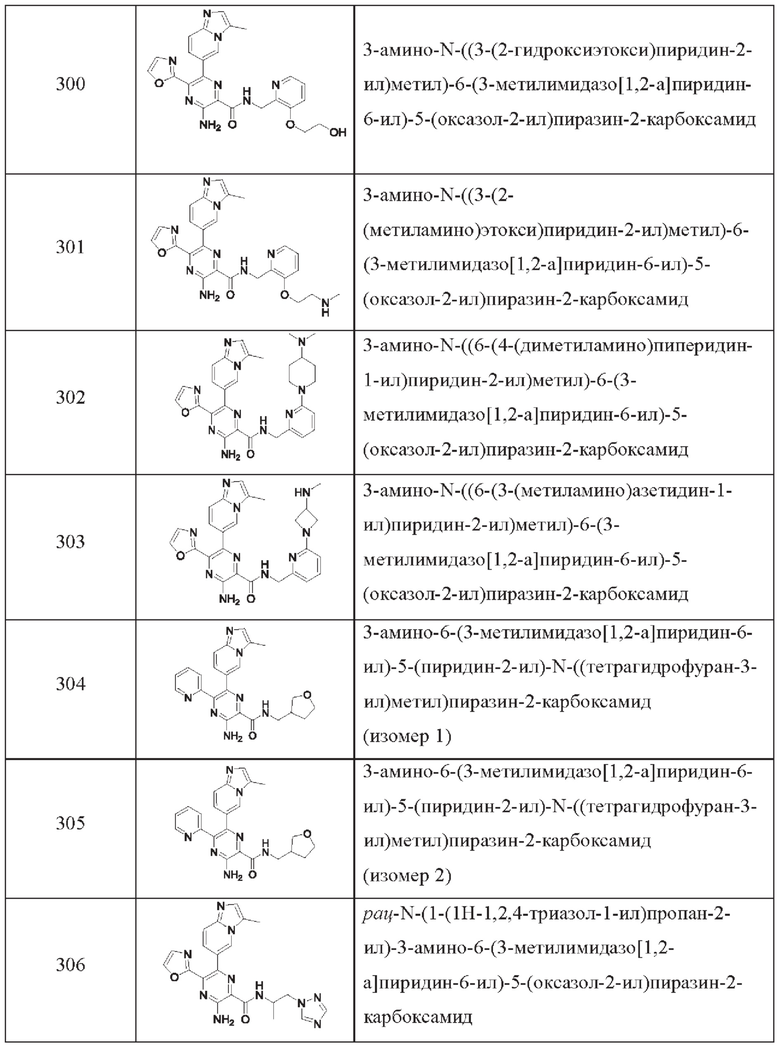
Очевидно, что некоторые признаки настоящего изобретения, которые, для наглядности, описаны в контексте отдельных воплощений, также могут быть предусмотрены в комбинации в одном воплощении. И наоборот, другие признаки настоящего изобретения, которые, для краткости, описаны в контексте одного воплощения, также могут быть предусмотрены по отдельности или в любой подходящей подкомбинации.
В различных местах настоящего описания изобретения описаны соединяющие заместители. Если структура явно требует наличия соединяющей группы, то понимается, что переменные Маркуша, перечисленные для этой группы, представляют собой соединяющие группы. Например, если структура требует наличия соединяющей группы, и в определении группы Маркуша для этой переменной перечисляется «алкил», то очевидно, что «алкил» представляет собой соединяющую алкиленовую группу.
Использованный в данном описании термин «замещенный», когда он относится к химической группе, означает, что химическая группа имеет один или более чем один атом водорода, который удален и заменен на заместитель. Использованный в данном описании термин «заместитель» имеет обычное значение, известное в данной области техники, и относится к химической группировке, которая ковалентно присоединена к исходной группе или, при необходимости, конденсирована с ней. Использованный в данном описании термин «возможно замещенный» или «возможно…замещенный» означает, что химическая группа может вообще не иметь заместителей (т.е. быть незамещенной) или может иметь один или более заместителей (т.е. быть замещенной). Следует понимать, что замещение по заданному атому ограничено валентностью.
Использованный в данном описании термин «Ci-j» указывает на диапазон числа атомов углерода, при этом i и j представляют собой целые числа, и диапазон числа атомов углерода включает конечные точки (т.е. i и j) и каждое целое число между ними, и при этом j больше i. В качестве примеров, С1-6 указывает на диапазон от одного до шести атомов углерода, включающий в себя один атом углерода, два атома углерода, три атома углерода, четыре атома углерода, пять атомов углерода и шесть атомов углерода. В некоторых воплощениях термин «С1-12» указывает на 1-12 атомов, в том числе 1-10, 1-8, 1-6, 1-5, 1-4, 1-3 или 1-2 атома углерода.
Использованный в данном описании термин «алкил», применяемый как часть другого термина или независимо, относится к насыщенной или ненасыщенной углеводородной цепи, вместе с тем последняя может быть дополнительно подразделена на углеводородную цепь, имеющую по меньшей мере одну двойную или тройную связи (алкенил или алкинил). В некоторых воплощениях алкил относится к насыщенной углеводородной цепи. Упомянутая выше углеводородная цепь может быть прямой или разветвленной цепью. Термин «Ci-jалкил» относится к алкилу имеющему от i до j атомов углерода. Примеры насыщенной алкильной группы включают, но не ограничиваются этим, метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил; гомологи более высокого порядка, такие как 2-метил-1-бутил, н-пентил, 3-пентил, н-гексил, 1,2,2-триметилпропил и тому подобное. Примеры ненасыщенных алкильных групп включают, но не ограничиваются этим, этенил, н-пропенил, изопропенил, н-бутенил, втор-бутенил, этинил, пропин-1-ил, пропин-2-ил и тому подобное. Примерами «С1-12алкила» являются метил, этил, пропил, изопропил и бутил. Примерами «С1-3алкила» являются метил, этил, пропил и изопропил.
Использованный в данном описании термин «алкилен», применяемый как часть другого термина или независимо, относится к двухвалентному алкилу. Примеры алкиленовой группы включают, но не ограничиваются этим, метилен, 1,1-этилен, 1,2-этилен, 1,1-пропилен, 1,2-пропилен, 1,3-пропилен, 2,2-пропилен и тому подобное.
Использованные в данном описании термины «галогено» и «галоген» относятся к атому, выбранному из фтора, хлора, брома или йода.
Использованный в данном описании термин «алкоксил», применяемый как часть другого термина или независимо, относится к группе формулы -О-алкил. Термин «Ci-jалкоксил» означает, что алкильная группировка алкоксигруппы имеет от i до j атомов углерода. Примеры алкоксигрупп включают, но не ограничиваются этим, метоксил, этоксил, пропоксил (например, н-пропокси и изопропокси), трет-бутокси и тому подобное. Примерами «С1-12алкоксила» являются метоксил, этоксил и пропоксил.
Использованный в данном описании термин «Ci-jалкил-ОН» относится к группе формулы «-Ci-jалкил-ОН», при этом алкильная группировка данной группы имеет от i до j атомов углерода, и к любому атому углерода в этой алкильной группировке может быть присоединена одна или более чем одна гидроксильная группа. В некоторых воплощениях «Ci-jалкил-ОН» имеет одну гидроксильную группу. Примерами группы «С1-12алкил-ОН» являются гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил и 1-гидроксиизопропил.
Использованный в данном описании термин «Ci-jгалогеналкил» относится к замещенной галогеном (одно- или многократно замещенной) Ci-jалкильной группе. Примерами «С1-12галогеналкила» являются фторметил, дифторметил, трифторметил, фторэтил, дифторэтил, трифторэтил, хлорэтил и бромизопропил. Примерами «дифторэтила» являются 1,1-дифторэтил. Примерами «трифторэтила» являются 2,2,2-трифторэтил и 1,2,2-трифторэтил.
Использованный в данном описании термин «Ci-jгалогеналкоксил» относится к замещенной галогеном (одно- или многократно замещенной) Ci-jалкоксильной группе. Примерами «Ci-jгалогеналкоксила» являются фторметоксил, дифторметоксил или трифторметоксил. Примерами «трифторэтокси» являются 2,2,2-трифторэтокси и 1,2,2-трифторэтокси.
Примерами «N-(С1-12алкил)амино» являются метиламино и этиламино.
Примерами «N-(С1-12галогеналкил)амино» являются фторметиламино, дифторметиламино, трифторметиламино, 2-хлорэтиламино и 1-бромизопропиламино.
Примерами «N,N-(С1-12алкил)2амино» являются ди-(N-метил)амино, ди-(N-этил)амино и N-этил-N-метиламино.
Использованный в данном описании термин «Ci-jалканоил» относится к Ci-jалкилкарбонилу. Примерами «С1-12алканоила» являются пропионил и ацетил.
Примерами «С1-12алканоиламино» являются формамидо, ацетамидо и пропиониламино.
Примером «С1-12алканоилокси» является ацетокси.
Примерами «С1-12алкоксикарбонила» являются метоксикарбонил, этоксикарбонил, н- и трет-бутоксикарбонил.
Использованный в данном описании термин «карбамоил» относится к аминокарбонильной группе. Примерами «N-(С1-12алкил)карбамоила» являются метиламинокарбонил и этиламинокарбонил. Примерами «N,N-(C1-12алкил)2карбамоила» являются диметиламинокарбонил и метилэтиламинокарбонил.
Использованный в данном описании термин «карбоциклил», применяемый как часть другого термина или независимо, относится к любому кольцу, в том числе к моноциклическому или полициклическому кольцу (кольцам) (например, имеющим 2 или 3 конденсированных, мостиковых или спиро-кольца), в котором все кольцевые атомы представляют собой атомы углерода, и которое содержит по меньшей мере три образующих кольцо атома углерода. В некоторых воплощениях карбоциклил может содержать от 3 до 12 образующих кольцо атомов углерода (т.е. представлять собой 3-12-членную состоящую из атомов углерода систему), от 3 до 10 образующих кольцо атомов углерода, от 3 до 9 образующих кольцо атомов углерода или от 4 до 8 образующих кольцо атомов углерода. Карбоциклильные группы могут быть насыщенными, частично ненасыщенными или полностью ненасыщенными. В некоторых воплощениях карбо циклильная группа может представлять собой насыщенную циклическую алкильную группу. В некоторых воплощениях карбоциклильная группа может представлять собой ненасыщенную циклическую алкильную группу, которая содержит по меньшей мере одну двойную связь в своей кольцевой системе. В некоторых воплощениях ненасыщенная карбоциклильная группа может содержать одно или более ароматических колец. В некоторых воплощениях одна или более чем одна образующая кольцо группа -СН2- насыщенного или ненасыщенного карбоциклила может быть заменена на группу -С(О)-.
В некоторых воплощениях карбоциклильная группа представляет собой моноциклическую алкильную группу. В некоторых воплощениях карбоциклильная группа представляет собой насыщенную моноциклическую алкильную группу. Примеры моноциклических насыщенных или ненасыщенных карбо циклильных групп включают, но не ограничиваются этим, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, циклогексадиенил, циклогептатриенил и тому подобное.
Использованный в данном описании термин «спиро»-кольца относиться к кольцевым системам, имеющим два кольца, соединенных через один единственный общий атом; термин «конденсированные» кольца относится к кольцевым системам из двух колец, совместно использующих два соседних атома; а термин «мостиковые» кольца относится к кольцевым системам из двух колец, совместно использующих три или более атомов.
3-12-, 3-10- или 5-6-«членный насыщенный или ненасыщенный карбоциклил» представляет собой насыщенную, частично ненасыщенную или полностью ненасыщенную моно- или полициклическую кольцевую систему имеющую 3-12, 3-10 или 5-6 образующих кольцо атомов углерода, соответственно, при этом одна или более чем одна из образующих кольцо групп -СН2- возможно может быть заменена на группу -С(О)-.
Примерами «3-12-членного насыщенного или ненасыщенного карбоциклила» являются С3-4циклоалкил, циклогексил, циклогексенил, циклопентил, фенил, нафтил и бицикло[1.1.1]пентан-1-ил. Примерами «С3-4циклоалкила» являются циклопропил и циклобутил. Примерами «5-6-членного насыщенного или ненасыщенного карбоциклила» являются циклопентил и фенил.
Использованный в данном описании термин «гетероциклил» относится к карбоциклильной группе, где один или несколько (например, 1, 2 или 3) атомов в кольце заменены на гетероатомы, которые включают, но не ограничиваются этим, О, S, N, Р и тому подобное. В некоторых воплощениях гетероциклил представляет собой насыщенный гетероциклил. В некоторых воплощениях гетероциклил представляет собой ненасыщенный гетероциклил, имеющий одну или более двойных связей в своей кольцевой системе. В некоторых воплощениях гетероциклил представляет собой частично ненасыщенный гетероциклил. В некоторых воплощениях гетероциклил представляет собой полностью ненасыщенный гетероциклил. В некоторых воплощениях ненасыщенная гетероциклильная группа может содержать одно или более ароматических колец. В некоторых воплощениях одна или более чем одна из образующих кольцо групп -СН2- в гетероциклиле возможно может быть заменена на группу -С(О)-, -S-, -S(O)- или -S(O)2-. В некоторых воплощениях, если гетероциклил содержит атом серы в своей кольцевой системе, то указанный входящий в состав кольца атом серы возможно может быть окислен с образованием S-оксидов. В некоторых воплощениях гетероциклил присоединен к другой части соединения через свой образующий кольцо атом углерода. В некоторых воплощениях гетероциклил присоединен к другой части соединения через свой образующий кольцо атом азота.
В некоторых воплощениях 3-12-членный насыщенный или ненасыщенный моно- или полициклический гетероциклил имеет 1, 2 или 3 гетероатома, выбранных из N, О или S.
3-12-, 3-10- или 5-6-«членный насыщенный или ненасыщенный гетероциклил» представляет собой насыщенную, частично ненасыщенную или полностью ненасыщенную моно- или полициклическую кольцевую (например, имеющую 2 или 3 конденсированных, мостиковых или спиро-кольца) систему, имеющую 3-12, 3-10 или 5-6 образующих кольцо атомов, соответственно, среди которых по меньшей мере один входящий в состав кольца атом выбран из атома азота, серы или кислорода, которая, если не указано иное, может быть присоединена к другой части соединения через свой образующий кольцо атом углерода или азота, при этом одна или более чем одна из образующих кольцо групп -СН2- в насыщенном или ненасыщенном гетероциклиле может быть заменена на группу -С(О)-, -S-, -S(O)- или -S(O)2-, и при этом, если гетероциклил содержит в своей кольцевой системе атом серы, то указанный атом серы в кольце возможно может быть окислен с образованием S-оксидов.
Типичные моноциклические гетероциклильные группы включают, но не ограничиваются этим, оксетанил, 1,1-диоксотиетанилпирролидил, тетрагидрофурил, тетрагидротиенил, пирролил, фуранил, тиенил, пиразолил, имидазолил, триазолил, оксазолил, тиазолил, пиперидил, пиперидил, пиперазинил, морфолинил, пиридинил, пиразинил, пиримидинил, пиридазинил, триазинил, пиридонил, пиримидонил, пиразинонил, пиримидонил, пиридазонил, триазинонил и тому подобное.
Примеры спиро-гетероциклила включают, но не ограничиваются этим, спиропиранил, спирооксазинил и тому подобное. Примеры конденсированного гетероциклила включают, но не ограничиваются этим, конденсированное фенильное кольцо или конденсированное пиридинильное кольцо, такое как хинолинильная, изохинолинильная, хиноксалинильная, хинолизинильная, хиназолинильная, азаиндолизинильная, птеридинильная, хроменильная, изохроменильная, индолильная, изоиндолильная, индолизинильная, индазолильная, пуринильная, бензофуранильная, изобензофуранильная, бензимидазолильная, бензотиенильная, бензотиазолильная, карбазолильная, феназинильная, фенотиазинильная, фенантридинильная, имидазо[1,2-а]пиридинильная, [1,2,4]триазоло[4,3-а]пиридинильная, [1,2,3]триазоло[4,3-а]пиридинильная группы и тому подобное. Примеры мостикового гетероциклила включают, но не ограничиваются этим, морфанил, гексаметилентетраминил, 8-аза-бицикло[3.2.1]октан, 1-аза-бицикло[2.2.2]октан, 1,4-диазабицикло[2.2.2]октан (DABCO) и тому подобное.
Подразумевается, что термин «соединение» согласно настоящему изобретению охватывает все стереоизомеры, геометрические изомеры и таутомеры приведенных структур, если не указано иное.
Термин «стереоизомер» относится к любой из различных стереоизомерных конфигураций (например, к энантиомерам, диастереомерам и рацематам) асимметрического соединения (например, таковых, которые имеют один или несколько асимметрически замещенных атомов углерода или «асимметрических центров»). Соединения по настоящему изобретению, которые содержат асимметрические центры, могут быть выделены в оптически активной (в виде энантиомеров или диастереомеров) или оптически неактивной (рацемической) формах. Термин «энантиомер» включает в себя пары стереоизомеров, которые не совпадают с зеркальными отображениями друг друга. Смесь 1:1 пары энантиомеров представляет собой «рацемическую смесь». Термины «диастереомеры» или «диастереоизомеры» включают в себя стереоизомеры, имеющие по меньшей мере два асимметрических атома, но которые не являются зеркальными отображениями друг друга. Некоторые соединения, содержащие один или более асимметрических центров, могут способствовать образованию энантиомеров, диастереомеров или других стереоизомерных форм, которые могут быть определены в терминах абсолютной конфигурации как (R)- или (S)-изомеры по каждому асимметрическому центру в соответствии с правилом R-S системы Кана-Ингольда-Прелога. Разрешенные соединения, абсолютная конфигурация которых не известна, могут быть обозначены с использованием термина «или» в отношении асимметрического центра. В данной области техники известны методы получения оптически активных форм из рацемических смесей, такие как разделение посредством высокоэффективной жидкостной хроматографии (HPLC), или методы стереоселективного синтеза.
Термины «геометрические изомеры» или «цис- и транс-изомеры» относятся к соединениям с одной и той же формулой, но их функциональные группы развернуты в разных направлениях в трехмерном пространстве.
Термин «таутомеры» включает в себя прототропные таутомеры, которые представляют собой соединения, имеющие одну и ту же формулу и один и тот же общий заряд, но характеризующиеся изомерными состояниями протонирования. Примеры прототропных таутомеров включают, но не ограничиваются этим, пары кетон-енол, пары амид-имидовая кислота, пары лактам-лактим, пары енамин-имин и кольцевые формы, в которых протон может занимать два или более положений в гетероциклической системе, например, 1Н- и 3Н-имидазол, 1Н-, 2Н- и 4Н-1,2,4-триазол, 1Н- и 2Н-изоиндол и 1H- и 2Н-пиразол. Таутомеры могут находиться в равновесии или быть стерически заблокированы в одну форму посредством соответствующего замещения. Подразумевается, что соединения по настоящему изобретению, идентифицированные по названию или структуре как одна конкретная таутомерная форма, включают и другие таутомерные формы, если не указано иное.
Также подразумевается, что «соединение» согласно настоящему изобретению охватывает все изотопы атомов в таких соединениях. Изотопы какого-либо атома включают атомы, имеющие тот же атомный номер, но другие массовые числа. Например, если не указано иное, подразумевается, что атомы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора, брома или йода в «соединении» по настоящему изобретению также включают свои изотопы, такие как, но не ограничиваясь этим: 1Н, 2Н, 3Н, 11C, 12С, 13С, 14С, 14N, 15N, 16О, 17O, 18O, 31Р, 32Р, 32S, 33S, 34S, 36S, 17F, 19F, 35Cl, 37Cl, 79Br, 81Br, 127I и 131I. В некоторых воплощениях водород включает протий, дейтерий и тритий. В некоторых воплощениях термин «замещенный дейтерием» или «дейтерий-замещенный» означает замену другой изоформы водорода (например, протия) в химической группе на дейтерий. В некоторых воплощениях углерод включает 12С и 13С. В некоторых воплощениях термин «соединение» по настоящему изобретению охватывает только изотопы атома водорода в данном соединении. В некоторых воплощениях термин «соединение» по настоящему изобретению охватывает только изотопы атомов, распространенные в природе.
Кроме того, следует понимать, что «соединение» по настоящему изобретению может существовать в сольватированной, а также несольватированной формах, таких как, например, гидратированные формы, твердые формы, и подразумевается, что настоящее изобретение охватывает все такие сольватированные и несольватированные формы.
Также понятно, что «соединение» по настоящему изобретению может существовать в формах фармацевтически приемлемых солей.
Использованный в данном описании термин «фармацевтически приемлемый» относится к таким соединениям, веществам, композициям и/или лекарственным формам, которые с медицинской точки зрения подходят для применения в контакте с тканями людей и животных без чрезмерных токсичности, раздражения, аллергической реакции или другой проблемы или другого осложнения, соизмеримых с разумным соотношением польза/риск. В некоторых воплощениях, соединения, вещества, композиции и/или лекарственные формы, которые являются фармацевтически приемлемыми, относятся к таковым, которые одобрены регулирующим органом (таким как Управление по контролю качества пищевых продуктов и лекарственных средств США, Управление по контролю качества пищевых продуктов и лекарственных средств Китая или Европейское агентство по лекарственным средствам), или перечислены в общепризнанной фармакопее (такой как Фармакопея США, Китайская фармакопея или Европейская фармакопея) для применения на животных и, более конкретно, на людях.
Использованный в данном описании термин «фармацевтически приемлемые соли» относится к производным соединений по настоящему изобретению, при этом исходное соединение модифицировано путем превращения существующей кислотной группировки (например, карбоксильной и тому подобной группы) или основной группировки (например, амина, щелочной группы и тому подобного) в их солевую форму. Во многих случаях соединения по настоящему изобретению способны образовывать соли с кислотами и/или основаниями благодаря присутствию амино- и/или карбоксильных групп или им подобных групп. Фармацевтически приемлемыми солями являются соли с кислотами и/или с основаниями, сохраняющие биологическую эффективность и свойства исходного соединения, которые обычно не являются нежелательными с биологической или иной точки зрения. Подходящие фармацевтически приемлемые соли соединения по настоящему изобретению включают, например, соль присоединения кислоты, которая может происходить, например, из неорганической кислоты (например, соляной, бромистоводородной, серной, азотной, фосфорной кислоты и им подобных) или органической кислоты (например, муравьиной, уксусной, пропионовой, гликолевой, щавелевой, малеиновой, малоновой, янтарной, фумаровой, винной, тримезиновой, лимонной, молочной, фенилуксусной, бензойной, миндальной, метансульфоновой, нападизиловой, этансульфоновой, толуолсульфоновой, трифторуксусной, салициловой, сульфосалициловой кислот и им подобных). В некоторых воплощениях фармацевтически приемлемой солью соединения по настоящему изобретению является соль муравьиной кислоты. В некоторых воплощениях фармацевтически приемлемой солью соединения по настоящему изобретению является соль трифторуксусной кислоты (TFA).
Подходящие фармацевтически приемлемые соли соединения по настоящему изобретению также включают, например, соль присоединения основания, которая может происходить, например, из неорганических оснований (например, солей и гидроксидов натрия, калия, аммония, карбонатных, бикарбонатных солей металлов из I-XII колонок Периодической таблицы, таких как кальций, магний, железо, серебро, цинк, медь и тому подобное) или органических оснований (например, первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов, основных ионообменных смол и тому подобного). Некоторые органические амины включают, но не ограничиваются этим, изопропиламин, бензатин, холинат, диэтаноламин, диэтиламин, лизин, меглумин, пиперазин и трометамин. Специалистам в данной области техники будет очевидно, что также может быть возможно добавление кислот или оснований для образования солей присоединения кислоты/основания, отличающихся от таковых, показанных в разделе Примеры. Перечни дополнительных подходящих солей можно найти, например, в ''Remington's Pharmaceutical Sciences", 20th ed, Mack Publishing Company, Easton, Pa. (1985); и в "Handbook of Pharmaceutical Salts: Properties, Selection and Use" под ред. Stahl и Wermuth (Wiley-VCH, Weinheim, Germany, 2002). В некоторых воплощениях подходящими фармацевтически приемлемыми солями соединения по настоящему изобретению являются соли с неорганическими основаниями.
Настоящее изобретение также включает активные промежуточные соединения, активные метаболиты и пролекарства соединений по настоящему изобретению. Как использовано в данном описании, «активное промежуточное соединение» означает промежуточное соединение в способе синтеза, которое проявляет такую же или по существу такую же биологическую активность, что и конечное синтезированное соединение.
Как использовано в данном описании, «активный метаболит» означает продукт расщепления или конечный продукт соединения по настоящему изобретению или его соли либо пролекарства, полученный в результате метаболизма или биотрансформации в организме животного или человека, который проявляет такую же или по существу такую же биологическую активность, что и указанное соединение. Такие метаболиты могут образовываться в результате, например, окисления, восстановления, гидролиза, амидирования, дезамидирования, этерификации, деэтерификации, ферментативного расщепления и тому подобного в отношении вводимого соединения или соли либо пролекарства.
Использованный в данном описании термин «пролекарства» относится к любым соединениям или конъюгатам, которые высвобождают активное исходное лекарственное средство при введении субъекту - животному или человеку. Пролекарства могут быть получены путем модификации функциональных групп, присутствующих в соединениях, таким образом, чтобы модифицирующие группы могли отщепляться от исходных соединений либо обычным способом, либо in vivo. Пролекарства включают соединения, в которых гидроксильная, амино, сульфгидрильная или карбоксильная группа связана с любой группой, отщепляемой при введении млекопитающему с образованием свободной гидроксильной, амино, сульфгидрильной или карбоксильной группы, соответственно. Примеры пролекарств включают, но не ограничиваются этим, ацетатные, формиатные и бензоатные производные соединений по настоящему изобретению по функциональным спиртовым и аминогруппам. Получение и применение пролекарств рассмотрено в работе Т. Higuchi and V. Stella, "Prodrugs as New Delivery Systems", том 14 из серии симпозиумов Американского химического общества (A.C.S.) и в книге Bioreversible Carriers in Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, обе из которых тем самым включены посредством ссылки во всей своей полноте.
Способ синтеза
Синтез соединений, предложенных в данном изобретении, в том числе их фармацевтически приемлемых солей, иллюстрируется на схемах синтеза в разделе Примеры. Соединения, предложенные в данном изобретении, могут быть получены с использованием любых известных методов органического синтеза и могут быть синтезированы в соответствии с любым из многочисленных возможных путей синтеза, и, таким образом, эти схемы являются только иллюстративными и не предназначены для ограничения других возможных способов, которые можно использовать для получения соединений, предложенных в данном изобретении. Кроме того, стадии на этих схемах представлены для лучшей иллюстрации и при необходимости могут быть изменены. Варианты соединений, приведенных в разделе Примеры, синтезировали в целях исследования и возможного представления в регулирующие органы.
Реакции, необходимые для получения соединений по настоящему изобретению, могут быть проведены в подходящих растворителях, которые легко могут быть выбраны специалистом в области органического синтеза. Подходящие растворители могут практически не вступать во взаимодействие с исходными веществами (реагентами), промежуточными соединениями или продуктами при температурах, при которых проводят данные реакции, например, при температурах, которые могут находиться в диапазоне от температуры замерзания растворителя до температуры кипения растворителя. Данное взаимодействие может быть проведено в одном растворителе или в смеси, состоящей более чем из одного растворителя. В зависимости от конкретной стадии реакции растворители, подходящие для конкретной стадии реакции, могут быть выбраны специалистом в данной области.
В ходе получения соединений по настоящему изобретению можно использовать введение и удаление защитных групп с различных химических групп. Необходимость введения и удаления защиты и выбор соответствующих защитных групп может быть легко определено специалистом в данной области техники. Химические характеристики защитных групп можно найти, например, в книге Т.W. Greene and P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., Wiley & Sons, Inc., New York (1999), которая включена в данное описание посредством ссылки во всей своей полноте.
Мониторинг этих реакций можно проводить любым подходящим методом, известным в данной области техники. Например, образование продукта можно регистрировать с использованием средств спектроскопии, таких как спектроскопия ядерного магнитного резонанса (например, 1Н или 13С), инфракрасная спектроскопия, спектрофотометрия (например, в ультрафиолетовой (УФ) и видимой области спектра), масс-спектрометрия, либо с применением хроматографических методов, таких как высокоэффективная жидкостная хроматография (HPLC), жидкостная хроматография-масс-спектроскопия (LCMS) или тонкослойная хроматография (TLC). Очистка соединений специалистами в данной области техники может быть выполнена различными методами, включая высокоэффективную жидкостную хроматографию (HPLC) (см. книгу "Preparative LC-MS Purification: Improved Compound Specific Method Optimization", Karl F. Blom, Brian Glass, Richard Sparks, Andrew P. Combs, J. Combi. Chem., 2004, 6(6), 874-883, которая включена в данное описание посредством ссылки во всей своей полноте) и хроматографию на диоксиде кремния в качестве нормальной фазы.
Структуры соединений в разделе Примеры характеризуют посредством ядерного магнитного резонанса (ЯМР) или/и жидкостной хроматографии-масс-спектрометрии (LC-MS). Химический сдвиг (δ) в спектрах ЯМР приводится в единицах 10-6 (млн-1). Спектры 1H-ЯМР регистрируют в диметилсульфоксиде-d6 (DMSO-d6), или CDCl3, или CD3OD, или D2O, или в ацетоне-d6, или CD3CN (от Innochem, или Sigma-Aldrich, или Cambridge Isotope Lab., Inc.) на спектрометрах для ЯМР AVANCE от Bruker (300 МГц или 400 МГц), используя программное обеспечение ICON-NMR (под управлением программы TopSpin) с тетраметилсиланом в качестве внутреннего стандарта.
MS-измерение осуществляют, используя масс-спектрометр Shimadzu 2020 с электрораспылительным источником в режиме положительных и отрицательных ионов.
Измерение с использованием высокоэффективной жидкостной хроматографии (HPLC) проводят на системе LC-20AD от Shimadzu, или системе LC-20ADXR от Shimadzu, или системе LC-30AD от Shimadzu, применяя С18 колонку Shim-pack XR-ODS (3,0*50 мм, 2,2 мкм), или С18 колонку Ascentis Express (2,1*50 мм, 2,7 мкм), или колонку Agilent Poroshell НРН-С18 (3,0*50 мм, 2,7 мкм).
Тонкослойную хроматографию проводят с использованием пластинок силикагеля от Sinopharm Chemical Reagent Beijing Co., Ltd. и Xinnuo Chemical. Для проведения тонкослойной хроматографии (TLC) используют пластинки с силикагелем 175-225 мкм. Для разделения и очистки продуктов посредством TLC используют пластинки с силикагелем с толщиной слоя 1,0 мм.
Для хроматографической очистки используют колонку с силикагелем в качестве носителя (100-200, 200-300 или 300-400 меш, производства Rushanshi Shangbang Xincailiao Co., Ltd. или Rushan Taiyang Desiccant Co., Ltd. и т.д.) или колонку для флэш-хроматографии (С18 колонку для обращенно-фазовой хроматографии, 20-45 мкм, производства Agela Technologies) в системе для флэш-хроматографии Agela Technologies. Размер колонок корректируют в соответствии с количеством соединений.
Известные исходные вещества по настоящему изобретению могут быть синтезированы с использованием известных в данной области техники методов или в соответствии с ними либо могут быть приобретены у Alfa Aesar, TCI, Sigma-Aldrich, Bepharm, Bide Pharmatech, PharmaBlock, Enamine, Innochem и JW&Y PharmLab и так далее.
Если не указано иное, все реакции проводят в атмосфере аргона или азота. Выражение «атмосфера аргона или азота» означает, что реакционную колбу подсоединяют к баллону с аргоном или азотом объемом примерно 1 л. Гидрирование обычно проводят под давлением. Если не указано иное, температура, при которой проводят реакции в разделе Примеры, представляет собой температуру окружающей среды, которая составляет 10°С-30°С.
Мониторинг развития реакций осуществляют посредством TLC или/и LC-MS. Системы элюентов, используемые для реакций, включают систему дихлорметан-метанол и систему петролейный эфир-этил ацетат. Объемные соотношения растворителей корректируют в соответствии с различной полярностью соединений.
Система элюирования для колоночной хроматографии, используемая для очистки соединений, и система элюентов для TLC включают систему дихлорметан-метанол и систему петролейный эфир-этилацетат. Объемные соотношения растворителей корректируют в соответствии с различной полярностью соединений. С целью корректировки могут быть добавлены небольшие количества щелочных или кислотных агентов (0,1%-1%), таких как муравьиная кислота, или уксусная кислота, или TFA, или аммиак.
Сокращения для химических реагентов, использованных при синтезе соединений, предложенных согласно данному изобретению, приведены ниже.



Фармацевтическая композиция
Согласно настоящему изобретению предложены фармацевтические композиции, содержащие по меньшей мере одно соединение по настоящему изобретению или его фармацевтически приемлемую соль. В некоторых воплощениях фармацевтическая композиция содержит больше одного соединения по настоящему изобретению или больше одной его фармацевтически приемлемой соли. В некоторых воплощениях фармацевтическая композиция содержит одно или более чем одно соединение по настоящему изобретению или одну или более чем одну его фармацевтически приемлемую соль и фармацевтический приемлемый носитель.
В общем случае, фармацевтически приемлемыми носителями являются традиционные для области медицины носители, которые могут быть получены способом, хорошо известным в области фармацевтики. В некоторых воплощениях, соединения по настоящему изобретению или их фармацевтически приемлемая соль могут быть смешаны с фармацевтически приемлемым носителем для приготовления фармацевтической композиции.
Форма фармацевтических композиций зависит от ряда критериев, включая, но не ограничиваясь этим, путь введения, степень заболевания или подлежащая введению доза. Фармацевтические композиции могут быть приготовлены для перорального, назального, ректального, чрескожного, внутривенного или внутримышечного введения. В соответствии с требуемым путем введения фармацевтические композиции могут быть приготовлены в форме таблеток, капсул, пилюль, порошка, гранул, саше, облаток, пастилок, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде), спрея, мази, пасты, крема, лосьона, геля, пластыря, средства для ингаляции или суппозитория.
В некоторых воплощениях фармацевтические композиции содержат соединения по настоящему изобретению или их фармацевтически приемлемую соль в количестве от примерно 1 мг до примерно 500 мг, в частности, от 1 мг до примерно 50 мг.
В некоторых воплощениях фармацевтические композиции содержат одно или более соединений по настоящему изобретению или их фармацевтически приемлемую соль в качестве первого активного ингредиента и дополнительно содержат второй активный ингредиент. Вторым активным ингредиентом может быть любой иммуномодулятор или противоопухолевый агент, известный в данной области техники, включая, без ограничения, химиотерапевтические средства, иммунотерапевтические средства, ингибиторы передачи сигнала в клетках, ингибиторы передачи сигнала в клетках, алкилирующие агенты, ингибиторы топоизомеразы, ингибиторы митоза, антигормональные агенты и так далее. Примерами таких иммуномодуляторов или противоопухолевых агентов являются химиотерапевтические средства на основе платины (например, цисплатин (цис-дихлордиаминплатина(II) (DDP)), карбоплатин (СВР), 1,2-диаминоциклогексан(сульфато)платина (SHP), недаплатин, оксалиплатин (ОХА), лабоплатин), доцетаксел, паклитаксел, доксорубицин, этопозид, митоксантрон, ингибиторы CTLA-4 (цитотоксический Т-лимфоцитарный антиген 4), антитела к CTLA-4, ингибиторы PD-1 (белок 1 программируемой (клеточной) смерти), ингибиторы PD-L1 (лиганд PD-1), антитела к PD-1/PD-L1, ингибиторы CD39 (кластер дифференцировки 39), антитела к CD39, ингибиторы CD73, антитела к CD73, ингибиторы CCR2 (хемокиновый рецептор 2 семейства С-С), антитела к CCR2, ингибиторы EGFR (рецептор эпидермального фактора роста), ингибиторы CDK (циклинзависимая киназа) 4/6, ингибиторы MELK (материнская эмбриональная киназа с «лейциновой застежкой»), агонисты ОХ40, ингибиторы антиандрогенов, антитела к изотипам IgG4, ингибиторы тирозинкиназ, ингибиторы ДНК-метилтрансферазы, ингибиторы Hsp90 (белок теплового шока 90), ингибиторы FGFR (рецептор фактора роста фибробластов), ингибиторы mTOR (мишень рапамицина у млекопитающих), ингибиторы ароматазы, ингибиторы VEGF (сосудистый эндотелиальный фактор роста), антагонисты LHRH (рилизинг-фактор лютеинизирующего гормона), ингибиторы PI3K (фосфатидилинозитол-3-киназа), ингибиторы АКТ (представитель семейства протеинкиназ В), ингибиторы Аврора-киназы, ингибиторы МЕК, ингибиторы HDAC (гистонде ацетил аза), ингибиторы BET (от англ. Bromodomain and Extra-Terminal domain), ингибиторы PIK3CA (каталитическая субъединица p110α PI3-киназы), ингибиторы протеасом, другие селективные негативные регуляторы рецепторов эстрогенов (SERD), ингибиторы фарнезилтрансферазы, антитела к VEGF-A, антитела к ErbB3 (Her3), ингибиторы протеасом, ингибиторы протеинкиназы Сβ, антитела к IGF-1R (рецептор инсулиноподобного ростового фактора 1), антитела к HER2 (рецептор эпидермального фактора роста человека, 2 типа), SERM (селективные модуляторы рецептора эстрогена), ингибиторы IGF (инсулиноподобный ростовой фактор), антитела к IgG и тому подобное. Репрезентативные примеры противоопухолевых агентов для лечения случаев рака или опухолей могут включать, но не ограничиваются этим, цисплатин, карбоплатин, SHP, недаплатин, оксалиплатин, лабоплатин, доцетаксел, паклитаксел, доксорубицин, этопозид, митоксантрон, винкристин, винбластин, гемцитабин, циклофосфамид, хлорамбуцил, кармустин, метотрексат, фторурацил, актиномицин, эпирубицин, антрациклин, блеомицин, митомицин-С, иринотекан, топотекан, тенипозид, интерлейкин, интерферон, тремелимумаб, ипилимумаб, пембролизумаб, ниволумаб, авелумаб, дурвалумаб, атезолизумаб, IPH 52, IPH 53, CPI-006, плозализумаб, MLN1202, цетуксимаб, лапатиниб, эрлотиниб, гефитиниб, нератиниб, трастузумаб, адо-трастузумаб эмтанзин, пертузумаб, MCLA-128, анастразол, ралоксифен, G1T38, тамоксифен, гозерелин, энзалутамид, вориностат, энтиностат, сунитиниб, пазопаниб, бевацизумаб, ранибизумаб, пегаптаниб, цедираниб, дазатиниб, GDC-0980, гедатолисиб, алпелисиб, ВКМ120, копанлисиб, AZD8835, GDC-0941, таселисиб, темсиролимус, эверолимус, сапанисертиб, AZD5363, МК2206, панитумумаб, пембролизумаб, сорафениб, палбоциклиб, абемациклиб, рибоциклиб, кризотиниб, довитиниб, руксолитиниб, азацитидин, СС-486, ингибитор HSP90 ганетеспиб, Debio 1347, эрдафитиниб, витусертиб, алисертиб, селуметиниб, GS-5829, GSK525762, MLN9708, GDC-0810, AFP464, типифарниб, серибантумаб, бортезомиб, энзастаурин, AVE 1642, ксентузумаб, далотузумаб, AMG 479 и тому подобное.
Лечение ассоциированных с аденозиновыми рецепторами заболеваний, определенных далее, может быть применено в виде монотерапии или может включать в себя, помимо соединения по изобретению, традиционную хирургию, или лучевую терапию, или химиотерапию, или иммунотерапию. Такая химиотерапия может включать применение одного или более чем одного из следующих химиотерапевтических средств: цисплатина (DDP), карбоплатина (СВР), 1,2-диаминоциклогексан(сульфато)платины (SHP), недаплатина, оксалиплатина (ОХА), лабоплатина, доцетаксела, паклитаксела, доксорубицина, этопозида или митоксантрона. Такие иммунотерапевтические средства могут включать один или более чем один из следующих противоопухолевых агентов: (1) антитело к CTLA-4; (2) антитело к PD-1; (3) антитело к PD-L1; (4) антитело к CD73; (5) антитело к CD39; или (6) антитело к CCR2.
В частности, антителом к CTLA-4 является тремелимумаб (описанный в US 6682736). Согласно другому аспекту изобретения, в частности, антителом к CTLA-4 является ипилимумаб (поставляемый на рынок компанией Bristol Myers Squib как YERVOY®).
В частности, антитело к PD-L1 представляет собой антитело, описанное в US 20130034559 (MedImmune). Согласно другому аспекту изобретения, в частности, антитело к PD-L1 представляет собой антитело, описанное в US 2010/0203056 (Genentech/Roche). Согласно другому аспекту изобретения, в частности, антитело к PD-L1 представляет собой антитело, описанное в US 20090055944 (Medarex). Согласно другому аспекту изобретения, в частности, антитело к PD-L1 представляет собой антитело, описанное в US 20130323249 (Sorrento Therapeutics).
В частности, антителом к PD-1 является MRK-3475 (Merck). Согласно другому аспекту изобретения, в частности, антителом к PD-1 является ниволумаб, или антитело к PD-1 представляет собой антитело, описанное в WO 2006/121168 или US 8008449 (Medarex). Согласно другому аспекту изобретения, в частности, антитело к PD-1 представляет собой антитело, описанное в WO 2009/101611 (CureTech). Согласно другому аспекту изобретения, в частности, антитело к PD-1 представляет собой антитело, описанное в WO2012/145493 (Amplimmune). Согласно другому аспекту изобретения, в частности, антитело к PD-1 представляет собой антитело, описанное в US 7488802 (Wyeth/Medlmmune). Согласно другому аспекту изобретения, в частности, антитело к PD-1 представляет собой антитело, описанное в US 20130280275 (Board of Regents, Univ. of Texas). Согласно другому аспекту изобретения, в частности, антитело к PD-1 представляет собой антитело, описанное в WO 99/42585 (Agonox), WO 95/12673 и WO 95/21915.
В частности, антителом к CD39 является IPH52 (Innate Pharmaceuticals).
В частности, антителом к CD73 является CPI-006 (Corvus Pharmaceuticals) или IPH53 (Innate Pharmaceuticals).
В частности, антителом к CCR2 является плозализумаб (Takeda Pharmaceuticals International Со.) или MLN1202 (Millennium Pharmaceuticals).
Согласно этому аспекту изобретения предложена комбинация, подходящая для применения в лечении ассоциированного с аденозиновыми рецепторами заболевания, в особенности, рака, содержащая соединение формулы (I), определенное ранее, или его фармацевтически приемлемую соль и любое одно или более чем одно из химиотерапевтических средств, перечисленных выше, и/или любое одно или более чем одно из иммунотерапевтических средств, перечисленных выше под номерами (1)-(6).
Например, соединения по настоящему изобретению могут быть представлены в комбинации с антителом к PD1/PD-L1. В некоторых конкретных воплощениях, соединения по настоящему изобретению могут быть представлены в комбинации с антителом к PD1/PD-L1 и, кроме того, в комбинации с антителом к CTLA-4, CD38, CD73 или CCR2.
Согласно этому аспекту настоящего изобретения предложена комбинация, подходящая для применения в лечении рака, содержащая соединение формулы (I), определенное ранее, или его фармацевтически приемлемую соль и любой из иммуномодуляторов или противоопухолевых агентов, перечисленных выше.
Таким образом, согласно другому аспекту настоящего изобретения предложены соединение формулы (I) или его фармацевтически приемлемая соль в комбинации с иммуномодулятором или химиотерапевтическими средствами, выбранными из средств, перечисленных выше.
Когда в данном описании используется термин «комбинация», следует понимать, что он относится к одновременному, раздельному или последовательному введению. В некоторых воплощениях «комбинация» относится к одновременному введению. Согласно другому аспекту настоящего изобретения «комбинация» относится к раздельному введению. Согласно другому аспекту настоящего изобретения «комбинация» относится к последовательному введению. Если введение осуществляют последовательно или раздельно, то задержка при введении второго компонента не должна приводить к утрате положительного эффекта комбинации.
Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с иммуномодулятором или противоопухолевым агентом, выбранным из агентов, перечисленных выше, вместе с фармацевтически приемлемым разбавителем или носителем.
Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с иммуномодулятором или противоопухолевым агентом, выбранным из веществ, перечисленных выше, вместе с фармацевтически приемлемым разбавителем или носителем, для применения в получении иммуномодулирующего или противоракового эффекта.
Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с иммуномодулятором или противоопухолевым агентом, выбранным из веществ, перечисленных выше, вместе с фармацевтически приемлемым разбавителем или носителем, для применения в лечении NSCLC, RCC, рака предстательной железы или рака молочной железы (и т.д.).
Согласно другому аспекту настоящего изобретения предложен набор, содержащий соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с иммуномодулятором или противоопухолевым агентом, выбранным из веществ, перечисленных выше.
Согласно другому аспекту настоящего изобретения предложен набор, содержащий:
a) соединение формулы (I) или его фармацевтически приемлемую соль в первой единичной лекарственной форме;
b) иммуномодулятор или противоопухолевый агент, выбранный из веществ, перечисленных выше, во второй единичной лекарственной форме; и
c) контейнер для размещения в нем указанных первой и второй лекарственных форм.
В дополнение к их применению в терапевтической медицине, соединения формулы (I) или их фармацевтически приемлемая соль также полезны в качестве фармакологических инструментов при разработке и стандартизации тест-систем in vitro и in vivo с целью оценки активности или экспрессии аденозиновых рецепторов на лабораторных животных, таких как кошки, собаки, кролики, обезьяны, крысы и мыши, в рамках поиска новых терапевтических агентов.
В случае других упомянутых выше признаков, касающихся фармацевтической композиции, процесса, способа, применения и получения лекарственного средства, также применимы альтернативные и предпочтительные воплощения соединений по настоящему изобретению, описанных в данной заявке.
Способ лечения
Согласно настоящему изобретению предложен способ лечения заболевания, ассоциированного с аденозиновыми рецепторами (включая, например, А1, А2а и/или A2b, в частности, А2а), путем введения субъекту терапевтически эффективного количества одного или более соединений, их фармацевтически приемлемых солей или фармацевтической композиции по настоящему изобретению.
Использованный в данном описании термин «заболевание, ассоциированное с аденозиновыми рецепторами» или «AR-ассоциированное заболевание» относится к заболеванию, начало или развитие которого либо и то, и другое, ассоциировано с геномными изменениями, экспрессией, сверхэкспрессией, деградацией или активностью AR (включая, например, А1, А2а и/или A2b, в особенности А2а), в зависимости от обстоятельств. Примеры включают, но не ограничиваются этим, воспалительные расстройства, рак, болезнь Паркинсона, эпилепсию, церебральную ишемию и инсульт, депрессию, когнитивную недостаточность, инфекцию ВИЧ, ADA-SCID, острую сердечную недостаточность (AHF) и хроническую сердечную недостаточность, хроническую обструктивную болезнь легких (COPD), астму и другие заболевания. В некоторых воплощениях AR-ассоциированное заболевание относится к заболеванию, лечение которого будет проходить путем ингибирования действия аденозинового рецептора.
В некоторых воплощениях AR-ассоциированое заболевание представляет собой рак, предпочтительно AR-экспрессирующий рак или AR-сверхэкспрессирующий рак. «AR-экспрессирующим раком» является рак, в развитии которого принимают участие раковые клетки или опухолевые клетки, имеющие такой белок, как AR, например, А2а, А1 и/или A2b, присутствующий на их клеточной поверхности. «AR-сверхэкспрессирующим раком» является рак, который характеризуется значительно более высокими уровнями такого белка, как AR, например, А2а, А1 и/или A2b, на клеточной поверхности раковой или опухолевой клетки по сравнению с нераковой клеткой ткани того же типа. Такая сверхэкспрессия может быть обусловлена амплификацией гена или усиленной транскрипцией или трансляцией. Экспрессию или сверхэкспрессию аденозиновых рецепторов можно определить в диагностическом или прогностическом анализе, оценивая повышение уровней белков AR, присутствующих на поверхности клетки (например, посредством иммуногистохимического (IHC) анализа). Альтернативно или дополнительно можно измерить уровни нуклеиновой кислоты, кодирующей AR, в клетке, например, посредством флуоресцентной гибридизации in situ (FISH; см. заявку WO 98/45479, опубликованную в октябре 1998 г.), методов саузерн-блоттинга или полимеразной цепной реакции (ПЦР), таких как количественная ПЦР в режиме реального времени (РВ-ПЦР) (Methods, 132: 73-80 (1990)). Помимо вышеуказанных анализов, специалисту в данной области техники доступны различные анализы in vivo. Например, клетки организма пациента можно подвергнуть действию антитела, которое возможно помечено детектируемой меткой, например, радиоактивным изотопом, и можно оценить связывание антитела с клетками пациента, например, путем внешнего сканирования на предмет радиоактивности или путем анализа биоптата, отобранного у пациента, ранее подвергавшегося воздействию данного антитела.
В частности, раковые заболевания включают, но не ограничиваются этим, рак легкого (например, немелкоклеточный рак легкого (NSCLC), мелкоклеточный рак легкого, аденокарциному легких, крупноклеточный рак легкого, плоскоклеточный рак легкого), почечноклеточную карциному (RCC), рак предстательной железы, рак молочной железы, рак яичников, рак эндометрия, рак шейки матки, рак кости, рак матки, рак толстой кишки, лейкоз, глиобластому, меланому, хондросаркому, рак головного мозга, холангиокарциному, остеосаркому, лимфому, аденому, миелому, гепатоклеточную карциному, адренокортикальную карциному, рак поджелудочной железы, рак мочевого пузыря, рак печени, рак желудка, колоректальный рак, рак пищевода, рак яичка, рак кожи, виды рака почки, мезотелиому, нейробластому, рак щитовидной железы, виды рака головы и шеи, виды рака пищевода, виды рака глаза, рак носоглотки или рак полости рта. В некоторых воплощениях рак представляет собой NSCLC, RCC, рак предстательной железы или рак молочной железы. Стадия развития рака, упомянутого в данном описании, может быть любой, если не указано иное. В некоторых воплощениях рак представляет собой рак на ранних стадиях развития. В некоторых воплощениях рак представляет собой локально распространенный рак. В некоторых воплощениях рак представляет собой локально распространенный и/или метастазирующий рак. В некоторых воплощениях рак представляет собой инвазивный рак. В некоторых воплощениях рак представляет собой рак, резистентный к существующим видам терапии.
В некоторых воплощениях соединения или их фармацевтически приемлемые соли по настоящему изобретению обладают способностью лечить рак (например, NSCLC, RCC, рак предстательной железы, рак молочной железы). Помимо этого, соединения по настоящему изобретению или их фармацевтически приемлемые соли также могут быть полезны в лечении других ассоциированных с аденозиновыми рецепторами заболеваний, например, болезни Паркинсона, эпилепсии, церебральной ишемии и инсульта, депрессии, когнитивной недостаточности, инфекции ВИЧ, ADA-SCID, AHF и хронической сердечной недостаточности, хронической обструктивной болезни легких (COPD) или астмы.
Использованные в данном описании термины «лечение» и «подвергать лечению» относятся к реверсированию, облегчению, задержке начала или подавлению развития заболевания или расстройства либо одного или нескольких его симптомов, которые изложены в данном описании. В некоторых воплощениях лечение может быть проведено после развития одного или более симптомов. В других воплощениях лечение может быть проведено при отсутствии симптомов. Например, лечение может быть проведено в отношении восприимчивого индивида до начала проявления симптомов (например, с учетом истории симптомов и/или с учетом генетических факторов или других факторов восприимчивости). Лечение также может быть продолжено после исчезновения симптомов, например, с целью выявления или отсрочки их рецидива.
Терапевтически эффективное количество соединения или его фармацевтически приемлемых солей, предложенных в данной заявке, будет зависеть от различных факторов, известных в данной области техники, таких как масса тела, возраст, история болезни, применяемые в настоящее время лекарственные средства, состояние здоровья субъекта и возможность перекрестной реактивности, аллергические реакции, чувствительность и неблагоприятные побочные эффекты, а также путь введения и степень развития заболевания. С учетом этих и других обстоятельств или потребностей дозировки могут быть пропорционально снижены или повышены специалистом в данной области техники (например, врачом или ветеринаром).
Применение соединений
В некоторых воплощениях настоящего изобретения предложено применение соединений, их фармацевтически приемлемых солей или фармацевтической композиции по настоящему изобретению в изготовлении лекарственных средств для лечения AR-ассоциированных заболеваний. Типичные AR-ассоциированные заболевания включают, но не ограничиваются этим, раковые (например, NSCLC, RCC, рак предстательной железы или молочной железы) и другие заболевания.
В такой ситуации, согласно настоящему изобретению также предложен способ скрининга пациента, подходящего для лечения только соединениями или фармацевтической композицией по настоящему изобретению либо в комбинации с другими ингредиентами (например, вторым активным ингредиентом, например, противоопухолевым агентом). Способ включает секвенирование материала из опухолевых образцов от пациентов и детектирование накопления или активации AR.
Таким образом, согласно другому аспекту настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль, которые определены ранее, для применения в качестве лекарственного средства.
Согласно другому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее, в изготовлении лекарственного средства для модулирования аденозиновых рецепторов у теплокровного животного, такого как человек.
Термин «модулировать», «модулирующий» или «модулирование» при использовании применительно к аденозиновым рецепторам относится к действию или результату изменения экспрессии, деградации и/или активности аденозиновых рецепторов.
Согласно другому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее, в изготовлении лекарственного средства для лечения AR-ассоциированных заболеваний у теплокровного животного, такого как человек.
Согласно этому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее, в изготовлении лекарственного средства для получения противоракового эффекта у теплокровного животного, такого как человек.
Согласно другому признаку настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее, в изготовлении лекарственного средства для применения в лечении NSCLC, RCC, рака предстательной железы или молочной железы.
Согласно другому признаку настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее, в изготовлении лекарственного средства для применения в лечении рака молочной железы.
Согласно другому признаку этого аспекта настоящего изобретения предложен способ модулирования аденозиновых рецепторов у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее.
Согласно другому признаку этого аспекта настоящего изобретения предложен способ лечения AR-ассоциированных заболеваний у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее.
Согласно другому признаку этого аспекта настоящего изобретения предложен способ получения противоракового эффекта у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее.
Согласно другому особенности этого аспекта настоящего изобретения предложен способ получения противоракового эффекта у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий (1) определение того имеет или не имеет теплокровное животное AR-экспрессирующий рак и (2), если это так, то введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее.
Согласно дополнительной особенности этого аспекта настоящего изобретения предложен способ лечения NSCLC, RCC, рака предстательная железа или молочной железы у теплокровного животного, такого как человек, нуждающегося в таком лечении, включающий введение указанному животному эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, которые определены ранее.
Согласно другому аспекту настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль, которые определены ранее, для применения в модулировании AR у теплокровного животного, такого как человек.
Согласно другому аспекту настоящего изобретения, предложено соединение формулы (I) или его фармацевтически приемлемая соль, которые определены ранее, для применения в лечении AR-ассоциированный заболеваний у теплокровного животного, такого как человек.
Согласно этому аспекту настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль, которые определены ранее, для применения в получении противоракового эффекта у теплокровного животного, такого как человек.
Согласно другой особенности настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль, которые определены ранее, для применения в лечении NSCLC, RCC, рака предстательной железы или молочной железы.
ПРИМЕРЫ
Следующие далее разделы описания служат для дополнительного разъяснения общих способов по настоящему изобретению. Соединения по настоящему изобретению могут быть получены способами, известными в данной области техники. Следующее далее описание подробно иллюстрирует способы получения предпочтительных соединений по настоящему изобретению. Однако, оно никаким образом не ограничивает способы получения соединений по настоящему изобретению.
Пример 01. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-((3-фторпиридин-2-ил)метил)пиразин-2-карбоксамида (соединения 01)
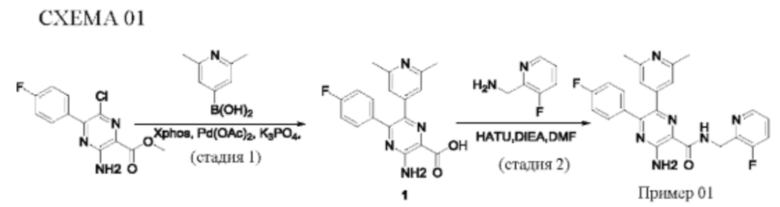
Стадия 1. Метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксилат
К раствору метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилата (200 мг; 0,71 ммоль; 1 экв.) и (2,6-диметилпиридин-4-ил)бороновой кислоты (214,4 мг; 1,42 ммоль; 2 экв.) в н-BuOH (25 мл) добавляли xPhos (67,7 мг; 0,14 ммоль; 0,2 экв.) и Pd(OAc)2 (31,9 мг; 0,14 ммоль; 0,2 экв.), K3PO4 (301,4 мг; 1,42 ммоль; 2 экв.). После этого выполняли перемешивание в течение 2 ч при 100°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 10:1), получая метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксилат (230 мг; 36,8%) в виде желтого твердого вещества. LCMS: m/z (ESI (электрораспылительная ионизация)), М+=339,2.
Стадия 2. 3-Амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-[(3-фторпиридин-2-ил)метил]пиразин-2-карбоксамид (соединение 01)
Раствор/смесь 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-пиразин-2-карбоновой кислоты (215 мг; 0,64 ммоль; 1 экв.) и 1-(3-фторпиридин-2-ил)метанамина (96,2 мг; 0,76 ммоль; 1,20 экв.), HATU (483,2 мг; 1,3 ммоль; 2,0 экв.), DIEA (246,4 мг; 1,9 ммоль; 3,0 экв.) в DMF (10 мл) перемешивали в течение 2 ч при 20°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (215 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)+0,1% NH3.H2O), подвижная фаза В: ACN (ацетонитрил); скорость потока: 20 мл/мин; градиент: от 53% В до 62% В за 7 мин; 220/254 нм; Rt (время удерживания): 6,1 мин), получая 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-[(3-фторпиридин-2-ил)метил]-пиразин-2-карбоксамид (соединение 01) (83,3 мг; 29,3%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), М+=447,2. 1Н ЯМР (400 МГц, метанол-d4): δ 2.4 (s, 6Н), 4.8 (d, J=1,7 Гц, 2Н), 7.1-7.2 (m, 4Н), 7.4 (dt, J=8,6; 4,4 Гц, 1H), 7.4-7.5 (m, 2Н), 7.6 (ddd, J=9,9; 8,4; 1,3 Гц, 1H), 8.4 (dt, J=4,8; 1,4 Гц, 1H).
Пример 02. Получение 3-амино-N-[(2,6-дифторфенил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамида (соединения 02)
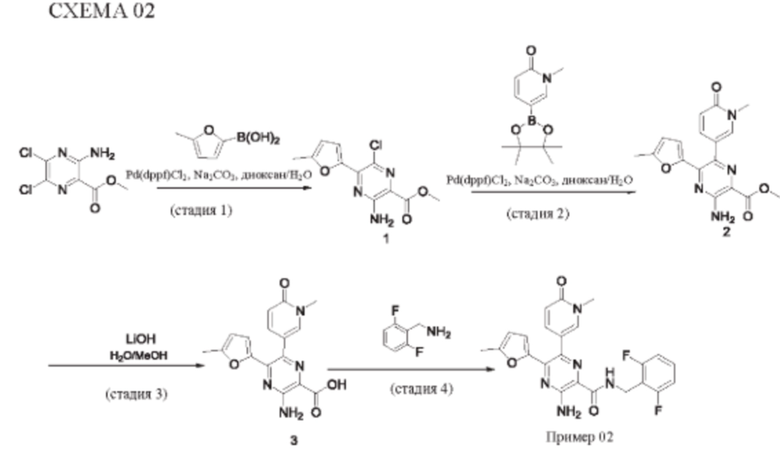
Стадия 1. Метил 6-хлор-3-метил-5-(5-метилфуран-3-ил)пиразин-2-карбоксилат
Смесь метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (1 г; 4,5 ммоль; 1 экв.) и (5-метилфуран-2-ил)бороновой кислоты (0,6 г; 4,8 ммоль) и Pd(dppf)Cl2 (0,3 г; 0,5 ммоль) и Na2CO3 (1,0 г; 9,0 ммоль) в смеси диоксан/H2O (40 мл) перемешивали в течение 4 часов при 90°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали смесью DCM:MeOH (1:1) (3 ×10 мл). Фильтрат экстрагировали CH2Cl2 (3 × 10 мл). Затем органический слой сушили, используя Na2SO4, и раствор концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (CH2Cl2:EtOAc (1:1)), получая метил 6-хлор-3-метил-5-(5-метилфуран-3-ил)-пиразин-2-карбоксилат (125 мг; 7,1%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=268,2.
Стадия 2. Метил 3-метил-6-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-5-(5-метилфуран-3-ил)пиразин-2-карбоксилат
Смесь метил 6-хлор-3-метил-5-(5-метилфуран-3-ил)пиразин-2-карбоксилата (65 мг; 0,24 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (56,4 мг; 0,24 ммоль; 1,00 экв.) и Pd(dppf)Cl2 (17,5 мг; 0,024 ммоль; 0,10 экв.) и Na2CO3 (50,88 мг; 0,48 ммоль; 2 экв.) в смеси диоксан/Н20 (6/1, 3 мл) перемешивали в течение 10 часов при 90°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали смесью CH2Cl2:МеОН (1:1) (3 × 10 мл). Фильтрат промывали 20 мл H2O и экстрагировали CH2Cl2 (3 × 20 мл). Водный слой сушили с использованием Na2SO4 и концентрировали при пониженном давлении. Затем остаток растворяли в этилацетате (10 мл). Выпавшие в осадок твердые вещества собирали фильтрованием и промывали диэтиловым эфиром (3×3 мл) и полученное твердое вещество сушили под вакуумом, получая метил 3-метил-6-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-5-(5-метилфуран-3-ил)пиразин-2-карбоксилат (55 мг; 63,2%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=341,2.
Стадия 3. 3-Метил-6-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-5-(5-метилфуран-3-ил)пиразин-2-карбоновая кислота
Метил 3-метил-6-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-5-(5-метилфуран-3-ил)пиразин-2-карбоксилат (90 мг; 0,3 ммоль; 1 экв.) растворяли в МеОН (9 мл) и для проведения реакции брали 1 мл. К этому раствору добавляли LiOH (25,2 мг; 1,1 ммоль; 4,0 экв.) и H2O (1,8 мл) при 0°С и перемешивали в течение 6 часов при комнатной температуре. Смесь доводили до рН 6, используя HCl (водн.). Раствор концентрировали при пониженном давлении и получали 3-метил-6-(1-метил-2-оксо-1,2-дигидропиридин-4-ил)-5-(5-метилфуран-3-ил)пиразин-2-карбоновую кислоту (85 мг; 96,6%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=327,1.
Стадия 4. 3-амино-N-[(2,6-дифторфенил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамид (соединение 02)
К перемешиваемому раствору 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,3 ммоль; 1 экв.) и DIEA (116,1 мг; 0,9 ммоль; 3,00 экв.) в DMSO (4 мл) порциями добавляли HATU (342 мг; 0,9 ммоль; 3,0 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 10 мин при комнатной температуре. Затем по каплям добавляли 1-(2,6-дифторфенил)метанамин (107,3 мг; 0,75 ммоль; 2,5 экв.) и перемешивали в течение 10 часов при комнатной температуре. Реакцию гасили путем добавления рассола (30 мл) при комнатной температуре. Полученное твердое вещество собирали фильтрованием и очищали препаративной TLC (CH2Cl2/EtOAc, 1:1), получая 30 мг неочищенного продукта, который очищали препаративной HPLC (колонка: препаративная колонка XBridge OBD С18, 5 мкм, 19*150 мм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)+0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 37% В до 37% В за 8 мин; 220/254 нм; Rt: 7,33 мин), получая 3-амино-N-[(2,6-дифторфенил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамид (соединение 02) (7,4 мг; 6,49%) в виде желтого твердого вещества. LCMS m/z (ESI) [М+Н]+=452,3. 1Н ЯМР (400 МГц, метанол-d4) δ 2.25 (s, 3Н), 3.64 (s, 3Н), 4.70 (s, 2Н), 6.18 (d, J=3,4 Гц, 1H), 6.55 (d, J=9,2 Гц, 1H), 6.81 (d, J=3,3 Гц, 1Н), 6.98 (t, J=7,9 Гц, 2Н), 7.39-7.28 (m, 1H), 7.52 (dd, J=9,2; 2,5 Гц, 1Н), 7.92 (d, J=2,5 Гц, 1H).
Пример 04. Получение N-((3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-ил)метил)-2,6-дифторбензамида (соединения 04)
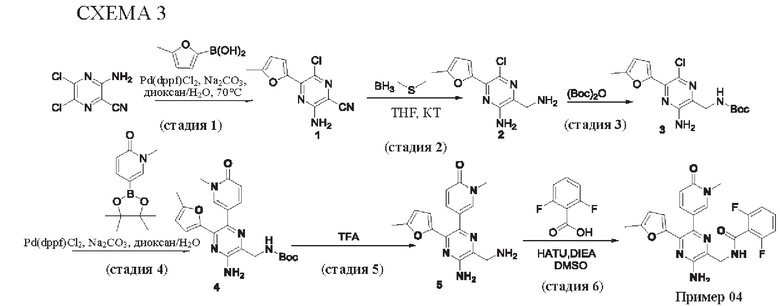
Стадия 1. 3-Амино-5-хлор-6-(5-метилфуран-2-ил)пиразин-2-карбонитрил
Смесь 3-амино-5,6-дихлорпиразин-2-карбонитрила (250 мг; 1,3 ммоль; 1 экв.) и (5-метилфуран-2-ил)бороновой кислоты (166,6 мг; 1,3 ммоль; 1,00 экв.) и Pd(dppf)Cl2 (96,8 мг; 0,1 ммоль; 0,1 экв.) и Na2CO3 (280,4 мг; 2,7 ммоль; 2 экв.) в смеси диоксан/Н2О (15 мл) перемешивали в течение 6 часов при 70°С в атмосфере азота.
Полученную смесь фильтровали, осадок на фильтре промывали смесью CH2Cl2:МеОН (1:1) (3×10 мл). Фильтрат промывали 20 мл H2O и экстрагировали CH2Cl2 (3 × 20 мл). Органический слой сушили с использованием Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с элюированием смесью РЕ:(CH2Cl2/EtOAc (1:1)) (1:1), получая 3-амино-5-хлор-6-(5-метилфуран-2-ил)пиразин-2-карбонитрил (130 мг; 28,9%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=235,1.
Стадия 2. 3-(Аминометил)-6-хлор-5-(5-метилфуран-2-ил)пиразин-2-амин
Смесь 3-амино-5-хлор-6-(5-метилфуран-2-ил)пиразин-2-карбонитрила (240 мг; 1,0 ммоль; 1 экв.) в THF (12 мл) перемешивали и к раствору смеси медленно добавляли DMSO (155,4 мг; 2,1 ммоль; 2,0 экв.) при 0°С и перемешивали в течение 6 часов при комнатной температуре. Реакцию гасили путем добавления Н2О (2 мл) при 0°С, затем добавляли раствор Na2CO3 и перемешивали в течение 30 мин при комнатной температуре, получая 3-(аминометил)-6-хлор-5-(5-метилфуран-2-ил)пиразин-2-амин (240 мг; 96,34%) в виде желтой жидкости. Неочищенный продукт использовали на следующей стадии непосредственно без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=239,2.
Стадия 3. трет-Бутил N-[[3-амино-5-хлор-6-(5-метилфуран-3-ил)пиразин-2-ил]метил]карбамат
К 3-(аминометил)-6-хлор-5-(5-метилфуран-2-ил)пиразин-2-амину (238 мг; 1,0 ммоль; 1,0 экв.) в DCM (10 мл) добавляли (ВОС)2О (438,9 мг; 2,0 ммоль; 2,0 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 10 часов при комнатной температуре. Полученную смесь гасили водой (20 мл) и экстрагировали CH2Cl2 (3 × 20 мл). Объединенные органические слои промывали Н2О (3 × 10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении и получали трет-бутил N-[[3-амино-5-хлор-6-(5-метилфуран-3-ил)пиразин-2-ил]метил]карбамат (150 мг; 41,83%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=339,2.
Стадия 4. трет-Бутил N-[[3-амино-5-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-6-(5-метилфуран-3-ил)пиразин-2-ил]метил]карбамат
трет-Бутил N-[[3-амино-5-хлор-6-(5-метилфуран-3-ил)пиразин-2-ил]метил]-карбамат (120 мг; 0,34 ммоль; 1 экв.) добавляли в смесь диоксан/H2O (10 мл), затем в атмосфере N2 добавляли 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-он (124,9 мг; 0,5 ммоль; 1,50 экв.), Pd(dppf)Cl2 (25,9 мг; 0,1 ммоль) и Na2CO3 (75,1 мг; 0,7 ммоль; 2 экв.) и перемешивали в течение 10 часов при 90° в атмосфере азота. Реакционный раствор концентрировали и очищали препаративной TLC (CH2Cl2/EtOAc, 1:1), получая трет-бутил N-[[3-амино-5-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-6-(5-метилфуран-3-ил)пиразин-2-ил]метил]карбамат (35 мг; 23,53%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=412,3.
Стадия 5. 5-[6-Амино-5-(аминометил)-3-(5-метилфуран-3-ил)пиразин-2-ил]-1-метил-1,2-дигидропиридин-2-он
трет-Бутил N-[[3-амино-5-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-6-(5-метилфуран-3-ил)пиразин-2-ил]метил]карбамат (120 мг; 1 экв.) добавляли в DCM (5 мл) и TFA (2,5 мл). Полученный раствор перемешивали в течение 10 часов при комнатной температуре в воздушной атмосфере. Смесь доводили до рН 7 насыщенным раствором Na2CO3 (водн.). Полученную смесь экстрагировали CH2Cl2 (3 × 30 мл). Объединенные органические слои промывали H2O (2×10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. В результате получали 5-[6-амино-5-(аминометил)-3-(5-метилфуран-3-ил)-пиразин-2-ил]-1-метил-1,2-дигидропиридин-2-он (80 мг; 84,58%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=312,2.
Стадия 6. N-((3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-ил)метил)-2,6-дифторбензамид (соединение 04)
К перемешиваемому раствору 5-[6-амино-5-(аминометил)-3-(5-метилфуран-3-ил)пиразин-2-ил]-1-метил-1,2-дигидропиридин-2-она (80 мг; 0,26 ммоль; 1 экв.) и 2,6-дифторбензойной кислоты (60,9 мг; 0,39 ммоль; 1,5 экв.) в DMSO (1 мл) порциями добавляли HATU (197 мг; 0,52 ммоль; 2,0 экв.) и DIEA(67 мг; 0,52 ммоль; 2,0 экв.) при комнатной температуре в воздушной атмосфере. Полученный раствор перемешивали в течение 10 часов при комнатной температуре. Полученную смесь гасили рассолом (20 мл), водный раствор экстрагировали CH2Cl2 (3 × 10 мл). Органические слои сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали препаративной TLC (DCM:MeOH, 20:1), получая N-[[3-амино-5-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-6-(5-метилфуран-3-ил)пиразин-2-ил]метил]-2,6-дифторбензамид (соединение 04) (112 мг; 93,7%) в виде светло-желтого твердого вещества. LCMS m/z (ESI) [М+Н]+=452,2. 1Н ЯМР (400 МГц, метанол-d4) δ 2.22-2.33 (m, 3Н), 3.36 (s, 14Н), 3.63 (s, 3Н), 4.66 (s, 2Н), 6.12-6.20 (m, 1Н), 6.67 (d, J=3,3 Гц, 1H), 7.09 (t, J=8,2 Гц, 2Н), 7.41-7.58 (m, 2Н), 7.85 (d, J=2,6 Гц, 1Н).
Пример 05. Получение 3-амино-N-(2,6-дифторбензил)-6-(2,6-диметилпиридин-4-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 05)

Стадия 1. Метил 3-амино-6-хлор-5-(оксазол-2-ил)пиразин-2-карбоксилат
К перемешиваемому раствору метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (500 мг; 2,25 моль; 1 экв.) и 2-(трибутилстаннил)-1,3-оксазола (806,5 мг; 2,25 моль; 1,00 экв.) в 1,4-диоксане (20 мл) порциями добавляли LiCl (190,9 мг; 4,50 ммоль; 2 экв.), трициклогексилфосфан (126,3 мг; 0,45 ммоль; 0,2 экв.) и Pd2(dba)3.CHCl3 (466,2 мг; 0,45 ммоль; 0,20 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 4 ч при 140°С в атмосфере азота с облучением микроволнами. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (160 мг; 27,9%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=255,1.
Стадия 2. 3-Амино-6-хлор-5-(оксазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (100 мг; 0,4 ммоль; 1 экв.) в МеОН (10 мл) и воде (1 мл) порциями добавляли LiOH.H2O (49,4 мг; 1,2 ммоль; 2,0 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 ч при комнатной температуре. Полученную смесь концентрировали под вакуумом. Остаток очищали обращенно-фазовой флэш-хроматографией в приведенных далее условиях: колонка: С18 силикагель; подвижная фаза: МеОН в воде, градиент от 10% до 50% за 35 мин; детектор: УФ, 254 нм, получая 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (50 мг; 52,9%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=241,1; 1H ЯМР (300 МГц, DMSO-d6) δ 7.50 (d, J=0,8 Гц, 1H), 8.34 (d, J=0,8 Гц, 1H).
Стадия 3. 3-Амино-6-хлор-N-(2,6-дифторбензил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемой смеси 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (150 мг; 0,62 ммоль; 1 экв.) и DIEA (241,7 мг; 1,87 ммоль; 3 экв.) в DMSO (10 мл) порциями добавляли 1-(2,6дифторфенил)метанамин (133,9 мг; 0,94 ммоль; 1,50 экв.) и HATU (355,6 мг; 0,94 ммоль; 1,5 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 05) (140 мг; 48,51%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=366,1; 1Н ЯМР (300 МГц, DMSO-d6) δ 9.10 (t, J=5,7 Гц, 1H), 8.42 (s, 1H), 7.88 (s, 2Н), 7.58 (s, 1H), 7.49-7.28 (m, 1H), 7.10 (t, J=8,0 Гц, 2H), 4.57 (d, J=5,8 Гц, 2H).
Стадия 4. 3-Амино-N-(2,6-дифторбензил)-6-(2,6-диметилпиридин-4-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 05)
К перемешиваемой смеси (2,6-диметилпиридин-4-ил)бороновой кислоты (82,6 мг; 550 ммоль; 2,00 экв.) и 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (100 мг; 270 ммоль; 1 экв.) в диоксане (10 мл) порциями добавляли Pd(dppf)Cl2.CH2Cl2 (44,7 мг; 0,05 ммоль; 0,2 экв.) и K3PO4 (232,2 мг; 1,09 ммоль; 4 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 90°С в атмосфере азота. Полученную смесь концентрировали под вакуумом. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-N-[(2,6-дифторфенил)метил]-6-(2,6-диметилпиридин-4-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 05) (40 мг; 33,2%) в виде желтого твердого вещества. FCMS: m/z (ESI), [М+Н]+=437,3; 1H ЯМР (300 МГц, DMSO-d6) δ 9.12 (t, J=5,8 Гц, 1H), 8.26 (s, 1H), 7.95 (s, 2H), 7.46-7.31 (m, 2H), 7.09 (t, J=8,0 Гц, 2H), 7.00 (s, 2H), 4.62 (d, J=5,9 Гц, 2H), 2.40 (s, 6H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 05.
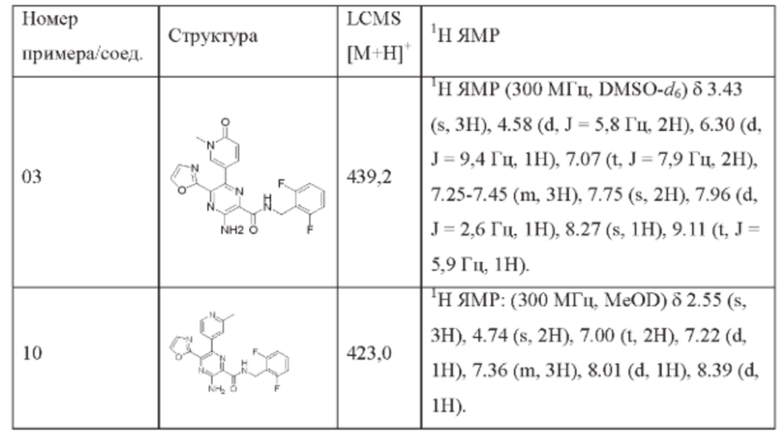
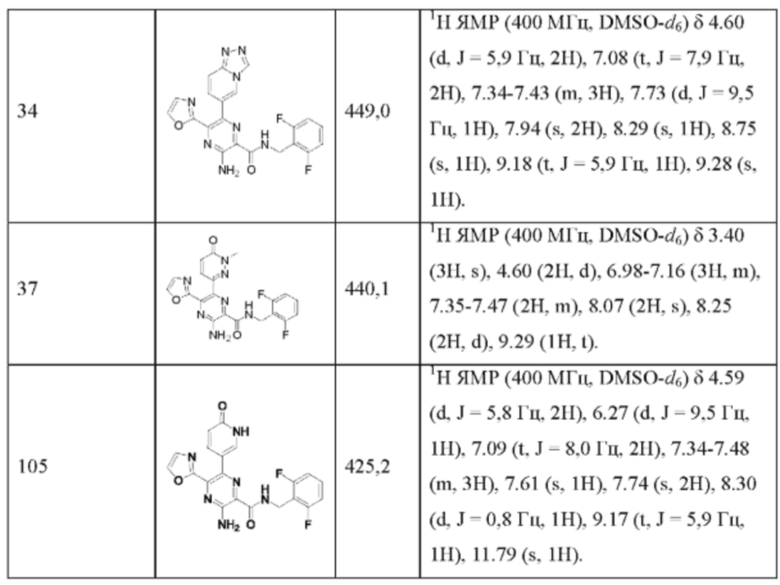
Пример 06. Получение 3-амино-N-(2,6-дифторбензил)-6-(2,6-диметилморфолино)-5-(4-фторфенил)пиразин-2-карбоксамида (соединения 06)
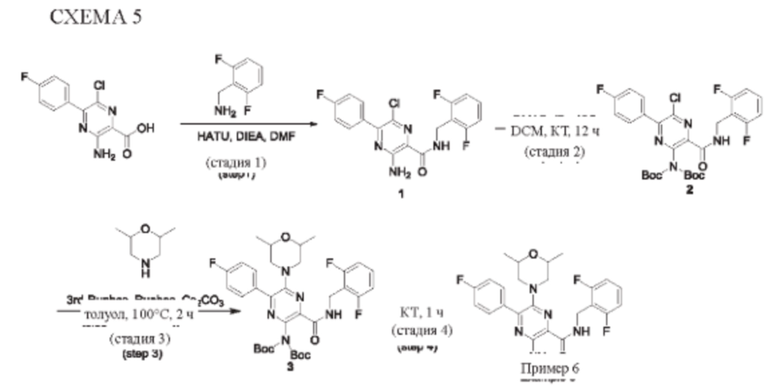
Стадия 1. 3-Амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(4-фторфенил)пиразин-2-карбоксамид
Раствор/смесь 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновой кислоты
(1,2 г; 4,48 ммоль; 1 экв.) и 1-(2,6-дифторфенил)метанамина (1,0 г; 6,99 ммоль; 1,56 экв.) в DMF (25 мл) перемешивали в течение 2 ч при 15°С в воздушной атмосфере. Полученную смесь промывали водой (3 × 10 объемов). Выпавшие в осадок твердые вещества собирали фильтрованием и промывали этиловым эфиром (3×10 мл), получая 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(4-фторфенил)пиразин-2-карбоксамид (1,3 г; 73,82%) в виде коричнево-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=393,2.
Стадия 2. трет-Бутил N-[(трет-бутокси)карбонил]-N-(5-хлор-3-[[(2,6-дифторфенил)метил]карбамоил]-6-(4-фторфенил)пиразин-2-ил)карбамат
В герметично закрываемую пробирку емкостью 40 мл добавляли трет-бутил N-[(трет-бутокси)карбонил]-N-(3-[[(2,6-дифторфенил)метил]карбамоил]-5-(2,6-диметилморфолин-4-ил)-6-(4-метилфенил)пиразин-2-ил)карбамат (500 мг; 1,27 ммоль; 1 экв.), DMAP (13 мг; 0,127 ммоль; 0,1 экв.) и ди-трет-бутилдикарбонат (687 мг; 3,18 ммоль; 2,5 экв.) в DCM (30 мл) при комнатной температуре. Полученный раствор перемешивали в течение 12 часов при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:2), получая трет-бутил N-[(трет-бутокси)карбонил]-N-(5-хлор-3-[[(2,6-дифторфенил)метил]карбамоил]-6-(4-фторфенил)пиразин-2-ил)карбамат (600 мг; 79%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=593,3.
Стадия 3. Получение трет-бутил N-[(трет-бутокси)карбонил]-N-(3-[[(2,6-дифторфенил)метил]карбамоил]-5-(2,6-диметилморфолин-4-ил)-6-(4-фторфенил)пиразин-2-ил)-карбамата
В герметично закрываемую пробирку емкостью 10 мл добавляли трет-бутил N-[(трет-бутокси)карбонил]-N-(5-хлор-3-[[(2,6-дифторфенил)метил]карбамоил]-6-(4-фторфенил)пиразин-2-ил)карбамат (230 мг; 0,39 ммоль; 1 экв.), 2,6-диметилморфолин (134,0 мг; 1,16 ммоль; 3 экв.), Cs2CO3 (252,7 мг; 0,78 ммоль; 2 экв.), RuPhos (2-дициклогексилфосфино-2',6'-диизопропоксибифенил) (36,2 мг; 0,08 ммоль; 0,2 экв.), палладацикл на основе RuPhos 3-го поколения (Gen.3) (32,4 мг; 0,04 ммоль; 0,1 экв.) и толуол (15 мл) при 100°С в течение 12 ч. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:2), получая трет-бутил N-[(трет-бутокси)карбонил]-N-(3-[[(2,6-дифторфенил)метил]карбамоил]-5-(2,6-диметилморфолин-4-ил)-6-(4-фторфенил)пиразин-2-ил)карбамат (30 мг; 11,51%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М-Вос+Н]+=572,3.
Стадия 4. 3-Амино-N-(2,6-дифторбензил)-6-(2,6-диметилморфолино)-5-(4-фторфенил)пиразин-2-карбоксамид (соединение 06)
В круглодонную колбу емкостью 50 мл добавляли трет-бутил N-[(трет-бутокси)карбонил]-N-(3-[[(2,6-дифторфенил)метил]карбамоил]-5-(2,6-диметилморфолин-4-ил)-6-(4-метилфенил)пиразин-2-ил)карбамат (50 мг; 0,07 ммоль; 1 экв.) и TFA (2 мл) в DCM (10 мл) при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (30 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с NH4HCOO3 (10 ммоль/л)+0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 78% В до 78% В за 7 мин; 220/254 нм; Rt: 6,68 мин), получая 3-амино-N-[(2,6-дифторфенил)метил]-6-(2,6-диметилморфолин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамид (соединение 06) (2 мг; 5,6%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=472,3. 1Н (300 МГц, DMSO-d6) δ 1.08 (6Н, s), 2.35 (2Н, t), 3.03 (2Н, d), 3.60 (2Н, d), 4.60 (2Н, d), 7.03-7.15 (4Н, т), 7.29 (2Н, t), 7.39 (1Н, q), 8.07 (2Н, t), 8.57 (1Н, t).
Пример 07. Получение N-[[3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил]метил]-2-фтор-6-(трифторметил)бензамида (соединения 07)
СХЕМА 6
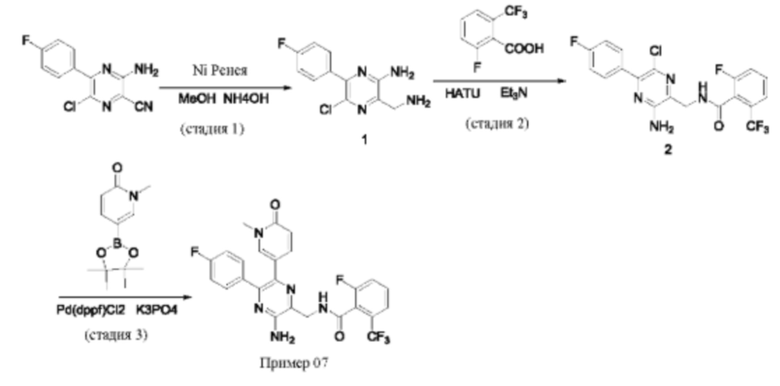
Стадия 1. 3-(Аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амин
К смеси 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрила (500 мг; 2,0 ммоль; 1 экв.) в МеОН (100 мл) порциями добавляли NH4OH (2 мл) и Ni Ренея (10 мг; 0,1 ммоль; 0,1 экв.). Смесь перемешивали в течение 10 часов при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали и фильтрат концентрировали при пониженном давлении. В результате получали 3-(аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амин (560 мг; 87,1%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=253,1.
Стадия 2. N-[[3-Амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-2-фтор-6-(трифторметил)бензамид
К смеси 3-(аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амина (210 мг; 0,8 ммоль; 1 экв.) и 2-фтор-6-(трифторметил)бензойной кислоты (259,4 мг; 1,3 ммоль; 1,5 экв.) в DCM (5 мл) порциями добавляли HATU (632,0 мг; 1,7 ммоль; 2 экв.) и Et3N (252,3 мг; 2,5 ммоль; 3 экв.). Смесь перемешивали в течение 4 часов при комнатной температуре в воздушной атмосфере и гасили водой (10 мл). Полученную смесь экстрагировали CH2Cl2 (3 × 20 мл). Объединенные органические слои промывали H2O (3 × 10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Затем остаток очищали препаративной TLC (РЕ/EtOAc, 2:1), получая N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-2-фтор-6-(трифторметил)бензамид (457 мг; 49,7%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=443,1.
Стадия 3. N-[[3-Амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил]метил]-2-фтор-6-(трифторметил)бензамид (соединение 07)
К смеси N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-2-фтор-6-(трифторметил)бензамида (90 мг; 200 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (167,3 мг; 0,7 ммоль; 3,5 экв.) в смеси диоксан/Н2О (10 мл) порциями добавляли Pd(dppf)Cl2 (44,6 мг; 0,06 ммоль; 0,30 экв.) и K3PO4 (258,9 мг; 1,2 ммоль; 6,0 экв.) в атмосфере азота. Смесь перемешивали в течение 10 часов при 110°С в атмосфере азота и концентрировали под вакуумом. Полученный остаток очищали препаративной TLC (РЕ/EtOAc, 5:4), получая содержащиеся в этом остатке продукты, затем этот неочищенный продукт очищали препаративной HPLC (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с NH4HCOO3 (10 ммоль/л)+0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 34% В до 54% В за 7 мин; 220/254 нм; Rt: 7,08 мин), получая N-[[3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил]метил]-2-фтор-6-(трифторметил)бензамид (соединение 07) (29 мг; 27,1%) в виде белого твердого вещества. LCMS m/z (ESI) [М+Н]+=516,1. 1Н ЯМР (400 МГц, метанол-d4) δ 3.53 (s, 2Н), 4.71 (s, 1H), 6.37 (d, J=9,4 Гц, 1H), 7.13 (t, J=8,8 Гц, 2Н), 7.31 (dd, J=9,4; 2,6 Гц, 1H), 7.53 (dt, J=8,8; 6,0 Гц, 2Н), 7.63 (d, J=7,6 Гц, 1H), 7.66-7.71 (m, 1H), 7.76 (d, J=2,5 Гц, 1Н).
Пример 08. Получение N-[[3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-ил]метил]пиридин-2-карбоксамида (соединения 08)
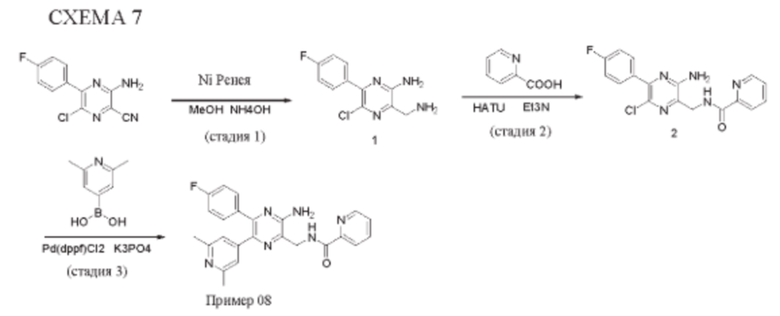
Стадия 1. 3-(Аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амин
3-Амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрил (500 мг; 2,0 ммоль; 1 экв.) добавляли в МеОН (100 мл) и добавляли NH4OH (2 мл), затем в указанную выше смесь медленно добавляли Ni Ренея (10 мг; 0,1 ммоль; 0,1 экв.) и перемешивали в течение 10 часов при комнатной температуре в атмосфере водорода. Полученную смесь концентрировали при пониженном давлении. В результате получали 3-(аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амин (560 мг; 87,1%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=253,2.
Стадия 2. N-[[3-Амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-ил]метил]пиридин-2-карбоксамид
Смесь 3-(аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амина (45 мг; 0,2 ммоль; 1 экв.), пиридин-2-карбоновой кислоты (32,9 мг; 0,3 ммоль; 1,5 экв.), HATU (135,4 мг; 0,4 ммоль; 2,0 экв.) и TEA (60,9 мг; 0,5 ммоль; 3,0 экв.) в DCM (3 мл) перемешивали в течение 4 часов при комнатной температуре в воздушной атмосфере.
Полученную смесь гасили водой (10 мл) и экстрагировали CH2Cl2 (3 × 20 мл). Объединенные органические слои промывали H2O (3 × 10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Затем остаток очищали препаративной TLC (РЕ/EtOAc, 1:2), получая N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]пиридин-2-карбоксамид (53 мг; 79,02%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=358,2.
Стадия 3. Получение N-[[3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-пиразин-2-ил]метил]пиридин-2-карбоксамида (соединения 08)
К смеси N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]пиридин-2-карбоксамида (25 мг; 0,1 ммоль; 1 экв.) и (2,6-диметилпиридин-4-ил)бороновой кислоты (16,2 мг; 0,1 ммоль; 1,5 экв.) в смеси диоксан/H2O (2,0 мл) добавляли Pd(dppf)Cl2 (5,1 мг; 0,01 ммоль; 0,1 экв.) и К3РО4 (44,5 мг; 0,21 ммоль; 3 экв.) в атмосфере азота. Смесь перемешивали в течение 10 часов при 90°С в атмосфере азота. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:1), получая содержащиеся в этом остатке продукты, затем этот неочищенный продукт очищали препаративной HPLC (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с NH4HCOO3 (10 ммоль/л)+0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 36% В до 64% В за 7 мин; 220/254 нм; Rt: 6,97 мин), получая N-[[3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-ил]метил]пиридин-2-карбоксамид (соединение 08) (6,7 мг; 9,4%) в виде белого твердого вещества. LCMS m/z (ESI) [М+Н]+=429,2. 1Н ЯМР (400 МГц, метанол-d4) δ 2.37 (s, 4Н), 4.74 (s, 1H), 7.01-7.20 (m, 2Н), 7.43 (s, 1H), 7.60 (s, 1Н), 8.02 (d, J=7,9 Гц, 1H), 8.18 (d, J=7,8 Гц, 1H), 8.69 (s, 1H).
Пример 09. Получение 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида (соединения 09)
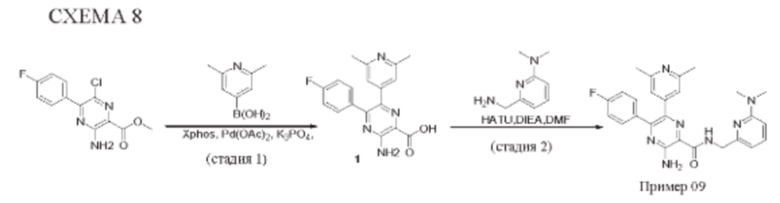
Стадия 1. 3-Амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновая кислота
К раствору метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилата (1 г; 3,55 моль; 1 экв.) и (2,6-диметилпиридин-4-ил)бороновой кислоты (1,1 г; 7,3 моль; 2,1 экв.) в н-BuOH (25 мл) добавляли x-Phos (0,3 г; 0,7 ммоль; 0,2 экв.) и Pd(OAc)2 (0,2 г; 0,7 ммоль; 0,2 экв.), K3PO4 (301,4 мг; 1,42 ммоль; 2 экв.) в атмосфере азота. Смесь перемешивали в течение 2 ч при 100°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 10:1), получая 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновую кислоту (400 мг; 33,30%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=339,0.
Стадия 2. 3-Амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамид (соединение 09)
К раствору 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновой кислоты (150 мг; 0,4 ммоль; 1 экв.), 6-(аминометил)-N,N-диметилпиридин-2-амина (134,1 мг; 0,9 ммоль; 2,0 экв.), HATU (337,1 мг; 0,9 ммоль; 2 экв.) в DMF (5 мл) по каплям добавляли DIEA (171,9 мг; 1,3 ммоль; 3 экв.) в течение 1 мин при 15°С. Полученную смесь перемешивали в течение еще 2 ч при 15°С. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (150 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3.H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 49% В до 69% В за 7 мин; 254/220 нм; Rt: 5,8 мин), получая 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамид (соединение 09) (39,0 мг; 18,6%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=472,3; 1Н ЯМР (400 МГц, DMSO-d6) δ 2.33 (s, 6Н), 2.97 (s, 6Н), 4.48 (d, J=5,6 Гц, 2Н), 6.52 (dd, J=10,2; 7,9 Гц, 2Н), 6.99 (s, 2Н), 7.16-7.26 (m, 2Н), 7.37-7.51 (m, 3Н), 9.20 (t, J=5,7 Гц, 1Н).
Пример 11. Получение 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2- ил)метил)пиразин-2-карбоксамида (соединения 11)
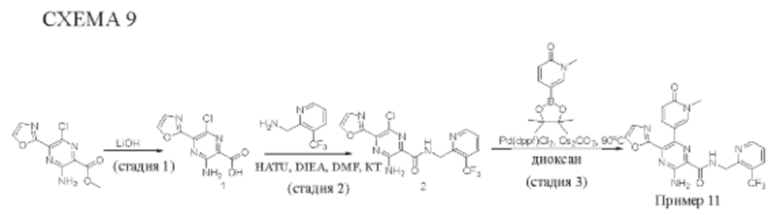
Стадия 1. 3-Амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоновая кислота
К раствору метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (400 мг; 1,57 ммоль; 1 экв.) в МеОН (2 мл) и THF (8 мл) добавляли LiOH.H2O (131,8 мг; 3,14 ммоль; 2 экв.). Полученную смесь перемешивали в течение 2 ч при 40°С в атмосфере азота. Значение рН смеси подводили до 8, используя HCl.H2O. Растворитель удаляли при пониженном давлении. В остатке получали 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (350 мг; 92,6%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=241,1; 1Н ЯМР: (300 МГц, DMSO-d6) δ 7.60 (s, 1H), 7.76 (s, 2Н), 8.44 (s, 1H), 13.68 (s, 1Н).
Стадия 2. 3-Амино-6-хлор-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметил)пиридин-2-ил]метил]пиразин-2-карбоксамид
В раствор 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (150 мг; 0,62 ммоль; 1 экв.) в DCM (15 мл) порциями добавляли 1-[3-(трифторметил)пиридин-2-ил]метанамин (219,6 мг; 1,25 ммоль; 2 экв.), НОВТ (гидроксибензотриазол) (168,5 мг; 1,25 ммоль; 2 экв.) и EDC.HCl (гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида) (239,0 мг; 1,25 ммоль; 2 экв.) в течение 5 мин при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в воздушной атмосфере. Растворитель удаляли при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:1), получая 3-амино-6-хлор-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметил)пиридин-2-ил]метил]пиразин-2-карбоксамид (20 мг; 8,1%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=399,1; 1Н ЯМР: (300 МГц, MeOD) δ 4.93 (s, 2Н), 7.53 (d, 2Н), 8.19 (m, 2Н), 8.83 (d, 1Н).
Стадия 3. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметил)пиридин-2-ил]метил]пиразин-2-карбоксамид (соединение 11)
К смеси 3-амино-6-хлор-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметил)-пиридин-2-ил]метил]пиразин-2-карбоксамида (20 мг; 0,05 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (23,6 мг; 0,10 ммоль; 2,00 экв.) в 1,4-диоксане (5 мл) порциями добавляли Pd(dppf)Cl2 (7,3 мг; 0,01 ммоль; 0,20 экв.) и Cs2CO3 (32,7 мг; 0,10 ммоль; 2 экв.). Смесь перемешивали в течение 5 мин при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 90°С в атмосфере азота и концентрировали под вакуумом. Неочищенный продукт (40 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 5 мкм, 19*150 мм; подвижная фаза А: вода (с NH4HCOO3 (10 ммоль/л)+0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 30% В до 40% В за 7 мин; 254/220 нм; Rt: 6,55 мин), получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметил)пиридин-2-ил]метил]пиразин-2-карбоксамид (соединение 11) (2 мг; 8,5%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=472,3; 1Н ЯМР: (300 МГц, MeOD) δ 3.66 (s, 3Н), 4.95 (s, 2Н), 6.55 (d, 1Н), 7.39 (d, 1H), 7.54 (m, 2H), 8.07 (m, 2H), 8.19 (d, 1H), 8.79 (d, 1H).
Пример 13. Получение 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 13)

Стадия 1. Получение 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида
К перемешиваемой смеси 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновой кислоты (350 мг; 1,308 ммоль; 1 экв.) и 6-(аминометил)-N,N-диметилпиридин-2-амина (296,62 мг; 1,962 ммоль; 1,5 экв.) в DMF (20 мл) порциями добавляли HATU (994,47 мг; 2,615 ммоль; 2 экв.) и DIEA (338,03 мг; 2,615 ммоль; 2 экв.) при 15°С в воздушной атмосфере. Полученную смесь перемешивали в течение 3 часов и гасили, используя 50 мл воды. Полученное твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая 3-амино-6-хлор-N-[[6-(диметиламино)пиридин-2-ил]метил]-5-(4-фторфенил)пиразин-2-карбоксамид (300 мг; 57,23%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=401,2.
Стадия 2. Получение 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 13)
К раствору 3-амино-6-хлор-N-[[6-(диметиламино)пиридин-2-ил]метил]-5-(4-фторфенил)пиразин-2-карбоксамида (50 мг; 0,12 ммоль; 1 экв.) и (1-метил-6-оксо-1,6-дигидропиридин-3-ил)бороновой кислоты (28,6 мг; 0,19 ммоль; 1,50 экв.) в воде (0,2 мл) и диоксане (1,8 мл) добавляли Cs2CO3 (81,3 мг; 0,25 ммоль; 2 экв.) и Pd(dppf)Cl2 (9,1 мг; 0,01 ммоль; 0,1 экв.) в атмосфере азота, полученную смесь перемешивали в течение 2 ч при 90°С в атмосфере азота и концентрировали при пониженном давлении. Неочищенный продукт (50 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3.H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 40% В до 48% В за 7 мин; 254/220 нм; Rt: 5,37 мин), получая 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамид (соединение 13) (12 мг; 20,3%) в виде светло-желтого твердого вещества.
LCMS: m/z (ESI), [М+Н]+=474,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 3.0 (s, 5Н), 3.4 (s, 2Н), 4.5 (d, J=5,9 Гц, 1Н), 6.2 (d, J=9,3 Гц, 1H), 6.4-6.5 (m, 1H), 7.3 (t, J=8,8 Гц, 1H), 7.5 (t, J=7,9 Гц, 1H), 7.5 (t, J=7,1 Гц, 2H), 7.9 (d, J=2,5 Гц, 1H), 9.3 (s, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 13.
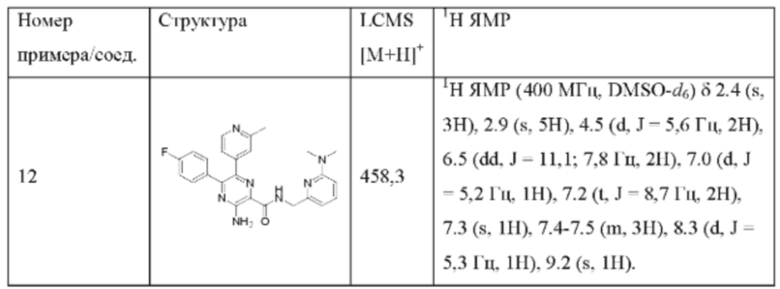
Пример 14. Получение 3-амино-N-((3-фторпиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 14)
СХЕМА 11

Стадия 1. Метил 3-((ди-трет-бутоксикарбонил)амино)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (80 мг; 0,2 ммоль; 1 экв.) и (Вос)2О (160,0 мг; 0,7 ммоль; 3,0 экв.) в DCM (2 мл) порциями добавляли DMAP (5,97 мг; 0,049 ммоль; 0,2 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 2 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (DCM/MeOH, 20:1), получая метил 3-[бис[(трет-бутокси)карбонил]амино]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (84 мг; 65,2%) в виде светло-желтого масла. LCMS: m/z (ESI), [М+Н]+=528.
Стадия 2. 3-((Ди-трет-бутоксикарбонил)амино)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемой смеси метил 3-[бис[(трет-бутокси)карбонил]амино]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (84 мг; 0,2 ммоль; 1 экв.) в МеОН (5 мл) порциями добавляли LiOH (7,6 мг; 0,3 ммоль; 2 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 1 ч при 50°С. Смесь оставляли охлаждаться до комнатной температуры. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (DCM/MeOH, 20:1), получая 3-[бис[(трет-бутокси)карбонил]амино]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (75 мг; 91,7%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=514,1.
Стадия 3. Ди-трет-бутил (3-(((3-фторпиридин-2-ил)метил)карбамоил)-5-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-6-(оксазол-2-ил)пиразин-2-ил)карбамат
К перемешиваемой смеси 3-[бис[(трет-бутокси)карбонил]амино]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (81 мг; 0,16 ммоль; 1 экв.) и 1-(3-фторпиридин-2-ил)метанамина (39,8 мг; 0,3 ммоль; 2,0 экв.) в DMF (2 мл) порциями добавляли HATU (120,0 мг; 0,3 ммоль; 2 экв.) и DIEA (61,2 мг; 0,47 ммоль; 3 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 6 ч при комнатной температуре. Полученную смесь гасили водой (20 мл) и экстрагировали EtOAc (3 × 50 мл). Объединенные органические слои промывали водой (3 × 50 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. В результате получали трет-бутил N-[(трет-бутокси)карбонил]-N-(3-[[(3-фторпиридин-2-ил)метил]карбамоил]-5-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-6-(1,3-оксазол-2-ил)пиразин-2-ил)карбамат (80 мг; 81,6%) в виде желтого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М-Вос+Н]+=522,3.
Стадия 4. 3-Амино-N-((3-фторпиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 14)
К перемешиваемому(ой) раствору/смеси трет-бутил N-[(трет-бутокси)карбонил]-N-(3-[[(3-фторпиридин-2-ил)метил]карбамоил]-5-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-6-(1,3-оксазол-2-ил)пиразин-2-ил)карбамата (70 мг; 0,11 ммоль; 1 экв.) и TFA (2 мл) в DCM (2 мл) порциями добавляли при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 0,5 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Остаток растворяли в МеОН (4 мл). Порциями добавляли NH3.H2O (4 мл) при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток растворяли в МеОН (4 мл). Остаток очищали препаративной TLC (DCM/MeOH, 20:1), получая 3-амино-N-[(3-фторпиридин-2-ил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 14) (22 мг; 45,9%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=422,2. 1Н ЯМР (DMSO-d6, 400 МГц) δ 3.5 (3Н, s), 4.7 (2Н, dd), 6.3 (1H, d), 7.3-7.5 (3Н, m), 7.7-7.9 (3Н, m), 8.0 (1Н, d), 8.3 (1H, s), 8.4 (1H, dt), 9.3 (1H, t).
Пример 15. Получение 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 15)
СХЕМА 12

Стадия 1. 6-(Диметиламино)пиридин-2-карбонитрил
К раствору 6-бромпиридин-2-карбонитрила (2 г; 10,9 ммоль; 1 экв.) в THF (25 мл) добавляли диметиламин (3,0 г; 65,6 ммоль; 6 экв.). Раствор перемешивали в течение 12 ч при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (5:1), получая 6-(диметиламино)пиридин-2-карбонитрил (1,1 г; 68,4%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=148,2.
Стадия 2. 6-(Аминометил)-N,N-диметилпиридин-2-амин
К смеси 6-(диметиламино)пиридин-2-карбонитрила (1,1 г; 7,5 ммоль; 1 экв.) в МеОН (50 мл), NH3.H2O (0,3 г; 7,5 ммоль; 1 экв.) добавляли Ni Ренея (64,03 мг; 0,747 ммоль; 0,10 экв.) при комнатной температуре. Смесь перемешивали в течение 30 мин при 20°С в атмосфере водорода. Полученную смесь фильтровали и фильтрат концентрировали при пониженном давлении, получая 6-(аминометил)-N,N-диметилпиридин-2-амин (1 г; 88,5%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=152,2.
Стадия 3. 3-Амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 15)
К смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,32 ммоль; 1 экв.) и 6-(аминометил)-N,N-диметилпиридин-2-амина (72,4 мг; 0,48 ммоль; 1,5 экв.) в DMF (3 мл) порциями добавляли HATU (243 мг; 0,64 ммоль; 2 экв.) и DIEA (118 мг; 0,96 ммоль; 3 экв.) при комнатной температуре. Смесь перемешивали в течение 10 мин при 15°С в воздушной атмосфере. Выпавшие в осадок твердые вещества собирали фильтрованием и промывали водой (3 × 10 мл). Полученное твердое вещество сушили под инфракрасным излучением, получая 3-амино-N-[[6-(диметиламино)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 15) (66,1 мг; 46,4%) в виде светло-желтого твердого вещества.
LCMS: m/z (ESI), [М+Н]+=447,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.9 (s, 5Н), 3.3 (s, 2Н), 4.4 (d, J=5,7 Гц, 2Н), 6.3 (d, J=9,3 Гц, 1H), 6.5 (dd, J=9,2; 7,9 Гц, 2Н), 7.3-7.4 (m, 2Н), 7.46 (dd, J=8,5; 7,3 Гц, 1H), 7.8 (s, 1H), 8.0 (d, J=2,6 Гц, 1H), 8.3 (d, J=0,8 Гц, 1H), 9.3 (t, J=5,7 Гц, 1H).
Пример 16. Получение 3-амино-N-((3-(диметиламино)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 16)
СХЕМА 13
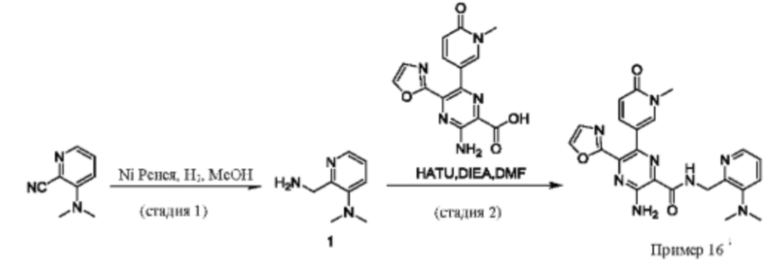
Стадия 1. 2-(Аминометил)-N,N-диметилпиридин-4-амин
К раствору 4-(диметиламино)пиридин-2-карбонитрила (200 мг; 1,4 ммоль; 1 экв.) в МеОН (5 мл) добавляли NH3.H2O (0,1 мл; 2,6 ммоль; 1,9 экв.). Полученную смесь перемешивали в течение 30 мин при 15°С в атмосфере водорода. Полученную смесь фильтровали, фильтрат концентрировали при пониженном давлении, получая 2-(аминометил)-N,N-диметилпиридин-4-амин (190 мг; 92,5%) в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=152,2.
Стадия 2. 3-Амино-N-((3-(диметиламино)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 16)
К смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,32 ммоль; 1 экв.) и 2-(аминометил)-N,N-диметилпиридин-3-амина (72,4 мг; 0,48 ммоль; 1,5 экв.) в DMF (5 мл) порциями добавляли HATU (242,7 мг; 0,64 ммоль; 2 экв.) и DIE А (165,12 мг; 1,28 ммоль; 4 экв.). Смесь перемешивали в течение 60 мин при 15°С в воздушной атмосфере и гасили водой (15 мл). Выпавшие в осадок твердые вещества собирали фильтрованием и промывали водой (3 × 100 мл). Полученную смесь концентрировали под вакуумом, получая 3-амино-N-((3-(диметиламино)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 16) (50,6 мг; 35,5%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=447,2; 1Н ЯМР (400 МГц, метанол-d4) δ -0.05 (s, 1H), 1.2 (s, 1Н), 2.7 (s, 6Н), 3.3 (s, 3Н), 4.7 (d, J=5,5 Гц, 2Н), 6.3 (d, J=9,4 Гц, 1Н), 7.3 (dd, J=8,1; 4,7 Гц, 1H), 7.3-7.4 (m, 2Н), 7.5 (dd, J=8,1; 1,5 Гц, 1H), 7.8 (s, 1H), 8.0 (d, J=2,6 Гц, 1H), 8.2 (dd, J=4,7; 1,4 Гц, 1H), 8.3 (d, J=0,7 Гц, 1H), 9.3 (t, J=5,5 Гц, 1Н).
Пример 17. Получение 3-амино-N-((6-метоксипиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 17)
СХЕМА 14
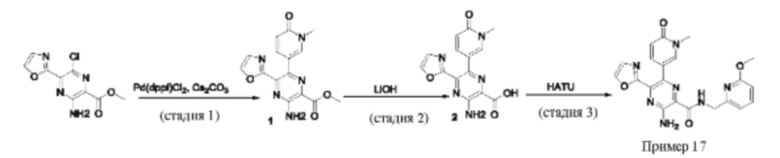
Стадия 1. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (1 г; 3,93 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (1,8 г; 7,85 ммоль; 2 экв.) в 1,4-диоксане (50 мл) порциями добавляли Cs2CO3 (2,6 г; 7,85 ммоль; 2 экв.) и Pd(dppf)Cl2.CH2Cl2 (0,5 г; 0,59 ммоль; 0,15 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 часов при 90°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали CH2Cl2 (1 × 200 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью DCM/PE (0-100%), затем EA/DCM (0-10%), получая метил 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (1,1 г; 85,58%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=328,0. 1Н ЯМР (300 МГц, DMSO-d6) δ3.47 (s, 3Н), 3.91 (s, 3Н), 6.36 (d, J=9,4 Гц, 1H), 7.35 (dd, J=9,3; 2,6 Гц, 1Н), 7.43 (d, J=0,8 Гц, 1H), 7.63 (s, 2H), 7.85 (d, J=2,6 Гц, 1H), 8.32 (d, J=0,8 Гц, 1H).
Стадия 2. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемой смеси метил 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (7 г; 21,39 ммоль; 1 экв.) в THF (500 мл) и метаноле (100 мл) порциями добавляли раствор LiOH (1024,4 мг; 42,77 ммоль; 2 экв.) в воде (20 мл) при 35°С в воздушной атмосфере. Полученную смесь перемешивали в течение 3 ч при 35°С в воздушной атмосфере. Смесь нейтрализовали до рН 6, используя раствор HCl (водн.). Полученную смесь концентрировали при пониженном давлении, получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (6,3 г; 94,03%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=314,0.
Стадия 3. 3-Амино-N-[(6-метоксипиридин-2-ил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 17)
К перемешиваемой смеси HATU (24,3 мг; 0,06 ммоль; 2 экв.) и 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (10 мг; 0,03 ммоль; 1 экв.) в DMF (5 мл) порциями добавляли DIEA (10,3 мг; 0,08 ммоль; 2,5 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 5 мин при комнатной температуре. Порциями добавляли 1-(6-метоксипиридин-2-ил)метанамин (6,6 мг; 0,05 ммоль; 1,5 экв.). Полученную смесь перемешивали в течение 3 часов при комнатной температуре. Реакцию гасили водой при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и очищали препаративной TLC (CH2Cl2/МеОН, 3:1), получая 3-амино-N-[(6-метоксипиридин-2-ил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 17) (30 мг; 27,10%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=434,0; 1Н ЯМР (300 МГц, DMSO-d6) δ 9.36 (t, J=6,1 Гц, 1H), 8.29 (d, J=0,8 Гц, 1H), 8.02 (d, J=2,6 Гц, 1H), 7.79 (s, 2Н), 7.65 (t, J=7,8 Гц, 1H), 7.48-7.32 (m, 2H), 6.90 (d, J=7,3 Гц, 1H), 6.68 (d, J=8,2 Гц, 1H), 6.31 (d, J=9,4 Гц, 1H), 4.53 (d, J=6,0 Гц, 2H), 3.81 (s, 3H), 3.45 (s, 3H).
Пример 18. Получение 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-[(6-метилпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 18)
СХЕМА 15
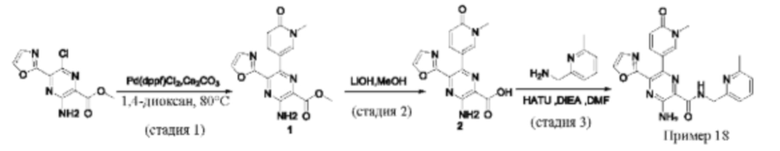
Стадия 1. Метил 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-пиразин-2-карбоксилат
К смеси метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (1,1 г; 4,32 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (2,0 г; 8,64 ммоль; 2 экв.) в 1,4-диоксане (40 мл) добавляли Pd(dppf)Cl2 (0,3 г; 0,43 ммоль; 0,1 экв.) и Cs2CO3 (2,8 г; 8,64 ммоль; 2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 90°С в атмосфере азота и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (4%), получая метил 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (1 г; 70,72%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=328,0. 1Н ЯМР: (400 МГц, DMSO-d6) δ 3.46 (s, 3Н), 3.90 (s, 3Н), 6.35 (d, 1H), 7.34 (dd, 1H), 7.43 (d, 1H), 7.64 (s, 2H), 7.85 (d, 1H), 8.32 (d, 1H).
Стадия 2. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновая кислота
К раствору метил 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (1 г; 3,06 ммоль; 1 экв.) в МеОН (30 мл) и THF (10 мл) добавляли LiOH (0,1 г; 6,11 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при 40°С в воздушной атмосфере. Значение рН смеси подводили до 5, используя HCl. Растворитель удаляли при пониженном давлении, получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (800 мг; 83,58%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=314,0. 1Н ЯМР: (400 МГц, DMSO-d6) δ 3.46 (s, 3Н), 6.30 (d, 1H), 7.28 (dd, 1Н), 7.39 (d, 1H), 7.83 (s, 2H), 7.97 (d, 1H), 8.30 (d, 1H).
Стадия 3. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-[(6-метилпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 18)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,32 ммоль; 1 экв.), HATU (242,7 мг; 0,64 ммоль; 2 экв.) и DIEA (123,8 мг; 0,96 ммоль; 3 экв.) в DMF (5 мл) порциями добавляли 1-(6-метилпиридин-2-ил)метанамин (58,5 мг; 0,48 ммоль; 1,5 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Смесь выливали в воду, фильтровали, твердое вещество собирали фильтрованием и промывали МеОН (10 мл), сушили под вакуумом, получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-[(6-метилпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 18) (24 мг; 18,01%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=418,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 3.48 (s, 3Н), 4.58 (d, J=6,1 Гц, 2Н), 6.33 (d, J=9,4 Гц, 1H), 7.15 (d, J=7,7 Гц, 2Н), 7.36-7.47 (m, 2Н), 7.65 (t, J=7,7 Гц, 1H), 7.81 (s, 2Н), 8.06 (d, J=2,6 Гц, 1Н), 31 (d, J=0,8 Гц, 1H), 8 2.47 (s, 3Н), 9.45 (t, J=6,1 Гц, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 18.
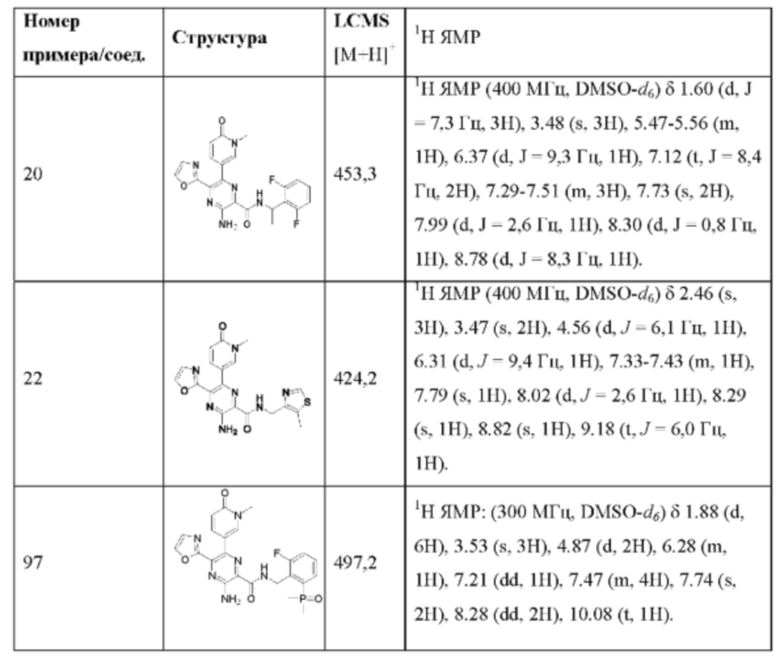

Пример 19. Получение 3-амино-N-[[3-(дифторметокси)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 19)
СХЕМА 16
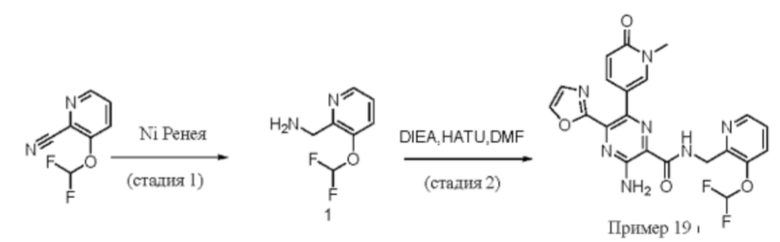
Стадия 1. 1-[3-(Дифторметокси)пиридин-2-ил]метанамин
К перемешиваемой смеси 3-(дифторметокси)пиридин-2-карбонитрила (70 мг; 0,41 ммоль; 1 экв.) и Ni Ренея (7,1 мг; 0,1 ммоль; 0,2 экв.) в МеОН (5 мл) порциями добавляли NH3.H2O (1 мл) при комнатной температуре. Полученную смесь перемешивали в течение еще 3 часов при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали 1-[3-(дифторметокси)пиридин-2-ил]метанамин (50 мг; 69,7%) в виде пурпурного масла. Неочищенный продукт использовали на следующей стадии непосредственно без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=175,2.
Стадия 2. 3-Амино-N-[[3-(дифторметокси)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 19)
К перемешиваемому(ой) раствору/смеси 1-[3-(дифторметокси)пиридин-2-ил]метанамина (41,7 мг; 0,24 ммоль; 1,5 экв.) и 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (50 мг; 0,16 ммоль; 1 экв.) в DMF (4 мл) по каплям добавляли HATU (242,7 мг; 0,64 ммоль; 4 экв.) и DIEA (82,5 мг; 0,64 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 0,5 ч при комнатной температуре. Полученную смесь по каплям добавляли в воду (200 мл). Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3×10 мл). В результате получали [3-(дифторметокси)пиридин-2-ил]метил-3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (соединение 19) (18 мг; 23,7%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=470,2. 1H ЯМР (DMSO, 400 МГц) δ 3.5 (3Н, s), 4.7 (2Н, d), 6.3 (1Н, d), 7.3-7.5 (3Н, m), 7.7 (1H, d), 7.8 (1H, s), 8.0 (1H, d), 8.3 (1H, s), 8.4 (1H, dd), 9.3 (1H, t).
Пример 21. Получение N-[[3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил]метил]-3-(дифторметокси)пиридин-2-карбоксамида (соединения 21)
СХЕМА 17
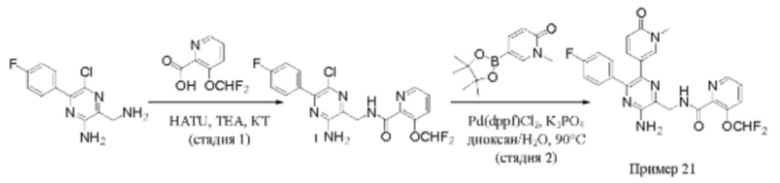
Стадия 1. N-[[3-Амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-3-(дифторметокси)пиридин-2-карбоксамид
К смеси 3-(аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амина (40 мг; 0,16 ммоль; 1 экв.) и 3-(дифторметокси)пиридин-2-карбоновой кислоты (59,9 мг; 0,32 ммоль; 2,0 экв.) в DCM (2,5 мл) добавляли HATU (120,4 мг; 0,32 ммоль; 2 экв.) и TEA (48,1 мг; 0,5 ммоль; 3 экв.) и перемешивали в течение 6 часов при комнатной температуре в воздушной атмосфере. Полученную смесь гасили водой (20 мл) и экстрагировали CH2Cl2 (3 × 20 мл). Объединенные органические слои промывали H2O (3 × 3 10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:1), получая N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-3-(дифторметокси)пиридин-2-карбоксамид (30 мг; 42,5%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=424,1.
Стадия 2. N-[[3-Амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил]метил]-3-(дифторметокси)пиридин-2-карбоксамид (соединение 21)
К смеси N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-3-(дифторметокси)пиридин-2-карбоксамида (30 мг; 0,07 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (33,3 мг; 0,14 ммоль; 2,0 экв.) в смеси диоксан/Н2О (1 мл) добавляли Pd(dppf)Cl2 (10,4 мг; 0,01 ммоль; 0,2 экв.) и K3PO4 (45,1 мг; 0,21 ммоль; 3 экв.) и перемешивали в течение 10 часов при 90°С в атмосфере азота. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:1), затем неочищенный продукт (25 мг) очищали препаративной HPLC (колонка: препаративная колонка XBridge OBD С18, 5 мкм, 19*150 мм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л) + 0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 25% В до 27% В за 8 мин; 254/220 нм; Rt: 7,32 мин), получая N-[[3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил]метил]-3-(дифторметокси)пиридин-2-карбоксамид (соединение 21) (2,7 мг; 7,61%) в виде белого твердого вещества. LCMS m/z (ESI) [М+Н]+=497,2. 1Н ЯМР (400 МГц, метанол-d4) δ 3.52 (s, 2Н), 4.70 (s, 1H), 7.08-7.23 (m, 1H), 7.33 (dd, J=9,4; 2,6 Гц, 1Н), 7.45-7.55 (m, 1H), 7.65 (dd, J=8,4; 4,6 Гц, 1H), 7.74-7.84 (m, 1H), 8.56 (dd, J=4,6; 1,3 Гц, 1Н).
Пример 23. Получение 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-[[6-(метиламино)пиридин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 23)
СХЕМА 18

Стадия 1. 6-(Метиламино)пиридин-2-карбонитрил
К раствору 6-бромпиридин-2-карбонитрила (500 мг; 2,7 ммоль; 1 экв.) в THF (10 мл) добавляли метанамин (424,3 мг; 13,6 ммоль; 5,0 экв.) при комнатной температуре и перемешивали в течение 6 часов при 80°С в воздушной атмосфере. Остаток очищали препаративной TLC (РЕ/EtOAc 5:1), получая 6-(метиламино)пиридин-2-карбонитрил (80 мг; 21,9%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=134,3.
Стадия 2. 6-(Аминометил)-N-метилпиридин-2-амин
К перемешиваемой смеси 6-(метиламино)пиридин-2-карбонитрила (80 мг; 0,6 ммоль; 1 экв.) и Ni Ренея (51,5 мг; 0,6 ммоль; 1,0 экв.) в МеОН (5 мл) порциями добавляли NH3.H2O (21,1 мг; 0,60 ммоль; 1 экв.) при КТ. Полученную смесь перемешивали в течение 30 мин при 15°С в атмосфере водорода и концентрировали при пониженном давлении, получая 6-(аминометил)-N-метилпиридин-2-амин (60 мг; 72,8%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=137,1.
Стадия 3. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-[[6-(метиламино)пиридин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 23)
К перемешиваемому(ой) раствору/смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (70 мг; 0,22 ммоль; 1 экв.) и 6-(аминометил)-N-метилпиридин-2-амина (46,0 мг; 0,3 ммоль; 1,5 экв.) в DMF (3 мл) по каплям/порциями добавляли HATU (169,9 мг; 0,5 ммоль; 2 экв.) и DIEA (86,6 мг; 0,6 ммоль; 3 экв.), перемешивали в течение 10 мин при 15°С в воздушной атмосфере. Неочищенный продукт (60 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30*150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3 Н2О), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 20% В до 28% В за 7 мин; 254/220 нм; Rt: 6,5 мин), получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-[[6-(метиламино)-пиридин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 23) (8 мг; 8,3%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=433,2. 1Н ЯМР (400 МГц, метанол-d4) δ 2.8 (s, 2Н), 3.6 (s, 2Н), 4.5 (s, 1Н), 6.4 (d, J=8,2 Гц, 1H), 6.4-6.6 (m, 1H), 7.3-7.4 (m, 1Н), 7.5 (dd, J=9,3; 2,6 Гц, 1H), 8.0 (d, J=2,5 Гц, 1H), 8.0 (d, J=0,8 Гц, 1Н).
Пример 24. Получение 3-амино-N-[(6-аминопиридин-2-ил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 24)
СХЕМА 19
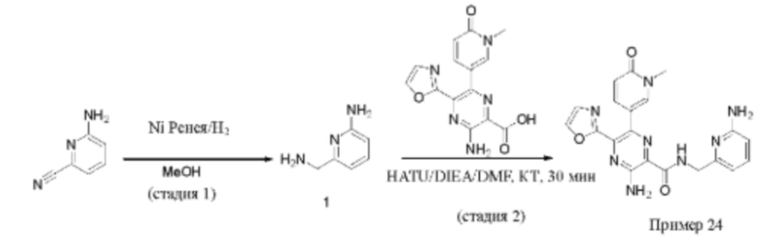
Стадия 1. 6-(Аминометил)пиридин-2-амин
К раствору 6-аминопиридинкарбонитрила (100 мг; 0,84 ммоль; 1 экв.) в 20 мл МеОН в круглодонной колбе емкостью 50 мл добавляли Ni Ренея (10 мг; 0,12 ммоль; 0,14 экв.) в атмосфере азота. Смесь гидрировали при комнатной температуре в течение 1,5 часа в атмосфере водорода, используя баллон с водородом. Полученную смесь фильтровали, фильтрат концентрировали при пониженном давлении, получая 6-(аминометил)пиридин-2-амин (100 мг; 96,73%) в виде коричневого масла. Неочищенный продукт непосредственно использовали на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=124,0.
Стадия 2. 3-Амино-N-[(6-аминопиридин-2-ил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 24)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (381,5 мг; 1,22 ммоль; 1,5 экв.) и HATU (617,5 мг; 1,62 ммоль; 2 экв.) в DMF (15,0 мл) порциями добавляли DIEA (314,8 мг; 2,44 ммоль; 3 экв.) и 6-(аминометил)пиридин-2-амин (100 мг; 0,81 ммоль; 1 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 30 мин при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC/хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (20:1), получая 3-амино-N-[(6-аминопиридин-2-ил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 24) (57 мг; 16,43%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=419,0. 1Н ЯМР (400 МГц, DMSO-d6) δ 3.48 (s, 3Н), 4.39 (d, J=6,2 Гц, 2Н), 5.92 (s, 2Н), 6.32 (dd, J=8,8; 3,8 Гц, 2Н), 6.42 (d, J=7,3 Гц, 1H), 7.28-7.40 (m, 2Н), 7.42 (s, 1H), 7.83 (s, 2Н), 8.07 (d, J=2,6 Гц, 1H), 8.31 (s, 1H), 9.26 (t, J=6,2 Гц, 1Н).
Пример 25. Получение 3-амино-N-((4-(диметиламино)пиримидин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 25)
СХЕМА 20
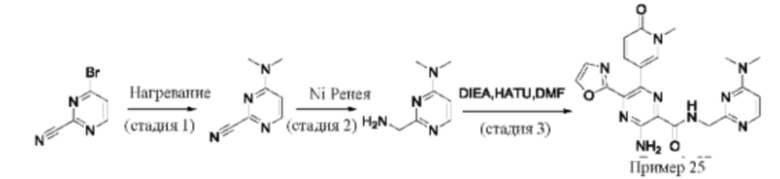
Стадия 1. 4-(Диметиламино)пиримидин-2-карбонитрил
В герметично закрываемую пробирку емкостью 40 мл добавляли 4-бромпиримидин-2-карбонитрил (980 мг; 5,3 ммоль; 1 экв.) и NHMe2 (15 мл; 30,00 ммоль; 5,6 экв.) в THF (10 мг) при 80°С в течение 6 ч. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью гексан/EtOAc (1:1), получая 4-(диметиламино)пиримидин-2-карбонитрил (700 мг; 88,7%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=149,2.
Стадия 2. 2-(Аминометил)-N,N-диметилпиримидин-4-амин
К перемешиваемой смеси 4-(диметиламино)пиримидин-2-карбонитрила (80 мг; 0,5 ммоль; 1 экв.) и Ni Ренея (9,3 мг; 0,1 ммоль; 0,2 экв.) в МеОН (5 мл) по каплям добавляли NH4OH (1 мл) при комнатной температуре. Полученную смесь перемешивали в течение еще 1 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении, получая 70 мг коричневого масла. Неочищенный продукт непосредственно использовали на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=153,2.
Стадия 3. 3-Амино-N-[[4-(диметиламино)пиримидин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1.3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 25)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (50 мг; 0,16 ммоль; 1 экв.) и 2-(аминометил)-N,N-диметилпиримидин-4-амина (36,4 мг; 0,2 ммоль; 1,5 экв.) в DMF (5 мл) порциями добавляли DIEA (82,5 мг; 0,64 ммоль; 4 экв.) и HATU (242,7 мг; 0,6 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 30 мин при комнатной температуре. Полученную смесь добавляли в воду и фильтровали, осадок на фильтре промывали EtOAc (3×5 мл) и МеОН (2×5 мл). Неочищенный продукт перекристаллизовывали из смеси вода/DMF (5:1 в мл), получая 3-амино-N-[[4-(диметиламино)пиримидин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 25) (14 мг; 19,41%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=448,3. 1Н ЯМР (DMSO, 400 МГц) δ 3.0 (6Н, s), 3.5 (3Н, s), 4.5 (2Н, d), 6.3 (1Н d), 6.6 (1H, d), 7.4-7.4 (2Н, m), 7.8 (1H, s), 8.0 (1H, d), 8.1 (1H, d), 8.3 (1H, d), 9.2 (1H, t).
Пример 26. Получение 3-амино-N-[[6-(азетидин-1-ил)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 26)
СХЕМА 21
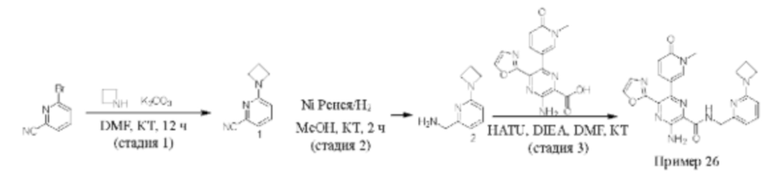
Стадия 1. 6-(Азетидин-1-ил)пиридин-2-карбонитрил
В герметично закрываемую пробирку емкостью 40 мл добавляли 6-бромпиридин-2-карбонитрил (500 мг; 2,732 ммоль; 1 экв.), азетидин (202,79 мг; 3,552 ммоль; 1,30 экв.) и K2CO3 (755,19 мг; 5,464 ммоль; 2,00 экв.) в DMF (20 мл) при комнатной температуре. Смесь перемешивали в течение 2 часов при 80°С и концентрировали под вакуумом. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (1:1), получая 6-(азетидин-1-ил)пиридин-2-карбонитрил (400 мг; 91,97%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=160,2.
Стадия 2. 1-[6-(Азетидин-1-ил)пиридин-2-ил]метанамин
В круглодонную колбу емкостью 50 мл добавляли Ni Ренея (40 мг; 0,47 ммоль; 0,32 экв.) и 6-(азетидин-1-ил)пиридин-2-карбонитрил (230 мг; 1,44 ммоль; 1 экв.) в МеОН (20 мл) при комнатной температуре. Смесь перемешивали в течение 2 ч в атмосфере Н2. Ni Ренея удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении, получая 1-[6-(азетидин-1-ил)пиридин-2-ил]метанамин (200 мг; 84,81%) в виде желтого масла, которое использовали на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=164,2.
Стадия 3. 3-Амино-N-[[6-(азетидин-1-ил)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 26)
К смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,26 ммоль; 1 экв.) и 1-[6-(азетидин-1-ил)пиридин-2-ил]метанамина (62,9 мг; 0,39 ммоль; 1,5 экв.) в DMF (5 мл) добавляли HATU (195,4 мг; 0,51 ммоль; 2 экв.) и DIEA (99,6 мг; 0,77 ммоль; 3 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 60 мин и концентрировали под вакуумом. Неочищенный продукт (50 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 5 мкм, 19*150 мм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л) + 0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 25% В до 43% В за 7 мин; 254/220 нм; Rt: 6,68 мин), получая 3-амино-N-[[6-(азетидин-1-ил)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 26) (11 мг; 9,40%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=459,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.28 (2Н, р), 3.47 (3Н, s), 3.89 (4Н, t), 4.45 (2Н, d), 6.22 (1H, d), 6.33 (1H, d), 6.58 (1H, d), 7.34-7.53 (3Н, m), 7.83 (2Н, s), 8.02 (1H, d), 8.31 (1Н, s), 9.35 (1Н, t).
Пример 27. Получение 3-амино-N-(5-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 27)
СХЕМА 22
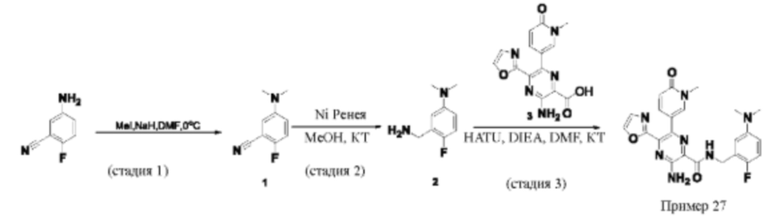
Стадия 1. Получение 5-(диметиламино)-2-фторциклогекса-1,3-диен-1-карбонитрила
К раствору 5-амино-2-фторбензонитрила (2 г; 14,69 ммоль; 1 экв.) в DMF (40 мл) добавляли NaH (1057,7 мг; 44,08 ммоль; 3 экв.) при 0°С.После перемешивания в течение 5 мин по каплям добавляли MeI (8341,4 мг; 58,77 ммоль; 4 экв.) при 0°С.Полученный раствор перемешивали в течение 2 ч при 0°С и гасили насыщенным водн. раствором NH4Cl (50 мл). Полученный раствор экстрагировали этилацетатом (3 × 50 мл), сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем с элюированием смесью дихлорметан/метанол (40:1). В результате получали 1,2 г (49,75%) 5-(диметиламино)-2-фторциклогекса-1,3-диен-1-карбонитрила в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=165,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.89 (6Н, s), 7.01-7.07 (2Н, m), 7.25-7.32 (1H, m).
Стадия 2. 3-(Аминометил)-4-фтор-N,N-диметиланилин
К смеси Ni Ренея (52,18 мг; 0,609 ммоль; 0,20 экв.) и 5-(диметиламино)-2-фторбензонитрила (500 мг; 3,045 ммоль; 1 экв.) в МеОН (50 мл) в круглодонной колбе емкостью 250 мл добавляли NH4OH (2 мл; 51,361 ммоль; 16,87 экв.). Полученный раствор перемешивали в течение 2 часов при комнатной температуре в атмосфере водорода. Ni Ренея отфильтровывали. Фильтрат концентрировали, получая 400 мг (78,08%) 3-(аминометил)-4-фтор-N,N-диметиланилина в виде твердого вещества. LCMS: m/z (ESI), [M-NH2]+=152,3. 1H ЯМР (400 МГц, DMSO-d6) δ 2.83 (6Н, s), 3.70 (2Н, d), 6.52-6.57 (1H, m), 6.75-6.88 (1H, m), 7.06-7.13 (1H, m).
Стадия 3. 3-Амино-N-(5-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 27)
К смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (50 мг; 0,16 ммоль; 1 экв.) и 3-(аминометил)-4-фтор-N,N-диметиланилина (32,2 мг; 0,19 ммоль; 1,20 экв.) в DMF (10 мл) в круглодонной колбе емкостью 25 мл добавляли TEA (48,5 мг; 0,48 ммоль; 3,0 экв.) и HATU (66,8 мг; 0,18 ммоль; 1,1 экв.). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Затем реакцию гасили, добавляя 50 мл воды. Полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 17,2 мг (23,25%) 3-амино-N-[[5-(диметиламино)-2-фторфенил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 27) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=464,2. 1H ЯМР (300 МГц, DMSO-d6) δ 2.80 (6Н, s), 3.45 (3Н, s), 4.52 (2Н, d), 6.30-6.33 (1H, m), 6.59-6.62 (1H, m), 6.63-6.64 (1Н, m), 6.73-6.76 (1H, m), 7.00-7.03 (1H, m), 7.36-7.39 (2Н, m), 7.76-7.78 (2Н, m), 8.02-8.03 (1H, m), 8.29 (1H, s), 9.20-9.24 (1H, m).
Пример 28. Получение 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)-N-((6-(пирролидин-1-ил)пиридин-2-ил)метил)пиразин-2-карбоксамида (соединения 28)
СХЕМА 23
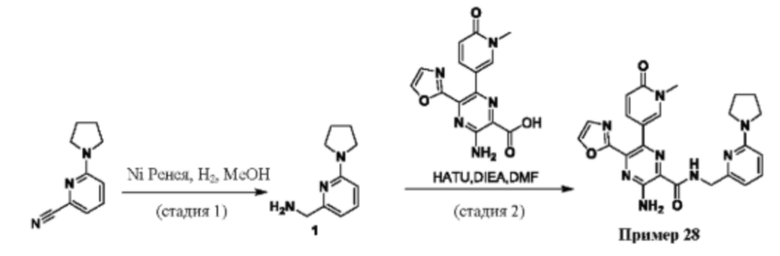
Стадия 1. 1-[6-Пирролидин-1-ил)пиридин-2-ил]метанамин
К смеси 6-(пирролидин-1-ил)пиридин-2-карбонитрила (200 мг; 1,1 ммоль; 1 экв.) и Ni Ренея (98,9 мг; 1,1 ммоль; 1,0 экв.) в МеОН (10 мл) добавляли NH3.H2O (40,5 мг; 1,1 ммоль; 1 экв.) и перемешивали в течение 30 мин при 15°С в атмосфере водорода. Полученную смесь фильтровали и фильтрат концентрировали при пониженном давлении, получая 1-[6-(пирролидин-1-ил)пиридин-2-ил]метанамин (120 мг; 58,6%) в виде белого твердого вещества. LCMS: m/z (ESI), [M+H]+=178,3.
Стадия 2. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-N-[[6-(пирролидин-1-ил)пиридин-2-ил]метил]пиразин-2-карбоксамид (соединение 28)
К смеси 1-[6-(пирролидин-1-ил)пиридин-2-ил]метанамина (100 мг; 0,56 ммоль; 1 экв.) и 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (176,7 мг; 0,56 ммоль; 1,00 экв.) в DMF (3 мл) добавляли HATU (429,0 мг; 1,13 ммоль; 2 экв.) и DIEA (218,7 мг; 1,69 ммоль; 3 экв.) при комнатной температуре. Смесь перемешивали в течение 60 мин при 15°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л) + 0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 39% В до 40% В за 9 мин; 254/220 нм; Rt: 8,3 мин), получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-N-[[6-(пирролидин-1-ил)пиридин-2-ил]метил]пиразин-2-карбоксамид (соединение 28) (36,7 мг; 13,17%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=473,3; 1H ЯМР (400 МГц, метанол-d4) δ 1.8-1.9 (m, 4Н), 3.3 (d, J=6,6 Гц, 4Н), 4.5 (d, J=5,5 Гц, 2Н), 6.3 (dd, J=13,3; 8,9 Гц, 2Н), 6.5 (d, J=7,3 Гц, 1H), 7.4-7.5 (m, 3Н), 7.8 (s, 1H), 7.9 (d, J=2,6 Гц, 1H), 8.3 (d, J=0,8 Гц, 1H), 9.3 (t, J=5,6 Гц, 1Н).
Пример 29. Получение 3-амино-N-[(2,6-дифторфенил)метил]-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 29)
СХЕМА 24
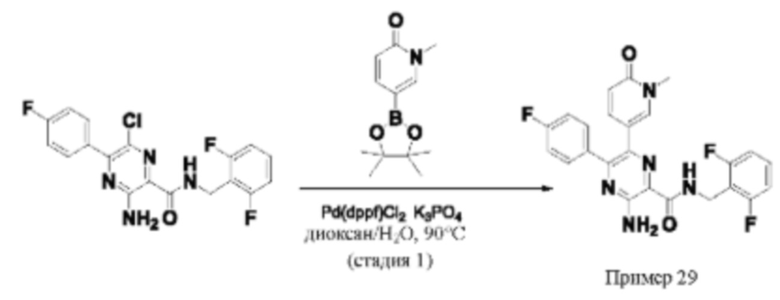
Стадия 1. Получение 3-амино-N-[(2,6-дифторфенил)метил]-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 29)
К смеси 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(4-фторфенил)пиразин-2-карбоксамида (100 мг; 0,25 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (119,7 мг; 0,5 ммоль; 2,0 экв.) в смеси диоксан/H2O (2 мл) добавляли Pd(dppf)Cl2 (37,3 мг; 0,1 ммоль; 0,2 экв.) и K3PO4 (162,1 мг; 0,8 ммоль; 3 экв.) в атмосфере азота при комнатной температуре. Смесь перемешивали в течение 10 часов при 90°С в атмосфере азота. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:2), далее неочищенный продукт очищали препаративной HPLC (колонка: препаративная колонка XBridge OBD С18, 30x150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3.H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 39% В до 49% В за 7 мин; 254/220 нм; Rt: 6,18 мин), получая 3-амино-N-[(2,6-дифторфенил)метил]-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамид (соединение 29) (7 мг; 5,85%) в виде желтого твердого вещества. LCMS m/z (ESI) [М+Н]+=466,2. 1H ЯМР (400 МГц, метанол-d4) δ 3.55 (s, 2Н), 4.73 (s, 2Н), 6.38 (d, J=9,2 Гц, 1H), 6.93-7.05 (m, 2Н), 7.10-7.19 (m, 2Н), 7.30 (dd, J=9,4; 2,6 Гц, 1H), 7.32-7.42 (m, 1H), 7.50-7.61 (m, 2Н), 7.88 (d, J=2,5 Гц, 1H).
Пример 30. Получение 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметокси)пиридин-2-ил]метил]пиразин-2-карбоксамида (соединения 30)
СХЕМА 25
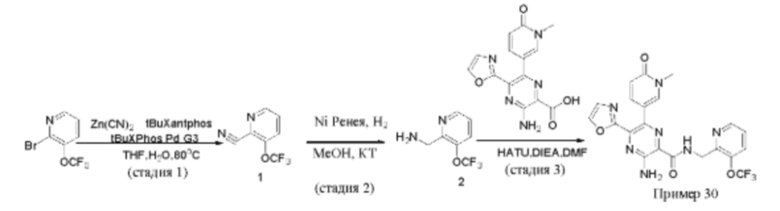
Стадия 1. 3-(Трифторметокси)пиридин-2-карбонитрил
К перемешиваемой смеси 2-бром-3-(трифторметокси)пиридина (300 мг; 1,24 ммоль; 1 экв.) и Zn(CN)2 (291,2 мг; 2,48 ммоль; 2 экв.) в THF (15 мл) и Н2О (3 мл) добавляли t-BuXantPhos-Pd-G3 (197,0 мг; 0,25 ммоль; 0,2 экв.) и t-BuXantPhos (171,3 мг; 0,25 ммоль; 0,2 экв.) в атмосфере азота при КТ. Полученную смесь перемешивали в течение 2 ч при 80°С в атмосфере азота. Растворитель удаляли при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-(трифторметокси)пиридин-2-карбонитрил (200 мг; 85,76%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=188,9.
Стадия 2. 1-[3-(Трифторметокси)пиридин-2-ил]метанамин
К раствору 3-(трифторметокси)пиридин-2-карбонитрила (100 мг; 0,53 ммоль; 1 экв.) и NH3.H2O (1,0 мл; 28,54 ммоль; 48,31 экв.) в МеОН (10 мл) добавляли Ni Ренея (22,8 мг; 0,27 ммоль; 0,5 экв.) в атмосфере азота. Полученную смесь перемешивали в течение 2 часов при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали 1-[3-(трифторметокси)пиридин-2-ил]метанамин (80 мг; 78,32%) в виде пурпурного масла. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=193,2.
Стадия 3. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметокси)пиридин-2-ил]метил]пиразин-2-карбоксамид (соединение 30)
К раствору 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,26 ммоль; 1 экв.) и 1-[3-(трифторметокси)пиридин-2-ил]метанамина (98,1 мг; 0,51 ммоль; 2 экв.) в DMF (10 мл) добавляли HATU (194,2 мг; 0,51 ммоль; 2 экв.) и DIEA (66,0 мг; 0,51 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 30 мин при комнатной температуре в воздушной атмосфере. Растворитель удаляли при пониженном давлении. Неочищенный продукт (80 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 5 мкм, 19*150 мм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л) + 0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 25% В до 46% В за 7 мин; 254/220 нм; Rt: 6,83 мин), получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)-N-[[3-(трифторметокси)пиридин-2-ил]метил]пиразин-2-карбоксамид (соединение 30) (10 мг; 8,03%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=488,2. 1Н ЯМР: (400 МГц, MeOD) δ 3.65 (s, 3Н), 4.85 (s, 2Н), 6.53 (d, 1Н), 7.38 (d, 1H), 7.51 (m, 2H), 7.84 (d, 1H), 8.07 (dd, 2H), 8.54 (d, 1H).
Пример 31. Получение 3-амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 31)
СХЕМА 26
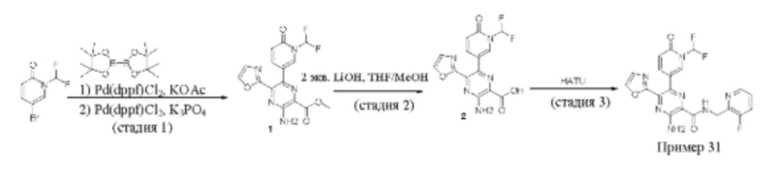
Стадия 1. Метил 3-амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат
К перемешиваемому раствору 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (340,1 мг; 1,34 ммоль; 2 экв.) и 5-бром-1-(дифторметил)-1,2-дигидропиридин-2-она (150 мг; 0,67 ммоль; 1 экв.) в THF (20 мл) порциями добавляли KOAc (197,2 мг; 2,01 ммоль; 3,00 экв.) и Pd(dppf)Cl2.CH2Cl2 (82,0 мг; 0,10 ммоль; 0,15 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 75°С в атмосфере азота. К этой полученной смеси 1-(дифторметил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она в THF (20 мл) порциями добавляли метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (84,5 мг; 0,33 ммоль; 0,50 экв.), Cs2CO3 (432,7 мг; 1,33 ммоль; 2 экв.) и Pd(dppf)Cl2.CH2Cl2; (70,5 мг; 0,09 ммоль; 0,13 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 4 ч при 75°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали CH2Cl2 (2 × 20 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая метил 3-амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (100 мг; 18,65%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=364,1. 1Н ЯМР (300 МГц, DMSO-d6) δ 3.87 (s, 3Н), 6.51 (d, J=9,7 Гц, 1H), 7.41 (s, 1H), 7.59 (dd, J=9,6; 2,5 Гц, 1Н), 7.69 (s, 1Н), 7.80 (d, J=2,5 Гц, 1H), 7.90 (d, J=8,8 Гц, 1Н),8.32 (d, J=0,8 Гц, 1H).
Стадия 2. 3-Амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (90 мг; 0,25 ммоль; 1 экв.) в THF (15 мл) по каплям добавляли LiOH (11,9 мг; 0,50 ммоль; 2,01 экв.) в воде (1 мл) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре в воздушной атмосфере. Смесь нейтрализовали до рН 6, используя 1 н. водн. раствор HCl, и концентрировали под вакуумом, получая неочищенную 3-амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (85 мг; 98,24%) в виде желтого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=350,0.
Стадия 3. 3-Амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 31)
К перемешиваемой смеси 3-амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (10 мг; 0,03 ммоль; 1 экв.), DIEA (11,1 мг; 0,09 ммоль; 3,00 экв.) и HATU (21,8 мг; 0,06 ммоль; 2,00 экв.) в DMF (8 мл) по каплям добавляли 1-(3-фторпиридин-2-ил)метанамин (5,4 мг; 0,04 ммоль; 1,50 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 3 ч при комнатной температуре в воздушной атмосфере. Реакцию гасили водой при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-6-[1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил]-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 31) (30 мг; 28,64%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=458,2; 1Н ЯМР (300 МГц, DMSO-d6) δ 9.30 (t, J=5,9 Гц, 1Н), 8.35 (dd, J=4,0; 2,3 Гц, 1H), 8.30 (d, J=0,8 Гц, 1H), 8.10 (s, 0Н), 7.97 (d, J=2,5 Гц, 1H), 7.87 (d, J=13,8 Гц, 2H), 7.75-7.64 (m, 2H), 7.41 (q, J=4,3 Гц, 2H), 6.50 (d, J=9,7 Гц, 1H), 4.68 (dd, J=5,7; 1,5 Гц, 2H).
Пример 32. Получение 3-амино-N-[(2,6-дифторфенил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 32)
СХЕМА 27
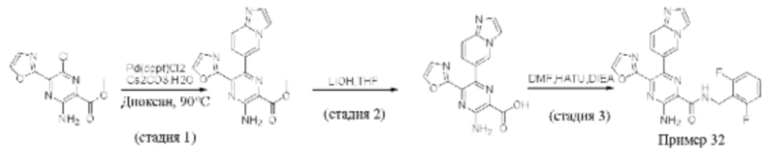
Стадия 1. Метил 3-амино-6-(имидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (300 мг; 1,18 ммоль; 1 экв.) и 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридина (431,4 мг; 1,77 ммоль; 1,5 экв.) в диоксане (18 мл) и H2O (2 мл) порциями добавляли Cs2CO3 (767,7 мг; 2,36 ммоль; 2 экв.) и Pd(dppf)Cl2 (172,4 мг; 0,24 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 90°С. Смесь оставляли охлаждаться до комнатной температуры. Полученную смесь фильтровали, осадок на фильтре промывали DCM (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (DCM/MeOH, 20:1), получая метил 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (165 мг; 41,6%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=337,2. 1Н ЯМР (DMSO-d6, 400 МГц) δ 3.9 (3Н, s), 7.1 (1H, dd, J=9,4; 1,8 Гц), 7.4 (1H, s), 7.5 (1H, d, J=9,3 Гц), 7.6 (1Н, d, J=1,2 Гц), 7.7 (1Н, d, J=19,0 Гц), 8.0 (1H, d, J=1,1 Гц), 8.3 (1H, s), 8.7 (1H, t, J=1,4 Гц).
Стадия 2. 3-Амино-6-(имидазо[2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-6-[имидазо[1,2-а]пиридин-7-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (160 мг; 0,48 ммоль; 1 экв.) в THF (20 мл) и воде (2 мл) порциями добавляли LiOH (13,7 мг; 0,57 ммоль; 1,2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 часов при комнатной температуре и рН подводили до 5, используя 1 н. водн. HCl. Полученную смесь концентрировали под вакуумом и использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=323,2.
Стадия 3. 3-Амино-N-[(2,6-дифторфенил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 32)
К перемешиваемой смеси 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,25 ммоль; 1 экв.) и 1-(2,6-дифторфенил)метанамина (71,1 мг; 0,50 ммоль; 2 экв.) в DMF (5 мл) порциями добавляли HATU (377,5 мг; 1 ммоль; 4 экв.) и DIEA (128,3 мг; 1 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 0,5 ч при комнатной температуре. Полученную смесь гасили водой, полученное твердое вещество собирали фильтрованием и суспендировали, используя МеОН (5 мл). Полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-N-[(2,6-дифторфенил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 32) (30 мг; 25,8%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=448,2. 1Н ЯМР (DMSO-d6, 400 МГц) δ 4.6 (2Н, d, J=5,8 Гц), 7.1 (2Н, t, J=7,9 Гц), 7.2 (1H, dd, J=9,4; 1,8 Гц), 7.3-7.4 (2Н, m), 7.5 (1H, d, J=9,3 Гц), 7.6 (1Н, d, J=1,3 Гц), 7.9 (3Н, d, J=23,3 Гц), 8.3 (1H, s), 8.7 (1H, t, J=1,3 Гц), 9.2 (1H, t, J=5,9 Гц).
Пример 33. Получение 3-амино-N-(3-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 33)
СХЕМА 28
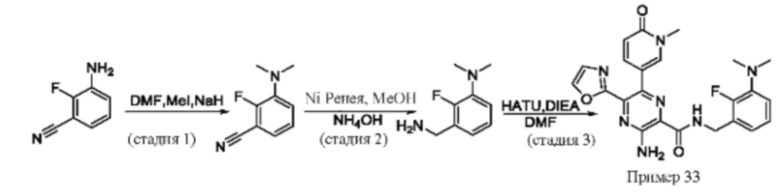
Стадия 1. 3-(Диметиламино)-2-фторбензонитрил
К перемешиваемой смеси 3-амино-2-фторбензонитрила (300 мг; 2,20 ммоль; 1 экв.) и NaH (158,7 мг; 6,61 ммоль; 3,00 экв.) в DMF (10 мл) порциями добавляли йодметан (938,4 мг; 6,61 ммоль; 3,00 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 4 часов при комнатной температуре. Полученную смесь гасили водой (30 мл) и экстрагировали EtOAc (3 × 50 мл). Объединенные органические слои промывали водой (3 × 10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении и очищали препаративной TLC (РЕ/EtOAc 5:1), получая 3-(диметиламино)-2-фторбензонитрил (160 мг; 44,2%) в виде светло-желтого неочищенного твердого вещества. LCMS: m/z (ESI), [М+Н]+=165,2. 1Н ЯМР (хлороформ-d6, 400 МГц) δ 2.9 (6Н, d, J=1,3 Гц), 7.1-7.1 (3Н, m).
Стадия 2. 3-(Аминометил)-2-фтор-N,N-диметиланилин
К перемешиваемой смеси 3-(диметиламино)-2-фторбензонитрила (160 мг; 0,97 ммоль; 1 экв.) и Ni Ренея (16,7 мг; 0,19 ммоль; 0,20 экв.) в МеОН (20 мл) порциями добавляли NH4OH (2 мл) при комнатной температуре. Полученную смесь перемешивали в течение еще 1 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. Полученный неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=169,0.
Стадия 3. 3-Амино-N-(3-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 33)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,26 ммоль; 1 экв.) и 3-(аминометил)-2-фтор-N,N-диметиланилина (85,9 мг; 0,5 ммоль; 2,0 экв.) в DMF (5 мл) порциями добавляли HATU (194,2 мг; 0,51 ммоль; 2,00 экв.) и DIE А (132,0 мл; 1,02 ммоль; 4,00 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 3 часов при комнатной температуре и концентрировали при пониженном давлении. Остаток очищали препаративной TLC (DCM/MeOH, 20:1), получая неочищенный продукт 3-амино-3-(3-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (100 мг) в виде коричнево-желтого масла. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: Xselect CSH OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% TFA), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 16% В до 27% В за 7 мин; 254/220 нм; Rt: 4,40 мин), получая 3-амино-N-(3-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 33) (44 мг; 37,06%) в виде коричнево-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=464,2. 1Н ЯМР (DMSO-d6, 400 МГц) δ 2.8 (5Н, s), 4.6 (2Н, d, J=6,3 Гц), 6.3 (1H, d, J=9,4 Гц), 6.9-7.0 (2Н, m), 7.1 (1H, t, J=7,8 Гц), 7.4-7.4 (2Н, m), 7.8 (1H, s), 8.0 (1H, d, J=2,6 Гц), 8.3 (1H, d,J=0,8 Гц), 9.3 (1H, t, J=6,4 Гц).
Пример 35. Получение 3-амино-N-(2,6-дифторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида (соединения 35)
СХЕМА 29
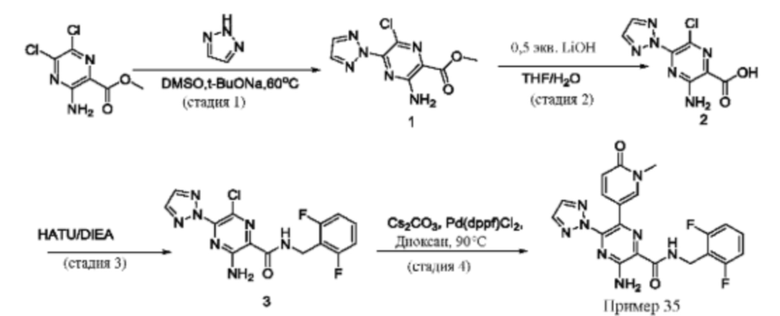
Стадия 1. Метил 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилат
К перемешиваемому раствору метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (2,5 г; 11,26 ммоль; 1 экв.) и 2Н-1,2,3-триазола (1555,4 мг; 22,52 ммоль; 2 экв.) в DMSO (50 мл) порциями добавляли трет-BuONa (1082,1 мг; 11,26 ммоль; 1 экв.) при КТ. Полученную смесь перемешивали в течение 3 ч при 60°С в масляной бане, охлаждали до КТ и гасили водой (200 мл). Полученное твердое вещество собирали фильтрованием, сушили под вакуумом и очищали на колонке с силикагелем (DCM:EA, 0-20%), получая 1,6 г неочищенного продукта. Неочищенный продукт далее очищали препаративной TLC (DCM:EA, 6:1), получая метил 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилат (800 мг; 29%). 1Н ЯМР (300 МГц, хлороформ-d) δ 4.06 (s, 3Н), 8.03 (s, 2Н).
Стадия 2. 3-Амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемой смеси метил 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (200 мг; 0,79 ммоль; 1 экв.) в THF (50 мл) по каплям добавляли раствор LiOH (38,0 мг; 1,59 ммоль; 2,02 экв.) в воде (2 мл) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при 40°С. Полученную смесь концентрировали до объема 10 мл под вакуумом. Смесь подкисляли до рН 6, используя раствор HCl (водн.). Выпавшие в осадок твердые вещества собирали фильтрованием и сушили под вакуумом, получая 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновую кислоту (120 мг; 52,91%) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=240,9.
Стадия 3. 3-Амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновой кислоты (130 мг; 0,54 ммоль; 1 экв.), DIE А (209,5 мг; 1,62 ммоль; 3,00 экв.) и 1-(2,6-дифторфенил)метанамина (116,0 мг; 0,81 ммоль; 1,50 экв.) в DMF (10 мл) по каплям добавляли 50%-ный (по массе) Т3Р (687 мг; 1,08 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Реакцию гасили водой при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (110 мг; 55,67%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=366,0. 1Н ЯМР (300 МГц, хлороформ-d) δ 8.00 (s, 3Н), 7.38-7.30 (m, 1H), 6.98 (t, J=7,8 Гц, 2Н), 4.77 (d, J=6,0 Гц, 2Н).
Стадия 4. 3-Амино-N-[(2,6-дифторфенил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 35)
К перемешиваемой смеси 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида (100 мг; 0,27 ммоль; 1 экв.), Cs2CO3 (267,3 мг; 0,82 ммоль; 3 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (128,6 мг; 0,55 ммоль; 2,00 экв.) в 1,4-диоксане (20 мл) порциями добавляли Pd(dppf)Cl2.CH2Cl2 (44,7 мг; 0,05 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 90°С в атмосфере азота. Полученную смесь фильтровали. Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-N-[(2,6-дифторфенил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 35) (40 мг; 33,04%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=439,2; 1Н ЯМР (300 МГц, DMSO-d6) δ 9.18 (t, J=5,9 Гц, 1H), 8.13 (s, 2Н), 7.93 (s, 2Н), 7.76 (d, J=2,6 Гц, 1Н), 7.48-7.25 (m, 1H), 7.08 (t, J=8,0 Гц, 2H), 6.73 (dd, J=9,5; 2,7 Гц, 1H), 6.20 (d, J=9,5 Гц, 1H), 4.61 (d, J=5,9 Гц, 2H), 3.39 (s, 3H).
Пример 36. Получение 3-амино-N-((3-(гидроксиметил)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 36)
СХЕМА 30

Стадия 1. Метил 2-(((трет-бутоксикарбонил)амино)метил)никотинат
К смеси метил 2-(аминометил)пиридин-3-карбоксилата (1 г; 6,02 ммоль; 1 экв.) и TEA (1826,8 мг; 18,05 ммоль; 3,0 экв.) в DCM (30 мл) в круглодонной колбе емкостью 250 мл порциями добавляли Boc2O (1379,0 мг; 6,32 ммоль; 1,05 экв.) при комнатной температуре. Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Полученный раствор разбавляли, используя 50 мл воды. Полученный раствор экстрагировали дихлорметаном (3 × 50 мл), сушили над безводным сульфатом натрия и концентрировали. В результате получали 1,5 г (93,61%) метил 2-([[(трет-бутокси)карбонил]амино]метил)пиридин-3-карбоксилата в виде твердого вещества. LCMS: m/z (ESI), [М+Н]+=267,1.
Стадия 2. трет-Бутил ((3-(гидроксиметил)пиридин-2-ил)метил)карбамат
В круглодонную колбу емкостью 50 мл помещали раствор метил 2-([[(трет-бутокси)карбонил]амино]метил)пиридин-3-карбоксилата (100 мг; 0,38 ммоль; 1 экв.) в THF (5 мл). Затем порциями добавляли LiAlH4, (42,8 мг; 1,13 ммоль; 3 экв.) при 0°С. Полученный раствор перемешивали в течение 1 часа при 0°С в ледяной бане. Затем реакцию гасили, добавляя 0,043 мл воды и 0,172 мл раствора NaOH (15%-ного водн.). Полученные твердые вещества отфильтровывали. Фильтрат концентрировали и получали 85 мг (94,9%) трет-бутил N-[[3-(гидроксиметил)пиридин-2-ил]метил]карбамата в виде твердого вещества. LCMS: m/z (ESI), [М+Н]+=239,2. 1H ЯМР (300 МГц, DMSO-d6) δ 1.40 (9Н, s), 4.28 (2Н, d), 4.58 (2Н, d), 5.31-5.33 (1H, m) 7.00 (1Н, s), 7.29-7.32 (1H, m), 7.77-7.79 (1H, m).
Стадия 3. (2-(Аминометил)пиридин-3-ил)метанол
В круглодонную колбу емкостью 10 мл помещали раствор трет-бутил N-[[3-(гидроксиметил)пиридин-2-ил]метил]карбамата (50 мг; 0,21 ммоль; 1 экв.), TFA (1 мл) в DCM (3 мл). Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Полученную смесь концентрировали и в результате получали 28 мг (96,6%) TFA-соли [2-(аминометил)пиридин-3-ил]метанола в виде твердого вещества. LCMS: m/z (ESI), [М+Н]+=139,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 4.25 (2Н, m) 4.58-4.60 (2Н, m), 7.44 (1H, m), 7.86-7.88 (1H, m), 8.25 (3Н, s), 8.54-8.56 (1H, m).
Стадия 4. 3-Амино-N-((3-(гидроксиметил)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 36)
К смеси [2-(аминометил)пиридин-3-ил]метанола (52,9 мг; 0,38 ммоль; 2,0 экв.), 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (60 мг; 0,19 ммоль; 1 экв.) в DMF (15 мл) в круглодонной колбе емкостью 50 мл добавляли HATU (87,4 мг; 0,23 ммоль; 1,2 экв.) и DIEA (74,3 мг; 0,57 ммоль; 3,0 экв.) при комнатной температуре. Полученный раствор перемешивали в течение 1 часа при комнатной температуре. Затем реакцию гасили, добавляя 20 мл воды. Полученный раствор экстрагировали этилацетатом (3 × 25 мл) и органические слои объединяли. Полученную смесь промывали водой, насыщенной солью (1 × 10 мл). Полученную смесь концентрировали. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 5 мкм, 19*150 мм; подвижная фаза А: вода (с NH4HCOO3 (10 ммоль/л)+0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 30% В до 30% В за 7 мин; 254/220 им; Rt: 6,35 мин). В результате получали 20 мг (24,09%) 3-амино-N-[[3-(гидроксиметил)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 36) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=434,2. 1H ЯМР (300 МГц, DMSO-d6) δ 3.47 (3Н, s), 4.65 (4Н, d), 5.42 (1H, d), 6.32-6.36 (1H, m), 7.29-7.34 (2H, m), 7.35-7.41 (1H, m), 7.75-7.81 (3Н, m), 8.01 (1H, s), 8.30-8.43 (1H, s), 8.35-8.38 (1H, m), 9.36-9.38 (1H, m).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 36.
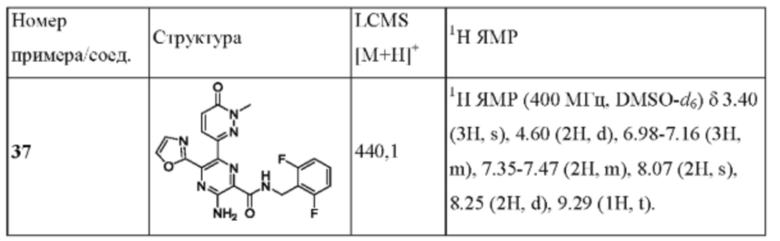
Пример 38. Получение 3-амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 38)
СХЕМА 31
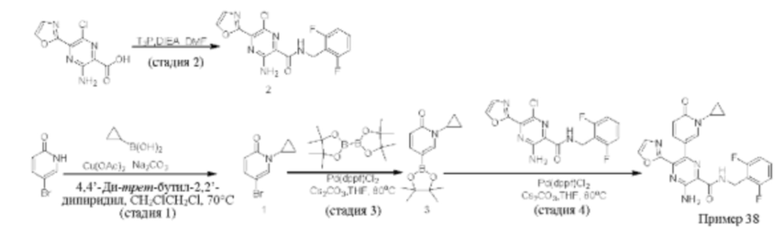
Стадия 1. 5-Бром-1-циклопропил-1,2-дигидропиридин-2-он
К смеси 5-бром-1,2-дигидропиридин-2-она (2 г; 11,49 ммоль; 1 экв.), циклопропилбороновой кислоты (2,0 г; 23,28 ммоль; 2,03 экв.) и Cu(АсО)2 (2,1 г; 0,01 ммоль; 1 экв.) в CH2ClCH2Cl (50 мл) добавляли Na2CO3 (2,4 г; 0,02 ммоль; 2 экв.) и 4,4-ди-трет-бутил-2,2-дипиридил (3,1 г; 0,01 ммоль; 1 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 12 часов при 70°С в атмосфере азота. Растворитель удаляли при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (20:1), получая 5-бром-1-циклопропил-1,2-дигидропиридин-2-он (600 мг; 24,39%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=213,9; 215,9. 1Н ЯМР: (300 МГц, CDCl3) δ 0.86 (tdd, 2Н), 1.13 (m, 2Н), 3.31 (tt, 1Н), 6.48 (m, 1H), 7.34 (m, 2H).
Стадия 2. 3-Амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид
К раствору 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (50 мг; 0,21 ммоль; 1 экв.) и 1-(2,6-дифторфенил)метанамина (44,6 мг; 0,31 ммоль; 1,5 экв.) в DMF (5 мл) добавляли Т3Р (132,2 мг; 0,42 ммоль; 2,00 экв.) и DIEA (80,6 мг; 0,62 ммоль; 3 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в воздушной атмосфере и концентрировали под вакуумом. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (120 мг; 39,47%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=366,0. 1H ЯМР: (300 МГц, DMSO-d6) δ 4.53 (d, 2Н), 7.06 (d, 2Н), 7.37 (q, 1H), 7.55 (s, 1H), 7.85 (s, 2Н), 8.39 (s, 1H), 9.08 (t, 1Н).
Стадия 3. 1-Циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-он
К раствору 5-бром-1-циклопропил-1,2-дигидропиридин-2-она (100 мг; 0,47 ммоль; 1 экв.) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (177,9 мг; 0,70 ммоль; 1,50 экв.) в THF (10 мл) добавляли KOAc (137,5 мг; 1,40 ммоль; 3,00 экв.) и Pd(dppf)Cl2.CH2Cl2 (38,1 мг; 0,05 ммоль; 0,1 экв.) в воздушной атмосфере при комнатной температуре. Смесь перемешивали в течение 2 часов при 80°С в атмосфере азота. Этот полученный раствор 1-циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она в THF (10 мл) использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=262,1.
Стадия 4. 3-Амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 38)
К раствору 1-циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (100 мг; 0,38 ммоль; 1 экв.) в THF (10 мл) добавляли 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (280,1 мг; 0,77 ммоль; 2 экв.), Cs2CO3 (249,5 мг; 0,77 ммоль; 2,00 экв.) и Pd(dppf)Cl2.CH2Cl2 (31,3 мг; 0,04 ммоль; 0,1 экв.) в атмосфере азота. Смесь перемешивали в течение 2 часов при 80°С в атмосфере азота и концентрировали под вакуумом. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 38) (20 мг; 11,25%) в виде желтого твердого вещества.
LCMS: m/z (ESI), [М+Н]+=465,2. 1Н ЯМР: (300 МГц, MeOD) δ 0.93 (dd, 2Н), 1.12 (m, 2Н), 2.00 (s, 1Н), 4.73 (s, 2H), 6.52 (d, 1H), 7.01 (t, 2H), 7.36 (m, 1H), 7.56 (dd, 1H), 7.84 (d, 1H), 8.08 (d, 1H).
Пример 39. Получение 3-амино-N-[[2-фтор-6-(морфолин-4-ил)фенил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 39)
СХЕМА 32
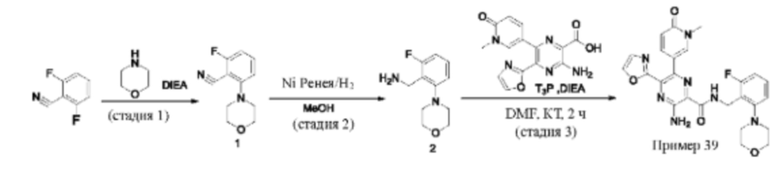
Стадия 1. 2-Фтор-6-(морфолин-4-ил)бензонитрил
К перемешиваемой смеси 2,6-дифторбензонитрила (1000 мг; 7,19 ммоль; 1 экв.) и морфолина (939,5 мг; 10,78 ммоль; 1,5 экв.) в DMSO (10 мл) порциями добавляли DIEA (1858,2 мг; 14,38 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2,5 ч при 80°С в воздушной атмосфере. Полученную смесь разбавляли водой (200 мл). Полученную смесь экстрагировали EtOAc (2 × 300 мл). Объединенные органические слои промывали водой (2 × 100 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении, получая 2-фтор-6-(морфолин-4-ил)бензонитрил (637 мг; 42,97%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=207,0. 1Н ЯМР (400 МГц, хлороформ-d) δ 3.21-3.28 (m, 4Н), 3.85-3.92 (m, 4Н), 6.78 (dt, J=8,4; 4,2 Гц, 2Н), 7.47 (td, J=8,4; 6,6 Гц, 1H).
Стадия 2. 1-[2-Фтор-6-(морфолин-4-ил)фенил]метанамин
К раствору 2-фтор-6-(морфолин-4-ил)бензонитрила (200 мг; 0,97 ммоль; 1 экв.) в МеОН добавляли Ni Ренея (166,2 мг; 1,94 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1,5 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (2×10 мл). Фильтрат концентрировали при пониженном давлении, получая 1-[2-фтор-6-(морфолин-4-ил)фенил]метанамин (150 мг; 73,56%) в виде белого масла, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=211,2.
Стадия 3. 3-Амино-N-[[2-фтор-6-(морфолин-4-ил)фенил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 39)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (200 мг; 0,64 ммоль; 1 экв.) и 1-[2-фтор-6-(морфолин-4-ил)фенил]метанамина (134,2 мг; 0,64 ммоль; 1 экв.) в DMF (10 мл) порциями добавляли Т3Р (812,5 мг; 2,55 ммоль; 4 экв.) и DIEA (247,5 мг; 1,92 ммоль; 3 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 2 часов при комнатной температуре в воздушной атмосфере. Полученную смесь выливали в воду (30 мл). Полученное твердое вещество собирали фильтрованием и суспендировали в МеОН (10 мл). Полученное твердое вещество собирали фильтрованием и сушили при пониженном давлении, получая 3-амино-N-[[2-фтор-6-(морфолин-4-ил)фенил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 39) (120 мг; 37,18%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=506,1. 1H ЯМР (400 МГц, DMSO-d6) δ 2.88 (t, J=4,5 Гц, 4Н), 3.34 (s, 3Н), 3.64 (t, J=4,5 Гц, 4Н), 4.72 (d, J=5,8 Гц, 2Н), 6.32 (d, J=9,4 Гц, 1Н), 7.00 (dd, J=9,8; 8,4 Гц, 1H), 7.07 (d, J=8,1 Гц, 1H), 7.29-7.43 (m, 3Н), 7.83 (s, 2H), 7.97 (d, J=2,6 Гц, 1H), 8.30 (d, J=0,8 Гц, 1H), 9.14 (t, J=5,8 Гц, 1H).
Получение 40. Получение 3-амино-N-(1-(2,6-дифторфенил)этил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 40)
СХЕМА 33
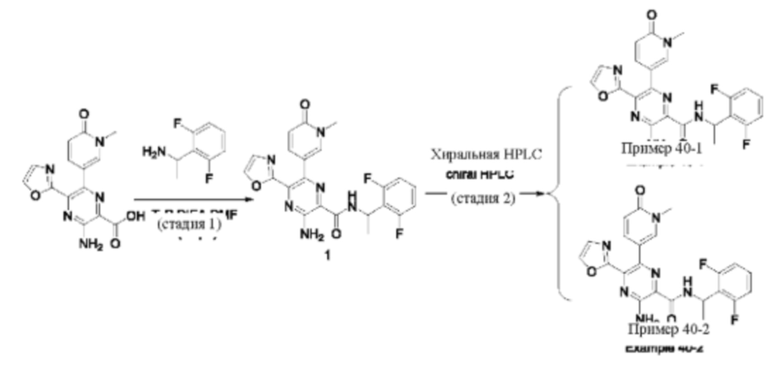
Стадия 1. 3-Амино-N-[1-(2,6-дифторфенил)этил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол 2-ил)пиразин-2-карбоксамид
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,32 ммоль; 1 экв.), Т3Р (242,7 мг; 0,76 ммоль; 2,39 экв.) и DIE А (123,8 мг; 0,96 ммоль; 3 экв.) в DMF (10 мл) порциями добавляли 1-(2,6-дифторфенил)этан-1-амин (75,3 мг; 0,48 ммоль; 1,5 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь выливали в воду (30 мл). Полученное твердое вещество собирали фильтрованием и суспендировали в МеОН (10 мл). Полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-N-[1-(2,6-дифторфенил)этил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (40 мг; 27,42%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=453,0.
Стадия 2. 3-Амино-N-(1-(2,6-дифторфенил)этил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 40-1 и соединение 40-2)
Рацемический продукт (60 мг) очищали препаративной хиральной HPLC на элюенте. Колонка: CHIRALPAK IG, 20*250 мм, 5 мкм; подвижная фаза A: Hex:DCM=5:1 (с 10 мМ NH3-MEOH) для HPLC, подвижная фаза В: EtOH для HPLC; скорость потока: 16 мл/мин; градиент: от 50 В до 50 В за 16 мин; 220/254 нм; Rt1: 10,8; Rt2: 12,8. В результате получали 3-амино-N-(1-(2,6-дифторфенил)этил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (изомер 1) (соединение 40-1) (15 мг) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=453. 1Н ЯМР: (400 МГц, MeOD) δ 1.62 (d, 3Н), 3.64 (s, 3Н), 5.68 (q, 1H), 6.53 (m, 1H), 7.00 (m, 2Н), 7.32 (m, 2Н), 7.49 (dd, 1H), 7.93 (d, 1H), 8.03 (d, 1Н). Для хирального соединения: tR=1,967 мин; и 3-амино-N-(1-(2,6-дифторфенил)этил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (изомер 2) (соединение 40-2) (15 мг) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=453,2. 1H ЯМР: (400 МГц, MeOD) δ 1.62 (d, 3Н), 3.64 (s, 3Н), 5.68 (q, 1Н), 6.53 (dd, 1H), 6.99 (m, 2H), 7.32 (m, 2H), 7.50 (dd, 1H), 7.93 (d, 1H), 8.03 (d, 1H). Для хирального соединения: tR=2,500 мин, для смеси хиральных соединений: tR=1,981 мин; 2,480 мин.
Пример 41. Получение 3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксиэтил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 41)
СХЕМА 34

Стадия 1. 5-Бром-1-(2-гидроксиэтил)пиридин-2(1Н)-он
К смеси 5-бром-1,2-дигидропиридин-2-она (2 г; 11,49 ммоль; 1 экв.), 2-иодэтан-1-ола (4,0 г; 22,98 ммоль; 1,999 экв.) в DMSO (30 мл) в круглодонной колбе емкостью 50 мл добавляли K2CO3 (4,8 г; 34,47 ммоль; 2,999 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 16 часов при комнатной температуре. Затем реакцию гасили, добавляя 50 мл воды. Полученный раствор экстрагировали этилацетатом (3×50 мл) и органические слои объединяли. Полученные органические слои промывали насыщ. раствором NaCl (3×50 мл). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали под вакуумом. Остаток наносили на колонку с силикагелем со смесью этилацетат/петролейный эфир (1:2), получая 330 мг (12%) 5-бром-1-(2-гидроксиэтил)-1,2-дигидропиридин-2-она в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=218,1. 1Н ЯМР (400 МГц, хлороформ-d) δ 3.93 (2Н, s), 4.08 (2Н, s), 4.41-4.53 (1H, m), 6.49 (1H, d), 7.66-7.69 (2Н, m).
Стадия 2. 3-Амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксиэтил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 41)
В круглодонную колбу емкостью 50 мл помещали 5-бром-1-(2-гидроксиэтил)-1,2-дигидропиридин-2-он (298,1 мг; 1,37 ммоль; 5 экв.), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (416,6 мг; 1,64 ммоль; 6 экв.), Pd(dppf)Cl2 (120,0 мг; 0,16 ммоль; 0,60 экв.), KOAc (80,5 мг; 0,82 ммоль; 3 экв.), диоксан (15 мл). Полученный раствор перемешивали в течение 2 часов при 80°С в масляной бане. Полученную смесь непосредственно использовали на следующей стадии. К этой смеси добавляли 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (100 мг; 0,27 ммоль; 1 экв.), Pd(dppf)Cl2 (100,0 мг; 0,14 ммоль; 0,5 экв.), K3PO4 (348,2 мг; 1,64 ммоль; 6,00 экв.), диоксан (15 мл) и воду (10 мл). Полученный раствор оставляли для осуществления взаимодействия с перемешиванием в атмосфере N2 еще на 16 часов при 80°С в масляной бане. Полученную смесь концентрировали. Полученный раствор экстрагировали этилацетатом (3×30 мл). Органические слои концентрировали. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 5 мкм, 30*150 мм; подвижная фаза А: вода (с NH4HCO3, 10 ммоль/л), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 18% В до 42% В за 7 мин; 254/220 нм; Rt: 6,42 мин). В результате получали 3-амино-N-[(2,6-дифторфенил)метил]-6-[1-(2-гидроксиэтил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 41) (20 мг; 15,3%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=469,2. 1Н ЯМР (300 МГц, DMSO-J6) δ 3.61-3.63 (2Н, m), 3.91-3.94 (2Н, m), 4.60 (2Н, d), 4.86-4.89 (2Н, m), 6.32-6.35 (1Н, m), 7.04-7.12 (2Н, m), 7.34-7.39 (3Н, m), 7.40-7.41 (2Н, m), 7.45-7.48 (1H, m), 8.28 (1H, s), 9.09-9.11 (1H, m).
Пример 42. Получение 3-амино-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)-6-[1-(оксетан-3-ил)-6-оксо-1,6-дигидропиридин-3-ил]пиразин-2-карбоксамида (соединения 42)
СХЕМА 35
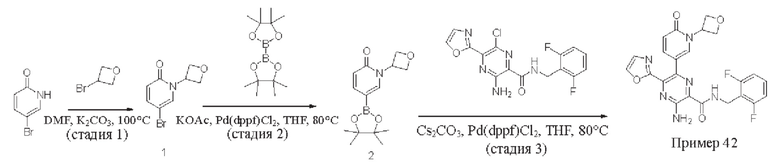
Стадия 1. 5-Бром-1-(оксетан-3-ил)-1,2-дигидропиридин-2-он
К перемешиваемой смеси 5-бром-1,2-дигидропиридин-2-она (200 мг; 1,15 ммоль; 1 экв.) и 3-бромоксетана (629,8 мг; 4,60 ммоль; 4 экв.) в DMF (10 мл) порциями добавляли K2CO3 (476,6 мг; 3,45 ммоль; 3 экв.) при КТ в воздушной атмосфере. Полученную смесь перемешивали в течение 3 часов при 100°С в воздушной атмосфере. Полученную смесь выливали в воду. Полученную смесь экстрагировали CH2Cl2 (2×100 мл). Объединенные органические слои промывали водой (1×30 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (10:1), получая 5-бром-1-(оксетан-3-ил)-1,2-дигидропиридин-2-он (120 мг; 45,38%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=230,0. 1Н ЯМР (400 МГц, хлороформ-d) δ 4.66-4.74 (m, 2Н), 4.96 (ddd, J=7,3; 6,2; 1,0 Гц, 2Н), 5.55 (tt, J=6,3; 5,3 Гц, 1H), 6.71 (dd, J=8,8; 0,7 Гц, 1Н), 7.67 (dd, J=8,7; 2,5 Гц, 1Н), 8.11 (dd, J=2,6; 0,7 Гц, 1H).
Стадия 2. 1-(Оксетан-3-ил)-5-(4,4,5,5-тетраметил-1,3.2-диоксаборолан-2-ил)пиридин-2(1H)-он
К перемешиваемой смеси 5-бром-1-(оксетан-3-ил)-1,2-дигидропиридин-2-она (230 мг; 1,00 ммоль; 1 экв.) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (507,7 мг; 2,00 ммоль; 2 экв.) в THF (7 мл) порциями добавляли KOAc (294,3 мг; 3,00 ммоль; 3 экв.) и Pd(dppf)Cl2 (146,3 мг; 0,20 ммоль; 0,2 экв.) при КТ в атмосфере азота. Полученную смесь перемешивали в течение 3 часов при 80°С в атмосфере азота. Полученную смесь использовали на следующей стадии непосредственно без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=278,2.
Стадия 3. 3-Амино-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)-6-[1-(оксетан-3-ил)-6-оксо-1,6-дигидропиридин-3-ил]пиразин-2-карбоксамид (соединение 42)
К перемешиваемому(ой) раствору/смеси 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (200 мг; 0,55 ммоль; 1 экв.) и 1-(оксетан-3-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (151,6 мг; 0,55 ммоль; 1 экв.) в THF (20 мл) порциями добавляли Pd(dppf)Cl2 (80,0 мг; 0,11 ммоль; 0,20 экв.) и Cs2CO3 (534,5 мг; 1,64 ммоль; 3,00 экв.) при КТ в атмосфере азота. Полученную смесь перемешивали в течение 3 часов при 80°С в атмосфере азота. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30*150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3.H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 25% В до 50% В за 7 мин; 254/220 нм; Rt: 5,20 мин), получая 3-амино-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)-6-[1-(оксетан-3-ил)-6-оксо-1,6-дигидропиридин-3-ил]пиразин-2-карбоксамид (5 мг; 1,90%) (соединение 42) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=481,2. 1H ЯМР (300 МГц, DMSO-d6) δ 4.58 (d, J=5,8 Гц, 2Н), 4.66 (t, J=7,0 Гц, 2Н), 4.83 (t, J=7,4 Гц, 2Н), 5.56 (р, J=7,3 Гц, 1Н), 6.37 (d, J=9,4 Гц, 1H), 7.07 (t, J=8,0 Гц, 2Н), 7.28-7.45 (m, 2Н), 7.60 (dd, J=9,4; 2,5 Гц, 1H), 7.75 (s, 2Н), 7.96 (d, J=2,5 Гц, 1H), 8.29 (d, J=0,8 Гц, 1H), 9.11 (t, J=5,9 Гц, 1Н).
Пример 45. Получение 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(1,3-тиазол-4-ил)метил]пиразин-2-карбоксамида (соединения 45)
СХЕМА 36
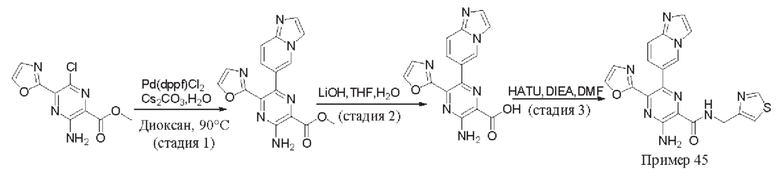
Стадия 1. Метил 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (1200 мг; 4,71 ммоль; 1 экв.) и 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридина (1725,6 мг; 7,07 ммоль; 1,50 экв.) в диоксане (20 мл) и воде (2 мл) порциями добавляли Pd(dppf)Cl2 (689,7 мг; 0,94 ммоль; 0,2 экв.) и Cs2CO3 (3071,0 мг; 9,43 ммоль; 2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 90°С. Смесь оставляли охлаждаться до комнатной температуры. Полученную смесь фильтровали, осадок на фильтре промывали DCM (3×10 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (50:1), получая метил 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (1200 мг; 75,71%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=337. 1Н ЯМР (DMSO-d6, 400 МГц) δ 3.9 (3Н, s), 7.1 (1H, dd, J=9,4; 1,8 Гц), 7.4 (1H, s), 7.5 (1H, d, J=9,3 Гц), 7.6 (1H, d, J=1,2 Гц), 7.7 (2Н, s), 8.0 (1H, s), 8.3 (1H, s), 8.7 (1H, t,J=1,4 Гц).
Стадия 2. 3-Амино-6-[имидазо[1.2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (2,5 г; 7,4 ммоль; 1 экв.) в THF (30 мл) порциями добавляли LiOH (0,2 г; 8,4 ммоль; 1,12 экв.) и H2O (5 мл) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 4 часов при комнатной температуре и подкисляли до рН 6, используя 1 н. водн. раствор HCl, полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (2 г; 83,5%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=323,2. 1Н ЯМР (DMSO-d6, 400 МГц) δ 3.9 (3Н, s), 7.1 (1H, dd, J=9,4; 1,8 Гц), 7.4 (1H, s), 7.5 (1H, d, J=9,3 Гц), 7.6 (1Н, d,J=1,2 Гц), 7.7 (2Н, s), 8.0 (1H, s), 8.3 (1H, s), 8.7 (1H, t,J=1,4 Гц).
Стадия 3. 3-Амино-6-[имидазо[1,2-а]пиридин-6-ил1-5-(1,3-оксазол-2-ил)-N-[(1,3-тиазол-4-ил)метил]пиразин-2-карбоксамид (соединение 45)
К перемешиваемой смеси 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,31 ммоль; 1 экв.) и 1-(1,3-тиазол-4-ил)метанамина (70,9 мг; 0,6 ммоль; 2,0 экв.) в DMF (3 мл) порциями добавляли HATU (471,9 мг; 1,2 ммоль; 4,0 экв.) и DIE А (160,4 мг; 1,2 ммоль; 4,0 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 60 мин при комнатной температуре. Полученную смесь выливали в воду (30 мл), полученное твердое вещество собирали фильтрованием и суспендировали в МеОН (16 мл), полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(1,3-тиазол-4-ил)метил]пиразин-2-карбоксамид (соединение 45) (43 мг; 32,8%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=419,2. 1H ЯМР (DMSO-d6, 400 МГц) δ 2.6 (3Н, s), 4.6 (2Н, d, J=6,2 Гц), 7.2 (1H, s), 7.3-7.4 (2Н, m), 7.6 (1H, d, J=9,3 Гц), 7.8 (1H, s), 8.0 (1Н, s), 8.0 (1H, s), 8.3 (1Н, s), 8.9 (1H, s), 9.3 (1H, t, J=6,1 Гц).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 45.
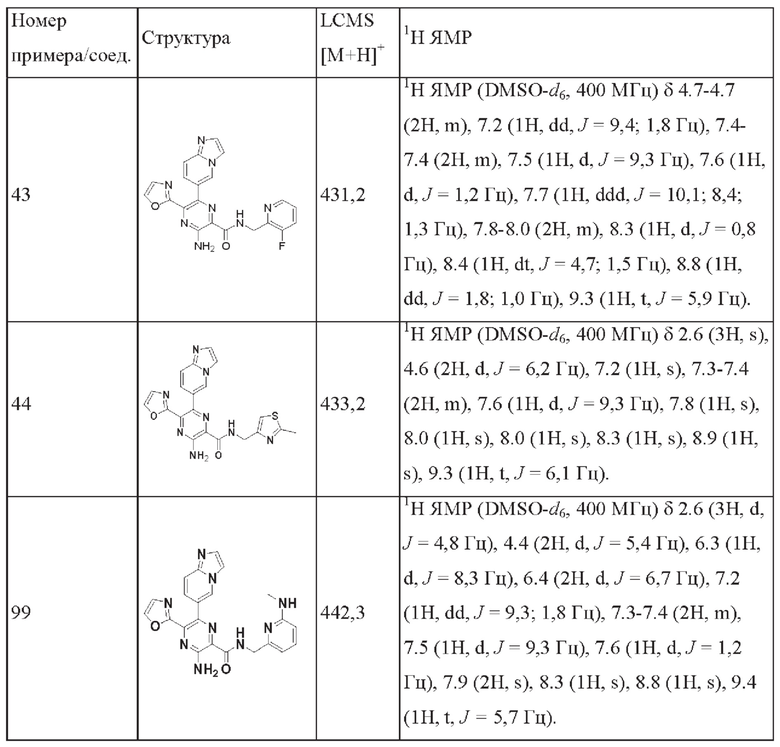
Пример 46. Получение 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-((3-(метиламино)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 46)
СХЕМА 37
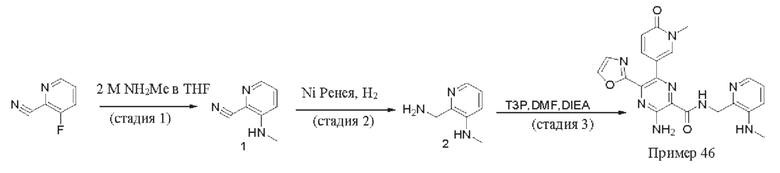
Стадия 1. 3-(Метиламино)пиколинонитрил
К раствору 3-фторпиридин-2-карбонитрила (500 мг; 4,09 ммоль; 1 экв.) в THF (20 мл) добавляли метанамин (190,8 мг; 6,14 ммоль; 1,50 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 50°С. Реакцию гасили путем добавления воды (10 мл) при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и сушили при пониженном давлении, получая 3-(метиламино)пиридин-2-карбонитрил (300 мг; 55,02%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=134,0.
Стадия 2. 2-(Аминометил)-N-метилпиридин-3-амин
К перемешиваемому раствору 3-(метиламино)пиридин-2-карбонитрила (100 мг; 0,75 ммоль; 1 экв.) в THF (15 мл) порциями добавляли Ni Ренея (128,7 мг; 1,50 ммоль; 2,00 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 5 часов при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (20 мл). Фильтрат концентрировали при пониженном давлении, получая 2-(аминометил)-N-метилпиридин-3-амин (90 мг; 87,35%) в виде коричневого полутвердого вещества. LCMS: m/z (ESI), [М+Н]+=138,0.
Стадия 3. 3-Амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-((3-(метиламино)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 46)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (70 мг; 0,22 ммоль; 1 экв.) и 2-(аминометил)-N-метилпиридин-3-амина (36,8 мг; 0,27 ммоль; 1,20 экв.) в DMF (10 мл) порциями добавляли DIEA (86,6 мг; 0,67 ммоль; 3 экв.) и Т3Р (142,2 мг; 0,45 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при комнатной температуре. Реакцию гасили водой (40 мл) при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и промывали водой (10 мл). Продукт обладал плохой растворимостью, и его очищали растиранием с DMF (5 мл). Полученное желтое твердое вещество собирали фильтрованием, промывали метанолом (10 мл) и сушили под инфракрасным излучением, получая 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-[[3-(метиламино)пиридин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 46) (20 мг; 19,46%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=433,2; 1Н ЯМР (300 МГц, DMSO-d6) δ 2.74 (d, J=4,5 Гц, 3Н), 3.47 (s, 3Н), 4.46 (d, J=5,3 Гц, 2Н), 5.68 (d, J=5,0 Гц, 1Н), 6.33 (d, J=9,4 Гц, 1H), 6.88 (d, J=7,9 Гц, 1H), 7.13 (dd, J=8,0; 4,8 Гц, 1H), 7.30-7.47 (m, 2H), 7.69-7.90 (m, 3H), 8.01 (d, J=2,6 Гц, 1H), 8.29 (s, 1H), 9.40 (d, J=5,4 Гц, 1H).
Пример 47. Получение 3-амино-6-(1Н-1,3-бензодиазол-5-ил)-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 47)
СХЕМА 38

Стадия 1. 3-Амино-6-хлор-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемой смеси 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (2000 мг; 8,31 ммоль; 1 экв.) и 1-(3-фторпиридин-2-ил)метанамина (1572,7 мг; 12,47 ммоль; 1,5 экв.) в DMF (20 мл) порциями добавляли DIEA (4297,4 мг; 33,25 ммоль; 4 экв.) и Т3Р (10579,6 мг; 33,25 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь выливали в воду. Полученное твердое вещество собирали фильтрованием и сушили под инфракрасной лампой, получая 3-амино-6-хлор-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (2,2 г; 75,89%) в виде желто-зеленого вещества. LCMS: m/z (ESI), [М+Н]+=349,1. 1Н ЯМР (400 МГц, DMSO-d6) δ 4.68 (dd, J=5,7; 1,7 Гц, 2Н), 7.43 (dt, J=8,6; 4,4 Гц, 1Н), 7.59 (s, 1H), 7.73 (ddd, J=10,0; 8,4; 1,3 Гц, 1H), 7.92 (s, 2H), 8.38-8.46 (m, 2H), 9.17 (t, J=5,7 Гц, 1H).
Стадия 2. 3-Амино-6-(1Н-1,3-бензодиазол-5-ил)-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 47)
К раствору 3-амино-6-хлор-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (100 мг; 0,29 ммоль; 1 экв.) и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-1,3-бензодиазола (140,0 мг; 0,57 ммоль; 2 экв.) в 1,4-диоксане (10 мл) и H2O (1 мл) добавляли Cs2CO3 (186,9 мг; 0,57 ммоль; 2 экв.) и Pd(dppf)Cl2 (21,0 мг; 0,03 ммоль; 0,1 экв.) в атмосфере N2. Полученную смесь перемешивали в течение 24 часов при 90°С в атмосфере азота и концентрировали под вакуумом. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3.H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 21% В до 31% В за 7 мин; 254/220 нм; Rt: 6,45 мин), получая 3-амино-6-(1Н-1,3-бензодиазол-5-ил)-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 47) (12 мг; 16,20%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=431,1. 1Н ЯМР: (300 МГц, DMSO-d6) δ 4.73 (m, 2Н), 7.23 (dd, 1H), 7.34 (s, 1H), 7.41 (dt, 1H), 7.55 (d, 1H), 7.72 (m, 4Н), 8.19 (s, 1H), 8.30 (s, 1H), 8.38 (dt, 1H), 9.31 (t, 1H), 13.12 (s, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 47.
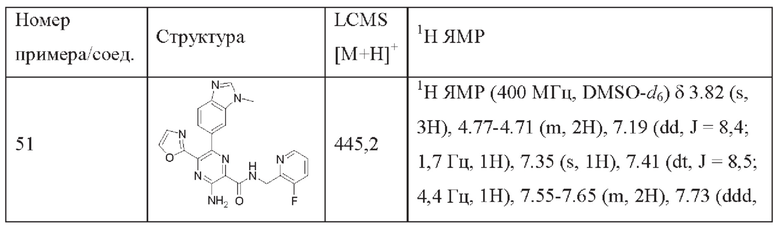
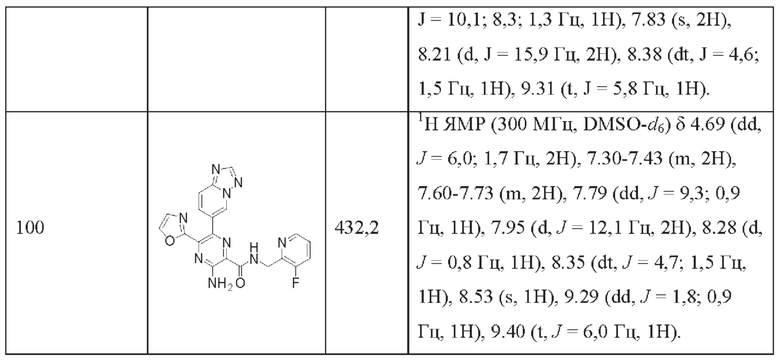
Пример 48. Получение 5-(2,6-диметилпиридин-4-ил)-6-(4-фторфенил)-N4-(2-((3-фторпиридин-2-ил)амино)этил)пиримидин-2,4-диамина (соединения 48)
СХЕМА 39
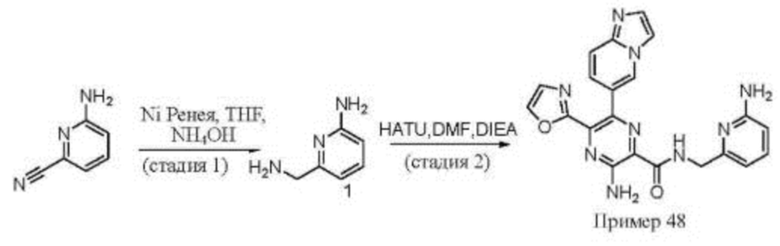
Стадия 1. 6-(Аминометил)пиридин-2-амин
К смеси 6-аминопиридин-2-карбонитрила (100 мг; 0,8 ммоль; 1 экв.) и Ni Ренея (21,6 мг; 0,3 ммоль; 0,3 экв.) в THF (10 мл) по каплям добавляли NH4OH (1 мл) при комнатной температуре. Полученную смесь перемешивали в течение еще 40 мин при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали и фильтрат концентрировали при пониженном давлении, получая 6-(аминометил)пиридин-2-амин (80 мг; 77,4%) в виде светло-коричневого масла, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=124,3.
Стадия 2. 3-Амино-N-[(6-аминопиридин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 48)
К перемешиваемому(ой) раствору/смеси 3-амино-6-[имидазо[1,2-а]пиридин-6 ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,3 ммоль; 1 экв.) и 6-(аминометил)пиридин-2-амина (76,4 мг; 0,6 ммоль; 2,0 экв.) в DMF (3 мл) по каплям/порциями добавляли HATU (471,9 мг; 1,2 ммоль; 4,0 экв.) и DIEA (160,4 мг; 1,2 ммоль; 4,0 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 30 мин при комнатной температуре. Полученную смесь по каплям добавляли в воду. Полученную смесь фильтровали, осадок на фильтре промывали водой (3×10 мл). Неочищенный продукт перекристаллизовывали из смеси DCM/MeOH (5:1, 6 мл), получая 3-амино-N-[(6-аминопиридин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 48) (89 мг; 66,1%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=428,1. 1H ЯМР (DMSO-d6, 400 МГц) δ 4.4 (2Н, d, J=6,1 Гц), 5.9 (2Н, d,J=6,0 Гц), 6.3 (1H, d, J=8,1 Гц), 6.4 (1H, d, J=7,2 Гц), 7.2 (1H, dd, J=9,4; 1,8 Гц), 7.3 (1H, t, J=7,8 Гц), 7.4 (1Н, s), 7.5 (1Н, d, J=9,4 Гц), 7.6 (1Н, d, J=1,3 Гц), 7.9 (3Н, s), 8.3 (1H, s), 8.8 (1H, t, J=1,4 Гц), 9.3 (1H, t, J=6,2 Гц).
Пример 49. Получение 3-амино-N-((6-амино-3-фторпиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 49)
СХЕМА 40
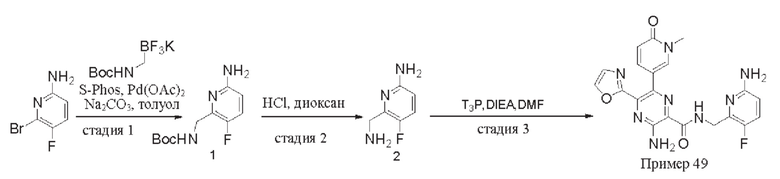
Стадия 1. трет-Бутил (6-амино-3-фторпиридин-2-ил)метилкарбамат
К перемешиваемой смеси 6-бром-5-фторпиридин-2-амина (19 мг; 0,10 ммоль; 1 экв.), Na2CO3 (42,2 мг; 0,40 ммоль; 4 экв.) и трет-бутил N-[(трифторборануидил)метил]карбамата калия (70,7 мг; 0,30 ммоль; 3 экв.) в толуоле (20 мл) и воде (3 мл) порциями добавляли S-Phos (12,3 мг; 0,03 ммоль; 0,3 экв.) и Pd(AcO)2 (6,7 мг; 0,03 ммоль; 0,3 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 100°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая трет-бутил N-[(6-амино-3-фторпиридин-2-ил)метил]карбамат (130 мг; 41,17%) в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=242,1.
Стадия 2. 6-(Аминометил)-5-фторпиридин-2-амин
К перемешиваемому раствору трет-бутил N-[(6-амино-3-фторпиридин-2-ил)метил]карбамата (120 мг; 0,50 ммоль; 1 экв.) в DCM (5 мл) по каплям добавляли раствор HCl (газ.) в 1,4-диоксане (362,7 мг; 9,95 ммоль; 20 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали, получая 6-(аминометил)-5-фторпиридин-2-амин (100 мг; 142,44%) в виде беловатого твердого вещества, которое использовали на следующей стадии без очистки. 1Н ЯМР (300 МГц, DMSO-d6) δ 3.98 (d, J=5,8 Гц, 2Н), 6.64 (dd, J=9,1; 3,3 Гц, 1H), 7.53 (t, J=9,1 Гц, 1Н).
Стадия 3. 3-Амино-N-((6-амино-3-фторпиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 49)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (90 мг; 0,29 ммоль; 1 экв.), 6-(аминометил)-5-фторпиридин-2-амина (61,2 мг; 0,43 ммоль; 1,51 экв.) и DIEA (149,3 мг; 1,15 ммоль; 4,02 экв.) в DMF (10 мл) по каплям добавляли Т3Р (182,8 мг; 0,57 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Реакцию гасили путем добавления воды (40 мл) при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и промывали метанолом (20 мл), получая 3-амино-N-[(6-амино-3-фторпиридин-2-ил)метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 49) (30 мг; 15,95%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=437,2. 1Н ЯМР (300 МГц, DMSO-d6) δ 3.48 (s, 3Н), 4.50 (dd, J=5,8; 2,1 Гц, 2Н), 5.85 (s, 2Н), 6.20-6.47 (m, 2Н), 7.20-7.49 (m, 3Н), 7.81 (s, 2Н), 8.05 (d, J=2,6 Гц, 1H), 8.31 (d, J=0,8 Гц, 1Н), 9.09 (t, J=5,8 Гц, 1H).
Пример 50. Получение 3-амино-N-[[3-фтор-6-(метиламино)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 50)
СХЕМА 41
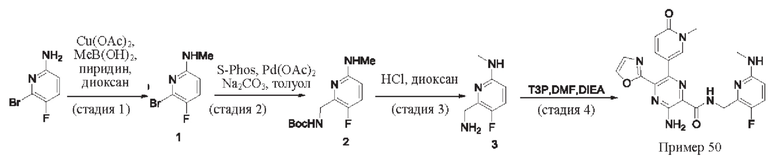
Стадия 1. 6-Бром-5-фтор-N-метилпиридин-2-амин
К перемешиваемой смеси ацетата меди(II) (1,64 г; 9,03 ммоль; 2,5 экв.) и метилбороновой кислоты (540,6 мг; 9,03 ммоль; 2,5 экв.) в диоксане (30 мл) порциями добавляли пиридин (1 г; 12,64 ммоль; 3,5 экв.) и 6-бром-5-фторпиридин-2-амин (690 мг; 3,61 ммоль; 1 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 3 часов при 100°С в воздушной атмосфере. Полученную смесь фильтровали, осадок на фильтре промывали DCM (2×30 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 4:1), получая 6-бром-5-фтор-N-метилпиридин-2-амин (120 мг; 16,20%) в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=205,1; 207,1.
Стадия 2. трет-Бутил (3-фтор-6-(метиламино)пиридин-2-ил)метилкарбамат
К перемешиваемой смеси mpem-бутил N-[(трифторборануидил)метил]карбамата калия (346,9 мг; 1,46 ммоль; 3 экв.) и 6-бром-5-фтор-N-метилпиридин-2-амина (100 мг; 0,49 ммоль; 1 экв.) в толуоле (20 мл) и воде (3 мл) порциями добавляли S-Phos (60,1 мг; 0,15 ммоль; 0,3 экв.), Pd(AcO)2 (32,9 мг; 0,15 ммоль; 0,3 экв.) и Na2CO3 (206,8 мг; 1,95 ммоль; 4,00 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 часов при 95°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая трет-бутил N-[[3-фтор-6-(метиламино)пиридин-2-ил]метил]карбамат (90 мг; 72,28%) в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=256,3.
Стадия 3. 6-(Аминометил)-5-фтор-N-метилпиридин-2-амин
К перемешиваемому раствору трет-бутил N-[[3-фтор-6-(метиламино)пиридин-2-ил]метил]карбамата (80 мг; 0,31 ммоль; 1 экв.) в DCM (5 мл) по каплям добавляли раствор HCl (6 М) (228,9 мг; 6,28 ммоль; 20,03 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при комнатной температуре. Полученную смесь концентрировали при пониженном давлении, получая 6-(аминометил)-5-фтор-N-метилпиридин-2-амин (45 мг; 98,71%) в виде беловатого твердого вещества. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.82 (d, J=2,5 Гц, 3Н), 4.02 (dd, J=5,9; 2,2 Гц, 2Н), 6.49 (d, J=9,6 Гц, 1Н), 7.40 (t, J=8,3 Гц, 1H).
Стадия 4. 3-Амино-N-((3-фтор-6-(метиламино)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 50)
К перемешиваемой смеси 3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (70 мг; 0,22 ммоль; 1 экв.) и 6-(аминометил)-5-фтор-N-метилпиридин-2-амина (38,1 мг; 0,25 ммоль; 1,10 экв.) в DMF (10 мл) по каплям добавляли DIEA (86,6 мг; 0,67 ммоль; 3 экв.) и (3Н3)фосфан (17,9 мг; 0,45 ммоль; 2,00 экв.) 50%-ный в ЕА (этилацетат) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре в воздушной атмосфере. Реакцию гасили водой при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и промывали МеОН (20 мл), получая 3-амино-N-[[3-фтор-6-(метиламино)пиридин-2-ил]метил]-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 50) (25 мг; 24,59%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=451,2. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.63 (d, J=4,7 Гц, 3Н), 3.43 (s, 3Н), 4.51 (dd, J=5,3; 2,1 Гц, 2Н), 6.21-6.42 (m, 2Н), 6.49 (p, J=4,5; 4,0 Гц, 1H), 7.22-7.46 (m, 3Н), 7.82 (s, 2Н), 7.95 (d, J=2,6 Гц, 1H), 8.28 (d, J=0,8 Гц, 1H), 9.21 (t, J=5,2 Гц, 1H).
Пример 52. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(4-фтор-2-метоксибензил)-5-(4-фторфенил)пиразин-2-карбоксамида (соединения 52)
СХЕМА 42
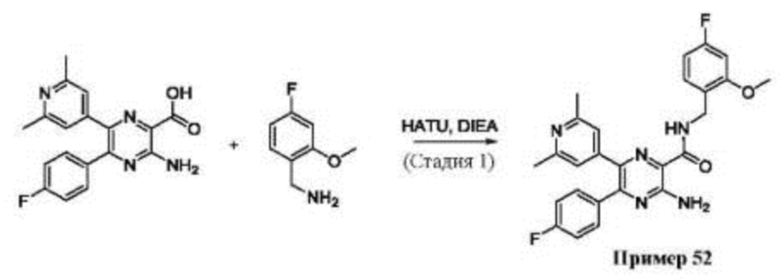
Стадия 1. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(4-фтор-2-метоксибензил)-5-(4-фторфенил)-пиразин-2-карбоксамида (соединения 52)
К смеси 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновой кислоты (0,05 г; 0,15 ммоль), (4-фтор-2-метоксифенил)метанамина (0,03 г; 0,22 ммоль) в DMF (5 мл) добавляли DIEA (0,06 г; 0,44 ммоль) и HATU (0,06 г; 0,15 ммоль) при 20°С. Затем смесь перемешивали при этой температуре в течение 1 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали с использованием колонки RP-C18 и концентрировали, получая продукт 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(4-фтор-2-метоксибензил)-5-(4-фторфенил)пиразин-2-карбоксамид (соединение 52) (0,04 г; выход: 56,9%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=476,1. 1Н ЯМР (500 МГц, DMSO-d6) δ млн-1 2.3 (s, 6Н), 3.9 (s, 3Н), 4.5 (d, J=6,3 Гц, 2Н), 6.7 (td, J=8,4; 2,4 Гц, 1H), 6.9 (d, J=11,2 Гц, 1H), 7.0 (s, 2Н), 7.2-7.2 (m, 3Н), 7.4 (dd, J=8,8; 5,7 Гц, 2Н), 9.1 (t, J=6,3 Гц, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 52.
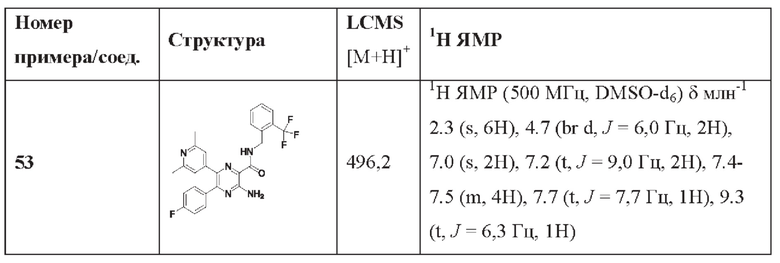
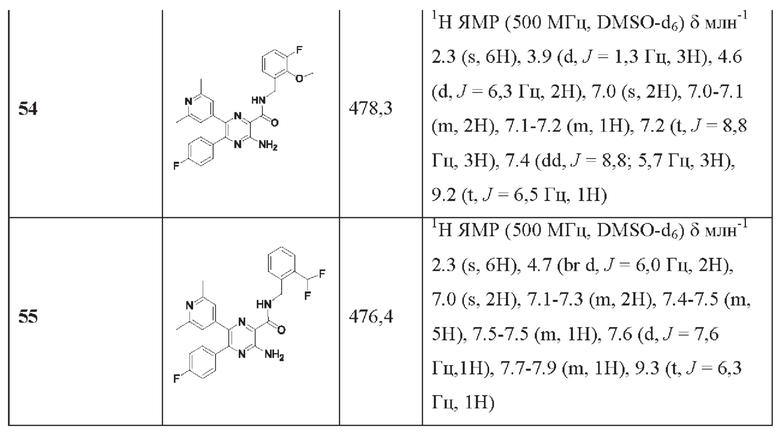
Пример 56. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамида (соединения 56)
СХЕМА 43
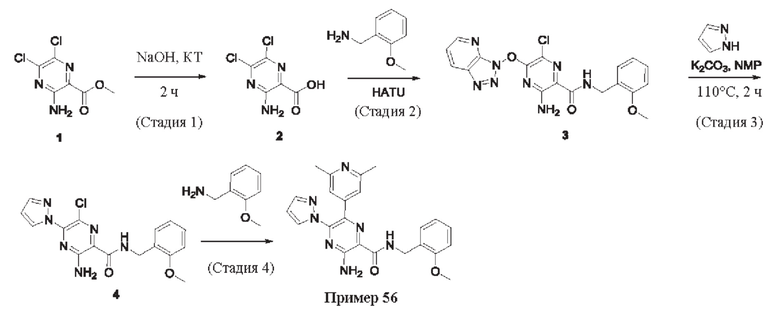
Стадия 1. Получение 3-амино-5,6-дихлорпиразин-2-карбоновой кислоты
К перемешиваемому раствору метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (3,6 г; 16,29 ммоль) в МеОН (20 мл) добавляли NaOH (1,3 г; 32,58 ммоль) при 25°С. Затем смесь перемешивали при этой температуре в течение 16 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор концентрировали, получая неочищенный продукт 3-амино-5,6-дихлорпиразин-2-карбоновую кислоту (2,6 г; выход: 77,1%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=208,1.
Стадия 2. Получение 5-((3Н-[1,2,31 триазоло[4,5-b]пиридин-3-ил)окси)-3-амино-6-хлор-N-(2-метоксибензил)пиразин-2-карбоксамида
К смеси 3-амино-5,6-дихлорпиразин-2-карбоновой кислоты (2,5 г; 12,08 ммоль), (2-метоксифенил)метанамина (1,99 г; 14,5 ммоль) в DMF (20 мл) добавляли DIEA (4,67 г; 36,24 ммоль) и HATU (4,59 г; 12,08 ммоль) при 20°С. Затем смесь перемешивали при этой температуре в течение 1 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали хроматографией на силикагеле и концентрировали, получая продукт 5-((3Н-[1,2,3]триазоло[4,5-b]пиридин-3-ил)окси)-3-амино-6-хлор-N-(2-метоксибензил)пиразин-2-карбоксамид (5 г; выход: 97,1%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=427,2.
Стадия 3. Получение 3-амино-6-хлор-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамида
К перемешиваемому раствору 5-((3Н-[1,2,3]триазоло[4,5-b]пиридин-3-ил)окси)-3-амино-6-хлор-N-(2-метоксибензил)пиразин-2-карбоксамида (0,2 г; 0,47 ммоль) в DMF (5 мл) добавляли 1H-пиразол (0,05 г; 0,7 ммоль) и K2CO3 (0,33 г; 2,35 ммоль) при 110°С. Затем смесь перемешивали при 110°С в течение 3 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали хроматографией на силикагеле и концентрировали, получая продукт 3-амино-6-хлор-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамид (0,14 г; выход: 83,3%) в виде белого твердого вещества. LCMS: m/z (ESI), [M+H]+=359,1.
Стадия 4. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамида (соединения 56)
К смеси 3-амино-6-хлор-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамида (0,07 г; 0,2 ммоль), (2-метоксифенил)метанамина (0,07 г; 0,29 ммоль) в диоксане (10 мл) добавляли K3PO4 (0,12 г; 0,59 ммоль) и Pd2dba3 (0,02 г; 0,02 ммоль) при 120°С. Затем смесь перемешивали при этой температуре в течение 0,5 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор концентрировали и очищали с использованием RP-C18, получая продукт 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамид (соединение 56) (0,017 г; выход: 20,3%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=429,5. 1Н ЯМР (500 МГц, DMSO-d6) δ млн-1 2.3 (s, 6Н), 2.7-2.8 (m, 2Н), 3.5 (br d, J=6,0 Гц, 2Н), 3.7 (s, 3Н), 5.6-5.7 (m, 1Н), 6.3 (br s, 2Н), 6.6 (s, 2Н) 6.7-6.9 (m, 3Н), 7.0 (br t,J=8,7 Гц, 2Н), 7.2 (br t, J=7,1 Гц, 3Н).
Пример 57. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамида (соединения 57)
СХЕМА 44
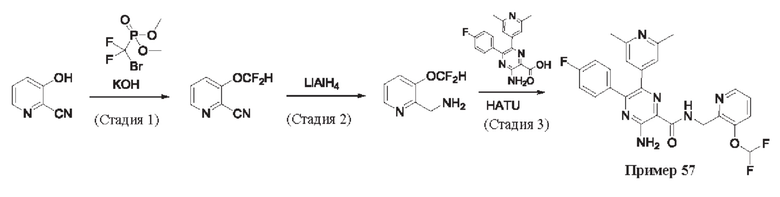
Стадия 1. Получение 3-(дифторметокси)пиколинонитрила
К перемешиваемому раствору 3-гидроксипиколинонитрила (2,2 г; 18,33 ммоль) в ACN (10 мл) и воде добавляли диметил(бромдифторметил)фосфонат (8,72 г; 36,66 ммоль) и КОН (3,08 г; 54,99 ммоль) при -78°С. Затем смесь перемешивали при -78°С в течение 16 ч. LCMS показала завершение реакции. Добавляли воду, смесь экстрагировали ЕА и концентрировали, получая в виде темного масла 3-(дифторметокси)пиколинонитрил. LCMS: m/z (ESI), [М+Н]+=171,4.
Стадия 2. Получение (3-(дифторметокси)пиридин-2-ил)метанамина
К перемешиваемому раствору 3-(дифторметокси)пиколинонитрила (1,5 г; 8,82 ммоль) в THF (20 мл) добавляли LiAlH4 (0,5 г; 13,23 ммоль) при 0°С. Затем смесь перемешивали при 0°С в течение 1 ч. LCMS показала наличие желаемого продукта. Добавляли воду и смесь экстрагировали ЕА. Концентрировали, получая желтое масло. LCMS: m/z (ESI), [М+Н]+=175,1.
Стадия 3. Получение 3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-6-(2.6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида (соединения 57)
К смеси 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновой кислоты (0,03 г; 0,09 ммоль), (3-(дифторметокси)пиридин-2-ил)метанамина (0,02 г; 0,13 ммоль) в DMF (5 мл) добавляли DIEA (0,03 г; 0,27 ммоль) и HATU (0,03 г; 0,09 ммоль) при 20°С. Затем смесь перемешивали при этой температуре в течение 1 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали с использованием RP-C18 и концентрировали, получая продукт 3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-пиразин-2-карбоксамид (соединение 57) (0,03 г; выход: 68,4%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=495,6. 1Н ЯМР (500 МГц, DMSO-d6) δ млн-1 2.3 (s, 6Н), 4.7 (d, J=6,0 Гц, 2Н), 7.0 (s, 2Н), 7.2-7.3 (m, 3Н), 7.3-7.5 (m, 4Н), 7.7 (d, J=8,5 Гц, 1H), 8.4 (d, J=3,5 Гц, 1H), 9.2 (t, J=5,7 Гц, 1H).
Пример 58. Получение 3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 58)
СХЕМА 45
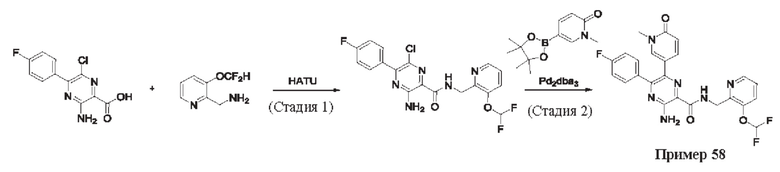
Стадия 1. Получение 3-амино-6-хлор-N-((3-(дифторметокси)пиридин-2-ил)метил)-5-(4-фторфенил)пиразин-2-карбоксамида
К смеси 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновой кислоты (0,12 г; 0,45 ммоль), (3-(дифторметокси)пиридин-2-ил)метанамина (0,08 г; 0,45 ммоль) в DMF (5 мл) добавляли DIEA (0,17 г; 1,35 ммоль) и HATU (0,17 г; 0,45 ммоль) при 20°С. Затем смесь перемешивали при этой температуре в течение 1 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали с использованием RP-C18 и концентрировали, получая продукт 3-амино-6-хлор-N-((3-(дифторметокси)пиридин-2-ил)метил)-5-(4-фторфенил)пиразин-2-карбоксамид (0,07 г; выход: 36,8%) в виде белого твердого вещества. LCMS: m/z (ESI), [M+H]+=424,2.
Стадия 2. Получение 3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,б-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 58)
К смеси 3-амино-6-хлор-N-((3-(дифторметокси)пиридин-2-ил)метил)-5-(4-фторфенил)пиразин-2-карбоксамида (0,06 г; 0,14 ммоль), 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она (0,05 г; 0,21 ммоль) в диоксане (3 мл) добавляли K3PO4 (0,09 г; 0,43 ммоль) и Pd2dba3 (0,01 г; 0,01 ммоль) при 120°С. Затем смесь перемешивали при этой температуре в течение 0,5 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор концентрировали и очищали с использованием RP-C18, получая продукт 3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамид (соединение 58) (0,025 г; выход: 35,5%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=497,2. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 3.4 (s, 3Н), 4.7 (d, J=5,7 Гц, 2Н), 6.2 (d, J=9,5 Гц, 1Н), 7.1 (dd, J=9,5; 2,5 Гц, 1H), 7.2-7.3 (m, 3Н), 7.4 (s, 1H), 7.4 (dd, J=8,5; 4,7 Гц, 1H), 7.5-7.6 (m, 3Н), 7.7 (d, J=8,2 Гц, 1H), 8.0 (d, J=2,5 Гц, 1Н), 8.4 (d, J=4,4 Гц, 1H), 9.2 (t, J=6,0 Гц, 1H).
Пример 59. Получение 3-амино-N-(2-(дифторметокси)фенил)-5-(3-метил-1Н-пиразол-1-ил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 59)
СХЕМА 46
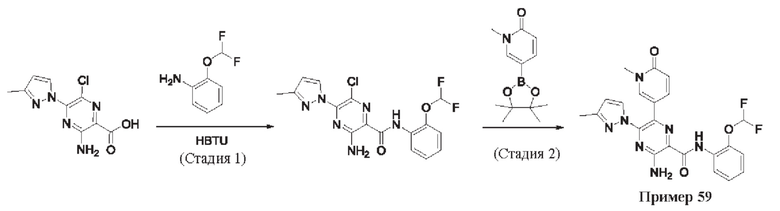
Стадия 1. Получение 3-амино-6-хлор-N-(2-(дифторметокси)фенил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамида
К смеси 3-амино-6-хлор-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоновой кислоты (0,1 г; 0,4 ммоль), 2-(дифторметокси)анилина (0,1 г; 0,59 ммоль) в DMF (5 мл) добавляли DIEA (0,15 г; 1,19 ммоль) и HATU (0,15 г; 0,4 ммоль) при 20°С. Затем смесь перемешивали при этой температуре в течение 1 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали с использованием RP-C18 и концентрировали, получая продукт 3-амино-6-хлор-N-(2-(дифторметокси)фенил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамид (0,05 г; выход: 30,7%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=413,4.
Стадия 2. Получение 3-амино-N-(2-(дифторметокси)фенил)-5-(3-метил-1Н-пиразол-1-ил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 59)
К смеси 3-амино-6-хлор-N-(2-(дифторметокси)фенил)-5-(3-метил-1H-пиразол-1-ил)пиразин-2-карбоксамида (0,03 г; 0,07 ммоль), 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она (0,03 г; 0,11 ммоль) в диоксане (3 мл) добавляли K3PO4 (0,05 г; 0,22 ммоль) и Pd2dba3 (0,01 г; 0,01 ммоль) при 120°С. Затем смесь перемешивали при этой температуре в течение 0,5 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор концентрировали и очищали с использованием RP-C18, получая продукт 3-амино-N-(2-(дифторметокси)фенил)-5-(3-метил-1Н-пиразол-1-ил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамид (соединение 59) (0,02 г; выход: 56,6%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=486,1. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 2.2 (s, 3Н), 3.5 (s, 3Н), 6.3 (d, J=9,5 Гц, 1Н), 6.4 (d, J=2,5 Гц, 1H), 7.0 (dd, J=9,5; 2,5 Гц, 1H), 7.1-7.5 (m, 5Н), 7.8-7.9 (m, 2Н), 8.1 (d, J=2,2 Гц, 1H), 8.3-8.3 (m, 1H), 10.3 (s, 1Н).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 59.
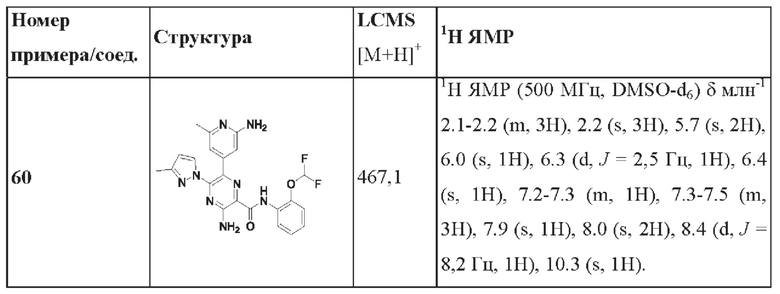
Пример 61. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(5-метилфуран-3-ил)пиразин-2-карбоксамида (соединения 61)
СХЕМА 47
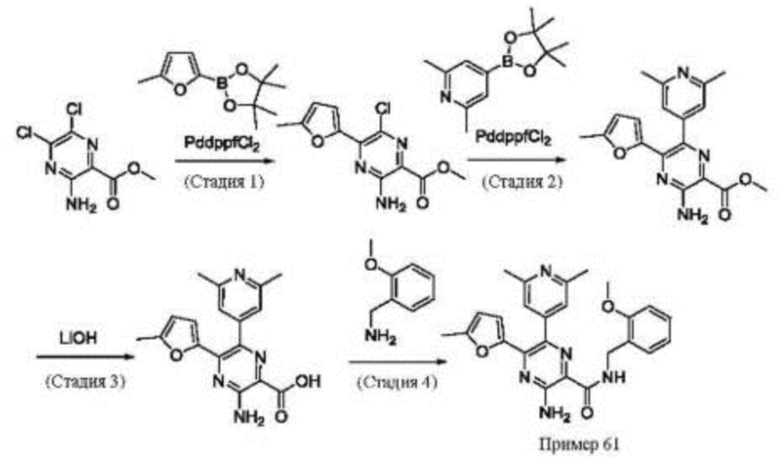
Стадия 1. Получение метил 3-амино-6-хлор-5-(5-метилфуран-3-ил)пиразин-2-карбоксилата
К смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (0,5 г; 2,26 ммоль), 4,4,5,5-тетраметил-2-(5-метилфуран-2-ил)-1,3,2-диоксаборолана (0,71 г; 3,39 ммоль) в диоксане (20 мл) добавляли Na2CO3 (0,94 г; 4,53 ммоль) и Pd(dppf)Cl2 (0,83 г; 1,13 ммоль) при 100°С. Затем смесь перемешивали при этой температуре в течение 2 ч. LCMS показала завершение реакции, и реакционную смесь очищали хроматографией на силикагеле, получая требуемый продукт метил 3-амино-6-хлор-5-(5-метилфуран-3-ил)пиразин-2-карбоксилат.LCMS: m/z (ESI), [М+Н]+=268,4.
Стадия 2. Получение метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксилата
К смеси метил 3-амино-6-хлор-5-(5-метилфуран-3-ил)пиразин-2-карбоксилата (0,26 г; 1 ммоль), 2,6-диметил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (0,23 г; 1 ммоль) в диоксане (20 мл) добавляли Na2CO3 (0,94 г; 4,53 ммоль) и Pd(dppf)Cl2 (0,073 г; 0,1 ммоль) при 100°С. Затем смесь перемешивали при этой температуре в течение 2 ч. LCMS показала завершение реакции, и реакционную смесь очищали хроматографией на силикагеле, получая требуемый продукт метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксилат.LCMS: m/z (ESI), [М+Н]+=339,5.
Стадия 3. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоновой кислоты
К перемешиваемому раствору метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксилата (0,4 г; 1,18 ммоль) в МеОН (20 мл) добавляли NaOH (0,09 г; 2,37 ммоль) при 25°С. Затем смесь перемешивали при этой температуре в течение 16 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×10 мл). После этого органический раствор концентрировали, получая неочищенный продукт 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоновую кислоту (0,3 г; выход: 78,2%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=325,2.
Стадия 4. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамида (соединения 61)
К смеси 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоновой кислоты (0,05 г; 0,15 ммоль), (2-метоксифенил)метанамина (0,021 г; 0,15 ммоль) в DMF (5 мл) добавляли DIEA (0,058 г; 0,45 ммоль) и HATU (0,057 г; 0,15 ммоль) при 20°С. Затем смесь перемешивали при этой температуре в течение 1 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали с использованием RP-C18 и концентрировали, получая продукт 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамид (соединение 61) (0,021 г; выход: 32%) в виде белого твердого вещества. LCMS: m/z (ESI), [M+H]+=444,1. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 2.2 (s, 3H), 2.4 (s, 6H), 3.8 (s, 3H), 4.5 (d, J=6,3 Гц, 2H), 6.2 (d, J=3,2 Гц, 1H), 6.5 (d, J=3,2 Гц, 1H), 6.9 (t, J=7,4 Гц, 1Н), 7.0 (d, J=8,2 Гц, 1H), 7.1-7.2 (m, 3H), 7.2 (t, J=7,1 Гц, 1H), 8.9 (t, J=6,3 Гц, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 61.

Пример 63. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксамида (соединения 63)
СХЕМА 48
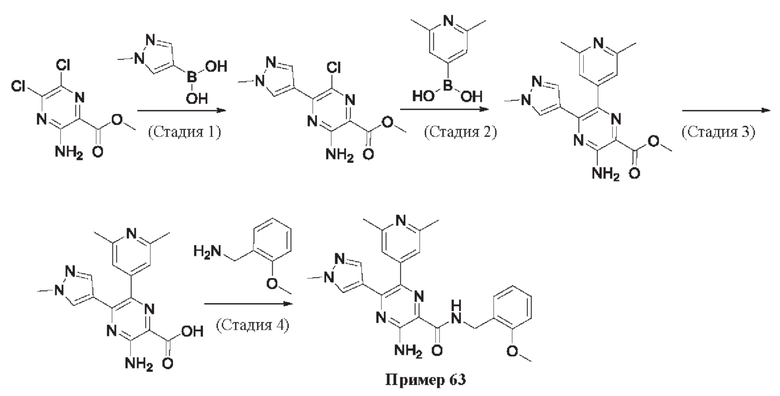
Стадия 1. Получение метил 3-амино-6-хлор-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксилата
К смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (0,5 г; 2,26 ммоль), (1-метил-1Н-пиразол-4-ил)бороновой кислоты (0,43 г; 3,39 ммоль) в диоксане (20 мл) добавляли Na2CO3 (0,57 г; 4,53 ммоль) и Pd(dppf)Cl2 (0,83 г; 1,13 ммоль) при 100°С. Затем смесь перемешивали при этой температуре в течение 2 ч. LCMS показала завершение реакции, и реакционную смесь очищали хроматографией на силикагеле, получая требуемый продукт метил 3-амино-6-хлор-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксилат. LCMS: m/z (ESI), [М+Н]+=268,6.
Стадия 2. Получение метил 3-амино-6-(2,б-диметилпиридин-4-ил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксилата
К смеси метил 3-амино-6-хлор-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксилата (0,4 г; 1,5 ммоль), (2,6-диметилпиридин-4-ил)бороновой кислоты (0,34 г; 2,25 ммоль) в диоксане (20 мл) добавляли Na2CO3 (0,45 г; 3 ммоль) и Pd(dppf)Cl2 (0,55 г; 0,75 ммоль) при 100°С. Затем смесь перемешивали при этой температуре в течение 2 ч. LCMS показала завершение реакции, и реакционную смесь очищали хроматографией на силикагеле, получая требуемый продукт метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксилат.LCMS: m/z (ESI), [М+Н]+=339,2.
Стадия 3. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоновой кислоты
К перемешиваемому раствору метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксилата (0,4 г; 1,18 ммоль) в МеОН (20 мл) добавляли NaOH (0,09 г; 2,37 ммоль) при 25°С.Затем смесь перемешивали при этой температуре в течение 16 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×10 мл). После этого органический раствор концентрировали, получая неочищенный продукт 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоновую кислоту (0,3 г; выход: 78,2%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=325,5.
Стадия 4. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксамида (соединения 63)
К смеси 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(1-метил-1H-пиразол-4-ил)пиразин-2-карбоновой кислоты (0,05 г; 0,15 ммоль), (2-метоксифенил)метанамина (0,021 г; 0,15 ммоль) в DMF (5 мл) добавляли DIEA (0,058 г; 0,45 ммоль) и HATU (0,057 г; 0,15 ммоль) при 20°С. Затем смесь перемешивали при этой температуре в течение 1 ч. LCMS показала завершение реакции. Далее смесь концентрировали, остаток выливали в воду и затем экстрагировали ЕА (2×25 мл). После этого органический раствор очищали с использованием RP-C18 и концентрировали, получая продукт 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксамид (соединение 63) (0,004 г; выход: 6%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=444,2. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 2.2 (s, 3Н), 2.4 (s, 6Н), 3.8 (s, 3Н), 4.5 (d, J=6,3 Гц, 2Н), 6.2 (d, J=3,2 Гц, 1H), 6.5 (d, J=3,2 Гц, 1H), 6.9 (t, J=7,4 Гц, 1H), 7.0 (d, J=8,2 Гц, 1H), 7.1-7.2 (m, 3Н), 7.2 (t, J=7,1 Гц, 1Н), 8.9 (t, J=6,3 Гц, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 63.
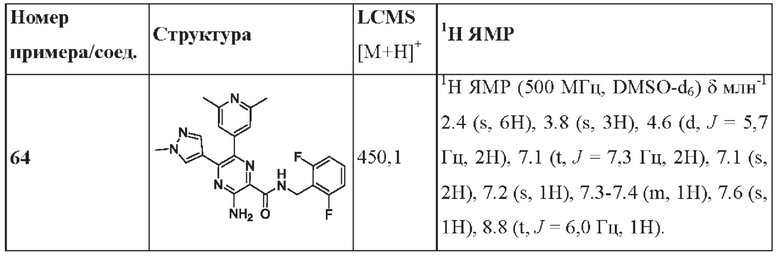
Пример 72. Получение 3-амино-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 72)
СХЕМА 49

Стадия 1. Получение метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилата
К смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (4,4 г; 19,91 ммоль), 2-(4-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (3,07 г; 21,9 ммоль) в диоксане (50 мл) и воде (5 мл) добавляли Na2CO3 (4,22 г; 39,82 ммоль) и dppfPdCl2 (2,84 г; 3,98 ммоль). Затем смесь перемешивали при 100°С в течение 1 ч в атмосфере N2. Далее смесь концентрировали, остаток выливали в воду (100 мл) и затем экстрагировали ЕА (100 мл × 3). После этого органический раствор концентрировали, получая неочищенный продукт (5,5 г; выход 98%) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS m/z (ESI) [М+Н]+=282,2.
Стадия 2. Получение 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновой кислоты
К смеси метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилата (1,1 г; 3,9 ммоль) в метаноле (5 мл) и воде (3 мл) добавляли LiOH (0,3 г; 12 ммоль). Затем смесь перемешивали при 20°С в течение 3 ч. Далее смесь разбавляли раствором лимонной кислоты (2 н.; 50 мл) и затем фильтровали. Твердое вещество сушили, получая 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновую кислоту (0,95 г; выход 91%) в виде желтого твердого вещества. MS m/z (ESI) [М+Н]+=268,2.
Стадия 3. Получение 3-амино-6-хлор-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-пиразин-2-карбоксамида
К смеси 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновой кислоты (100 мг; 0,37 ммоль), (2-(дифторметокси)фенил)метанамина (80 мг; 0,46 ммоль) и DIEA (100 мг; 0,78 ммоль) в DMF (3 мл) добавляли HATU (200 мг; 0,53 ммоль) при 20°С. Полученную смесь перемешивали при 20°С в течение 10 мин. Смесь очищали на С18 (40 г; MeCN/вода, 5%-80%), получая 3-амино-6-хлор-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)пиразин-2-карбоксамид (120 мг; выход 76%) в виде желтого твердого вещества. MS m/z (ESI) [М+Н]+=423,3.
Стадия 4. Получение 3-амино-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 72)
К смеси 3-амино-6-хлор-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-пиразин-2-карбоксамида (90 мг; 0,21 ммоль), 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она (50 мг; 0,21 ммоль), Pd2(dba)3 (8 мг; 0,0087 ммоль), трициклогексилфосфина (11 мг; 0,039 ммоль) и K3PO4 (75 мг; 0,35 ммоль) в диоксане (3 мл) добавляли воду (1 мл). Полученную смесь герметично закрывали и нагревали при 120°С в течение 15 мин в микроволновом реакторе. Смесь фильтровали и фильтрат очищали на С18 (40 г; MeCN/вода, 5%-80%), получая 3-амино-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамид (соединение 72) (82 мг; выход 78%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=496,3. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 3.42 (s, 3Н), 4.57 (d, J=6,31 Гц, 2Н), 6.20 (d, J=9,46 Гц, 1H), 7.10 (dd, J=9,30; 2,68 Гц, 1H), 7.16-7.30 (m, 5Н), 7.30-7.36 (m, 2Н), 7.44-7.83 (m, 3Н), 7.64 (br d,J=16,08 Гц, 1Н), 7.99 (d, J=2,52 Гц, 1Н), 9.23 (t, J=6,31 Гц, 1H).
Соединение, приведенное ниже в таблице, получали с использованием способов, описанных для получения соединения 72.
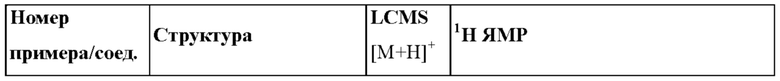
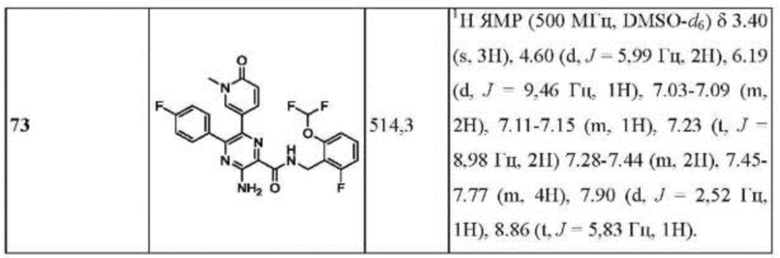
Примере 75. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамида (соединения 75)
СХЕМА 50

Стадия 1. Получение 3-амино-6-хлор-Х-(2-метоксибензил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамида
К смеси 5-((3Н-[1,2,3]триазоло[4,5-b]пиридин-3-ил)окси)-3-амино-6-хлор-N-(2-метокси бензил)пиразин-2-карбоксамида (500 мг; 1,2 ммоль) в DMF (5 мл) добавляли 3-метил-1H-пиразол (120 мг; 1,5 ммоль) и K2CO3 (350 мг; 2,5 ммоль). Полученную смесь нагревали при 120°С в течение 1 ч. Смесь очищали на С18 (40 г; MeCN/вода, 5%-80%), получая 3-амино-6-хлор-N-(2-метоксибензил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамид (200 мг; выход 46%) и 3-амино-6-хлор-N-(2-метоксибензил)-5-(5-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамид (40 мг; выход 7%) в виде желтых твердых веществ. LCMS m/z (ESI) [М+Н]+=373,2.
Стадия 2. Получение 3-амино-6-(2,б-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамида (соединения 75)
К смеси 3-амино-6-хлор-N-(2-метоксибензил)-5-(3-метил-1H-пиразол-1-ил)пиразин-2-карбоксамида (45 мг; 0,12 ммоль), (2,6-диметилпиридин-4-ил)бороновой кислоты (20 мг; 0,13 ммоль), Pd2(dba)3 (7 мг; 0,0076 ммоль), трициклогексилфосфина (13 мг; 0,046 ммоль) и K3PO4 (45 мг; 0,21 ммоль) в диоксане (3 мл) добавляли воду (1 мл). Полученную смесь герметично закрывали и нагревали при 120°С в течение 15 мин в микроволновом реакторе. Смесь фильтровали и фильтрат очищали на С18 (40 г; MeCN/вода, 5%-80%), получая 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамид (соединение 75) (36 мг; выход 67%) в виде белого твердого вещества. LCMS: m/z (ESI), [M+H]+=444,3. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 2.10 (s, 3Н), 2.34 (s, 6Н), 3.84 (s, 3Н), 4.50 (d, J=6,31 Гц, 2Н), 6.34 (d, J=2,52 Гц, 1Н), 6.86 (s, 2Н), 6.89 (t, J=7,41 Гц, 1H), 7.00 (d, J=8,20 Гц, 1H), 7.15 (d, J=7,25 Гц, 1H), 7.23 (t, J=7,90 Гц, 1H), 7.98 (d, J=2,21 Гц, 3Н), 9.04 (t, J=6,42 Гц, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 75.
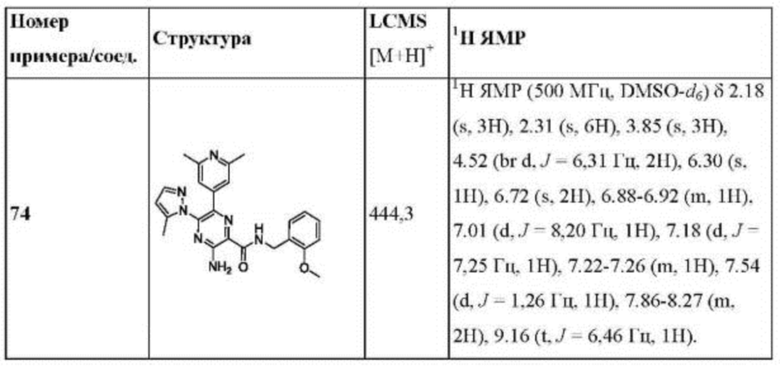
Пример 77. Получение 3-амино-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 77)
СХЕМА 51

Стадия 1. Получение 5-бром-1-(оксетан-3-ил)пиридин-2(1Н)-она
К смеси 5-бромпиридин-2(1Н)-она (1,2 г; 6,9 ммоль) в DMF (10 мл) добавляли 3-иодоксетан (1,3 г; 7,1 ммоль) и Cs2CO3 (2,7 г; 8,3 ммоль). Полученную смесь нагревали при 100°С в течение 4 ч. Смесь фильтровали и фильтрат очищали на С18 (40 г; MeCN/вода, 5%-40%), получая 5-бром-1-(оксетан-3-ил)пиридин-2(1Н)-он (310 мг; выход 20%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=230,1.
Стадия 2. Получение 1-(оксетан-3-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она
К смеси 5-бром-1-(оксетан-3-ил)пиридин-2(1Н)-она (260 мг; 1,1 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (300 мг; 1,2 ммоль) и PdCl2(dppf) (30 мг; 0,041 ммоль) в диоксане (5 мл) добавляли KОАс (250 мг; 2,6 ммоль). Затем смесь нагревали при 90°С в течение 30 мин в микроволновом реакторе. Далее смесь разбавляли водой (50 мл) и экстрагировали ЕА (50 мл). Органический слой сушили, используя рассол и безводный Na2SO4, затем концентрировали, получая неочищенный продукт (250 мг; выход 80%) в виде коричневого твердого вещества. MS m/z (ESI) 278,3 [М+Н]+.
Стадия 3. Получение 3-амино-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида (соединения 77)
К смеси 1-(оксетан-3-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она (20 мг; 0,072 ммоль), 3-амино-6-хлор-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида (35 мг; 0,89 ммоль), Pd2(dba)3 (7 мг; 0,0076 ммоль), трициклогексилфосфина (13 мг; 0,046 ммоль) и K3PO4 (45 мг; 0,21 ммоль) в диоксане (3 мл) добавляли воду (1 мл). Полученную смесь герметично закрывали и нагревали при 120°С в течение 15 мин в микроволновом реакторе. Смесь фильтровали и фильтрат очищали на С18 (40 г; MeCN/вода, 5%-80%), получая 3-амино-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамид (соединение 77) (21 мг; выход 57%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=508,3. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 4.30 (s, 2Н), 4.64 (t, J=6,94 Гц, 2Н), 4.94 (t, J=7,41 Гц, 2Н), 5.62 (quin, J=7,01 Гц, 1H), 6.40 (d, J=9,14 Гц, 1H), 6.99 (br t, J=7,72 Гц, 2Н), 7.10 (br t,J=8,67 Гц, 2Н), 7.24 (dd, J=9,46; 2,21 Гц, 1H), 7.30-7.37 (m, 1Н), 7.54 (br dd, J=8,51; 5,36 Гц, 2Н),7.86 (d, J=2,21 Гц, 1H).
Пример 78. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-фторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида (соединения 78)
СХЕМА 52

Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-фторбензил)-5-(4-фторфенил)-пиразин-2-карбоксамида (соединения 78)
К перемешиваемой смеси 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновой кислоты (20 мг; 0,059 ммоль), (2-фторфенил)метанамина (7,4 мг; 0,059 ммоль) и DIPEA (15 мг; 0,118 ммоль) добавляли в виде одной порции HATU (25 мг; 0,065 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Раствор очищали на С18 (40 г; MeCN/вода, 0%-80%), получая 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-фторбензил)-5-(4-фторфенил)пиразин-2-карбоксамид (соединение 78) (16,3 мг; выход 61,94%) в виде беловатого твердого вещества. LCMS: m/z (ESI), [М+Н]+=446,4. 1H ЯМР (500 МГц, CDCl3) δ млн-1 1.9 (brs, 2Н), 2.5 (s, 6Н), 4.7 (d, J=6,3 Гц, 2Н), 6.9 (s, 2Н), 7.0 (t, J=8,7 Гц, 2Н), 7.1-7.2 (m, 2Н), 7.25-7.30 (m, 1H), 7.3-7.4 (m, 3Н), 8.3 (brt, J=6,1 Гц, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 78.
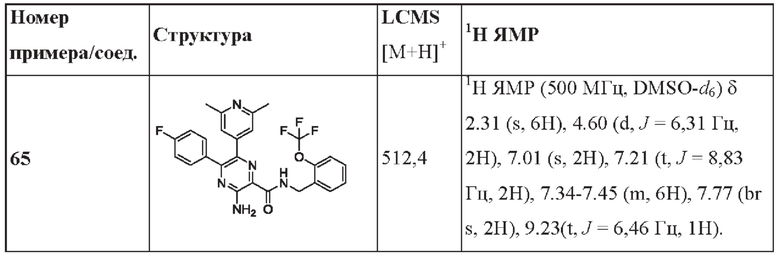

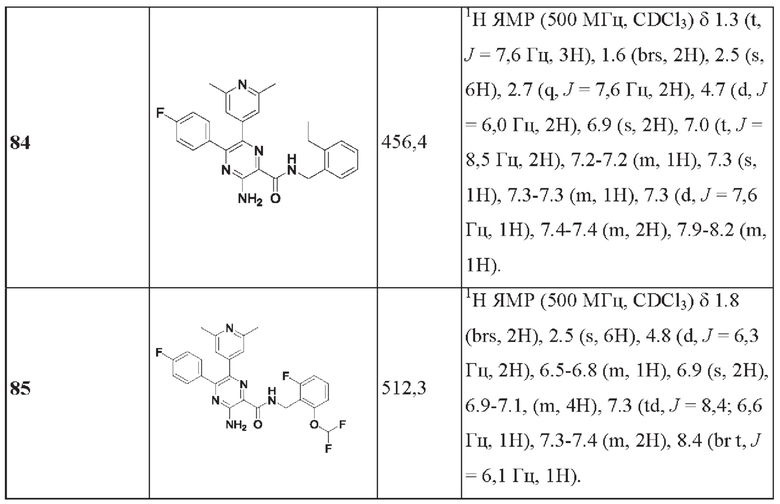
Пример 82. Получение 3-амино-6-(1,5-диметил-6-оксо-1,6-дигидропиридин-3-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида (соединения 82)
СХЕМА 53
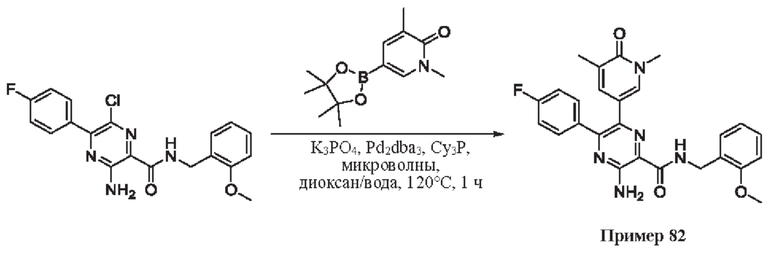
Суспензию 3-амино-6-хлор-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида (30 мг; 0,078 ммоль), 1,3-диметил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она (23 мг; 0,093 ммоль) и K3PO4 (28 мг; 0,132 ммоль) в смеси диоксан (1,50 мл)/вода (0,375 мл) дегазировали и 3 раза продували N2, затем добавляли РСу3 (трициклогексилфосфин) (6,5 мг; 0,023 ммоль) и Pd2(dba)3 (7 мг; 0,008 ммоль). Полученную смесь опять дегазировали и 3 раза продували N2. Реакционную смесь герметично закрывали и нагревали при 120°С в течение 1 ч, используя микроволновой реактор. Раствор фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на С18 (40 г) с элюированием градиентом от 0% до 60% MeCN в воде (с 0,05% гидроксида аммония), получая 3-амино-6-(1,5-диметил-6-оксо-1,6-дигидропиридин-3-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамид (соединение 82) (25 мг; выход 68,08%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=474,4. 1H ЯМР (500 МГц, CDCl3) δ млн-1 1.7 (s, 2Н), 2.1 (s, 3Н), 3.5 (s, 3Н), 3.9 (s, 3Н), 4.7 (d, J=6,3 Гц, 2Н), 6.9 (d, J=8,2 Гц, 1H), 6.9 (t, J=7,4 Гц, 1Н), 7.1 (t, J=8,7 Гц, 2H), 7.1 (d, J=2,2 Гц, 1H), 7.2 (s, 1H), 7.3-7.3 (m, 1H), 7.3-7.4 (m, 1H) 7.5 (dd, J=8,8; 5,4 Гц, 2H), 8.4 (brt, J=6,0 Гц, 1H).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 82.
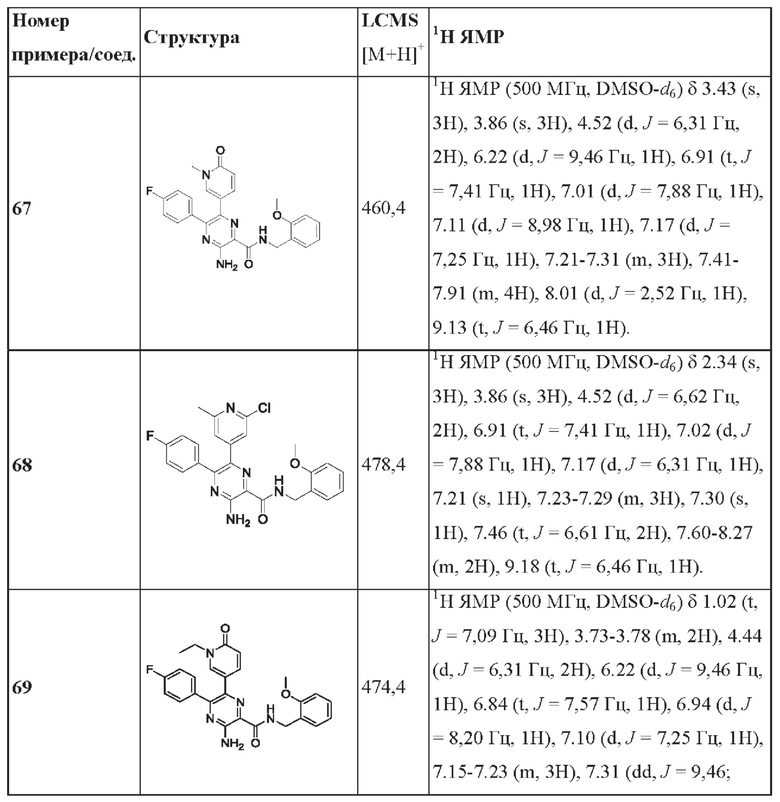
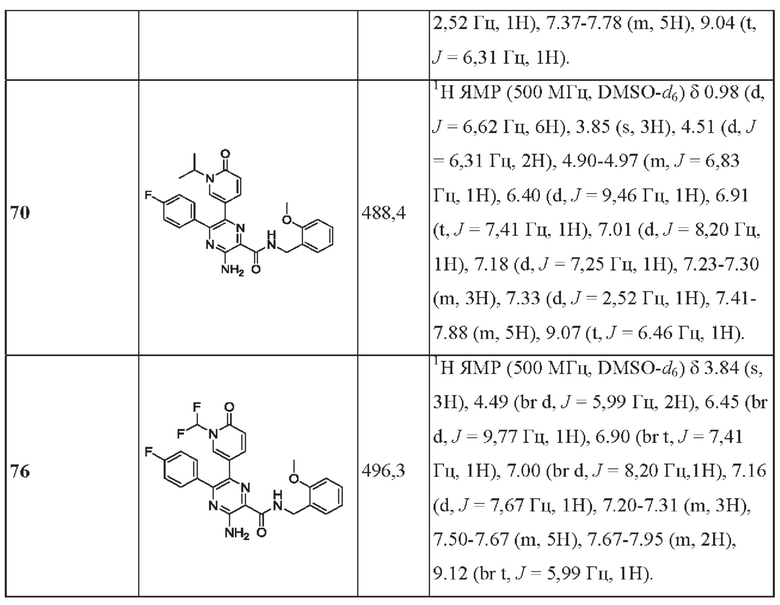
Пример 83. Получение 3-амино-6-(2-амино-6-метилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида (соединения 83)
СХЕМА 54
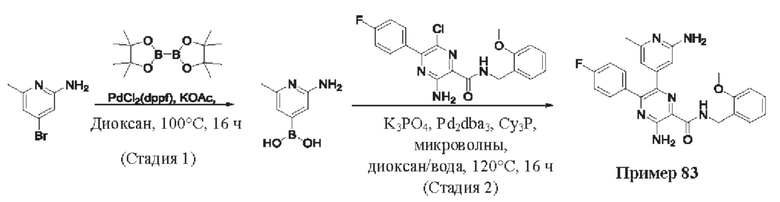
Стадия 1. Получение (2-амино-6-метилпиридин-4-ил) бороновой кислоты
Суспензию 4-бром-6-метилпиридин-2-амина (80 мг; 0,428 ммоль), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолана) (130 мг; 0,513 ммоль) и KOAc (50 мг; 0,51 ммоль) в диоксане (4 мл) дегазировали и 3 раза продували N2, затем добавляли PdCl2(dppf) (16 мг; 0,021 ммоль). Полученную смесь опять дегазировали и 3 раза продували N2. Реакционную смесь герметично закрывали и нагревали при 100°С в течение 16 ч. Раствор фильтровали и упаривали при пониженном давлении, получая (2-амино-6-метилпиридин-4-ил)бороновую кислоту (96 мг; неочищенную), которую использовали на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=153,3.
Стадия 2. 3-Амино-6-(2-амино-6-метилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)-пиразин-2-карбоксамид (соединение 83)
Суспензию 3-амино-6-хлор-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида (30 мг; 0,078 ммоль), (2-амино-6-метилпиридин-4-ил)бороновой кислоты (48 мг; 0,093 ммоль) и K3PO4 (48 мг; 0,244 ммоль) в смеси диоксан (1,50 мл)/вода (0,37 мл) дегазировали и 3 раза продували N2, затем добавляли РСу3 (6,5 мг; 0,023 ммоль) и Pd2(dba)3 (7 мг; 0,008 ммоль). Полученную смесь опять дегазировали и 3 раза продували N2. Реакционную смесь герметично закрывали и нагревали при 120°С в течение 1 ч, используя микроволновой реактор. Раствор фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на С18 (40 г) с элюированием градиентом от 0% до 100% MeCN в воде (с 0,05% гидроксида аммония), получая 3-амино-6-(2-амино-6-метилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)-пиразин-2-карбоксамид (соединение 83) (7,6 мг; выход 21,3%) в виде беловатого твердого вещества. LCMS: m/z (ESI), [М+Н]+=495,3. 1H ЯМР (500 МГц, CDCl3) δ млн-1 1.9 (brs, 2Н), 2.3 (s, 3Н), 3.9 (s, 3Н), 4.7 (d, J=6,3 Гц, 2Н), 4.7 (brs, 2Н), 6.3 (s, 1Н), 6.5 (s, 1H), 6.9 (d, J=8,2 Гц, 1H), 6.9-7.0 (m, 1Н), 7.0 (t, J=8,5 Гц, 2Н), 7.3-7.4 (m, 2Н), 7.4-7.5 (m, 2Н), 8.4 (brt, J=6,1 Гц, 1Н).
Пример 86. Получение N-((3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-ил)метил)-2-метоксибензамида (соединения 86)
СХЕМА 55
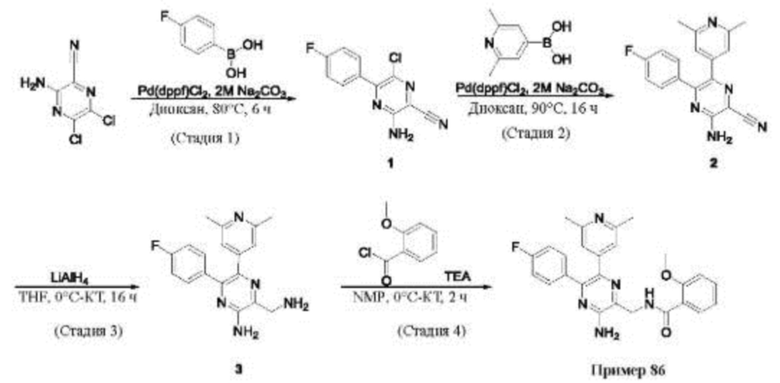
Стадия 1. Получение 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрила
В реакционную смесь к раствору 3-амино-5,6-дихлорпиразин-2-карбонитрила (300 мг; 1,5 ммоль) и (4-фторфенил)бороновой кислоты (233 мг; 1,6 ммоль) в диоксане (14 мл) добавляли 2 М раствор Na2CO3 (1,6 мл). Полученную смесь дегазировали и 3 раза продували N2, затем добавляли PdCl2(dppf) (58 мг; 0,079 ммоль). Полученную смесь опять дегазировали и 3 раза продували N2. Полученную смесь нагревали при 80°С в атмосфере азота с использованием баллона в течение 6 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали EtOAc (3 × 20 мл). Объединенные органические экстракты сушили над безводным сульфатом натрия, фильтровали и фильтрат упаривали при пониженном давлении, получая 3-амино-6-хлор-5-(4- фторфенил)пиразин-2-карбонитрил (395 мг; неочищенный) в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=249,2.
Стадия 2. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбонитрила
Готовили раствор 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрила (395 мг; 1,5 ммоль) и (2,6-диметилпиридин-4-ил)бороновой кислоты (288 мг; 1,9 ммоль) в диоксане (14 мл). Затем в реакционную смесь добавляли 2 М раствор Na2CO3 (1,6 мл). Полученную смесь дегазировали и 3 раза продували N2, затем добавляли PdCl2(dppf) (58 мг; 0,079 ммоль). Полученную смесь опять дегазировали и 3 раза продували N2. Полученную смесь нагревали при 90°С в атмосфере азота с использованием баллона в течение 16 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали EtOAc (3 × 20 мл). Объединенные органические экстракты сушили над безводным сульфатом натрия, фильтровали, фильтрат упаривали при пониженном давлении и очищали колоночной хроматографией на силикагеле (петролейный эфир/EtOAc, 10/1-3/1 (об./об.)), получая 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбонитрил (311 мг; выход 61%) в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=320,3.
Стадия 3. Получение 3-(аминометил)-5-(2,6-диметилпиридин-4-ил)-6-(4- фторфенил)пиразин-2-амина
Раствор 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбонитрила (60 мг; 0,188 ммоль) в безводном THF (0,5 мл) по каплям добавляли в перемешиваемую суспензию LiAlH4 (14 мг; 0,376 ммоль) в безводном THF (1,5 мл) при 0°С в бане со смесью лед/вода. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли безводным THF (10 мл), охлаждали и перемешивали при 0°С в бане со смесью лед/вода. Затем добавляли декагидрат сульфата натрия (500 мг; три порции) и полученную смесь перемешивали при этой температуре в течение 30 мин. Затем фильтровали и фильтрат концентрировали в вакууме, получая 3-(аминометил)-5-(2,6-диметилпиридин-4-ил)-6-(4-фторфенил)пиразин-2-амин (50 мг; выход 82%) в виде коричневого масла. LCMS: m/z (ESI), [М+Н]+=324,4.
Стадия 4. Получение N-((3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4- фторфенил)пиразин-2-ил)метил)-2-метоксибензамида (соединения 86)
Раствор 3-(аминометил)-5-(2,6-диметилпиридин-4-ил)-6-(4-фторфенил)пиразин- 2-амина (50 мг; 0,15 ммоль) и TEA (47 мг; 0,46 ммоль) в NMP (1 мл) охлаждали в бане со смесью лед/вода при 0°С, затем в реакционную смесь по каплям добавляли раствор 2-метоксибензоилхлорида (26 мг; 0,155 ммоль) в NMP (1,0 мл). Полученную смесь перемешивали и медленно нагревали до комнатной температуры в течение 2 ч. Раствор очищали флэш-хроматографией на С18 (40 г) с элюированием градиентом от 0% до 50% MeCN в воде (с 0,05% гидроксида аммония), получая N-((3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-ил)метил)-2-метоксибензамид (соединение 86) (15 мг; выход 46%) в виде беловатого твердого вещества. LCMS: m/z (ESI), [М+Н]+=458,3. 1Н ЯМР (500 МГц, CDCl3) δ млн-1 2.5 (s, 6Н), 3.9 (s, 3Н), 4.8 (d, J=6,3 Гц, 2Н), 6.0 (brs, 2Н), 6.9 (s, 2Н), 7.0-7.0 (m, 3Н), 7.1-7.1 (m, 1H), 7.3-7.4 (m, 2Н), 7.5-7.5 (m, 1H), 8.3 (dd, J=7,9; 1,6 Гц, 1Н), 8.7 (brt, J=6,0 Гц, 1H).
Пример 87. Получение 3-амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида (соединения 87)
СХЕМА 56
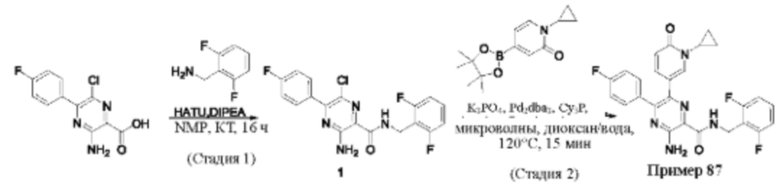
Стадия L Получение 3-амино-6-хлор-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида
К перемешиваемой смеси 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновой кислоты (200 мг; 0,74 ммоль), (2,6-дифторфенил)метанамина (107 мг; 0,74 ммоль) и DIPEA (93 мг; 1,49 ммоль) добавляли в виде одной порции HATU (313 мг; 0,82 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Раствор очищали на С18 (40 г; MeCN/вода, 0%-60%), получая 3-амино-6-хлор-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамид (290 мг; выход 99%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=393,2.
Стадия 2. Получение 3-амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида (соединения 87)
Суспензию 3-амино-6-хлор-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида (50 мг; 0,12 ммоль), 1-циклопропил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она (40 мг; 0,15 ммоль) и K3PO4 (46 мг; 0,21 ммоль) в смеси диоксан (2,0 мл)/вода (0,4 мл) дегазировали и 3 раза продували N2, затем добавляли РСу3 (11 мг; 0,039 ммоль) и Pd2(dba)3 (12 мг; 0,013 ммоль). Полученную смесь опять дегазировали и 3 раза продували N2. Реакционную смесь герметично закрывали и нагревали при 120°С в течение 15 мин, используя микроволновой реактор. Раствор фильтровали и упаривали при пониженном давлении. Остаток очищали флэш-хроматографией на С18 (40 г) с элюированием градиентом от 0% до 70% MeCN в воде (с 0,05% гидроксида аммония), получая 3-амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамид (соединение 87) (40 мг; выход 64%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=492,3. 1Н ЯМР (500 МГц, CDCl3) δ млн-1 0.5-0.7 (m, 2Н), 0.9-1.2 (m, 2Н) 1.6 (brs, 2Н), 3,2-3.4 (m, 1H), 4.8 (d, J=6,3 Гц, 2Н), 6.5 (d, J=9,1 Гц, 1H), 6.9 (t, J=7,9 Гц, 2Н), 7.1 (t, J=8,5 Гц, 2Н), 7.2-7.3 (m, 1H), 7.3-7.3 (m, 2Н), 7.4-7.5 (m, 2Н), 8.2 (brt, J=6,3 Гц, 1Н).
Пример 88. Получение N-((3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил)метил)-2,6-дифторбензамида (соединения 88)
СХЕМА 57

Стадия 1. Получение 3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбонитрила
В реакционную смесь к раствору 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрила (395 мг; 1,587 ммоль) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1Н)-она (448 мг; 1,905 ммоль) в диоксане (14 мл) добавляли 2 М раствор Na2CO3 (336 мг; 1,6 мл). Полученную смесь дегазировали и 3 раза продували N2, затем добавляли PdCl2dppf) (58 мг; 0,079 ммоль). Полученную смесь опять дегазировали и 3 раза продували N2. Полученную смесь нагревали при 90°С в атмосфере азота с использованием баллона в течение 16 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали EtOAc (3 × 20 мл). Объединенные органические экстракты сушили над безводным сульфатом натрия, фильтровали, фильтрат упаривали при пониженном давлении и очищали колоночной хроматографией на силикагеле (петролейный эфир/EtOAc, 10/1-3/1 (об./об.)), получая 3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбонитрил (235 мг; выход 46%) в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=322,3.
Стадия 2. Получение 5-(5-амино-6-(аминометил)-3-(4-фторфенил)пиразин-2-ил)-1-метилпиридин-2(1Н)-она
Раствор 3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3- ил)пиразин-2-карбонитрила (51 мг; 0,159 ммоль) в безводном THF (0,5 мл) по каплям добавляли в перемешиваемую суспензию LiAlH4(12 мг; 0,317 ммоль) в безводном THF (1,5 мл) при 0°С в бане со смесью лед/вода. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли безводным THF (10 мл), охлаждали и перемешивали при 0°С в бане со смесью лед/вода. Затем добавляли декагидрат сульфата натрия (500 мг; три порции) и полученную смесь перемешивали при этой температуре в течение 30 мин. Далее фильтровали и фильтрат концентрировали в вакууме, получая 5-(5-амино-6-(аминометил)-3-(4-фторфенил)пиразин-2-ил)-1-метилпиридин-2(1Н)-он (52 мг; выход 100%) в виде коричневого масла. LCMS: m/z (ESI), [М+Н]+=326,5.
Стадия 3. Получение N-((3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил)метил)-2,6-дифторбензамида (соединения 88)
Раствор 5-(5-амино-6-(аминометил)-3-(4-фторфенил)пиразин-2-ил)-1-метилпиридин-2(1Н)-она (52 мг; 0,16 ммоль) и TEA (49 мг; 0,48 ммоль) в NMP (1 мл) охлаждали в бане со смесью лед/вода при 0°С, затем в реакционную смесь по каплям добавляли раствор 2,6-дифторбензоилхлорида (34 мг; 0,19 ммоль) в NMP (1,0 мл). Полученную смесь перемешивали и медленно нагревали до комнатной температуры в течение 2 ч. Раствор очищали флэш-хроматографией на С18 (40 г) с элюированием градиентом от 0% до 60% MeCN в воде (с 0,05% гидроксида аммония), получая N-((3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил)метил)-2,6-дифторбензамид (соединение 88) (8 мг; выход 11%) в виде беловатого твердого вещества. LCMS: m/z (ESI), [М+Н]+=466,3. 1H ЯМР (500 МГц, CDCl3) δ млн-1 3.5 (s, 3Н), 4.8 (d, J=6,3 Гц, 2Н), 5.5 (brs, 2Н), 6.4 (d, J=9,5 Гц, 1H), 7.0-7.0 (m, 3Н), 7.1 (t, J=8,7 Гц, 2Н), 7.1 (dd, J=9,5; 2,5 Гц, 1H), 7.4-7.5 (m, 4Н).
Пример 89. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида (соединения 89)
СХЕМА 58
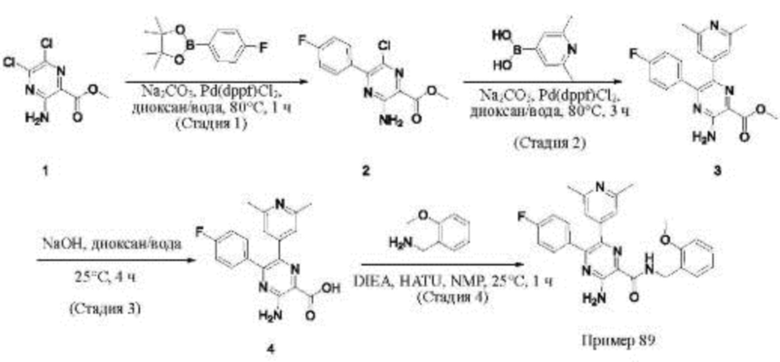
Стадия 1. Получение метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилата
К смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (4,4 г; 19,91 ммоль), 2-(4-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (3,07 г; 21,9 ммоль) в диоксане (50 мл) и воде (5 мл) добавляли Nа2СО3 (4,22 г; 39,82 ммоль) и dppfPdCl2 (2,84 г; 3,98 ммоль). Затем смесь перемешивали при 100°С в течение 1 ч в атмосфере N2. Далее смесь концентрировали, остаток выливали в воду (100 мл) и затем экстрагировали ЕА (100 мл × 3). После этого органический раствор концентрировали, получая неочищенный продукт (5,5 г; выход 98%) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS m/z (ESI) [М+Н]+=282,2.
Стадия 2. Получение метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4- фторфенил)пиразин-2-карбоксилата
К смеси метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилата (2,8 г; 9,96 ммоль), (2,6-диметилпиридин-4-ил)бороновой кислоты (1,51 г; 9,96 ммоль) в диоксане (50 мл) и воде (5 мл) добавляли Na2CO3 (3,01 г; 19,93 ммоль) и Pd(PPh3)4 (1,42 г; 1,99 ммоль). Затем смесь перемешивали при 80°С в течение 8 ч в атмосфере N2. Далее смесь концентрировали и остаток выливали в воду (100 мл) и затем экстрагировали ЕА (100 мл × 3). После этого органический раствор концентрировали, получая неочищенный продукт, который дополнительно очищали на колонке для флэш-хроматографии, получая требуемый метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксилат (2,5 г; выход 71%) в виде желтого твердого вещества. MS m/z (ESI) [М+Н]+=353,4. 1Н ЯМР (500 МГц, DMSO-d6) δ млн-1 2.33 (s, 6Н), 3.89 (s, 3Н), 6.89 (s, 2Н), 7.22 (t, J=8,29 Гц, 2Н), 7.43 (t, J=6,58 Гц, 2Н), 7.61 (br s, 2Н).
Стадия 3, Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновой кислоты
К перемешиваемому раствору метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4- фторфенил)пиразин-2-карбоксилата (2,3 г; 6,53 ммоль) в метаноле (25 мл) и воде (5 мл) добавляли гидроксид натрия (1,3 г; 32,66 ммоль). Затем смесь перемешивали при 45°С в течение 2 часов. Далее раствор концентрировали и остаток суспендировали в 25 мл воды. Раствор дважды промывали 15 мл DCM. Затем неорганический слой подкисляли 0,5 н. раствором HCl до рН 3. Образовавшееся твердое вещество собирали и сушили, получая требуемый продукт (1,70 г; выход 77%) в виде белого твердого вещества. MS m/z (ESI) [М+Н]+=339,4. 1H ЯМР (500 МГц, DMSO-d6) δ млн-1 2.31-2.38 (m, 6Н), 6.94 (s, 2Н), 7.22 (t, J=8,41 Гц, 2Н), 7.43 (t, J=6,73 Гц, 2Н), 7.64 (br s, 2Н), 12.56-13.99 (m, 1H).
Стадия 4. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида (соединения 89)
К перемешиваемому раствору 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоновой кислоты (25 мг; 0,07 ммоль), (2-метоксифенил)метанамина (20 мг; 0,15 ммоль) и DIEA (15 мг; 0,118 ммоль) в DMF (2 мл) добавляли в виде одной порции HATU (40 мг; 0,11 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 1 ч в атмосфере азота. Раствор очищали на С18 (40 г; MeCN/вода, 5%-60%), получая 3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамид (соединение 89) (19,8 мг; выход 59,2%) в виде беловатого твердого вещества. MS m/z (ESI) [М+Н]+=458,4. 1Н ЯМР (500 МГц, CDCl3) δ млн-1 2.33 (s, 6Н), 3.86 (s, 3Н), 4.46-4.57 (m, 2Н), 6.87-6.95 (m, 1H), 7.02 (s, 3Н), 7.13-7.30 (m, 4Н), 7.38-7.48 (m, 2Н), 7.51-8.20 (m, 2Н), 9.02-9.13 (m, 1H).
Соединения, приведенные ниже в таблице, получали с использованием
способов, описанных для получения соединения 89.


Пример 93; Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-фенилпиразин-2-карбоксамида (соединения 93)
СХЕМА 59
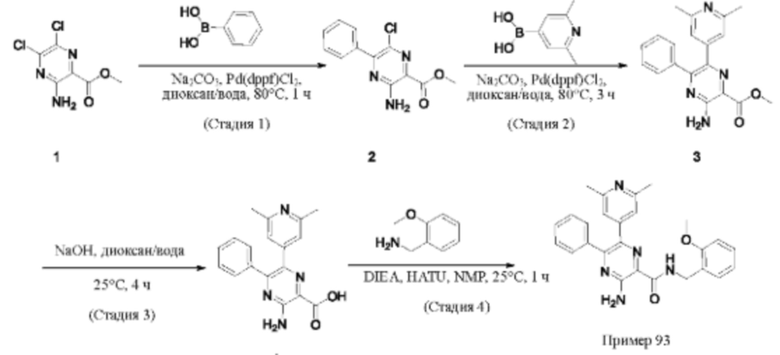
Стадия 1. Получение метил 3-амино-6-хлор-5-фенилпиразин-2-карбоксилата
К смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (0,22 г; 1,0 ммоль), фенилбороновой кислоты (0,13 г; 1,05 ммоль) в диоксане (3 мл) и воде (0,3 мл) добавляли Na2CO3 (0,21 г; 1,99 ммоль) и Pd(dppf)Cl2 (0,14 г; 0,20 ммоль). Затем смесь перемешивали при 100°С в течение 1 ч в атмосфере N2. Далее смесь концентрировали, остаток выливали в воду (100 мл) и затем экстрагировали ЕА (10 мл × 3). После этого органический раствор концентрировали, получая неочищенный продукт (0,24 г; выход 91%) в виде желтого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MS m/z (ESI) [М+Н]+=263,3.
Стадия 2. Получение метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-фенилпиразин-2-карбоксилата
К смеси метил 3-амино-6-хлор-5-фенилпиразин-2-карбоксилата (0,24 г; 0,91 ммоль), (2,6-диметилпиридин-4-ил)бороновой кислоты (0,14 г; 0,96 ммоль) в диоксане (5 мл) и воде (0,5 мл) добавляли Na2CO3 (0,19 г; 1,82 ммоль) и Pd(PPh3)4 (0,14 г; 0,20 ммоль). Затем смесь перемешивали при 80°С в течение 8 ч в атмосфере N2. Далее смесь концентрировали, остаток выливали в воду (10 мл) и затем экстрагировали ЕА (10 мл × 3). После этого органический раствор концентрировали, получая неочищенный продукт, который дополнительно очищали на колонке для флэш-хроматографии, получая требуемый метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5-фенилпиразин-2-карбоксилат (0,30 г; выход 98%) в виде желтого твердого вещества. MS m/z (ESI) [М+Н]+=335,4.
Стадия 3. Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-5-фенилпиразин-2-карбоновой кислоты
К перемешиваемому раствору метил 3-амино-6-(2,6-диметилпиридин-4-ил)-5- фенилпиразин-2-карбоксилата (0,30 г; 0,90 ммоль) в метаноле (10 мл) и воде (2 мл) добавляли гидроксид натрия (0,18 г; 4,49 ммоль). Затем смесь перемешивали при 45°С в течение 2 часов. Далее раствор концентрировали и остаток суспендировали в 5 мл воды. Раствор промывали DCM (2×5 мл). Затем неорганический слой подкисляли 0,5 н. раствором HCl до рН 3. Образовавшееся твердое вещество собирали и сушили, получая требуемый продукт (0,14 г; выход 49%) в виде белого твердого вещества. MS m/z (ESI) [М+Н]+=321,4.
Стадия 4 Получение 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-фенилпиразин-2-карбоксамида (соединения 93)
К перемешиваемому раствору 3-амино-6-(2,6-диметилпиридин-4-ил)-5- фенилпиразин-2-карбоновой кислоты (35 мг; 0,11 ммоль), (2-метоксифенил)метанамина (22 мг; 0,16 ммоль) и DIEA (28 мг; 0,22 ммоль) в DMF (2 мл) в виде одной порции добавляли HATU (50 мг; 0,13 ммоль) при комнатной температуре. Полученную смесь перемешивали при комнатной температуре в течение 1 ч в атмосфере азота. Раствор очищали на С18 (40 г; MeCN/вода, 5%-60%), получая 3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-фенилпиразин-2-карбоксамид (соединение 93) (23,0 мг; выход 48%) в виде беловатого твердого вещества. MS m/z (ESI) [М+Н]+=440,4. 1Н ЯМР (500 МГц, CDCl3) δ млн-1 2.30 (s, 6Н), 3.86 (s, 3Н), 4.52 (d, J=6,31 Гц, 2Н), 6.91 (t, J=7,36 Гц, 1Н), 6.99-7.04 (m, 3Н), 7.18 (d, J=7,57 Гц, 1H), 7.25 (t, J=7,87 Гц, 1Н), 7.35- 7.45 (m, 5Н),7.82 (br s, 2Н), 9.06 (t, J=6,31 Гц, 1H).
Пример 94. Получение 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-N-[(5-метил-1,3-тиазол-4-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 94)
СХЕМА 60
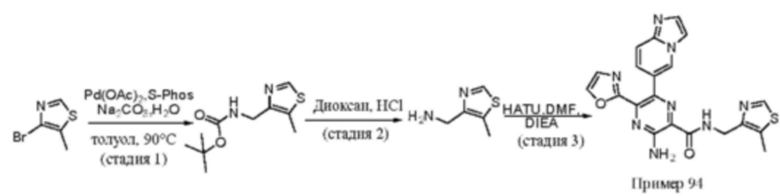
Стадия 1. трет-Бутил N-[(5-метил-1,3-тиазол-4-ил)метил]карбамат
К перемешиваемой смеси 4-бром-5-метил-1,3-тиазола (400 мг; 2,3 ммоль; 1 экв.) и трет-бутил N-[(трифтор-лямбда4-боранил)метил]карбамата калия (639,11 мг; 2,7 ммоль; 1,2 экв.) в толуоле (16 мл) порциями добавляли Na2CO3 (714,3 мг; 6,7 ммоль; 3,0 экв.), S-Phos (368,9 мг; 0,9 ммоль; 0,4 экв.), воду (2 мл) и Pd(AcO)2 (100,9 мг; 0,45 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 90°С. Смесь оставляли охлаждаться до комнатной температуры. Полученную смесь фильтровали, осадок на фильтре промывали EtOAc (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 5:1), получая трет-бутил N-[(5-метил-1,3-тиазол-4- ил)метил]карбамат (280 мг; 54,6%) в виде неочищенного желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=229,2.
Стадия 2. 1-(5-Метил-1,3-тиазол-4-ил)метанамин
К перемешиваемому раствору трет-бутил N-[(5-метил-1,3-тиазол-4-ил)метил]карбамата (270 мг; 1,2 ммоль; 1 экв.) в DCM (5 мл) по каплям добавляли 4 н. раствор HCl в диоксане (5 мл) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 3 часов при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. В результате получали 1-(5-метил-1,3-тиазол-4-ил)метанамин (150 мг; 91,0%) в виде коричневого неочищенного твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=129,3.
Стадия 3. 3-Амино-6-[имидазо[1.2-а]пиридин-6-ил]-N-[(5-метил-1,3-тиазол-4-ил)метил]-5-(1.3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 94)
К перемешиваемой смеси 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,3 ммоль; 1 экв.) и 1-(5-метил-1,3-тиазол-4-ил)метанамина (79,6 мг; 0,6 ммоль; 2,0 экв.) в DMF (5 мл) порциями добавляли HATU (471,9 мг; 1,24 ммоль; 4,0 экв.) и DIEA (160,4 мг; 1,2 ммоль; 4,0 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение еще 60 мин при комнатной температуре. Полученную смесь выливали в воду (20 мл), полученное твердое вещество собирали фильтрованием и промывали водой (10 мл). Неочищенный продукт суспендировали в МеОН (5 мл), получая 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-N-[(5-метил-1,3-тиазол-4-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 94) (106 мг; 77,9%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=433,2. 1H ЯМР (метанол-d4, 400 МГц) δ 2,6 (3Н, s), 4.7 (2Н, s), 7.2 (1H, dd, J=9,3; 1,8 Гц), 7.3 (1H, s), 7.5 (1Н, d, J=9,3 Гц), 7.6 (1H, d, J=1,3 Гц), 7.9 (1H, s), 8.0 (1H, s), 8.7 (1H, d, J=1,5 Гц), 8.8 (1H, s).
Пример 95. Получение 3-амино-N-[(4-аминопиримидин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 95)
СХЕМА 61
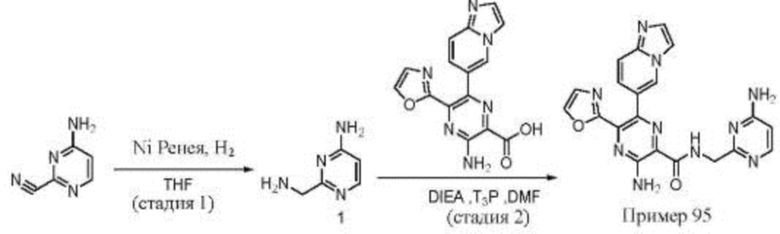
Стадия 1. 2-(Аминометил)пиримидин-4-амин
К перемешиваемой смеси 4-аминопиримидин-2-карбонитрила (200 мг; 1,67 ммоль; 1 экв.) в THF (10 мл) добавляли Ni Ренея (71,3 мг; 0,83 ммоль; 0,5 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 1,5 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали THF (2×5 мл). Фильтрат концентрировали при пониженном давлении, получая 2-(аминометил)пиримидин-4-амин (200 мг; 96,75%) в виде светло-желтого твердого вещества, которое непосредственно использовали на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=125,1.
Стадия 2. 3-Амино-N-[(4-аминопиримидин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 95)
К перемешиваемой смеси 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,31 ммоль; 1 экв.) и 2-(аминометил)пиримидин-4-амина (77,0 мг; 0,62 ммоль; 2 экв.) в DMF (10 мл) порциями добавляли Т3Р (394,9 мг; 1,24 ммоль; 4 экв.) и DIEA (120,3 мг; 0,93 ммоль; 3 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение ночи при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (60 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 15% В до 25% В за 7 мин; 254/220 нм; Rt: 5,77 мин), получая 3-амино-N-[(4-аминопиримидин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 95) (13 мг; 9,78%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=429,2. 1H ЯМР (400 МГц, DMSO-d6) δ 4.33-4.77 (m, 2Н), 6.29 (d, J=5,9 Гц, 1Н), 7.18 (dd, J=9,3; 1,8 Гц, 2Н), 7.37 (d, J=0,8 Гц, 1H), 7.52 (d, J=9,3 Гц, 1H), 7.61 (d, J=1,2 Гц, 1H), 7.96 (d, J=1,1 Гц, 1Н), 8.00 (d, J=5,9 Гц, 4Н), 8.28 (d, J=0,8 Гц, 1H), 8.80 (t, J=1,4 Гц, 1H), 9.18 (t, J=5,8 Гц, 1H).
Пример 96. Получение 3-амино-N-[[2-(диметилфосфорил)-6-фторфенил]метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 96)
СХЕМА 62
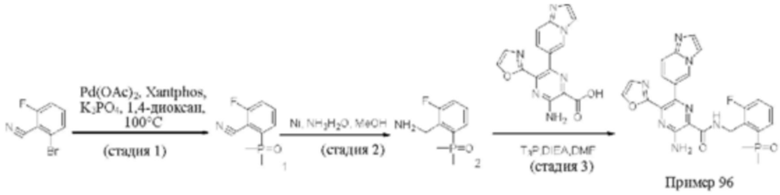
Стадия 1. 2-(Диметилфосфорил)-6-фторбензонитрил
К смеси 2-бром-6-фторбензонитрила (1 г; 5,00 ммоль; 1 экв.) и (метилфосфоноил)метана (0,4 г; 1,00 экв.) в 1,4-диоксане (15 мл) добавляли Pd(AcO)2 (0,1 г; 0,1 экв.), XantPhos (0,6 г; 0,2 экв.) и K3PO4 (2,1 г; 0,01 ммоль; 2,00 экв.) в атмосфере азота. Полученную смесь перемешивали в течение 2 часов при 100°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 2- (диметилфосфорил)-6-фторбензонитрил (620 мг; 62,90%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=198,0. 1Н ЯМР: (300 МГц, DMSO-d6) δ 1.83 (s, 3Н), 1.87 (s, 3Н), 7.80 (m, 2Н), 7.95 (m, 1Н).
Стадия 2. 1-[2-(Диметилфосфорил)-6-фторфенил]метанамин
К раствору 2-(диметилфосфорил)-6-фторбензонитрила (600 мг; 3,04 ммоль; 1 экв.) и NH3.H2O (0,1 мл; 3,82 ммоль; 1,13 экв.) в МеОН (10 мл) добавляли Ni Ренея (130,4 мг; 1,52 ммоль; 0,5 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 часов при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3×10 мл). Фильтрат концентрировали при пониженном давлении, получая 1-[2-(диметилфосфорил)-6-фторфенил]метанамин (550 мг; 89,83%) в виде пурпурного масла, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=202,2. 1Н ЯМР: (300 МГц, DMSO-d6) δ 1.82 (m, 6Н), 3.17 (s, 3Н), 4.02 (d, 2Н), 7.45 (s, 3Н).
Стадия 3; 3-Амино-N-[[2-(диметилфосфорил)-6-фторфенил]метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 96)
К раствору 1-[2-(диметилфосфорил)-6-фторфенил]метанамина (10 мг; 0,05 ммоль; 1 экв.) и 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (16,0 мг; 0,05 ммоль; 1,00 экв.) в DMF (5 мл) добавляли Т3Р (31,6 мг; 0,10 ммоль; 2 экв.) и DIEA (19,3 мг; 0,15 ммоль; 3 экв.) при комнатной температуре. Полученный раствор перемешивали в течение 60 мин при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: XBridge Shield RP18 OBD колонка, 5 мкм, 19*150 мм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 25% В до 35% В за 8 мин; 254/220 нм; Rt: 6,27 мин), получая 3-амино-N-[[2-(диметилфосфорил)-6-фторфенил]метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 96) (95 мг; 37,81%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=506,2. 1H ЯМР: (300 МГц, DMSO-d6) δ 1.85 (d, 6Н), 4.90 (d, 2Н), 7.12 (dd, 1Н), 7.37 (d, 1H), 7.49 (m, 4H), 7.62 (m, 1H), 7.86 (s, 2H), 7.91 (s, 1H), 8.28 (d, 1H), 8.88 (d, 1H), 9.98 (t, 1H).
Пример 101. Получение 3-амино-N-((3-фторпиридин-2-ил)метил)-6-(3- метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 101)
СХЕМА 63
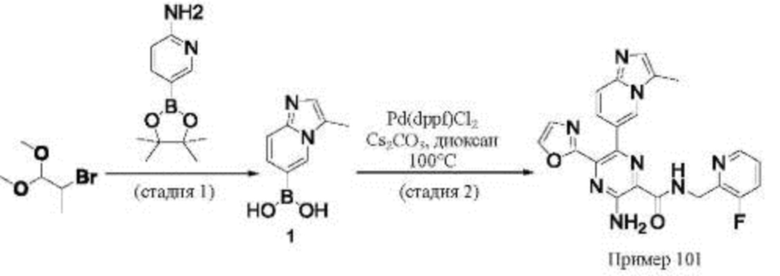
Стадия 1. 3-Метилимидазо[1,2-a]пиридин-6-ил-бороновая кислота
Смесь 2-бром-1,1-диметоксипропана (500 мг; 2,73 ммоль; 1 экв.) в 2,5 мл 1 н. водн. раствора HCl перемешивали в течение 1 ч при 80°С. Смесь охлаждали до КТ и нейтрализовали до рН 7, используя NaHCO3 (твердый). Водный слой экстрагировали CHCl3 (3×5 мл). К полученному раствору в CHCl3 порциями добавляли 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин (180,3 мг; 0,82 ммоль; 0,30 экв.) при комнатной температуре. Полученную смесь перемешивали в течение ночи при 80°С. Полученную смесь концентрировали при пониженном давлении, получая неочищенные продукты в виде неочищенного масла, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=177,0.
Стадия 2. 3-Амино-N-((3-фторпиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 101)
К перемешиваемой смеси 3-амино-6-хлор-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (100 мг; 0,29 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (100,9 мг; 0,57 ммоль; 2,00 экв.) в 1,4-диоксане (20 мл) порциями добавляли Cs2CO3 (467,2 мг; 1,43 ммоль; 5 экв.) и Pd(dppf)Cl2.CH2Cl2 (70,3 мг; 0,09 ммоль; 0,3 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 105°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-N-[(3-фторпиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 101) (23 мг; 18,05%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=445,2. 1H ЯМР (400 МГц, DMSO-d6) δ 2.44 (d, J=0,9 Гц, 3Н), 4.72 (dd, J=5,8; 1,7 Гц, 2Н), 7.25 (dd, J=9,4; 1,8 Гц, 1H), 7.31-7.47 (m, 3Н), 7.50 (dd, J=9,4; 1,0 Гц, 1H), 7.72 (ddd, J=10,0; 8,3; 1,3 Гц, 1H), 7.90 (s, 2Н), 8.29 (d, J=0,8 Гц, 1H), 8.33-8.42 (m, 2Н), 9.36 (t, J=5,9 Гц, 1Н).
Пример 102. Получение 3-амино-N-[(2,6-дифторфенил)метил]-6-[1-(3-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (Пример 102)
СХЕМА 64
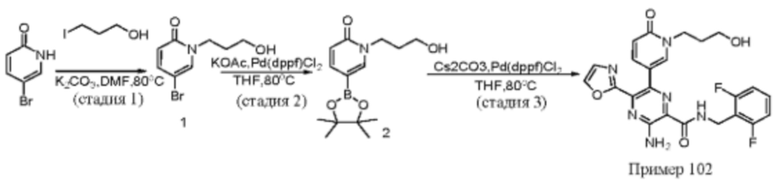
Стадия 1. 5-Бром-1-(3-гидроксипропил)-1,2-дигидропиридин-2-он
К раствору 5-бром-1,2-дигидропиридин-2-она (1 г; 5,75 ммоль; 1 экв.) и 3-иодпропан-1-ола (2,1 г; 11,49 ммоль; 2 экв.) в DMF (15 мл) добавляли K2CO3 (1,6 г; 11,49 ммоль; 2 экв.) при комнатной температуре. Смесь перемешивали в течение 4 часов при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CHCl3/МеОН, 20:1), получая 5-бром-1-(3-гидроксипропил)-1,2-дигидропиридин-2-он (300 мг; 22,49%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=232,1; 234,1. 1H ЯМР: (300 МГц, DMSO-d6) δ 1.12 (q, 2Н), 2.79 (m, 2Н), 3,27 (t, 2Н), 4.03 (s, 1H), 5.69 (d, 1H), 6.78 (dd, 1H), 7.09 (d, 1H).
Стадия 2. 1-(3-Гидроксипропил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-он
К раствору 5-бром-1-(3-гидроксипропил)-1,2-дигидропиридин-2-она (200 мг; 0,86 ммоль; 1 экв.) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (437,7 мг; 1,72 ммоль; 2 экв.) в THF (15 мл) добавляли KOAc (137,5 мг; 1,40 ммоль; 3,00 экв.) и Pd(dppf)Cl2 (63,1 мг; 0,09 ммоль; 0,1 экв.) при комнатной температуре в атмосфере азота. Смесь перемешивали в течение 2 часов при 80°С в атмосфере азота. Смесь использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=280,3.
Стадия 3. 3-Амино-N-[(2,6-дифторфенил)метил]-6-[1-(3-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 102)
К раствору 1-(3-гидроксипропил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (305,3 мг; 1,09 ммоль; 2,00 экв.) в THF (15 мл) добавляли 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (200 мг; 0,55 ммоль; 1 экв.),Cs2CO3 (356,4 мг; 1,09 ммоль; 2,00 экв.) и Pd(dppf)Cl2 (40,0 мг; 0,05 ммоль; 0,10 экв.) в атмосфере азота при комнатной температуре. Смесь перемешивали в течение 2 часов при 80°С в атмосфере азота, остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-N-[(2,6-дифторфенил)метил]-6-[1-(3-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 102) (60 мг; 22,74%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=483,3. 1Н ЯМР: (300 МГц, DMSO-d6) δ 1.76 (р, 2Н), 3.40 (q, 2Н), 3.91 (t, 2Н), 4.58 (m, 3Н), 6.36 (d, 1H), 7.08 (t, 2Н), 7.38 (m, 2Н), 7.51 (dd, 1H), 7.75 (s, 2H), 7.85 (d, 1H), 8.28 (s, 1H), 9.10 (t, 1H).
Пример 103. Получение 3-амино-N-[(2,6-дифторфенил)метил]-6-[1-(2-метоксиэтил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 103)
СХЕМА 65
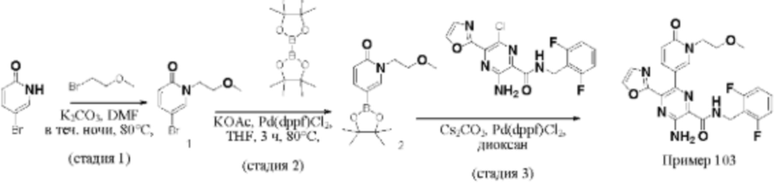
Стадия 1. 5-Бром-1-(2-метоксиэтил)-1,2-дигидропиридин-2-он
К перемешиваемой смеси 5-бром-1,2-дигидропиридин-2-она (500 мг; 2,87 ммоль; 1 экв.) и 1-бром-2-метоксиэтана (1597,6 мг; 11,49 ммоль; 4 экв.) в DMF (15 мл) порциями добавляли K2CO3 (1191,4 мг; 8,62 ммоль; 3 экв.) при 80°С в воздушной атмосфере. Полученную смесь перемешивали в течение 5 часов при 80°С в воздушной атмосфере. Полученную смесь выливали в воду. Полученную смесь экстрагировали EtOAc (2 × 100 мл). Объединенные органические слои промывали водой (1 × 40 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (5:1), получая 5-бром-1-(2-метоксиэтил)-1,2-дигидропиридин-2-он (200 мг; 29,99%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=231,9. 1H ЯМР (400 МГц, DMSO-d6) δ 3,24 (s, 3Н), 3.56 (t, J=5,3 Гц, 2H), 4.04 (t, J=5,3 Гц, 2H), 6.38 (d, J=9,6 Гц, 1H), 7.53 (dd, J=9,7; 2,8 Гц, 1H), 7.91 (d, J=2,8 Гц, 1H).
Стадия 2. 1-(2-Метоксиэтил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2(1H)-он
К перемешиваемой смеси 5-бром-1-(2-метоксиэтил)-1,2-дигидропиридин-2-она (150 мг; 0,65 ммоль; 1 экв.) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2- диоксаборолан-2-ил)-1,3,2-диоксаборолана (328,3 мг; 1,29 ммоль; 2 экв.) в THF (5 мл) порциями добавляли Pd(dppf)Cl2 (94,6 мг; 0,13 ммоль; 0,2 экв.) и KOAc (190,3 мг; 1,94 ммоль; 3 экв.) при 80°С в атмосфере азота. Полученную смесь перемешивали в течение 3 часов при 80°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=280,3.
Стадия 3. 3-Амино-N-[(2,6-дифторфенил)метил]-6-[1-(2-метоксиэтил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 103)
К перемешиваемой смеси 3-амино-6-хлор-N-[(2,6-дифторфенил)метил]-5-(1,3- оксазол-2-ил)пиразин-2-карбоксамида (100 мг; 0,27 ммоль; 1 экв.) и 1-(2-метоксиэтил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (152,7 мг; 0,55 ммоль; 2,00 экв.) в THF (8 мл) порциями добавляли Pd(dppf)Cl2 (40,0 мг; 0,05 ммоль; 0,2 экв.) и Cs2CO3 (356,4 мг; 1,09 ммоль; 4 экв.) при 100°С в атмосфере азота. Полученную смесь перемешивали в течение ночи при 100°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (20:1), получая 3-амино-N-[(2,6-дифторфенил)метил]-6-[1-(2-метоксиэтил)-6-оксо-1,6-дигидропиридин-3-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 103) (33 мг; 24,77%) в виде желто-зеленого твердого вещества. LCMS: m/z (ESI), [М+Н]+=483,2. 1H ЯМР (400 МГц, DMSO-d6) δ 3,22 (s, 3Н), 3.57 (t, J=5,4 Гц, 2H), 4.04 (t, J=5,5 Гц, 2H), 4.61 (d, J=5,9 Гц, 2H), 6.35 (d, J=9,4 Гц, 1H), 7.10 (t, J=8,0 Гц, 2H), 7.34-7.46 (m, 2H), 7.47 (dd, J=9,4; 2,6 Гц, 1H), 7.75-7.80 (m, 2H), 7.88 (d, J=2,6 Гц, 1H), 8.30 (d, J=0,8 Гц, 1H), 9.07 (t, J=5,9 Гц, 1H).
Пример 104. Получение 3-амино-N-[(3-фторпиридин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида (соединения 104)
СХЕМА 66
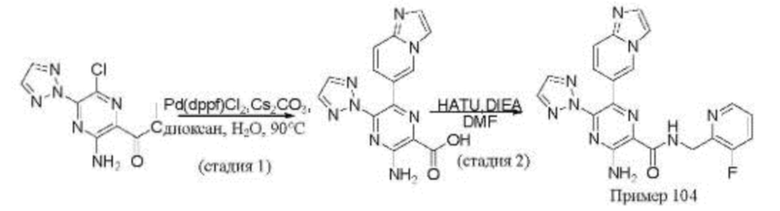
Стадия 1. 3-Амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемой смеси метил 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (300 мг; 1,178 ммоль; 1 экв.) и 6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а] пиридина (431,39 мг; 1,767 ммоль; 1,5 экв.) в диоксане (20 мл) порциями добавляли Pd(dppf)Cl2 (172,41 мг; 0,236 ммоль; 0,2 экв.), воду (2 мл) и Cs2CO3 (1151,62 мг; 3,535 ммоль; 3 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 90°С. Полученную смесь фильтровали, осадок на фильтре промывали DCM (3 × 10 мл). Фильтрат подкисляли до рН 5, используя 2 н. водн. раствор HCl. Полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновую кислоту (290 мг; 76,37%) в виде неочищенного коричневого твердого вещества, которое непосредственно использовали на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=323,2.
Стадия 2. 3-Амино-N-[(3-фторпиридин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 104)
К перемешиваемой смеси 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3- триазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,31 ммоль; 1 экв.) и 1-(3-фторпиридин-2-ил)метанамина (67,1 мг; 0,62 ммоль; 2 экв.) в DMF (3 мл) порциями добавляли HATU (471,9 мг; 1,24 ммоль; 4 экв.) и DIEA (160,4 мг; 1,24 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Полученную смесь гасили водой (10 мл), полученное твердое вещество собирали фильтрованием и промывали водой (3 × 10 мл). Неочищенный продукт суспендировали в МеОН (6 мл), полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-N-[(3-фторпиридин-2-ил)метил]-6-[имидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 104) (48 мг; 35,5%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=431,2. 1Н ЯМР (DMSO-d6, 400 МГц) δ 4.7 (2Н, d, J=5,9 Гц), 6.7 (1H, dd, J=9,4; 1,8 Гц), 7.4 (2Н, dd, J=8,8; 4,4 Гц), 7.6 (1H, d, J=1,2 Гц), 7.7 (1H, ddd, J=10,0; 8,3; 1,3 Гц), 7.9 (1H, s), 8.1 (3Н, s), 8.4 (1H, dt, J=4,7; 1,5 Гц), 8.6-8.7 (1H, m), 9.4 (1H, t, J=6,0 Гц).
Пример 107. Получение 3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида
Пример 108. Получение 3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида

Стадия 1. 5-Бром-1-(2-гидроксипропил)-1,2-дигидропиридин-2-он
Раствор 5-бром-1,2-дигидропиридин-2-она (1 г; 5,75 ммоль; 1 экв.) и 1- бромпропан-2-ола (1,6 г; 0,01 ммоль; 2,00 экв.), K2CO3 (1,6 г; 0,01 ммоль; 2,00 экв.) в DMF (15 мл) перемешивали в течение 4 ч при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 5-бром-1-(2-гидроксипропил)-1,2-дигидропиридин-2-он (0,9 г; 67,48%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=232,1; 234,1. 1Н ЯМР: (300 МГц, DMSO-d6) δ 1.05 (dd, 3Н), 3.55 (ddd, 1H), 3.85 (dddd, 1H), 3.96 (ddd, 1H), 4.89 (dd, 1H), 6.35 (dd, 1H), 7.50 (m, 1H), 7.82 (t, 1H).
Стадия 2. 1-(2-Гидроксипропил)-5-(4,45,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-он
К раствору 5-бром-1-(2-гидроксипропил)-1,2-дигидропиридин-2-она (300 мг; 1,29 ммоль; 1 экв.) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (656,5 мг; 2,59 ммоль; 2 экв.) в THF (15 мл) добавляли KOAc (137,5 мг; 1,40 ммоль; 3,00 экв.) и Pd(dppf)Cl2 (94,6 мг; 0,13 ммоль; 0,10 экв.). Смесь перемешивали в течение 2 часов при 80°С в атмосфере азота. Полученную смесь использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=280,1.
Стадия 3. 3-Амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6- дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К раствору метил 3-амино-6-бром-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (200 мг; 0,67 ммоль; 1 экв.) и 1-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2-дигидропиридин-2-она (314,4 мг; 1,34 ммоль; 2,00 экв.) в THF (15 мл) добавляли Cs2CO3 (435,8 мг; 1,34 ммоль; 2 экв.) и Pd(dppf)Cl2 (48,9 мг; 0,07 ммоль; 0,1 экв.). После перемешивания в течение 2 ч при 80°С в атмосфере азота остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (рацемат; 10 мг; 4,77%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=483,3. 1H ЯМР: (300 МГц, DMSO-d6) δ 1.05 (d, 3Н), 3.62 (m, 1H), 3.93 (m, 2H), 4.60 (s, 2H), 4.83 (d, 1H), 6.35 (d, 1H), 7.08 (t, 2H), 7.38 (m, 2H), 7.49 (dd, 1H), 7.74 (s, 2H), 7.80 (d, 1H), 8.27 (d, 1H), 9.05 (t, 1H).
Стадия 4. 3-Амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (абсолютная конфигурация не известна, пик L соединение 107) и 3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (абсолютная конфигурация не известна, пик 2. соединение 108)
Рацемический продукт (100 мг) очищали препаративной хиральной HPLC на элюенте. Колонка: (R,R) Whelk-O 1; 21,1*250 мм, 5 мкм; подвижная фаза A: Hex (с NH3.MeOH (8 ммоль/л)) для HPLC, подвижная фаза В: EtOH для HPLC; скорость потока: 20 мл/мин; градиент: от 50 В до 50 В за 26 мин; 254/220 нм; Rt1: 16,649; Rt2: 19,223. В результате получали 3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (изомер 1) (соединение 107) (30 мг; 30%) в виде желтого твердого вещества LCMS: m/z (ESI), [М+Н]+=483,3. 1H ЯМР: (300 МГц, DMSO-d6) δ 1.05 (d, 3Н), 3.62 (m, 1H), 3.93 (m, 2Н), 4.60 (s, 2Н), 4.83 (d, 1H), 6.35 (d, 1H), 7.08 (t, 2H), 7.38 (m, 2H), 7.49 (dd, 1H), 7.74 (s, 2H), 7.80 (d, 1H), 8.27 (d, 1H), 9.05 (t, 1H). Для хирального соединения: tR=2,59 мин; и 3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (изомер 2) (соединение 108) (30 мг; 30%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=483,3. 1H ЯМР: (300 МГц, DMSO-d6) δ 1.05 (d, 3Н), 3.62 (m, 1H), 3.93 (m, 2Н), 4.60 (s, 2Н), 4.83 (d, 1H), 6.35 (d, 1H), 7.08 (t, 2H), 7.38 (m, 2H), 7.49 (dd, 1H), 7.74 (s, 2H), 7.80 (d, 1H), 8.27 (d, 1H), 9.05 (t, 1H). Для хирального соединения: tR=3,03 мин, для смеси хиральных соединений: tR=2,59 мин, 3,03 мин.
Пример 111. Получение 3-амино-N-((6-(3-(диметиламино)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 111)
СХЕМА 67
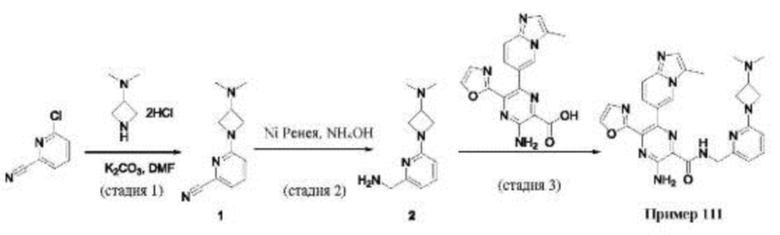
Стадия 1. 6-(3-(Диметиламино)азетидин-1-ил)пиколипонитрил
В круглодонную колбу емкостью 50 мл помещали 6-хлорпиридин-2-карбонитрил (1,5 г; 10,826 ммоль; 1 экв.), дигидрохлорид N,N-диметилазетидин-3-амина (1,87 г; 10,826 ммоль; 1 экв.), DMF (10 мл; 129,218 ммоль; 11,94 экв.), K2CO3 (4,49 г; 32,479 ммоль; 3 экв.). Полученный раствор перемешивали в течение 16 часов при 80°С. Полученный раствор экстрагировали дихлорметаном (3 × 20 мл). Остаток наносили на колонку с силикагелем, используя для разделения смесь дихлорметан/метанол (50:1). В результате получали 6-[3-(диметиламино)азетидин-1-ил]пиридин-2-карбонитрил (соединение 111) (475 мг; 21,69%) в виде светло-коричневого твердого вещества. 1Н ЯМР (400 МГц, хлороформ-d) δ 3.96 (1H, s), 6.20 (6Н, s), 7.22-7.33 (6Н, m), 7.83 (2Н, dd), 8.05-8.14 (2Н, m), 8.81 (6Н, s), 10.62 (1H, dd), 11.02 (1H, dd), 11.57 (1H, dd).
Стадия 2. 1-(6-(Аминометил)пиридин-2-ил)-N,N-диметилазетидин-3-амин
В круглодонную колбу емкостью 25 мл помещали 6-(3-(диметиламино)азетидин-1-ил)пиколинонитрил. После этого добавляли МеОН (10 мл; 246,989 ммоль; 111,01 экв.), NH4OH (2 мл; 51,361 ммоль; 23,09 экв.) и Ni Ренея при КТ. Полученную смесь перемешивали в течение 1 часа при комнатной температуре. Твердые вещества отфильтровывали. Полученную смесь концентрировали. В результате получали 290 мг 1-[6-(аминометил)пиридин-2-ил]-N,N-диметилазетидин-3-амина (63,18%) в виде твердого вещества. LCMS: m/z (ESI), [М+Н]+=207,1. 1Н ЯМР (300 МГц, метанол-d4) δ 2.24 (6Н, s), 3,27 (1H, d), 3.77 (2Н, s), 3.79-3.89 (2Н, m), 4.12 (2Н, t), 6.32 (1H, s), 6.66 (1H, d), 7.51 (1H, t).
Стадия 3. 3-Амино-N-((6-(3-(диметиламино)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1.2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 111)
В круглодонную колбу емкостью 25 мл помещали 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (130 мг), DMF (5 мл), Т3Р (750 мг), DIEA (530 мг), 1-[6-(аминометил)пиридин-2-ил]-N,N-диметилазетидин-3-амин (130 мг). Полученный раствор перемешивали в течение 16 часов при комнатной температуре. Полученный раствор экстрагировали этилацетатом (3 × 10 мл), органические слои объединяли и концентрировали. Остаток наносили на колонку с силикагелем, используя для разделения смесь дихлорметан/метанол (8:1). Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 31% В до 41% В за 7 мин; 254/220 нм; Rt: 5,10 мин) и получали продукт. В результате получали 3-амино-N-([6-[3-(диметиламино)азетидин-1-ил]пиридин-2-ил] метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 111) (51,6 мг) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=525,3. 1Н ЯМР (300 МГц, метанол-d6) δ 2.03 (6Н, s), 2.49 (3Н, d), 3.03 (1H, t), 3.66 (2Н, dd), 3.88-3.99 (2Н, m), 4.55 (2Н, s), 6.29 (1H, d), 6.67 (1H, d), 7.25-7.35 (2Н, m), 7.39 (1H, s), 7.43-7.54 (2Н, m), 7.99 (1Н, d), 8.37 (1H, s).
Пример 112. Получение 3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((6-(4-метилпиперазин-1-ил)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 112)
СХЕМА 68

Стадия 1. 6-(4-Метилпиперазин-1-ил)пиколинонитрил
6-Фторпиридин-2-карбонитрил (500 мг; 4,095 ммоль; 1 экв.), 1-метилпиперазин (615,25 мг; 6,142 ммоль; 1,5 экв.), K2CO3 (1131,89 мг; 8,190 ммоль; 2 экв.) растворяли в 3 мл DMF. Смесь перемешивали при 50°С в течение 8 часов. LCMS показала завершение реакции. Неочищенный продукт очищали на колонке с силикагелем с элюированием смесью DCM : СН3ОН (15:1), продукт далее очищали препаративной HPLC, получая 6-(4-метилпиперазин-1-ил)пиколинонитрил (158 мг; 19,08%) в виде коричневого масла. LCMS: m/z (ESI), [М+Н]+=203,3.
Стадия 2. (6-(4-Метилпиперазин-1-ил)пиридин-2-ил)метанамин
6-(4-Метилпиперазин-1-ил)пиридин-2-карбонитрил (140 мг; 0,692 ммоль; 1 экв.), Ni Ренея (118,60 мг; 1,384 ммоль; 2,00 экв.) растворяли в 3 мл NH4OH и МеОН. Смесь перемешивали при комнатной температуре в атмосфере Н2 в течение 3 часов. LCMS показала завершение реакции. Неочищенный продукт очищали на колонке с силикагелем с элюированием смесью DCM : CH3OH (15:1), продукт далее очищали препаративной HPLC, получая (6-(4-метилпиперазин-1-ил)пиридин-2-ил)метанамин (40 мг; 28,01%) в виде серого масла. LCMS: m/z (ESI), [М+Н]+=207,3.
Стадия 3, 3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((6-(4-метилпиперазин-1-ил)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 112)
1-[6-(4-Метилпиперазин-1-ил)пиридин-2-ил]метанамин (29,44 мг; 0,143 ммоль; 1,20 экв.), 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (40 мг; 0,119 ммоль; 1 экв.), EDCI (1-этил-3-(3- диметиламинопропил)карбодиимид) (45,60 мг; 0,238 ммоль; 2,00 экв.), НОВТ (32,14 мг; 0,238 ммоль; 2,00 экв.), DIEA (92,23 мг; 0,714 ммоль; 6,00 экв.) растворяли в 3 мл DMF. Смесь перемешивали при комнатной температуре в течение 2 ч. LCMS показала завершение реакции. Неочищенный продукт очищали на колонке с силикагелем с элюированием смесью DCM : CH3OH (15:1), продукт далее очищали препаративной HPLC, получая 3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((6-(4-метилпиперазин-1-ил)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (26,5 мг; 42,47%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=525,3. 1H-ЯМР (300 МГц, метаноле) δ: 1.29 (s, 6Н), 2.29 (1H, d), 2.49 (3Н, d), 3.31-3.48 (4Н, m), 4.58 (2Н, s), 6.67 (2Н, dd), 7.24-7.33 (2Н, m), 7.42 (1H, d), 7.46-7.58 (2Н, m), 7.99 (1H, d), 8.39 (1H, t).
Пример 113. Получение 3-амино-5-(4-фторфенил)-N-[[3-(2-гидроксиэтокси)- пиридин-2-ил] метил]-6-(1 -метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамида (соединения 113)
СХЕМА 69
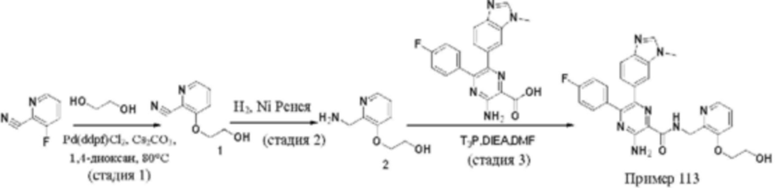
Стадия 1. 3-(2-Гидроксиэтокси)пиридин-2-карбонитрил
К смеси 3-фторпиридин-2-карбонитрила (1,5 г; 12,3 ммоль; 1 экв.) и этан-1,2-диола (1,5 г; 24,5 ммоль; 2 экв.) в 1,4-диоксане (25 мл) добавляли Cs2CO3 (8,0 г; 24,5 ммоль; 2 экв.). Полученную смесь перемешивали в течение 4 часов при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (5:1), получая 3-(2-гидроксиэтокси) пиридин-2-карбонитрил (1 г; 49,6%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=166,1. 1Н ЯМР (300 МГц, DMSO-d6) δ 3.75 (2Н, q), 4.23 (2Н, m), 4.97 (1H, t), 7.68 (1H, dd), 7.81 (1H, dd), 8.28 (1H, dd).
Стадия 2. 2-[[2-(Аминометил)пиридин-3-ил]окси]этан-1-ол
К раствору 3-(2-гидроксиэтокси)пиридин-2-карбонитрила (200 мг; 1,2 ммоль; 1 экв.) в МеОН (5 мл) и NH3H2O (1 мл) добавляли Ni Ренея (469,7 мг; 5,5 ммоль; 3 экв.). Полученную смесь перемешивали в течение 2 часов при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали 2-[[2-(аминометил)пиридин-3-ил]окси]этан-1-ол (200 мг) в виде пурпурного масла. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=169,3.
Стадия 3. 3-Амино-5-(4-фторфенил)-N-[[3-(2-гидроксиэтокси)пиридин-2-ил]метил]-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 113)
К раствору 2-[[2-(аминометил)пиридин-3-ил]окси]этан-1-ола (200 мг; 1,2 ммоль; 1 экв.) и 3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоновой кислоты (302,4 мг; 0,8 ммоль; 0,7 экв.) в DMF(15 мл) порциями добавляли Т3Р (756,7 мг; 2,4 ммоль; 2 экв.), DIEA (307,4 мг; 2,4 ммоль; 2 экв.). Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (60 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: Xselect CSH OBD, 30*150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% TFA), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 35% В до 45% В за 7 мин; 254/220 нм; Rt: 7,02 мин), получая 3-амино-5-(4-фторфенил)-N-[[3-(2-гидроксиэтокси)пиридин-2-ил]метил]-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 113) (20 мг; 6,55%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=514,3. 1H ЯМР (300 МГц, DMSO-d6) δ 3.76 (2Н, t), 3.98 (3Н, s), 4.12 (2Н, t), 4.69 (2Н, d), 7.15 (2Н, q), 7.37 (4Н, m), 7.51 (1H, d), 7.67 (1H, d), 7.76 (2Н, s), 8.04 (1Н, d), 8.10 (1H, dd), 9.22 (2Н, d). 19F ЯМР (282 МГц, DMSO-d6) δ -74.48, -112.25.
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 113.
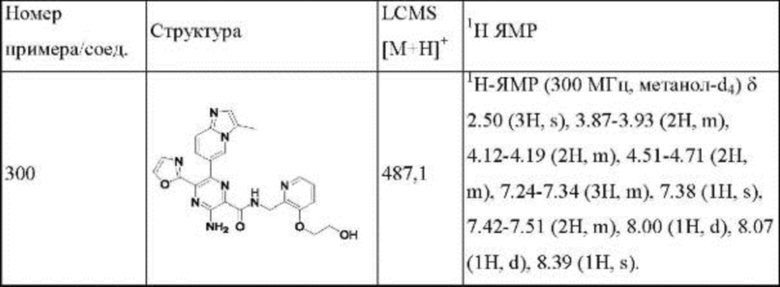
Пример 114. Получение 3-амино-5-(4-фторфенил)-N-[[3-(2-метоксиэтокси)-пиридин-2-ил]метил]-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамида (соединения 114)
СХЕМА 70
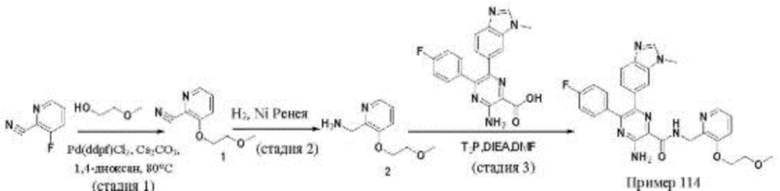
Стадия 1. N-[2-[(2-Цианопиридин-3-ил)окси]этил]-N-метилкарбамат
К смеси 3-фторпиридин-2-карбонитрила (1,5 г; 12,2 ммоль; 1 экв.) и трет-бутил N-(2-гидроксиэтил)-N-метилкарбамата (4,3 г; 24,5 ммоль; 2 экв.) в 1,4-диоксане (25 мл) добавляли Cs2CO3 (8,01 г; 24,6 ммоль; 2,0 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 часов при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (10:1), получая трет-бутил N-[2-[(2-цианопиридин-3-ил)окси]этил]-N-метилкарбамат (1,8 г; 52,8%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=179,0. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.36 (9Н, s), 2.90 (3Н, d), 3.57 (2Н, t), 4.33 (2Н, q), 7.69 (1Н, dd), 7.82 (1H, d), 8.29 (1H, dd).
Стадия 2. 1-[3-(2-Метоксиэтокси)пиридин-2-ил]метанамин
К раствору 3-(2-метоксиэтокси)пиридин-2-карбонитрила (300 мг; 1,7 ммоль; 1 экв.) в МеОН (5 мл) и NH3H2O (1 мл) порциями добавляли Ni Ренея (288,4 мг; 3,3 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали 1-[3-(2-метоксиэтокси)пиридин-2-ил]метанамин (200 мг; 65,2%) в виде пурпурного масла. Неочищенный продукт использовали на следующей стадии непосредственно без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=183,1.
Стадия 3. 3-Амино-5-(4-фторфенил)-N-[[3-(2-метоксиэтокси)пиридин-2-ил]метил]-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 114)
К раствору 1-[3-(2-метоксиэтокси)пиридин-2-ил]метанамина (180 мг; 1 ммоль; 1 экв.) и 3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоновой кислоты (251,2 мг; 0,7 ммоль; 0,7 экв.) в DMF (15 мл) порциями добавляли Т3Р (628,6 мг; 2 ммоль; 2 экв.) и DIEA (255,3 мг; 2 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (60 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 35% В до 45% В за 7 мин; 254/220 нм; Rt: 6,83 мин), получая 3-амино-5-(4-фторфенил)-N-[[3-(2-метоксиэтокси)пиридин-2-ил]метил]-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 114) (48,1 мг; 9,2%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=528,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 3,29 (3Н, s), 3.69 (2Н, dd), 3.78 (3Н, s), 4.20 (2Н, dd), 4.62 (2Н, d), 7.10 (1H, d), 7.15 (2Н, t), 7.28 (1H, dd), 7.44 (4Н, m), 7.69 (2Н, m), 8.08 (1H, dd), 8.19 (1H, s), 9.18 (1H, t).
Пример 115. Получение 3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-N-([3-[2-(метиламино)этокси]пиридин-2-ил]метил)пиразин-2-карбоксамида (соединения 115)
СХЕМА 71

Стадия 1. трет-Бутил N-[2-[(2-цианопиридин-3-ил)окси]этил]-N-метилкарбамат
К смеси 3-фторпиридин-2-карбонитрила (1,5 г; 12,2 ммоль; 1 экв.) и трет-бутил Х-(2-гидроксиэтил)-N-метилкарбамата (4,3 г; 24,5 ммоль; 2 экв.) в 1,4-диоксане (25 мл) порциями добавляли Cs2CO3 (8,01 г; 24,5 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 ч при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (10:1), получая трет-бутил N-[2-[(2-цианопиридин-3-ил)окси]этил]-N-метилкарбамат (1,8 г; 52,8%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=278,0. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.36 (9Н, s), 2.90 (3Н, d), 3.57 (2Н, t), 4.33 (2Н, q), 7.69 (1Н, dd), 7.82 (1Н, d), 8.29 (1H, dd).
Стадия 2. трет-Бутил N-(2-[[2-(аминометил)пиридин-3-ил]окси]этил)-N-метилкарбамат
К раствору трет-бутил N-[2-[(2-цианопиридин-3-ил)окси]этил]-N-метилкарбамата (300 мг; 1,08 ммоль; 1 экв.) в МеОН (5 мл) и NH3H2O (1 мл) добавляли Ni Ренея (185,3 мг; 2,1 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали трет-бутил N-(2-[[2-(аминометил)пиридин-3-ил]окси]этил)-N-метилкарбамат (200 мг; 65,7%) в виде пурпурного масла. Неочищенный продукт использовали на следующей стадии непосредственно без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=282,3.
Стадия 3. N-(2-[[2-([[3-Амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-ил]формамидо]метил)пиридин-3-ил]окси]этил)-N-метилкарбамат
К раствору трет-бутил N-(2-[[2-(аминометил)пиридин-3-ил]окси]этил)-N- метилкарбамата (200 мг; 0,7 ммоль; 1 экв.) и 3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоновой кислоты (180,8 мг; 0,5 ммоль; 0,7 экв.) в DMF (15 мл) порциями добавляли Т3Р (452,3 мг; 1,4 ммоль; 2 экв.) и DIEA (183,7 мг; 1,4 ммоль; 2,0 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая трет-бутил N-(2-[[2-([[3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-ил]формамидо]метил)пиридин-3-ил]окси]этил)-N-метилкарбамат (150 мг; 33,6%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=627,4.
Стадия 4. 3-Амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-N-([3-[2-(метиламино)этокси]пиридин-2-ил]метил)пиразин-2-карбоксамид (соединение 115)
К 4 н. раствору HCl (газ.) в 1,4-диоксане (10 мл) порциями добавляли трет-бутил N-(2-[[2-([[3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6- ил)пиразин-2-ил]формамидо]метил)пиридин-3-ил]окси]этил)-N-метилкарбамат (150 мг; 0,2 ммоль; 1 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30× 150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 33% В до 43% В за 7 мин; 254/220 нм; Rt: 5,8 мин), получая 3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-N-([3-[2-(метиламино)этокси]пиридин-2-ил]метил)пиразин-2-карбоксамид (соединение 115) (51 мг; 40,5%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=527,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.31 (3Н, s), 2.85 (2Н, m), 3.79 (3Н, s), 4.11 (2Н, t), 4.66 (2Н, d), 7.09 (3Н, m), 7.28 (1H, dd), 7.44 (5Н, m), 7.69 (2Н, d), 8.08 (1H, dd), 8.20 (1H, s), 9.18 (1H, t).
Пример 116. Получение 3-амино-N-([3-[2-(диметиламино)этокси]пиридин-2-ил]метил)-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамида (соединения 116)
СХЕМА 72
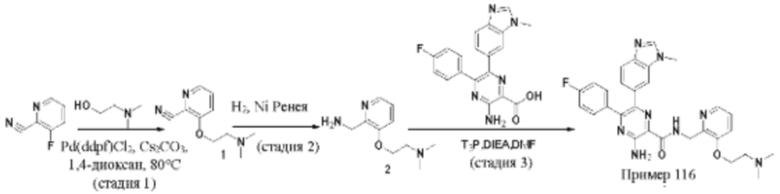
Стадия 1. 3-[2-(Диметиламино)этокси]пиридин-2-карбонитрил
К смеси 3-фторпиридин-2-карбонитрила (1 г; 8,1 ммоль; 1 экв.) и 2-(диметиламино)этан-1-ола (1,4 г; 0,02 ммоль; 2,0 экв.) в 1,4-диоксане (25 мл) добавляли Cs2CO3 (5,3 г; 0,02 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 ч при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (2:3), получая 3-[2-(диметиламино)этокси]пиридин-2-карбонитрил (1,2 г; 76,6%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=192,1. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.21 (6Н, s), 2,66 (2Н, t), 4.26 (2H, t), 7.68 (1H, ddd), 7.79 (1H, dt), 8.27 (1H, dt).
Стадия 2. 1-[3-[2-(Диметиламино)этокси]пиридин-2-ил]метанамин
К раствору 3-[2-(диметиламино)этокси]пиридин-2-карбонитрила (300 мг; 1,5 ммоль; 1 экв.) в МеОН (5 мл) и NH3H2O (1 мл) добавляли Ni Ренея (403,2 мг; 4,7 ммоль; 3 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали 1-[3-[2-(диметиламино)этокси]пиридин-2-ил]метанамин (200 мг; 65,3%) в виде пурпурного масла. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=196,1.
Стадия 3. 3-Амино-N-([3-[2-(диметиламино)этокси]пиридин-2-ил]метил)-5-(4- фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 116}
К раствору 1-[3-[2-(диметиламино)этокси]пиридин-2-ил]метанамина (200 мг; 1,02 ммоль; 1 экв.) и 3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоновой кислоты (260,5 мг; 0,7 ммоль; 0,7 экв.) в DMF (15 мл) порциями добавляли Т3Р (651,8 мг; 2,04 ммоль; 2 экв.) и DIEA (264,7 мг; 2,04 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 33% В до 43% В за 7 мин; 254/220 нм; Rt: 7,08 мин), получая 3-амино-N-([3-[2-(диметиламино)этокси]пиридин-2-ил] метил)-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 116) (46,5 мг; 8,40%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=541,4. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.20 (6Н, s), 2,66 (2Н, t), 3.79 (3Н, s), 4.15 (2Н, t), 4.63 (2Н, d), 7.10 (3Н, m), 7.29 (1H, dd), 7.46 (4Н, m), 7.58 (2Н, s), 7.69 (1H, d), 8.08 (1H, dd), 8.20 (1H, s), 9.18 (1H, t).
Пример 117. Получение 3-амино-5-(4-фторфенил)-N-([3-[(2-гидроксиэтил)амино]пиридин-2-ил]метил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамида (соединения 117)
СХЕМА 73
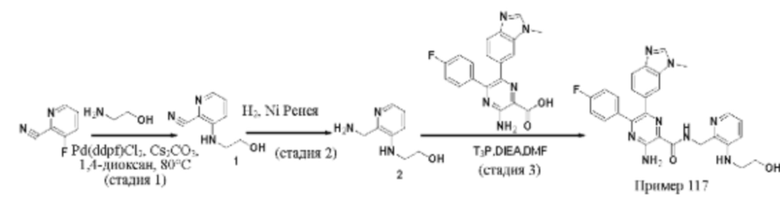
Стадия 1. 3-[(2-Гидроксиэтил)амино]пиридин-2-карбонитрил
К смеси 3-фторпиридин-2-карбонитрила (1,5 г; 12,3 ммоль; 1 экв.) и 2- аминоэтан-1-ола (1,5 г; 24,5 ммоль; 2 экв.) в DMSO (25 мл) порциями добавляли Cs2CO3 (8,01 г; 24,5 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 ч при 80°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (1:1), получая 3-[(2-гидроксиэтил)амино]пиридин-2-карбонитрил (1 г; 49,8%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=164,2. 1Н ЯМР (300 МГц, DMSO-d6) δ 3,25 (2Н, q), 3.54 (2Н, t), 483 (1H, s), 6.18 (1H, t), 7.29 (1H, dd), 7.39 (1H, ddd), 7.86 (1H, dd).
Стадия 2. 2-[[2-(Аминометил)пиридин-3-ил]амино]этан-1-ол
К раствору 3-[(2-гидроксиэтил)амино]пиридин-2-карбонитрила (300 мг; 1,8 ммоль; 1 экв.) в МеОН (5 мл) и NH3H2O (1 мл) добавляли Ni Ренея (472,5 мг; 5,5 ммоль; 3 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3 × 10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали 2-[[2-(аминометил)пиридин-3-ил]амино]этан-1-ол (230 мг; 74,8%) в виде пурпурного масла. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=168,1.
Стадия 3. 3-Амино-5-(4-фторфенил)-N-([3-[(2-гидроксиэтил)амино]пиридин-2- ил]метил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 117)
К раствору 2-[[2-(аминометил)пиридин-3-ил]амино]этан-1-ола (200 мг; 1,2 ммоль; 1 экв.) и 3-амино-5-(4-фторфенил)-6-(1-метил-1H-1,3-бензодиазол-6-ил)пиразин-2-карбоновой кислоты (304,2 мг; 0,8 ммоль; 0,7 экв.) в DMF(15 мл) порциями добавляли Т3Р (761,1 мг; 2,3 ммоль; 2 экв.) и DIEA (309,1 мг; 2,4 ммоль; 2 экв.). Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Реакционную смесь (60 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 35% В до 36% В за 7 мин; 254/220 нм; Rt: 5,57 мин), получая 3-амино-5-(4-фторфенил)-N-([3-[(2-гидроксиэтил)амино]пиридин-2-ил]метил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 117) (33,3 мг; 5,4%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=513,4. 1Н ЯМР (300 МГц, DMSO-d6) δ 3.17 (2Н, d), 3.60 (2Н, q), 3.78 (3Н, s), 4.50 (2Н, d), 4.78 (1H, t), 5.47 (1H, t), 6.98 (1H, d), 7.09 (4Н, m), 7.44 (3Н, m), 7.74 (4Н, m), 8.19 (1H, s), 9.40 (1H, t).
Пример 118. Получение 3-амино-N-((4-(диметиламино)пиридин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 118)
СХЕМА 74

Стадия 1. 4-(Диметиламино)никотинонитрил
Во флакон емкостью 20 мл добавляли диметиламин (295,63 мг; 6,557 ммоль; 2,00 экв.), 4-бромпиридин-3-карбонитрил (600 мг; 3,279 ммоль; 1 экв.) и K2CO3 (1,36 г; 9,836 ммоль; 3,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при 40°С. Полученную смесь фильтровали, осадок на фильтре промывали DCM (2×20 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (EtOAc), получая 4-(диметиламино)пиридин-3-карбонитрил (470 мг; 97,40%) в виде беловатого твердого вещества (неочищенного). 1H-ЯМР (400 МГц, CDCl3) δ 3,26 (6Н, s), 6.55 (1Н, d), 8.23 (1H, d), 8.47 (1H, s).
Стадия 2. 3-(Аминометил)-N,N-диметилпиридин-4-амин
Раствор 4-(диметиламино)пиридин-3-карбонитрила (470 мг; 3,193 ммоль; 1 экв.) и никеля Ренея (957,56 мг; 11,177 ммоль; 3,50 экв.), NH3H2O (1,12 г; 31,958 ммоль; 10,01 экв.) в МеОН перемешивали в течение 7 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали DCM (2×10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали 3-(аминометил)-N,N-диметилпиридин-4-амин (467 мг; 96,71%) в виде зеленого масла. LCMS: m/z (ESI), [М+Н]+=152,3. 1Н ЯМР (300 МГц, MeOD-d4) δ 2.75-3.05 (6Н, m), 3.93 (2Н, s), 6.95 (1H, s), 7.90-8.51 (2Н, m).
Стадия 3; 3-Амино-N-((4-(диметиламино)пиридин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 118)
К перемешиваемому раствору 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (70 мг; 0,208 ммоль; 1 экв.) и DIEA (80,70 мг; 0,624 ммоль; 3,00 экв.), Т3Р (132,45 мг; 0,416 ммоль; 2,00 экв.) в DMF по каплям добавляли 3-(аминометил)-N,N-диметилпиридин-4-амин (62,95 мг; 0,416 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая желтое твердое вещество. Неочищенный продукт (90 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 15% В до 50% В за 7 мин; 254/220 нм; Rt: 5,82 мин), получая 3-амино-N-[[4-(диметиламино)пиридин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 118) (45 мг; 46,05%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=470,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.42 (3Н, d), 2.80 (6Н, s), 457 (2Н, d), 6.89 (1H, d), 7.26 (1H, dd), 7.38 (2Н, dd), 7.48 (1H, dd), 7.89 (2Н, s), 8.19-8.30 (3Н, m), 8.34 (1H, dd), 9.39 (1H, t).
Пример 119. Получение 3-амино-N-[[3-(карбамоилметокси)пиридин-2-ил]метил]-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамида (соединения 119)
СХЕМА 75
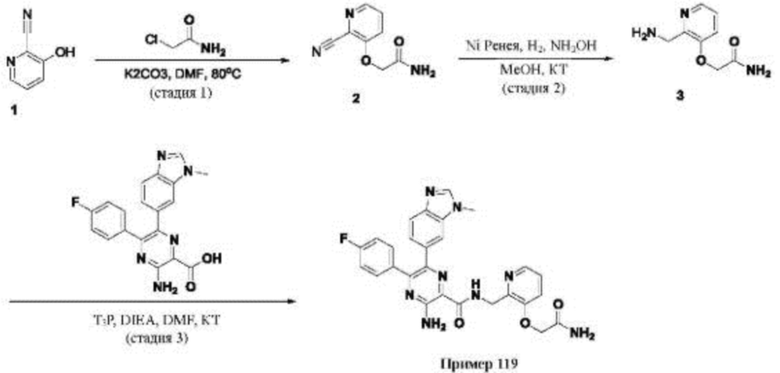
Стадия 1. 2-[(2-Цианопиридин-3-ил)окси]ацетамид
Смесь K2CO3 (448,75 мг; 3,247 ммоль; 3 экв.), 2-хлорацетамида (121,45 мг; 1,299 ммоль; 1,2 экв.) и 3-гидроксипиридин-2-карбонитрила (130 мг; 1,082 ммоль; 1 экв.) в DMF (6 мл) перемешивали в течение 16 часов при 80°С в воздушной атмосфере. Полученную смесь разбавляли водой (30 мл) и экстрагировали EtOAc (3 × 20 мл). Объединенные органические слои промывали рассолом (3 × 30 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 12:1), получая 2-[(2-цианопиридин-3-ил)окси]ацетамид (100 мг; 52,15%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=178,0. 1H-ЯМР (300 МГц, CDCl3) δ: 478 (2Н, s), 7.47 (1H, d), 7.61 (2Н, d), 7.70 (1H, d), 8.32 (1H, d).
Стадия 2. 2-[[2-(Аминометил)пиридин-3-ил]окси]ацетамид
Смесь никеля Ренея (26,98 мг; 0,315 ммоль; 0,62 экв.) и 2-[(2-цианопиридин-3-ил)окси]ацетамида (90 мг; 0,508 ммоль; 1 экв.) в МеОН (5 мл) перемешивали в течение 1 ч при комнатной температуре в атмосфере водорода. Выпавшие в осадок твердые вещества собирали фильтрованием и промывали МеОН (3×10 мл). Полученную смесь концентрировали при пониженном давлении, получая 2-[[2-(аминометил)пиридин-3-ил]окси]ацетамид (60 мг; 65,18%) в виде пурпурного твердого вещества. LCMS: m/z (ESI), [М+Н]+=182,1.
Стадия 3. 3-Амино-N-[[3-(карбамоилметокси)пиридин-2-ил]метил]-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 119)
Смесь Т3Р (100 мг; 1,344 ммоль; 4 экв.), DIEA (470,5 мг; 1,344 ммоль; 4,00 экв.), 3-амино-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоновой кислоты (120 мг; 0,336 ммоль; 1,00 экв.) и 2-[[2-(аминометил)пиридин-3-ил] оке и] ацетамида (59,8 мг; 0,336 ммоль; 1 экв.) в DMF (0,2 мл) перемешивали в течение 4 часов при комнатной температуре в воздушной атмосфере. Неочищенный продукт (70 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 31% В до 45% В за 8 мин; 254/220 нм; Rt: 7,30 мин), получая 3-амино-N-[[3-(карбамоилметокси)пиридин-2-ил]метил]-5-(4-фторфенил)-6-(1-метил-1Н-1,3-бензодиазол-6-ил)пиразин-2-карбоксамид (соединение 119) (20 мг; 12,14%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=527,3. 1H ЯМР (300 МГц, DMSO-d6) δ 3.80 (3Н, s), 4.61 (2Н, s), 4.75 (2Н, d), 7.08 (1Н, d), 7.15 (2Н, t), 7.27-7.38 (2Н, m), 7.43 (2Н, d), 7.50 (2Н, d), 7.64 (2Н, s), 7.72 (1Н, s), 8.13 (1Н, d), 8.21 (1Н, s), 9.23 (1Н, d). 19F ЯМР (282 МГц, DMSO-d6) δ: -112.591.
Примеры 120/121. Получение (R/S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединений 120/121)
СХЕМА 76
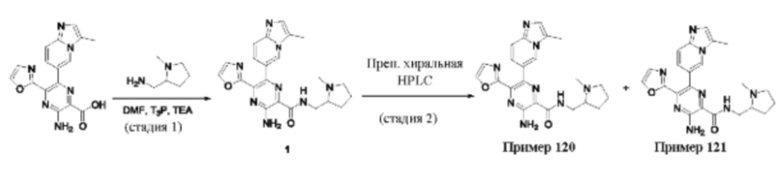
Стадия 1. 3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (300 мг; 0,892 ммоль; 1 экв.), Et3N (270,79 мг; 2,676 ммоль; 3,00 экв.) и Т3Р (851,48 мг; 2,676 ммоль; 3,00 экв.) в DMF по каплям добавляли 1-(1-метилпирролидин-2-ил)метанамин (203,73 мг; 1,784 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение ночи при комнатной температуре. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая желтое твердое вещество. Неочищенный продукт (260 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 23% В до 38% В за 7 мин; 254/220 нм; Rt: 6,33 мин), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[(1-метилпирролидин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (120 мг; 31,10%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=433,3. 1H-ЯМР (400 МГц, DMSO-d6) δ 1.55-1.67 (3Н, m), 1.78-1.88 (1Н, m), 2.14 (1Н, q), 2.31 (3Н, s), 2.42 (4Н, d), 2.94 (1Н, dd), 3.20-3.29 (1Н, m), 3.48 (1Н, ddd), 7.19 (1Н, dd), 7.36 (1Н, d), 7.40 (1Н, d), 7.49(1Н, dd), 7.90 (2Н, s), 8.27 (1Н, d), 8.31-8.36 (1Н, m), 8.66 (1Н, t).
Стадия 2. (R/S)-3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединения 120/121)
Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: CHIRALPAK IG, 20*250 мм, 5 мкм; подвижная фаза A: Hex:DCM, 3:1 (с 10 мМ NH3-MEOH) для HPLC, подвижная фаза В: EtOH для HPLC; скорость потока: 18 мл/мин; градиент: от 50 В до 50 В за 25 мин; 220/254 нм; Rt1: 13,303; Rt2: 19,802), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (изомер 1) (соединение 120) (42 мг; 42,00%), LCMS: m/z (ESI), [М+Н]+=433,2. 1Н-ЯМР (400 МГц, DMSO-d6) δ 1.60 (3Н, dp), 1.76-1.89 (1Н, m), 2.15 (1Н, q), 2.30 (3Н, s), 2.42 (4Н, d), 2.93 (1Н, dd), 3.24 (1Н, dd), 3.48 (1Н, dd), 7.19 (1Н, dd), 7.35 (1Н, d), 7.40 (1Н, d), 7.48 (1Н, dd), 8.24 (1Н, d), 8.35 (1Н, dd);
3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (изомер 2) (соединение 121) (40 мг; 40%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=433,2. 1H-ЯМР (400 МГц, DMSO-d6) δ 1.59 (3Н, ddt), 1.77-1.90 (1Н, m), 2.14 (1Н, q), 2.29 (3Н, s), 2.42 (4Н, d), 2.89-2.96 (1Н, m), 3.24 (1Н, dd), 3.48 (1Н, dd), 7.19 (1Н, dd), 7.34 (1Н, d), 7.40 (1Н, d), 7.48 (1Н, dd), 8.24 (1Н, d), 8.35 (1Н, dd).
Пример 122. Получение (R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(пирролидин-2-илметил)пиразин-2-карбоксамида (соединения 122)
СХЕМА 77
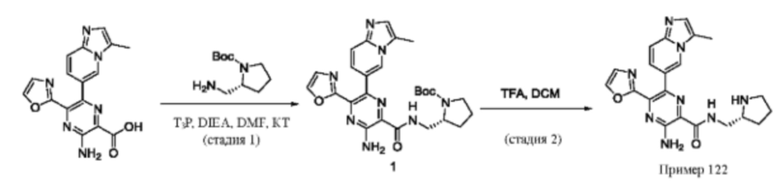
Стадия 1. (R)-трет-Бутил 2-((3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамидо)метил)пирролидин-1-карбоксилат
К перемешиваемому раствору 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (140 мг; 0,416 ммоль; 1 экв.) и трет-бутил (2R)-2-(аминометил)пирролидин-1-карбоксилата (125,06 мг; 0,624 ммоль; 1,50 экв.), DIEA (161,40 мг; 1,249 ммоль; 3,00 экв.) в DMF по каплям добавляли Т3Р (264,91 мг; 0,833 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре. Полученную смесь разбавляли водой (100 мл). Полученную смесь экстрагировали CH2Cl2 (4 × 100 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая трет-бутил (2R)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пирролидин-1-карбоксилат (156 мг; 72,26%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=519,2.
Стадия 2. (2R)-3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(пирролидин-2-илметил)пиразин-2-карбоксамид (соединение 122)
В круглодонную колбу емкостью 50 мл добавляли трет-бутил(2R)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пирролидин-1-карбоксилат (140 мг; 0,270 ммоль; 1 экв.) и TFA (2,00 мл; 17,541 ммоль; 99,74 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Полученную смесь разбавляли DCM (100 мл). Реакцию гасили насыщенным раствором NaHCO3 при комнатной температуре. Полученную смесь экстрагировали CH2Cl2 (3 × 100 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л) + 0,1% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 10% В до 30% В за 7 мин; 254/220 нм; Rt: 6,82 мин), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[[(2R)-пирролидин-2-ил] метил] пиразин-2-карбоксамид (соединение 122) (60 мг; 53,11%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=419,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.32-1.44 (1Н, m), 1.54-1.82 (3Н, m), 2.43 (3Н, d), 2.71-2.86 (2Н, m), 3.23 (3Н, ddt), 7.21 (1Н, dd), 7.38 (2Н, dd), 7.49 (1Н, dd), 7.91 (2Н, s), 8.27 (1Н, d), 8.34 (1Н, t), 8.75 (1Н, t).
Пример 123. Получение (S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(пирролидин-2-илметил)пиразин-2-карбоксамида (соединения 123)
СХЕМА 78
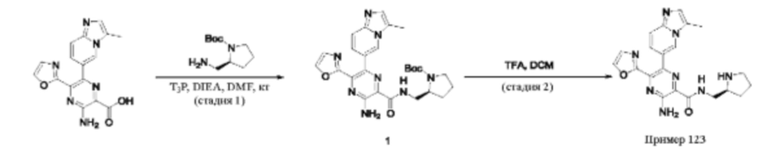
Стадия 1. (S)-трет-Бутил 2-((3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамидо)метил)пирролидин-1-карбоксилат
Во флакон емкостью 8 мл добавляли 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (140 мг; 0,416 ммоль; 1 экв.) и трет-бутил (2S)-2-(аминометил)пирролидин-1-карбоксилат (125,06 мг; 0,624 ммоль; 1,50 экв.) и DIEA (161,40 мг; 1,249 ммоль; 3,00 экв.), Т3Р (264,91 мг; 0,833 ммоль; 2,0 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре. Полученную смесь разбавляли водой (100 мл). Полученную смесь экстрагировали CH2Cl2 (4 × 100 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая трет-бутил (2S)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пирролидин-1-карбоксилат (170 мг; 78,75%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=519,4.
Стадия 2. (S)-3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(пирролидин-2-илметил)пиразин-2-карбоксамид (соединение 123)
В круглодонную колбу емкостью 50 мл добавляли трет-бутил (2S)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пирролидин-1-карбоксилат (170 мг; 0,328 ммоль; 1 экв.) и TFA (3 мл; 40,389 ммоль; 123,21 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Полученную смесь разбавляли DCM (100 мл). Реакцию гасили насыщенным раствором NaHCO3 при комнатной температуре и реакционную смесь экстрагировали CH2Cl2 (3 × 100 мл). Объединенные органические слои сушили над безводным Na2SO4 После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 17% В до 37% В за 7 мин; 254/220 нм; Rt: 5,73 мин), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[[(2S)-пирролидин-2-ил]метил]пиразин-2-карбоксамид (соединение 123) (60 мг, выход (Y) 43,74%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=419,2. 1H ЯМР (400 МГц, DMSO-d6) δ 1.38 (1Н, ddt), 1.51-1.81 (3Н, m), 2.43 (3Н, d), 2.71-2.84 (2Н, m), 3.22 (3Н, ddt), 7.20 (1Н, dd), 7.38 (2Н, dd), 7.49 (1Н, dd), 7.91 (2Н, s), 8.27 (1Н, d), 8.34 (1Н, dd), 8.74 (1Н, t).
Пример 128. Получение (R)-3-амино-6-(3-этилпиразоло[1,5-а]пиридин-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 128)
СХЕМА 79
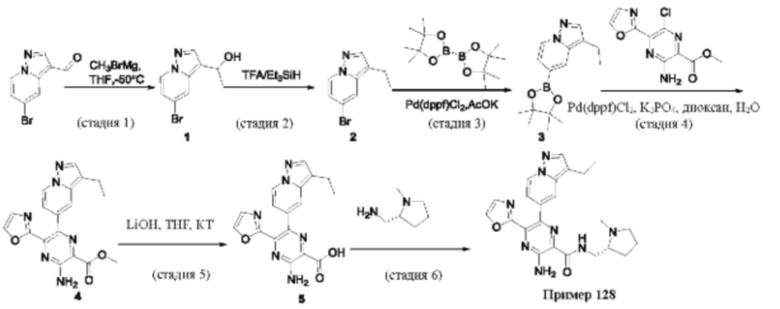
Стадия 1. 1-[5-Бромпиразоло[1,5-а]пиридин-3-ил]этан-1-ол
К перемешиваемому раствору 5-бромпиразоло[1,5-а]пиридин-3-карбальдегида (1 г; 4,444 ммоль; 1 экв.) добавляли CH3MgBr (2,12 г; 17,8 ммоль; 4,00 экв.) в THF (20 мл) при -50°С в атмосфере азота. Реакцию гасили путем добавления насыщ. раствора (водн.) NH4Cl (5 мл) при 0°С. Водный слой экстрагировали CH2Cl2 (3 × 30 мл). Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (5:1), получая 1-[5-бромпиразоло[1,5-а]пиридин-3-ил]этан-1-ол (600 мг; 56,01%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=241,2.
Стадия 2. 5-Бром-3-этилпиразоло[1,5-а]пиридин
К перемешиваемому раствору 1-[5-бромпиразоло[1,5-а]пиридин-3-ил]этан-1-ола (640 мг; 2,65 ммоль; 1 экв.) добавляли триэтилсилан (1852,03 мг; 15,93 ммоль; 6,0 экв.) в TFA (10 мл) при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 5:1), получая 5-бром-3-этилпиразоло[1,5-а]пиридин (490 мг; 82,0%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=225,1.
Стадия 3. 3-Этил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразоло[1,5-a]пиридин
К раствору 5-бром-3-этилпиразоло[1,5-а]пиридина (430 мг; 1,9 ммоль; 1 экв.) и 4,4,5,5 -тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (970,2 мг; 3,81 ммоль; 2,0 экв.) в диоксане (10 мл) добавляли K3PO4 (1216,5 мг; 5,73 ммоль; 3,0 экв.) и Pd(dppf)Cl2 (279,6 мг; 0,38 ммоль; 0,2 экв.). После перемешивания в течение 2 ч при 90°С в атмосфере азота полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 12:1), получая 3-этил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразоло[1,5-а]пиридин (420 мг; 80,78%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=273,2.
Стадия 4. Метил 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат
К раствору метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (400 мг; 1,571 ммоль; 1 экв.) и 3-этил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразоло[1,5-а]пиридина (641,31 мг; 2,356 ммоль; 1,50 экв.) в диоксане (10 мл) и воде (1 мл) добавляли K3PO4 (1000,35 мг; 4,713 ммоль; 3 экв.) и Pd(dppf)Cl2 (229,89 мг; 0,314 ммоль; 0,2 экв.). После перемешивания в течение 2 ч при 85°С в атмосфере азота остаток очищали препаративной TLC (CH2Cl2/МеОН, 15:1), получая метил 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (300 мг; 52,4%) в виде коричнево-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=365,3.
Стадия 5. 3-Амино-6-(3-этилпиразоло[1,5-а]пиридин-5-ил)-5-(оксазол-2-ил)пиразин-2-карбоновая кислота
Раствор метил 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (280 мг; 0,77 ммоль; 1 экв.) и LiOH (36,8 мг; 1,54 ммоль; 2,0 экв.) в THF (20 мл) перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Смесь/остаток подкисляли до рН 5, используя раствор HCl (водн.). Выпавшие в осадок твердые вещества собирали фильтрованием и концентрировали под вакуумом, получая 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (240 мг; 89,15%) в виде коричнево-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=351,3.
Стадия 6. 3-Амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил1-5-(1.3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 128)
Раствор 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (70 мг; 0,2 ммоль; 1 экв.), 1-[(2R)-1-метилпирролидин-2-ил]метанамина (34,22 мг; 0,3 ммоль; 1,5 экв.), HATU (151,95 мг; 0,4 ммоль; 2 экв.), DIEA (77,5 мг; 0,6 ммоль; 3 экв.) в DMF (2 мл) перемешивали в течение 30 мин при комнатной температуре в воздушной атмосфере. Реакционную смесь очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 40% В до 50% В за 8 мин; 254/220 нм; Rt: 7,25 мин), получая 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 128) (20,1 мг; 22,42%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=447,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.2 (3Н, t), 1.6 (3Н, dt), 1.8 (1Н, q), 2.2 (1Н, q), 2.3 (3Н, s), 2.4 (1Н, s), 2.7 (2Н, q), 2.9-3.0 (1Н, m), 3.2-3.3 (m, 1H), 3.4-3.5 (m, 1H), 6.8 (1Н, dd), 7.4 (1Н, d), 7.6 (1Н, dd), 7.9 (1Н, s), 7.9 (1Н, s), 8.3 (1Н, d), 8.6 (1H, dd), 8.6 (1H, t).
Пример 129. Получение (S)-3-амино-6-(3-этилпиразоло[1,5-а]пиридин-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 129)
СХЕМА 80
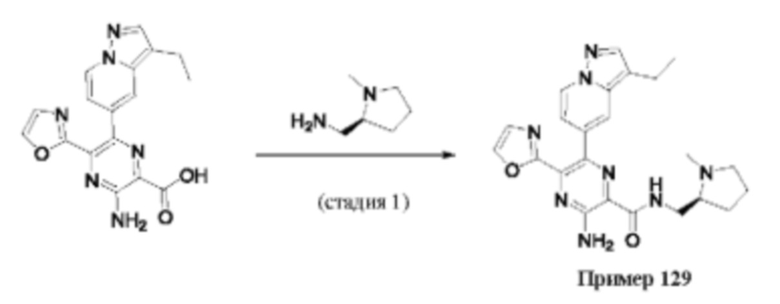
Стадия 1. 3-Амино-6-[3-этилпиразоло[1.5-а]пиридин-5-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-(1.3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 129)
Раствор 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (70 мг; 0,200 ммоль; 1 экв.), 1-[(2S)-1-метилпирролидин-2-ил]метанамина (34,22 мг; 0,300 ммоль; 1,5 экв.), HATU (151,95 мг; 0,400 ммоль; 2,00 экв.), DIEA (77,47 мг; 0,599 ммоль; 3 экв.) в DMF (2 мл) перемешивали в течение 30 мин при комнатной температуре в воздушной атмосфере. Неочищенный продукт (70 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 39% В до 51% В за 8 мин; 254/220 нм; Rt: 7,67 мин), получая 3-амино-6-[3-этилпиразоло[1,5-а]пиридин-5-ил]-N-[[(2S)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 129) (29,8 мг; 22,42%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=447,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.2 (3Н, t), 1.5-1.7 (3Н, m), 1.8-1.9 (1Н, m), 2.2 (1Н, q), 2.3 (3Н, s), 2.4 (1Н, s), 2.7 (2Н, q), 2.9-3.0 (1Н, m), 3.2-3.3 (1Н, m), 3.5 (1Н, ddd), 6.8 (1Н, dd), 7.4 (1Н, s), 7.5-7.6 (1Н, m), 7.9 (1Н, s), 7.9 (1Н, s), 8.3 (1Н, s), 8.6 (1Н, d), 8.6 (1Н, t).
Пример 130. Получение 3-амино-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-N-[[(2S)-1-метилпирролидин-2-ил]метил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида (соединения 232)
СХЕМА 81
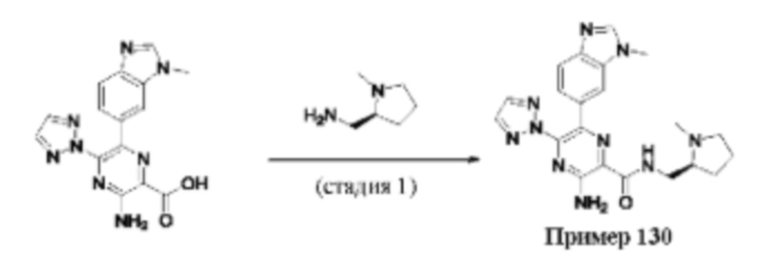
Стадия 1. 3-Амино-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-5-(1,3-оксазол-2-ил)-N-[(1,3-тиазол-4-ил)метил]пиразин-2-карбоксамид (соединение 130)
К перемешиваемому раствору 3-амино-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновой кислоты (300 мг; 0,892 ммоль; 1 экв.) и 1-[(2S)-1-метилпирролидин-2-ил]метанамина (101,86 мг; 0,892 ммоль; 1 экв.) в DMF по каплям/порциями добавляли Т3Р (851,47 мг; 2,676 ммоль; 3 экв.) и DIEA (576,44 мг; 4,460 ммоль; 5 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 4 ч при комнатной температуре в воздушной атмосфере. Полученную смесь экстрагировали EtOAc (3 × 20 мл). Объединенные органические слои промывали рассолом (3 × 10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт (300 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 18% В до 35% В за 7 мин; 254/220 нм; Rt: 7,08 мин), получая 3-амино-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-N-[[(2S)-1-метилпирролидин-2-ил]метил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 130) (20 мг; 5,18%) в виде желтого твердого вещества. LCMS m/z (ESI) [М+Н]+=433,2; 1Н ЯМР (400 МГц, MeOD-d4) δ 1.68-1.81 (2Н, m), 1.81 (1Н, s), 1.96-2.08 (1Н, m), 2.33 (1Н, q), 2.47 (3Н, d), 2.61 (1Н, s), 3.06-3.13 (1Н, m), 3.42-3.47 (1Н, m), 3.66-3.70 (1Н, m), 3.85 (3Н, s), 7.03-7.06 (1Н, m), 7.40 (1Н, s), 7.53 (1Н, d), 7.91 (2Н, s), 8.14 (1Н, s).
Пример 131. Получение (R)-3-амино-6-(1-метил-1H-бензо[d]имидазол-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида (соединения 233)
СХЕМА 82
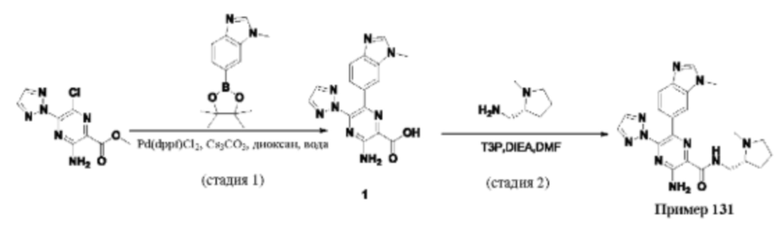
Стадия 1. 3-Амино-6-(1-метил-1H-бензо[d]имидазол-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота
Раствор метил 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (500 мг; 1,964 ммоль; 1 экв.), 1-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1Н-1,3-бензодиазола (608,25 мг; 2,356 ммоль; 1,20 экв.), Pd(dppf)Cl2 (287,36 мг; 0,393 ммоль; 0,2 экв.) и Cs2CO3 (2559,16 мг; 7,855 ммоль; 4,0 экв.) в диоксане (40 мл) и воде (5 мл) перемешивали в течение 16 ч при 100°С в атмосфере азота. Полученную смесь экстрагировали EtOAc (3×40 мл). Водный раствор подкисляли до рН 6, используя раствор HCl (1 М). Выпавшие в осадок твердые вещества собирали фильтрованием и промывали водой (2×10 мл). В результате получали 3-амино-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновую кислоту (240 мг; 36,34%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=337,1. 1Н-ЯМР (300 МГц, MeOD-d4) δ 3.93 (3Н, s), 7.33-7.35 (2Н, m), 7.43-7.46 (1Н, m), 7.82-7.84 (2Н, m), 8.12 (1Н, s).
Стадия 2. (R)-3-Амино-6-(1-метил-1H-бензо[d]имидазол-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 131)
Смесь 3-амино-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,297 ммоль; 1 экв.), 1-[(2R)-1-метилпирролидин-2-ил]метанамина (67,91 мг; 0,595 ммоль; 2,0 экв.), Т3Р (473,04 мг; 1,487 ммоль; 5 экв.) и DIEA (384,29 мг; 2,973 ммоль; 10 экв.) в DMF (5 мл) перемешивали в течение 2 ч при комнатной температуре. Полученную смесь экстрагировали EtOAc (3 × 20 мл). Объединенные органические слои промывали рассолом (20 мл), сушили над безводным Na2SO4 После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: Kinetex EVO CIS-колонка, 30*150, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 20% В до 35% В за 7 мин; 254/220 им; Rt: 5,73 мин), получая 3-амино-6-(1-метил-1H-1,3-бензодиазол-6-ил)-N-[[(2R)-l-метилпирролидин-2-ил]метил]-5-(2H-l,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 131) (20 мг; 15,55%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=433,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.67-1.69 (3Н, m), 1.86-1.89 (1Н, m), 2.15-2.17 (1Н, m), 2.33 (3Н, s), 2.45-2.47 (1Н, m), 2.96-2.97 (1Н, m), 3.31-3.34 (1Н, m), 3.74 (3Н, m), 6.84-6.87 (1Н, m), 7.25 (1Н, s), 7.48 (1Н, s), 8.01-8.03 (2Н, m), 8.07-8.09 (2Н, m), 8.20 (1Н, s), 8.66-8.68 (1Н, т).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 131.
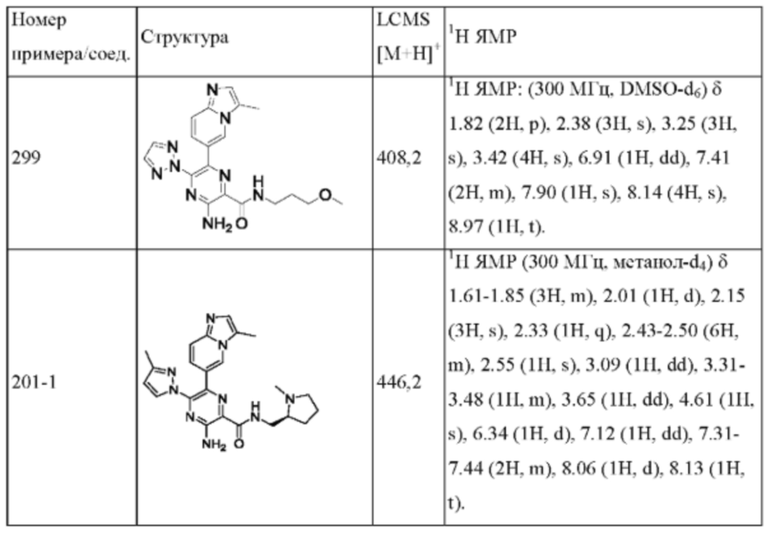
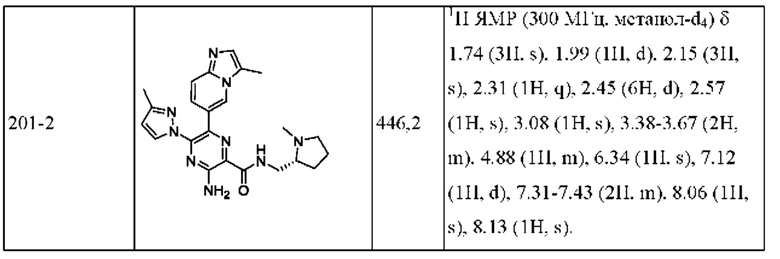
Примеры 134/135. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[[(2R/2S)-оксетан-2-ил]метил]пиразин-2-карбоксамида (соединений 134/135)
СХЕМА 83
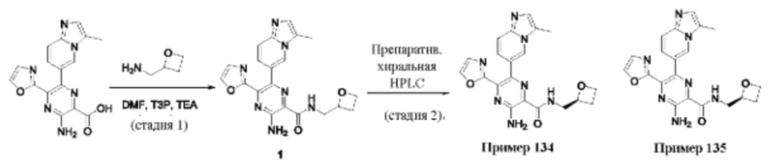
Стадия 1. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-([1,3-оксазол-2-ил)-N-[(оксетан-2-ил)метил]пиразин-2-карбоксамид
К перемешиваемой смеси Т3Р (946,09 мг; 2,973 ммоль; 5,00 экв.) и 1-(оксетан-2-ил)метанамина (77,72 мг; 0,892 ммоль; 1,50 экв.) в DMF (5 мл) по каплям добавляли 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (200 мг; 0,595 ммоль; 1 экв.) и DIEA (307,44 мг; 2,379 ммоль; 4,00 экв.) при 25°С в атмосфере азота. Полученную смесь перемешивали в течение 6 ч при 25°С в атмосфере азота. Реакцию гасили путем добавления воды (50 мл) при 25°С. Водный слой экстрагировали EtOAc (3x50 мл). Водный слой упаривали. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 19% В до 29% В за 7 мин; 254/220 нм; Rt: 6,45 мин), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(оксетан-2-ил)метил]пиразин-2-карбоксамид (90 мг; 37,33%) в виде желтого твердого вещества. LCMS: m/z (ESI), [M+H]+=406,2.
Стадия 2. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[[(2R/2S)-оксетан-2-ил]метил]пиразин-2-карбоксамида (соединений 134/135)
Неочищенный продукт (150 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: CHIRALPAK IE, 2*25 см, 5 мкм; подвижная фаза А: МТВЕ (с 10 мМ NH3-MEOH) для HPLC, подвижная фаза В: EtOH для HPLC; скорость потока: 20 мл/мин; градиент: от 20 В до 20 В за 18 мин; 220/254 нм; Rt1: 12,678; Rt2: 14,094), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[[(2R)-оксетан-2-ил]метил]пиразин-2-карбоксамид (изомер 1) (соединение 134) (60 мг; 40%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=406,1. 1H ЯМР (300 МГц, MeOD-d4) δ 2.50 (3Н, d), 2.52-2.61 (1Н, m), 2.72 (1Н, t), 3.60-3.79 (2Н, m), 4.56 (1Н, dt), 4.63-4.74 (1Н, m), 4.95-5.07 (1Н, m), 7.26 (1Н, dd), 7.32 (1Н, d), 7.38 (1Н, d), 7.48 (1Н, dd), 8.00 (1H, d), 8.37 (1H, d); и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[[(2R)-оксетан-2-ил]метил]-пиразин-2-карбоксамид (изомер 2) (соединение 135) (60 мг; 40%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=406,1. 1Н ЯМР (300 МГц, MeOD-d4) δ 2.50 (3Н, d), 2.55 (1Н, d), 2.71 (1Н, d), 3.64 (1Н, dd), 3.74 (2Н, dd), 4.56 (1Н, dt), 4.63-4.74 (1Н, m), 4.95-5.07 (1Н, m), 7.26 (1Н, dd), 7.32 (1Н, d), 7.38 (1Н, d), 7.48 (1Н, dd), 8.00 (1Н, d), 8.37 (1Н, s).
Пример 136. Получение (R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида (соединения 136)
СХЕМА 84
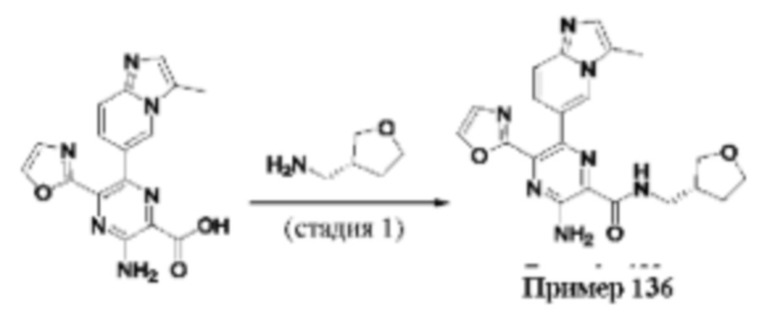
Стадия 1. (R)-3-Амино-6-(3-метилимидазо[2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамид (соединение 136)
В круглодонную колбу емкостью 25 мл помещали 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (100 мг; 0,297 ммоль; 1 экв.), DIEA (384,30 мг; 2,973 ммоль; 10 экв.) и (R)-(тетрагидрофуран-3-ил)метанамин (90,23 мг; 0,892 ммоль; 3 экв.) в DMF (4 мл). К указанному выше раствору добавляли Т3Р (378,44 мг; 1,189 ммоль; 4 экв.) при 0°С. Полученный раствор перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л) + 0,1% NH3⋅H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 17% В до 37% В за 7 мин; 254/220 нм; Rt: 5,85 мин). В результате получали 67 мг (53,72%) (R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида (соединения 136) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=420,2. 1H-ЯМР (400 МГц, MeOD-d4) δ 1.75 (1Н, dt), 2.02-2.15 (1Н, m), 2.53 (3Н, d), 2.65 (1Н, t), 3.45 (2Н, d), 3.65 (1Н, dd), 3.76 (1Н, q), 3.83 (1Н, dd), 3.92 (1Н, td), 7.28 (1Н, dd), 7.34 (1Н, d), 7.41 (1Н, s), 7.46-7.53 (1Н, m), 8.02 (1Н, d), 8.40 (1Н, s).
Пример 137. Получение (S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида (соединения 137)
СХЕМА 85
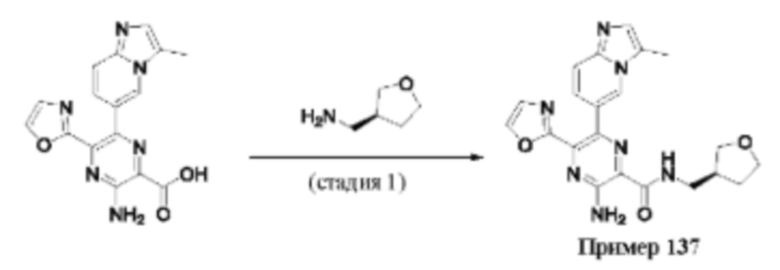
Стадия 1. (S)-3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамид (соединение 137)
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,297 ммоль; 1 экв.) и (S)-(тетрагидрофуран-3-ил)метанамина (130 мг; 1,285 ммоль; 4,32 экв.) в DMF по каплям добавляли DIEA (1,04 мл; 5,946 ммоль; 20 экв.) и Т3Р (473,05 мг; 1,487 ммоль; 5 экв.) при комнатной температуре в воздушной атмосфере. Реакционную смесь разбавляли водой (25 мл). Водный слой экстрагировали EtOAc (2 × 25 мл). Объединенный органический слой концентрировали при пониженном давлении. Остаток очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30 × 150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л) + 0,1% NH3.H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 15% В до 35% В за 7 мин; 254/220 нм; Rt: 6,48 мин), получая (S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамид (соединение 137) (70 мг; 56,00%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=420,3; 1H-ЯМР (400 МГц, MeOD-d4) δ 1.75 (1Н, dt), 2.02-2.15 (1Н, m), 2.53 (3Н, d), 2.65 (1Н, t), 3.45 (2Н, d), 3.65 (1Н, dd), 3.76 (1Н, q), 3.83 (1Н, dd), 3.92 (1Н, td), 7.28 (1Н, dd), 7.34 (1Н, d), 7.41 (1Н, s), 7.46-7.53 (1Н, m), 8.02 (1Н, d), 8.40 (1Н, s).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 137.
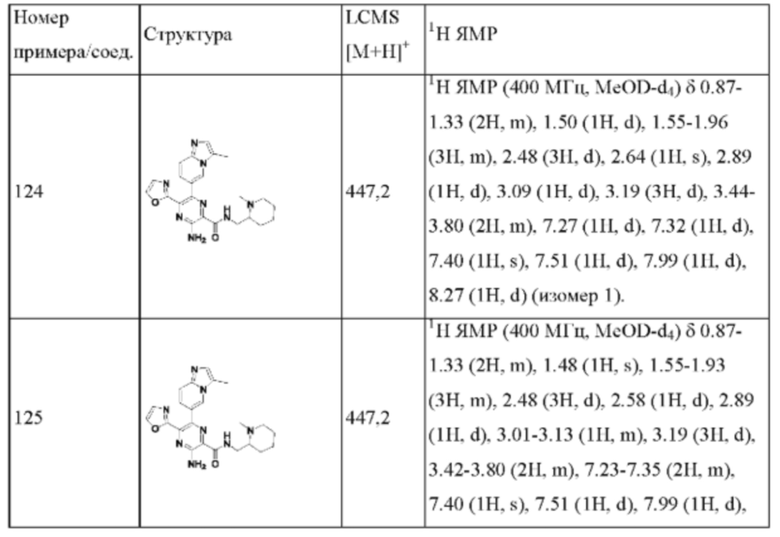
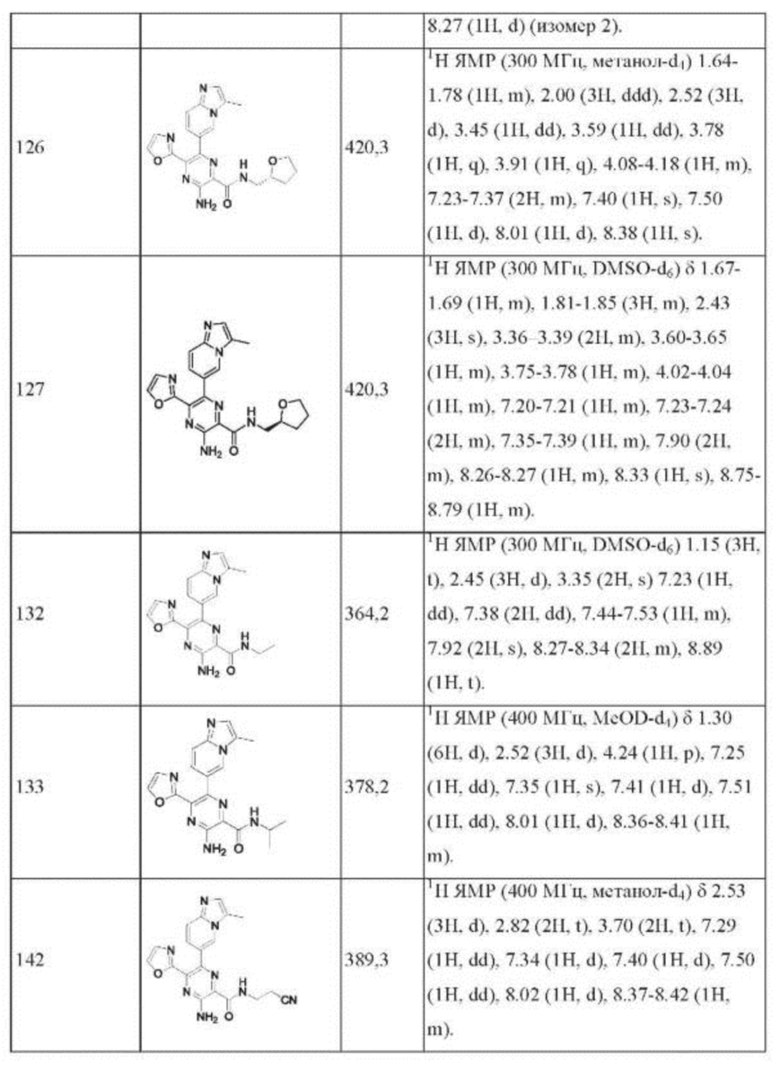

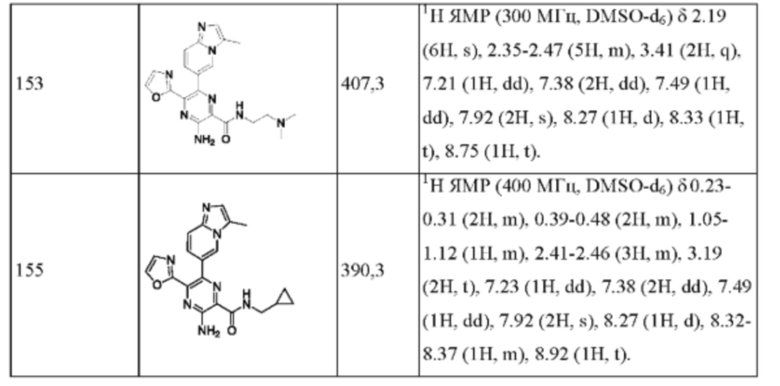
Пример 138. Получение 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]пиразин-2-карбоксамида (соединения 138)
СХЕМА 86
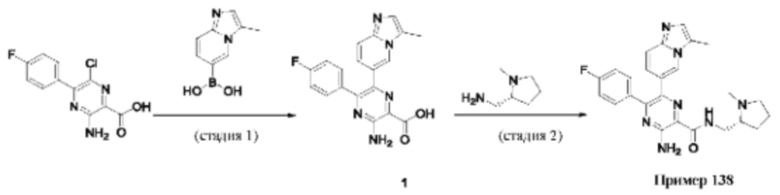
Стадия 1. 3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновая кислота
В круглодонную колбу емкостью 100 мл, дегазированную и поддерживаемую в инертной атмосфере азота, помещали 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоновую кислоту (1 г; 3,736 ммоль; 1 экв.), [3-метилимидазо[1,2-а]пиридин-6-ил]бороновую кислоту (1,12 г; 6,364 ммоль; 1,70 экв.), Cs2CO3 (3,04 г; 9,330 ммоль; 2,50 экв.), диоксан (25 мл), Pd(dppf)Cl2 (273,39 мг; 0,374 ммоль; 0,10 экв.). Полученный раствор перемешивали в течение 16 часов при 100°С. Полученный раствор разбавляли 20 мл Н2О. Полученный раствор экстрагировали этилацетатом (3 × 20 мл) и водные слои объединяли. Значение рН раствора подводили до 4, используя раствор HCl (1 моль/л). Твердые вещества собирали фильтрованием. В результате получали 500 мг (36,83%) 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновой кислоты в виде коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+=364. 1H ЯМР (400 МГц, DMSO-d6) δ 2.37 (3Н, s), 6.97 (1Н, d), 7.21 (2Н, t), 7.38 (2Н, t), 7.51 (2Н, d), 7.62 (2Н, s), 8.26 (1Н, s).
Стадия 2. 3-Амино-5-[4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]пиразин-2-карбоксамид (соединение 138)
Во флакон емкостью 20 мл помещали 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновую кислоту (130 мг; 0,358 ммоль; 1 экв.), 1-[(2R)-1-метилпирролидин-2-ил]метанамин (81,71 мг; 0,716 ммоль; 2,00 экв.), DMF (6 мл), DIEA (0,31 мл; 2,396 ммоль; 3,42 экв.), Т3Р (569,19 мг; 1,789 ммоль; 5,00 экв.). Полученный раствор перемешивали в течение 16 часов при 20°С.Полученную смесь концентрировали под вакуумом. Неочищенный продукт очищали препаративной HPLC (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 34% В до 49% В за 7 мин; 254/220 нм; Rt: 6,52 мин). В результате получали 54,29 мг (33,02%) 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]пиразин-2-карбоксамида (соединения 138) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=460. 1H-ЯМР (400 МГц, DMSO-d6) δ 1.61 (3Н, d), 1.73-1.95 (1Н, m), 2.12 (1Н, dd), 2.32 (3Н, s), 2.37 (3Н, d), 2.42 (1Н, s), 2.89-3.03 (1Н, m), 3.17-3.29 (1Н, m), 3.50 (1Н, d), 6.99 (1Н, d), 7.21 (2Н, t), 7.31-7.43 (2Н, m), 7.45-7.56 (2Н, m), 7.74 (2Н, s), 8.24 (1Н, d), 8.63 (1Н, t). 19F ЯМР (400 МГц, DMSO-d6) -112.225 (1F).
Пример 147. Получение 3-амино-N-(2-метоксиэтил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 147)
СХЕМА 87
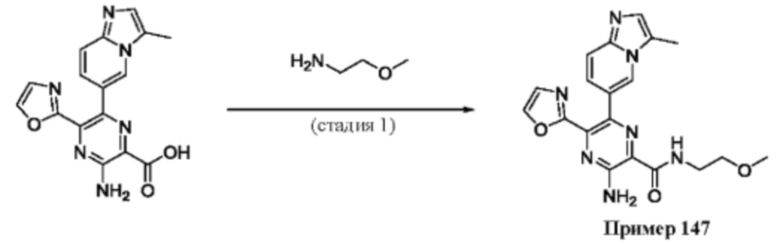
Стадия 1. 3-Амино-N-(2-метоксиэтил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 147)
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (90 мг; 0,268 ммоль; 1 экв.) и 2-метоксиэтан-1-амина (60,30 мг; 0,803 ммоль; 3 экв.) в DMF по каплям добавляли DIEA (164,08 мг; 1,270 ммоль; 5 экв.) и Т3Р (323,16 мг; 1,016 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученный раствор перемешивали в течение 1 ч при комнатной температуре. В реакционную смесь добавляли воду (25 мл). Полученную смесь экстрагировали EtOAc (3 × 25 мл). Объединенные органические слои промывали рассолом (1x15 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 18% В до 32% В за 7 мин; 254 нм; Rt: 6,83 мин), получая 3-амино-N-(2-метоксиэтил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 147) (50 мг; 49,78%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=394,2. 1H-ЯМР (400 МГц, MeOD-d4) δ 2.52 (3Н, d), 3.39 (3Н, s), 3.55-3.65 (4Н, m), 7.26-7.29 (1Н, m), 7.33 (1Н, d), 7.40 (1Н, d), 7.48-7.51 (1Н, m), 8.00 (1Н, d), 8.36-8.38 (1Н, m).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 147.
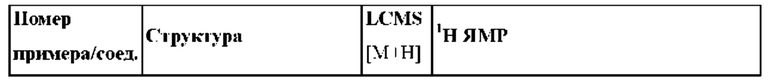
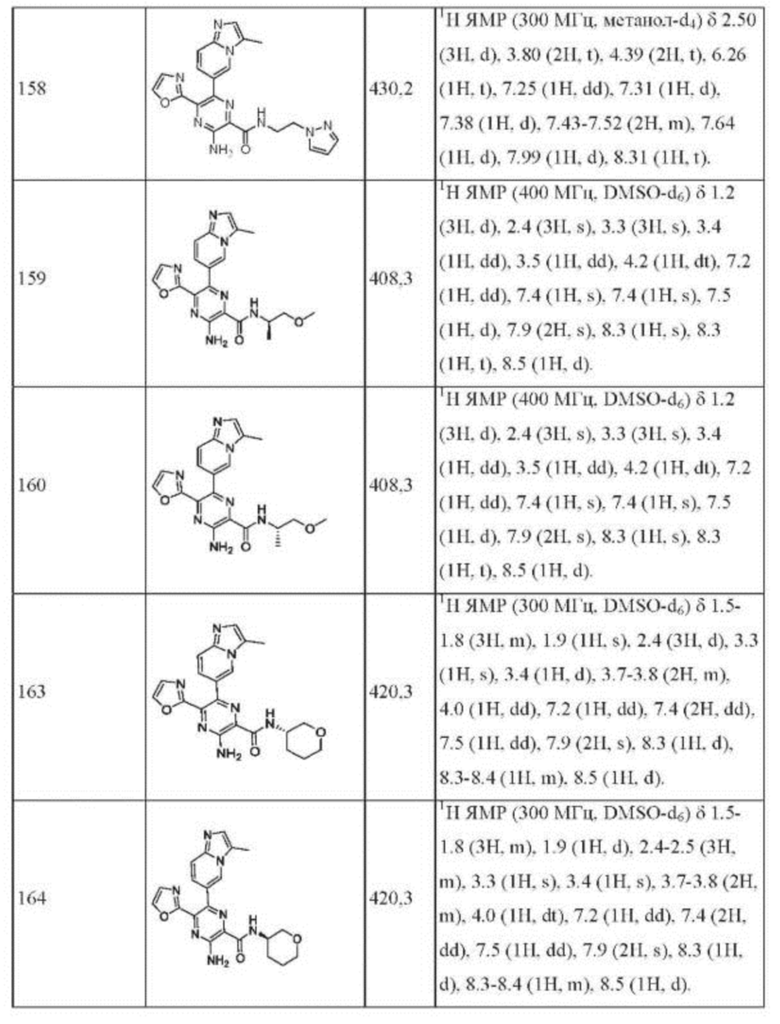
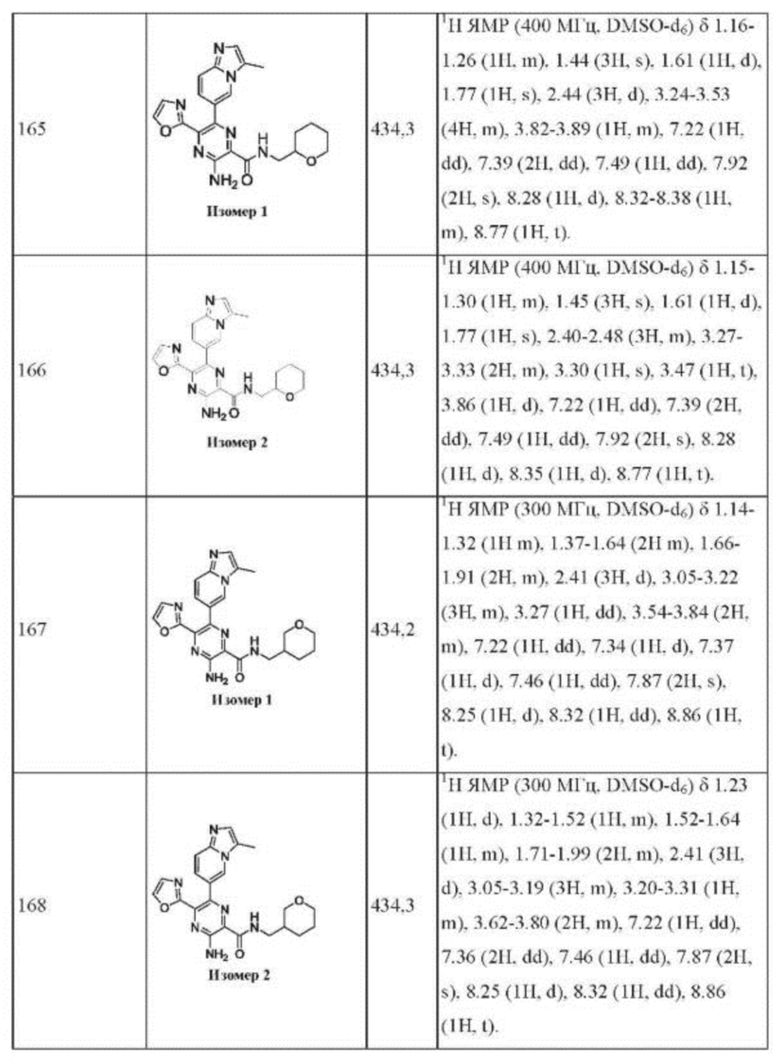
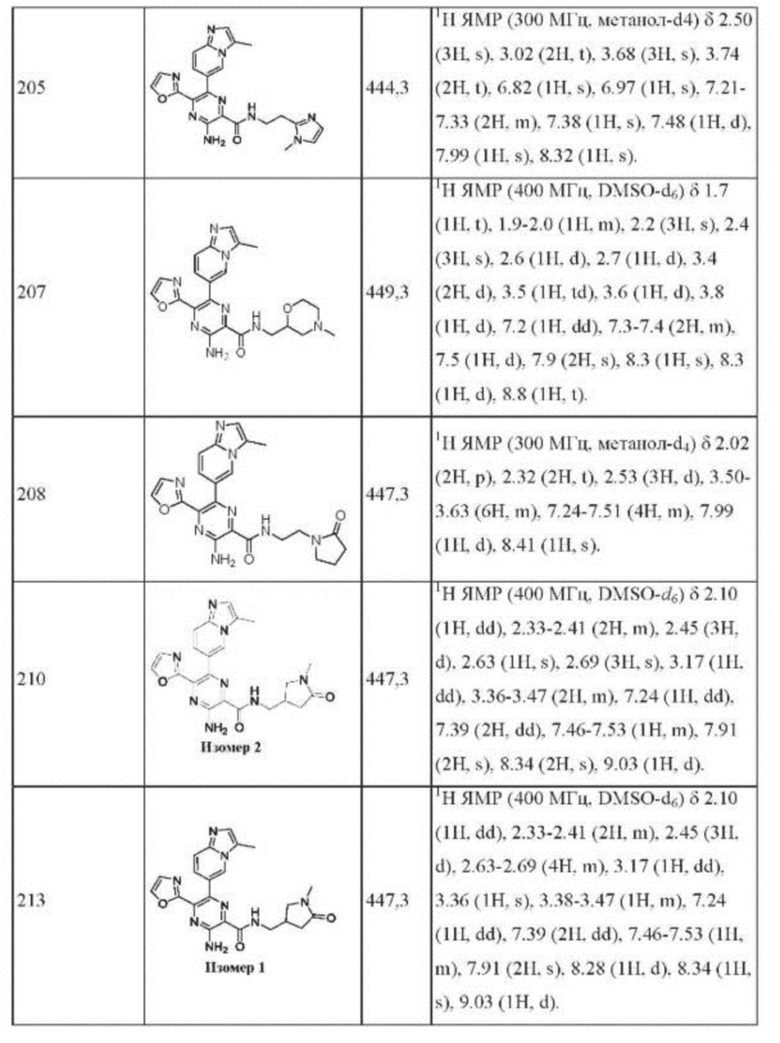

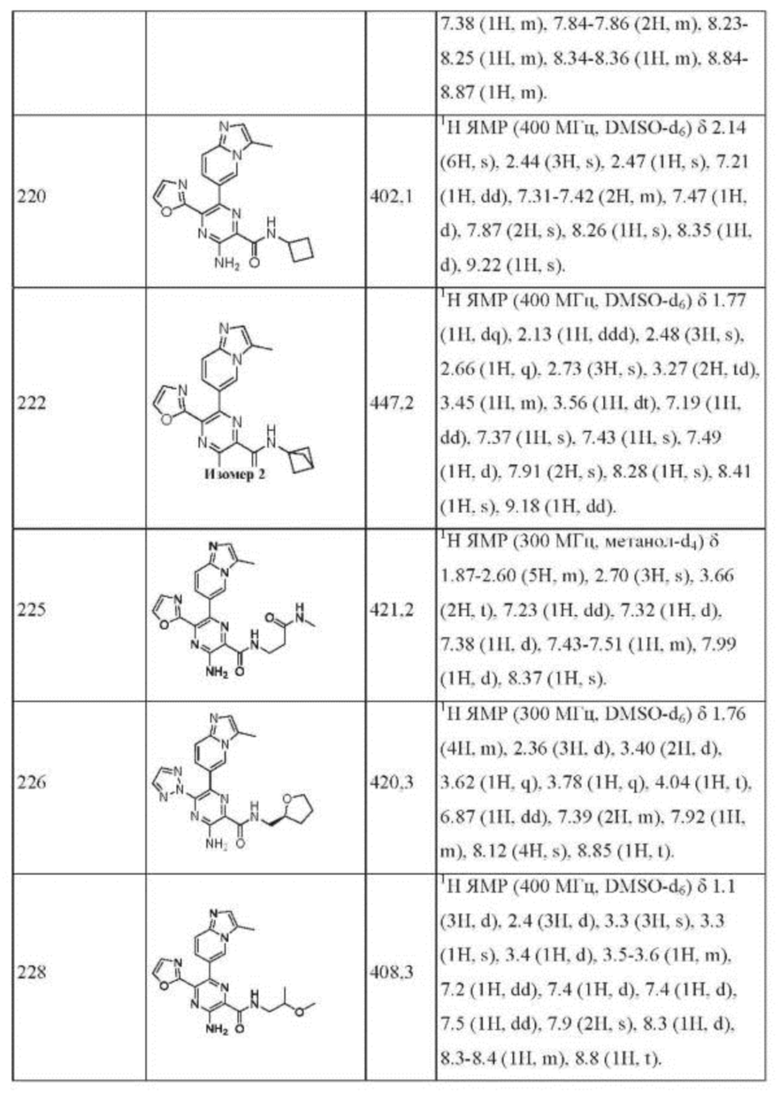
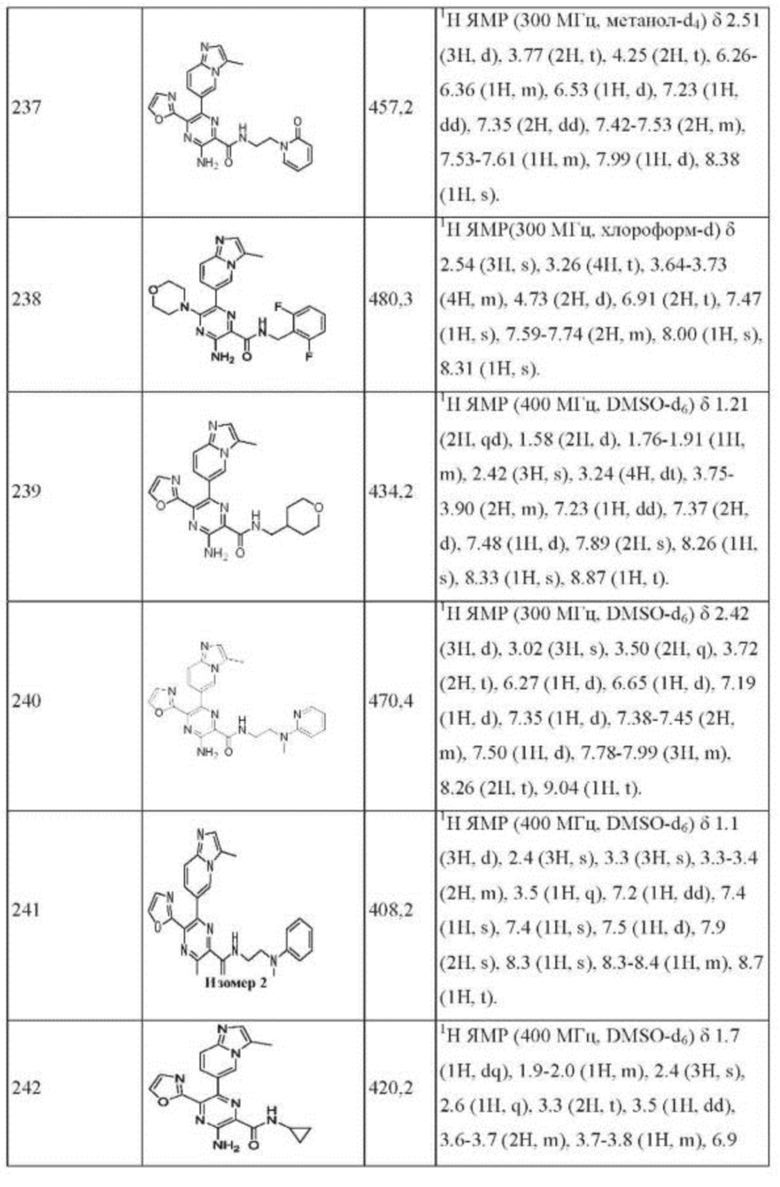
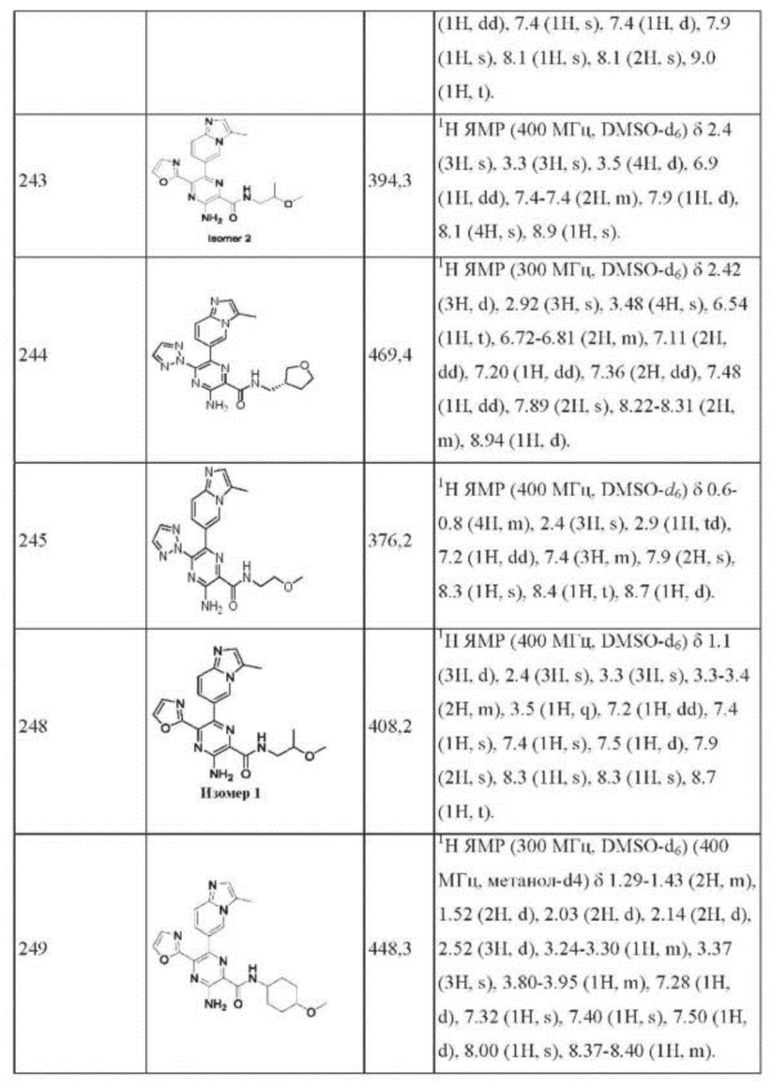
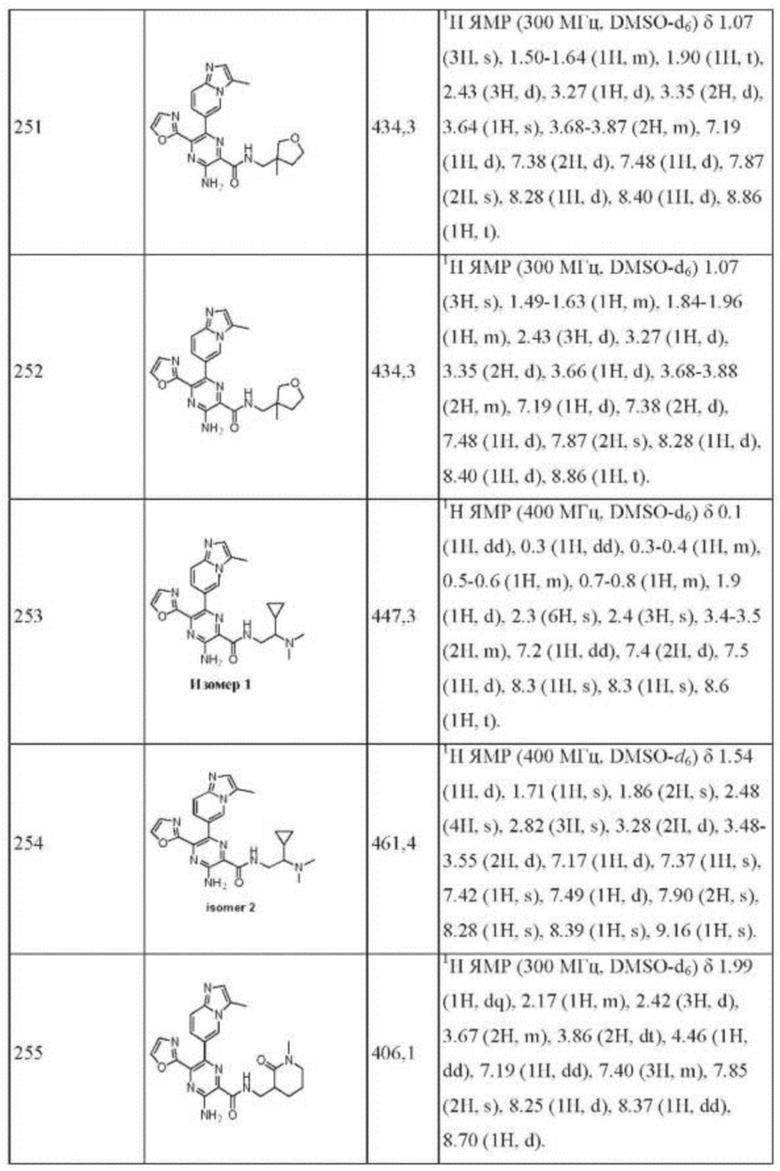
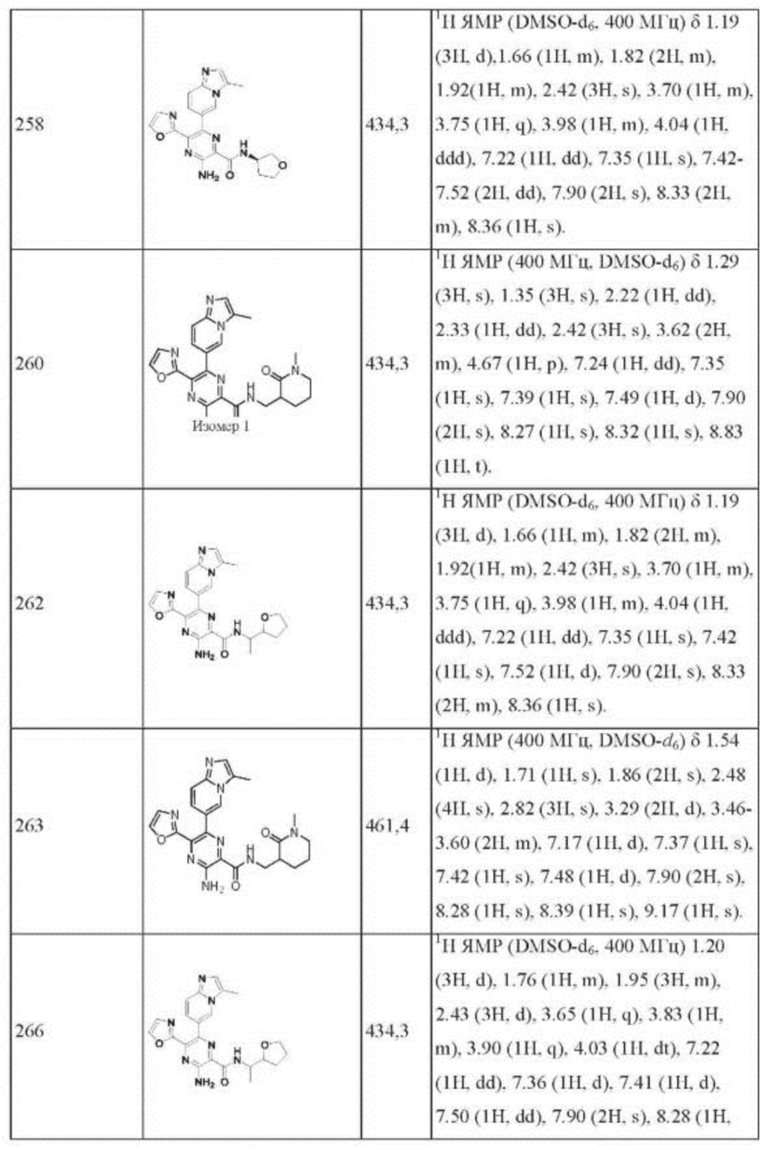
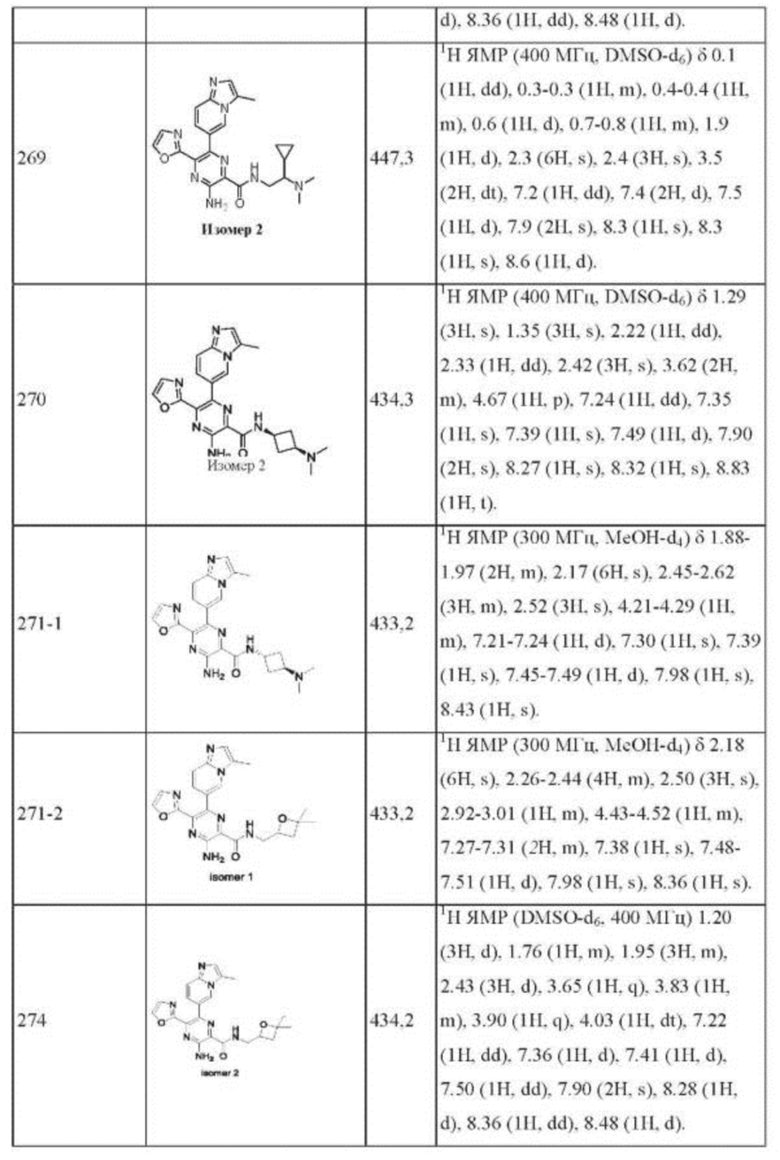
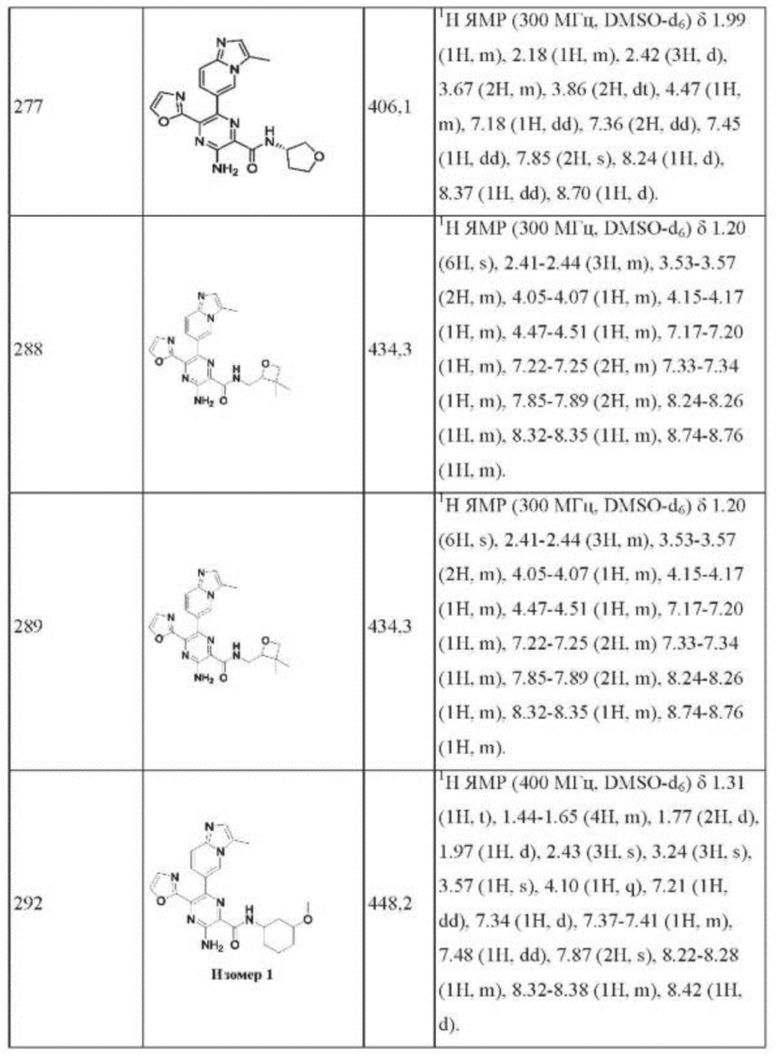
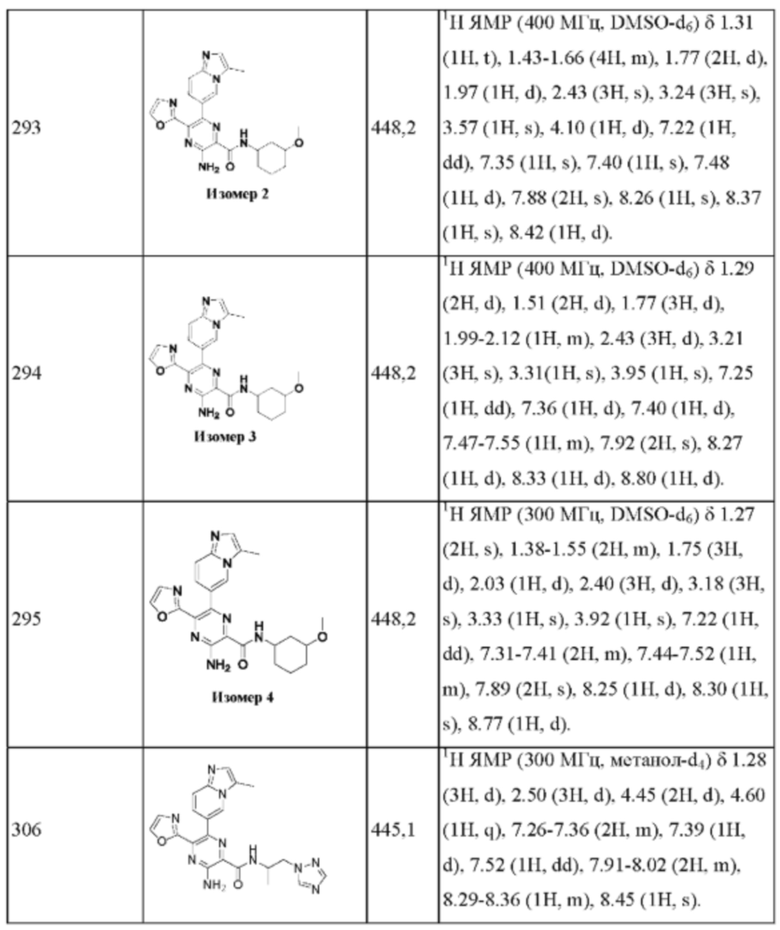
Пример 149. Получение 3-амино-N-(3-метоксипропил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 149)
СХЕМА 88
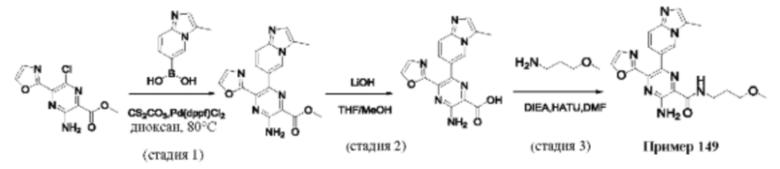
Стадия 1. Метил 3-амино-6-[3-метилимидазо[1,2-а]иридин-6-ил1-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (3000 мг; 11,8 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (4146,7 мг; 23,6 ммоль; 2 экв.) в диоксане (300 мл) порциями добавляли Cs2CO3 (11516,2 мг; 35,3 ммоль; 3 экв.) и Pd(dppf)Cl2 (1724,1 мг; 2,4 ммоль; 0,2 экв.) при 80°С в атмосфере азота. Полученную смесь перемешивали в течение 1,5 ч при 95°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с элюированием CH2Cl2/EtOAc (1:4), получая метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (1500 мг; 36,3%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=351,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.12 (3Н, s), 2.38 (3Н, d), 7.04 (1Н, dd), 7.36-7.38 (2Н, m), 7.46-7.55 (1Н, m), 7.71 (2Н, s), 8.27 (1Н, d), 8.80 (1Н, t).
Стадия 2. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновая кислота
Смесь метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилата (1500 мг; 4,3 ммоль; 1 экв.) и LiOH (205,1 мг; 8,6 ммоль; 2 экв.) в THF (100 мл) и МеОН (20 мл) перемешивали в течение 1,5 ч при 45°С.Полученную смесь перемешивали в течение 2,5 ч при 45°С в воздушной атмосфере. Смесь подкисляли до рН 5, используя раствор HCl (водн.). Полученную смесь концентрировали под вакуумом, получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (1200 мг; 83,3%) в виде желтого твердого вещества. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=337,3.
Стадия 3. 3-Амино-N-(3-метоксипропил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 149)
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,3 ммоль; 1 экв.) и 3-метоксипропан-1-амина (53 мг; 0,6 ммоль; 2 экв.) в DMF (8 мл) порциями добавляли HATU (226,1 мг; 0,6 ммоль; 2 экв.) и DIEA (115,3 мг; 0,9 ммоль; 3 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 2,5 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (80 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 21% В до 34% В за 7 мин; 254/220 нм; Rt: 6,67 мин), получая 3-амино-N-(3-метоксипропил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 149) (10 мг; 8,3%) в виде желто-зеленого твердого вещества. LCMS: m/z (ESI), [М+Н]+=408,3. 1H ЯМР (400 МГц, DMSO-d6) δ 1.78 (2Н, р), 2.43 (3Н, s), 3.22 (3Н, s), 3.39 (4Н, q), 7.23 (1Н, dd), 7.38 (2Н, d), 7.48 (1Н, d), 7.91 (2Н, s), 8.23-8.35 (2Н, m), 8.89 (1Н, t).
Пример 154. Получение 3-амино-N-[[1-(диметиламино)циклопропил]метил]-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамида (соединения 154)
СХЕМА 89
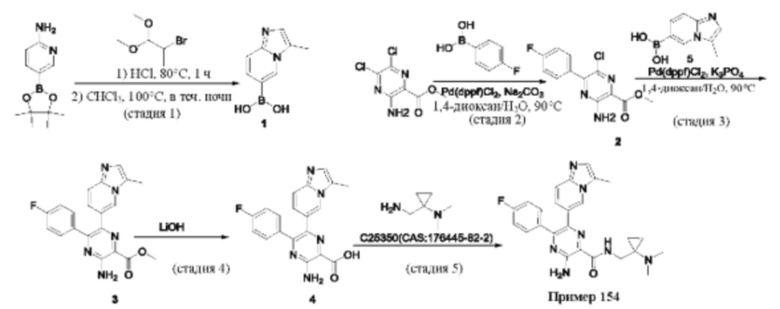
Стадия 1. [3-Метилимидазо[1,2-а]пиридин-6-ил]бороновая кислота
5-(3,3,4,4-Тетраметилборолан-1-ил)пиридин-2-амин (20,0 г; 92,5 ммоль; 1,0 экв.) добавляли в раствор HCl (1,0 моль/л), перемешивали в течение 1 ч при 80°С в воздушной атмосфере. Смесь подщелачивали до рН 7, используя NaHCO3 (тв.). Полученную смесь экстрагировали CHCl3 (5 × 40 мл) и сушили над безводным N2SO4. После фильтрования в указанную выше смесь добавляли 2-бром-1,1-диметоксипропан (49,9 г; 272,9 ммоль; 2,9 экв.). Полученную смесь перемешивали в течение 10 ч при 100°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт перекристаллизовывали из EtOAc/МеОН (20:1, 50 мл), получая [3-метилимидазо[1,2-а]пиридин-6-ил]бороновую кислоту (14,6 г; 87,8%) в виде белого твердого вещества. LCMS: m/z (ESI), [M+H]+=177,2.
Стадия 2. Метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилат
Смесь метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (20 г; 90,1 ммоль; 1,0 экв.), (4-фторфенил)бороновой кислоты (13,9 г; 99,1 ммоль; 1,1 экв.), Pd(dppf)Cl2 (6,6 г; 9,0 ммоль; 0,1 экв.) и Na2CO3 (19,1 г; 180,2 ммоль; 2,0 экв.) в смеси 1,4-диоксан/H2O (300 мл) перемешивали в течение 2 ч при 90°С в атмосфере азота. Полученную смесь экстрагировали EtOAc (3 × 200 мл). Объединенные органические слои промывали Н2О (3 × 80 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт перекристаллизовывали из МеОН (100 мл), получая метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилат (19,2 г; 74,2%) в виде желтого твердого вещества. LCMS: m/z (ESI), [M+H]+=282,2.
Стадия 3. Метил 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил!пиразин-2-карбоксилат
Смесь метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилата (9,2 г; 32,6 ммоль; 1,0 экв.), [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (11,5 г; 65,3 ммоль; 2,0 экв.), Pd(dppf)Cl2 (2,4 г; 3,3 ммоль; 0,1 экв.) и K3PO4 (13,9 г; 65,3 ммоль; 2,0 экв.) в смеси 1,4-диоксан/H2O (200 мл) перемешивали в течение 2 ч при 90°С в атмосфере азота. Полученную смесь экстрагировали EtOAc (4 × 80 мл). Объединенные органические слои промывали H2O (3 × 30 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/EtOAc (2:1), получая метил 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксилат (9,5 г; 76,1%) в виде коричневато-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=378,3.
Стадия 4. 3-Амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксилата (3,0 г; 7,9 ммоль; 1,0 экв.) в смеси 20:1 THF/H2O (82 мл) добавляли гидроксид лития (380,8 мг; 15,9 ммоль; 2,0 экв.). Полученную смесь перемешивали в течение 4,0 ч при комнатной температуре в воздушной атмосфере. Требуемый продукт можно было обнаружить посредством LCMS. Смесь подкисляли до рН 3, используя раствор HCl (в диоксане). Выпавшие в осадок твердые вещества собирали фильтрованием и промывали водой (2 × 10 мл), получая 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновую кислоту (2,1 г; 72,7%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=364,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.35-2.42 (3Н, m), 6.97 (1Н, dd), 7.14-7.28 (2Н, m), 7.34-7.43 (2Н, m), 7.45-7.57 (2Н, m), 7.65 (2Н, s), 8.28 (1Н, t).
Стадия 5. 3-Амино-N-[[1-(диметиламино)циклопропил]метил]-5-(4-фторфенил)-6-[3-метилимидазо[1.2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 154)
Смесь 3-амино-5-(4-фторфенил)-6-[имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновой кислоты (100,0 мг; 0,3 ммоль; 1,0 экв.), 1-(аминометил)-N,N-диметилциклопропан-1-амина (49,0 мг; 0,4 ммоль; 1,5 экв.), HATU (217,6 мг; 0,6 ммоль; 2,0 экв.) и DIEA (111,0 мг; 0,9 ммоль; 3,0 экв.) в DMF (2,5 мл) перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Реакцию гасили водой при комнатной температуре. Твердые вещества отделяли, затем неочищенный продукт перекристаллизовывали из EtOH (4 мл), получая 3-амино-N-[[1-(диметиламино)циклопропил]метил]-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 154) (25 мг; 18,6%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=460,3. 1H ЯМР (400 МГц, DMSO-d6) δ 0.43-0.52 (2Н, m), 0.61-0.70 (2Н, m), 2.39 (9Н, d), 3.49 (2Н, d), 6.97 (1Н, dd), 7.21 (2Н, t), 7.33-7.44 (2Н, m), 7.46-7.54 (2Н, m), 7.72 (2Н, s), 8.32 (1Н, s), 8.67 (1Н, t).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 154.
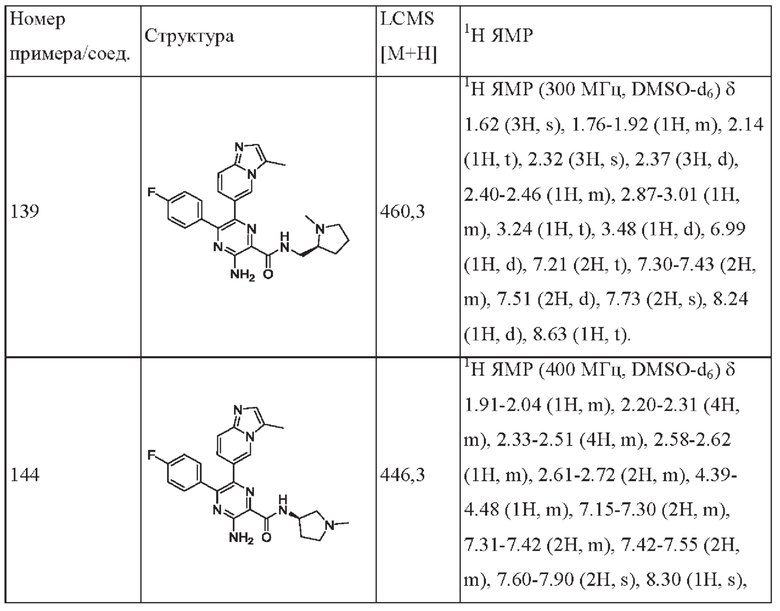
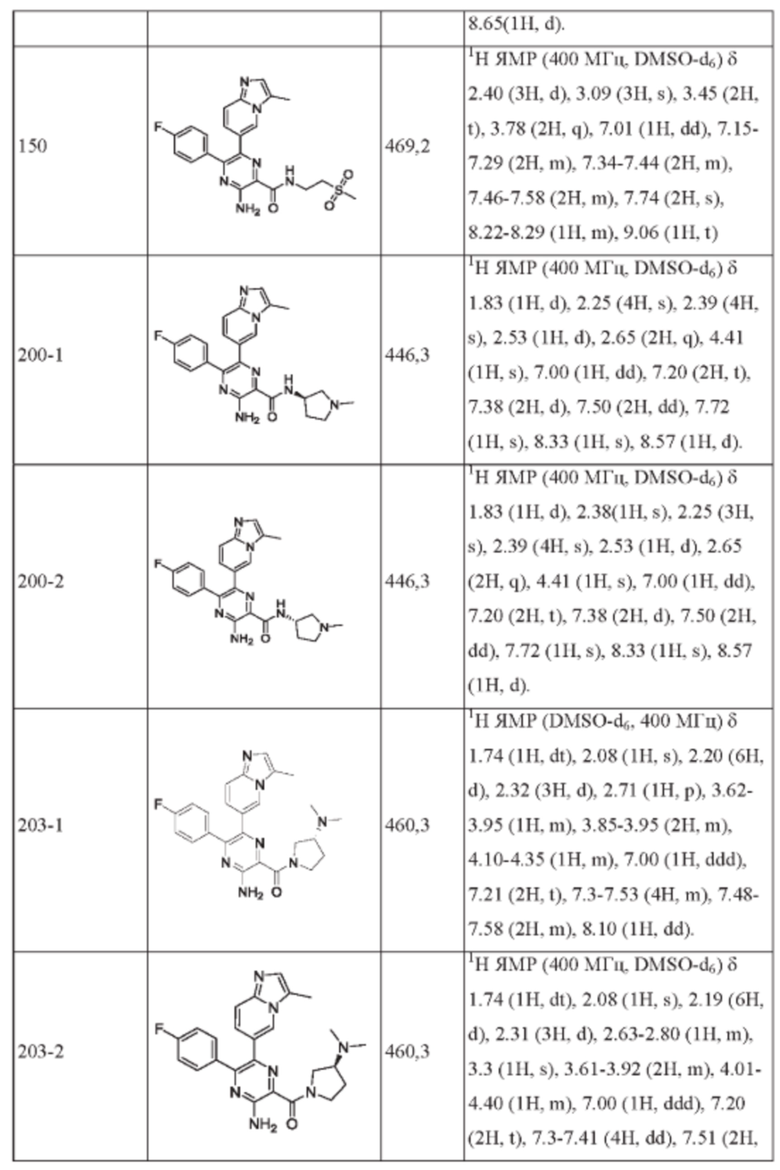
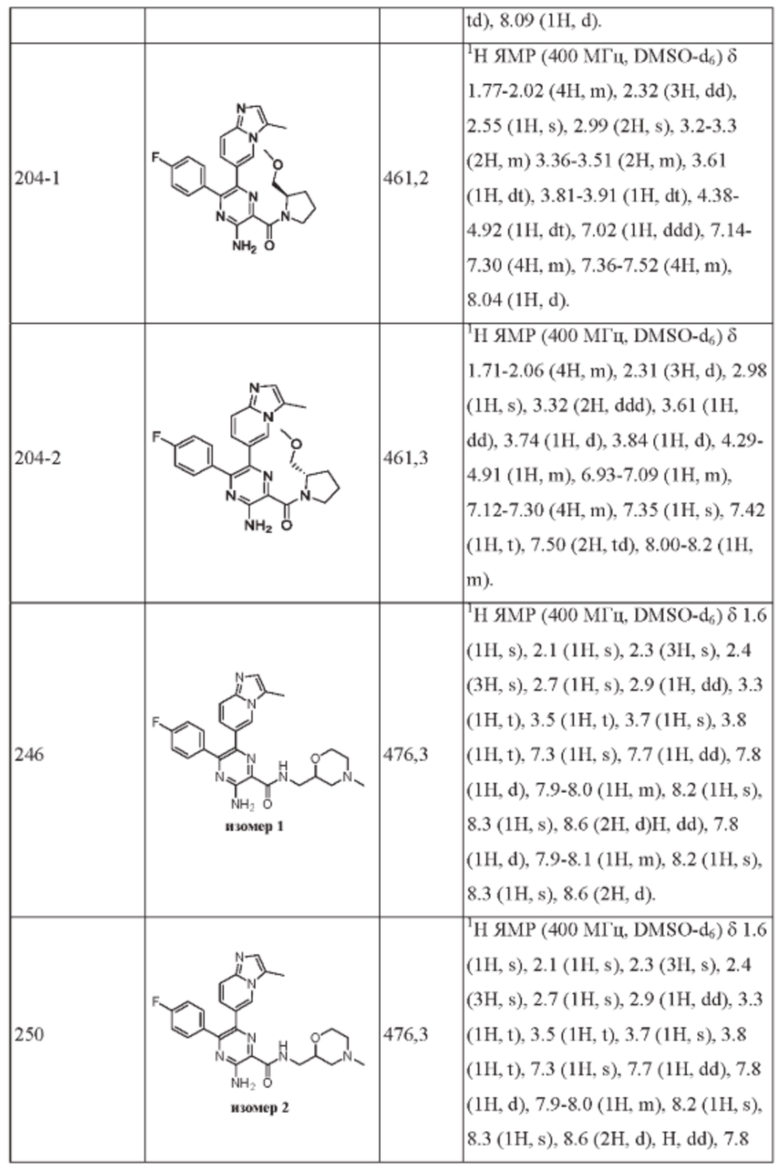
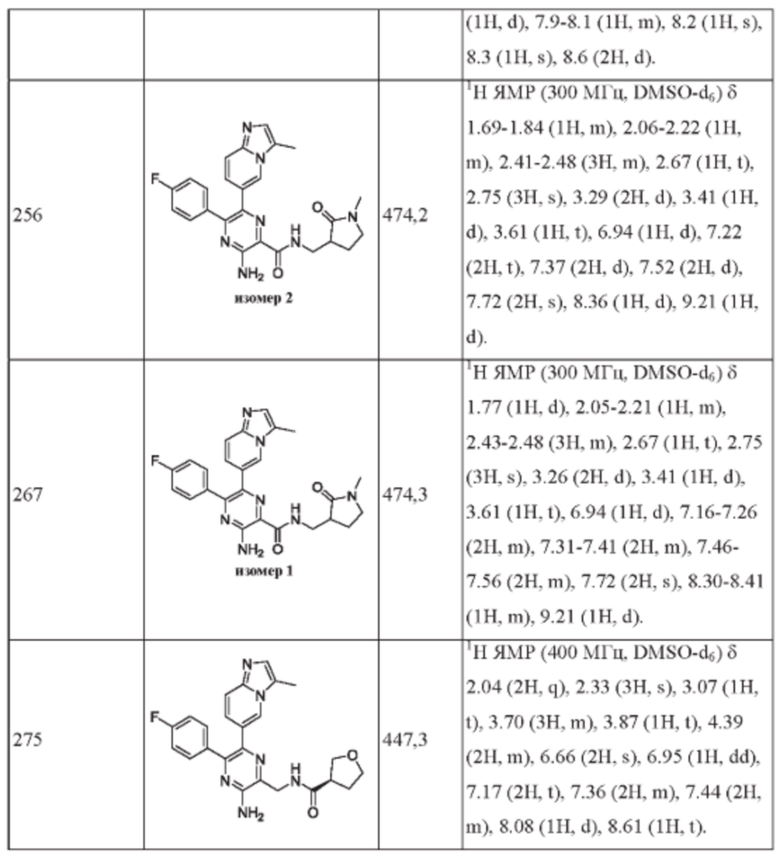
Пример 156. Получение (2S)-N-[[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамида (соединения 156)
СХЕМА 90
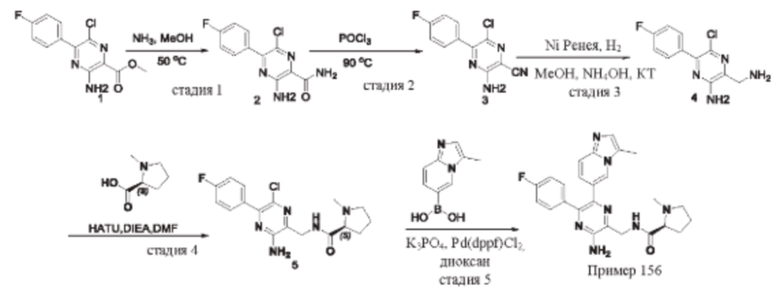
Стадия 1. 3-Амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксамид
В герметично закрываемую пробирку емкостью 50 мл добавляли метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилат (2,0 г; 7,10 ммоль; 1 экв.) и раствор NH3 (газ.) в МеОН (30 мл; 7,0 ммоль/л) при комнатной температуре, нагревали в течение 5 ч при 50°С, концентрировали, получая 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксамид (1,5 г; 79%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=267,1.
Стадия 2. 3-Амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрил
В круглодонную колбу емкостью 25 мл добавляли 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксамид (1,5 г; 5,63 ммоль; 1 экв.) и POCl3 (10 мл; 107,28 ммоль; 19,07 экв.) при комнатной температуре, нагревали в течение 3 ч при 90°С. Охлаждали до комнатной температуры, выливали в раствор NaHCO3 (водн., 200 мл), фильтровали и сушили, получая 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрил (1,2 г; 86%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=249,2.
Стадия 3. 3-(Аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амин
В круглодонную колбу емкостью 500 мл добавляли 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрил (1,4 г; 5,63 ммоль; 1 экв.) и Ni Ренея (0,3 г; 3,50 ммоль; 0,62 экв.) в метаноле (150 мл) при комнатной температуре, перемешивали в течение 15 ч в атмосфере Н2 (примерно 1,5 ат (147 кПа)), фильтровали и концентрировали, получая 3-(аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амин (1,1 г; неочищенный) в виде светло-коричневого твердого вещества. LCMS: m/z (ESI), [М-NH2]+=236,2.
Стадия 4. (2S)-N-[[3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид
К перемешиваемой смеси (2S)-1-метилпирролидин-2-карбоновой кислоты (168,68 мг; 1,31 ммоль; 1,10 экв.), 3-(аминометил)-5-хлор-6-(4-фторфенил)пиразин-2-амина (300 мг; 1,19 ммоль; 1 экв.) и HATU (496,58 мг; 1,31 ммоль; 1,1 экв.) в DMF(3,0 мл) по каплям добавляли DIEA (306,89 мг; 2,38 ммоль; 2,0 экв.) при 0°С в атмосфере азота, перемешивали в течение 3 ч при комнатной температуре, добавляли воду (15 мл), фильтровали и сушили, получая (2S)-N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (250 мг; 57,88%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=364,2.
Стадия 5. (2S)-N-[[3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (соединение 156)
Смесь (2S)-N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамида (180,0 мг; 0,5 ммоль; 1,0 экв.), [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (174,1 мг; 0,9 ммоль; 2,0 экв.), Pd(dppf)Cl2 (36,2 мг; 0,1 ммоль; 0,1 экв.) и K3PO4 (315,1 мг; 1,5 ммоль; 3,0 экв.) в смеси 1,4-диоксан/H2O (4,0 мл) перемешивали в течение 10 ч при 90°С в атмосфере азота. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 40:1), затем неочищенный продукт (80,0 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 30% В до 43% В за 7 мин; 254/220 нм; Rt: 6,70 мин), получая (2S)-N-[[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (соединение 157) (20,0 мг; 8,6%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=460,3. 1H ЯМР (400 МГц, DMSO-d6) δ 1.73 (3Н, td), 2.10 (1H, dd), 2.19-2.38 (7Н, m), 2.80 (1H, dd), 3.04 (1Н, dd), 4.30-4.49 (2Н, m), 6.68 (2Н, s), 6.99 (1H, dd), 7.17 (2Н, t), 7.34 (1H, s), 7.37-7.49 (3Н, m), 8.01 (1H, s), 8.44 (1H, t).
Пример 157. Получение (2R)-N-[[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамида (соединения 157)
СХЕМА 91
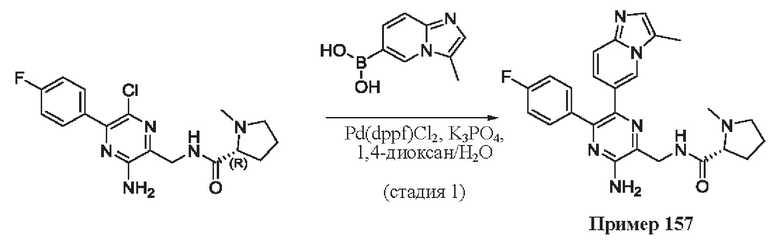
Стадия 1. (2R)-N-[[3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (соединение 157)
Смесь (2R)-N-[[3-амино-6-хлор-5-(4-фторфенил)пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамида (180,0 мг; 0,5 ммоль; 1,0 экв.), [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (174,1 мг; 0,9 ммоль; 2,0 экв.), Pd(dppf)Cl2 (36,2 мг; 0,1 ммоль; 0,2 экв.) и K3PO4 (315,1 мг; 1,5 ммоль; 3,0 экв.) в смеси 1,4-диоксан/H2O (4,0 мл) перемешивали в течение 10 ч при 90°С в атмосфере азота. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 40:1), затем неочищенный продукт (80,0 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 30% В до 43% В за 7 мин; 254/220 нм; Rt: 6,70 мин), получая (2R)-N-[[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (соединение 157) (20,0 мг; 8,6%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=460,3. 1H ЯМР (400 МГц, DMSO-d6) δ 1.73 (3Н, td), 2.10 (1H, dd), 2.19-2.38 (7Н, m), 2.80 (1H, dd), 3.04 (1H, dd), 4.30-4.49 (2Н, m), 6.68 (2Н, s), 6.99 (1Н, dd), 7.17 (2Н, t), 7.34-7.49 (4Н, m), 8.01 (1Н, s), 8.44 (1Н, t).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 157.

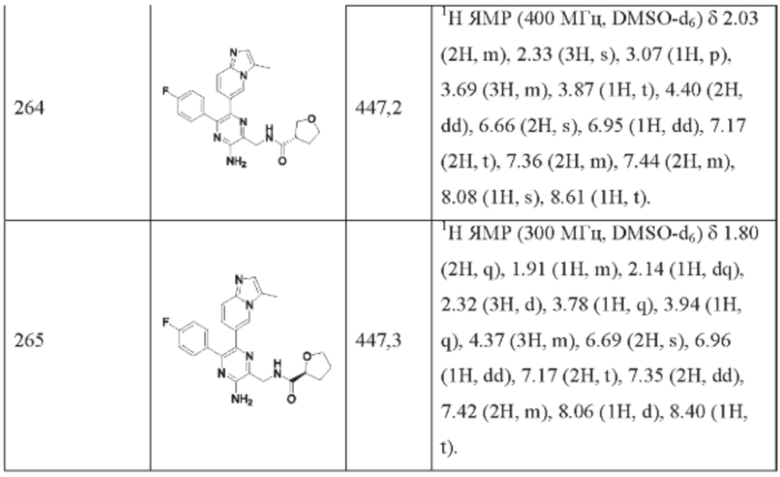
Пример 161. Получение (S)-3-амино-N-((4,4-дифтор-1-метилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 161)
СХЕМА 92
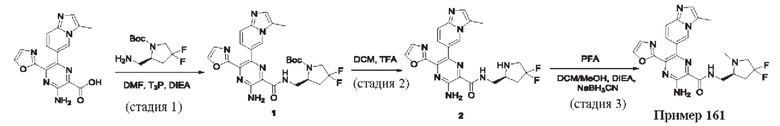
Стадия 1. (S)-трет-Бутил 2-((3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамидо)метил)-4.4-дифторпирролидин-1-карбоксилат
К перемешиваемому раствору 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (150 мг; 0,446 ммоль; 1 экв.) и трет-бутил (28)-2-(аминометил)-4,4-дифторпирролидин-1-карбоксилата (210,75 мг; 0,892 ммоль; 2,00 экв.), DIEA (172,93 мг; 1,338 ммоль; 3,00 экв.) в DMF по каплям добавляли Т3Р (283,83 мг; 0,892 ммоль; 2,00 экв.) при 0°С в воздушной атмосфере. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь разбавляли EtOAc (40 мл). Полученную смесь промывали водой (2×40 мл). Органический слой сушили над безводным Na2SO4 и твердое вещество отфильтровывали, концентрировали под вакуумом. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 200:15), получая трет-бутил (2S)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-4,4-дифторпирролидин-1-карбоксилат (220 мг; 88,95%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=555,2.
Стадия 2. (S)-3-Амино-N-((4,4-дифторпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а1пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
В круглодонную колбу емкостью 50 мл добавляли трет-бутил (2S)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-4,4-дифторпирролидин-1-карбоксилат (220 мг; 0,397 ммоль; 1 экв.) и TFA (2 мл; 26,926 ммоль; 67,87 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Растворитель и TFA выпаривали, получая 3-амино-N-[(4,4-дифторпирролидин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (180 мг; 99,84%) в виде желтого твердого вещества (неочищенного). LCMS: m/z (ESI), [М+Н]+=455,2.
Стадия 3. (S)-3-Амино-N-((4,4-дифтор-1-метилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 161)
К перемешиваемой смеси 3-амино-N-[[(2S)-4,4-дифторпирролидин-2-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (180 мг; 0,396 ммоль; 1 экв.) и НСНО (118,93 мг; 3,961 ммоль; 10,00 экв.), DIEA (510,9 мг; 3,961 ммоль; 10,00 экв.) в CH2Cl2 (6 мл) и МеОН (3 мл) порциями добавляли NaBH3CN (149,35 мг; 2,377 ммоль; 6,00 экв.) при комнатной температуре в воздушной атмосфере. Реакционную смесь перемешивали при КТ в течение 2 часов. Гасили водой (50 мл) и экстрагировали DCM (2×50 мл), органический слой объединяли и сушили над безводным Na2SO4, твердое вещество отфильтровывали и растворитель выпаривали. Остаток очищали препаративной TLC (DCM:MeOH, 20:1), получая желтое твердое вещество. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: колонка Kinetex EVO С18, 30*150, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 27% В до 40% В за 7 мин; 254/220 нм; Rt: 6,05 мин), получая 3-амино-N-[[(2S)-4,4-дифтор-1-метилпирролидин-2-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 161) (60 мг; 32,34%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=469,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.19 (1H, dt), 2.33 (3Н, s), 2.43 (4Н, s), 2.61 (1H, ddd), 2.78 (1H, s), 3.38 (1H, d), 3.53 (1H, s), 7.20 (1H, dd), 7.38 (2Н, d), 7.49 (1Н d), 7.89 (2Н, s), 8.29 (2Н, d), 8.77 (1H, t).
Пример 162. Получение (R)-3-амино-N-((4,4-дифтор-1-метилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 162)
СХЕМА 93
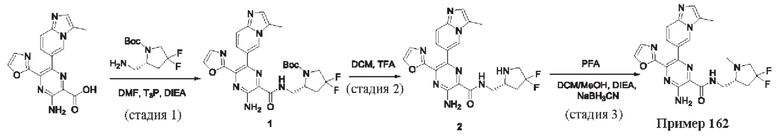
Стадия 1. (R)-трет-Бутил 2-((3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамидо)метил)-4,4-дифторпирролидин-1-карбоксилат
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (150 мг; 0,446 ммоль; 1 экв.) и трет-бутил (2R)-2-(аминометил)-4,4-дифторпирролидин-1-карбоксилата (210,75 мг; 0,892 ммоль; 2,00 экв.), DIEA (172,93 мг; 1,338 ммоль; 3,00 экв.) в DMF по каплям добавляли Т3Р (283,83 мг; 0,892 ммоль; 2,00 экв.) при 0°С в воздушной атмосфере. Полученную смесь разбавляли EtOAc (50 мл). Полученную смесь промывали водой (2×50 мл) и насыщенным раствором NaCl (2×50 мл), органический слой сушили над безводным Na2SO4. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая трет-бутил (2R)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-4,4-дифторпирролидин-1-карбоксилат (220 мг; 88,95%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=555,2; 1Н ЯМР (400 МГц, DMSO-d6) δ 1.28 (9Н, s), 2.43 (4Н, s), 2.63 (1Н, s), 3.48 (1Н, s), 3.64 (1H, s), 3.80 (1Н, s), 4.02 (1H, q), 4.29 (1H, s), 7.20 (1H, s), 7.42 (3Н, dd), 7.89 (2Н, s), 8.3 (2Н, d), 9.03 (1H, d).
Стадия 2. (R)-3-Амино-N-((4,4-дифторпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору трет-бутил (2R)-2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-4,4-дифторпирролидин-1-карбоксилата (220 мг; 0,397 ммоль; 1 экв.) в DCM добавляли TFA (2 мл; 26,926 ммоль; 67,87 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. DCM и TFA выпаривали, получая 3-амино-N-[[(2R)-4,4-дифторпирролидин-2-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (99,84%) в виде желтого твердого вещества (неочищенного). LCMS: m/z (ESI), [М+Н]+=455,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.40 (1Н, t), 2.56 (3Н, s), 2.73 (1Н, dq), 3.75 (3Н, d), 3.85 (1H, q), 4.08 (1H, dd), 7.34 (1H, s), 7.92-8.17 (5Н, m), 8.34 (1H, s), 8.96 (1H, s), 9.20 (1Н, t).
Стадия 3. (R)-3-Амино-N-((4,4-дифтор-1-метилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 162)
К перемешиваемой смеси 3-амино-N-[[(2R)-4,4-дифторпирролидин-2-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (180 мг; 0,396 ммоль; 1 экв.), НСНО (118,93 мг; 3,961 ммоль; 10,00 экв.) и DIEA (307,15 мг; 2,377 ммоль; 6,00 экв.) в смеси CH2Cl2 (6 мл)/МеОН (3 мл) по каплям добавляли NaBH3CN (149,35 мг; 2,377 ммоль; 6,00 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в воздушной атмосфере. Реакцию гасили путем добавления воды (50 мл) при комнатной температуре. Водный слой экстрагировали CH2Cl2 (2×50 мл). Органический слой объединяли, сушили над безводным Na2SO4 и растворитель выпаривали, получая желтое твердое вещество. Неочищенный продукт (160 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 32% В до 45% В за 8 мин; 254/220 нм; Rt: 7,67 мин), получая 3-амино-N-[[(2R)-4,4-дифтор-1-метилпирролидин-2-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 162) (40 мг; 21,56%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=469,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.19 (1H, dt), 2.33 (3Н, s), 2.42 (4Н, s), 2.54-2.71 (1H, m), 2.79 (1H, s), 3.55 (1H, d), 7.20 (1H, dd), 7.38 (2Н, d), 7.49 (1H, d), 7.90 (2Н, s), 8.29 (2Н, d), 8.77 (1H, t).
Пример 171. Получение 3-амино-Н-[(6-[1-метил-1,6-диазаспиро[3.3]гептан-6-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 171)
СХЕМА 94
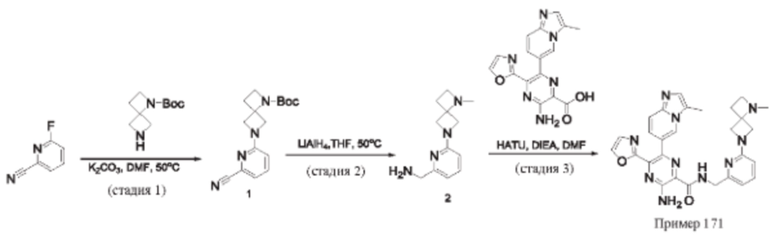
Стадия 1. трет-бутил 6-(6-цианопиридин-2-ил)-1,6-диазаспиро[3.3]гептан-1-карбоксилат
Смесь 6-фторпиридин-2-карбонитрила (1,5 г; 12,29 ммоль; 1 экв.), трет-бутил 1,6-диазаспиро[3.3]гептан-1-карбоксилата (2,92 г; 14,73 ммоль; 1,20 экв.) и K2CO3 (5,09 г; 36,829 ммоль; 3,00 экв.) в DMF (20 мл) перемешивали в течение 10 ч при 50°С в воздушной атмосфере. Полученную смесь экстрагировали EtOAc (4×20 мл). Объединенные органические слои промывали Н2О (2×10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении.
Остаток очищали хроматографией на колонке с силикагелем с элюированием смесью РЕ/EtOAc (6:1), получая трет-бутил 6-(6-цианопиридин-2-ил)-1,6-диазаспиро[3.3]гептан-1-карбоксилат (2,69 г; 72,17%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=301,3.
Стадия 2. 1-(6-[1-Метил-1,6-диазаспиро[3.3]гептан-6-ил)пиридин-2-ил)метанамин
Смесь трет-бутил 6-(6-цианопиридин-2-ил)-1,6-диазаспиро[3.3]гептан-1-карбоксилата (0,5 г; 1,665 ммоль; 1 экв.) и LiAlH4 (0,13 г; 3,425 ммоль; 2,06 экв.) в THF (10 мл) перемешивали в течение 6 ч при 50°С в воздушной атмосфере. Реакционную смесь гасили путем добавления EtOAc (20 мл) при комнатной температуре и затем экстрагировали EtOAc (4×20 мл). Объединенные органические слои промывали водой (3×10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. В результате получали 1-(6-[1-метил-1,6-диазаспиро[3.3]гептан-6-ил]пиридин-2-ил)метанамин (200 мг; 53,93%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=219,2.
Стадия 3. 3-Амино-N-[(6-[1-метил-1,6-диазаспиро[3.3]гептан-6-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 171)
К перемешиваемому(ой) раствору/смеси 3-амино-6-[имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,31 ммоль; 1 экв.) и 1-(6-[1-метил-1,6-диазаспиро[3.3]гептан-6-ил]пиридин-2-ил)метанамина (101,6 мг; 0,465 ммоль; 1,50 экв.) в DMF (3 мл) по каплям добавляли HATU (235,96 мг; 0,621 ммоль; 2,00 экв.) и DIEA (120,31 мг; 0,931 ммоль; 3,0 экв.) при комнатной температуре в воздушной атмосфере. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А:, подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 28% В до 40% В за 7 мин; 254/220 нм; Rt: 6,37 мин), получая 3-амино-N-[(6-[1-метил-1,6-диазаспиро[3.3]гептан-6-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 171) (20 мг; 12,01%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=537,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.1 (5Н, d), 2.4 (3Н, s), 2.9 (2Н, t), 3.8 (2Н, d), 4.0 (2Н, d), 4.5 (2Н, d), 6.3 (1H, d), 6.6 (1H, d), 7.3 (1H, d), 7.4 (2Н, d), 7.4-7.5 (2Н, m), 7.9 (1H, s), 8.3 (1H, s), 8.3 (1Н, s), 9.4 (1H, t).
Пример 172. Получение 3-амино-N-((6-((8-метил-3,8-диазабицикло[3.2.1]октан-3-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 172)
СХЕМА 95
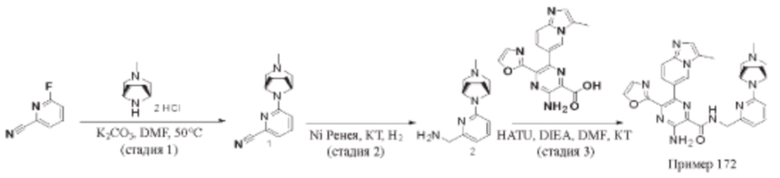
Стадия 1. 6-((1R,5S)-3-Метил-3,8-диазабицикло[3.2.1]октан-3-ил)пиколинонитрил
К перемешиваемому раствору 6-фторпиридин-2-карбонитрила (594 мг; 4,865 ммоль; 1 экв.) и 3-метил-3,8-диазабицикло[3.2.1]октана (675,35 мг; 5,351 ммоль; 1,10 экв.) в DMF (10,5 мл) порциями добавляли K2CO3 (2756,59 мг; 19,946 ммоль; 4,10 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 6,0 ч при 50°С в воздушной атмосфере. Полученную смесь концентрировали под вакуумом. Остаток очищали препаративной TLC (гексан/EtOAc, 1:1), получая 6-[3-метил-3,8-диазабицикло[3.2.1]октан-8-ил]пиридин-2-карбонитрил (613 мг; 55,19%) в виде светло-желтого масла. LCMS: m/z (ESI), [М+Н]+=229,3.
Стадия 2. (6-((1R,5S)-3-Метил-3,8-диазабицикло[3.2.1]октан-3-ил)пиридин-2-ил)метанамин
К перемешиваемому раствору 6-[8-метил-3,8-диазабицикло[3.2.1]октан-3-ил]пиридин-2-карбонитрила (613 мг; 2,685 ммоль; 1 экв.) и NH3.H2O (1,2 мл; 190,218 ммоль; 65,14 экв.) в МеОН (15 мл) по каплям добавляли Ni Ренея (345,07 мг; 4,028 ммоль; 1,50 экв.) при комнатной температуре в атмосфере водорода. Полученную смесь перемешивали в течение 1,0 ч при комнатной температуре в атмосфере водорода.
Требуемый продукт можно было обнаружить посредством LCMS. Полученную смесь концентрировали при пониженном давлении, получая 1-(6-[8-метил-3,8-диазабицикло[3.2.1]октан-3-ил]пиридин-2-ил)метанамин (580 мг; 94,99%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=233,3.
Стадия 3. 3-Амино-N-((6-((1R,5S)-3-метил-3.8-диазабицикло[3.2.1]октан-8-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (200 мг; 0,596 ммоль; 1 экв.) и 1-(6-[3-метил-3,8-диазабицикло[3.2.1]октан-8-ил]пиридин-2-ил)метанамина (207,85 мг; 0,895 ммоль; 1,50 экв.) в DMF (4,00 мл; 205,218 ммоль; 324,98 экв.) порциями добавляли HATU (453,56 мг; 1,193 ммоль; 2,00 экв.) и DIEA (308,34 мг; 2,386 ммоль; 4,00 экв.) при комнатной температуре в воздушной атмосфере. Требуемый продукт можно было обнаружить посредством LCMS. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-N-[(6-[3-метил-3,8-диазабицикло[3.2.1]октан-8-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (100 мг; 30,45%) в виде темно-желтого твердого вещества. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 31% В до 43% В за 7 мин; 254/220 нм; Rt: 6,77 мин), получая 3-амино-N-[(6-[3-метил-3,8-диазабицикло[3.2.1]октан-8-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 172) (39 мг; 23,9%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=551,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.57 (4Н, s), 1.92 (3Н, s), 2.04 (2Н, d), 2.17 (2Н, d), 2.43 (3Н, d), 4.36 (2Н, s), 4.48 (2Н, d), 6.57 (2Н, t), 7.23 (1H, dd), 7.35 (1H, d), 7.38-7.55 (3Н, m), 7.94 (2Н, s), 8.27 (1H, d), 8.38 (1H, s), 9.34 (1H, t).
Пример 175. Получение 3-амино-N-((6-(6-метил-2,6-диазаспиро[3.4]октан-2-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 175)
СХЕМА 96
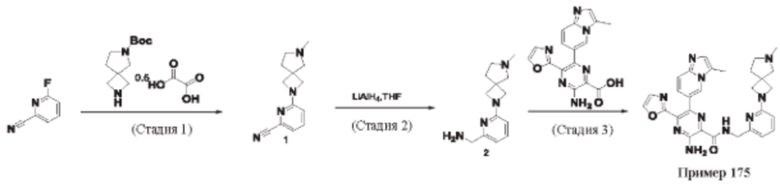
Стадия 1. 6-(6-Метил-2,6-диазаспиро[3.4]октан-2-ил)пиколинонитрил
В герметично закрываемую пробирку емкостью 40 мл добавляли 6-фторпиридин-2-карбонитрил (500 мг; 4,095 ммоль; 1 экв.) трет-бутил 2,6-диазаспиро[3.4]октан-6-карбоксилат, соль щавелевой кислоты, (1609,41 мг; 5,323 ммоль; 1,3 экв.), K2CO3 (1697,83 мг; 12,285 ммоль; 3 экв.) и DMF (10 мл) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 50°С. Реакцию гасили путем добавления насыщ. раствора NaCl (водн.) (250 мл) при комнатной температуре. Полученную смесь экстрагировали EtOAc (2×125 мл). Объединенные органические слои промывали насыщ. раствором NaCl (водн.) (250 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая 6-[(1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил]пиридин-2-карбонитрил (700 мг; 79,78%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=259,2.
Стадия 2. (6-(6-Метил-2.б-диазаспиро[3.4]октан-2-ил)пиридин-2-ил)метанамин
В герметично закрываемую пробирку емкостью 40 мл добавляли трет-бутил 2-(6-цианопиридин-2-ил)-2,6-диазаспиро[3.4]октан-6-карбоксилат (500 мг; 1,590 ммоль; 1 экв.) в THF (10 мл), затем добавляли LiAlH4 (301,81 мг; 7,952 ммоль; 5 экв.) при 0°С. Этот раствор перемешивали при 70°С в течение 2 ч. Требуемый продукт можно было обнаружить посредством LCMS. Реакцию гасили путем добавления воды (0,5 мл) при 0°С. Твердое вещество отфильтровывали. Фильтрат концентрировали под вакуумом, получая 1-(6-[6-метил-2,6-диазаспиро[3.4]октан-2-ил]пиридин-2-ил)метанамин (250 мг; 67,66%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=233,3.
Стадия 3. 3-Амино-N-((6-(6-метил-2,6-диазаспиро[3.4]октан-2-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
В герметично закрываемую пробирку емкостью 10 мл добавляли 1-(6-[6-метил-2,6-диазаспиро[3.4]октан-2-ил]пиридин-2-ил)метанамин (150 мг; 0,646 ммоль; 1 экв.), 3-амино-6- [3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (65,14 мг; 0,194 ммоль; 1,50 экв.), HATU (490,98 мг; 1,291 ммоль; 2,00 экв.) и DIEA (333,77 мг; 2,583 ммоль; 4 экв.) в DMF (10 мл) при комнатной температуре в течение 2 ч. Требуемый продукт можно было обнаружить посредством LCMS. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А:, подвижная фаза В: МеОН для HPLC; скорость потока: 20 мл/мин; градиент: от 66% В до 70% В за 7 мин; 254/220 нм; Rt: 6,32 мин), получая 3-амино-N-[(6-[6-метил-2,6-диазаспиро[3.4]октан-2-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 175) (15 мг; 14,3%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=551,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.87 (2Н, t), 2.22 (3Н, s), 2.36-2.45 (5Н, m), 2.48 (2Н, s), 3.66-3.80 (4Н, m), 4.47 (2Н, d), 6.23 (1H, d), 6.61 (1H, d), 7.28 (1H, dd), 7.36 (1H, d), 7.38-7.57 (3Н, m), 7.93 (2Н, s), 8.25-8.37 (2Н, m), 9.38 (1Н, d).
Пример 198. Получение 3-амино-6-(3-(аминометил)имидазо[1,2-а]пиридин-6-ил)-N-((3-фторпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 198)
СХЕМА 97

Стадия 1. (S)-2-Метил-N-((6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-3-ил)метил)пропан-2-сульфинамид
Смесь трет-бутил N-([6-бромимидазо[1,2-а]пиридин-3-ил]метил)карбамата (700 мг; 2,146 ммоль; 1 экв.), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (817,42 мг; 3,219 ммоль; 1,50 экв.), Pd(dppf)Cl2 (157,02 мг; 0,215 ммоль; 0,1 экв.) и AcOK (421,22 мг; 4,292 ммоль; 2 экв.) в 1,4-диоксане (10 мл) перемешивали в течение 2 ч при 90°С в атмосфере азота. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая трет-бутил N-[[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-3-ил]метил]карбамат (500 мг; 49,94%) в виде коричнево-желтого твердого вещества. LCMS: m/z (ES), [М+Н]+=432,3.
Стадия 2. (S)-3-Амино-6-(3-(((трет-бутилсульфинил)амино)метил)имидазо[1,2-а]пиридин-6-ил)-N-((3-фторпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору (S)-2-метил-N-[[6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1,2-а]пиридин-3-ил]метил]пропан-2-сульфинамида (649,19 мг; 1,721 ммоль; 2,00 экв.) и 3-амино-6-хлор-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (300 мг; 0,860 ммоль; 1 экв.) в смеси 7:1 диоксан/Н2О (16 мл) по каплям/ порциями добавляли K3PO4 (547,83 мг; 2,581 ммоль; 3,0 экв.) и Pd(dppf)Cl2.CH2Cl2 (147,53 мг; 0,181 ммоль; 0,21 экв.) при комнатной температуре в атмосфере водорода. Полученную смесь перемешивали в течение 2,0 ч при 80°С в атмосфере азота. Требуемый продукт можно было обнаружить посредством LCMS: m/z (ES+), [М+Н]+=564,3.
Стадия 3. 3-Амино-6-(3-(аминометил)имидазо[1,2-а]пиридин-6-ил)-N-((3-фторпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
В герметично закрываемую пробирку емкостью 10,0 мл добавляли 3-амино-N-[(3-фторпиридин-2-ил)метил]-6-[3-([[(S)-2-метилпропан-2-сульфинил]амино]метил)-имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (150 мг) и смесь диоксан/HCl (6,0 мл) при комнатной температуре. Полученную смесь перемешивали в течение 60 мин при комнатной температуре в воздушной атмосфере. Требуемый продукт можно было обнаружить посредством LCMS. Полученную смесь концентрировали при пониженном давлении. Полученную смесь разбавляли DMF (4 мл) и подвергали препаративной HPLC. Очистку неочищенного продукта (100 мг) посредством препаративной HPLC проводили в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 21% В до 31% В за 8 мин; 254/220 нм; Rt: 7,53 мин), получая 3-амино-6-[3-(аминометил)имидазо[1,2-а]пиридин-6-ил]-N-[(3-фторпиридин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 198) (20 мг; 6,12%) в виде желтого твердого вещества. LCMS: m/z (ES+), [М+Н]+=460,2. 1Н ЯМР (DMSO-d6, 40 МГц) δ 4.01 (2Н, s), 4.67-4.76 (2Н, m), 7.29 (1H, dd), 7.33-7.56 (4Н, m), 7.72 (1H, ddd), 7.90 (2Н, s), 8.28 (1H, d), 8.38 (1H, dt), 8.57 (1Н, t), 9.34 (1Н, t).
Пример 199. 3-Амино-5-(4-фторфенил)-N-([3-[2-(метиламино)этокси]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 199)
СХЕМА 98
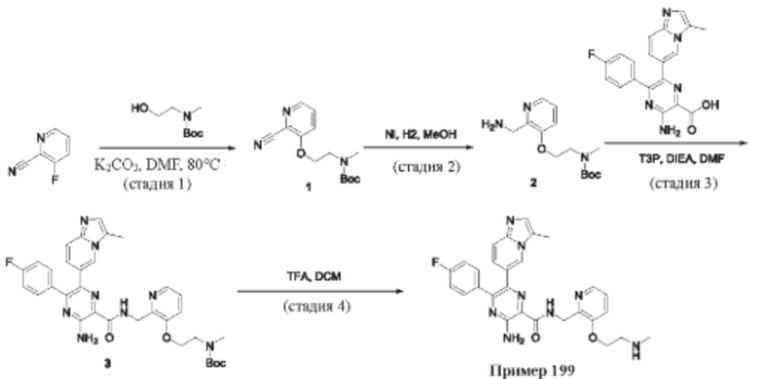
Стадия 1. трет-бутил N-[2-[(2-цианопиридин-3-ил)окси]этил]-N-метилкарбамат
Во флакон емкостью 20 мл помещали 3-фторпиридин-2-карбонитрил (800 мг; 6,552 ммоль; 1 экв.), трет-бутил N-(2-гидроксиэтил)-N-метилкарбамат (1,38 г; 7,875 ммоль; 1,20 экв.), DMF (4 мл), K2CO3 (2,26 г; 16,352 ммоль; 2,50 экв.). Полученную смесь перемешивали в течение 16 ч при 80°С. Полученную смесь разбавляли, используя 20 мл H2O. Полученный раствор экстрагировали этилацетатом (3×8 мл) и органические слои объединяли. Полученный раствор промывали рассолом (3×10 мл), органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали под вакуумом. Остаток очищали препаративной TLC (EtOAc:петролейный эфир, 1:1). В результате получали 738 мг (40,62%) трет-бутил N-[2-[(2-цианопиридин-3-ил)окси]этил]-N-метилкарбамата в виде пурпурного твердого вещества. LCMS: m/z (ESI), [M+H-tBu]+=222,1. 1H ЯМР (300 МГц, DMSO-d6) δ 1.34 (9Н, d), 2.91 (3Н, d), 3.58 (2Н, t), 4.34 (2Н, s), 7.71 (1H, d), 7.84 (1H, d), 8.31 (1H, d).
Стадия 2. трет-бутил N-(2-[[2-(аминометил)пиридин-3-ил]окси]этил)-N-метилкарбамат
В круглодонную колбу емкостью 25 мл, дегазированную и поддерживаемую в инертной атмосфере водорода, помещали трет-бутил N-[2-[(2-цианопиридин-3-ил)окси]этил]-N-метилкарбамат (738 мг; 2,661 ммоль; 1 экв.), МеОН (10 мл), NH3.H2O (1 мл; 25,681 ммоль; 9,65 экв.), Ni Ренея (227,99 мг; 2,661 ммоль; 1,00 экв.). Полученный раствор перемешивали в течение 2 ч при 16°С. Твердые вещества отфильтровывали. Полученную смесь концентрировали под вакуумом. В результате получали 700 мг (93,49%) трет-бутил N-(2-[[2-(аминометил)пиридин-3-ил]окси]этил)-N-метилкарбамата в виде пурпурного твердого вещества. LCMS: m/z (ESI), [М+Н]+=282,2.
Стадия 3. трет-бутил N-(2-[[2-([[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]формамидо]метил)пиридин-3-ил]окси]этил)-N-метилкарбамат
Во флакон емкостью 6 мл помещали трет-бутил N-(2-[[2-(аминометил)пиридин-3-ил]окси]этил)-N-метилкарбамат (154,87 мг; 0,550 ммоль; 2,00 экв.), 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновую кислоту (100 мг; 0,275 ммоль; 1 экв.), DIEA (0,34 мл; 2,061 ммоль; 7,49 экв.), DMF (2,5 мл), Т3Р (262,70 мг; 0,826 ммоль; 3,00 экв.). Полученный раствор перемешивали в течение 16 ч при 16°С. Полученный раствор разбавляли 20 мл H2O. Полученный раствор экстрагировали этилацетатом (3×10 мл) и органические слои объединяли. Полученный раствор экстрагировали рассолом (3×10 мл), органические слои объединяли и сушили над безводным сульфатом натрия. Остаток очищали препаративной TLC (DCM:MeOH, 7:1). В результате получали 93 мг (53,92%) трет-бутил N-(2-[[2-([[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]формамидо]метил)пиридин-3-ил]окси]этил)-N-метилкарбамата в виде желтого твердого вещества. LCMS: m/z (ESI), [М/2+Н]+=314,3.
Стадия 4. 3-Амино-5-(4-фторфенил)-N-((3-(2-(метиламино)этокси)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоксамида 2.2.2-трифторацетат (соединение 199)
Во флакон емкостью 6 мл помещали трет-бутил N-(2-[[2-([[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]формамидо]метил)пиридин-3-ил]окси]этил)-N-метилкарбамат (80 мг; 0,128 ммоль; 1 экв.), DCM (3,00 мл), TFA (1,00 мл; 13,46 ммоль; 105,2 экв.). Полученный раствор перемешивали в течение 2 ч при 20°С. Полученную смесь концентрировали под вакуумом. Значение рН раствора подводили до 9 насыщенным раствором бикарбоната натрия. Полученный раствор экстрагировали этилацетатом (3×10 мл) и органические слои объединяли. Полученную смесь концентрировали под вакуумом. Остаток очищали препаративной TLC (DCM:MeOH, 3:1). Неочищенный продукт очищали препаративной HPLC (колонка: препаративная колонка Sunfire С18 OBD, 10 мкм, 19*250 мм; подвижная фаза А: вода (с 0,05% TFA), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 10% В до 25% В за 10 мин; 254/220 нм; Rt: 8,7 мин). В результате получали 20,22 мг 3-амино-5-(4-фторфенил)-N-((3-(2-(метиламино)этокси)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоксамида 2,2,2-трифторацетата (соединения 199) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=527,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.52-2.54 (3Н, m), 2.71 (3Н, t), 3.43 (2Н, s), 4.34 (2Н, t), 4.75 (2Н, d), 7.23 (2Н, t), 7.34 (1H, d), 7.44-7.58 (3Н, m), 7.69 (1H, d), 7.79-7.90 (2Н, m), 8.03 (1H, d), 8.13 (1H, d), 8.76 (3Н, d), 9.34 (1H, t). 19F ЯМР (300 МГц, DMSO-d6) δ -111.615 (1F), -74.101 (7,27F).
Примеры 202/206. 3-Амино-N-[[1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 202),
3-амино-N-[1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 206)
СХЕМА 99
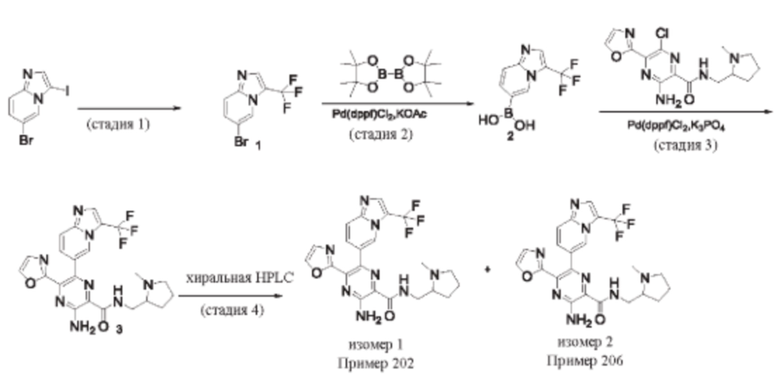
Стадия 1. 6-Бром-3-(трифторметил)имидазо[1,2-а]пиридин
Смесь 6-бром-3-иодимидазо[1,2-а]пиридина (1,5 г; 4,645 ммоль; 1 экв.), 15-(трифторметил)-1лямбда4,12лямбда4-диаза-15-купратетрацикло[10.2.1.0∧[5,14].0∧[8,13]]пентадека-1,3,5(14),6,8,10,12-гептаен-15-илиума (1,74 г; 5,574 ммоль; 1,2 экв.) в DMF (15 мл) перемешивали в течение ночи при 50°С. Полученную смесь разбавляли CH2Cl2 (100 мл). Полученную смесь фильтровали, осадок на фильтре промывали DCM (2×50 мл). Полученную смесь промывали водой (2×150 мл). Органическую фазу концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (детектирование проводили по поглощению на 220 нм в 10-3 единицах оптической плотности (mAU; от англ. milli Absorbance Unit)), элюировали смесью CH2Cl2/PE (40:60), получая 6-бром-3-(трифторметил)имидазо[1,2-а]пиридин (780 мг; 63,36%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=267,1. 1Н ЯМР (300 МГц, DMSO-d6) δ 7.7 (1H, dd), 7.7-7.8 (1H, m), 8.2-8.2 (1H, m), 8.6-8.8 (1H, m).
Стадия 2. [3-(Трифторметил)имидазо[1,2-а]пиридин-6-ил]бороновая кислота
К раствору 6-бром-3-(трифторметил)имидазо[1,2-а]пиридина (500 мг; 1,887 ммоль; 1 экв.) и 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (958,14 мг; 3,773 ммоль; 2,00 экв.) в диоксане (20 мл) добавляли АсОК (555,45 мг; 5,660 ммоль; 3 экв.) и Pd(dppf)Cl2 (276,08 мг; 0,377 ммоль; 0,2 экв.). После перемешивания в течение 2 ч при 90°С в атмосфере азота полученную смесь концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой флэш-хроматографией в приведенных далее условиях: колонка: С18 силикагель; подвижная фаза: МеОН в воде; градиент: от 10% до 50% за 10 мин; детектор: УФ, 254 нм, получая [3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]бороновую кислоту (370 мг; 85,29%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=231,1.
Стадия 3. 3-Амино-N-[[(2S)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид
К раствору [3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]бороновой кислоты (350 мг; 1,522 ммоль; 1 экв.) и 3-амино-6-хлор-N-[(1-метилпирролидин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (512,60 мг; 1,522 ммоль; 1,00 экв.) в диоксане (20 мл) и H2O (2 мл) добавляли K3PO4 (969,25 мг; 4,566 ммоль; 3 экв.) и Pd(dppl)Cl2 (222,74 мг; 0,304 ммоль; 0,2 экв.). После перемешивания в течение 2 ч при 90°С в атмосфере азота полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC/хроматографией на колонке с силикагелем с элюированием смесью CH2Cl2/МеОН (15:1), получая 3-амино-N-[[1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (200 мг; 27,01%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=487,3.
Стадия 4. 3-Амино-N-[[1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 202)/(соединение 206)
Неочищенный продукт (100 мг) очищали препаративной хиральной HPLC в приведенных далее условиях (колонка: CHIRALPAK IG, внутр. диам. (внутренний диаметр) 2,0 см, длина (L) 25 см (5 мкм); подвижная фаза А: CO2: 75, подвижная фаза В: EtOH:ACN=1:25; скорость потока: 40 мл/мин; 220 нм; Rt1: 10; Rt2: 12,65), получая 3-амино-Н-[1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 202) (50 мг; 27,78%) и 3-амино-N-[1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид (соединение 206) в виде желтого твердого вещества. 3-Амино-N-[1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)-6-[3-(трифторметил)имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксамид.
(Соединение 202) LCMS: m/z (ESI), [М+Н]+=487,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.6 (3Н, ddd), 1.8 (1H, dd), 2.1 (1Н, q), 2.3 (3Н, s), 2.4 (1Н, s), 2.9 (1H, dd), 3.2 (1Н, ddd), 3.5 (1H, ddd), 7.3 (1H, s), 7.7 (1H, dd), 7.8 (1H, d), 7.9-8.1 (1H, m), 8.2 (1H, s), 8.3 (1H, s), 8.6 (2Н, d).
(Соединение 206) LCMS: m/z (ESI), [М+Н]+=487,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.6 (3Н, ddd), 1.8 (1H, dd), 2.1 (1H, q), 2.3 (3Н, s), 2.4 (1H, s), 2.9 (1H, dd), 3.2 (1H, ddd), 3.5 (1H, ddd), 7.3 (1H, s), 7.7 (1H, dd), 7.8 (1H, d), 7.9-8.1 (1H, m), 8.2 (1Н, s), 8.3 (1H, s), 8.6 (2Н, d).
Примеры 214/209. Получение 3-амино-6-(3-хлоримидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединений 214/209)
СХЕМА 100
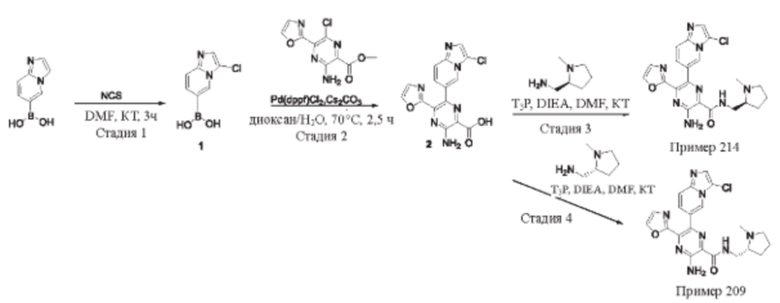
Стадия 1. (3-Хлоримидазо[1,2-а]пиридин-6-ил)бороновая кислота
[Имидазо[1,2-а]пиридин-6-ил]бороновую кислоту (600 мг; 3,705 ммоль; 1 экв.) и NCS (1,24 г; 9,262 ммоль; 2,50 экв.) растворяли в 3 мл DMF. Смесь перемешивали при комнатной температуре в течение 3 ч. LCMS показала завершение реакции.
Неочищенный продукт очищали обращенно-фазовой HPLC, получая [3-хлоримидазо[1,2-а]пиридин-6-ил]бороновую кислоту (235 мг; 32,3%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=197,2.
Стадия 2. 3-Амино-6-(3-хлоримидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоновая кислота
[3-Хлоримидазо[1,2-а]пиридин-6-ил]бороновую кислоту (169,69 мг; 0,864 ммоль; 1,00 экв.), метил 3-амино-6-хлор-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (220 мг; 0,864 ммоль; 1 экв.), Pd(dppf)Cl2 (126,44 мг; 0,173 ммоль; 0,2 экв.) и Cs2CO3 (1126,03 мг; 3,456 ммоль; 4 экв.) растворяли в 2,4 мл смеси диоксан/H2O (5:1). Смесь перемешивали при 70°С в течение 2 ч. LCMS показала завершение реакции. Смесь концентрировали, подкисляли уксусной кислотой и очищали обращенно-фазовой HPLC, получая метил 3-амино-6-[3-хлоримидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксилат (100 мг; 31,22%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=371,2.
Стадия 3. 3-Амино-6-[3-хлоримидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-(1.3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 214)
3-Амино-6-[3-хлоримидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (100 мг; 0,280 ммоль; 1 экв.), 1-[(2R)-1-метилпирролидин-2-ил]метанамин (48,02 мг; 0,420 ммоль; 1,5 экв.), DIEA (253,61 мг; 1,962 ммоль; 7 экв.) и Т3Р (267,58 мг; 0,841 ммоль; 3 экв.) добавляли в DMF (3 мл). Полученную суспензию перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь гасили насыщенным раствором NH4Cl (15 мл) и экстрагировали EtOAc (3×50 мл), органический слой сушили над Na2SO4, фильтровали и упаривали, получая желтое смолообразное вещество. Остаток очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 29% В до 37% В за 8 мин; 254/220 нм; Rt: 6,57/7,42 мин), получая 3-амино-6-[3-хлоримидазо [1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 214) (23,9 мг; 18,8%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=453,2. 1H ЯМР (400 МГц, метанол-d4) δ 1.66-1.84 (3Н, m), 2.02 (1H, dq), 2.32 (1H, q), 2.46 (3Н, s), 2.59 (1H, s), 3.09 (1Н, dd), 3.42 (1Н, dd), 3.66 (1H, dd), 7.33 (1H, d), 7.43 (1H, dd), 7.59 (1Н, dd), 7.66 (1H, s), 8.03 (1H, d), 8.50 (1H, dd).
Стадия 4. 3-Амино-6-[3-хлоримидазо[1,2-а]пиридин-6-ил]-N-[[(2S)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 209)
3-Амино-6-[3-хлоримидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (100 мг; 0,280 ммоль; 1 экв.), 1-[(2R)-1-метилпирролидин-2-ил]метанамин (48,02 мг; 0,420 ммоль; 1,5 экв.), DIEA (253,61 мг; 1,962 ммоль; 7 экв.), Т3Р (267,58 мг; 0,841 ммоль; 3 экв.) добавляли в DMF (3 мл). Полученную суспензию перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь гасили насыщенным раствором NH4Cl (15 мл), экстрагировали EtOAc (3×50 мл), органический слой сушили над Na2SO4, фильтровали и упаривали, получая желтое смолообразное вещество. Остаток очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 29% В до 37% В за 8 мин; 254/220 нм; Rt: 6,57/7,42 мин), получая 3-амино-6-[3-хлоримидазо [1,2-а]пиридин-6-ил]-N-[[(2S)-1-метилпирролидин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (18,9 мг; 14,8%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=453,2. 1Н ЯМР (400 МГц, метанол-d4) δ 1.72-1.84 (3Н, m), 2.02 (1H, dq), 2.32 (1H, q), 2.46 (3Н, s), 2.59 (1H, s), 3.09 (1H, dt), 3.42 (1H, dd), 3.66 (1H, dd), 7.33 (1H, d), 7.42 (1H, dd), 7.59 (1H, dd), 7.66 (1H, s), 8.03 (1Н, d), 8.50 (1H, dd).
Пример 219. Получение 3-амино-N-[[(3R)-1-циклопропанкарбонилпирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 219)
СХЕМА 101
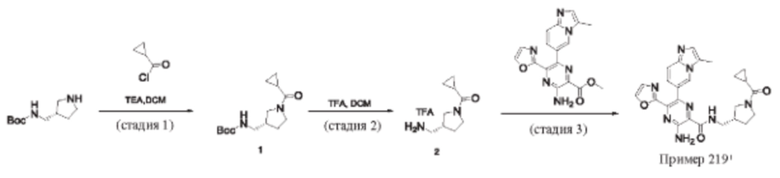
Стадия 1. трет-бутил N-[[(3R-1-циклопропанкарбонилпирролидин-3-ил]метил]карбамат
Смесь TEA (757,86 мг; 7,489 ммоль; 3 экв.), циклопропанкарбонилхлорида (391,44 мг; 3,745 ммоль; 1,5 экв.) и трет-бутил N-[[(3S)-пирролидин-3-ил]метил]карбамата (500 мг; 2,496 ммоль; 1 экв.) в DCM (15 мл) перемешивали в течение 16 ч при комнатной температуре в воздушной атмосфере. Реакционную смесь разбавляли DCM (90 мл), органические слои промывали водой (2×100 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении, получая трет-бутил N-[[(3R)-1-циклопропанкарбонилпирролидин-3-ил]метил]карбамат (750 мг; 111,95%) в виде коричневого масла. 1Н ЯМР (300 МГц, хлороформ-d) δ 0.77 (2Н, d), 1.01 (2Н, d), 1.46 (9Н, d), 1.61 (1H, d), 1.68-1.85 (1H, m), 2.07 (1H, d), 2.33-2.58 (1H, m), 3.03-3.28 (2Н, m), 3.28-3.49 (1Н, m), 3.58-3.72 (1Н, m), 3.72-3.87 (1H, m).
Стадия 2. 1-[(3R)-1-Циклопропанкарбонилпирролидин-3-ил]метанамин
Смесь TFA (1 мл) и трет-бутил N-[[(3R)-1-циклопропанкарбонилпирролидин-3-ил]метил]карбамата (300 мг; 1,118 ммоль; 1 экв.) в DCM (3 мл) перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток подщелачивали до рН 7 насыщенным раствором NaHCO3 (водн.). Полученную смесь экстрагировали CH2Cl2 (2×50 мл). Объединенные органические слои промывали водой (2×50 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении, получая 1-[(3R)-1-циклопропанкарбонилпирролидин-3-ил]метанамин (180 мг; 95,71%) в виде коричневого масла. LCMS: m/z (ESI), [М+Н]+=169,1. 1Н ЯМР (300 МГц, DMSO-d6) δ 0.64-0.79 (4Н, m), 1.09-1.25 (1H, m), 1.59-1.81 (2Н, m), 1.91-2.17 (1H, m), 2.90 (2Н, q), 2.98-3.16 (1Н, m), 3.23-3.50 (1Н, m), 3.52-3.67 (1H, m), 3.69-3.90 (1Н, m), 7.85 (2Н, s).
Стадия 3. 3-Амино-N-[[(3R)-1-циютопропанкарбонилпирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 219)
Смесь DIEA (215,21 мг; 1,665 ммоль; 7 экв.), Т3Р (378,44 мг; 1,189 ммоль; 5 экв.), 1-[(3R)-1-циклопропанкарбонилпирролидин-3-ил]метанамина (160,08 мг; 0,952 ммоль; 4 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,238 ммоль; 1 экв.) в DMF (3 мл) перемешивали в течение ночи при комнатной температуре в воздушной атмосфере. Требуемый продукт можно было обнаружить посредством LCMS. Остаток очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 28% В до 28% В за 7 мин; 254/220 нм; Rt: 5,37 мин), получая 3-амино-N-[[(3R)-1-циклопропанкарбонилпирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 219) (60 мг; 50,81%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=487,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 0.68 (4Н, d), 1.59-1.83 (2Н, m), 1.85-2.17 (1H, m), 2.44 (3Н, s), 2.61 (1H, s), 3.05-3.32 (1H, m), 3.36-3.53 (3Н, m), 3.60 (1H, t), 3.68-3.84 (1H, m), 7.24 (1H, d), 7.33-7.43 (2Н, m), 7.49 (1H, d), 7.91 (2Н, s), 8.28 (1H, s), 8.35 (1H, d), 8.96-9.10 (1H, m).
Пример 221. Получение 3-амино-N-[[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 221)
СХЕМА 102
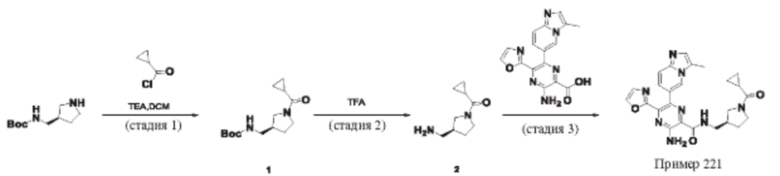
Стадия 1. трет-бутил N-[[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метил]карбамат
К перемешиваемой смеси TEA (1515,71 мг; 14,979 ммоль; 6,00 экв.) и циклопропанкарбонилхлорида (521,91 мг; 4,993 ммоль; 2,00 экв.) в DCM (10 мл) порциями добавляли трет-бутил N-[[(3R)-пирролидин-3-ил]метил]карбамат (500 мг; 2,496 ммоль; 1 экв.) при 25°С в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 25°С в воздушной атмосфере. Полученную смесь экстрагировали CH2Cl2 (3×20 мл) и затем органическую фазу сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении, получая трет-бутил N-[[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метил]карбамат (670 мг; 100,01%) в виде желтого твердого вещества. 1H ЯМР (300 МГц, MeOD-d4) δ 0.85 (4Н, dt), 1.44 (9Н, s), 1.58-1.85 (2Н, m), 2.05 (1H, ddq), 2.42 (1H, dp), 3.09 (3Н, dd), 3.37 (1H, q), 3.48-3.73 (2Н, m), 3.80 (1H, dt).
Стадия 2. 1-Г(38)-1-Циклопропанкарбонилпирролидин-3-ил]метанамин
К перемешиваемой смеси трет-бутил N-[[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метил]карбамата (300 мг; 1,118 ммоль; 1 экв.) в DCM (3 мл) добавляли TFA (1 мл) при 25°С в атмосфере азота. Полученную смесь перемешивали в течение 20 мин при 25°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении, получая 1-[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метанамин (170 мг; 90,39%) в виде желтого масла. LCMS: m/z (ESI), [2М+Н]+=337,2.
Стадия 3. 3-Амино-N-[[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 221)
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (99,95 мг; 0,297 ммоль; 0,50 экв.) и DIEA (153,64 мг; 1,189 ммоль; 2 экв.) в DMF (5 мл) порциями добавляли Т3Р (472,81 мг; 1,486 ммоль; 2,50 экв.) и 1-[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метанамин (100 мг; 0,594 ммоль; 1 экв.) при 25°С в атмосфере азота. Полученную смесь перемешивали в течение 4 ч при 25°С в атмосфере азота. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 28% В до 28% В за 7 мин; 254/220 нм; Rt: 5,37 мин), получая 3-амино-N-[[(3S)-1-циклопропанкарбонилпирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (60 мг; 20,75%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=487,2. 1H ЯМР (300 МГц, DMSO-d6) δ 0.69 (4Н, d), 1.70-2.10 (3Н, m), 2.44 (3Н, s), 2.50 (1H, t), 3.10 (1H, dd), 3.52 (4Н, d), 3.68-3.80 (1H, m), 7.24 (1H, dd), 7.33-7.43 (2Н, m), 7.49 (1H, d), 7.90 (2Н, s), 8.28 (1Н, s), 8.36 (1H, d), 9.02 (1H, d).
Пример 223. Получение 3-амино-N-[(3-фторпиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоксамида (соединения 223)
СХЕМА 103
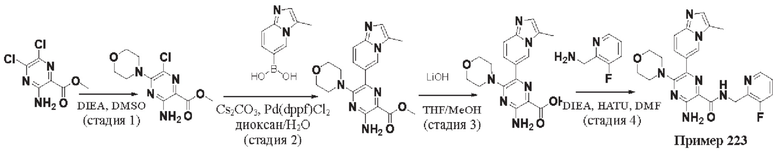
Стадия 1. метил 3-амино-6-хлор-5-(морфолин-4-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (50 мг; 0,225 ммоль; 1 экв.) и DIEA (87,31 мг; 0,676 ммоль; 3 экв.) в DMSO порциями добавляли морфолин (39,24 мг; 0,450 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение ночи при комнатной температуре. Реакцию гасили водой при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и промывали водой (1×100 мл), сушили под вакуумом, получая метил 3-амино-6-хлор-5-(морфолин-4-ил)пиразин-2-карбоксилат (1,8 г; 97,71%) в виде желтого твердого вещества. 1H ЯМР (400 МГц, хлороформ-с/) 5 3.61-3.72 (4Н, m), 3.75-3.88 (4Н, m), 3.94 (3Н, s).
Стадия 2. метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(морфолин-4-ил)пиразин-2-карбоксилата (600 мг; 2,200 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (580,81 мг; 3,300 ммоль; 1,5 экв.) в диоксане (50 мл) порциями добавляли Cs2CO3 (2150,70 мг; 6,601 ммоль; 3 экв.) и Pd(dppf)Cl2 (321,99 мг; 0,440 ммоль; 0,2 экв.) при 95°С в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 95°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем с элюированием смесью CH2Cl2/МеОН (20:1), получая метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоксилат (400 мг; 49,35%) в виде желто-зеленого твердого вещества. LCMS: m/z (ESI), [М+Н]+=369,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 3.26 (4Н, d), 3.58 (4Н, d), 3.79 (3Н, s), 3.93 (3Н, s), 7.30 (2Н s), 7.40 (1H, s), 7.52 (1H, d), 7.60 (1H, d), 8.45(1Н, s).
Стадия 3. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоновая кислота
К раствору метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоксилата (400 мг; 1,086 ммоль; 1 экв.) в THF (50 мл) и метаноле (10 мл) порциями добавляли LiOH (156,01 мг; 6,515 ммоль; 6 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в воздушной атмосфере. Смесь подкисляли до рН 6, используя раствор HCl (водн.). Полученную смесь концентрировали под вакуумом, получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоновую кислоту (350 мг; 90,96%) в виде желтого твердого вещества. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=355,1.
Стадия 4. 3-Амино-N-[(3-фторпиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил1-5-(морфолин-4-ил)пиразин-2-карбоксамид (соединение 223)
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоновой кислоты (100 мг; 0,282 ммоль; 1 экв.) и 1-(3-фторпиридин-2-ил)метанамина (71,19 мг; 0,564 ммоль; 2 экв.) в DMF (10 мл) порциями добавляли HATU (214,59 мг; 0,564 ммоль; 2 экв.) и DIE А (109,41 мг; 0,847 ммоль; 3 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 2,5 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Полученный неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: 5%-ный аммиак в воде, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 33% В до 48% В за 8 мин; 254/220 нм; Rt: 7,47 мин), получая 3-амино-N-[(3-фторпиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(морфолин-4-ил)пиразин-2-карбоксамид (9 мг; 6,83%) (соединение 223) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=463,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.54 (3Н, d), 3.63 (4Н, t), 461-4.74 (4Н, m), 7.36-7.45 (2Н, m), 7.57-7.64 (1H, m), 7.66-7.79 (2Н, m), 8.36 (1H, dt), 8.63 (1H, s), 8.93 (1H, t).
Примеры 227/224. Получение транс/цис-3-амино-N-((6-((3-(диметиламино)циклобутил)амино)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединений 227/224)
СХЕМА 104

Стадия 1. 6-((3-(Диметиламино)циклобутил)амино)пиколинонитрил
Смесь 6-фторпиридин-2-карбонитрила (136 мг; 1,114 ммоль; 1 экв.), дигидрохлорида N1,N1-диметилциклобутан-1,3-диамина (250 мг; 1,336 ммоль; 1,20 экв.) и дикарбоната калия (462 мг; 3,343 ммоль; 3,00 экв.) в 3 мл DMF перемешивали при 50°С в течение 18 ч. После охлаждения до комнатной температуры добавляли воду и экстрагировали EtOAc (3×100 мл). Объединенные органические слои промывали рассолом, сушили над безводным Na2SO4. После фильтрования и концентрирования остаток очищали на колонке (DCM/MeOH, 3/1), получая 6-[[3-(диметиламино)циклобутил]амино]пиридин-2-карбонитрил (155 мг; 64,3%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=217,3.
Стадия 2. N1-(6-(Аминометил)пиридин-2-ил)-N3,N3-диметилциклобутан-1,3-диамин
Смесь 6-[[3-(диметиламино)циклобутил]амино]пиридин-2-карбонитрила (155 мг; 0,717 ммоль; 1 экв.), 1 мл раствора аммиака и Ni Ренея (100 мг) в метаноле (10 мл) гидрировали в атмосфере Н2 (1 ат (98,1 кПа)) при комнатной температуре в течение 3 ч. После фильтрования через целит фильтрат концентрировали досуха под вакуумом и остаток непосредственно использовали на следующей стадии. LCMS: m/z (ESI), [М+Н]+=221,2.
Стадия 3. цис/транс-3-Амино-N-((6-((3-(диметиламино)циклобутил)амино)-пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединения 224/227)
К смеси 3-амино-6-(1-метил-1Н-1,3-бензодиазол-6-ил)-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (150 мг; 0,446 ммоль; 1 экв.) и N3-[6-(аминометил)пиридин-2-ил]-N1,N1-диметилциклобутан-1,3-диамина (145 мг; 0,66 ммоль; 1,48 экв.) в N,N-диметилформамиде (5 мл) добавляли DIEA (0,39 мл; 2,239 ммоль; 5,02 экв.) и 50%-ный (по массе) раствор Т3Р в этилацетате (860 мг; 1,351 ммоль; 3,03 экв.). Смесь перемешивали при комнатной температуре в течение 18 ч. После концентрирования досуха остаток очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 29% В до 37% В за 8 мин; 254/220 нм; Rt: 6,57/7,42 мин), получая транс-3-амино-6-[3-метил-имидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(6-[[3-(диметиламино)цикло-бутил]амино]пиридин-2-ил)метил]пиразин-2-карбоксамид (соединение 227) (6,6 мг; 2,7%) (соединение 227). LCMS: m/z (ESI), [М+Н]+=539,4. 1Н ЯМР (300 МГц, MeOH-d4) δ 1.87-1.95 (2Н, m), 2.02-2.14 (8Н, m), 2.43 (3Н, s), 2.71-2.81 (1Н, m), 3.97-4.02 (1Н, m), 4.48 (2Н, s), 6.26-6.28 (1Н, d), 6.55-6.57 (1H, d), 7.22-7.48 (5Н, m), 7.99 (1H, s), 8.38 (1Н, s); и цис-3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(6-[[3-(ди-метиламино)циклобутил]амино]пиридин-2-ил)метил]пиразин-2-карбоксамид (соединение 224) (6,1 мг; 2,5%) в виде желтого твердого вещества (соединение 224). LCMS: m/z (ESI), [М+Н]+=539,3. 1Н ЯМР (300 МГц, MeOH-d4) δ 1.39-1.48 (2Н, m), 1.56-1.66 (1H, m), 1.89 (6Н, s), 2.16-2.24 (2Н, m), 2.44 (3Н, s), 3.76-3.87 (1H, m), 4.49 (2Н, s), 6.29-6.32 (1H, d), 6.50-6.52 (1H, d), 7.25-7.37 (4Н, m), 7.48-7.52 (1Н, d), 7.97 (1H, s), 8.43 (1H, s).
Пример 229. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-оксолан-2-ил]метил]-5-(2H-1,2,3-триазол-2-ил)пиразин-2-карбоксамида (соединения 229)
СХЕМА 105
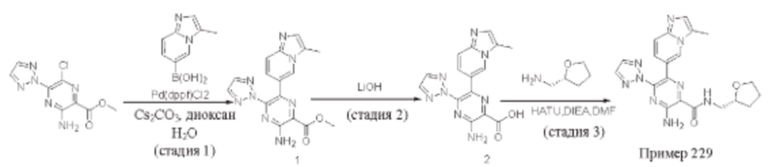
Стадия 1. метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (1 г; 3,927 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (1,38 г; 7,855 ммоль; 2 экв.) в 1,4-диоксане (15 мл) и H2O (1,5 мл) порциями добавляли Cs2CO3 (2,56 г; 7,855 ммоль; 2,00 экв.) и Pd(dppf)Cl2.CH2Cl2 (0,64 г; 0,785 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение ночи при 100°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилат (1 г; 72,68%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=351,1. 1H ЯМР: (300 МГц, DMSO-d6) δ 2.31 (3Н, s), 3.91 (3Н, s), 6.91 (1Н, m), 7.42 (2H, m), 7.73 (1H, m), 7.91 (2H, s), 8.12 (2H, s).
Стадия 2. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (950 мг; 2,712 ммоль; 1 экв.) в МеОН (15 мл) и THF (3 мл) порциями добавляли LiOH (97,42 мг; 4,067 ммоль; 1,5 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 ч при комнатной температуре. Остаток подкисляли до рН 5, используя раствор HCl (водн.). Полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоновую кислоту (400 мг; 43,86%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=337,1.
Стадия 3. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-оксолан-2-ил]метил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 229)
К перемешиваемой смеси 1-[(2R)-оксолан-2-ил]метанамина (60,15 мг; 0,595 ммоль; 2 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)-пиразин-2-карбоновой кислоты (100 мг; 0,297 ммоль; 1 экв.) в DMF (10 мл) по каплям добавляли DIEA (76,86 мг; 0,595 ммоль; 2 экв.) и Т3Р (23,80 мг; 0,595 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Реакцию гасили водой при комнатной температуре. Полученную смесь концентрировали под вакуумом. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А:, подвижная фаза В:; скорость потока: 20 мл/мин; градиент: от 30% В до 41% В за 8 мин; 254/220 нм; Rt: 7,17 мин), получая 3-амино-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-N-[[(2R)-оксолан-2-ил]метил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамид (соединение 229) (43 мг; 34,48%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=420,3. 1H ЯМР: (300 МГц, DMSO-d6) δ 1.78 (4Н, m), 2.36 (3Н, d), 3.40 (2Н, d), 3.62 (1H, m), 3.78 (1H, m), 4.04 (1H, p), 6.87 (1H, dd), 7.39 (2H, m), 7.92 (1H, m), 8.12 (4H, s), 8.85 (1H, t).
Примеры 230-1/230-2. Получение 3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((1,4,4-триметилпирролидин-2-ил)метил)пиразин-2-карбоксамида (соединений 230-1/230-2)
СХЕМА 106
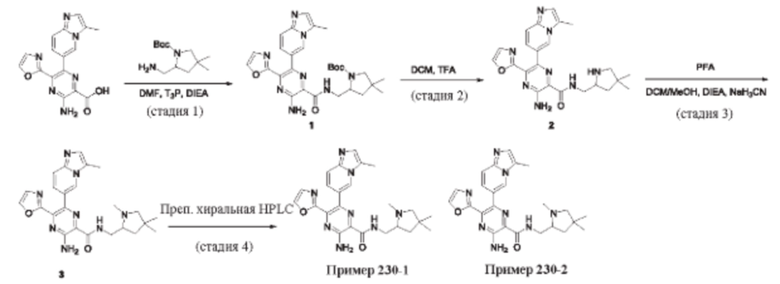
Стадия 1. трет-бутил 2-((3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамидо)метил)-4,4-диметилпирролидин-1-карбоксилат
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (200 мг; 0,595 ммоль; 1 экв.), DIEA (230,58 мг; 1,784 ммоль; 3 экв.) и трет-бутил 2-(аминометил)-4,4-диметилпирролидин-1-карбоксилата (271,58 мг; 1,189 ммоль; 2 экв.) в DMF (12 мл) по каплям добавляли Т3Р (378,44 мг; 1,189 ммоль; 2 экв.) при 0°С в атмосфере азота. Полученную смесь перемешивали в течение 1 ч при комнатной температуре в атмосфере азота. Реакцию гасили путем добавления воды (20 мл) при комнатной температуре. Полученную смесь экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая трет-бутил 2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-4,4-диметилпирролидин-1-карбоксилат (180 мг; 55,37%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=547,4.
Стадия 2. 3-Амино-N-((4,4-диметилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору трет-бутил 2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-4,4-диметилпирролидин-1-карбоксилата (160 мг; 0,293 ммоль; 1 экв.) в DCM (8 мл) по каплям добавляли TFA (3 мл; 40,389 ммоль; 137,99 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 30 мин при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении, получая 3-амино-N-[(4,4-диметилпирролидин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (135 мг; 98,12%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=447,4.
Стадия 3. 3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((1,4,4-триметилпирролидин-2-ил)метил)пиразин-2-карбоксамид
К перемешиваемой смеси 3-амино-N-[(4,4-диметилпирролидин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (155 мг; 0,347 ммоль; 1 экв.), DIEA (89,73 мг; 0,694 ммоль; 2 экв.) и параформальдегида (PFA; 312,69 мг; 3,471 ммоль; 10 экв.) в DCM (12 мл) и МеОН (4 мл) порциями добавляли NaBH3CN (65,44 мг; 1,041 ммоль; 3 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 12 ч при комнатной температуре в атмосфере азота. Реакцию гасили путем добавления воды (20 мл) при комнатной температуре. Полученную смесь экстрагировали CH2Cl2 (3×15 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 10:1), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(1,4,4-триметилпирролидин-2-ил)метил]пиразин-2-карбоксамид (130 мг; 81,32%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 461,4.
Стадия 4. 3-Амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((1,4,4-триметилпирролидин-2-ил)метил)пиразин-2-карбоксамид (230-1/230-2)
Неочищенный продукт (100 мг) очищали хиральной препаративной HPLC в приведенных далее условиях (колонка: CHIRALPAK ID-03, внутр. диам. 2,0 см, длина 25 см (5 мкм); подвижная фаза A: Hex:DCM, 5:1 (с 10 мМ NH3-MEOH) для HPLC, подвижная фаза В: IPA (изопропиловый спирт) для HPLC; скорость потока: 20 мл/мин; градиент: от 25 В до 25 В за 22 мин; 220/254 нм; Rt1: 15,342; Rt2: 17,566), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(1,4,4-триметилпирролидин-2-ил)метил]пиразин-2-карбоксамид (соединение 230-1) (45 мг; 43,41%), LCMS: m/z (ESI), [М+Н]+ = 461,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.01 (6Н, d), 1.46 (1H, s), 1.68 (1H, s), 2.05 (1H, s), 2.28 (3Н, s), 2.42 (3Н, s), 2.68 (1H, s), 3.48 (1H, s), 7.19 (1H, dd), 7.40 (2Н, d), 7.49 (1H, d), 7.90 (2Н, s), 8.31 (2Н, d), 8.65 (1H, s); и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(1,4,4-триметилпирролидин-2-ил)метил]пиразин-2-карбоксамид (соединение 230-2) (45 мг; 45%), LCMS: m/z (ESI), [М+Н]+ = 461,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.01 (6Н, d), 1.46 (1Н, s), 1.68 (1H, s), 2.05-2.28 (4Н, m), 2.42 (3Н, s), 2.68 (1H, s), 3.30 (1H, s), 3.48 (1H, s), 7.19 (1H, dd), 7.36 (1H, s), 7.40 (1H, s), 7.49 (1H, d), 7.90 (2Н, s), 8.27 (1H, s), 8.31 (1Н, s), 8.65 (1H, s).
Пример 231. Получение (R)-3-амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида (соединения 231)
СХЕМА 107
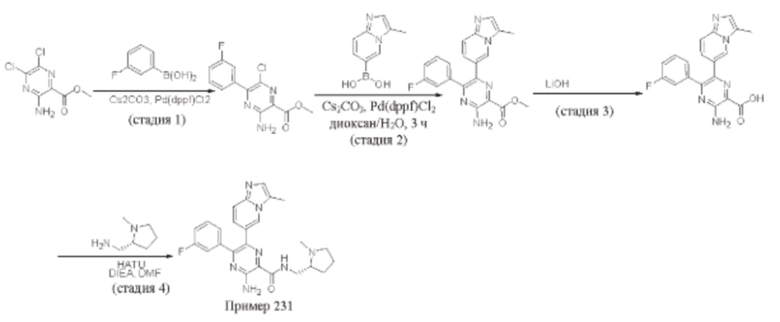
Стадия 1. Получение метил 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбоксилата
К перемешиваемой смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (1,5 г; 6,756 ммоль; 1 экв.) и (3-фторфенил)бороновой кислоты (0,95 г; 6,790 ммоль; 1,00 экв.) в 1,4-диоксане (100 мл) и Н2О (5 мл) порциями добавляли Cs2CO3 (6,60 г; 0,020 ммоль; 3 экв.) и Pd(dppf)Cl2 (0,74 г; 0,001 ммоль; 0,15 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 70°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали CH2Cl2 (1×30 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/EtOAc (4:1), получая метил 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбоксилат (900 мг; 47,30%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 282,0. 1Н ЯМР (300 МГц, хлороформ-d) δ 4.03 (3Н, s), 7.22 (1H, m), 7.41-7.59 (2Н, m), 7.65 (1Н, ddd).
Стадия 2. метил 3-амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбоксилата (400 мг; 1,420 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (324,88 мг; 1,846 ммоль; 1,30 экв.) в 1,4-диоксане (20 мл) и Н2О (2 мл) порциями добавляли Cs2CO3 (1388,09 мг; 4,260 ммоль; 3 экв.) и Pd(dppf)Cl2 (155,86 мг; 0,213 ммоль; 0,15 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 90°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали CH2Cl2 (1×20 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая метил 3-амино-5-(3-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксилат (300 мг; 55,98%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 378,1.
1H ЯМР (300 МГц, хлороформ-d) δ 2.22-2.65 (3Н, m), 4.04 (3Н, s), 6.91-7.05 (1H, m), 7.05-7.23 (2Н, m), 7.30 (2Н, d), 7.44 (2Н, d), 8.11 (1H, t).
Стадия 3. 3-Амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-5-(3-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксилата (300 мг; 0,795 ммоль; 1 экв.) в THF (20 мл) и Н2О (4 мл) порциями добавляли LiOH (38,08 мг; 1,590 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Смесь подкисляли до рН 5, используя раствор HCl (водн.). Полученную смесь концентрировали при пониженном давлении, получая 3-амино-5-(3-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновую кислоту (280 мг; 96,94%) в виде желтого твердого вещества, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+ = 364,2.
Стадия 4. (R)-3-Амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамид (соединение 231)
К перемешиваемой смеси 1-[(2R)-1-метилпирролидин-2-ил]метанамина (62,85 мг; 0,550 ммоль; 2,00 экв.) и 3-амино-5-(3-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновой кислоты (100 мг; 0,275 ммоль; 1 экв.) в DMF (10 мл) порциями добавляли DIEA (106,71 мг; 0,826 ммоль; 3,00 экв.) и Т3Р (175,14 мг; 0,550 ммоль; 2,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А (5% NH4HCO3 в воде), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 37% В до 51% В за 8 мин; 254/220 нм; Rt: 7,27 мин), получая 3-амино-5-(3-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]пиразин-2-карбоксамид (соединение 231) (20 мг; 15,81%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 460,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.65 (3Н, s), 1.86 (1H, s), 2.18 (1Н, s), 2.34 (3Н, s), 2.37 (3Н, d), 2.45 (1H, s), 2.97 (1H, s), 3.31 (1H, s), 3.51 (1H, s), 7.03 (1H, dd), 7.26 (2Н, ddd), 7.30-7.35 (1Н, m), 7.36-7.43 (3Н, m), 7.77 (2Н, s), 8.13-8.32 (1Н, m), 8.67 (1H, s).
Примеры 235/232. Получение 3-амино-N-((6-(3-(диметиламино)пирролидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединений 235/232)
СХЕМА 109
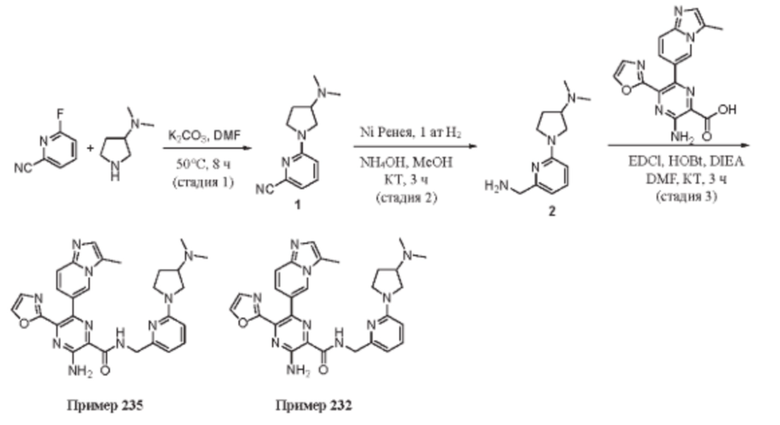
Стадия 1.16-[3-(Диметиламино)пирролидин-1-ил]пиридин-2-карбонитрил
К смеси 6-фторпиридин-2-карбонитрила (500 мг; 4,095 ммоль; 1 экв.) и N,N-диметилпирролидин-3-амина (701,41 мг; 6,142 ммоль; 1,5 экв.) в 2 мл DMF добавляли карбонат калия (1,14 г; 8,190 ммоль; 2,00 экв.). Смесь перемешивали при 50°С в течение 8 ч. После концентрирования досуха остаток очищали хроматографией на колонке с силикагелем с элюированием смесью DCM/CH3OH (10/1), получая 6-[3-(диметиламино)пирролидин-1-ил]пиридин-2-карбонитрил (810 мг; 80,0%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 217,1.
Стадия 2. 1-[6-(Аминометил)пиридин-2-ил]-N,N-диметилпирролидин-3-амин
Смесь 6-[3-(диметиламино)пирролидин-1-ил]пиридин-2-карбонитрила (200 мг; 0,925 ммоль; 1 экв.), Ni Ренея (158,45 мг; 1,849 ммоль; 2 экв.) и NH4OH (50 мг) в метаноле (16 мл) гидрировали в атмосфере Н2 (1 ат (98,1 кПа)) при комнатной температуре в течение 3 ч. После фильтрования через целит фильтрат концентрировали досуха под вакуумом и остаток использовали непосредственно на следующей стадии. LCMS: m/z (ESI), [М+Н]+ = 221,1.
Стадия 3. 3-Амино-N-([6-[3-(диметиламино)пирролидин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединения 235/232)
К смеси 1-[6-(аминометил)пиридин-2-ил]-N,N-диметилпирролидин-3-амина (185 мг; 0,840 ммоль; 1 экв.), 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (423 мг; 1,260 ммоль; 1,50 экв.) в N,N-диметилформамиде (5 мл) добавляли DIEA (651,14 мг; 5,038 ммоль; 6 экв.), HOBt (226,92 мг; 1,679 ммоль; 2 экв.) и EDCl (321,94 мг; 1,679 ммоль; 2 экв.). Смесь перемешивали при комнатной температуре в течение 3 ч. После концентрирования досуха остаток очищали хиральной препаративной HPLC в приведенных далее условиях (колонка: CHIRAL ART Cellulose-SB S-5 um, 2*25 см, 5 мкм; подвижная фаза A: Hex (с NH3.MeOH, 8 ммоль/л) для HPLC, подвижная фаза В: МеОН:EtOH (1:1, для HPLC); скорость потока: 20 мл/мин; градиент: от 50 В до 50 В за 13 мин; 220/254 нм; RT1: 8,028 мин; RT2: 10,436 мин), получая 3-амино-N-([6-[3-(диметиламино)пирролидин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 235) (77 мг; 17,0%), LCMS: m/z (ESI), [М+Н]+ = 539,4. 1H ЯМР (300 МГц, метанол-d4) δ 1.28 (1Н, m), 1.48 (1H, m), 2.16 (6Н, s), 2.48 (3Н, d), 2.55-2.66 (1Н, m), 3.09 (2Н, dt), 3.52 (2Н, dt), 4.54 (2Н, s), 6.31 (1H, d), 6.57 (1H, d),7.22-7.33 (2Н, m), 7.38-7.56 (3Н, m), 7.98 (1H, d), 8.37 (1H, s), и 3-амино-N-([6-[3-(диметиламино)пирролидин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 232) (30 мг; 6,63%), LCMS: m/z (ESI), [М+Н]+ = 539,3. 1H ЯМР (300 МГц, метанол-d4) δ 1.39-1.59 (2Н, m), 2.16 (6Н, s), 2.48 (3Н, d), 2.55-2.66 (1H, m), 3.09 (2Н, dt), 3.52 (2Н, dt), 4.54 (2Н, s), 6.31 (1H, d), 6.57 (1H, d),7.22-7.33 (2Н, m), 7.38-7.56 (3Н, m), 7.98 (1Н, d), 8.37 (1Н, s).
Пример 233. Получение рац-3-амино-N-(2-(метил(тетрагидрофуран-3-ил)амино)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 233)
СХЕМА 110
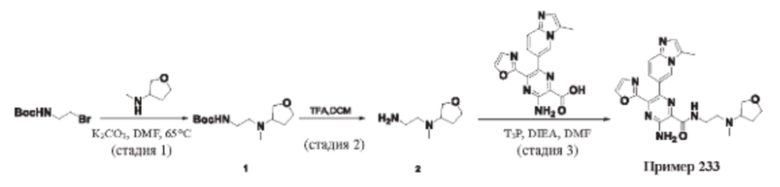
Стадия 1. трет-бутил (2-(метил(тетрагидрофуран-3-ил)амино)этил)карбамат
Смесь трет-бутил N-(2-бромэтил)карбамата (400 мг; 1,785 ммоль; 1 экв.), N-метилоксолан-3-амина (180,54 мг; 1,785 ммоль; 1 экв.) и K2CO3 (740,06 мг; 5,355 ммоль; 3,0 экв.) в DMF (30 мл) перемешивали в течение 16 ч при 65°С. Полученную смесь разбавляли водой (30 мл). Полученную смесь экстрагировали EtOAc (3×30 мл). Объединенные органические слои промывали насыщенным рассолом (20 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. В результате получали трет-бутил N-[2-[метил(оксолан-3-ил)амино]этил]карбамат (410 мг; 94,0%) в виде светло-желтого масла. LCMS: m/z (ESI), [М+Н]+ = 245,1. 1Н ЯМР (300 МГц, DMSO-d6) δ 0.62 (9Н, s), 1.02-1.05 (1H, m), 1.35-1.18 (1Н, m), 1.45 (2Н, s), 1.80-1.56 (2Н, m), 2.37-2.39 (3Н, m), 2.50-2.53 (1H, m), 2.87-2.69 (1H, m), 2.91-2.94 (1H, m), 3.01-3.05 (1H, m), 3.12-3.15 (1H, m).
Стадия 2. N1-Метил-N1-(тетрагидрофуран-3-ил)этан-1,2-диамин
Раствор трет-бутил N-[2-[метил(оксолан-3-ил)амино]этил]карбамата (200 мг; 0,819 ммоль; 1 экв.) и TFA (3 мл) в DCM (6 мл) перемешивали в течение 1 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Остаток нейтрализовали до рН 7 насыщенным раствором (водн.) NaHCO3. Водный слой экстрагировали EtOAc (3×20 мл). Полученную смесь концентрировали при пониженном давлении. В результате получали N-(2-аминоэтил)-N-метилоксолан-3-амин (105 мг; 88,95%) в виде светло-желтого масла. LCMS: m/z (ESI), [М+Н]+=145,1. 1H ЯМР (300 МГц, DMSO-d6) δ 1.41-1.44 (1Н, m), 1.60-1.64 (1Н, m), 2.05-2.08 (1H, d), 2.16-2.19 (1H, s), 2.50-2.53 (1H, m), 2.65-2.67 (4Н, m), 2.89-2.90 (1H, m), 2.97-2.99 (1H, m), 3.30-3.32 (1H, m), 3.37-3.39 (2Н, m).
Стадия 3. рац-3-Амино-N-(2-(метил(тетрагидрофуран-3-ил)амино)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
Раствор 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,238 ммоль; 1 экв.), N-(2-аминоэтил)-N-метилоксолан-3-амина (41,17 мг; 0,285 ммоль; 1,2 экв.), Т3Р (227,06 мг; 0,714 ммоль; 3,0 экв.) и DIEA (92,23 мг; 0,714 ммоль; 3,0 экв.) в DMF (2 мл) перемешивали в течение 2 ч при комнатной температуре. Полученную смесь разбавляли водой (30 мл) и экстрагировали EtOAc (3×30 мл). Объединенные органические слои промывали насыщенным рассолом (10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge С18 OBD 19×150 мм, 5 мкм; подвижная фаза А, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 20% В до 37% В за 7 мин; 254/220 нм; Rt: 6,58 мин), получая 3-амино-N-[2-[метил(оксолан-3-ил)амино]этил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 233) (12,2 мг; 11,09%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 463,4. 1Н ЯМР (300 МГц, MeOD-d4) δ 1.81-1.85 (1H, m), 2.04-2.05 (1H, m), 2.32 (3Н, s), 2.49 (3Н, s), 2.59-2.63 (2Н, m), 3.22-3.24 (1H, m), 3.29-3.34 (2Н, m), 3.51-3.55 (2Н, m), 3.60-3.65 (2Н, m), 7.25-7.30 (2Н, m), 7.31-7.38 (1H, s), 7.47-7.50 (1H, m), 8.02 (1H, s), 8.68 (1H, s).
Пример 234. Получение (3S)-3-[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N-диметилбутанамида (соединения 234)
СХЕМА 111
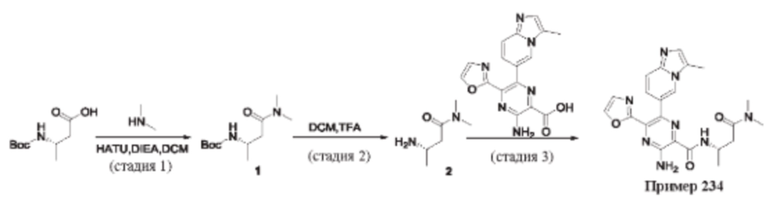
Стадия 1. (S)-трет-Бутил 4-(диметиламино)-4-оксобутан-2-илкарбамат
К перемешиваемой смеси (3S)-3-[[(трет-бутокси)карбонил]амино]бутановой кислоты (500 мг; 2,460 ммоль; 1 экв.) и диметиламина (221,83 мг; 4,920 ммоль; 2 экв.) в DCM добавляли HATU (1870,86 мг; 4,920 ммоль; 2 экв.) порциями и DIEA (1,59 г; 12,301 ммоль; 5 экв.) по каплям при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение ночи при комнатной температуре в воздушной атмосфере. Остаток очищали обращенно-фазовой флэш-хроматографией в приведенных далее условиях: колонка: С18 силикагель; подвижная фаза: ACN в воде; градиент: от 5% до 20% за 10 мин; детектор: УФ 220 нм. В результате получали трет-бутил N-[(2S)-1-(диметилкарбамоил)пропан-2-ил]карбамат (550 мг; 64,07%) в виде розового твердого вещества. LCMS (ESI) m/z [М+Н]+ = 231,1; 1Н ЯМР (400 МГц, CDCl3-d) δ 1.27 (3Н, d), 1.44 (9Н, s), 2.44-2.49 (1Н, m), 2.60-2.65 (1H, m), 2.95 (3H, s), 3.04 (3Н, s), 4.00-4.05 (1H, m).
Стадия 2. (S)-3-Амино-N,N-диметилбутанамид
В круглодонную колбу емкостью 50 мл добавляли трет-бутил N-[(2S)-1-(диметилкарбамоил)пропан-2-ил]карбамат (200 мг; 0,868 ммоль; 1 экв.) и TFA (0,99 г; 8,684 ммоль; 10 экв.) при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. ECMS (ESI) m/z [М+Н]+ = 131,1; 1Н ЯМР (300 МГц, CDCl3-d) δ 1.40 (3Н, d), 2.70 (2Н, d), 2.95 (3Н, s), 3.01 (3Н, s), 3.74 (1H, s), 7.78 (3Н, s), 11.00 (2Н, s).
Стадия 3. (S)-3-Амино-N-(4-(диметиламино)-4-оксобутан-2-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 234)
К перемешиваемому раствору/смеси (3S)-3-амино-N,N-диметилбутанамида (77,42 мг; 0,595 ммоль; 2 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,297 ммоль; 1 экв.) в DMF по каплям добавляли DIEA (768,59 мг; 5,947 ммоль; 20,00 экв.) и Т3Р (946,09 мг; 2,973 ммоль; 10,00 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение ночи при комнатной температуре в воздушной атмосфере. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А:, подвижная фаза В: МеОН для HPLC; скорость потока: 20 мл/мин; градиент: от 49% В до 59% В за 8 мин; 254/220 нм; Rt: 6,97 мин), получая (3S)-3-[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N-диметилбутанамид (15 мг; 11,15%) в виде желтого твердого вещества. LCMS (ESI) [М+Н]+ = 449,3; 1Н ЯМР (400 МГц, DMSO-d6) δ 1.23 (3Н, d), 2.48 (3Н, d), 2.52-2.60 (1H, m), 2.74-2.79 (1Н, m), 2.83 (3Н, s), 3.00 (3Н, s), 4.38 (1H, s), 7.14-7.17 (1H, m), 7.37-7.41 (2Н, m), 7.47-7.49 (1H, m), 8.28 (1H, d), 8.37 (1H, s), 9.01 (1H, d).
Пример 236. Получение (3R)-3-[(3-амино-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N-диметилбутанамида (соединения 236)
СХЕМА 112

Стадия 1. трет-бутил N-[(2R)-1-(диметилкарбамоил)пропан-2-ил]карбамат
Смесь DIEA (1589,80 мг; 12,301 ммоль; 5 экв.), HATU (1870,86 мг; 4,920 ммоль; 2 экв.), гидрохлорида диметиламина (401,20 мг; 4,920 ммоль; 2 экв.) и (3R)-3-[[(трет-бутокси)карбонил]амино]бутановой кислоты (500 мг; 2,460 ммоль; 1 экв.) в DCM (15 мл; 1 экв.) перемешивали в течение ночи при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (1000 мг) очищали препаративной HPLC в приведенных далее условиях (0-20% H2O в ACN), получая трет-бутил N-[(2R)-1-(диметилкарбамоил)пропан-2-ил]карбамат (550 мг; 1,35%) в виде бесцветного масла. LCMS: m/z (ESI), [М+Н]+ = 231,0. 1Н ЯМР (300 МГц, хлороформ-d) δ 1.27 (3Н, d), 1.44 (9Н, s), 2.47 (1H, d), 2.64 (1H, d), 2.95 (3Н, s), 3.04 (3Н, s), 4.02 (1H, d).
Стадия 2. (3R)-3-Амино-N,N-диметилбутанамид
Смесь TFA (1,00 мл; 13,463 ммоль; 15,50 экв.) и трет-бутил N-[(2R)-1-(диметилкарбамоил)пропан-2-ил]карбамата (200 мг; 0,868 ммоль; 1 экв.) в DCM (3 мл) перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении, получая (3R)-3-амино-N,N-диметилбутанамид (100 мг; 88,45%) в виде розового масла. 1H ЯМР (300 МГц, хлороформ-d) δ 1.47 (3Н, d), 2.76 (2Н, d), 3.00 (3Н, s), 3.06 (3Н, s), 3.79 (1H, s), 7.81 (2Н, s).
Стадия 3. (3R)-3-[(3-Амино-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N-диметилбутанамид (соединение 236)
Смесь DIEA (245,95 мг; 1,903 ммоль; 8 экв.), Т3Р (454,12 мг; 1,427 ммоль; 6 экв.), (3R)-3-амино-N,N-диметилбутанамида (123,88 мг; 0,952 ммоль; 4 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,238 ммоль; 1 экв.) в DMF (3 мл) перемешивали в течение ночи при комнатной температуре в воздушной атмосфере. Требуемый продукт можно было обнаружить посредством LCMS. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А:, подвижная фаза В: МеОН для HPLC; скорость потока: 20 мл/мин; градиент: от 47% В до 59% В за 8 мин; 254/220 нм; Rt: 7,40 мин), получая (3R)-3-[(3-амино-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N-диметилбутанамид (соединение 236) (60 мг; 55,12%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 449,3. 1H ЯМР (300 МГц, DMSC-d6) δ 1.23 (3Н, d), 2.46-2.49 (3Н, m), 2.58 (1H, d), 2.76-2.83 (4Н, m), 3.00 (3Н, s), 4.39 (1H, s), 7.15 (1Н, d), 7.39 (2Н, d), 7.49 (1H, d), 7.93 (2Н, s), 8.28 (1H, d), 8.38 (1H, d), 9.02 (1H, d).
Примеры 247-1/247-2. Получение 3-амино-N-((1,2-диметилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединений 247-1/247-2)
СХЕМА 113
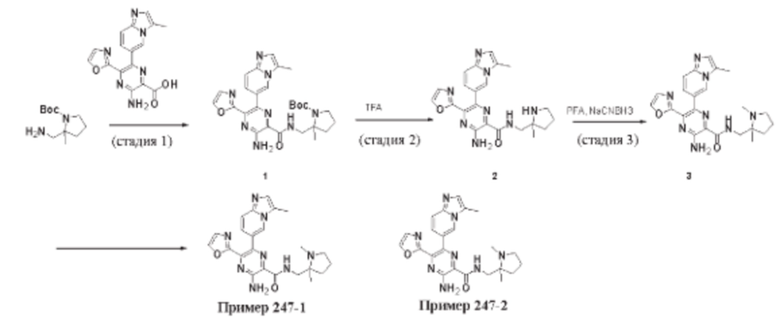
Стадия 1. трет-бутил 2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-2-метилпирролидин-1-карбоксилат
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (200 мг; 0,595 ммоль; 1 экв.) и трет-бутил 2-(аминометил)-2-метилпирролидин-1-карбоксилата (254,89 мг; 1,189 ммоль; 2 экв.) в DMF по каплям добавляли Т3Р (946,09 мг; 2,973 ммоль; 5 экв.) и DIEA (307,44 мг; 2,379 ммоль; 4 экв.) при 25°С в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 25°С в атмосфере азота. Полученную смесь разбавляли водой (50 мл), экстрагировали CH2Cl2 (3×50 мл). Объединенные органические слои промывали рассолом (3×50 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной ТГС (CH2Cl2/МеОН, 20:1), получая трет-бутил 2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-2-метилпирролидин-1-карбоксилат (280 мг; 88,40%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 533,3. 1Н ЯМР (300 МГц, MeOD-d4) δ 1.18 (5Н, s), 1.40 (7Н, d), 1.81 (2Н, d), 2.49 (3Н, d), 3.49 (1H, s), 3.63 (1H, t), 3.80 (1Н, d), 7.23-7.41 (3Н, m), 7.49 (1H, d), 8.00 (1H, s), 8.30 (1H, s).
Стадия 2. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[(2-метилпирролидин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору трет-бутил 2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-2-метилпирролидин-1-карбоксилата (280 мг) в DCM добавляли TFA (1,5 мл) при 25°С в атмосфере азота. Полученную смесь перемешивали в течение 30 мин при 25°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении, получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[(2-метилпирролидин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (200 мг; 87,96%). LCMS: m/z (ESI), [М+Н]+ = 433,2.
Стадия 3. трет-бутил 2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-2-метилпирролидин-1-карбоксилат
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[(2-метилпирролидин-2-ил)метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (200 мг; 0,462 ммоль; 1 экв.) и PFA (138,73 мг; 4,624 ммоль; 10 экв.) в МеОН (8 мл) по каплям добавляли NaBH3CN (145,30 мг; 2,312 ммоль; 5 экв.) и DIE А (239,07 мг; 1,850 ммоль; 4 экв.) при 25°С в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 25°С в атмосфере азота. Реакционную смесь очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная Atlantis Т3 OBD, 19*150 мм, 5 мкм; подвижная фаза А: вода, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 10% В до 20% В за 7 мин; 254/220 нм; Rt: 6,08 мин), получая 3-амино-N-[(1,2-диметилпирролидин-2-ил)метил]-6-[3-метилимидазо [1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (100 мг; 58,12%) в виде желтого твердого вещества.
Стадия 4. трет-бутил 2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]-2-метилпирролидин-1-карбоксилат (соединения 247-1/247-2)
Продукт (100 мг) очищали хиральной препаративной HPLC в приведенных далее условиях (колонка: CHIRALPAK IG, 5*25 см, 5 мкм; подвижная фаза A: Hex:DCM, 3:1 (с 10 мМ NH3-MEOH) для HPLC, подвижная фаза В: EtOH для HPLC; скорость потока: 20 мл/мин; градиент: от 40 В до 40 В за 10 мин; 220/254 нм; Rt1: 6,193, Rt2: 7,693), получая 3-амино-N-[(1,2-диметилпирролидин-2-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 247-1) (30 мг; 30,0%) и 3-амино-N-[(1,2-диметилпирролидин-2-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 247-2) (30 мг; 30,0%) в виде желтого твердого вещества.
(Соединение 247-1): LCMS: m/z (ESI), [М+Н]+ = 447,2. 1Н ЯМР (300 МГц, MeOD-d4) δ 1.05 (3Н, s), 1.56-1.68 (1H, m), 1.77 (2Н, р), 1.85-1.97 (1H, m), 2.33 (3Н, s), 2.49 (3Н, d), 2.58-2.69 (1H, m), 2.97 (1Н, s), 3.25 (1Н, s), 3.53 (1H, d), 7.26 (1H, dd), 7.32 (1H, d), 7.39 (1H, s), 7.49 (1H, d), 8.00 (1H, d), 8.35 (1H, s).
(Соединение 247-2): ECMS: m/z (ESI), [М+Н]+ = 447,4. 1Н ЯМР (300 МГц, MeOD-d4) δ 1.05 (3Н, s), 1.56-1.68 (1H, m), 1.77 (2Н, р), 1.85-1.97 (1H, m), 2.33 (3Н, s), 2.49 (3Н, d), 2.58-2.69 (1H, m), 2.97 (1H, s), 3.25 (1Н, s), 3.53 (1H, d), 7.26-7.39 (3Н, m), 7.49 (1H, d), 8.00 (1H, d), 8.35 (1H, s).
Пример 257. Получение (2R)-N-[[3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамида (соединения 257)
СХЕМА 114
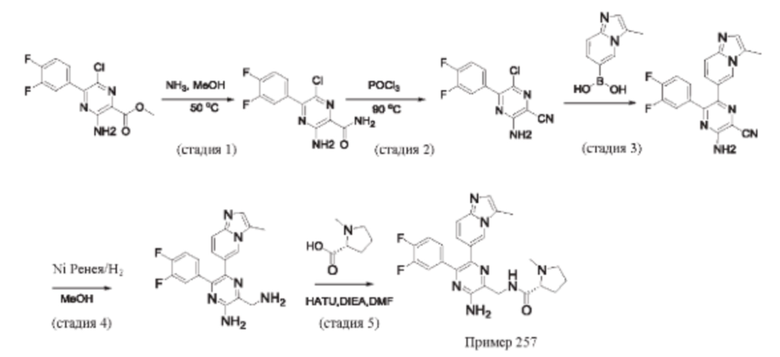
Стадия 1. 3-Амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбоксамид
К раствору NH3 (газ.) в МеОН (15 мл) порциями добавляли метил 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбоксилат (1000 мг; 3,337 ммоль; 1 экв.) при комнатной температуре. Смесь перемешивали в течение 5 ч при 50°С в воздушной атмосфере. Полученную смесь концентрировали под вакуумом, получая 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбоксамид (930 мг; 97,90%) в виде желтого твердого вещества. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+ = 285,2. 1H ЯМР (400 МГц, DMSO-d6) δ 7.55-7.67 (3Н, m), 7.74-7.85 (3Н, m), 8.04 (1H, s).
Стадия 2. 3-Амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбонитрил
К раствору фосфорилтрихлорида (5 мл) порциями добавляли 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбоксамид (900 мг; 3,162 ммоль; 1 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при 90°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток растворяли, используя CH2Cl2 (100 мл), и подщелачивали до рН 8 насыщенным раствором (водн.) NaHCO3. Полученную смесь экстрагировали CH2Cl2 (2×100 мл). Объединенные органические слои промывали водой (2×30 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью PE/EtOAc (6:1), получая 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбонитрил (550 мг; 65,24%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 267,0. 1H ЯМР (400 МГц, DMSO-d6) δ 7.56-7.68 (2Н, m), 7.73 (2Н, s), 7.75-7.85 (1Н, m).
Стадия 3. 3-Амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрил
К перемешиваемой смеси 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбонитрила (400 мг; 1,500 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (395,99 мг; 2,250 ммоль; 1,5 экв.) в диоксане (50 мл) порциями добавляли Cs2CO3 (977,56 мг; 3,000 ммоль; 2 экв.) и Pd(dppf)Cl2 (219,53 мг; 0,300 ммоль; 0,2 экв.) при 90°С в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 90°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрил (400 мг; 55,19%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 363,3.
Стадия 4. 3-(Аминометил)-6-(3,4-дифторфенил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-амин
К раствору 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрила (400 мг; 1,104 ммоль; 1 экв.) в МеОН (50 мл) порциями добавляли Ni Ренея (189,16 мг; 2,208 ммоль; 2,00 экв.) при комнатной температуре. Смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (2×50 мл). Фильтрат концентрировали под вакуумом, получая 3-(аминометил)-6-(3,4-дифторфенил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-амин (300 мг; 74,17%) в виде бежевого твердого вещества. Неочищенный продукт использовали на следующей стадии непосредственно без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+ = 367,3.
Стадия 5. (2R)-N-[[3-Амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (соединение 257)
К перемешиваемой смеси 3-(аминометил)-5-хлор-6-(3,4-дифторфенил)пиразин-2-амина (100 мг; 0,369 ммоль; 1 экв.) и (2R)-1-метилпирролидин-2-карбоновой кислоты (95,44 мг; 0,739 ммоль; 2 экв.) в DMF (10 мл) порциями добавляли HATU (210,72 мг; 0,554 ммоль; 1,5 экв.) и DIEA (191,00 мг; 1,478 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: Kinetex EVO С18, 30*150, 5 мкм; подвижная фаза А: 5%-ный аммиак в воде, подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 30% В до 50% В за 7 мин; 254/220 нм; Rt: 5,95 мин), получая (2R)-N-[[3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (41 мг; 23,17%) (соединение 257) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 478,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.64-1.83 (3Н, m), 2.03-2.19 (1H, m), 2.21-2.39 (7Н, m), 2.81 (1Н, dd), 3.04 (1Н, dt), 4.32-4.49 (2Н, m), 6.75 (2Н, s), 6.98 (1H, dd), 7.15-7.24 (1H, m), 7.33-7.44 (3Н, m), 7.49 (1H, ddd), 8.07-8.13 (1H, m), 8.45 (1H, t).
Пример 259. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-фенилпиразин-2-карбоксамида (соединения 259)
СХЕМА 115
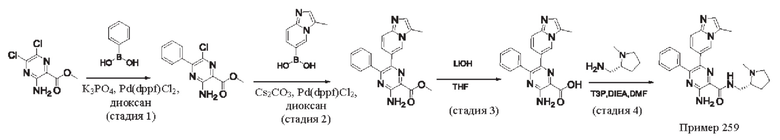
Стадия 1. метил 3-амино-6-хлор-5-фенилпиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (600 мг; 2,702 ммоль; 1 экв.) и фенилбороновой кислоты (336,09 мг; 2,756 ммоль; 1,02 экв.) в диоксане (20 мл) порциями добавляли K3PO4 (1147,23 мг; 5,405 ммоль; 2 экв.) и Pd(dppf)Cl2 (395,46 мг; 0,540 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 70°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:1), получая метил 3-амино-6-хлор-5-фенилпиразин-2-карбоксилат (400 мг; 56,14%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 264,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 3.89 (3Н, s), 7.53 (3Н, dd), 7.61 (2Н, s), 7.71-7.78 (2Н, m).
Стадия 2. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-фенилпиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-фенилпиразин-2-карбоксилата (150 мг; 0,569 ммоль; 1 экв.) и [3-метилимидазо [1,2-а]пиридин-6-ил]бороновой кислоты (200,22 мг; 1,138 ммоль; 2 экв.) в диоксане (10 мл) порциями добавляли Cs2CO3 (556,05 мг; 1,707 ммоль; 3 экв.) и Pd(dppf)Cl2 (83,25 мг; 0,114 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 80°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/MeOH, 20:1), получая метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-фенилпиразин-2-карбоксилат (130 мг; 63,59%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 360,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.27 (3Н, d), 3.91 (3Н, s), 7.09 (1H, dd), 7.34-7.48 (7Н, m), 7.55 (2Н, d), 8.00 (1H, dd).
Стадия 3. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-фенилпиразин-2-карбоновая кислота
К раствору метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-фенилпиразин-2-карбоксилата (130 мг; 0,417 ммоль; 1 экв.) в THF (15 мл) и метаноле (5 мл) добавляли LiOH (19,99 мг; 0,835 ммоль; 2,00 экв.) при комнатной температуре. Смесь перемешивали в течение 2,5 ч при 50°С в воздушной атмосфере. Смесь подкисляли до рН 6, используя раствор HCl (водн.). Полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-фенилпиразин-2-карбоновую кислоту (100 мг; 80,05%) в виде желтого твердого вещества. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+ = 346,2.
Стадия 4. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-фенилпиразин-2-карбоксамид (соединение 259)
К перемешиваемой смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-фенилпиразин-2-карбоновой кислоты (100 мг; 0,290 ммоль; 1 экв.) и 1-[(2R)-1-метилпирролидин-2-ил]метанамина (66,13 мг; 0,579 ммоль; 2 экв.) в DMF (5 мл) порциями добавляли DIEA (112,27 мг; 0,869 ммоль; 3 экв.) и Т3Р (368,52 мг; 1,158 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 2,5 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 38% В до 50% В за 8 мин; 254/220 нм; Rt: 7,65 мин), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]-5-фенилпиразин-2-карбоксамид (соединение 259) (33 мг; 25,81%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 442,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.54-1.71 (3Н, m), 1.79-1.90 (1H, m), 2.16 (1H, q), 2.33 (6Н, d), 2.41-2.48 (1H, m), 2.96 (1H, dd), 3.26 (1H, dt), 3.51 (1H, ddd), 7.05 (1Н, dd), 7.33-7.46 (5Н, m), 7.43-7.51 (2Н, m), 7.73 (2Н, s), 8.14-8.20 (1H, m), 8.64 (1H, t).
Пример 261. Получение 3-амино-N-((6-(3-((диметиламино)метил)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 261)
СХЕМА 116
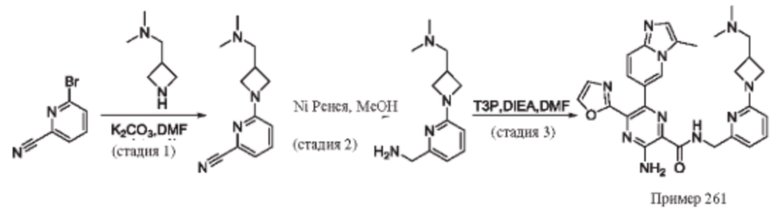
Стадия 1. 6-(3-((Диметиламино)метил)азетидин-1-ил)пиколинонитрил
В круглодонную колбу емкостью 50 мл помещали 6-бромпиридин-2-карбонитрил (423,10 мг; 2,312 ммоль; 1,10 экв.), DMF (4 мл; 51,687 ммоль; 24,59 экв.), K2CO3 (871,41 мг; 6,305 ммоль; 3 экв.), [(азетидин-3-ил)метил]диметиламин (240 мг; 2,102 ммоль; 1 экв.). Полученный раствор перемешивали в течение 16 ч при 50°С. Полученный раствор экстрагировали этилацетатом (3×10 мл), органические слои объединяли и концентрировали. Остаток наносили на колонку с силикагелем, используя смесь дихлорметан/метанол (8:1). В результате получали 190 мг (41,80%) 6-[3-[(диметиламино)метил]азетидин-1-ил]пиридин-2-карбонитрила в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 217,1. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.13 (6Н, s), 2.47-2.49 (2Н, m), 2.84-2.91 (1Н, m), 3.62 (2Н, t), 4.06 (2Н, t), 6.65 (1H, d), 7.16 (1Н, d), 7.64 (1H, t).
Стадия 2. 1-(1-(6-(Аминометил)пиридин-2-ил)азетидин-3-ил)-N,N-диметилметанамин
В круглодонную колбу емкостью 50 мл помещали МеОН (5 мл; 0,094 ммоль; 2,03 экв.), Ni Ренея (0,75 мг; 0,009 ммоль; 0,01 экв.), 6-[3-[(диметиламино)метил]азетидин-1-ил]пиридин-2-карбонитрил (190 мг; 0,878 ммоль; 1 экв.), NH4OH (1 мл; 25,681 ммоль; 29,23 экв.). Полученный раствор перемешивали в течение 1 ч при комнатной температуре. В результате получали 40 мг (20,67%) 1-(6-[3-[(диметиламино)метил]азетидин-1-ил]пиридин-2-ил)метанамина в виде коричнево-желтого масла. LCMS: m/z (ESI), [М+Н]+ = 220,95. 1Н ЯМР (400 МГц, DMSO-d6) δ 2.13 (6Н, s), 2.46 (2Н, d), 2.83 (1Н, dt), 3.53 (2Н, dd), 3.59 (2Н, s), 3.98 (2Н, t), 6.17 (1H, d), 6.64 (1H, d), 7.43 (1Н, t).
Стадия 3. 3-Амино-N-((6-(3-((диметиламино)метил)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 261)
В круглодонную колбу емкостью 25 мл помещали 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (80 мг; 0,238 ммоль; 1 экв.), DMF (0,041 ммоль; 0,17 экв.), DIEA (307,44 мг; 2,379 ммоль; 10 экв.), Т3Р (454,12 мг; 1,427 ммоль; 6 экв.), 1-(6-[3-[(диметиламино)метил]азетидин-1-ил]пиридин-2-ил)метанамин (104,82 мг; 0,476 ммоль; 2 экв.). Полученный раствор перемешивали в течение 16 ч при комнатной температуре. Полученный раствор разбавляли водой (15 мл), экстрагировали дихлорметаном (3×10 мл), органические слои объединяли и концентрировали. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: С18-колонка Kinetex EVO, 30*150, 5 мкм; подвижная фаза А:, подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 30% В до 40% В за 7 мин; 254/220 нм; Rt: 5,82 мин) и получали продукт. В результате получали 23,6 мг (18,42%) 3-амино-N-[(6-[3-[(диметиламино)метил]азетидин-1-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 261) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 539,5. 1H ЯМР (400 МГц, метанол-d4) δ 2.23 (6Н, s), 2.42 (2Н, d), 2.53 (3Н, d), 2.71-2.80 (1H, m), 3.53 (2Н, dd), 4.00 (2Н, t), 4.56 (2Н, s), 6.27 (1H, d), 6.67 (1H, d), 7.27-7.36 (2Н, m), 7.43 (1H, d), 7.46-7.56 (2Н, m), 8.02 (1H, d), 8.41 (1H, s).
Пример 268. Получение (2S)-N-[[3-амино-5-(4-фторфенил)-6-[3-метил-имидазо-[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]оксолан-2-карбоксамида (соединения 268)
СХЕМА 117

Стадия 1. 3-Амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксамид
В герметично закрываемую пробирку емкостью 50 мл добавляли метил 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксилат (2,0 г; 7,10 ммоль; 1 экв.) и NH3 (газ.) в МеОН (30 мл; 7,0 ммоль/л) при комнатной температуре, нагревали в течение 5 ч при 50°С, концентрировали, получая 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксамид (1,5 г; 79%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 267,0.
Стадия 2. 3-Амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрил
К перемешиваемому раствору POCl3 (20 мл) порциями добавляли 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбоксамид (5,0 г; 18,750 ммоль; 1 экв.) при 0°С, перемешивали в течение 3 ч при 90°С, концентрировали. Остаток растворяли в DCM (300 мл), добавляли раствор NaHCO3 (водн.) до рН 8,0. Водный слой экстрагировали DCM (3×50 мл), объединенный органический слой сушили и концентрировали, получая 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрил (3,5 г; 75%) в виде светло-коричневого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 249,2.
Стадия 3. 3-Амино-5-(4-фторфенил)-6-[3-метил-имидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрил
К перемешиваемой смеси 3-амино-6-хлор-5-(4-фторфенил)пиразин-2-карбонитрила (500 мг; 2,01 ммоль; 1 экв.), [3-метилимидазо [1,2-а]пиридин-6-ил]бороновой кислоты (530,81 мг; 3,02 ммоль; 1,5 экв.) и Pd(dppf)Cl2 (147 мг; 0,20 ммоль; 0,1 экв.) в диоксане (15 мл) порциями добавляли K3PO4 (854 мг; 4,02 ммоль; 2,0 экв.) в Н2О (2,5 мл) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 90°С, концентрировали и очищали препаративной TLC (DCM/MeOH, 40/1), получая 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрил (300 мг; 43%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 345,2.
Стадия 4. (2S)-N-[[3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид
К перемешиваемой смеси 3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрила (500 мг; 1,45 ммоль; 1 экв.) и Ni Ренея (62 мг; 0,73 ммоль; 0,5 экв.) в этаноле (10 мл) добавляли NH3.H2O (1,0 мл) при комнатной температуре в атмосфере водорода, перемешивали в течение 2 ч при комнатной температуре. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3×30 мл). Фильтрат концентрировали при пониженном давлении, получая 3-(аминометил)-6-(4-фторфенил)-5-[3-метил-имидазо[1,2-а]пиридин-6-ил]пиразин-2-амин (450 мг; 89%) в виде светло-коричневого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ 2.28 (3Н, d), 4.65 (2Н, d), 5.47 (1Н, t), 6.77 (1H, dd), 6.96 (2Н, s), 7.34 (2Н, m), 7.63 (1H, dd).
Стадия 5. (2S)-N-[[3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]оксолан-2-карбоксамид (соединение 268)
Раствор (2S)-оксолан-2-карбоновой кислоты (66,66 мг; 0,57 ммоль; 2,0 экв.) в DMF (2,0 мл) обрабатывали HATU (218 мг; 0,57 ммоль; 2,0 экв.) в течение 20 мин при комнатной температуре, затем по каплям добавляли 3-(аминометил)-6-(4-фторфенил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-амин (100 мг; 0,29 ммоль; 1 экв.), DIEA (111 мг; 0,86 ммоль; 3,0 экв.) при комнатной температуре, перемешивали в течение 2 ч, гасили водой (20 мл), экстрагировали DCM (3×20 мл), сушили и концентрировали, затем очищали препаративной TLC, получая (2S)-N-[[3-амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]оксолан-2-карбоксамид (соединение 268) (45,2 мг; 35%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 447,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.80 (2Н, q), 1.91 (1Н, m), 2.14 (1H, dq), 2.32 (3Н, d), 3.78 (1H, q), 3.94 (1H, q), 4.37 (3Н, m), 6.69 (2Н, s), 6.96 (1H, dd), 7.17 (2Н, t), 7.35 (2Н, dd), 7.42 (2Н, m), 8.06 (1H, d), 8.40 (1Н, t).
Пример 272. Получение 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]пиразин-2-карбоксамида (соединения 272)
СХЕМА 118
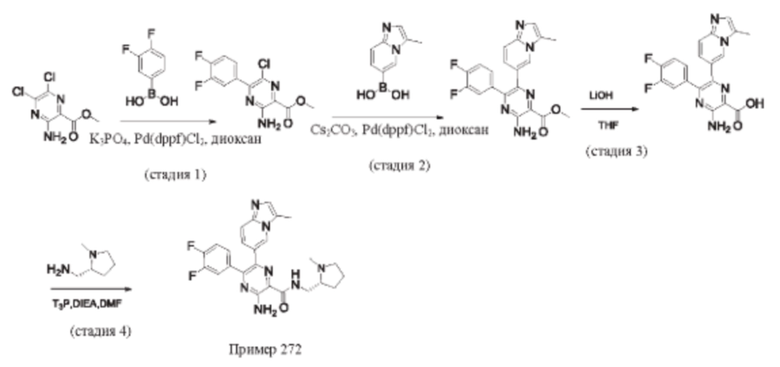
Стадия 1. метил 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (2000 мг; 9,008 ммоль; 1 экв.) и (3,4-дифторфенил)бороновой кислоты (1450,87 мг; 9,188 ммоль; 1,02 экв.) в диоксане (100 мл) порциями добавляли K3PO4 (3824,10 мг; 18,016 ммоль; 2 экв.) и Pd(dppf)Cl2 (1318,20 мг; 1,802 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 70°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью PE/EtOAc (5:1), получая метил 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбоксилат (1500 мг; 55,57%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 300,2. 1Н-ЯМР (400 МГц, DMSO-d6) δ 3.89 (3Н, s), 7.54-7.72 (4Н, m), 7.78-7.89 (1Н, m).
Стадия 2. 3-Амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-6-хлор-5-(3,4-дифторфенил)пиразин-2-карбоксилата (400 мг; 1,335 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (469,81 мг; 2,670 ммоль; 2 экв.) в диоксане (40 мл) порциями добавляли Cs2CO3 (869,84 мг; 2,670 ммоль; 2 экв.) и Pd(dppf)Cl2 (195,34 мг; 0,267 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при 80°С в атмосфере азота. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 20:1), получая метил 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксилат (300 мг; 56,84%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 396,3.
Стадия 3. 3-Амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновая кислота
К раствору метил 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоксилата (200 мг; 0,506 ммоль; 1 экв.) в THF (20 мл) и метаноле (5 мл) добавляли LiOH (48,46 мг; 2,023 ммоль; 4 экв.) при комнатной температуре. Смесь перемешивали в течение 3 ч при комнатной температуре в воздушной атмосфере и подкисляли до рН 6, используя раствор HCl (водн.). Полученное твердое вещество собирали фильтрованием и сушили под вакуумом, получая 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновую кислоту (150 мг; 77,76%) в виде желтого твердого вещества. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+ = 382,2.
Стадия 4. 3-Амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[(2R-1-метилпирролидин-2-ил]метил]пиразин-2-карбоксамид (соединение 272)
К перемешиваемой смеси 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбоновой кислоты (150 мг; 0,393 ммоль; 1 экв.) и 1-[(2R)-1-метилпирролидин-2-ил]метанамина (89,83 мг; 0,787 ммоль; 2 экв.) в DMF (15 мл) порциями добавляли DIEA (152,51 мг; 1,180 ммоль; 3 экв.) и Т3Р (500,62 мг; 1,573 ммоль; 4 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь перемешивали в течение 3 ч при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: 5%-ный водный раствор аммиака, подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 36% В до 49% В за 7 мин; 254/220 нм; Rt: 6,83 мин), получая 3-амино-5-(3,4-дифторфенил)-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-N-[[(2R)-1-метилпирролидин-2-ил]метил]пиразин-2-карбоксамид (соединение 272) (23 мг; 12,25%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 478,3. 1H ЯМР (400 МГц, DMSO-d6) δ 1.53-1.70 (3Н, m), 1.78-1.89 (1H, m), 2.15 (1H, q), 2.32 (3Н, s), 2.41 (3Н, s), 2.41-2.49 (1H, m), 2.95 (1H, dd), 3.25 (1H, dt), 3.50 (1H, ddd), 6.99 (1Н, dd), 7.26 (1Н, t), 7.38-7.49 (3Н, m), 7.57 (1H, ddd), 7.77 (2Н, s), 8.29 (1H, d), 8.66 (1H, t).
Пример 273. Получение 3-амино-N-[[(3S)-1-(диметилкарбамоил)пирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 273)
СХЕМА 119
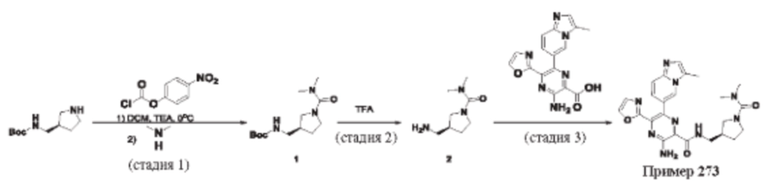
Стадия 1. трет-бутил N-[[(3S)-1-(диметилкарбамоил)пирролидин-3-ил]метил]карбамат
Смесь TEA (854,86 мг; 8,448 ммоль; 5 экв.), гидрохлорида диметиламина (206,66 мг; 2,534 ммоль; 1,50 экв.), 4-нитрофенил-хлорформиата (408,67 мг; 2,028 ммоль; 1,20 экв.) и гидрохлорида трет-бутил N-[[(3R)-пирролидин-3-ил]метил]карбамата (400 мг; 1,690 ммоль; 1 экв.) в ACN (20 мл) перемешивали в течение ночи при 70°С в воздушной атмосфере. Полученную смесь разбавляли водой (50 мл) и экстрагировали EtOAc (3×50 мл). Объединенные органические слои промывали рассолом (3×50 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:1), получая трет-бутил N-[[(3S)-1-(диметилкарбамоил)пирролидин-3-ил]метил]карбамат (370 мг; 80,70%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+ = 272,1. 1Н-ЯМР (300 МГц, хлороформ-d) δ 1.47 (9Н, s), 1.56-1.70 (1H, m), 1.91-2.04 (1H, m), 2.27-2.43 (1Н, m), 2.86 (6Н, s), 3.16 (3Н, d), 3.46 (3Н, q).
Стадия 2. (3S)-3-(Аминометил)-N,N-диметилпирролидин-1-карбоксамид
Смесь TFA (2 мл; 26,926 ммоль; 42,98 экв.) и трет-бутил N-[[(3S)-1-(диметилкарбамоил)пирролидин-3-ил]метил]карбамата (170 мг; 0,626 ммоль; 1 экв.) в DCM (5 мл) перемешивали в течение 1 ч при комнатной температуре в воздушной атмосфере. Требуемый продукт можно было обнаружить посредством LCMS. Полученную смесь концентрировали при пониженном давлении, получая (3S)-3-(аминометил)-N,N-диметилпирролидин-1-карбоксамид (100 мг; 93,21%) в виде бесцветного масла. LCMS: m/z. 1H ЯМР (300 МГц, хлороформ-d) δ 1.71 (1H, s), 2.14 (1H, s), 2.59 (1H, s), 2.90 (6Н, s), 3.00 (1H, s), 3.18 (1H, s), 3.36 (1H, s), 3.50 (3Н, q).
Стадия 3. 3-Амино-N-[[(3S)-1-(диметилкарбамоил)пирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 273)
Смесь DIEA (184,46 мг; 1,427 ммоль; 6 экв.), Т3Р (227,06 мг; 0,714 ммоль; 3 экв.), (3S)-3-(аминометил)-N,N-диметилпирролидин-1-карбоксамида (81,47 мг; 0,476 ммоль; 2 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,238 ммоль; 1 экв.) в DMF (3 мл) перемешивали в течение ночи при комнатной температуре в воздушной атмосфере. Полученную смесь разбавляли водой (30 мл) и насыщ. раствором NaHCO3 (30 мл), экстрагировали CH2Cl2 (3×40 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 12:1), получая неочищенный продукт. Неочищенный продукт (100 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: Kinetex EVO С18, 30*150, 5 мкм; подвижная фаза А:, подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 15% В до 35% В за 7 мин; 254/220 нм; Rt: 6,93 мин), получая 3-амино-N-[[(3S)-1-(диметилкарбамоил)пирролидин-3-ил]метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 273) (20 мг; 17,00%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 490,4. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.60 (1H, d), 1.82-1.92 (1H, m), 2.44 (4Н, d), 2.70 (6Н, s), 3.11 (1H, d), 3.23-3.35 (4Н, m), 3.37 (1H, s), 7.24 (1H, d), 7.38 (2Н, d), 7.49 (1H, d), 7.90 (1Н, s), 8.28 (1Н, d), 8.32-8.39 (1H, m), 8.98 (1H, t).
Пример 276. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[6-(морфолин-4-ил)пиридин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 276)
СХЕМА 120
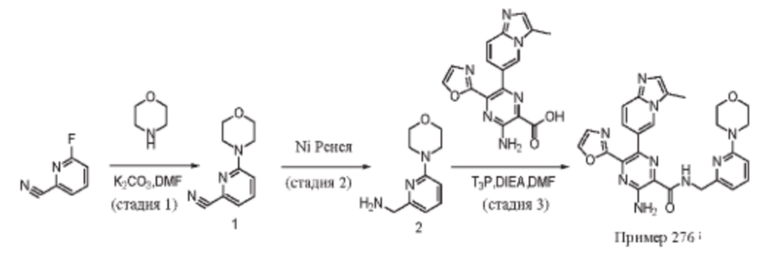
Стадия 1. 6-(Морфолин-4-ил)пиридин-2-карбонитрил
В круглодонную колбу емкостью 40 мл добавляли 6-фторпиридин-2-карбонитрил (1 г; 8,190 ммоль; 1 экв.), морфолин (1,43 г; 0,016 ммоль; 2 экв.) и K2CO3 (2,26 г; 0,016 ммоль; 2 экв.) в DMF (15 мл) при комнатной температуре. Полученную смесь перемешивали в течение 6 ч при 80°С. Реакцию гасили водой при комнатной температуре. Выпавшие в осадок твердые вещества собирали фильтрованием и промывали водой (1×100 мл), сушили под вакуумом, получая 6-(морфолин-4-ил)пиридин-2-карбонитрил (1,5 г; 96,79%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 190,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 3.46 (4Н, dd), 3.66 (4Н, dd), 7.18 (2Н, m), 7.70 (1H, dd).
Стадия 2. 1-[6-(Морфолин-4-ил)пиридин-2-ил]метанамин
К раствору 6-(морфолин-4-ил)пиридин-2-карбонитрила (200 мг; 1,057 ммоль; 1 экв.) в МеОН (15 мл) и NH3.H2O (1 мл) порциями добавляли Ni Ренея (271,67 мг; 3,171 ммоль; 3 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3×10 мл). Фильтрат концентрировали при пониженном давлении, получая 1-[6-(морфолин-4-ил)пиридин-2-ил]метанамин (150 мг; 73,44%) в виде пурпурного масла, которое использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+ = 194,3.
Стадия 3. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[6-(морфолин-4-ил)пиридин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 276)
К раствору 1-[6-(морфолин-4-ил)пиридин-2-ил]метанамина (172,39 мг; 0,892 ммоль; 2 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (150 мг; 0,446 ммоль; 1 экв.) в DMF (15 мл) по каплям добавляли Т3Р (283,83 мг; 0,892 ммоль; 2 экв.) и DIEA (115,29 мг; 0,892 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 30 мин при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 31% В до 50% В за 8 мин; 220/254 нм; Rt: 8,15 мин), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[6-(морфолин-4-ил)пиридин-2-ил]метил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 276) (60 мг; 26,30%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 512,4. 1Н ЯМР: (300 МГц, DMSO-d6) δ 2.40 (3Н, d), 3.35 (4Н, s), 3.47 (4Н, dd), 4.47 (2Н, d), 6.65 (2Н, t), 7.31 (3Н, m), 7.49 (2Н, m), 7.90 (2Н, s), 8.26 (1H, d), 8.33 (1H, m), 9.33 (1H, t).
Пример 278. Получение (R)-N-((3-амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида (соединения 278)
СХЕМА 121
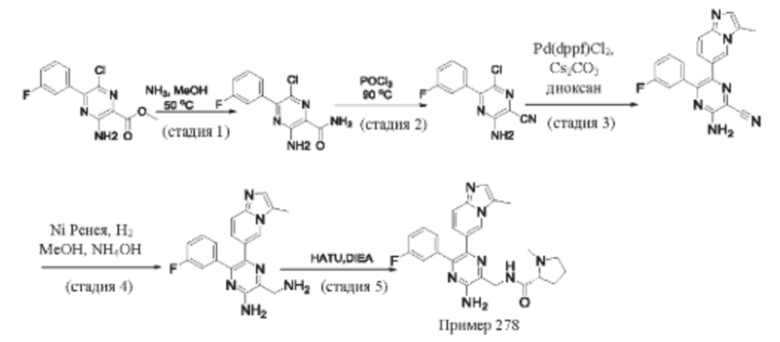
Стадия 1. Получение 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбоксамида
К перемешиваемому 30%-ному раствору NH3 (газ.) в МеОН (20 мл) порциями добавляли метил 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбоксилат (900 мг) при комнатной температуре. Полученную смесь перемешивали в течение 4 ч при 50°С. Полученную смесь концентрировали под вакуумом, получая 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбоксамид (600 мг) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 267,0. 1Н ЯМР (400 МГц, хлороформ-d) δ 7.21 (1H, m), 7.42-7.58 (2Н, m), 7.62 (1H, m).
Стадия 2. 3-Амино-6-хлор-5-(3-фторфенил)пиразин-2-карбонитрил
К перемешиваемому раствору фосфорилтрихлорида (2 мл) порциями добавляли 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбоксамид (30 мг) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при 90°С. Полученную смесь концентрировали при пониженном давлении и разбавляли DCM (20 мл). Реакцию гасили насыщ. раствором (водн.) NaHCO3 при комнатной температуре. Полученную смесь экстрагировали CH2Cl2 (2×30 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/EtOAC, 5:1), получая 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбонитрил (400 мг) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 249,0. 1Н ЯМР (300 МГц, хлороформ-d) δ 5.32 (2Н, d), 7.21 (1H, m), 7.42-7.56 (2Н, m), 7.61 (1H, m).
Стадия 3. 3-Амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбонитрил
К перемешиваемой смеси 3-амино-6-хлор-5-(3-фторфенил)пиразин-2-карбонитрила (350 мг; 1,408 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (371,56 мг; 2,111 ммоль; 1,50 экв.) в диоксане (20 мл) и Н2О (2 мл) порциями добавляли Cs2CO3 (1375,87 мг; 4,223 ммоль; 3 экв.) и Pd(dppf)Cl2 (205,99 мг; 0,282 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 90°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали CH2Cl2 (1×10 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 40:1), получая 3-амино-5-(3-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрил (300 мг; 61,89%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 345,2.
Стадия 4. 3-(Аминометил)-6-(3-фторфенил)-5-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-амин
К перемешиваемому раствору 3-амино-5-(3-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрила (20 мг; 0,058 ммоль; 1 экв.) и NH3.H2O (4,07 мг; 0,116 ммоль; 2,00 экв.) в EtOH (2 мл) порциями добавляли Ni Ренея (9,95 мг; 0,116 ммоль; 2,00 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали EtOH (1×10 мл). Фильтрат концентрировали при пониженном давлении, получая 3-(аминометил)-6-(3-фторфенил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-амин (180 мг; 71,17%) в виде коричнево-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 349,3.
Стадия 5. (R)-N-((3-Амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамид (соединение 278)
К перемешиваемой смеси (2R)-1-метилпирролидин-2-карбоновой кислоты (36,70 мг; 0,284 ммоль; 1,10 экв.) в DMF (10 мл) порциями добавляли HATU (196,45 мг; 0,517 ммоль; 2 экв.) и DIEA (133,55 мг; 1,033 ммоль; 4 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 10 мин при комнатной температуре. К этому перемешиваемому раствору порциями добавляли 3-(аминометил)-6-(3-фторфенил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-амин (90 мг; 0,258 ммоль; 1 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: 5%-ный NH3 в воде, подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 31% В до 43% В за 7 мин; 254/220 нм; Rt: 6,48 мин), получая (R)-N-((3-амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамид (соединение 278) (26 мг; 21,90%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 460,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.40-1.92 (3Н, m), 1.94-2.19 (1H, m), 2.22-2.39 (7Н, m), 2.81 (1H, dd), 3.05 (1H, dd), 4.26-4.53 (2Н, m), 6.73 (2Н, s), 7.02 (1H, dd), 7.09-7.51 (6Н, m), 7.91-8.18 (1H, m), 8.46 (1H, t).
Примеры 279/280. Получение 3-амино-N-((3-метокситетрагидрофуран-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединений 279/280)
СХЕМА 122
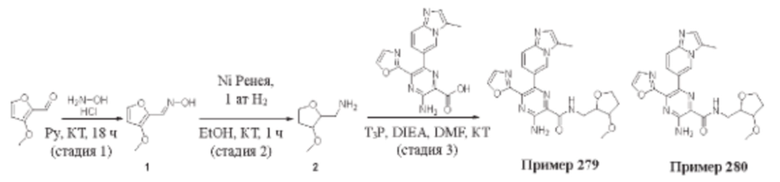
Стадия 1. 3-Метоксифуран-2-карбальдегидоксим
Смесь 3-метоксифуран-2-карбальдегида (252 мг; 1,998 ммоль; 1 экв.) и гидроксиламина гидрохлорида (210 мг; 3,022 ммоль; 1,51 экв.) в пиридине (4 мл) перемешивали при комнатной температуре в течение 18 ч. После концентрирования досуха остаток очищали на колонке (РЕ/ЕА, 2/1), получая N-[(3-метоксифуран-2-ил)метилиден]гидроксиламин (200 мг; 70,9%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 142,2.
Стадия 2. (3-Метокситетрагидрофуран-2-ил)метанамин
Смесь N-[(3-метоксифуран-2-ил)метилиден]гидроксиламина (460 мг; 3,26 ммоль; 1 экв.) и Ni Ренея (300 мг; 3,502 ммоль; 1,07 экв.) в этаноле (70 мл) гидрировали в атмосфере Н2 (1 ат (98,1 кПа)) при комнатной температуре в течение 1 ч. После фильтрования через целит фильтрат концентрировали досуха под вакуумом и остаток непосредственно использовали на следующей стадии. LCMS: m/z (ESI), [М+Н]+ = 132,2.
Стадия 3. 3-Амино-N-((3-метокситетрагидрофуран-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
К смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-пиразин-2-карбоновой кислоты (313 мг; 0,931 ммоль; 1 экв.) и 1-(3-метоксиоксолан-2-ил)метанамина (366 мг; 2,790 ммоль; 3,00 экв.) в 5 мл DMF добавляли DIEA (1,62 мл; 9,300 ммоль; 9,99 экв.) и 50%-ный (по массе) раствор Т3Р в этилацетате (1,77 г; 2,793 ммоль; 2,99 экв.). Смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь очищали препаративной HPLC (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 23% В до 33% В за 7 мин; 254/220 нм; Rt: 6,45 мин) и разделением на хиральном носителе (колонка: CHIRALPAK IG, 20×250 мм, 5 мкм; подвижная фаза A: Hex:DCM, 3:1 (с 10 мМ NH3-МеОН) для HPLC, подвижная фаза В: EtOH для HPLC; скорость потока: 20 мл/мин; градиент: от 30 В до 30 В за 50 мин; 254/220 нм; Rt1: 15,377; Rt2: 24,388), получая 3-амино-N-((3-метокситетрагидрофуран-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 279) (15 мг; 3,5%) и 3-амино-N-((3-метокситетрагидрофуран-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 280) (15 мг; 3,5%) в виде желтого твердого вещества. (Соединение 279) LCMS: m/z (ESI), [М+Н]+ = 450,2. 1Н-ЯМР (300 МГц, DMSO-d6) δ 1.93-2.00 (2Н, m), 2.40 (3Н, s), 3.25 (3Н, s), 3.41-3.48 (1H, m), 3.54-3.67 (2Н, m), 3.75-3.83 (1H, m), 3.91-3.99 (2Н, m), 7.20-7.23 (1H, d), 7.34 (1H, s), 7.38 (1H, s), 7.47-7.50 (1Н, d), 7.89 (2Н, brs), 8.25 (1H, s), 8.32 (1H, s), 8.66-8.70 (1H, t).
(Соединение 280) LCMS: m/z (ESI), [М+Н]+ = 450,1. 1Н-ЯМР (300 МГц, DMSO-d6) δ 1.93-1.99 (2Н, m), 2.40 (3Н, s), 3.24 (3Н, s), 3.41-3.48 (1Н, m), 3.54-3.66 (2Н, m), 3.75-3.83 (1H, m), 3.91-3.98 (2Н, m), 7.20-7.23 (1H, d), 7.34 (1H, s), 7.38 (1Н, s), 7.47-7.50 (1H, d), 7.89 (2Н, brs), 8.25 (1H, s), 8.32 (1H, s), 8.66-8.70 (1H, t).
Пример 281. Получение 3-[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N,2,2-тетраметилпропанамида (соединения 281)
СХЕМА 123

Стадия 1. 2-(5-Бром-2-оксо-1,2-дигидропиридин-1-ил)пропаннитрил
К перемешиваемой смеси 3-[[(трет-бутокси)карбонил]амино]-2,2-диметилпропановой кислоты (250 мг; 1,151 ммоль; 1 экв.), HATU (525,02 мг; 1,381 ммоль; 1,2 экв.) и DIEA (743,58 мг; 5,753 ммоль; 5 экв.) в DMF (5 мл) по каплям добавляли раствор диметиламина (1,15 мл; 2,301 ммоль; 2 экв.) при 0°С, после чего перемешивали в течение 2 ч при 0°С. Полученную смесь разбавляли EtOAc (30 мл). Объединенные органические слои промывали водой (3×10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении, получая трет-бутил N-[2-(диметилкарбамоил)-2,2-диметилэтил]карбамат (200 мг; 71,1%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 245,4.
Стадия 2. 3-Амино-N,N,2,2-тетраметилпропанамид
Во флакон емкостью 6 мл добавляли трет-бутил N-[2-(диметилкарбамоил)-2,2-диметилэтил]карбамат (190 мг; 0,778 ммоль; 1 экв.) и раствор хлористого водорода в диоксане (4 М; 5 мл) и диоксан (3 мл) при комнатной температуре. Затем смесь перемешивали при комнатной температуре в течение 1,5 ч. Реакционную смесь концентрировали, получая 3-амино-N,N,2,2-тетраметилпропанамид (110 мг; 98,0%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 145,4.
Стадия 3. 3-[(3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N,2,2-тетраметилпропанамид
Во флакон емкостью 6 мл добавляли 3-амино-N,N,2,2-тетраметилпропанамид (110 мг; 0,72 ммоль; 2 экв.), 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (120 мг; 0,36 ммоль; 1 экв.), HATU (164 мг; 0,432 ммоль; 1,2 экв.), DIEA (140 мг; 1,08 ммоль; 3 экв.) и DMF (1,5 мл) при комнатной температуре. Затем смесь перемешивали при комнатной температуре в течение 2 ч. Полученную смесь разбавляли EtOAc (20 мл). Остаток промывали рассолом (3×10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 25% В до 40% В за 7 мин; 254/220 нм; tR: 5,77 мин), получая 3-[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]-N,N,2,2-тетраметилпропанамид (10 мг; 6,0%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 463,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.26 (6Н, s), 2.47 (3Н, d), 2.95 (6Н, s), 3.44 (2Н, d), 7.11 (1H, dd), 7.38 (1H, d), 7.41 (1H, d), 7.49 (1H, dd), 7.91 (2Н, s), 8.28 (1H, d), 8.35 (1H, dd), 8.79 (1H, t).
Пример 284. Получение 3-амино-N-[(6-[6-метил-2,6-диазаспиро[3.3]гептан-2-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида (соединения 284)
СХЕМА 124
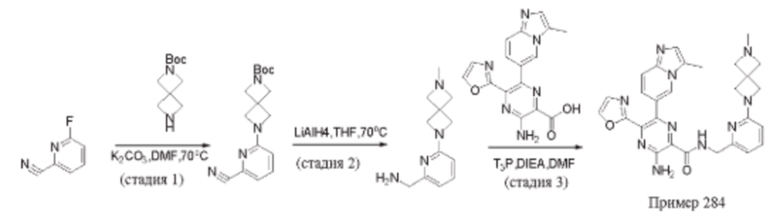
Стадия 1. трет-бутил 6-(6-цианопиридин-2-ил)-2,6-диазаспиро[3.3]гептан-2-карбоксилат
К смеси 6-фторпиридин-2-карбонитрила (1 г; 8,190 ммоль; 1 экв.) и трет-бутил 2,6-диазаспиро[3.3]гептан-2-карбоксилата (3,25 г; 16,380 ммоль; 2 экв.) в DMF (25 мл) порциями добавляли K2CO3 (2,26 г; 16,380 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при 50°С в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью РЕ/EtOAc (2:1), получая трет-бутил 6-(6-цианопиридин-2-ил)-2,6-диазаспиро[3.3]гептан-2-карбоксилат (1,2 г; 48,78%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 301,2. 1H-ЯМР (300 МГц, DMSO-d6) δ 1.38 (9Н, s), 4.03 (4Н, s), 4.12 (4Н, s), 6.68 (1H, dd), 7.20 (1H, dd), 7.67 (1H, dd).
Стадия 2. 1-(6-[6-Метил-2,6-диазаспиро[3.3]гептан-2-ил]пиридин-2-ил)метанамин
К раствору трет-бутил 6-(6-цианопиридин-2-ил)-2,6-диазаспиро[3.3]гептан-2-карбоксилата (300 мг; 0,999 ммоль; 1 экв.) в THF (15 мл) порциями добавляли LiAlH4; (189,54 мг; 4,994 ммоль; 5 экв.) при 0°С в воздушной атмосфере. Смесь перемешивали в течение 1 ч при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при 70°С в воздушной атмосфере. Реакционную смесь гасили, используя смесь вода/лед, при комнатной температуре и экстрагировали EtOAc (3×50 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении, получая 1-(6-[6-метил-2,6-диазаспиро[3.3]гептан-2-ил]пиридин-2-ил)метанамин (100 мг; 45,86%) в виде желтого масла. 1Н-ЯМР (300 МГц, DMSO-d6) δ 1.30 (2Н, d), 2.18 (3Н, s), 3.10 (4Н, d), 3.60 (2Н, s), 3.94 (4Н, s), 6.19 (1Н, d), 6.67 (1Н, d), 7.45 (1H, t).
Стадия 3. 3-Амино-N-[(6-[6-метил-2,6-диазаспиро[3.3]гептан-2-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 284)
К раствору 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (90 мг; 0,268 ммоль; 1 экв.) и 1-(6-[6-метил-2,6-диазаспиро[3.3]гептан-2-ил]пиридин-2-ил)метанамина (116,84 мг; 0,535 ммоль; 2 экв.) в DMF (10 мл) по каплям добавляли Т3Р (170,30 мг; 0,535 ммоль; 2 экв.) и DIEA (69,17 мг; 0,535 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 30 мин при комнатной температуре в воздушной атмосфере. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 29% В до 38% В за 8 мин; 254/220 нм; Rt: 6,95 мин), получая 3-амино-N-[(6-[6-метил-2,6-диазаспиро[3.3]гептан-2-ил]пиридин-2-ил)метил]-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 284) (30 мг; 20,89%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 537,4. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.14 (3Н, s), 2.40 (3Н, d), 3.09 (4Н, s), 3.84 (4Н, s), 4.43 (2Н, d), 6.21 (1Н, d), 6.58 (1H, d), 7.26 (1H, dd), 7.34 (1H, d), 7.39 (1H, s), 7.45 (1H, m), 7.52 (1H, dd), 7.89 (2Н, s), 8.25 (1H, d), 8.32 (1H, s), 9.34 (1H, s).
Пример 285. 3-Амино-N-([6-[(3R)-3,4-диметилпиперазин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 285)
СХЕМА 125
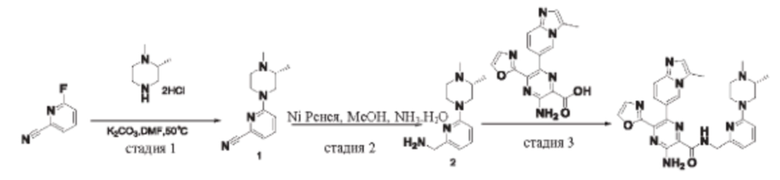
Стадия 1. 6-[(3R)-3,4-Диметилпиперазин-1-ил]пиридин-2-карбонитрил
В герметично закрываемую пробирку емкостью 40 мл добавляли (2R)-1,2-диметилпиперазин (607,9 мг; 5,32 ммоль; 1,3 экв.), 6-фторпиридин-2-карбонитрил (500 мг; 4,095 ммоль; 1 экв.), K2CO3 (1131,89 мг; 8,190 ммоль; 2 экв.) и DMF (10 мл) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 50°С. Реакцию гасили путем добавления насыщ. раствора (водн.) NaCl (250 мл) при комнатной температуре. Полученную смесь экстрагировали EtOAc (2×125 мл). Объединенные органические слои промывали насыщ. раствором (водн.) NaCl (250 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая 6-[(3R)-3,4-диметилпиперазин-1-ил]пиридин-2-карбонитрил (540 мг; 60,97%) в виде бесцветного масла. LCMS: m/z (ESI), [М+Н]+ = 217,3.
Стадия 2. 1-[6-[(3R)-3,4-Диметилпиперазин-1-ил]пиридин-2-ил]метанамин
К перемешиваемой смеси 6-[(3R)-3,4-диметилпиперазин-1-ил]пиридин-2-карбонитрила (200 мг; 0,925 ммоль; 1 экв.) в МеОН (5 мл) и NH3.H2O (0,5 мл) по каплям/порциями добавляли Ni Ренея (15,84 мг; 0,185 ммоль; 0,20 экв.) при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, фильтрат концентрировали при пониженном давлении. В результате получали 1-[6-[(3R)-3,4-диметилпиперазин-1-ил]пиридин-2-ил]метанамин (162 мг; 79,52%) в виде неочищенного продукта/смеси в форме бесцветного масла и использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+ = 221,4.
Стадия 3. 3-Амино-N-([6-[(3R)-3,4-диметилпиперазин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид
К перемешиваемому(ой) раствору/смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,297 ммоль; 1 экв.) и 1-[6-[(3R-3,4-диметилпиперазин-1-ил]пиридин-2-ил]метанамина (98,27 мг; 0,446 ммоль; 1,5 экв.) в DMF (5 мл) по каплям/порциями добавляли HATU (226,12 мг; 0,595 ммоль; 2 экв.) и DIEA (115,29 мг; 0,892 ммоль; 3 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь экстрагировали CH2Cl2 (3×20 мл). Объединенные органические слои промывали водой (3×10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 15:1). Неочищенный продукт (80 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А:, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 34% В до 45% В за 8 мин; 254/220 нм; Rt: 7,53 мин), получая 3-амино-N-([6-[(3R)-3,4-диметилпиперазин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 285) (20 мг; 12,49%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+ = 539,4. 1H-ЯМР (DMSO-d6, 40 МГц) δ 1.7 (3Н, d), 2.7 (2Н, s), 2.9 (3Н, s), 3.2 (5Н, s), 3.6 (1H, s), 4.7-4.9 (2Н, m), 5.3 (1H, d), 7.5 (2Н, dd), 8.0 (1Н, d), 8.2 (2Н, d), 8.2-8.4 (2Н, m), 8.7 (1H, s), 9.1 (1H, d), 10.1 (1H, t).
Пример 287-2. (S)-3-Амино-N-((6-(2,4-диметилпиперазин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 287-2)

Стадия 1. 6-[(3S)-3.4-Диметилпиперазин-1-ил]пиридин-2-карбонигрил
В герметично закрываемую пробирку емкостью 40 мл добавляли (3S)-1,3-диметилпиперазин (607,89 мг; 5,323 ммоль; 1,3 экв.), 6-фторпиридин-2-карбонитрил (500 мг; 4,095 ммоль; 1 экв.), K2CO3 (1131,89 мг; 8,190 ммоль; 2 экв.) и DMF (10 мл) при комнатной температуре. Полученную смесь перемешивали в течение 3 часов при 50°С. Реакцию гасили путем добавления насыщ. раствора (водн.) NaCl (250 мл) при комнатной температуре. Полученную смесь экстрагировали EtOAc (2 х 125 мл). Объединенные органические слои промывали насыщ. раствором (водн.) NaCl (250 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (СН2С12/МеОН, 30:1), получая 6-[(2S)-2,4-диметилпиперазин-1-ил]пиридин-2-карбонитрил (280 мг; 31,61%) в виде бесцветного масла. LCMS: m/z (ESI), [М+Н]+=217,3.
Стадия 2. 1-[6-[(2S)-2,4-Диметилпиперазин-1-ил]пиридин-2-ил]метанамин
К перемешиваемому(ой) раствору/смеси 6-[(2S)-2,4-диметилпиперазин-1-ил]пиридин-2-карбонитрила (280 мг; 1,295 ммоль; 1 экв.) в МеОН (5 мл) и NH2NH2⋅H2O (0,5 мл) по каплям/порциями добавляли Ni Ренея (22,18 мг; 0,259 ммоль; 0,2 экв.) при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали и концентрировали при пониженном давлении, получая 1-[6-[(2S)-2,4-диметилпиперазин-1-ил]пиридин-2-ил]метанамин (200 мг; 70,12%) в виде бесцветного твердого вещества. LCMS: m/z (ESI), [М+Н]+=221,4.
Стадия 3. 3-Amhho-N-([6-[(2S)-2,4-диметилпиперазин-1-ил]пиридин-2-
ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 287-2)
К перемешиваемому(ой) раствору/смеси 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (100 мг; 0,297 ммоль; 1 экв.) и 1-[6-[(2S)-2,4-диметилпиперазин-1-ил]пиридин-2-ил]метанамина (98,27 мг; 0,446 ммоль; 1,50 экв.) в DMF (10 мл) по каплям/порциями добавляли HATU (226,12 мг; 0,595 ммоль; 2 экв.) и DIEA (115,29 мг; 0,892 ммоль; 3 экв.) при комнатной температуре в воздушной атмосфере. Полученную смесь экстрагировали CH2Cl2 (3 х 20 мл). Объединенные органические слои промывали водой (3x20 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 15:1). Неочищенный продукт (80 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 19*250 мм, 5 мкм; подвижная фаза А:, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 36% В до 47% В за 8 мин; 254/220 нм; Rt: 7,65 мин), получая 3-амино-N-([6-[(2S)-2,4-диметилпиперазин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 287-2) (20 мг; 12,49%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=539,4. 1Н ЯМР (400 МГц, DMSO-d6) δ 0.9 (3Н, d), 1.7 (1H, t), 1.8 (1H, dd), 2.0 (3Н, s), 2.3 (1H, d), 2.4 (4Н, s), 2.8-2.9 (1H, m), 3.9 (1H, d), 4.3 (1Н, s), 4.5 (2Н, dd), 6.6 (2Н, dd), 7.2 (1Н, dd), 7.3 (1H, s), 7.4 (1H, s), 7.4-7.5 (2Н, m), 7.9 (1H, s), 8.3 (1H, s), 8.4 (1H, s), 9.3 (1H, t).
Соединения, приведенные ниже в таблице, получали с использованием способов, описанных для получения соединения 287-2.
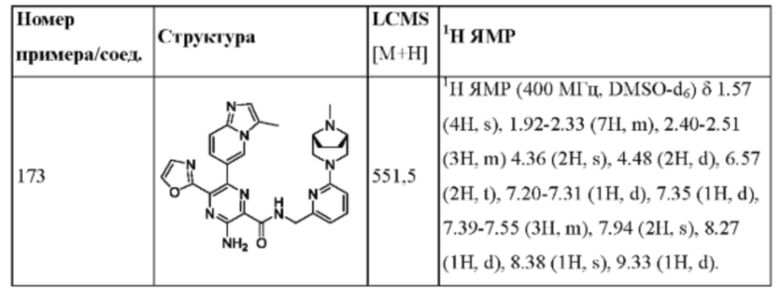
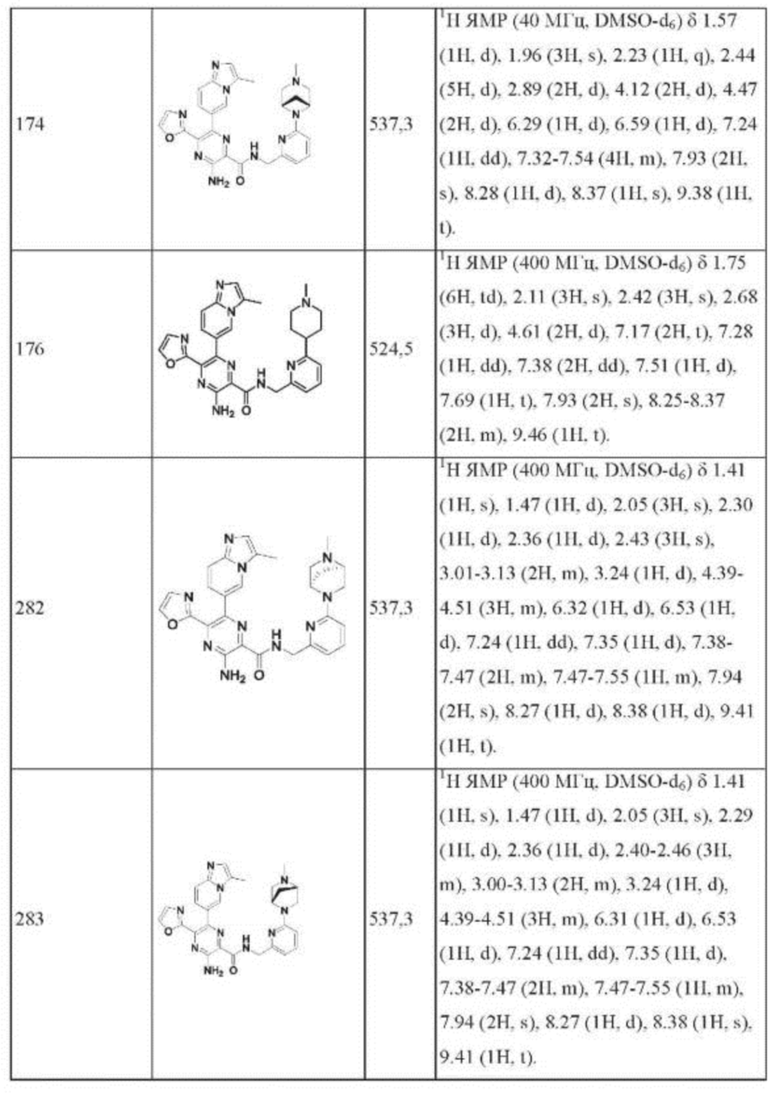
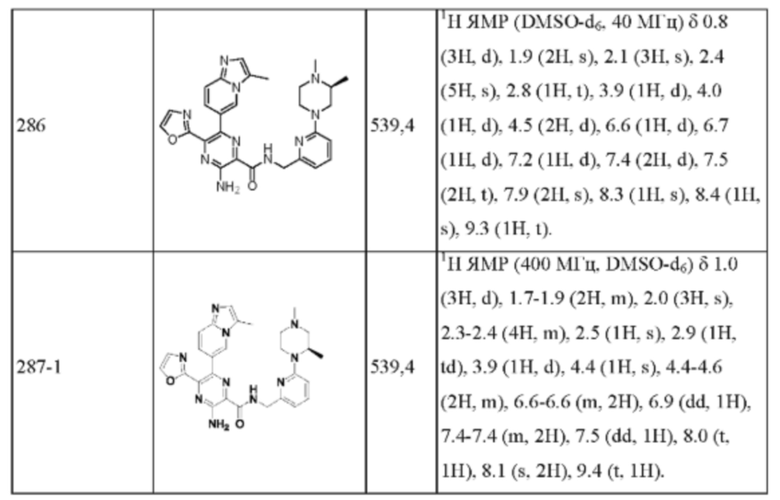
Пример 290. Получение (2S)-N-[[3-амино-5-(4-фторфенил)-6-[3-метил-имидазо-[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]оксолан-2-карбоксамида (соединения 290)
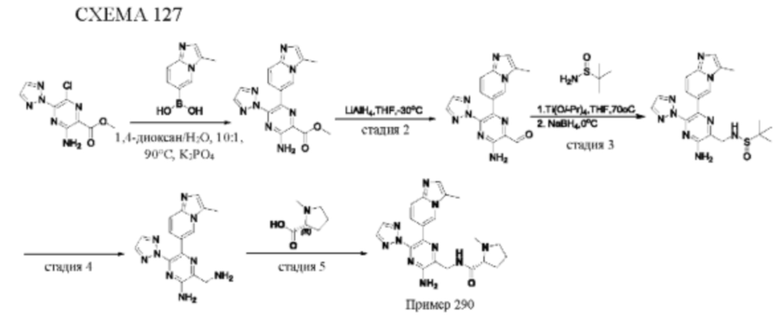
Стадия 1. метил 3-метил-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин
Раствор метил 3-амино-6-хлор-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (3,0 г; 11,8 ммоль; 1 экв.) в диоксане (50 мл) обрабатывали [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислотой (4,15 г; 23,6 ммоль; 2,00 экв.), Pd(dppf)Cl2 (0,86 г; 1,19 ммоль; 0,1 экв.) и K3PO4 (7,50 г; 35,3 ммоль; 3,0 экв.) в Н2О (5,0 мл) в атмосфере азота при комнатной температуре, нагревали в течение 2 ч при 90°С, охлаждали до комнатной температуры, концентрировали. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (20/1), получая метил 3-метил-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилат (1,8 г; 44%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=351,3.
Стадия 2. 3-Метил-6-[3-метил-имидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбальдегид
Раствор метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксилата (1,0 г; 2,85 ммоль; 1 экв.) в THF (20 мл) обрабатывали LiAlH4 (162,5 мг; 4,28 ммоль; 1,5 экв.) при -70°С, перемешивали в течение 2 ч, гасили ЕА (2,5 мл), очищали препаративной TLC, получая 3-метил-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбальдегид (280 мг; 31%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=321,1.
Стадия 3. N-[(3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1.2,3-триазол-2-ил)пиразин-2-ил)метил1-2-метилпропан-2-сульфинамид
Смесь 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбальдегида (260 мг; 0,81 ммоль; 1 экв.) и 2-метилпропан-2-сульфинамида (195 мг; 1,62 ммоль; 2,0 экв.) в THF (2,5 мл) обрабатывали Ti(Oi-Pr)4 (2,5 мл) при комнатной температуре, нагревали при 70°С в течение 2 ч, охлаждали до комнатной температуры, добавляли NaBH4; (123 мг; 3,25 ммоль; 4,0 экв.), перемешивали в течение 2 ч, гасили водой (2,0 мл), фильтровали. Твердое вещество промывали смесью DCM/MeOH (5/1, 20 мл), объединяли с органическим слоем, концентрировали, очищали препаративной TLC (DCM/MeOH, 50/1), получая N-[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-ил)метил]-2-метилпропан-2-сульфинамид (230 мг; 67%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=426,3.
Стадия 4. (2S)-N-[[3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил] метил]-1-метилпирролидин-2-карбоксамид
Раствор N-[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-
триазол-2-ил)пиразин-2-ил)метил]-2-метилпропан-2-сульфинамида (160 мг; 0,36 ммоль; 1 экв.) в DCM (2,0 мл) обрабатывали раствором HCl (газ.) в 1,4-диоксане (2,0 мл; 4,0 моль/л) при комнатной температуре, перемешивали в течение 2 ч, концентрировали, получая 3-(аминометил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]-6-(2Н-1,2,3-триазол-2-ил)пиразин-2-амин (160 мг; неочищенный). LCMS: m/z (ESI), [М+Н]+=322,3.
Стадия 5. (2S)-N-[[3-Амино-5-(4-фторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]оксолан-2-карбоксамид (соединение 290)
Раствор (2R)-1-метилпирролидин-2-карбоновой кислоты (112,5 мг; 0,87 ммоль; 2,0 экв.) в DMF (3,0 мл) обрабатывали HATU (331 мг; 0,87 ммоль; 2,00 экв.) в течение 20 мин при комнатной температуре, затем по каплям добавляли 3-(аминометил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]-6-(2Н-1,2,3-триазол-2-ил)пиразин-2-амин (140 мг; 0,44 ммоль; 1 экв.), DIEA (167 мг; 1,31 ммоль; 3,0 экв.) при комнатной температуре, перемешивали в течение 2 ч. Остаток очищали препаративной TLC (DCM/MeOH, 30/1), получая (2R)-N-[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-ил)метил]-1-метилпирролидин-2-карбоксамид (65 мг; 35%) в виде белого твердого вещества. LCMS [М+Н]=433,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.74 (3Н, m), 2.11 (1H, m), 2.32 (7Н, d), 2.82 (1H, dd), 3.07 (1H, dd), 4.46 (2Н, t), 6.87 (1H, dd), 7.15 (2Н, s), 7.35 (1H, s), 7.42 (1H, d), 7.55 (1Н, d), 8.09 (2Н, s), 8.49 (1H, t).
Пример 291. Получение (2R)-N-[[3-амино-5-(3,5-дифторфенил)-6-[3-метилимидазо[1,2-а] пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамида (соединения 291) 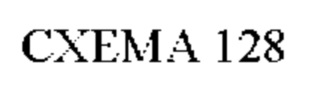
Стадия 1. метил 3-амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбоксилат
К перемешиваемой смеси метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (4 г; 18,016 ммоль; 1 экв.) и (3,5-дифторфенил)бороновой кислоты (2,90 г; 18,376 ммоль; 1,02 экв.) в 1,4-диоксане (100 мл) и Н2О (5 мл) порциями добавляли K3PO4 (7,65 г; 36,031 ммоль; 2 экв.) и Pd(dppf)Cl2 (2,64 г; 3,603 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 70°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали CH2Cl2 (1x30 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/EtOAc (4:1), получая метил 3-амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбоксилат (4 г; 74,09%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=300,2.1Н ЯМР (300 МГц, DMSO-d6) δ 3.89 (3Н, s), 7.47 (3Н, dd), 7.66 (2Н, s).
Стадия 2. 3-Амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбоксамид
К перемешиваемому раствору 30%-ного NH3 в МеОН (100 мл) порциями добавляли метил 3-амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбоксилат (4 г; 13,348 ммоль; 1 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 4 ч при 50°С. Полученную смесь концентрировали под вакуумом, получая 3-амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбоксамид (3,5 г; 92,11%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=285,2. 1H ЯМР (300 МГц, DMSO-d6) δ 7.43 (3Н, m), 7.75 (3Н, s), 8.04 (1H, s).
Стадия 3. 3-Амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбонитрил
К перемешиваемому раствору фосфорилтрихлорида (40 мл) порциями добавляли 3-амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбоксамид (2 г; 7,026 ммоль; 1 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 12 ч при 90°С. Полученную смесь концентрировали при пониженном давлении и разбавляли DCM (20 мл). Реакцию гасили насыщ. раствором (водн.) NaHCO3 при комнатной температуре. Полученную смесь экстрагировали CH2Cl2 (2 х 30 мл). Объединенные органические слои сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (РЕ/EtOAc, 1:1), получая 3-амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбонитрил (700 мг; 37,36%) в виде желтого твердого вещества. 1H-ЯМР: (300 МГц, DMSO-d6) δ 7.43 (3Н, m), 7.73 (2Н, s).
Стадия 4. 3-Амино-5-(3,5-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрил
К перемешиваемой смеси 3-амино-6-хлор-5-(3,5-дифторфенил)пиразин-2-карбонитрила (600 мг; 2,250 ммоль; 1 экв.) и [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (791,99 мг; 4,500 ммоль; 2,00 экв.) в 1,4-диоксане (30 мл) и H2O (4 мл) порциями добавляли Cs2CO3 (1466,34 мг; 4,500 ммоль; 2 экв.) и Pd(dppf)Cl2 (329,30 мг; 0,450 ммоль; 0,2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 3 ч при 90°С в атмосфере азота. Полученную смесь фильтровали, осадок на фильтре промывали CH2Cl2 (1x10 мл). Фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая 3-амино-5-(3,5-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрил (300 мг; 36,79%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=363,3. 1Н-ЯМР (300 МГц, DMSO-d6) δ 2.37 (3Н, m), 6.94 (1H, dd), 7.13 (2Н, m), 7.37 (3Н, m), 7.67 (2Н, s), 8.18 (1H, m).
Стадия 5. 3-(Аминометил)-6-(3,5-дифторфенил)-5-[3-метилимидазо[1,2-a]пиридин-6- ил]пиразин- 2-амин
К перемешиваемому раствору 3-амино-5-(3,5-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-карбонитрила (100 мг; 0,276 ммоль; 1 экв.) и NH3⋅H2O (1 мл) в МеОН (15 мл) порциями добавляли Ni Ренея (47,29 мг; 0,552 ммоль; 2 экв.) при комнатной температуре в атмосфере азота. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (1x10 мл). Фильтрат концентрировали при пониженном давлении, получая 3-(аминометил)-6-(3,5-дифторфенил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-амин (90 мг; 89,01%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=367,3.
Стадия 6. (2R)-N-[[3-Амино-5-(3,5-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (соединение 291)
К перемешиваемой смеси (2R)-1-метилпирролидин-2-карбоновой кислоты (56,41 мг; 0,437 ммоль; 2,00 экв.) в DMF (10 мл) порциями добавляли HATU (166,05 мг; 0,437 ммоль; 2 экв.) и DIEA (56,44 мг; 0,437 ммоль; 2 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 10 мин при комнатной температуре. Затем к этому перемешиваемому раствору порциями добавляли 3-(аминометил)-6-(3,5-дифторфенил)-5-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-амин (80 мг; 0,218 ммоль; 1 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 3 ч при комнатной температуре. Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge С18 OBD, 5 мкм, 19*150 мм; подвижная фаза А: вода, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 35% В до 48% В за 7 мин; 254/220 нм; Rt: 6,77 мин), получая (2R)-N-[[3-амино-5-(3,5-дифторфенил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]пиразин-2-ил]метил]-1-метилпирролидин-2-карбоксамид (соединение 291) (7 мг; 6,71%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=478,4. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.72 (3Н, s), 2.11 (1H, dd), 2.34 (7Н, m), 2.81 (1H, dd), 3.04 (1H, m), 4.40 (2Н, m), 6.77 (2Н, s), 7.00 (1H, dd), 7.09 (2Н, m), 7.25 (1H, tt), 7.40 (2Н, m), 8.09 (1H, t), 8.45 (1H,t).
Пример 296-1. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-Н-[(28)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил]пиразин-2-карбоксамида (соединения 296-1)
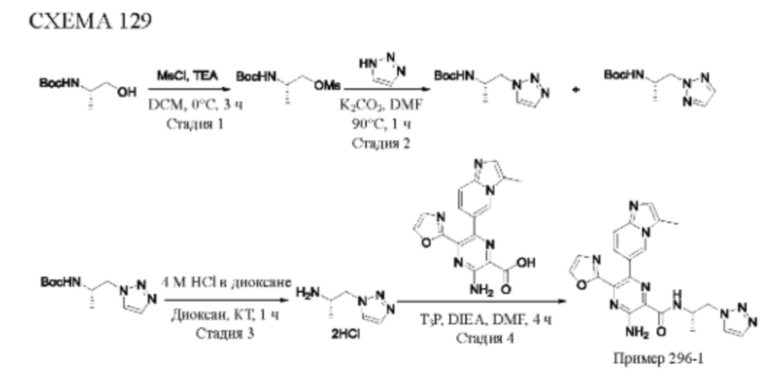
Стадия 1. (S)-2-((трет-Бутоксикарбонил)амино)пропил-метансульфонат
К перемешиваемому раствору трет-бутил N-[(2S)-1-гидроксипропан-2-ил]карбамата (5,0 г; 28,534 ммоль; 1 экв.) и TEA (3753,60 мг; 37,095 ммоль; 1,3 экв.) в DCM по каплям добавляли MsCl (4,90 г; 42,801 ммоль; 1,5 экв.) при 0°С в атмосфере азота. Полученную смесь экстрагировали CH2Cl2 (2 х 20 мл). Объединенные органические слои промывали водой (2 х 20 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. В результате получали (S)-2-((трет-бутоксикарбонил)амино)пропил-метансульфонат (6,5 г; 89,9%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+- MS-сигнал не приводится.
Стадия 2. трет-бутил (S)-(1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил)карбамат
К перемешиваемому раствору трет-бутил N-[(2S)-1-(метансульфонилокси)пропан-2-ил]карбамата (3 г; 11,843 ммоль; 1 экв.) и 1H-1,2,3-триазола (1,23 г; 17,765 ммоль; 1,50 экв.) в DMF (50 мл) порциями добавляли K2CO3 (3,27 г; 23,686 ммоль; 2,00 экв.). Полученную смесь перемешивали при 90°С в атмосфере азота. Полученную смесь разбавляли ЕА (10 мл), промывали водой (2 х 10 мл). Полученную смесь концентрировали под вакуумом. Остаток очищали обращенно-фазовой HPLC, получая трет-бутил (S)-(1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил)карбамат (1,2 г; 44,7%) и трет-бутил (8)-(1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил)карбамат (0,62 г; 23,1%) в виде белого твердого вещества.
трет-Бутил-(S)-(1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил)карбамат. 1H-ЯМР (300 МГц, хлороформ-d) δ 1.09 (3Н, d), 1.43 (9Н, s), 4.21 (1H, s), 4.51 (2Н, d), 7.63 (2Н, s).
трет-Бутил-(S)-(1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил)карбамат. 1Н-ЯМР (300 МГц, DMSO-d6) δ 1.02 (4Н, d), 1.33 (9Н, s), 3.91 (1H, р), 4.34 (2Н, qd), 6.92 (1H, d), 7.70 (1H, s), 8.01 (1H, d).
Стадия 3. (S)-1-(1Н-1,2,3-Триазол-1-ил)пропан-2-амина дигидрохлорид
К перемешиваемому раствору трет-бутил (S)-(1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил)карбамата (280 мг; 1 экв.) в 1,4-диоксане (5 мл) по каплям добавляли 4 М раствор HCl в 1,4-диоксане (5 мл) при 25°С. Смесь перемешивали при комнатной температуре в течение 1 ч. После концентрирования досуха получали (S)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-амина дигидрохлорид (266 мг; 90,5%) в виде белого твердого вещества. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. 1Н-ЯМР (300 МГц, DMSO-d6) δ 1.13 (3Н, d), 3.68 (1Н, dt), 4.63 (2Н, qd), 7.78 (1H, s), 8.24 (1H, s), 8.44 (2Н, s).
Стадия 4. 3-Амино-6-[3-метилимидазо[1.2-а]пиридин-6-ил]-5-(1.3-оксазол-2-ил)-N-[(2S)-1-(1H-1.2,3-триазол-1-ил)пропан-2-ил]пиразин-2-карбоксамид
К перемешиваемой смеси (2S)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-амина (45 мг; 0,357 ммоль; 1,50 экв.), 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,238 ммоль; 1 экв.) и DIEA (184,46 мг; 1,427 ммоль; 6,00 экв.) в DMF по каплям добавляли Т3Р (454,12 мг; 0,714 ммоль; 3,00 экв.; 50%-ный) при 0°С.Реакционную смесь очищали препаративной HPLC в приведенных далее условиях (колонка: Shiseido CAPCELLCORE С18, 2,1*50 мм, 2,7 мкм; подвижная фаза А: вода/0,05% TFA, подвижная фаза В: ACN/0,05% TFA; скорость потока: 1,0 мл/мин; градиент: от 5% В до 95% В за 2,0 мин; выдерживание в течение 0,7 мин; 254 нм), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(2S-1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил]пиразин-2-карбоксамид (соединение 296-1) (75 мг; 70,9%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=445,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.19 (3Н, d), 2.45 (3Н, d), 4.49-4.71 (3Н, m), 7.19 (1H, dd), 7.37 (2Н, dd), 7.48 (1H, dd), 7.69 (1H, d), 7.80 (2Н, s), 8.10 (1H, d), 8.25 (1Н, d), 8.28-8.35 (1H, m), 8.75 (1H, d).
Пример 296-2. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(2R)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]пиразин-2-карбоксамида (соединения 296-2)
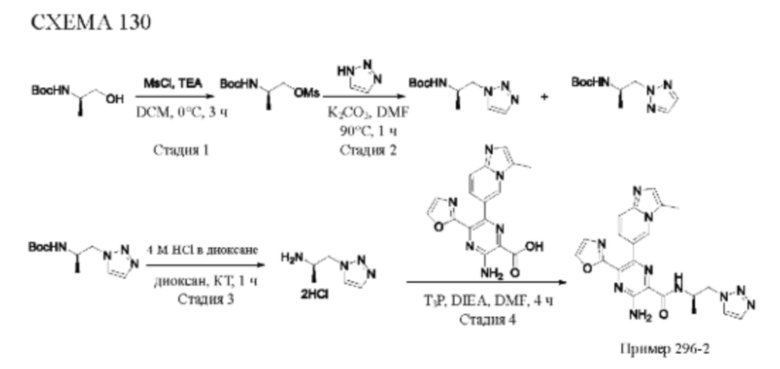
Стадия 1. ®-2-((трет-Бутоксикарбонил)амино)пропил-метансульфонат
К перемешиваемому раствору трет-бутил N-[(2R)-1-гидроксипропан-2-ил]карбамата (3 г; 17,121 ммоль; 1 экв.) и MsCl (2,55 г; 22,257 ммоль; 1,3 экв.) в DCM (50 мл) порциями добавляли TEA (3,46 г; 34,241 ммоль; 2 экв.) при 0°С в течение 2 ч. Реакционную смесь гасили, добавляя H2O с NaHCO3 (10 мл), экстрагировали DCM (3 х 20 мл), органический слой сушили над Na2SO4. В результате получали (R)-2-((трет-бутоксикарбонил)амино)пропил-метансульфонат (6,5 г; 89,9%) в виде белого твердого вещества. LCMS: m/z (ESI), [M+H-tBu+MeCN]+=239,1.
Стадия 2. трет-бутил N-[(2R)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]карбамат
Во флакон емкостью 10 мл добавляли трет-бутил N-[(2R)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]карбамат (5 г; 19,739 ммоль; 1 экв.), 1Н-1,2,3-триазол (2,04 г; 29,608 ммоль; 1,50 экв.), K2CO3 (5,46 г; 39,477 ммоль; 2,00 экв.) и DMF (50 мл) при 0°. Затем смесь перемешивали при 90°С в атмосфере азота в течение 1 ч. Полученную смесь разбавляли EtOAc (50 мл). Органические слои промывали рассолом (3x10 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали обращенно-фазовой HPLC в приведенных далее условиях: колонка: C18 силикагель; подвижная фаза: МеОН в воде; градиент: от 10% до 50% за 10 мин; детектор: УФ 254 нм, получая:
трет-бутил-N-[(2R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил]карбамат (1 г; 22,3%) 1H ЯМР (300 МГц, DMSO-d6) δ 0.99 (3Н, d), 1.31 (9Н, s), 3.72-4.00 (1H, m), 4.32 (2Н, qd), 6.90 (1H, d), 7.68 (1Н, d), 7.99 (1H, d);
трет-бутил-N-[(2R)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]карбамат (2,9 г; 64,9%) в виде белого твердого вещества. 1H ЯМР (300 МГц, DMSO-d6) δ 0.94 (3Н, d), 1.31 (9Н, s), 3.94 (1H, р), 4.24-4.43 (2Н, m), 6.84 (1H, d), 7.74 (2Н, s).
Стадия 3. Дигидрохлорид ®-1-(1Н-1,2,3-триазол-1-ил)пропан-2-амина
К перемешиваемому раствору трет-бутил (R)-(1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил)карбамата (280 мг; 1,24 ммоль; 1 экв.) в 1,4-диоксане (5 мл) по каплям добавляли 4 М раствор HCl в 1,4-диоксане (5 мл) при 25°С. Смесь перемешивали при комнатной температуре в течение 1 ч. После концентрирования досуха получали дигидрохлорид (R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-амина (266 мг; количественный выход) в виде белого твердого вещества. Неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=127,1.
Стадия 4. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(2R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил]пиразин-2-карбоксамид
Во флакон емкостью 10 мл добавляли 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (100 мг; 0,297 ммоль; 1 экв.), (2R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-амин (56,27 мг; 0,446 ммоль; 1,5 экв.), Т3Р (283,83 мг; 0,892 ммоль; 3 экв.), DIEA (192,15 мг; 1,487 ммоль; 5 экв.) и DMF (10 мл) при 0°С. Затем смесь перемешивали при комнатной температуре в атмосфере азота в течение 3 ч. Полученную смесь очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 10% В до 50% В за 7 мин; 254/220 нм; Rt: 5,48 мин), получая 3-амино-6-[3-метилимидазо[1,2-a]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(2R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил]пиразин-2-карбоксамид (соединение 296-2) (20 мг; 15,1%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=445,2. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.19 (3Н, d), 2.45 (3Н, d), 4.49-4.71 (3Н, m), 7.20 (1H, dd), 7.37 (2Н, dd), 7.48 (1Н, dd), 7.69 (1H, d), 7.79 (2H, s), 8.10 (1H, d), 8.25 (1H, d), 8.31 (1H, d), 8.75 (1H, d).
Пример 297. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N- [(2S)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]пиразин-2-карбоксамида
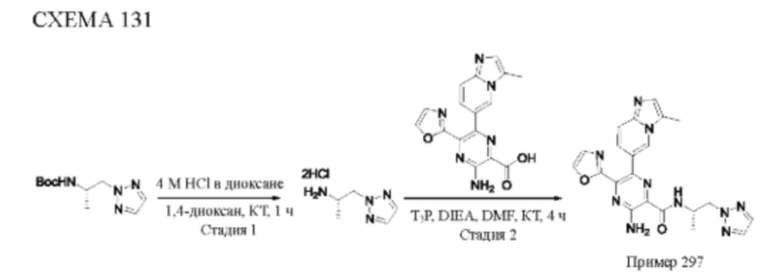
Стадия 1. Дигидрохлорид (2S)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-амина
К перемешиваемой смеси трет-бутил N-[(2S)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]карбамата (260 мг; 1,15 ммоль; 1 экв.) в 5 мл 1,4-диоксана по каплям добавляли раствор HCl в 1,4-диоксане (5 мл) при комнатной температуре. После перемешивания в течение 1 ч смесь концентрировали, получая дигидрохлорид (2S)-1-(2H-1,2,3-триазол-2-ил)пропан-2-амина (230 мг; 90,0%) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=127,2.
Стадия 2. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1.3-оксазол-2-ил)-N-[(2S)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]пиразин-2-карбоксамид
К перемешиваемому раствору дигидрохлорида (2S)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-амина (71 мг; 0,357 ммоль; 1,50 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,238 ммоль; 1 экв.), DIE А (184 мг; 1,427 ммоль; 6,00 экв.) в DMF по каплям добавляли Т3Р (454 мг; 0,714 ммоль; 3,00 экв.; 50 масс. %-ный) при 0°С в воздушной атмосфере. Реакционную смесь очищали препаративной HPLC (колонка: Shiseido CAPCELLCORE С18, 2,1*50 мм, 2,7 мкм; подвижная фаза А: вода/0,05% TFA, подвижная фаза В: ACN/0,05% TFA; скорость потока: 1,0 мл/мин; градиент: от 5% В до 95% В за 2,0 мин, выдерживание в течение 0,7 мин; 254 нм), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N- [(2S)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]пиразин-2-карбоксамид (соединение 297) (37 мг; 35,0%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=445,3. 1Н ЯМР (300 МГц, DMSO-d6) δ 1.13 (3Н, d), 2.43 (3Н, d), 4.48-4.74 (3Н, m), 7.24 (1Н, dd), 7.37 (2Н, dd), 7.52 (1H, dd), 7.77 (2Н, s), 7.82 (2Н, s), 8.25 (1H, d), 8.30 (1H, d), 8.78 (1H, d).
Пример 298. Получение 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(2R)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]пиразин-2-карбоксамида (соединения 298)
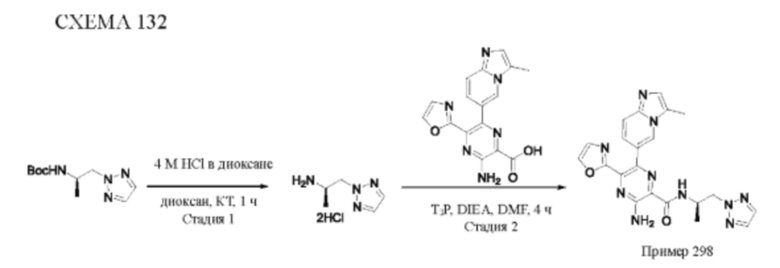
Стадия 1. Дигидрохлорид (2R-1-(2Н-1,2,3-триазол-2-ил)пропан-2-амина
К перемешиваемому раствору трет-бутил N-[(2R)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил]карбамата (200 мг; 0,88 ммоль; 1 экв.) по каплям добавляли 4 М раствор HCl (газ.) в 1,4-диоксане (4 мл) при комнатной температуре в воздушной атмосфере в течение 1 ч. Растворитель выпаривали. В результате получали дигидрохлорид (2R)-1-(2Н-1,2,3-триазол-2-ил)пропан-2-амина (180 мг; количественный выход) в виде белого твердого вещества. LCMS: m/z (ESI), [М+Н]+=127,2.
Стадия 2. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(2R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил]пиразин-2-карбоксамид
Во флакон емкостью 10 мл добавляли 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (100 мг; 0,297 ммоль; 1 экв.), (2R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-амин (56,27 мг; 0,446 ммоль; 1,5 экв.), Т3Р (283,83 мг; 0,892 ммоль; 3 экв.), DIEA (192,15 мг; 1,487 ммоль; 5 экв.) и DMF (10 мл) при 0°С. Затем смесь перемешивали при комнатной температуре в атмосфере азота в течение 4 ч. Полученную смесь очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с NH4HCO3 (10 ммоль/л)), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 10% В до 50% В за 7 мин; 254/220 нм; Rt: 5,48 мин), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)-N-[(2R)-1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил]пиразин-2-карбоксамид (соединение 298) (20 мг; 15,1%) в виде белого твердого вещества. LCMS: m/z(ESI), [М+Н]+=445,3. 1H ЯМР (300 МГц, DMSO-d6) δ 1.13 (3Н, d), 2.38-2.44 (3Н, m), 4.61(1Н, m), 4.62-4.64 (2Н, m), 7.19-7.27 (1H, m), 7.33-7.42 (2Н, m), 7.52 (1H, d), 7.77 (4Н, s), 8.18-8.34 (2Н, m), 8.78 (1H, d).
Пример 301. 3-Амино-N-([3-[2-(метиламино)этокси]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 301)
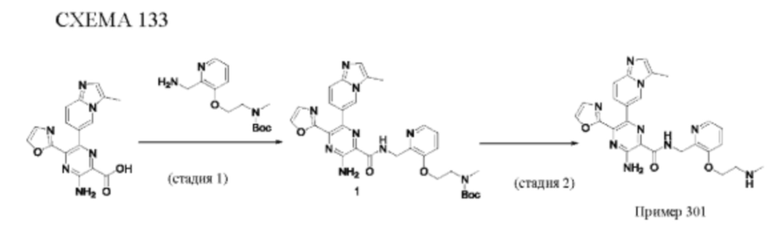
Стадия 1. трет-бутил Т-[2-[(2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пиридин-3-ил)окси]этил]-N-метилкарбамат
Во флакон емкостью 6 мл помещали трет-бутил N-(2-[[2-(аминометил)пиридин-3-ил]окси]этил)-N-метилкарбамат (209,15 мг; 0,743 ммоль; 2,50 экв.), 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновую кислоту (100 мг; 0,297 ммоль; 1 экв.), DIE А (0,36 мл; 2,805 ммоль; 9 экв.), DMF (2,5 мл), Т3Р (283,83 мг; 0,892 ммоль; 3,00 экв.). Полученный раствор перемешивали в течение 16 ч при 0°С. Полученный раствор разбавляли, используя 20 мл Н2О. Полученный раствор экстрагировали дихлорметаном (3x15 мл) и органические слои объединяли. Остаток очищали препаративной TLC (DCM: МеОН, 5:1). В результате получали 60 мг (33,65%) трет-бутил N-[2-[(2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пиридин-3-ил)окси]этил]-N-метилкарбамата в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=600,3.
Стадия 2. 3-Амино-N-([3-[2-(метиламино)этокси]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид
В круглодонную колбу емкостью 25 мл помещали трет-бутил N-[2-[(2-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пиридин-3-ил)окси]этил]-N-метилкарбамат (60 мг; 0,100 ммоль; 1 экв.), DCM (3 мл), TFA (1 мл; 13,463 ммоль; 134,55 экв.). Полученный раствор перемешивали в течение 1 ч при 20°С. Полученную смесь концентрировали под вакуумом. Значение рН раствора подводили до 8 насыщенным раствором (водн.) бикарбоната натрия. Полученную смесь концентрировали под вакуумом. Остаток очищали препаративной TLC (DCM:MeOH, 5:1), получая желтое твердое вещество. Неочищенный продукт очищали препаративной HPLC (колонка: препаративная колонка XBridge С18 OBD, 19×150 мм, 5 мкм; подвижная фаза А:, подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 20% В до 38% В за 8 мин; 254/220 нм; Rt: 7,19 мин). В результате получали 10,53 мг (19,59%) 3-амино-N-([3-[2-(метиламино)этокси]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамида в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=500,4. 1Н ЯМР (300 МГц, DMSO-d6) δ 2.30 (3Н, s), 2.44 (3Н, s), 2.85 (2Н, d), 4.10 (2Н, d), 4.65 (2Н, d), 7.20-7.31 (2Н, m), 7.37 (1H, d), 7.38-7.46 (2Н, m), 7.47-7.54 (1H, m), 8.06-8.08 (2Н, s) 8.06 (1H, d), 8.28 (1H, d), 8.37 (1H, s), 9.26 (1H, t).
Пример 302. Получение 3-амино-N-((6-(4-(диметиламино)пиперидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 302)
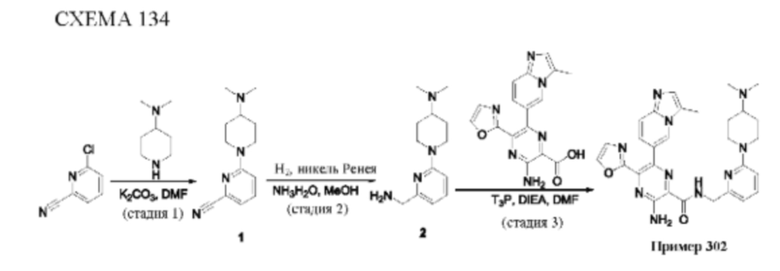
Стадия 1. 6-(4-(Диметиламино)пиперидин-1-ил)пиколинонитрил
Во флакон емкостью 20 мл добавляли 6-хлорпиридин-2-карбонитрил (500 мг; 3,609 ммоль; 1 экв.), N,N-диметилпиперидин-4-амин (508,99 мг; 3,970 ммоль; 1,10 экв.) и K2CO3 (1496,27 мг; 10,826 ммоль; 3,00 экв.) в DMF (10 мл) при комнатной температуре. Полученную смесь перемешивали в течение 15 ч при 60°С в воздушной атмосфере. Полученную смесь разбавляли EtOAc (100 мл). Полученную смесь промывали водой (2x100 мл) и насыщенным рассолом (2x100 мл). Органический слой сушили над безводным Na2SO4 и твердое вещество отфильтровывали, растворитель выпаривали, получая желтое масло. Неочищенный продукт очищали посредством TLC (ЕА:РЕ, 1:2), получая 6-[4-(диметиламино)пиперидин-1-ил]пиридин-2-карбонитрил (438 мг; 52,7%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=231,3. 1H-ЯМР (400 МГц, MeOD-d4) δ 1.45 (2Н, qd), 1.99 (2Н, dt), 2.33 (6Н, s), 2.49 (1H, tt), 2.89 (2Н, td), 4.46 (2Н, dp), 7.02 (1Н, d), 7.08 (1Н, d), 7.61 (1H, dd).
Стадия 2. 1-(6-(Аминометил)пиридин-2-ил)-N,N-диметилпиперидин-4-амин
В круглодонную колбу емкостью 50 мл добавляли 6-[4-(диметиламино)пиперидин-1-ил]пиридин-2-карбонитрил (438 мг; 1,902 ммоль; 1 экв.) и Ni Ренея (162,93 мг; 1,902 ммоль; 1,00 экв.), NH3⋅H2O (66,65 мг; 1,902 ммоль; 1,00 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода. Твердое вещество отфильтровывали и растворитель выпаривали, получая 1-[6-(аминометил)пиридин-2-ил]-N,N-диметилпиперидин-4-амин (406 мг; 91,1%) в виде желтого масла. LCMS: m/z (ESI), [М+Н]+=235,1. 1H ЯМР (400 МГц, MeOD-d4) δ 1.39-1.55 (2Н, m), 1.97 (2Н, d), 2.32 (6Н, s), 2.43 (1H, tt), 2.80 (2Н, t), 3.74 (2Н, s), 4.46 (2Н, d), 6.50-6.72 (2Н, m), 7.48 (1H, t).
Стадия 3. 3-Амино-N-((6-(4-(диметиламино)пиперидин-1-ил)пиридин-2-
ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид (соединение 302)
К перемешиваемой смеси 1-[6-(аминометил)пиридин-2-ил]-N,N-диметилпиперидин-4-амина (55,75 мг; 0,238 ммоль; 1,00 экв.) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоновой кислоты (80 мг; 0,238 ммоль; 1 экв.), DIEA (92,23 мг; 0,714 ммоль; 3,00 экв.) в DMF по каплям добавляли Т3Р (151,37 мг; 0,476 ммоль; 2,00 экв.) при 0°С в воздушной атмосфере. Полученную смесь перемешивали в течение 12 ч при комнатной температуре в воздушной атмосфере. Полученную смесь разбавляли EtOAc (50 мл). Полученную смесь промывали водой (1x50 мл) и рассолом (3x50 мл). Органический слой сушили над безводным Na2SO4, фильтровали и упаривали, получая неочищенное твердое вещество. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 12:1), получая желтое твердое вещество. Неочищенный продукт (50 мг) очищали препаративной HPLC в приведенных далее условиях (колонка: препаративная колонка XBridge OBD С18, 30×150 мм, 5 мкм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 60 мл/мин; градиент: от 37% В до 50% В за 7 мин; 254/220 нм; Rt: 5,52 мин), получая 3-амино-N-([6-[4-(диметиламино)пиперидин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 302) (20 мг; 15,21%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=553,4. 1Н ЯМР (400 МГц, MeOD-d4) δ 1.21 (2Н, tt), 1.52 (2Н, d), 2.09-2.15 (7Н, m), 2.49 (3Н, s), 2.56 (2Н, dd), 4.33 (2Н, d), 4.57 (2Н, s), 6.65 (2Н, dd), 7.30 (2Н, d), 7.42 (1Н, s), 7.47-7.54 (2Н, m), 8.00 (1Н, s), 8.40 (1Н, s).
Пример 303. Получение 3-амино-N-((6-(3-(метиламино)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (соединения 303)
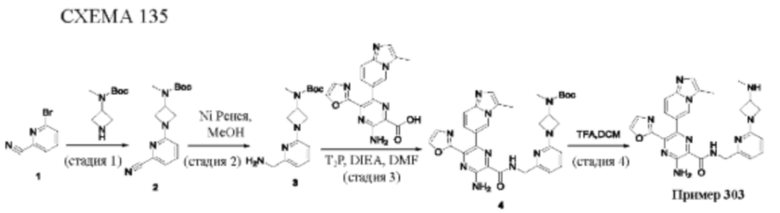
Стадия 1. Получение трет-бутил (1-(6-цианопиридин-2-ил)азетидин-3-ил)(метил)карбамата
Смесь 6-бромпиридин-2-карбонитрила (500 мг; 2,732 ммоль; 1 экв.), трет-бутил N-(азетидин-3-ил)-N-метилкарбамата (559,76 мг; 3,005 ммоль; 1,1 экв.) и K2CO3 (1132,78 мг; 8,196 ммоль; 3,0 экв.) в DMF (20 мл) перемешивали в течение 3 ч при 60°С. Полученную смесь разбавляли водой (40 мл). Полученную смесь экстрагировали EtOAc (3 х 50 мл). Объединенные органические слои промывали рассолом (20 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью PE/EtOAc (9:1), получая трет-бутил N-[1-(6-цианопиридин-2-ил)азетидин-3-ил]-N-метилкарбамат (600 мг; 76,16%) в виде светло-желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=289,2. 1H-ЯМР (300 МГц, DMSO-d6) δ 1.38 (9Н, s) 2.86-2.88 (3Н, m), 4.02-4.05 (2Н, m), 4.16-4.19 (2Н, m), 4.85 (1H, s), 6.70-6.73 (1H, m), 7.19-7.23 (1H, m), 7.67-7.69 (1H, m).
Стадия 2. трет-бутил (1-(6-(аминометил)пиридин-2-ил)азетидин-3-ил) (метил)карбамат
Смесь трет-бутил N-[1-(6-цианопиридин-2-ил)азетидин-3-ил]-N-метилкарбамата (500 мг; 1,734 ммоль; 1 экв.), гидроксида аммония (20,00 мл) и Ni Ренея (99,54 мг) в МеОН (20 мл) перемешивали в течение 1 ч при комнатной температуре в атмосфере Н2. Полученную смесь фильтровали, осадок на фильтре промывали МеОН (3x10 мл). Фильтрат концентрировали при пониженном давлении. В результате получали трет-бутил N-[1-[6-(аминометил)пиридин-2-ил]азетидин-3-ил]-N-метилкарбамат (502 мг; 99,02%) в виде светло-желтого масла. LCMS: m/z (ESI), [М+Н]+=293,1. 1H-ЯМР (300 МГц, DMSO-d6) δ 1.38 (9Н, s), 2.85-2.87 (3Н, m), 3.76 (2Н, s), 3.92 (2Н, s), 4.11 (2Н, s), 6.28 (1H, s), 6.69 (1Н, s), 7.51 (1H, s).
Стадия 3. трет-бутил (1-(6-((3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамидо)метил)пиридин-2-ил)азетидин-3-ил)-(метил)карбамат
Раствор 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-
ил)пиразин-2-карбоновой кислоты (100 мг; 0,297 ммоль; 1 экв.), трет-бутил N-[1-[6-(аминометил)пиридин-2-ил]азетидин-3-ил]-N-метилкарбамата (173,88 мг; 0,595 ммоль; 2,0 экв.), DIEA (192,15 мг; 1,487 ммоль; 5,0 экв.) и Т3Р (189,22 мг; 0,595 ммоль; 2,0 экв.) в DMF (10 мл) перемешивали в течение 2 ч при комнатной температуре. Полученную смесь разбавляли водой (20 мл). Полученную смесь экстрагировали EtOAc (3 х 30 мл). Объединенные органические слои промывали рассолом (20 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (10:1), получая трет-бутил N-[1-(6-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пиридин-2-ил)азетидин-3-ил]-N-метилкарбамат (80 мг; 44,06%) в виде светло-желтого масла. LCMS: m/z (ESI), [М+Н]+=611,3.
Стадия 4. 3-Амино-N-((6-(3-(метиламино)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамид
Раствор трет-бутил N-[1-(6-[[(3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-ил)формамидо]метил]пиридин-2-ил)азетидин-3-ил]-N-метилкарбамата (80 мг; 0,131 ммоль; 1 экв.) и TFA (2 мл) в DCM (5 мл) перемешивали в течение 2 ч при комнатной температуре. Остаток нейтрализовали до рН 7 насыщенным раствором (водн.) NaHCO3. Полученную смесь экстрагировали EtOAc (3 х 50 мл). Объединенные органические слои промывали водой (2x30 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Неочищенный продукт очищали препаративной HPLC в приведенных далее условиях (колонка: XBridge Shield RP18 OBD, 5 мкм, 19*150 мм; подвижная фаза А: вода (с 0,05% NH3H2O), подвижная фаза В: ACN; скорость потока: 20 мл/мин; градиент: от 32% В до 52% В за 8 мин; 254/220 нм; Rt: 7,88 мин), получая 3-амино-N-([6-[3-(метиламино)азетидин-1-ил]пиридин-2-ил]метил)-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(1,3-оксазол-2-ил)пиразин-2-карбоксамид (соединение 303) (30 мг; 44,85%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=511,3. 1H ЯМР (300 МГц, DMSO-d6) δ 2.20 (3Н, s), 2.49 (3Н, s), 3.57-3.59 (1H, m), 3.60-3.63 (2H, m), 4.03-4.07 (2H, m), 4.53 (2H, s), 6.26-6.28 (1H, m), 6.64-6.66 (1H, m), 7.28-7.30 (2H, m), 7.31-7.33 (1H, m), 7.45-7.49 (2H, m), 8.01 (1H, s), 8.37 (1H, s).
Примеры 304/305. Получение 3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(пиридин-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида (соединений 304/305)
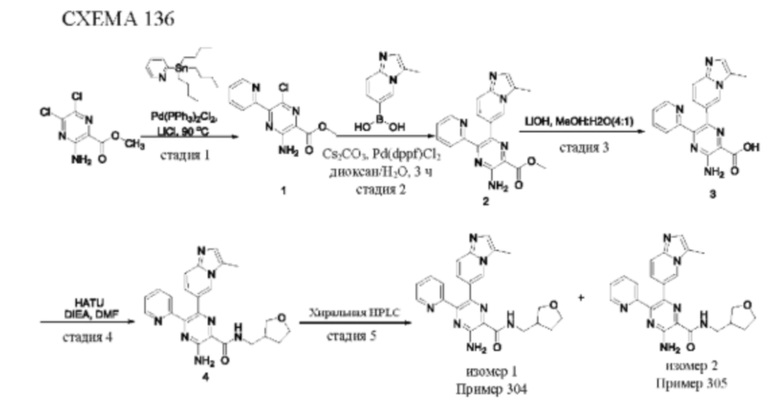
Стадия 1. 3-Амино-6-хлор-5-(пиридин-2-ил)пиразин-2-карбоксилат Раствор 2-(трибутилстаннил)пиридина (1658,12 мг; 5,05 ммоль; 2,00 экв.), метил 3-амино-5,6-дихлорпиразин-2-карбоксилата (500 мг; 2,525 ммоль; 1 экв.), Pd(PPh3)2Cl2 (158,06 мг; 0,226 ммоль; 0,1 экв.) и LiCl (190,94 мг; 5,05 ммоль; 2 экв.) в 1,4-диоксане (20 мл) перемешивали в течение 16 часов при 90°С в атмосфере азота. Эту реакционную смесь очищали вместе с другой партией Е02189-006. Смесь подвергали быстрой хроматографии на колонке с силикагелем, элюировали смесью CH2Cl2/МеОН (1:1), получая неочищенный продукт. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 30:1), получая метил 3-амино-6-хлор-5-(пиридин-2-ил)пиразин-2-карбоксилат (180 мг; 30,20%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=265,2. 1H ЯМР (300 МГц, DMSO-d6) δ 3.9 (3Н, s), 7.5 (1H, ddd), 7.6-7.7 (2Н, m), 7.8 (1H, dt), 8.0 (1h, td), 8.7 (1Н, ddd).
Стадия 2. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил1-5-(пиридин-2-ил)пиразин-2-карбоксилат
Раствор метил 3-амино-6-хлор-5-(пиридин-2-ил)пиразин-2-карбоксилата (120 мг; 0,453 ммоль; 1 экв.), [3-метилимидазо[1,2-а]пиридин-6-ил]бороновой кислоты (159,58 мг; 0,907 ммоль; 2 экв.), Pd(dppf)Cl2.CH2Cl2 (37,03 мг; 0,045 ммоль; 0,1 экв.) и Cs2CO3 (295,45 мг; 0,907 ммоль; 2 экв.) в 1,4-диоксане (12,5 мл) и H2O (1,5 мл) перемешивали в течение 4 часов в атмосфере N2. Полученную смесь концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 25:1), получая метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(пиридин-2-ил)пиразин-2-карбоксилат (50 мг; 30,60%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=361,3.
Стадия 3. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(пиридин-2-ил)пиразин-2-карбоновая кислота
К перемешиваемому раствору метил 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(пиридин-2-ил)пиразин-2-карбоксилата (1 экв.) в 1,4-диоксане (10 мл) и H2O (1 мл) порциями добавляли LiOH (3 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре. Смесь подкисляли до рН 3, используя раствор HCl (водн.). Полученную смесь концентрировали при пониженном давлении. Неочищенный продукт (50 мг) использовали непосредственно на следующей стадии без дополнительной очистки. LCMS: m/z (ESI), [М+Н]+=347,3.
Стадия 4. 3-Амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[(оксолан-3-ил)метил]-5-(пиридин-2-ил)пиразин-2-карбоксамид
К перемешиваемому раствору 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-5-(пиридин-2-ил)пиразин-2-карбоновой кислоты (50 мг; 0,144 ммоль; 1 экв.), DMF (5 мл) и 1-(оксолан-3-ил)метанамина (73,01 мг; 0,722 ммоль; 5 экв.) в DMF (5 мл) порциями добавляли DIPEA (93,29 мг; 0,722 ммоль; 5 экв.) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч при комнатной температуре. Реакцию гасили путем добавления воды (20 мл) при комнатной температуре. Полученную смесь экстрагировали CH2Cl2 (2 х 25 мл). Объединенные органические слои промывали водой (2x20 мл), сушили над безводным Na2SO4. После фильтрования фильтрат концентрировали при пониженном давлении. Остаток очищали препаративной TLC (CH2Cl2/МеОН, 15:1), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[(оксолан-3-ил)метил]-5-(пиридин-2-ил)пиразин-2-карбоксамид (30 мг; 48,39%) в виде желтого твердого вещества. LCMS: m/z (ESI), [М+Н]+=430,3.
Стадия 5. rel-3-Амино-6-[3-метилимидазо[1.2-а]пиридин-6-ил]-N-[[(3R-оксолан-3-ил]метил]-5-(пиридин-2-ил)пиразин-2-карбоксамид
Неочищенный продукт (30 мг) очищали препаративной хиральной HPLC в приведенных далее условиях (колонка: Chiralpak ID-2, 2*25 см, 5 мкм; подвижная фаза А: МТВЕ (с 10 мМ NH3-MEOH) для HPLC, подвижная фаза В: МеОН для HPLC; скорость потока: 20 мл/мин; градиент: от 15 В до 15 В за 20 мин; 220/254 нм; Rtl: 12,919; Rt2: 16,74), получая 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[оксолан-3-ил]метил]-5-(пиридин-2-ил)пиразин-2-карбоксамид (соединение 304) (8 мг; 26,67%) и 3-амино-6-[3-метилимидазо[1,2-а]пиридин-6-ил]-N-[[оксолан-3-ил]метил]-5-(пиридин-2-ил)пиразин-2-карбоксамид (соединение 305) в виде желтого твердого вещества.
(Соединение 304) LCMS: m/z (ESI), [М+Н]+=430,3. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.7 (1h, dq), 1.9-2.1 (1H, m), 2.3 (3Н, s), 2.6 (1H, dt), 3.29-3.37 (2Н, m), 3.5 (1H, dd), 3.6-3.7 (2Н, m), 3.8 (1H, td), 7.1 (1H, dd), 7.3 (2Н, t), 7.4 (1H, dd), 7.8 (2Н, d), 7.9 (1H td), 8.1 (1Н, s), 8.4 (1H, d), 9.0 (1Н, t).
(Соединение 305) LCMS: m/z (ESI), [М+Н]+=430,2. 1Н ЯМР (400 МГц, DMSO-d6) δ 1.7 (1H, dq), 1.9-2.1 (1Н, m), 2.3 (3Н, s), 2.6 (1Н, dt), 3.37 (2Н, s), 3.5-3.8 (4Н, td), 7.1 (1H, dd), 7.3 (2Н, t), 7.4 (1H, dd), 7.8 (2Н, d), 7.9 (1H, td), 8.1 (1H, s), 8.4 (1H, d), 9.0 (1H, t).
Пример 307. Аффинности связывания с разными аденозиновыми рецепторами
Аффинность и специфичность связывания соединений с аденозиновыми рецепторами человека разных подтипов (hA1, hA2A, hA2B и hA3) характеризовали, используя анализ связывания по данным хроматографии с применением клеточных мембран.
Образцы соединений в разных концентрациях инкубировали с hA1-мембраной (от PerkinElmer) и [3Н]-8-циклопентил-1,3-дипропилксантином (DPCPX) в течение 50 мин при 25°С, тем временем в лунки фильтровального планшета UNIFILTER-96 GF/B добавляли по 100 мкл 0,5%-ного раствора полиэтиленимина (PEI) с выдерживанием в течение 60 мин при 4°С, затем фильтровальный планшет UNIFILTER-96 GF/B дважды промывали, используя 50 мл буфера для промывки, в фильтровальный планшет UNIFILTER-96 GF/B переносили смесь мембран и фильтровальный планшет 4 раза промывали, после чего инкубировали при 55°С в течение 10 мин. Наконец, в каждую лунку добавляли по 40 мкл ULTIMA GOLD и измеряли число импульсов в минуту (СРМ) на счетчике TopCount.
Образцы соединений в разных концентрациях инкубировали с hA2a-мембраной (от PerkinElmer) и [3H]-CGS21680 в течение 90 мин при 25°С, тем временем в лунки фильтровального планшета UNIFILTER-96 GF/B добавляли по 100 мкл 0,5%-ного раствора PEI с выдерживанием в течение 60 мин при 4°С, затем фильтровальный планшет UNIFILTER-96 GF/B дважды промывали, используя 50 мл буфера для промывки, в фильтровальный планшет UNIFILTER-96 GF/B переносили смесь мембран и фильтровальный планшет 4 раза промывали, после чего инкубировали при 55°С в течение 10 мин. Наконец, в каждую лунку добавляли по 40 мкл ULTIMA GOLD и измеряли СРМ на счетчике TopCount.
Образцы соединений в разных концентрациях инкубировали с hA2b-мембраной (от PerkinElmer) и [3H]-DPCPX в течение 60 мин при 27°С и реакции связывания останавливали путем быстрого фильтрования через покрытые с использованием 0,5%-ного BSA (бычий сывороточный альбумин) планшеты UNIFILTER-96 GF/B, применяя харвестер клеток. Затем фильтровальные планшеты три раза промывали охлажденным во льду буфером для промывки и сушили при 37°С в течение 120 мин. Наконец, в каждую лунку добавляли по 50 мкл жидкой сцинтилляционной смеси и измеряли СРМ на счетчике TopCount.
Образцы соединений в разных концентрациях инкубировали с hA3-мембраной (от PerkinElmer) и [125I]-АВ-МЕСА в течение 60 мин при 27°С и реакции связывания останавливали путем быстрого фильтрования покрытые с использованием 0,5%-ного BSA планшеты UNIFILTER-96 GF/B, применяя харвестер клеток. Затем фильтровальные планшеты три раза промывали охлажденным во льду буфером для промывки и сушили при 37°С в течение 120 мин. Наконец, в каждую лунку добавляли по 50 мкл жидкой сцинтилляционной смеси и измеряли СРМ на счетчике TopCount.
Аффинность и специфичность связывания типичных соединений с рецепторами человека A1, А2а, A2b и A3 показаны ниже в Таблице 3. Незаполненные ячейки в приведенных ниже таблицах указывают на то, что данные еще не получены.
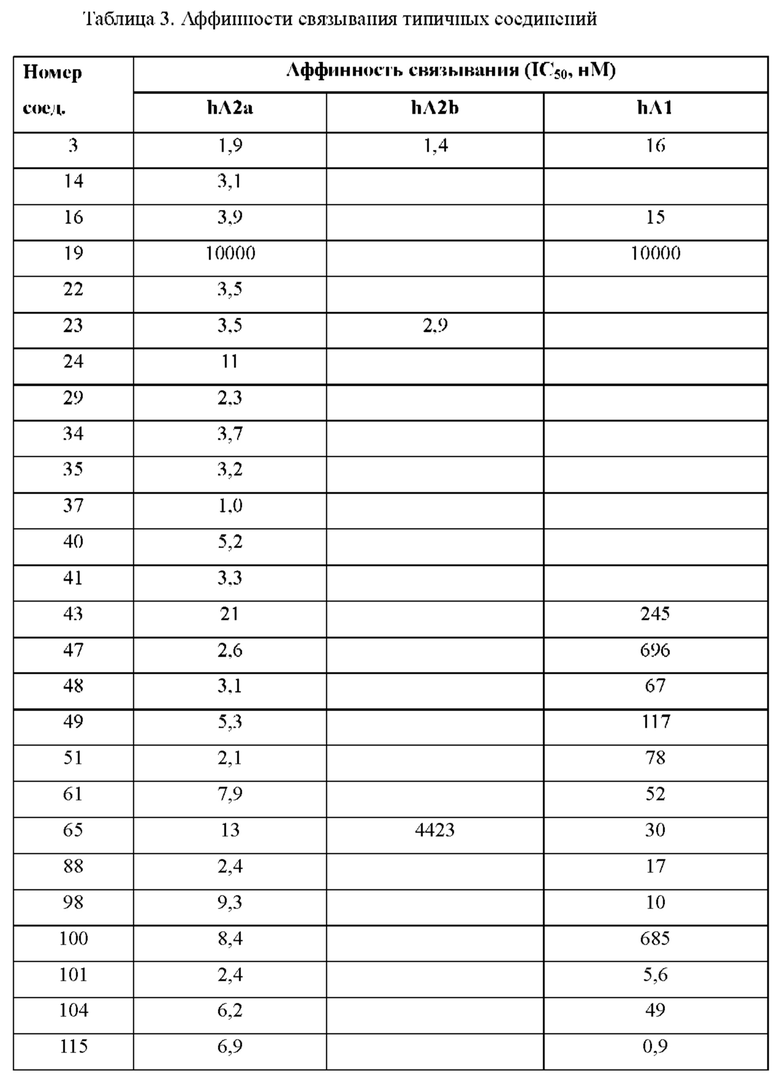

Пример 308. Анализ ингибирования с использованием FLIPR™ и ингибирования образования цАМФ (циклоаденозинмонофосфат)
Клетки hADORA1/CHO (яичников китайского хомячка, экспрессирующие А1 человека) (Genscript) высевали из расчета 1х104 клеток/лунка в 384-луночные полистироловые планшеты за одни сутки до начала эксперимента. В день эксперимента супернатант отбрасывали, заменяли на 40 мкл раствора красителя (набор 5 для анализа содержания кальция с использованием FLIPR) из расчета на одну лунку и планшеты инкубировали в течение 60 мин при 37°С и 5% СО2. Затем добавляли тестируемые соединения в разных концентрациях для проведения анализа ингибирования с использованием FLIPR™. Через 400 с инкубации с соединением к клеткам добавляли 10 мкМ аденозин и сигнал фиксировали с использованием флуоресцентного лазерного визуализирующего планшетного ридера (FLIPR).
Клетки hA2a/CHO, hA2b/CHO, hA3/CHO и mA2a/CHO (экспрессирующие А2а мыши) (Genscript) высевали из расчета 5x103 клеток/лунка в 384-луночные полистироловые планшеты в день проведения эксперимента. Предварительно с этими клетками инкубировали соединения в течение 30 мин при 37°С, 5% СО2. Затем к клеткам добавляли 10 мкМ аденозин и инкубировали в течение 30 мин при 37°С, 5% CO2. Добавляли детектирующий реагент (CISBIO) и планшеты инкубировали в течение 60 мин при комнатной температуре. Сигнал фиксировали с использованием системы En Vision.
Активности типичных соединений в отношении ингибирования с использованием FLIPR™ и цАМФ на линиях клеток, сверхэкспрессирующих разные аденозиновые рецепторы, показаны ниже в Таблице 4.
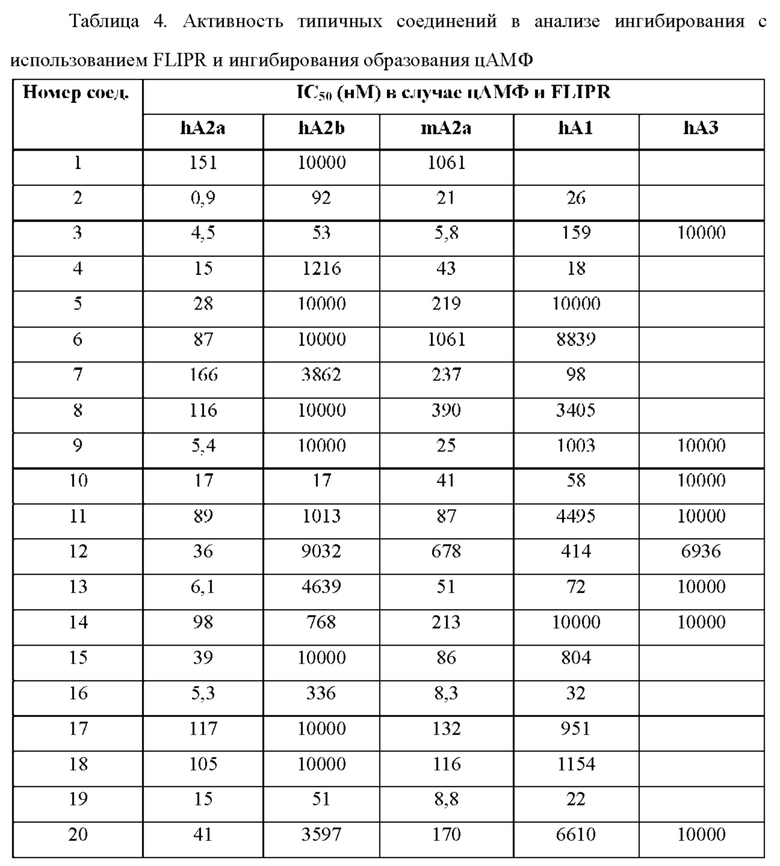
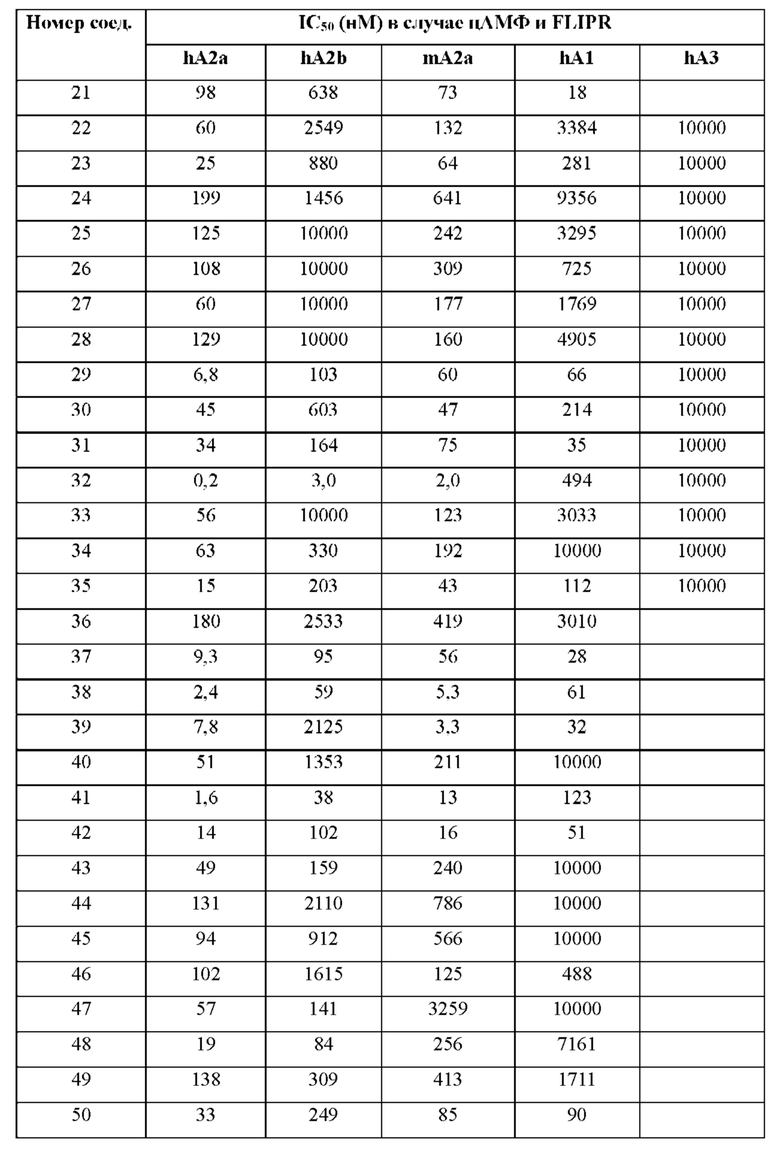
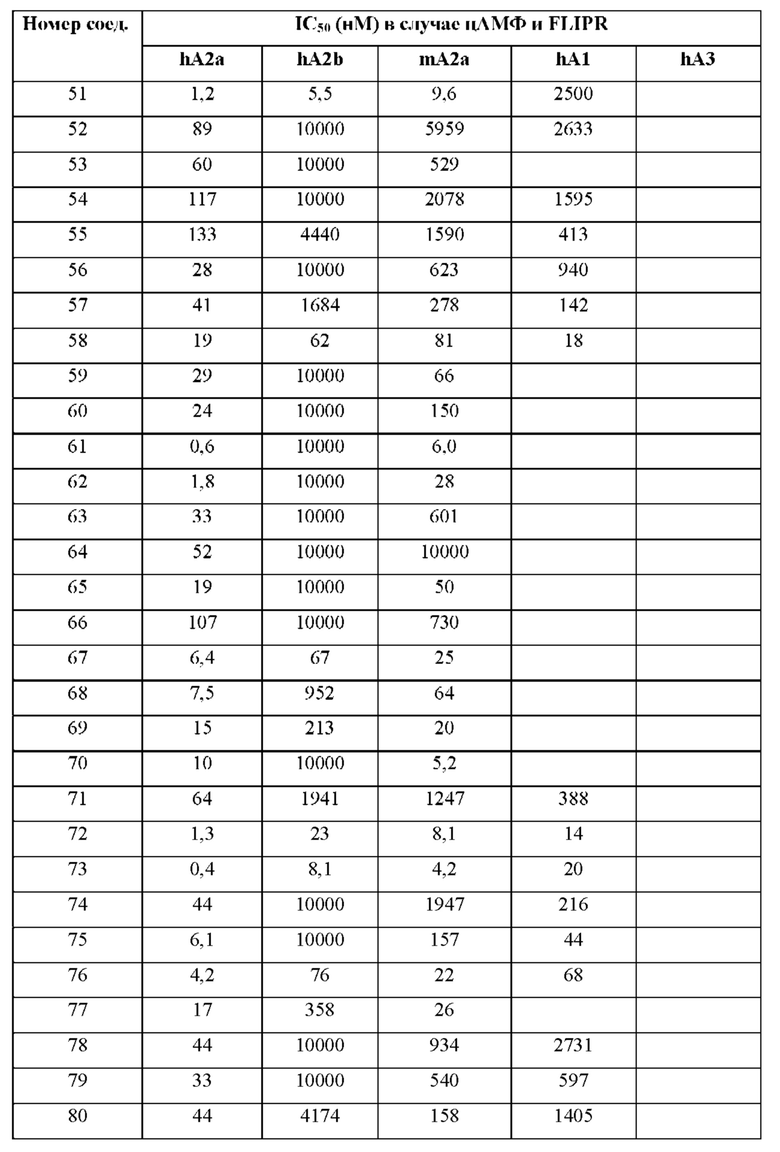
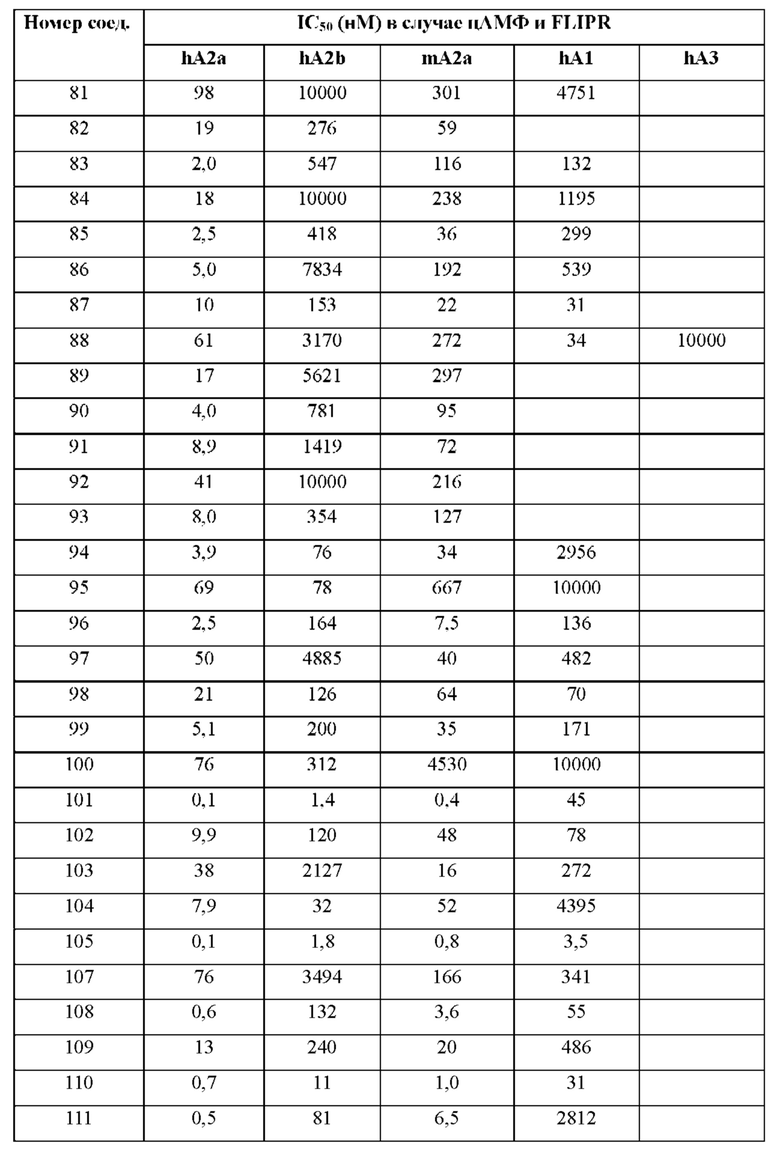
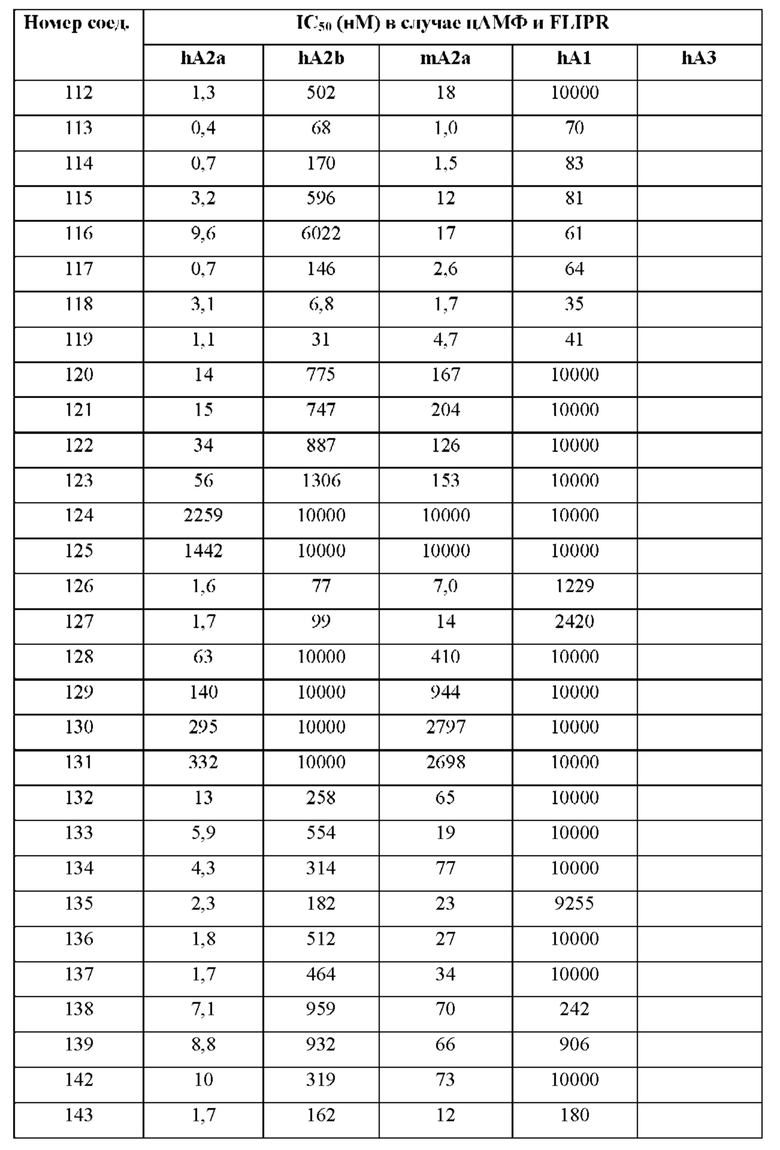
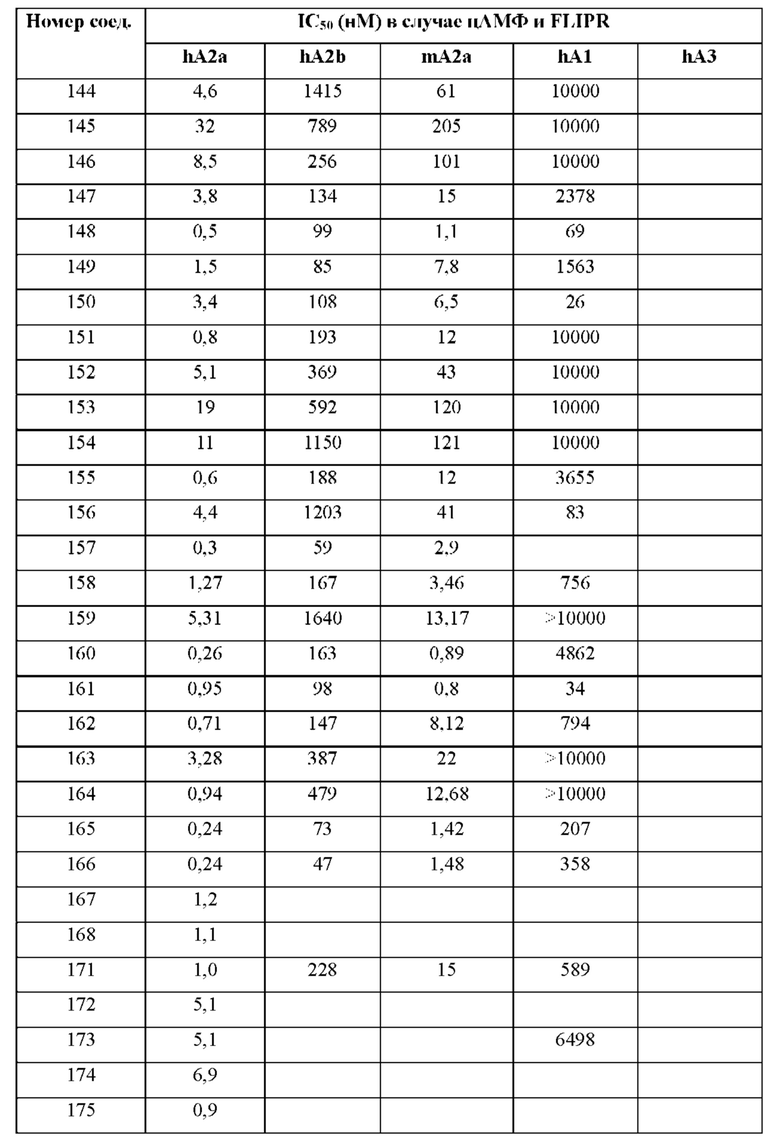
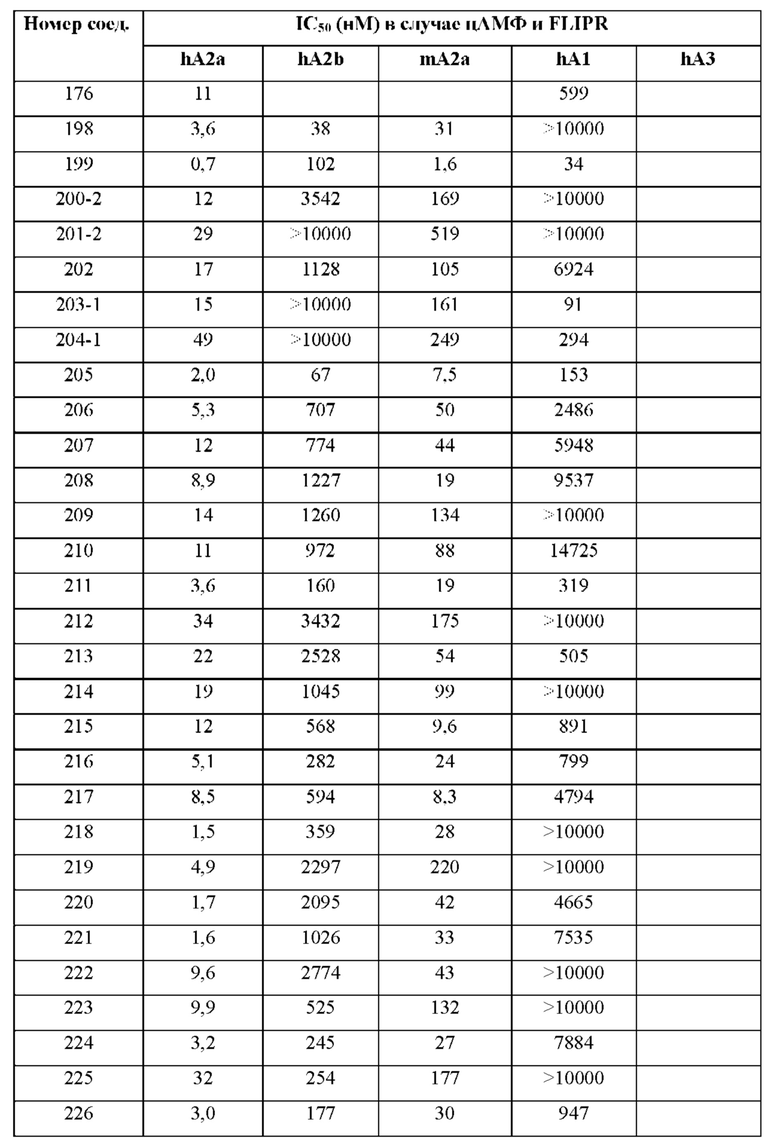
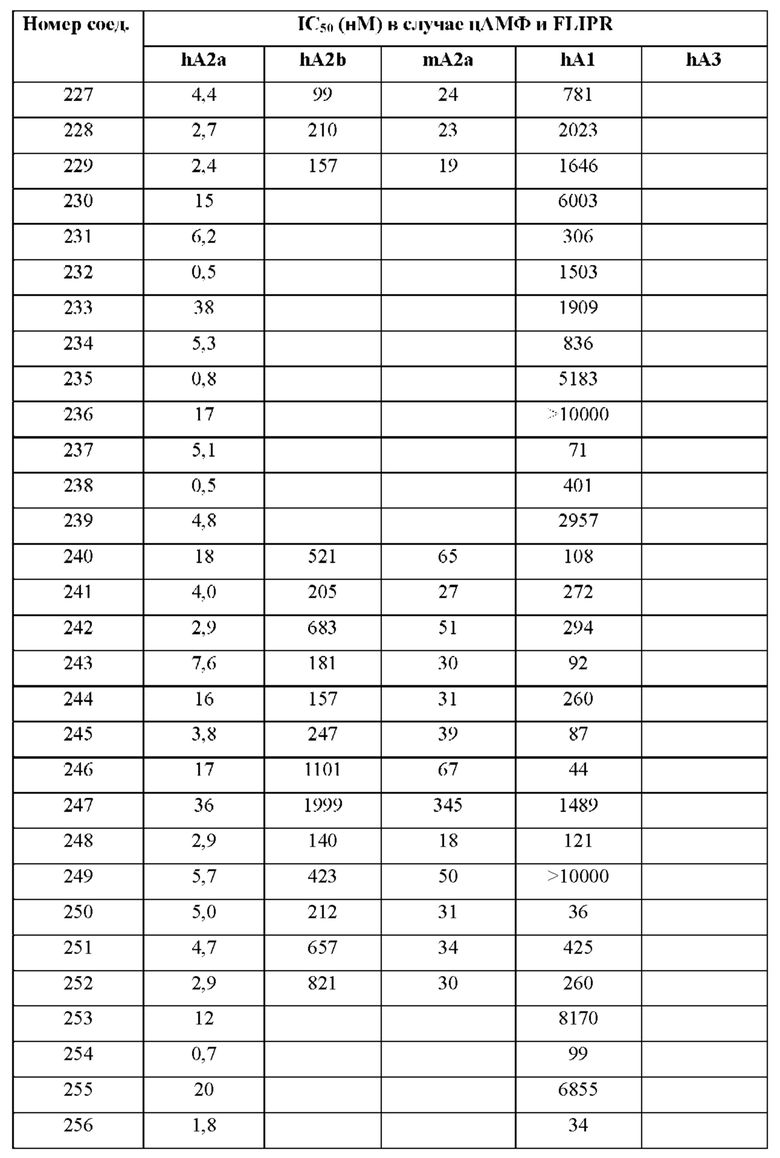
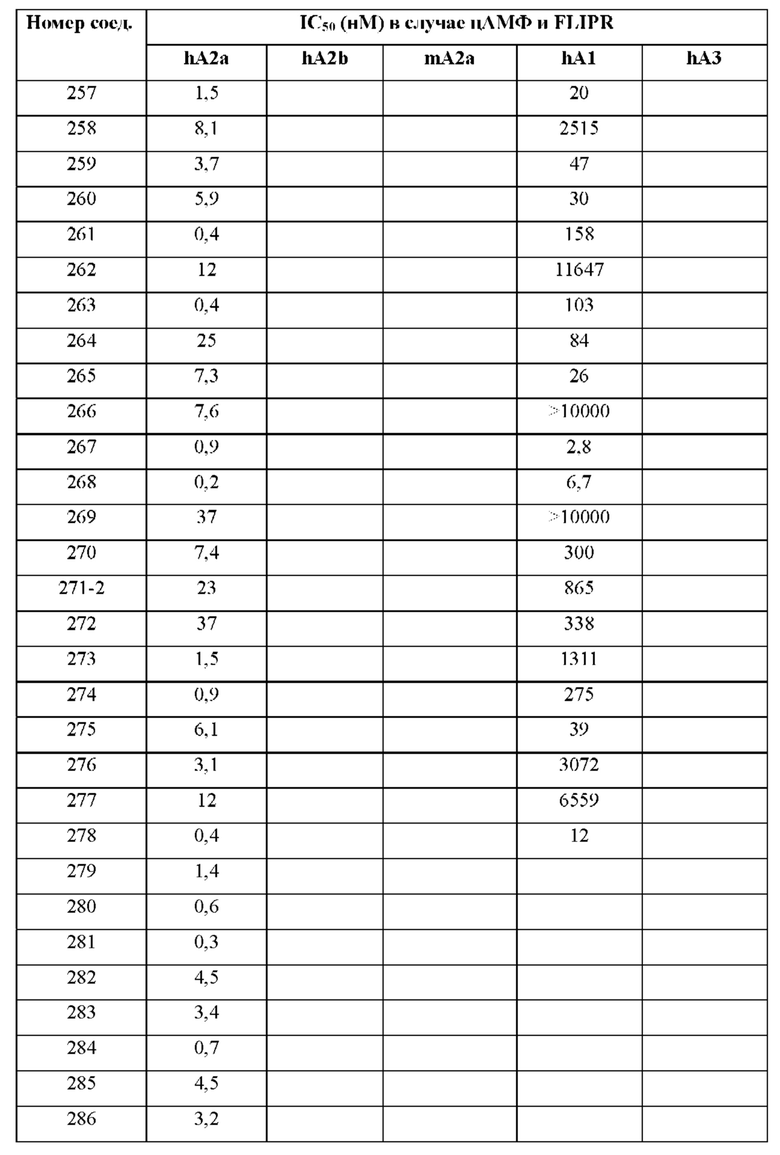

| название | год | авторы | номер документа |
|---|---|---|---|
| Соединения триазоло-пиримидина и их применение | 2019 |
|
RU2802866C2 |
| СОЕДИНЕНИЯ 8-ФТОРФТАЛАЗИН-1(2Н)-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ БРУТОНА | 2012 |
|
RU2622391C2 |
| ЗАМЕЩЕННЫЕ НИКОТИНИМИДНЫЕ ИНГИБИТОРЫ ВТК, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В ТЕРАПИИ РАКОВЫХ, ВОСПАЛИТЕЛЬНЫХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2677884C2 |
| Ингибитор ДНК-зависимой протеинкиназы | 2020 |
|
RU2835434C2 |
| ПРОИЗВОДНЫЕ ПИРИДАЗИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ RORc | 2017 |
|
RU2757571C2 |
| СПИРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2781639C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| ИМИДАЗОПИРАЗИНОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE1 | 2016 |
|
RU2712219C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| Ингибитор CDK4/6 | 2017 |
|
RU2747311C2 |
Изобретение относится к новым пиразиновым соединениям формулы I, где A, B, R1, R2, V, W, X, Y, m, n определены в формуле изобретения, которые направленно действуют на аденозиновые рецепторы, в частности на А2а. Настоящее изобретение также относится к фармацевтическим композициям, содержащим одно или более соединений в качестве активного ингредиента, и применению этих соединений в лечении заболеваний, ассоциированных с аденозиновыми рецепторами (AR), например рака, такого как немелкоклеточный рак легкого (NSCLC), почечноклеточная карцинома (RCC), рак предстательной железы и рак молочной железы. 6 н. и 41 з.п. ф-лы, 4 табл., 308 пр.
1. Соединение формулы (I)
или его фармацевтически приемлемая соль,
где X представляет собой амино;
кольцо А выбрано из
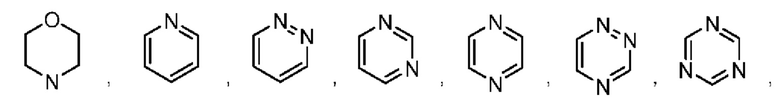
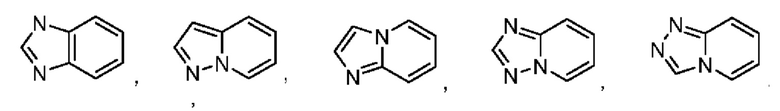
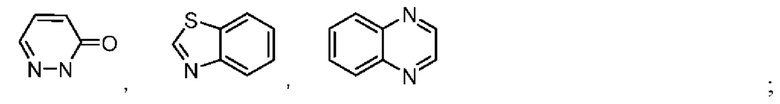
кольцо В выбрано из 3-12-членного ненасыщенного карбоциклила либо 3-12-членного насыщенного или ненасыщенного гетероциклила, содержащего 1-3 гетероатома, независимо выбранных из О и N, где одна из образующих кольцо групп -CH2- возможно замещена группой -С(О)-;
W представляет собой -С1-12алкилен- или -С(О)-;
V представляет собой -NH-, -NH-С1-12алкилен-, -NH-C(O)- или N-присоединенный пирролидинил, каждый из которых может быть замещен однократно или независимо многократно гидроксилом, С1-12алкилом, С1-12алкоксилом, группой N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино или С1-12алкил-ОН;
Y представляет собой гидроксил, циано, амино, карбамоил, карбонил, сульфонил, С1-12алкил, С1-12алкоксил, С1-12алкил-ОН, С1-12алкил-циано, С1-12галогеналкоксил, N-(C1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, С1-12алкилсульфонил, С1-12алканоиламино, 3-12-членный насыщенный или ненасыщенный карбоциклил либо 3-12-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из N, О и S, где одна из образующих кольцо групп -CH2- возможно замещена группой -С(О)-, каждый из которых возможно может быть замещен однократно или независимо многократно группой R3;
каждый R1 независимо выбран из галогена, циано, амино, С1-12алкила, С1-12галогеналкила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, 3-10-членного насыщенного карбоциклила либо 3-10-членного насыщенного гетероциклила, содержащего 1 гетероатом О, при этом каждый R1 возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 независимо выбран из галогена, С1-12алкила, С1-12галогеналкила;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-12алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, содержащего 1-2 гетероатома, независимо выбранных из N и О, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
причем каждый R4 или R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, С1-12алканоиламино, С1-12алкилсульфонил, С1-12алкил-замещенный циклоалкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3 или 4.
2. Соединение по п. 1, где каждый R1 независимо выбран из фтора, хлора, брома, амино, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метиламино, диметиламино этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила или оксетанила, каждый из которых возможно может быть дополнительно замещен однократно или независимо многократно группой R4, при этом каждая группа R4 независимо выбрана из галогена, гидроксила, циано, амино, С1-12алкила, C1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила.
3. Соединение по п. 1, где m равно 0, 1 или 2.
4. Соединение по п. 1, где кольцо В выбрано из:
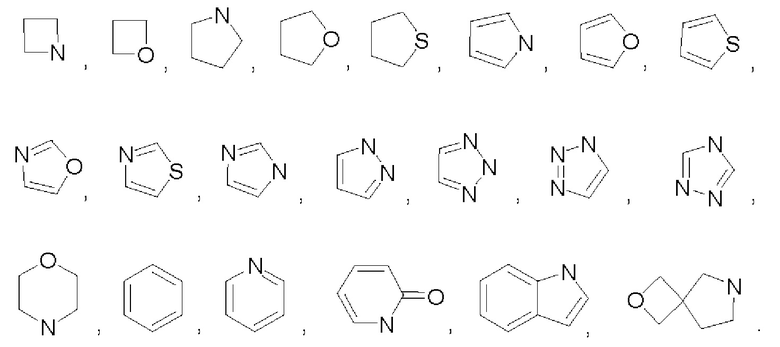
5. Соединение по п. 1, где каждый R2 независимо выбран из галогена, С1-12алкила или С1-12галогеналкила.
6. Соединение по п. 5, где каждый R2 независимо выбран из фтора, хлора, брома, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила или трифторэтила.
7. Соединение по п. 1, где n равно 0, 1 или 2.
8. Соединение по п. 1, где W представляет собой метилен или -С(О)-.
9. Соединение по п. 8, где, когда W представляет собой метилен, V представляет собой -NH-C(O)-; или, когда W представляет собой -С(О)-, V представляет собой -NH-, -NH-С1-12алкилен- или N-присоединенный пирролидинил, каждый из которых может быть замещен однократно или независимо многократно гидроксилом, С1-12алкилом, C1-12алкоксилом или группой С1-12алкил-ОН.
10. Соединение по п. 1, где Y представляет собой 3-12-членный насыщенный или ненасыщенный карбоциклил либо 3-12-членный насыщенный или ненасыщенный гетероциклил, выбранный из:
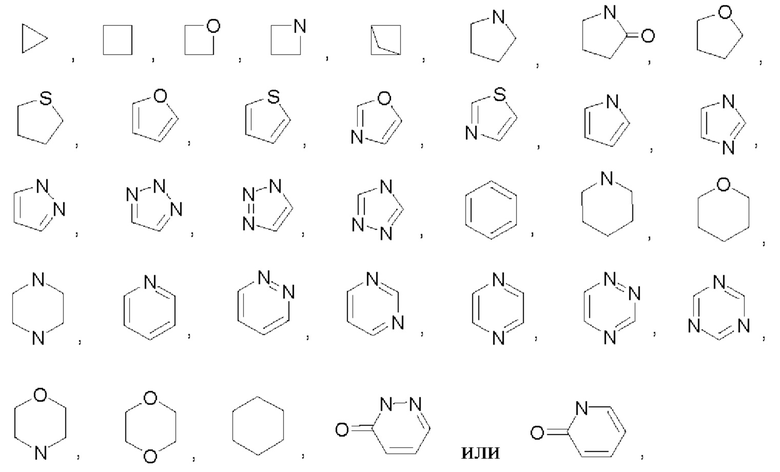
который возможно может быть замещен однократно или независимо многократно группой R3.
11. Соединение по п. 1, где Y представляет собой гидроксил, амино, циано, карбонил, карбамоил, С1-12алкил, С1-12алкил-ОН, С1-12алкоксил, сульфонил, (С1-12алкил)сульфонил, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, 3-12-членный насыщенный или ненасыщенный карбоциклил либо 3-12-членный насыщенный или ненасыщенный гетероциклил, каждый из которых возможно может быть замещен однократно или независимо многократно группой R3.
12. Соединение по п. 1, где каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфорила, фосфинила, С1-12алкила, С1-12 галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(C1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(C1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (C1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-12алкил-ОН)амино, С1-12галогеналкоксил, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6.
13. Соединение по п. 1, где каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, C1-12алканоиламино или С1-12алкил-замещенный циклоалкил.
14. Соединение по п. 1, имеющее структуру формулы (Ia)
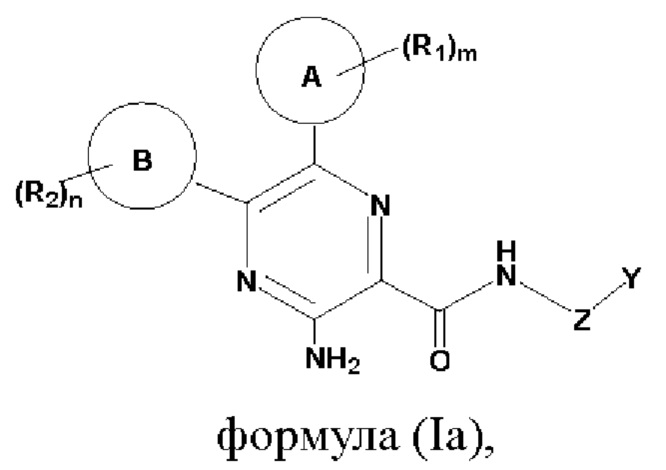
или его фармацевтически приемлемая соль,
где кольцо А выбрано из
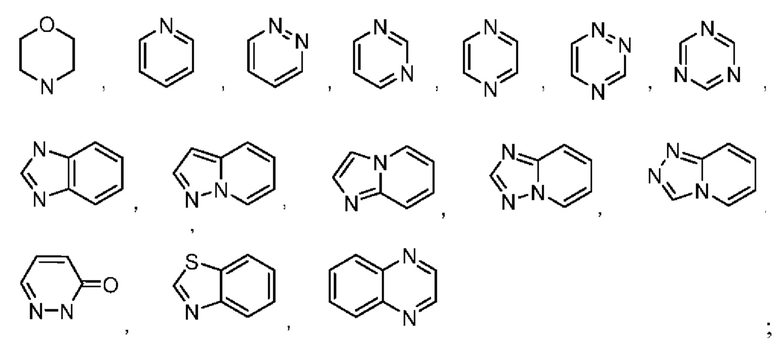
кольцо В представляет собой 5-6-членный ненасыщенный карбоциклил либо 5-6-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из О и N, где одна из образующих кольцо групп -СН2- возможно замещена группой -С(О)-;
Z представляет собой -С1-12алкилен- или связь;
Y представляет собой амино, карбамоил, карбонил, сульфонил, С1-12алкил, С1-12алкоксил, С1-12алкил-ОН, С1-12алкил-циано, С1-12галогеналкоксил, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(C1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алкилсульфонил, С1-12алканоиламино, 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из N, О и S, где одна из образующих кольцо групп -СН2- возможно замещена группой -С(О)-, каждый из которых возможно может быть замещен однократно или независимо многократно группой R3;
каждый R1 независимо выбран из фтора, хлора, брома, амино, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метиламино, диметиламино этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила или оксетанила, каждый из которых возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 независимо представляет собой галоген, С1-12алкил или C1-12галогеналкил;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-12алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, содержащего 1-2 гетероатома, независимо выбранных из N и О, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(C1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино или С1-12алкил-замещенный циклоалкил;
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3 или 4.
15. Соединение по п. 14, где Z представляет собой связь, Y представляет собой циклобутил, монозамещенный С1-12алкоксилом, возможно метоксилом.
16. Соединение по п. 14, где Z представляет собой этилен, Y представляет собой метоксил.
17. Соединение по п. 1, имеющее структуру формулы (Ia-i)

или его фармацевтически приемлемая соль,
где кольцо А выбрано из
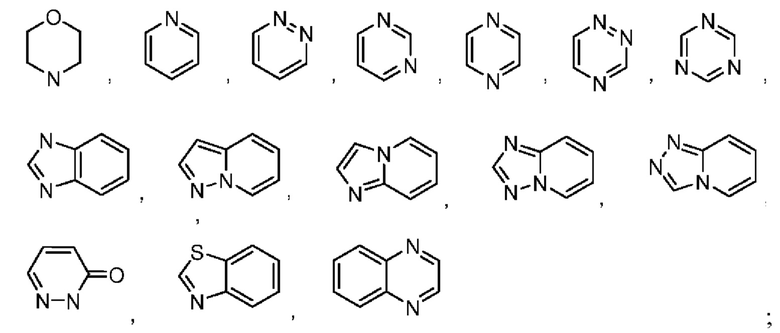
кольцо В представляет собой 5-6-членный ненасыщенный карбоциклил либо 5-6-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из О и N, где одна из образующих кольцо групп -СН2- возможно замещена группой -С(О)-;
кольцо Q представляет собой 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из N, О и S, где одна из образующих кольцо групп СН2- возможно замещена группой -С(О)-;
R7 представляет собой водород, С1-12алкил, С1-12алкоксил или С1-12алкил-ОН;
каждый R1 независимо выбран из фтора, хлора, брома, амино, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метиламино, диметиламино или этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила или оксетанила, каждый из которых возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 независимо представляет собой галоген, С1-12алкил или С1-12галогеналкил;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-12алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, содержащего 1-2 гетероатома, независимо выбранных из N и О, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(C1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино или С1-12алкил-замещенный циклоалкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3 или 4; и
i равно 0, 1, 2, 3 или 4.
18. Соединение по п. 1, имеющее структуру формулы (Ib)
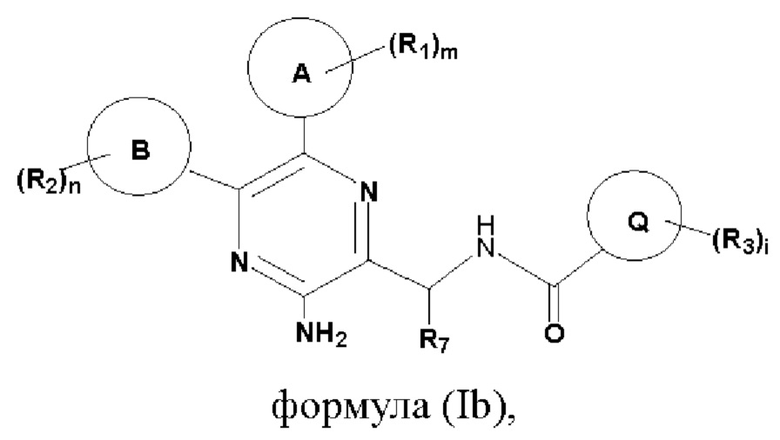
или его фармацевтически приемлемая соль,
где кольцо А выбрано из
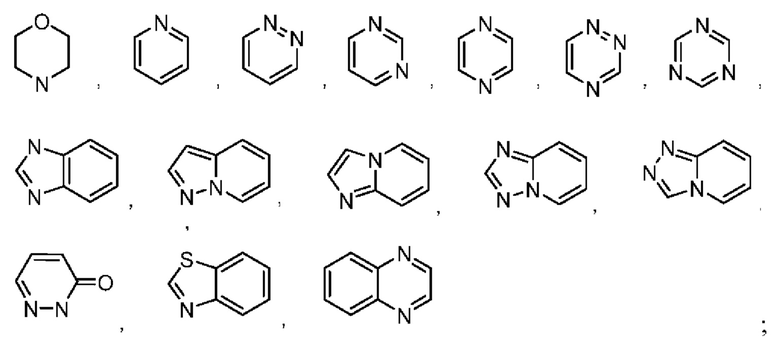
кольцо В представляет собой 5-6-членный ненасыщенный карбоциклил либо 5-6-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из О и N, где одна из образующих кольцо групп -CH2- возможно замещена группой -С(О)-;
кольцо Q представляет собой 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из N, О и S, где одна из образующих кольцо групп -СН2- возможно замещена группой -С(О)-;
R7 представляет собой водород;
каждый R1 независимо выбран из фтора, хлора, брома, амино, циано, метила, этила, н-пропила, изопропила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метиламино, диметиламино этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила или оксетанила, каждый из которых возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R2 независимо представляет собой галоген, С1-12алкил или С1-12галогеналкил;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12 галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (C1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, С1-12алканоиламино, N-(С1-12алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, содержащего 1-2 гетероатома, независимо выбранных из N и О, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(C1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино или С1-12алкил-замещенный циклоалкил;
m равно 0, 1, 2, 3 или 4;
n равно 0, 1, 2, 3 или 4; и
i равно 0, 1, 2, 3 или 4.
19. Соединение по п. 14, 17 или 18, где кольцо А выбрано из
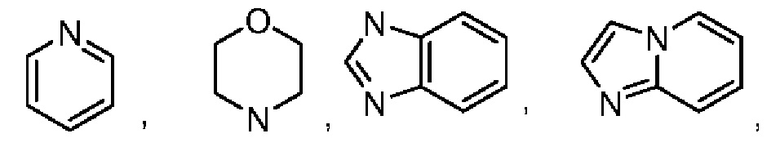
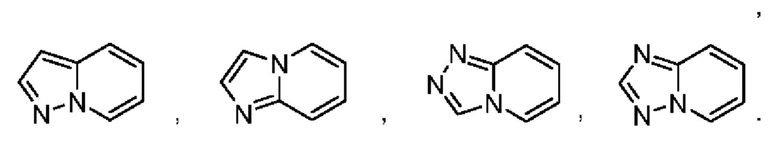
20. Соединение по п. 14, 17 или 18, где каждый R1 независимо выбран из фтора, хлора, амино, метила, этила, изопропила, фторметила, дифторметила, трифторметила, гидроксиэтила, гидроксипропила, метоксиэтила, 2-гидроксипропила, циклопропила или оксетанила.
21. Соединение по п. 14, 17 или 18, где m равно 0, 1 или 2.
22. Соединение по п. 14, 17 или 18, где кольцо В выбрано из:

23. Соединение по п. 14, 17 или 18, где R2 представляет собой метил или фтор.
24. Соединение по п. 14, 17 или 18, где n равно 0 или 1.
25. Соединение по п. 17 или 18, где кольцо Q выбрано из:

26. Соединение по п. 14, 17 или 18, где каждый R3 независимо выбран из фтора, хлора, брома, циано, метила, этила, фторметила, дифторметила, трифторметила, метоксила, этоксила, дифторметоксила, трифторметоксила, трифторэтоксила, гидроксиметила, гидроксиэтила, гидроксиэтилоксила, метоксиэтилоксила, амино, метиламино, диметиламино, этиламино, изопропиламино, гидроксиэтиламино, метиламиноэтилоксила, диметиламиноэтилоксила, диметилфосфинил-метила, карбамоила, карбамоилметоксила, азетидинила, пирролидила, морфолинила, пиразинила, диметиламиноазетидинила, 1-метил-пиразин-4-ила, 3-метил-3,8-диаза-бицикло[3.2.1]октан-8-ила, 3-метил-3,6-диаза-бицикло[3.1.1]гептанила, 8-метил-3,8-диаза-бицикло[3.2.1]октан-3-ила, 6-метил-2,6-диаза-спиро[3.4]октан-2-ила или 5-метил-2,5-диаза-спиро[3.3]-гептан-2-ила.
27. Соединение по п. 17 или 18, где i равно 0, 1, 2 или 3.
28. Соединение по п. 1, имеющее структуру формулы (Ia-ii)

или его фармацевтически приемлемая соль,
где кольцо А выбрано из

Z представляет собой -С1-12алкилен- или связь;
Y представляет собой С1-12алкил, С1-12алкоксил, С1-12алкил-ОН, 3-6-членный насыщенный или ненасыщенный карбоциклил либо 3-6-членный насыщенный или ненасыщенный гетероциклил, содержащий 1-3 гетероатома, независимо выбранных из N, О и S, где одна из образующих кольцо групп -СН2- возможно замещена группой -С(О)-, каждый из которых возможно может быть замещен однократно или независимо многократно группой R3;
каждый R1 независимо выбран из фтора, хлора, брома, амино, циано, С1-12алкила, фторметила, дифторметила, трифторметила, фторэтила, дифторэтила, трифторэтила, метиламино, диметиламино, этиламино, гидроксиметила, гидроксиэтила, циклопропила, оксациклопентанила или оксетанила, каждый из которых возможно может быть дополнительно замещен однократно или независимо многократно группой R4;
каждый R3 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, фосфорила, фосфинила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С3-12циклоалкил)амино, N-(С1-12алкил)карбамоил, N,N-(C1-12алкил)2карбамоил, (С1-12алкил)сульфонил, (С1-12алкил)фосфинил, (С1-12алкил)2фосфинил, (С1-12алкил)фосфорил, (С1-12алкил)2фосфорил, C1-12алканоиламино, N-(С1-12алкил-ОН)амино, 3-10-членного насыщенного или ненасыщенного карбоциклила либо 3-10-членного насыщенного или ненасыщенного гетероциклила, содержащего 1-2 гетероатома, независимо выбранных из N и О, при этом каждый R3 возможно может быть дополнительно замещен однократно или независимо многократно группой R6;
каждый R4 независимо выбран из галогена, гидроксила, циано, амино, С1-12алкила, С1-12галогеналкила, С1-12алкоксила или С1-12галогеналкоксила;
каждый R6 независимо выбран из галогена, гидроксила, циано, амино, карбамоила, сульфонила, С1-12алкила, С1-12галогеналкила, С1-12алкоксила, С1-12галогеналкоксила, групп С1-12алкил-ОН, N-(С1-12алкил)амино, N,N-(С1-12алкил)2амино, N-(С1-12алкил)карбамоил, N,N-(С1-12алкил)2карбамоил, С1-12алканоиламино или С1-12алкил-замещенный циклоалкил;
m равно 0, 1, 2, 3 или 4; и
n равно 0, 1, 2, 3 или 4.
29. Соединение по п. 28, где кольцо А представляет собой азаиндолизинил.
30. Соединение по п. 28, где m равно 1 и R1 представляет собой С1-12алкил, предпочтительно C1-3алкил, более предпочтительно метил.
31. Соединение по п. 28, где Z представляет собой связь, Y представляет собой циклобутил, монозамещенный метоксилом.
32. Соединение по п. 28, где Z представляет собой этилен, Y представляет собой метоксил.
33. Соединение по п. 28, где Z представляет собой метилен, Y представляет собой фенил, пирролидил или тетрагидрофурил, каждый из которых возможно может быть замещен однократно или независимо многократно группой R3.
34. Соединение по п. 33, где R3 представляет собой галоген или С1-12алкил.
35. Соединение по п. 33, где R3 представляет собой фтор или метил.
36. Соединение, выбранное из группы, состоящей из:
3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-((3-фторпиридин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
N-((3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(5-метилфуран-2-ил)пиразин-2-ил)метил)-2,6-дифторбензамида;
3-амино-N-(2,6-дифторбензил)-6-(2,6-диметилпиридин-4-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(2,6-диметилморфолино)-5-(4-фторфенил)пиразин-2-карбоксамида;
N-((3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил)метил)-2-фтор-6-(трифторметил)бензамида;
N-((3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-ил)метил)пиколинамида;
3-амино-N-((6-(диметиламино)пиридин-2-ил)метил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(2-метилпиридин-4-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)-N-((3-(трифторметил)пиридин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-((6-(диметиламино)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(2-метилпиридин-4-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(диметиламино)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-N-((3-фторпиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(диметиламино)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(диметиламино)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-метоксипиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-((6-метилпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(1-(2,6-дифторфенил)этил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
N-((3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил)метил)-3-(дифторметокси)пиколинамида;
3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-((5-метилтиазол-4-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-((6-(метиламино)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-аминопиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((4-(диметиламино)пиримидин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(азетидин-1-ил)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(5-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)-N-((6-(пирролидин-1-ил)пиридин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)-N-((3-(трифторметокси)пиридин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-6-(1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил)-N-((3-фторпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(имидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(3-(диметиламино)-2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
6-([1,2,4]триазоло[4,3-а]пиридин-6-ил)-3-амино-N-(2,6-дифторбензил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-(гидроксиметил)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридазин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-(2,6-дифторбензил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-фтор-6-морфолинобензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(1-(2,6-дифторфенил)этил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксиэтил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-5-(оксазол-2-ил)-6-(1-(оксетан-3-ил)-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-N-((3-фторпиридин-2-ил)метил)-6-(имидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(имидазо[1,2-а]пиридин-6-ил)-N-((2-метилтиазол-4-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(имидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(тиазол-4-илметил)пиразин-2-карбоксамида;
3-амино-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-N-((3-(метиламино)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(1Н-бензо[d]имидазол-5-ил)-N-((3-фторпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-аминопиридин-2-ил)метил)-6-(имидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-амино-3-фторпиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-фтор-6-(метиламино)пиридин-2-ил)метил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-фторпиридин-2-ил)метил)-6-(3-метил-3Н-бензо[d]имидазол-5-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(4-фтор-2-метоксибензил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-(2-(трифторметил)бензил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(3-фтор-2-метоксибензил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-N-(2-(дифторметил)бензил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1Н-пиразол-1-ил)пиразин-2-карбоксамида;
3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-N-((3-(дифторметокси)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-N-(2-(дифторметокси)фенил)-5-(3-метил-1Н-пиразол-1-ил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-6-(2-амино-6-метилпиридин-4-ил)-N-(2-(дифторметокси)фенил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(2,6-диметилпиридин-4-ил)-5-(5-метилфуран-2-ил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(2,6-диметилпиридин-4-ил)-5-(1-метил-1Н-пиразол-4-ил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-(2-(трифторметокси)бензил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-((2-метоксипиридин-3-ил)метил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-N-(2-метоксибензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-6-(2-хлор-6-метилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида;
3-амино-6-(1-этил-6-оксо-1,6-дигидропиридин-3-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-6-(1-изопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-(2-метоксибензил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-((3-метоксипиридин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-(2-(дифторметокси)бензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-N-(2-(дифторметокси)-6-фторбензил)-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(5-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-(3-метил-1Н-пиразол-1-ил)пиразин-2-карбоксамида;
3-амино-6-(1-(дифторметил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-5-(4-фторфенил)-6-(1-(оксетан-3-ил)-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-фторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-N-(2-хлорбензил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-N-(2-бромбензил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метилбензил)пиразин-2-карбоксамида;
3-амино-6-(1,5-диметил-6-оксо-1,6-дигидропиридин-3-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида;
3-амино-6-(2-амино-6-метилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-этилбензил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-N-(2-(дифторметокси)-6-фторбензил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида;
N-((3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-ил)метил)-2-метоксибензамида;
3-амино-6-(1-циклопропил-6-оксо-1,6-дигидропиридин-3-ил)-N-(2,6-дифторбензил)-5-(4-фторфенил)пиразин-2-карбоксамида;
N-((3-амино-5-(4-фторфенил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-ил)метил)-2,6-дифторбензамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)-N-(2-метоксибензил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-фтор-6-метоксибензил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-N-(2-(дифторметокси)бензил)-6-(2,6-диметилпиридин-4-ил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(5-фтор-2-метоксибензил)-5-(4-фторфенил)пиразин-2-карбоксамида;
3-амино-6-(2,6-диметилпиридин-4-ил)-N-(2-метоксибензил)-5-фенилпиразин-2-карбоксамида;
3-амино-6-(имидазо[1,2-а]пиридин-6-ил)-N-((5-метилтиазол-4-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((4-аминопиримидин-2-ил)метил)-6-(имидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-(диметилфосфорил)-6-фторбензил)-6-(имидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-(диметилфосфорил)-6-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(1-(2,6-дифторфенил)-2-гидроксиэтил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(имидазо[1,2-а]пиридин-6-ил)-N-((6-(метиламино)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
6-([1,2,4]триазоло[1,5-а]пиридин-6-ил)-3-амино-N-((3-фторпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-фторпиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-(3-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-(2-метоксиэтил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-фторпиридин-2-ил)метил)-6-(имидазо[1,2-а]пиридин-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-5-(оксазол-2-ил)-6-(6-оксо-1,6-дигидропиридин-3-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
3-амино-N-(2-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-хлор-6-фторбензил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(3-(диметиламино)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((6-(4-метилпиперазин-1-ил)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-N-((3-(2-гидроксиэтокси)пиридин-2-ил)метил)-6-(3-метил-3Н-бензо[d]имидазол-5-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-N-((3-(2-метоксиэтокси)пиридин-2-ил)метил)-6-(3-метил-3Н-бензо[d]имидазол-5-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-6-(3-метил-3Н-бензо[d]имидазол-5-ил)-N-((3-(2-(метиламино)этокси)пиридин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-((3-(2-(диметиламино)этокси)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(3-метил-3H-бензо[d]имидазол-5-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-N-((3-(2-гидроксиэтиламино)пиридин-2-ил)метил)-6-(3-метил-3Н-бензо[d]имидазол-5-ил)пиразин-2-карбоксамида;
3-амино-N-((4-(диметиламино)пиридин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-(2-амино-2-оксоэтокси)пиридин-2-ил)метил)-5-(4-фторфенил)-6-(3-метил-3H-бензо[d]имидазол-5-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(пирролидин-2-илметил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(пирролидин-2-илметил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпиперидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-2-ил)метил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-2-ил)метил)пиразин-2-карбоксамида;
(R)-3-амино-6-(3-этилпиразоло[1,5-а]пиридин-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-этилпиразоло[1,5-а]пиридин-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-метил-3Н-бензо[d]имидазол-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-6-(3-метил-3Н-бензо[d]имидазол-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-этил-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-изопропил-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(оксетан-2-илметил)пиразин-2-карбоксамида (изомеров);
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида;
(R)-3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида;
(S)-3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-(2-цианоэтил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(3-(диметиламино)-3-оксопропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-(1-метилпирролидин-3-ил)пиразин-2-карбоксамида;
(R)-3-амино-N-(2-гидроксипропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-N-(2-гидроксипропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-метоксиэтил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(2-(трифторметокси)этил)пиразин-2-карбоксамида;
3-амино-N-(3-метоксипропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-(2-(метилсульфонил)этил)пиразин-2-карбоксамида;
3-амино-N-((1r,3r)-3-метоксициклобутил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((1s,3s)-3-метоксициклобутил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-(диметиламино)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((1-(диметиламино)циклопропил)метил)-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоксамида;
3-амино-N-(циклопропилметил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-N-((3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида;
(R)-N-((3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида;
N-(2-(1H-пиразол-1-ил)этил)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-N-(1-метоксипропан-2-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-N-(1-метоксипропан-2-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-N-((4,4-дифтор-1-метилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-N-((4,4-дифтор-1-метилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(тетрагидро-2Н-пиран-3-ил)пиразин-2-карбоксамида (изомеров);
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидро-2Н-пиран-2-ил)метил)пиразин-2-карбоксамида (изомеров);
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидро-2Н-пиран-3-ил)метил)пиразин-2-карбоксамида (изомеров);
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((тетрагидрофуран-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((тетрагидрофуран-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(1-метил-1,6-диазаспиро[3.3]гептан-6-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-((1R,5S)-3-метил-3,8-диазабицикло[3.2.1]октан-8-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-((1R,5S)-8-метил-3,8-диазабицикло[3.2.1]октан-3-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(3-метил-3,6-диазабицикло[3.1.1]гептан-6-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(6-метил-2,6-диазаспиро[3.4]октан-2-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((6-(1-метилпиперидин-4-ил)пиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(1-(2,6-дифторфенил)этил)-6-(1-метил-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(1-(2-гидроксипропил)-6-оксо-1,6-дигидропиридин-3-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(пирролидин-2-илметил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпиперидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-2-ил)метил)пиразин-2-карбоксамида;
3-амино-6-(3-этилпиразоло[1,5-а]пиридин-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метил-3Н-бензо[d]имидазол-5-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(оксетан-2-илметил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-(1-метилпирролидин-3-ил)пиразин-2-карбоксамида;
3-амино-N-(2-гидроксипропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((1r,3r)-3-метоксициклобутил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
N-((3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида;
3-амино-N-(1-метоксипропан-2-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((4,4-дифтор-1-метилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(тетрагидро-2Н-пиран-3-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидро-2Н-пиран-2-ил)метил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидро-2Н-пиран-3-ил)метил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((тетрагидрофуран-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-(аминометил)имидазо[1,2-а]пиридин-6-ил)-N-((3-фторпиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-N-((3-(2-(метиламино)этокси)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоксамида 2,2,2-трифторацетата;
(R)-3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-(1-метилпирролидин-3-ил)пиразин-2-карбоксамида;
(S)-3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-(1-метилпирролидин-3-ил)пиразин-2-карбоксамида;
(S)-3-амино-5-(3-метил-1Н-пиразол-1-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида;
(R)-3-амино-5-(3-метил-1H-пиразол-1-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)-6-(3-(трифторметил)имидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоксамида (изомеров);
(R)-(3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)(3-(диметиламино)пирролидин-1-ил)метанона;
(S)-(3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)(3-(диметиламино)пирролидин-1-ил)метанона;
(R)-(3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)(2-(метоксиметил)пирролидин-1-ил)метанона;
(S)-(3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)(2-(метоксиметил)пирролидин-1-ил)метанона;
3-амино-N-(2-(1-метил-1Н-имидазол-2-ил)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
рац-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((4-метилморфолин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(2-(2-оксопирролидин-1-ил)этил)пиразин-2-карбоксамида;
(R)-3-амино-6-(3-хлоримидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-хлоримидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((1-метил-5-оксопирролидин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
рац-N-((1,4-диоксан-2-ил)метил)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
рац-3-амино-N-((1-метил-5-оксопирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(3-оксо-3-(пиперидин-1-ил)пропил)пиразин-2-карбоксамида;
3-амино-N-((1-метил-2-оксопирролидин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(3-оксо-3-(пирролидин-1-ил)пропил)пиразин-2-карбоксамида;
3-амино-N-циклобутил-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-N-((1-(циклопропанкарбонил)пирролидин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-N-((1-(циклопропанкарбонил)пирролидин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(бицикло[1.1.1]пентан-1-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-фторпиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-морфолинопиразин-2-карбоксамида;
цис-3-амино-N-((6-(3-(диметиламино)циклобутиламино)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
транс-3-амино-N-((6-(3-(диметиламино)циклобутиламино)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(3-(метиламино)-3-оксопропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((тетрагидрофуран-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((тетрагидрофуран-2-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
рац-3-амино-N-(2-метоксипропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-метоксипропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((1,4,4-триметилпирролидин-2-ил)метил)пиразин-2-карбоксамида (изомеров);
(R)-3-амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида;
3-амино-N-((6-(3-(диметиламино)пирролидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
рац-3-амино-N-(2-(метил(тетрагидрофуран-3-ил)амино)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-N-(4-(диметиламино)-4-оксобутан-2-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-N-(4-(диметиламино)-4-оксобутан-2-ил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(2-(2-оксопиридин-1(2Н)-ил)этил)пиразин-2-карбоксамида;
3-амино-N-(2,6-дифторбензил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-морфолинопиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-((тетрагидро-2Н-пиран-4-ил)метил)пиразин-2-карбоксамида;
3-амино-N-(2-(метил(пиридин-2-ил)амино)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((тетрагидрофуран-3-ил)метил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-метоксиэтил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(2-(метил(фенил)амино)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-циклопропил-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((4-метилморфолин-2-ил)метил)пиразин-2-карбоксамида (изомеров);
3-амино-N-((1,2-диметилпирролидин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
3-амино-N-(4-метоксициклогексил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((3-метилтетрагидрофуран-3-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
3-амино-N-(2-циклопропил-2-(диметиламино)этил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида (изомеров);
3-амино-N-((1-метил-2-оксопиперидин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(тетрагидрофуран-3-ил)пиразин-2-карбоксамида;
(S)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(тетрагидрофуран-3-ил)пиразин-2-карбоксамида;
3-амино-5-(4-фторфенил)-N-((1-метил-2-оксопирролидин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-карбоксамида;
(R)-N-((3-амино-5-(3,4-дифторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)-N-(1-(тетрагидрофуран-2-ил)этил)пиразин-2-карбоксамида;
(R)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)-5-фенилпиразин-2-карбоксамида;
3-амино-N-((4,4-диметилоксетан-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(3-((диметиламино)метил)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-N-((3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)тетрагидрофуран-3-карбоксамида;
(R)-N-((3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)тетрагидрофуран-3-карбоксамида;
(S)-N-((3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)тетрагидрофуран-2-карбоксамида;
(R)-N-((3-амино-5-(4-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)тетрагидрофуран-2-карбоксамида;
цис-3-амино-N-(3-(диметиламино)циклобутил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
транс-3-амино-N-(3-(диметиламино)циклобутил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-5-(3,4-дифторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((1-метилпирролидин-2-ил)метил)пиразин-2-карбоксамида;
(S)-3-амино-N-((1-(диметилкарбамоил)пирролидин-3-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-N-((6-морфолинопиридин-2-ил)метил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-N-((3-амино-5-(3-фторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида;
3-амино-N-((-3-метокситетрагидрофуран-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(3-(диметиламино)-2,2-диметил-3-оксопропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-((1R,4R)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-((1S,4S)-5-метил-2,5-диазабицикло[2.2.1]гептан-2-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(6-метил-2,6-диазаспиро[3.3]гептан-2-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-3-амино-N-((6-(3,4-диметилпиперазин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-N-((6-(3,4-диметилпиперазин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-3-амино-N-((6-(2,4-диметилпиперазин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3,3-диметилоксетан-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-N-((3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида;
(R)-N-((3-амино-5-(3,5-дифторфенил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)пиразин-2-ил)метил)-1-метилпирролидин-2-карбоксамида;
3-амино-N-(3-метоксициклогексил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-N-(1-(1Н-1,2,3-триазол-1-ил)пропан-2-ил)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(S)-N-(1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
(R)-N-(1-(2Н-1,2,3-триазол-2-ил)пропан-2-ил)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-(3-метоксипропил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(2Н-1,2,3-триазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-(2-гидроксиэтокси)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((3-(2-(метиламино)этокси)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(4-(диметиламино)пиперидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-N-((6-(3-(метиламино)азетидин-1-ил)пиридин-2-ил)метил)-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида;
3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(пиридин-2-ил)-N-((тетрагидрофуран-3-ил)метил)пиразин-2-карбоксамида;
рац-N-(1-(1H-1,2,4-триазол-1-ил)пропан-2-ил)-3-амино-6-(3-метилимидазо[1,2-а]пиридин-6-ил)-5-(оксазол-2-ил)пиразин-2-карбоксамида,
или его фармацевтически приемлемая соль.
37. Фармацевтическая композиция, способная ингибировать аденозиновые рецепторы, которая содержит эффективное количество одного или более соединений по любому из пп. 1-36 и фармацевтически приемлемый носитель.
38. Применение одного или более соединений по любому из пп. 1-36 в изготовлении лекарственного средства для лечения заболевания, ассоциированного с аденозиновыми рецепторами.
39. Применение по п. 38, где ассоциированное с аденозиновыми рецепторами заболевание представляет собой рак, болезнь Паркинсона, эпилепсию, церебральную ишемию и инсульт, депрессию, когнитивную недостаточность, инфекцию вирусом иммунодефицита человека (ВИЧ), вызванный дефицитом аденозиндезаминазы тяжелый комбинированный иммунодефицит (ADA-SCID), острую сердечную недостаточность и хроническую сердечную недостаточность, хроническую обструктивную болезнь легких (COPD) или астму.
40. Применение по п. 39, где рак представляет собой NSCLC (немелкоклеточный рак легкого), RCC (почечноклеточная карцинома), рак предстательной железы или рак молочной железы.
41. Применение по п. 39, где лекарственное средство используют в комбинации с лучевой терапией, химиотерапией или иммунотерапией.
42. Способ ингибирования аденозиновых рецепторов, включающий введение субъекту эффективного количества одного или более соединений по любому из пп. 1-36 или фармацевтической композиции по п. 37.
43. Способ по п. 42, дополнительно включающий введение одного или более чем одного иммунотерапевтического средства или химиотерапевтического средства субъекту.
44. Способ по п. 42, дополнительно включающий назначение лучевой терапии субъекту.
45. Комбинация, способная ингибировать аденозиновые рецепторы, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по любому из пп. 1-36 и иммунотерапевтические средства или химиотерапевтические средства.
46. Комбинация по п. 45, где указанные иммунотерапевтические средства выбраны из группы, состоящей из антитела к PD-1/PD-L1 (белок 1 программируемой (клеточной) смерти/лиганд PD-1), антитела к CTLA-4 (цитотоксический Т-лимфоцитарный антиген 4), антитела к CD73 (кластер дифференцировки 73), антитела к CD39, антитела к CCR2 (хемокиновый рецептор 2 семейства С-С) и любой их комбинации.
47. Комбинация по п. 46, где указанные химиотерапевтические средства выбраны из группы, состоящей из химиотерапевтических средств на основе платины (цисплатина, оксалиплатиона), доцетаксела, паклитаксела, доксорубицина, этопозида, митоксантрона и любой их комбинации.
| WO 2005040151 A1, 06.05.2005 | |||
| WO 2005095384 A1, 13.10.2005 | |||
| WO 2016081290 A1, 26.05.2016. |
Авторы
Даты
2023-12-14—Публикация
2019-08-16—Подача