Область техники, к которой относится настоящее изобретение
Настоящее изобретение относится к имидазохинолиновым соединениям содержащим мочевинную, тиомочевинную, ацилмочевинную или сульфонилмочевинную функциональную группу в положении 1, к фармацевтическим препаратам, содержащим эти соединения, и к фармацевтическим препаратам, содержащим имидазохинолиновые соединения с карбаматной функциональной группой в положении 1. Кроме того, настоящее изобретение относится к использованию этих соединений в качестве иммуномодуляторов, индуцирующих биосинтез цитокинов у животных, и для лечения различных патологий, в том числе вирусных и неоплазических заболеваний.
Предпосылки к созданию изобретения
В первом заслуживающем доверия сообщении о циклической системе 1Н-имидазо[4,5-с]хинолина Бэкман и др. (Backman et al., J.Orq.Chem. 15,1278-1284 (1950)) описывают синтез 1-(6-метокси-8-хинолинил)-2-метил-1Н-имидазо[4,5-с]хинолина для возможного использования в качестве противомалярийного средства. Впоследствии были описаны синтезы различных замещенных 1Н-имидазо[4,5-с]хинолинов. Например, Джэйн и др. (Jain et al., J.Med.Chem. 11, pp.87-92 (1988)) синтезировали соединение 1-[2-(4-пиперидил)этил]-1Н-имидазо[4,5-с]хинолин для использования в качестве противосудорожного и сердечнососудистого средства. Баранов и др. (Baranov et al., Chem.Abs. 85, 94362 (1976)) также сообщали о нескольких 2-оксоимидазо[4,5-с]хинолинах, а Берени и др. (Berenyi et al., J. Heterocyclic Chem. 18,1537-1540 (1981)) описали некоторые оксоимидазо[4,5-с]хинолины.
Впоследствии выяснилось, что некоторые 1Н-имидазо[4,5-с]хинолин-4-амины и их замещенные в положениях 1 и 2 производные могут применяться в качестве антивирусных средств, бронхолитических средств и иммуномодуляторов. Они описаны, в том числе, в патентах США №№4689338, 4698348,4929624, 5037986, 5268376, 5346905 и 5389640, которые все инкорпорированы в настоящее изобретение путем отсылки.
Интерес к циклическим имидазохинолиновым системам сохраняется. Например, в ЕР 894797 описываются соединения имидазохинолинового типа, имеющие амидосодержащий заместитель в положении 1. В описании этого патента показано, что активные соединения этого ряда должны иметь концевой аминный заместитель, который может быть включен в гетероциклическое кольцо. Другим примером может служить WO 00/09506 который описывает имидазопиридиновые и имидазохинолиновые соединения, которые могут иметь амидо- или мочевиносодержащий заместитель в положении 1. Те соединения, которые согласно этой публикации могут иметь практическое применение, содержат заместитель в положении 1, в котором амидный или мочевинный азот является частью гетероциклического кольца. Несмотря на эти работы по выявлению соединений, которые могут быть использованы в качестве иммуномодуляторов, сохраняется потребность в соединениях, способных модулировать иммунный ответ, индуцирующих биосинтез цитокинов или активирующих другие механизмы.
Краткая формулировка сущности изобретения
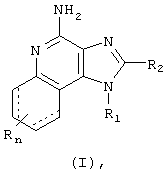
Мы открыли новый класс соединений, которые могут применяться для индукции у животных биосинтеза цитокинов. В соответствии с этим, в настоящем изобретении представлены имидазохинолиновые и тетрагидроимидазохинолиновые соединения Формулы (I):
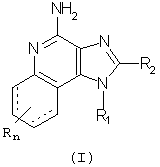
где R1, R2 и R определены ниже. Настоящее изобретение представляет также фармацевтические препараты, содержащие соединения формулы (Ia); причем эти соединения имеют ту же общую структурную формулу, что и названные выше соединения (I).
Соединения Формул I и (Ia) могут быть использованы в качестве иммуномодуляторов благодаря их способности индуцировать биосинтез цитокинов или иным способом модулировать иммунный ответ при их введении животным. Это позволяет применять эти соединения для лечения различных патологий, таких как вирусные заболевания и опухоли, чувствительных к таким изменениям иммунного ответа.
Кроме того, настоящее изобретение представляет фармацевтические препараты, содержащие терапевтически эффективные количества соединения Формулы (I) или (Ia), и методы индукции биосинтеза цитокинов у животных, лечения вирусной инфекции и/или лечения неоплазических патологий у животных путем введения животному соединения Формулы (I) или (Ia).
Помимо этого, представлены методы синтеза соединений настоящего изобретения и промежуточных продуктов, используемых в синтезе этих соединений.
Подробное описание изобретения
Как сказано выше, мы обнаружили, что некоторые соединения индуцируют биосинтез цитокинов у животных. Такие соединения представлены ниже Формулами (I) и (Ia).
В настоящем изобретении представлены соединения Формулы (I):

где
R1 - это -алкин-NR3-CY-NR5-X-R4 или -алкенил-NR3CY-NR5-X-R4; где
Y - это=O или=S;
Х - это связь, -СО- или -S02-;
R4 - это арил, гетероарил, гетероциклил, алкил или алкенил, каждый из которых может быть незамещенным или замещенным одним или более заместителями, выбираемыми из группы, в которую входят:
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- замещенный арил;
- замещенный гетероарил;
- замещенный гетероциклил;
-O-алкил;
-O-(алкил)0-1-арил;
-O-(алкил)0-1-замещенный арил;
-O-(алкил)0-1-гетероарил;
-O-(алкил)0-1-замещенный гетероарил;
-O-(алкил)0-1-гетероциклил;
-O-(алкил)0-1-замещенный гетероциклил;
-СООН;
-СО-O-алкил;
-СО-алкил;
-S(O)0-2-алкил;
-S(O)0-2-(алкил)0-1-арил;
-S(O)0-2-(алкил)0-1-замещенныйарил;
-S(O)0-2-(алкил)0-1-гетероарил;
-S(O)0-2-(алкил)0-1-замещенный гетероарил;
-S(O)0-2-(алкил)0-1-гетероциклил;
-S(O)0-2-(алкил)0-1-замещенный гетероциклил;
-(алкил)0-1-NR3R3;
-(алкил)0-1-NR3СО-O-алкил;
-(алкил)0-1-NR3СО-алкил;
-(алкил)0-1-NR3СО-арил;
-(алкил)0-1-NR3СО-замещенный арил;
-(алкил)0-1-NR3СО-гетероарил;
-(алкил)0-1-NR3СО-замещенный гетероарил;
-N3;
- галоген;
- галогеналкил;
- галогеналкоксил;
-СО-галогеналкоксил;
-NO2;
-CN;
-ОН; и
-SH; и в случае алкила, алкенила или гетероциклила, кетогруппа;
при том условии, что если Х - это связь, то R4 может также быть водородом.
R2 выбирается из группы, в которую входят:
- водород;
- алкил;
- алкенил;
- арил;
- замещенный арил
- гетероарил;
- замещенный гетероарил;
-алкил-O-алкил;
-алкил-O-алкенил; и
- алкил или алкенил, замещенный одним или более заместителями, выбираемыми из группы, в которую входят:
-ОН;
- галоген;
-N(R3)2;
-CO-N(R3)2;
-СО-алкил C1-10;
-СО-O-алкил C1-10;
-N3;
- арил;
- замещенный арил;
- гетероарил;
- замещенный гетероарил;
- гетероциклил;
- замещенный гетероциклил;
-СО-арил;
-CO-(замещенный арил);
-СО-гетероарил; и
-CO-(замещенный гетероарил);
каждый из R3 независимо выбирают из группы, в которую входят водород и алкил C1-10;
R5 выбирают из группы, в которую входят водород и алкил C1-10; либо R4 и R5 в совокупности могут образовывать 3-7-членное гетероциклическое или замещенное гетероциклическое кольцо;
n - это число от 0 до 4, а каждый R независимо выбирают из группы, в которую входят алкил C1-10 алкоксил C1-10, галоген и трифторметил, или его фармацевтически приемлемая соль.
Настоящее изобретение представляет также фармацевтические препараты, содержащие терапевтически эффективное количество соединения Формулы (Ia):
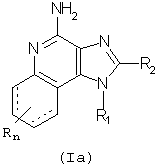
где
R1 - это -алкил-NR3-СО-O-R4 или -алкенил-NR3-СО-О-R4;
R4 - это арил, гетероарил, гетероциклил, алкил или алкенил, каждый из которых может быть незамещенным или замещенным одним или более заместителями, выбираемыми из группы, в которую входят:
- алкил;
- алкенил;
- арил;
- гетероарил;
- гетероциклил;
- замещенный арил;
- замещенный гетероарил;
- замещенный гетероциклил;
-O-алкил;
-O-(алкил)0-1-арил;
-O-(алкил)0-1-замещенный арил;
-O-(алкил)0-1-гетероарил;
-O-(алкил)0-1-замещенный гетероарил;
-O-(алкил)0-1-гетероциклил;
-O-(алкил)0-1-замещенный гетероциклил;
-СООН;
-СО-O-алкил;
-СО-алкил;
-S(O)0-2-алкил;
-S(O)0-2-(алкил)0-1-арил;
-S(O)0-2-(алкил)0-1-замещенныйарил;
-S(O)0-2-(алкил)0-1-гетероарил;
-S(O)0-2-(алкил)0-1-замещенный гетероарил;
-S(O)0-2-(алкил)0-1-гетероциклил;
-S(O)0-2-(алкил)0-1-замещенный гетероцикпил;
-(алкил)0-1-NR3R3;
-(алкил)0-1-NR3-СО-O-алкил;
-(алкил)0-1-NR3-СО-алкил;
-(алкил)0-1-NR3-СО-арил;
-(алкил)0-1-NR3-СО-замещенныйарил;
-(алкил)0-1-NR3-СО-гетероарил;
-(алкил)0-1-NR3-СО-замещенный гетероарил;
-N3;
- галоген;
- галогеналкил;
- галогеналкоксил;
-СО-галогеналкоксил;
-NO2;
-CN;
-ОН: и
-SH; и в случае алкила, алкенила или гетероциклила, кетогруппа;
R2 выбирается из группы, в которую входят:
- водород;
- алкил;
- алкенил;
- арил;
- замещенный арил
- гетероарил;
- замещенный гетероарил;
-алкил-O-алкил;
-алкил-O-алкенил; и
- алкил или алкенил, замещенный одним или более заместителями, выбираемыми из группы, в которую входят:
-ОН;
- галоген;
-N(R3)2;
-СО-N(R3)2;
-СО-алкил C1-10;
-СО-O-алкил C1-10;
-N3;
- арил;
- замещенный арил;
- гетероарил;
- замещенный гетероарил;
- гетероциклил;
- замещенный гетероциклил;
-СО-арил;
-CO-(замещенный арил);
-СО-гетероарил; и
-CO-(замещенный гетероарил);
каждый из R3 независимо выбирают из группы, в которую входят водород и алкил C1-10;
n - это число от 0 до 4, а каждый R независимо выбирают из группы, в которую входят алкил С1-10, алкоксил C1-10, галоген и трифторметил, или его фармацевтически приемлемая соль в сочетании с фармацевтически приемлемым носителем.
Получение соединений
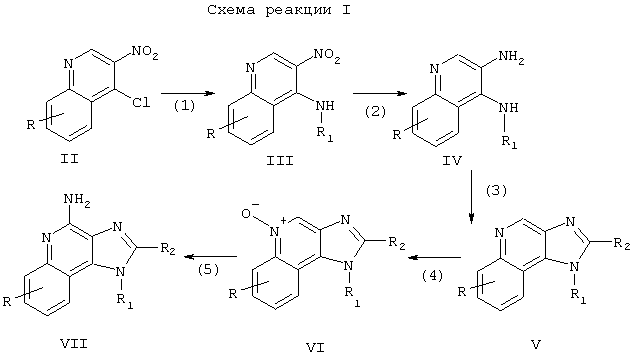
Имидазохинолины настоящего изобретения можно получить в соответствии со Схемой реакции 1, в которой R, R1, R2 и n определены выше.
На стадии (1) Схемы реакции 14-хлор-3-нитрохинолин Формулы II взаимодействует с амином формулы R1NH2, в которой R1 определен выше, с образованием 3-нитрохинолин-4-амина Формулы III. Реакцию можно осуществить, прибавляя амин к раствору соединения Формулы II в подходящем растворителе, таком как хлороформ или дихлорметан, с возможным нагреванием. Многие хинолины Формулы II это известные соединения (см., например, патент США №4689338 и ссылки в нем).
На стадии (2) Схемы реакции I 3-нитрохинолин-4-амин Формулы III восстанавливается до хинолин-3,4-диамина Формулы IV. Восстановление предпочтительно проводить на обычном гетерогенном катализаторе гидрирования, таком как платина на угле или палладий на угле. Реакцию удобно осуществлять в аппарате Парра в подходящем растворителе, таком как изопропиловый спирт или толуол.
На стадии (3) Схемы реакции I хинолин-3,4-диамин Формулы IV взаимодействует с карбоновой кислотой или ее эквивалентом с образованием 1Н-имидазо[4,5-с]хинолина Формулы V. Эквивалентом карбоновой кислоты вполне могут служить галогенангидриды, простые ортоэфиры и 1,1-диалкоксиалкилалканоаты. Карбоновую кислоту или ее эквивалент выбирают таким образом, чтобы обеспечить нужный заместитель R2 в Формуле V. Например, триэтилортоформиат позволит получить соединение, в котором R2 - это водород, а при использовании триэтилортоацетата образуется соединение, в котором R2 это метил. Реакция может протекать как в отсутствии растворителя, так и в таком инертном растворителе, как толуол. Реакцию проводят при значительном нагревании с тем, чтобы удалять любые спирты или воду, образующиеся в качестве побочных продуктов реакции.
На стадии (4) Схемы реакции I 1Н-имидазо[4,5-с]хинолин Формулы V под действием обычного окислителя, способного образовывать N-оксиды, окисляется до 1Н-имидазо[4,5-с]хинолин-5N-оксида Формулы VI. Реакцию предпочтительно проводить путем взаимодействия раствора соединения Формулы V в хлороформе с 3-хлорпероксибензойной кислотой при комнатных условиях.
На стадии (5) Схемы реакции I 1Н-имидазо[4,5-с]хинолин-5N-оксид Формулы VI аминируют с образованием 1Н-имидазо[4,5-с]хинолин-4-амина Формулы VII, которая является одним из вариантов Формулы I. Стадия (5) включает в себя (i) взаимодействие соединения Формулы VI с ацилирующим агентом, а затем (ii) взаимодействие продукта этой реакции с аминирующим агентом. Часть (i) стадии (5) включает в себя взаимодействие N-оксида Формулы VI с ацилирующим агентом. В качестве ацилирующих агентов целесообразно использовать алкил- или арилсульфонилхлориды (например, бензолсульфонилхлорид, метансульфонилхлорид, п-толуолсульфонилхлорид). Арилсульфонилхлориды предпочтительны. Наиболее предпочтителен пара-толуолсульфонилхлорид. Часть (ii) стадии (5) включает в себя взаимодействие продукта из части (i) с избытком аминирующего агента. В качестве аминирующих агентов целесообразно использовать аммиак (например, в виде гидроокиси аммония) или соли аммония (например, карбонат аммония, бикарбонат аммония, фосфат аммония). Гидроокись аммония предпочтительна. Реакцию предпочтительно осуществлять путем растворения N-оксида Формулы VI в инертном растворителе, таком как дихлорметан, прибавляя к раствору ацилирующий агент, а затем медленно прибавляя аминирующий агент. Продукт или его фармацевтически приемлемую соль можно выделить обычными способами.
По-другому стадию (5) можно провести путем (i) взаимодействия N-оксида Формулы VI с изоцианатом с последующим (ii) гидролизом полученного продукта. Часть (i) включает в себя взаимодействие N-оксида с изоцианатом, в котором изоцианатная группа подсоединена к карбонильной группе. К предпочтительным изоцианатам относятся трихлоацетилизоцианат и ароилизоцианаты, например, бензоилизоцианат. Взаимодействие изоцианата с N-оксидом протекает в безводных условиях путем прибавления изоцианата к раствору N-оксида в таком инертном растворителе, как хлороформ или дихлорметан. Часть (ii) включает в себя гидролиз продукта, полученного в части (i). Гидролиз можно осуществлять обычными методами, такими как нагревание в присутствии воды или низшего спирта, либо в присутствии такого катализатора, как гидроокись щелочного металла или низший алкоголят.
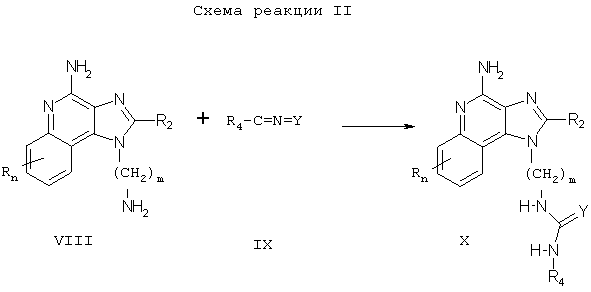
Соединения настоящего изобретения, в которых заместитель R1 содержит мочевину или тиомочевину, также могут быть получены в соответствии со Схемой реакции II, где R, R2, R4 и n определены выше, Y это О или S, a m - это целое число от 1 до 20.
Согласно Схеме реакции II аминоалкилзамещенный 1Н-имидазо[4,5-с]хинолин-4-амин Формулы VIII взаимодействует с изоцианатом или тиоизоцианатом Формулы IX с образованием соединения Формулы X, которая является одним из вариантов Формулы I. Реакцию можно проводить, прибавляя раствор (тио)изоцианата в подходящем растворителе, таком как дихлорметан, к раствору соединения Формулы VIII, возможно при пониженной температуре. Многие 1Н-имидазо[4,5-с]хинолин-4-амины это известные соединения, см., например, патент США №6069149 (Нанба (Nanba)); другие легко получаются известными синтетическими методами. Многие изоцианаты и тиоизоцианаты Формулы IX являются промышленными продуктами; другие легко получаются известными синтетическими методами. Продукт или его фармацевтически приемлемую соль выделяют с помощью обычных методов.
Соединения настоящего изобретения, в которых заместитель R1 содержит мочевину, также могут быть получены в соответствии со Схемой реакции III, где R1, R2, R4, R5 и n определены выше, a m - это целое число от 1 до 20.
Согласно Схеме реакции III аминоалкилзамещенный 1Н-имидазо[4,5-с]хинолин-4-амин Формулы VIII взаимодействует с карбамоилхлоридом Формулы XI с образованием соединения Формулы XII, которая является одним из вариантов Формулы I. Реакцию можно проводить прибавляя раствор карбамоилхлорида в подходящем растворителе, таком как пиридин, к раствору соединения Формулы VIII при комнатной температуре. Некоторые карбамоилхлориды Формулы XI являются промышленными продуктами; другие легко получаются известными синтетическими методами. Продукт или его фармацевтически приемлемую соль выделяют с помощью обычных методов.
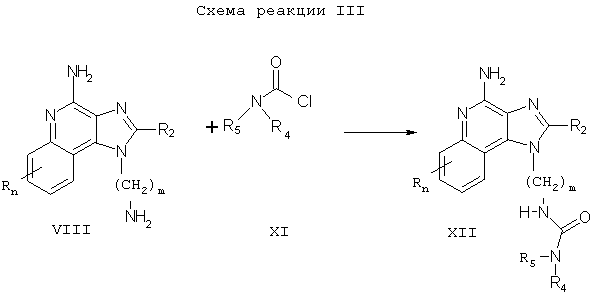
Соединения настоящего изобретения, в которых заместитель R1 содержит карбамат, также могут быть получены в соответствии со Схемой реакции IV, где R, R2, R4, n и m определены выше.
Согласно Схеме реакции IV, аминоалкилзамещенный 1Н-имидазо[4,5-с]хинолин-4-амин Формулы VIII взаимодействует с хлорформиатом Формулы XIII с образованием соединения Формулы XIV, которая является одним из вариантов Формулы Ia. Реакцию можно проводить, прибавляя раствор хлорформиата в подходящем растворителе, таком как дихлорметан или пиридин, к раствору соединения Формулы VIII, возможно при пониженной температуре. Многие хлорформиаты Формулы XIII являются промышленными продуктами; другие легко получаются известными синтетическими методами. Продукт или его фармацевтически приемлемую соль выделяют с помощью обычных методов.
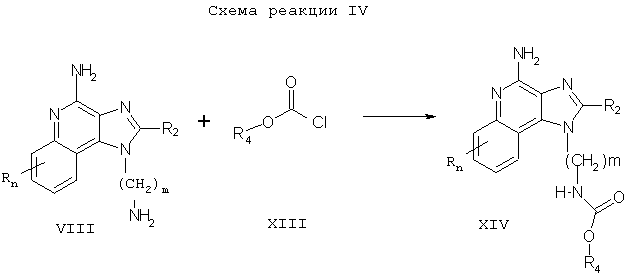
Соединения настоящего изобретения, в которых заместитель R1 содержит ацилмочевину, могут быть получены в соответствии со Схемой реакции V, где R1, R2, R4, n и m определены выше.
Согласно Схеме реакции V, аминоалкилзамещенный 1Н-имидазо[4,5-с]хинолин-4-амин Формулы VIII взаимодействует с ацилизоцианатом Формулы XV с образованием соединения Формулы XVI, которая является одним из вариантов Формулы I. Реакцию можно проводить, прибавляя раствор ацилизоцианата в подходящем растворителе, таком как дихлорметан, к раствору соединения Формулы VIII при пониженной температуре. Некоторые ацилизоцианаты Формулы XV являются промышленными продуктами; другие легко получаются известными синтетическими методами. Продукт или его фармацевтически приемлемую соль выделяют с помощью обычных методов.
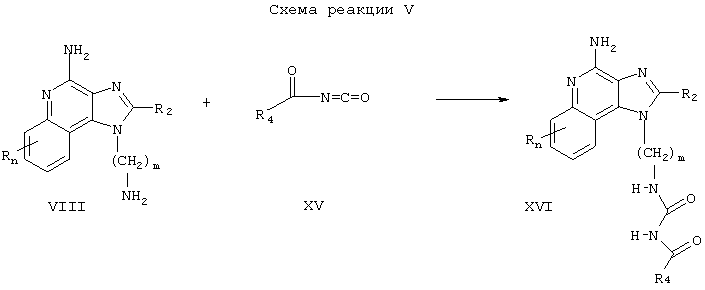
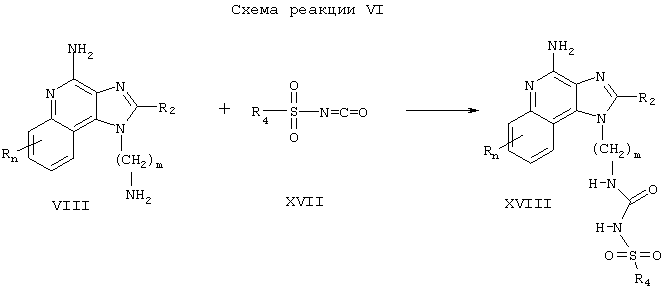
Соединения настоящего изобретения, в которых заместитель R1 содержит сульфонилмочевину, могут быть получены в соответствии со Схемой реакции V, где R, R2, R3, n и m определены выше.
Согласно Схеме реакции V аминоалкилзамещенный 1Н-имидазо[4,5-с]хинолин-4-амин Формулы VIII взаимодействует с сульфонилизоцианатом Формулы XVII с образованием соединения Формулы XVIII, которая является одним из вариантов Формулы I. Реакцию можно проводить, прибавляя раствор сульфонилизоцианата в подходящем растворителе, таком как дихлорметан, к раствору соединения Формулы VIII, возможно при пониженной температуре. Некоторые сульфонилизоцианаты Формулы XVII являются промышленными продуктами; другие легко получаются известными синтетическими методами. Продукт или его фармацевтически приемлемую соль выделяют с помощью обычных методов.
Тетрагидроимидазохинолины настоящего изобретения можно синтезировать в соответствии со Схемой реакции VII, где R2, R3, R4, R5, X, Y и m определены выше.
На стадии (1) Схемы реакции VI аминоалкилзамещенный 1Н-имидазо[4,5-с]хинолин-4-амин Формулы XIX восстанавливается до аминоалкилзамещенного 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амина Формулы XX. Реакцию восстановления предпочтительно проводить путем суспендирования или растворения соединения Формулы XIX в трифторуксусной кислоте, добавления каталитических количеств оксида платины (IV) и помещения реакционной смеси под давление водорода. Реакцию удобно проводить в аппарате Парра. Продукт или его соль можно выделить обычными методами.
Стадию (2) Схемы реакции VII можно проводить с помощью методов, описанных в Схемах реакций II, III, IV, V и VI, с образованием соединения Формулы XXI, которая является одним из вариантов Формулы I.
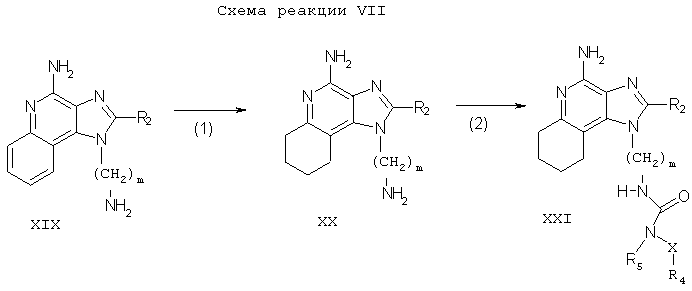
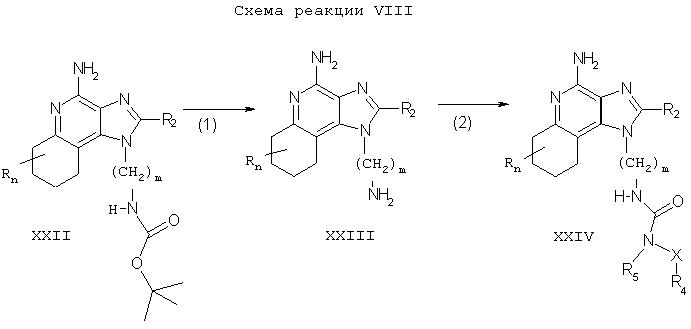
Тетрагидроимидазохинолины настоящего изобретения также можно синтезировать в соответствии со Схемой реакции VIII, где R1, R2, R3, R4, R5, X, Y, n и m определены выше.
На стадии (1) Схемы реакции VIII 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолинил-трет-бутилкарбамат Формулы XXII гидролизуется до аминоалкилзамещенного 6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амина Формулы XXIII. Реакцию можно осуществить путем растворения соединения Формулы XXII в смеси трифторуксусной кислоты и ацетонитрила и перемешивания при комнатной температуре. Помимо этого, соединение Формулы XXII можно смешать с разбавленной соляной кислотой и нагреть на паровой бане. Тетрагидро-1Н-имидазо[4,5-с]хинолинил-трет-бутилкарбаматы Формулы XX можно получить синтетическим методом, описанным в патенте США №5352784 (Николаидис (Nikolaides)). Продукт или его соль выделяют обычными методами.
Стадию (2) Схемы реакции VIII можно проводить с помощью методов, описанных в Схемах реакций II, III, IV, V и VI, с образованием соединения Формулы XXIV, которая является одним из вариантов Формулы I.
Некоторые соединения Формулы 1 легко можно получить из других соединений Формулы I. Например, соединения, в которых заместитель R4 содержит хлоралкильную группу, могут взаимодействовать с амином с образованием заместителя R4, замещенного вторичной или третичной аминогруппой; соединения, в которых заместитель R4 содержит нитрогруппу, могут восстанавливаться до соединения, в которых заместитель R4, содержит первичный амин.
В рамках настоящего изобретения, терминами "алкил", "алкенил", "алкинил" и приставкой "-алк" обозначают как линейные и разветвленные, так и циклические группы, т.е. циклоалкильные и циклоалкенильные группы. Если не указано иное, то эти группы содержат от 1 до 20 атомов углерода, тогда как алкенильные и алкинильные группы содержат от 2 до 20 атомов углерода. Предпочтительны группы, содержащие до 10 атомов углерода. Циклические группы могут быть моноциклическими или полициклическими и предпочтительно содержат от 3 до 10 атомов углерода, входящих в циклы. Примерами циклических групп могут служить циклопропил, циклопентил, циклогексил и адамантил.
Термином "галогеналкил" обозначают группы, замещенные одним или более галогенными атомами, в том числе группы, в которых все доступные атомы водорода замещены на атомы галогена. Это также относится к группам, в названии которых содержится приставка "галогеналк-". Примерами приемлемых галогеналкильных групп могут служить хлорметил, трифторметил и т.п.
В рамках настоящего изобретения, термином "арил" обозначают ароматические кольца и циклические системы. Примерами арильных групп могут служить фенил, нафтил, бифенил, флуоренил и инденил. Термином "гетероарил" обозначают ароматические кольца и циклические системы, содержащие в кольце по крайней мере один гетероатом (например, О, S, N). К приемлемым гетероарильным группам относятся фурил, тиенил, пиридил, хинолинил, тетразолил, имидазолил, пиразолил, оксазолил, тиазолил и т.п.
Термином "гетероциклил" обозначают неароматические кольца и циклические системы, содержащие в кольце по крайней мере один гетероатом (например, О, S, N). Примерами гетероциклических групп могут служить пирролидинил, тетрагидрофуранил, морфолинил, тиоморфолинил, пиперидинил, пиперазинил, тиазолидинил, имидазолинил и т.п.
Если не указано иное, термины "замещенный циклоалкил", "замещенный арил", "замещенный гетероарил" и "замещенный гетероциклил" подразумевают, что кольца или циклические системы дополнительно замещены одним или более заместителями, независимо отбираемыми из группы, в которую входят алкил, алкоксил, алкилтио, гидроксил, галоген, галогеналкил, галогеналкилкарбонил, галогеналкоксил (например, трифторметоксил), нитрогруппа, алкилкарбонил, алкенилкарбонил, арилкарбонил, гетероарилкарбонил, арил, арилалкил, гетероарил, гетероарилалкил, гетероциклил, гетероциклоалкил, нитрил, алкоксикарбонил, алканоилоксил, алканоилтио и, в случае циклоалкила и гетероциклила, кетогруппа.
В структурных формулах, представляющих соединения настоящего изобретения, некоторые связи изображены пунктирными линиями. Такие линии означают, что связи, изображенные пунктирной линией могут как присутствовать, так и отсутствовать. Соответственно, Формулой 1 могут быть описаны как имидазохинолиновые соединения, так и тетрагидроимидазохинолиновые соединения.
Настоящее изобретение включает в себя описанные в нем соединения в любой из их фармацевтически приемлемых форм, в том числе такие изомеры, как диастереомеры, энантиомеры, соли, сольваты, полиморфы и т.п.
Фармацевтические препараты и биологическая активность
Фармацевтические препараты настоящего изобретения содержат терапевтически эффективное количество соединения Формулы I в сочетании с фармацевтически приемлемым носителем.
В рамках настоящего изобретения, термин "терапевтически эффективное количество" означает количество соединения, достаточное для проявления такого терапевтического эффекта, как индукция цитокинов, противоопухолевая активность и/или противовирусная активность. Хотя точное количество активного соединения в фармацевтическом препарате настоящего изобретения может меняться в зависимости от таких известных специалистам в данной области факторов, как физическая и химическая природа соединения и природа носителя, а также схема приема препарата, следует понимать, что препараты настоящего изобретения должны содержать активного ингредиента достаточно для того, чтобы организм получил дозу соединения от 100 нг/кг до 50 мг/кг, а предпочтительно - от 10 мкг/кг до 5 мг/кг. Могут быть использованы любые обычные лекарственные формы, такие как таблетки, лепешки, парентеральные препараты, сиропы, кремы, мази, аэрозольные препараты, черескожные пластыри, пластыри на слизистую и т.п.
Соединения настоящего изобретения можно вводить в качестве единственного лекарственного средства в процессе лечения, либо соединения настоящего изобретения можно вводить в сочетании с другим или с другими активными средствами, включая дополнительные иммуномодуляторы, противовирусные средства, антибиотики и т.д.
В опытах, проведенных по описанным ниже методикам, было показано, что соединения настоящего изобретения индуцируют синтез некоторых цитокинов. Эти результаты показывают, что такие соединения могут быть использованы в качестве иммуномодуляторов, способных несколькими разными способами модифицировать иммунный ответ, что позволяет применять их для лечения различных отклонений.
К цитокинам, которые могут быть индуцированы вследствие введения соединений настоящего изобретения, вообще говоря, относятся интерферон (ИФН) и/или α-фактор некроза опухоли (α-ФНО), а также некоторые интерлейкины (ИЛ). Цитокины, биосинтез которых могут индуцировать соединения настоящего изобретения, включают α-ИФН, α-ФНО, ИЛ-1, 6,10 и 12, а также разные другие цитокины. Среди прочих эффектов, цитокины ингибируют размножение вирусов и рост опухолевых клеток, что делает их эффективным средством для лечения вирусных заболеваний и опухолей.
Помимо индуцирования синтеза цитокинов, соединения настоящего изобретения оказывают воздействие и на другие аспекты врожденного иммунного ответа. Например, под действием вырабатываемых цитокинов, скорее всего, повышается активность клеток естественных киллеров. Эти соединения также могут активировать макрофаги, что, в свою очередь, стимулирует выделение окиси азота и продукцию дополнительных цитокинов. Кроме того, эти соединения могут способствовать пролиферации и дифференцировке В-лимфоцитов.
Соединения настоящего изобретения также могут повлиять на приобретенный иммунный ответ. Например, хотя считается, что не существует какого-либо воздействия на Т-лимфоциты или прямой индукции цитокинов Т-лимфоцитов, введение этих соединений косвенно индуцирует продукцию цитокина γ-ИФН Т-хелпера 1-го типа (Th-1) и ингибирует продукцию цитокинов ИЛ-4, ИЛ-5 и ИЛ-13 Т-хелпера 2-го типа (Th-2). Такая активность указывает на то, что эти соединения являются эффективным средством при лечении таких заболеваний, где требуется активизация Th-1 ответа и/или подавление Th-2 ответа. Имея ввиду способность соединений Формулы Ia подавлять иммунный Th-2 ответ, ожидается, что эти соединения будут полезны в лечении патологий, связанных с избыточным стимулированием Th-2 ответа, например, таких атопических заболеваний, как атопический дерматит, астма и аллергический ринит, как системная красная волчанка; а также в качестве адъювантной вакцины для клеточно опосредованного иммунитета; и возможно для лечения рецидивирующих грибковых заболеваний и хламидий.
Способность этих соединений модифицировать иммунный ответ делает их полезными в лечении широкого спектра отклонений. Благодаря их способности индуцировать выработку таких цитокинов, как α-ИФН и/или α-ФНО, а также ИЛ-12, эти соединения особенно эффективны при лечении вирусных заболеваний и опухолей. Такая иммуномодулирующая активность предполагает, что соединения настоящего изобретения эффективны при лечении таких и не только таких заболеваний, как вирусные заболевания, к которым относятся остроконечная бородавка; обычная бородавка; подошвенная бородавка; гепатит В, гепатит С, вирус простого герпеса типа I и типа II; кантагиозный моллюск; ВИЧ; цитомегаловирус; вирус ветряной оспы; интраэпителиапьные неоплазии, такие как цервикальная интраэпителиальная неоплазия, папилломавирус человека (ПВЧ) и связанные с ним неоплазии; грибковые заболевания, например, кандидозный, аспергиллезный и криптококковый менингит; неоплазические патологии, например, базально-клеточная карцинома; лейкемический ретикулез, саркома Капоши, почечно-клеточная карцинома, плоскоклеточная карцинома, миелогенная лейкемия, множественная миелома, меланома, не-ходжкинская лейкома, кожная Т-клеточная лимфома, другие виды рака; паразитические заболевания, например, pneumocystis carnii, криптоспоридиоз, гистоплазмоз, токсоплазмоз, трипаносомная инфекция, лейшманиоз; а также бактериальные инфекции, например, туберкулез, mycobacterium avium. Кроме того, с помощью соединений настоящего изобретения можно лечить такие заболевания, как экзема; эозинофилия; врожденная тромбоцитэмия; лепра; рассеянный склероз; синдром Омена; болезнь Боуэна; боуэновидный папулез. Эти соединения также способствуют заживлению ран, в том числе хронических язв, и стимулируют его.
Таким образом, настоящее изобретение представляет способ индукции биосинтеза цитокинов в организме животного путем введения в него эффективного количества соединения Формулы Ia. Количество соединения, эффективное для индукции биосинтеза цитокинов, - это количество, достаточное для того, чтобы один или несколько типов клеток, таких как моноциты, макрофаги, дендритные клетки и В-клетки, стали продуцировать один или несколько таких цитокинов, как, например α-ИФН, α-ФНО, ИЛ-1, 6, 10 и 12, которое превысило бы базовый уровень этих цитокинов. Точное количество может меняться в зависимости от факторов, известных специалистам в данной области, однако, скорее всего, это будет доза от 100 нг/кг до 50 мг/кг, а предпочтительно от 10 мкг/кг до 5 мг/кг. Настоящее изобретение также представляет способ лечения вирусных инфекций у животных и способ лечения неоплазических состояний у животных, включающий в себя введение в организм эффективного количества соединения Формулы Ia. Количество, эффективное для лечения или подавления вирусного заболевания, это такое количество, которое вызывает ослабление одного или более признаков инфекции, таких как вирусное поражение, вирусная нагрузка, уровень продукции вируса и смертность, по сравнению с контрольной группой животных, не подвергавшихся воздействию соединения. Точное количество может меняться в зависимости от факторов, известных специалистам в данной области, однако можно предположить, что доза составит от 100 нг/кг до 50 мг/кг, а предпочтительно от 10 мкг/кг до 5 мг/кг. Количество соединения, эффективное для лечения неоплазического состояния, это такое количество, которое приводит к уменьшению размера опухоли или количества очагов опухолей. Опять же, точное количество может меняться в зависимости от факторов, известных специалистам в данной области, однако можно предположить, что доза составит от 100 нг/кг до 50 мг/кг, а предпочтительно от 10 мкг/кг до 5 мг/кг.
Далее настоящее изобретение описывается на примерах, которые предназначены только для иллюстрации, а вовсе не для ограничения.
Пример 1
трет-Бутил-N-[2-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)этил]карбамат
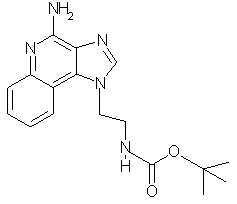
Часть А
Триэтиламин (66,8 г, 0,33 моль) прибавляют к раствору трет-бутил-N-(2-аминоэтил)карбамата (55,0 г, 0,34 моль) в безводном дихлорметане (500 мл). Медленно прибавляют 4-хлор-3-нитрохинолин (68,2 г, 0,33 моль), и начинается экзотермическая реакция. Реакционную смесь оставляют на ночь перемешиваться при комнатной температуре. Образовавшийся осадок отфильтровывают и выделяют твердый продукт желтого цвета. Фильтрат промывают водой, сушат над сульфатом магния и концентрируют под вакуумом. Полученный остаток суспендируют в гексане и фильтруют с образованием дополнительного твердого продукта желтого цвета. После объединения обеих порций получается 101 г твердого желтого трет-бутил-N-[2-(3-нитрохинолин-4-ил)аминометил]карбамата с температурой плавления 157-158°С.
Часть Б
К суспензии трет-бутил-N-[2-(3-нитрохинолин-4-ил)аминометил]карбамата (100 г, 0,30 моль) в толуоле (500 мл) прибавляют платину на угле (1 г 10%) и сульфат натрия (2 г). Смесь на ночь помещают в атмосферу водорода под давлением 50 фунтов/кв. дюйм (3,4×104 Па) в аппарате Парра при комнатной температуре. Реакционную смесь фильтруют. После упаривания фильтрата получается 73 г трет-бутил-N-[2-(3-аминохинолин-4-ил)аминометил]карбамата в виде темно-золотистой маслянистой жидкости.
Часть В
К раствору трет-бутил-N-[2-(3-аминохинолин-4-ил)аминометил]карбамата (21 г, 69,4 ммоль) в безводном толуоле (250 мл) прибавляют триэтилортоформиат (11,3 г, 73,4 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 5 часов, а затем дают медленно остыть до комнатной температуры. Образовавшийся осадок отфильтровывают и высушивают. Выход: 17,6 г твердого светло-коричневого трет-бутил-N-[2-(1Н-имидазо[4,5-с]хинолин-1-ил)этил]карбамата с температурой плавления 154-155°С.
Часть Г
К раствору трет-бутил-N-[2-(1Н-имидазо[4,5-с]хинолин-1-ил)этил]карбамата (17,2 г, 55,1 ммоль) в хлороформе (250 мл) небольшими порциями прибавляют 3-хлорпероксибензойную кислоту (13,4 г, 60,6 ммоль). Реакционную смесь оставляют на ночь при комнатной температуре, а затем останавливают реакцию 5%-ным раствором карбоната натрия. Слои разделяют. Органический слой сушат над сульфатом магния, а затем концентрируют под вакуумом. Получается 15,0 г твердого серовато-белого 1 -[2-(трет-бутилкарбамил)этил]-1Н-имидазо[4,5-с]хинолин-5N-оксида с температурой плавления 213-215°С.
Часть Д
К раствору 1-[2-(трет-бутилкарбамил)этил]-1Н-имидазо[4,5-с]хинолин-5N-оксида (15,0 г, 45,7 ммоль) в хлороформе (200 мл) при перемешивании медленно прибавляют трихлорацетилизоцианат (9,5 г, 50,2 ммоль). Через 2 часа реакцию останавливают концентрированной гидроокисью аммония (100 мл). Прибавляют воду (100 мл) и разделяют слои. Водный слой экстрагируют хлороформом. Органические слои соединяют, сушат над сульфатом магния, а затем концентрируют под вакуумом. Получается твердое белое вещество. Этот материал суспендируют в теплом метилацетате, а затем фильтруют. Выход: 15 г твердого белого трет-бутил-N-[2-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)этил]карбамата с температурой плавления 215°С. ЯМР 1H (500 МГц, ДМСО-D6) δ 8,13 (триплет, J=8,0 Гц, 1Н), 8,03 (с., 1Н). 7,61 (дублет, J=8,0 Гц, 1Н), 7,44 (триплет, J=8,0 Гц, 1Н), 7,23 (триплет, J=8,0 Гц, 1Н), 7,06 (триплет, J=6,0 Гц, 1Н), 6,56 (шир. с., 2Н), 4,63 (триплет, J=7,0 Гц, 2Н), 3,43 (квадруплет, J=6,0 Гц, 2Н), 1,32 (с., 9Н); Масс-спектрометрия (электронный удар) m/е 327,1696 (327,1695 рассчитано для C17H21N502).
Пример 2
трет-Бутил-N-[2-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамат

Часть А
В соответствии с общей методикой, описанной в Части А Примера 1, трет-бутил-N-(2-аминобутил)карбамат (254 г, 1,35 моль) взаимодействует с 4-хлор-3-нитрохинолин гидрохлоридом (331 г, 1,35 моль) с образованием 486 г твердого желтого трет-бутил-N-(4-[(3-нитрохинолин-4-ил)амино]бутил)карбамата. Элементный анализ: теор. для C18H24N4O4: %С 59,99; %Н 6,71; %N 15,55; эксп.: %С 59,68; %Н 6,59; %N 15,74.
Часть Б
В соответствии с общей методикой, описанной в Части Б Примера 1, трет-бутил-N-(4-[(3-нитрохинолин-4-ил)амино]бутил)карбамат (162,6 г, 0,451 моль) гидрируют с образованием 149 г темно-золотистого резиноподобного трет-бутил-N-(4-[(3-аминохинолин-4-ил)амино]бутил)карбамата.
Часть В
В соответствии с общей методикой, описанной в Части В Примера 1, трет-бутил-N-(4-[(3-аминохинолин-4-ил)амино]бутил)карбамат (149 г, 0,451 моль) взаимодействует с триэтилортоформиатом с образованием сырого продукта. Этот материал перекристаллизовывают из изопропилового спирта и получают 84 г твердого кристаллического трет-бутил-N-[4-(1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамата.
Часть Г
В соответствии с общей методикой, описанной в Части Г Примера 1, окислением трет-бутил-N-[4-(1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамата (84 г, 0,247 моль) получают 87,9 г зеленовато-желтого пенистого 1-[4-(трет-бутилкарбамил)бутил]-1Н-имидазо[4,5-с]хинолин-5N-оксида.
Часть Д
К раствору 1-[4-(трет-бутилкарбамил)бутил]-1Н-имидазо[4,5-с]хинолин-5N-оксида (87,9 г, 0,247 моль) в дихлорметане (750 мл) при бурном перемешивании небольшими порциями прибавляют концентрированную гидроокись аммония (250 мл). Затем в течение 30 минут небольшими порциями прибавляют тозилхлорид (47,0 г, 0,247 моль). Реакционную смесь оставляют на ночь перемешиваться при комнатной температуре, а затем от нее отфильтровывают желто-коричневый осадок. Слои фильтрата разделяют. Водный слой экстрагируют дихлорметаном (4 раза по 50 мл). Дихлорметановые фракции соединяют, сушат над сульфатом натрия, а затем концентрируют под вакуумом и получают светло-коричневое твердое вещество. После перекристаллизации этого материала из изопропилового спирта получают 75,7 г твердого светло-желтого трет-бутил-N-[2-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамата с температурой плавления 171-173°С. ЯМР 1H (500 МГц, CDCl3) δ 8,19 (с., 1Н), 8,03 (дублет, J=8,0 Гц, 1Н), 7,26 (дублет, J=8,0 Гц, 1Н), 6,83 (триплет, J=6,0 Гц, 1Н), 6,60 (шир. с., 2Н), 4,59 (триплет, J=7,0 Гц, 2Н), 2,95 (квадруплет, J=6,0 Гц, 2Н), 1,83 (квинтет, J=7,0 Гц, 2Н), 1,42 (квинтет, J=7,0 Гц, 2Н), 1,33 (с., 9Н); Масс-спектрометрия (электронный удар) m/e 335,2001 (335,2008 рассчитано для C19H25N5O2).
Пример 3
Фенил-N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамат
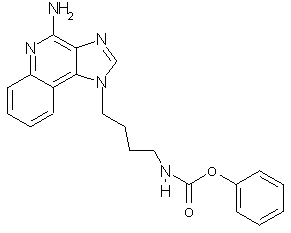
Раствор 1-(4-аминобутил)-1Н-имидазо[4,5-с]хинолин-4-амина (9,3 мг, 36 мкмоль) в 10 мл дихлорметана охлаждают до -5°С и, для лучшего перемешивания барботируя аргон, прибавляют раствор фенилхлорформиата (7 мг, 45 мкмоль) в 1,5 мл дихлорметана. Затем, в течение 10 минут при вихревом перемешивании смеси дают нагреться до комнатной температуры. Для того, чтобы погасить избыток хлорформиата, прибавляют аминометил-полистирол (приблизительно 80 мг, 1 мг-экв/г, 100-200 меш, Bachem), и в течение нескольких часов кипятят смесь с обратным холодильником при вихревом перемешивании. После хроматографирования смеси через короткую пробку силикагеля смесью дихлорметан-метанол 10:1 в качестве элюэнта выделяют твердый продукт. ЯМР 1H (500 МГц, ДМСО-D6) δ 8,28 (с., 1Н), 8,06 (дублет, J=7,6 Гц, 1Н), 7,76 (триплет, J=5,6 Гц, 1Н), 7,63 (дублет, J=8,2 Гц, 1Н), 7,45 (триплет, J=7 Гц, 1Н), 7,34 (триплет, J=8,2 Гц, 2Н), 7,18 (триплет, J=7,3 Гц, 1Н). 7,00 (дублет, J=8,6 Гц. 2Н), 6,65 (шир., с., 2Н), 4,64 (триплет, J=7 Гц, 2Н), 3,10 (квадруплет, J=6 Гц, 2Н), 1,92 (квинтет, J=7 Гц, 2Н), 1,52 (квинтет, J=7 Гц, 2Н); Масс-спектрометрия (ХИАД) m/е 376,15 (М+Н).
Пример 4
9Н-9-Флуоренилметил-N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамат
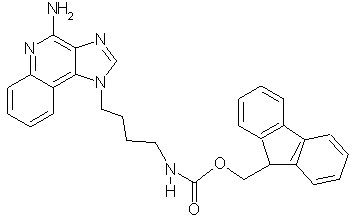
К раствору 1-(4-аминобутил)-1Н-имидазо[4,5-с]хинолин-4-амина (9,3 мг, 36 мкмоль) в 10 мл дихлорметана при комнатной температуре прибавляют твердый 9-флуоренилметилхлорформиат (8 мг, 30 мкмоль). Примерно через 1 минуту вихревого перемешивания смеси при комнатной температуре она слегка мутнеет. Для того, чтобы погасить избыток хлорформиата, прибавляют аминометил-полистирол (приблизительно 90 мг, 0,64 мг-экв/г. 100-200 меш, Bachem), через несколько минут фильтруют смесь через короткую пробку силикагеля смесью дихлорметан-метанол 10:1 в качестве элюэнта и выделяют твердый продукт. ЯМР 1H (500 МГц, ДМСО-D6) δ 8,27 (с., 1Н), 8,08 (дублет, J=8,1 Гц, 1Н), 7,87 (дублет, J=7,6 Гц, 1Н), 7,65 (ср., 1Н), 7,50 (триплет, J=7,6 Гц, 1Н), 7.40 (триплет, J=7,3 Гц, 1Н), 7,3 (ср., 4Н), 7,15 (шир. с., 2Н), 4,62 (триплет, J=7 Гц, 2Н). 4,27 (дублет, J=7 Гц, 2Н), 4,17 (триплет, J=7 Гц, 1Н), 3,03 (квадруплет, J=7 Гц, 2Н), 1,84 (квинтет, J=7 Гц, 2Н), 1,45 (квинтет, J=7 Гц, 2Н); Масс-спектрометрия (ХИАД) m/e 478,28 (М+Н).
Пример 5
N4-[4-(4-Амино-1H-имидазо[4,5-c]хинолин-1-ил)бутил]-4-морфолинкарбоксамид
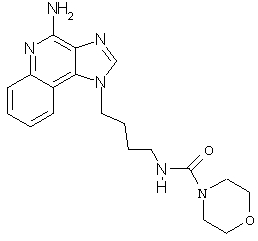
К раствору 1-(4-аминобутил)-1Н-имидазо[4,5-с]хинолин-4-амина (0,3 г, 1,2 ммоль) в пиридине (70 мл) при перемешивании прибавляют 4-морфолинкарбонилхлорид (0,15 мл, 1,3 ммоль). Реакционную смесь оставляют на ночь при комнатной температуре. Растворитель удаляют под вакуумом, а остаток очищают колоночной хроматографией под давлением (силикагель, 9:1 дихлорметан/метанол). Фракции, содержащие продукт, соединяют, промывают насыщенным водным раствором бикарбоната натрия, сушат (MgSO4), фильтруют, концентрируют и получают 0,86 г желто-коричневого порошка N4-[4-(4-амино-1H-имидазо[4,5-с]хинолин-1-ил)бутил]-4-морфолинкарбоксамида с температурой плавления 177,0-179,5°С. ЯМР 1H (300 МГц, ДМСО-D6) δ 8,22 (с., 1Н), 8,04 (дублет, J=7,1 Гц, 1Н), 7,64 (дублет, J=7,5 Гц, 1Н), 7,47 (триплет, J=7,1 Гц, 1Н), 7,28 (триплет, J=7,1 Гц, 1Н), 6,72 (шир. с., 2Н), 6,52 (триплет, J=5,4 Гц, 1Н), 4,61 (триплет, J=6,9 Гц, 2Н), 3,48 (триплет, J=4,6 Гц, 4Н), 3,18 (триплет, J=4,6 Гц, 4Н), 3,05 (ср., 2Н), 1,84 (ср., 4Н), 1,44 (ср., 4Н); Масс-спектрометрия (электронный удар) m/e 368,1966 (368,1961 рассчитано для C19H24N602).
Пример 6
N1-[4-(4-Амино-1H-имидазо[4,5-c]хинолин-1-ил)бутил]-N-метил-N-фенилмочевина
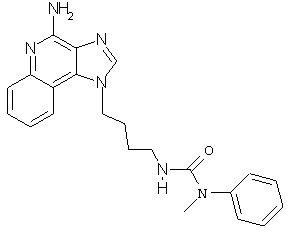
В соответствии с общей методикой, описанной в Примере 5,1-(4-аминобутил)-11-1-имидазо[4,5-с]хинолин-4-амин взаимодействует с N-метил-N-фенилкарбамоилхлоридом с образованием желтовато-коричневого порошка N1-[4-(4-амино-1H-имидазо[4,5-с]хинолин-1-ил)бутил]-N-метил-N-фенилмочевины с температурой плавления 87,0-88,0°С. ЯМР 1H (300 МГц, ДМСО-D6) δ 8,19 (с, 1Н), 8,04 (дублет, J=8,1 Гц, 1Н), 7,63 (двойной дублет, J=8,1,1,2 Гц, 1Н), 7,45 (двойной триплет, J=8,1 1,2 Гц, 1Н), 7,31-7,24 (ср., 3Н), 7,18-7,09 (ср., 3Н), 6,62 (с., 2Н). 5,95 (шир., с., 1Н), 4,59 (триплет, J=6,9 Гц, 2Н), 3,07 (с., 3Н), 3,03 (ср., 2Н). 1,82 (квинтет, J=7,2 Гц, 2Н), 1,42 (квинтет, J=7,2 Гц, 2Н); Масс-спектрометрия (электронный удар) m/e 388,2023 (388,2012 рассчитано для С22Н24N6О).
Пример 7
(1R,2S,5R)-2-Изопропил-5-метилциклогексил-N-[3-(4-амино-1Н-имидазо[4,5-с]хинолин-1 -ил)бутил]карбамат
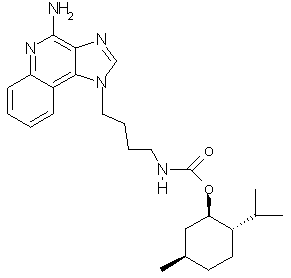
К раствору 1-(4-аминобутил)-2-бутил-1Н-имидазо[4,5-с]хинолин-4-амина (0,80 г, 3,14 ммоль) в пиридине (200 мл) при перемешивании прикапывают (-)-ментилхлорформиат (0,675 мл, 3,15 ммоль). Реакционную смесь оставляют на ночь при комнатной температуре. Растворитель удаляют под вакуумом, а остаток очищают колоночной хроматографией под давлением (силикагель, 95:5 дихлорметан/метанол). Фракции, содержащие продукт, соединяют, промывают насыщенным водным раствором бикарбоната натрия, сушат (MgSO4), фильтруют, концентрируют и получают 0,32 г желто-коричневого порошка (1R,2S,5R)-2-изопропил-5-метилциклогексил-N-[3-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамата с температурой плавления 84,0-86,0°С. ЯМР 13С (75 МГц, ДМСО-D6) δ 156,5, 152,5, 145,3, 143,1, 131,9, 128,5, 127,0, 126,5, 121,5, 120,8, 115,2, 73,0, 47,2, 46,5, 41,7, 34,1 31,2, 27,5, 26,8, 26,1, 23,4, 22,3, 20,8, 16,6; Масс-спектрометрия (электронный удар) m/e 437,2797 (437,2791 рассчитано для C25H35N5O2).
Пример 8
2-Нафтил-N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамат
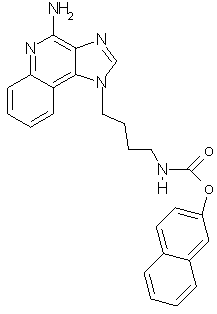
В соответствии с общей методикой, описанной в Примере 7,1-(4-аминобутил)-1Н-имидазо[4,5-с]хинолин-4-амин взаимодействует с 2-нафтиловым эфиром хлормуравьиной кислоты с образованием белого порошка 2-нафтил-N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамата с температурой плавления 154,0-155,0°С. ЯМР 1H (300 МГц, ДМСО-D6) δ 8,23 (с., 1Н), 8,08 (дублет, J=7,4 Гц, 1Н), 7,94-7,86 (ср., 4Н). 7,64 (двойной дублет, J=8,3, 1,0 Гц, 1Н), 7,56-7,43 (ср., 4Н), 7,30 (ср., 1Н), 7,20 (двойной дублет, J=8,8, 2,3 Гц, 1Н), 6,61 (шир., с., 2Н), 4,65 (триплет, J=6,9 Гц, 2Н), 3,14 (квадруплет, J=6,4 Гц, 2Н), 1,94 (ср., 2Н), 1,56 (ср., 2Н); Масс-спектрометрия (электронный удар) m/e 426,1927 (426, 1930 рассчитано для C25H23N5O2).
Пример 9
1-Нафтил-N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамат
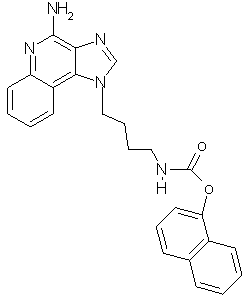
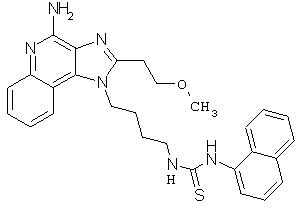
В соответствии с общей методикой, описанной в Примере 7,1-(4-аминобутил)-1Н-имидазо[4,5-с]хинолин-4-амин взаимодействует с 1-нафтиловым эфиром хлормуравьиной кислоты с образованием желто-коричневого порошка 1-нафтил-N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамата с температурой плавления 89,0-92,0°С. ЯМР 1H (300 МГц, ДМСО-D6) δ 8,25 (с., 1Н), 8,10 (дублет, J=7,4 Гц, 1Н), 8,05 (триплет, J=5,8 Гц, 1Н), 7,96 (дублет, J=7,6 Гц, 1Н), 7,79 (дублет, J=8,2 Гц, 1Н), 7,66-7,45 (ср., 6Н), 7,30 (ср., 1Н), 7,19 (дублет, J=7,5 Гц, 1Н), 6,72 (шир., с., 2Н), 4.67 (триплет, J=6,9 Гц, 2Н), 3,17 (квадруплет, J=6,3 Гц, 2Н), 1,96 (ср., 2Н), 1,59 (ср., 2Н); Масс-спектрометрия (электронный удар) m/e 426,1929 (426, 1930 рассчитано для C25H23N502).
Пример 10
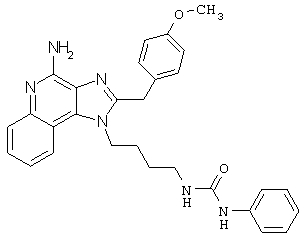
N-{4-[4-Амино-2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}мочевина
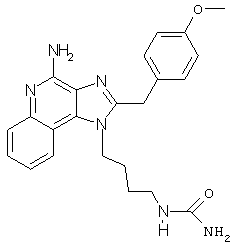
Часть А
В соответствии с общей методикой, описанной в Частях Г и Д Примера 1, из трет-бутил-N-{4-[2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}карбамата получают твердый трет-бутил-N-аминокарбонил-N-{4-[4-амино-2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}карбамат. ЯМР 1H (300 МГц, ДМСО-D6) δ 7,93 (дублет, J=8,1 Гц, 1Н), 7,86 (шир., с., 1Н), 7,61 (двойной дублет, J=8,3,1,1 Гц, 1Н), 7,41 (ср., 1Н), 7,24-7,17 (ср., 1Н), 6,87 (дублет, J=8,7 Гц, 1Н), 6,55 (шир., с., 2Н), 4,45 (шир., с., 2Н), 4,32 (с., 2Н), 3,71 (с., 3Н), 3,49 (ср., 2Н), 1,49 (ср., 4Н), 1,31 (с., 9Н).
Часть Б
трет-Бутилкарбамоильную группу удаляют из трет-бутил-N-аминокарбонил-N-{4-[4-амино-2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}карбамата путем нагревания этого соединения в растворе HCl и этанола. После нейтрализации реакционной смеси (NH4OH) получают серовато-белую твердую N-{4-[4-Амино-2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}мочевину с температурой плавления 196°С (разл.). ЯМР 1H (300 МГц, ДМСО-D6) δ 7,96 (дублет, J=7,9 Гц, 1Н), 7,61 (дублет, J=8,3 Гц, 1Н), 7,43 (триплет, J=7,6 Гц, 1Н), 7,25 (ср., 3Н), 6,89 (дублет, J=8,6 Гц, 2Н), 6,58 (шир. с., 2Н), 5,92 (шир. с., 1Н), 5,36 (шир. с., 2Н), 4,41 (ср., 2Н), 4,32 (с., 2Н), 3,72 (с., 2Н), 2,93 (дублет, J=5,8 Гц, 2Н), 1,48 (ср., 4Н); Масс-спектрометрия (ХИ) m/e 419.
Пример 11
N4-{4-[4-Амино-2-(2-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-4-морфолинкарбоксамид
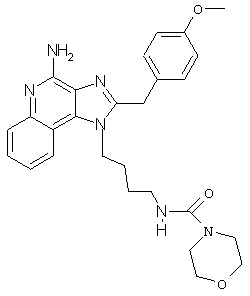
В соответствии с общей методикой, описанной в Примере 5,1-(4-аминобутил)-2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-4-амин взаимодействует с 4-морфолинкарбонилхлоридом с образованием N4-{4-[4-амино-2-(2-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-4-морфолинкарбоксамида. ЯМР 1Н (500 МГц, CDCl3) δ 7,85-7,81 (ср., 2Н), 7,50 (ср., 1Н), 7,30 (ср., 2Н), 7,17 (дублет, J=8,6 Гц, 2Н), 6,86 (дублет, J=8,6 Гц, 2Н), 5,62 (шир. с., 2Н), 4,36 (ср., 2Н), 4,31 (с., 2Н), 3,78 (с., 3Н), 3,64 (триплет, J=4,9 Гц, 4Н), 3,25 (триплет, J=4,9 Гц, 4Н), 3,18 (ср., 2Н), 1,70 (ср., 2Н), 1,54 (ср., 2Н); Масс-спектрометрия (электронный удар) m/e 488,2533 (488,2536 рассчитано для С27Н32N6О3).
Пример 12
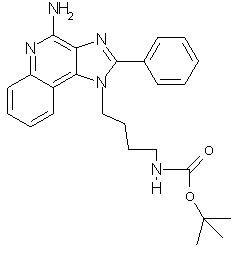
трет-Бутил-N-[2-(4-амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамат
Часть А
Раствор бензоилхлорида (5,3 г, 37,7 ммоль) в дихлорметане (100 мл) при комнатной температуре медленно прибавляют к раствору третбутил-N-{4-[(3-аминохинолин-4-ил)амино]бутил}карбамата (12,5 г, 37,7 ммоль) в дихлорметане (250 мл). Реакционную смесь оставляют на ночь при комнатной температуре. Образовавшийся осадок отфильтровывают, сушат и получают 11,0 г твердого белого трет-бутил-N-(4-{[3-(бензоиламино)хинолин-4-ил]амино}бутил)карбамата гидрохлорида.
Часть Б
Триэтиламин (7,26 г, 71,7 ммоль) прибавляют к раствору материала из Части А в этаноле (200 мл) и кипятят с обратным холодильником в течение 2 дней. Реакционную смесь концентрируют и получают оранжевый сироп. По данным ВЭЖХ/МС сироп содержит как целевой продукт, так и исходный материал. Сироп переносят в дихлорметан (100 мл), а затем охлаждают на ледяной бане. Прибавляют триэтиламин (5 мл) и бензоилхлорид (1,9 мл). После выдерживания реакционной смеси при комнатной температуре в течение 2 дней ВЭЖХ показывает, что реакция не завершена. Реакционную смесь концентрируют под вакуумом. Остаток переносят в изопропиловый спирт (150 мл). Прибавляют триэтиламин (5 мл) и оставляют реакционную смесь на ночь кипеть с обратным холодильником. Реакционную смесь концентрируют под вакуумом. Остаток очищают колоночной хроматографией под давлением (силикагель, элюирование смесью 10% метанола в дихлорметане). Фракции, содержащие продукт, соединяют и концентрируют под вакуумом. После перекристаллизации остатка из ацетонитрила получают 6,7 г твердого трет-бутил-N-[4-(2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамата с температурой плавления 158-159°С.
Часть В
3-Хлорпероксибензойную кислоту (1,05 эквивалента 65%) медленно небольшими порциями прибавляют к раствору трет-бутил-N-[4-(2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил1карбамата (6,56 г, 15,75 ммоль) в дихлорметане (120 мл). Через 3 часа реакцию останавливают 1%-ным водным раствором бикарбоната натрия (200 мл). Разделяют слои. Водный слой экстрагируют дихлорметаном (2 раза по 50 мл). Органические фракции соединяют, сушат над сульфатом магния, затем концентрируют под вакуумом и получают светло-оранжевый сироп. После перетирания сиропа с диэтиловым эфиром получают 6,8 г светло-коричневого твердого 1-[4-(трет-бутилкарбамил)бутил]-2-фенил-1Н-имидазо[4,5-с]хинолин-5N-оксида с температурой плавления 178-181°С.
Часть Г
Раствор 1-[4-(трет-бутилкарбамил)бутил]-2-фенил-1Н-имидазо[4,5-с]хинолин-5N-оксида (6,8 г, 15,75 ммоль) в дихлорметане (100 мл) охлаждают на ледяной бане. Прибавляют концентрированную гидроокись аммония (30 мл). В течение 30 минут небольшими порциями прибавляют тозилхлорид (3,0 г, 15,75 ммоль). Реакционную смесь оставляют на ночь нагреваться до комнатной температуры. Реакцию останавливают водой (350 мл). Слои разделяют. Водный слой экстрагируют дихлорметаном. Органические фракции соединяют, сушат над сульфатом магния, затем концентрируют под вакуумом и получают желто-коричневое твердое вещество. Этот материал очищают колоночной хроматографией под давлением (силикагель, элюирование смесью 10% метанола в дихлорметане) и получают 4,8 г продукта. Небольшую часть перекристаллизовывают из толуола и получают твердый трет-бутил-N-[2-(4-амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]карбамат с температурой плавления 182-183°С. Элементный анализ: теор. для C25H29N5O2: %С 69,58; %Н 6,77; %N 16,22; эксп.: %С 69,86; %Н 6.95; %N 15,80.
Пример 13
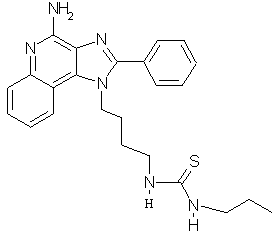
N-[4-(4-Амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1 -ил)бутил]-N'-пропилтиомочевина
Часть А
трет-Бутил-N-[4-(4-амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1 -ил)бутил]карбамат (4,3 г, 10,0 ммоль) растворяют в метаноле (15 мл) и 1Н -соляной кислоте (100 мл), а затем 2 часа кипятят с обратным холодильником. Реакционную смесь концентрируют под вакуумом до объема примерно 50 мл. После прибавления концентрированной гидроокиси аммония до рН 12 осадок не выпадает. С помощью 1Н соляной кислоты рН доводят до 7. Смесь экстрагируют дихлорметаном, а затем этилацетатом. Водный слой упаривают досуха. Остаток растворяют в воде (50 мл), а затем в течение 36 часов непрерывно экстрагируют кипящим хлороформом с обратным холодильником. Хлороформенный экстракт концентрируют под вакуумом и получают светло-коричневое твердое вещество. После перекристаллизации этого материала из ацетонитрила получают 2,5 г серовато-белого твердого 1-(4-аминобутил)-2-фенил-1Н-имидазо[4,5-с]хинолин-4-амина с температурой плавления 175-177°С. Элементный анализ: теор. для C20H21N5: %С 72,48; %Н 6,39; %N 21,13; эксп.: %С 72,72; %Н 6,32; %N 20,71.
Часть Б
Раствор пропилизоцианата (0,78 г, 7,72 ммоль) в хлороформе (5 мл) при комнатной температуре прибавляют к раствору 1-(4-аминобутил)-2-фенил-1Н-имидазо[4,5-с]хинолин-4-амина (0,256 г, 7,72 ммоль) в смеси хлорформа (25 мл) и пиридина (5 мл). Реакционную смесь оставляют на выходные дни при комнатной температуре. Реакционную смесь гасят этанолом, а затем концентрируют под вакуумом и получают светло-оранжевый сироп. Этот материал очищают колоночной хроматографией под давлением (силикагель, элюирование смесью 10% метанола в дихлорметане). Чистые фракции соединяют, концентрируют под вакуумом и получают 0,22 г твердой белой N-[4-(4-амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-пропилтиомочевины с температурой плавления 113-116°С. Масс-спектрометрия: М+1=433,2.
Пример 14
N-[4-(4-Амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-(3-пиридил)тиомочевина
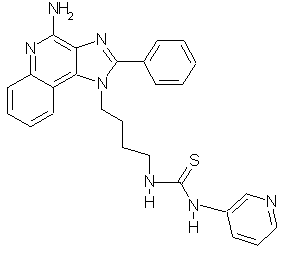
Раствор пиридин-3-изотиоцианата (0,136 г, 1,0 ммоль) в хлороформе (5 мл) при комнатной температуре прибавляют к раствору 1-(4-аминобутил)-2-фенил-1Н-имидазо[4,5-с]хинолин-4-амина (0,331 г, 1,0 ммоль) в смеси хлороформа (25 мл) и пиридина (5 мл). Реакционную смесь оставляют на выходные дни при комнатной температуре. Реакционную смесь гасят этанолом, а затем концентрируют под вакуумом и получают серовато-белое твердое вещество. Этот материал очищают колоночной хроматографией под давлением (силикагель, элюирование смесью 10% метанола в дихлорметане). Чистые фракции соединяют, концентрируют под вакуумом и получают 0,2 г твердой белой N-[4-(4-амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-(3-пиридил)тиомочевины с температурой плавления 118-120°С. Масс-спектрометрия: М+1=468,3. Элементный анализ: теор. для C26H25N7S: %С 66,79; %Н 5,39; %N 20,97; эксп.: %С 64,29; %Н 5,46; %N 20,06.
Пример 15
N-[4-(4-Амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-(4-фторфенил)мочевина
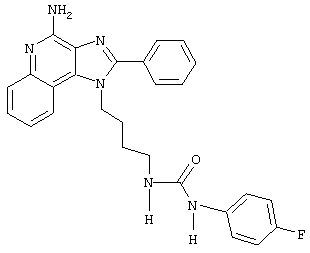
Раствор 4-фторфенилизоцианата (0,137 г, 1,0 ммоль) в хлороформе (5 мл) при комнатной температуре прибавляют к раствору 1-(4-аминобутил)-2-фенил-1Н-имидазо[4,5-с]хинолин-4-амина (0,331 г, 1,0 ммоль) в смеси хлороформа (25 мл) и пиридина (5 мл). Реакционную смесь оставляют на выходные дни при комнатной температуре. Реакцию останавливают этанолом. Образовавшийся светло-желтый осадок (идентифицированный, как бис-аддукт) отделяют фильтрованием. Фильтрат концентрируют под вакуумом и получают серовато-белое твердое вещество. Этот материал очищают колоночной хроматографией под давлением (силикагель, элюирование смесью 10% метанола в дихлорметане). Чистые фракции соединяют, концентрируют под вакуумом и получают 0,22 г твердой белой N-[4-(4-амино-2-фенил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-(4-фторфенил)мочевины с температурой плавления 145-150°С. Масс-спектрометрия: М+1=469,2. Элементный анализ: теор. для C27H28FN6O: %C 69,21; %Н 5,37; %N 17,94; эксп.: %C 66,70; %Н 5,33; %N 17,03.
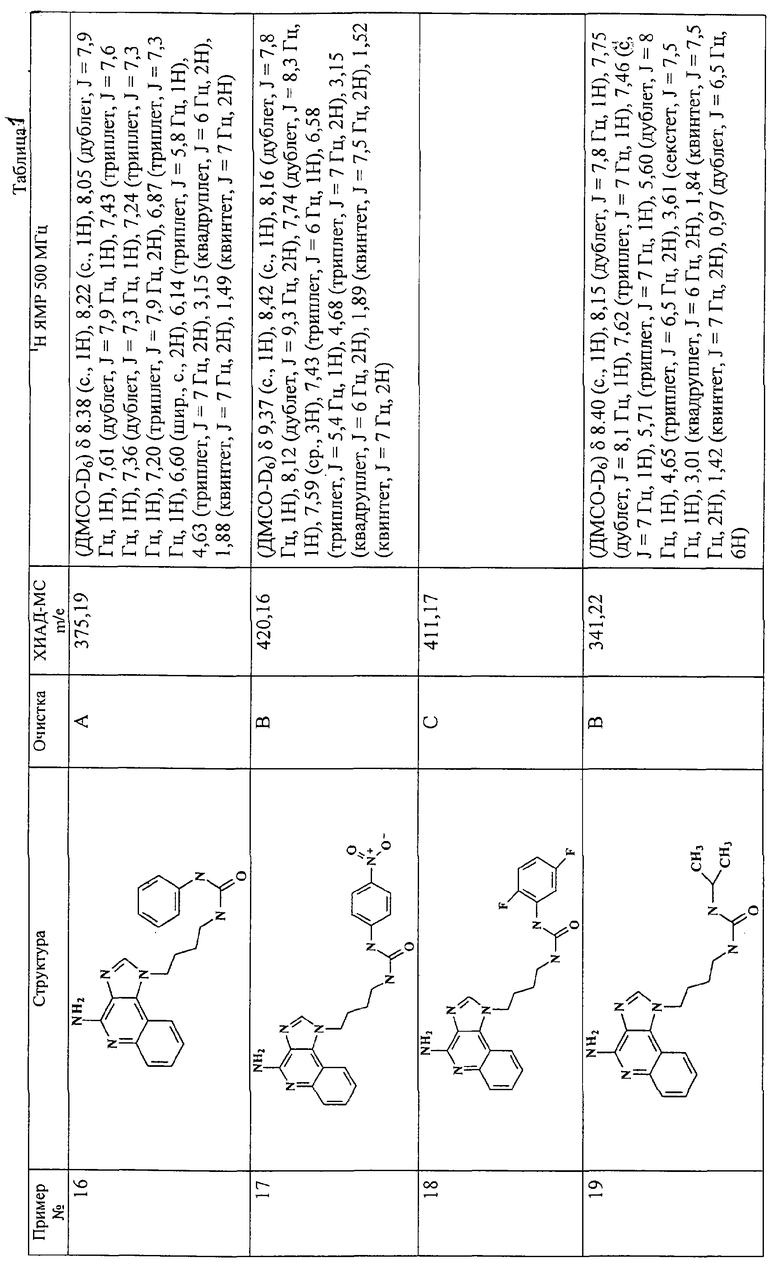
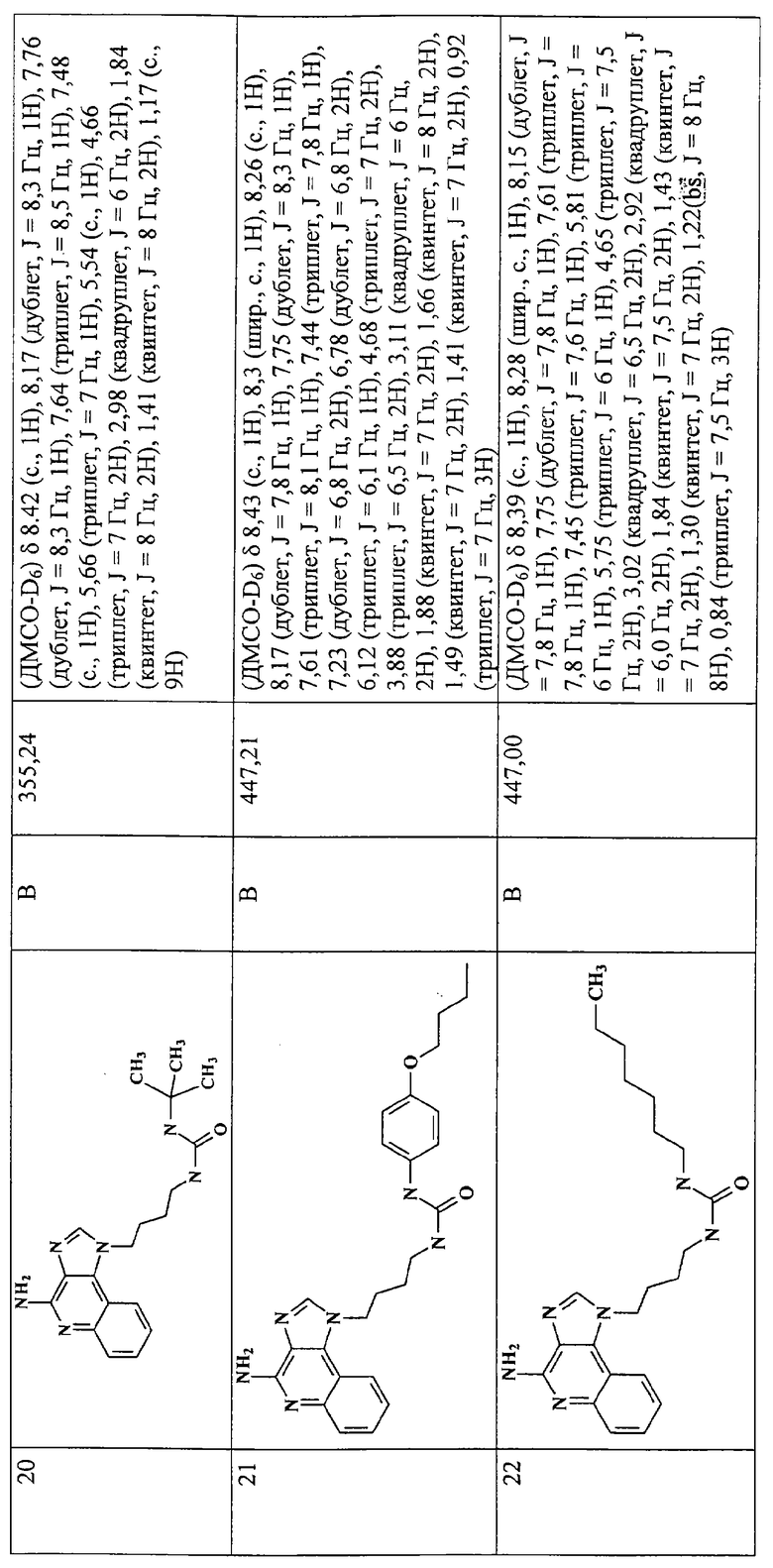
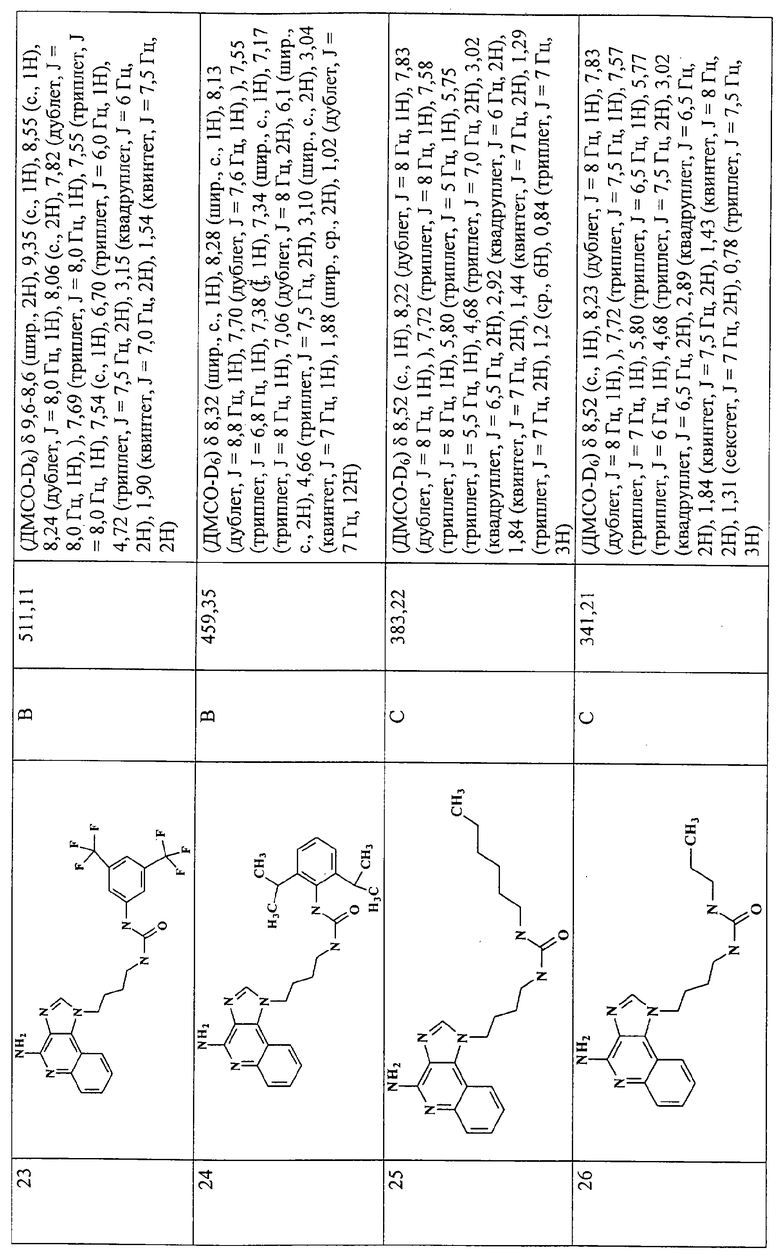
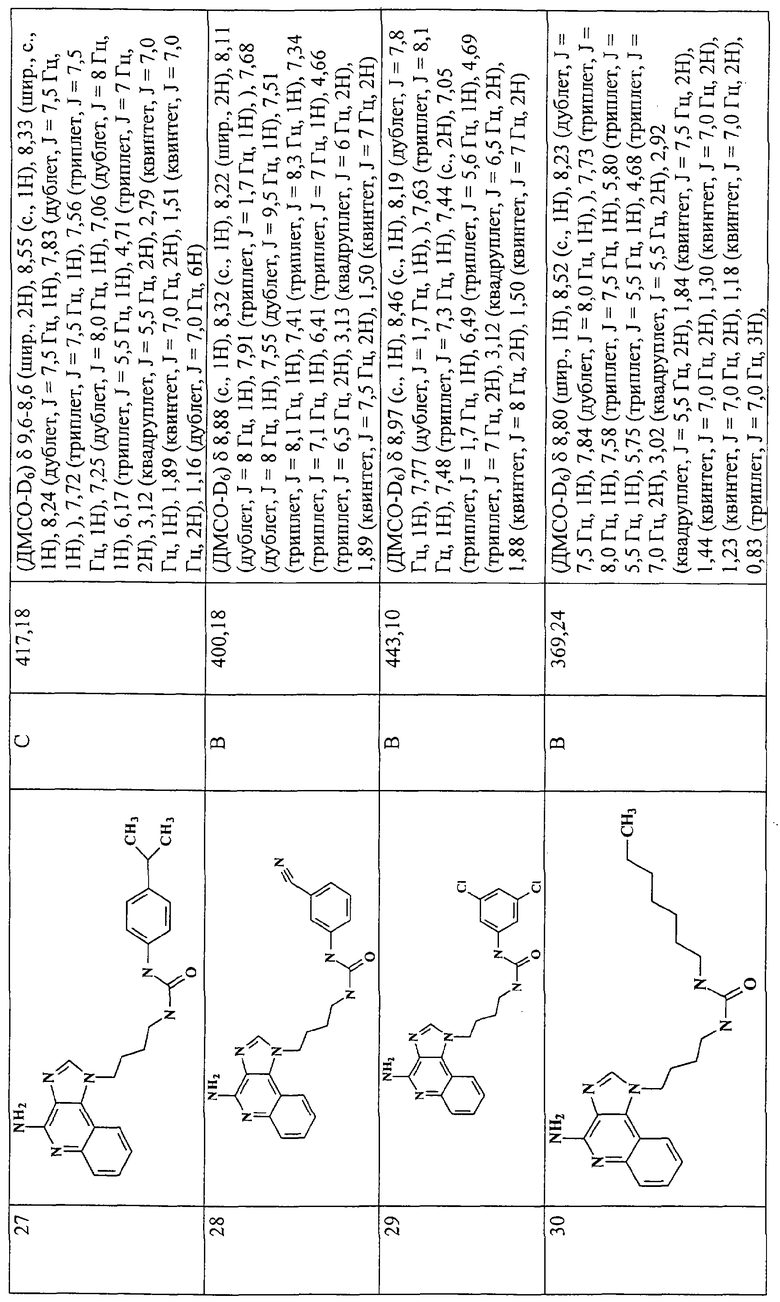
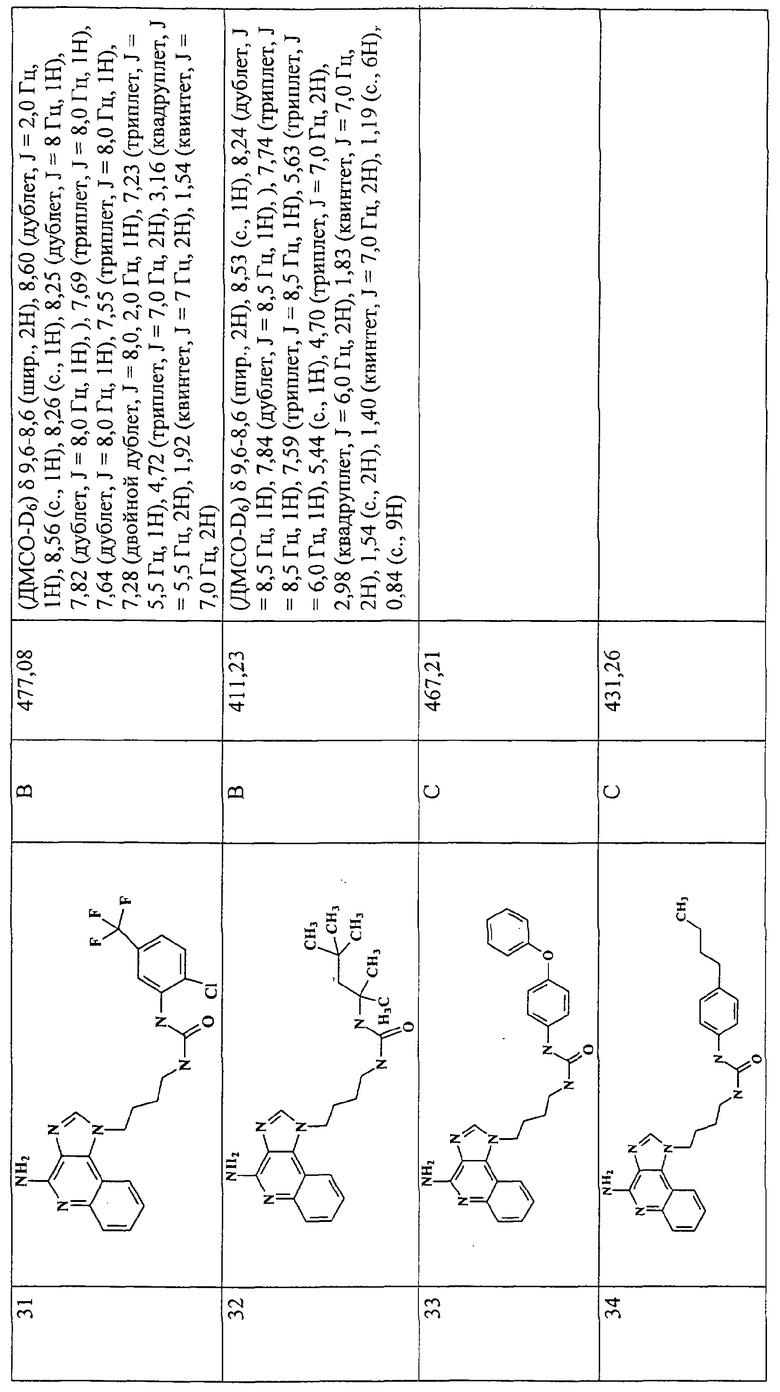
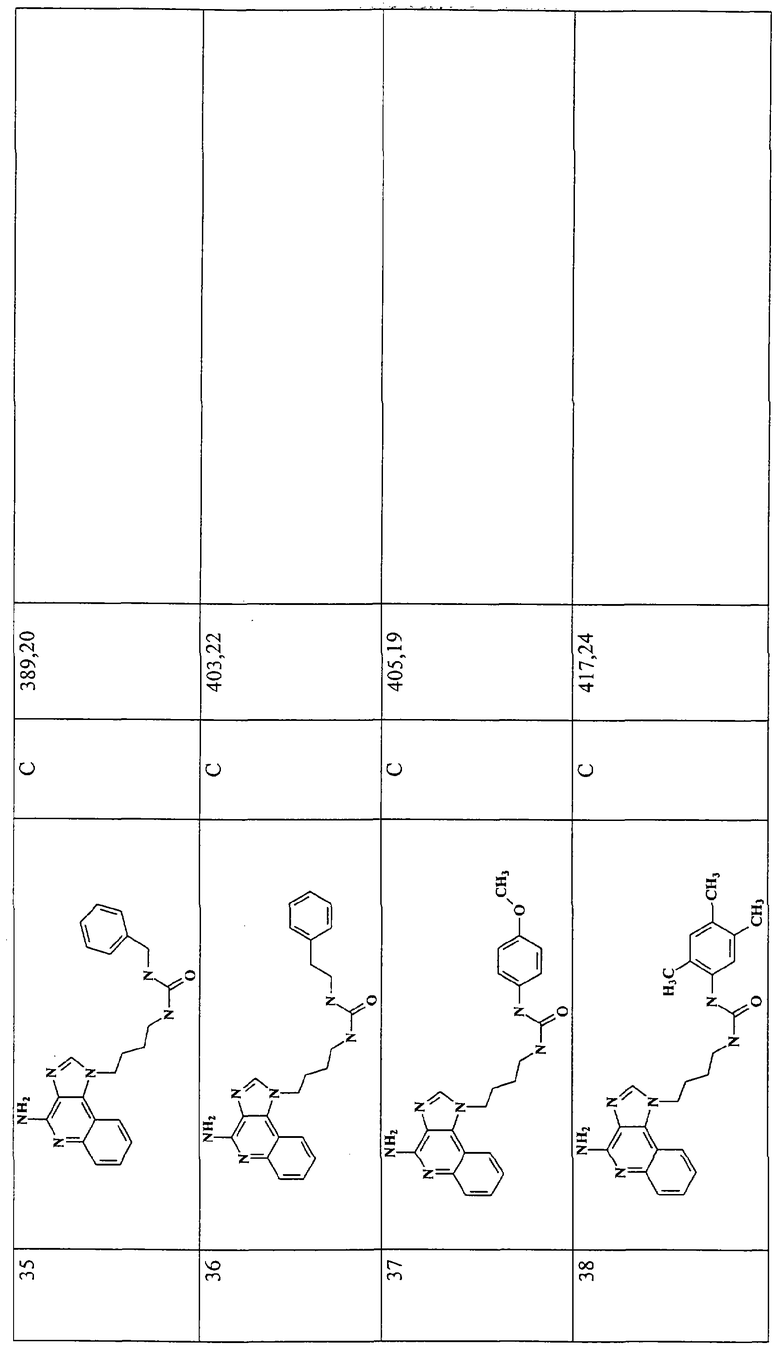
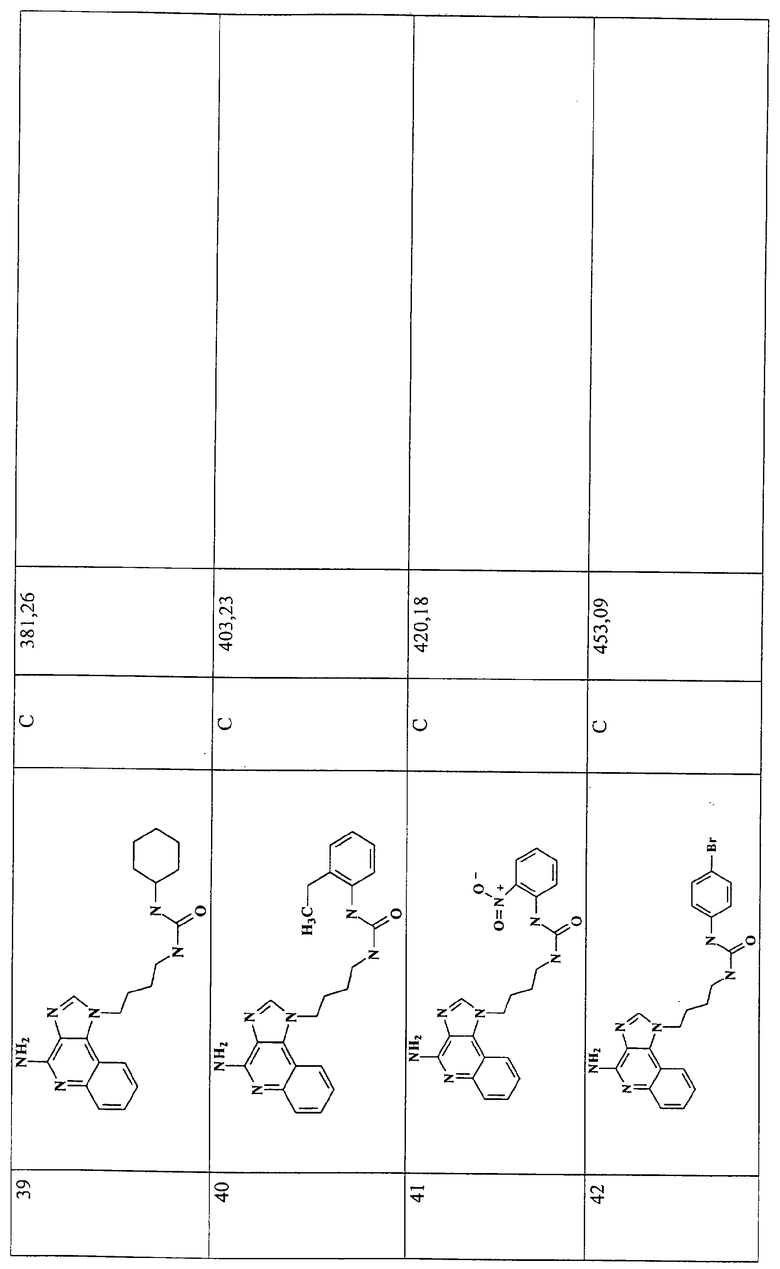
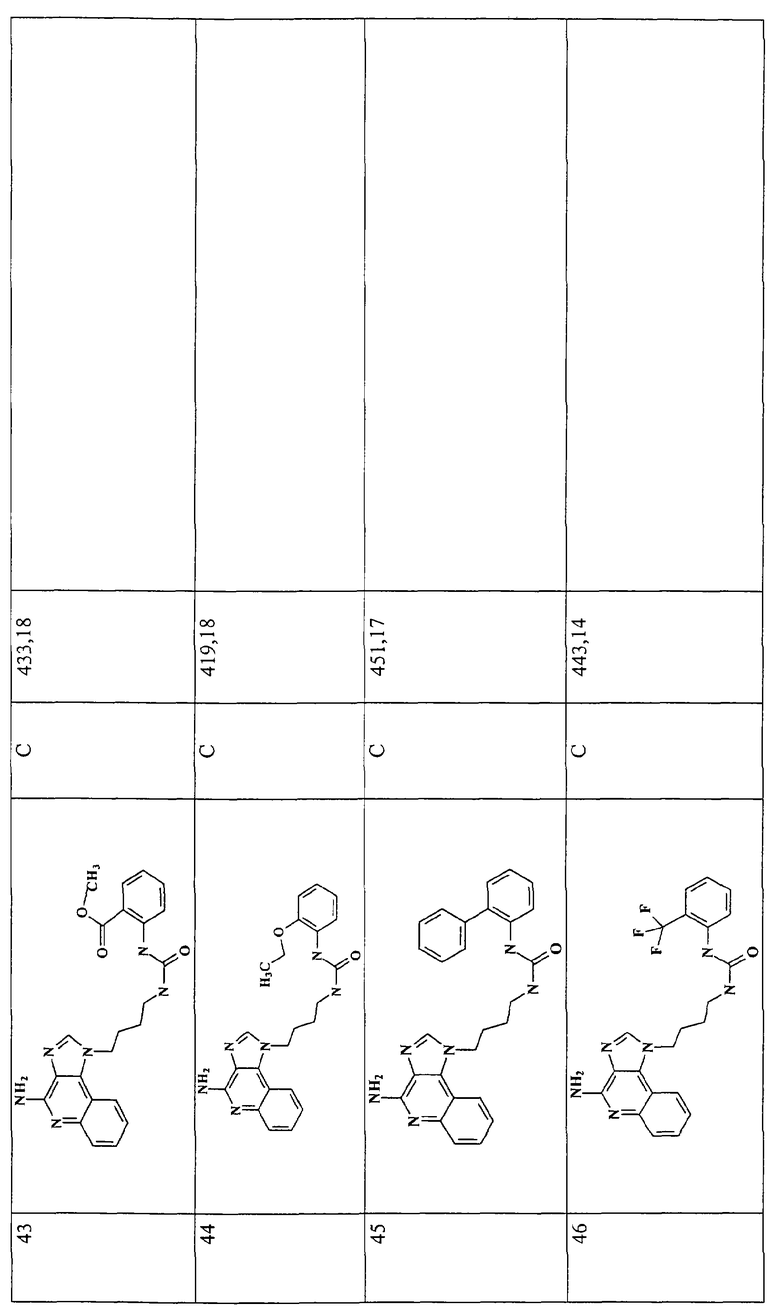
Примеры 16-52
Соединения, представленные ниже в Таблице 1, получают в соответствии с общей методикой синтеза, описанной выше в Схеме реакции II.
Раствор 1-(4-аминобутил)-1Н-имидазо[4,5-с]хинолин-4-амина (36 мкмоль) в 10 мл дихлорметана в пробирке с завинчивающейся крышкой охлаждают до -5°С. В виде 0,3 М раствора в дихлорметане прибавляют изоцианат (45 мкмоль). В ходе прибавления и еще 15 секунд после его окончания через смесь барботируют аргон и оставляют смесь на ночь при -5°С. К этой смеси прибавляют приблизительно 90 мг аминометил-полистирольной смолы (0,62 мг-экв/г, 100-200 меш), смесь нагревают до кипения с обратным холодильником и встряхивают в течение 3 часов при 600 об/мин. Для того, чтобы удалить смолу, смесь фильтруют через колонки Poly-Prep (Bio-Rad №731-1550). Используют три различные метода очистки. По Методу А фильтрат загружают в колонку с силикагелем. Колонку элюируют смесью дихлорметан/метанол 10:1, и фракции, содержащие продукт, соединяют и сушат под вакуумом. По Методу С фильтраты высушивают под вакуумом и очищают полупрепаративной ВЭЖХ на системе Джилсона (колонка Rainin Microsorb C18, 21,4×250 мм, размер частиц 8 мкм, поры 60 А, 10 мл/мин, градиентное элюирование от 2 до 95% Б в течение 25 минут, 5-минутная задержка на 95% Б, где Б=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС, нужные фракции лиофилизуют и получают трифторацетатные соли соответствующего соединения. В соответствии с Методом В, соединения сначала очищают по Методу С, а затем, чтобы выделить свободное основание, трифторацетатную соль растворяют в 3-5 мл смеси дихлорметан/метанол 2:1, в течение 1-2 часов встряхивают примерно с 80 мг (300 мкмоль) диизопропиламинометил-полистирольной смолы (Argonaut PS-DIEA, 3,86 ммоль/г), а потом фильтруют и сушат под вакуумом. Соединения, как правило, представляют собой аморфные твердые вещества.

Примеры 53-66
Соединения, представленные ниже в Таблице 2, получают в соответствии с методикой синтеза, описанной выше в Схеме реакции II, с помощью приведенного ниже общего метода. 1-(2-Аминоэтил)-2-бутил-1Н-имидазо[4,5-с]хинолин-4-амин (50 мг), дихлорметан (2 мл) и изоцианат помещают в ампулу на 2 драхмы (7,4 мл). Примерно на 2-16 часов ампулу помещают во встряхиватель при комнатной температуре. Для того, чтобы подтвердить образование целевого продукта, реакционную смесь анализируют на хромато-масс-спектрометре. Растворитель удаляют, а остаток очищают полупрепаративной ВЭЖХ (колонка Capcell Pak C18, 35 мм ×20 мм, размер частиц 5 мкм, 20 мл/мин, градиентное элюирование от 5 до 95% Б в течение 10 минут, 2-минутная задержка на 95% Б, где А=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС и соответствующие фракции соединяют и лиофилизуют. Образуется трифторацетатная соль нужной мочевины.
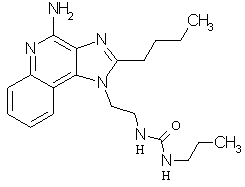
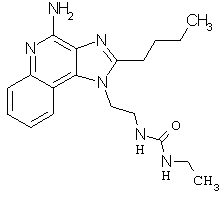
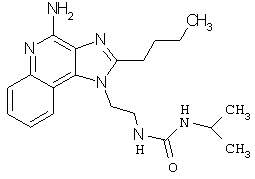
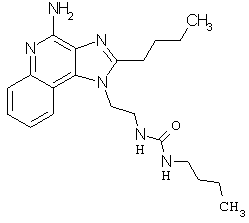
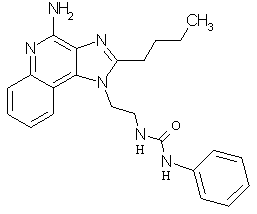
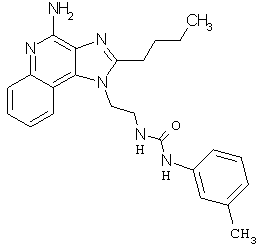
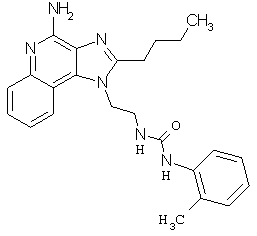

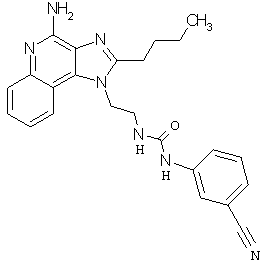
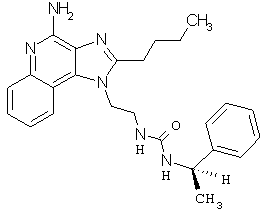
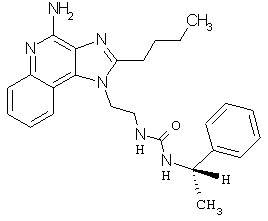
Примеры 67-69
Соединения, представленные ниже в Таблице 3, получают в соответствии со следующей методикой синтеза. 1-(2-Аминоэтил)-2-этоксиметил-1Н-имидазо[4,5-с]хинолин-4-амин гидрохлорид (50 мг), дихлорметан (2 мл) и диизопропилметан (1,2 эквивалента) помещают в ампулу на 2 драхмы (7,4 мл). Примерно на 1 час ампулу помещают во встряхиватель при комнатной температуре. Прибавляют соответствующий тиоизоцианат, и встряхивают ампулу при комнатной температуре еще примерно 4 часа. Для того, чтобы подтвердить образование целевого продукта, реакционную смесь анализируют на хромато-масс-спектрометре. Растворитель удаляют, а остаток очищают полупрепаративной ВЭЖХ (колонка Capcell Pak C18, 35 мм ×20 мм, размер частиц 5 мкм, 20 мл/мин, градиентное элюирование от 5 до 95% Б в течение 10 минут, 2-минутная задержка на 95% Б, где А=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС и соответствующие фракции соединяют и лиофилизуют. Образуется трифторацетатная соль нужной тиомочевины.
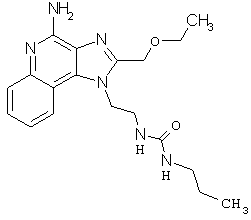

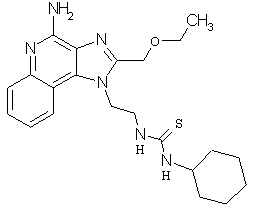
Примеры 70-99
Соединения, представленные ниже в Таблице 4, получают в соответствии методикой синтеза, описание выше в Схеме реакции II, путем взаимодействия 1-(4-аминобутил)-2-бутил-1Н-имидазо [4,5-c]хинолин-4-амина с соответствующим изоцианатом согласно общему методу, описанному выше в Примерах 53-66.

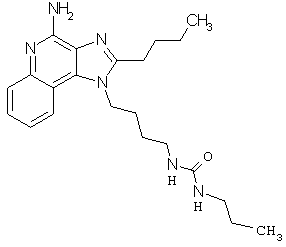
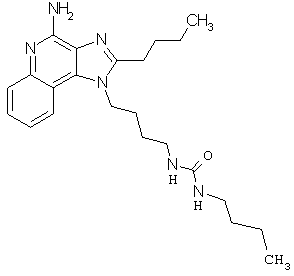

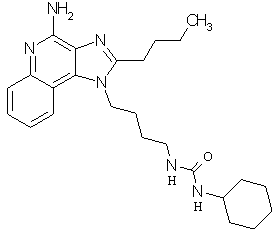
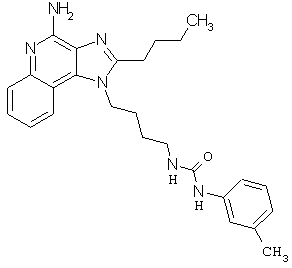
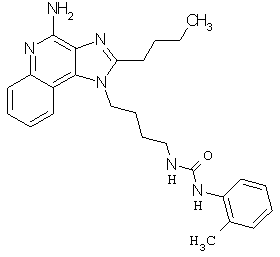
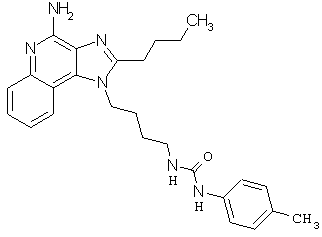
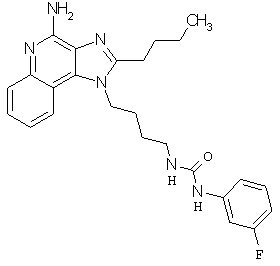
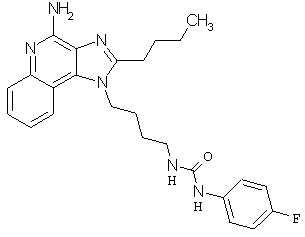
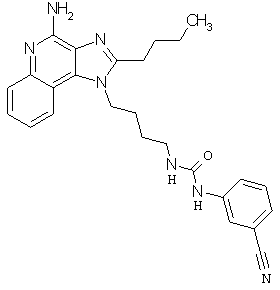
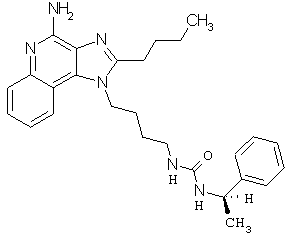

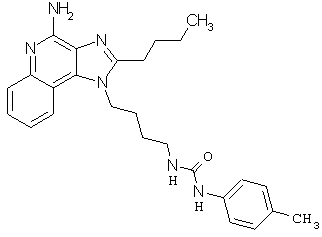
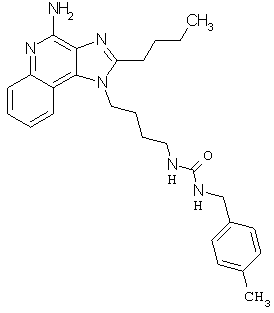
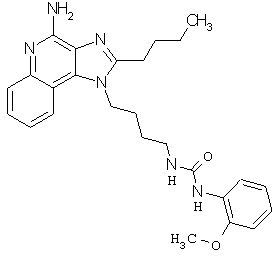
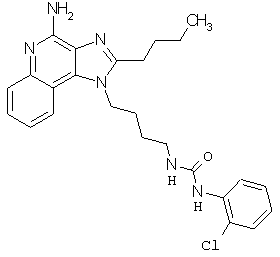
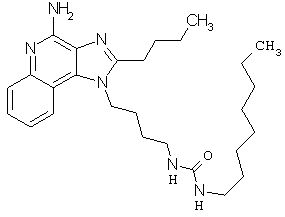
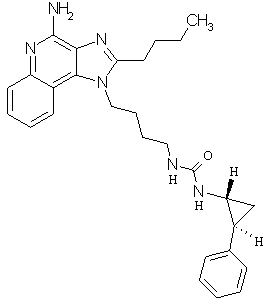
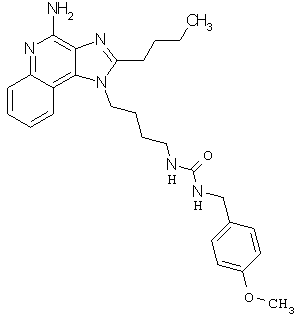
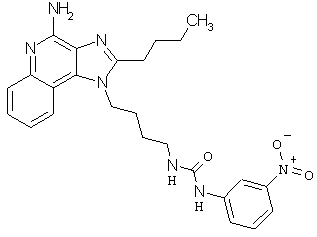
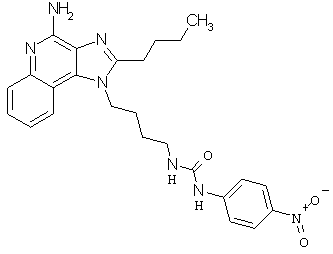
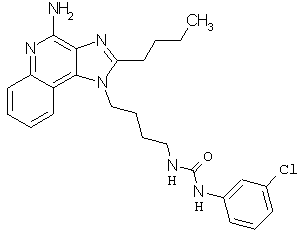
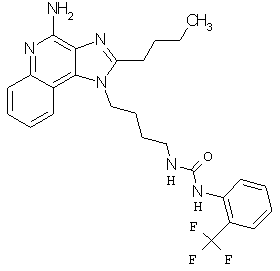
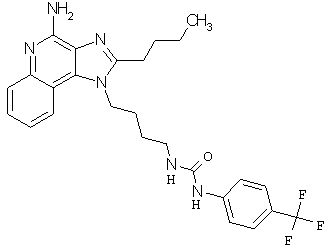
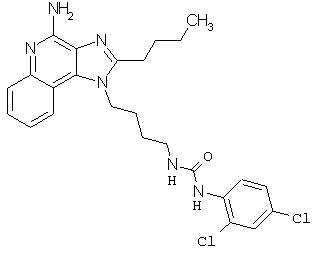
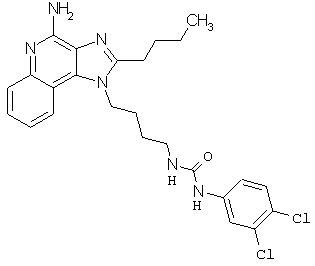
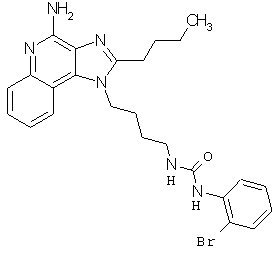
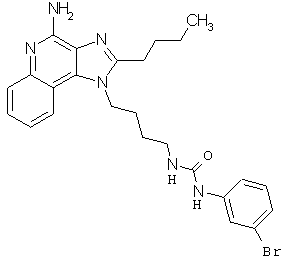
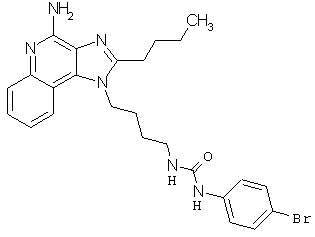
Примеры 100-119
Соединения, представленные ниже в Таблице 5, получают в соответствии с методикой синтеза, описанной выше в Схеме реакции II, путем взаимодействия 1-(4-аминобутил)-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-4-амина с соответствующим изоцианатом согласно общему методу, описанному выше в Примерах 53-66.
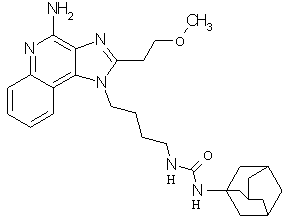
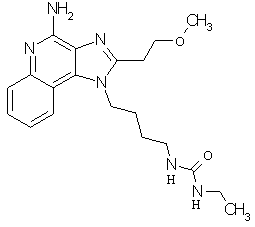
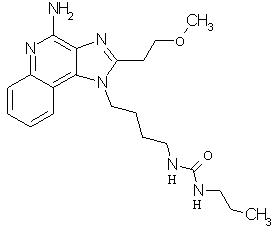
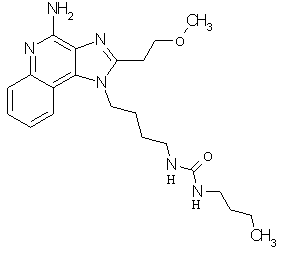
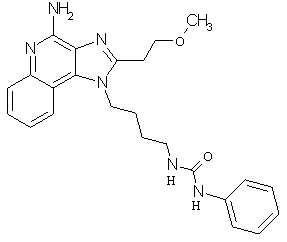
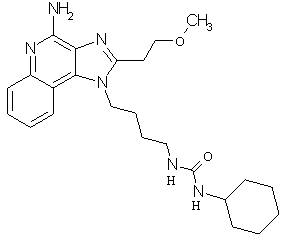
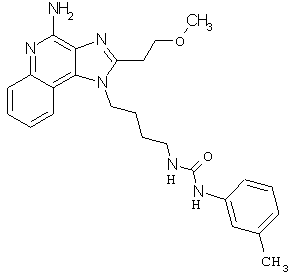

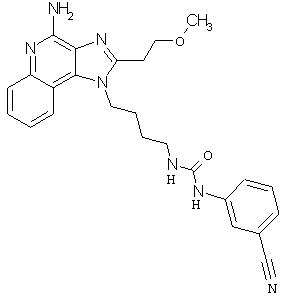
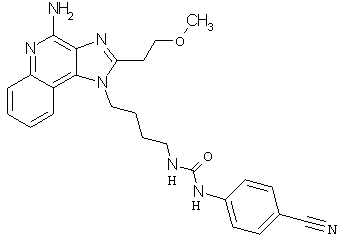
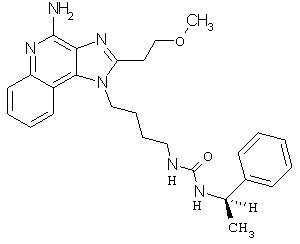
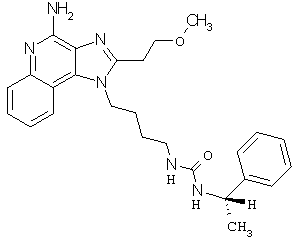
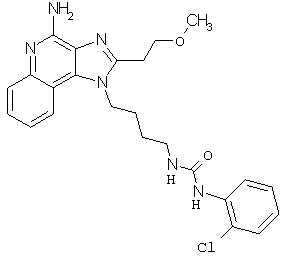
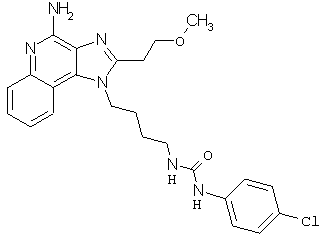
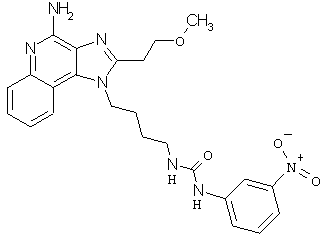
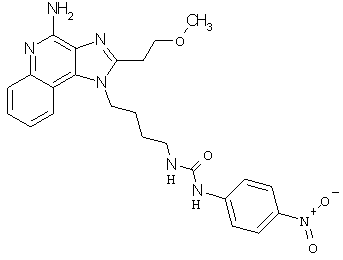
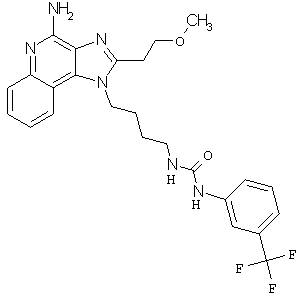
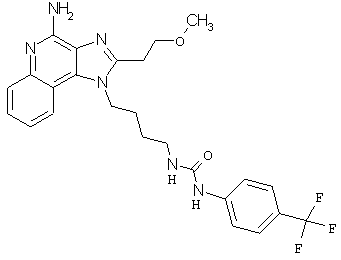

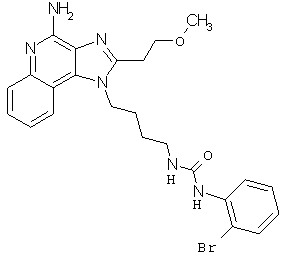
Примеры 120-122
Соединения, представленные ниже в Таблице 6, получают в соответствии с методикой синтеза, описанной выше в Схеме реакции III, с помощью приведенного ниже общего метода. 1-(2-Аминобутил)-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-4-амин (50 мг), диизопропилэтиламин (34 мкл), дихлорметан (2 мл) и карбамилхлорид (1,1 эквивалента) помещают в ампулу на 2 драхмы (7,4 мл). Примерно на 2 часа ампулу помещают во встряхиватель при комнатной температуре. Для того, чтобы подтвердить образование целевого продукта, реакционную смесь анализируют на хромато-масс-спектрометре. Растворитель удаляют, а остаток очищают полупрепаративной ВЭЖХ (колонка Capcell Рак С18, 35 мм ×20 мм, размер частиц 5 мкм, 20 мл/мин, градиентное элюирование от 5 до 95% Б в течение 10 минут, 2-минутная задержка на 95% Б, где А=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС и соответствующие фракции соединяют и лиофилизуют. Образуется трифторацетатная соль нужной мочевины.
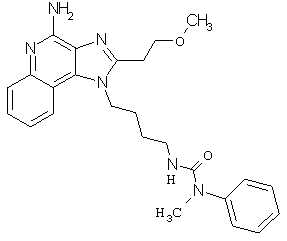
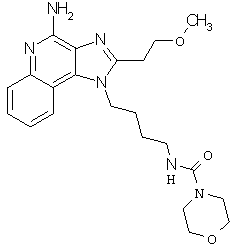
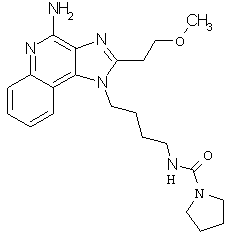
Пример 123-124
Соединения, представленные ниже в Таблице 7, получают в соответствии с методикой синтеза, описанной выше в Схеме реакции II, путем взаимодействия 1-(4-аминобутил)-2-(4-метоксифенилметил)-1Н-имидазо[4,5-c]хинолин-4-амина с соответствующим изоцианатом согласно общему методу, описанному выше в Примерах 53-66.
Примеры 125-131
Соединения, представленные ниже в Таблице 8, получают в соответствии с методикой синтеза, описанной выше в Схеме реакции II, с помощью следующего общего метода. 1-(4-Аминобутил)-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-4-амин (50 мг), дихлорметан (2 мл) и тиоизоцианат (1,1 эквивалента) помещают в ампулу на 2 драхмы (7,4 мл). Примерно на 30-60 минут ампулу помещают во встряхиватель при комнатной температуре. Для того, чтобы подтвердить образование целевого продукта, реакционную смесь анализируют на хромато-масс-спектрометре. Растворитель удаляют, а остаток очищают полупрепаративной ВЭЖХ (колонка Capcell Pak C18, 35 мм ×20 мм, размер частиц 5 мкм, 20 мл/мин, градиентное элюирование от 5 до 95% Б в течение 10 минут, 2-минутная задержка на 95% Б, где А=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС и соответствующие фракции соединяют и лиофилизуют. Образуется трифторацетатная соль нужной тиомочевины.
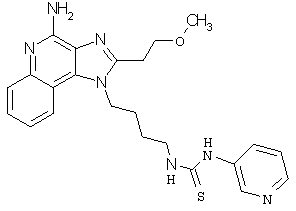
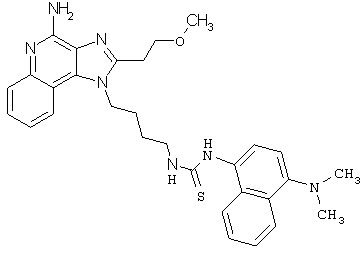
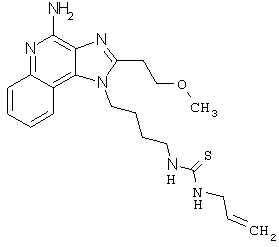

Примеры 132-137
Соединения, представленные ниже в Таблице 9, получают в соответствии с общей методикой синтеза, описанной выше в Схеме реакции VII.
Часть А
Исходные тетрагидрохинолинамины получают следующим образом.
Каталитическое количество оксида платины (IV) прибавляют к раствору 1-(4-аминобутил)-2-бутил-1Н-имидазо[4,5-с]хинолин-4-амина (2,2 г, 7,06 ммоль) в трифторуксусной кислоте (200 мл). В течение 6 суток реакционную смесь гидрируют в аппарате Парра под давлением 50 фунтов на кв. дюйм (3,44×105 Па). Для того, чтобы удалить катализатор, смесь фильтруют, и фильтрат концентрируют под вакуумом. Остаток соединяют с 1Н соляной кислотой (100 мл) и в течение 2 часов нагревают на паровой бане. Смесь охлаждают, подщелачивают гидроокисью аммония, а затем экстрагируют дихлорметаном. Экстракт концентрируют под вакуумом и получают твердый 1-(4-аминобутил)-2-бутил-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-4-амин с температурой плавления 63-67°С.
Каталитическое количество оксида платины (IV) прибавляют к раствору 1-(4-аминобутил)-2-метоксиэтил-1Н-имидазо[4,5-с]хинолин-4-амина (7,7 г, 24,5 ммоль) в трифторуксусной кислоте (250 мл). Реакционную смесь гидрируют в аппарате Парра под давлением 50 фунтов/кв.дюйм (3,44×105 Па). За ходом реакции следят по хромато-масс-спектрометру. Через 7,11 и 17 дней после начала реакции добавляют дополнительные количества катализатора. Через 25 дней реакция завершается. Для того, чтобы удалить катализатор, смесь фильтруют через слой ускорителя фильтрования целит (Celite®), и фильтрат концентрируют под вакуумом. Остаток соединяют с 1Н соляной кислотой (100 мл) и оставляют на ночь перемешиваться. Смесь подщелачивают гидроокисью аммония до рН 11, а затем экстрагируют дихлорметаном (3 раза по 300 мл). Экстракты соединяют и концентрируют под вакуумом. Выход: 3,5 г твердого 1-(4-аминобутил)-6,7,8,9-тетрагидро-2-метоксиэтил-1Н-имидазо[4,5-с]хинолин-4-амина.
Часть Б
С помощью методики, описанной для примеров 53-66, тетрагидроимидазохинолинамины из части А взаимодействуют с соответствующим изоцианатом или сульфонилизоцианатом с образованием нужной мочевины или сульфонилмочевины.
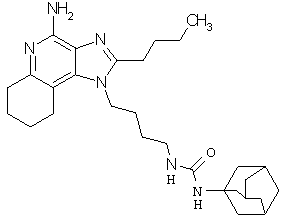
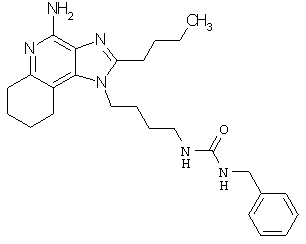
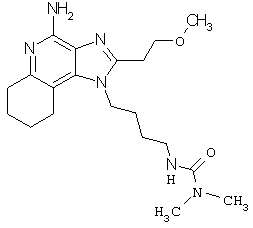
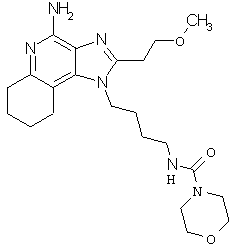
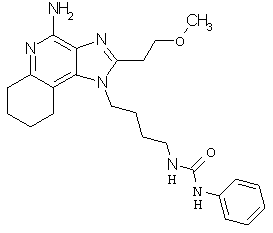
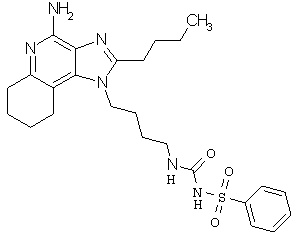
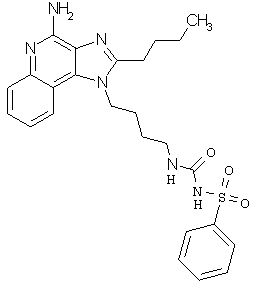
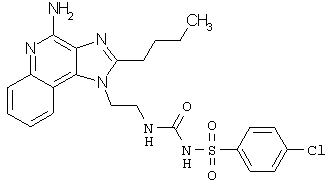
Примеры 138-140
Соединения, представленные ниже в Таблице 10, получают в соответствии с методикой синтеза, описанной выше в Схеме реакции VI, с помощью следующего общего метода. 1Н-Имидазо[4,5-с]хинолин-4-амин (50 мг), дихлорметан (2 мл) и сульфонилизоцианат (1,3 эквивалента) помещают в ампулу на 2 драхмы (7,4 мл). Ампулу помещают во встряхиватель при комнатной температуре. Для того, чтобы подтвердить образование целевого продукта, реакционную смесь анализируют на хромато-масс-спектрометре. Растворитель удаляют, а остаток очищают полупрепаративной ВЭЖХ (колонка Capcell Рак С18, 35 мм ×20 мм, размер частиц 5 мкм, 20 мл/мин, градиентное элюирование от 5 до 95% Б в течение 10 минут, 2-минутная задержка на 95% Б, где А=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС и соответствующие фракции соединяют и лиофилизуют. Образуется трифторацетатная соль нужной сульфонилмочевины.

Пример 141
N1-{4-[4-Амино-2-метоксиэтил)-1H-имидазо[4,5-с]хинолин-1ил]бутил}-N3-бензоилмочевина трифторацетат
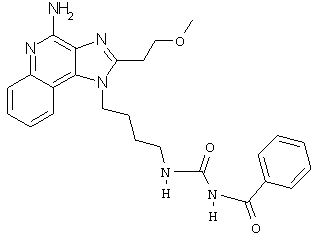
Это соединение получают в соответствии с общей методикой, описанной выше в Схеме реакции V. 1-(4-Аминобутил)-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-4-амин (50 мг), дихлорметан (2 мл) и бензоилизоцианат (1,1 эквивалента) помещают в ампулу на 2 драхмы (7,4 мл). Примерно на 2 часа ампулу помещают во встряхиватель при комнатной температуре. Для того, чтобы подтвердить образование целевого продукта, реакционную смесь анализируют на хромато-масс-спектрометре. Растворитель удаляют, а остаток очищают полупрепаративной ВЭЖХ (колонка Capcell Pak C18, 35 мм ×20 мм, размер частиц 5 мкм, 20 мл/мин, градиентное элюирование от 5 до 95% Б в течение 10 минут, 2-минутная задержка на 95% Б, где А=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС и соответствующие фракции соединяют и лиофилизуют. Образуется трифторацетатная соль целевого соединения. Масс-спектрометрия: (ХИАД) m/e 461.2 (М+Н).
Пример 142
N1-{4-[4-Амино-2-метоксиэтил)-1H-имидазо[4,5-с]хинолин-1ил]бутил}-карбамат трифторацетат

Это соединение получают в соответствии с общей методикой, описанной выше в Схеме реакции IV. 1-(4-Аминобутил)-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-4-амин (50 мг), диизопропилэтиламин (1,2 эквивалента), дихлорметан (2 мл) и бензилхлорформиатт (1,1 эквивалента) помещают в ампулу на 2 драхмы (7,4 мл). На 2 часа ампулу помещают во встряхиватель при комнатной температуре. Для того, чтобы подтвердить образование целевого продукта, реакционную смесь анализируют на хромато-масс-спектрометре. Растворитель удаляют, а остаток очищают полупрепаративной ВЭЖХ (колонка Capcell Pak C18, 35 мм х 20 мм, размер частиц 5 мкм, 20 мл/мин, градиентное элюирование от 5 до 95% Б в течение 10 минут, 2-минутная задержка на 95% Б, где А=0,1% трифторуксусной кислоты в воде, а Б=0,1% трифторуксусной кислоты в ацетонитриле, включение сбора фракций детектируется по пику 254 нм). Фракции, полученные полупрепаративной жидкостной хроматографией, анализируют на хромато-масс-спектрометре ЖХ-ХИАД/МС и соответствующие фракции соединяют и лиофилизуют. Образуется трифторацетатная соль целевого соединения. Масс-спектрометрия: (ХИАД) m/e 448.2 (М+Н).
ИНДУКЦИЯ ЦИТОКИНОВ В КЛЕТКАХ ЧЕЛОВЕКА
Для изучения индукции цитокинов соединениями настоящего изобретения была использована система клеток крови человека in vitro. Метод основан на измерении уровня (α) интерферона и фактора некроза опухоли (ИФН и ФНО, соответственно), секретируемых в культуральную среду, как описано Тестерманом и др (Testerman et al, "Cytokine induction by Immunomodulators Imiquimod and S-27609", Journal of Leukocyte Biology. 58, 365-372 (September, 1995)).
Приготовление клеток крови для культуры
Цельную кровь забирают из вены здорового человека и помещают в пробирки. Мононуклеарные клетки периферической крови (МКПК) выделяют из цельной крови в градиенте плотности путем центрифугирования с использованием прибора Histipaque®-1077 (ф. Sigma Chemicals, St. Louis, МО). Мононуклеары периферической крови суспендируют в концентрации 3-4×106 кпеток/мл в среде RPMI1640, содержащей 10% фетальной бычьей сыворотки, 2 мМ L-глютамина и 1% смеси пеницилина и стрептомицина (полная среда RPMI). Суспензию МКПК вносят в 48-луночные плоскодонные стерильные планшеты для культуры тканей (ф. Costar, Cambridge, МА, или ф. Becton Dickinson Labware, Lincoln Park, NJ), в которых находятся равные объемы полной среды RPMI, содержащей тестируемый препарат.
Приготовление препарата
Препарат солюбилизируют в диметилсульфоксиде (ДМСО). Конечная концентрация ДМСО для добавления в культуральные лунки не должна превышать 1%.
Инкубация
Раствор тестируемого препарата в концентрации 60 мкМ вносят в первую лунку, содержащую полную среду RPMI, затем делают серию последовательных разведений (3- или 10-кратных). Суспензию МКПК затем добавляют в лунки в равных объемах, что позволяет добиться необходимого спектра концентраций тестируемого препарата. Конечная концентрация суспензии МКПК составляет 1,5-2×106 клеток/мл. Плашки закрывают стерильными пластиковыми крышками и подвергают аккуратному перемешиванию и далее инкубируют в течение 18-24 часов при температуре 37°С в атмосфере с 5%-ной концентрацией двуокиси углерода.
Выделение
После инкубации плашки центрифугируют в течение 5-10 минут в режиме 1000 об/мин (˜200 g) при температуре 4°С. Супернатант извлекают из клеточной культуры стерильной полипропиленовой пипеткой и переносят в стерильные полипропиленовые пробирки. Полученные пробы хранят до анализа при температуре от -30 до -70°С. Затем пробы тестируют на содержание α-интерферона и α-фактора некроза опухоли методом твердофазного иммуноферментного анализа (ТИФА) [ELISA].
Анализ методом ТИФА (ELISA) на содержание α-интерферона и α-фактора некроза опухоли.
Метод ТИФА позволяет определить концентрацию α-интерферона с помощью набора Human Multi-Species kit (ф. PBL Biomedical Laboratories, New Brunswick, NJ).
Концентрацию фактора некроза опухоли определяют с помощью набора для ТИФА от ф. Genzyme, Cambridge, МА; ф. R&D Systems, Minneapolis, MN; или ф. Phamnigen, San Diego, CA).
Таблица 11, приведенная ниже, демонстрирует найденную наименьшую концентрацию каждого препарата для индукции фактора некроза опухоли. "**" -отражает отсутствие индукции в какой-либо из тестированных концентраций (0,12, 0,37, 1,11, 3,33, 10 и 30 мкМ); "***" - отражает отсутствие индукции в какой-либо из тестированных концентраций (0,0001, 0,001, 0,01, 0,1,1 и 10 мкМ).
В описании настоящего изобретения рассмотрены некоторые примеры его осуществления. Приведенные выше подробное описание и примеры представлены здесь только для ясности понимания и из них не следует каких-либо ограничений. Специалистам в данной области понятно, что возможны многочисленные изменения в описанных примерах осуществления, не меняющие сущности и объема настоящего изобретения. Таким образом, объем настоящего изобретения ограничен не конкретными деталями описанных здесь составов и структур, а лишь формулировками нижеследующей формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИДОЗАМЕЩЕННЫЕ ИМИДАЗОХИНОЛИНЫ | 2000 |
|
RU2295343C2 |
| ИМИДАЗОХИНОЛИНЫ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ИНДУКЦИИ БИОСИНТЕЗА ЦИТОКИНОВ НА ИХ ОСНОВЕ | 2000 |
|
RU2248975C2 |
| АРИЛЭФИРЗАМЕЩЕННЫЕ ИМИДАЗОХИНОЛИНЫ, ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ НА ИХ ОСНОВЕ, СПОСОБЫ ЛЕЧЕНИЯ ВИРУСНОГО ЗАБОЛЕВАНИЯ НА ИХ ОСНОВЕ, СПОСОБЫ ЛЕЧЕНИЯ ОПУХОЛЕВОГО ЗАБОЛЕВАНИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2308456C2 |
| ТИОЭФИРЗАМЕЩЕННЫЕ ИМИДАЗОХИНОЛИНЫ | 2001 |
|
RU2315049C2 |
| ЗАМЕЩЕННЫЕ ИМИДАЗОПИРИДИНЫ | 2001 |
|
RU2294934C2 |
| N-{2-[4-АМИНО-2-(ЭТОКСИМЕТИЛ)-1Н-ИМИДАЗО-[4,5-с]-ХИНОЛИН-1-ИЛ]-1,1-ДИМЕТИЛЭТИЛ}-МЕТАНСУЛЬФОНАМИД И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2004 |
|
RU2374246C2 |
| КАРБАМИДЗАМЕЩЕННЫЕ ИМИДАЗОХИНОЛИНОВЫЕ ЭФИРЫ | 2001 |
|
RU2302418C2 |
| ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЯ НА ОСНОВЕ КЕТОАМИДА | 2021 |
|
RU2819346C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ ИМИДАЗО(4,5-B)ХИНОЛИНИЛОКСИАЛКАНОВЫХ КИСЛОТ ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИМЕНЯЕМЫХ СОЛЕЙ | 1990 |
|
RU2041210C1 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИМИДАЗОПИРИДИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2697090C1 |
Изобретение относится к новым мочевинозамещенным имидазохинолинам формулы 1:

где R, R1, R2 и n имеют значения, указанные в описании, а также к фармацевтическим препаратам на основе этих соединений, которые обладают действием иммуномодуляторов, инициирующих биосинтез различных цитокинов, и способам лечения различных состояний, в том числе вирусных заболеваний и неоплазменных патологий. Технический результат - получение новых биологически активных соединений и их возможное использование в медицине. 13 н. и 34 з.п. ф-лы., 11 табл.
где связи, указанные пунктирной линией могут как присутствовать, так и отсутствовать,
R1 - это -алкил-NR3-CY-NR5-X-R4,
Y - это =O или =S;
Х - это связь, -СО- или -SO2-;
R4 - это фенил, нафтил, пиридил, алкил или алкенил, каждый из которых может быть незамещенным или замещенным одним или более заместителями, выбираемыми из группы, в которую входят:
- алкил;
- фенил;
-O-алкил;
-O-(алкил)0-1-фенил;
-СО-O-алкил;
-СО-алкил;
-S(O)0-2-алкил;
-(алкил)0-1-NR3R3;
- галоген;
- галогеналкил;
- галогеналкоксил;
-СО-галогеналкоксил;
-NO2;
-CN;
при условии, что, если Х - это связь, то R4 может также быть водородом;
R2 выбирается из группы, в которую входят:
- водород;
- алкил;
- фенил;
-алкил-O-алкил и
- алкил, замещенный одним или более заместителями, выбираемыми из группы, в которую входят:
- фенил;
- фенил, замещенный алкоксилом;
-O-фенил;
каждый из R3 является водородом;
R5 выбирают из группы, в которую входят водород и алкил C1-10; либо R4 и R5 в совокупности могут образовывать кольцо морфолина или пирролидина;
n - это число 0,
или его фармацевтически приемлемая соль.
- алкил;
- фенил;
-O-алкил;
-O-(алкил)0-1-фенил;
-СО-O-алкил;
-СО-алкил;
-S(O)0-2-алкил;
-(алкил)0-1-NR3R3;
- галоген;
- галогеналкил;
- галогеналкоксил;
-NO2 и
-CN.
- алкил;
- фенил;
-O-алкил;
-O-(алкил)0-1-фенил;
-СО-O-алкил;
-СО-алкил;
-S(O)0-2-алкил;
-(алкил)0-1-NR3R3;
- галоген;
- галогеналкил;
- галогеналкоксил;
-NO2 и
-CN.
- алкил;
- фенил;
-O-алкил;
-O-(алкил)0-1-фенил;
-СО-O-алкил;
-CO-алкил;
-S(O)0-2-алкил;
-(алкил)0-1-NR3R3;
- галоген;
- галогеналкил;
- галогеналкоксил;
- NO2;
- CN.
- алкил;
- фенил;
-O-алкил;
-O-(алкил)0-1-фенил;
-СО-O-алкил;
-СО-алкил;
-S(O)0-2-алкил;
-(алкил)0-1-NR3R3;
- галоген;
- галогеналкил;
- галогеналкоксил;
-NO2 и
-CN.
N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-бензилмочевина;
N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-бутилмочевина;
N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-(2-этилфенил)мочевина;
N-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-циклогексилмочевина;
N'-[4-(4-амино-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N-метил-N-фенилмочевина;
N-[2-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)этил]-N'-фенилмочевина;
N-[2-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)этил]-N'-(4-феноксифенил)мочевина;
N-[2-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)этил]-N'-бензилмочевина;
N-[2-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)этил]-N'-пропилмочевина;
N-{2-[4-амино-2-(этоксиметил)-1Н-имидазо[4,5-с]хинолин-1-ил]этил}-N'-пропилмочевина;
N-{2-[4-амино-2-(этоксиметил)-1Н-имидазо[4,5-с]хинолин-1-ил]этил}-N'-фенилмочевина;
N-{2-[4-амино-2-(этоксиметил)-1Н-имидазо[4,5-с]хинолин-1-ил]этил}-N'-циклогексилмочевина;
N-{2-[4-амино-2-(этоксиметил)-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]этил}-N'-циклогексилмочевина;
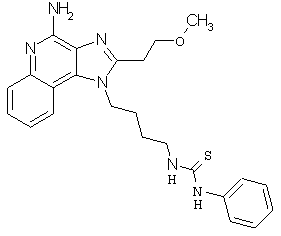
N-{2-[4-амино-2-(этоксиметил)-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]этил}-N'-фенилмочевина;
N-[4-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-пропилмочевина;
N-[4-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-[(1S)-1-фенилэтил]мочевина;
N-[4-(4-амино-2-бутил-1Н-имидазо(4,5-с]хинолин-1-ил)бутил]-N'-[(1R)-1-фенилэтил]мочевина;
N-[4-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]-N'-(2-метоксифенил) мочевина;
N-(4-ацетилфенил)N'-[4-(4-амино-2-бутил-1Н-имидазо[4,5-с]хинолин-1-ил)бутил]мочевина;
N-[4-(4-амино-2-бутил-1H-имидазо[4,5-c]хинолин-1-ил)бутил]-N'-[4-(диметиламино)фенил]мочевина;
N-[4-(4-амино-2-бутил-1Н-имидазо[4,5-c]хинолин-1-ил)бутил]-N'-(4-метоксибензил)мочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-пропилмочевина;
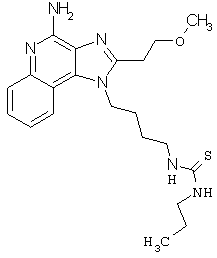
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-(3-метилфенил)мочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-(3-фторфенил)мочевина;
N4-{4-[4-амино-2-(2-метоксиэтил)-1H-имидазо[4,5-c]хинолин-1-ил]бутил}-4-морфолинкарбоксамид;
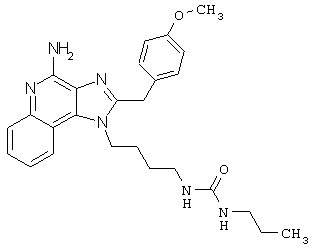
N-{4-[4-амино-2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-пропилмочевина;
N-{4-[4-амино-2-(4-метоксибензил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-фенилмочевина; и
N-{4-[4-амино-2-(4-метоксибензил)-1H-имидазо[4,5-c]хинолин-1-ил]бутил}-N'-(3-пиридил)мочевина;
N-(4-амино-2-бутил-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-бензилмочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин-1-ил]бутил}-N,N-диметилмочевина;
N4-{4-[4-амино-2-(2-метоксиэтил)-6,7,8,9-тетрагидро-1H-имидазо[4,5-с]хинолин-1-ил]бутил}-4-морфолинкарбоксамид; и
N-{4-[4-амино-2-(2-метоксиэтил)-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-фенилмочевина;
N-{2-[4-амино-2-(этоксиметил)-1Н-имидазо[4,5-с]хинолин-1-ил]этил}-N'-циклогексилтиомочевина;
N-[4-(4-амино-2-бутил-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-циклогексилтиомочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-(3-пиридил)мочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-(4-(диметиламино)-1-нафтил)тиомочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-пропилтиомочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-фенилтиомочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-фенилтиомочевина;
N-аллил-N'-{4-[4-амино-2-(2-метоксиэтил)-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}тиомочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-(трет-бутил)тиомочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-(1-нафтил)тиомочевина;
N-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}-N'-(трет-бутил)тиомочевина; и
N-аллил-N'-{4-[4-амино-2-(2-метоксиэтил)-1Н-имидазо[4,5-с]хинолин-1-ил]бутил}тиомочевина.
4-амино-2-бутил-1-[4-({[(фенилсульфонил)амино]карбонил}амино)бутил]-6,7,8,9-тетрагидро-1Н-имидазо[4,5-с]хинолин;
4-амино-2-бутил-1-[4-({[(фенилсульфонил)амино]карбонил}амино)бутил]-1Н-имидазо[4,5-с]хинолин;
4-амино-2-бутил-1-{4-[({[(4-фторфенил)сульфонил]амино}карбонил)амино]бутил}-1Н-имидазо[4,5-с]хинолин;
4-амино-2-бутил-1-{4-[({[(4-хлорфенил)сульфонил]амино}карбонил)амино]бутил}-1Н-имидазо[4,5-с]хинолин;
4-амино-2-бутил-1-{4-[({[(4-этилфенил)сульфонил]амино}карбонил)амино]бутил}-1Н-имидазо[4,5-с]хинолин;
4-амино-2-(2-метоксиэтил)-1-{4-[({[(4-метилфенил)сульфонил]амино}карбонил)амино]бутил}-1Н-имидазо[4,5-с]хинолин;
4-амино-2-(2-метоксиэтил)-1-[4-({[(фенилсульфонил)амино]карбонил}амино)бутил]-1Н-имидазо[4,5-с]хинолин;
4-амино-2-(этоксиметил)-1-[4-({[(фенилсульфонил)амино]карбонил}амино)этил]-1Н-имидазо[4,5-с]хинолин;
4-амино-2-бутил-1-{4-[({[(4-метилфенил)сульфонил]амино}карбонил)амино]этил}-1Н-имидазо[4,5-с]хинолин;
4-амино-2-бутил-1-{4-[({[(4-хлорфенил)сульфонил]амино}карбонил)амино]этил}-1Н-имидазо[4,5-с]хинолин.
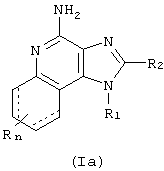
где связи, изображенные пунктирной линией, могут как присутствовать, так и отсутствовать;
R1 - это -алкил-NR3-СО-O-R4;
R4 - это арил или алкил, а также алкил, замещенный арилом;
R2 выбирается из группы, в которую входят:
- водород или
- фенил;
-алкил-O-алкил;
каждый из R3 выбирают из группы, в которую входят водород и алкил C1-10;
n - это число, равное 0,
R независимо выбирают из группы, в которую входят алкил C1-10, алкоксил C1-10, галоген и трифторметил,
или его фармацевтически приемлемая соль.
Приоритет по пунктам и признакам:
| Уплотнение поршня | 1950 |
|
SU89479A1 |
| JP 9208584 А1, 12.08.1997 | |||
| ПРОИЗВОДНОЕ 1,3-ДИГИДРО-2H-ИМИДАЗО/4,5-B/ХИНОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРА ФОСФОДИЭСТЕРАЗЫ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ ДЛЯ НЕГО, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1992 |
|
RU2127273C1 |
Авторы
Даты
2005-11-27—Публикация
2000-06-08—Подача