ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области биотехнологии и генной инженерии и, в частности, относится к полинуклеотиду, обладающему промоторной активностью, и транскрипционной экспрессионной кассете, рекомбинантному экспрессионному вектору и рекомбинантной клетке-хозяину, содержащей полинуклеотид, обладающий промоторной активностью, а также к способу конструирования промоторного мутанта, способу регуляции транскрипции целевого гена и способу получения белка и способу получения целевого соединения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Микробная ферментация может обеспечивать производство различных целевых соединений, таких как аминокислоты и органические кислоты, которые могут широко использоваться в медицине, пищевой промышленности, кормах для животных и косметике и имеют большую экономическую ценность. В последние годы, с увеличением рыночного спроса на аминокислоты, органические кислоты и так далее, увеличение выхода целевого соединения и реализация промышленного крупномасштабного производства целевого соединения является важной проблемой, которую необходимо решить в срочном порядке.
Разведение высокопродуктивных ферментирующих микроорганизмов является важным средством повышения промышленного выхода целевых соединений. По сравнению с традиционной технологией селекции мутаций, технология генноинженерной селекции широко используется из-за ее сильной актуальности и высокой эффективности. Многочисленные исследования показали, что эффективная экспрессия ключевого гена в пути синтеза целевого соединения является ключом к улучшению выхода и скорости превращения целевого соединения.
Это важный способ повышения выхода ферментации целевого соединения путем трансформации ключевого гена в микробном метаболическом пути с помощью генной инженерии. Промотор является важным регуляторным элементом, который влияет на экспрессию генов, и тонкая регуляция промотора может оптимизировать скорость превращения целевого соединения. Промоторы с различной интенсивностью экспрессии могут удовлетворять потребности в различных интенсивностях экспрессии различных генов, тем самым улучшая выход и скорость превращения целевого соединения.
Поэтому в области микробной ферментации необходимо срочно решить важную проблему разработки большего количества промоторов с высокой активностью, чтобы усилить экспрессию ключевых генов в пути синтеза целевых соединений, улучшить выход целевых соединений и повысить конкурентоспособность биоферментационной промышленности.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
С учетом технической проблемы, существующей в уровне техники, например, необходимо разработать больше промоторов с высокой активностью, чтобы усилить экспрессию ключевых генов в пути синтеза целевых соединений, настоящее изобретение относится к полинуклеотиду, обладающему промоторной активностью, который представляет собой мутант полинуклеотида, содержащего последовательность, представленную в SEQ ID NO: 1. Мутант согласно настоящему изобретению обладает промоторной активностью, значительно улучшенной по сравнению с промотором дикого типа, и обеспечивает компонент регуляции экспрессии с большим потенциалом применения для трансформации целевого гена. Функционально лигируя мутант с целевым геном, экспрессия целевого гена может быть эффективно улучшена, тем самым эффективно улучшая выход и скорость превращения целевого соединения.
Решение проблемы
В настоящем изобретении предложен полинуклеотид, обладающий промоторной активностью, выбранный из группы, представленной в любом из следующих вариантов (i)-(iv):
(i) мутант полинуклеотида, содержащего последовательность SEQ ID NO: 1, содержащий мутированный нуклеотид в одном или более положениях 105-126 последовательности SEQ ID NO: 1;
(ii) полинуклеотид, содержащий последовательность, комплементарную нуклеотидной последовательности, как указано в (i);
(iii) полинуклеотид, содержащий обратно комплементарную последовательность, способную гибридизоваться с нуклеотидной последовательностью, как указано в (i) или (ii), в жестких условиях гибридизации или в очень жестких условиях гибридизации;
(iv) полинуклеотид, идентичный на по меньшей мере 90%, необязательно по меньшей мере 95%, предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98% и наиболее предпочтительно по меньшей мере 99% нуклеотидной последовательности, указанной в (i) или (ii);
где полинуклеотид, представленный в любом из (i) - (iv), имеет нуклеотидную последовательность, которая не является TTCTCTTTTAAGCGGGATAGCA в положениях 105-126 последовательности, представленной в SEQ ID NO: 1; и полинуклеотид, представленный в любом из (i) - (iv), обладает повышенной промоторной активностью по сравнению с полинуклеотидом, имеющим последовательность, представленную в SEQ ID NO: 1.
В некоторых вариантах реализации настоящего изобретения предложен полинуклеотид, обладающий промоторной активностью, где указанный мутант имеет в 0,4-13 раз или более улучшенную промоторную активность по сравнению с промоторной активностью полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1.
В некоторых вариантах реализации настоящего изобретения предложен полинуклеотид, обладающий промоторной активностью, где нуклеотидная последовательность мутанта, соответствующая положениям 105-126 последовательности, представленной в SEQ ID NO: 1, выбрана из любой из группы, состоящей из (Pmdh-1) - (Pmdh-49):
(Pmdh-1) CAGGTAACAACTGCGAGTACGG;
(Pmdh-2) AGTCTGAGGGATATAATTAAGA;
(Pmdh-3) GGTCGTGGAGGACAAGTTAAGA;
(Pmdh-4) CTACTACCATCGGGTGCTAAGG;
(Pmdh-5) GATAGGTAGGCGTTAAGTAAAC;
(Pmdh-6) GGCAATTCGCGGGGAGGTAGAC;
(Pmdh-7) TATTGGGCGCGGCATTATAGGA;
(Pmdh-8) GGGAACTGCTTTGGTAGTATCA;
(Pmdh-9) GTTCAGGTTTGGGCCGCTATGC;
(Pmdh-10) TGATCGGGGCGCTTTGGTACGG;
(Pmdh-11) TATGAAATAAATTGGAGTAGGC;
(Pmdh-12) AACGGTATCTTTCTCCATATAA;
(Pmdh-13) AACGGAGCGTGTACGACTAGAA;
(Pmdh-14) TGCGCGGGTAAACGCTGTAGAG;
(Pmdh-15) TTGATGTCGTAGCGTAGTATTA;
(Pmdh-16) AGCTCGGACTTTGGTGGTAGGC;
(Pmdh-17) CCGGCGCATTATAACGCTACAA;
(Pmdh-18) CGGGGGTGTAAGTCGAGTAGAC;
(Pmdh-19) ACGGGTAGGTATTTCGCTAGGA;
(Pmdh-20) TAGTGTATGCTTTTACATAGAC;
(Pmdh-21) AGGCAGCATGTACATGATATCG;
(Pmdh-22) TTGAGCGGAGTTAATAGTACAC;
(Pmdh-23) ATACACACAACTTTCGATACTA;
(Pmdh-24) ATTCCAACCTTATGTTATACTG;
(Pmdh-25) GAGGTAGTCGTTTGGGGTAGGA;
(Pmdh-26) ATTGCTCGCGTAAATGGTAAAC;
(Pmdh-27) TGTTATTATGGGAGATGTAAGT;
(Pmdh-28) GAAAAATGTACGTGTGTTAAAA;
(Pmdh-29) AGTCCTCAGTGGAGTGGTAACA;
(Pmdh-30) TTTCCGGTGTTTTCGCGTAGAG;
(Pmdh-31) GGCGTCGGTAGGTATGTTATTG;
(Pmdh-32) ACGGCGATCAGAGTGTGTAAGA;
(Pmdh-33) CCGTGCGTGATATGGGGTAGTG;
(Pmdh-34) GGGTTGTGAGTTATCGGTATAA;
(Pmdh-35) TGCTCCGATGATGGTGGTAAGA;
(Pmdh-36) GTTCTCACGGGTCCGTGTATGA;
(Pmdh-37) TTTCGGAATGGATGGTGTACGC;
(Pmdh-38) ATTATGTCTTCTTTTGGTAAAA;
(Pmdh-39) GATCATAGGTTCTGTGGTAGAT;
(Pmdh-40) CATGGCCGATCATGATGTAATA;
(Pmdh-41) TAGTGGCGGTGTACGTGTATGA;
(Pmdh-42) ATTTGTTACAGGTATGGTAGTT;
(Pmdh-43) ACGGAACTTATTTCTGGTAACG;
(Pmdh-44) ACCGGGAGGACTAATGGTATGG;
(Pmdh-45) GCCACCCCTTTTTCTGCTATTA;
(Pmdh-46) TTGCGCCGGAGTTGCGGTATAG;
(Pmdh-47) GTTTACGGGTGTTCATGTAGTA;
(Pmdh-48) TTTGTCTCGTATCTGTGTAAGA;
(Pmdh-49) ATTTTGGGCACTTAGTGTATTG.
В некоторых вариантах реализации настоящего изобретения предложен полинуклеотид, обладающий промоторной активностью, где нуклеотидная последовательность мутанта выбрана из последовательностей, представленных в любой из SEQ ID NO: 3-51.
Согласно настоящему изобретению также предложена транскрипционная экспрессионная кассета, содержащая полинуклеотид, обладающий промоторной активностью; необязательно, транскрипционная экспрессионная кассета дополнительно содержит целевой ген, который функционально лигирован с полинуклеотидом, обладающим промоторной активностью; предпочтительно, целевой ген представляет собой ген, кодирующий белок.
В настоящем изобретении дополнительно предложен рекомбинантный экспрессионный вектор, содержащий полинуклеотид, обладающий промоторной активностью, в соответствии с настоящим изобретением, или транскрипционную экспрессионную кассету по настоящему изобретению.
Настоящее изобретение дополнительно относится к рекомбинантной клетке-хозяину, содержащей транскрипционную экспрессионную кассету по настоящему изобретению или рекомбинантный экспрессионный вектор по настоящему изобретению.
В некоторых вариантах осуществления настоящего изобретения предложена рекомбинантная клетка-хозяин, которая относится к роду Corynebacterium, роду Brevibacterium, роду Arthrobacterium, роду Microbacterium или роду Escherichia; предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum или Escherichia coli; более предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum ATCC 13032, Corynebacterium glutamicum ATCC 13869, Corynebacterium glutamicum ATCC 14067 или производные штаммы Corynebacterium glutamicum.
Настоящее изобретение дополнительно относится к применению полинуклеотида, обладающего промоторной активностью, в соответствии с настоящим изобретением, транскрипционной экспрессионной кассеты в соответствии с настоящим изобретением, рекомбинантного экспрессионного вектора в соответствии с настоящим изобретением и рекомбинантной клетки-хозяина в соответствии с настоящим изобретением по меньшей мере в одном из следующих случаев:
а) повышение уровня транскрипции гена или получение реагента или набора для повышения уровня транскрипции гена;
b) получение белка или получение реагента или набора для получения белка;
c) получение целевого соединения или получение реагента или набора для получения целевого соединения.
В некоторых вариантах реализации настоящего изобретения предложено применение настоящего изобретения, где белок выбран из белка, регулирующего экспрессию гена, белка, связанного с синтезом целевого соединения, или белка, связанного с мембранным транспортом.
В некоторых вариантах реализации настоящего изобретения предложено применение настоящего изобретения, где целевое соединение содержит по меньшей мере одну из аминокислот, органических кислот;
необязательно, аминокислоты включают одну или комбинацию двух или более из следующего: пролин, гидроксипролин, лизин, глутаминовую кислоту, треонин, глицин, аланин, валин, лейцин, изолейцин, серин, цистеин, глутамин, метионин, аспарагиновую кислоту, аспарагин, аргинин, гистидин, фенилаланин, тирозин, триптофан, 5-аминолевулиновую кислоту или производные любой из вышеуказанных аминокислот;
необязательно, органические кислоты включают одну или комбинацию двух или более из следующего: лимонная кислота, янтарная кислота, молочная кислота, уксусная кислота, масляная кислота, пальмитиновая кислота, щавелевая кислота, щавелевоуксусная кислота, винная кислота, пропионовая кислота, гексеновая кислота, декановая кислота, каприловая кислота, валериановая кислота, яблочная кислота или производные любой из вышеуказанных органических кислот.
В настоящем изобретении дополнительно предложен способ конструирования промоторного мутанта, включающий следующие стадии:
стадия мутации: мутация полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1, с образованием мутированных нуклеотидов в одном или более положениях 105-126 последовательности, представленной в SEQ ID NO: 1;
стадия скрининга: скрининг мутанта полинуклеотида, обладающего улучшенной промоторной активностью, по сравнению с полинуклеотидом, имеющим последовательность, представленную в SEQ ID NO: 1, с получением промоторного мутанта.
В некоторых вариантах осуществления предложен способ конструирования по настоящему изобретению, где стадия мутации включает:
мутирование полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1, так что нуклеотиды в положениях 105-126 последовательности, представленной в SEQ ID NO: 1, мутированы в нуклеотидную последовательность, представленную ниже: NNNNNNNNNNNNNNNNNTANNNT; где N выбран из A, T, C или G;
предпочтительно, мутант промотора имеет в 0,4-13 раз или более улучшенную промоторную активность по сравнению с промоторной активностью полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1.
В настоящем изобретении дополнительно предложен способ регуляции транскрипции, включающий стадию функционального лигирования полинуклеотида, обладающего промоторной активностью, по настоящему изобретению в отношении целевой РНК или целевого гена. Необязательно, целевая РНК включает по меньшей мере одну из тРНК, рРНК, целевой ген включает по меньшей мере один из гена, кодирующего белок, связанный с синтезом целевого соединения, гена, кодирующего белок, регулирующий экспрессию гена, и гена, кодирующего белок, связанный с мембранным транспортом;
необязательно, целевой ген включает по меньшей мере один из следующих генов: ген пируваткарбоксилазы, ген фосфоенолпируваткарбоксилазы, ген γ-глутамилкиназы, ген глутаматполуальдегиддегидрогеназы, ген пирролин-5-карбоксилатредуктазы, ген белка переноса аминокислот, ген, связанный с системой ptsG, ген пируватдегидрогеназы, ген гомосериндегидрогеназы, ген декарбоксилазы щавелевоуксусной кислоты, ген репрессора глюконовой кислоты, ген глюкоздегидрогеназы, ген аспартаткиназы, ген аспартатполуальдегиддегидрогеназы, ген лиазы аспартата аммония, ген дигидродипиколинатсинтазы, ген редуктазы дигидропиридиновой кислоты, ген сукцинилдиаминопимелат-аминотрансферазы, ген тетрагидродипиколинат сукцинилазы, ген сукцинилдиаминопимелатдеацилазы, ген эпимеразы диаминопимелиновой кислоты, ген деацилазы диаминопимелиновой кислоты, ген глицеральдегид-3-фосфатдегидрогеназы, ген транскетолазы, ген диаминопимелатдегидрогеназы.
В настоящем изобретении дополнительно предложен способ получения белка, включающий стадию экспрессии белка с использованием транскрипционной экспрессионной кассеты по настоящему изобретению, рекомбинантного экспрессионного вектора по настоящему изобретению или рекомбинантной клетки-хозяина по настоящему изобретению; необязательно, белок представляет собой белок, связанный с синтезом целевого соединения, белок, связанный с мембранным транспортом, или белок, регулирующий экспрессию генов;
необязательно, способ дополнительно включает стадию выделения или очистки белка.
Настоящее изобретение дополнительно относится к способу получения целевого соединения, включающий стадию экспрессии белка, связанного с синтезом целевого соединения, белка, связанного с мембранным транспортом, или белка, регулирующего экспрессию гена, с использованием транскрипционной экспрессионной кассеты по настоящему изобретению, рекомбинантного экспрессионного вектора по настоящему изобретению или рекомбинантной клетки-хозяина по настоящему изобретению, и получения целевого соединения в присутствии белка, связанного с синтезом целевого соединения, или белка, регулирующего экспрессию гена;
необязательно, целевое соединение включает по меньшей мере одну из аминокислот, органических кислот;
необязательно, аминокислоты включают одну или комбинацию двух или более из следующего: лизин, глутаминовую кислоту, треонин, пролин, гидроксипролин, глицин, аланин, валин, лейцин, изолейцин, серин, цистеин, глутамин, метионин, аспарагиновую кислоту, аспарагин, аргинин, гистидин, фенилаланин, тирозин, триптофан, 5-аминолевулиновую кислоту или производные любой из вышеуказанных аминокислот;
необязательно, органические кислоты включают одну или комбинацию двух или более из следующего: лимонная кислота, янтарная кислота, молочная кислота, уксусная кислота, масляная кислота, пальмитиновая кислота, щавелевая кислота, щавелевоуксусная кислота, винная кислота, пропионовая кислота, гексеновая кислота, декановая кислота, каприловая кислота, валериановая кислота, яблочная кислота или производные любой из вышеуказанных органических кислот;
необязательно, белок, связанный с синтезом целевого соединения, представляет собой белок, связанный с синтезом L-аминокислоты; необязательно, белок, связанный с синтезом L-аминокислоты, включает один или комбинацию двух или более из: пируваткарбоксилазы, фосфоенолпируваткарбоксилазы, γ-глутамилкиназы, глутаматполуальдегиддегидрогеназы, пирролин-5-карбоксилатредуктазы, белок транспорта аминокислот, системы ptsG, пируватдегидрогеназы, гомосериндегидрогеназы, декарбоксилазы щавелевоуксусной кислоты, репрессора глюконовой кислоты, глюкоздегидрогеназы, аспартаткиназы, аспартатполуальдегиддегидрогеназы, лиазы аспартата аммония, дигидродипиколинатсинтазы, редуктазы дигидропиридиновой кислоты, сукцинилдиаминопимелат-аминотрансферазы, тетрагидродипиколинат сукцинилазы, сукцинилдиаминопимелатдеацилазы, эпимеразы диаминопимелиновой кислоты, деацилазы диаминопимелиновой кислоты, глицеральдегид-3-фосфатдегидрогеназы, транскетолазы, диаминопимелатдегидрогеназы.
необязательно, способ дополнительно включает стадию выделения или очистки целевого соединения.
Эффекты
В некоторых вариантах реализации полинуклеотид, обладающий промоторной активностью, согласно настоящему изобретению, представляет собой мутант промотора гена малатдегидрогеназы (гена mdh), и мутант обладает промоторной активностью, значительно улучшенной по сравнению с геном mdh дикого типа. Когда мутант функционально лигирован с целевым геном, эффективность экспрессии целевого гена может быть значительно улучшена, тем самым обеспечивая экспрессионный элемент, имеющий большой потенциал применения для модификации ключевого гена в пути синтеза целевого соединения. Применение мутанта для получения целевого соединения может значительно увеличить скорость превращения целевого соединения и обеспечивает сильный промотор с большим потенциалом применения для промышленной ферментации целевых соединений, таких как аминокислоты и органические кислоты.
В некоторых вариантах реализации полинуклеотид, обладающий промоторной активностью, согласно настоящему изобретению, обладает промоторной активностью в 0,4-13 раз или более улучшенной по сравнению с промоторной активностью промотора гена mdh дикого типа.
В некоторых вариантах осуществления настоящее изобретение относится к транскрипционной экспрессионной кассете, рекомбинантному экспрессионному вектору и рекомбинантной клетке-хозяину, которые содержат вышеупомянутый полинуклеотид, обладающий промоторной активностью. В транскрипционной экспрессионной кассете, рекомбинантном экспрессионном векторе и рекомбинантной клетке-хозяине полинуклеотид, обладающий промоторной активностью, функционально лигирован с целевым геном, и может быть реализована эффективная экспрессия ключевого гена в пути синтеза целевого соединения.
В некоторых вариантах осуществления настоящее изобретение относится к способу получения белка, способного повышать уровень экспрессии белка, связанного с синтезом аминокислот, органических кислот или белков, регулирующих экспрессию генов, тем самым обеспечивая эффективное получение целевого соединения.
В некоторых вариантах осуществления настоящее изобретение относится к способу получения целевого соединения, способного повышать эффективность экспрессии белка, связанного с синтезом целевого соединения, с использованием вышеупомянутого полинуклеотида, обладающего промоторной активностью, и тогда выход и скорость превращения целевого соединения могут быть эффективно улучшены, и может быть реализовано крупномасштабное промышленное производство целевого соединения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1 показан профиль плазмиды pEC-XK99E-Pmdh-rfp;
На фиг. 2 показан результат флуоресценции мутантных клонов, выращенных на культуральном планшете.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При использовании в комбинации с термином "содержащий" в формуле изобретения и/или описании, термины в единственном числе могут относиться к "одному" или относиться к "одному или более", "по меньшей мере одному" и "одному или более чем одному".
Как используется в формуле изобретения и описании, термин "содержать", "иметь/имеет", "включать" или "содержать" предназначен для включения или неограниченного использования и не исключает дополнительные или неуказанные элементы или стадии способа.
В настоящем документе термин "приблизительно" означает, что значение включает стандартное отклонение ошибки устройства или способа, используемого для измерения значения.
Применительно к содержанию, раскрытому в настоящем документе, термин "или" определяется только как альтернативы и "и/или", но термин "или", используемый в настоящем документе, относится к "и/или", если явно не указано иное, является просто альтернативой или взаимным исключением между альтернативами.
Выбранный/необязательный/предпочтительный "числовой диапазон" при использовании в формуле или описании изобретения включает не только числовые конечные точки на обоих концах диапазона, но и все натуральные числа, попадающие между предыдущими числовыми конечными точками в отношении этих числовых конечных точек.
В данном контексте термин "малатдегидрогеназа" катализирует обратимое превращение между яблочной кислотой и щавелевоуксусной кислотой и кодируется геном mdh. В некоторых вариантах осуществления ген mdh по настоящему изобретению получен из Corynebacterium glutamicum.
В данном контексте термин "фосфоенолпируваткарбоксилаза" (фосфоенолпируваткарбоксилаза) катализирует превращение фосфоенолпирувата (ФЕП) в щавелевоуксусную кислоту и кодируется геном ppc.
В данном контексте термин "пируваткарбоксилаза" катализирует обратимое карбоксилирование пировиноградной кислоты с образованием ацетилоксалата и кодируется геном pyc.
В контексте настоящего документа термин "полинуклеотид" относится к полимеру, состоящему из нуклеотидов. Полинуклеотид может быть в форме отдельного фрагмента или компонента более крупной структуры нуклеотидной последовательности, и он получен из нуклеотидной последовательности, разделенной по меньшей мере один раз по количеству или концентрации, и может быть распознан, обработан и восстановлен из последовательности и ее компонентных нуклеотидных последовательностей стандартными методами молекулярной биологии (такими как использование вектора клонирования). Когда нуклеотидная последовательность представлена последовательностью ДНК (т.е. A, T, G, C), она также включает последовательность РНК (т.е. A, U, G, C), где "U" заменяет "T". Другими словами, "полинуклеотид" относится к нуклеотидному полимеру, который был удален из других нуклеотидов (отдельного фрагмента или целого фрагмента), или может быть составной частью или компонентом более крупной нуклеотидной структуры, такой как экспрессионный вектор или полицистронная последовательность. Полинуклеотид включает последовательности ДНК, РНК и кДНК (комплементарная ДНК).
В контексте настоящего документа термин "дикий тип" относится к объекту, который встречается в природе. Например, полипептид или полинуклеотидная последовательность, присутствующие в организме, которые могут быть выделены из одного источника в природе и не были намеренно модифицированы человеком в лаборатории, являются встречающимися в природе. В данном контексте термины "встречающийся в природе" и "дикий тип" являются синонимами. В некоторых вариантах осуществления промотор дикого типа в настоящем изобретении относится к промотору гена mdh дикого типа, то есть полинуклеотиду, имеющему последовательность SEQ ID NO: 1.
В контексте настоящего документа термин "мутант" относится к полинуклеотиду или полипептиду, который по отношению к полинуклеотиду или полипептиду "дикого типа" или "сравнительному" полинуклеотиду или полипептиду содержит изменение (изменения) (т. е. замену, инсерцию и/или делецию полинуклеотида) в одном или более (например, нескольких) положениях, где замена относится к замене другим нуклеотидом нуклеотида, который занимает одно положение; делеция относится к удалению нуклеотида, который занимает определенное положение; и инсерция относится к добавлению нуклеотида после нуклеотида, прилегающего к и следующего сразу за занятым положением.
В некоторых вариантах осуществления "мутация" в настоящем изобретении представляет собой "замену", которая представляет собой мутацию, вызванную заменой одного основания в нуклеотиде другим основанием, которая также называется заменой основания или точечной мутацией.
В частности, последовательность, представленная в SEQ ID NO: 1, представляет собой последовательность промотора гена mdh, которая содержит ядровую область промотора, имеющую нуклеотидную последовательность "CGTCAAGATCACCCAAAACTGGTGGCTGTTCTCTTTTAAGCGGGATAGCATGGGTTCTTA", где подчеркнутая часть представляет собой последовательность области -10. Мутант по настоящему изобретению включает мутированные нуклеотиды в области -10 и 17 пар оснований (п.о.) перед областью -10, и обнаружено, что промоторная активность мутантов после введения мутаций в вышеуказанных положениях значительно усиливается, и получали серию новых сильных промоторов, обеспечивающих большое количество регуляторных элементов экспрессии для эффективного синтеза целевых соединений.
В некоторых вариантах осуществления данного изобретения указанный полинуклеотид, обладающий промоторной активностью, относится к мутанту полинуклеотида, содержащему последовательность, представленную в SEQ ID NO: 1, причем указанный мутант имеет мутированный нуклеотид(ы) в одном или большем количестве положений 105-126 последовательности, представленной в SEQ ID NO: 1, и не содержит полинуклеотид, мутирующий в TTCTCTTTTAAGCGGGATAGCA в положении 105-126 последовательности, представленной в SEQ ID NO: 1. Мутант обладает улучшенной промоторной активностью по сравнению с полинуклеотидом, содержащим последовательность SEQ ID NO: 1.
В некоторых вариантах осуществления данного изобретения мутант полинуклеотида, содержащего последовательность, представленную в SEQ ID NO: 1, имеет улучшенную промоторную активность в 0,4-13 раз или более по сравнению с промоторной активностью полинуклеотида, содержащего последовательность, представленную в SEQ ID NO: 1.
В некоторых более конкретных вариантах реализации изобретения мутант имеет в 0,4, 1,7, 1,8, 2,0, 2,1, 2,3, 2,4, 3,1, 3,2, 3,4, 3,6, 4,0, 4,3, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,6, 5,7, 5,9, 6,1, 6,2, 6,4, 6,5, 6,6, 6,7, 6,8, 7,1, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 8,2, 9,6, 13,0 раз улучшенную промоторную активность по сравнению с промоторной активностью полинуклеотида, содержащего последовательность SEQ ID NO: 1.
В данном контексте термин "промотор" относится к молекуле нуклеиновой кислоты, которая обычно расположена выше от кодирующей последовательности целевого гена, обеспечивая сайт распознавания РНК-полимеразы, и расположена выше в направлении 5'-сайта инициации транскрипции мРНК. Это нетранслируемая последовательность нуклеиновой кислоты, с которой связывается РНК-полимераза и которая инициирует транскрипцию целевого гена. В синтезе рибонуклеиновой кислоты (РНК) промотор может взаимодействовать с факторами транскрипции и регулировать транскрипцию гена и контролировать время инициации и степень экспрессии гена (транскрипция), и он содержит коровую область промотора и регуляторную область, функционирует как "переключатель", определяет активность гена, а затем контролирует, какой тип белка начинает продуцировать клетка.
В данном контексте термин "основная область промотора" относится к последовательности нуклеиновой кислоты, расположенной в промоторной области прокариот, и представляет собой область основной последовательности, которая играет роль промотора, в основном включающую область -35, область -10 и область между областью -35 и областью -10, и сайт инициации транскрипции, причем область -35 является сайтом распознавания РНК-полимеразы, а область -10 является сайтом связывания РНК-полимеразы. В некоторых вариантах осуществления данного изобретения полинуклеотид, обладающий промоторной активностью, по данному изобретению, представляет собой мутант, который содержит область ядра промотора гена mdh, и несет мутацию в области -10, и 17 п.о. перед областью -10 области ядра промотора, с тем чтобы получить промоторную активность, значительно улучшенную по сравнению с активностью промотора гена mdh.
В контексте настоящего документа термины "идентичность последовательностей" и "процент идентичности" относятся к проценту нуклеотидов или аминокислот, которые являются одинаковыми (т. е. идентичными) в двух или более полинуклеотидах или полипептидах. Идентичность последовательностей между двумя или более полинуклеотидами или полипептидами может быть определена путем выравнивания нуклеотидных или аминокислотных последовательностей полинуклеотидов или полипептидов и оценки количества положений, в которых нуклеотидные или аминокислотные остатки в выровненных полинуклеотидах или полипептидах идентичны, и сравнения количества этих положений с количеством положений, в которых нуклеотидные или аминокислотные остатки в выровненных полинуклеотидах или полипептидах отличаются. Полинуклеотиды могут быть различными в одном положении, например, путем содержания другого нуклеотида (т.е. замены или мутации) или делеции нуклеотида (т.е. вставки нуклеотида или делеции нуклеотида в одном или двух полинуклеотидах). Полипептиды могут быть различными в одном положении, например, путем содержания другой аминокислоты (т.е. замены или мутации) или делеции аминокислоты (т.е. вставки аминокислоты или делеции аминокислоты в одном или двух полипептидах). Идентичность последовательностей может быть рассчитана путем деления количества положений, в которых нуклеотидные или аминокислотные остатки идентичны, на общее количество нуклеотидных или аминокислотных остатков в полинуклеотидах или полипептидах. Например, процент идентичности можно рассчитать путем деления количества положений, в которых нуклеотидные или аминокислотные остатки идентичны, на общее количество нуклеотидных или аминокислотных остатков в полинуклеотиде или полипептиде и умножения результата на 100.
В некоторых вариантах осуществления две или более последовательностей или подпоследовательностей при сравнении и выравнивании при максимальном соответствии алгоритмом выравнивания последовательностей или путем визуального контроля обладают по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% "идентичностью последовательностей" или "процентом идентичности" нуклеотидов. В некоторых вариантах осуществления последовательность по существу идентична по всей длине одного или обоих сравниваемых биополимеров (например, полинуклеотидов).
В контексте настоящего документа термин "комплементарный" относится к гибридизации или спариванию оснований между нуклеотидами и нуклеотидами, например, между двумя цепями двухцепочечной молекулы ДНК или между олигонуклеотидным праймером и сайтом связывания праймера на одноцепочечном нуклеотиде, подлежащем секвенированию или амплификации.
В контексте настоящего документа термин "жесткие условия" означает, что после стандартных процедур блоттинга ДНК зонд длиной по меньшей мере 100 нуклеотидов предварительно гибридизуется или гибридизуется в течение 12-24 часов при 42 °C в 5× SSPE (солевой фосфат натрия-ЭДТА), 0,3% SDS (додецилсульфат натрия), 200 мкг/мл расщепленной и денатурированной ДНК сперматозоида лосося и 50% формамида. Наконец, материал вектора промывали три раза при 65 °С с 2× SSC и 0,2% SDS, каждый раз в течение 15 мин.
В контексте настоящего документа термин "очень жесткие условия" означает, что после стандартных процедур блоттинга ДНК зонд длиной по меньшей мере 100 нуклеотидов предварительно гибридизуется или гибридизуется в течение 12-24 часов при 42 C в 5× SSPE (солевой фосфат натрия-ЭДТА), 0,3% SDS (додецилсульфат натрия), 200 мкг/мл расщепленной и денатурированной ДНК сперматозоида лосося и 50% формамида. Наконец, материал вектора промывали три раза при 70 °С с 2× SSC и 0,2% SDS, каждый раз в течение 15 мин.
В некоторых других вариантах осуществления полинуклеотид, обладающий промоторной активностью, по настоящему изобретению, может быть использован для инициирования экспрессии генов, кодирующих белок. В некоторых других вариантах осуществления полинуклеотид, обладающий промоторной активностью, по настоящему изобретению, может быть использован для инициирования экспрессии некодирующих генов.
В данном контексте термин "экспрессия" включает любую стадию, включающую продукцию РНК и продукцию белка, включая, но не ограничиваясь этим, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
В данном контексте термин "транскрипционная экспрессионная кассета" относится к рекомбинантному экспрессионному элементу, содержащему полинуклеотид, обладающий промоторной активностью. В некоторых вариантах реализации изобретения регуляторный элемент транскрипции, который регулирует целевой ген, может содержать такие элементы, как энхансер, сайленсер, инсулятор в дополнение к полинуклеотиду, обладающему промоторной активностью. В некоторых вариантах осуществления целевой ген по настоящему изобретению представляет собой, в частности, ген, кодирующий белок. "Функциональное лигирование" целевого гена с полинуклеотидом, обладающим промоторной активностью, означает, что полинуклеотид, обладающий промоторной активностью, функционально лигирован с целевым геном для инициирования и опосредования транскрипции целевого гена, и функциональное лигирование может быть любым из способов, описанных специалистами в данной области техники.
В данном контексте термин "вектор" относится к конструкции ДНК, содержащей последовательность ДНК, функционально лигированную с подходящими регуляторными последовательностями, чтобы экспрессировать целевой ген в подходящем хозяине. "Рекомбинантный экспрессионный вектор" относится к структуре ДНК, используемой для экспрессии, например, полинуклеотида, кодирующего желаемый полипептид. Рекомбинантный экспрессионный вектор может включать, например, i) набор генетических элементов, которые имеют регуляторные функции экспрессии генов, такие как промоторы и энхансеры; ii) структуру или кодирующую последовательность, транскрибируемую в мРНК и транслируемую в белок; и iii) субъединицы транскрипции, которые соответствующим образом транскрибировали и транслировали начальную и стоп-последовательности. Рекомбинантный экспрессионный вектор сконструирован любым подходящим способом. Природа вектора не является существенной, и может быть использован любой вектор, включая плазмиды, вирусы, фаги и транспозоны. Возможные векторы для применения в настоящем изобретении включают, но не ограничиваются ими, хромосомные, нехромосомные и синтетические последовательности ДНК, такие как бактериальные плазмиды, фаговая ДНК, дрожжевые плазмиды и векторы, полученные из комбинаций плазмид и фаговой ДНК, и ДНК из вирусов, таких как вирус осповакцины, аденовирус, вирус оспы птиц, бакуловирус, SV40 и вирус псевдобешенства и т. д. В настоящем изобретении "рекомбинантный экспрессионный вектор" и "рекомбинантный вектор" могут быть использованы взаимозаменяемо.
В данном контексте термин "целевая РНК" включает функциональные РНК, которые играют определенную роль в таких процессах, как генетическое кодирование, трансляция, регуляция, экспрессия генов и т. д. В настоящем изобретении целевая РНК, лигированная с полинуклеотидом, обладающим промоторной активностью, может представлять собой любую функциональную РНК в данной области техники.
В некоторых вариантах осуществления данного изобретения целевая РНК представляет собой тРНК или рРНК. В некоторых других вариантах осуществления целевая РНК также может представлять собой другие типы РНК, такие как одиночная направляющая РНК, крРНК, трансактивирующая CRISPR РНК, микроРНК, миРНК и т. д.
В данном контексте термин "целевой ген" относится к любому из генов, которые лигированы с полинуклеотидом, обладающим промоторной активностью, по настоящему изобретению, для регулирования его уровня транскрипции.
В некоторых вариантах осуществления целевой ген представляет собой ген, кодирующий белок, связанный с синтезом целевого соединения. В некоторых вариантах осуществления целевой ген представляет собой ген, кодирующий белок, регулирующий экспрессию гена. В некоторых вариантах осуществления целевой ген представляет собой ген, кодирующий белок, связанный с мембранным транспортом.
Например, целевой ген представляет собой кодирующий ген, кодирующий фермент, связанный с биосинтезом целевого соединения, ген, кодирующий фермент, связанный с восстанавливающей способностью, ген, кодирующий фермент, связанный с гликолизом или циклом Кребса, или ген, кодирующий фермент, связанный с высвобождением целевого соединения, и т. д.
Например, целевой ген включает по меньшей мере один из следующих генов: ген пируваткарбоксилазы, ген фосфоенолпируваткарбоксилазы, ген γ-глутамилкиназы, ген глутаматполуальдегиддегидрогеназы, ген пирролин-5-карбоксилатредуктазы, ген белка переноса аминокислот, ген, связанный с системой ptsG, ген пируватдегидрогеназы, ген гомосериндегидрогеназы, ген декарбоксилазы щавелевоуксусной кислоты, ген репрессора глюконовой кислоты, ген глюкоздегидрогеназы, ген аспартаткиназы, ген аспартатполуальдегиддегидрогеназы, ген лиазы аспартата аммония, ген дигидродипиколинатсинтазы, ген редуктазы дигидропиридиновой кислоты, ген сукцинилдиаминопимелат-аминотрансферазы, ген тетрагидродипиколинат сукцинилазы, ген сукцинилдиаминопимелатдеацилазы, ген эпимеразы диаминопимелиновой кислоты, ген деацилазы диаминопимелиновой кислоты, ген глицеральдегид-3-фосфатдегидрогеназы, ген транскетолазы, ген диаминопимелатдегидрогеназы, ген глицеральдегид-3-фосфатдегидрогеназы.
В данном контексте термин "целевое соединение" может быть выбран из аминокислот, органических кислот, а также может быть выбран из других типов соединений, которые могут быть получены путем биосинтеза в данной области техники.
В некоторых вариантах реализации целевое соединение представляет собой "аминокислоту" или "L-аминокислоту". "Аминокислота" или "L-аминокислота" обычно относится к основной составляющей единице белка, в которой амино и карбоксильная группа связаны с одним и тем же атомом углерода. В качестве примера, аминокислота выбрана из одного или более из следующего: глицин, аланин, валин, лейцин, изолейцин, треонин, серин, цистеин, глутамин, метионин, аспарагиновая кислота, аспарагин, глутаминовая кислота, лизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, пролин, гидроксипролин, 5-аминолевулиновая кислота или производные любой из вышеуказанных аминокислот. Кроме того, аминокислота также может представлять собой другие типы аминокислот в данной области техники.
В некоторых вариантах реализации целевое соединение представляет собой органическую кислоту. Органическая кислота может представлять собой кислотное органическое соединение, например, те соединения, которые содержат карбоксильную группу и группу сульфоновой кислоты. В качестве примера, органическая кислота включает одно или более из следующего: молочную кислоту, уксусную кислоту, янтарную кислоту, масляную кислоту, пальмитиновую кислоту, щавелевую кислоту, щавелевоуксусную кислоту, винную кислоту, лимонную кислоту, пропионовую кислоту, гексеновую кислоту, декановую кислоту, каприловую кислоту, валериановую кислоту, яблочную кислоту или производные любой из вышеуказанных органических кислот. Кроме того, органическая кислота также может представлять собой любые другие типы органических кислот в данной области техники.
Термин "ген, кодирующий белок" в настоящем изобретении относится к молекуле ДНК, способной направлять синтез белка по определенным правилам, и способ, посредством которого ген, кодирующий белок, направляет синтез белка, как правило, включает процесс транскрипции с использованием двухцепочечной ДНК в качестве матрицы и трансляцию с использованием мРНК в качестве матрицы. Кодирующий белок ген содержит последовательность CDS (кодирующая последовательность), направляющую продукцию мРНК, кодирующей белок.
В качестве примера, ген, кодирующий белок, включает, но не ограничивается ими, гены, кодирующие белки, связанные с синтезом целевого соединения, и в некоторых вариантах осуществления данного изобретения ген, кодирующий белок, относится к генам, кодирующим белки, связанные с синтезом L-аминокислоты. В качестве примера, белки, относящиеся к синтезу L-аминокислоты, включают, но не ограничиваются ими, одну или комбинацию двух или более из: пируваткарбоксилазы, фосфоенолпируваткарбоксилазы, γ-глутамилкиназы, глутаматполуальдегиддегидрогеназы, пирролин-5-карбоксилатредуктазы, белка транспорта аминокислот, системы ptsG, пируватдегидрогеназы, гомосериндегидрогеназы, декарбоксилазы щавелевой кислоты, белка-репрессора глюконовой кислоты, глюкозодегидрогеназы. В некоторых вариантах реализации белок, связанный с синтезом L-аминокислоты, представляет собой белок, связанный с синтезом L-лизина, включая одну или комбинацию двух или более из: аспартаткиназы, аспартатполуальдегиддегидрогеназы, аспартатаммиклиазы, дигидродипиколинатсинтазы, редуктазы дигидропиридиновой кислоты, сукцинилдиаминопимелатаминотрансферазы, тетрагидродипиколинатсукцинилазы, сукцинилдиаминопимелатдеацилазы, эпимеразы диаминопимелиновой кислоты, деацилазы диаминопимелиновой кислоты, глицеральдегид-3-фосфатдегидрогеназы, белка, транспортирующего лизин, транскетолазы, диаминопимелатдегидрогеназы и пируваткарбоксилазы.
В некоторых вариантах осуществления данного изобретения ген, кодирующий белок, относится к гену, кодирующему белок, который связан с синтезом органических кислот. Например, ген, кодирующий белок, используется для кодирования белка, связанного с синтезом щавелеуксусной кислоты, белка, связанного с синтезом лимонной кислоты, или используется для кодирования белка, связанного с синтезом янтарной кислоты.
В некоторых вариантах осуществления данного изобретения ген, кодирующий белок, относится к гену, кодирующему родственный фермент, который способствует синтезу щавелеуксусной кислоты. Например, ген, кодирующий белок, представляет собой ген ppc, кодирующий ген фосфоенолпируваткарбоксилазы. Как сообщается в существующей литературе[1], экспрессия родственного фермента, способствующего синтезу щавелеуксусной кислоты, может увеличить выход 5-аминолевулиновой кислоты.
В настоящем изобретении термин "клетка-хозяин" относится к любому типу клеток, которые легко трансформируются, трансфицируются, трансдуцируются и т.д., с элементом инициации транскрипции или экспрессионным вектором, содержащим полинуклеотид по настоящему изобретению. Термин "рекомбинантная клетка-хозяин" охватывает клетку-хозяина, которая отличается от родительской клетки после введения элемента инициации транскрипции или рекомбинантного экспрессионного вектора, и рекомбинантная клетка-хозяин специфически реализуется путем трансформации.
В настоящем описании термин "трансформация" имеет значение, в целом понятное специалистам в данной области техники, то есть способ введения экзогенной ДНК в хозяина. Способ трансформации включает любой способ введения нуклеиновой кислоты в клетку, включая, но не ограничиваясь этим, электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, способ с применением полиэтиленгликоля (PEG), способ с применением DEAE-декстрана (DEAE - диэтиламиноэтил), катионный липосомный метод и метод DMSO-ацетата лития (DMSO - диметилсульфоксид).
Клетка-хозяин по настоящему изобретению может представлять собой прокариотическую клетку или эукариотическую клетку, если она представляет собой клетку, в которую может быть введен полинуклеотид, обладающий промоторной активностью, по настоящему изобретению. В одном варианте осуществления клетка-хозяин относится к прокариотической клетке. В частности, клетка-хозяин получена из микроорганизма, подходящего для получения аминокислот, органических кислот путем ферментации, такого как род Corynebacterium, род Brevibacterium, род Arthrobacterium, род Microbacterium или род Escherichia. Предпочтительно клетка-хозяин представляет собой Corynebacterium glutamicum из рода Corynebacterium. В том числе Corynebacterium glutamicum может представлять собой Corynebacterium glutamicum ATCC 13032, Corynebacterium glutamicum ATCC 13869 или Corynebacterium glutamicum ATCC 14067 и мутантный штамм, продуцирующий аминокислоты, особенно лизин, или производный штамм Corynebacterium glutamicum, полученный из вышеуказанных штаммов. В некоторых вариантах осуществления клетка-хозяин по настоящему изобретению может представлять собой штаммы любого типа, способные продуцировать аминокислоты, включая штаммы дикого типа и рекомбинантные штаммы.
В качестве примера, клетка-хозяин представляет собой клетку-хозяина, продуцирующую лизин. В некоторых вариантах осуществления клетка-хозяин, продуцирующая лизин, может представлять собой штамм, экспрессирующий аспартаткиназу, которая ослабляет ингибирование по типу обратной связи, на основе Corynebacterium glutamicum ATCC 13032. Кроме того, клетка-хозяин, продуцирующая лизин, также может представлять собой другие типы штаммов, которые способны продуцировать лизин.
В некоторых вариантах осуществления данного изобретения клетка-хозяин, продуцирующая лизин, может также включать, но не ограничивается ими, один или большее количество генов, выбранных из следующих, экспрессия которых ослаблена или снижена:
a. ген adhE, кодирующий этанолдегидрогеназу;
b. ген ackA, кодирующий ацетаткиназу;
c. ген pta, кодирующий фосфат ацетилтрансферазу;
d. ген ldhA, кодирующий лактатдегидрогеназу;
e. ген focA, кодирующий транспортер формиата;
f. ген pflB, кодирующий пируватформиатлиазу;
g. ген poxB, кодирующий пируватоксидазу;
h. ген thrA, кодирующий бифункциональный фермент аспартаткиназы I/гомосериндегидрогеназы I;
i. ген thrB, кодирующий гомосеринкиназу;
j. ген ldcC, кодирующий лизиндекарбоксилазу; и
h. ген cadA, кодирующий лизиндекарбоксилазу.
В некоторых вариантах осуществления клетка-хозяин, продуцирующая лизин, может дополнительно включать, не ограничиваясь перечисленным, один или более генов, выбранных из одного или более из следующих, которые характеризуются повышенной экспрессией или сверх экспрессией:
a. ген dapA, кодирующий дигидродипиридинсинтазу, которая ослабляет ингибирование по типу обратной связи лизином;
b. ген dapB, кодирующий дигидродипиколинатредуктазу;
c. ген ddh, кодирующий диаминопимелатдегидрогеназу;
d. dapD, кодирующий тетрагидродипиколинатсукцинилазу, и dapE, кодирующий сукцинилдиаминопимелатдеацилазу
e. ген asd, кодирующий аспартатполуальдегиддегидрогеназу;
f. ген ppc, кодирующий фосфоенолпируваткарбоксилазу;
g. ген pntAB, кодирующий никотинамидадениндинуклеотидтрансгидрогеназу;
i. ген lysE, кодирующий белок, транспортирующий лизин.
В качестве примера, клетка-хозяин представляет собой клетку-хозяина, продуцирующую треонин. В некоторых вариантах осуществления данного изобретения клетка-хозяин, продуцирующая треонин, представляет собой штамм, экспрессирующий ген аспартаткиназы LysC, который ослабляет ингибирование по типу обратной связи на, основе Corynebacterium glutamicum ATCC 13032. В некоторых других вариантах осуществления изобретения клетка-хозяин, продуцирующая треонин, также может представлять собой другие типы штаммов, способные продуцировать треонин.
В некоторых вариантах осуществления клетка-хозяин, продуцирующая треонин, содержит один или более генов, выбранных из следующих, которые характеризуются повышенной экспрессией или сверх экспрессией:
a. ген thrABC, кодирующий треониновый оперон;
b. ген hom, кодирующий гомосериндегидрогеназу, который ослабляет ингибирование по типу обратной связи;
c. ген gap, кодирующий глицеральдегид-3-фосфатдегидрогеназу;
d. ген pyc, кодирующий пируваткарбоксилазу;
e. ген mqo, кодирующий малат:хиноноксидоредуктазу;
f. ген tkt, кодирующий транскетолазу;
g. ген gnd, кодирующий 6-фосфоглюконатдегидрогеназу;
h. ген thrE, кодирующий экспортер треонина;
i. ген eno, кодирующий энолазу
В качестве примера, клетка-хозяин представляет собой клетку-хозяина, продуцирующую изолейцин. В некоторых вариантах осуществления данного изобретения клетка-хозяин, продуцирующая изолейцин, представляет собой штамм, который продуцирует L-изолейцин путем замены аланина на указаннную аминокислоту в положении 323 гена ilvA L-треониндегидратазы. В некоторых других вариантах осуществления клетка-хозяин, продуцирующая изолейцин, также может представлять собой другие типы штаммов, способных продуцировать изолейцин.
В качестве примера, клетка-хозяин представляет собой клетку-хозяина, продуцирующую O-ацетилгомосерин. В некоторых вариантах осуществления клетка-хозяин, продуцирующая O-ацетилгомосерин, представляет собой штамм, который продуцирует O-ацетилгомосерин путем инактивации O-ацетилгомосерин(тиол)-лиазы. В некоторых других вариантах осуществления клетка-хозяин, продуцирующая O-ацетилгомосерин, также может представлять собой другие типы штаммов, обладающих способностью продуцировать O-ацетилгомосерин.
В качестве примера, клетка-хозяин представляет собой клетку-хозяина, продуцирующую метионин. В некоторых вариантах осуществления данного изобретения продуцирующая метионин клетка-хозяин представляет собой штамм, который продуцирует метионин путем инактивации регуляторов транскрипции метионина и цистеина. В некоторых других вариантах осуществления продуцирующие метионин клетки-хозяева могут также представлять собой другие типы штаммов, обладающих способностью продуцировать метионин.
В настоящем изобретении культивирование клетки-хозяина может быть осуществлено в соответствии с общепринятыми способами в данной области техники, включая, но не ограничиваясь этим, культивирование на планшете, культивирование со встряхиванием, периодическое культивирование, непрерывное культивирование и культивирование с подпиткой и т.д., и различные условия культивирования, такие как температура, время и значение рН культуральной среды, могут быть соответствующим образом скорректированы в соответствии с фактическими ситуациями.
Если не указано иное, все технические и научные термины в настоящем описании имеют те же значения, которые обычно понимаются специалистами в данной области техники, к которой относится настоящее изобретение.
Мутант основной области промотора гена mdh
В настоящем изобретении используется последовательность основной области промотора гена mdh и вводится мутация в области -10 и 17 п.о. перед областью -10 промотора гена mdh для получения мутанта основной области промотора гена mdh, который содержит мутированную область -10.
Для полинуклеотида, обладающего промоторной активностью, по настоящему изобретению, путем мутации основной области промотора гена mdh, в частности, путем введения мутаций в (TTCTCTTTTAAGCGGGATAGCA) вблизи области -10 основной области промотора гена mdh, мутанты по настоящему изобретению значительно улучшили промоторную активность по сравнению с промотором дикого типа, который содержит основную область промотора гена mdh, и представляют собой серию новых сильных промоторов; мутанты при применении к ферментации целевого соединения демонстрируют более высокие скорость превращения и выход целевого соединения по сравнению с промотором дикого типа.
В некоторых вариантах осуществления полинуклеотид, обладающий промоторной активностью, по настоящему изобретению, имеет мутированные нуклеотиды в 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 положениях в положениях 105-126 последовательности, представленной в SEQ ID NO: 1, и обладает улучшенной промоторной активностью по сравнению с промотором гена mdh дикого типа, имеющим последовательность, представленную в SEQ ID NO: 1.
В некоторых вариантах осуществления полинуклеотид, обладающий промоторной активностью, по настоящему изобретению, дополнительно включает полинуклеотид, который обратно комплементарен нуклеотидной последовательности мутанта промотора гена mdh, представленной в SEQ ID NO: 1. Кроме того, полинуклеотид обладает улучшенной промоторной активностью по сравнению с промотором гена mdh дикого типа, имеющим последовательность, представленную в SEQ ID NO: 1.
В некоторых вариантах осуществления полинуклеотид, обладающий промоторной активностью, по настоящему изобретению, дополнительно включает полинуклеотид, обратно комплементарен последовательности, которая гибридизуется с нуклеотидной последовательностью мутанта промотора гена mdh, представленной в SEQ ID NO: 1, в условиях высокой жесткости гибридизации или в условиях очень высокой жесткости гибридизации. Кроме того, полинуклеотид имеет нуклеотидную последовательность, которая не является TTCTCTTTTAAGCGGGATAGCA в положениях 105-126 последовательности, представленной в SEQ ID NO: 1; и полинуклеотид обладает улучшенной промоторной активностью по сравнению с промотором гена mdh дикого типа, имеющим последовательность, представленную в SEQ ID NO: 1.
В некоторых вариантах осуществления полинуклеотид, обладающий промоторной активностью, по настоящему изобретению, по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% (включая все диапазоны и проценты между числами) идентичен последовательности вышеупомянутого полинуклеотида. Кроме того, полинуклеотид имеет нуклеотидную последовательность, которая не является TTCTCTTTTAAGCGGGATAGCA в положениях 105-126 последовательности, представленной в SEQ ID NO: 1; и полинуклеотид обладает улучшенной промоторной активностью по сравнению с промотором гена mdh дикого типа, имеющим последовательность, представленную в SEQ ID NO: 1.
В некоторых конкретных вариантах осуществления нуклеотидная последовательность мутанта, соответствующая положениям 105-126 последовательности, представленной в SEQ ID NO: 1, выбрана из любой из группы, состоящей из (Pmdh-1) - (Pmdh-49):
(Pmdh-1) CAGGTAACAACTGCGAGTACGG;
(Pmdh-2) AGTCTGAGGGATATAATTAAGA;
(Pmdh-3) GGTCGTGGAGGACAAGTTAAGA;
(Pmdh-4) CTACTACCATCGGGTGCTAAGG;
(Pmdh-5) GATAGGTAGGCGTTAAGTAAAC;
(Pmdh-6) GGCAATTCGCGGGGAGGTAGAC;
(Pmdh-7) TATTGGGCGCGGCATTATAGGA;
(Pmdh-8) GGGAACTGCTTTGGTAGTATCA;
(Pmdh-9) GTTCAGGTTTGGGCCGCTATGC;
(Pmdh-10) TGATCGGGGCGCTTTGGTACGG;
(Pmdh-11) TATGAAATAAATTGGAGTAGGC;
(Pmdh-12) AACGGTATCTTTCTCCATATAA;
(Pmdh-13) AACGGAGCGTGTACGACTAGAA;
(Pmdh-14) TGCGCGGGTAAACGCTGTAGAG;
(Pmdh-15) TTGATGTCGTAGCGTAGTATTA;
(Pmdh-16) AGCTCGGACTTTGGTGGTAGGC;
(Pmdh-17) CCGGCGCATTATAACGCTACAA;
(Pmdh-18) CGGGGGTGTAAGTCGAGTAGAC;
(Pmdh-19) ACGGGTAGGTATTTCGCTAGGA;
(Pmdh-20) TAGTGTATGCTTTTACATAGAC;
(Pmdh-21) AGGCAGCATGTACATGATATCG;
(Pmdh-22) TTGAGCGGAGTTAATAGTACAC;
(Pmdh-23) ATACACACAACTTTCGATACTA;
(Pmdh-24) ATTCCAACCTTATGTTATACTG;
(Pmdh-25) GAGGTAGTCGTTTGGGGTAGGA;
(Pmdh-26) ATTGCTCGCGTAAATGGTAAAC;
(Pmdh-27) TGTTATTATGGGAGATGTAAGT;
(Pmdh-28) GAAAAATGTACGTGTGTTAAAA;
(Pmdh-29) AGTCCTCAGTGGAGTGGTAACA;
(Pmdh-30) TTTCCGGTGTTTTCGCGTAGAG;
(Pmdh-31) GGCGTCGGTAGGTATGTTATTG;
(Pmdh-32) ACGGCGATCAGAGTGTGTAAGA;
(Pmdh-33) CCGTGCGTGATATGGGGTAGTG;
(Pmdh-34) GGGTTGTGAGTTATCGGTATAA;
(Pmdh-35) TGCTCCGATGATGGTGGTAAGA;
(Pmdh-36) GTTCTCACGGGTCCGTGTATGA;
(Pmdh-37) TTTCGGAATGGATGGTGTACGC;
(Pmdh-38) ATTATGTCTTCTTTTGGTAAAA;
(Pmdh-39) GATCATAGGTTCTGTGGTAGAT;
(Pmdh-40) CATGGCCGATCATGATGTAATA;
(Pmdh-41) TAGTGGCGGTGTACGTGTATGA;
(Pmdh-42) ATTTGTTACAGGTATGGTAGTT;
(Pmdh-43) ACGGAACTTATTTCTGGTAACG;
(Pmdh-44) ACCGGGAGGACTAATGGTATGG;
(Pmdh-45) GCCACCCCTTTTTCTGCTATTA;
(Pmdh-46) TTGCGCCGGAGTTGCGGTATAG;
(Pmdh-47) GTTTACGGGTGTTCATGTAGTA;
(Pmdh-48) TTTGTCTCGTATCTGTGTAAGA;
(Pmdh-49) ATTTTGGGCACTTAGTGTATTG.
В некоторых конкретных вариантах осуществления нуклеотидная последовательность мутанта выбрана из последовательности, представленной в любой из SEQ ID NO: 3-51.
В некоторых вариантах реализации изобретения полинуклеотид, обладающий промоторной активностью, по настоящему изобретению, имеет в 0,4-13 раз или более улучшенную промоторную активность по сравнению с промоторной активностью полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1, и также имеет 0,4, 1,7, 1,8, 2,0, 2,1, 2,3, 2,4, 3,1, 3,2, 3,4, 3,6, 4,0, 4,3, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,6, 5,7, 5,9, 6,1, 6,2, 6,4, 6,5, 6,6, 6,7, 6,8, 7,1, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 8,2, 9,6, 13,0 раз повышенную промоторную активность по сравнению с промоторной активностью полинуклеотида, содержащего последовательность SEQ ID NO: 1.
Рекомбинантный экспрессионный вектор и рекомбинантная клетка-хозяин
В некоторых вариантах осуществления амплификацию проводят по настоящему изобретению с использованием генома ATCC13032 (Corynebacterium glutamicum ATCC 13032, Gene ID: 2830649) в качестве матрицы и mdh-1 и mdh-2 в качестве праймеров для получения фрагмента ДНК промотора гена mdh; фрагмент N-конца 180 п.о. амплифицировали с использованием gapN180-1 и gapN180-2 в качестве праймеров и синтетического N-конца 180 п.о. гена gapN, полученного из Streptococcus mutans в качестве матрицы; плазмидный скелет pEC-XK99E амплифицировали с использованием плазмиды PEC-XK99E-rfp в качестве матрицы и pEC-1 и pEC-2 в качестве праймеров; фрагменты ДНК гена красного флуоресцентного белка, содержащего линкерный пептид, амплифицировали с использованием RFP-1/2 в качестве праймеров и плазмиды PEC-XK99E-rfp в качестве матрицы. Указанный промоторный фрагмент гена mdh, N-концевой фрагмент гена gapN размером 180 п.н., фрагменты ДНК гена красного флуоресцентного белка, содержащего линкерный пептид, и плазмидный скелет pEC-XK99E рекомбинантно лигировали с получением рекомбинантного экспрессионного вектора pEC-XK99E-Pmdh-rfp.
В некоторых вариантах осуществления с использованием pEC-XK99E-Pmdh-rfp в качестве матрицы фрагмент, содержащий область мутации, амплифицировали с использованием праймера mdh-N1 и праймера TK-1, фрагмент скелета плазмиды амплифицировали с использованием праймера mdh-N2 и праймера TK-2 по настоящему изобретению, и вышеупомянутые два вида фрагментов рекомбинантно лигировали с получением библиотеки мутантов промотора гена mdh.
В некоторых вариантах реализации изобретения Corynebacterium glutamicum ATCC13032 трансформировали с использованием плазмиды библиотеки мутантов промотора гена mdh и pEC-XK99E-Pmdh-rfp, соответственно, с получением рекомбинантной клетки-хозяина по настоящему изобретению. Мутанты, имеющие повышенную интенсивность флуоресценции, подвергали скринингу после культивирования на планшете с получением мутантов промотора гена mdh, имеющих улучшенную промоторную активность.
В некоторых вариантах осуществления амплификацию проводят с использованием плазмиды библиотеки мутантов промотора гена mdh в качестве матрицы и mdh-P1, mdh-P2 в качестве праймеров для получения фрагментов соответствующих мутантов промотора гена mdh по настоящему изобретению; фрагменты гена ppc амплифицировали с использованием генома Corynebacterium glutamicum ATCC 13032 в качестве матрицы и ppc-1/ppc-2 в качестве праймеров; скелет плазмиды амплифицировали с использованием плазмиды pEC-XK99E в качестве матрицы и PEC-1/PEC-2 в качестве праймеров. Соответствующие фрагменты мутантного промотора рекомбинантно лигировали с фрагментами гена ppc и плазмидным скелетом с получением плазмид мутантного промотора гена mdh.
В некоторых конкретных вариантах реализации изобретения плазмиды мутантного промотора гена mdh включают любую из следующих: pEC-Pmdh-1-ppc, pEC-Pmdh-2-ppc, pEC-Pmdh-3-ppc, pEC-Pmdh-4-ppc, pEC-Pmdh-5-ppc, pEC-Pmdh-6-ppc, pEC-Pmdh-7-ppc, pEC-Pmdh-8-ppc, pEC-Pmdh-9-ppc, pEC-Pmdh-10-ppc, pEC-Pmdh-11-ppc, pEC-Pmdh-12-ppc, pEC-Pmdh-13-ppc, pEC-Pmdh-14-ppc, pEC-Pmdh-15-ppc, pEC-Pmdh-16-ppc, pEC-Pmdh-17-ppc, pEC-Pmdh-18-ppc, pEC-Pmdh-19-ppc, pEC-Pmdh-20-ppc, pEC-Pmdh-21-ppc, pEC-Pmdh-22-ppc, pEC-Pmdh-23-ppc, pEC-Pmdh-24-ppc, pEC-Pmdh-25-ppc, pEC-Pmdh-26-ppc, pEC-Pmdh-27-ppc, pEC-Pmdh-28-ppc, pEC-Pmdh-29-ppc, pEC-Pmdh-30-ppc, pEC-Pmdh-31-ppc, pEC-Pmdh-32-ppc, pEC-Pmdh-33-ppc, pEC-Pmdh-34-ppc, pEC-Pmdh-35-ppc, pEC-Pmdh-36-ppc, pEC-Pmdh-37-ppc, pEC-Pmdh-38-ppc, pEC-Pmdh-39-ppc, pEC-Pmdh-40-ppc, pEC-Pmdh-41-ppc, pEC-Pmdh-42-ppc, pEC-Pmdh-43-ppc, pEC-Pmdh-44-ppc, pEC-Pmdh-45-ppc, pEC-Pmdh-46-ppc, pEC-Pmdh-47-ppc, pEC-Pmdh-48-ppc, pEC-Pmdh-49-ppc.
В некоторых других вариантах осуществления требуемый рекомбинантный вектор также может быть сконструирован в настоящем изобретении с использованием мутанта промотора, как указано в любом из (Pmdh-1) - (Pmdh-49), в соответствии с конкретными потребностями в клонировании.
В некоторых вариантах осуществления данного изобретения штамм Corynebacterium glutamicum SCgL30 по данному изобретению, треонин в положении 311 аспартаткиназы (кодируемой геном lysC) в геноме Corynebacterium glutamicum ATCC 13032 мутирован в изолейцин для конструирования штамма SCgL30, который обладает определенной способностью к синтезу лизина.
В некоторых конкретных вариантах осуществления рекомбинантный экспрессионный вектор, представленный в любом из pEC-Pmdh-1-ppc - pEC-Pmdh-49-ppc, трансформируют в штамм SCgL30 с получением рекомбинантной клетки-хозяина по настоящему изобретению, и, например, рекомбинантный экспрессионный вектор, представленный в pEC-Pmdh-39-ppc, трансформируют в штамм SCgL30 с получением рекомбинантной клетки-хозяина по настоящему изобретению. В некоторых других конкретных вариантах осуществления рекомбинантный вектор, содержащий промоторный мутант, как указано в любом из (Pmdh-1) - (Pmdh-49), также может быть трансформирован в штамм SCgL30 с получением рекомбинантной клетки-хозяина по настоящему изобретению.
Способ получения целевого соединения
(1) Полинуклеотид, обладающий промоторной активностью, функционально лигировали с геном, кодирующим белок, связанный с синтезом целевого соединения, или с геном, кодирующим белок, регулирующий экспрессию гена, с получением рекомбинантного экспрессионного вектора белка, связанного с синтезом целевого соединения или белка, регулирующего экспрессию гена, и рекомбинантный экспрессионный вектор использовали для трансформации клетки-хозяина с получением рекомбинантной клетки-хозяина.
(2) Рекомбинантную клетку-хозяина подвергали ферментационной культуре, и целевое соединение собирали из рекомбинантной клетки-хозяина или культурального бульона рекомбинантной клетки-хозяина для завершения способа получения целевого соединения.
В вышеуказанном способе получения, поскольку полинуклеотид обладает улучшенной промоторной активностью, в рекомбинантной клетке-хозяине повышается активность транскрипции гена, кодирующего белок, связанный с синтезом целевого соединения, или белок, регулирующий экспрессию гена, и повышается уровень экспрессии белка, связанного с синтезом целевого соединения или белка, регуляторующего экспрессию гена, тем самым значительно повышается выход целевого соединения.
В некоторых вариантах осуществления целевое соединение представляет собой аминокислоту, и ген, кодирующий белок, связанный с синтезом целевого соединения, относится к гену, кодирующему белок, связанный с синтезом аминокислоты. В некоторых вариантах осуществления целевое соединение представляет собой L-аминокислоту, и ген, кодирующий белок, связанный с синтезом аминокислоты, относится к гену, кодирующему белок, связанный с синтезом L-аминокислоты.
В некоторых конкретных вариантах осуществления данного изобретения белок, связанный с синтезом аминокислоты, представляет собой фосфоенолпируваткарбоксилазу. Повышение экспрессии ppc с помощью полинуклеотида, обладающего промоторной активностью, может усиливать синтез из фосфоенолпирувата (ФЕП) в щавелевоуксусную кислоту, что, в свою очередь, способствует получению целевого соединения, зависящего от предложения предшественника щавелевоуксусной кислоты, включая аминокислоты семейства аспарагиновой кислоты (лизин, треонин, изолейцин, метионин) и аминокислоты семейства глутаминовой кислоты (глутаминовая кислота, пролин, гидроксипролин, аргинин, глутамин) и т. д.
В некоторых конкретных вариантах осуществления клетка-хозяин представляет собой Corynebacterium glutamicum, важный штамм для получения целевых соединений, таких как аминокислоты, органические кислоты и т. д., и после модификации Corynebacterium glutamicum с использованием полинуклеотида, транскрипционной экспрессионной кассеты или рекомбинантного экспрессионного вектора, обладающего сильной конститутивной промоторной активностью, уровень экспрессии белка, связанного с синтезом целевого соединения в Corynebacterium glutamicum, значительно повышается, что приводит к гораздо более высокой способности к долгосрочному ферментативному накоплению целевого соединения в Corynebacterium glutamicum.
В некоторых конкретных вариантах осуществления клетка-хозяин представляет собой Corynebacterium glutamicum, модифицированную следующим образом: треонин в положении 311 аспартаткиназы (кодируемой геном lysC) в геноме Corynebacterium glutamicum ATCC 13032 мутирован в изолейцин.
В некоторых конкретных вариантах осуществления условия культивирования рекомбинантных клеток-хозяев являются следующими: рекомбинантные клетки-хозяева инокулировали в жидкую среду TSB и культивируют, а культуру инокулировали в качестве затравки в 24-луночный планшет, каждая лунка которого содержит ферментационную среду, и культивировали при 30 °С в течение 18 часов при скорости вращения планшетного шейкера 800 об./мин. Выход продукции L-лизина определяли после ферментации.
Ингредиенты ферментационной среды для лизина следующие: глюкоза, 80 г/л; дрожжевой порошок, 1 г/л; соевый пептон, 1 г/л; NaCl, 1 г/л; сульфат аммония, 1 г/л; мочевина, 10 г/л; K2HPO4⋅3H2O, 1 г/л; MgSO4⋅7H2O, 0,45г/л; FeSO4⋅7H2O, 0,05г/л; биотин, 0,4 мг/л; витамин B1, 0,1 мг/л; MOPS (3-(N-морфолино)пропансульфоновая кислота), 40 г/л; исходный pH 7,2. В среду добавляли 25 мкг/мл канамицина.
В некоторых конкретных вариантах осуществления целевого соединения могут быть выделены из рекомбинантных клеток-хозяев или культуральных бульонов рекомбинантных клеток способами, обычно используемыми в данной области техники, включая, но не ограничиваясь этим, фильтрацию, анионообменную хроматографию, кристаллизацию и HPLC (высокоэффективная жидкостная хроматография).
В данной области техники известны способы манипулирования микроорганизмами, как описано в таких публикациях, как Current Protocols in Molecular Biology (Online ISBN: 9780471142720, John Wiley и Sons, Inc.), Microbial Metabolic Engineering: Methods and Protocols (Qiong Cheng Ed., Springer) и Systems Metabolic Engineering: Methods and Protocols (Hal S.Alper Ed.,Springer).
Примеры
Другие объекты, признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения. Однако следует понимать, что подробное описание и конкретные примеры (хотя и с указанием конкретных вариантов осуществления настоящего изобретения) приведены только для пояснения, поскольку различные вариации и модификации в рамках сущности и объема настоящего изобретения станут очевидными для специалистов в данной области техники после прочтения подробного описания.
Экспериментальные методы и способы, используемые в примерах, являются обычными техническими методами, если не указано иное. Например, экспериментальные методы, для которых конкретные условия не указаны в следующих примерах, обычно соответствуют обычным условиям, таким как те, которые описаны в Molecular Cloning: Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989), Sambrook и др., или предложены производителями. Если не указано иное, материалы и реагенты, используемые в примерах, могут быть получены через официальные коммерческие каналы.
Пример 1. Конструирование плазмиды для определения интенсивности промотора гена mdh Corynebacterium glutamicum
В настоящем изобретении промотор гена mdh (малатдегидрогеназа) Corynebacterium glutamicum был выбран для проведения характеристики интенсивности, и дополнительно была введена мутация конкретной области для конструирования библиотеки промоторов с получением промоторных мутантов, имеющих повышенную интенсивность экспрессии. У бактерий регуляторная последовательность экспрессии и N-концевая кодирующая область гена являются ключевыми областями, которые влияют на экспрессию гена. В настоящем изобретении интенсивность экспрессии целевого промотора характеризовали на основе интенсивности флуоресценции с использованием способа последовательного лигирования гена выше промотора, 180 п.о. N-концевой кодирующей области гена gapN НАДФ+-зависимой глицеральдегид-3-фосфатдегидрогеназы, полученного из Streptococcus mutans, гибкого линкерного пептида и гена rfp красного флуоресцентного белка.
В настоящем примере сначала сконструировали вектор для характеристики промотора гена mdh Corynebacterium glutamicum. На основе скелета плазмиды pEC-XK99E 60 аминокислот на N-конце гена gapN Streptococcus mutans, линкерного пептида и гена красного флуоресцентного белка экспрессировали с помощью области регуляции экспрессии, включающей промотор, расположенный выше гена mdh. Конкретная конструкция была следующей:
(1) Амплификация фрагментов промотора гена mdh и N-концевой последовательности
Праймеры для амплификации были сконструированы в соответствии с опубликованной последовательностью генома Corynebacterium glutamicum ATCC13032 (Gene ID: 2830649), информацией об аннотации гена mdh Corynebacterium glutamicum и 180 п.о. синтетического N-конца гена gapN, полученного из Streptococcus mutans.
Промотор mdh дикого типа (последовательность представлена в SEQ ID NO: 1) амплифицировали с использованием mdh-1/2 в качестве праймеров и генома ATCC13032 в качестве матрицы; 180 п.о. N-концевого фрагмента амплифицировали с использованием gapN180-1/2 в качестве праймеров и синтетического N-конца 180 п.о. гена GapN, полученного из Streptococcus mutans (последовательность представлена в SEQ ID NO: 2) в качестве матрицы.
(2) Амплификация плазмидного скелета и фрагмента rfp
При использовании плазмиды pEC-XK99E-rfp [2], описанной в литературе в качестве матрицы, скелет плазмиды pEC-XK99E амплифицировали с использованием pEC-1/2 в качестве праймеров, а фрагмент ДНК гена красного флуоресцентного белка, содержащего линкерный пептид (последовательность ДНК представляет собой GGCGGTGGCTCTGGAGGTGGTGGGTCCGGCGGTGGCTCT), амплифицировали с использованием RFP-1/2 в качестве праймеров.
Полученный выше промоторный фрагмент гена mdh, 180 п.о. N-концевого фрагмента гена gapN, фрагмент ДНК гена красного флуоресцентного белка, содержащий линкерный пептид, и плазмидный скелет клонировали и лигировали с помощью набора для одноэтапного клонирования Vazyme с получением вектора для характеристики pEC-XK99E-Pmdh-rfp, карта плазмид которого показана на фиг. 1. Последовательности используемых выше праймеров показаны в Таблице 1.
Пример 2. Скрининг и характеристика интенсивности мутантов промотора гена mdh Corynebacterium glutamicum
(1) Конструирование библиотеки мутантов промотора гена mdh Corynebacterium glutamicum и предварительный скрининг
В настоящем изобретении ряд мутаций был введен в область -10 и вышележащую последовательность 17 п.о. промотора гена mdh Corynebacterium glutamicum для конструирования промоторной библиотеки. Центральная область промотора mdh является следующей, где подчеркнутая часть представляет собой основную последовательность области -10 промотора:
CGTCAAGATCACCCAAAACTGGTGGCTGTTCTCTTTTAAGCGGGATAGCATGGGTTCTTA;
Последовательность, в которую были введены мутации, выглядит следующим образом:
CGTCAAGATCACCCAAAACTGGTGGCTGNNNNNNNNNNNNNNNNNTANNNTGGGTTCTTA.
При использовании вектора для характеристики pEC-XK99E-Pmdh-rfp, сконструированного в примере 1 в качестве матрицы, фрагмент, содержащий мутантную область, амплифицировали с использованием праймера mdh-N1 и праймера TK-1, а фрагмент скелета плазмиды амплифицировали с использованием праймера mdh-N2 и праймера TK-2. Вышеуказанные два фрагмента лигировали с помощью набора для одноэтапного клонирования Vazyme, и собирали все клоны, полученные мутацией промотора гена, и экстрагировали плазмиды с получением библиотеки плазмид мутантов промотора гена mdh.
Corynebacterium glutamicum ATCC13032 трансформировали вышеуказанной библиотекой плазмид и наносили на твердый планшет TSB с добавлением 25 мкг/мл канамицина. Планшет, на котором выращивали сотни клонов, фотографировали с помощью системы флуоресцентной визуализации, и предварительно отбирали мутанты с улучшенной интенсивностью экспрессии по яркости флуоресценции клонов. Ингредиенты (г/л) среды TSB планшета являются следующими: глюкоза, 5 г/л; дрожжевой порошок, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота, 0,5 г/л; K2HPO4⋅3H2O, 1 г/л; MgSO4⋅7H2O, 0,1 г/л; биотин, 0,01мг/л; витамин B1, 0,1 мг/л; MOPS, 20 г/л; порошок агара, 15 г/л. Кроме того, Corynebacterium glutamicum ATCC13032 трансформировали плазмидой для характеристики промотора дикого типа, полученной в Примере 1, с получением контрольного штамма. В настоящем изобретении предварительно отбирали более 10000 клонов библиотеки промоторов для получения мутантов с повышенной яркостью флуоресценции. Скрининговая пластина показана на фиг. 2. Последовательности используемых выше праймеров показаны в Таблице 2.
(2) Характеристика и анализ последовательностей библиотеки мутантов промотора гена Corynebacterium glutamicum
Все мутанты с повышенной яркостью флуоресценции, продемонстрированной флуоресцентной визуализацией в вышеуказанном планшете, культивировали в 96-луночном планшете для характеристики интенсивности промоторов. Ингредиенты (г/л) жидкой среды TSB следующие: глюкоза, 5 г/л; дрожжевой порошок, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота, 0,5 г/л; K2HPO4⋅3H2O, 1 г/л; MgSO4⋅7H2O, 0,1 г/л; биотин, 0,01мг/л; витамин B1, 0,1 мг/л; MOPS, 20 г/л. В культуральную среду добавляли 25 мкг/мл канамицина. Клоны с повышенной яркостью флуоресценции, полученные в планшете, и контрольный штамм промотора дикого типа инокулировали зубочистками в 96-луночный планшет, содержащий 200 мкл жидкой культуральной среды TSB в каждой лунке, с тремя параллельными штаммами для каждого штамма. При скорости вращения планшетного шейкера 800 об./мин, после культивирования при 30 °С в течение 24 часов детектировали интенсивности флуоресценции штаммов. Для штаммов с улучшенной интенсивностью флуоресценции по сравнению с контролем дикого типа фрагменты мутационной области амплифицировали с использованием праймеров pEC-F (TACGGTTCCTGGCCTTTTGC) и RFP-CX (CGGGTGTTTAACGTAAGCTTTG) и секвенировали.
Характеристика и результаты секвенирования мутантов промотора mdh показаны в таблице 3. В библиотеке промоторов гена mdh были успешно получены 49 мутантных промоторов (нуклеотидные последовательности соответствующих мутантных промоторов представляли собой SEQ ID NO: 3-51) с повышенной интенсивностью экспрессии по сравнению с промотором дикого типа, а улучшение составляло 0,4-13,0 раз, что указывает на то, что мутации в области -10 и близлежащих последовательностях промотора гена mdh могут значительно усиливать активность промотора и обеспечивать избыточность элементов для усиления экспрессии целевых генов.
Пример 3. Применение мутантов промотора гена mdh Corynebacterium glutamicum при производстве L-лизина
(1) Конструирование штаммов мутантов промотора гена mdh Corynebacterium glutamicum для применения в производстве L-лизина
В настоящем изобретении точечную мутацию T311I впервые ввели в ген аспартаткиназы lysC штамма Corynebacterium glutamicum ATCC13032 с мутацией кодона с ACC по ATC с получением штамма SCgL30. В настоящем изобретении мутант промотора гена mdh дополнительно случайным образом применяли для сверхэкспрессии гена фосфонопируваткарбоксилазы (PPC, NCBI-GeneID: 1019553, NCBI-Protein ID: NP_600799) для проверки его влияния на продукцию L-лизина.
Сверхэкспрессирующая плазмида была сконструирована следующим образом: ген ppc был сверхэкспрессирован с использованием промоторного мутанта Pmdh-39 на основе плазмидного скелета pEC-XK99E. Фрагмент мутантного промотора амплифицировали с использованием соответствующей плазмиды мутантного промотора, определенной в Примере 2, в качестве матрицы, и mdh-P1/mdh-P2 в качестве праймеров; фрагмент гена ppc амплифицировали с использованием генома Corynebacterium glutamicum ATCC 13032 в качестве матрицы и ppc-1/ppc-2 в качестве праймеров; скелет плазмиды амплифицировали с использованием плазмиды pEC-XK99E в качестве матрицы и PEC-1/2 в качестве праймеров. Полученный выше фрагмент мутантного промотора, фрагмент гена ppc и фрагмент скелета плазмиды клонировали и лигировали с помощью набора для одноэтапного клонирования Vazyme с получением плазмиды pEC-Pmdh-39-ppc. Контрольную плазмиду pEC-XK99E и вышеупомянутую плазмиду трансформировали в штаммы SCgL30, соответственно, с получением контрольного штамма SCgL30 (pEC-XK99E) и сверхэкспрессирующего штамма SCgL30 с мутантным промотором (pEC-Pmdh-39-ppc). Последовательности используемых выше праймеров показаны в Таблице 4.
(2) Оценка способности продуцировать L-лизин сверхэкспрессирующего штамма с мутантным промотором
Чтобы проверить влияние сверхэкспрессии гена ppc мутантным промотором Pmdh-39 в Corynebacterium glutamicum на продукцию L-лизина указанным штаммом, проводили ферментационные тесты на SCgL30 (pEC-XK99E) и SCgL30 (pEC-Pmdh-39-ppc), соответственно. Ингредиенты ферментационной среды следующие: глюкоза, 80 г/л; дрожжевой порошок, 1 г/л; соевый пептон, 1 г/л; NaCl, 1 г/л; сульфат аммония, 1 г/л; мочевина, 10 г/л; K2HPO4⋅3H2O, 1 г/л; MgSO4⋅7H2O, 0,45г/л; FeSO4⋅7H2O, 0,05г/л; биотин, 0,4 мг/л; витамин B1, 0,1 мг/л; MOPS (3-(N-морфолино)пропансульфоновая кислота), 40 г/л; исходный pH 7,2. В среду добавляли 25 мкг/мл канамицина. Сначала штаммы инокулировали в жидкую среду TSB для культивирования в течение 8 часов, культуры инокулировали в качестве затравок в 24-луночный планшет, содержащий 800 мкл ферментационной среды в каждой лунке, и количество инокуляции составляло 12 мкл. Начальную OD600 контролировали при около 0,1, и культивирование проводили при 30 °С в течение 17 часов при скорости вращения встряхивателя планшета 800 об./мин с тремя параллельными штаммами для каждого штамма. После ферментации выход L-лизина определяли с помощью биосенсора SBA, а OD600 измеряли с помощью считывателя микропланшетов. Результаты представлены в Таблице 5. Выход L-лизина с использованием промотора mdh сверхэкспрессирующего штамма SCgL30 (pEC-Pmdh-39-ppc) был увеличен на 59%, что указывает на то, что мутанты промотора по настоящему изобретению могут быть использованы для усиления экспрессии гена ppc и могут быть применены для продукции L-лизина.
Как показано вышеприведенными результатами, мутанты промоторов по настоящему изобретению могут быть использованы для усиления экспрессии PPC в Corynebacterium glutamicum и, тем самым, для усиления синтеза из фосфоенолпирувата (PEP) в щавелевоуксусную кислоту, таким образом, могут применяться для получения целевого продукта, зависящего от предложения предшественника щавелевоуксусной кислоты, включая аминокислоты семейства аспарагиновой кислоты (лизин, треонин, изолейцин, метионин), аминокислоты семейства глутаминовой кислоты (глутаминовая кислота, пролин, гидроксипролин, аргинин, глутамин), и для биологического получения аминокислот, таких как 5-аминолевулиновая кислота, для которой щавелевоуксусная кислота является важным метаболическим предшественником.
Поскольку усиление экспрессии и активности PPC может быть использовано для увеличения выхода целевого соединения, такого как 5-аминолевулиновая кислота[1], в то время как все мутанты промоторов по настоящему изобретению могут быть использованы для усиления экспрессии и активности PPC, таким образом, мутанты промоторов по настоящему изобретению могут использоваться для получения 5-аминолевулиновой кислоты.
Было подтверждено, что мутанты промоторов по настоящему изобретению могут улучшать экспрессию слитого белка гена gapN и RFP Streptococcus mutans, а также могут применяться для улучшения экспрессии PPC, а мутанты промоторов по настоящему изобретению также могут применяться для экспрессии других генов и для получения различных продуктов.
Pmdh-WT(SEQ ID NO: 1):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgttctcttttaagcgggatagcatgggttcttagaggaccccctacaaggattgaggattgttta
180 п.о. кодирующей области (SEQ ID NO: 2) N-конца гена gapN:
atgacaaaacaatataaaaattatgtcaatggcgagtggaagctttcagaaaatgaaattaaaatctacgaaccggccagtggagctgaattgggttcagttccagcaatgagtactgaagaagtagattatgtttatgcttcagccaagaaagctcaaccagcttggcgatcactttca
Pmdh-1(SEQ ID NO: 3):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgcaggtaacaactgcgagtacggtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-2(SEQ ID NO: 4):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgagtctgagggatataattaagatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-3(SEQ ID NO: 5):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgggtcgtggaggacaagttaagatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-4(SEQ ID NO: 6):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgctactaccatcgggtgctaaggtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-5(SEQ ID NO: 7):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggataggtaggcgttaagtaaactgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-6(SEQ ID NO: 8):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgggcaattcgcggggaggtagactgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-7(SEQ ID NO: 9):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtattgggcgcggcattataggatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-8(SEQ ID NO: 10):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggggaactgctttggtagtatcatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-9(SEQ ID NO: 11):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggttcaggtttgggccgctatgctgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-10(SEQ ID NO: 12):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtgatcggggcgctttggtacggtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-11(SEQ ID NO: 13):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtatgaaataaattggagtaggctgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-12(SEQ ID NO: 14):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgaacggtatctttctccatataatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-13(SEQ ID NO: 15):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgaacggagcgtgtacgactagaatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-14(SEQ ID NO: 16):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtgcgcgggtaaacgctgtagagtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-15(SEQ ID NO: 17):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgttgatgtcgtagcgtagtattatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-16(SEQ ID NO: 18):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgagctcggactttggtggtaggctgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-17(SEQ ID NO: 19):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgccggcgcattataacgctacaatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-18(SEQ ID NO: 20):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgcgggggtgtaagtcgagtagactgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-19(SEQ ID NO: 21):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgacgggtaggtatttcgctaggatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-20(SEQ ID NO: 22):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtagtgtatgcttttacatagactgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-21(SEQ ID NO: 23):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgaggcagcatgtacatgatatcgtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-22(SEQ ID NO: 24):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgttgagcggagttaatagtacactgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-23(SEQ ID NO: 25):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgatacacacaactttcgatactatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-24(SEQ ID NO: 26):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgattccaaccttatgttatactgtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-25(SEQ ID NO: 27):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggaggtagtcgtttggggtaggatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-26(SEQ ID NO: 28):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgattgctcgcgtaaatggtaaactgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-27(SEQ ID NO: 29):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtgttattatgggagatgtaagttgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-28(SEQ ID NO: 30):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggaaaaatgtacgtgtgttaaaatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-29(SEQ ID NO: 31):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgagtcctcagtggagtggtaacatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-30(SEQ ID NO: 32):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtttccggtgttttcgcgtagagtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-31(SEQ ID NO: 33):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgggcgtcggtaggtatgttattgtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-32(SEQ ID NO: 34):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgacggcgatcagagtgtgtaagatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-33(SEQ ID NO: 35):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgccgtgcgtgatatggggtagtgtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-34(SEQ ID NO: 36):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggggttgtgagttatcggtataatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-35(SEQ ID NO: 37):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtgctccgatgatggtggtaagatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-36(SEQ ID NO: 38):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggttctcacgggtccgtgtatgatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-37(SEQ ID NO: 39):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtttcggaatggatggtgtacgctgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-38(SEQ ID NO: 40):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgattatgtcttcttttggtaaaatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-39(SEQ ID NO: 41):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggatcataggttctgtggtagattgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-40(SEQ ID NO: 42):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgcatggccgatcatgatgtaatatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-41(SEQ ID NO: 43):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtagtggcggtgtacgtgtatgatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-42(SEQ ID NO: 44):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgatttgttacaggtatggtagtttgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-43(SEQ ID NO: 45):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgacggaacttatttctggtaacgtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-44(SEQ ID NO: 46):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgaccgggaggactaatggtatggtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-45(SEQ ID NO: 47):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggccacccctttttctgctattatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-46(SEQ ID NO: 48):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgttgcgccggagttgcggtatagtgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-47(SEQ ID NO: 49):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctggtttacgggtgttcatgtagtatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-48(SEQ ID NO: 50):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgtttgtctcgtatctgtgtaagatgggttcttagaggaccccctacaaggattgaggattgttta
Pmdh-49(SEQ ID NO: 51):
cgattccccatgatgccctaacatcttgcaggtgaggggtacatattggggcaattcgggggtaattttgcagtatcgtcaagatcacccaaaactggtggctgattttgggcacttagtgtattgtgggttcttagaggaccccctacaaggattgaggattgttta
Ссылки:
[1] CN103981203A
[2] Wang, YC et al., Screening efficient constitutive promoters in Corynebacterium glutamicum based on time-series transcriptome analysis. Chinese Journal of Biotechnology, 2018, 34(11):1760 - 1771.
Все технические признаки, раскрытые в данном описании, могут комбинироваться любым способом. Каждый признак, раскрытый в данном описании, также может быть заменен другим признаком, имеющим такую же, равную или аналогичную функцию. Следовательно, если не указано иное, каждый признак, раскрытый в настоящем документе, является просто примером ряда равных или аналогичных признаков.
Кроме того, согласно приведенному выше описанию настоящего изобретения, специалисты в данной области техники могут легко понять ключевые признаки настоящего изобретения, и в изобретение может быть внесено множество модификаций для адаптации к различным целям и условиям использования без отступления от сущности и объема настоящего изобретения, и, следовательно, такие модификации также предназначены для попадания в объем прилагаемой формулы изобретения
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ПОЛИНУКЛЕОТИД НА ОСНОВЕ ГЕНА MDH, ОБЛАДАЮЩИЙ ПРОМОТОРНОЙ
АКТИВНОСТЬЮ, И ЕГО ПРИМЕНЕНИЕ
<120> ТЯНЬЦЗИНЬ ИНСТИТЬЮТ ОФ ИНДАСТРИАЛ БАЙОТЕКНОЛОДЖИ, ЧАЙНИЗ
ЭКЭДЕМИ ОФ САЙЕНСИЗ
<130> 6A17-2143180IB
<150> CN202110638496.5
<151> 2021-06-08
<160> 67
<170> PatentIn версия 3.5
<210> 1
<211> 168
<212> ДНК
<213> Corynebacterium glutamicum
<400> 1
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgttctct tttaagcggg 120
atagcatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 2
<211> 180
<212> ДНК
<213> Streptococcus mutans
<400> 2
atgacaaaac aatataaaaa ttatgtcaat ggcgagtgga agctttcaga aaatgaaatt 60
aaaatctacg aaccggccag tggagctgaa ttgggttcag ttccagcaat gagtactgaa 120
gaagtagatt atgtttatgc ttcagccaag aaagctcaac cagcttggcg atcactttca 180
<210> 3
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 3
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgcaggta acaactgcga 120
gtacggtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 4
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 4
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgagtctg agggatataa 120
ttaagatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 5
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 5
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgggtcgt ggaggacaag 120
ttaagatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 6
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 6
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgctacta ccatcgggtg 120
ctaaggtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 7
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 7
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggatagg taggcgttaa 120
gtaaactggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 8
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 8
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgggcaat tcgcggggag 120
gtagactggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 9
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 9
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtattgg gcgcggcatt 120
ataggatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 10
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 10
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggggaac tgctttggta 120
gtatcatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 11
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 11
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggttcag gtttgggccg 120
ctatgctggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 12
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 12
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtgatcg gggcgctttg 120
gtacggtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 13
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 13
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtatgaa ataaattgga 120
gtaggctggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 14
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 14
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgaacggt atctttctcc 120
atataatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 15
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 15
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgaacgga gcgtgtacga 120
ctagaatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 16
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 16
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtgcgcg ggtaaacgct 120
gtagagtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 17
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 17
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgttgatg tcgtagcgta 120
gtattatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 18
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 18
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgagctcg gactttggtg 120
gtaggctggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 19
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 19
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgccggcg cattataacg 120
ctacaatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 20
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 20
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgcggggg tgtaagtcga 120
gtagactggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 21
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 21
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgacgggt aggtatttcg 120
ctaggatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 22
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 22
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtagtgt atgcttttac 120
atagactggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 23
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 23
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgaggcag catgtacatg 120
atatcgtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 24
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 24
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgttgagc ggagttaata 120
gtacactggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 25
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 25
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgatacac acaactttcg 120
atactatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 26
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 26
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgattcca accttatgtt 120
atactgtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 27
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 27
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggaggta gtcgtttggg 120
gtaggatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 28
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 28
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgattgct cgcgtaaatg 120
gtaaactggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 29
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 29
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtgttat tatgggagat 120
gtaagttggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 30
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 30
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggaaaaa tgtacgtgtg 120
ttaaaatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 31
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 31
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgagtcct cagtggagtg 120
gtaacatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 32
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 32
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtttccg gtgttttcgc 120
gtagagtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 33
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 33
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgggcgtc ggtaggtatg 120
ttattgtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 34
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 34
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgacggcg atcagagtgt 120
gtaagatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 35
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 35
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgccgtgc gtgatatggg 120
gtagtgtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 36
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 36
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggggttg tgagttatcg 120
gtataatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 37
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 37
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtgctcc gatgatggtg 120
gtaagatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 38
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 38
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggttctc acgggtccgt 120
gtatgatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 39
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 39
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtttcgg aatggatggt 120
gtacgctggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 40
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 40
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgattatg tcttcttttg 120
gtaaaatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 41
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 41
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggatcat aggttctgtg 120
gtagattggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 42
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 42
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgcatggc cgatcatgat 120
gtaatatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 43
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 43
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtagtgg cggtgtacgt 120
gtatgatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 44
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 44
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgatttgt tacaggtatg 120
gtagtttggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 45
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 45
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgacggaa cttatttctg 120
gtaacgtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 46
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 46
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgaccggg aggactaatg 120
gtatggtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 47
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 47
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggccacc cctttttctg 120
ctattatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 48
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 48
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgttgcgc cggagttgcg 120
gtatagtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 49
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 49
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctggtttac gggtgttcat 120
gtagtatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 50
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 50
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgtttgtc tcgtatctgt 120
gtaagatggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 51
<211> 168
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность мутанта mdh
<400> 51
cgattcccca tgatgcccta acatcttgca ggtgaggggt acatattggg gcaattcggg 60
ggtaattttg cagtatcgtc aagatcaccc aaaactggtg gctgattttg ggcacttagt 120
gtattgtggg ttcttagagg accccctaca aggattgagg attgttta 168
<210> 52
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 52
cctgatgcgg tattttctcc cgattcccca tgatgcccta ac 42
<210> 53
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 53
taaacaatcc tcaatccttg tagg 24
<210> 54
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 54
caaggattga ggattgttta atgacaaaac aatataaaaa ttatgtc 47
<210> 55
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 55
ccacctccag agccaccgcc tgaaagtgat cgccaagctg g 41
<210> 56
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 56
ctgcaggcat gcaagcttgg 20
<210> 57
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 57
ggagaaaata ccgcatcagg c 21
<210> 58
<211> 64
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 58
ggcggtggct ctggaggtgg tgggtccggc ggtggctctg cttcctccga agacgttatc 60
aaag 64
<210> 59
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 59
ccaagcttgc atgcctgcag ttaagcaccg gtggagtgac gac 43
<210> 60
<211> 65
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<220>
<221> misc_feature
<222> (21)..(37)
<223> n представляет собой a, c, g, или t
<220>
<221> misc_feature
<222> (40)..(42)
<223> n представляет собой a, c, g, или t
<400> 60
tcacccaaaa ctggtggctg nnnnnnnnnn nnnnnnntan nntgggttct tagaggaccc 60
cctac 65
<210> 61
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 61
cagccaccag ttttgggtga tc 22
<210> 62
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 62
aaccttccat acgaactttg aaacg 25
<210> 63
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 63
caaagttcgt atggaaggtt ccg 23
<210> 64
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 64
cctgatgcgg tattttctcc cgattcccca tgatgcccta ac 42
<210> 65
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 65
tcgcgtaaaa aatcagtcat taaacaatcc tcaatccttg tagg 44
<210> 66
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 66
atgactgatt ttttacgcga tgac 24
<210> 67
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность праймера
<400> 67
ccaagcttgc atgcctgcag ctagccggag ttgcgcagc 39
<---
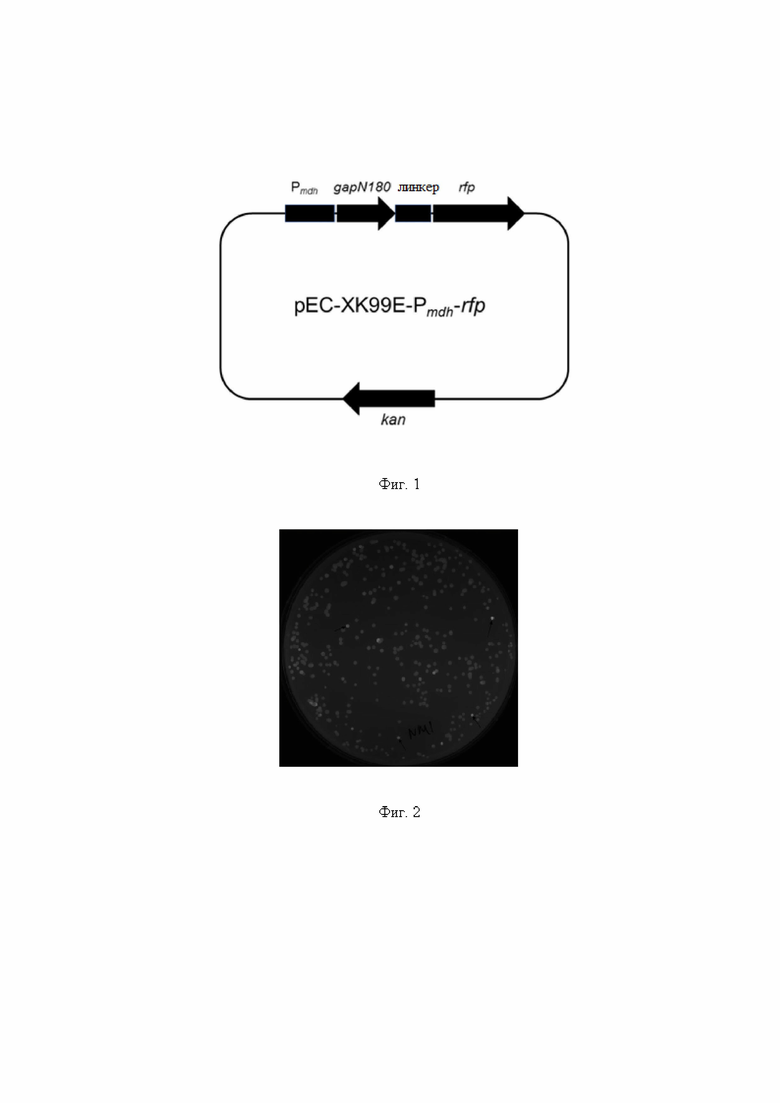
Изобретение относится к области биотехнологии, в частности к полинуклеотиду, обладающему промоторной активностью, а также к транскрипционной кассете, вектору и клетке, его содержащим. Изобретение эффективно для получения целевого соединения. 10 н. и 9 з.п. ф-лы, 2 ил., 5 табл., 3 пр.
1. Полинуклеотид, обладающий промоторной активностью, выбранный из мутанта полинуклеотида, содержащего последовательность SEQ ID NO: 1, содержащего мутированный нуклеотид в одном или более положениях 105-126 последовательности SEQ ID NO: 1; где
нуклеотидная последовательность мутанта, соответствующая положениям от 105 до 126 последовательности, представленной в SEQ ID NO: 1, выбрана из любой из группы, состоящей из (Pmdh-1) - (Pmdh-49):


где полинуклеотид обладает повышенной промоторной активностью по сравнению с полинуклеотидом, имеющим последовательность, представленную в SEQ ID NO: 1.
2. Полинуклеотид, обладающий промоторной активностью, по п. 1, где указанный мутант имеет в 0,4-13 раз или более улучшенную промоторную активность по сравнению с промоторной активностью полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1.
3. Транскрипционная экспрессионная кассета, содержащая полинуклеотид, обладающий промоторной активностью, по п. 1 или 2; где транскрипционная экспрессионная кассета дополнительно содержит ген-мишень, который функционально лигирован с полинуклеотидом, обладающим промоторной активностью.
4. Транскрипционная экспрессионная кассета по п. 3, где ген-мишень представляет собой ген, кодирующий белок.
5. Рекомбинантный экспрессионный вектор, содержащий полинуклеотид, обладающий промоторной активностью, по п. 1 или 2, который функционально лигирован с геном-мишенью, или транскрипционную экспрессионную кассету по п. 3 или 4.
6. Рекомбинантная клетка-хозяин для получения целевых соединений, содержащая транскрипционную экспрессионную кассету по п. 3 или 4 или рекомбинантный экспрессионный вектор по п. 5.
7. Рекомбинантная клетка-хозяин по п. 6, которая относится к роду Corynebacterium, роду Brevibacterium, роду Arthrobacterium, роду Microbacterium или роду Escherichia; предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum или Escherichia coli; более предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum АТСС 13032, Corynebacterium glutamicum АТСС 13869, Corynebacterium glutamicum АТСС 14067 или производные штаммы Corynebacterium glutamicum.
8. Применение полинуклеотида по п. 1 или 2 в качестве промотора по меньшей мере в одном из следующих случаев:
a) повышение уровня транскрипции гена;
b) получение белка;
c) получение целевого соединения.
9. Применение полинуклеотида по п. 1 или 2 в качестве промотора в получении реагента или набора для по меньшей мере одного из следующего:
a) повышение уровня транскрипции гена;
b) получение белка;
c) получение целевого соединения.
10. Применение по п. 8 или 9, где белок выбран из белка, регулирующего экспрессию гена, белка, связанного с синтезом целевого соединения, или белка, связанного с мембранным транспортом.
11. Применение по любому из пп. 8-10, где целевое соединение включает по меньшей мере одну из аминокислот, органических кислот;
необязательно, аминокислоты включают одну или комбинацию двух или более из следующего: пролин, гидроксипролин, лизин, глутаминовую кислоту, треонин, глицин, аланин, валин, лейцин, изолейцин, серин, цистеин, глутамин, метионин, аспарагиновую кислоту, аспарагин, аргинин, гистидин, фенилаланин, тирозин, триптофан, 5-аминолевулиновую кислоту или производные любой из вышеуказанных аминокислот;
необязательно, органические кислоты включают одну или комбинацию двух или более из следующего: лимонная кислота, янтарная кислота, молочная кислота, уксусная кислота, масляная кислота, пальмитиновая кислота, щавелевая кислота, щавелевоуксусная кислота, винная кислота, пропионовая кислота, гексеновая кислота, декановая кислота, каприловая кислота, валериановая кислота, яблочная кислота или производные любой из вышеуказанных органических кислот.
12. Способ конструирования промоторного мутанта, включающий следующие стадии:
стадия мутации: обеспечение мутации полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1, так что нуклеотиды в одном или более положениях 105-126 последовательности, представленной в SEQ ID NO: 1, мутируют в нуклеотидную последовательность, представленную ниже: NNNNNNNNNNNNNNNNNTANNNT; где N выбран из А, Т, С или G;
стадия скрининга: скрининг мутанта полинуклеотида, обладающего улучшенной промоторной активностью по сравнению с полинуклеотидом, имеющим последовательность, представленную в SEQ ID NO: 1, с получением промоторного мутанта.
13. Способ конструирования по п. 12, где промоторный мутант имеет в 0,4-13 раз или более улучшенную промоторную активность по сравнению с промоторной активностью полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 1.
14. Способ регуляции транскрипции, включающий стадию функционального лигирования полинуклеотида, обладающего промоторной активностью, по п. 1 или 2 с целевой РНК или целевым геном.
15. Способ по п. 14, где целевая РНК включает по меньшей мере одну из тРНК, рРНК, причем целевой ген включает по меньшей мере один из гена, кодирующего белок, связанный с синтезом целевого соединения, гена, кодирующего белок, регулирующий экспрессию гена, и гена, кодирующего белок, связанный с мембранным транспортом;
необязательно, целевой ген включает по меньшей мере один из следующих генов: ген пируваткарбоксилазы, ген фосфоенолпируваткарбоксилазы, ген γ-глутамилкиназы, ген глутаматполуальдегиддегидрогеназы, ген пирролин-5-карбоксилатредуктазы, ген белка переноса аминокислот, ген, связанный с системой ptsG, ген пируватдегидрогеназы, ген гомосериндегидрогеназы, ген декарбоксилазы щавелевоуксусной кислоты, ген репрессора глюконовой кислоты, ген глюкоздегидрогеназы, ген аспартаткиназы, ген аспартатполуальдегиддегидрогеназы, ген лиазы аспартата аммония, ген дигидродипиколинатсинтазы, ген редуктазы дигидропиридиновой кислоты, ген сукцинилдиаминопимелат-аминотрансферазы, ген тетрагидродипиколинат сукцинилазы, ген сукцинилдиаминопимелатдеацилазы, ген эпимеразы диаминопимелиновой кислоты, ген деацилазы диаминопимелиновой кислоты, ген глицеральдегид-3-фосфатдегидрогеназы, ген транскетолазы, ген диаминопимелатдегидрогеназы.
16. Способ получения белка, включающий стадию экспрессии белка с использованием транскрипционной экспрессионной кассеты по п. 3 или 4, рекомбинантного экспрессионного вектора по п. 5 или рекомбинантной клетки-хозяина по п. 6 или 7.
17. Способ по п. 16, где белок представляет собой белок, связанный с синтезом целевого соединения, или белок, регулирующий экспрессию гена;
необязательно, способ дополнительно включает стадию выделения или очистки белка.
18. Способ получения целевого соединения, включающий стадию экспрессии белка, связанного с синтезом целевого соединения, белка, связанного с мембранным транспортом, или белка, регулирующего экспрессию гена, с использованием рекомбинантной клетки-хозяина по п. 6 или 7, и получения целевого соединения, где рекомбинантную клетку-хозяин подвергают ферментационной культуре, и целевое соединение собирают из рекомбинантной клетки-хозяина.
19. Способ по п. 18, где целевое соединение включает по меньшей мере одну из аминокислот, органических кислот;
необязательно, аминокислоты включают одну или комбинацию двух или более из следующего: лизин, глутаминовую кислоту, треонин, пролин, гидроксипролин, глицин, аланин, валин, лейцин, изолейцин, серин, цистеин, глутамин, метионин, аспарагиновую кислоту, аспарагин, аргинин, гистидин, фенилаланин, тирозин, триптофан, 5-аминолевулиновую кислоту или производные любой из вышеуказанных аминокислот;
необязательно, органические кислоты включают одну или комбинацию двух или более из следующего: лимонная кислота, янтарная кислота, молочная кислота, уксусная кислота, масляная кислота, пальмитиновая кислота, щавелевая кислота, щавелевоуксусная кислота, винная кислота, пропионовая кислота, гексеновая кислота, декановая кислота, каприловая кислота, валериановая кислота, яблочная кислота или производные любой из вышеуказанных органических кислот;
необязательно, белок, связанный с синтезом целевого соединения, представляет собой белок, связанный с синтезом L-аминокислоты; необязательно, белок, связанный с синтезом L-аминокислоты, включает один или комбинацию двух или более из: пируваткарбоксилазы, фосфоенолпируваткарбоксилазы, γ-глутамилкиназы, глутаматполуальдегиддегидрогеназы, пирролин-5-карбоксилатредуктазы, белок транспорта аминокислот, системы ptsG, пируватдегидрогеназы, гомосериндегидрогеназы, декарбоксилазы щавелевоуксусной кислоты, репрессора глюконовой кислоты, глюкоздегидрогеназы, аспартаткиназы, аспартатполуальдегиддегидрогеназы, лиазы аспартата аммония, дигидродипиколинатсинтазы, редуктазы дигидропиридиновой кислоты, сукцинилдиаминопимелат-аминотрансферазы, тетрагидродипиколинат сукцинилазы, сукцинилдиаминопимелатдеацилазы, эпимеразы диаминопимелиновой кислоты, деацилазы диаминопимелиновой кислоты, глицеральдегид-3-фосфатдегидрогеназы, транскетолазы, диаминопимелатдегидрогеназы;
необязательно, способ дополнительно включает стадию выделения или очистки целевого соединения.
| WO 9308277 A1, 29.04.1993 | |||
| Устройство для сортировки чая | 1987 |
|
SU1440458A1 |
| WO 2006028063 A1, 16.03.2006 | |||
| XIULING SHANG et al | |||
| Native promoters of Corynebacterium glutamicum and its application in L-lysine production, Biotechnol Lett, 2018, vol | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Передвижная комнатная печь | 1922 |
|
SU383A1 |
| М.Г | |||
| ТАРУТИНА и др | |||
| Оценка эффективности промоторов Corynebacterium glutamicum и их использование для | |||
Авторы
Даты
2024-08-26—Публикация
2022-05-24—Подача