ОБЛАСТЬ ТЕХНИКИ
[0001] Настоящее изобретение относится к области молекулярной биологии и биоинженерии и, в частности, относится к полинуклеотиду, обладающему промоторной активностью, экспрессионной транскрипционной кассете, рекомбинантному вектору экспрессии и рекомбинантной клетке-хозяину, содержащей полинуклеотид, обладающий промоторной активностью, а также к способу повышения экспрессии целевого гена, способу получения белков и способу получения аминокислот.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0002] Лизин, химическое название которого 2,6-диаминопимеловая кислота, является незаменимой аминокислотой для животных и человека. Он может способствовать развитию человека, повышать иммунитет и улучшать функцию центральной нервной системы. Существует три химических оптических изомера лизина: L-форма (левовращающая), D-форма (правовращающая) и DL-форма (рацемическая форма), среди которых только L-форма биологически пригодна для использования, а лизином обычно называют L-лизин.
[0003] L-лизин является одной из 20 распространенных аминокислот, которые составляют белки. L-лизин является основной аминокислотой, как гистидин и аргинин. Поскольку организмы человека и животных не могут синтезировать L-лизин самостоятельно, L-лизин может быть получен только из пищи, поэтому является одной из восьми незаменимых аминокислот. Содержание L-лизина в основных зерновых продуктах питания человека низкое, и его дефицит вызывает метаболические и функциональные нарушения белка, отрицательно влияющие на рост, и может быть разрушен во время обработки, таким образом, известен как первая ограничивающая аминокислота, которая играет очень важную роль в медицине, здравоохранении, пищевой, кормовой и косметической промышленности.
[0004] До сих пор существует три основных метода промышленного производства L-лизина: протеолиз, химический синтез и микробная ферментация. Среди них микробная ферментация является наиболее широко используемым методом промышленного производства L-лизина из-за его преимуществ, таких как низкая себестоимость производства, высокая интенсивность производства, высокая специфичность и низкое загрязнение окружающей среды. Corynebacterium и Escherichia широко используются в промышленном производстве L-лизина. Обычно используемая Escherichia представляет собой, например, Escherichia coli, и обычно используемая Corynebacterium включает Corynebacterium glutamicum рода Corynebacterium, Brevibacterium flavum рода Brevibacterium, Brevibacterium lactofermentus и некоторые виды рода Arthrobacterium и некоторые виды рода Microbacterium.
[0005] Среди микроорганизмов и растений, которые, как известно, имеют пути биосинтеза L-лизина, пути биосинтеза L-лизина можно классифицировать как два различных пути, т.е. путь альфа-аминогликолевой кислоты (AAA) и путь диаминопимелата (DAP). Путь диаминопимелата (DAP) является частью пути синтеза аминокислот семейства аспарагиновых кислот. Используя аспарагиновую кислоту в качестве субстрата, путь DAP включает путь сукцинилазы, путь ацетилазы и путь трансаминазы, которые синтезируют мезо-диаминопимеловую кислоту, и путь дегидрогеназы, который непосредственно синтезирует рацемическую диаминопимеловую кислоту без прохождения мезо-диаминопимеловую кислоту.
[0006] Corynebacterium glutamicum является важным промышленным микроорганизмом, и его преимущество заключается в его способности к ферментативному производству аминокислот в промышленном масштабе. Corynebacterium glutamicum использует путь дегидрогеназы для синтеза L-лизина с шестью ферментами, катализирующими реакцию, то есть аспартаткиназой (AK, кодируемая геном lysC), аспартат полуальдегид дегидрогеназой (ASADH, кодируемая геном asd), дигидродипиколинатсинтазой (DHDPS, кодируемая геном dapA), дигидродипиколинатредуктазой (DHDPR, кодируемая геном dapB), диаминопимелатдегидрогеназой (DAPDH, кодируемая геном ddh) и диаминопимелатдекарбоксилазой (DAPDC, кодируемая геном lysA). Процесс синтеза L-лизина с помощью Corynebacterium glutamicum с использованием пути сукцинилазы также включает четыре фермента, которые синтезируют мезодиаминопимеловую кислоту: тетрагидродипиколинатсукцинилазу (кодируемую геном dapD), N-сукцинилдиаминопимелатаминотрансферазу (кодируемую геном dapC), сукцинилдиаминопимелатдеацилазу (кодируемую геном dapE) и диаминопимелатэпимеразу (кодируемую геном dapF). Как хорошо известно, повышение экспрессии одного или более генов в пути синтеза L-лизина может эффективно увеличивать выход L-лизина.
[0007] Литературный источник 1 раскрывает бактерии Corynebacterium, которые имеют, помимо по меньшей мере одной копии, присутствующие в природном сайте (локусе) открытой рамки считывания (ORF), гена или аллеля, который кодирует синтез белка или РНК, в каждом случае вторую, необязательно третью или четвертую копию этой открытой рамки считывания (ORF), гена или аллеля, в каждом случае второй, необязательно третий или четвертый сайт в форме интеграции в хромосому. Бактерии Corynebacterium в таком способе могут улучшить уровень экспрессии генов за счет увеличения количества копий генов, тем самым увеличивая выход аминокислот, продуцируемых бактериями Corynebacterium. Однако увеличение числа копий генов снизит стабильность генома штамма, поэтому не может гарантировать стабильную и эффективную продукцию L-лизина.
[0008] Литературный источник 2 раскрывает способ получения L-лизина путем культивирования Escherichia coli со способностью продуцировать L-лизин в среде, из которой собирают L-лизин, причем Escherichia coli модифицировали для снижения активности или активностей одного или более ферментов в пути синтеза мезо α,ε-диаминопимеловой кислоты, например, 2,3,4,5-тетрагидропиридин-2,6-дикарбоксилата N-сукцинилтрансферазы, сукцинилдиаминопимелаттрансаминазы, сукцинилдиаминопимелатдесукцинилазы и диаминопимелатэпимеразы, а Escherichia coli вводили с геном, кодирующим диаминопимелатдегидрогеназу. Данный способ требует повышения экспрессии диаминопимелатдегидрогеназы при одновременном ингибировании ферментной активности пути синтеза мезо α,ε-диаминопимелиновой кислоты, что связано с проблемами сложного операционного процесса, высокой стоимостью и невозможностью эффективного получения L-лизина.
[0009] Литературный источник 3 раскрывает молекулу нуклеиновой кислоты, которая функционально лигирована геном, кодирующим диаминопимелатдегидрогеназу, и что активность диаминопимелатдегидрогеназы может быть увеличена, чтобы тем самым увеличить выход L-лизина штамма. Хотя в настоящем документе молекула нуклеиновой кислоты обладает более высокой активностью по сравнению с промотором дикого типа, неизвестно, существует ли молекула нуклеиновой кислоты с более высокой промоторной активностью. Как хорошо известно специалистам в данной области техники, чем выше активность диаминопимелатдегидрогеназы, тем более она благоприятна для производства лизина. Следовательно, разработка промотора с более высокой активностью будет полезна для повышения экспрессии диаминопимелатдегидрогеназы, тем самым обладая большим потенциалом для промышленного применения.
[0010] Литературные источники:
[0011] Литературный источник 1: CN1748031A.
[0012] Литературный источник 2: CN101765659A.
[0013] Литературный источник 3: CN101939432A.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0014] Техническая проблема
[0015] Учитывая техническую проблему, существующую в уровне техники, например, бактерии Corynebacterium, которые увеличивают выход за счет увеличения количества копий генов, имеют плохую стабильность генома, штамм, имеющий производственный потенциал L-лизина, имеет дефекты сложного процесса трансформации и неспособность стабильно и эффективно продуцировать L-лизин. В настоящем изобретении предложен полинуклеотид, обладающий промоторной активностью, значительно улучшенной по сравнению с промотором гена ddh дикого типа. Путем функционального лигирования полинуклеотида, обладающего промоторной активностью, с целевым геном, интенсивность экспрессии целевого гена может быть улучшена при сохранении стабильности генома.
[0016] Решение проблемы
[0017] (1) Полинуклеотид, обладающий промоторной активностью, где полинуклеотид выбран из группы, представленной в любом из следующих (i)-(ii):
[0018] (i) мутант полинуклеотида, имеющего последовательность, представленную SEQ ID NO: 9, содержащий мутированный нуклеотид в одном или более положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9;
[0019] (ii) полинуклеотид, обладающий по меньшей мере 90%-й, необязательно по меньшей мере 95%-й, предпочтительно по меньшей мере 97%-й, более предпочтительно по меньшей мере 98%-й и наиболее предпочтительно по меньшей мере 99%-й идентичностью последовательности по сравнению с последовательностью, указанной в (i), и не содержащий последовательность, представленную в SEQ ID NO: 9;
[0020] где мутант обладает более высокой промоторной активностью, чем полинуклеотид, имеющий последовательность, представленную в SEQ ID NO: 9;
[0021] и нуклеотидная последовательность мутанта в позициях 292-300 последовательности, представленной в SEQ ID NO: 9, не выбрана из ATGCATTGT.
[0022] (2) Полинуклеотид, обладающий промоторной активностью, по (1), где мутант обладает повышенной промоторной активностью в 18 или более раз по сравнению с промоторной активностью полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 9.
[0023] (3) Полинуклеотид, обладающий промоторной активностью, по (1) или (2), где мутант содержит мутированные нуклеотиды в 4, 5, 6, 7, 8 или 9 положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9; предпочтительно, мутант содержит мутированные нуклеотиды в 6, 7, 8 или 9 положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9.
[0024] Полинуклеотид, обладающий промоторной активностью, по любому из (1)-(3), где нуклеотидная последовательность в позициях 292-300 полинуклеотида, обладающего промоторной активностью, выбрана из любой из следующих групп:
[0025] (a) ACAAAAGGT;
[0026] (b) TCTTCATCT;
[0027] (c) GGAAAGTAT;
[0028] (d) TTATTATAT;
[0029] (e) TAATCCTCT;
[0030] (f) TCAATTTAT;
[0031] (g) GCGCAATCT;
[0032] (h) CAGTTCCGT;
[0033] (i) AAGTTTTAT;
[0034] (g) TAAATGTAT;
[0035] (k) GGATTGTAT;
[0036] (l) CAAACTCAT;
[0037] (m) TACAAATCT;
[0038] (n) TATCAGTCT;
[0039] (o) CGAGGATAT;
[0040] (p) CCTTGTTAT.
[0041] (5) Экспрессионная транскрипционная кассета, содержащая полинуклеотид, обладающий промоторной активностью по любому из (1)-(4); необязательно, экспрессионная транскрипционная кассета дополнительно содержит ген, кодирующий белок, функционально лигирован с полинуклеотидом, обладающим промоторной активностью.
[0042] (6) Рекомбинантный вектор экспрессии, содержащий полинуклеотид, обладающий промоторной активностью по любому из (1)-(4), или экспрессионную транскрипционную кассету по (5).
[0043] (7) Рекомбинантная клетка-хозяин, содержащая экспрессионную транскрипционную кассету по (5) или рекомбинантный вектор экспрессии по (6).
[0044] (8) Рекомбинантная клетка-хозяин по (7), которая относится к роду Corynebacterium, роду Brevibacterium, роду Arthrobacterium, роду Microbacterium или роду Escherichia; предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum; более предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum ATCC 13032, Corynebacterium glutamicum ATCC 13869, Corynebacterium glutamicum ATCC 14067 или их производные штаммы.
[0045] (9) Применение полинуклеотида, обладающего промоторной активностью по любому из (1)-(4), экспрессионной транскрипционной кассеты по (5), рекомбинантного вектора экспрессии по (6) или рекомбинантной клетки-хозяина по любому из (7)-(8) при получении реагента или набора для повышения уровня транскрипции гена.
[0046] (10) Применение рекомбинантного вектора экспрессии по (6) или рекомбинантной клетки-хозяина по любому из (7)-(8) при получении белка или получении аминокислоты и ее производных; необязательно, аминокислота и ее производные выбраны из одной или комбинации двух или более из следующего: пролина, гидроксипролина, лизина, глутаминовой кислоты, аргинина, орнитина, глутамина, треонина, глицина, аланина, валина, лейцина, изолейцина, серина, цистеина, метионина, аспарагиновой кислоты, аспарагина гистидина, фенилаланинв, тирозинв, триптофанв, 5-аминолевулиновой кислоты или производные любой из вышеуказанных аминокислот;
[0047] предпочтительно, белок представляет собой фермент, участвующий в синтезе аминокислот; предпочтительно, фермент, участвующий в синтезе аминокислот, представляет собой диаминопимелатдегидрогеназу;
[0048] предпочтительно аминокислота включает L-лизин и его производные, где производные включают по меньшей мере одно из пентандиамина, 5-аминопентановой кислоты и глутаровой кислоты.
[0049] (11) Способ повышения экспрессии целевого гена, включающий стадию функционального лигирования полинуклеотида, обладающего промоторной активностью по любому из (1)-(4), с целевой РНК или целевым геном; причем необязательно целевая РНК содержит по меньшей мере одну из тРНК (транспортная РНК) и мРНК (малая РНК), а целевой ген включает по меньшей мере один из гена, кодирующего белок, связанный с синтезом целевого продукта, гена, кодирующего белок-регулятор экспрессии гена и гена, кодирующего белок, связанный с мембранным транспортом.
[0050] (12) Способ получения белка, где экспрессионная транскрипционная кассета по (5), рекомбинантный вектор экспрессии по (6) или рекомбинантная клетка-хозяин по любому из (7)-(8) выбрана для экспрессии белка; необязательно белок представляет собой белок, связанный с синтезом целевого продукта, белок, связанный с мембранным транспортом, или белок-регулятор экспрессии гена; необязательно белок представляет собой фермент, участвующий в синтезе L-лизина; необязательно ферменты участвующие в синтезе L-лизина включают одну или более аспартаткиназу, аспартатполуальдегиддегидрогеназу, аспартат-аммоний-лиазу, дигидродипиколинатсинтазу, дигидродипиколинатредуктазу, сукцинилдиаминопимелатаминотрансферазу, тетрагидродипиколинатсукцинилазу, сукцинилдиаминопимелатдеацилазу, эпимеразу диаминопимелиновой кислоты, деацилазу диаминопимелиновой кислоты, глицеральдегид-3-фосфатдегидрогеназу, транспортный белок лизина, транскетолазу, диаминопимелатдегидрогеназу и карбоксилазу пирувата; предпочтительно белок представляет собой диаминопимелатдегидрогеназу.
[0051] (13) Способ получения аминокислоты и ее производных, где экспрессионная транскрипционная кассета по (5), рекомбинантный вектор экспрессии по (6) или рекомбинантная клетка-хозяин по любому из (7)-(8) выбрана для экспрессии фермента, участвующего в синтезе аминокислоты и ее производных, и фермент, участвующий в синтезе аминокислоты и ее производных, использовали для получения аминокислоты и ее производных; необязательно, аминокислота и ее производные выбраны из одной или комбинации двух или более из: пролина, гидроксипролина, лизина, глутаминовой кислоты, аргинина, орнитина, глутамина, треонина, глицина, аланина, валина, лейцина, изолейцина, серина, цистеина, метионина, аспарагиновой кислоты, аспарагина, гистидина, фенилаланина, тирозина, триптофана, 5-аминолевулиновой кислоты или производных любой из вышеуказанных аминокислот;
[0052] предпочтительно аминокислота включает L-лизин и его производные, где производные включают по меньшей мере один одно пентандиамина, 5-аминопентановой кислоты и глутаровой кислоты;
[0053] предпочтительно фермент, участвующий в синтезе аминокислоты, представляет собой диаминопимелатдегидрогеназу.
[0054] Эффекты
[0055] В одном варианте осуществления настоящего изобретения предложен полинуклеотид, обладающий промоторной активностью, который является мутантом промотора гена диаминопимелатдегидрогеназы (гена ddh) со значительно улучшенной промоторной активностью. По сравнению с промотором гена ddh дикого типа, мутант обладает значительно улучшенной промоторной активностью, и функциональное лигирование его с целевым геном способно значительно улучшить интенсивность экспрессии целевого гена без разрушения стабильности генома, и целевой ген может быть стабильно и эффективно экспрессирован, и может быть реализована стабильная и эффективная продукция последующих продуктов.
[0056] В другом варианте осуществления настоящее изобретение относится к экспрессионной транскрипционной кассете, рекомбинантному вектору экспрессии и рекомбинантной клетке-хозяину, которые содержат вышеупомянутый полинуклеотид, обладающий промоторной активностью. В экспрессионной транскрипционной кассете, рекомбинантном векторе экспрессии и рекомбинантной клетке-хозяине полинуклеотид, обладающий промоторной активностью, функционально лигирован с геном, кодирующим белок, интенсивность экспрессии гена, кодирующего белок, может быть улучшена.
[0057] В другом варианте осуществления настоящее изобретение относится к способу получения аминокислоты, которая может усиливать экспрессию фермента для синтеза аминокислоты с использованием вышеупомянутого полинуклеотида, обладающего промоторной активностью, а затем аминокислота может быть получена стабильно и эффективно. При его использовании в производстве L-лизина может быть получен стабильный и высокопродуктивный L-лизин.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0058] На фиг. 1 показана схематическая диаграмма плазмид pEC-XK99E-Pddh-rfp.
[0059] На фиг. 2 показан результат флуоресценции, отображающий мутированные клоны, выращенные на культуральной чашке, а положение, отмеченное стрелкой на фигуре, указывает на отдельный клон, демонстрирующий высокоинтенсивную красную флуоресценцию.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0060] Определения
[0061] При использовании в комбинации с термином «содержащий» в формуле изобретения и/или описании, термины в единственном числе могут относиться к «одному» или относиться к «одному или более», «по меньшей мере одному» и «одному или более чем одному».
[0062] Как используется в формуле изобретения и описании, термин «содержать», «иметь/имеет», «включать» или «состоять» предназначен для включения или неограниченного использования и не исключает дополнительные или неуказанные элементы или стадии способа.
[0063] В настоящем документе термин «приблизительно» означает, что значение включает стандартное отклонение ошибки устройства или способа, используемого для измерения значения.
[0064] Применимо к содержанию, раскрытому в настоящем документе, что термин «или» определяется только как альтернативы и «и/или», но термин «или», используемый в настоящем документе, относится к «и/или», если явно не указано иное, является просто альтернативой или взаимным исключением между альтернативами.
[0065] Выбранный/необязательный/предпочтительный «числовой диапазон» при использовании в формуле изобретения или описании включает не только числовые конечные точки на обоих концах диапазона, но и все натуральные числа, охватываемые между предыдущими числовыми конечными точками в отношении этих числовых конечных точек.
[0066] В настоящем описании термин «полинуклеотид» относится к полимеру, состоящему из нуклеотидов. Полинуклеотид может быть в форме отдельного фрагмента или компонента более крупной структуры нуклеотидной последовательности, и он получен из нуклеотидной последовательности, отделенной по меньшей мере один раз по количеству или концентрации, и может быть распознан, обработан и восстановлен из последовательности и ее компонентных нуклеотидных последовательностей стандартными методами молекулярной биологии (например, с использованием вектора клонирования). Когда нуклеотидная последовательность представлена последовательностью ДНК (т.е. A, T, G, C), она также включает последовательность РНК (т.е. A, U, G, C), где «U» заменяет «T». Другими словами, «полинуклеотид» относится к нуклеотидному полимеру, который был удален из других нуклеотидов (отдельного фрагмента или целого фрагмента), или может быть составной частью или компонентом более крупной нуклеотидной структуры, такой как вектор экспрессии или полицистронная последовательность. Полинуклеотид включает последовательности ДНК, РНК и кДНК (комплементарная ДНК).
[0067] В настоящем описании термин «мутация» относится к нуклеотиду, который содержит мутации в одном или более (например, нескольких) положениях полинуклеотида и поддерживает промоторную активность полинуклеотида. В настоящем описании мутация (содержащая замену, вставку и/или делецию), в частности, относится к замене, что означает замену нуклеотида, занимающего положение с другим нуклеотидом. Делеция относится к удалению нуклеотида, занимающего определенное положение. Вставка относится к добавлению нуклеотида, прилегающего к нуклеотиду, занимающему положение, и непосредственно за ним.
[0068] В некоторых конкретных вариантах осуществления "мутация" в настоящем описании содержит нуклеотиды, замещенные в одном или более позициях 292-300 последовательности, представленной в SEQ ID NO: 9, и не содержит нуклеотид, замещенный ATGCATTGT в позициях 292-300 последовательности, представленной в SEQ ID NO: 9. Мутанты с нуклеотидами, замещенными в указанных положениях, обладают более высокой промоторной активностью, чем полинуклеотид с последовательностью, представленной в SEQ ID NO: 9.
[0069] Например, «мутация» в настоящем описании включает нуклеотиды, замещенные в 1, 2, 3, 4, 5, 6, 7, 8 или 9 положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9. В некоторых конкретных вариантах осуществления изобретения "мутация" в настоящем описании включает нуклеотиды, содержащие мутации в 4, 5, 6, 7, 8 или 9 положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9, предпочтительно нуклеотиды, включающие мутации в 6, 7, 8 или 9 положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9. Мутанты с нуклеотидами, замещенными в указанных положениях, обладают более высокой промоторной активностью, чем мутанты с нуклеотидами, замещенными в других положениях.
[0070] В настоящем описании термин «идентичность последовательности» и «процент идентичности» относятся к проценту нуклеотидов или аминокислот, которые являются одинаковыми (т.е. идентичными) между двумя или более полинуклеотидами или полипептидами. Идентичность последовательности между двумя или более полинуклеотидами или полипептидами может быть определена путем выравнивания нуклеотидных или аминокислотных последовательностей полинуклеотидов или полипептидов, оценки количества положений, в которых нуклеотидные или аминокислотные остатки идентичны в выровненных полинуклеотидах или полипептидах, и сравнения количества этих положений с количеством положений, в которых нуклеотидные или аминокислотные остатки отличаются в выровненных полинуклеотидах или полипептидах. Полинуклеотиды могут быть различными в одном положении, например, путем содержания другого нуклеотида (т.е. замены или мутации) или делеции нуклеотида (т.е. вставки нуклеотида или делеции нуклеотида в одном или двух полинуклеотидах). Полипептиды могут быть различными в одном положении, например, путем содержания другой аминокислоты (т.е. замены или мутации) или делеции аминокислоты (т.е. вставки аминокислоты или делеции аминокислоты в одном или двух полипептидах). Идентичность последовательности может быть рассчитана путем деления количества положений, в которых нуклеотидные или аминокислотные остатки идентичны, на общее количество нуклеотидных или аминокислотных остатков в полинуклеотиде или полипептиде. Например, процент идентичности можно рассчитать путем деления количества положений, в которых нуклеотидные или аминокислотные остатки идентичны, на общее количество нуклеотидных или аминокислотных остатков в полинуклеотиде или полипептиде и умножения результата на 100.
[0071] В некоторых конкретных вариантах осуществления изобретения полинуклеотид, обладающий промоторной активностью, содержит последовательности, обладающие по меньшей мере 90%-й, 91%-й, 92%-й, 93%-й, 94%-й, 95%-й, 96%-й, 97%-й, 98%-й, 99%-й и 100%-й идентичностью последовательности по сравнению с мутантом полинуклеотида, как указано в SEQ ID NO: 9. В настоящем описании наличие определенного процента идентичности последовательности означает, что у мутанта полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 9, имеется мутированная последовательность, которая может поддерживать или улучшать активность транскрипции мутанта.
[0072] В настоящем описании термин «промотор» относится к молекуле нуклеиновой кислоты, которая обычно расположена выше от кодирующей последовательности целевого гена, обеспечивая сайт распознавания РНК-полимеразы, и расположена выше в направлении 5’сайта инициации транскрипции иРНК. Это нетранслируемая последовательность нуклеиновой кислоты, с которой связывается РНК-полимераза и которая инициирует транскрипцию целевого гена. В синтезе рибонуклеиновой кислоты (РНК) промотор может взаимодействовать с факторами транскрипции и регулировать транскрипцию гена и контролировать время инициации и степень экспрессии гена (транскрипция), и он содержит коровую область промотора и регуляторную область, функционирует как «свитч» («switch»), определяет активность гена, а затем контролирует, какой тип белка начинает продуцировать клетка.
[0073] В настоящем описании термин «промоторная коровая область» относится к последовательности нуклеиновой кислоты, расположенной в промоторной области прокариот, и именно область коровой последовательности играет роль промотора, главным образом, включая область -35, область -10 и область между областью -35 и областью -10, и сайт инициации транскрипции, причем область -35 является сайтом распознавания РНК-полимеразы, а область -10 является сайтом связывания РНК-полимеразы.
[0074] В некоторых конкретных вариантах осуществления полинуклеотид, обладающий промоторной активностью по настоящему изобретению, может быть использован для инициирования экспрессии генов, кодирующих белок. В некоторых других вариантах осуществления полинуклеотид, обладающий промоторной активностью по настоящему изобретению, может быть использован для инициирования экспрессии некодирующих генов.
[0075] В настоящем описании термин «экспрессия» включает любую стадию, включающую продукцию РНК и продукцию белка, включая, но не ограничиваясь этим, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
[0076] В настоящем описании термин «ген, кодирующий белок» относится к молекуле ДНК, способной направлять синтез белка по определенным правилам, и процесс, посредством которого ген, кодирующий белок, направляющий синтез белка, обычно включает процесс транскрипции с использованием двухцепочечной ДНК в качестве матрицы и трансляцию с использованием иРНК в качестве матрицы. Ген, кодирующий белок, содержит последовательность CDS (кодирующая последовательность), направляющую продукцию иРНК, кодирующей белок. Ген, кодирующий белок, включает, но не ограничиваясь этим, гены, используемые для кодирования ферментов, участвующих в синтезе аминокислот. В некоторых вариантах осуществления ген, кодирующий белок, относится к кодированию фермента, участвующего в синтезе L-лизина. Фермент, участвующий в синтезе L-лизина, включает один или комбинацию двух или более из: аспартаткиназы, аспартатполуальдегиддегидрогеназы, аспартат-аммоний-лиазы, дигидродипиколинатсинтазу, дигидродипиколинатредуктазу, сукцинилдиаминопимелатаминотрансферазы, тетрагидродипиколинатсукцинилазы, сукцинилдиаминопимелатдеацилазы, эпимеразы диаминопимелиновой кислоты, деацилазы диаминопимелиновой кислоты, глицеральдегид-3-фосфатдегидрогеназы, транспортного белка лизина и транскетолазы, диаминопимелатдегидрогеназы и карбоксилазы пирувата. Полинуклеотид, обладающий промоторной активностью согласно настоящему изобретению, подходит для регулирования экспрессии целевого гена и осуществления эффективной продукции целевого продукта.
[0077] В настоящем описании термин «экспрессионная транскрипционная кассета» относится к виду экспрессионного элемента, содержащего регуляторный элемент транскрипции и целевой ген, и использует регуляторный элемент транскрипции для регулирования экспрессии целевого гена. В настоящем изобретении регуляторный элемент транскрипции содержит промотор и может дополнительно содержать такие элементы, как энхансер, сайленсер, инсулятор. В настоящем описании целевой ген конкретно представляет собой ген, кодирующий белок. «Функциональное лигирование» целевого гена с полинуклеотидом означает, что полинуклеотид, обладающий промоторной активностью, функционально лигируется с целевым геном для инициирования и опосредования транскрипции целевого гена, и функциональное лигирование может быть любым из способов, описанных специалистами в данной области техники.
[0078] В настоящем описании термин «вектор» относится к конструкции ДНК, содержащей последовательность ДНК, функционально лигированную с подходящими регуляторными последовательностями, для экспрессии целевого гена в подходящем хозяине. «Рекомбинантный вектор экспрессии» относится к структуре ДНК, используемой для экспрессии, например, полинуклеотида, кодирующего желаемый полипептид. Рекомбинантный вектор экспрессии может включать, например, i) набор генетических элементов, которые имеют регуляторные функции экспрессии генов, такие как промоторы и энхансеры; ii) структуру или кодирующую последовательность, транскрибируемую в иРНК и транслируемую в белок; и iii) субъединицы транскрипции, которые соответствующим образом транскрибировали и транслировали начальную и стоп-последовательности. Рекомбинантный вектор экспрессии сконструирован любым подходящим способом. Свойство вектора не критично, и может быть использован любой вектор, включая плазмиды, вирусы, фаги и транспозоны. Возможные векторы для применения в настоящем изобретении включают, но не ограничиваясь этим, хромосомные, нехромосомные и синтетические последовательности ДНК, такие как бактериальные плазмиды, фаговая ДНК, дрожжевые плазмиды и векторы, полученные из комбинаций плазмид и фаговой ДНК, и ДНК из вирусов, таких как вирус осповакцины, аденовирус, вирус оспы птиц, бакуловирус, SV40 (вирус обезьян 40) и вирус псевдорабиса и т.д.
[0079] Например, вектор, рассматриваемый в настоящем изобретении, представляет собой плазмиду pEC-XK99E-Pddh-rfp для характеризации интенсивности промотора гена ddh, сконструированную на основе плазмиды pEC-XK99E-rfp[1], и карта плазмиды pEC-XK99E-Pddh-rfp является такой, как показано на фиг. 1. На фиг. 1 Pddh представляет собой промотор гена ddh; ddh представляет собой ген диаминопимелатдегидрогеназы дикого типа; линкер представляет собой линкерный пептид, расположенный между геном ddh и белком rfp; rfp представляет собой красный флуоресцентный белок (RFP); Kan представляет собой устойчивый к канамицину. После трансформации в подходящего хозяина pEC-XK99E-Pddh-rfp может реплицироваться и функционировать независимо от генома хозяина или в некоторых случаях интегрироваться в геном клетки-хозяина как таковой.
[0080] В настоящем изобретении термин «клетка-хозяин» относится к любому типу клеток, которые легко трансформируются, трансфицируются, трансдуцируются и т.д., с элементом инициации транскрипции или вектором экспрессии, содержащим полинуклеотид по настоящему изобретению. Термин «рекомбинантная клетка-хозяин» охватывает клетку-хозяина, которая отличается от родительской клетки после введения элемента инициации транскрипции или рекомбинантного вектора экспрессии, и рекомбинантная клетка-хозяин специфически реализуется путем трансформации.
[0081] В настоящем описании термин «трансформация» имеет значение, в целом понятное специалистам в данной области техники, то есть способ введения экзогенной ДНК в хозяина. Способ трансформации включает любой способ введения нуклеиновой кислоты в клетку, включая, но не ограничиваясь этим, электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекцию, способ с применением полиэтиленгликоля (PEG), способ с применением DEAE-декстрана (DEAE - диэтиламиноэтил), катионный липосомный метод и метод DMSO-ацетата лития (DMSO - диметилсульфоксид).
[0082] Клетка-хозяин по настоящему изобретению может представлять собой прокариотическую клетку или эукариотическую клетку, если она представляет собой клетку, в которую может быть введен полинуклеотид, обладающий промоторной активностью по настоящему изобретению. В одном варианте осуществления клетка-хозяин относится к прокариотической клетке. В частности, клетка-хозяин получена из микроорганизма, подходящего для получения аминокислот путем ферментации, такого как род Corynebacterium, род Brevibacterium, род Arthrobacterium, род Microbacterium или род Escherichia. Предпочтительно клетка-хозяин представляет собой Corynebacterium glutamicum из рода Corynebacterium. Среди них Corynebacterium glutamicum может представлять собой Corynebacterium glutamicum ATCC 13032, Corynebacterium glutamicum ATCC 13869, Corynebacterium glutamicum ATCC 14067 или их производные штаммы.
[0083] В настоящем изобретении культивирование клетки-хозяина может быть осуществлено в соответствии с общепринятыми способами в данной области техники, включая, но не ограничиваясь этим, культивирование на планшете, культивирование со встряхиванием, периодическое культивирование, непрерывное культивирование и культивирование с подпиткой и т.д., и различные условия культивирования, такие как температура, время и значение рН культуральной среды, могут быть соответствующим образом скорректированы в соответствии с фактическими ситуациями.
[0084] Если не указано иное, все технические и научные термины в настоящем описании имеют те же значения, которые обычно понимаются специалистами в данной области техники, к которой относится настоящее изобретение.
[0085] Мутант промотора гена диаминопимелатдегидрогеназы
[0086] В настоящем изобретении используется промоторная последовательность гена диаминопимелатдегидрогеназы дикого типа (ddh) для мутации коровой промоторной последовательности гена ddh и для получения мутантов промотора гена диаминопимелатдегидрогеназы. Промоторная последовательность гена диаминопимелатдегидрогеназы является такой, как представлено в SEQ ID NO: 9, и мутанты промотора гена диаминопимелатдегидрогеназы содержат мутированные нуклеотиды в одном или более положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9, и нуклеотидные последовательности мутантов в позициях 290-300 последовательности, представленной в SEQ ID NO: 9, не выбраны из ATGCATTGT.
[0087] Было обнаружено, что мутанты промотора гена диаминопимелатдегидрогеназы представляют собой полинуклеотид, обладающий промоторной активностью, и мутанты промотора гена диаминопимелатдегидрогеназы обладают улучшенной промоторной активностью по сравнению с промотором гена диаминопимелатдегидрогеназы, имеющим последовательность, представленную в SEQ ID NO: 9.
[0088] В некоторых конкретных вариантах осуществления изобретения полинуклеотид, обладающий промоторной активностью, имеет по меньшей мере 90%-ю, 91%-ю, 92%-ю, 93%-ю, 94%-ю, 95%-ю, 96%-ю, 97%-ю, 98%-ю, 99%-ю, 100%-ю идентичность последовательности (включая все диапазоны и проценты между этими значениями) по сравнению с мутированной последовательностью промотора гена диаминопимелатдегидрогеназы и не включает последовательность, представленную в SEQ ID NO: 9.
[0089] В некоторых конкретных вариантах осуществления изобретения полинуклеотид, обладающий промоторной активностью, содержит мутированные нуклеотиды в 4, 5, 6, 7, 8 или 9 положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9, и обладает промоторной активностью выше, чем у последовательности, представленной в SEQ ID NO: 9, предпочтительно мутированные нуклеотиды в 6, 7, 8 или 9 положениях в позициях 292-300 последовательности, представленной в SEQ ID NO: 9.
[0090] В некоторых конкретных вариантах осуществления изобретения нуклеотидная последовательность позиций 292-300 полинуклеотида, обладающего промоторной активностью, выбрана из любой из следующих групп: (a) ACAAAAGGT; (b) TCTTCATCT; (c) GGAAAGTAT; (d) TTATTATAT; (e) TAATCCTCT; (f) TCAATTTAT; (g) GCGCAATCT; (h) CAGTTCCGT; (i) AAGTTTTAT; (g) TAAATGTAT; (k) GGATTGTAT; (l) CAAACTCAT; (m) TACAAATCT; (n) TATCAGTCT; (o) CGAGGATAT; (p) CCTTGTTAT. Полинуклеотид, обладающий промоторной активностью, содержит последовательности, представленные в любой из SEQ ID NO: 10-25. По сравнению с промотором гена диаминопимелатдегидрогеназы, имеющим последовательность, представленную в SEQ ID NO: 9, мутанты обладают промоторной активностью, повышенной 18 или более раз, предпочтительно 19 или более раз, предпочтительно 20 или более раз, предпочтительно 22 или более раз, предпочтительно 23 или более раз, предпочтительно 24 или более раз, предпочтительно 25 или более раз, предпочтительно 26 или более раз, более предпочтительно 27 или более раз, более предпочтительно 28 или более раз, более предпочтительно 30 или более и более предпочтительно 31 или более раз.
[0091] Построение рекомбинантного вектора экспрессии
[0092] В некоторых конкретных вариантах осуществления сначала конструировали рекомбинантный вектор, содержащий промотор гена диаминопимелатдегидрогеназы, а затем подвергали мутации коровую промоторную область гена ddh с получением рекомбинантного вектора экспрессии, содержащего полинуклеотид, обладающий промоторной активностью.
[0093] Для конструирования рекомбинантного вектора праймеры ddh-F и ddh-R конструировали по опубликованной геномной информации Corynebacterium glutamicum, а геном Corynebacterium glutamicum подвергали PCR-амплификации (PCR - полимеразная цепная реакция) с ddh-F и ddh-R для получения промоторной последовательности гена ddh.
[0094] Праймеры pEC-F и pEC-R сконструированы с использованием информации о плазмиде pEC-XK99E-rfp[1]. С плазмидой pEC-XK99E-rfp в качестве матрицы праймеры pEC-F и PEC-R используют для выполнения амплификации для получения фрагментов ДНК скелета pEC-XK99E, линкерных пептидов и красного флуоресцентного белка.
[0095] Амплифицированные фрагменты, полученные из праймеров ddh-F и ddh-R, и амплифицированные фрагменты, полученные из праймеров pEC-F и pEC-R, рекомбинантно лигированы с получением рекомбинантного экспрессионного вектора, связанного с полинуклеотидом, обладающим промоторной активностью (т.е. мутированной последовательностью промотора гена ddh).
[0096] Специфическим источником Corynebacterium glutamicum является Corynebacterium glutamicum ATCC 13032 (Gene ID: 2830649).
[0097] Процесс получения аминокислот
[0098] (1) В настоящем изобретении полинуклеотид, обладающий промоторной активностью, функционально лигировали с кодирующим геном фермента, участвующего в синтезе аминокислот, для получения рекомбинантного вектора экспрессии, способного синтезировать фермент, участвующий в синтезе аминокислот, и рекомбинантный вектор экспрессии использовали для трансформации клетки-хозяина с получением рекомбинантной клетки-хозяина.
[0099] (2) Рекомбинантная клетка-хозяин подвергается ферментативному культивированию, и аминокислоты собирали из рекомбинантной клетки-хозяина или культуральных бульонов рекомбинантной клетки-хозяина для завершения процесса производства аминокислот.
[00100] В указанном способе получения, поскольку полинуклеотид обладает улучшенной промоторной активностью, в рекомбинантной клетке-хозяине повышается транскрипционная активность кодирующего гена фермента, участвующего в синтезе аминокислот, и повышается уровень экспрессии фермента, участвующего в синтезе аминокислот, тем самым значительно повышается выход аминокислот.
[00101] Что касается полученных аминокислот, то аминокислоты включают L-лизин и его производные. Необязательно, аминокислота выбрана из одной или комбинации двух или более из следующих: пролина, гидроксипролина, лизина, глутаминовой кислоты, аргинина, орнитина, глутамина, треонина, глицина, аланина, валина, лейцина, изолейцина, серина, цистеина, метионина, аспарагиновой кислоты, аспарагина, гистидина, фенилаланина, тирозина, триптофана, 5-аминолевулиновой кислоты или производного любой из вышеуказанных аминокислот. Предпочтительно, производные включают по меньшей мере одно из пентандиамина, 5-аминопентановой кислоты и глутаровой кислоты.
[00102] Что касается фермента, участвующего в синтезе аминокислот, фермент, участвующий в синтезе аминокислот, представляет собой фермент, участвующий в синтезе L-лизина; предпочтительно фермент, участвующий в синтезе аминокислот, представляет собой диаминопимелатдегидрогеназу. Полинуклеотид, обладающий промоторной активностью, может значительно повышать транскрипционную активность диаминопимелатдегидрогеназы и значительно повышать уровень экспрессии диаминопимелатдегидрогеназы.
[00103] В некоторых вариантах осуществления клетка-хозяин в настоящем описании может представлять собой штамм любого типа, обладающий способностью продуцировать целевой продукт, включая штаммы дикого типа и рекомбинантные штаммы. Например, клетка-хозяин получена из микроорганизмов, подходящих для ферментативной продукции целевого продукта, такого как аминокислота и ее производные, например, Enterobacterium, Corynebacterium, Brevibacterium, Arthrobacterium, Microbacterium и т.д.
[00104] В некоторых предпочтительных вариантах осуществления клетка-хозяин представляет собой Enterobacterium или Corynebacterium, более предпочтительно Corynebacterium glutamicum, включая, но не ограничиваясь этим, Corynebacterium glutamicum ATCC 13032, Corynebacterium glutamicum ATCC 13869, Corynebacterium glutamicum B253, Corynebacterium glutamicum ATCC 14067 и производные штаммы, продуцирующие L-аминокислоты, полученные из вышеуказанных штаммов.
[00105] В некоторых конкретных вариантах осуществления клетка-хозяин представляет собой Corynebacterium glutamicum, важный штамм для продуцирования L-лизина. После модификации Corynebacterium glutamicum с использованием полинуклеотида, экспрессионная транскрипционная кассета или рекомбинантного вектора экспрессии, обладающего промоторной активностью, уровень экспрессии фермента, участвующего в синтезе L-лизина в Corynebacterium glutamicum, значительно увеличивается, в частности, уровень экспрессии диаминопимелатдегидрогеназы значительно увеличивается, что приводит к гораздо более высокой способности к ферментативной продукции L-лизина в Corynebacterium glutamicum.
[00106] В некоторых конкретных вариантах осуществления рекомбинантная клетка-хозяин представляет собой Corynebacterium glutamicum, модифицированную следующим образом: 1) мутированная кодирующая последовательность T311I вводится в кодирующий ген аспартаткиназы в Corynebacterium glutamicum; 2) коровая область из позиций 279-317 промотора гена пируваткарбоксилазы в Corynebacterium glutamicum представляет собой CGGGCCTTTGAAGACATTATTAGATTATTATTATTATTATTAG; 3) полинуклеотид, обладающий промоторной активностью, функционально лигируется с геном, кодирующим диаминопимелатдегидрогеназу, а затем вводится в Corynebacterium glutamicum. Corynebacterium glutamicum, модифицированный вышеуказанным способом, представляет собой высокопродуктивный штамм L-лизина.
[00107] В частности, кодирующие гены аспартаткиназы, пируваткарбоксилазы и диаминопимелатдегидрогеназы могут быть выделены и вставлены в экспрессионный вектор для продуцирования трансформации, где в клетке-хозяине вектор экспрессии может реплицироваться и экспрессировать ферменты независимо от клетки-хозяина или в некоторых случаях интегрироваться в геном клетки-хозяина. В данной области техники известны способы манипулирования микроорганизмами, как описано в таких публикациях, как Current Protocols in Molecular Biology (Online ISBN: 9780471142720, John Wiley и Sons, Inc.), Microbial Metabolic Engineering: Methods and Protocols (Qiong Cheng Ed., Springer) и Systems Metabolic Engineering: Methods and Protocols (Hal S.Alper Ed.,Springer).
[00108] В некоторых других вариантах осуществления клетка-хозяин может также представлять собой другие виды штаммов, продуцирующих аминокислоты. «Штамм, продуцирующий аминокислоты» в настоящем описании относится к штамму, который может продуцировать аминокислоты и накапливать аминокислоты, когда бактерии культивируют в культуральной среде, или секретировать аминокислоты в культуральную среду, то есть штамм, который может получать внеклеточные свободные аминокислоты. Например, это может быть природный штамм, продуцирующий аминокислоты, или модифицированный штамм, продуцирующий аминокислоты, полученный путем генетической модификации.
[00109] В качестве примера, клетка-хозяин представляет собой лизин-продуцирующую клетку-хозяина. В некоторых вариантах осуществления лизин-продуцирующая клетка-хозяин может содержать, но не ограничиваясь этим, один или более генов, выбранных из следующих, которые ослаблены или снижены в экспрессии:
[00110] a. ген adhE, кодирующий этанолдегидрогеназу;
[00111] b. ген ackA, кодирующий ацетаткиназу;
[00112] c. ген pta, кодирующий фосфат ацетилтрансферазу;
[00113] d. ген ldhA, кодирующий лактатдегидрогеназу;
[00114] e. ген focA, кодирующий транспортер формиата;
[00115] f. ген pflB, кодирующий пируватформиат-лиазу;
[00116] g. ген poxB, кодирующий пируват-оксидазу;
[00117] h. ген thrA, кодирующий бифункциональный фермент аспартаткиназы I/гомосериндегидрогеназы I;
[00118] i. ген thrB, кодирующий гомосеринкиназу;
[00119] j. ген ldcC, кодирующий лизиндекарбоксилазу; и
[00120] h. ген cadA, кодирующий лизиндекарбоксилазу.
[00121] В некоторых вариантах осуществления лизин-продуцирующая клетка-хозяин может содержать, но не ограничиваясь этим, один или более генов, выбранных из следующих, которые повышены или сверхэкспрессированы:
[00122] a. ген dapA, кодирующий дигидродипиридинсинтазу, которая ослабляет ингибирование лизина по типу обратной связи;
[00123] b. ген dapB, кодирующий дигидродипиколинатредуктазу;
[00124] c. ген ddh, кодирующий диаминопимелатдегидрогеназу;
[00125] d. dapD, кодирующий тетрагидродипиколинатсукцинилазу, и dapE, кодирующий сукцинилдиаминопимелатдеацилазу;
[00126] e. ген asd, кодирующий аспартат-семиальдегиддегидрогеназу;
[00127] f. ген ppc, кодирующий фосфоенолпируваткарбоксилазу;
[00128] g. ген pntAB, кодирующий никотинамидадениндинуклеотидтрансгидрогеназу;
[00129] i. ген lysE, кодирующий транспортный белок лизина.
[00130] В качестве примера, клетка-хозяин представляет собой клетку-хозяина, продуцирующую треонин. В некоторых вариантах осуществления треонин-продуцирующая клетка-хозяин представляет собой штамм, который экспрессирует ген LysC аспартаткиназы, который ослабляет ингибирование обратной связи на основе Corynebacterium glutamicum ATCC 13032. В некоторых других вариантах осуществления изобретения клетка-хозяин, продуцирующая треонин, также может представлять собой другие штаммы, обладающие способностью продуцировать треонин.
[00131] В некоторых вариантах осуществления лизин-продуцирующая клетка-хозяин может содержать, но не ограничиваясь этим, один или более генов, выбранных из следующих, которые повышены или сверхэкспрессированы:
[00132] a. ген thrABC, кодирующий треониновый оперон;
[00133] b. ген hom, кодирующий гомосериндегидрогеназу, который ослабляет ингибирование обратной связи;
[00134] c. ген gap, кодирующий глицеральдегид-3-фосфатдегидрогеназу;
[00135] d. ген pyc, кодирующий пируваткарбоксилазу;
[00136] e. ген mqo, кодирующий малат:хинон-оксидоредуктазу;
[00137] f. ген tkt, кодирующий транскетолазу;
[00138] g. ген gnd, кодирующий 6-фосфоглюконатдегидрогеназу;
[00139] h. ген thrE, кодирующий экспортер треонина;
[00140] i. ген eno, кодирующий енолазу.
[00141] В качестве примера, клетка-хозяин представляет собой изолейцин-продуцирующую клетку-хозяина. В некоторых вариантах осуществления данного изобретения изолейцин-продуцирующая клетка-хозяин представляет собой штамм, который продуцирует L-изолейцин путем замены аминокислоты в позиции 323 гена ilvA L-треониндегидратазы на аланин. В некоторых других вариантах осуществления изобретения клетка-хозяин, продуцирующая изолейцин, может также представлять собой другие типы штаммов, обладающих способностью продуцировать изолейцин.
[00142] В качестве примера, клетка-хозяин представляет собой O-ацетилгомосерин-продуцирующую клетку-хозяина. В некоторых вариантах осуществления O-ацетилгомосерин-продуцирующая клетка-хозяин представляет собой штамм, который продуцирует O-ацетилгомосерин путем инактивации O-ацетилгомосерин (тиол)-лиазы. В некоторых других вариантах осуществления клетка-хозяин, продуцирующая O-ацетилгомосерин, также может представлять собой другие типы штаммов, обладающих способностью продуцировать O-ацетилгомосерин.
[00143] В качестве примера, клетка-хозяин представляет собой продуцирующую метионин клетку-хозяина. В некоторых вариантах осуществления данного изобретения продуцирующая метионин клетка-хозяин представляет собой штамм, который продуцирует метионин путем инактивации регуляторов транскрипции метионина и цистеина. В некоторых других вариантах осуществления данного изобретения продуцирующая метионин клетка-хозяин может также представлять собой другие типы штаммов, обладающих способностью продуцировать метионин.
[00144] В некоторых конкретных вариантах осуществления условия культивирования рекомбинантных клеток-хозяев являются следующими: сначала Corynebacterium glutamicum инокулировали в жидкую среду TSB (триптон-соевый бульон) и культивировали в течение 8 часов, а культуру инокулировали в виде семян в 24-луночный планшет с 800 мкл ферментационной среды/лунку и, при начальной OD (оптическая плотность), контролируемой как около 0,1, культивировали при 30°С в течение 17 часов при скорости вращения встряхивателя планшетов 800 об/мин.
[00145] Ингредиенты жидкой среды TSB следующие: глюкоза, 5 г/л; дрожжевой порошок, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота, 0,5 г/л; K2HPO4 3H2O, 1 г/л; MgSO4·7H2O, 0,1 г/л; биотин, 0,01мг/л; витамин B1,0,1 мг/л; MOPS (3-морфолинопропансульфоновая кислота), 20 г/л.
[00146] Ингредиенты ферментационной среды следующие: глюкоза, 80 г/л; дрожжевой порошок, 1 г/л; соевый пептон, 1 г/л; NaCl, 1 г/л; сульфат аммония, 1 г/л; мочевина, 10 г/л; K2HPO4 3H2O, 1 г/л; MgSO4·7H2O, 0,45г/л; FeSO4·7H2O, 0,05г/л; биотин, 0,4 мг/л; витамин B1, 0,1 мг/л; MOPS, 40 г/л; начальный pH 7,2.
[00147] В некоторых конкретных вариантах осуществления аминокислоты могут быть выделены из рекомбинантных клеток-хозяев или культуральных бульонов рекомбинантных клеток способами, обычно используемыми в данной области техники, включая, но не ограничиваясь этим, фильтрацию, анионообменную хроматографию, кристаллизацию и HPLC (высокоэффективная жидкостная хроматография).
[00148] Примеры
[00149] Другие объекты, признаки и преимущества настоящего изобретения будут очевидны из нижеследующего подробного описания изобретения. Однако следует понимать, что подробное описание и конкретные примеры (хотя и с указанием конкретных вариантов осуществления настоящего изобретения) приведены только для пояснения, поскольку различные вариации и модификации в рамках сущности и объема настоящего изобретения станут очевидными для специалистов в данной области техники после прочтения подробного описания.
[00150] Экспериментальные методы и способы, используемые в примерах, являются обычными техническими методами, если не указано иное. Например, экспериментальные методы, для которых конкретные условия не указаны в следующих примерах, обычно соответствуют обычным условиям, таким как те, которые описаны в Molecular Cloning: Laboratory Manual (New York: Cold Spring Harbor Laboratory Press, 1989), Sambrook и др., или предложены производителями. Если не указано иное, материалы и реагенты, используемые в примерах, могут быть получены через официальные коммерческие каналы.
[00151] Пример 1. Конструирование плазмиды для характеризации интенсивности промотора гена ddh Corynebacterium glutamicum
[00152] Чтобы охарактеризовать интенсивность промотора гена ddh Corynebacterium glutamicum, в настоящем примере сначала сконструировали вектор для характеризации, лигирующий промотор гена ddh и фрагмент гена ddh на основе скелета плазмиды pEC-XK99E, а ген ddh, линкерный пептид и ген красного флуоресцентного белка (rfp) экспрессировали с использованием промотора гена ddh. Подробная информация приводится ниже.
[00153] (1) Праймеры ddh-F и ddh-R были сконструированы в соответствии с опубликованной последовательностью генома Corynebacterium glutamicum ATCC13032 (Gene ID: 2830649) и информацией об аннотации гена ddh, используя геном ATCC 13032 в качестве матрицы, промотор гена ddh и фрагмент гена ddh были получены с помощью PCR-амплификации. Нуклеотидная последовательность амплифицированного фрагмента представлена в SEQ ID NO: 34.
[00154] (2) Фрагменты ДНК скелета плазмиды pEC-XK99E, линкерного пептида и гена красного флуоресцентного белка амплифицировали с использованием плазмиды PEC-XK99E-rfp в качестве матрицы и pEC-F и pEC-R в качестве праймеров. Нуклеотидная последовательность амплифицированного фрагмента представлена в SEQ ID NO: 35.
[00155] Амплифицированный фрагмент генома Corynebacterium glutamicum ATCC13032 и амплифицированный фрагмент плазмиды pEC-XK99E-rfp клонировали и лигировали с помощью набора для одношагового клонирования Vazyme с получением вектора для характеризации pEC-XK99E-Pddh-rfp, из которого карта плазмид показана на фиг. 1. Последовательности праймеров, используемых выше, показаны в Таблице 1, а информация о последовательности линкерного пептида показана в Таблице 2.
[00156] Пример 2. Скрининг и характеризация интенсивности мутантов промотора гена ddh Corynebacterium glutamicum
[00157] (1) Конструирование мутантной библиотеки промотора гена ddh Corynebacterium glutamicum
[00158] В настоящем примере коровая область
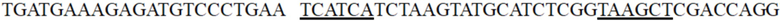
промотора гена ddh Corynebacterium glutamicum была мутирована, при этом подчеркнутые части представляют собой основные последовательности области -35 и области -10 промотора, соответственно. В настоящем примере мутацию 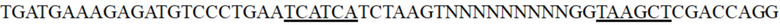
проводили в соответствующем положении вышеуказанной коровой области, два фрагмента плазмиды амплифицировали с использованием ddh-M1, ddh-M2, ddh-M3 и ddh-M4 праймеров, соответственно, и клонировали и лигировали с помощью одношагового набора для клонирования Vazyme. Все полученные клоны собирали и плазмиды экстрагировали с получением библиотеки мутированного промотора гена ddh. Для сравнения с мутированными промоторами ddh, уже опубликованными в предшествующем уровне техники, авторы изобретения сконструировали такой же мутированный промотор ddh, как описано в литературном источнике 3 (CN101939432A), на основе плазмиды pEC-XK99E-Pddh-rfp. В частности, последовательность коровой промоторной области представляет собой 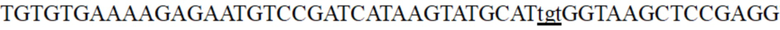 , где подчеркнутая часть представляет собой мутированные сайты, описанные в литературном источнике 3. Corynebacterium glutamicum ATCC13032 трансформировали вышеуказанной библиотекой, мутированной pEC-XK99E-Pddh-x-rfp в уровне техники и контрольной pEC-XK99E-Pddh-rfp дикого типа, полученным в Примере 1, соответственно, и нанесли на планшет TSB. Планшет, на котором выращивали сотни клонов, был визуализирован с помощью флуоресценции с помощью системы флуоресцентной визуализации, и мутанты с улучшенной интенсивностью экспрессии были предварительно скринированы в соответствии с яркостью флуоресценции клонов. На фиг. 2 показана флуоресцентное изображение мутированных клонов, выращенных на культуральном планшете, в которой положение со стрелкой представляет собой индивидуальный клон, демонстрирующий высокую интенсивность красной флуоресценции. Ингредиенты (г/л) среды планшета TSB являются следующими: глюкоза, 5 г/л; дрожжевой порошок, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота, 0,5 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,1 г/л; биотин, 0,01мг/л; витамин B1, 0,1 мг/л; MOPS, 20 г/л; порошок агара, 15 г/л. В настоящем примере было предварительно скринировано более 10 000 клонов, и было получено около 20 мутантов со значительно повышенной интенсивностью флуоресценции. Последовательности используемых выше праймеров показаны в Таблице 3.
, где подчеркнутая часть представляет собой мутированные сайты, описанные в литературном источнике 3. Corynebacterium glutamicum ATCC13032 трансформировали вышеуказанной библиотекой, мутированной pEC-XK99E-Pddh-x-rfp в уровне техники и контрольной pEC-XK99E-Pddh-rfp дикого типа, полученным в Примере 1, соответственно, и нанесли на планшет TSB. Планшет, на котором выращивали сотни клонов, был визуализирован с помощью флуоресценции с помощью системы флуоресцентной визуализации, и мутанты с улучшенной интенсивностью экспрессии были предварительно скринированы в соответствии с яркостью флуоресценции клонов. На фиг. 2 показана флуоресцентное изображение мутированных клонов, выращенных на культуральном планшете, в которой положение со стрелкой представляет собой индивидуальный клон, демонстрирующий высокую интенсивность красной флуоресценции. Ингредиенты (г/л) среды планшета TSB являются следующими: глюкоза, 5 г/л; дрожжевой порошок, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота, 0,5 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,1 г/л; биотин, 0,01мг/л; витамин B1, 0,1 мг/л; MOPS, 20 г/л; порошок агара, 15 г/л. В настоящем примере было предварительно скринировано более 10 000 клонов, и было получено около 20 мутантов со значительно повышенной интенсивностью флуоресценции. Последовательности используемых выше праймеров показаны в Таблице 3.
[00159] (2) Характеризация интенсивности библиотеки мутированного промотора гена ddh Corynebacterium glutamicum
[00160] Все мутанты с повышенной интенсивностью флуоресценции, наблюдаемой на вышеуказанных планшетах, культивировали в 96-луночном планшете для характеризации интенсивности промоторов. Ингредиенты (г/л) жидкой среды TSB следующие: глюкоза, 5 г/л; дрожжевой порошок, 5 г/л; соевый пептон, 9 г/л; мочевина, 3 г/л; янтарная кислота, 0,5 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,1 г/л; биотин, 0,01 мг/л; витамин B1, 0,1 мг/л; MOPS, 20 г/л. Штаммы, полученные в результате скрининга, контроля дикого типа и контроля предшествующего уровня техники, инокулировали зубочистками в 96-луночный планшет, содержащий 200 мкл жидкой культуральной среды TSB в каждой лунке, с тремя параллельными штаммами для каждого штамма. При скорости вращения встряхивателя планшета 800 об/мин после культивирования при 30°С в течение 24 часов определяли интенсивности флуоресценции штаммов и секвенировали штаммы с улучшенной интенсивностью флуоресценции по сравнению с контролем дикого типа. Некоторые мутированные промоторы имели одинаковую последовательность, и, наконец, были успешно получены 16 различных мутированных промоторов со значительно улучшенной интенсивностью экспрессии, и результаты показаны в Таблице 4, в которой промоторы, полученные в настоящем описании, последовательно пронумерованы от Pddh-1 до Pddh-16. Активности промоторов от Pddh-1 до Pddh-16 была увеличена примерно в 18-31 раз, обеспечивая обильное количество элементов для модификации экспрессии генов, таких как ddh и т.д.
[00161] Интенсивность флуоресценции мутированного промотора ddh (Pddh-x) литературного источника 3 была обнаружена вышеуказанным способом, и результат показан в таблице 4. Активность Pddh-x была увеличена только в 15 раз по сравнению с промотором дикого типа, и интенсивность экспрессии промотора по настоящему изобретению была улучшена на 15-101% по сравнению с активностью промотора, описанного в предшествующем уровне техники, и, следовательно, это является существенным прогрессом.
[00162] Пример 3. Применение мутированных промоторов гена ddh Corynebacterium glutamicum в продукции лизина
[00163] (1) Конструирование рекомбинантных векторов мутированного промотора гена ddh Corynebacterium glutamicum
[00164] Согласно заявленной последовательности генома Corynebacterium glutamicum ATCC13032, расположенные до и после гомологичные плечи мутированных промоторов Pddh-1, Pddh-10 и Pddh-16 подвергали PCR-амплификации с использованием генома ATCC13032 в качестве матрицы и с использованием ddh-UF/ddh-UR и ddh-DF1/ddh-DR, ddh-UF/ddh-UR и ddh-DF10/ddh-DR, ddh-UF/ddh-UR и ddh-DF16/ddh-DR в качестве праймеров, соответственно; тем временем, скелет pK18mobsacB (GenBank: FJ437239.1) усиливали с использованием pK18-1/2 в качестве праймеров. Вышеуказанные две группы фрагментов PCR были выделены, а затем лигированы с помощью набора для одношагового клонирования Vazyme, и были получены рекомбинантные векторы pK18-Pddh-1, pK18-Pddh-10 и pK18-Pddh-16 с мутированными промоторами, соответственно. Последовательности используемых выше праймеров перечислены в Таблице 5.
[00165] (2) Конструирование мутированного промотора гена ddh штамма, продуцирующего лизин Corynebacterium glutamicum
[00166] Лизин-продуцирующий штамм Corynebacterium glutamicum SCgL37 (штамм, в котором мутированная кодирующая последовательность T311I (основание, мутированное из ACC в ATC), введена в кодирующий ген аспартаткиназы в Corynebacterium glutamicum ATCC13032, и коровая область в позициях 279-317 промотора гена пируваткарбоксилазы мутирована в CGGGCCTTTGATGAGAGAGACATTATATATATATATATATATATATATAG) была трансформирована рекомбинантными векторами pK18-Pddh-1, pK18-Pddh-10 и pK18-Pddh-16, сконструированными выше, и нанесены на твердую среду LBHIS, содержащую 5 г/глюкозу и 25 мкг/мл канамицина, и культивирована при 30°C для получения первого рекомбинантного превращения. Правильные первичные рекомбинантные трансформанты инокулировали в среду LB (лизогенный бульон), содержащую 5 г/л глюкозы, культивировали в течение ночи и разводили и покрывали на планшетах с твердой средой LB, к которым добавляли 100 г/л сахарозы, соответственно, для проведения скрининга, и получали штаммы SCgL38, SCgL39 и SCgL40 с мутантным по промотору ddh, были получены соответственно.
[00167] (3) Оценка продуцирующей способности L-лизина мутированного промотора гена ddh штаммов, продуцирующих лизин Corynebacterium glutamicum
[00168] Чтобы проверить влияние мутации промотора ddh в Corynebacterium glutamicum на продукцию L-лизина, были проведены ферментационные тесты на штаммах SCgL37, SCgL38, SCgL39 и SCgL40 соответственно. Ингредиенты ферментационной среды следующие: глюкоза, 80 г/л; дрожжевой порошок, 1 г/л; соевый пептон, 1 г/л; NaCl, 1 г/л; сульфат аммония, 1 г/л; мочевина, 10 г/л; K2HPO4·3H2O, 1 г/л; MgSO4·7H2O, 0,45г/л; FeSO4·7H2O, 0,05 г/л; биотина, 0,4 мг/л; витамин B1, 0,1 мг/л; MOPS, 40 г/л; исходный pH 7,2. Во-первых, штаммы инокулировали в жидкую среду TSB для культивирования в течение 8 часов, и культуры инокулировали в виде семян в 24-луночный планшет, содержащий 800 мкл ферментационной среды в каждой лунке. Начальную OD600 контролировали при около 0,1, и культивирование проводили при 30°С в течение 17 часов при скорости вращения встряхивателя планшета 800 об/мин с тремя параллельными штаммами для каждого штамма. После ферментации измеряли выход L-лизина и потребление глюкозы и рассчитывали скорость превращения глюкозы из глюкозы в L-лизин. Результаты показаны в Таблице 6, которая показывает, что штаммы с мутированными промоторами ddh имели повышенный выход лизина и повышенную скорость конверсии глюкоза-кислота, и увеличение было более значительным с увеличением интенсивности промотора. Приведенные выше результаты показывают, что мутанты с повышенной интенсивностью экспрессии промотора ddh могут быть применены к продукции L-лизина.
[00169] Поскольку синтез последующих продуктов L-лизина полностью зависит от стадий реакции, катализируемых диаминопимелатдегидрогеназой, выход последующих продуктов также может быть увеличен путем повышения экспрессии гена ddh мутантами промотора гена ddh по настоящему изобретению. Таким образом, техническое решение, представленное в настоящем описании, также может быть использовано для получения последующих продуктов L-лизина, таких как пентандиамин, 5-аминовалеровая кислота, глутаровая кислота и т.д.
[00170] Все технические признаки, раскрытые в данном описании, могут комбинироваться любым способом. Каждый признак, раскрытый в этом описании, также может быть заменен другим признаком, имеющим такую же, равную или аналогичную функцию. Следовательно, если не указано иное, каждый признак, раскрытый в настоящем документе, является просто примером ряда равных или схожих признаков.
[00171] Кроме того, в соответствии с вышеприведенным описанием настоящего изобретения специалисты в данной области техники могут легко понять ключевые признаки настоящего изобретения, и в настоящее изобретение могут быть внесены многие модификации для адаптации к различным целям и условиям использования без отступления от сущности и объема настоящего изобретения, и поэтому такие модификации также подпадают под объем прилагаемой формулы изобретения.
Литературный источник:
[1] Wang, YC и др. Screening efficient constitutive promoters in Corynebacterium glutamicum based on time-series transcriptome analysis. Chinese Journal of Biotechnology, 2018, 34(11):1760 - 1771.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ТЯНЬЦЗИНЬ ИНСТИТЬЮТ ОФ ИНДАСТРИАЛ БАЙОТЕКНОЛОДЖИ, ЧАЙНИЗ
ЭКЭДЕМИ ОФ САЙЕНСИЗ
<120> ПОЛИНУКЛЕОТИД, ОБЛАДАЮЩИЙ ПРОМОТОРНОЙ АКТИВНОСТЬЮ,
И ПРИМЕНЕНИЕ ПОЛИНУКЛЕОТИДА ДЛЯ ПОЛУЧЕНИЯ АМИНОКИСЛОТЫ
<130> 6A17-2073508IB
<150> CN202010838604.9
<151> 2020-08-19
<160> 38
<170> SIPOSequenceListing 1.0
<210> 1
<211> 42
<212> ДНК
<213> Corynebacterium glutamicum
<400> 1
cctgatgcgg tattttctcc gtgcgtggcg agttttacaa ag 42
<210> 2
<211> 21
<212> ДНК
<213> Corynebacterium glutamicum
<400> 2
gacgtcgcgt gcgatcagat c 21
<210> 3
<211> 84
<212> ДНК
<213> Плазмида
<400> 3
atctgatcgc acgcgacgtc ggcggtggct ctggaggtgg tgggtccggc ggtggctctg 60
cttcctccga agacgttatc aaag 86
<210> 4
<211> 21
<212> ДНК
<213> Плазмида
<400> 4
ggagaaaata ccgcatcagg c 21
<210> 5
<211> 51
<212> ДНК
<213> Corynebacterium glutamicum
<400> 5
ccctgaatca tcatctaagt nnnnnnnnng gtaagctcga ccaggacagt g 51
<210> 6
<211> 25
<212> ДНК
<213> Corynebacterium glutamicum
<400> 6
aaccttccat acgaactttg aaacg 25
<210> 7
<211> 23
<212> ДНК
<213> Corynebacterium glutamicum
<400> 7
caaagttcgt atggaaggtt ccg 23
<210> 8
<211> 22
<212> ДНК
<213> Corynebacterium glutamicum
<400> 8
acttagatga tgattcaggg ac 22
<210> 9
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 9
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tatgcatctc 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 10
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 10
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tacaaaaggt 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 11
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 11
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag ttcttcatct 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 12
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 12
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tggaaagtat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 13
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 13
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tttattatat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 14
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 14
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag ttaatcctct 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 15
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 15
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag ttcaatttat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 16
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 16
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tgcgcaatct 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 17
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 17
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tcagttccgt 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 18
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 18
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag taagttttat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 19
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 19
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag ttaaatgtat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 20
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 20
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tggattgtat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 21
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 21
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tcaaactcat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 22
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 22
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag ttacaaatct 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 23
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 23
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag ttatcagtct 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 24
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 24
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tcgaggatat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 25
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 25
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tccttgttat 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 361
<210> 26
<211> 41
<212> ДНК
<213> Corynebacterium glutamicum
<400> 26
caggaaacag ctatgacatg ttccagccat cgccaaataa g 41
<210> 27
<211> 22
<212> ДНК
<213> Corynebacterium glutamicum
<400> 27
acttagatga tgattcaggg ac 22
<210> 28
<211> 51
<212> ДНК
<213> Corynebacterium glutamicum
<400> 28
ccctgaatca tcatctaagt acaaaaggtg gtaagctcga ccaggacagt g 51
<210> 29
<211> 51
<212> ДНК
<213> Corynebacterium glutamicum
<400> 29
ccctgaatca tcatctaagt taaatgtatg gtaagctcga ccaggacagt g 51
<210> 30
<211> 51
<212> ДНК
<213> Corynebacterium glutamicum
<400> 30
ccctgaatca tcatctaagt ccttgttatg gtaagctcga ccaggacagt g 51
<210> 31
<211> 43
<212> ДНК
<213> Corynebacterium glutamicum
<400> 31
tgtaaaacga cggccagtgc tgtactggac tgccttttga acg 43
<210> 32
<211> 19
<212> ДНК
<213> Плазмида
<400> 32
gcactggccg tcgttttac 19
<210> 33
<211> 24
<212> ДНК
<213> Плазмида
<400> 33
catgtcatag ctgtttcctg tgtg 24
<210> 34
<211> 1331
<212> ДНК
<213> Corynebacterium glutamicum
<400> 34
cctgatgcgg tattttctcc gtgcgtggcg agttttacaa agaaccccac atcatcaatg 60
cctaaatggc gggtattttc atccaaaccc aaccgcgcat cattccaatg ctgatccacc 120
ccatccggat aaaccaccat gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc 180
cccacagatc ctgactgctg ggagccatga aaatagatca gcgcatccgt ggtggaacca 240
aaaggctcaa caatacgaaa cgttcgcttt cggtcctgat gaaagagatg tccctgaatc 300
atcatctaag tatgcatctc ggtaagctcg accaggacag tgccaccaca attttggagg 360
attacaagaa catgaccaac atccgcgtag ctatcgtggg ctacggaaac ctgggacgca 420
gcgtcgaaaa gcttattgcc aagcagcccg acatggacct tgtaggaatc ttctcgcgcc 480
gggccaccct cgacacaaag acgccagtct ttgatgtcgc cgacgtggac aagcacgccg 540
acgacgtgga cgtgctgttc ctgtgcatgg gctccgccac cgacatccct gagcaggcac 600
caaagttcgc gcagttcgcc tgcaccgtag acacctacga caaccaccgc gacatcccac 660
gccaccgcca ggtcatgaac gaagccgcca ccgcagccgg caacgttgca ctggtctcta 720
ccggctggga tccaggaatg ttctccatca accgcgtcta cgcagcggca gtcttagccg 780
agcaccagca gcacaccttc tggggcccag gtttgtcaca gggccactcc gatgctttgc 840
gacgcatccc tggcgttcaa aaggcagtcc agtacaccct cccatccgaa gacgccctgg 900
aaaaggcccg ccgcggcgaa gccggcgacc ttaccggaaa gcaaacccac aagcgccaat 960
gcttcgtggt tgccgacgcg gccgatcacg agcgcatcga aaacgacatc cgcaccatgc 1020
ctgattactt cgttggctac gaagtcgaag tcaacttcat cgacgaagca accttcgact 1080
ccgagcacac cggcatgcca cacggtggcc acgtgattac caccggcgac accggtggct 1140
tcaaccacac cgtggaatac atcctcaagc tggaccgaaa cccagatttc accgcttcct 1200
cacagatcgc tttcggtcgc gcagctcacc gcatgaagca gcagggccaa agcggagctt 1260
tcaccgtcct cgaagttgct ccatacctgc tctccccaga gaacttggac gatctgatcg 1320
cacgcgacgt c 1331
<210> 35
<211> 5938
<212> ДНК
<213> Плазмида
<400> 35
atctgatcgc acgcgacgtc ggcggtggct ctggaggtgg tgggtccggc ggtggctctg 60
cttcctccga agacgttatc aaagagttca tgcgtttcaa agttcgtatg gaaggttccg 120
ttaacggtca cgagttcgaa atcgaaggtg aaggtgaagg tcgtccgtac gaaggtaccc 180
agaccgctaa actgaaagtt accaaaggtg gtccgctgcc gttcgcttgg gacatcctgt 240
ccccgcagtt ccagtacggt tccaaagctt acgttaaaca cccggctgac atcccggact 300
acctgaaact gtccttcccg gaaggtttca aatgggaacg tgttatgaac ttcgaagacg 360
gtggtgttgt taccgttacc caggactcct ccctgcaaga cggtgagttc atctacaaag 420
ttaaactgcg tggtaccaac ttcccgtccg acggtccggt tatgcagaaa aaaaccatgg 480
gttgggaagc ttccaccgaa cgtatgtacc cggaagacgg tgctctgaaa ggtgaaatca 540
aaatgcgtct gaaactgaaa gacggtggtc actacgacgc tgaagttaaa accacctaca 600
tggctaaaaa accggttcag ctgccgggtg cttacaaaac cgacatcaaa ctggacatca 660
cctcccacaa cgaagactac accatcgttg aacagtacga acgtgctgaa ggtcgtcact 720
ccaccggtgc ttaactgcag gcatgcaagc ttggctgttt tggcggatga gagaagattt 780
tcagcctgat acagattaaa tcagaacgca gaagcggtct gataaaacag aatttgcctg 840
gcggcagtag cgcggtggtc ccacctgacc ccatgccgaa ctcagaagtg aaacgccgta 900
gcgccgatgg tagtgtgggg tctccccatg cgagagtagg gaactgccag gcatcaaata 960
aaacgaaagg ctcagtcgaa agactgggcc tttcgtttta tctgttgttt gtcggtgaac 1020
gctctcctga gtaggacaaa tccgccggga gcggatttga acgttgcgaa gcaacggccc 1080
ggagggtggc gggcaggacg cccgccataa actgccaggc atcaaattaa gcagaaggcc 1140
atcctgacgg atggcctttt tgcgtttcta caaactcttt ttgtttattt ttctaaatac 1200
attcaaatat gtatccgctc atgaattaat tccgctagat gacgtgcggc ttcgacctcc 1260
tgggcgtggc gcttgttggc gcgctcgcgg ctggctgcgg cacgacacgc gtctgagcag 1320
tattttgcgc gccgtcctcg tgggtcaggc cggggtggga tcaggccacc gcagtaggcg 1380
cagctgatgc gatcctccac tactgcgcgt cctcctggcg ctgccgagca cgcagctcgt 1440
cggccagctc ttcaaggtcg gccacaagcg tttctaggtc gctcgcggca cttgcccagt 1500
cgcgtgatgc tggcgcgtct gtcgtatcga gggcgcggaa aaatccgatc accgttttta 1560
aatcgacggc ggcatcgagt gcgtcggact ccagcgcgac atcggagaga tccaccgctg 1620
atgcttcagg ccagttttgg tacttcgtcg tgaaggtcat gacaccatta taacgaacgt 1680
tcgttaaaaa ttctagcccc aattctgata atttcttccg gcactcctgc gaaaacctgc 1740
gagacttctt gcccagaaaa aacgccaagc gcagcggtta ccgcactttt tttccaggtg 1800
atttcaccct gaccagcgaa gcggcacttt agtgcatgag gtgtgcccct ggtttcccct 1860
ctttggaggg ttcaacccaa aaaagcacac aagcaaaaat gaaaatcatc atgagcaagt 1920
tggtgcgaag cagcaacgcg ctagctccaa aaaggtctcc aggatctcga ggagattttt 1980
gagggggagg gagtcgagga agagccagag cagaaggcgg ggaaccgttc tctgccgaca 2040
gcgtgagccc cccttaaaaa tcaggccggg gaggaaccgg ggagggatca gagctaggag 2100
cgagacaccc taaagggggg gaaccgtttt ctgctgacgg tgtttcgttt attagttttc 2160
agcccgtgga tagcggaggg tgagggcaag tgagagccag agcaaggacg ggacccctaa 2220
aggggggaac cgttttctgc tgacggtgtt tcgtttatta gttttcagcc cgtggacggc 2280
cgcgtttagc ttccattcca agtgcctttc tgacttgttg gatgcgcctt tcactgacac 2340
ctagttcgcc tgcaagctca cgagtcgagg gatcagcaac cgattgagaa cgggcatcca 2400
ggatcgcagt tttgacgcga agttcgagca actcgcctgt catttctcgg cgtttgtttg 2460
cttccgctaa tcgctgtcgc gtctcctgcg catacttact ttctgggtca gcccatctgc 2520
gtgcattcga tgtagctgcg ccccgtcgcc ccatcgtcgc tagagctttc cgccctcggc 2580
tgctctgcgt ttccacccga cgagcaggga cgactggctg gcctttagcc acgtagccgc 2640
gcacacgacg cgccatcgtc aggcgatcac gcatggcggg aagatccggc tcccggccgt 2700
ctgcaccgac cgcctgggca acgttgtacg ccacttcata cgcgtcgatg atcttggcat 2760
cttttaggcg ctcaccagca gctttgagct ggtatcccac ggtcaacgcg tggcgaaacg 2820
cggtctcgtc gcgcgctcgc tctggatttg tccagagcac tcgcacgccg tcgatcaggt 2880
cgccggacgc gtccagggcg ctcggcaggc tcgcgtccaa aatcgctagc gccttggctt 2940
ctgcggtggc gcgttgtgcc gcttcaatgc gggcgcgtcc gctggaaaag tcctgctcaa 3000
tgtacttttt cggcttctgt gatccggtca tcgttcgagc aatctccatt aggtcggcca 3060
gccgatccac acgatcatgc tggcagtgcc atttataggc tgtcggatcg tctgagacgt 3120
gcagcggcca ccggctcagc ctatgcgaaa aagcctggtc agcgccgaaa acacgagtca 3180
tttcttccgt cgttgcagcc agcaggcgca tatttgggct ggttttacct gctgcggcat 3240
acaccgggtc aatgagccag atgagctggc atttcccgct cagcggattc acgccgatcc 3300
aagccggcgc tttttctagg cgtgcccatt tctctaaaat cgcgtagacc tgcgggttta 3360
cgtgctcaat cttcccgccg gcctggtggc tgggcacatc gatgtcaagc acgatcaccg 3420
cggcatgttg cgcgtgcgtc agcgcaacgt actggcaccg cgtcagcgct tttgagccag 3480
cccggtagag ctttggttgg gtttcgccgg tatccgggtt tttaatccag gcgctcgcga 3540
aatctcttgt cttgctgccc tggaagcttt cgcgtcccag gtgagcgagc agttcgcggc 3600
gatcttctgc cgtccagccg cgtgagccgc agcgcatagc ttcggggtgg gtgtcgaaca 3660
gatcggcgga caatttccac gcgctagctg tgactgtgtc ctgcggatcg gctagagtca 3720
tgtcttgagt gctttctccc agctgatgac tgggggttag ccgacgccct gtgagttccc 3780
gctcacgggg cgttcaactt tttcaggtat ttgtgcagct tatcgtgttt tcttcgtaaa 3840
tgaacgctta actaccttgt taaacgtggc aaataggcag gattgatggg gatctagctt 3900
cacgctgccg caagcactca gggcgcaagg gctgctaaag gaagcggaac acgtagaaag 3960
ccagtccgca gaaacggtgc tgaccccgga tgaatgtcag ctactgggct atctggacaa 4020
gggaaaacgc aagcgcaaag agaaagcagg tagcttgcag tgggcttaca tggcgatagc 4080
tagactgggc ggttttatgg acagcaagcg aaccggaatt gccagctggg gcgccctctg 4140
gtaaggttgg gaagccctgc aaagtaaact ggatggcttt cttgccgcca aggatctgat 4200
ggcgcagggg atcaagatct gatcaagaga caggatgagg atcgtttcgc atgattgaac 4260
aagatggatt gcacgcaggt tctccggccg cttgggtgga gaggctattc ggctatgact 4320
gggcacaaca gacaatcggc tgctctgatg ccgccgtgtt ccggctgtca gcgcaggggc 4380
gcccggttct ttttgtcaag accgacctgt ccggtgccct gaatgaactc caagacgagg 4440
cagcgcggct atcgtggctg gccacgacgg gcgttccttg cgcagctgtg ctcgacgttg 4500
tcactgaagc gggaagggac tggctgctat tgggcgaagt gccggggcag gatctcctgt 4560
catctcacct tgctcctgcc gagaaagtat ccatcatggc tgatgcaatg cggcggctgc 4620
atacgcttga tccggctacc tgcccattcg accaccaagc gaaacatcgc atcgagcgag 4680
cacgtactcg gatggaagcc ggtcttgtcg atcaggatga tctggacgaa gagcatcagg 4740
ggctcgcgcc agccgaactg ttcgccaggc tcaaggcgcg gatgcccgac ggcgaggatc 4800
tcgtcgtgac ccatggcgat gcctgcttgc cgaatatcat ggtggaaaat ggccgctttt 4860
ctggattcat cgactgtggc cggctgggtg tggcggaccg ctatcaggac atagcgttgg 4920
ctacccgtga tattgctgaa gagcttggcg gcgaatgggc tgaccgcttc ctcgtgcttt 4980
acggtatcgc cgctcccgat tcgcagcgca tcgccttcta tcgccttctt gacgagttct 5040
tctgagcggg actctggggt tcgcggaatc atgaccaaaa tcccttaacg tgagttttcg 5100
ttccactgag cgtcagaccc cgtagaaaag atcaaaggat cttcttgaga tccttttttt 5160
ctgcgcgtaa tctgctgctt gcaaacaaaa aaaccaccgc taccagcggt ggtttgtttg 5220
ccggatcaag agctaccaac tctttttccg aaggtaactg gcttcagcag agcgcagata 5280
ccaaatactg tccttctagt gtagccgtag ttaggccacc acttcaagaa ctctgtagca 5340
ccgcctacat acctcgctct gctaatcctg ttaccagtgg ctgctgccag tggcgataag 5400
tcgtgtctta ccgggttgga ctcaagacga tagttaccgg ataaggcgca gcggtcgggc 5460
tgaacggggg gttcgtgcac acagcccagc ttggagcgaa cgacctacac cgaactgaga 5520
tacctacagc gtgagctatg agaaagcgcc acgcttcccg aagggagaaa ggcggacagg 5580
tatccggtaa gcggcagggt cggaacagga gagcgcacga gggagcttcc agggggaaac 5640
gcctggtatc tttatagtcc tgtcgggttt cgccacctct gacttgagcg tcgatttttg 5700
tgatgctcgt caggggggcg gagcctatgg aaaaacgcca gcaacgcggc ctttttacgg 5760
ttcctggcct tttgctggcc ttttgctcac atgttctttc ctgcgttatc ccctgattct 5820
gtggataacc gtattaccgc ctttgagtga gctgataccg ctcgccgcag ccgaacgacc 5880
gagcgcagcg agtcagtgag cgaggaagcg gaagagcgcc tgatgcggta ttttctcc 6134
<210> 36
<211> 13
<212> ПРТ
<213> Corynebacterium glutamicum
<400> 36
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10
<210> 37
<211> 39
<212> ДНК
<213> Corynebacterium glutamicum
<400> 37
ggcggtggct ctggaggtgg tgggtccggc ggtggctct 39
<210> 38
<211> 351
<212> ДНК
<213> Corynebacterium glutamicum
<400> 38
gtgcgtggcg agttttacaa agaaccccac atcatcaatg cctaaatggc gggtattttc 60
atccaaaccc aaccgcgcat cattccaatg ctgatccacc ccatccggat aaaccaccat 120
gaacggcaac ggatcaaaag tcctgttggt gaagctgcgc cccacagatc ctgactgctg 180
ggagccatga aaatagatca gcgcatccgt ggtggaacca aaaggctcaa caatacgaaa 240
cgttcgcttt cggtcctgat gaaagagatg tccctgaatc atcatctaag tatgcattgt 300
ggtaagctcg accaggacag tgccaccaca attttggagg attacaagaa c 351
<---

Группа изобретений относится к области молекулярной биологии и биоинженерии. Предложены полинуклеотид, обладающий промоторной активностью, экспрессионная транскрипционная кассета, рекомбинантный вектор экспрессии и рекомбинантная клетка-хозяин, а также способ повышения экспрессии целевого гена, способ получения аминокислот. Полинуклеотид, обладающий промоторной активностью, является мутантом полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 9. Промоторная активность мутанта значительно повышена, тем самым способствуя стабильной и эффективной экспрессии целевого гена при сохранении стабильности генома. 7 н. и 5 з.п. ф-лы, 2 ил., 6 табл., 3 пр.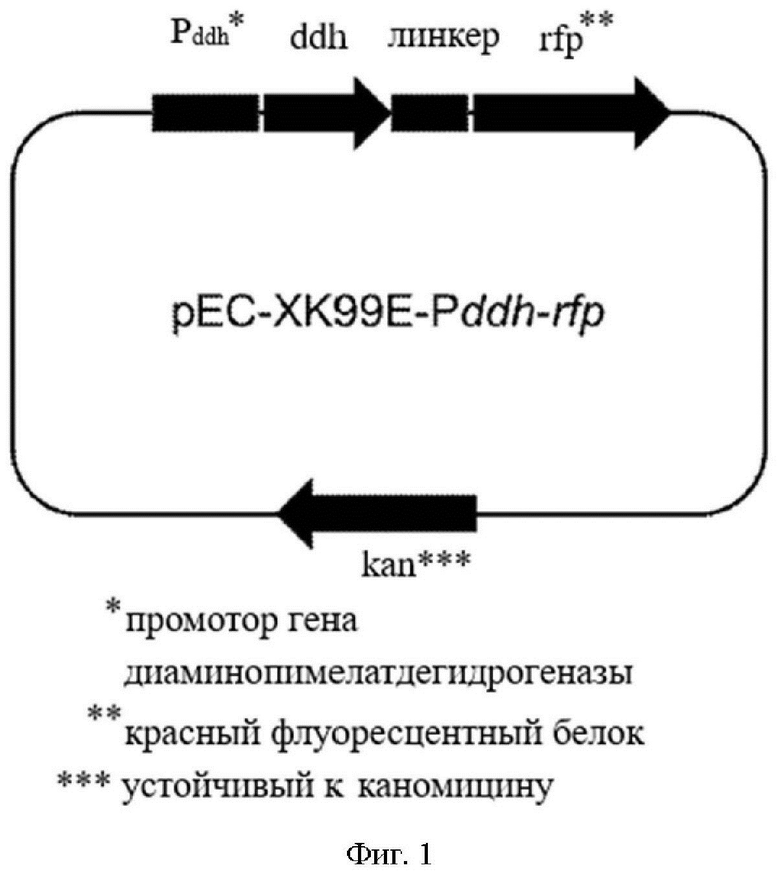
1. Полинуклеотид, обладающий промоторной активностью, где полинуклеотид представляет собой мутант полинуклеотида, имеющего последовательность, представленную в SEQ ID NO: 9, причем мутант имеет в позициях 292-300 последовательности, представленной в SEQ ID NO: 9, нуклеотидную последовательность, выбранную из любой из следующих групп:
(a) ACAAAAGGT;
(b) TCTTCATCT;
(c) GGAAAGTAT;
(d) TTATTATAT;
(e) TAATCCTCT;
(f) TCAATTTAT;
(g) GCGCAATCT;
(h) CAGTTCCGT;
(i) AAGTTTTAT;
(g) TAAATGTAT;
(k) GGATTGTAT;
(l) CAAACTCAT;
(m) TACAAATCT;
(n) TATCAGTCT;
(o) CGAGGATAT;
(p) CCTTGTTAT.
2. Полинуклеотид, обладающий промоторной активностью, по п. 1, где мутант обладает повышенной промоторной активностью в 18 или более раз по сравнению с полинуклеотидом, имеющим последовательность, представленную в SEQ ID NO: 9.
3. Экспрессионная транскрипционная кассета, содержащая полинуклеотид, обладающий промоторной активностью, по любому из пп. 1, 2.
4. Экспрессионная транскрипционная кассета по п. 3, которая дополнительно содержит ген, кодирующий белок, который функционально лигирован с полинуклеотидом, обладающим промоторной активностью.
5. Экспрессионная транскрипционная кассета по п. 4, где белок представляет собой фермент, участвующий в синтезе аминокислоты и ее производных.
6. Рекомбинантный вектор экспрессии, содержащий полинуклеотид, обладающий промоторной активностью, по любому из пп. 1, 2, или экспрессионную транскрипционную кассету по любому из пп. 3-5.
7. Рекомбинантный вектор экспрессии по п. 6, содержащий экспрессионную транскрипционную кассету по п. 5.
8. Рекомбинантная клетка-хозяин для продуцирования аминокислоты и ее производных, содержащая экспрессионную транскрипционную кассету по п. 5 или рекомбинантный вектор экспрессии по п. 7.
9. Рекомбинантная клетка-хозяин по п. 8, которая относится к роду Corynebacterium, роду Brevibacterium, роду Arthrobacterium, роду Microbacterium или роду Escherichia; предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum; более предпочтительно, клетка-хозяин представляет собой Corynebacterium glutamicum ATCC 13032, Corynebacterium glutamicum ATCC 13869, Corynebacterium glutamicum ATCC 14067 или их производные штаммы.
10. Применение рекомбинантного вектора экспрессии по п. 7 или рекомбинантной клетки-хозяина по любому из пп. 8, 9 при получении аминокислоты и ее производных;
необязательно аминокислота и ее производные выбраны из одного или комбинации двух или более из следующего: пролина, гидроксипролина, лизина, глутаминовой кислоты, аргинина, орнитина, глутамина, треонина, глицина, аланина, валина, лейцина, изолейцина, серина, цистеина, метионина, аспарагиновой кислоты, аспарагина, гистидина, фенилаланина, тирозина, триптофана, 5-аминолевулиновой кислоты или производных любой из вышеуказанных аминокислот;
предпочтительно аминокислота включает L-лизин и его производные, где производные включают по меньшей мере одно из пентандиамина, 5-аминопентановой кислоты и глутаровой кислоты.
11. Способ повышения экспрессии целевого гена, включающий стадию функционального лигирования полинуклеотида, обладающего промоторной активностью, по любому из пп. 1, 2, с целевой РНК или целевым геном; причем необязательно целевая РНК содержит по меньшей мере одну из тРНК (транспортная РНК) и мРНК (малая РНК), а целевой ген содержит по меньшей мере один из гена, кодирующего белок, связанный с синтезом целевого продукта, гена, кодирующего белок-регулятор экспрессии гена, и гена, кодирующего белок, связанный с мембранным транспортом.
12. Способ получения аминокислоты и ее производных, включающий осуществление экспрессии фермента, участвующего в синтезе аминокислоты и ее производных, при помощи экспрессионной транскрипционной кассеты по п. 5, рекомбинантного вектора экспрессии по п. 7 или рекомбинантной клетки-хозяина по любому из пп. 8, 9, и использование фермента, участвующего в синтезе аминокислоты и ее производных, для получения аминокислоты и ее производных; необязательно аминокислота и ее производные выбраны из одного или комбинации двух или более из: пролина, гидроксипролина, лизина, глутаминовой кислоты, аргинина, орнитина, глутамина, треонина, глицина, аланина, валина, лейцина, изолейцина, серина, цистеина, метионина, аспарагиновой кислоты, аспарагина, гистидина, фенилаланина, тирозина, триптофана, 5-аминолевулиновой кислоты или производных любой из вышеуказанных аминокислот;
предпочтительно аминокислота включает L-лизин и его производные, где производные включают по меньшей мере один из пентандиамина, 5-аминопентановой кислоты и глутаровой кислоты;
предпочтительно фермент, участвующий в синтезе аминокислоты, представляет собой диаминопимелатдегидрогеназу.
| JP 2009261262 A, 12.11.2009 | |||
| DONG X., ZHAO Y., HU J., LI Y., WANG X | |||
| Attenuating l-lysine production by deletion of ddh and lysE and their effect on l-threonine and l-isoleucine production in Corynebacterium glutamicum | |||
| Enzyme Microb Technol | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| BOYLE-VAVRA S., DE JONGE B.L., EBERT | |||
Авторы
Даты
2024-03-25—Публикация
2021-07-15—Подача