ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к первичным (то есть не перезаряжаемым) и вторичным (то есть перезаряжаемым) батареям, в которых, по меньшей мере, анод содержит магний и факультативно электролит и катод также содержат магний, а также к способам получения указанных батарей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Как известно, огромное и быстрое развитие цифровой электроники, которое имеет место в последние годы, обеспечило возможность создания большого числа новых портативных приборов, например, компьютеров, сотовых телефонов, видеокамер и так далее. Эти приборы почти исключительно оборудованы аккумуляторными батареями, полученными по одной технологии; а именно кадмиево-никелевыми (Ni -Cd) батареями.
Необходимость получения еще более миниатюрных портативных приборов, имеющих даже еще меньшую массу, вместе с необходимостью длительной автономности работы таких устройств толкает многочисленные частные фирмы, работающие в этой области техники, а также бюджетные исследовательские организации проводить исследования, направленные на разработку новых технологий, способных соответствовать требованиям, перечисленным выше.
В конце восьмидесятых годов и в начале девяностых годов прошлого столетия на рынке появилось два новых типа батарей: металлогидрид-никелевые (Ni-MH) и ионно-литиевые (Li-ion) батареи.
Только через несколько лет рабочие характеристики батарей, полученных с использованием этих технологий, значительно увеличились и в настоящее время рабочие характеристики этих батарей превосходят рабочие характеристики кадмиево-никелевых батарей.
Дополнительное преимущество батарей, получаемых с помощью этих новых технологий, заключается в отсутствии кадмия, который, поскольку он является тяжелым металлом, оказывает очень серьезное вредное воздействие на окружающую среду.
Как известно, ионно-литиевые батареи в энергетическом отношении еще являются самыми перспективными, но их себестоимость относительно высока. Однако если рассматривать затраты в расчете на цикл эксплуатации этих систем, то можно отметить, что они становятся конкурентоспособными по сравнению с более экономичными кадмиево-никелевыми батареями. На основе технических характеристик, влияния на окружающую среду и затрат в расчете на цикл эксплуатации на международном рынке ожидается значительный рост ионно-литиевых батарей.
С другой стороны, рост металлогидрид-никелевых батарей должен быть более скромным, тогда как оценивается, что кадмиево-никелевые батареи вряд ли сохранят свои нынешние уровни производства.
Международный сценарий свидетельствует о концентрации большей части производства в секторе ионно-литиевых батарей, которые являются эволюцией литиевых систем.
Первичные литиевые батареи, которые нашли широкое применение в калькуляторах, настенных и наручных часах, электрокардиостимуляторах сердца и так далее, изготавливают с литиевым анодом и катодом, выполненным из окислов переходных металлов (например, MnO2). Благодаря высокому электрохимическому потенциалу, обеспечиваемому литиевым анодом, такие батареи обеспечивают высокие напряжения элементов и, следовательно, также высокие плотности энергии.
Однако эти системы не являются обратимыми или в большинстве случаев применимы только для нескольких циклов.
Идея использования лития для получения вторичных батарей подросла до первой технологии, известной как полимерно-литиевой (Li-полимер) технологии. Однако этот способ, в котором используют металлический литий для получения анода, имеет серьезные трудности в отношении обратимости. В течение фазы перезарядки на поверхности анода образуются дендритные осадки, которые являются результатом химической реакции лития с органическим полимерным электролитом и ответственными за быстрое ухудшение качества (старение) этого типа батарей.
В лучшем случае число циклов, получаемых при использовании систем этого типа, составляет только несколько дюжин или сотен.
С другой стороны, реакционная способность лития в отношении полимерного электролита также может стать причиной серьезных проблем, связанных с надежностью в период эксплуатации самой батареи.
Следующим этапом в разработке таких устройств был этап введения так называемой ионно-литиевой технологии, которая основана на использовании технических приемов, которые склонны решать проблему образования дендритов на литиевом аноде путем замены лития композиционными материалами, способными внедрять ион Li+ в их структуру с помощью реакций интеркалирования (включения).
В последние годы стало возможным получать аноды на основе углерода со свойствами интеркалирования. Некоторые углероды с регулярной структурой (турбостатической или поддающейся графитированию) или с высоко кристаллической структурой (натуральные или синтетические графиты) фактически могут интеркалировать ион Li+ в свои слои обратимым образом, давая, таким образом, увеличение комплексов типа LixC6.
Другие ионно-литиевые батареи предусматривают с интеркалированным анодом на основе двусернистого титана (LixTiS2). Такой анод имеет свойства, аналогичные свойствам углеродного электрода.
Как правило, вместо этого катод получают при использовании окислов лития и переходных металлов, среди которых наиболее широко используемым до настоящего времени является кобальтат лития (LiCoO2), который по причине стоимости, доступности и токсичности стремятся заменять никколатом лития (LiNiO2) или манганитом лития (LiMnO4).
Число циклов, получаемых при использовании ионно-литиевой технологии, достигает одной тысячи.
Как правило, в этих системах электролит состоит из органического полимера со свойствами растворителя, который приобретает ионную проводимость благодаря легированию специальными солями лития (например, LiPF6, LiClO4 и так далее).
Хотя вышеуказанные успехи позволяют решать проблемы, связанные с трудностями использования лития из-за высокой реакционной способности этого элемента, и, в частности, с основной проблемой, связанной с образованием дендритов на аноде, для полного решения этих проблем нужно провести еще много исследований. Проблема образования дендритов еще не решена полностью, в то время как проблема высокой реакционной способности лития вместе с известными вышеуказанными проблемами надежности и проблема обратимости еще остается открытой.
Магний может стать элементом, пригодным для преодоления этих проблем, в частности такой как замена лития.
Как сообщалось в технической литературе, ряд исследователей, например Фаррингтон и Чернг, делали попытку разработки полимерных электролитов на основе магния для возможного создания магниевых батарей, но однако не получили достаточно хороших результатов. Полученные полимерные электролиты фактически имели проводимости, которые при комнатной температуре слишком высоки (то есть проводимости менее 10-6 Сименс/см) для получения первичных и/или вторичных батарей.
Тем не менее, в патенте US 44575, выданном Моултону, предлагается возможность получения магниевых батарей, однако без определения последовательности технологических операций, в частности без определения того, как получить анод, катод и полимерный электролит. Делается ссылка на полимерные электролиты, легированные солями магния, которые при испытании при комнатной температуре давали удельное сопротивление более 107 Ом·см, тогда как для получения батарей необходимо, чтобы величина удельного сопротивления была ниже 105 Ом·см.
Основной задачей настоящего изобретения является успешная разработка первичных (не перезаряжаемых) батарей и/или вторичных (перезаряжаемых) батарей, которые не имеют недостатков, связанных с реакционной способностью и обратимостью, которые являются типичными для батарей на основе лития.
В рамках вышеуказанной задачи логически последовательной целью должна быть разработка батарей с высокими техническими характеристиками, взаимосвязанными с уменьшением себестоимости.
Другой важной целью является разработка миниатюрных батарей, имеющих малую массу.
Еще одной целью является разработка батарей, пригодных для применения в портативных цифровых электронных приборах.
Важной дополнительной целью является почти полное исключение оказания отрицательного влияния на окружающую среду.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Эти и другие цели, которые станут более очевидными из приведенного ниже описания, достигаются посредством получения первичных (неперезаряжаемых) и вторичных (перезаряжаемых) батарей (аккумуляторов), которые являются объектом настоящего изобретения, содержащих, по меньшей мере, один анод, по меньшей мере, один катод, по меньшей мере, один электролит и токосъемники, причем указанные батареи отличаются тем, что, по меньшей мере, анод и также электролит содержат магний. Катод батарей, который является объектом настоящего изобретения, также может факультативно содержать магний.
Анод, соответствующий настоящему изобретению, отличается тем, что в нем используется магний в различных состояниях окисления Mgn+ (n+=0,1+,2+), факультативно соединенный с металлическим магнием, а электролит, содержащий магний, отличается тем, что содержит в качестве ионных разновидностей хлориды магния в δ-форме в растворителях, включающих в себя полимерные растворители, которые способны давать электролиты, имеющие хорошую ионную проводимость и способные сольватировать указанные ионные разновидности.
Если катод содержит магний, то он является разновидностью магния в состоянии окисления 2+ и может иметь подложку из высоко проводящих неорганических или органических материалов или еще может быть интеркалирован или внедрен в высокопроводящие неорганические или органические материалы.
Дополнительным объектом настоящего изобретения являются способы получения указанных первичных и вторичных батарей, содержащих, по меньшей мере, один анод, по меньшей мере, один катод, по меньшей мере, один электролит, расположенный между анодом и катодом и электросоединительные токосъемники, причем указанные батареи отличаются тем, что, по меньшей мере, анод и электролит содержат магний и даже катод может факультативно содержать магний.
Дополнительные характеристики и преимущества настоящего изобретения станут вполне очевидными из следующего подробного описания настоящего изобретения, вариант осуществления которого иллюстрируется только с целью обеспечения неограничивающего примера, причем подробное описание сделано со ссылкой на прилагаемый сопроводительный чертеж.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖА
чертеж - схематический разрез батареи, полученной в соответствии с настоящим изобретением, в которой
позицией 10 обозначен анод, который имеет такие свойства и выполнен так, как подробно описано ниже;
позицией 11 обозначен катод, который имеет такие свойства и выполнен так, как подробно описано ниже;
позицией 12 обозначен электролит, который имеет такие свойства и выполнен так, как подробно описано ниже.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Несмотря на то, что попытки, на которые делалась ссылка выше, не дали обещающих результатов, авторы настоящего изобретения с удивлением обнаружили, что магний является элементом, который может быть эффективно использован при получении первичных и вторичных батарей.
В результате обширного и подробного исследования авторы настоящего изобретения установили, что для целей настоящего изобретения, то есть для получения первичных и вторичных батарей с техническими характеристиками, которые сравнимы, если не превосходят технические характеристики литиевых батарей, известных или нашедших в настоящее время применение, указанные батареи, иллюстрируемые на приведенном чертеже и являющиеся объектом настоящего изобретения, могут быть первичными и вторичными батареями, содержащими, по меньшей мере, один анод, по меньшей мере, один катод, по меньшей мере, один электролит, расположенный между анодом и катодом, и токосъемники, причем указанные батареи отличаются тем, что, по меньшей мере, анод и также электролит содержат магний.
В указанных батареях, которые являются объектом настоящего изобретения, катод также может факультативно содержать магний.
Если катод не содержит магния, то он является обычным катодом и, следовательно, является известным самим по себе и, следовательно, не будет дополнительно описан в этой заявке.
Первичные и вторичные батареи, которые являются объектом настоящего изобретения, могут, кроме того, содержать возможные диэлектрические прокладки, которые не показаны на сопроводительном чертеже.
В частности, батареи, соответствующие настоящему изобретению, могут содержать анод 10, отличающийся тем, что в нем используется магний в различных состояниях окисления Mgn+ (n*=0,1+,2+) факультативно соединенный с металлическим магнием.
В указанном аноде магний может содержаться как таковой или он может иметь подложку из высокопроводящих неорганических или органических материалов или еще из высокопроводящих неорганических или органических материалов, которые способны поглощать посредством интеркалирования или внедрения в их собственные матрицы кристаллиты магния меньших размеров или монокристаллы магния.
В частности, анод 10 может состоять из металлического магния как такового и в этом случае магний может быть использован в ламинированном или спеченном виде.
В том случае, когда вместо этого магний может иметь подложку из высоко проводящих материалов, то эти материалы могут быть неорганическими веществами, выбранными из группы, состоящей из металлов, например алюминия, меди и других эквивалентных металлов или окислов, сплавов и тканей, полученных из них. Указанные высокопроводящие материалы подложки могут быть также органическими веществами, а также веществами полимерного типа; причем в последнем случае они могут быть выбраны из таких материалов, как ткани из углеродного волокна, графита или даже из композиционных материалов на основе графита или других эквивалентных материалов, пригодных для этих целей.
Также в том случае, когда для анода используют материалы интеркалирования или внедрения, то они могут быть органическими или неорганическими веществами. Материалами интеркалирования или внедрения, которые могут быть использованы для целей настоящего изобретения, являются химические соединения переходных металлов, химические соединения щелочных металлов и химические соединения щелочноземельных металлов, а также химические соединения неметаллов, выбранные из группы, содержащей окислы, сульфиды, фосфаты или фосфиды, например окислы вольфрама (WyOx), оксиды железа (FeyOx), сульфиды титана (TiySx), оксиды кобальта (СОуОх), оксиды никеля (NiyOx), оксиды марганца (MnyOx) или еще другие эквивалентные химические соединения или вещества на основе углерода со свойствами интеркалирования и с высоко кристаллической структурой, или нерегулярной структурой, или эквивалентные вещества, или еще вещества полимерного типа, например полимеры на основе углерода или эквивалентные полимеры, которые способны поглощать благодаря интеркалированию или внедрению в их собственные матрицы кристаллиты магния меньших размеров или монокристаллы магния.
Кроме того, указанный анод 10 может быть факультативно окислен окислителями, например газообразным кислородом или перекисью, например перекисью водорода Н2O2 или органическими перекисями, и стабилизированы посредством обработки стабилизирующими веществами, например металлоалкоголятами (например, тетраалкоксититаном, тетраалкоксисиланами, триалкоксиалюминием, тетраалкоксицирконием или диалкоксиматием или эквивалентными химическими соединениями).
Катод 11 отличается тем, что он содержит разновидности магния с состоянием окисления 2+.
В том случае, если катод содержит магний, то последний может иметь подложку из высоко проводящих неорганических или органических веществ, включая полимерные вещества, или еще магний может быть интеркалирован или внедрен в неорганические или органические вещества. Вещества, которые могут быть использованы как в случае, где магний имеет подложку, так и в случае, где магний интеркалирован или внедрен, являются веществами, которые аналогичны веществам, описанным ранее для анода.
Этот тип катода может быть использован при диспергировании активного вещества в пористую и проводящую матрицу. Такое использование дает преимущество улучшения электрохимических свойств батарей.
Катод также может быть факультативно окислен некоторыми окислителями. Окисление катода может быть аналогично аноду естественным и иметь место в процессе его получения или в отличие от анода катод может быть получен с электрохимическим активными веществами, которые были частично окислены до его получения.
Если катод 11 не содержит магния, то это обычный катод, известный сам по себе; следовательно, он не будет дополнительно описан в этой заявке. В этом случае каким бы то ни было образом катод содержит электрохимически активные вещества, имеющие основу из металлических смесей в адекватных пропорциях в восстановленном или окисленном виде. Для этой цели, как известно из предшествующего уровня техники, могут быть использованы вещества, содержащие переходные металлы, например, но не исключительно, магний с состоянием окисления в диапазоне 7+-2+ и другие эквивалентные металлы.
Электролит 12 отличается тем, что он содержит в качестве ионных разновидностей магния хлориды магния в δ-форме в растворителях, включающих в себя полимерные растворители, способные давать электролиты с хорошей ионной проводимостью и способные сольватировать указанные разновидности.
Ионная разновидность δ-MgCl2 имеет очень низкое отношение заряд/объем и энергию кристаллической решетки менее 500 ккал/моль.
Растворители, используемые для электролита, могут быть различных типов, поскольку существенной требуемой характеристикой является то, чтобы они обладали хорошей ионной проводимостью и чтобы они в любом случае были одновременно способными сольватировать ионные разновидности магния, которые были выбраны. По этой причине они могут быть, следовательно, жидкими растворителями или растворителями в твердом или вязком состоянии.
В случае жидких растворителей их выбирают из веществ, имеющих полярные группы, которые способны гармонизировать и разлагать ионные соли или комплексы магния и которые содержат кислород, азот, серу и углерод. Такие растворители, следовательно, могут быть выбраны из простых эфиров, спиртов, ди-спиртов, сложных эфиров, аминов и амидов, тиоэфиров, тиоспиртов, алкилкарбонатов и алкилтиокарбонатов или других эквивалентов.
В том случае, если растворитель для электролита является твердым или вязким, он может быть полимерного типа.
Для этой цели пригодны все полимеры или сополимеры, имеющие разные молекулярные массы, которые способны сольватировать соли или комплексы магния, пригодные для этой цели. Такие полимеры и/или сополимеры могут быть выбраны из группы, содержащей полиэтиленоксиды, полиалкиленгликоли, поликарбонаты, полиалкилсилоксаны, полиэтилендиаминтетраацетат, или эквивалентные полимеры, или сополимеры одних макромолекулярных каркасов, имеющие разные молекулярные массы, содержащие также в своих цепях гетероатомы кислорода, азота, кремния и фосфора.
Для этой цели также пригодны полифосфазенполимеры, функционализированные с полимерами и/или сополимерами, упомянутыми ранее.
В качестве примеров полиалкиленоксидов могут быть указаны следующие: полиметиленоксид, полиэтиленоксид, полипропиленоксид и другие; в качестве примеров полимергликолей могут быть указаны следующие: полиметиленгликоли, полиэтиленгликоли, полипропиленгликоли и фторированные производные тех и других, в качестве примеров полиалкилсилоксанов могут быть указаны следующие: полиметилсилоксан, полиэтилсилоксан, полипропилсилоксан и другие.
Для этой цели пригодны также сополимеры, производные от полиалкиленоксидов и полиалкиленгликолей, поликарбонатов, полиалкилсилоксанов, полиэтилендиаминтетраацетата; полиалкиленгликолей и поликарбонатов, полиалкилсилоксанов, полиэтилендиаминтетраацетата; поликарбонатов и полиалкилсилоксанов, полиэтилендиаминтетраацетата; полиалкилсилоксанов и полиэтилендиаминтетраацетата, например, полиэтиленоксид-полипропиленоксид, полиметиленоксид-полиэтиленоксид и полиметиленоксид-полипропиленоксид; полиэтиленоксид-полиметиленкарбонат, полипропиленоксид-полиэтиленкарбонат, и полиэтиленоксид-полипропиленкарбонат; полиэтиленгликоль-полиметилполисилоксан, полиэтиленоксид-полиметилсилоксан, и полиэтиленоксид-полиэтилендиаминтетраацетат и так далее.
Для этой цели можно использовать, например, полифосфазенполимеры, функциализированные с полимерами и/или сополимерами типа полиэтиленоксида или аналогичного полимера, имеющими разные молекулярные массы.
Полимеры и/или сополимеры, которые могут быть использованы для получения электролита, могут быть, кроме того, функционализированы с группами, которые связывают или гармонизируют магний так, чтобы улучшить их взаимодействие с солями или комплексами последнего.
Для улучшения ионной проводимости электролита он может быть подвергнут также факультативному подкислению или подщелачиванию в соответствии с процедурами, известными на предшествующем уровнем техники, которые, следовательно, не будут подробно описаны в этой заявке.
Однако в том случае, если электролит подкисляют, то предпочтительными подкислителями электролита являются химические соединения на основе фосфора, полифосфаты, P2O5, или эквиваленты типа ортофосфорной кислоты. В том случае, если электролиты подщелачивают, то могут быть использованы химические соединения на основе азота, и в этом случае предпочтительными являются амины и аммиак, а также основные производные серы и фосфора.
Подкисление улучшает проводимость электролита, и этот процесс должен проводиться всякий раз, когда рабочие характеристики не являются адекватными для применения. Этот процесс должен быть предпочтительным в случае стабилизированных электродов.
Подщелачивание также улучшает проводимость электролита и осуществляется с целью оказания помощи электрохимическому функционированию электродов. Однако этот процесс должен быть предпочтительным в том случае, если используют нестабилизированные электроды.
Прокладки (не показанные на сопроводительном чертеже) содержат неорганические или органические вещества, которые являются проницаемыми для ионов и имеют высокие диэлектрические свойства; при необходимости их адекватно функционализируют для исключения полярных групп, которые могут иметься на поверхностях волокон. Для этой цели можно использовать, например, целлюлозу, стеклоткани, органические мембраны или другие эквивалентные материалы.
Токосъемники 13 (металлические или неметаллические) с проводимостью и удельным сопротивлением не более 10 Ом·м предназначены для улавливания электронов и для обеспечения электрического соединения полюсов элемента батареи. Для этой цели можно использовать, например, металлы, даже в виде окислов, сплавы и ткани, полученные, например, из алюминия, меди, стали, латуни и так далее, или органические материалы, полученные из углерода или тканей на основе углеродного волокна, или аналогичные материалы.
Способ получения первичных и/или вторичных батарей, соответствующих настоящему изобретению, предусматривает, по меньшей мере, один из следующих этапов:
получение анода, отличающегося тем, что он содержит магний в различных состояниях окисления Mgn+ (n+=0,1+,2+) факультативно соединенный с металлическим магнием, причем указанный анод имеет основу из металлического магния как такового или еще магний на подложке из высоко проводящих неорганических или органических веществ, или в неорганических или органических веществах для интеркалирования или внедрения магния;
получение катода, отличающегося тем, что он содержит разновидности магния в состоянии окисления 2+ и имеет подложку из высокопроводящих неорганических или органических веществ или в неорганических или органических композиционных материалах для интеркалирования или внедрения магния;
получение электролита, отличающегося тем, что он в качестве ионных разновидностей содержит хлориды магния в δ-форме в растворителях, которые способны давать электролиты, имеющие хорошую ионную проводимость, и сольватировать указанные разновидности.
Электролит может быть, кроме того, факультативно армирован прокладками, как описано ранее.
Вышеуказанные три, компонента приводят в контактное взаимодействие друг с другом, причем слой электролита 12 располагают между анодом 10 и катодом 11. Тесное контактное взаимодействие между анодом 10, электролитом 12 и катодом 11 может быть также получено путем приложения небольшого давления к указанному набору компонентов при температуре, находящейся в диапазоне от комнатной температуры до температуры, равной приблизительно 150°С.
Для получения батарей с адекватными рабочими характеристиками может быть приспособлена такая же технология, что и для получения уже известных литиевых батарей.
В частности, можно:
использовать технологию получения однослойных или многослойных батарей таблеточного типа;
соединять многослойные пленки параллельно (параллельное пакетирование) или еще соединять многослойные пленки последовательно (биполярное пакетирование), для нескладных структур;
использовать технологию получения плоского проката, или технологию получения желеобразного проката, или технологию получения плоского пакета для складных структур.
Ниже приведено подробное описание методологий получения отдельных компонентов, когда они содержат магний и, следовательно, не являются стандартными или известными специалистам в этой области техники, как в отношении характеристик, так и в отношении методологий получения.
А - Общие методологии получения компонентов
А.1 - Получение анода 10
Для целей настоящего изобретения могут быть использованы три типа анода 10: анод на основе магния, имеющий характеристики, уже описанные ранее, магния (1) как такового или магния (2) на подложке из высокопроводящих органических или неорганических веществ, или магния (3) интеркалированного или внедренного в вещество для интеркалирования или внедрения магния.
Магний как таковой может быть ламинирован, начиная от магния классификации Григнарда или может быть в виде порошка с адекватным размером зерен, или еще в виде ленты переменной длины, которая выпускается на промышленной основе. Помимо этого, магний может быть также в спеченном виде.
Анод может также состоять из магния на подложке из высокопроводящих органических или неорганических веществ, включая полимерные материалы, как описано ранее. Такой тип анода может быть получен химическим, электролитическим или электрохимическим методами осаждения разновидностей магния или термическим осаждением разновидностей магния из паровой фазы.
Другой тип анода 10 получают с помощью материала интеркалирования или внедрения магния. В частности, такой анод получают суспендированием в растворителе, например бензоле, толуоле, N-N диметилацетамиде, диметилформамиде или тетрагидрофуране или аналогичном веществе, смеси полиэтилена или поливинилхлорида, или полиакриламида, или полиакрилнитрила или подобного другого вещества с материалом интеркалирования, предварительно выдержанного до полной гомогенизации с магнием. Эту систему обрабатывают до тех пор, пока не будет получено полное и гомогенное распределение вышеописанных веществ в самом растворителе. Затем путем медленного выпаривания растворителя получают композитную пленку с основой из вещества интеркалирования или внедрения.
Для получения анода другие методы интеркалирования (помимо методов, описанных выше) могут быть основаны на физических методологиях, например, на способе плазменного распыления или катодного распыления магния на выбранный материал интеркалирования или внедрения.
Какой бы тип анода ни был выбран, он может быть затем окислен газообразным кислородом или перекисью, например перекисью водорода H2O2, или органическими перекисями. Анод может быть, кроме того, подвергнут дополнительной и, возможно, стабилизирующей обработке. В качестве стабилизаторов могут быть использованы алкоголяты, например тетраалкоксититан, тетраалкоксисиланы, триалкоксиалюминий, тетраалкоксицирконий или диалкоксимагний или другие эквивалентные химические соединения.
С помощью вышеуказанных дополнительных процессов можно получить анод, который имеет более хорошие характеристики в отношении стабильности, обратимости и обменных токов.
А. 2 - Получение катода 11
Катод 11 может быть получен либо путем обеспечения подложки для магния, или с композиционным материалом, имеющим основу материала интеркалирования или внедрения, приспособив методологии, которые аналогичны методологиям, уже описанным для получения анода 10 и которые по этой причине не будут дополнительно описаны в этой заявке. Материалы интеркалирования аналогичны материалам интеркалирования, пригодным для получения анода и могут быть, например, но не исключительно, на основе углерода, графита, двусернистого титана (TiS2), двуокиси кобальта (СоО2), двуокиси никеля (NiO2), двуокиси марганца (MnO2) или других эквивалентов, выбранных из веществ, уже описанных ранее.
Также как и при получении анода, катод также может подвергаться дополнительному естественному окислению в процессе его получения или после его получения, причем эти технологические процессы уже были описаны ранее. Однако в отличие от анода катод может быть получен с электрохимически активными веществами, которые уже были частично окислены перед получением катода.
А.3 - Получение материала интеркалирования
Материал интеркалирования выбирают из материалов, которые для этой цели могут быть использованы в аноде или катоде и получены в соответствии с общей процедурой, описанной ниже. Материал интеркалирования измельчают в шаровой мельнице до тех пор, пока не будет достигнуто полное структурное разупорядочение материала. Затем этот материал приводят в тесное контактное взаимодействие с карбонатами магния или окислами магния. Полученную таким образом смесь после гомогенизации и гранулирования доводят до температуры приблизительно 100-400°С и выдерживают в течение 1-3 часа, затем доводят температуру до 800-1200°С в инертной атмосфере (например, в атмосфере аргона) и после этого выдерживают в указанном температурном диапазоне в условиях вакуума в течение 1-5 дней.
А.4 - Получение электролита 12
Электролит 12, соответствующий настоящему изобретению, может быть получен при использовании растворителей, включающих в себя, но не исключительно, полимерные растворители, способные сольватировать любые ионные разновидности магния и давать электролиты, имеющие хорошую ионную проводимость. Электролит, соответствующий настоящему изобретению, содержит в качестве ионных разновидностей хлориды магния в δ-форме, имеющие очень низкое отношение заряд/объем кристаллической решетки менее 500 ккал/моль.
Получение соответствует следующей химической реакции:
растворитель + соль/неорганический комплекс → электролит
Получение электролита 12 в соответствии вышеуказанной реакцией может осуществляться в процессе проведения трех общих процедур. Первая процедура относится к направлению растворения соли или комплекса магния в жидком растворителе или в расплавленном полимере (если последний позволяет это). Вторая процедура относится к растворению полимерного растворителя и соли или комплекса магния в общем растворителе для получения полимерной пленки посредством медленного выпаривания растворителя (метод растворного литья). Третья процедура относится к получению полимерных электролитов, которые могут иметь высокую проводимость и основаны на полимерных электролитах, имеющих высокую степень образования поперечных мостиковых межмолекулярных связей. В таких обстоятельствах полимерный электролит по очевидным причинам должен быть получен при получении растворов мономера и соли или комплекса магния с последующим проведением реакции полимеризации.
Растворителями, пригодными для этой цели, являются все растворители уже указанные выше и, в частности, для обеспечения, например, любого жидкого вещества, имеющего полярные группы, содержащие кислород, азот, серу, и углерод, которые гармонизируют и разлагают ионные соли и комплексы магния, например простые эфиры, спирты, ди-спирты, сложные эфиры, амины и амины, тиоэфиры, тиоспирты, алкилкарбонаты и алкилтиокарбонаты или еще полимеры и/или сополимеры, имеющие разные молекулярные массы, полиалкиленоксиды, полиалкиленгликоли, поликарбонаты, полиалкилсилоксаны, полиэтилендиаминтетраацетат, их производные, в которых один или более атомов в цепи замещены одним или более гетероатомами, выбранными из группы, содержащей кислород, азот, кремний и фосфор и полифосфазенполимеры, функционализированные с полимерами или сополимерами, упомянутыми ранее.
Среди солей или комплексов магния, которые могут быть использованы для целей настоящего изобретения, особенно предпочтительным является химическое соединение δ-MgCl2, которое, поскольку оно имеет очень низкую энергию кристаллической решетки, то есть энергию очень близкую к 0 ккал/моль, может быть растворено в органических растворителях, которые способны гармонизировать магний.
Электролит, полученный в соответствии с одним из способов, описанных выше, может быть подкислен или подвергнут подщелачиванию при использовании процедур и средств, известных для достижения этой цели. В том случае, если электролит подкисляют, то он может оказаться предпочтительным для целей настоящего изобретения путем введения адекватных количеств химических соединений на основе фосфора, например ортофосфорной кислоты (P2O5) или других эквивалентов, при перемешивании до полного растворения. Аналогичной процедуре следуют в том случае, если электролит подщелачивают химическими соединениями на основе азота или основными производными серы и фосфора.
А.5 - Получение диэлектрических прокладок
Диэлектрические прокладки могут быть получены из любых ионопроницаемых диэлектрических материалов, имеющих хорошие электрическую прочность изоляции и диэлектрическую постоянную. В том случае, если материал имеет на своей поверхности полярные группы, то химическую инертизацию осуществляют посредством адекватной функциализации для предотвращения взаимодействия с ионами магния или с ионными комплексами магния. Например, в случае стекловолокон, гидроксильные группы, имеющиеся на поверхности, деактивируют посредством химической реакции с триэтоксиалкилсиланом, делая таким образом поверхность прокладки очень неполярной.
В - Общие примеры получения компонентов
Далее настоящее изобретение дополнительно пояснено в его общих аспектах на нескольких примерах практического осуществления, единственной целью которых является иллюстрация настоящего изобретения без какого-либо ограничения его объема.
B.1 - Пример получения анода 10 посредством спекания
Анод 10 получали из исходного металлического магния, который мелко измельчали и спекали под давлением 1400 МПа. В этом случае после приложения давления в течение приблизительно десяти минут образовывалась металлическая пленка, имеющая требуемую толщину.
B.2 - Получение графита, предварительно термически интеркалированного магнием
Смесь окиси магния и графита в массовом отношении 3% подвергали раз упорядочиванию с помощью шаровой мельницы. Такое механическое перемешивание продолжали приблизительно в течение 30 минут и имели целью тщательную гомогенизацию этих двух компонентов. Механическое воздействие мельницы, кроме того, увеличивало кристаллографическую раз упорядоченность графита. Полученный таким образом материал затем вводили в кварцевую трубу и подвергали воздействию шести циклов азот-вакуум для исключения микропримесей воздуха.
Затем в трубе создавали вакуум посредством диффузионного насоса при давлении 10-6 мбар и повышали температуру до 700°С, при которой делали выдержку в течение приблизительно 14 часов.
B.3 - Получение композитного катода 11
Интеркалированный графит, описанный в примере В.2, подвешивали в растворе ксилола, содержащем 10 мас.% полиэтилена, растворенного в нем. Из смеси, полученной таким образом, медленно выпаривали растворитель (метод растворного литья) для получения черной слегка вязкой пленки, которая разрушалась на крошечные чешуйки и затем преобразовывалась в спеченный катод 11 благодаря приложению давления 1400 МПа.
В.4 - Примеры получения полимеров для электролита
Пример В.4.1
Могут быть использованы выпускаемые на промышленной основе полиэтиленгликоли, имеющие молекулярные массы в диапазоне от 200 до 1000 единиц.
Пример В.4.2
Для получения полимера можно использовать выпускаемые на промышленной основе полимеры, например поликарбонаты или эквивалентные им химические вещества.
Пример В.4.3 - (Синтез сополимеров полиэтиленгликоля и полидиметилполисилоксана)
Получали аликвотную часть, составляющую приблизительно 3 г диметилдихлорсилана для обеспечения химической реакции в толуоле с 50 мол.% полиэтиленгликоля 400. Реакцию проводили в азоте в течение приблизительно 10 часов. Получали прозрачный полимер, имеющий высокую вязкость. После исключения толуола и остатка диметилдихлорсилана в условиях вакуума (10-3 бар) при температуре приблизительно 120°С, получали густой жидкий полимер, который по внешнему виду напоминает мед. Анализ показал, что синтезированное таким образом вещество является сополимером с блоками полиэтиленоксида и полидиметилсилоксана.
Пример В.4.4 - (Синтез мономера диангидрида этилендиаминтетраацетатной кислоты)
Приблизительно 3 г этилендиаминтетраацетатной кислоты получали для химической реакции в толуоле с ангидридом ацетила в присутствии небольших количеств пиридина. После приблизительно двух часов дефлегмации сначала отфильтровывали белый осадок ангидрида этилендиаминтетраацетатной кислоты, а затем промывали толуолом в строго инертной атмосфере азота. Полученное таким образом белое твердое вещество затем подвергали в течение приблизительно одного дня вакуумной сушке. Анализ показал, что полученный продукт является ангидридом чистой этилендиаминтетраацетатной кислоты.
Пример В.4.5 - (Синтез сополимера с блоками этилендиаминтетраацетат - полиэтиленгликоль)
Ангидрид этилендиаминтетраацетатной кислоты получали для обеспечения химической реакции с аликвотной частью полиэтиленгликоля, имеющего молекулярную массу в диапазоне 400-800, в пропорции 1:1.
B.5 - Пример получения δ-хлорида магния
Один грамм металлического магния вводили в 250 мл колбу в строго инертной атмосфере аргона. Колбу в боксе с сухим аргоном оборудовали конденсатной ловушкой орошающей фракции и вакуумными кранами. Приблизительно 100 мл n-хлорбутана вводили в магний, используя капельную подачу. Полученную таким образом смесь подвергали в течение восьми часов реакции в потоке аргона при температуре кипения хлор бутана. Через 2 часа реакции получали сероватое твердое вещество, имеющее мучнистый внешний вид. После вакуумной сушки в течение шести часов получали белый порошок. Анализ показал, что это хлорид магния в δ-форме.
B.6 - Примеры получения полимерных электролитов на основе магния
Пример В.6.1 - (Получение полимерного электролита полиэтиленгликоль/(MgCl2)х)
Предварительно в этилацетате растворяли соль магния. В таком же растворителе отдельно приготавливали раствор полиэтиленгликоля. Полученные таким образом растворы смешивали вместе. После нагрева в течение приблизительно одного часа при дефлегмации раствор удаляли посредством вакуумирования (10-3 мбар) и нагрева до температуры, составляющей приблизительно 100°С. Затем в условиях высокого вакуума (10-6 мбар) в течение приблизительно двух дней удаляли какие-либо следы растворителей.
Пример В.6.2 - (Синтез полимерного электролита полиэтиленгликоль-полиметилсилоксан)
Некоторое количество полиэтиленгликоль-полиметилсилоксана растворяли совершенно безводно в этиловом спирте. Отдельно в таком же растворителе получали раствор δ-MgCl2. Затем два полученных раствора смешивали вместе. После этого в вакууме (10-3 мбар) при температурах в диапазоне 80-100°С удаляли растворитель.
Пример В.6.3 - (Синтез полимерного электролита, полученного легированием сополимера полиэтилендиаминтетраацетата и простого полиэфира солями магния)
Синтезированный сополимер полиэтилендиаминтетраацетата и простого полиэфира легировали непосредственно солями магния при температуре плавления сополимера.
Пример В.6.4 - (Прямой синтез, то есть без растворителей, полимерных электролитов на основе полиэтиленгликолей или полиэтиленоксидов и δ-хлорида магния)
Полиэфиры, имеющие различные молекулярные массы (200-200000) непосредственно обрабатывали δ-MgCl2 Полученную таким образом гетерогенную систему гомогенизировали для полного растворения соли в полимере путем нагрева и непрерывного перемешивания.
Пример В.6.5 - (Прямой синтез, то есть без растворителей, полимерных электролитов на основе полиэтиленгликолей или полиэтиленоксидов и δ-хлорида магния, подкисленных P2O5)
Полимерный электролит, полученный в соответствии с процедурой, описанной в Примере В.6.4, обрабатывали 8 мас.% Р2О5. Время, требуемое для получения полимерного электролита посредством перемешивания и полного растворения Р2O5, приблизительно составляло 4 часа. Введение P2O5 увеличивает вязкость полимера.
В.7 - Пример получения полимерного электролита 12, армированного стекловолокнами
Для пропитки стеклоткани использовали жидкий полимерный электролит или твердый полимерный электролит в расплавленном состоянии. В этом случае получали тонкий полимерный электролит, который был армирован стекловолокнами.
С - Примеры полученных опытных образцов
Практические испытания, выполненные на опытных образцах, показали, что поставленные цели были достигнуты.
В частности, в одном первом случае (одноэлементной батареи таблеточного типа с полимерным электролитом, армированным бумажным фильтром) анодный диск (анод 10), полученный из спеченного металлического магния и имеющий диаметр 8 мм, служил средством связи с пленкой полимерного электролита PEG 400 (MgCl2)x, армированного бумажным диском, имеющим аналогичный диаметр, после предварительного нагрева этих двух химических соединений. Поверх пленки полимерного электролита была уложена композитная катодная пленка (катод 11) на основе материала интеркалирования, содержащего металлические окислы с графитом в жидкой суспензии, высушенной впоследствии, полученной в соответствии с примерами, описанными ранее. Полученный таким образом элемент был расположен на системе, содержащей два токосъемника 13. Через несколько мгновений после сборки этот опытный образец генерировал электрическое напряжение, составляющее приблизительно 0,8 В. В пределах приблизительно 5-6 часов электрическое напряжение опытного образца батареи увеличивалось до тех пор, пока оно не достигло приблизительно 1,8 В. После того как было сделано нескольких перезарядок при постоянном токе между 5 и 150 мкА, опытный образец показывал пороговое напряжение между 2 и 3 В. После разрядки электрическое напряжение вернулось к величине 1,8 В.
Во втором случае (одноэлементной батареи таблеточного типа с полимерным электролитом, армированным стекловолокном) анод 10 и катод 11 получали в соответствии с процедурами, описанными для первого опытного образца. В этом случае для армирования полимерного электролита 12 использовали стекловолокно толщиной 0,02 мм. Характеристики этого опытного образца были аналогичны характеристикам первого опытного образца, но обратимость была значительно выше.
В третьем случае (одноэлементной батареи таблеточного типа с полимерным электролитом, подкисленным P2O5 и армированным стекловолокнами) анод 10 и катод 11 получали в соответствии с процедурами, описанными для первого опытного образца. Подкисление полимерного электролита 12 посредством P2O5 обеспечило возможность получения электрического напряжения приблизительно 2,2 В вместе с превосходной обратимостью, высокой удельной плотностью энергии и значительной зарядной емкостью.
Из вышеприведенных примеров становятся очевидными преимущества, которые могут быть получены при использовании магния для производства батарей, которые являются объектом настоящего изобретения. Кроме того, по сравнению с литием магний, который является очень легким элементом, обладает лучшей обрабатываемостью вместе с хорошей реакционной способностью и напряжением восстановления окиси. Возможность для магния обменивать два электрона может обеспечить возможность получения 100% коэффициента полезного действия и при одинаковых объемах магний по сравнению с литием может обеспечить увеличение зарядки на 80% и энергии на 45%.
Системы, разработанные в соответствии с технологией, которая была описана выше в этой заявке, фактически обеспечивают получение превосходных технических характеристик вместе с преимуществом уменьшения себестоимости и практически полного отсутствия отрицательного воздействия на окружающую среду, поскольку материалы всех компонентов не являются загрязняющими окружающую среду, а магний является безопасным элементом, как показали медицинские и клинические применения.
Таким образом, предполагается, что первичные (не перезаряжаемые) и вторичные (перезаряжаемые) батареи, соответствующие настоящему изобретению, без отклонения от объема и сущности настоящего изобретения могут быть подвергнуты многочисленным модификациям и изменениям, которые очевидны квалифицированным в этой области техники специалистам, причем все модификации и усовершенствования получают в результате нормального ноу-хау и опыта в этом секторе, а также из нормальной оценки состояния уровня техники.
Изобретение относится к первичным и вторичным батареям, в которых анод содержит магний. Техническим результатом изобретения является разработка батареи с высокими техническими характеристиками и пониженной себестоимостью. Согласно изобретению батареи содержат, по меньшей мере, один анод, по меньшей мере, один катод, по меньшей мере, один электролит и токосъемники, причем в указанных батареях, по меньшей мере, анод получен на основе магния и факультативно катод и электролит также содержат магний. Батареи предусматривают получение отдельных компонентов и введение между анодом и катодом на основе магния тонкого слоя электролита. 2 н. и 31 з.п. ф-лы, 1 ил.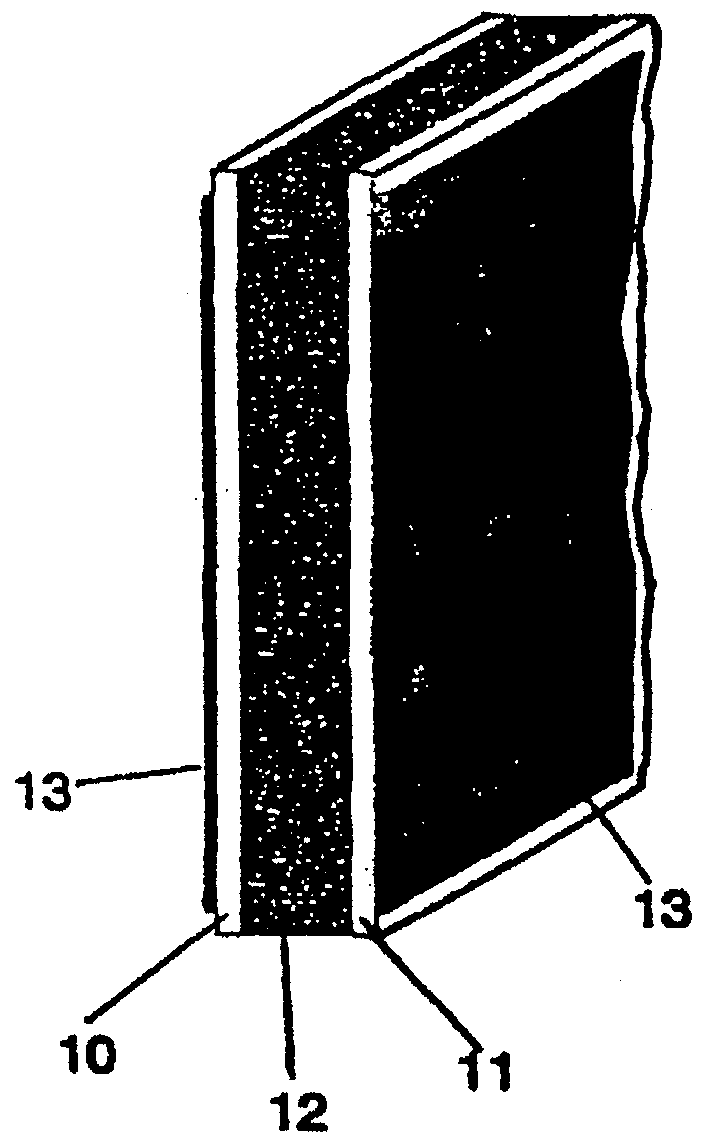
получение анода, содержащего магний в различных состояниях окисления Mg+ (n+=0, 1+, 2+), соединенный с металлическим магнием, причем указанный анод имеет, по существу, основу из металлического магния или магния на подложке из высокопроводящих неорганических или органических материалов, или в неорганических или органических материалах для интеркалирования или внедрения магния;
получение электролита, содержащего в качестве ионных разновидностей хлориды магния в δ-форме, имеющие энергию кристаллической решетки менее 500 ккал/моль в растворителях, которые способны давать электролиты, имеющие хорошую ионную проводимость и способные сольватировать указанные разновидности; и фалькультативно
получение катода, содержащего разновидности магния в состоянии окисления 2+, имеющие подложку из высокопроводящих неорганических или органических материалов, или в неорганических или органических материалах для интеркалирования или внедрения магния.
| Первичный электрохимический источник тока | 1957 |
|
SU109345A1 |
| US 4894302 А, 16.01.1990 | |||
| US 5449575 A, 12.09.1995 | |||
| Турбинный датчик расхода бурового раствора | 1976 |
|
SU602782A1 |
Авторы
Даты
2006-02-10—Публикация
2000-07-27—Подача