Изобретение относится к области техники, касающейся синтеза биологически активных средств защиты растений, в частности, синтеза L-2-амино-4-(гидроксиметилфосфинил)масляной кислоты (L-фосфинотрицин, L-ФТ) из 4-(гидроксиметилфосфинил)-2-оксомасляной кислоты (ГМФОМК) путем ферментативного трансаминирования с помощью аспартата в присутствии специфичной к ГМФОМК аспартаттрансаминазы (Асп-ТА). Соединение L-ФТ, его соли и некоторые его производные являются обладающими гербицидным действием, не встречающимися в белках аминокислотами или их солями и производными (заявка на патент ФРГ 2717440). Соответствующая L-форма является при этом биологически активной, в то время как соответствующая D-форма практически неактивна (заявка на патент ФРГ 2856260). Уже известно, что трансаминазы вследствие их высокой стереоселективности и относительно широкой специфичности к субстрату особенно подходят для хирального ферментативного синтеза аминокислот из их соответствующих кетокислотных предшественников. Недостатком в случае технологического использования трансаминаз является, однако, их константа равновесия, примерно равная 1, так что желаемый продукт может быть получен, в общем, только с выходом 50% (патент США №4826766). В заявке на европейский патент 0344683 и в патенте США №5221737 описывается получение биологически активного вещества с гербицидным действием, L-фосфинотрицина [(L-гомоаланин-4-ил(метил)фосфиновая кислота, L-2-амино-4-(гидроксиметил-фосфинил)масляная кислота, L-ФТ), не встречающейся в белках аминокислоты, путем трансаминирования из соответствующей кетокислоты [(2-оксо-4-(гидроксиметилфосфинил)масляная кислота, ГМФОМК] с помощью 4-аминобутират: 2-кетоглутарат - трансаминазы (γ-аминомасляная кислота /ГАМК/ - трансаминаза, в классификации ферментов /КФ/ 2.6.1.19) из Escherichia coli. Для количественного превращения требуется более высокий молярный избыток глутамата как донора аминогруппы, что затрудняет очистку продукта реакции.
Решение этой проблемы возможно путем применения аспартата в качестве донора аминогруппы, так как соответствующая кетокислота, оксалоацетат, неустойчива в водной среде и самопроизвольно декарбоксилируется в пируват. Благодаря удалению продукта реакции из равновесия не может происходить ни одна обратная реакция и возможно количественное превращение также при эквимолярном использовании кетокислоты и донорной аминокислоты. Подобный способ описывается, например, в заявке на европейский патент 0135846.
Использование такого принципа для ферментативного синтеза L-фосфинотрицина было, однако, до сих пор невозможно, так как описанная ГАМК-трансаминаза не акцептирует аспартат в качестве донора аминогруппы и не была известна никакая другая трансаминаза с общей специфичностью к L-фосфинотрицину и аспартату.
Дополнительно была предложена спаренная система из 2 ферментов, состоящая из специфичных к ФТ трансаминазы и глутамат: оксалоацетаттрансаминазы (ГОТ, КФ 2.6.1.1) (заявки на европейские патенты 0249188 и 0477902). При таком проведении реакции расходуемый при синтезе L-ФТ глутамат регенерируется из аспартата с помощью ГОТ. Сама аспартаттрансаминаза не обладает никакой специфичностью по отношению к L-ФТ/ ГМФОМК. Самопроизвольное превращение оксалоацетата в пируват приводит также в общей реакции к смещению равновесия в направлении синтеза L-ФТ. При этом возможны количественные выходы продукта при эквимолярном использовании ГМФОМК и аспартата и при явном избытке глутамата.
Благодаря этому спаренному ферментному способу можно явно уменьшить передозировку находящихся в растворе субстрата донорных аминокислот по сравнению с акцепторной кетокислотой ГМФОМК, что упрощает обработку раствора продукта. Однако при спаренном проведении реакции далее необходимо применение глутамата, который в равновесии с кетоглутаратом должен оставаться в продукте реакции или должен отделяться посредством дорогостоящего способа очистки от очень близкой по структуре аминокислоты L-ФТ. Кроме того, оптимизация проведения реакции при применении двух ферментов сложнее из-за различных кинетических параметров, чем в случае одного фермента.
Хотя ранее известные аспартаттрансаминазы, как, например, ГОТ, не показали никакого превращения ГМФОМК, были совершенно неожиданно найдены аспартаттрансаминазы из микроорганизмов, которые также акцептировали L-ФТ/ГМФОМК с высокой специфичностью в качестве субстрата. Эти ферменты катализируют прямой перенос α-аминогруппы аспартата на ГМФОМК.
Объектом данного изобретения является поэтому способ получения L-2-амино-4-(гидроксиметилфосфинил)масляной кислоты (L-фосфинотрицин, L-ФТ) формулы (I), ее производных и/или солей
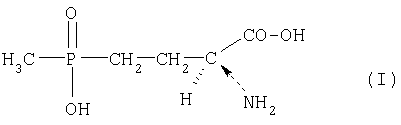
из 4-(гидроксиметилфосфинил)-2-оксомасляной кислоты (ГМФОМК) формулы (II),
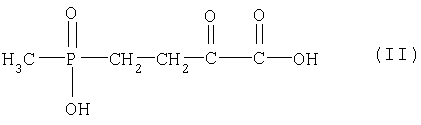
ее производных и/или солей в качестве акцептора путем ферментативного трансаминирования в присутствии аспартата в качестве донора, причем трансаминирование в оксалоацетат и соединение формулы (I), его производные и/или соли осуществляют в присутствии одной или нескольких специфичных к акцептору, предпочтительно специфичных к ГМФОМК, аспартаттрансаминаз (Асп-ТА), предпочтительно в присутствии одной или нескольких термостабильных и/или выделенных аспартаттрансаминаз и в высшей степени предпочтительно в присутствии одной или нескольких аспартаттрансаминаз с возможно более незначительной субстратной специфичностью к пирувату, так что образование в качестве побочного продукта аланина может уменьшаться или значительно сокращаться.
Соли L-ФТ являются, в основном, солями с неорганическими и/или органическими кислотами или моно- и дисолями с неорганическими и/или органическими основаниями. Соли с кислотами (соли, полученные в результате присоединения кислот) являются, например, солями с минеральными кислотами, как, например, с соляной кислотой (гидрохлорид) или с серной кислотой (сульфаты), или с угольной кислотой (карбонаты, гидрокарбонаты), или с органическими кислотами, как, например, уксусная кислота (ацетаты), муравьиная кислота (формиаты), пропионовая кислота (пропионаты) или винная кислота (тартраты). Солями с основаниями являются, например, соли со щелочными и щелочноземельными металлами, аммонийные соли, соли с органическими аминами, например, с первичными, вторичными или третичными аминами, и соль четвертичного аммониевого основания.
Производными являются, например, сложные эфиры L-ФТ, которые проэтерифицированы по кислотной группе фосфиновой кислоты, например, проэтерифицированы с помощью алканолов с 1-12 атомами углерода в алкильном остатке, как, например, метанол, этанол, н-пропанол, изопропанол, н-, изо- и втор- или трет-бутанол, и (С3-С6)циклоалканолов, как, например, циклогексанол. Производными также являются сложные эфиры L-ФТ, которые альтернативно или дополнительно проэтерифицированы по карбоксильной группе карбоновой кислоты, например, с помощью уже вышеупомянутых спиртов. Производными являются также образованный по карбоксильной группе амид L-ФТ и его производные, при известных условиях N-алкил- или N-диалкиламиды, предпочтительно с 1-4 атомами углерода в алкильном остатке.
Производными ГМФОМК являются, например, ее соли с неорганическими и/или органическими основаниями, причем для этого годятся основания, уже упомянутые в связи с L-ФТ. Производными являются, например, также сложные эфиры ГМФОМК, которые получены при этерификации по карбоксильной группе, или по кислотной группе фосфиновой кислоты, или по обеим. В качестве спиртов для сложноэфирных групп формально годятся спирты, которые используются для получения сложных эфиров L-ФТ, предпочтительно названные выше алканолы. Производными являются также образованный по карбоксильной группе амид ГМФОМК и его производные, которые проэтерифицированы по кислотной группе фосфиновой кислоты, а также, при необходимости, соответствующие N-алкил- или N,N-диалкиламиды.
Аспартат означает преимущественно L-аспарагиновую кислоту или ее соли, предпочтительно соли со щелочными металлами. Но в качестве аспартата может также использоваться L-аспарагиновая кислота в смесях с D-аспарагиновой кислотой, например, как рацемическая D,L-аспарагиновая кислота.
Альтернативно, присутствующий при необходимости в способе по изобретению пируват может быть удален из реакционной смеси физическими методами, химически и/или ферментативно, предпочтительно путем превращения с помощью ферментативного катализа, например, с помощью ацетолактатсинтазы (АЛС), пируватдекарбоксилазы, пируватоксидазы, в особенности, ацетолактатсинтазы; в высшей степени предпочтительно осуществляют превращение пирувата в присутствии относительно термостабильного фермента. Применяемые при этом ферменты могут находиться, при необходимости, в иммобилизованной форме.
Оба субстрата (донор и акцептор) применяются, например, в молярном соотношении 0,5-2:1 (в расчете на L-аспарагиновую кислоту: ГМФОМК), предпочтительно 0,75-1,5: 1, в особенности, примерно эквимолярном. При использовании смесей L- и D-аспарагиновых кислот (солей) решающим является молярное количество L-аспарагиновой кислоты (соли). Производные ГМФОМК используются в молярных количествах относительно ГМФОМК. Присутствие глутамата в растворе субстрата не является обязательным. Некоторые из найденных ферментов характеризуются отличной термостабильностью. Проведение процесса поэтому возможно в широкой области температур от 10 до 95°С, предпочтительно от 40 до 90°С, в особенности, от 60 до 85°С. Для ферментов, не обладающих особой термостабильностью, предпочтительная область температур находится при 20-70°С, в особенности от 30 до 40°С. Благодаря относительно высоким температурам скорость реакции значительно увеличивается, что способствует также превращению концентрированных растворов субстрата (10%-ных) с высокой объемной производительностью. Реакция осуществляется преимущественно при значении рН в области 6,5-10, предпочтительно от 7 до 9, в особенности от 7,5 до 8,5, в соответствующей подходящей буферной системе со значением рКа в области 7-9, между прочим, в фосфатном буфере или трис-буфере. Неожиданно биохимически более детально охарактеризованные ферменты не обладают специфичностью к ГАМК и четко отличаются тем самым от ранее известных специфичных к L-ФТ/ ГМФОМК трансаминаз.
Особенно высокие скорости превращения достигаются в реакции, когда можно избежать или сократить до минимума образование аланина при трансаминировании. С этой целью могут применяться при необходимости оптимизированные варианты Асп-ТА без субстратной специфичности к пирувату. Альтернативно, пируват может быть удален из реакционной смеси физически, например, благодаря применению мембран с селективной проницаемостью, и/или химически, или ферментативно, например, при реакции с пируватдекарбоксилазой, пируватоксидазой или ацетолактатсинтазой (см., например, Taylor и др., TIBTECH (1998), том 16, 412-418; Fotheringham и др., CHIMICA OGGI/ chemistry today (1997), 9/10, 33-38; международная заявка на патент 98/53088).
Очистку продукта, L-ФТ, из реакционного раствора можно, при необходимости, осуществить известными и общепринятыми способами, например путем экстракции метилизобутилкетоном или с помощью катионообменной хроматографии, например с использованием амберлита® IR 120 (изготовитель фирма Сигма).
Способ по изобретению поясняется далее в следующих примерах, и изобретение определяется пунктами формулы изобретения. Понятно, что следующие далее примеры не следует рассматривать в этом отношении лимитирующими.
Примеры:
1. Выделение микроорганизмов почвы со специфичной к L-ФТ аспартаттрансаминазной активностью:
По 1 г различных проб почвы (гумус, глина, песок/ Schwanheimer Düne, Франкфурт) экстрагировали 10 мл 10 мМ натрийфосфатного буфера, рН 7,0, в течение 1 ч при комнатной температуре. Обогащенные культуры из экстрактов высевали в следующую среду:
5 мМ глюкоза
5 мМ сукцинат
10 мМ глицерин
10 мМ ГМФОМК
10 мМ L-аспарагиновая кислота
50 мл/л раствора А
25 мл/л раствора Б
Раствор А: 50 г/л вторичного кислого фосфата калия
Раствор Б: 2,5 г/л сульфата магния
0,5 г/л хлористого натрия
25 мл/л концентрированного
основного раствора, содержащего: 1 г/л FeSO4×7Н2O
0,22 г/л MnSO4×H2O
0,1 г/л Н3ВО3
0,1 г/л Na2MoO4×2H2O
0,18 г/л ZnSO4×7H2O
0,16 г/л CuSO4×5H2O
0,1 г/л CoCl2×6Н2O
1 мл/л 1 н. HCl
Культуры инкубировали в течение 3-5 дней при 28°С и 200 об/мин в встряхивающем устройстве. Из одной из исследуемых проб почвы (гумус) получались обогащенные микроорганизмы, которые могли расти с L-аспарагиновой кислотой в качестве единственного источника азота. Культуру многократно в такой же среде подвергали дальнейшему пассажу и затем для выделения отдельных клонов высевали на агаризованную твердую питательную среду подобного же состава. После инкубирования в течение 3-5 дней при 28°С выделяли всего 100 отдельных колоний и опять их высевали в жидкую среду (см. выше). Разделение на агаровых планшетах повторяли еще дважды, чтобы обеспечить получение чистых культур.
После таких циклов селекции имели 20 отдельных штаммов, которые могли расти с L-аспарагиновой кислоты в качестве единственного источника азота.
Для изучения активности аспартаттрансаминазы в отношении ГМФОМК использовали по 2 мл культур штаммов, как указано выше. Затем каждые 400 мкл культур обрабатывали для придания проницаемости 0,5% толуолом, 0,5% этанолом в течение 30 мин при 37°С. Клеточные пеллеты ресуспендировали в каждые 50 мкл реакционной смеси, состоящей из 50 мМ ГМФОМК, 50 мМ L-аспарагиновой кислоты, 50 мМ трис/HCl, рН 8,0, 10 мкМ пиридоксальфосфата, и инкубировали в течение ночи при 28°С.
Для качественной оценки образовавшегося ФТ реакционную надосадочную жидкость разбавляли водой 1:5 и по 5 мл такого разведения анализировали с помощью тонкослойной хроматографии на целлюлозных пластинах для высокоразрешающей тонкослойной хроматографии (фирма Мерк) с использованием н-бутанола : ледяной уксусной кислоты : воды =60:15:25 в качестве растворителя. Аминокислоты визуально определяли с помощью окрашивания нингидрином. В случае 4 штаммов (DSM 13353, DSM 13354, DSM 13355, DSM 13356; все штаммы были депонированы в "Германскую Коллекцию Микроорганизмов и Клеточных Культур ГмбХ" /DSM/) смогли подтвердить образование фосфинотрицина. Энантиомерная чистота продукта реакции была исследована с помощью хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ) [колонка для разделения Chirex® (D) с пеницилламином в качестве матрицы (изготовитель Феноменекс)] (растворитель: 2 мМ сульфат меди (2), 10% метанол, скорость потока: 0,5 мл/мин., УФ-детектирование: 254 нм, время удерживания: L-ФТ: примерно 17 мин., D-ФТ: примерно 21 мин.). Во всех четырех исследуемых пробах смогли таким образом обнаружить в качестве продукта реакции L-ФТ, а не D-ФТ.
Для получения L-ФТ посредством биотрансформации, а также для количественного анализа протекания реакции использовали по 1 л культур штаммов бактерий из почвы DSM 13354, DSM 13355 и DSM 13356 в среде, описанной выше, в течение 48 часов при 28°С. Клетки удаляли при центрифугировании, промывали 1× в 10 мМ хлориде натрия, 10 мМ фосфате натрия, рН 7,5, и затем подвергали лиофилизации в течение ночи.
Для осуществления биотрансформации по 200 мг высушенной клеточной массы вышеобозначенных штаммов бактерий из почвы заново суспендировали в 10 мл следующего раствора субстрата:
100 мМ ГМФОМК
200 мМ L-аспарагиновая кислота
100 мМ трис/HCl, рН 8,0
1 мМ пиридоксальфосфат.
Смеси инкубировали на встряхивающем устройстве для инкубирования при 200 об/мин и 37°С. Через 1, 2, 4, 8, 24 и 30 ч отбирали пробы по 200 мкл и анализировали с помощью ВЭЖХ, как описано выше. Результаты анализа L-ФТ и L-аспарагиновой кислоты представлены в таблице 1. Максимально достигнутая степень превращения [продуцированный L-ФТ/ГМФОМК в субстрате х 100] составляла примерно 59% (DSM 13355).
2. Доказательство прямого ГМФОМК/ аспартат-трансаминирования с помощью содержащих трансаминазы ферментных препаратов:
Всего 7 различных коммерчески доступных трансаминаз исследовались в опытах по ГМФОМК/аспартат-трансаминированию. Это происходящие от микроорганизмов трансаминазы (термостабильные трансаминазы AMN-001-01, -001-02, -001-03, -001-04, -001-05, содержащиеся в наборе аминотрансфераз для исследований, с каталожным номером в разделе "Разное" AMN-001 (1998); глутаматоксалоацетаттрансаминаза (ГОТ), глутаматпируваттрансаминаза (ГПТ), фирма Сигма). Ферментные препараты растворяли при концентрации белка 5 мг/мл в 50 мМ трис/ HCl-буфере, рН 8,0, и затем в течение ночи подвергали диализу при 4°С против подобного же буфера. Благодаря этому должны удаляться возможно присутствующие в ферментных препаратах доноры и акцепторы аминогрупп, которые могли бы действовать в качестве промежуточных переносчиков при трансаминировании. Затем концентрацию растворов ферментов устанавливали 1 мг/мл и инкубировали в смесях объемом 50 мкл с буфером для реакции, состоящих из 50 мМ ГМФОМК, 50 мМ L-аспарагиновой кислоты, 50 мМ трис/HCl, рН 8,0, 10 мкМ пиридоксальфосфата, в течение 1ч при оптимальной для соответствующего фермента температуре.
Анализ ферментных проб проводили с помощью тонкослойной хроматографии и хиральной ВЭЖХ, как описано в примере 1. Для 2 термостабильных ферментов, AMN-001-03 и AMN-001-04 (температура реакции 80°С), смогли подтвердить энантиоселективное образование L-ФТ из L-аспарагиновой кислоты при трансаминировании. Все другие исследованные ферменты не проявили активности.
3. Количественное изучение ГМФОМК/аспартат - трансаминирования с помощью термостабильной трансаминазы АММ-001-03:
Вследствие более высокой специфической активности была выбрана трансаминаза AMN-001-03 для более точной характеристики реакции синтеза L-ФТ. Инкубировали 1 мл раствора субстрата, состоящего из 40 мМ ГМФОМК, 48 мМ L-аспарагиновой кислоты, 50 мМ трис/HCl, рН 8,0, 0,1 мМ пиридоксальфосфата, с 1 мг трансаминазы AMN-001-03 при 80°С. Для анализа протекания реакции через промежуток времени в 24 ч отбирали аликвотные пробы по 50 мкл и замораживали при -20°С. L-ФТ и аспартат определяли в аминокислотном анализаторе (Биотроник LC 5001). Результаты представлены в таблице 2. При выбранных условиях реакционное равновесие при синтезе L-ФТ достигалось через 2-4 ч. Использованная в качестве донора аминогруппы L-аспарагиновая кислота через 7 ч была полностью израсходована. Была достигнута степень превращения [продуцированный L-ФТ/ ГМФОМК в субстрате ×100] примерно в 75%.
4. Ферментативный хиральный синтез L-ФТ из ГМФОМК и аспартата с помощью частично очищенной термостабильной трансаминазы AMN-001-03:
Для изучения синтеза использовали частично очищенную трансаминазу AMN-001-03 со специфической активностью 107 нкат/мг белка (1 нкат=1 нмоль аспартата/сек). Реакционный раствор объемом 1 мл содержал 552 мМ ГМФОМК (10%), 700 мМ L-аспарагиновую кислоту, 0,1 мМ пиридоксальфосфат, рН 8,0, установленный с помощью бикарбоната калия, и 11,5 мг фермента. Смесь инкубировали при 80°С. Отбор проб и анализ проводили, как описано в примере 3.
Результаты обобщены в таблице 3. В этом исследовании равновесие реакции достигалось уже через 1 ч. L-Аспарагиновая кислота, донор аминогруппы, была полностью израсходована через 4 ч. Степень превращения составляла примерно 52% и объемная производительность находилась при 4,5 [г L-ФТ/г биокатализатора/ч]. В параллельном опыте с одинаковым раствором субстрата и одинаковой концентрацией фермента, но при температуре реакции 60°С, была достигнута аналогичная степень превращения при, разумеется, явно уменьшенной скорости реакции. Объемная производительность составляла только 0,95 [г L-ФТ/г биокатализатора/ч]. Эти результаты подтверждают большое значение высокой термостабильности трансаминазы для степени превращения и эффективного проведения реакции.
Лишь умеренная степень превращения в 52%, в основном, объясняется образованием побочного продукта, аланина, вследствие трансаминирования пирувата. Существенно более высокие степени превращения достигаются, когда уменьшается образование аланина при реакции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СТЕРЕОСЕЛЕКТИВНОГО СИНТЕЗА ХИРАЛЬНЫХ АМИНОВ | 1990 |
|
RU2116347C1 |
| СПОСОБ ЭНАНТИОМЕРНОГО ОБОГАЩЕНИЯ СМЕСИ ДВУХ ЭНАНТИОМЕРНЫХ ХИРАЛЬНЫХ АМИНОВ | 1990 |
|
RU2087536C1 |
| Способ получения L-2-амино-4-(гидроксиметилфосфинил)-масляной кислоты | 1987 |
|
SU1731067A3 |
| ПИТЬЕВАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ МОНАТИН, И СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2004 |
|
RU2380989C2 |
| СИСТЕМА ВОССТАНОВЛЕНИЯ КОНФЕРМЕНТА, НАБОР ДЛЯ ФЕРМЕНТАТИВНОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА И ФЕРМЕНТАТИВНЫЙ СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ АНАЛИЗИРУЕМОГО ВЕЩЕСТВА | 1996 |
|
RU2184778C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНОГО АМИНА | 1999 |
|
RU2213142C2 |
| ПОЛУЧЕНИЕ 1,4 ДИАМИНОБУТАНА | 2010 |
|
RU2577967C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ГЛЮТАМАТА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ МОНАТИНА | 2002 |
|
RU2280078C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДОЛ-3-ПИРОВИНОГРАДНОЙ КИСЛОТЫ И ЕЕ ПРОИЗВОДНЫХ | 2006 |
|
RU2325442C2 |
| Фермент трансаминаза D-аминокислот из Haliscomenobacter hydrossis с расширенной субстратной специфичностью | 2023 |
|
RU2824015C1 |
Изобретение относится к биотехнологии, в частности к способу ферментативного синтеза L-фосфинотрицина путем трансаминирования из 4-(гидроксиметилфосфинил)-2-оксомасляной кислоты, с использованием аспартата в качестве донора аминогруппы. Количественное превращение может быть осуществлено с помощью подходящей технологии с использованием примерно эквимолярных количеств доноров и акцепторов аминогрупп, на основании чего донорная аминокислота аспартат полностью используется. Применение термостабильных аспартат трансаминаз обеспечивает высокую скорость реакции и, соответственно, высокую объемную производительность. 8 з.п. ф-лы, 3 табл.
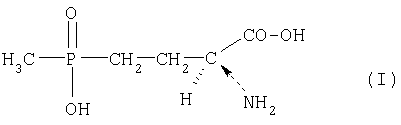
ее производных, которые выбираются из группы сложных эфиров и амидов карбоновых кислот и сложных эфиров фосфиновой кислоты, и/или ее соответствующих солей из 4-(гидроксиметилфосфинил)-2-оксомасляной кислоты формулы (II)
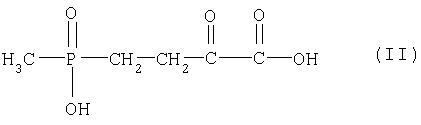
ее производных, которые выбираются из группы сложных эфиров и амидов карбоновых кислот и сложных эфиров фосфиновой кислоты, и/или ее соответствующих солей в качестве акцептора путем ферментативного трансаминирования в присутствии аспартата в качестве донора, причем трансаминирование в оксалоацетат и соединение формулы (I), его производные и/или соли осуществляют в присутствии одной или нескольких специфичных к акцептору аспартаттрансаминаз и причем донор и акцептор применяют в молярном соотношении 0,5-2:1 (в расчете на L-аспаригиновую кислоту: 4-(гидроксиметилфосфинил)-2-оксомасляной кислоте).
| Способ получения L-2-амино-4-(гидроксиметилфосфинил)-масляной кислоты | 1987 |
|
SU1731067A3 |
| БИБЛИО- С.КА | 0 |
|
SU349965A1 |
| EP 0249188 A, 16.12.1987 | |||
| Контейнер для хранения цветочного сырья | 1973 |
|
SU477902A1 |
Авторы
Даты
2006-04-27—Публикация
2000-03-30—Подача