Изобретение относится к новым производным фенилпиперазина формулы (1):
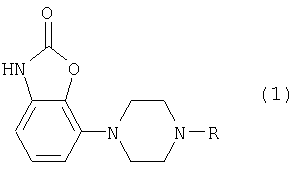
где:
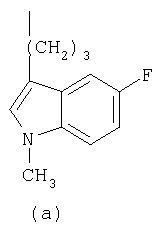
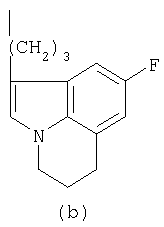
- R означает группу формулы (а) или (b)
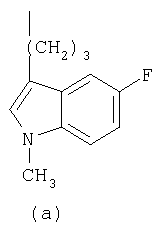
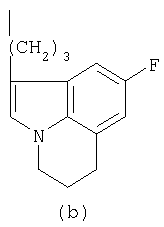
и их солям.
Обнаружено, что соединения согласно изобретению проявляют высокое сродство как к рецептору допамина D2, так и к сайту повторного поглощения серотонина. Такая комбинация пригодна для лечения психотических заболеваний, подобных шизофрении (лечение как позитивных, так и негативных симптомов) и других психиатрических заболеваний.
Соединения проявляют активность в качестве (частичных) агонистов, что делает их пригодными также для лечения болезни Паркинсона.
Соединения проявляют активность антагонистов к рецепторам допамина D2, так как они антагонизируют вызываемое апоморфином у мышей поведение карабкания. Соединения также проявляют активность как ингибиторы повторного поглощения серотонина, так как они усиливают у мышей поведение, индуцированное 5-HTP.
Эти соединения активны в терапевтических моделях, чувствительных к клинически релевантным антипсихотическим средствам (например, реакция условно-рефлекторного избегания; Van der Heyden & Bradford, Behav. Brain Res., 1988, 31: 61-67) и андидепрессантам или анксиолитикам (например, подавление вызванных стрессом криков; van der Poel и др. Psychopharmacology, 1989, 97: 147-148).
Соединения активны в клинически релевантных моделях для болезни Паркинсона (например, изменение поведения крыс; U. Ungerstedt, Acta Physiol. Scand., 1971, 82 (приложение 367): 69-93).
В противоположность клинически релевантным антагонистам рецептора допамина D2, описанные соединения имеют низкую склонность индуцировать каталепсию у грызунов и таким образом, вероятно, индуцируют меньшие экстрапирамидальные побочные эффекты, чем существующие антипсихотические средства.
Ингибирующая активность повторного поглощения серотонина, свойственная указанным соединениям, может быть ответственной за терапевтические эффекты, наблюдавшиеся в поведенческих моделях, чувствительных к антидепрессантам или анксиолитикам.
Соединения могут быть использованы для лечения поражений или заболеваний центральной нервной системы, вызванных нарушениями либо в допаминергической, либо в серотонергический системах, например агрессия, состояние тревоги, аутизм, вертиго, депрессия, расстройства познавательной способности или памяти, болезнь Паркинсона, и при шизофрении и других психотических заболеваниях.
Фармакологически приемлемыми кислотами, с которыми соединения изобретения могут образовывать подходящие кислотно-аддитивные соли, являются, например, хлористоводородная кислота, серная кислота, фосфорная кислота, азотная кислота и органические кислоты, такие как лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, уксусная кислота, бензойная кислота, пара-толуолсульфокислота, метансульфокислота и нафталинсульфокислота.
Соединения и их кислотно-аддитивные соли могут быть произведены в формах, подходящих для введения, с применением подходящих способов при использовании дополнительных веществ, таких как жидкие и твердые носители.
Соединения, имеющие формулу (1), могут быть получены реакцией соединения формулы
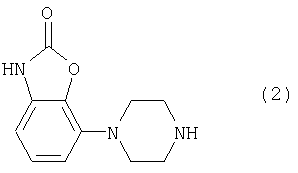
в основных условиях с соединением формулы L-(a) или L-(b),
где формулы (а) и (b) имеют приведенные выше значения и L означает так называемую отщепляемую группу, такую как атом галогена или мезилатная группа.
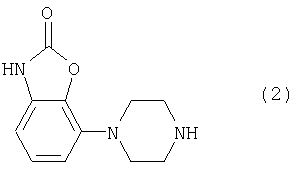
Пиперазиновое соединение формулы (2) может быть получено, как описано в патенте ЕР 0189612.
Исходные вещества формулы L-(a) могут быть получены согласно следующей схеме:
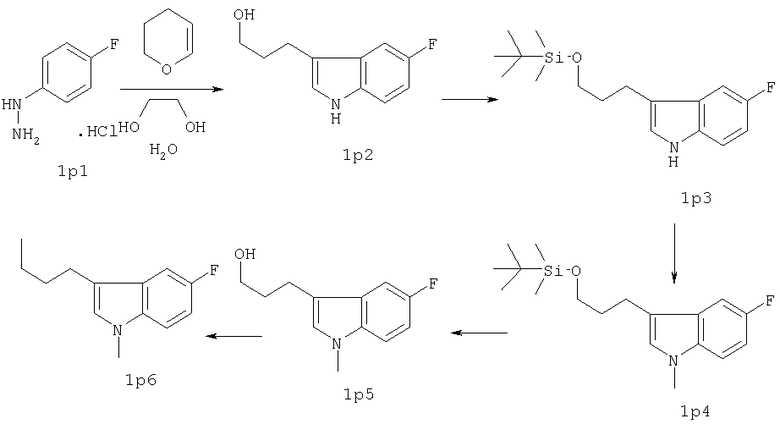
Схема А
Соединение 1р2 может быть получено из 1р1 таким же способом, как соединение 2р4, то есть соединение L-(b), где L означает мезилатную группу, из соединения 2р3 (смотри схему В ниже).
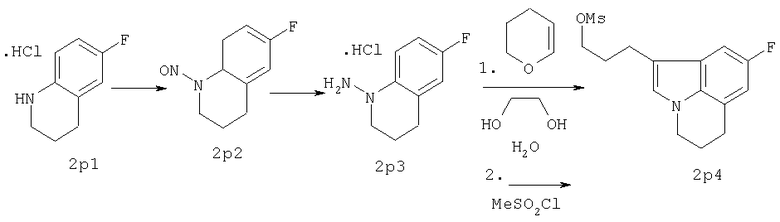
Схема В
Изобретение иллюстрируется следующими примерами.
Пример 1
18,1 г (0,1 моль) 2р1 растворяли в 250 мл СН2Cl2 и доводили до 0°С. К раствору в СН2Cl2 прибавляли раствор, полученный из 50 мл концентрированной серной кислоты, вылитой на 200 г льда. Полученную смесь выдерживали при 0°С, используя охлаждающую баню лед/ацетон. К последнему раствору прибавляли по каплям 8,3 г (0,12 моль) NaNO2, растворенного в 50 мл воды, причем температуру поддерживали ниже 2°С. Перемешивание продолжали 1 час. Затем органический слой отделяли, водный слой один раз экстрагировали (СН2Cl2), объединенные органические фракции сушили над MgSO4. Осушитель удаляли фильтрованием и фильтрат концентрировали в вакууме, получая 17,8 г (99%) сырого темно-желтого 2р2. Раствор 17,8 г (0,099 моль) 2р2 в 100 мл сухого ТГФ в атмосфере азота очень осторожно прибавляли по каплям к суспензии LiAlH4 (9,75 г, 244 ммоль) в кипящем сухом ТГФ. После окончания прибавления полученную смесь оставляли реагировать еще 40 минут. Реакционную смесь доводили до комнатной температуры и далее охлаждали на охлаждающей бане лед/этанол. Затем прибавляли: 9,75 мл воды/ТГФ (1/1), 18,5 мл 2н. NaOH (водн.) и 18,5 мл воды. Полученную смесь доводили до кипения за 20 минут. После охлаждения реакционную смесь фильтровали (Hyflo), полученный фильтрат концентрировали в вакууме, получая 15,9 г остатка. Последний растворяли в 98 мл 1н. HCl в EtOAc, образующийся осадок отфильтровывали, получая 17,5 г (87%) 2р3·HCl.
17,5 г (86 ммоль) 2p3·HCl растворяли в смеси 190 мл этиленгликоля и 90 мл воды, полученный раствор нагревали до 95°С. Затем осторожно прибавляли по каплям 7,96 г (94,6 ммоль) (3,4)-дигидро-2Н-пирана. После окончания прибавления перемешивание продолжали в течение 3 часов при 95°С. После того как реакционная смесь достигала комнатной температуры, прибавляли воду и немного рассола и экстрагировали EtOAc (3×). Объединенные органические фракции промывали водой, NaHSO4(водн.), NaCl(водн.) соответственно, после чего органическую фракцию сушили над Na2SO4. Удаление осушителя и растворителя давало остаток, который очищали колоночной хроматографией (SiO2, элюент МеОН/СН2Cl2 3/97), получая 12 г (63%) темно-красного масла, содержащего соответствующий спирт 2р4, которое затвердевало при стоянии. Затем спирт превращали в мезилат стандартным способом (MsCl, диизопропилэтиламин в СН2Cl2, 0°С), получая 2р4 (выход 98%).
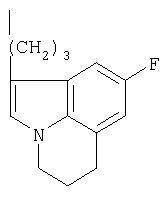
Фенилпиперазин, имеющий формулу (2), подвергали взаимодействию с 2р4 согласно способу, описанному в патенте ЕР 0900792, с получением соединения (1), где R означает группу формулы (b); (т.пл.: 182-5°С).
Пример 2
1р1 превращали в 1р2 аналогично получению 2р4 (в примере 1). 1р2 превращали в 1р3 (98%) согласно способу, описанному RajanBabu и др., J.Org.Chem. 51, (1986), 1704.
31,9 г (103 ммоль) 1р3 в атмосфере азота растворяли в 49 мл ДМФА. Полученный раствор медленно прибавляли к раствору, содержащему 5,88 г (134 ммоль, 1,3 экв.) масляной суспензии, содержащей 55% NaH в 148 мл ДМФА, после чего перемешивание продолжали один час при комнатной температуре, затем реакционную смесь охлаждали (лед/вода). К последнему раствору прибавляли по каплям 8,34 мл (19,02 г, 134 ммоль, 1,3 экв.) MeI, растворенного в 49 мл ДМФА. Реакционную смесь перемешивали дополнительно 16 часов при комнатной температуре. К последней добавляли воду и экстрагировали Et2O (2×), органическую фракцию промывали водой (2×) и рассолом (1×) и в конце концов сушили над MgSO4. После удаления осушителя и растворителя в вакууме остаток подвергали колоночной хроматографии (SiO2, элюент: CH2Cl2/гексан 3/1), получая 26,2 г (79%) 1р4 в виде желтоватого масла.
25,03 г (78 ммоль) 1р4 растворяли в атмосфере азота в 110 мл ТГФ, после чего добавляли 93 мл (0,93 ммоль, 1,2 экв.) 1н. (н-But)4N+F- в ТГФ. После перемешивания в течение одного часа прибавляли Et2O и полученную смесь промывали водой (3×) и рассолом (1×). Органический слой сушили над Na2SO4. После удаления осушителя и растворителя остаток извлекали толуолом и затем концентрировали в вакууме для удаления следов (трет)бутилтриметилсилилфторида. Остаток подвергали флэш-хроматографии (SiO2, элюент Et2O), в конце концов получая 14,8 г (92%) 1р5.
1,69 г (6,45 ммоль) PPh3 и 0,44 г (6,44 ммоль) имидазола растворяли в 20 мл CH2Cl2, после чего порциями прибавляли 1,64 г (6,45 ммоль) иода. Реакционную смесь перемешивали еще 30 минут при комнатной температуре. К последней смеси медленно прибавляли 1,07 г (5,16 ммоль) 1р5, растворенного в 10 мл CH2Cl2. Через 30 минут реакционную смесь промывали NaHCO3(водн.), NaHSO3(водн.) и рассолом, остающуюся органическую фракцию сушили над Na2SO4. После удаления осушителя и растворителя в вакууме остаток растворяли в Et2O, образовавшийся осадок (Ph3PO) удаляли фильтрованием. Фильтрат концентрировали в вакууме, остаток очищали флэш-хроматографией (SiO2, элюент: CH2Cl2/гексан 1/1), получая 1,45 г (88%) желаемого иодида 1р6.
Фенилпиперазин, имеющий формулу (2), подвергали взаимодействию с 1р6 согласно способу, описанному в патенте ЕР 0900792, с получением соединения 1, где R означает группу (а) (т.пл.: 202-4°С).
Фармакологические данные для соединений формулы (1):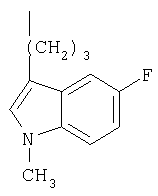
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ФЕНИЛПИПЕРАЗИНЫ | 2000 |
|
RU2246494C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 1998 |
|
RU2197488C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА И ПИПЕРИДИНА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2178414C2 |
| СОЕДИНЕНИЯ ПИПЕРАЗИНА И ПИПЕРИДИНА | 2001 |
|
RU2261250C2 |
| ПОЗИТИВНЫЕ АЛЛОСТЕРИЧЕСКИЕ МОДУЛЯТОРЫ НИКОТИНОВОГО РЕЦЕПТОРА АЦЕТИЛХОЛИНА | 2012 |
|
RU2604737C2 |
| ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ ТЕТРАГИДРОИЗОХИНОЛИНА КАК ПОЗИТИВНЫЙ АЛЛОСТЕРИЧЕСКИЙ МОДУЛЯТОР D1 | 2020 |
|
RU2824581C2 |
| ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ ТЕТРАГИДРОИЗОХИНОЛИНА КАК ПОЗИТИВНЫЙ АЛЛОСТЕРИЧЕСКИЙ МОДУЛЯТОР D1 | 2020 |
|
RU2824527C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1991 |
|
RU2076100C1 |
| ТРИЗАМЕЩЕННЫЕ 1,2,4-ТРИАЗОЛЫ | 2008 |
|
RU2474579C2 |
| 2,7-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ОКТАГИДРОПИРРОЛО[1,2-А]ПИРАЗИНА, СПОСОБ ЛЕЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1996 |
|
RU2162470C2 |
Изобретение относится к новым производным фенилпиперазина, которые являются (частичными) агонистами D2-рецептора и применимы для лечения расстройств ЦНС, в частности болезни Паркинсона. Описываются производные бензоксазолона, имеющие формулу (1)
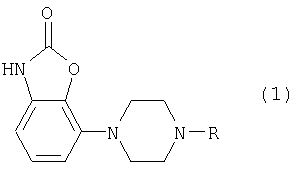
где R означает группу формулы (а) или (b)
и их соли. Также описываются способ получения соединений формулы 1, фармацевтическая композиция на основе соединений формулы 1, способ лечения болезни Паркинсона на основе соединений формулы 1 и способ лечения расстройств ЦНС, таких как шизофрения, состояние тревоги и депрессия на основе соединений формулы 1. Технический результат - получены новые соединения, обладающие полезными биологическими свойствами. 5 н.п. ф-лы, 1 табл.
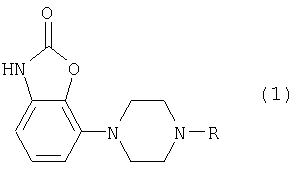
где R означает группу формулы (а) или (b)
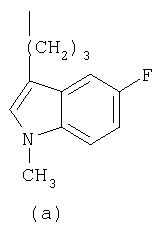
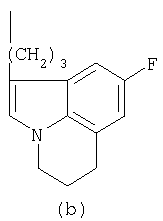
и их соли.
подвергают взаимодействию в основных условиях с соединением формулы L-(a) или L-(b)
где L означает отщепляемую группу, а (а) и (b) имеют значения, приведенные в п.1.
| ЕР 0900792 A1, 10.03.1999 | |||
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| WO 00/23441 A1, 27.04.2000 | |||
| Способ получения производных N-(4-индолилпиперидиноалкил)-бензимидазолона или их солей с кислотами | 1982 |
|
SU1088665A3 |
Авторы
Даты
2006-07-10—Публикация
2002-02-19—Подача