Изобретение относится к области органической химии, а именно к новым биологически активным соединениям класса изохинолин-спиро-пирролов.
Известен в практической медицине препарат фенилсалицилат, аналогичный по фармакологическому (противомикробному) действию предлагаемым соединениям (см. Машковский М.Д. Лекарственные средства. - М.: Медицина, 1986, т.2, с.406).
Наиболее близким по структуре к предлагаемым соединениям являются 1-алкил-6,6-диметил-2,4-диоксо-2,3,4,5,6,7-гексагидро-1Н-индол-3-спиро-2-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидропирролы), не проявляющие антимикробной активности (см. Банникова Ю.Н., Масливец А.Н., Алиев З.Г. Пятичленные 2,3-диоксогетероциклы XLIX. Взаимодействие 1-арил-4-ароил-5-метоксикарбонил-2,3-дигидро-2,3-пирролдионов с замещенными 3-амино-5,5-диметил-2-циклогексен-1-онами. - ЖОрХ, 2004, т.40, вып.12, с.1840-1845.).
Аналоги имеют следующую структуру:

Структурные аналоги не обладают антимикробной активностью.
Задачей изобретения является получение соединений класса изохинолин-спиро-пирролов, проявляющих антимикробную активность.
Техническая задача решается посредством настоящего изобретения, состоит в синтезе 11,11-диметил-1-оксо-1,2,10,11-тетрагидробензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидропирролов) формулы I
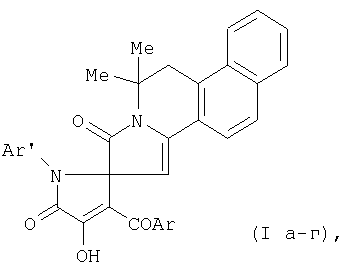
где Ar=Ph (Ia, б), С6H4OEt-4 (Iв), С6Н4Cl-4 (Iг); Ar'=С6Н4Ме-4 (Ia, в, г), С6Н4Cl-4 (Iб), проявляющих антимикробную активность.
Соединения (Ia-г) получают взаимодействием 1-арил-4-ароил-5-метоксикарбонил-2,3-дигидро-2,3-пирролдионов с 1,3,3-триметил-3,4-дигидробензо[f]изохинолином в среде абсолютного бензола при кипячении в течение 2 минут с последующим выделением целевых продуктов известными приемами. Реакция идет по схеме, приведенной ниже.
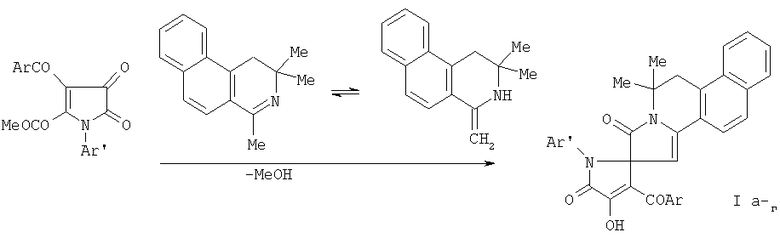

Соединения (Ia-г) отличаются от структурных аналогов наличием изохинолинового фрагмента.
Технический результат, получаемый в результате реализации изобретения, состоит в получении практически нетоксичных соединений с высокими выходами и высокой антимикробной активностью.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез.
11,11-Диметил-1-оксо-1,2,10,11-тетрагидробензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(3-бензоил-4-гидрокси-5-оксо-1-п-толил-2,5-дигидропиррол) (Ia). Раствор 0,35 г (0,001 моль) 5-метоксикарбонил-4-бензоил-1-п-толил-2,3-дигидро-2,3-пирролдиона и 0,22 г (0,001 моль) 1,3,3-триметил-3,4-дигидробензо[f]изохинолина в 10 мл абсолютного бензола кипятили 2 мин, охлаждали, выпавший осадок отфильтровывали. Выход 90%. Т.пл. 234-236°С (с разл., из этилацетата-дихлорэтана). Соединение (Ia) С35Н28N2O4.
Найдено, %: С, 77.78; Н, 5.20; N, 5.19.
Вычислено, %: С, 77.76; Н, 5.22; N, 5.18.
11,11-Диметил-1-оксо-1,2,10,11-тетрагидробензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(3-бензоил-4-гидрокси-5-оксо-1-п-хлорфенил-2,5-дигидропиррол) (Iб) синтезировали аналогично. Выход 88%. Т.пл. 219-220°С (с разл., из этилацетата-дихлорэтана). Соединение (Iб) С34Н35ClN2O4.
Найдено, %: С, 72.78; Н, 4.48; N, 4.98.
Вычислено, %: С, 72.79; Н, 4.49; N, 4.99.
11,11-Диметил-1 -оксо-1,2,10,11-тетрагидробензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(3-п-этоксибензоил-4-гидрокси-5-оксо-1-п-толил-2,5-дигидропиррол) (Iв) синтезировали аналогично. Выход 86%. Т.пл. 200-202°С (с разл., из этилацетата-дихлорэтана). Соединение (Iв) С37Н32Н2O5.
Найдено, %: С, 76.02; Н, 5.53; N, 4.78.
Вычислено, %: С, 76.01; Н, 5.52; N, 4.79.
11,11-Диметил-1-оксо-1,2,10,11-тетрагидробензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(4-гидрокси-5-оксо-1-п-толил-3-п-хлорбензоил-2,5-дигидропиррол) (Iг) синтезировали аналогично. Выход 95%. Т.пл. 257-259°С (с разл., из этилацетата-дихлорэтана). Соединение (Iг) С35Н27ClN2O4.
Найдено, %: С, 73.13; Н 4.75; Cl, 6.18; N, 4.89.
Вычислено, %: С, 73.10; Н, 4.73; Cl, 6.16; N, 4.87.
Соединения (Ia-г) - светло-желтые кристаллические вещества с высокими температурами плавления, легкорастворимые в ДМСО и ДМФА, труднорастворимые в обычных органических растворителях, нерастворимые в воде и алканах, дающие положительную пробу (вишневое окрашивание) на наличие енольного гидроксила со спиртовым раствором хлорида железа (III). Устойчивы при хранении в обычных условиях.
В ИК спектрах соединений (Ia-г), снятых в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний енольной группы ОН в виде широкой полосы в области 3180-3220 см-1, двух лактамных карбонильных групп в виде одной или двух полос в области 1688-1730 см-1, ароильной карбонильной группы в виде полосы в области 1625-1636 см-1.
В спектрах ПМР соединений (Ia-г), снятых в растворе в ДМСО-d6, кроме сигналов протонов ароматических колец присутствуют два синглета метальных групп в области 1,01-1,61 м.д., сигналы двух протонов группы СН2 изохинолинового фрагмента в виде дублета дублетов (АВ-системы), расщепленные вследствие неэквивалентности из-за соседства с хиральным центром, в области 3,12-3,63 м.д., сигнал протона группы СН в области 6,01-6,98 м.д.
Пример 2. Антимикробная активность и токсичность.
Исследование биологической активности (токсичности и специфического действия) заявляемых соединений проводили на белых беспородных мышах массой 18-20 г и грамположительных микроорганизмах Staphylococus aureus, штаммах 906,6538Р.
Определение средней летальной дозы (ЛД50) проводили по методике Першина Г.Н. путем однократного орального введения и наблюдения за поведением и гибелью животных в течение 7 суток. Противомикробное действие выявляли методом двукратных серийных разведений в соответствии с методикой изучения противомикробного действия препаратов (Першин Г.Н. Методы экспериментальной химиотерапии. - М.: Медицина, 1971, с.109). Для культивирования бактерий использовали рыбнопептонный агар и бульон (рН 7,2-7,4). Готовили исходные разведения микробных тел по оптическому стандарту мутности из суточной агаровой культуры. Для определения противомикробного (бактериостатического и бактерицидного) действия микробную взвесь (микробная нагрузка равна 2,5·105 микробных тел в 1 мл питательной среды) вносили в приготовленные разведения препарата в питательной среде. Результаты опытов учитывали после 20 часового (ингибирующее) и 7-суточного (бактерицидное действие) термостатирования при 37°С.
Противомикробную активность оценивали по минимально действующей концентрации. Максимально испытанная концентрация соединения составила 1000 мкг/мл. Эталоном сравнения служил известный в медицинской практике фенилсалицилат.
Проведенные исследования показали (см. таблицу), что все соединения проявляют выраженное ингибирующее действие относительно штаммов золотистого стафилококка и тормозят их рост в интервале концентраций 7,8-62,5 мкг/мл, чем активнее эталона - фенилсалицилата в 11-96 раз.
Концентрации 31,2-125,0 мкг/мл заявляемых соединений вызывают гибель испытанных штаммов золотистого стафилококка, т.е. проявляют бактерицидный эффект. В сравнении с цидным действием эталона фенилсалицилата заявляемые соединения активнее в 16-64 раза.
Лучшее по противомикробным показателям соединение 11,11-диметил-1-оксо-1,2,10,11-тетрагидробензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(3-бензоил-4-гидрокси-5-оксо-1-п-хлорфенил-2,5-дигидропиррол) (Iб) является умеренно токсичным, так как ЛД50 его при однократном оральном введении превышала 151,0 мг/кг массы тела животных.
В связи с тем что 11,11 -диметил-1-оксо-1,2,10,11-тетрагидро-бензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидропирролы) обладают выраженным противомикробным действием на гармположительную микрофлору, они могут найти применение в практической медицине.
Изобретение относится к новым 11,11-диметил-1-оксо-1,2,10,11-тетрагидро-бензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидропирролам (1а-г), формулы:

где Ar=Ph (Ia, б), С6Н4OEt-4 (Iв), С6Н4Cl-4 (Iг); Ar'=С6Н4Ме-4 (Ia, в, г), С6Н4Cl-4 (Iб), которые проявляют антимикробную активность относительно грамположительной микрофлоры. Соединения формулы (I) получают взаимодействием 1арил-4-ароил-5-метоксикарбонил-2,3-дигидро-2,3-пирролдионов с 1,3,3-триметил-3,4-дигидробензо[f]изохинолином в среде абсолютного бензола при кипячении в течение 2 минут с последующим выделением целевых продуктов известными приемами. Полученные соединения практически нетоксичны. 1 табл.
11,11-Диметил-1-оксо-1,2,10,11-тетрагидробензо[h]пирроло[2,1-а]изохинолин-2-спиро-2-(1-арил-3-ароил-4-гидрокси-5-оксо-2,5-дигидропирролы) формулы I
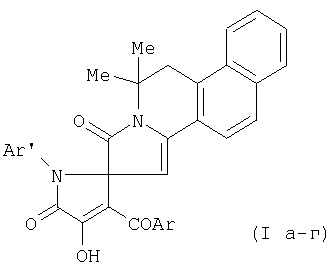
где Ar=Ph (Ia, б), С6Н4OEt-4 (Iв), С6Н4Cl-4 (Iг); Ar'=С6Н4Ме-4 (Ia, в, г), С6Н4Cl-4 (Iб),
проявляющие антимикробную активность относительно грамположительной микрофлоры.
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - Харьков: Торсинг, 1998, т.2, с.418 | |||
| 1-ФЕНИЛ-2-[β-(5'-НИТРО-2'-ФУРИЛ)ВИНИЛ]-6,7,8,9-ТЕТРАГИДРОПИРИМИДО[4,5-b] ХИНОЛИН-4-ОН И 1-МЕТАХЛОРФЕНИЛ-2-[β-(5'-НИТРО-2'-ФУРИЛ)ВИНИЛ]-7,8-ДИГИДРО-6Н-ПИРИМИДО[4 ,5-b]-ПИРИНДИН-4-ОН, ПРОЯВЛЯЮЩИЕ АНТИМИКРОБНУЮ АКТИВНОСТЬ | 1999 |
|
RU2165421C2 |
| ЖОрХ, 2004, т.40, вып.12, с.1840-1845 | |||
| US 4885351, 05.12.1989. | |||
Авторы
Даты
2006-08-10—Публикация
2005-06-24—Подача