Изобретение относится к области органической химии, а именно к новым индивидуальным соединениям класса метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов, обладающих анальгетической активностью, и способу их получения. Полученные соединения являются перспективными кандидатами для синтеза новых гетероциклических соединений и лекарственных препаратов в фармакологии.
Известен структурный аналог заявленных соединений [Пятичленные 2,3-диоксогетероциклы. XXXIX. Взаимодействие 1-арил-4-ароил-5-метоксикарбонил- и 1-арил-4-изопропоксиоксалил-5-фенил-2,3-дигидро-2,3-пирролдионов с о-фенилендиамином / А.Н. Масливец, Л.И. Смирнова, О.И. Иваненко, Ю.С. Андрейчиков // ЖОрХ. – 1995. – Т. 31. – № 4. – С. 610-615], который получают по следующей схеме:
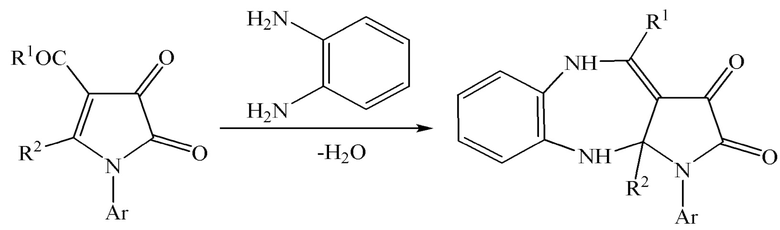
К недостаткам данного способа относится невозможность получения метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов.
Задачей изобретения является разработка простого способа синтеза неописанных в литературе метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов, проявляющих анальгетическую активность и низкую токсичность.
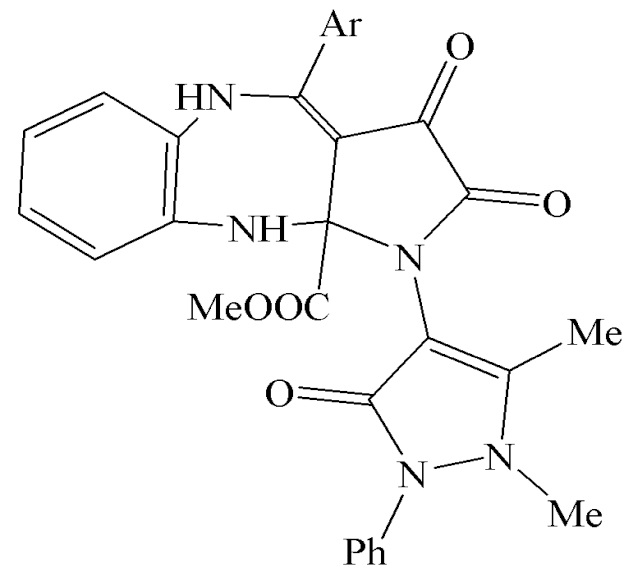
Поставленная задача решается за счет того, что получены метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилаты общей формулы:
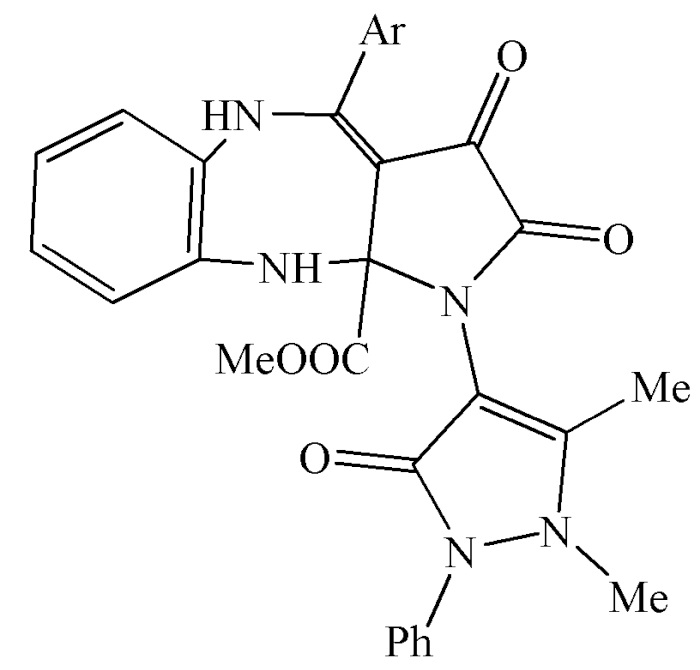
где Ar означает Ph(IIIа), 4-MeOC6H4(IIIб), 4-MeC6H4 (IIIв), 4-ClC6H4 (IIIг) или 4-BrC6H4(IIIд).
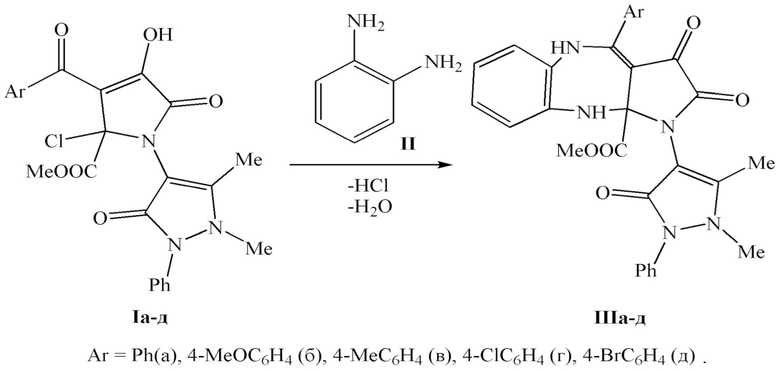
Поставленная задача также решается путем взаимодействия метил 3-ароил-4-гидрокси-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-5-оксо-2-хлор-2,5-дигидро-1Н-пиррол-2-карбоксилатов (Iа-д) с орто-фенилендиамином (II), взятыми в соотношении 1:1 в абсолютном толуоле
при температуре кипения толуола в течение 2 - 2,5 часов по схеме:
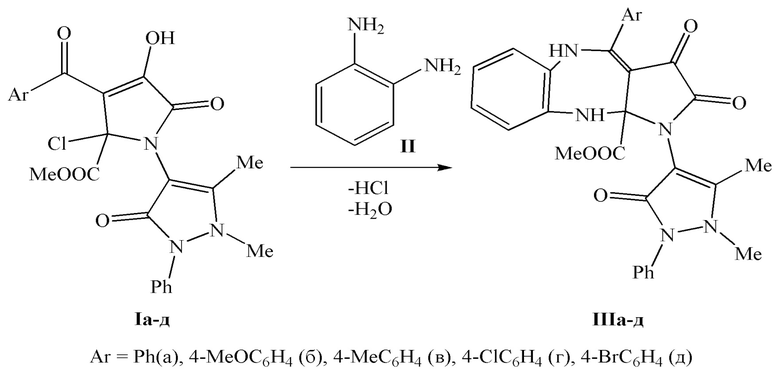
Поставленная задача также решается применением метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов в качестве средств, обладающих анальгетической активностью.
Из патентной и технической литературы не были выявлены способы получения метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов, имеющих схожие признаки с заявляемым способом, а именно не использовались исходные продукты и интервал времени реакции, на основании чего можно сделать вывод о соответствии заявленных технических решений критерию «новизна» и «изобретательный уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1
Метил 1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-4-фенил-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилат (IIIа).
Получение (IIIа): Соединение (Iа) 2,40 г (5 ммоль) смешивают с 45 мл безводного толуола и постепенно нагревают до растворения. Затем 0,54 г (5 ммоль) соединения (II) смешивают с 5 мл безводного толуола и нагревают до растворения. Получившиеся растворы смешивают и кипятят 2,5 часа. После кипячения смесь остужают до комнатной температуры. Выпавшие кристаллы фильтруют, сушат. Выход 2,10 г (84%), т.пл. 209-211 °С (с разложением).
Соединение (IIIа) – бордовое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, ацетонитриле, ацетоне, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
Спектр ЯМР 1Н соединения (IIIа) снят в растворе ДМСО-d6 при частоте 400 МГц, δ, м.д.: 2.16 с (3H, Me-С), 3.20 с (3H, Me-N), 3.62 с (3H, OMe), 6.97 c (1H, NH), 7.61-7.79 гр.с (14Н, 2Ph, С6Н4), 10.01 c (1Н, NH (C-Ar)). Соединение (IIIа) C30H25N5O5. Найдено, %: С 67.48, H 4.54, N 13.14. Вычислено, %: С 67.28, H 4.71, N 13.08.
Пример 2
Метил 1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-4-(4-метоксифенил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилат (IIIб).
Получение (IIIб): Соединение (Iб) 2,56 г (5 ммоль) смешивают с 45 мл безводного толуола и постепенно нагревают до растворения. Затем 0,54 г (5 ммоль) соединения (II) смешивают с 5 мл безводного толуола и нагревают до растворения. Получившиеся растворы смешивают и кипятят 2,5 часа. После кипячения смесь остужают до комнатной температуры. Выпавшие кристаллы фильтруют, сушат. Выход 2,25 г (85%), т.пл. 238-240 °С (с разложением).
Соединение (IIIб) – бордовое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, ацетонитриле, ацетоне, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
Спектр ЯМР 1Н соединения (IIIб) снят в растворе ДМСО-d6 при частоте 400 МГц, δ, м.д.: 2.17 с (3H, Me-С), 3.29 с (3H, Me-N), 3.61 с (3H, OMe), 3.87 с (3H, MeO-С6H4), 7.00 c (1H, NH), 7.61-7.79 гр.с (13Н, Ph, 2С6Н4), 10.01 c (1Н, NH (C-Ar)). Соединение (IIIб) C31H27N5O6. Найдено, %: С 65.48, H 4.52, N 12.44. Вычислено, %: С 65.83, H 4.81, N 12.38.
Пример 3
Метил 4-(4-метилфенил)-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилат (IIIв).
Получение (IIIв): Соединение (Iв) 2,48 г (5 ммоль) смешивают с 45 мл безводного толуола и постепенно нагревают до растворения. Затем 0,54 г (5 ммоль) соединения (II) смешивают с 5 мл безводного толуола и нагревают до растворения. Получившиеся растворы смешивают и кипятят 2 часа. После кипячения смесь остужают до комнатной температуры. Выпавшие кристаллы фильтруют, сушат. Выход 2,08 г (81%), т.пл. 265-267 °С (с разложением).
Соединение (IIIв) – бордовое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, ацетонитриле, ацетоне, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
Спектр ЯМР 1Н соединения (IIIв) снят в растворе ДМСО-d6 при частоте 400 МГц, δ, м.д.: 2.16 с (3H, Me-С), 2.34 с (3H, Me-С6H4), 3.29 с (3H, Me-N), 3.62 с (3H, OMe), 6.98 c (1H, NH), 7.14-7.61 гр.с (13Н, Ph, 2С6H4), 10.00 c (1Н, NH (C-Ar)). Соединение (IIIв) C31H27N5O5. Найдено, %: С 67.43, H 4.74, N 12.54. Вычислено, %: С 67.75, H 4.95, N 12.74.
Пример 4
Метил 1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-4-(4-хлорфенил)-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилат (IIIг).
Получение (IIIг): Соединение (Iг) 2,58 г (5 ммоль) смешивают с 45 мл безводного толуола и постепенно нагревают до растворения. Затем 0,54 г (5 ммоль) соединения (II) смешивают с 5 мл безводного толуола и нагревают до растворения. Получившиеся растворы смешивают и кипятят 2,5 часа. После кипячения смесь остужают до комнатной температуры. Выпавшие кристаллы фильтруют, сушат. Выход 2,21 г (83%), т.пл. 230-232 °С (с разложением).
Соединение (IIIг) – бордовое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, ацетонитриле, ацетоне, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
Спектр ЯМР 1Н соединения (IIIг) снят в растворе ДМСО-d6 при частоте 400 МГц, δ, м.д.: 2.16 с (3H, Me-С), 3.29 с (3H, Me-N), 3.62 с (3H, OMe), 6.99 c (1H, NH), 7.61-7.80 гр.с (13Н, Ph, 2С6H4), 10.01 c (1Н, NH (C-Ar)). Соединение (IIIг) C30H24ClN5O5. Найдено, %: С 63.87, H 4.54, N 11.74. Вычислено, %: С 63.22, H 4.24, N 12.29.
Пример 5
Метил 4-(4-бромфенил)-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилат (IIIд).
Получение (IIIд): Соединение (Iд) 2,80 г (5 ммоль) смешивают с 45 мл безводного толуола и постепенно нагревают до растворения. Затем 0,54 г (5 ммоль) соединения (II) смешивают с 5 мл безводного толуола и нагревают до растворения. Получившиеся растворы смешивают и кипятят 2 часа. После кипячения смесь остужают до комнатной температуры. Выпавшие кристаллы фильтруют, сушат. Выход 2,37 г (82%), т.пл. 211-213 °С (с разложением).
Соединение (IIIд) – бордовое кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, ацетонитриле, ацетоне, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
Спектр ЯМР 1Н соединения (IIIд) снят в растворе ДМСО-d6 при частоте 400 МГц, δ, м.д.: 2.15 с (3H, Me-С), 3.29 с (3H, Me-N), 3.61 с (3H, OMe), 6.98 c (1H, NH), 7.12-7.74 гр.с (13Н, Ph, 2С6H4), 9.99 c (1Н, NH (C-Ar)). Соединение (IIIд) C30H24BrN5O5. Найдено, %: С 58.48, H 4.14, N 11.14. Вычислено, %: С 58.64, H 3.94, N 11.40.
Пример 6. Фармакологическое исследование соединений (IIIа-IIIд) на наличие анальгетической активности.
Оценка острой токсичности и анальгетической активности
Оценку острой токсичности соединений IIIа - IIIд проводили на аутбредных белых мышах линии CD-1 на минимальном количестве животных [OECD Guideline 423: Acute oral toxicity. OECD, Paris, 1996].
Исследуемые вещества вводили в виде взвеси в 1% крахмальной слизи внутрибрюшинно однократно, каждый образец трем животным. После введения веществ оценивали выживаемость мышей в группах при мониторинге в течение 24 часов и последующем общем наблюдении в течение 14 дней. Установлено, что соединения IIIа - IIIд не являются токсичными в дозе 300 мг/кг и, следовательно, являются по меньшей мере малотоксичными (т.е. 4 класс токсичности по классификации Сидорова [К.К. Сидоров, Токсикология новых промышленных веществ, Москва, (1973), вып. 13, с. 47-51]). При этом соединения IIIа - IIIд обладают значительно меньшей токсичностью, чем препарат сравнения диклофенак натрия (таблица).
Анальгетическую активность соединений IIIа - IIIд оценивали в тесте «горячая пластинка» [А. Н. Миронов, Руководство по проведению доклинических исследований лекарственных средств. Часть первая. — М.: Гриф и К, 2012. — 944 с.], который проводили на аутбредных крысах SpragueDawley (по 3 самки и 3 самца в каждой группе). Использовали три группы животных - две экспериментальных и одна контрольная. 1 группа: вещества IIIа - IIIд вводили внутрибрюшинно в виде взвеси в 1% крахмальной слизи в дозе 15 мг/кг; 2 группа: препарат сравнения диклофенак натрия («Хемофарм», Сербия) в 1% крахмальной слизи в дозе 10 мг/кг: 3 группа - контрольная, животным вводили только 1% крахмальную слизь. Латентный период определяли на приборе «Hotplate серии 60200» (TSE Systems, Германия), при температуре пластины 50°С. Измерения проводили через 1 час и через 2 часа после введения вещества. Максимальное время, в течение которого животное могло находиться на горячей пластинке, было установлено равным 30 с, чтобы предотвратить непреднамеренное повреждение кожи экспериментальных животных [Европейская Конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях.ETS N 123. Страсбург, 18.03.1986 г. /European Convention for the Protection of Vertebrate Animals Used for Experimental and other Scientific Purposes. ETS 123.Strasbourg, 18.03.1986)].
Различия между величиной латентного периода для экспериментальной и контрольной групп животных считали достоверными при р≤0,05.
Анальгетическую активность выражали как увеличение (в процентах) времени ответа на ноцицептивную стимуляцию в в экспериментальных группах животных по сравнению с контрольной группой животных и рассчитывали только для тех веществ, которые достоверно увеличивали латентный период, по формуле:
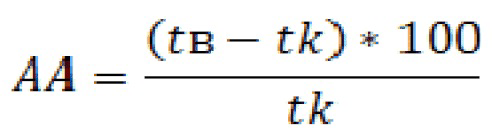
где tв - время ответа на ноцицептивную стимуляцию у группы животных, получивших вещество, tk - время ответа на ноцицептивную стимуляцию у животных контрольной группы.
Полученные экспериментальные данные обрабатывали с использованием программы GraphPad Prism 6 методом «Multiplet tests». Результаты экспериментов приведены в таблице.
Установлено, что соединения IIIа - IIIд обладают выраженным анальгетическим действием (таблица).
Таблица
Результаты исследования острой токсичности и анальгетической активности
% (Р)
% (Р)
Н/а – не активно. По сравнению с контрольной группой: * - Р<0,05; ** - P<0,01; *** - P<0,001; **** - P<0,0001.
Изобретение относится к метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатам общей формулы
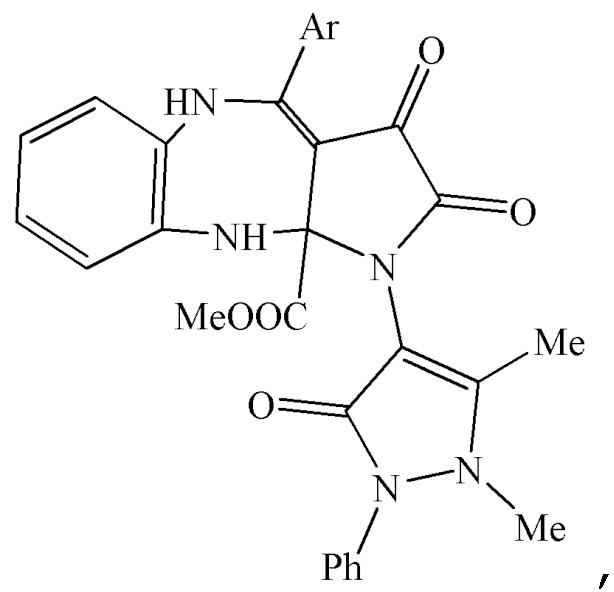
где Ar означает Ph (IIIа), 4-MeOC6H4 (IIIб), 4-MeC6H4 (IIIв), 4-ClC6H4 (IIIг) или 4-BrC6H4 (IIIд). Также изобретение относится к способу получения указанных соединений. Технический результат – получены новые соединения, которые могут найти применение в медицине в качестве средств, обладающих анальгетической активностью. 6 н.п. ф-лы, 1 табл., 6 пр.
1. Метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилаты общей формулы
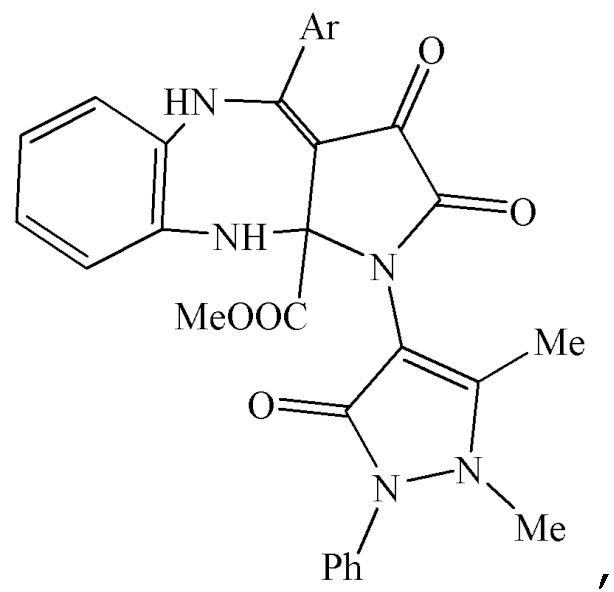
где Ar означает Ph (IIIа), 4-MeOC6H4 (IIIб), 4-MeC6H4 (IIIв), 4-ClC6H4 (IIIг) или 4-BrC6H4 (IIIд).
2. Способ получения метил 4-арил-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов, заключающийся в том, что метил 3-ароил-4-гидрокси-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-5-оксо-2-хлор-2,5-дигидро-1Н-пиррол-2-карбоксилаты (Iа-д) подвергают взаимодействию с орто-фенилендиамином (II), взятыми в соотношении 1:1 в абсолютном толуоле при температуре кипения толуола в течение 2-2,5 часов по схеме
3. Применение метил 1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-4-фенил-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилата (IIIа) в качестве средства, обладающего анальгетической активностью
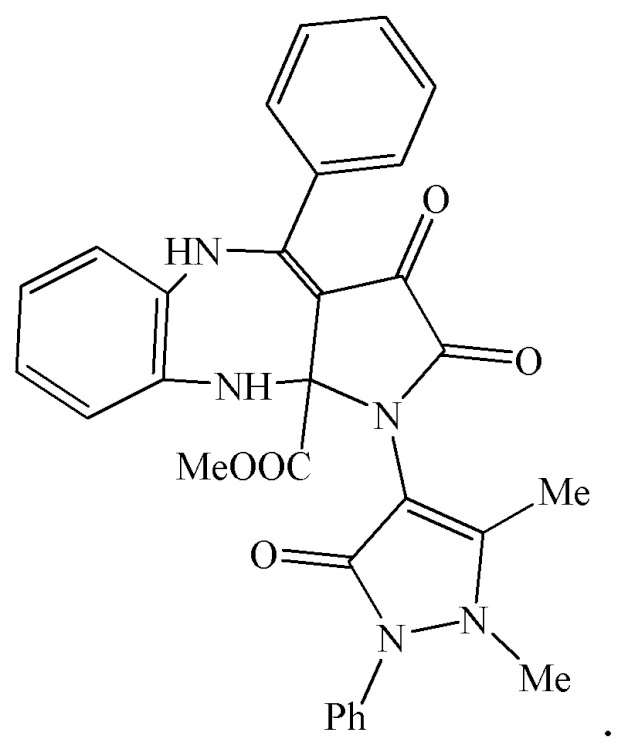
4. Применение метил 1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-4-(4-метоксифенил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилата (IIIб) в качестве средства, обладающего анальгетической активностью
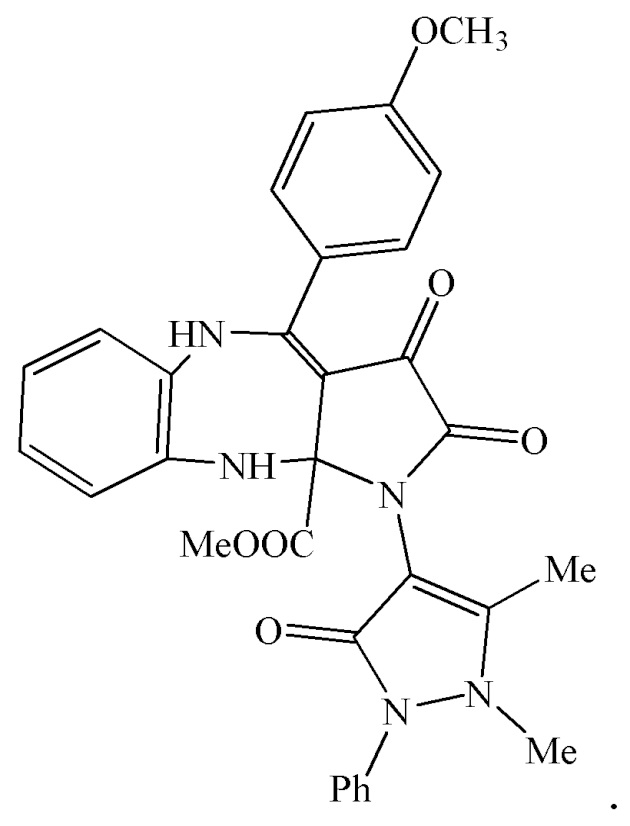
5. Применение метил 4-(4-метилфенил)-1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов (IIIв) в качестве средства, обладающего анальгетической активностью
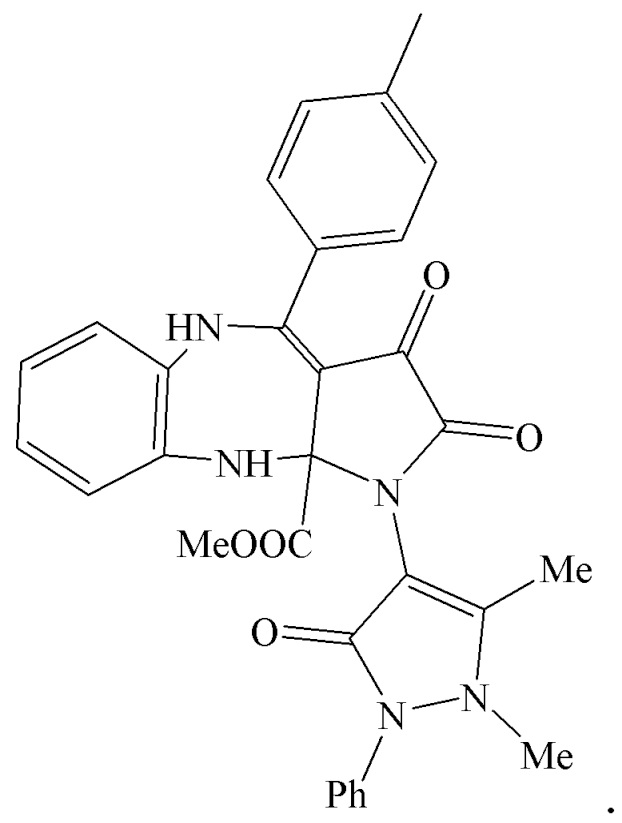
6. Применение метил 1-(1,5-диметил-3-оксо-2-фенил-2,3-дигидро-1Н-пиразол-4-ил)-2,3-диоксо-4-(4-хлорфенил)-2,3,5,10-тетрагидробензо[b]пирроло[2,3-e][1,4]диазепин-10a(1H)-карбоксилатов (IIIг) в качестве средства, обладающего анальгетической активностью
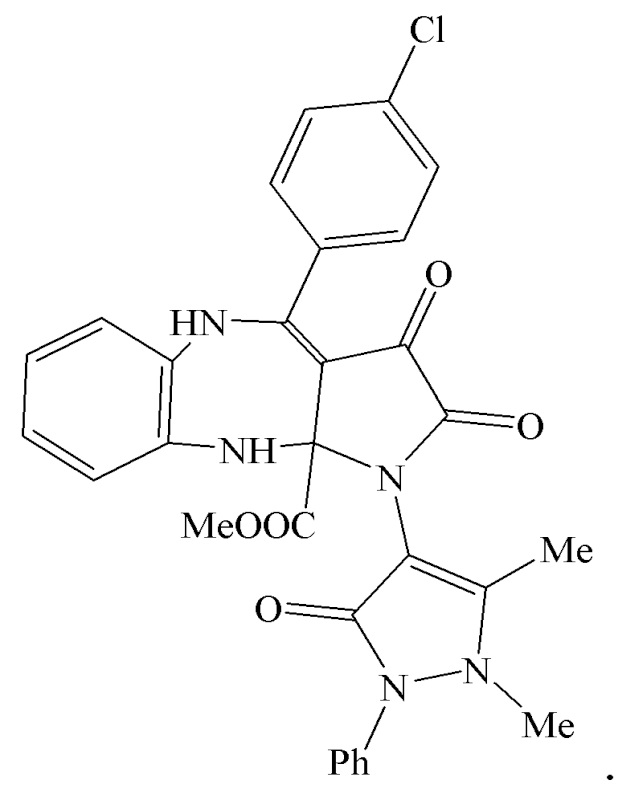
Авторы
Даты
2024-01-11—Публикация
2022-12-27—Подача