Изобретение относится к области медицины и биологии, в частности к лабораторной диагностике, и предназначено для микроскопических исследований мазков и срезов биологических материалов для выявления форменных элементов клеток, многих микроорганизмов, кристаллов некоторых солей и органических веществ, а также может найти широкое применение для выявления и исследования возбудителей инфекционных заболеваний (хламидий, микоплазм, уреаплазм, гонококков, менингококков, гарднерелл, кандид, герпесвирусов, цитомегаловирусов и др.), представителей банальной микрофлоры (палочек Дедерлейна, кишечной палочки, лептотрикса и др.), клеточных элементов (ядер, мембран), некоторых веществ.
Известен цитологический способ исследования раковых опухолей, который осуществляется следующим образом. С помощью шприца производится диагностическая пункция. Полученный пунктат помещают в пробирку, центрифугируют, из осадка готовят мазки и после окрашивания их подвергают микроскопированию (Петрова А.С. Руководство по цитологической диагностике опухолей человека. - М.: Медицина, 1976, с.142 и 143).
Недостатком данного способа является большая трудоемкость исследования, а также ограниченность области применения данного способа только для исследования раковых опухолей.
Известны методы окрашивания цитологических препаратов, в которых применяют красители, используемые для гематологических исследований, в частности краски Романовского-Гимзы, Лейшмана, Мая-Грюнвальда. Данные методы включают первоначальное приготовление растворов указанных красителей, подготовку мазков (высушивание), окраску в течение 5-20 мин, промывку проточной водой, последующее высушивание и затем микроскопическое исследование («Микроскопическая техника»: Руководство/ Под ред. Д.С.Саркисова и Ю.Л.Перова. - М.Ж Медицина, 1996 г., стр.289-294).
Недостатком известных методов является длительность процесса как приготовления красителей, так и самого окрашивания. Кроме того, при изготовлении данных красителей зачастую используются токсичные, экологически опасные вещества (например, азур).
Известные методы обнаружения хламидий микроскопией окрашенного мазка (например, метод Романовского-Гимзы) отличаются низкой чувствительностью, значительной продолжительностью и трудоемкостью, использованием ядовитых компонентов (азур, метанол) и нестабильностью качества окраски. Существующие методы, основанные на иммунофлуоресцентых (ПИФ) и генных методах (ПЦР), отличаются узкой специфичностью к видам, подвидам или сероварам хламидий и применяются, в основном, для выявления Chl.trachomatis. Для Chl.pneumoniae и Chl.psittaci удовлетворительных методов диагностики не разработано.
Известен способ выявления ядрышек (нуклеол) метиленовым синим, при котором фиксируют исследуемый материал в метаноле в течение 5 мин, затем на несколько секунд опускают в эфир, после чего окрашивают 0,1% раствором метиленового синего с кратковременным подогреванием до легкого парообразования в течение 5-10 мин, затем смывают краску, высушивают мазок, помещают в цитратный буфер - 30-60 сек и вновь высушивают (сведения получены с использованием Интернет).
Недостатком известного способа является ограниченность использования данного способа только для выявления ядрышек нуклеол, тогда как для диагностирования иных мокроорганизмов (грибов, вирусов и т.п.) он не применим.
Известен способ окрашивания мазков крови, включающий термическую фиксацию при 160-180°С и обработку красителями, в качестве которых используют 0,2% раствор эозина, а затем 0,2% раствор диазагемицианинового бензтиазолового в течение 50-70 сек (патент РФ №2044295, G 01 N 1/30, 1995 г.).
Недостатком известного способа является его узкопрофильная направленность, т.к. он предназначен только для исследования мазков крови и не может быть применен для исследования и диагностирования иных биологических материалов.
Задача, решаемая изобретением, - создание способа исследования биологических материалов, позволяющего с минимальными затратами времени использовать его для самых разнообразных исследований (для скрининга и выявления возбудителей инфекционных заболеваний (хламидий, микоплазм, уреаплазм, гонококков, менингококков, гарднерелл, кандид, герпесвирусов, цитомегаловирусов и др.), представителей банальной микрофлоры (палочек Дедерлейна, кишечной палочки, лептотрикса и др.), клеточных элементов (ядер, мембран), некоторых веществ.
Поставленная задача решается за счет того, что в известном способе окрашивания мазков, включающем фиксацию мазка и обработку красителями, в соответствии с изобретением мазки последовательно прокрашиваются в растворах красителей бриллиантового желтого и метиленового синего.
Окрашивание производят при концентрации растворов от 0,01% до насыщенного раствора.
Технический результат достигается за счет последовательного применения для окрашивания исследуемых материалов бриллиантового желтого и метиленового синего, поскольку данные красители при взаимодействии между собой образуют нерастворимый в воде и иных органических растворителях комплекс. Использование данных красителей позволяет значительно снизить время проведения исследований, а также расширить область применения данных исследований, поскольку обработанный таким способом материал пригоден для микроскопического выявления форменных элементов клеток, многих микроорганизмов, кристаллов некоторых солей и органических веществ.
Патентные исследования не выявили способов, характеризующихся заявляемой совокупностью признаков, следовательно, можно предположить, что указанный способ соответствует критерию "новизна".
Использование совокупности отличительных признаков также не известно, что говорит о соответствии критерию "изобретательский уровень".
Кроме того, предлагаемый способ может быть реализован в промышленных масштабах и найдет применение в области медицины, в частности в области исследования биологического материала, т.е. характеризуется критерием "промышленная применимость".
Описание способа сопровождается в качестве иллюстраций микрофотографиями.
Фото 1 - пример 1, Sng 1 - окрашивание форменных элементов крови;
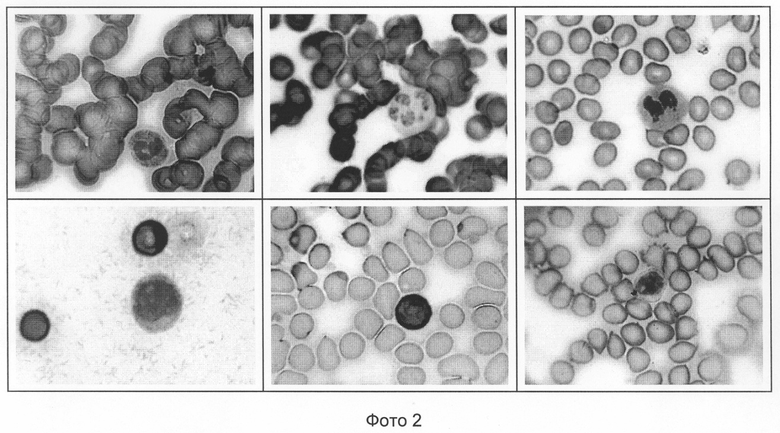
Фото 2 - пример 2, Sng 2 - окрашивание форменных элементов крови;
Фото 3 - пример 3 - другие форменные элементы;
Фото 4 - пример 4, Chl.1 - хламидии;
Фото 5 - пример 5, Chl.2 - хламидии;
Фото 6 - пример 6, Chl.3 - хламидии;
Фото 7 - пример 7 Chl.4 - хламидии;
Фото 8 - пример 8, Myc.1 - микоплазмы;
Фото 9 - пример 9, Myc.2 - микоплазмы;
Фото 10 - другие бактерии;
Фото 11 - вирусы;
Фото 12 - простейшие;
Фото 13 - грибы;
Фото 14 - яйца гельминтов.
Способ осуществляется следующим образом.
Отобранный материал фиксируют любым способом или высушивают на предметном стекле или иной подложке сообразно целям исследования. Затем окрашивают в растворе красителя бриллиантового желтого (БЖ). При этом концентрация раствора составляет от 100 мг/л (0,01%) до насыщенного раствора и зависит от поставленной задачи исследования. Время выдержки в красителе - несколько секунд или дольше - в зависимости от свойств исследуемого материала; передержка в растворе не мешает. Промывают в проточной, дистиллированной воде или в другом подходящем органическом растворителе до исчезновения окраски и затем окрашивают в растворе красителя метиленового синего (МС) (синонимы: метиленовый голубой, метиленовая синь), концентрация раствора составляет от 100 мг/л (0.01%) до насыщенного раствора и зависит от поставленной задачи исследования. Время выдержки в красителе - несколько секунд или дольше - в зависимости от свойств исследуемого материала; передержка в растворе не мешает. Вновь промывают в воде или в другом подходящем органическом растворителе до исчезновения окраски. После этого исследуемый материал высушивают при комнатной температуре или с подогревом.
Заявляемый способ был изучен в различных модификациях, при которых варьировались методы фиксации материала, концентрации красителей, растворители для красителей, продолжительность прокрашивания, pH растворов, методы просушки готовых мазков и некоторые другие параметры. Во всех случаях в пределах заявленных диапазонов результаты оказывались сопоставимыми и редко можно было отдать предпочтение какой-либо из модификаций. Ниже приводятся примеры применимости способа, снабженные микрофотографиями в качестве иллюстраций. Конкретные прописи приведены только для препаратов хламидий и микоплазм, т.к. способ особенно интересен для диагностики именно этих труднодиагностируемых патогенов. Однако те же самые параметры осуществления способа могут быть использованы и для других приведенных здесь объектов, окраска которых для иллюстративных целей производилась способом, описанным в примере Chl.1.
В качестве первых примеров рассмотрим возможность окрашивания форменных элементов крови.
Метод позволяет осуществлять дифференциальную окраску многих тканей растительного и животного происхождения. При этом ядерный хроматин клеток окрашивается в насыщенные тона от розового до темно-коричневого, а мембраны, в зависимости от вида клеток и их целостности, окрашены в светлые оттенки синего, розового, желтого или серого тонов, но при этом контуры клеток получаются отчетливыми. Кроме этих элементов, иногда могут быть обнаружены ядрышки, глыбки хроматина и элементы цитоплазматической структуры. Хорошо прокрашиваются соматические клетки, форменные элементы крови, сперматозоиды, апоптотические фрагменты.
Метод позволяет распознавать по структуре, оттенкам и характеру зернистости форменные элементы крови, поэтому после дополнительных исследований и оптимизации может служить дополнением или заменой существующим методам общего анализа крови.
Пример 1. Sng.1
На предметном стекле делают тонкий мазок из свежезабранной крови, подсушивают на воздухе до полного высыхания и фиксируют погружением в метанол в течение 1-3 минут (допускается передержка). Извлекают из фиксатора и дают мазку подсохнуть на воздухе.
Погружают мазок в 0.1% р-р БЖ в водопроводной воде, выдерживают около минуты (допускается передержка). Извлекают. Дают красителю стечь. Осторожно промывают водопроводной водой до прекращения окрашивания стекающих капель.
На поверхность мазка наслаивают р-р МС, полученный смешением 3 об. ч. насыщенного этанольного р-ра МС и 10 об. ч. 0.01% водного р-ра гидроксида калия (т.н. «щелочная синька Леффлера»), слегка покачивая стекло, выдерживают 1-3 минуты до равномерного окрашивания, контролируемого визуально. Декантируют раствор и промывают мазок водопроводной водой до прекращения стекания окрашенных капель.
Оставляют высыхать при комнатной температуре или подсушивают феном в токе слегка подогретого воздуха.
Для исследования форменных элементов микроскопируют под масляной иммерсией при общем увеличении микроскопа 900-1200x. При правильной окраске эритроциты приобретают красновато-коричневый цвет, а клетки белой крови окрашиваются гетерохромно (см. подборку фото 1).
Пример 2. Sng.2
На предметном стекле делают тонкий мазок из свежезабранной крови, подсушивают на воздухе до полного высыхания и фиксируют поливом этанола в течение 1-3 минут (допускается передержка). Дают фиксатору стечь и полностью испариться с поверхности.
Погружают мазок в 0.1% р-р БЖ в дистиллированной воде, выдерживают около минуты (допускается передержка). Извлекают. Дают красителю стечь. Осторожно промывают дистиллированной водой до прекращения окрашивания стекающих капель.
Погружают мазок в 1% р-р МС в дистиллированной воде, выдерживают около минуты (допускается передержка). Извлекают. Дают красителю стечь. Осторожно промывают дистиллированной водой до прекращения окрашивания стекающих капель.
Оставляют высыхать при комнатной температуре или подсушивают феном в токе слегка подогретого воздуха.
Для исследования форменных элементов микроскопируют под масляной иммерсией при общем увеличении микроскопа 900-1200x. При правильной окраске мазка, фиксированного в этаноле, эритроциты приобретают зеленый цвет, оттенок которого может варьировать в зависимости от деталей прокраски, свежести крови и, возможно, наличия/отсутствия в ней консервантов (см. фото 2).
Пример 3. Другие форменные элементы.
Красители легко и быстро проникают сквозь клеточные мембраны, но при этом прочно фиксируются и на некоторых компонентах самих мембран, создавая тем самым мелкомозаичный контур клетки. Причем мембраны клеток, сохранявших целостность на момент отбора мазка (а также поврежденных только в момент его обработки), имеют светло-серую или серовато-голубую окраску в отличие от мембран клеток, подвергшихся апоптозу (естественному «запрограммированному» саморазрушению), которые окрашены в яркие желтые или зеленые тона, как проиллюстрировано ниже. Встречаются также более интенсивно окрашенные клетки, по-видимому, несущие на своей поверхности иммунные комплексы и/или очень мелкую микрофлору.
Кроме соматических клеток, метод позволяет также окрашивать сперматозоиды и может быть применен для определения их концентрации и морфологии при исследовании спермы, а также для выявления сперматореи и примесей спермы в исследуемом материале (как в проиллюстрированном случае препуциального мазка).
Хламидии - род мелких патогенных бактерий, включающий в себя несколько видов. Особенностью жизненного цикла всех видов хламидий является размножение внутри эпителиальных клеток хозяина с образованием т.н. ретикулярных телец (РТ) - особых вакуолей, внутри которых происходит процесс бинарного деления с образованием новых бактериальных клеток - т.н. элементарных телец (ЭТ). Каждое РТ может содержать от десятков до сотен ЭТ, которые после созревания РТ покидают инфицированную клетку, заражают другие клетки организма и дают начало новым РТ. В зависимости от вида, штамма и других факторов каждая инфицированная эпителиальная клетка может содержать от одного до нескольких десятков РТ, которые либо ассоциированы с ядром (как у «классических» штаммов Chl.trachomatis), либо диффузно расположены в цитоплазме (Chl.pneumoniae, Chl.psittaci).
Настоящий способ позволяет уверенно обнаруживать РТ (ЭТ неотличимы от другой кокковой флоры) в клетках хозяина независимо от видовой принадлежности хламидий (на микроснимках РТ любых видов хламидий отмечены как «РТ Chl.spp.»).
Пример 4. Chl.1.
Мазок, взятый ватным аппликатором из дистальной части уретры женщины, легкими точечными прикосновениями наносят на предметное стекло, подсушивают на воздухе, погружают для фиксации в кювету с 95% этанолом, извлекают через несколько секунд и дают этанолу испариться на воздухе.
Сухой зафиксированный мазок погружают в 0,5% р-р БЖ в водопроводной воде до равномерного желтого окрашивания, контролируемого визуально (здесь и в других примерах: обычно - 1-2 минуты, допускается сколь угодно длительная передержка). Извлекают. Дают красителю стечь. Промывают проточной водой до прекращения окрашивания стекающих капель.
Погружают без подсушивания (подсушивание допускается) в 0,5% раствор МС в водопроводной воде и выдерживают в нем до равномерного интенсивного окрашивания, контролируемого визуально (здесь и в других примерах: обычно - 2-4 минуты, допускается сколь угодно длительная передержка). Промывают проточной водой до прекращения стекания окрашенных капель. Высушивают на воздухе.
Микроскопируют с масляной иммерсией при общем увеличении микроскопа 900-1200x (допускается меньшее увеличение и отсутствие иммерсии, однако это может затруднить работу).
РТ хламидий выявляются внутри эпителиальных клеток в виде одиночных или множественных включений округлой или продолговатой формы, прилегающих к ядру или диффузно расположенных в цитоплазме, обычно имеющих отличную от ядра окраску и меньшие размеры (см. фото 4).
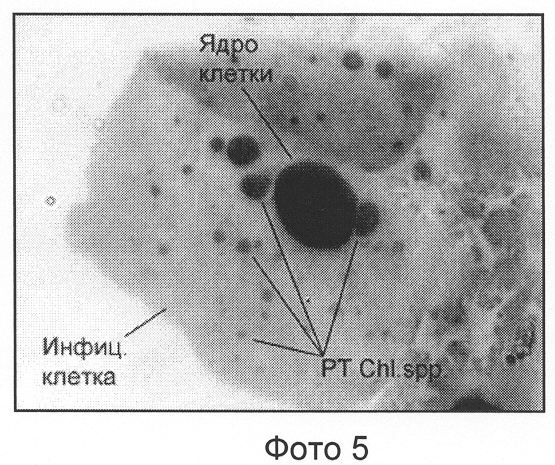
Пример 5. Chl.2.
Мазок, взятый ватным аппликатором из дистальной части уретры женщины, легкими точечными прикосновениями наносят на предметное стекло, подсушивают до полного высыхания и фиксируют нагреванием на электроплитке с закрытой спиралью и регулируемой мощностью, нагретой до температуры 110°С, в течение 5-10 минут. Дают охладиться.
Погружают в 1% р-р БЖ в дистиллированной воде, выдерживают до равномерного желтого окрашивания, контролируемого визуально. Извлекают. Дают красителю стечь. Промывают дистиллированной водой до прекращения окрашивания стекающих капель.
Погружают без подсушивания в 1% р-р МС в дистиллированной воде и выдерживают в нем до равномерного интенсивного окрашивания, контролируемого визуально (допускается передержка). Промывают дистиллированной водой до прекращения стекания окрашенных капель. Высушивают нагреванием на микроплитке. Подщелачивают для улучшения цветового контраста обработкой в течение нескольких секунд парами аммиака.
Микроскопируют под масляной иммерсией при общем увеличении микроскопа 900-1200x.
Данная модификация не приводит к существенным различиям в микроморфологической картине мазка в сравнении с модификацией, описанной в примере Chl.1, но несколько изменяет оттенки и интенсивность окраски некоторых форменных элементов (см. фото 5).
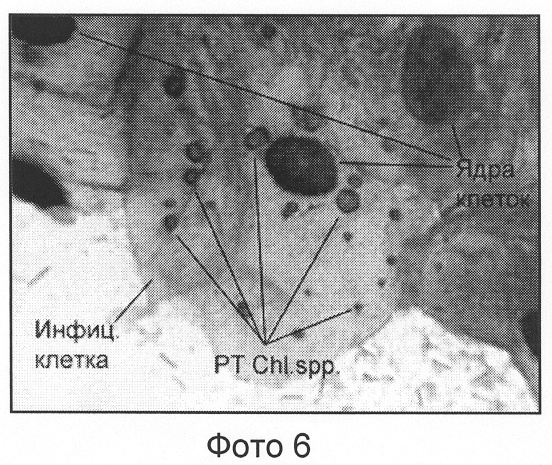
Пример 6. Chl.3.
Мазок, взятый ватным аппликатором из влагалища, легкими точечными прикосновениями наносят на предметное стекло, подсушивают до полного высыхания и фиксируют сухим ацетоном в течение 1 минуты (допускается передержка). Дают ацетону испариться.
Смешивают в равных объемах 1% р-р БЖ в дистиллированной воде и 4% р-р хлористоводородной кислоты. Краситель почти полностью выпадает из раствора в виде темного осадка. Тем не менее, мазок погружают в полученную смесь и выдерживают в ней 3 минуты. Извлекают. Дают красителю стечь. Промывают водопроводной водой до прекращения окрашивания стекающих капель.
Погружают без подсушивания в 1% р-р МС в водопроводной воде и выдерживают в нем до равномерного интенсивного окрашивания, контролируемого визуально (допускается передержка). Промывают водопроводной водой до прекращения стекания окрашенных капель. Высушивают нагреванием на микроплитке.
Микроскопируют под масляной иммерсией при общем увеличении микроскопа 900-1200x.
Данная модификация не приводит к существенным различиям в микроморфологической картине мазка в сравнении с модификациями, описанными в примерах Chl.1-2 (см. фото 6).
Пример 7. Chl.4.
Мазок, взятый посредством прямой аппликации с губок уретры мужчины, завершившего курс лечения от хламидиоза, подсушивают (если требуется) до полного высыхания и фиксируют метанолом в течение 1 минуты (допускается передержка). Извлекают. Дают метанолу испариться с поверхности.
Погружают в насыщенный р-р БЖ в водопроводной воде до равномерного желтого окрашивания, контролируемого визуально (допускается передержка). Извлекают. Дают красителю стечь. Промывают водопроводной водой до прекращения окрашивания стекающих капель.
Погружают без подсушивания в насыщенный р-р МС и выдерживают в нем до равномерного интенсивного окрашивания, контролируемого визуально. Промывают водопроводной водой до прекращения стекания окрашенных капель. Высушивают феном в токе горячего (90°C) воздуха.
Микроскопируют под масляной иммерсией при общем увеличении микроскопа 900-1200x. Следы погибших ретикулярных телец в эпителиальных клетках обнаруживают в виде темных пятен с неровными краями.
Данная модификация не приводит к существенным различиям в микроморфологической картине мазка в сравнении с модификациями, описанными в примерах Chl.1-3 (см. фото 7).
Микоплазмы - семейство мелких патогенных бактерий, включающее в себя множество родов и множество видов. Некоторые из них являются паразитами клеточных мембран и патогенны для человека. Микоплазмы прочно удерживаются на клеточных мембранах инфицированных клеток и размножаются, распространяясь по их поверхности. Для питания и размножения они используют вещества, содержащиеся в межклеточном пространстве и входящие в состав клеток, нарушая трофику тканей и межклеточные коммуникации. По внешнему виду колоний и характеру их распространения они очень напоминают грибы, что и отражено в названии семейства. Молодые клетки, в основном, округлые, содержат много нейтральных липидов и практически не окрашиваются красителями (кроме липофильных), старые клетки могут быть сильно вытянуты, часто имеют неотпочковавшиеся ответвления дочерних клеток и образуют сетеподобные сплетения на поверхности клеток, более восприимчивые к окрашиванию. Свободные клетки бактерий очень мелки, полиморфны и обычными методами неотличимы от банальной микрофлоры.
Удобных и при этом надежных методов обнаружения микоплазм в биологическом материале не разработано (наилучшие результаты - выявляемость ок. 60% - дают методы с применением посева на специальные питательные среды, разработанные для Ureaplasma urealyticum и Mycolasma hominis). Для большинства видов микоплазм какие-либо методы диагностики вообще отсутствуют.
Настоящий способ позволяет уверенно обнаруживать патогенные (паразитирующие на клеточных мембранах) микоплазмы в биологическом материале, однако не позволяет установить их видовую принадлежность, которая ввиду сходства патогенезов имеет второстепенное значение.
При окрашивании таким способом старые клетки образуют на слабоокрашенной мембране хорошо различимую тонкую сеть тонких темных нитей, а молодые - сферические неокрашенные везикулы, контрастированные окраской мембраны и старых клеток.
Пример 8. Myc.1.
Мазок, взятый посредством прямой аппликации с губок уретры мужчины, подсушивают (если нужно) на воздухе и далее поступают, как описано в примере Chl.2.
Эпителиальная клетка слева не инфицирована. Клетка справа - инфицирована микоплазмами. На увеличенном фрагменте инфицированной эпителиальной клетки видны неокрашенные везикулы молодых микоплазменных клеток и темные сливающиеся фибриллы старых (см. фото 8).
Пример 9. Myc.2.
Мазок, взятый ватным аппликатором из влагалища, обрабатывают, как указано в примере Chl.1. Выявляют клетки с характерными везикулярными и фибриллярными включениями на мембранах (см. фото 9).
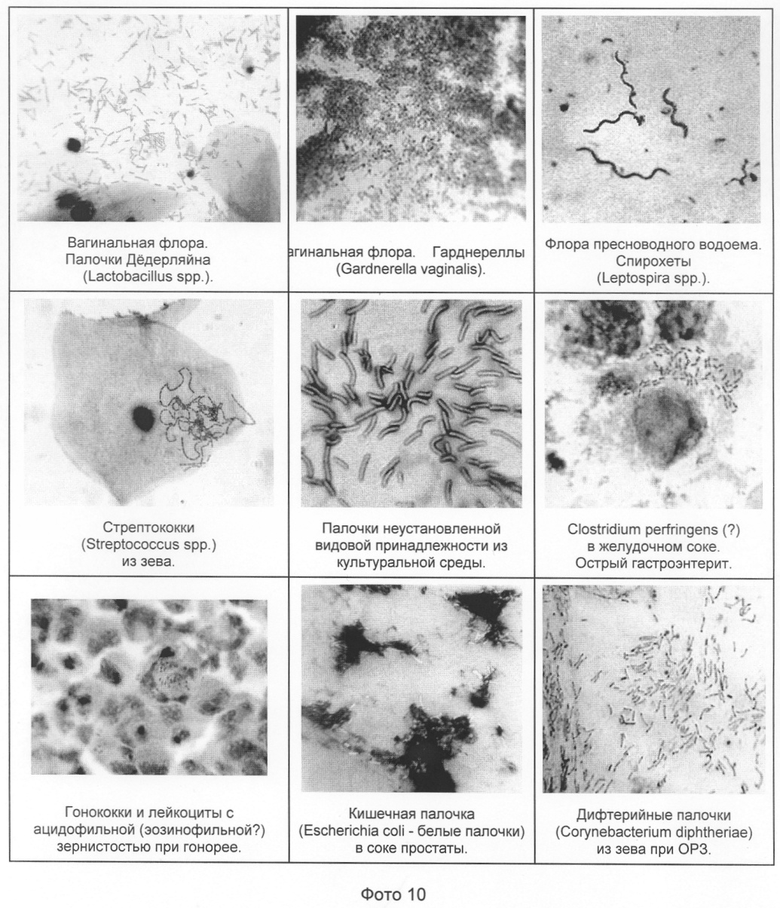
Применяя методы, аналогичные вышеописанным, можно надежно диагностировать различных представителей патогенной и банальной микрофлоры человека, животных и других природных объектов, в том числе инфектологически значимые, такие как диплококки (включая гонококки и менингококки), гарднереллы, бактероиды, клостридии, дифтерийную палочку и др. (см. фото 10).
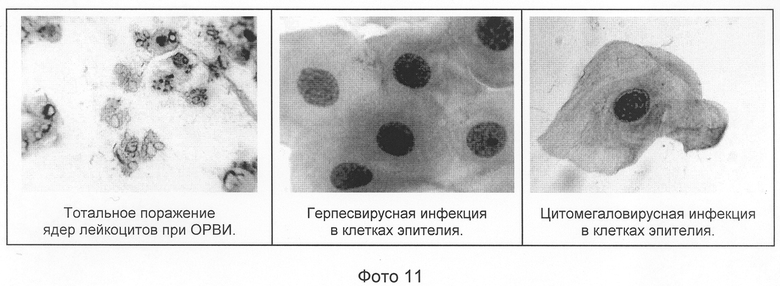
Некоторые вирусы (в том числе, вирус герпеса и цитомегаловирус) могут быть обнаружены предлагаемым способом в клетках по характерным изменениям в их ядрах и/или цитоплазме эпителиальных клеток. В небольшом количестве они выявляются даже в состоянии ремиссии. При манифестации вирусной инфекции численность зараженных клеток резко возрастает. На фото 11 приводятся типичные микроскопические картины мазков при вирусных инфекциях.
При любых модификациях метода простейшие прокрашиваются так же легко, как и форменные элементы тканей человека и животных (см. фото 12).
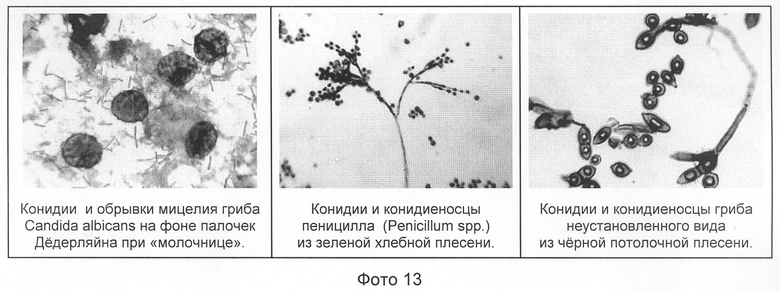
Многие грибы могут быть легко и полихромно прокрашены предлагаемым методом. Для целей дополнительной дифференциации грибов от иной микрофлоры допустим щелочной гидролиз образца, к которому грибы в отличие от большинства бактериальных и эукариотических клеток устойчивы (см. фото 13).
Применимость метода для выявления яиц гельминтов специально не изучалась.
На фото 14 приводится несколько микрофотографий яиц гельминтов, сделанных при случайном обнаружении их в биологическом материале.
Способ отличается простотой, дешевизной, скоростью, высоким качеством окраски и может найти широкое применения для скрининга и выявления возбудителей инфекционных заболеваний (хламидий, микоплазм, уреаплазм, гонококков, менингококков, гарднерелл, кандид, герпесвирусов, цитомегаловирусов и др.), представителей банальной микрофлоры (палочек Дедерлейна, кишечной палочки, лептотрикса и др.), клеточных элементов (ядер, мембран), некоторых веществ.
При осуществлении способа используются известные и широко применяемые в медицинской практике устройства.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВИЗУАЛИЗАЦИИ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ ПТИЦ НА ОДНОМ МАЗКЕ | 2002 |
|
RU2224235C2 |
| СПОСОБ ОКРАСКИ ТРОМБОЦИТОВ ПОСЛЕ УЛЬТРАЗВУКОВОГО ВОЗДЕЙСТВИЯ | 2015 |
|
RU2589680C1 |
| СПОСОБ ДИАГНОСТИКИ КРОВЕПАРАЗИТАРНЫХ ИНФЕКЦИЙ | 2008 |
|
RU2362995C1 |
| СПОСОБ ОКРАСКИ ТРОМБОЦИТОВ ПОСЛЕ ВОЗДЕЙСТВИЯ МОДУЛИРОВАННЫМ УЛЬТРАЗВУКОМ | 2015 |
|
RU2589679C1 |
| СПОСОБ ОЦЕНКИ СОСТАВА БИОПСИЙНОГО МАТЕРИАЛА СЛИЗИСТОЙ ОБОЛОЧКИ НОСА | 2022 |
|
RU2819990C1 |
| СПОСОБ ДИАГНОСТИКИ КРОВЕПАРАЗИТАРНЫХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2218565C1 |
| СПОСОБ ОБНАРУЖЕНИЯ ВНЕКЛЕТОЧНОЙ ДНК В ЦЕЛЬНОЙ ПЕРИФЕРИЧЕСКОЙ КРОВИ | 2019 |
|
RU2715557C1 |
| Способ окраски тромбоцитов на мазках | 1987 |
|
SU1532548A1 |
| СПОСОБ ОКРАСКИ МАЗКОВ КРОВИ | 2005 |
|
RU2304776C2 |
| СПОСОБ ДИАГНОСТИКИ УРОГЕНИТАЛЬНОГО ТРИХОМОНИАЗА | 2017 |
|
RU2639452C1 |







Изобретение относится к области медицины, в частности к лабораторной диагностике, и предназначено для микроскопических исследований биологических материалов для выявления форменных элементов клеток, многих микроорганизмов. Отобранный материал фиксируют любым способом или высушивают на предметном стекле или иной подложке сообразно целям исследования. Затем прокрашивают в растворе красителя бриллиантового желтого (БЖ). Промывают в проточной воде до исчезновения окраски и затем окрашивают в растворе красителя метиленового синего (МС) (синонимы: метиленовый голубой, метиленовая синь), концентрация раствора составляет от 100 мг/л (0.01%) до насыщенного раствора и зависит от поставленной задачи исследования. Изобретение позволяет с минимальными затратами времени провести окрашивание как мазков крови, так и иных биологических материалов. 2 з.п. ф-лы, 14 ил.
| СПОСОБ ВИЗУАЛИЗАЦИИ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ ПТИЦ НА ОДНОМ МАЗКЕ | 2002 |
|
RU2224235C2 |
| RU 2070948 C1, 27.12.1996 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ РЕТИКУЛОЦИТОВ В ИНКУБИРОВАННОЙ КРОВИ ПТИЦ | 2002 |
|
RU2227280C2 |
| СПОСОБ ДИАГНОСТИКИ СТАФИЛОКОККОВОЙ ИНФЕКЦИИ | 1998 |
|
RU2144190C1 |
| Полиазокрасители триазинового ряда для поливинилхлоридных и каучуковых материалов, целлюлозных, протеиновых и полиамидных волокон | 1974 |
|
SU657048A1 |
Авторы
Даты
2006-08-10—Публикация
2004-06-15—Подача