Изобретение относится к биотехнологии, в частности к рыбоводству, к способам получения лечебно-профилактических препаратов для лечения вибриоза рыб.
Вибриоз рыб - это опасное бактериальное заболевание. Встречается у 42 видов рыб и гидробионтов в 16 странах мира в солоноватой, морской и пресной воде. Клиническими признаками заболевания являются покраснение кожных покровов, ерошение чешуи, язвы на поверхности тела рыбы, воспаление анального отверстия. При патологоанатомическом вскрытии наблюдаются наличие гнойного эксудата в полости тела рыбы, увеличение и потемнение почек, точечные кровоизлияния в печени. Это заболевание имеет несколько форм течения, от хронического - с покраснением участков наружных покровов и образованием язв на поверхности тела, до острого септического, характеризующегося внезапной гибелью рыб без внешних признаков поражения. В настоящее время отсутствует специфическая профилактика заболевания, а борьба сводится к организационно-хозяйственным и ветеринарно-санитарным мероприятиям.
Технической задачей заявленного изобретения является получение бивалентной вакцины, обладающей стабильной антигенной и иммуногенной активностью.
Поставленная задача достигается тем, что способ получения бивалентной вакцины против вибриоза рыб (см. чертеж) включает подготовку питательной среды для матровых расплодок штаммов Vibrio anguillarum №2 и VUR-19 и культивирование в ферментере, при этом в качестве питательной среды берут смесь, содержащую перевар Хоттингера, пептон, натрий фосфорно-кислый двузамещенный, натрий хлористый и воду, матровые расплодки ведут 3-мя пассажами, а культивирование - в течение 36-48 ч при температуре 18-25°С и постоянном перемешивании, по окончании массу инактивируют 0,5% формалином и гомогенезируют в течение 5-6 мин при скорости перемешивания 3-8 тыс. об/мин, затем расфасовывают в емкости по 200 - 500 мл с концентрацией бактериальных клеток 80-100 млрд/мл.
Для изготовления вакцины используют два штамма возбудителя вибриоза рыб Vibrio anguillarum №2 и VUR-19, которые хранятся и поддерживаются в ВГНКИ ветпрепаратов и имеют регистрационные номера 78 и 7-25/1 и выделены в Балтийском и Черноморском регионах России соответственно.
Штамм Vibrio anguillarum №2 обладает генетически закрепленными культуральными морфологическими и биохимическими свойствами, характеризующимися следующими признаками. Величина клеток односуточной агаровой культуры (1,6-2,5)×(0,4-1,0) мкм. Слабоизогнутые палочки, подвижные, с одним полярно расположенным жгутиком. Спор и капсул не образует. По Граму не окрашивается. На мясо-пептонном агаре с 1,5% NaCl (pH 7,2-7,4) через 24 ч при 20°С образуются гладкие колонии, блестящие с ровными краями. Щелочной мясо-пептонный агар (pH 8,0-8,2): через 24 ч мелкие, крупные, S-блестящие колонии. На дифференциально-диагностическом агаре с пенициллином (pH 8,0-8,2) через 24-48 ч на сине-зеленом фоне образуются выпуклые, гладкие S-колонии желтого цвета. Физико-биохимические признаки. Размножаются при температуре 5-35°С pH 7,2-8,2. Оптимальная концентрация NaCl в питательной среде 1,5%. Разжижает желатину, гидролизует крахмал, дает альфа-гемолиз на кровяном агаре. Реакция на оксидазу, каталазу, тест окисления - ферментации по Хью-Лейфсону, на ацетилметилкарбинол - положительная. Восстанавливает нитраты до нитритов, сероводорода не образует, мочевину не расщепляет. Обладает специфическим антигеном. Агглютинируется диагностической сывороткой Vibrio anguillarum.
Штамм Vibrio anguillarum VUR-19 обладает стабильными, генетическими закрепленными культурально-морфологическими и физико-биохимическими свойствами, хорошей иммуногенностью со способностью вызывать образование антител, а также выраженной способностью к размножению и продукции бактериальной массы. Величина клеток односуточной агаровой культуры (1,6-2,5)×(0,4-1,0) мкм. Это слабоизогнутые, подвижные палочки, с одним полярно расположенным жгутиком. Спор и капсул не образует. По Граму не окрашивается. На мясо-пептонном агаре с добавлением 1,5% NaCl (pH 7,2-7,4) наблюдается хороший рост штамма через 24 ч при 20°С, колонии гладкие, блестящие с ровными краями размером 2 мм. На щелочном, мясо-пептонном агаре (pH 8,0-8,2) через 24 ч появляются мелкие, блестящие колонии размером 4 мм. На дифференциально-диагностическом агаре с пенициллином (pH 8,0-8,2): через 24-48 ч на сине-зеленом фоне образуются выпуклые гладкие колонии желтого цвета размером 2-3 мм. Физико-биохимические признаки. Штамм галофильный, размножается при 5-35°С, оптимум роста при 18-25°С. Оптимальная концентрация NaCl в питательных средах 1,5%, pH 7,2-8,2. Разжижает желатину, гидролизует крахмал, дает L-гемолиз на кровяном агаре. Восстанавливает нитраты до нитритов, сероводорода не образует, мочевину не расщепляет. Обладает специфическим антигеном и отличается от известных штаммов рода Vibrio по своим антигенным свойствам. В перекрестных реакциях агглютинируется гомологичной диагностической сывороткой в реакции агглютинации (РА) в титре антител 1:3200. Штамм стабилен. Адаптирован на питательных средах.
Предлагаемый способ осуществляется следующим образом.
Для приготовления 100 л питательной среды берут 25 л перевара Хоттингера, заливают в пищеварочный котел, добавляют воду до содержания аминного азота не менее 160-180 мг %. 3атем добавляют 500 мл пептона, 200 мл натрия фосфорнокислого двузамещенного, 1500 мл натрия хлористого и 15 л воды на выкипание. Доводят смесь до кипения. Устанавливают рН 7,8-8,0 и кипятят 40 мин, отстаивают 60 мин, затем фильтруют и перекачивают в реактор, где далее будет проходить культивирование. Стерилизацию питательной среды в реакторе проводят при 120°С в течение 40 мин. Готовая питательная среда должна быть стерильной, прозрачной, рН 7,4-7,8, и содержать аминного азота 160-180 мг %.
Получение матровой расплодки 1-го пассажа. Сухие штаммы, полученные из ВГНКИ, ресуспендируют путем внесения в ампулы по 1,0-1,5 см3, стерильного МПБ и высевают в объеме 0,3-0,5 см3 на пробирки с МПА, предварительно приготовленные. Пробирки с высевом оставляют на 2-е суток в темном месте при температуре 18-25°С. Одновременно делают контрольные высевы.
Получение матровой расплодки 2-го пассажа. После проверки выросших культур на чистоту и типичность роста ее пересевают бактериологической петлей на скошенный МПА, содержащий 1,5% NaCl. Через 2-е суток выросшую культуру смывают физраствором и высевают во флаконы емкостью 500 см3 с питательной средой из расчета 1-2 пробирки на 1 флакон.
Получение матровой расплодки 3-го пассажа. Через 2 суток при отсутствии роста посторонней микрофлоры производственные расплодки штаммов из флаконов пересевают в бутыли емкостью 10 л с питательной средой.
Культивирование. Матровые расплодки засевают в реактор каждого штамма из расчета 5% каждого к объему питательной среды. Выращивание ведут в течение 36-48 ч при температуре 18-25°С и постоянном перемешивании. Выращенную культуру штаммов инактивируют добавлением в реактор формалина до его конечной концентрации 0,5%. Инактивацию ведут в течение 24 ч при температуре 37°С и перемешивании через каждые 2 ч. По окончании бакмассу гомогенизируют в течение 5-6 мин при скорости перемешивания 3-8 тыс. об/мин. Затем расфасовывают в емкости по 200 - 500 мл с концентрацией бактериальных клеток 80-100 млрд/мл.
Использование в вакцине только одного штамма не создает напряженного иммунитета против других серогрупп возбудителя. Штаммы Vibrio anguillarum №2 и VUR-19 отличаются друг от друга своей серологической активностью и набором поверхностно-оболочечных антигенов, что позволяет создать у рыб иммунитет против более широкого спектра циркулирующих в природе эпизоотических штаммов Vibrio anguillarum.
Для сравнения антигенной активности и специфичности штаммов, используемых в вакцине, проводят перекрестные серологические реакции с гомологичными и гетерологичными сыворотками, полученными на кроликах. При постановке реакции агглютинации /РА/ на кроликах кроличьи сыворотки с предельным титром /1:3200/ разводят формалинизированным раствором от 1:25 до 1:3200. Результаты испытания антигенов в РА были следующие: антиген из штамма Vibrio anguillarum №2 агглютинировался гомологичной сывороткой в титре 1:1600, а с гетерологичной, т.е. полученной на штамм VUR-19, в титре 1:200. Антиген из штамма VUR-19 агглютинировался гомологичной сывороткой в титре 1:800, а гетерологичной, т.е. полученной на штамм Vibrio anguillarum №2, агглютинировался в титре 1:100, что указывает на их определенную активность и специфичность по отношению друг к другу. Концентрацию антигена в РА использовали 1 млрд микробных клеток в 1 мл.
Пример 1. Для приготовления 100 л питательной среды берут 20 л перевара Хоттингера, заливают в пищеварочный котел, добавляют воду до содержания аминного азота не менее 160 мг %. Затем добавляют 100 мл пептона, 200 мл натрия фосфорнокислого двузамещенного, 1000 мл натрия хлористого и 20 л воды на выкипание. Доводят смесь до кипения. Устанавливают рН 7,8 и кипятят 40 мин, отстаивают 60 мин, затем фильтруют и перекачивают в реактор, где далее будет проходить культивирование. Стерилизацию питательной среды в реакторе проводят при 120°С в течение 40 мин. Готовая питательная среда должна быть стерильной, прозрачной, рН 7,4, и содержать аминного азота 160 мг %.
Получение матровой расплодки 1-го пассажа. Сухие штаммы, полученные из ВГНКИ, ресуспендируют путем внесения в ампулы по 1,0 см3 стерильного МПБ и высевают в объеме 0,3 см3 на пробирки с МПА, предварительно приготовленные. Пробирки с высевом оставляют на 2-е суток в темном месте при температуре 18°С. Одновременно делают контрольные высевы.
Получение матровой расплодки 2-го пассажа. После проверки выросших культур на чистоту и типичность роста ее пересевают бактериологической петлей на скошенный МПА, содержащий 1,5% NaCl. Через 2-е суток выросшую культуру смывают физраствором и высевают во флаконы емкостью 500 см3 с питательной средой из расчета 1 пробирка на 1 флакон.
Получение матровой расплодки 3-го пассажа. Через 2 суток при отсутствии роста посторонней микрофлоры производственные расплодки штаммов из флаконов пересевают в бутыли емкостью 10 л с питательной средой.
Культивирование. Матровые расплодки засевают в реактор каждого штамма из расчета 5% каждого к объему питательной среды. Выращивание ведут в течение 36 ч при температуре 18°С и постоянном перемешивании. Выращенную культуру штаммов инактивируют добавлением в реактор формалина до его конечной концентрации 0,5%. Инактивацию ведут в течение 24 ч при температуре 37°С и перемешивании через каждые 2 ч. По окончании бакмассу гомогенизируют в течение 5 мин при скорости перемешивания 8 тыс. об/мин. Затем расфасовывают в емкости по 500 мл с концентрацией бактериальных клеток 80 млрд/мл.
Бивалентная инактивированная вакцина характеризуется стерильностью, стабильностью, безвредностью и иммуногенностью.
Пример 2. Для приготовления 100 л питательной среды берут 25 л перевара Хоттингера, заливают в пищеварочный котел, добавляют воду до содержания аминного азота не менее 180 мг %. Затем добавляют 500 мл пептона, 200 мл натрия фосфорнокислого двузамещенного, 1500 мл натрия хлористого и 15 л воды на выкипание. Доводят смесь до кипения. Устанавливают рН 8,0 и кипятят 40 мин, отстаивают 60 мин, затем фильтруют и перекачивают в реактор, где далее будет проходить культивирование. Стерилизацию питательной среды в реакторе проводят при 120°С в течение 40 мин. Готовая питательная среда должна быть стерильной, прозрачной, рН 7,8, и содержать аминного азота 180 мг %.
Получение матровой расплодки 1-го пассажа. Сухие штаммы, полученные из ВГНКИ ресуспендируют путем внесения в ампулы по 1,5 см3 стерильного МПБ и высевают в объеме 0,5 см3 на пробирки с МПА, предварительно приготовленные. Пробирки с высевом оставляют на 2-е суток в темном месте при температуре 25°С. Одновременно делают контрольные высевы.
Получение матровой расплодки 2-го пассажа. После проверки выросших культур на чистоту и типичность роста ее пересевают бактериологической петлей на скошенный МПА, содержащий 1,5% NaCl. Через 2-е суток выросшую культуру смывают физраствором и высевают во флаконы емкостью 500 см3 с питательной средой из расчета 2 пробирки на 1 флакон.
Получение матровой расплодки 3-го пассажа. Через 2 суток при отсутствии роста посторонней микрофлоры производственные расплодки штаммов из флаконов пересевают в бутыли емкостью 10 л с питательной средой.
Культивирование. Матровые расплодки засевают в реактор каждого штамма из расчета 5% каждого к объему питательной среды. Выращивание ведут в течение 48 ч при температуре 25°С и постоянном перемешивании. Выращенную культуру штаммов инактивируют добавлением в реактор формалина до его конечной концентрации 0,5%. Инактивацию ведут в течение 24 ч при температуре 37°С и перемешивании через каждые 2 ч. По окончании бакмассу гомогенизируют в течение 6 мин при скорости перемешивания 3-8 тыс. об/мин. Затем рассфасовывают в емкости по 200 мл с концентрацией бактериальных клеток 80-100 млрд/мл.
Бивалентная инактивированная вакцина характеризуется стерильностью, стабильностью, безвредностью и иммуногенностью.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ЭРИТРОЦИТАРНОГО АНТИГЕНА ДЛЯ ДИАГНОСТИКИ ВИБРИОЗА РЫБ | 2005 |
|
RU2295974C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДСОРБИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ВИБРИОЗА ЛОСОСЕВЫХ РЫБ | 2019 |
|
RU2723580C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ВИБРИОЗА РЫБ | 2005 |
|
RU2284831C1 |
| Питательная среда для культивирования пастерелл в промышленных биореакторах | 2022 |
|
RU2803269C1 |
| АССОЦИИРОВАННАЯ ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ХЛАМИДИОЗА, КАМПИЛОБАКТЕРИОЗА, САЛЬМОНЕЛЛЕЗА И ЛЕПТОСПИРОЗА МЕЛКОГО РОГАТОГО СКОТА | 1994 |
|
RU2086259C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ НЕКРОБАКТЕРИОЗА ЖИВОТНЫХ | 1997 |
|
RU2109519C1 |
| ШТАММ "БИСС № 113" ВИРУСА СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ - 76 ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2221865C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВАКЦИНЫ ПРОТИВ БРУЦЕЛЛЕЗА МЕЛКОГО РОГАТОГО СКОТА | 2016 |
|
RU2642316C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОМАССЫ ЭНТЕРОБАКТЕРИЙ ESCHERICHIA COLI ИЛИ SALMONELLA В ПРОИЗВОДСТВЕННЫХ БИОРЕАКТОРАХ | 2019 |
|
RU2743396C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИВАЛЕНТНОЙ СЫВОРОТКИ ПРОТИВ ПСЕВДОМОНОЗА СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ | 2008 |
|
RU2376034C1 |
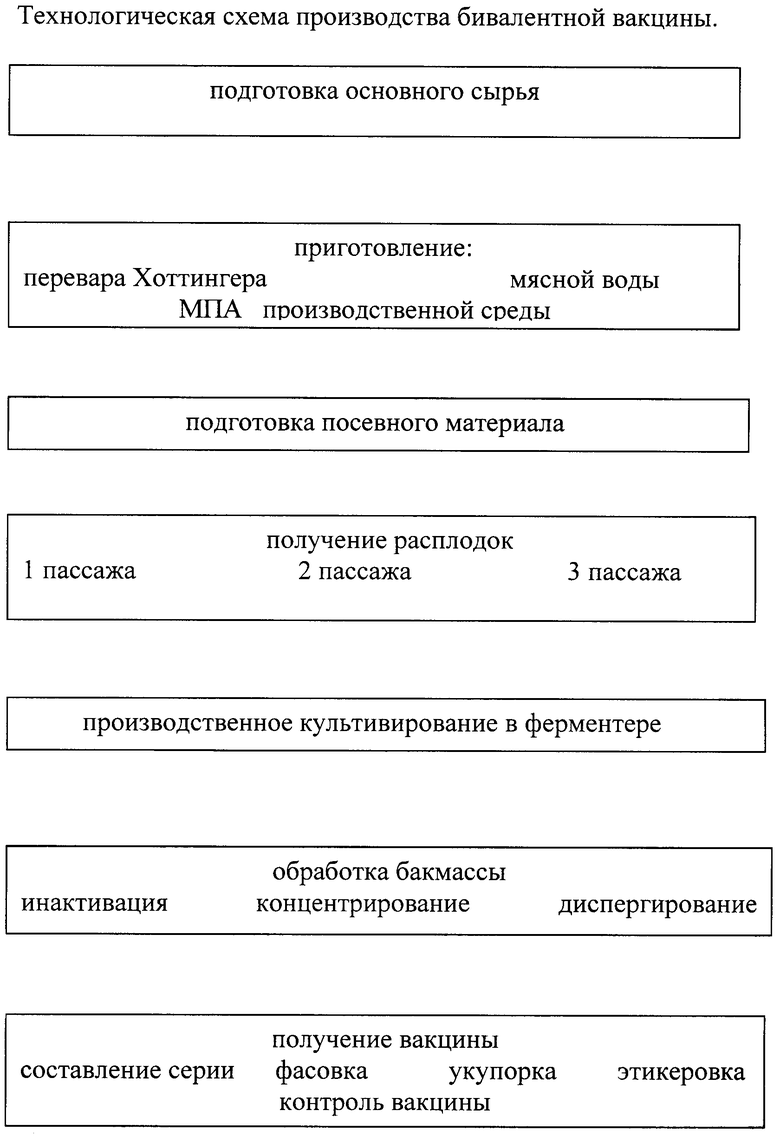
Изобретение относится к биотехнологии. Способ включает получение матровых расплодок штаммов Vibrio anguillarum на питательной среде, смешивание их и культивирование в ферментере, инактивацию выращенной культуры формалином и расфасовку. В качестве штаммов Vibrio anguillarum используют штамм Vibrio anguillarum №2 и штамм Vibrio anguillarum VUR-19, матровые расплодки которых смешивают в равном соотношении. Расфасовку вакцины осуществляют с концентрацией микробных клеток 80-100 млрд/мл питательной среды. Способ позволяет получить вакцину, обладающую высокой профилактической и лечебной активностью. 4 з.п. ф-лы, 1 ил.
| US 5284653 А, 08.02.1994 | |||
| US 4223014 А, 16.09.1980 | |||
| Устройство активного контроля диаметров деталей,обрабатываемых на станках с ЧПУ | 1981 |
|
SU1001016A1 |
| WO 9955835 А, 17.05.2000. | |||
Авторы
Даты
2006-10-10—Публикация
2005-04-18—Подача