Изобретение относится к биотехнологии, а именно травматологии и ортопедии, и может быть использовано для увеличения числа специализированных клеток, перспективных для коррекции дегениративно-деструктивных изменений хрящевой ткани.
Известны способы культивирования клеток, полученных из артикулярных хрящей.
Культивирование артикулярных хондроцитов производится на следующих питательных средах: питательная среда ДМЕМ с добавлением 10% сыворотки плодов коровы (FBS), аскорбиновой кислоты (50 мкг/мл) [Weisser J., Rahfoth В., Timmermann A., Aigner Т., Brauer R. and von der Mark K. Role of growth factors in rabbit articular cartilage repair by chondrocytes in agarose. // Osteoarthritis and Cartilage. 2001. №9. Supplement A. P.48-54], питательная среда F12 с 10% FBS и аскорбиновой кислоты [Badger A. M., Roshak А. К., Cook. M. N., Newman - Tarr Т. M., Swift В. A., Carlson К., Connor J. R., Lee J. С., Gowen M., Lark M. W. and Kumar S. Differential effects of SB 242235, a selective p38 mitogen-activated protein kinase inhibitor, on IL-1 treated bovine and human cartilage/chondrocyte cultures. // J. Osteoarthritis and Cartilage. 2000. №8. P. 434 - 443], среда ДМЕМ/Р12 или среда RPMI/NCTC (1/1) [Freyria A.-M., Cortial D., Ronziere M.-C., Guerret S., Herbage D. Influence of medium composition, static and stirred conditions on the proliferation of and matrixprotein expression of bovine articular chondrocytes cultured in a 3-D collagen scaffold. // Biomaterials 2004. №25. Р.687-697] с добавлением 10% сыворотки. FBS индуцирует дозозависимый эффект на пролиферацию хондроцитов с максимумом при концентрации сыворотки 20% [Guerne P, Sublet A, Lotz M. Growth factor responsiveness of human articular chondrocytes: distinct profiles in primary chondrocytes, subcultured chondrocytes and fibroblasts. // J. Cell Physiol. 1994. №158. P.476-84]. Возможно культивирование хондроцитов в бессывороточной среде с добавлением 1% ITS, 1 мМ цистеина и 1 мМ пирувата [Freyria A.-M., Cortial D., Ronziere M.-C., Guerret S., Herbage D. Influence of medium composition, static and stirred conditions on the proliferation of and matrixprotein expression of bovine articular chondrocytes cultured in a 3-D collagen scaffold. // Biomaterials 2004. №25. Р.687-697]. Во все питательные среды входит аскорбиновая кислота. Добавление в состав питательной среды аскорбиновой кислоты может провоцировать бактериальное инфицирование культуры клеток и изменить ее свойства.
Наиболее близким к заявленному способу является способ культивирования хондробластов из межпозвонковых дисков [Masuda К., Sah R.L., Hejna M.J., Thonar E.J.-M.A. A novel two-step method for the formation of tissue-engineered cartilage by mature bovine chondrocytes: the alginate-recovered-chondrocyte (ARC) method. // J. of Orthopaedic Research. 2003. №21. P.39-148] с использованием питательной среды ДМЕМ с добавлением 6% FBS, 50 мкг/мл аскорбиновой кислоты и 100-150 ммоль/л сахарозы. Смену питательной среды производят каждые 2 дня. Число пассажей не превышает 5 раз. Основными недостатками данного метода культивирования являются использование сложной питательной среды для культивирования и частая смена питательной среды, что может привести к контаминации культуры клеток разнообразными инфекционными агентами; культивирование разных частей диска отдельно, что при дальнейшем использовании культуры может приводить к формированию фибробластоподобных клеток.
Задача изобретения - предложить способ культивирования хондробластов пластинок роста тел позвонков, перспективных для использования в клеточной терапии при коррекции дегениративно-деструктивных изменений хрящевой ткани.
Решение поставленной задачи позволяет достичь положительный лечебный эффект.
Планируемые результаты будут использованы в хирургической практике. Использование донорского материала для коррекции дегенеративно-дисструктивных изменений хрящевой ткани позволит нормализовать структуру хрящевой ткани, сократить послеоперационный реабилитационный период и количество послеоперационных койкодней, улучшить качество жизни больного.
Технический результат достигается за счет того, что для получения донорских хондробластов используются пластинки роста (ПР) тел позвонков мини-поросят в возрасте до 4-х месяцев, поскольку морфогистохимические и биохимические данные продемонстрировали сходство между ПР тел позвонков мини-свиней (мини-просенка) и ПР тел позвонков человека. Для получения донорских хондробластов используются ПР тел позвонков, а не ткани межпозвонкового диска (МПД), так как именно в ПР тел позвонков, в отличие от МПД, содержатся только хондробласты. Культивирование клеток из МПД может формировать фибробластоподобный тип клеток. М максимальный выход хондробластов из ткани ПР тела позвонка обеспечивается за счет обрабатки 1,5% раствором коллагеназы в течение 8 часов, причем объем раствора коллагеназы должен превышать минимум в 10 раз объем обрабатываемой ткани. Культивирование полученных хондробластов осуществляется в питательной среде ДМЕМ с добавлением 20% FBS, поскольку FBS индуцирует дозозависимый эффект на пролиферацию хондроцитов с максимумом при концентрации сыворотки 20%. Пересев хондробластов осуществляется дважды в неделю, так как частая смена питательной среды может привести к контаминации культуры клеток разнообразными инфекционными агентами. Пересев хондробластов осуществлялся с кратностью рассева 1/(2-3), поскольку количество клеток за период культивирования увеличивается вдвое, втрое. Число пассажей не должно превышать 5 раз, поскольку на этом пассаже происходит дифференцировка хондробластов в фибробласты.
Поставленная задача решается за счет того, что используют хондробласты ПР тел позвонков мини-поросят в возрасте до 4-х месяцев; выделяют хондробласты раствором 1,5% коллагеназы в течение 8 часов, объем раствора превышает в 10 раз объем обрабатываемой ткани; культивируют хондробласты в питательной среде ДМЕМ с добавлением 20% FBS; пересевают хондроблсты 2 раза в неделю с кратностью рассева 1/(2-3).
Способ осуществляется следующим образом.
1. Получение клеток ПР тел позвонков мини-поросенка.
ПР тел позвонков выделяют стерильно в асептических условиях и помещают в раствор Хенкса с канамицином 1 г/л на 15 минут. Данный временной промежуток подобран имперически, поскольку антибиотики имеют токсическое действие на живую клетку, и время эскпозиции с антибиотиком должно быть оптимальным для сохранения жизнеспособности хондробласта и воздействия на патогенную флору. После обработки ПР тел позвонков очищают от мягких тканей с помощью скальпеля и измельчают в чашке Петри с минимальным объемом среды RPMI (для того, чтобы хондробласты оставались жизнеспособными) до размеров 1-2 мм3 (оптимальный размер для проникновения и действия фермента). Измельченный хрящ помещают в раствор 1,5% коллагеназы (имперически подобрано для максимального выхода клеток) в силиконизированную посуду (силиконизированная посуда - комерческий продукт используется для тог, чтобы клетки не прилипали к стенкам посуды), объем раствора должен превышать объем ткани не менее чем в 10 раз; инкубируют на шейкере при температуре 37°С (температурный режим действия коллагеназы) в течение 8 часов (оптимальный временной период действия коллагеназы для получения максимального количества клеток). Суспензию пропускают через нейлоновый фильтр (для отделения от обломков не растворившейся хрящевой ткани) и центрифугируют 10 мин при 1500 оборотов в мин. После центрифугирования клетки ресуспензируют в ростовой питательной среде ДМЕМ и доводят концентрацию клеток в суспензии с учетом их жизнеспособности и исходной концентрации. Для этого производят окраску клеточной суспензии прижизненным красителем - трипановым синим. Мертвые клетки окрашиваются интенсивно - синим, у живых слегка окрашивается клеточная мембрана, краситель не проникает внутрь клетки.
Сначала подсчитывают число мертвых клеток (под микроскопом), потом число живых клеток и, наконец, число всех клеток. Число всех клеток принимают за сто процентов, вычисляют процент живых клеток (жизнеспособность). Для рассева учитывается только число живых клеток, мертвые клетки в расчет не принимаются.
2. Культивирование клеток ПР тел позвонков мини-поросенка.
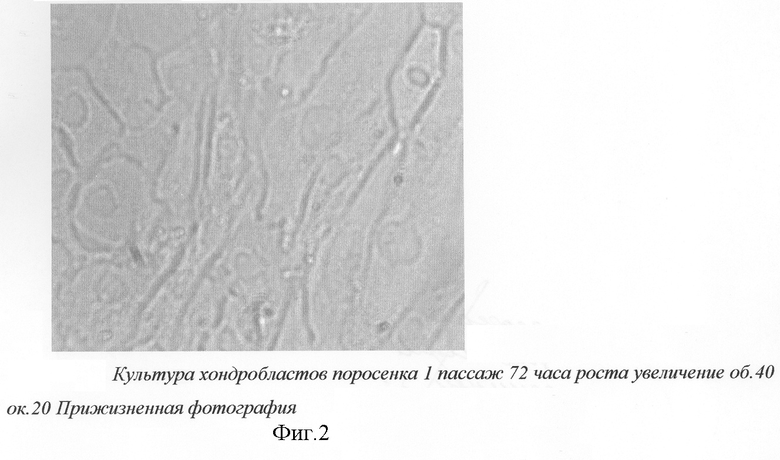
Культивирование клеток проводят в питательной среде ДМЕМ с добавлением 20% FBS. После подсчета жизнеспособных клеток в суспензии концентрацию клеток доводят до 100 тыс.клеток в мл и рассевают в культуральные флаконы. Флаконы помещают в термостат при 37°С. Через 3-4 дня клетки формируют монослой изокруглых и овальных клеток (фиг.1, 2). После получения монослоя клетки снимают с поверхности смесью растворов трипсина 0,02% и версена 0,025% (для растворения и функционирования трипсина). Подсчитывают концентрацию клеток в камере Горяева. Для этого подсчитывают все клетки в "больших" квадратах камеры Горяева, полученные значения суммируем, полученное число делим на 60, полученное число - миллионы клеток в мл. И проводят рассев клеток 1/(2-3). Число пассажей не должно превышать 5 раз, для того чтобы избежать дифференцировки хондробластов в фибробласты.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНОГО ХОНДРОТРАНСПЛАНТАТА | 2008 |
|
RU2392973C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДОНОРСКИХ ХОНДРОЦИТОВ | 2009 |
|
RU2409662C2 |
| СПОСОБ ПОЛУЧЕНИЯ НАЗАЛЬНЫХ ХОНДРОЦИТОВ НОВОРОЖДЕННЫХ КРЫСЯТ | 2024 |
|
RU2825897C2 |
| Способ биофабрикации трансплантата в виде клеточных сфероидов для регенеративных технологий восстановления хряща субъекта на основе надхрящницы собственного реберного хряща субъекта и мультипотентных мезенхимальных стромальных клеток костного мозга этого же субъекта | 2022 |
|
RU2800991C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХРЯЩЕПОДОБНЫХ СТРУКТУР ИЗ СТВОЛОВЫХ КЛЕТОК С ИНДУЦИРОВАННОЙ ПЛЮРИПОТЕНТНОСТЬЮ И СТРУКТУРЫ, ПОЛУЧЕННЫЕ УКАЗАННЫМ СПОСОБОМ | 2023 |
|
RU2814248C1 |
| Способ получения трансплантата - тканеинженерной надхрящницы на основе клеточных сфероидов | 2022 |
|
RU2807692C2 |
| Трансплантат - тканеинженерная надхрящница для восстановления хряща субъекта | 2023 |
|
RU2822238C1 |
| БИОТРАНСПЛАНТАТ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ И ТРАВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ ХРЯЩЕВОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2005 |
|
RU2301677C1 |
| СПОСОБ РЕГЕНЕРАЦИИ ХРЯЩЕВОЙ ГИАЛИНОВОЙ ТКАНИ СУСТАВОВ НА НАЧАЛЬНЫХ СТАДИЯХ ДЕСТРУКТИВНЫХ ЗАБОЛЕВАНИЙ | 2010 |
|
RU2452527C1 |
| Способ выделения хондроцитов | 2017 |
|
RU2677688C1 |
Изобретение относится к биотехнологии, конкретно к получению донорских хондробластов, и может быть использовано в травматологии и ортопедии. Хондробласты выделяют из пластинок роста тел позвонков мини-свиней в возрасте до 4-х месяцев, при этом проводят ферментативную обработку измельченной донорской ткани 1,5% коллагеназой в течение 8 часов в объеме, в 10 раз превышающем объем обрабатываемой ткани. Полученные хондробласты культивируют в питательной среде ДМЕМ с добавлением 20% FBS, с пересевом 2 раза в неделю с кратностью рассева 1/(2-3). Изобретение позволяет получить при минимальных затратах необходимый материал для коррекции дегенеративно-дисструктивных изменений хрящевой ткани. 2 ил.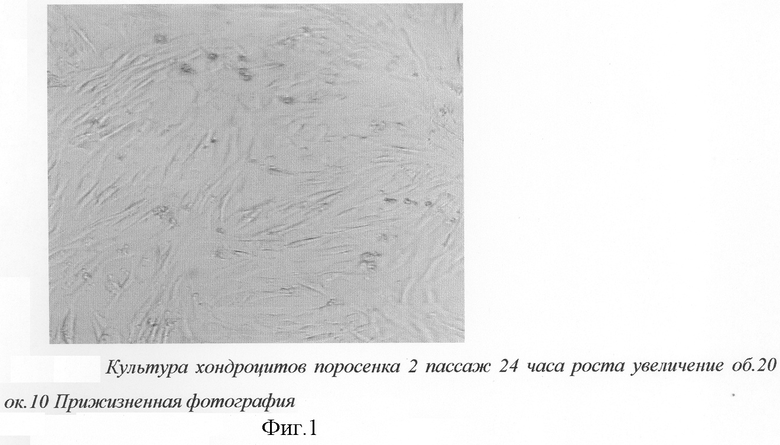
Способ получения донорских хондробластов путем выделения и измельчения хрящевой ткани, проведения ферментативной обработки, фильтрации и центрифугирования полученной суспензии, ресуспендирования хондробластов и культивирования их в питательной среде ДМЕМ с добавлением 20% FBS, отличающийся тем, что используют для выделения хондробластов пластинки роста тел позвонков мини-свиней в возрасте до 4-х месяцев, проводят ферментативную обработку 1,5% коллагеназой в течение 8 ч, в объеме, в 10 раз превышающем объем обрабатываемой ткани, пересевают хондробласты 2 раза в неделю с кратностью рассева 1/(2-3).
| MASUDA К | |||
| et | |||
| al | |||
| A novel two-step method for the formation of tissue-engineered cartilage by mature bovine chondrocytes: the alginate-recovered-chondrocyte (ARC) method, J | |||
| Orthop | |||
| Res., 2003, v | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| DE 4431598, 07.03.1996 | |||
| Способ культивирования хрящевых фрагментов | 1989 |
|
SU1611931A1 |
Авторы
Даты
2006-10-10—Публикация
2004-07-06—Подача